Micardis 20mg, 40mg, 80mg Telmisartan Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Micardis 40 mg und wie wird es angewendet?
Micardis ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Bluthochdruck (Hypertonie) und zur Verringerung des Risikos von Herz-Kreislauf-Erkrankungen wie Schlaganfall und Herzinfarkt. Micardis 20 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Micardis 80 mg gehört zu einer Klasse von Arzneimitteln, die als ARBs bezeichnet werden.
Es ist nicht bekannt, ob Micardis bei Kindern unter 18 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Micardis haben?
Micardis 80 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Micardis gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Micardis. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
Fötale Toxizität
BEZEICHNUNG
MICARDIS 40 mg ist ein Anon-Peptid-Angiotensin-II-Rezeptor (Typ AT1)-Antagonist.
Telmisartan wird chemisch als 4'-[(1,4'-Dimethyl-2'-propyl [2,6'-bi-1H-benzimidazol]-1'-yl)methyl beschrieben ]-[1,1'-Biphenyl]-2-Carbonsäure. Seine Summenformel ist C33H30N4O2, sein Molekulargewicht ist 514,63 und seine Strukturformel ist:
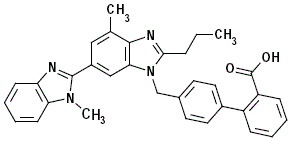
Telmisartan ist ein weißer bis leicht gelblicher Feststoff. Es ist praktisch unlöslich in Wasser und im pH-Bereich von 3 bis 9, kaum löslich in starker Säure (außer unlöslich in Salzsäure) und löslich in starker Base.
MICARDIS 20 mg ist als Tabletten zur oralen Verabreichung mit 20 mg, 40 mg oder 80 mg Telmisartan erhältlich. Die Tabletten enthalten die folgenden Hilfsstoffe: Natriumhydroxid, Meglumin, Povidon, Sorbit und Magnesiumstearat. MICARDIS-Tabletten sind hygroskopisch und müssen vor Feuchtigkeit geschützt werden.
INDIKATIONEN
MICARDIS HCT (Telmisartan und Hydrochlorothiazid) ist angezeigt zur Behandlung von Bluthochdruck, um den Blutdruck zu senken. Die Senkung des Blutdrucks verringert das Risiko tödlicher und nicht tödlicher kardiovaskulärer Ereignisse, vor allem Schlaganfälle und Myokardinfarkte. Diese Vorteile wurden in kontrollierten Studien mit blutdrucksenkenden Arzneimitteln aus einer Vielzahl von pharmakologischen Klassen, einschließlich der Klassen, zu denen dieses Arzneimittel hauptsächlich gehört, beobachtet. Es gibt keine kontrollierten Studien, die eine Risikominderung mit MICARDIS HCT belegen.
Die Kontrolle des Bluthochdrucks sollte Teil eines umfassenden kardiovaskulären Risikomanagements sein, einschließlich, soweit angemessen, Lipidkontrolle, Diabetesmanagement, antithrombotische Therapie, Raucherentwöhnung, Bewegung und begrenzte Natriumaufnahme. Viele Patienten benötigen mehr als ein Medikament, um ihre Blutdruckziele zu erreichen. Spezifische Ratschläge zu Zielen und Management finden Sie in den veröffentlichten Richtlinien, wie denen des Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) des National High Blood Pressure Education Program.
In randomisierten kontrollierten Studien wurde gezeigt, dass zahlreiche Antihypertensiva aus einer Vielzahl von pharmakologischen Klassen und mit unterschiedlichen Wirkmechanismen die kardiovaskuläre Morbidität und Mortalität verringern, und es kann geschlussfolgert werden, dass es sich um eine Blutdrucksenkung und nicht um eine andere pharmakologische Eigenschaft handelt die Medikamente, die größtenteils für diese Vorteile verantwortlich sind. Der größte und beständigste Nutzen für das kardiovaskuläre Ergebnis war eine Verringerung des Schlaganfallrisikos, aber auch eine Verringerung des Myokardinfarkts und der kardiovaskulären Mortalität wurde regelmäßig beobachtet.
Ein erhöhter systolischer oder diastolischer Druck verursacht ein erhöhtes kardiovaskuläres Risiko, und der absolute Risikoanstieg pro mmHg ist bei höheren Blutdrucken größer, so dass selbst eine geringfügige Verringerung einer schweren Hypertonie einen erheblichen Nutzen bringen kann. Die Reduktion des relativen Risikos durch Blutdrucksenkung ist in Populationen mit unterschiedlichem absolutem Risiko ähnlich, sodass der absolute Nutzen bei Patienten größer ist, die unabhängig von ihrer Hypertonie einem höheren Risiko ausgesetzt sind (z. B. Patienten mit Diabetes oder Hyperlipidämie), und solche Patienten wären zu erwarten um von einer aggressiveren Behandlung zu einem niedrigeren Blutdruckziel zu profitieren.
Einige Antihypertensiva haben geringere Blutdruckwirkungen (als Monotherapie) bei Patienten mit schwarzer Hautfarbe, und viele Antihypertensiva haben zusätzliche zugelassene Indikationen und Wirkungen (z. B. bei Angina pectoris, Herzinsuffizienz oder diabetischer Nierenerkrankung). Diese Überlegungen können die Auswahl der Therapie leiten [siehe Klinische Studien ].
MICARDIS 40 mg HCT ist nicht für die Initialtherapie zur Behandlung von Bluthochdruck indiziert [siehe DOSIERUNG UND ANWENDUNG ].
MICARDIS HCT kann allein oder in Kombination mit anderen blutdrucksenkenden Mitteln angewendet werden.
DOSIERUNG UND ANWENDUNG
Dosierungsinformationen
Beginnen Sie bei einem Patienten, dessen Blutdruck nicht ausreichend kontrolliert ist, mit Telmisartan-Monotherapie 80 mg auf MICARDIS 40 mg HCT, 80 mg/12,5 mg einmal täglich. Falls erforderlich, kann die Dosis nach 2 bis 4 Wochen auf bis zu 160 mg/25 mg titriert werden.
Beginnen Sie einen Patienten, dessen Blutdruck durch 25 mg Hydrochlorothiazid einmal täglich nicht ausreichend kontrolliert wird, oder der kontrolliert ist, aber Hypokaliämie mit diesem Regime auf MICARDIS HCT 80 mg/12,5 mg einmal täglich entwickelt. Falls erforderlich, kann die Dosis nach 2 bis 4 Wochen auf bis zu 160 mg/25 mg titriert werden.
Patienten, die auf die einzelnen Komponenten (Telmisartan und Hydrochlorothiazid) eingestellt wurden, können stattdessen die entsprechende Dosis MICARDIS 20 mg HCT erhalten.
MICARDIS 20 mg HCT kann zusammen mit anderen blutdrucksenkenden Arzneimitteln verabreicht werden.
Dosisanpassung bei eingeschränkter Leberfunktion
Beginnen Sie Patienten mit obstruktiven Gallenerkrankungen oder Leberinsuffizienz unter engmaschiger ärztlicher Überwachung mit der 40-mg/12,5-mg-Kombination. MICARDIS 40 mg HCT-Tabletten werden für Patienten mit schwerer Leberfunktionsstörung nicht empfohlen [siehe Verwendung in bestimmten Bevölkerungsgruppen und KLINISCHE PHARMAKOLOGIE ].
Wichtige Verwaltungsanweisungen
MICARDIS HCT-Tabletten sollten erst unmittelbar vor der Verabreichung aus der Blisterpackung entnommen werden.
WIE GELIEFERT
Darreichungsformen und Stärken
Lagerung und Handhabung
MICARDIS 20 mg HCT ist in drei Stärken als bikonvexe, zweischichtige, längliche, unbeschichtete Tabletten erhältlich, die Telmisartan und Hydrochlorothiazid enthalten:
Lagerung
Bei 25 °C (77 °F) lagern; Exkursionen erlaubt bis 15°C-30°C (59°F-86°F) [siehe USP Kontrollierte Raumtemperatur]. Tabletten sollten erst unmittelbar vor der Anwendung aus Blisterpackungen entnommen werden.
Vertrieb durch: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Überarbeitet: Oktober 2018
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden an anderer Stelle in der Kennzeichnung diskutiert:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien eines Arzneimittels beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die Sicherheit von MICARDIS HCT wurde bei mehr als 1700 Patienten untersucht, darunter 716, die länger als 6 Monate wegen Bluthochdruck behandelt wurden, und 420, die länger als 1 Jahr behandelt wurden. Die Nebenwirkungen beschränkten sich auf diejenigen, die zuvor mit Telmisartan und/oder Hydrochlorothiazid berichtet wurden.
Nebenwirkungen, die bei mit Telmisartan/Hydrochlorothiazid behandelten Patienten mit einer Inzidenz von ≥ 2 % und häufiger als bei mit Placebo behandelten Patienten auftraten, sind in Tabelle 1 aufgeführt [siehe Klinische Studien ].
Andere unter Telmisartan/Hydrochlorothiazid beobachtete Nebenwirkungen waren: Schmerzen (einschließlich Rücken- und Bauchschmerzen), Dyspepsie, Erythem, Erbrechen, Bronchitis und Pharyngitis.
Nebenwirkungen traten bei Männern und Frauen, bei älteren und jüngeren Patienten sowie bei Patienten mit und ohne schwarzer Hautfarbe in etwa gleicher Häufigkeit auf.
Telmisartan
Andere Nebenwirkungen, die unter Telmisartan berichtet wurden, sind unten aufgeführt:
Vegetatives Nervensystem: Impotenz, vermehrtes Schwitzen, Hitzewallungen
Körper als Ganzes: Allergie, Fieber, Beinschmerzen, Brustschmerzen
Herz-Kreislauf: Herzklopfen, Angina pectoris, abnormes EKG, Bluthochdruck, peripheres Ödem
Zentrales Nervensystem: Schlaflosigkeit, Schläfrigkeit, Migräne, Parästhesien, unwillkürliche Muskelkontraktionen, Hypästhesie
Magen-Darm: Blähungen, Verstopfung, Gastritis, Mundtrockenheit, Hämorrhoiden, gastroösophagealer Reflux, Zahnschmerzen
Hepato-biliär: Erhöhungen der Leberenzyme oder des Serumbilirubins
Stoffwechsel: Gicht, Hypercholesterinämie, Diabetes mellitus
Bewegungsapparat: Arthritis, Arthralgie, Wadenkrämpfe, Myalgie
Psychiatrie: Angst, Depression, Nervosität
Widerstandsmechanismus: Infektion, Abszess, Mittelohrentzündung
Atmung: Asthma, Rhinitis, Dyspnoe, Epistaxis
Haut: Dermatitis, Ekzem, Juckreiz
Urin: Miktionsfrequenz, Blasenentzündung
Gefäß: zerebrovaskuläre Störung
Besondere Sinne: Sehstörungen, Konjunktivitis, Tinnitus, Ohrenschmerzen
Hydrochlorothiazid
Andere unerwünschte Ereignisse, die mit Hydrochlorothiazid berichtet wurden, sind unten aufgeführt:
Körper als Ganzes: die Schwäche
Verdauungs: Pankreatitis, Gelbsucht (intrahepatischer cholestatischer Ikterus), Sialadenitis, Krämpfe, Magenreizung
Hämatologisch: aplastische Anämie, Agranulozytose, Leukopenie, hämolytische Anämie, Thrombozytopenie
Überempfindlichkeit: Purpura, Lichtempfindlichkeit, Urtikaria, nekrotisierende Angiitis (Vaskulitis und kutane Vaskulitis), Fieber, Atemnot einschließlich Pneumonitis und Lungenödem, anaphylaktische Reaktionen
Stoffwechsel: Hyperglykämie, Glykosurie
Bewegungsapparat: Muskelkrampf
Nervensystem/Psychiatrie: Unruhe
Nieren: interstitielle Nephritis
Haut: Erythema multiforme einschließlich Stevens-Johnson-Syndrom, exfoliative Dermatitis einschließlich toxischer epidermaler Nekrolyse
Besondere Sinne: vorübergehend verschwommenes Sehen, Xanthopsie
Klinische Laborbefunde
Kreatinin, Blut-Harnstoff-Stickstoff (BUN)
Anstiege von BUN (≥ 11,2 mg/dl) und Serumkreatinin (≥ 0,5 mg/dl) wurden bei 2,8 % bzw. 1,4 % der Patienten mit essenzieller Hypertonie beobachtet, die in kontrollierten Studien mit MICARDIS 80 mg HCT-Tabletten behandelt wurden. Kein Patient brach die Behandlung mit MICARDIS 80 mg HCT-Tabletten wegen eines Anstiegs von BUN oder Kreatinin ab [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von MICARDIS HCT nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Erkrankungen des Blut- und Lymphsystems: Eosinophilie
Herzerkrankungen: Vorhofflimmern, dekompensierte Herzinsuffizienz, Myokardinfarkt, Tachykardie, Bradykardie
Erkrankungen des Ohrs und des Labyrinths: Schwindel
Allgemeine Erkrankungen und Bedingungen am Verabreichungsort: Asthenie, Ödem
Hepato-biliär: Abnorme Leberfunktion/Lebererkrankung
Erkrankungen des Immunsystems: anaphylaktische Reaktion
Infektionen und Schädlinge: Infektion der Harnwege
Untersuchungen: erhöhte CPK
Stoffwechsel- und Ernährungsstörungen: Hypoglykämie (bei Diabetikern)
Erkrankungen des Bewegungsapparates und des Bindegewebes: Sehnenschmerzen (einschließlich Tendinitis, Tenosynovitis), Rhabdomyolyse
Erkrankungen des Nervensystems: Synkope, Kopfschmerzen
Nieren- und Harnwegserkrankungen: Nierenversagen, Nierenfunktionsstörung einschließlich akutem Nierenversagen
Störungen des Fortpflanzungssystems und der Brust: erektile Dysfunktion
Erkrankungen der Atemwege, des Brustraums und des Mediastinums: Husten
Erkrankungen der Haut und des Unterhautgewebes: Arzneimittelexanthem (toxischer Hautausschlag, meist berichtet als Toxicodermie, Hautausschlag und Urtikaria), Angioödem (mit tödlichem Ausgang)
Gefäßerkrankung: orthostatische Hypotonie
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Mittel zur Erhöhung des Serumkaliums
Die gleichzeitige Anwendung von Telmisartan mit anderen Arzneimitteln, die den Kaliumspiegel im Serum erhöhen, kann zu einer Hyperkaliämie führen. Überwachen Sie bei solchen Patienten das Serumkalium.
Lithium
Bei gleichzeitiger Anwendung von Thiazid-Diuretika oder Angiotensin-II-Rezeptor-Antagonisten, einschließlich Telmisartan, wurde über einen Anstieg der Lithiumkonzentration im Serum und eine Lithiumtoxizität berichtet. Überwachen Sie den Lithiumspiegel bei Patienten, die MICARDIS 80 mg HCT und Lithium erhalten.
Nichtsteroidale Entzündungshemmer, einschließlich selektiver Cyclooxygenas E-2-Inhibitoren
Telmisartan
Nichtsteroidale Entzündungshemmer einschließlich selektiver Cyclooxygenase-2-Hemmer (COX-2-Hemmer): Bei älteren Patienten, Patienten mit Volumenmangel (einschließlich Patienten unter Diuretika-Therapie) oder mit eingeschränkter Nierenfunktion, gleichzeitige Verabreichung von NSAIDs, einschließlich selektive COX-2-Hemmer mit ARBs, einschließlich Telmisartan, können zu einer Verschlechterung der Nierenfunktion führen, einschließlich eines möglichen akuten Nierenversagens. Diese Effekte sind normalerweise reversibel. Die blutdrucksenkende Wirkung von ARBs kann durch NSAIDs abgeschwächt werden. Daher sollten bei Patienten, die MICARDIS 40 mg HCT und NSAIDs erhalten, regelmäßig die Nierenfunktion und der Blutdruck überwacht werden.
Hydrochlorothiazid
Die Verabreichung eines nichtsteroidalen Entzündungshemmers, einschließlich eines selektiven COX2-Hemmers, kann die diuretische, natriuretische und blutdrucksenkende Wirkung von Diuretika verringern. Daher ist bei gleichzeitiger Anwendung von MICARDIS HCT und nichtsteroidalen Antirheumatika einschließlich selektiver COX2-Hemmer genau zu beobachten, ob die gewünschte Wirkung des Diuretikums eintritt.
Duale Blockade des Renin-Angiotens-In-Aldosteron-Systems und Veränderungen der Nierenfunktion
Die duale Blockade des Renin-Angiotensin-Aldosteron-Systems (RAS) mit Angiotensin-Blockern, ACE-Hemmern oder Aliskiren ist mit einem erhöhten Risiko für Hypotonie, Hyperkaliämie und Nierenfunktionsstörung verbunden. In die ONTARGET-Studie wurden 25.620 Patienten im Alter von ≥ 55 Jahren mit atherosklerotischer Erkrankung oder Diabetes mit Endorganschäden aufgenommen, die randomisiert entweder nur Telmisartan (ARB), nur Ramipril (ACE-Hemmer) oder der Kombination erhielten, und sie über einen medianen Zeitraum von 56 Monaten nachbeobachtet . Patienten, die die Kombination aus ARB und ACE-Hemmern erhielten, erzielten im Vergleich zur ARB-Monotherapie oder ACE-Hemmer-Monotherapie keinen zusätzlichen Nutzen (keine zusätzliche Verringerung des Risikos für kardiovaskulären Tod, Myokardinfarkt, Schlaganfall oder Krankenhauseinweisung aufgrund von Herzinsuffizienz), erlebten jedoch einen Anstieg Inzidenz von Nierenfunktionsstörungen (z. B. akutes Nierenversagen) im Vergleich zu Monotherapiegruppen.
Vermeiden Sie im Allgemeinen die kombinierte Anwendung von RAS-Hemmern. Bei Patienten, die MICARDIS 40 mg HCT und andere Wirkstoffe, die das RAS beeinflussen, erhalten, sind Blutdruck, Nierenfunktion und Elektrolyte engmaschig zu überwachen.
Verabreichen Sie Aliskiren nicht gleichzeitig mit MICARDIS HCT bei Patienten mit Diabetes. Vermeiden Sie die gleichzeitige Anwendung von Aliskiren mit MICARDIS HCT bei Patienten mit eingeschränkter Nierenfunktion (GFR
Digoxin
Bei gleichzeitiger Anwendung von Telmisartan mit Digoxin wurden mediane Anstiege der Digoxin-Spitzenplasmakonzentration (49 %) und der Talkonzentration (20 %) beobachtet. Überwachen Sie die Digoxinspiegel bei Patienten, die gleichzeitig MICARDIS 40 mg HCT und Digoxin einnehmen.
Antidiabetika (orale Mittel und Insulin)
Bei gleichzeitiger Anwendung mit Hydrochlorothiazid kann eine Dosisanpassung von Antidiabetika erforderlich sein.
Cholestyramin- und Colestipol-Harze
Die Resorption von Hydrochlorothiazid wird in Gegenwart von Anionenaustauscherharzen beeinträchtigt. Staffeln Sie die Dosierung von Hydrochlorothiazid und Harz so, dass Hydrochlorothiazid mindestens 4 Stunden vor oder 4 bis 6 Stunden nach der Verabreichung des Harzes verabreicht wird.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Fötale Toxizität
Telmisartan
Die Einnahme von Arzneimitteln, die während des zweiten und dritten Trimenons der Schwangerschaft auf das Renin-Angiotensin-System wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod. Das resultierende Oligohydramnion kann mit fetaler Lungenhypoplasie und Skelettdeformationen einhergehen. Mögliche Nebenwirkungen bei Neugeborenen sind Schädelhypoplasie, Anurie, Hypotonie, Nierenversagen und Tod. Wenn eine Schwangerschaft festgestellt wird, setzen Sie MICARDIS HCT so schnell wie möglich ab.
Hydrochlorothiazid
Thiazide passieren die Plazentaschranke und treten im Nabelschnurblut auf. Zu den Nebenwirkungen gehören fötale oder neonatale Gelbsucht und Thrombozytopenie [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Hypotonie bei Patienten mit Volumen- oder Salzmangel
Bei Patienten mit einem aktivierten Renin-Angiotensin-System, wie z. B. Patienten mit Volumen- oder Salzmangel (z. B. Patienten, die mit hochdosierten Diuretika behandelt werden), kann nach Beginn der Behandlung mit MICARDIS HCT eine symptomatische Hypotonie auftreten. Korrigieren Sie den Volumen- oder Salzmangel vor der Verabreichung von MICARDIS 80 mg HCT.
Beeinträchtigte Nierenfunktion
Veränderungen der Nierenfunktion einschließlich akutem Nierenversagen können durch Arzneimittel, die das Renin-Angiotensin-System hemmen, und durch Diuretika verursacht werden. Patienten, deren Nierenfunktion teilweise von der Aktivität des Renin-Angiotensin-Systems abhängt (z. B. Patienten mit Nierenarterienstenose, chronischer Nierenerkrankung, schwerer kongestiver Herzinsuffizienz oder Volumenmangel), können einem besonderen Risiko ausgesetzt sein, eine Oligurie oder progressive Azotämie zu entwickeln oder akutes Nierenversagen unter MICARDIS HCT. Überwachen Sie die Nierenfunktion bei diesen Patienten regelmäßig. Erwägen Sie das Aussetzen oder Absetzen der Therapie bei Patienten, die unter MICARDIS HCT eine klinisch signifikante Abnahme der Nierenfunktion entwickeln.
Elektrolyte und Stoffwechselstörungen
Arzneimittel, einschließlich Telmisartan, die das Renin-Angiotensin-System hemmen, können eine Hyperkaliämie verursachen, insbesondere bei Patienten mit Niereninsuffizienz, Diabetes oder bei gleichzeitiger Anwendung mit anderen Angiotensin-Rezeptorblockern oder ACE-Hemmern und bei gleichzeitiger Anwendung anderer Arzneimittel, die den Kaliumspiegel im Serum erhöhen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Hydrochlorothiazid kann Hypokaliämie und Hyponatriämie verursachen. Es wurde gezeigt, dass Thiazide die Ausscheidung von Magnesium über den Urin erhöhen; dies kann zu einer Hypomagnesiämie führen. Hypomagnesiämie kann zu Hypokaliämie führen, die trotz Kaliumsättigung schwierig zu behandeln sein kann. Serumelektrolyte regelmäßig überwachen.
In kontrollierten Studien mit der Telmisartan/Hydrochlorothiazid-Kombinationsbehandlung kam es bei keinem Patienten, dem 40 mg/12,5 mg, 80 mg/12,5 mg oder 80 mg/25 mg verabreicht wurden, zu einer Abnahme des Kaliums um ≥ 1,4 mEq/l, und bei keinem Patienten kam es zu einer Hyperkaliämie.
Hydrochlorothiazid verringert die Kalziumausscheidung im Urin und kann Erhöhungen des Serumkalziums verursachen.
Hydrochlorothiazid kann die Glukosetoleranz verändern und die Serumspiegel von Cholesterin und Triglyceriden erhöhen.
Bei bestimmten Patienten, die eine Thiazid-Therapie erhalten, kann eine Hyperurikämie auftreten oder eine offene Gicht ausgelöst werden. Da Telmisartan die Harnsäure senkt, schwächt Telmisartan in Kombination mit Hydrochlorothiazid die Diuretika-induzierte Hyperurikämie ab.
Überempfindlichkeitsreaktion
Hydrochlorothiazid
Überempfindlichkeitsreaktionen auf Hydrochlorothiazid können bei Patienten mit oder ohne Allergie oder Bronchialasthma in der Vorgeschichte auftreten, sind aber bei Patienten mit einer solchen Vorgeschichte wahrscheinlicher [siehe KONTRAINDIKATIONEN ].
Akute Myopie und sekundäres Engwinkelglaukom
Hydrochlorothiazid, ein Sulfonamid, kann eine idiosynkratische Reaktion hervorrufen, die zu akuter vorübergehender Myopie und akutem Engwinkelglaukom führt. Zu den Symptomen gehören ein akuter Beginn einer verminderten Sehschärfe oder Augenschmerzen und treten typischerweise innerhalb von Stunden bis Wochen nach Beginn der Behandlung auf. Unbehandeltes akutes Engwinkelglaukom kann zu dauerhaftem Sehverlust führen. Die primäre Behandlung besteht darin, Hydrochlorothiazid so schnell wie möglich abzusetzen. Wenn der Augeninnendruck unkontrolliert bleibt, müssen möglicherweise umgehend medizinische oder chirurgische Behandlungen in Betracht gezogen werden. Risikofaktoren für die Entwicklung eines akuten Engwinkelglaukoms können eine Sulfonamid- oder Penicillinallergie in der Vorgeschichte sein.
Systemischer Lupus erythematodes
Es wurde berichtet, dass Thiaziddiuretika eine Exazerbation oder Aktivierung des systemischen Lupus erythematodes verursachen.
Postsympathektomie-Patienten
Die blutdrucksenkende Wirkung von Hydrochlorothiazid kann bei Postsympathektomie-Patienten verstärkt werden.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( INFORMATIONEN ZUM PATIENTEN ).
Schwangerschaft
Informieren Sie Patientinnen im gebärfähigen Alter über die Folgen einer Exposition gegenüber MICARDIS 40 mg HCT während der Schwangerschaft. Besprechen Sie Behandlungsmöglichkeiten mit Frauen, die eine Schwangerschaft planen. Weisen Sie die Patientinnen an, Schwangerschaften so schnell wie möglich ihrem Arzt zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Stillzeit
Weisen Sie stillende Frauen darauf hin, während der Behandlung mit MICARDIS HCT nicht zu stillen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Symptomatische Hypotonie und Synkope
Weisen Sie die Patienten darauf hin, dass insbesondere in den ersten Tagen der Therapie Schwindel auftreten kann, und melden Sie dies Ihrem Arzt. Informieren Sie die Patienten darüber, dass unzureichende Flüssigkeitsaufnahme, übermäßiges Schwitzen, Durchfall oder Erbrechen zu einem übermäßigen Abfall des Blutdrucks führen können, mit den gleichen Folgen wie Benommenheit und möglichen Synkopen. Raten Sie den Patienten, sich an ihren Arzt zu wenden, wenn eine Synkope auftritt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Kalium-Ergänzungen
Weisen Sie die Patienten darauf hin, keine kaliumhaltigen Kaliumpräparate oder kaliumhaltigen Salzersatzmittel ohne Rücksprache mit dem verschreibenden Arzt zu verwenden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Akute Myopie und sekundäres Engwinkelglaukom
Weisen Sie die Patienten an, MICARDIS 80 mg HCT abzusetzen und sofort einen Arzt aufzusuchen, wenn bei ihnen Symptome einer akuten Myopie oder eines sekundären Winkelverschlussglaukoms auftreten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Telmisartan und Hydrochlorothiazid
Es wurden keine Karzinogenitäts-, Mutagenitäts- oder Fertilitätsstudien mit der Kombination von Telmisartan und Hydrochlorothiazid durchgeführt.
Telmisartan
Es gab keine Hinweise auf Karzinogenität, wenn Telmisartan Mäusen und Ratten über einen Zeitraum von bis zu 2 Jahren mit dem Futter verabreicht wurde. Die höchsten an Mäuse (1000 mg/kg/Tag) und Ratten (100 mg/kg/Tag) verabreichten Dosen betragen auf mg/m2-Basis etwa das 59- bzw. 13-fache der maximal empfohlenen Humandosis (MRHD). Telmisartan. Es wurde gezeigt, dass dieselben Dosen zu einer durchschnittlichen systemischen Exposition gegenüber Telmisartan führen, die >100-mal bzw. >25-mal höher ist als die systemische Exposition bei Menschen, die die MRHD von Telmisartan (80 mg/Tag) erhalten.
Tests zur Genotoxizität zeigten keine mit Telmisartan in Verbindung stehenden Wirkungen, weder auf Gen- noch auf Chromosomenebene. Diese Assays umfassten bakterielle Mutagenitätstests mit Salmonella und E. coli (Ames), einen Genmutationstest mit V79-Zellen des chinesischen Hamsters, einen zytogenetischen Test mit menschlichen Lymphozyten und einen Maus-Mikrokerntest.
Bei 100 mg/kg/Tag (höchste verabreichte Dosis), etwa dem 13-Fachen der MRHD von Telmisartan auf mg/m2-Basis, wurden keine arzneimittelbedingten Wirkungen auf die Fortpflanzungsleistung männlicher und weiblicher Ratten festgestellt. Diese Dosis führte bei Ratten zu einer durchschnittlichen systemischen Exposition (Telmisartan-AUC, bestimmt am Tag 6 der Trächtigkeit), die mindestens dem 50-fachen der durchschnittlichen systemischen Exposition beim Menschen bei der MRHD (80 mg/Tag) entsprach.
Hydrochlorothiazid
Zweijährige Fütterungsstudien an Mäusen und Ratten, die unter der Schirmherrschaft des National Toxicology Program (NTP) durchgeführt wurden, ergaben keine Hinweise auf ein karzinogenes Potenzial von Hydrochlorothiazid bei weiblichen Mäusen (bei Dosen von bis zu etwa 600 mg/kg/Tag) oder bei männlichen und weibliche Ratten (in Dosen von bis zu etwa 100 mg/kg/Tag). Das NTP fand jedoch zweideutige Beweise für die Hepatokanzerogenität bei männlichen Mäusen.
Hydrochlorothiazid war in vitro im Ames-Mutagenitätstest der Salmonella typhimurium-Stämme TA 98, TA 100, TA 1535, TA 1537 und TA 1538 und im Chinese Hamster Ovary (CHO)-Test auf Chromosomenaberrationen oder in vivo in Assays nicht genotoxisch Keimzellchromosomen der Maus, Knochenmarkchromosomen des chinesischen Hamsters und das geschlechtsgebundene rezessive letale Merkmalsgen von Drosophila. Positive Testergebnisse wurden im In-vitro-CHO-Schwesterchromatid-Austauschtest (Klastogenität), im Maus-Lymphomzellen-Test (Mutagenität) und im Aspergillus nidulans-Non-Disjunction-Test erzielt.
Hydrochlorothiazid hatte keine nachteiligen Auswirkungen auf die Fertilität von Mäusen und Ratten beiderlei Geschlechts in Studien, in denen diese Arten über ihre Nahrung Dosen von bis zu 100 bzw. 4 mg/kg vor der Paarung und während der gesamten Trächtigkeit ausgesetzt waren.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
MICARDIS HCT kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Die Einnahme von Arzneimitteln, die auf das Renin-Angiotensin-System während des zweiten und dritten Trimenons der Schwangerschaft wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod (siehe Klinische Überlegungen ). Die meisten epidemiologischen Studien, die fötale Anomalien nach Anwendung von Antihypertensiva im ersten Trimenon untersuchten, haben Arzneimittel, die das Renin-Angiotensin-System beeinflussen, nicht von anderen Antihypertonika unterschieden. Studien an Ratten und Kaninchen mit Telmisartan zeigten Fetotoxizität nur bei für das Muttertier toxischen Dosen (vgl Daten ). Wenn eine Schwangerschaft festgestellt wird, setzen Sie MICARDIS HCT so schnell wie möglich ab.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 % bis 4 % bzw. 15 % bis 20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryo/fetales Risiko
Bluthochdruck in der Schwangerschaft erhöht das mütterliche Risiko für Präeklampsie, Schwangerschaftsdiabetes, Frühgeburt und Geburtskomplikationen (z. B. Notwendigkeit eines Kaiserschnitts und postpartale Blutungen). Bluthochdruck erhöht das fötale Risiko für eine intrauterine Wachstumsbeschränkung und einen intrauterinen Tod. Schwangere Frauen mit Bluthochdruck sollten sorgfältig überwacht und entsprechend behandelt werden.
Fötale/neonatale Nebenwirkungen
Telmisartan
Die Anwendung von Arzneimitteln, die im zweiten und dritten Trimenon der Schwangerschaft auf das RAS einwirken, kann zu Folgendem führen: Oligohydramnion, reduzierte fetale Nierenfunktion, die zu Anurie und Nierenversagen führt, fetale Lungenhypoplasie, Skelettdeformationen, einschließlich Schädelhypoplasie, Hypotonie und Tod . In dem ungewöhnlichen Fall, dass es für einen bestimmten Patienten keine geeignete Alternative zu einer Therapie mit Arzneimitteln gibt, die das Renin-Angiotensin-System beeinflussen, informieren Sie die Mutter über das potenzielle Risiko für den Fötus.
Führen Sie bei Patientinnen, die MICARDIS HCT während der Schwangerschaft einnehmen, serielle Ultraschalluntersuchungen durch, um das intraamniotische Milieu zu beurteilen. Abhängig von der Schwangerschaftswoche kann ein fetaler Test angebracht sein. Wenn Oligohydramnion beobachtet wird, ist MICARDIS HCT abzusetzen, es sei denn, es wird als lebensrettend für die Mutter angesehen. Patienten und Ärzte sollten sich jedoch darüber im Klaren sein, dass Oligohydramnion möglicherweise erst auftritt, nachdem der Fötus eine irreversible Verletzung erlitten hat.
Beobachten Sie Säuglinge, die in der Vergangenheit Micardis 20 mg HCT in der Gebärmutter ausgesetzt waren, genau auf Hypotonie, Oligurie und Hyperkaliämie. Wenn Oligurie oder Hypotonie auftritt, unterstützen Sie den Blutdruck und die Nierendurchblutung. Austauschtransfusionen oder Dialyse können erforderlich sein, um eine Hypotonie umzukehren und die Nierenfunktion zu ersetzen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Hydrochlorothiazid
Thiazide passieren die Plazenta, und die Anwendung von Thiaziden während der Schwangerschaft ist mit einem Risiko von fötaler oder neonataler Gelbsucht, Thrombozytopenie und möglichen anderen Nebenwirkungen verbunden, die bei Erwachsenen aufgetreten sind.
Daten
Tierdaten
MICARDIS 40 mg HCT
Eine Entwicklungstoxizitätsstudie wurde an Ratten mit Telmisartan/Hydrochlorothiazid-Dosen von 3,2/1,0, 15/4,7, 50/15,6 und 0/15,6 mg/kg/Tag durchgeführt. Obwohl die beiden höheren Dosiskombinationen für die Muttertiere toxischer zu sein schienen (signifikante Abnahme der Körpergewichtszunahme) als jedes Arzneimittel allein, schien es keine Zunahme der Toxizität für die sich entwickelnden Embryonen zu geben.
Telmisartan
Es wurden keine teratogenen Wirkungen beobachtet, wenn Telmisartan trächtigen Ratten in oralen Dosen von bis zu 50 mg/kg/Tag und trächtigen Kaninchen in oralen Dosen von bis zu 45 mg/kg/Tag verabreicht wurde. Bei Kaninchen wurde bei 45 mg/kg/Tag (etwa das 12-fache der maximal empfohlenen Humandosis [MRHD] von 80 mg auf mg/m2-Basis) Embryoletalität in Verbindung mit maternaler Toxizität (reduzierte Körpergewichtszunahme und Futteraufnahme) beobachtet. Bei Ratten wurde beobachtet, dass mütterlich toxische (verringerte Körpergewichtsentwicklung und Futteraufnahme) Telmisartan-Dosen von 15 mg/kg/Tag (ungefähr das 1,9-fache der MRHD auf mg/m2-Basis), die während der späten Trächtigkeit und Laktation verabreicht wurden, unerwünschte Wirkungen hervorriefen bei Neugeborenen, einschließlich reduzierter Lebensfähigkeit, niedrigem Geburtsgewicht, verzögerter Reifung und verringerter Gewichtszunahme. Die Dosen ohne beobachtete Wirkung für Entwicklungstoxizität bei Ratten und Kaninchen, 5 bzw. 15 mg/kg/Tag, sind ungefähr das 0,64- bzw. 3,7-Fache auf mg/m2-Basis der MRHD von Telmisartan (80 mg/Tag ).
Hydrochlorothiazid
Studien, in denen Hydrochlorothiazid trächtigen Mäusen und Ratten in Dosen von bis zu 3000 bzw. 1000 mg/kg/Tag (etwa das 600- bzw. 400-fache der MRHD) während ihrer jeweiligen Phase der Hauptorganogenese verabreicht wurde, ergaben keine Hinweise auf eine Schädigung des Fötus .
Thiazide können die Plazenta passieren, und die in der Nabelvene erreichten Konzentrationen nähern sich denen im mütterlichen Plasma. Hydrochlorothiazid kann wie andere Diuretika eine Hypoperfusion der Plazenta verursachen. Es reichert sich im Fruchtwasser an, mit berichteten Konzentrationen bis zum 19-fachen der im Nabelvenenplasma. Die Anwendung von Thiaziden während der Schwangerschaft ist mit dem Risiko einer fötalen oder neonatalen Gelbsucht oder Thrombozytopenie verbunden. Da sie den Verlauf der EPH (Ödem, Proteinurie, Hypertonie) Gestose (Präeklampsie) nicht verhindern oder verändern, sollten diese Arzneimittel nicht zur Behandlung von Bluthochdruck bei schwangeren Frauen angewendet werden. Die Anwendung von Hydrochlorothiazid für andere Indikationen (z. B. Herzerkrankungen) in der Schwangerschaft sollte vermieden werden.
Stillzeit
Zusammenfassung der Risiken
Es liegen keine Informationen über das Vorhandensein von MICARDIS 20 mg HCT oder Telmisartan in der Muttermilch, die Auswirkungen auf den gestillten Säugling oder die Auswirkungen auf die Milchproduktion vor. Begrenzte veröffentlichte Studien berichten, dass Hydrochlorothiazid in der Muttermilch vorhanden ist. Es liegen jedoch keine ausreichenden Informationen vor, um die Auswirkungen von Hydrochlorothiazid auf den gestillten Säugling oder die Auswirkungen von Hydrochlorothiazid auf die Milchproduktion zu bestimmen. Telmisartan ist in der Milch säugender Ratten vorhanden. (sehen Daten ). Aufgrund der Möglichkeit schwerwiegender Nebenwirkungen beim gestillten Säugling, einschließlich Hypotonie, Hyperkaliämie und Nierenfunktionsstörung, raten Sie einer stillenden Frau, während der Behandlung mit MICARDIS HCT nicht zu stillen.
Daten
Telmisartan war 4 bis 8 Stunden nach der Verabreichung in der Milch laktierender Ratten in 1,5- bis 2-fach höheren Konzentrationen als im Plasma vorhanden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von MICARDIS HCT bei pädiatrischen Patienten wurde nicht nachgewiesen.
Neugeborene mit einer Vorgeschichte von In-utero-Exposition gegenüber MICARDIS HCT
Wenn Oligurie oder Hypotonie auftritt, unterstützen Sie den Blutdruck und die Nierendurchblutung. Austauschtransfusionen oder Dialyse können erforderlich sein, um eine Hypotonie umzukehren und/oder eine gestörte Nierenfunktion zu ersetzen.
Geriatrische Verwendung
In den kontrollierten klinischen Studien (n = 1017) waren etwa 20 % der mit Telmisartan/Hydrochlorothiazid behandelten Patienten 65 Jahre oder älter und 5 % waren 75 Jahre oder älter. Insgesamt wurden bei diesen Patienten keine Unterschiede in der Wirksamkeit und Sicherheit von Telmisartan/Hydrochlorothiazid im Vergleich zu jüngeren Patienten beobachtet. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und von Begleiterkrankungen oder anderen medikamentösen Therapien widerzuspiegeln.
Anwendung bei Patienten mit eingeschränkter Leberfunktion
Patienten mit obstruktiven Gallenerkrankungen oder Leberinsuffizienz sollten die Behandlung unter engmaschiger ärztlicher Überwachung mit der Kombination 40 mg/12,5 mg beginnen.
Telmisartan
Da der Großteil von Telmisartan über die Galle ausgeschieden wird, ist bei Patienten mit obstruktiven Gallenstörungen oder Leberinsuffizienz mit einer verringerten Clearance und höheren Blutspiegeln zu rechnen.
Hydrochlorothiazid
Geringfügige Veränderungen des Flüssigkeits- und Elektrolythaushalts können bei Patienten mit eingeschränkter Leberfunktion oder fortschreitender Lebererkrankung ein hepatisches Koma auslösen.
Anwendung bei Patienten mit eingeschränkter Nierenfunktion
Die Sicherheit und Wirksamkeit von MICARDIS 40 mg HCT bei Patienten mit schwerer Nierenfunktionsstörung (CrCl ≤ 30 ml/min) wurde nicht nachgewiesen. Bei Patienten mit schwerer Nierenfunktionsstörung werden MICARDIS 80 mg HCT-Tabletten nicht empfohlen. Bei Patienten mit leichter (CrCl 60 bis 90 ml/min) oder mäßiger (CrCl 30 bis 60 ml/min) Nierenfunktionsstörung ist keine Dosisanpassung erforderlich.
ÜBERDOSIS
Telmisartan
Zur Überdosierung von Telmisartan beim Menschen liegen begrenzte Daten vor. Die wahrscheinlichsten Manifestationen einer Überdosierung mit Telmisartan sind Hypotonie, Schwindel und Tachykardie; Bradykardie kann durch parasympathische (vagale) Stimulation auftreten. Wenn eine symptomatische Hypotonie auftritt, sollte eine unterstützende Behandlung eingeleitet werden. Telmisartan wird nicht durch Hämodialyse entfernt.
Hydrochlorothiazid
Die häufigsten Anzeichen und Symptome, die bei Patienten mit einer Überdosierung von Hydrochlorothiazid beobachtet werden, sind solche, die durch Elektrolytmangel (Hypokaliämie, Hypochlorämie, Hyponatriämie) und Dehydratation infolge übermäßiger Diurese verursacht werden. Wenn auch Digitalis verabreicht wurde, kann eine Hypokaliämie Herzrhythmusstörungen verstärken. Das Ausmaß, in dem Hydrochlorothiazid durch Hämodialyse entfernt wird, wurde nicht ermittelt. Die orale LD von Hydrochlorothiazid liegt sowohl bei Mäusen als auch bei Ratten über 10 g/kg.
KONTRAINDIKATIONEN
MICARDIS HCT ist kontraindiziert:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
MICARDIS 40 mg HCT
MICARDIS 20 mg HCT ist eine Kombination aus zwei Arzneimitteln mit blutdrucksenkenden Eigenschaften: einem Thiaziddiuretikum, Hydrochlorothiazid und einem Angiotensin-II-Rezeptorblocker (ARB), Telmisartan.
Telmisartan
Angiotensin II wird aus Angiotensin I in einer durch das Angiotensin-Converting-Enzym (ACE, Kininase II) katalysierten Reaktion gebildet. Angiotensin II ist der wichtigste blutdruckerhöhende Wirkstoff des Renin-Angiotensin-Systems mit Effekten wie Vasokonstriktion, Stimulierung der Synthese und Freisetzung von Aldosteron, Herzstimulation und renale Reabsorption von Natrium. Telmisartan blockiert die vasokonstriktorischen und Aldosteronsekretionseffekte von Angiotensin II, indem es in vielen Geweben, wie der glatten Gefäßmuskulatur und der Nebenniere, selektiv die Bindung von Angiotensin II an den AT1-Rezeptor blockiert. Seine Wirkung ist daher unabhängig von den Wegen der Angiotensin-II-Synthese.
Es gibt auch einen AT2-Rezeptor, der in vielen Geweben gefunden wird, aber es ist nicht bekannt, dass AT2 mit der kardiovaskulären Homöostase assoziiert ist. Telmisartan hat eine viel größere Affinität (>3.000-fach) für den AT1-Rezeptor als für den AT2-Rezeptor.
Telmisartan hemmt weder ACE (Kininase II) noch bindet oder blockiert es andere Hormonrezeptoren oder Ionenkanäle, von denen bekannt ist, dass sie wichtig für die kardiovaskuläre Regulation sind.
Die Blockade des Angiotensin-II-Rezeptors hemmt die negative regulatorische Rückkopplung von Angiotensin II auf die Reninsekretion, aber die resultierende erhöhte Plasma-Renin-Aktivität und die zirkulierenden Angiotensin-II-Spiegel überwinden nicht die Wirkung von Telmisartan auf den Blutdruck.
Hydrochlorothiazid
Hydrochlorothiazid ist ein Thiazid-Diuretikum. Thiazide beeinflussen die renalen tubulären Mechanismen der Elektrolytreabsorption und erhöhen direkt die Ausscheidung von Natriumsalz und Chlorid in ungefähr äquivalenten Mengen. Indirekt verringert die diuretische Wirkung von Hydrochlorothiazid das Plasmavolumen, was zu einem Anstieg der Plasma-Renin-Aktivität, einem Anstieg der Aldosteronsekretion, einem Anstieg des Kaliumverlusts im Urin und einem Abfall des Serumkaliums führt. Die Renin-Aldosteron-Verbindung wird durch Angiotensin II vermittelt, sodass die gleichzeitige Verabreichung eines ARB dazu neigt, den mit diesen Diuretika verbundenen Kaliumverlust umzukehren. Der Mechanismus der blutdrucksenkenden Wirkung von Thiaziden ist nicht vollständig geklärt.
Pharmakodynamik
Telmisartan
Bei gesunden Probanden hemmte eine Telmisartan-Dosis von 80 mg die pressorische Reaktion auf eine intravenöse Infusion von Angiotensin II um etwa 90 % bei maximalen Plasmakonzentrationen, wobei eine Hemmung von etwa 40 % über 24 Stunden anhielt.
Die Plasmakonzentration von Angiotensin II und die Plasma-Renin-Aktivität stiegen dosisabhängig nach Einzelgabe von Telmisartan an gesunde Probanden und nach wiederholter Gabe an Bluthochdruckpatienten. Die einmal tägliche Verabreichung von bis zu 80 mg Telmisartan an gesunde Probanden hatte keinen Einfluss auf die Plasma-Aldosteronkonzentrationen. In Mehrfachdosisstudien mit Bluthochdruckpatienten gab es keine klinisch signifikanten Veränderungen der Elektrolyte (Serumkalium oder -natrium) oder der Stoffwechselfunktion (einschließlich Serumspiegel von Cholesterin, Triglyceriden, HDL, LDL, Glukose oder Harnsäure).
Die blutdrucksenkende Wirkung von Telmisartan wurde in sechs placebokontrollierten klinischen Studien mit insgesamt 1773 Patienten mit leichter bis mittelschwerer Hypertonie (diastolischer Blutdruck von 95 bis 114 mmHg) untersucht, von denen 1031 mit Telmisartan behandelt wurden. Nach einmal täglicher Gabe von Telmisartan betrug das Ausmaß der Blutdrucksenkung vom Ausgangswert nach Abzug des Placebos ungefähr (SBP/DBP) 6-8/6 mmHg für 20 mg, 9-13/6-8 mmHg für 40 mg und 12 -13/7-8 mmHg für 80 mg. Höhere Dosen (bis zu 160 mg) schienen keine weitere Senkung des Blutdrucks zu verursachen.
Der Beginn der blutdrucksenkenden Wirkung tritt innerhalb von 3 Stunden ein, mit einer maximalen Reduktion nach etwa 4 Wochen. Bei Dosierungen von 20, 40 und 80 mg blieb die blutdrucksenkende Wirkung einer einmal täglichen Gabe von Telmisartan über das gesamte 24-stündige Dosierungsintervall erhalten.
Bei 30 hypertensiven Patienten mit normaler Nierenfunktion, die 8 Wochen lang mit Telmisartan 80 mg oder Telmisartan 80 mg in Kombination mit Hydrochlorothiazid 12,5 mg behandelt wurden, gab es keine klinisch signifikanten Veränderungen gegenüber dem Ausgangswert in Bezug auf Nierendurchblutung, glomeruläre Filtrationsrate, Filtrationsfraktion, renovaskulären Widerstand, oder Kreatinin-Clearance.
Hydrochlorothiazid
Nach oraler Gabe von Hydrochlorothiazid beginnt die Diurese innerhalb von 2 Stunden, erreicht ihren Höhepunkt nach etwa 4 Stunden und hält etwa 6 bis 12 Stunden an.
Wechselwirkungen mit anderen Medikamenten
Hydrochlorothiazid
Alkohol, Barbiturate oder Betäubungsmittel
Es kann zu einer Verstärkung der orthostatischen Hypotonie kommen.
Skelettmuskelrelaxantien
Mögliche erhöhte Reaktion auf Muskelrelaxanzien wie Curare-Derivate.
Kortikosteroide, ACTH
Verstärkter Elektrolytmangel, insbesondere Hypokaliämie.
Pressoramine (z. B. Norepinephrin)
Mögliche verminderte Reaktion auf Pressoramine, aber nicht ausreichend, um ihre Verwendung auszuschließen.
Pharmakokinetik
Telmisartan
Absorption:
Nach oraler Gabe werden Spitzenkonzentrationen (Cmax) von Telmisartan 0,5 bis 1 Stunde nach der Einnahme erreicht. Nahrungsaufnahme reduziert die Bioverfügbarkeit von Telmisartan leicht, mit einer Verringerung der Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC) von etwa 6 % bei 40 mg und etwa 20 % nach einer 160-mg-Dosis. MICARDIS 20 mg HCT kann mit oder ohne Nahrung verabreicht werden. Die absolute Bioverfügbarkeit von Telmisartan ist dosisabhängig. Bei 40 und 160 mg betrug die Bioverfügbarkeit 42 % bzw. 58 %. Die Pharmakokinetik von Telmisartan mit oral verabreichtem MICARDIS 20 mg ist über den Dosisbereich von 20 bis 160 mg nicht linear, mit überproportionalem Anstieg der Plasmakonzentrationen (Cmax und AUC) mit steigenden Dosen. Telmisartan zeigt eine biexponentielle Abbaukinetik mit einer terminalen Eliminationshalbwertszeit von etwa 24 Stunden. Die minimalen Plasmakonzentrationen von Telmisartan bei einmal täglicher Gabe betragen etwa 10 % bis 25 % der maximalen Plasmakonzentrationen. Telmisartan hat einen Akkumulationsindex im Plasma von 1,5 bis 2,0 bei wiederholter einmal täglicher Gabe.
Verteilung:
Telmisartan wird in hohem Maße an Plasmaproteine gebunden (>99,5 %), hauptsächlich Albumin und α1-saures Glykoprotein. Die Plasmaproteinbindung ist über den mit den empfohlenen Dosen erreichten Konzentrationsbereich konstant. Das Verteilungsvolumen von Telmisartan beträgt etwa 500 Liter, was auf eine zusätzliche Gewebebindung hinweist.
Stoffwechsel:
Telmisartan wird durch Konjugation zu einem pharmakologisch inaktiven Acylglucuronid metabolisiert; das Glucuronid der Ausgangsverbindung ist der einzige Metabolit, der in menschlichem Plasma und Urin identifiziert wurde. Nach einer Einzeldosis macht das Glucuronid ungefähr 11 % der gemessenen Radioaktivität im Plasma aus. Die Cytochrom-P450-Isoenzyme sind nicht am Metabolismus von Telmisartan beteiligt.
Beseitigung:
Nach entweder intravenöser oder oraler Gabe von 14C-markiertem Telmisartan wurde der größte Teil der verabreichten Dosis (> 97 %) unverändert über die Galle mit den Fäzes ausgeschieden; im Urin wurden nur geringe Mengen gefunden (0,91 % bzw. 0,49 % der Gesamtradioaktivität).
Die Gesamtplasmaclearance von Telmisartan beträgt >800 ml/min. Terminale Halbwertszeit und Gesamtclearance scheinen dosisunabhängig zu sein.
Hydrochlorothiazid
Hydrochlorothiazid wird nicht metabolisiert, sondern schnell über die Nieren ausgeschieden. Wenn die Plasmaspiegel mindestens 24 Stunden lang beobachtet wurden, wurde beobachtet, dass die Plasmahalbwertszeit zwischen 5,6 und 14,8 Stunden schwankt. Mindestens 61 % der oralen Dosis werden unverändert innerhalb von 24 Stunden ausgeschieden.
Hydrochlorothiazid passiert die Plazenta-, aber nicht die Blut-Hirn-Schranke und wird in die Muttermilch ausgeschieden.
Spezifische Populationen
Telmisartan
Niereninsuffizienz
Telmisartan wird nicht durch Hämofiltration aus dem Blut entfernt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , und Verwendung in bestimmten Bevölkerungsgruppen ].
Leberinsuffizienz
Bei Patienten mit Leberinsuffizienz sind die Plasmakonzentrationen von Telmisartan erhöht und die absolute Bioverfügbarkeit nähert sich 100 % [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Geschlecht
Die Plasmakonzentrationen von Telmisartan sind bei Frauen im Allgemeinen 2- bis 3-mal höher als bei Männern. In klinischen Studien wurde jedoch bei Frauen kein signifikanter Anstieg der Blutdruckreaktion oder des Auftretens von orthostatischer Hypotonie festgestellt. Eine Dosisanpassung ist nicht erforderlich.
Geriatrische Patienten
Die Pharmakokinetik von Telmisartan unterscheidet sich nicht zwischen älteren und jüngeren Patienten unter 65 Jahren.
Arzneimittelwechselwirkungsstudien
Telmisartan
Ramipril
Die gleichzeitige Anwendung von Telmisartan 80 mg einmal täglich und Ramipril 10 mg einmal täglich bei gesunden Probanden erhöht die Cmax und AUC von Ramipril im Steady State um das 2,3- bzw. 2,1-Fache und die Cmax und AUC von Ramiprilat um das 2,4- bzw. 1,5-Fache . Im Gegensatz dazu nehmen Cmax und AUC von Telmisartan um 31 % bzw. 16 % ab. Bei gleichzeitiger Anwendung von Telmisartan und Ramipril kann das Ansprechen aufgrund der möglicherweise additiven pharmakodynamischen Wirkungen der kombinierten Arzneimittel und auch aufgrund der erhöhten Exposition gegenüber Ramipril und Ramipril in Gegenwart von Telmisartan stärker sein.
Andere Drogen
Die gleichzeitige Anwendung von Telmisartan führte zu keiner klinisch signifikanten Wechselwirkung mit Paracetamol, Amlodipin, Glyburid, Simvastatin, Hydrochlorothiazid, Warfarin oder Ibuprofen. Telmisartan wird nicht durch das Cytochrom-P450-System metabolisiert und hatte in vitro keine Auswirkungen auf Cytochrom-P450-Enzyme, mit Ausnahme einer gewissen Hemmung von CYP2C19. Es ist nicht zu erwarten, dass Telmisartan mit Arzneimitteln interagiert, die Cytochrom-P450-Enzyme hemmen; Es ist auch nicht zu erwarten, dass es mit Arzneimitteln interagiert, die durch Cytochrom-P450-Enzyme metabolisiert werden, mit Ausnahme einer möglichen Hemmung des Metabolismus von Arzneimitteln, die durch CYP2C19 metabolisiert werden.
Klinische Studien
Telmisartan und Hydrochlorothiazid
In kontrollierten klinischen Studien mit mehr als 2500 Patienten mit Bluthochdruck erhielten 1017 Patienten Telmisartan (20 mg bis 160 mg) und gleichzeitig Hydrochlorothiazid (6,25 mg bis 25 mg). Diese Studien umfassten eine faktorielle Studie (Studie 1) mit Kombinationen aus Telmisartan (20 mg, 40 mg, 80 mg, 160 mg oder Placebo) und Hydrochlorothiazid (6,25 mg, 12,5 mg, 25 mg und Placebo). Die faktorielle Studie randomisierte 818 Patienten, darunter 493 (60 %) Männer; 596 (73 %) Nicht-Schwarze und 222 (27 %) Schwarze; und 143 (18 %) im Alter von ≥ 65 Jahren (Durchschnittsalter war 53 Jahre). Der mittlere Blutdruck in Rückenlage zu Studienbeginn für die Gesamtpopulation betrug 154/101 mmHg.
Die Kombination von Telmisartan und Hydrochlorothiazid führte bei Dosen zwischen 40 mg/12,5 mg und 80 mg/25 mg im Vergleich zu 9-13 zu einer zusätzlichen Placebo-adjustierten Senkung des systolischen und diastolischen Blutdrucks im Tal von 16-21/9-11 mmHg /7-8 mmHg für Telmisartan 40 mg bis 80 mg Monotherapie und 4/4 mmHg für Hydrochlorothiazid 12,5 mg Monotherapie. Die blutdrucksenkende Wirkung war alters- und geschlechtsunabhängig. Bei Patienten, die in der placebokontrollierten Studie mit der Kombination aus Telmisartan und Hydrochlorothiazid behandelt wurden, gab es im Wesentlichen keine Veränderung der Herzfrequenz.
Vier weitere Studien mit Bluthochdruckpatienten mit einer Dauer von mindestens sechs Monaten erlaubten eine zusätzliche Gabe von Hydrochlorothiazid bei Patienten, die entweder mit der randomisierten Telmisartan-Monotherapiedosis nicht ausreichend eingestellt waren oder nach Abschluss der Hochtitration von Telmisartan keine ausreichende Blutdruckreaktion erreicht hatten. In aktiv kontrollierten Studien führte die Zugabe von 12,5 mg Hydrochlorothiazid zu titrierten Telmisartan-Dosen bei Patienten, die auf eine Telmisartan-Monotherapie kein ausreichendes Ansprechen erreichten oder aufrechterhielten, zu einer weiteren Senkung des systolischen und diastolischen Blutdrucks.
INFORMATIONEN ZUM PATIENTEN
MICARDIS® HCT (my-CAR-dis HCT) (Telmis artan und Hydrochlorothiazid) Tabletten
Lesen Sie diese Patienteninformation, bevor Sie mit der Einnahme von MICARDIS HCT-Tabletten beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Arzt über Ihren Gesundheitszustand oder Ihre Behandlung.
Was sind die wichtigsten Informationen, die ich über MICARDIS 20 mg HCT-Tabletten wissen sollte?
MICARDIS HCT kann ein ungeborenes Kind schädigen oder zum Tod führen. Sprechen Sie mit Ihrem Arzt über andere Möglichkeiten, Ihren Blutdruck zu senken, wenn Sie eine Schwangerschaft planen. Wenn Sie während der Einnahme von MICARDIS 20 mg HCT schwanger werden, informieren Sie sofort Ihren Arzt.
Was ist MICARDIS HCT?
MICARDIS 40 mg HCT ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von Bluthochdruck (Hypertonie).
MICARDIS 40 mg HCT enthält:
Ihr Arzt kann Ihnen andere Arzneimittel verschreiben, die Sie zusammen mit MICARDIS 80 mg HCT einnehmen müssen, um Ihren Bluthochdruck zu behandeln.
Es ist nicht bekannt, ob MICARDIS 40 mg HCT bei Kindern sicher und wirksam ist.
Nehmen Sie MICARDIS 20 mg HCT-Tabletten nicht ein, wenn Sie:
Was sollte ich meinem Arzt vor der Anwendung von MICARDIS 40 mg HCT-Tabletten mitteilen?
Bevor Sie MICARDIS 20 mg HCT-Tabletten einnehmen, informieren Sie Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen. Informieren Sie Ihren Arzt auch, wenn Sie Alkohol trinken.
MICARDIS 20 mg HCT kann die Wirkungsweise anderer Arzneimittel beeinflussen, und andere Arzneimittel können die Wirkungsweise von MICARDIS 20 mg HCT beeinflussen. Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Fragen Sie Ihren Arzt, wenn Sie sich nicht sicher sind, ob Sie eines der oben aufgeführten Arzneimittel einnehmen.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste darüber und zeigen Sie diese Ihrem Arzt oder Apotheker, wenn Sie ein neues Arzneimittel erhalten.
Wie soll ich MICARDIS HCT Tabletten einnehmen?
Was sind die möglichen Nebenwirkungen von MICARDIS 80 mg HCT-Tabletten?
MICARDIS 20 mg HCT-Tabletten können schwerwiegende Nebenwirkungen verursachen, einschließlich:
Wenn Sie sich schwach oder schwindelig fühlen, legen Sie sich hin und rufen Sie sofort Ihren Arzt an.
Rufen Sie sofort Ihren Arzt an, wenn Sie eines der oben aufgeführten Symptome bekommen.
HKT. Informieren Sie sofort Ihren Arzt, wenn Sie Folgendes haben:
Zu den häufigsten Nebenwirkungen von MICARDIS 80 mg HCT-Tabletten gehören:
Dies sind nicht alle möglichen Nebenwirkungen von MICARDIS 20 mg HCT-Tabletten. Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt. Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie soll ich MICARDIS 80 mg HCT-Tabletten aufbewahren?
Bewahren Sie MICARDIS 80 mg HCT-Tabletten und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zu MICARDIS 40 mg HCT-Tabletten:
Arzneimittel werden manchmal zu anderen als den in der Packungsbeilage aufgeführten Zwecken verschrieben. Verwenden Sie MICARDIS HCT-Tabletten nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie MICARDIS 20 mg HCT-Tabletten nicht an andere Personen weiter, selbst wenn sie an derselben Krankheit leiden wie Sie. Es kann ihnen schaden.
Diese Packungsbeilage fasst die wichtigsten Informationen zu MICARDIS HCT Tabletten zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt. Sie können Ihren Apotheker oder Arzt um Informationen zu MICARDIS 20 mg HCT-Tabletten bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Für aktuelle Verschreibungsinformationen scannen Sie den unten stehenden Code oder rufen Sie Boehringer Ingelheim Pharmaceuticals, Inc. unter 1-800-542-6257 oder (TTY) 1-800-459-9906 an.
Was sind die Inhaltsstoffe von MICARDIS 20 mg HCT-Tabletten?
Wirkstoffe: Telmisartan und Hydrochlorothiazid
Inaktive Inhaltsstoffe: Natriumhydroxid, Meglumin, Povidon, Sorbit, Magnesiumstearat, Lactosemonohydrat, mikrokristalline Cellulose, Maisstärke und Natriumstärkeglykolat
Die 40 mg/12,5 mg und 80 mg/12,5 mg Tabletten enthalten außerdem: Eisen(III)-oxid.
Die 80 mg/25 mg Tabletten enthalten außerdem: Eisen(III)-oxid gelb.
Was ist Bluthochdruck (Hypertonie)?
Der Blutdruck ist die Kraft in Ihren Blutgefäßen, wenn Ihr Herz schlägt und wenn Ihr Herz ruht. Sie haben Bluthochdruck, wenn die Kraft zu groß ist. Arzneimittel, die Ihren Blutdruck senken, verringern Ihr Risiko, einen Schlaganfall oder Herzinfarkt zu erleiden.
Hoher Blutdruck führt dazu, dass das Herz schwerer arbeitet, um Blut durch den Körper zu pumpen, und verursacht Schäden an den Blutgefäßen. MICARDIS 80 mg HCT-Tabletten können Ihren Blutgefäßen helfen, sich zu entspannen, sodass Ihr Blutdruck sinkt.
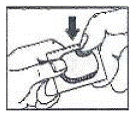
So öffnen Sie die Blisterpackung:
Diese Patienteninformation wurde von der US Food and Drug Administration genehmigt.