Plavix 75mg Clopidogrel Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Plavix 75 mg und wie wird es angewendet?
Plavix 75 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome des akuten Koronarsyndroms wie Schlaganfall, Blutgerinnsel oder schwerwiegende Herzprobleme nach einem Herzinfarkt, starke Brustschmerzen oder Kreislaufprobleme. Plavix 75 mg kann allein oder mit anderen Medikamenten verwendet werden.
Plavix 75 mg gehört zu einer Klasse von Arzneimitteln, die Thrombozytenaggregationshemmer, Herz-Kreislauf-, Thrombozytenaggregationshemmer, Hämatologika genannt werden.
Es ist nicht bekannt, ob Plavix bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Plavix 75 mg haben?
Plavix 75 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Plavix gehören:
WARNUNG
VERRINGERTE Thrombozytenaggregationshemmung bei Patienten mit zwei Funktionsverlust-Allelen des CYP2C19-Gens
Die Wirksamkeit von Plavix 75 mg ergibt sich aus seiner gerinnungshemmenden Aktivität, die von seiner Umwandlung in einen aktiven Metaboliten durch das Cytochrom P450 (CYP)-System abhängt, hauptsächlich CYP2C19 [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , KLINISCHE PHARMAKOLOGIE ]. Plavix bildet in den empfohlenen Dosen weniger des aktiven Metaboliten und hat daher eine verringerte Wirkung auf die Thrombozytenaktivität bei Patienten, die für nicht-funktionelle Allele des CYP2C19-Gens homozygot sind (als „CYP2C19-Low-Metabolizers“ bezeichnet). Tests sind verfügbar, um Patienten zu identifizieren, die langsame CYP2C19-Metabolisierer sind [siehe KLINISCHE PHARMAKOLOGIE ]. Erwägen Sie die Anwendung eines anderen Thrombozyten-P2Y12-Inhibitors bei Patienten, die als langsame CYP2C19-Metabolisierer identifiziert wurden.
BEZEICHNUNG
Plavix (Clopidogrelbisulfat) ist ein Inhibitor der P2Y12-ADP-Thrombozytenrezeptoren der Thienopyridin-Klasse. Chemisch ist es Methyl (+)-(S)-α-(2-chlorphenyl)-6,7-dihydrothieno[3,2-c]pyridin-5(4H)-acetatsulfat (1:1). Die empirische Formel von Clopidogrel-Bisulfat lautet C16H16ClNO2S·H2SO4 und sein Molekulargewicht beträgt 419,9. Die Strukturformel lautet wie folgt:

Clopidogrelbisulfat ist ein weißes bis cremefarbenes Pulver. Es ist praktisch unlöslich in Wasser bei neutralem pH, aber frei löslich bei pH 1. Es löst sich auch frei in Methanol, löst sich kaum in Methylenchlorid und ist praktisch unlöslich in Ethylether. Es hat eine spezifische optische Drehung von etwa +56°.
Plavix zur oralen Verabreichung ist entweder als rosafarbene, runde, bikonvexe, geprägte Filmtabletten mit 97,875 mg Clopidogrel-Bisulfat, was dem molaren Äquivalent von 75 mg Clopidogrel-Base entspricht, oder als rosafarbene, längliche, geprägte Filmtabletten mit 391,5 mg erhältlich Clopidogrel-Bisulfat, das dem molaren Äquivalent von 300 mg Clopidogrel-Base entspricht.
Jede Tablette enthält hydriertes Rizinusöl, Hydroxypropylcellulose, Mannitol, mikrokristalline Cellulose und Polyethylenglycol 6000 als inaktive Bestandteile. Der rosa Filmüberzug enthält Eisenoxid, Hypromellose 2910, Lactose-Monohydrat, Titandioxid und Triacetin. Die Tabletten sind mit Carnaubawachs poliert.
INDIKATIONEN
Akute Koronarsyndrom (ACS)
Kürzlich aufgetretener Myokardinfarkt, kürzlich aufgetretener Schlaganfall oder festgestellte periphere arterielle Verschlusskrankheit
Bei Patienten mit bestehender peripherer arterieller Verschlusskrankheit oder mit kürzlich aufgetretenem Myokardinfarkt (MI) oder Schlaganfall in der Vorgeschichte ist Plavix 75 mg indiziert, um die Rate von MI und Schlaganfällen zu reduzieren.
DOSIERUNG UND ANWENDUNG
Akutes Koronar-Syndrom
Bei Patienten, die eine gerinnungshemmende Wirkung innerhalb von Stunden benötigen, beginnen Sie die Behandlung mit Plavix mit einer einmaligen oralen Aufsättigungsdosis von 300 mg und fahren Sie dann mit 75 mg einmal täglich fort. Der Beginn von Plavix 75 mg ohne Aufsättigungsdosis verzögert die Entstehung einer gerinnungshemmenden Wirkung um mehrere Tage [siehe KLINISCHE PHARMAKOLOGIE und Klinische Studien ].
Kürzlich aufgetretener Myokardinfarkt, kürzlich aufgetretener Schlaganfall oder festgestellte periphere arterielle Verschlusskrankheit
75 mg einmal täglich oral ohne Aufsättigungsdosis [vgl KLINISCHE PHARMAKOLOGIE und Klinische Studien ].
WIE GELIEFERT
Darreichungsformen und Stärken
Lagerung und Handhabung
Plavix (Clopidogrel-Bisulfat) 75 mg Tabletten sind als rosafarbene, runde, bikonvexe Filmtabletten mit der Prägung „75“ auf der einen und „1171“ auf der anderen Seite erhältlich. Tabletten werden wie folgt bereitgestellt:
NDC 63653-1171-6 30 Flaschen NDC 63653-1171-1 Flaschen zu 90 NDC 63653-1171-5 Flaschen zu 500 NDC 63653-1171-3 Blister mit 100 Stück
Plavix (Clopidogrelbisulfat) 300 mg Die Tabletten sind als rosafarbene, längliche Filmtabletten mit der Prägung „300“ auf der einen und „1332“ auf der anderen Seite erhältlich. Tabletten werden wie folgt bereitgestellt:
NDC 63653-1332-2 Einheitspackungen mit 30 Stück
Bei 25 °C (77 °F) lagern; Exkursionen erlaubt bis 15°C-30°C (59°F-86°F) [siehe USP kontrollierte Raumtemperatur ].
Vertrieb durch: Bristol-Myers Squibb/Sanofi Pharmaceuticals Partnership, Bridgewater, NJ 08807. Überarbeitet: März 2021
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden nachstehend und an anderer Stelle in der Kennzeichnung erörtert:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen und Nachsorgedauern durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Plavix wurde bei mehr als 54.000 Patienten auf Sicherheit untersucht, darunter mehr als 21.000 Patienten, die ein Jahr oder länger behandelt wurden. Die klinisch bedeutsamen Nebenwirkungen, die in Studien zum Vergleich von Plavix 75 mg plus Aspirin mit Placebo plus Aspirin und in Studien zum Vergleich von Plavix allein mit Aspirin allein beobachtet wurden, werden nachstehend erörtert.
Blutung
HEILUNG
In CURE war die Anwendung von Plavix mit Aspirin im Vergleich zu Placebo mit Aspirin mit einer Zunahme schwerer Blutungen (hauptsächlich gastrointestinal und an Punktionsstellen) verbunden (siehe Tabelle 1). Die Inzidenz von intrakraniellen Blutungen (0,1 %) und tödlichen Blutungen (0,2 %) war in beiden Gruppen gleich. Andere Blutungsereignisse, die häufiger in der Clopidogrel-Gruppe berichtet wurden, waren Nasenbluten, Hämaturie und blaue Flecken.
Die Gesamtinzidenz von Blutungen ist in Tabelle 1 beschrieben.
VERPFLICHTEN
In COMMIT wurden ähnliche Raten schwerer Blutungen in der Plavix-75-mg- und der Placebo-Gruppe beobachtet, die beide auch Aspirin erhielten (siehe Tabelle 2).
CAPRIE (Plavix gegen Aspirin)
In CAPRIE traten gastrointestinale Blutungen mit einer Rate von 2,0 % bei denjenigen auf, die Plavix 75 mg einnahmen, gegenüber 2,7 % bei denjenigen, die Aspirin einnahmen; Blutungen, die einen Krankenhausaufenthalt erforderten, traten bei 0,7 % bzw. 1,1 % auf. Die Inzidenz intrakranieller Blutungen betrug 0,4 % bei Plavix im Vergleich zu 0,5 % bei Aspirin.
Andere Blutungsereignisse, die häufiger in der Plavix 75 mg-Gruppe berichtet wurden, waren Nasenbluten und Hämatome.
Andere unerwünschte Ereignisse
In den Studien CURE und CHARISMA, die Plavix plus Aspirin mit Aspirin allein verglichen, gab es keinen Unterschied in der Häufigkeit unerwünschter Ereignisse (außer Blutungen) zwischen Plavix und Placebo.
In CAPRIE, das Plavix 75 mg mit Aspirin verglich, wurde Pruritus häufiger bei Patienten berichtet, die Plavix einnahmen. Es wurde kein weiterer Unterschied in der Häufigkeit unerwünschter Ereignisse (außer Blutungen) berichtet.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von Plavix nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet wurden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Blutungen, einschließlich solcher mit tödlichem Ausgang, wurden bei mit Plavix behandelten Patienten berichtet.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
CYP2C19-Induktoren
Da Clopidogrel teilweise durch CYP2C19 zu seinem aktiven Metaboliten metabolisiert wird, ist zu erwarten, dass die Anwendung von Arzneimitteln, die die Aktivität dieses Enzyms induzieren, zu erhöhten Arzneimittelspiegeln des aktiven Metaboliten von Clopidogrel führt.
Rifampin induziert stark CYP2C19, was sowohl zu einem Anstieg des aktiven Metaboliten von Clopidogrel als auch zu einer Hemmung der Blutplättchen führt, was insbesondere das Blutungsrisiko verstärken könnte. Vermeiden Sie vorsichtshalber die gleichzeitige Anwendung starker CYP2C19-Induktoren [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
CYP2C19-Inhibitoren
Clopidogrel wird teilweise durch CYP2C19 zu seinem aktiven Metaboliten metabolisiert. Die gleichzeitige Anwendung von Arzneimitteln, die die Aktivität dieses Enzyms hemmen, führt zu verringerten Plasmakonzentrationen des aktiven Metaboliten von Clopidogrel und zu einer Verringerung der Thrombozytenhemmung [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Omeprazol oder Esomeprazol
Vermeiden Sie die gleichzeitige Anwendung von Plavix 75 mg mit Omeprazol oder Esomeprazol. In klinischen Studien hat sich gezeigt, dass Omeprazol die gerinnungshemmende Wirkung von Plavix 75 mg bei gleichzeitiger Gabe oder im Abstand von 12 Stunden signifikant reduziert. Eine ähnliche Verringerung der Thrombozytenaggregationshemmung wurde bei gleichzeitiger Gabe von Esomeprazol und Plavix beobachtet. Dexlansoprazol, Lansoprazol und Pantoprazol hatten eine geringere Wirkung auf die gerinnungshemmende Aktivität von Plavix als Omeprazol oder Esomeprazol [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Opioide
Wie bei anderen oralen P2Y12-Inhibitoren verzögert und verringert die gleichzeitige Verabreichung von Opioidagonisten die Resorption von Clopidogrel, vermutlich aufgrund einer verlangsamten Magenentleerung, was zu einer verringerten Exposition gegenüber seinen Metaboliten führt [siehe KLINISCHE PHARMAKOLOGIE ]. Erwägen Sie die Anwendung eines parenteralen Thrombozytenaggregationshemmers bei Patienten mit akutem Koronarsyndrom, die eine gleichzeitige Verabreichung von Morphin oder anderen Opioidagonisten benötigen.
Nichtsteroidale Antirheumatika (NSAIDs)
Die gleichzeitige Verabreichung von Plavix 75 mg und NSAIDs erhöht das Risiko von Magen-Darm-Blutungen.
Warfarin (CYP2C9-Substrate)
Obwohl die Verabreichung von Clopidogrel 75 mg pro Tag die Pharmakokinetik von S-Warfarin (ein CYP2C9-Substrat) oder die INR bei Patienten, die eine Langzeittherapie mit Warfarin erhielten, nicht veränderte, erhöht die gleichzeitige Verabreichung von Plavix 75 mg mit Warfarin das Blutungsrisiko aufgrund unabhängiger Wirkungen auf Hämostase.
Bei hohen Konzentrationen in vitro hemmt Clopidogrel jedoch CYP2C9.
SSRIs und SNRIs
Da selektive Serotonin-Wiederaufnahmehemmer (SSRIs) und Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRIs) die Thrombozytenaktivierung beeinflussen, kann die gleichzeitige Anwendung von SSRIs und SNRIs mit Clopidogrel das Blutungsrisiko erhöhen.
Repaglinid (CYP2C8-Substrate)
Der Acyl-β-glucuronid-Metabolit von Clopidogrel ist ein starker Inhibitor von CYP2C8. Plavix 75 mg kann die systemische Exposition gegenüber Arzneimitteln erhöhen, die hauptsächlich durch CYP2C8 ausgeschieden werden, weshalb eine Dosisanpassung und eine angemessene Überwachung erforderlich sind.
Plavix erhöhte die Repaglinid-Exposition um das 3,9- bis 5,1-Fache [vgl KLINISCHE PHARMAKOLOGIE ]. Vermeiden Sie die gleichzeitige Anwendung von Repaglinid mit Plavix. Wenn eine gleichzeitige Anwendung nicht vermieden werden kann, beginnen Sie mit Repaglinid mit 0,5 mg vor jeder Mahlzeit und überschreiten Sie eine tägliche Gesamtdosis von 4 mg nicht. Bei gleichzeitiger Anwendung kann eine häufigere Glukosekontrolle erforderlich sein.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Verminderte Thrombozytenaggregationshemmung bei Patienten mit eingeschränkter CYP2C19-Funktion
Clopidogrel ist ein Prodrug. Die Hemmung der Thrombozytenaggregation durch Clopidogrel wird durch einen aktiven Metaboliten erreicht. Die Metabolisierung von Clopidogrel zu seinem aktiven Metaboliten kann durch genetische Variationen in CYP2C19 beeinträchtigt werden [siehe Eingerahmte Warnung ].
Der Metabolismus von Clopidogrel kann auch durch Arzneimittel beeinträchtigt werden, die CYP2C19 hemmen, wie Omeprazol oder Esomeprazol. Vermeiden Sie die gleichzeitige Anwendung von Plavix mit Omeprazol oder Esomeprazol, da beide die thrombozytenaggregationshemmende Aktivität von Plavix signifikant reduzieren [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Allgemeines Blutungsrisiko
P2Y12-Inhibitoren (Thienopyridine), einschließlich Plavix, erhöhen das Blutungsrisiko.
P2Y12-Inhibitoren (Thienopyridine) hemmen die Blutplättchenaggregation für die Lebensdauer der Blutplättchen (7-10 Tage). Da die Halbwertszeit des aktiven Metaboliten von Clopidogrel kurz ist, kann es möglich sein, die Hämostase durch die Verabreichung exogener Blutplättchen wiederherzustellen; Thrombozytentransfusionen innerhalb von 4 Stunden nach der Aufsättigungsdosis oder 2 Stunden nach der Erhaltungsdosis können jedoch weniger wirksam sein.
Es ist zu erwarten, dass die Anwendung von Arzneimitteln, die die Aktivität von CYP2C19 induzieren, zu erhöhten Arzneimittelspiegeln des aktiven Metaboliten von Clopidogrel führt und das Blutungsrisiko potenzieren könnte. Vermeiden Sie vorsichtshalber die gleichzeitige Anwendung starker CYP2C19-Induktoren [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
Einstellung von Plavix
Das Absetzen von Plavix erhöht das Risiko kardiovaskulärer Ereignisse. Wenn Plavix vorübergehend abgesetzt werden muss (z. B. zur Behandlung von Blutungen oder bei Operationen mit hohem Blutungsrisiko), nehmen Sie die Behandlung so bald wie möglich wieder auf. Wenn möglich, unterbrechen Sie die Behandlung mit Plavix für fünf Tage vor einer solchen Operation. Setzen Sie die Einnahme von Plavix 75 mg fort, sobald eine Blutstillung erreicht ist.
Thrombotisch-thrombozytopenische Purpura (TTP)
TTP, manchmal tödlich, wurde nach der Anwendung von Plavix 75 mg berichtet, manchmal nach einer kurzen Exposition ( NEBENWIRKUNGEN ].
Kreuzreaktivität zwischen Thienopyridinen
Überempfindlichkeit einschließlich Hautausschlag, Angioödem oder hämatologische Reaktion wurde bei Patienten berichtet, die Plavix 75 mg erhielten, einschließlich Patienten mit einer Vorgeschichte von Überempfindlichkeit oder hämatologischen Reaktionen auf andere Thienopyridine [siehe KONTRAINDIKATIONEN und NEBENWIRKUNGEN ].
Informationen zur Patientenberatung
Raten Sie den Patienten, die von der FDA zugelassene Patientenkennzeichnung zu lesen ( Leitfaden für Medikamente ).
Einstellung
Weisen Sie die Patienten darauf hin, Plavix nicht abzusetzen, ohne dies vorher mit dem medizinischen Betreuer zu besprechen, der es verschrieben hat [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Blutung
Weisen Sie die Patienten darauf hin, dass sie:
Thrombotische thrombozytopenische Purpura
Weisen Sie die Patienten an, unverzüglich ärztliche Hilfe in Anspruch zu nehmen, wenn sie Symptome von TTP bemerken, die anderweitig nicht erklärt werden können [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Invasive Verfahren
Weisen Sie die Patienten darauf hin, Ärzte und Zahnärzte vor einer Operation oder einem zahnärztlichen Eingriff über die Einnahme von Plavix zu informieren [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Protonenpumpenhemmer
Weisen Sie die Patienten darauf hin, Omeprazol oder Esomeprazol nicht einzunehmen, während sie Plavix einnehmen. Dexlansoprazol, Lansoprazol und Pantoprazol hatten weniger ausgeprägte Auswirkungen auf die gerinnungshemmende Wirkung von Plavix 75 mg als Omeprazol oder Esomeprazol [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es gab keine Hinweise auf Tumorigenität, wenn Clopidogrel 78 Wochen lang an Mäuse und 104 Wochen lang an Ratten in Dosierungen von bis zu 77 mg/kg pro Tag verabreicht wurde, was zu Plasmaexpositionen führte, die >25-mal höher waren als beim Menschen bei der empfohlenen Tagesdosis von 75 mg.
Clopidogrel war in vier In-vitro-Tests (Ames-Test, DNA-Reparaturtest in Rattenhepatozyten, Genmutationstest in Fibroblasten des chinesischen Hamsters und Metaphase-Chromosomenanalyse menschlicher Lymphozyten) und in einem In-vivo-Test (Mikronukleustest auf oralem Wege in Mäuse).
Es wurde festgestellt, dass Clopidogrel keinen Einfluss auf die Fertilität männlicher und weiblicher Ratten hat, die vor der Paarung und während der Trächtigkeit mit oralen Dosen von bis zu 400 mg/kg pro Tag behandelt wurden (das 52-fache der beim Menschen empfohlenen Dosis auf mg/m²-Basis).
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Verfügbare Daten aus Fällen, die in der veröffentlichten Literatur und Postmarketing-Überwachung mit der Anwendung von Clopidogrel bei schwangeren Frauen berichtet wurden, haben keine arzneimittelbedingten Risiken für schwere Geburtsfehler oder Fehlgeburten identifiziert [siehe Daten ]. Es bestehen Risiken für die schwangere Frau und den Fötus im Zusammenhang mit Myokardinfarkt und Schlaganfall [siehe Klinische Überlegungen ]. Es wurden keine Hinweise auf Fetotoxizität beobachtet, wenn Clopidogrel trächtigen Ratten und Kaninchen während der Organogenese in Dosen verabreicht wurde, die dem 65- und 78-Fachen der empfohlenen Tagesdosis für Menschen entsprachen [siehe Daten ].
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebenen Populationen ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere unerwünschte Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 % bis 4 % bzw. 15 % bis 20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryonale/fetales Risiko
Herzinfarkt und Schlaganfall sind medizinische Notfälle. Die Therapie der Schwangeren sollte nicht wegen möglicher Bedenken hinsichtlich der Auswirkungen von Clopidogrel auf den Fötus zurückgehalten werden.
Arbeit oder Lieferung
Die Anwendung von Clopidogrel während der Wehen oder der Geburt erhöht das Risiko von mütterlichen Blutungen und Blutungen. Vermeiden Sie eine neuraxiale Blockade während der Anwendung von Clopidogrel wegen des Risikos eines spinalen Hämatoms. Wenn möglich, Clopidogrel 5 bis 7 Tage vor Wehen, Entbindung oder neuraxialer Blockade absetzen.
Daten
Menschliche Daten
Die verfügbaren Daten aus veröffentlichten Fallberichten über zwei Jahrzehnte nach der Markteinführung haben keinen Zusammenhang mit der Anwendung von Clopidogrel bei Schwangerschaft und schweren Geburtsfehlern, Fehlgeburten oder unerwünschten fetalen Folgen festgestellt.
Tierdaten
Toxikologische Studien zur embryofetalen Entwicklung wurden an trächtigen Ratten und Kaninchen mit Dosen von bis zu 500 bzw. 300 mg/kg/Tag durchgeführt, die während der Organogenese verabreicht wurden. Diese Dosen, die dem 65- bzw. 78-Fachen der empfohlenen Tagesdosis für den Menschen auf mg/m²-Basis entsprechen, ergaben keine Hinweise auf eine Beeinträchtigung der Fertilität oder Fetotoxizität durch Clopidogrel.
Stillzeit
Zusammenfassung der Risiken
Es liegen keine Daten zum Vorhandensein von Clopidogrel in der Muttermilch oder zu den Auswirkungen auf die Milchbildung vor. In einer kleinen Anzahl von Fällen nach Markteinführung wurden bei der mütterlichen Anwendung von Clopidogrel während der Stillzeit keine unerwünschten Wirkungen auf gestillte Säuglinge beobachtet. Studien an Ratten haben gezeigt, dass Clopidogrel und/oder seine Metaboliten in der Milch vorhanden sind. Wenn ein Arzneimittel in tierischer Milch vorhanden ist, ist es wahrscheinlich, dass das Arzneimittel auch in der Muttermilch vorhanden ist. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an PLAVIX und möglichen Nebenwirkungen von PLAVIX 75 mg auf den gestillten Säugling oder von zugrunde liegenden Erkrankungen der Mutter berücksichtigt werden.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei pädiatrischen Populationen wurden nicht nachgewiesen.
Eine randomisierte, placebokontrollierte Studie (CLARINET) zeigte keinen klinischen Nutzen von Clopidogrel bei Neugeborenen und Säuglingen mit angeborenem zyanotischem Herzfehler, der mit einem systemisch-zu-pulmonalarteriellen Shunt gelindert wurde. Mögliche Faktoren, die zu diesem Ergebnis beigetragen haben, waren die Clopidogrel-Dosis, die gleichzeitige Gabe von Aspirin und der späte Therapiebeginn nach Shunt-Palliation. Es kann nicht ausgeschlossen werden, dass eine Studie mit einem anderen Design einen klinischen Nutzen in dieser Patientenpopulation zeigen würde.
Geriatrische Verwendung
Von der Gesamtzahl der Probanden in den kontrollierten klinischen Studien CAPRIE und CURE waren etwa 50 % der mit Plavix behandelten Patienten 65 Jahre und älter und 15 % waren 75 Jahre und älter. In COMMIT waren etwa 58 % der mit Plavix 75 mg behandelten Patienten 60 Jahre und älter, davon 26 % 70 Jahre und älter.
Das beobachtete Risiko von Blutungsereignissen mit Plavix 75 mg plus Aspirin im Vergleich zu Placebo plus Aspirin nach Altersgruppe ist in Tabelle 1 und Tabelle 2 für die CURE- bzw. COMMIT-Studien aufgeführt [siehe NEBENWIRKUNGEN ]. Bei älteren Patienten ist keine Dosisanpassung erforderlich.
Nierenfunktionsstörung
Die Erfahrung bei Patienten mit schwerer und mittelschwerer Nierenfunktionsstörung ist begrenzt [siehe KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Bei Patienten mit eingeschränkter Leberfunktion ist keine Dosisanpassung erforderlich [siehe KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Die Thrombozytenhemmung durch Plavix ist irreversibel und hält ein Leben lang an. Eine Überdosierung nach der Verabreichung von Clopidogrel kann zu Blutungskomplikationen führen. Eine orale Einzeldosis von 1500 oder 2000 mg/kg Clopidogrel war tödlich für Mäuse und Ratten und bei 3000 mg/kg für Paviane. Symptome einer akuten Toxizität waren Erbrechen, Erschöpfung, Atembeschwerden und Magen-Darm-Blutungen bei Tieren.
Basierend auf biologischer Plausibilität kann eine Thrombozytentransfusion die Gerinnungsfähigkeit wiederherstellen.
KONTRAINDIKATIONEN
Aktive Blutung
Plavix ist bei Patienten mit aktiven pathologischen Blutungen wie Magengeschwüren oder intrakraniellen Blutungen kontraindiziert.
Überempfindlichkeit
Plavix 75 mg ist kontraindiziert bei Patienten mit Überempfindlichkeit (z. B. Anaphylaxie) gegenüber Clopidogrel oder einem Bestandteil des Arzneimittels [siehe NEBENWIRKUNGEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Clopidogrel ist ein Inhibitor der Blutplättchenaktivierung und -aggregation durch die irreversible Bindung seines aktiven Metaboliten an die P2Y12-Klasse von ADP-Rezeptoren auf Blutplättchen.
Pharmakodynamik
Clopidogrel muss durch CYP450-Enzyme metabolisiert werden, um den aktiven Metaboliten zu produzieren, der die Thrombozytenaggregation hemmt. Der aktive Metabolit von Clopidogrel hemmt selektiv die Bindung von Adenosindiphosphat (ADP) an seinen Thrombozyten-P2Y12-Rezeptor und die nachfolgende ADP-vermittelte Aktivierung des Glykoprotein-GPIIb/IIIa-Komplexes, wodurch die Thrombozytenaggregation gehemmt wird. Diese Aktion ist irreversibel. Folglich sind Blutplättchen, die dem aktiven Metaboliten von Clopidogrel ausgesetzt sind, für den Rest ihrer Lebensdauer (etwa 7 bis 10 Tage) betroffen. Die durch andere Agonisten als ADP induzierte Blutplättchenaggregation wird auch gehemmt, indem die Verstärkung der Blutplättchenaktivierung durch freigesetztes ADP blockiert wird.
Eine dosisabhängige Hemmung der Thrombozytenaggregation ist 2 Stunden nach oraler Einzeldosis von Plavix zu beobachten. Wiederholte Dosen von 75 mg Plavix pro Tag hemmen die ADP-induzierte Thrombozytenaggregation am ersten Tag und die Hemmung erreicht Steady State zwischen Tag 3 und Tag 7. Im Steady State war die durchschnittliche Hemmung bei einer Dosis von 75 mg Plavix pro Tag beobachtet zwischen 40 % und 60 %. Die Thrombozytenaggregation und die Blutungszeit kehren nach Absetzen der Behandlung allmählich auf die Ausgangswerte zurück, im Allgemeinen nach etwa 5 Tagen.
Geriatrische Patienten
Ältere (≥75 Jahre) und junge gesunde Probanden hatten ähnliche Wirkungen auf die Thrombozytenaggregation.
Patienten mit eingeschränkter Nierenfunktion
Nach wiederholter Gabe von 75 mg Plavix 75 mg pro Tag zeigten Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance von 5 bis 15 ml/min) und mittelschwerer Nierenfunktionsstörung (Kreatinin-Clearance von 30 bis 60 ml/min) eine geringe (25 %) Hemmung von ADP-induzierte Thrombozytenaggregation.
Patienten mit eingeschränkter Leberfunktion
Nach wiederholter Gabe von 75 mg Plavix pro Tag über 10 Tage bei Patienten mit schwerer Leberfunktionsstörung war die Hemmung der ADP-induzierten Thrombozytenaggregation ähnlich wie bei gesunden Probanden.
Geschlecht
In einer kleinen Studie, in der Männer und Frauen verglichen wurden, wurde bei Frauen eine geringere Hemmung der ADP-induzierten Thrombozytenaggregation beobachtet.
Pharmakokinetik
Clopidogrel ist ein Prodrug und wird zu einem pharmakologisch aktiven Metaboliten und inaktiven Metaboliten metabolisiert.
Absorption
Nach einmaliger und wiederholter oraler Gabe von 75 mg pro Tag wird Clopidogrel rasch resorbiert. Die Resorption beträgt mindestens 50 %, basierend auf der Ausscheidung von Clopidogrel-Metaboliten im Urin.
Wirkung von Lebensmitteln
Plavix kann mit oder ohne Nahrung verabreicht werden. In einer Studie mit gesunden männlichen Probanden, bei denen Plavix 75 mg pro Tag mit einem Standardfrühstück verabreicht wurde, verringerte sich die mittlere Hemmung der ADP-induzierten Thrombozytenaggregation um weniger als 9 %. Die AUC0-24 des aktiven Metaboliten blieb in Gegenwart von Nahrung unverändert, während die Cmax des aktiven Metaboliten um 57 % abnahm. Ähnliche Ergebnisse wurden beobachtet, als eine Aufsättigungsdosis von 300 mg Plavix zusammen mit einem fettreichen Frühstück verabreicht wurde.
Stoffwechsel
Clopidogrel wird weitgehend über zwei Hauptstoffwechselwege metabolisiert: Einer wird durch Esterasen vermittelt und führt zur Hydrolyse in ein inaktives Carbonsäurederivat (85 % der zirkulierenden Metaboliten) und einer wird durch mehrere Cytochrom-P450-Enzyme vermittelt. Cytochrome oxidieren zunächst Clopidogrel zu einem 2-Oxo-Clopidogrel-Zwischenmetaboliten. Die anschließende Metabolisierung des 2-Oxoclopidogrel-Zwischenmetaboliten führt zur Bildung des aktiven Metaboliten, eines Thiolderivats von Clopidogrel. Der aktive Metabolit wird hauptsächlich von CYP2C19 mit Beiträgen mehrerer anderer CYP-Enzyme, einschließlich CYP1A2, CYP2B6 und CYP3A, gebildet. Der aktive Thiol-Metabolit bindet schnell und irreversibel an Thrombozytenrezeptoren und hemmt so die Thrombozytenaggregation für die Lebensdauer der Thrombozyten.
Die Cmax des aktiven Metaboliten ist nach einer einmaligen Aufsättigungsdosis von 300 mg Clopidogrel doppelt so hoch wie nach vier Tagen mit einer Erhaltungsdosis von 75 mg. Cmax tritt etwa 30 bis 60 Minuten nach der Einnahme auf. Im Dosisbereich von 75 bis 300 mg weicht die Pharmakokinetik des aktiven Metaboliten von der Dosisproportionalität ab: Eine 4-fache Dosis führt zu einer 2,0-fachen bzw. 2,7-fachen Cmax und AUC.
Beseitigung
Nach einer oralen Dosis von 14C-markiertem Clopidogrel beim Menschen wurden in den 5 Tagen nach der Einnahme etwa 50 % der Gesamtradioaktivität mit dem Urin und etwa 46 % mit dem Stuhl ausgeschieden. Nach einer oralen Einzeldosis von 75 mg hat Clopidogrel eine Halbwertszeit von etwa 6 Stunden. Die Halbwertszeit des aktiven Metaboliten beträgt etwa 30 Minuten.
Wechselwirkungen mit anderen Medikamenten
Wirkung anderer Medikamente auf Plavix
Clopidogrel wird teilweise durch CYP2C19 zu seinem aktiven Metaboliten metabolisiert.
CYP2C19-Induktoren
Die gleichzeitige Anwendung von starken Induktoren von CYP2C19 führt zu einer erhöhten Plasmakonzentration des aktiven Metaboliten von Clopidogrel und einer verstärkten Thrombozytenhemmung.
Rifampin: Die gleichzeitige Gabe von Rifampin 300 mg zweimal täglich über 7 Tage mit 600 mg Clopidogrel-Aufsättigungsdosis bei gesunden Erwachsenen erhöhte die mittlere AUC und Cmax der Thiol-Metaboliten von Clopidogrel um das 3,8-Fache. Die mittlere Hemmung der Thrombozytenaggregation 4 Stunden nach der Einnahme war in Gegenwart von Rifampin um 34 % höher als bei alleiniger Gabe von Clopidogrel.
CYP2C19-Inhibitoren
Die gleichzeitige Anwendung bestimmter Inhibitoren dieses Enzyms führt zu verringerten Plasmakonzentrationen des aktiven Metaboliten von Clopidogrel und zu einer Verringerung der Thrombozytenhemmung.
Protonenpumpenhemmer (PPI)
Die Wirkung von Protonenpumpenhemmern (PPI) auf die systemische Exposition gegenüber dem aktiven Metaboliten von Clopidogrel nach mehreren Dosen von Plavix 75 mg, die in speziellen Studien zu Wechselwirkungen mit anderen Arzneimitteln bewertet wurden, ist in Abbildung 1 dargestellt.
Abbildung 1: Exposition gegenüber aktivem Metaboliten von Clopidogrel nach mehreren Dosen von Plavix 75 mg allein oder mit Protonenpumpenhemmern (PPIs)
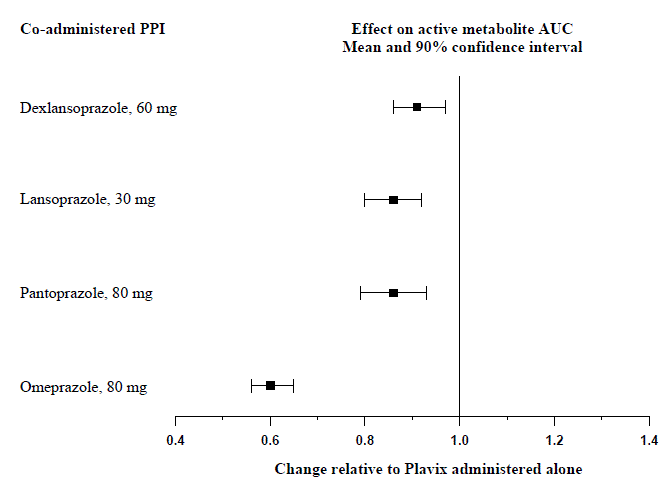
Die in diesen Studien gemessenen pharmakodynamischen und pharmakokinetischen Parameter zeigten, dass die Wechselwirkung mit Omeprazol am höchsten und mit Dexlansoprazol am geringsten war.
Opioide
Die gleichzeitige Verabreichung von 5 mg intravenösem Morphin mit 600 mg Clopidogrel-Aufsättigungsdosis bei gesunden Erwachsenen verringerte die AUC und Cmax der Thiol-Metaboliten von Clopidogrel um 34 %. Die mittlere Thrombozytenaggregation war bei gleichzeitiger Gabe von Morphin bis zu 2 bis 4 Stunden höher.
Wirkung von Plavix 75 mg auf andere Medikamente
In-vitro-Studien haben gezeigt, dass der Glucuronid-Metabolit von Clopidogrel ein starker Inhibitor von CYP2C8 ist. Die gleichzeitige Verabreichung von Repaglinid mit Plavix erhöhte die systemische Repaglinid-Exposition (AUC0-∞) um das 5,1-Fache nach der Aufsättigungsdosis (300 mg) und um das 3,9-Fache an Tag 3 der Erhaltungsdosis (75 mg) von Plavix [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Pharmakogenomik
CYP2C19 ist an der Bildung sowohl des aktiven Metaboliten als auch des 2-Oxo-Clopidogrel-Zwischenmetaboliten beteiligt. Die Pharmakokinetik des aktiven Metaboliten von Clopidogrel und die thrombozytenaggregationshemmenden Wirkungen, gemessen durch Ex-vivo-Thrombozytenaggregationsassays, unterscheiden sich je nach CYP2C19-Genotyp. Patienten, die für nicht funktionierende Allele des CYP2C19-Gens homozygot sind, werden als „CYP2C19-Low-Metabolizers“ bezeichnet. Ungefähr 2 % der weißen und 4 % der schwarzen Patienten sind schlechte Metabolisierer; Die Prävalenz eines schlechten Stoffwechsels ist bei asiatischen Patienten höher (z. B. 14 % der Chinesen). Tests sind verfügbar, um Patienten zu identifizieren, die langsame CYP2C19-Metabolisierer sind.
Eine Crossover-Studie mit 40 gesunden Probanden, jeweils 10 in den vier CYP2C19-Metabolisierer-Gruppen, untersuchte die pharmakokinetischen und gerinnungshemmenden Reaktionen unter Verwendung von 300 mg, gefolgt von 75 mg pro Tag und 600 mg, gefolgt von 150 mg pro Tag, jeweils für insgesamt 5 Tage. Im Vergleich zu den anderen Gruppen wurden bei den langsamen Metabolisierern eine verringerte Exposition gegenüber aktiven Metaboliten und eine verringerte Hemmung der Thrombozytenaggregation beobachtet.
Klinische Studien
Akutes Koronar-Syndrom
HEILUNG
An der CURE-Studie nahmen 12.562 Patienten mit ACS ohne ST-Hebung (UA oder NSTEMI) teil, die innerhalb von 24 Stunden nach Beginn der letzten Episode von Brustschmerzen oder Ischämiesymptomen auftraten. Die Patienten mussten entweder EKG-Veränderungen aufweisen, die mit einer neuen Ischämie (ohne ST-Hebung) kompatibel waren, oder erhöhte Herzenzyme oder Troponin I oder T auf mindestens das Zweifache der oberen Normgrenze.
Die Patienten wurden randomisiert einer Behandlung mit Plavix (300 mg Aufsättigungsdosis, gefolgt von 75 mg einmal täglich) oder Placebo zugeteilt und bis zu einem Jahr behandelt. Die Patienten erhielten auch Aspirin (75–325 mg einmal täglich) und andere Standardtherapien wie Heparin. Die Verwendung von GPIIb/IIIa-Inhibitoren war drei Tage vor der Randomisierung nicht erlaubt.
Die Patientenpopulation war größtenteils weiß (82 %) und umfasste 38 % Frauen und 52 % im Alter von ≥ 65 Jahren. Nur etwa 20 % der Patienten unterzogen sich während des anfänglichen Krankenhausaufenthalts einer Revaskularisierung, und nur wenige unterzogen sich einer notfallmäßigen oder dringenden Revaskularisierung.
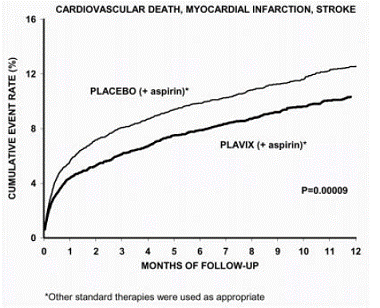
Die Anzahl der Patienten, bei denen der primäre Endpunkt (CV-Tod, Myokardinfarkt oder Schlaganfall) auftrat, betrug 582 (9,3 %) in der mit Plavix behandelten Gruppe und 719 (11,4 %) in der mit Placebo behandelten Gruppe, eine relative Risikoreduktion von 20 % (95 % CI von 10 %–28 %; p
Der größte Nutzen von Plavix trat in den ersten zwei Monaten auf, aber der Unterschied zu Placebo blieb während des gesamten Verlaufs der Studie (bis zu 12 Monate) bestehen (siehe Abbildung 2).
Abbildung 2: Herz-Kreislauf-Tod, Myokardinfarkt und Schlaganfall in der CURE-Studie
Die Wirkung von Plavix 75 mg unterschied sich in verschiedenen Untergruppen nicht signifikant, wie in Abbildung 3 gezeigt. Die mit Plavix 75 mg verbundenen Vorteile waren unabhängig von der Anwendung anderer akuter und langfristiger kardiovaskulärer Therapien, einschließlich Heparin/LMWH, intravenöses Glykoprotein IIb/IIIa (GPIIb/IIIa)-Hemmer, Lipidsenker, Betablocker und ACE-Hemmer. Die Wirksamkeit von Plavix wurde unabhängig von der Aspirin-Dosis (75-325 mg einmal täglich) beobachtet. Die Verwendung von oralen Antikoagulanzien, nicht in der Studie enthaltenen Thrombozytenaggregationshemmern und chronischen NSAIDs war in CURE nicht erlaubt.
Abbildung 3: Hazard Ratio für Patienten-Baseline-Merkmale und begleitende Medikationen/Interventionen während der Studie für die CURE-Studie
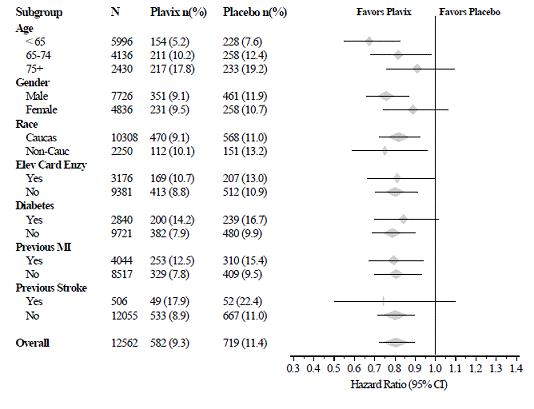
Abbildung 3: Hazard Ratio für Patienten-Baseline-Merkmale und begleitende Medikationen/Interventionen während der Studie für die CURE-Studie (Fortsetzung)
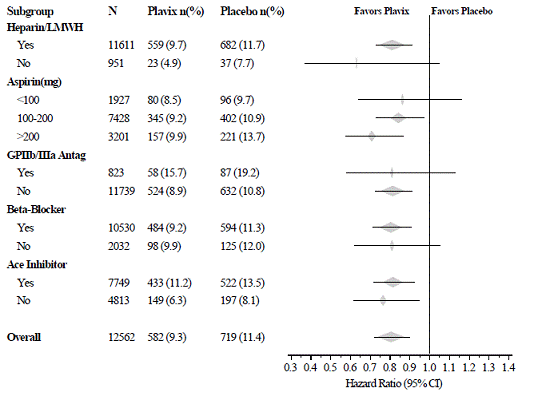
Die Anwendung von Plavix in CURE war mit einer Abnahme der Anwendung von Thrombolytika verbunden (71 Patienten [1,1 %] in der Plavix-75-mg-Gruppe, 126 Patienten [2,0 %] in der Placebo-Gruppe; relative Risikoreduktion von 43 %) und GPIIb/IIIa-Inhibitoren (369 Patienten [5,9 %] in der Plavix-75-mg-Gruppe, 454 Patienten [7,2 %] in der Placebo-Gruppe, relative Risikoreduktion von 18 %). Die Anwendung von Plavix 75 mg in CURE hatte keinen Einfluss auf die Anzahl der Patienten, die mit CABG oder PCI (mit oder ohne Stent) behandelt wurden (2.253 Patienten [36,0 %] in der Plavix 75 mg-Gruppe, 2.324 Patienten [36,9 %] in der Placebo-Gruppe; relativ Risikoreduktion von 4,0 %).
VERPFLICHTEN
Bei Patienten mit STEMI wurden die Sicherheit und Wirksamkeit von Plavix in der randomisierten, placebokontrollierten Doppelblindstudie COMMIT untersucht. COMMIT umfasste 45.852 Patienten, die sich innerhalb von 24 Stunden nach Beginn der Myokardinfarktsymptome mit unterstützenden EKG-Anomalien (dh ST-Hebung, ST-Senkung oder Linksschenkelblock) vorstellten. Die Patienten wurden randomisiert und erhielten Plavix (75 mg einmal täglich) oder Placebo in Kombination mit Aspirin (162 mg pro Tag) für 28 Tage oder bis zur Entlassung aus dem Krankenhaus, je nachdem, was zuerst eintrat.
Die primären Endpunkte waren Tod jeglicher Ursache und das erste Auftreten von Reinfarkt, Schlaganfall oder Tod.
Die Patientenpopulation bestand zu 28 % aus Frauen und zu 58 % aus Altersgruppen von ≥ 60 Jahren (26 % aus Altersgruppen von ≥ 70 Jahren). Fünfundfünfzig Prozent (55 %) der Patienten erhielten Thrombolytika und nur 3 % unterzogen sich einer PCI.
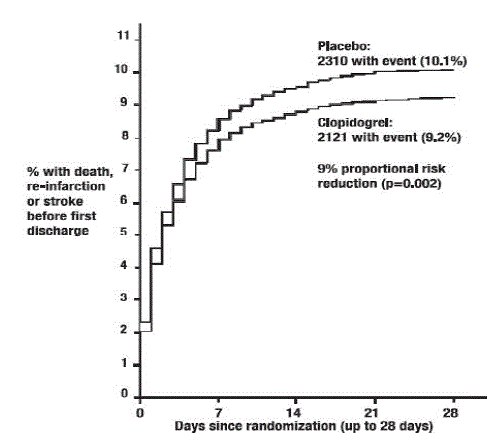
Wie in Tabelle 5 und Abbildung 4 und Abbildung 5 unten gezeigt, reduzierte Plavix signifikant das relative Risiko für Tod jeglicher Ursache um 7 % (p = 0,029) und das relative Risiko für die Kombination von Reinfarkt, Schlaganfall oder Tod um 9 % ( p=0,002).
Abbildung 4: Kumulierte Ereignisraten für Todesfälle in der COMMIT-Studie*
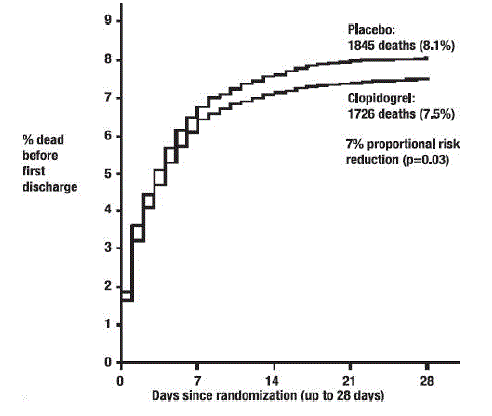
Abbildung 5: Kumulative Ereignisraten für die kombinierten Endpunkte Reinfarkt, Schlaganfall oder Tod in der COMMIT-Studie*
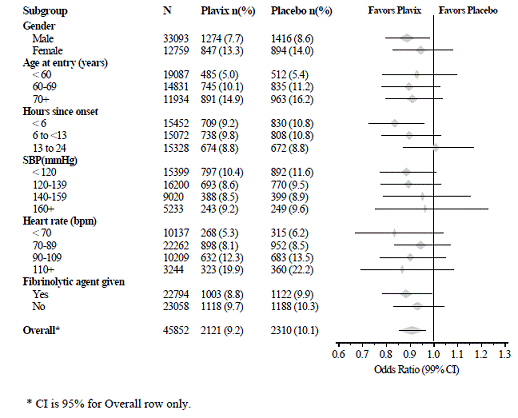
Die Wirkung von Plavix 75 mg unterschied sich in verschiedenen vorab festgelegten Untergruppen nicht signifikant, wie in Abbildung 6 gezeigt. Die Wirkung war auch in nicht vorab festgelegten Untergruppen ähnlich, einschließlich derjenigen, die auf der Infarktlokalisation, der Killip-Klasse oder der früheren MI-Vorgeschichte beruhten. Solche Subgruppenanalysen sollten mit Vorsicht interpretiert werden.
Abbildung 6: Auswirkungen der Zugabe von Plavix 75 mg zu Aspirin auf den kombinierten primären Endpunkt in den Untergruppen der Baseline- und Begleitmedikation für die COMMIT-Studie
Kürzlicher Myokardinfarkt, kürzlicher Schlaganfall oder festgestellte periphere arterielle Verschlusskrankheit
CAPRIE
Die CAPRIE-Studie war eine internationale, randomisierte, doppelblinde Parallelgruppenstudie mit 19.185 Patienten an 304 Zentren, in der Plavix (75 mg täglich) mit Aspirin (325 mg täglich) verglichen wurde. Um für die Aufnahme in Frage zu kommen, mussten die Patienten Folgendes aufweisen: 1) kürzlich aufgetretenen Myokardinfarkt (innerhalb von 35 Tagen); 2) kürzlich aufgetretener ischämischer Schlaganfall (innerhalb von 6 Monaten) mit mindestens einer Woche verbleibender neurologischer Anzeichen; und/oder 3) etablierte periphere arterielle Verschlusskrankheit (PAVK). Die Patienten erhielten eine randomisierte Behandlung für durchschnittlich 1,6 Jahre (maximal 3 Jahre).
Das primäre Ergebnis der Studie war die Zeit bis zum ersten Auftreten eines neuen ischämischen Schlaganfalls (tödlich oder nicht), eines neuen Myokardinfarkts (tödlich oder nicht) oder eines anderen vaskulären Todes. Todesfälle, die nicht ohne Weiteres auf nichtvaskuläre Ursachen zurückgeführt werden konnten, wurden alle als vaskulär klassifiziert.
Wie in Tabelle 6 gezeigt, war Plavix mit einer geringeren Inzidenz von Outcome-Ereignissen, hauptsächlich MI, verbunden. Die relative Gesamtrisikoreduktion (9,8 % vs. 10,6 %) betrug 8,7 %, p = 0,045. Ähnliche Ergebnisse wurden erhalten, wenn anstelle von vaskulärer Mortalität und ischämischen Schlaganfällen die Gesamtmortalität und Schlaganfälle aller Ursachen gezählt wurden (Risikoreduktion 6,9 %). Bei Patienten, die einen Schlaganfall oder Myokardinfarkt während der Studie überlebten, war die Inzidenz nachfolgender Ereignisse in der Plavix-75-mg-Gruppe geringer.
Die Kurven, die die Gesamtereignisrate zeigen, sind in Abbildung 7 dargestellt. Die Ereigniskurven trennten sich früh und gingen während des 3-jährigen Nachbeobachtungszeitraums weiter auseinander.
Abbildung 7: Tödliche oder nicht tödliche vaskuläre Ereignisse in der CAPRIE-Studie
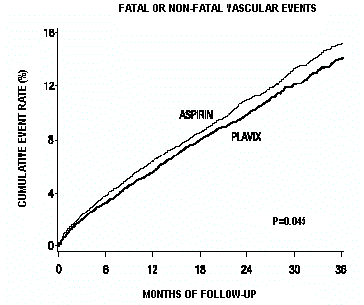
Die statistische Signifikanz zugunsten von Plavix 75 mg gegenüber Aspirin war marginal (p = 0,045). Da Aspirin jedoch selbst bei der Reduzierung kardiovaskulärer Ereignisse bei Patienten mit kürzlich aufgetretenem Myokardinfarkt oder Schlaganfall wirksam ist, ist die Wirkung von Plavix 75 mg erheblich.
In die CAPRIE-Studie wurde eine Population aufgenommen, die kürzlich einen Herzinfarkt, einen kürzlichen Schlaganfall oder eine pAVK hatte. Die Wirksamkeit von Plavix 75 mg im Vergleich zu Aspirin war in diesen Untergruppen heterogen (p = 0,043) (siehe Abbildung 8). Dennoch kann dieser Unterschied ein Zufallsereignis sein, da die CAPRIE-Studie nicht darauf ausgelegt war, den relativen Nutzen von Plavix 75 mg gegenüber Aspirin in den einzelnen Patientenuntergruppen zu bewerten. Der Nutzen war am deutlichsten bei Patienten, die wegen peripherer arterieller Verschlusskrankheit aufgenommen wurden, und weniger deutlich bei Schlaganfallpatienten. Bei Patienten, die allein aufgrund eines kürzlich aufgetretenen Myokardinfarkts in die Studie aufgenommen wurden, war Plavix 75 mg Aspirin zahlenmäßig nicht überlegen.
Abbildung 8: Hazard Ratio und 95 % KI nach Baseline-Subgruppen in der CAPRIE-Studie
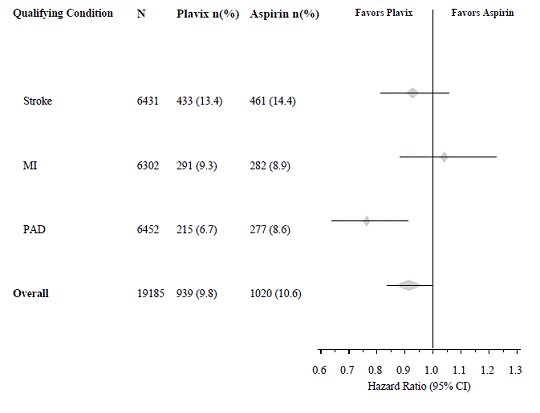
Kein nachgewiesener Nutzen von Plavix 75 mg plus Aspirin bei Patienten mit mehreren Risikofaktoren oder etablierter Gefäßerkrankung
CHARISMA
Die CHARISMA-Studie war eine randomisierte, doppelblinde Parallelgruppenstudie mit 15.603 Probanden, in der Plavix (75 mg täglich) mit Placebo zur Vorbeugung von ischämischen Ereignissen bei Patienten mit Gefäßerkrankungen oder mehreren Risikofaktoren für Atherosklerose verglichen wurde. Alle Probanden wurden täglich mit 75–162 mg Aspirin behandelt. Die mittlere Behandlungsdauer betrug 23 Monate. Die Studie konnte keine Verringerung des Auftretens des primären Endpunkts, einer Kombination aus kardiovaskulärem Tod, Myokardinfarkt oder Schlaganfall, nachweisen. Bei insgesamt 534 (6,9 %) Patienten in der Plavix-Gruppe im Vergleich zu 573 (7,4 %) Patienten in der Placebo-Gruppe kam es zu einem primären Outcome-Ereignis (p = 0,22). Blutungen aller Schweregrade traten häufiger bei den Patienten auf, die randomisiert Plavix erhielten.
INFORMATIONEN ZUM PATIENTEN
Plavix® (PLAV-iks) (Clopidogrelbisulfat) Tabletten
Lesen Sie diesen Medikationsleitfaden, bevor Sie mit der Einnahme von Plavix beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Dieser Medikationsleitfaden ersetzt nicht das Gespräch mit Ihrem Arzt über Ihren Gesundheitszustand oder Ihre Behandlung.
Was sind die wichtigsten Informationen, die ich über Plavix 75 mg wissen sollte?
1. Plavix wirkt möglicherweise nicht so gut bei Menschen, die:
2. Plavix 75 mg kann Blutungen verursachen, die schwerwiegend sein und manchmal zum Tod führen können. Plavix ist ein blutverdünnendes Arzneimittel, das die Wahrscheinlichkeit der Bildung von Blutgerinnseln in Ihrem Körper verringert. Während Sie Plavix einnehmen:
Rufen Sie sofort Ihren Arzt an, wenn Sie eines dieser Anzeichen oder Symptome einer Blutung haben:
Brechen Sie die Einnahme von Plavix 75 mg nicht ab, ohne mit dem Arzt zu sprechen, der es Ihnen verschreibt. Menschen, die die Einnahme von Plavix 75 mg zu früh beenden, haben ein höheres Risiko, einen Herzinfarkt zu erleiden oder zu sterben. Wenn Sie Plavix wegen einer Blutung absetzen müssen, kann Ihr Risiko für einen Herzinfarkt höher sein.
Was ist Plavix 75 mg?
Plavix ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von Patienten mit einer der folgenden Erkrankungen:
Plavix wird allein oder zusammen mit Aspirin angewendet, um die Wahrscheinlichkeit zu verringern, dass Sie ein weiteres schwerwiegendes Problem mit Ihrem Herzen oder Ihren Blutgefäßen wie Herzinfarkt, Schlaganfall oder Blutgerinnsel haben, das zum Tod führen kann.
Blutplättchen sind Blutzellen, die Ihre Blutgerinnung normal unterstützen. Plavix 75 mg hilft zu verhindern, dass Blutplättchen zusammenkleben und ein Gerinnsel bilden, das eine Arterie verstopfen kann.
Es ist nicht bekannt, ob Plavix 75 mg bei Kindern sicher und wirksam ist.
Wer sollte Plavix 75 mg nicht einnehmen?
Nehmen Sie Plavix nicht ein, wenn Sie:
Was sollte ich meinem Arzt vor der Einnahme von Plavix 75 mg mitteilen?
Informieren Sie vor der Einnahme von Plavix Ihren Arzt, wenn Sie:
Informieren Sie alle Ihre Ärzte und Ihren Zahnarzt, dass Sie Plavix einnehmen. Sie sollten mit dem Arzt sprechen, der Ihnen Plavix 75 mg verschrieben hat, bevor Sie sich einer Operation oder einem invasiven Eingriff unterziehen.
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen.
Plavix 75 mg kann die Wirkungsweise anderer Arzneimittel beeinflussen, und andere Arzneimittel können die Wirkungsweise von Plavix beeinflussen. Sehen „Was sind die wichtigsten Informationen, die ich über Plavix 75 mg wissen sollte?“
Plavix 75 mg kann die Blutspiegel anderer Arzneimittel wie Repaglinid (Prandin®) erhöhen.
Die Einnahme von Plavix zusammen mit bestimmten anderen Arzneimitteln kann Ihr Blutungsrisiko erhöhen.
Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste davon, um sie Ihrem Arzt oder Apotheker zu zeigen, wenn Sie ein neues Arzneimittel erhalten.
Wie soll ich Plavix einnehmen?
Welche Nebenwirkungen kann Plavix haben?
Plavix 75 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt. Informieren Sie Ihren Arzt, wenn Sie während der Einnahme von Plavix eine allergische Reaktion einschließlich Hautreaktionen entwickeln.
Dies sind nicht alle möglichen Nebenwirkungen von Plavix. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie soll ich Plavix 75 mg aufbewahren?
Bewahren Sie Plavix und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zu Plavix
Medikamente werden manchmal für andere Zwecke als die in einem Medikationsleitfaden aufgeführten verwendet. Nehmen Sie Plavix 75 mg nicht für einen Zustand ein, für den es nicht verschrieben wurde. Geben Sie Plavix nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Dieser Arzneimittelleitfaden fasst die wichtigsten Informationen zu Plavix zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt. Fragen Sie Ihren Arzt oder Apotheker nach Informationen über Plavix, die für medizinisches Fachpersonal geschrieben wurden.
Weitere Informationen erhalten Sie unter www.sanofi-aventis.us oder www.bms.com oder telefonisch unter 1-800-321-1335.
Welche Inhaltsstoffe enthält Plavix 75 mg?
Wirkstoff: Clopidogrelbisulfat
Inaktive Zutaten:
Tablette: hydriertes Rizinusöl, Hydroxypropylcellulose, Mannitol, mikrokristalline Cellulose, Polyethylenglycol 6000
Filmüberzug: Eisenoxid, Hypromellose 2910, Lactose-Monohydrat, Titandioxid, Triacetin, Carnaubawachs
Dieser Medikationsleitfaden wurde von der US Food and Drug genehmigt.