Pepcid 20mg, 40mg Famotidine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Pepcid und wie wird es angewendet?
Pepcid (Famotidin) wird verwendet, um Sodbrennen, GERD und das Zollinger-Ellison-Syndrom zu behandeln. Es ist rezeptfrei erhältlich. Pepcid 20 mg ist als Generikum erhältlich.
Was sind mögliche Nebenwirkungen bei der Verwendung von Pepcid?
Nebenwirkungen sind gelegentlich, können aber beinhalten:
BEZEICHNUNG
Der Wirkstoff in PEPCID® (Famotidin) ist ein Histamin-H2-Rezeptor-Antagonist. Famotidin ist N'(Aminosulfonyl)-3-[[[2-[(Diaminomethylen)amino]-4-thiazolyl]methyl]thio]propanimidamid. Die empirische Formel von Famotidin ist C8H15N7O2S3 und sein Molekulargewicht beträgt 337,43. Seine Strukturformel lautet:
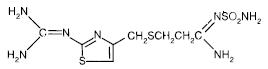
Famotidin ist eine weiße bis blassgelbe kristalline Verbindung, die in Eisessig leicht löslich, in Methanol schwer löslich, in Wasser sehr schwer löslich und in Ethanol praktisch unlöslich ist.
Jede Tablette zur oralen Verabreichung enthält entweder 20 mg oder 40 mg Famotidin und die folgenden Hilfsstoffe: Hydroxypropylcellulose, Hypromellose, Eisenoxide, Magnesiumstearat, mikrokristalline Cellulose, Maisstärke, Talk, Titandioxid und Carnaubawachs.
INDIKATIONEN
PEPCID 40 mg ist angezeigt bei:
DOSIERUNG UND ANWENDUNG
Zwölffingerdarmgeschwür
Akuttherapie: Die empfohlene orale Dosierung für Erwachsene bei aktivem Zwölffingerdarmgeschwür beträgt 40 mg einmal täglich vor dem Schlafengehen. Die meisten Patienten heilen innerhalb von 4 Wochen; Es gibt selten einen Grund, PEPCID in voller Dosierung länger als 6 bis 8 Wochen zu verwenden. Ein Schema mit 20 mg zweimal täglich ist ebenfalls wirksam.
Erhaltungstherapie: Die empfohlene orale Dosis für Erwachsene beträgt 20 mg einmal täglich vor dem Schlafengehen.
Gutartiges Magengeschwür
Akuttherapie: Die empfohlene orale Dosierung für Erwachsene bei aktivem gutartigem Magengeschwür beträgt 40 mg einmal täglich vor dem Schlafengehen.
Gastroösophageale Refluxkrankheit (GERD)
Die empfohlene orale Dosis zur Behandlung von erwachsenen Patienten mit GERD-Symptomen beträgt 20 mg zweimal täglich für bis zu 6 Wochen. Die empfohlene orale Dosierung für die Behandlung von erwachsenen Patienten mit Ösophagitis einschließlich Erosionen und Ulzerationen und begleitenden Symptomen aufgrund von GERD beträgt 20 oder 40 mg zweimal täglich für bis zu 12 Wochen (siehe KLINISCHE PHARMAKOLOGIE bei Erwachsenen , Klinische Studien ).
Dosierung für pädiatrische Patienten
Sehen VORSICHTSMASSNAHMEN , Pädiatrische Patienten
Die unter VORSICHTSMASSNAHMEN, Pädiatrische Patienten
Dosierung für pädiatrische Patienten im Alter von 1-16 Jahren
Sehen VORSICHTSMASSNAHMEN , Pädiatrische Patienten im Alter von 1-16 Jahren.
Die in VORSICHTSMASSNAHMEN, Pädiatrische Patienten im Alter von 1 bis 16 Jahren beschriebenen Studien empfehlen die folgenden Anfangsdosen bei pädiatrischen Patienten im Alter von 1 bis 16 Jahren:
Magengeschwür - 0,5 mg/kg/Tag p.o. vor dem Schlafengehen oder geteilt 2-mal täglich bis zu 40 mg/Tag.
Gastroösophageale Refluxkrankheit mit oder ohne Ösophagitis einschließlich Erosionen und Ulzerationen - 1,0 mg/kg/Tag p.o. geteilt 2-mal täglich bis zu 40 mg 2-mal täglich
Während veröffentlichte unkontrollierte Studien die Wirksamkeit von Famotidin bei der Behandlung von gastroösophagealer Refluxkrankheit und peptischem Ulkus vermuten lassen, reichen die Daten bei pädiatrischen Patienten nicht aus, um eine prozentuale Reaktion in Abhängigkeit von Dosis und Therapiedauer zu ermitteln. Daher sollten die Behandlungsdauer (zunächst auf der Grundlage der Empfehlungen für Erwachsene) und die Dosis auf der Grundlage des klinischen Ansprechens und/oder der pH-Bestimmung (Magen oder Ösophagus) und der Endoskopie individualisiert werden. In veröffentlichten unkontrollierten klinischen Studien bei pädiatrischen Patienten im Alter von 1 bis 16 Jahren wurden Dosen von bis zu 1 mg/kg/Tag bei Magengeschwüren und 2 mg/kg/Tag bei GERD mit oder ohne Ösophagitis, einschließlich Erosionen und Ulzerationen, angewendet.
Pathologische hypersekretorische Zustände (z. B. Zollinger-Ellison-Syndrom, multiple endokrine Adenome)
Die Dosierung von PEPCID bei Patienten mit pathologischen hypersekretorischen Zuständen variiert von Patient zu Patient. Die empfohlene orale Anfangsdosis für Erwachsene bei pathologischen hypersekretorischen Zuständen beträgt 20 mg alle 6 h. Bei manchen Patienten kann eine höhere Anfangsdosis erforderlich sein. Die Dosierung sollte an die individuellen Bedürfnisse des Patienten angepasst und so lange fortgesetzt werden, wie es klinisch indiziert ist. Dosen von bis zu 160 mg alle 6 h wurden einigen erwachsenen Patienten mit schwerem Zollinger-Ellison-Syndrom verabreicht.
Gleichzeitige Anwendung von Antazida
Bei Bedarf können gleichzeitig Antazida verabreicht werden.
Dosisanpassung für Patienten mit mittelschwerer oder schwerer Niereninsuffizienz
Bei erwachsenen Patienten mit mäßiger (Kreatinin-Clearance
Basierend auf dem Vergleich der pharmakokinetischen Parameter von PEPCID bei Erwachsenen und pädiatrischen Patienten sollte eine Dosisanpassung bei pädiatrischen Patienten mit mittelschwerer oder schwerer Niereninsuffizienz in Betracht gezogen werden.
WIE GELIEFERT
PEPCID 40 mg Tabletten 20 mg, sind beigefarbene, abgerundete, quadratische Filmtabletten mit der Prägung MSD auf einer Seite und glatt auf der anderen Seite. Sie werden wie folgt geliefert:
NDC 42998-639-09 Gebrauchseinheit Flaschen zu 30 NDC 42998-639-98 Verwendungseinheit Flaschen zu 100 Stück.
PEPCID 40 mg Tabletten, 40 mg, sind hellbraune, abgerundete, quadratische Filmtabletten mit der Prägung MSD auf einer Seite und glatt auf der anderen Seite. Sie werden wie folgt geliefert:
NDC 42998-649-09 Gebrauchseinheit Flaschen zu 30 NDC 42998-649-98 Verwendungseinheit Flaschen zu 100. Lagerung
Bei kontrollierter Raumtemperatur lagern.
PEPCID® (Famotidin) Tabletten 20 mg und Tabletten 40 mg werden hergestellt für: Marathon Pharmaceuticals, LLC, Northbrook, IL 60062, USA. Ausgestellt Februar 2014.
NEBENWIRKUNGEN
Die unten aufgeführten Nebenwirkungen wurden im Rahmen nationaler und internationaler klinischer Studien bei etwa 2500 Patienten berichtet. In den kontrollierten klinischen Studien, in denen PEPCID 40 mg Tabletten mit Placebo verglichen wurden, war die Inzidenz unerwünschter Ereignisse in der Gruppe, die PEPCID Tabletten, 40 mg vor dem Schlafengehen, erhielt, ähnlich wie in der Placebogruppe.
Die folgenden Nebenwirkungen wurden bei mehr als 1 % der Patienten unter Therapie mit PEPCID in kontrollierten klinischen Studien berichtet und könnten in ursächlichem Zusammenhang mit dem Medikament stehen: Kopfschmerzen (4,7 %), Schwindel (1,3 %), Verstopfung (1,2 % ) und Durchfall (1,7 %).
Die folgenden anderen Nebenwirkungen wurden selten in klinischen Studien oder seit der Markteinführung des Arzneimittels berichtet. Der Zusammenhang zur Therapie mit PEPCID 20mg war in vielen Fällen unklar. Innerhalb jeder Kategorie sind die Nebenwirkungen nach abnehmendem Schweregrad aufgelistet:
Körper als Ganzes: Fieber, Asthenie, Müdigkeit
Herz-Kreislauf: Arrhythmie, AV-Block, Herzklopfen. Sehr selten wurde über eine Verlängerung des QT-Intervalls bei Patienten mit eingeschränkter Nierenfunktion berichtet.
Magen-Darm: cholestatischer Gelbsucht, Hepatitis, Leberenzymanomalien, Erbrechen, Übelkeit, Bauchbeschwerden, Anorexie, Mundtrockenheit
Hämatologisch: seltene Fälle von Agranulozytose, Panzytopenie, Leukopenie, Thrombozytopenie
Überempfindlichkeit: Anaphylaxie, Angioödem, Orbital- oder Gesichtsödem, Urtikaria, Hautausschlag, Bindehautinjektion
Bewegungsapparat: Rhabdomyolyse, Muskel-Skelett-Schmerzen einschließlich Muskelkrämpfe, Arthralgie
Nervensystem/Psychiatrie: Grand-mal-Anfall; psychische Störungen, die in Fällen reversibel waren, die nachuntersucht wurden, einschließlich Halluzinationen, Verwirrtheit, Erregung, Depression, Angst, verminderte Libido; Parästhesien; Schlaflosigkeit; Schläfrigkeit. Krampfanfälle wurden bei Patienten mit eingeschränkter Nierenfunktion sehr selten berichtet.
Atmung: Bronchospasmus, interstitielle Pneumonie
Haut: toxische epidermale Nekrolyse/Stevens-Johnson-Syndrom (sehr selten), Alopezie, Akne, Juckreiz, trockene Haut, Hautrötung
Besondere Sinne: Tinnitus, Geschmacksstörung
Sonstiges: seltene Fälle von Impotenz und seltene Fälle von Gynäkomastie wurden berichtet; In kontrollierten klinischen Studien waren die Inzidenzen jedoch nicht höher als bei Placebo.
Die für PEPCID-Tabletten berichteten Nebenwirkungen können auch bei PEPCID 20 mg als Suspension zum Einnehmen auftreten.
Pädiatrische Patienten
In einer klinischen Studie mit 35 pädiatrischen Patienten
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Es wurden keine Arzneimittelwechselwirkungen festgestellt. Studien mit Famotidin am Menschen, in Tiermodellen und in vitro haben keine signifikante Beeinflussung der Disposition von Verbindungen gezeigt, die durch hepatische mikrosomale Enzyme, z. B. das Cytochrom-P450-System, metabolisiert werden. Beim Menschen getestete Verbindungen umfassen Warfarin, Theophyllin, Phenytoin, Diazepam, Aminopyrin und Antipyrin. Indocyaningrün als Index für die hepatische Drogenextraktion wurde getestet und es wurden keine signifikanten Auswirkungen festgestellt.
WARNUNGEN
Keine Informationen bereitgestellt
VORSICHTSMASSNAHMEN
Allgemein
Das symptomatische Ansprechen auf die Therapie mit PEPCID schließt das Vorliegen einer malignen Erkrankung des Magens nicht aus.
Patienten mit mittelschwerer oder schwerer Niereninsuffizienz
Da ZNS-Nebenwirkungen bei Patienten mit mittelschwerer und schwerer Niereninsuffizienz berichtet wurden, müssen möglicherweise längere Intervalle zwischen den Dosen oder niedrigere Dosen bei Patienten mit mittelschwerer (Kreatinin-Clearance KLINISCHE PHARMAKOLOGIE bei Erwachsenen und DOSIERUNG UND ANWENDUNG ). Bei Patienten mit eingeschränkter Nierenfunktion, deren Dosis/Dosierungsintervall von Famotidin möglicherweise nicht angemessen angepasst wurde, wurde sehr selten über ein verlängertes QT-Intervall berichtet.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einer 106-wöchigen Studie an Ratten und einer 92-wöchigen Studie an Mäusen, denen orale Dosen von bis zu 2000 mg/kg/Tag (etwa das 2500-Fache der empfohlenen Humandosis für aktives Zwölffingerdarmgeschwür) verabreicht wurden, gab es keine Hinweise auf ein karzinogenes Potenzial für PEPCID.
Famotidin war im mikrobiellen Mutagentest (Ames-Test) mit Salmonella typhimurium und Escherichia coli mit oder ohne Rattenleberenzymaktivierung bei Konzentrationen bis zu 10.000 µg/Platte negativ. In In-vivo-Studien an Mäusen mit einem Mikrokerntest und einem Chromosomenaberrationstest wurden keine Hinweise auf eine mutagene Wirkung beobachtet.
In Studien mit Ratten, denen orale Dosen von bis zu 2000 mg/kg/Tag oder intravenöse Dosen von bis zu 200 mg/kg/Tag verabreicht wurden, wurden die Fertilität und Fortpflanzungsfähigkeit nicht beeinträchtigt.

Schwangerschaft
Schwangerschaftskategorie B
Reproduktionsstudien wurden an Ratten und Kaninchen mit oralen Dosen von bis zu 2000 bzw. 500 mg/kg/Tag und bei beiden Spezies mit IV-Dosen von bis zu 200 mg/kg/Tag durchgeführt und ergaben keine signifikanten Hinweise auf Beeinträchtigung der Fruchtbarkeit oder Schädigung des Fötus aufgrund von PEPCID. Obwohl keine direkten fetotoxischen Wirkungen beobachtet wurden, wurden bei einigen Kaninchen bei oralen Dosen von 200 mg/kg/Tag (250-fache der üblichen Humandosis) oder höher sporadische Aborte beobachtet, die nur bei Müttern auftraten, die eine deutlich verringerte Nahrungsaufnahme aufwiesen. Es gibt jedoch keine adäquaten oder gut kontrollierten Studien bei Schwangeren. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Stillende Mutter
Studien an laktierenden Ratten haben gezeigt, dass Famotidin in die Muttermilch übergeht. Bei jungen Ratten, die von Müttern gesäugt wurden, die mit maternotoxischen Dosen von mindestens dem 600-Fachen der üblichen Dosis beim Menschen behandelt wurden, wurde eine vorübergehende Wachstumsdepression beobachtet. Famotidin ist in der Muttermilch nachweisbar. Aufgrund der Möglichkeit schwerwiegender Nebenwirkungen bei gestillten Säuglingen durch PEPCID sollte eine Entscheidung getroffen werden, ob das Stillen oder das Arzneimittel abgesetzt werden soll, wobei die Bedeutung des Arzneimittels für die Mutter zu berücksichtigen ist.
Pädiatrische Patienten
Die Anwendung von PEPCID 20 mg bei pädiatrischen Patienten
Zwei pharmakokinetische Studien bei pädiatrischen Patienten 3 Monate bis 1 Jahr ähnlich ist wie bei älteren pädiatrischen Patienten (1-15 Jahre) und Erwachsenen . Im Gegensatz dazu wiesen pädiatrische Patienten im Alter von 0–3 Monaten Famotidin-Clearance-Werte auf, die 2- bis 4-mal niedriger waren als bei älteren pädiatrischen Patienten und Erwachsenen. Diese Studien zeigen auch, dass die mittlere Bioverfügbarkeit bei pädiatrischen Patienten im Alter von KLINISCHE PHARMAKOLOGIE bei pädiatrischen Patienten , Pharmakokinetik und Pharmakodynamik .)
In einer doppelblinden, randomisierten Absetzstudie wurden 35 pädiatrische Patienten NEBENWIRKUNGEN , Pädiatrische Patienten ).
Diese Studien deuten darauf hin, dass eine Anfangsdosis von 0,5 mg/kg/Dosis Famotidin-Suspension zum Einnehmen für die Behandlung von GERD über einen Zeitraum von bis zu 4 Wochen einmal täglich bei Patienten im Alter von
Pädiatrische Patienten im Alter von 1-16 Jahren
Die Anwendung von PEPCID 40 mg bei pädiatrischen Patienten im Alter von 1-16 Jahren wird durch Beweise aus angemessenen und gut kontrollierten Studien zu PEPCID bei Erwachsenen und durch die folgenden Studien bei pädiatrischen Patienten gestützt: In veröffentlichten Studien mit einer kleinen Anzahl von pädiatrischen Patienten 1-15 Lebensjahr war die Clearance von Famotidin ähnlich wie bei Erwachsenen. Bei pädiatrischen Patienten im Alter von 11 bis 15 Jahren waren orale Dosen von 0,5 mg/kg mit einer mittleren Fläche unter der Kurve (AUC) verbunden, die derjenigen ähnelte, die bei Erwachsenen beobachtet wurde, die oral mit 40 mg behandelt wurden. In ähnlicher Weise waren bei pädiatrischen Patienten im Alter von 1 bis 15 Jahren intravenöse Dosen von 0,5 mg/kg mit einer mittleren AUC verbunden, die derjenigen ähnelte, die bei Erwachsenen beobachtet wurde, die intravenös mit 40 mg behandelt wurden. Begrenzte veröffentlichte Studien deuten auch darauf hin, dass die Beziehung zwischen Serumkonzentration und Säuresuppression bei pädiatrischen Patienten im Alter von 1 bis 15 Jahren im Vergleich zu Erwachsenen ähnlich ist. Diese Studien schlagen eine Anfangsdosis für pädiatrische Patienten im Alter von 1 bis 16 Jahren wie folgt vor:
Magengeschwür - 0,5 mg/kg/Tag p.o. vor dem Schlafengehen oder geteiltes Gebot bis zu 40 mg/Tag.
Gastroösophageale Refluxkrankheit mit oder ohne Ösophagitis einschließlich Erosionen und Ulzerationen - 1,0 mg/kg/Tag p.o. geteilt 2-mal täglich bis zu 40 mg 2-mal täglich
Während veröffentlichte unkontrollierte Studien die Wirksamkeit von Famotidin bei der Behandlung von gastroösophagealer Refluxkrankheit und peptischem Ulkus vermuten lassen, reichen die Daten bei pädiatrischen Patienten nicht aus, um eine prozentuale Reaktion in Abhängigkeit von Dosis und Therapiedauer zu ermitteln. Daher sollten die Behandlungsdauer (zunächst auf der Grundlage der Empfehlungen für Erwachsene) und die Dosis auf der Grundlage des klinischen Ansprechens und/oder der pH-Bestimmung (Magen oder Ösophagus) und der Endoskopie individualisiert werden. In veröffentlichten unkontrollierten klinischen Studien bei pädiatrischen Patienten wurden Dosen von bis zu 1 mg/kg/Tag bei Magengeschwüren und 2 mg/kg/Tag bei GERD mit oder ohne Ösophagitis, einschließlich Erosionen und Ulzerationen, angewendet.
Geriatrische Verwendung
Von den 4.966 Probanden in klinischen Studien, die mit Famotidin behandelt wurden, waren 488 Probanden (9,8 %) 65 Jahre und älter und 88 Probanden (1,7 %) waren älter als 75 Jahre. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet. Eine erhöhte Empfindlichkeit einiger älterer Personen kann jedoch nicht ausgeschlossen werden.
Es ist keine altersabhängige Dosisanpassung erforderlich (siehe KLINISCHE PHARMAKOLOGIE bei Erwachsenen , Pharmakokinetik ). Es ist bekannt, dass dieses Medikament im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko toxischer Reaktionen auf dieses Medikament kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da bei älteren Patienten mit größerer Wahrscheinlichkeit eine eingeschränkte Nierenfunktion vorliegt, sollte die Dosis sorgfältig ausgewählt werden, und es kann sinnvoll sein, die Nierenfunktion zu überwachen. Bei mäßiger oder schwerer Nierenfunktionsstörung ist eine Dosisanpassung erforderlich (vgl VORSICHTSMASSNAHMEN , Patienten mit mäßiger oder schwerer Niereninsuffizienz und DOSIERUNG UND ANWENDUNG , Dosisanpassung für Patienten mit mittelschwerer oder schwerer Niereninsuffizienz ).
ÜBERDOSIS
Die Nebenwirkungen in Fällen von Überdosierung ähneln den Nebenwirkungen, die in der normalen klinischen Erfahrung auftreten (siehe NEBENWIRKUNGEN ). Orale Dosen von bis zu 640 mg/Tag wurden erwachsenen Patienten mit pathologischen hypersekretorischen Zuständen ohne schwerwiegende Nebenwirkungen verabreicht. Im Falle einer Überdosierung sollte die Behandlung symptomatisch und unterstützend erfolgen. Nicht resorbiertes Material sollte aus dem Gastrointestinaltrakt entfernt werden, der Patient sollte überwacht und eine unterstützende Therapie eingeleitet werden.
Die orale LD50 von Famotidin bei männlichen und weiblichen Ratten und Mäusen war größer als 3000 mg/kg und die tödliche akute orale Mindestdosis bei Hunden überstieg 2000 mg/kg. Famotidin verursachte bei hohen oralen Dosen bei Mäusen, Ratten, Katzen und Hunden keine offensichtlichen Wirkungen, induzierte jedoch bei Kaninchen eine signifikante Anorexie und Wachstumsdepression, beginnend mit 200 mg/kg/Tag oral. Die intravenöse LD50 von Famotidin lag bei Mäusen und Ratten im Bereich von 254–563 mg/kg und die tödliche minimale intravenöse Einzeldosis bei Hunden betrug etwa 300 mg/kg. Anzeichen einer akuten Vergiftung bei intravenös behandelten Hunden waren Erbrechen, Ruhelosigkeit, Blässe der Schleimhäute oder Rötung von Mund und Ohren, Hypotonie, Tachykardie und Kollaps.
KONTRAINDIKATIONEN
Überempfindlichkeit gegen einen Bestandteil dieser Produkte. Bei dieser Klasse von Verbindungen wurde Kreuzempfindlichkeit beobachtet. Daher sollte PEPCID 40 mg nicht an Patienten mit bekannter Überempfindlichkeit gegen andere H2-Rezeptor-Antagonisten verabreicht werden.
KLINISCHE PHARMAKOLOGIE
Klinische Pharmakologie bei Erwachsenen
GI-Effekte
PEPCID ist ein kompetitiver Inhibitor von Histamin-H2-Rezeptoren. Die primäre klinisch wichtige pharmakologische Aktivität von PEPCID 40 mg ist die Hemmung der Magensekretion. Sowohl die Säurekonzentration als auch das Volumen der Magensekretion werden durch PEPCID unterdrückt, während Änderungen der Pepsinsekretion proportional zur Volumenabgabe sind.
Bei gesunden Probanden und Hypersekretoren hemmte PEPCID 20 mg die basale und nächtliche Magensekretion sowie die durch Nahrung und Pentagastrin stimulierte Sekretion. Nach oraler Gabe trat die antisekretorische Wirkung innerhalb einer Stunde ein; die maximale Wirkung war dosisabhängig und trat innerhalb von ein bis drei Stunden auf. Die Dauer der Sekretionshemmung durch Dosen von 20 und 40 mg betrug 10 bis 12 Stunden.
Einmalige orale Abenddosen von 20 und 40 mg hemmten die basale und nächtliche Säuresekretion bei allen Probanden; mittlere nächtliche Magensäuresekretion wurde um 86 % bzw. 94 % für einen Zeitraum von mindestens 10 Stunden gehemmt. Dieselben morgens verabreichten Dosen unterdrückten bei allen Probanden die durch Nahrung stimulierte Säuresekretion. Die mittlere Unterdrückung betrug 76 % bzw. 84 % 3 bis 5 Stunden nach der Verabreichung und 25 % bzw. 30 % 8 bis 10 Stunden nach der Verabreichung. Bei einigen Probanden, die die 20-mg-Dosis erhielten, verschwand die antisekretorische Wirkung jedoch innerhalb von 6-8 Stunden. Es gab keine kumulative Wirkung bei wiederholter Gabe. Der nächtliche intragastrische pH-Wert wurde durch Abenddosen von 20 und 40 mg PEPCID auf mittlere Werte von 5,0 bzw. 6,4 angehoben. Wenn PEPCID 40 mg nach dem Frühstück verabreicht wurde, stieg der basale interdigestive pH-Wert tagsüber 3 und 8 Stunden nach 20 oder 40 mg PEPCID 40 mg auf etwa 5 an.
PEPCID 40 mg hatte wenig oder keine Wirkung auf die Nüchtern- oder postprandialen Gastrinspiegel im Serum. Die Magenentleerung und die exokrine Pankreasfunktion wurden durch PEPCID nicht beeinflusst.
Andere Effekte
Systemische Wirkungen von PEPCID auf das ZNS, kardiovaskuläre, respiratorische oder endokrine System wurden in klinisch-pharmakologischen Studien nicht festgestellt. Auch wurden keine antiandrogenen Wirkungen festgestellt. (Sehen NEBENWIRKUNGEN .) Serumhormonspiegel, einschließlich Prolaktin, Cortisol, Thyroxin (T4) und Testosteron, wurden nach der Behandlung mit PEPCID nicht verändert.
Pharmakokinetik
PEPCID 20 mg wird unvollständig resorbiert. Die Bioverfügbarkeit oraler Dosen beträgt 40-45 %. Die Bioverfügbarkeit kann durch Nahrung leicht erhöht oder durch Antazida leicht verringert werden; diese Wirkungen sind jedoch ohne klinische Konsequenz. PEPCID unterliegt einem minimalen First-Pass-Metabolismus. Nach oraler Gabe treten innerhalb von 1-3 Stunden maximale Plasmaspiegel auf. Die Plasmaspiegel nach Mehrfachdosen sind denen nach Einzeldosen ähnlich. 15 bis 20 % von PEPCID 20 mg im Plasma sind proteingebunden. PEPCID hat eine Eliminationshalbwertszeit von 2,5-3,5 Stunden. PEPCID wird renal (65–70 %) und metabolisch (30–35 %) ausgeschieden. Die renale Clearance beträgt 250–450 ml/min, was auf eine gewisse tubuläre Ausscheidung hinweist. 25–30 % einer oralen Dosis und 65–70 % einer intravenösen Dosis werden im Urin als unveränderte Verbindung wiedergefunden. Der einzige beim Menschen identifizierte Metabolit ist das S-Oxid.
Es besteht ein enger Zusammenhang zwischen den Kreatinin-Clearance-Werten und der Eliminationshalbwertszeit von PEPCID. Bei Patienten mit schwerer Niereninsuffizienz, d. h. einer Kreatinin-Clearance von weniger als 10 ml/min, kann die Eliminationshalbwertszeit von PEPCID 20 Stunden überschreiten und eine Anpassung der Dosis oder der Dosierungsintervalle bei mittelschwerer und schwerer Niereninsuffizienz kann erforderlich sein (siehe Abschnitt 4.4). VORSICHTSMASSNAHMEN , DOSIERUNG UND ANWENDUNG ).
Bei älteren Patienten gibt es keine klinisch signifikanten altersbedingten Veränderungen der Pharmakokinetik von PEPCID. Bei älteren Patienten mit eingeschränkter Nierenfunktion kann die Clearance des Arzneimittels jedoch verringert sein (vgl VORSICHTSMASSNAHMEN , Geriatrische Verwendung ).
Klinische Studien
Zwölffingerdarmgeschwür
In einer multizentrischen Doppelblindstudie in den USA bei ambulanten Patienten mit endoskopisch bestätigtem Zwölffingerdarmgeschwür wurde oral verabreichtes PEPCID mit Placebo verglichen. Wie in Tabelle 1 gezeigt, waren 70 % der mit PEPCID 40 mg hs behandelten Patienten bis Woche 4 geheilt.
Patienten, die bis Woche 4 nicht geheilt waren, wurden in der Studie fortgesetzt. Bis Woche 8 waren 83 % der mit PEPCID behandelten Patienten geheilt gegenüber 45 % der mit Placebo behandelten Patienten. Die Inzidenz der Ulkusheilung war bei PEPCID zu jedem Zeitpunkt signifikant höher als bei Placebo, basierend auf dem Anteil der endoskopisch bestätigten geheilten Ulzera.
In dieser Studie war die Zeit bis zur Linderung der Tages- und Nachtschmerzen bei Patienten, die PEPCID erhielten, signifikant kürzer als bei Patienten, die Placebo erhielten; Patienten, die PEPCID erhielten, nahmen auch weniger Antazida ein als die Patienten, die Placebo erhielten.
Langzeitbehandlung von Zwölffingerdarmgeschwüren
PEPCID 40 mg, 20 mg p.o., wurde als Erhaltungstherapie in zwei doppelblinden, multizentrischen Studien an Patienten mit endoskopisch bestätigten geheilten Zwölffingerdarmgeschwüren mit Placebo hs verglichen. In der US-Studie war die beobachtete Inzidenz von Geschwüren innerhalb von 12 Monaten bei mit Placebo behandelten Patienten 2,4-mal höher als bei mit PEPCID behandelten Patienten. Die 89 mit PEPCID behandelten Patienten hatten eine kumulative beobachtete Ulkusinzidenz von 23,4 % im Vergleich zu einer beobachteten Ulkusinzidenz von 56,6 % bei den 89 Patienten, die Placebo erhielten (p
Magengeschwür
Sowohl in einer US-amerikanischen als auch in einer internationalen multizentrischen Doppelblindstudie bei Patienten mit endoskopisch bestätigtem aktivem gutartigem Magengeschwür wurde oral verabreichtes PEPCID 20 mg, 40 mg hs, mit Placebo hs verglichen. Antazida waren während der Studien erlaubt, aber der Verbrauch war nicht signifikant unterschiedlich zwischen der PEPCID- und der Placebo-Gruppe. Wie in Tabelle 2 gezeigt, war die Inzidenz der Ulkusheilung (Abbruch als nicht geheilt gezählt) mit PEPCID 20 mg statistisch signifikant besser als Placebo in den Wochen 6 und 8 in der US-Studie und in den Wochen 4, 6 und 8 in der internationalen Studie, basierend auf die Anzahl der geheilten Geschwüre, bestätigt durch Endoskopie.
Die Zeit bis zur vollständigen Linderung der Tages- und Nachtschmerzen war bei Patienten, die PEPCID 20 mg erhielten, statistisch signifikant kürzer als bei Patienten, die Placebo erhielten; jedoch gab es in keiner Studie einen statistisch signifikanten Unterschied im Anteil der Patienten, deren Schmerzen am Ende der Studie (Woche 8) gelindert waren.
Gastroösophageale Refluxkrankheit (GERD)
Oral verabreichtes PEPCID wurde in einer US-Studie, in die Patienten mit GERD-Symptomen und ohne endoskopischen Nachweis einer Erosion oder Ulzeration der Speiseröhre aufgenommen wurden, mit Placebo verglichen. PEPCID 20 mg zweimal täglich war 40 mg hs und Placebo statistisch signifikant überlegen, was ein erfolgreiches symptomatisches Ergebnis anbelangte, definiert als mäßige oder ausgezeichnete Verbesserung der Symptome (Tabelle 3).
Nach zweiwöchiger Behandlung wurde bei einem größeren Prozentsatz der Patienten, die PEPCID 20 mg zweimal täglich einnahmen, ein symptomatischer Erfolg beobachtet, verglichen mit Placebo (p ≤ 0,01).
In zwei weiteren Studien wurden die symptomatische Besserung und Heilung endoskopisch nachgewiesener Erosionen und Ulzerationen untersucht. Heilung wurde als vollständige Auflösung aller endoskopisch sichtbaren Erosionen oder Ulzerationen definiert. Die US-Studie, in der PEPCID 40 mg p.o. zweimal täglich mit Placebo und PEPCID 20 mg p.o.
Im Vergleich zu Placebo kam es bei Patienten, die PEPCID erhielten, zu einer schnelleren Linderung des Sodbrennens am Tag und in der Nacht, und ein größerer Prozentsatz der Patienten erfuhr eine vollständige Linderung des nächtlichen Sodbrennens. Diese Unterschiede waren statistisch signifikant.
In der internationalen Studie wurde beim Vergleich von PEPCID 40 mg p.o. zweimal täglich mit Ranitidin 150 mg p.o. Es gab jedoch keinen signifikanten Unterschied zwischen den Behandlungen in Bezug auf die Linderung der Symptome.
Pathologische hypersekretorische Zustände (z. B. Zollinger-Ellison-Syndrom, multiple endokrine Adenome)
In Studien an Patienten mit pathologischen hypersekretorischen Zuständen wie dem Zollinger-Ellison-Syndrom mit oder ohne multiple endokrine Adenome hemmte PEPCID die Magensäuresekretion signifikant und kontrollierte die damit verbundenen Symptome. Oral verabreichte Dosen von 20 bis 160 mg alle 6 h hielten die basale Säuresekretion unter 10 mEq/h; Anfangsdosen wurden auf die individuellen Bedürfnisse des Patienten titriert, und bei einigen Patienten waren im Laufe der Zeit spätere Anpassungen erforderlich. PEPCID 40 mg wurde bei diesen hohen Dosierungen über einen längeren Zeitraum (länger als 12 Monate) von acht Patienten gut vertragen, und es wurden keine Fälle von Gynäkomastie, erhöhten Prolaktinspiegeln oder Impotenz berichtet, die auf das Medikament zurückgeführt wurden.
Klinische Pharmakologie bei pädiatrischen Patienten
Pharmakokinetik
Tabelle 6 enthält pharmakokinetische Daten aus klinischen Studien und einer veröffentlichten Studie an pädiatrischen Patienten (
Bei pädiatrischen Patienten im Alter von 0-3 Monaten ist die Plasmaclearance verringert und die Eliminationshalbwertszeit verlängert im Vergleich zu älteren pädiatrischen Patienten. Die pharmakokinetischen Parameter für pädiatrische Patienten im Alter von > 3 Monaten bis 15 Jahren sind mit denen für Erwachsene vergleichbar.
Bioverfügbarkeitsstudien an 8 pädiatrischen Patienten (11-15 Jahre) zeigten eine mittlere orale Bioverfügbarkeit von 0,5 im Vergleich zu Werten von 0,42 bis 0,49 bei Erwachsenen. Orale Dosen von 0,5 mg/kg erreichten AUCs von 645 ± 249 ng-h/ml und 580 ± 60 ng-h/ml bei pädiatrischen Patienten
Pharmakodynamik
Die Pharmakodynamik von Famotidin wurde bei 5 pädiatrischen Patienten im Alter von 2 bis 13 Jahren unter Verwendung des Sigmoid-Emax-Modells untersucht. Diese Daten deuten darauf hin, dass die Beziehung zwischen der Serumkonzentration von Famotidin und der Unterdrückung der Magensäure ähnlich derjenigen ist, die in einer Studie mit Erwachsenen beobachtet wurde (Tabelle 7).
Fünf veröffentlichte Studien (Tabelle 8) untersuchten die Wirkung von Famotidin auf den pH-Wert im Magen und die Dauer der Säuresuppression bei pädiatrischen Patienten. Obwohl jede Studie ein anderes Design hatte, werden die Daten zur Säuresuppression im Laufe der Zeit wie folgt zusammengefasst:
In einer Studie wurde gezeigt, dass die Wirkungsdauer von Famotidin i.v. 0,5 mg/kg auf den Magen-pH-Wert und die Säuresuppression bei pädiatrischen Patienten
INFORMATIONEN ZUM PATIENTEN
Keine Informationen bereitgestellt. Bitte wende dich an die VORSICHTSMASSNAHMEN Sektion.