Protonix 20mg, 40mg Pantoprazole Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Protonix 40 mg und wie wird es angewendet?
Protonix 40 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome einer durch Magensäure verursachten Ösophagitis aufgrund von gastroösophagealer Refluxkrankheit oder GERD und Zollinger-Ellison-Syndrom oder anderen Erkrankungen, die zu viel Magensäure verursachen. Protonix 40 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Protonix gehört zu einer Klasse von Medikamenten, die als Protonenpumpenhemmer (PPIs) bezeichnet werden.
Es ist nicht bekannt, ob Protonix bei Kindern unter 5 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Protonix haben?
Protonix kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Protonix gehören:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Prometrium. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Der Wirkstoff in PROTONIX (Pantoprazol-Natrium) zur oralen Suspension mit verzögerter Freisetzung und PROTONIX (Pantoprazol-Natrium) Tabletten mit verzögerter Freisetzung, ein PPI, ist ein substituiertes Benzimidazol, Natrium-5-(difluormethoxy)-2-[[(3,4- Dimethoxy-2-pyridinyl)methyl]sulfinyl]-1H-benzimidazol-sesquihydrat, eine Verbindung, die die Magensäuresekretion hemmt. Seine empirische Formel ist C16H14F2N3NaO4S x 1,5 H2O mit einem Molekulargewicht von 432,4. Die Strukturformel lautet:
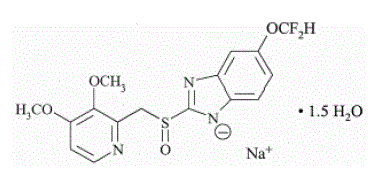
Pantoprazol-Natrium-Sesquihydrat ist ein weißes bis cremefarbenes kristallines Pulver und ist racemisch. Pantoprazol hat schwach basische und saure Eigenschaften. Pantoprazol-Natrium-Sesquihydrat ist frei löslich in Wasser, sehr schwer löslich in Phosphatpuffer bei pH 7,4 und praktisch unlöslich in n-Hexan.
Die Stabilität der Verbindung in wässriger Lösung ist pH-abhängig. Die Abbaugeschwindigkeit steigt mit sinkendem pH-Wert. Bei Umgebungstemperatur beträgt die Abbauhalbwertszeit etwa 2,8 Stunden bei pH 5 und etwa 220 Stunden bei pH 7,8.
PROTONIX 40 mg wird als Suspension zum Einnehmen mit verzögerter Freisetzung in Einzeldosispackungen geliefert, erhältlich in einer Stärke (40 mg) Pantoprazol (entsprechend 45,1 mg Pantoprazol-Natrium) und als Tablette mit verzögerter Freisetzung, erhältlich in zwei Stärken 20 mg Pantoprazol (entsprechend 22,56 mg Pantoprazol-Natrium) und 40 mg Pantoprazol (entsprechend 45,1 mg Pantoprazol-Natrium).
PROTONIX Tabletten mit verzögerter Freisetzung enthalten die folgenden inaktiven Bestandteile: Calciumstearat, Crospovidon, Hypromellose, Eisenoxid, Mannit, Methacrylsäure-Copolymer, Polysorbat 80, Povidon, Propylenglycol, Natriumcarbonat, Natriumlaurylsulfat, Titandioxid und Triethylcitrat. PROTONIX Retardtabletten (40 mg und 20 mg) erfüllen den USP-Auflösungstest 2.
PROTONIX 40 mg zur oralen Suspension mit verzögerter Freisetzung enthält die folgenden inaktiven Bestandteile: Crospovidon, Hypromellose, Methacrylsäure-Copolymer, mikrokristalline Cellulose, Polysorbat 80, Povidon, Natriumcarbonat, Natriumlaurylsulfat, Talk, Titandioxid, Triethylcitrat und gelbes Eisenoxid.
INDIKATIONEN
PROTONIX für die orale Suspension mit verzögerter Freisetzung und PROTONIX 40 mg Tabletten mit verzögerter Freisetzung sind indiziert für:
Kurzzeitbehandlung der erosiven Ösophagitis im Zusammenhang mit der gastroösophagealen Refluxkrankheit (GERD)
PROTONIX 20 mg ist angezeigt bei Erwachsenen und Kindern und Jugendlichen ab fünf Jahren zur Kurzzeitbehandlung (bis zu 8 Wochen) zur Heilung und symptomatischen Linderung einer erosiven Ösophagitis (EE). Bei erwachsenen Patienten, die nach 8-wöchiger Behandlung noch nicht geheilt sind, kann eine zusätzliche 8-wöchige Behandlung mit PROTONIX in Betracht gezogen werden. Die Sicherheit der Behandlung bei pädiatrischen Patienten über 8 Wochen hinaus wurde nicht nachgewiesen.
Aufrechterhaltung der Heilung der erosiven Ösophagitis
PROTONIX ist indiziert zur Aufrechterhaltung der Heilung von EE und zur Verringerung der Rückfallraten von Sodbrennen-Symptomen am Tag und in der Nacht bei erwachsenen Patienten mit GERD. Kontrollierte Studien erstreckten sich nicht über 12 Monate.
Pathologische hypersekretorische Zustände einschließlich Zollinger-Ellison-Syndrom
PROTONIX 20 mg ist angezeigt für die Langzeitbehandlung pathologischer hypersekretorischer Zustände, einschließlich des Zollinger-Ellison (ZE)-Syndroms.
DOSIERUNG UND ANWENDUNG
Empfohlener Dosierungsplan
PROTONIX wird als Granulat mit verzögerter Freisetzung in Packungen zur Herstellung oraler Suspensionen oder als Tabletten mit verzögerter Freisetzung geliefert. Die empfohlenen Dosierungen sind in Tabelle 1 aufgeführt.
Verwaltungsanweisungen
Anweisungen zur Art der Verabreichung für jede Dosierungsform sind in Tabelle 2 dargestellt.
Nehmen Sie eine vergessene Dosis so bald wie möglich ein. Wenn es fast Zeit für die nächste Dosis ist, überspringen Sie die vergessene Dosis und nehmen Sie die nächste Dosis zur regulären geplanten Zeit ein. Nehmen Sie nicht 2 Dosen gleichzeitig ein.
PROTONIX Tabletten mit verzögerter Freisetzung
Schlucken Sie PROTONIX Retardtabletten unzerkaut mit oder ohne Nahrung im Magen. Patienten, die eine 40-mg-Tablette nicht schlucken können, können zwei 20-mg-Tabletten einnehmen. Die gleichzeitige Verabreichung von Antazida hat keinen Einfluss auf die Resorption von PROTONIX Retardtabletten.
PROTONIX Zur oralen Suspension mit verzögerter Freisetzung
Verabreichen Sie PROTONIX für die orale Suspension mit verzögerter Freisetzung ungefähr 30 Minuten vor einer Mahlzeit durch orale Verabreichung in Apfelsaft oder Apfelmus oder durch eine nasogastrale Sonde nur in Apfelsaft. Da für die Stabilität ein angemessener pH-Wert erforderlich ist, darf PROTONIX 20 mg zur oralen Suspension mit verzögerter Freisetzung nicht in anderen Flüssigkeiten als Apfelsaft oder anderen Nahrungsmitteln als Apfelmus verabreicht werden.
Teilen Sie die Packung mit 40 mg PROTONIX 20 mg zur oralen Suspension mit verzögerter Freisetzung nicht, um eine 20-mg-Dosierung für pädiatrische Patienten herzustellen, die nicht in der Lage sind, die Tablettenformulierung einzunehmen.
PROTONIX zur oralen Suspension mit verzögerter Freisetzung - Orale Verabreichung in Apfelmus
PROTONIX Zur oralen Suspension mit verzögerter Freisetzung - Orale Verabreichung in Apfelsaft
PROTONIX 40 mg zur oralen Suspension mit verzögerter Freisetzung – Verabreichung über eine Magensonde (NG) oder Gastrostomiesonde
Bei Patienten mit einer Magensonde oder Gastrostomiesonde kann PROTONIX 40 mg als orale Suspension mit verzögerter Freisetzung wie folgt verabreicht werden:
WIE GELIEFERT
Darreichungsformen und Stärken
Tabletten mit verzögerter Freisetzung:
Für die orale Suspension mit verzögerter Freisetzung:
Lagerung und Handhabung
PROTONIX (Pantoprazol-Natrium) Tabletten mit verzögerter Freisetzung sind als gelbe, ovale, bikonvexe Retardtabletten mit dem Aufdruck PROTONIX (braune Tinte) auf einer Seite mit 40 mg Pantoprazol erhältlich und sind wie folgt erhältlich:
NDC 0008-0841-81, Flaschen zu 90
PROTONIX (Pantoprazol-Natrium) Tabletten mit verzögerter Freisetzung sind als gelbe, ovale, bikonvexe Retardtabletten mit dem Aufdruck P20 (braune Tinte) auf einer Seite mit 20 mg Pantoprazol erhältlich und sind wie folgt erhältlich:
NDC 0008-0843-81, Flaschen zu 90
PROTONIX (Pantoprazol-Natrium) Zur oralen Suspension mit verzögerter Freisetzung wird als blass gelbliches bis dunkel bräunliches magensaftresistentes Granulat mit 40 mg Pantoprazol in Einzeldosispackungen geliefert und ist wie folgt erhältlich:
NDC 0008-0844-02, Einzeldosiskarton mit 30 Stück
Lagerung
PROTONIX 40 mg als orale Suspension mit verzögerter Freisetzung und PROTONIX 20 mg Tabletten mit verzögerter Freisetzung bei 20 °C bis 25 °C (68 °F bis 77 °F) lagern; Exkursionen erlaubt bis 15° bis 30°C (59° bis 86°F) [siehe USP kontrollierte Raumtemperatur ].
Vertrieb durch: Wyeth Pharmaceuticals LLC, eine Tochtergesellschaft von Pfizer Inc., Philadelphia, PA 19101. Überarbeitet: Nov. 2020
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden unten und an anderer Stelle in der Kennzeichnung beschrieben:
Erfahrung mit klinischen Studien
Die Nebenwirkungsprofile von PROTONIX (Pantoprazol-Natrium) zur oralen Suspension mit verzögerter Freisetzung und PROTONIX (Pantoprazol-Natrium) Tabletten mit verzögerter Freisetzung sind ähnlich.
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Erwachsene
Die Sicherheit in neun randomisierten klinischen Vergleichsstudien in den USA bei Patienten mit GERD umfasste 1.473 Patienten mit oralem PROTONIX (20 mg oder 40 mg), 299 Patienten mit einem H2-Rezeptorantagonisten, 46 Patienten mit einem anderen PPI und 82 Patienten mit Placebo. Die am häufigsten auftretenden Nebenwirkungen sind in Tabelle 3 aufgeführt.
Zusätzliche Nebenwirkungen, die für PROTONIX 20 mg in klinischen Studien mit einer Häufigkeit von ≤ 2 % berichtet wurden, sind unten nach Körpersystem aufgelistet:
Körper als Ganzes: allergische Reaktion, Fieber, Lichtempfindlichkeitsreaktion, Gesichtsödem
Magen-Darm: Verstopfung, Mundtrockenheit, Hepatitis
Hämatologisch: Leukopenie, Thrombozytopenie
Stoffwechsel/Ernährung: erhöhte CK (Kreatinkinase), allgemeines Ödem, erhöhte Triglyceride, erhöhte Leberenzyme
Bewegungsapparat: Myalgie
Nervös: Depressionen, Schwindel
Haut und Anhängsel: Urtikaria, Hautausschlag, Juckreiz
Besondere Sinne: verschwommene Sicht
Pädiatrische Patienten
Die Sicherheit von PROTONIX bei der Behandlung von EE im Zusammenhang mit GERD wurde bei pädiatrischen Patienten im Alter von 1 Jahr bis 16 Jahren in drei klinischen Studien untersucht. Sicherheitsstudien umfassten pädiatrische Patienten mit EE; Da EE jedoch in der pädiatrischen Population ungewöhnlich ist, wurden 249 pädiatrische Patienten mit endoskopisch nachgewiesener oder symptomatischer GERD ebenfalls untersucht. Alle Nebenwirkungen von PROTONIX 20 mg bei Erwachsenen gelten als relevant für pädiatrische Patienten. Bei Patienten im Alter von 1 Jahr bis 16 Jahren sind die am häufigsten berichteten (> 4 %) Nebenwirkungen: URI, Kopfschmerzen, Fieber, Durchfall, Erbrechen, Hautausschlag und Bauchschmerzen.
Informationen zur Sicherheit bei Patienten unter 1 Jahr finden Sie unter Verwendung in bestimmten Bevölkerungsgruppen .
Zusätzliche Nebenwirkungen, die für PROTONIX 20 mg bei pädiatrischen Patienten in klinischen Studien mit einer Häufigkeit von ≤4 % berichtet wurden, sind unten nach Körpersystem aufgelistet:
Körper als Ganzes: allergische Reaktion, Gesichtsödem
Magen-Darm: Verstopfung, Blähungen, Übelkeit
Stoffwechsel/Ernährung: erhöhte Triglyzeride, erhöhte Leberenzyme, erhöhte CK (Kreatinkinase)
Bewegungsapparat: Arthralgie, Myalgie
Nervös: Schwindel, Schwindel
Haut und Anhängsel: Urtikaria
Die folgenden Nebenwirkungen, die bei Erwachsenen in klinischen Studien beobachtet wurden, wurden bei pädiatrischen Patienten in klinischen Studien nicht berichtet, gelten aber als relevant für pädiatrische Patienten: Lichtempfindlichkeitsreaktion, Mundtrockenheit, Hepatitis, Thrombozytopenie, generalisiertes Ödem, Depression, Pruritus, Leukopenie und verschwommenes Sehen .
Zollinger-Ellison (ZE)-Syndrom
In klinischen Studien zum ZE-Syndrom waren die Nebenwirkungen, die bei 35 Patienten berichtet wurden, die PROTONIX 80 mg/Tag bis 240 mg/Tag für bis zu 2 Jahre einnahmen, ähnlich denen, die bei erwachsenen Patienten mit GERD berichtet wurden.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von PROTONIX nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Diese Nebenwirkungen sind unten nach Körpersystem aufgelistet:
Gastrointestinale Störungen: Fundusdrüsenpolypen
Allgemeine Erkrankungen und Verabreichungsbedingungen: Asthenie, Müdigkeit, Unwohlsein
Hämatologisch: Panzytopenie, Agranulozytose
Leber- und Gallenerkrankungen: hepatozelluläre Schäden, die zu Gelbsucht und Leberversagen führen
Erkrankungen des Immunsystems: Anaphylaxie (einschließlich anaphylaktischer Schock), systemischer Lupus erythematodes
Infektionen und Schädlinge: Clostridium difficile-assoziierter Durchfall
Untersuchungen: Gewichtsänderungen
Stoffwechsel- und Ernährungsstörungen: Hyponatriämie, Hypomagnesiämie
Störung des Bewegungsapparates: Rhabdomyolyse, Knochenbruch
Nervös: Ageusie, Dysgeusie
Psychische Störungen: Halluzination, Verwirrtheit, Schlaflosigkeit, Somnolenz
Nieren- und Harnwegserkrankungen: akute tubulointerstitielle Nephritis
Erkrankungen der Haut und des Unterhautgewebes: schwere dermatologische Reaktionen (einige mit tödlichem Ausgang), einschließlich Erythema multiforme, Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse (TEN, einige mit tödlichem Ausgang), Angioödem (Quincke-Ödem) und kutaner Lupus erythematodes
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Tabelle 4 enthält Arzneimittel mit klinisch wichtigen Arzneimittelwechselwirkungen und Wechselwirkungen mit Diagnostika bei gleichzeitiger Verabreichung mit PROTONIX sowie Anweisungen zu deren Vorbeugung oder Behandlung.
Konsultieren Sie die Kennzeichnung von gleichzeitig angewendeten Arzneimitteln, um weitere Informationen über Wechselwirkungen mit PPIs zu erhalten.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Vorhandensein einer malignen Magenerkrankung
Bei Erwachsenen schließt das symptomatische Ansprechen auf die Therapie mit PROTONIX das Vorliegen einer malignen Erkrankung des Magens nicht aus. Erwägen Sie zusätzliche Nachsorge und diagnostische Tests bei erwachsenen Patienten, die nach Abschluss der Behandlung mit einem PPI ein suboptimales Ansprechen oder einen frühen symptomatischen Rückfall zeigen. Ziehen Sie bei älteren Patienten auch eine Endoskopie in Betracht.
Akute tubulointerstitielle Nephritis
Akute tubulointerstitielle Nephritis (TIN) wurde bei Patienten beobachtet, die PPIs einnahmen, und kann zu jedem Zeitpunkt während der PPI-Therapie auftreten. Die Patienten können unterschiedliche Anzeichen und Symptome aufweisen, von symptomatischen Überempfindlichkeitsreaktionen bis hin zu unspezifischen Symptomen einer verminderten Nierenfunktion (z. B. Unwohlsein, Übelkeit, Anorexie). In gemeldeten Fallserien wurden einige Patienten bei der Biopsie und ohne extrarenale Manifestationen (z. B. Fieber, Hautausschlag oder Arthralgie) diagnostiziert. Setzen Sie PROTONIX 20 mg ab und untersuchen Sie Patienten mit Verdacht auf akute TIN [siehe KONTRAINDIKATIONEN ].
Clostridium difficile-assoziierter Durchfall
Veröffentlichte Beobachtungsstudien deuten darauf hin, dass eine PPI-Therapie wie PROTONIX 20 mg mit einem erhöhten Risiko für Clostridium difficile-assoziierte Diarrhoe verbunden sein kann, insbesondere bei Krankenhauspatienten. Diese Diagnose sollte bei Durchfall in Betracht gezogen werden, der sich nicht bessert [siehe NEBENWIRKUNGEN ].
Die Patienten sollten die niedrigste Dosis und kürzeste Dauer der PPI-Therapie anwenden, die für die zu behandelnde Erkrankung geeignet ist.
Knochenbruch
Mehrere veröffentlichte Beobachtungsstudien deuten darauf hin, dass die PPI-Therapie mit einem erhöhten Risiko für osteoporosebedingte Frakturen der Hüfte, des Handgelenks oder der Wirbelsäule verbunden sein kann. Das Frakturrisiko war bei Patienten erhöht, die eine hohe Dosis, definiert als mehrere Tagesdosen, und eine PPI-Langzeittherapie (ein Jahr oder länger) erhielten. Die Patienten sollten die niedrigste Dosis und kürzeste Dauer der PPI-Therapie anwenden, die für die zu behandelnde Erkrankung geeignet ist. Patienten mit einem Risiko für osteoporosebedingte Frakturen sollten gemäß etablierten Behandlungsrichtlinien behandelt werden [siehe DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN ].
Kutaner und systemischer Lupus erythematodes
Kutaner Lupus erythematodes (CLE) und systemischer Lupus erythematodes (SLE) wurden bei Patienten berichtet, die PPI, einschließlich Pantoprazol-Natrium, einnahmen. Diese Ereignisse traten sowohl als Neubeginn als auch als Exazerbation einer bestehenden Autoimmunerkrankung auf. Die Mehrzahl der Fälle von PPI-induziertem Lupus erythematöse waren CLE.
Die häufigste Form von CLE, die bei mit PPI behandelten Patienten berichtet wurde, war subakuter CLE (SCLE) und trat innerhalb von Wochen bis Jahren nach kontinuierlicher medikamentöser Therapie bei Patienten auf, die von Säuglingen bis zu älteren Menschen reichten. Im Allgemeinen wurden histologische Befunde ohne Organbeteiligung beobachtet.
Systemischer Lupus erythematodes (SLE) wird seltener als CLE bei Patienten berichtet, die PPI erhalten. PPI-assoziierter SLE verläuft in der Regel milder als nicht medikamentös induzierter SLE. Der Beginn des SLE trat typischerweise innerhalb von Tagen bis Jahren nach Beginn der Behandlung auf, hauptsächlich bei Patienten, die von jungen Erwachsenen bis zu älteren Menschen reichten. Die Mehrheit der Patienten stellte sich mit Hautausschlag vor; jedoch wurden auch Arthralgie und Zytopenie berichtet.
Vermeiden Sie die Verabreichung von PPI länger als medizinisch angezeigt. Wenn bei Patienten, die PROTONIX 40 mg erhalten, Anzeichen oder Symptome festgestellt werden, die mit CLE oder SLE übereinstimmen, setzen Sie das Medikament ab und überweisen Sie den Patienten zur Untersuchung an den entsprechenden Spezialisten. Die meisten Patienten bessern sich nach Absetzen des PPI allein in 4 bis 12 Wochen. Serologische Tests (z. B. ANA) können positiv sein und erhöhte serologische Testergebnisse können länger dauern, bis sie behoben sind, als klinische Manifestationen.
Cyanocobalamin (Vitamin B-12)-Mangel
Im Allgemeinen kann die tägliche Behandlung mit säureunterdrückenden Medikamenten über einen längeren Zeitraum (z. B. länger als 3 Jahre) zu einer durch Hypo- oder Achlorhydrie verursachten Malabsorption von Cyanocobalamin (Vitamin B-12) führen. In der Literatur wurde in seltenen Fällen über einen Cyanocobalamin-Mangel berichtet, der bei einer säureunterdrückenden Therapie auftrat. Diese Diagnose sollte erwogen werden, wenn klinische Symptome beobachtet werden, die mit einem Cyanocobalamin-Mangel übereinstimmen.
Hypomagnesiämie
Hypomagnesiämie, symptomatisch und asymptomatisch, wurde selten bei Patienten berichtet, die mindestens drei Monate lang und in den meisten Fällen nach einem Jahr Therapie mit PPI behandelt wurden. Schwerwiegende Nebenwirkungen sind Tetanie, Arrhythmien und Krampfanfälle. Bei den meisten Patienten erforderte die Behandlung der Hypomagnesiämie eine Magnesiumsubstitution und das Absetzen des PPI.
Bei Patienten, die voraussichtlich über einen längeren Zeitraum behandelt werden oder die PPI zusammen mit Medikamenten wie Digoxin oder Arzneimitteln einnehmen, die eine Hypomagnesiämie verursachen können (z. B. Diuretika), kann medizinisches Fachpersonal erwägen, den Magnesiumspiegel vor Beginn der PPI-Behandlung und regelmäßig zu überwachen [siehe NEBENWIRKUNGEN ].
Tumorigenität
Aufgrund der chronischen Natur von GERD besteht die Möglichkeit einer verlängerten Verabreichung von PROTONIX. In Langzeitstudien an Nagetieren war Pantoprazol krebserregend und verursachte seltene Arten von Magen-Darm-Tumoren. Die Relevanz dieser Befunde für die Tumorentwicklung beim Menschen ist unbekannt [vgl Nichtklinische Toxikologie ].
Fundusdrüsenpolypen
Die Anwendung von PPI ist mit einem erhöhten Risiko für Fundusdrüsenpolypen verbunden, das bei Langzeitanwendung zunimmt, insbesondere über ein Jahr hinaus. Die meisten PPI-Anwender, die Fundusdrüsenpolypen entwickelten, waren asymptomatisch und Fundusdrüsenpolypen wurden zufällig bei der Endoskopie identifiziert. Verwenden Sie die kürzeste Dauer der PPI-Therapie, die für die zu behandelnde Erkrankung geeignet ist.
Beeinträchtigung von Untersuchungen auf neuroendokrine Tumore
Die Spiegel von Chromogranin A (CgA) im Serum steigen sekundär zu einer arzneimittelinduzierten Abnahme der Magensäure. Der erhöhte CgA-Spiegel kann bei diagnostischen Untersuchungen auf neuroendokrine Tumore zu falsch positiven Ergebnissen führen. Gesundheitsdienstleister sollten die Behandlung mit PROTONIX 20 mg mindestens 14 Tage vor der Bestimmung der CgA-Spiegel vorübergehend unterbrechen und eine Wiederholung des Tests in Betracht ziehen, wenn die anfänglichen CgA-Spiegel hoch sind. Wenn Reihentests durchgeführt werden (z. B. zur Überwachung), sollte dasselbe kommerzielle Labor für die Tests verwendet werden, da die Referenzbereiche zwischen den Tests variieren können [siehe KLINISCHE PHARMAKOLOGIE ].
Interferenz mit dem Urin-Screening für THC
Es gibt Berichte über falsch-positive Urin-Screening-Tests für Tetrahydrocannabinol (THC) bei Patienten, die PPIs, einschließlich PROTONIX, erhalten [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Gleichzeitige Anwendung von PROTONIX mit Methotrexat
Die Literatur legt nahe, dass die gleichzeitige Anwendung von PPI mit Methotrexat (hauptsächlich in hoher Dosis; siehe Verschreibungsinformationen zu Methotrexat) die Serumspiegel von Methotrexat und/oder seines Metaboliten erhöhen und verlängern kann, was möglicherweise zu Methotrexat-Toxizitäten führt. Bei hochdosierter Gabe von Methotrexat kann bei einigen Patienten ein vorübergehendes Absetzen des PPI in Betracht gezogen werden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Medikationsleitfaden und Gebrauchsanweisung ).
Malignität des Magens
Raten Sie den Patienten, sich an ihren Arzt zu wenden, wenn sie nicht optimal ansprechen oder einen frühen symptomatischen Rückfall haben [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Akute tubulointerstitielle Nephritis
Raten Sie den Patienten, sofort ihren Arzt anzurufen, wenn sie Anzeichen und/oder Symptome einer akuten tubulointerstitiellen Nephritis bemerken [siehe KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Clostridium difficile-assoziierter Durchfall
Raten Sie den Patienten, sofort ihren Arzt anzurufen, wenn sie Durchfall bekommen, der sich nicht bessert [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Knochenbruch
Raten Sie den Patienten, Frakturen, insbesondere der Hüfte, des Handgelenks oder der Wirbelsäule, ihrem medizinischen Betreuer zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Kutaner und systemischer Lupus erythematodes
Raten Sie den Patienten, bei neuen oder sich verschlechternden Symptomen im Zusammenhang mit kutanem oder systemischem Lupus erythematodes sofort ihren Arzt anzurufen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Cyanocobalamin (Vitamin B-12)-Mangel
Weisen Sie die Patienten darauf hin, alle klinischen Symptome, die mit einem Cyancobalamin-Mangel in Zusammenhang stehen könnten, ihrem medizinischen Betreuer zu melden, wenn sie PROTONIX 40 mg länger als 3 Jahre erhalten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hypomagnesiämie
Weisen Sie die Patienten darauf hin, alle klinischen Symptome, die möglicherweise mit einer Hypomagnesiämie in Zusammenhang stehen, ihrem medizinischen Betreuer zu melden, wenn sie PROTONIX 40 mg für mindestens 3 Monate erhalten haben [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Wechselwirkungen mit anderen Medikamenten
Weisen Sie die Patienten an, ihren Arzt über alle anderen Medikamente zu informieren, die sie derzeit einnehmen, einschließlich Rilpivirin-haltiger Produkte [siehe KONTRAINDIKATIONEN ] Digoxin [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ] und hochdosiertes Methotrexat [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schwangerschaft
Informieren Sie eine schwangere Frau über das potenzielle Risiko für einen Fötus. Weisen Sie gebärfähige Frauen an, ihren Arzt über eine bekannte oder vermutete Schwangerschaft zu informieren [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Verwaltung
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einer 24-monatigen Kanzerogenitätsstudie wurden Sprague-Dawley-Ratten oral mit Pantoprazol-Dosen von 0,5 bis 200 mg/kg/Tag behandelt, was etwa dem 0,1- bis 40-fachen der Exposition bezogen auf die Körperoberfläche einer 50 kg schweren Person mit 40 mg entspricht /Tag. Im Magenfundus führte die Behandlung mit 0,5 bis 200 mg/kg/Tag zu enterochromaffinen (ECL) Zellhyperplasie und dosisabhängig zu gut- und bösartigen neuroendokrinen Zelltumoren. Im Vormagen führte die Behandlung mit 50 und 200 mg/kg/Tag (etwa das 10- bis 40-fache der empfohlenen Humandosis bezogen auf die Körperoberfläche) zu gutartigen Plattenepithel-Papillomen und bösartigen Plattenepithel-Karzinomen. Seltene gastrointestinale Tumoren im Zusammenhang mit der Behandlung mit Pantoprazol umfassten ein Adenokarzinom des Zwölffingerdarms mit 50 mg/kg/Tag und gutartige Polypen und Adenokarzinome des Magenfundus mit 200 mg/kg/Tag. In der Leber führte die Behandlung mit 0,5 bis 200 mg/kg/Tag zu einem dosisabhängigen Anstieg der Inzidenz von hepatozellulären Adenomen und Karzinomen. In der Schilddrüse führte die Behandlung mit 200 mg/kg/Tag sowohl bei männlichen als auch bei weiblichen Ratten zu einer erhöhten Inzidenz von Follikelzelladenomen und -karzinomen.
In einer 24-monatigen Karzinogenitätsstudie wurden Fischer 344-Ratten oral mit Dosen von 5 bis 50 mg/kg/Tag Pantoprazol behandelt, was ungefähr dem 1- bis 10-Fachen der empfohlenen Dosis für Menschen, basierend auf der Körperoberfläche, entspricht. Im Magenfundus führte die Behandlung mit 5 bis 50 mg/kg/Tag zu einer enterochromaffinen (ECL) Zellhyperplasie und gutartigen und bösartigen neuroendokrinen Zelltumoren. Die Dosisauswahl für diese Studie war möglicherweise nicht angemessen, um das karzinogene Potenzial von Pantoprazol umfassend zu bewerten.
In einer 24-monatigen Karzinogenitätsstudie wurden B6C3F1-Mäuse oral mit Dosen von 5 bis 150 mg/kg/Tag Pantoprazol behandelt, was dem 0,5- bis 15-Fachen der empfohlenen Humandosis basierend auf der Körperoberfläche entspricht. In der Leber führte die Behandlung mit 150 mg/kg/Tag bei weiblichen Mäusen zu einer erhöhten Inzidenz von hepatozellulären Adenomen und Karzinomen. Die Behandlung mit 5 bis 150 mg/kg/Tag führte auch zu Magen-Fundus-ECL-Zellhyperplasie.
Eine 26-wöchige Kanzerogenitätsstudie mit p53 +/-transgenen Mäusen war nicht positiv.
Pantoprazol war in den In-vitro-Chromosomenaberrationsassays an humanen Lymphozyten, in einem von zwei Maus-Mikrokerntests auf klastogene Wirkungen und in dem In-vitro-Ovarialzellen/HGPRT-Vorwärtsmutationsassay des chinesischen Hamsters auf mutagene Wirkungen positiv. Zweideutige Ergebnisse wurden im kovalenten In-vivo-Rattenleber-DNA-Bindungsassay beobachtet. Pantoprazol war negativ im In-vitro-Ames-Mutationstest, im In-vitro-Unscheduled-DNA-Synthese(UDS)-Test mit Rattenhepatozyten, im In-vitro-AS52/GPT-Säugerzellen-Forward-Genmutationstest, im In-vitro-Thymidinkinase-Mutationstest mit Mauslymphom L5178Y Zellen und der In-vivo-Chromosomenaberrationsassay an Ratten-Knochenmarkszellen.
Es gab keine Auswirkungen auf die Fertilität oder Fortpflanzungsfähigkeit, wenn Pantoprazol in oralen Dosen von bis zu 500 mg/kg/Tag bei männlichen Ratten (98-fache der empfohlenen Dosis für den Menschen, basierend auf der Körperoberfläche) und 450 mg/kg/Tag bei weiblichen Ratten verabreicht wurde (88-fache der empfohlenen menschlichen Dosis basierend auf der Körperoberfläche).
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Verfügbare Daten aus veröffentlichten Beobachtungsstudien zeigten keinen Zusammenhang zwischen schweren Missbildungen oder anderen unerwünschten Schwangerschaftsausgängen mit Pantoprazol.
In Reproduktionsstudien an Tieren wurden mit Pantoprazol keine Hinweise auf Nebenwirkungen beobachtet. Reproduktionsstudien wurden an Ratten mit oralen Dosen von bis zu 450 mg/kg/Tag (etwa das 88-fache der empfohlenen Dosis beim Menschen) und an Kaninchen mit oralen Dosen bis zu 40 mg/kg/Tag (etwa dem 16-fachen der empfohlenen Dosis beim Menschen) durchgeführt Gabe von Pantoprazol während der Organogenese bei trächtigen Tieren und ergaben in dieser Studie keine Hinweise auf eine Schädigung des Fötus durch Pantoprazol (vgl Daten ).
Mit Pantoprazol-Natrium wurde eine prä- und postnatale Entwicklungstoxizitätsstudie an Ratten mit zusätzlichen Endpunkten zur Bewertung der Wirkung auf die Knochenentwicklung durchgeführt. Orale Pantoprazol-Dosen von 5, 15 und 30 mg/kg/Tag (etwa das 1-, 3- und 6-fache der Humandosis von 40 mg/Tag) wurden schwangeren Frauen vom 6. Gestationstag (GD) bis zum Laktationstag (LD) verabreicht ) 21. Veränderungen der Knochenmorphologie wurden bei Welpen beobachtet, die Pantoprazol in utero und über die Milch während der Laktation sowie nach oraler Gabe vom 4. postnatalen Tag (PND) bis zum 21. PND erhielten [siehe Verwendung in bestimmten Bevölkerungsgruppen ]. Bei mütterlichen Tieren gab es keine arzneimittelbedingten Befunde. Weisen Sie schwangere Frauen auf das potenzielle Risiko einer fetalen Schädigung hin.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere unerwünschte Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 bis 4 % bzw. 15 bis 20 %.
Daten
Menschliche Daten
Verfügbare Daten aus veröffentlichten Beobachtungsstudien konnten keinen Zusammenhang zwischen unerwünschten schwangerschaftsbedingten Folgen und der Anwendung von Pantoprazol nachweisen. Methodische Limitationen dieser Beobachtungsstudien können ein arzneimittelassoziiertes Risiko während der Schwangerschaft nicht definitiv feststellen oder ausschließen. In einer prospektiven Studie des European Network of Teratology Information Services wurden die Ergebnisse einer Gruppe von 53 schwangeren Frauen, denen eine mediane Tagesdosis von 40 mg Pantoprazol verabreicht wurde, mit einer Kontrollgruppe von 868 schwangeren Frauen verglichen, die keine Protonenpumpenhemmer (PPI) einnahmen. . Es gab keinen Unterschied in der Rate schwerer Fehlbildungen zwischen Frauen, die PPIs ausgesetzt waren, und der Kontrollgruppe, was einem relativen Risiko (RR) = 0,55 entspricht [95 % Konfidenzintervall (KI) 0,08–3,95]. In einer bevölkerungsbezogenen retrospektiven Kohortenstudie, die alle Lebendgeburten in Dänemark von 1996 bis 2008 umfasste, gab es bei der Analyse der Pantoprazol-Exposition im ersten Trimenon bei 549 Lebendgeburten keine signifikante Zunahme schwerer Geburtsfehler. Eine Metaanalyse, die 1.530 schwangere Frauen, die mindestens im ersten Trimenon PPI ausgesetzt waren, mit 133.410 nicht exponierten schwangeren Frauen verglich, zeigte keine signifikante Erhöhung des Risikos für angeborene Fehlbildungen oder spontane Abtreibungen bei Exposition gegenüber PPI (für schwere Fehlbildungen OR = 1,12 ([95 % KI 0,86-1,45] und für Spontanaborte OR=1,29 [95 % KI 0,84-1,97]).
Tierdaten
Reproduktionsstudien wurden an Ratten mit oralen Pantoprazol-Dosen von bis zu 450 mg/kg/Tag (etwa das 88-fache der empfohlenen Humandosis basierend auf der Körperoberfläche) und an Kaninchen mit oralen Dosen von bis zu 40 mg/kg/Tag (etwa 16 fache der empfohlenen Humandosis basierend auf der Körperoberfläche) bei Verabreichung von Pantoprazol-Natrium während der Organogenese bei trächtigen Tieren. Die Studien haben keine Hinweise auf eine Beeinträchtigung der Fruchtbarkeit oder eine Schädigung des Fötus durch Pantoprazol ergeben.
Mit Pantoprazol-Natrium wurde eine prä- und postnatale Entwicklungstoxizitätsstudie an Ratten mit zusätzlichen Endpunkten zur Bewertung der Wirkung auf die Knochenentwicklung durchgeführt. Orale Pantoprazol-Dosen von 5, 15 und 30 mg/kg/Tag (etwa das 1-, 3- und 6-fache der menschlichen Dosis von 40 mg/Tag auf Basis der Körperoberfläche) wurden schwangeren Frauen ab dem Tag der Trächtigkeit (GD) verabreicht. 6 bis Laktationstag (LD) 21. Am postnatalen Tag (PND 4) bis PND 21 wurden den Welpen orale Dosen von 5, 15 und 30 mg/kg/Tag verabreicht (etwa das 1-, 2,3- und 3,2-fache der Exposition ( AUC) beim Menschen in einer Dosis von 40 mg). Bei mütterlichen Tieren gab es keine arzneimittelbedingten Befunde. Während der Dosierungsphase vor dem Absetzen (PND 4 bis 21) der Jungtiere kam es bei 5 mg/kg/Tag (ungefähr gleicher Exposition (AUC)) bei Menschen, die 40 erhielten, zu erhöhter Sterblichkeit und/oder Moribundität sowie verringertem Körpergewicht und Körpergewichtszunahme mg-Dosis) und höheren Dosen. Am PND 21 wurden bei den Nachkommen bei 5 mg/kg/Tag (ungefähr gleiche Expositionen (AUC) beim Menschen bei der 40-mg-Dosis) und höheren Dosen eine verringerte mittlere Femurlänge und -gewicht sowie Veränderungen der Femurknochenmasse und -geometrie beobachtet. Die Femurbefunde umfassten die untere Gesamtfläche, Knochenmineralgehalt und -dichte, Periost- und Endostalumfang und Trägheitsmoment im Querschnitt. Es gab keine mikroskopischen Veränderungen im distalen Femur, der proximalen Tibia oder den Kniegelenken. Veränderungen der Knochenparameter waren nach einer Erholungsphase teilweise reversibel, wobei die Befunde zu PND 70 auf die kortikale/subkortikale Knochenmineraldichte der unteren Femurmetaphyse bei weiblichen Welpen bei 5 mg/kg/Tag (ungefähr gleiche Expositionen (AUC) beim Menschen bei 40) beschränkt waren mg-Dosis) und höheren Dosen.
Stillzeit
Zusammenfassung der Risiken
Pantoprazol wurde in der Muttermilch einer stillenden Mutter nach einer oralen Einzeldosis von 40 mg Pantoprazol nachgewiesen. Es gab keine Auswirkungen auf den gestillten Säugling (vgl Daten ). Es liegen keine Daten zu den Auswirkungen von Pantoprazol auf die Milchproduktion vor.

Die entwicklungsbezogenen und gesundheitlichen Vorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an PROTONIX 40 mg und möglichen Nebenwirkungen von Pantoprazol oder der zugrunde liegenden Erkrankung der Mutter auf das gestillte Kind berücksichtigt werden.
Daten
Die Muttermilch einer 42-jährigen Frau, die 10 Monate nach der Geburt 40 mg Pantoprazol zum Einnehmen erhielt, wurde 24 Stunden lang untersucht, um einen niedrigen Gehalt an Pantoprazol in der Muttermilch nachzuweisen. Pantoprazol war nur 2 und 4 Stunden nach der Einnahme in der Milch nachweisbar, wobei die Milchkonzentrationen etwa 36 µg/l bzw. 24 µg/l betrugen. 2 Stunden nach der Arzneimittelverabreichung wurde ein Milch-zu-Plasma-Verhältnis von 0,022 beobachtet. Pantoprazol war 6, 8 und 24 Stunden nach der Einnahme nicht in der Milch nachweisbar (
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von PROTONIX für die Kurzzeitbehandlung (bis zu acht Wochen) von EE im Zusammenhang mit GERD wurde bei pädiatrischen Patienten im Alter von 1 Jahr bis 16 Jahren nachgewiesen. Die Wirksamkeit bei EE wurde bei Patienten unter 1 Jahr nicht nachgewiesen. Darüber hinaus steht für Patienten unter 5 Jahren keine geeignete Dosisstärke in einer altersgerechten Formulierung zur Verfügung. Daher ist PROTONIX für die Kurzzeitbehandlung von EE im Zusammenhang mit GERD bei Patienten ab 5 Jahren indiziert. Die Sicherheit und Wirksamkeit von PROTONIX für andere pädiatrische Anwendungen als EE wurde nicht nachgewiesen.
1 Jahr bis 16 Jahre alt
Die Anwendung von PROTONIX bei pädiatrischen Patienten im Alter von 1 Jahr bis 16 Jahren zur Kurzzeitbehandlung (bis zu acht Wochen) von EE im Zusammenhang mit GERD wird gestützt durch: a) Extrapolation von Ergebnissen aus angemessenen und gut kontrollierten Studien, die die Zulassung von unterstützten PROTONIX zur Behandlung von EE im Zusammenhang mit GERD bei Erwachsenen und b) Sicherheits-, Wirksamkeits- und pharmakokinetische Studien, die bei pädiatrischen Patienten durchgeführt wurden [siehe Klinische Studien , KLINISCHE PHARMAKOLOGIE ].
Die Sicherheit von PROTONIX 40 mg bei der Behandlung von EE im Zusammenhang mit GERD bei pädiatrischen Patienten im Alter von 1 bis 16 Jahren wurde in drei multizentrischen, randomisierten, doppelblinden Parallelbehandlungsstudien mit 249 pädiatrischen Patienten, darunter 8 mit EE (4 Patienten Alter 1 Jahr bis 5 Jahre und 4 Patienten 5 Jahre bis 11 Jahre). Die Kinder im Alter von 1 bis 5 Jahren mit endoskopisch diagnostizierter EE (definiert als endoskopischer Hetzel-Dent-Score ≥ 2) wurden 8 Wochen lang einmal täglich mit einer von zwei Dosierungen von PROTONIX (ungefähr 0,6 mg/kg oder 1,2 mg/kg) behandelt ). Alle 4 dieser Patienten mit EE waren nach 8 Wochen geheilt (Hetzel-Dent-Score von 0 oder 1). Da EE in der pädiatrischen Population ungewöhnlich ist, wurden auch überwiegend pädiatrische Patienten mit endoskopisch nachgewiesener oder symptomatischer GERD in diese Studien eingeschlossen. Die Patienten wurden 8 Wochen lang mit einer Reihe von Dosierungen von PROTONIX 20 mg einmal täglich behandelt. Sicherheitsbefunde siehe NEBENWIRKUNGEN Da diese pädiatrischen Studien kein Placebo, aktives Vergleichspräparat oder Hinweise auf eine Dosiswirkung enthielten, waren die Studien hinsichtlich des klinischen Nutzens von PROTONIX 20 mg bei symptomatischer GERD in der pädiatrischen Population nicht schlüssig. Die Wirksamkeit von PROTONIX 40 mg zur Behandlung von symptomatischer GERD bei pädiatrischen Patienten wurde nicht nachgewiesen.
Obwohl die Daten aus den klinischen Studien die Anwendung von PROTONIX zur Kurzzeitbehandlung von EE im Zusammenhang mit GERD bei pädiatrischen Patienten im Alter von 1 bis 5 Jahren unterstützen, gibt es keine im Handel erhältliche Dosierungsformulierung, die für Patienten unter 5 Jahren geeignet ist [siehe DOSIERUNG UND ANWENDUNG ].
In einer populationspharmakokinetischen Analyse lagen die Clearance-Werte bei Kindern im Alter von 1 bis 5 Jahren mit endoskopisch nachgewiesener GERD im Median bei 2,4 l/h. Nach einer Äquivalentdosis von 1,2 mg/kg (15 mg für ≤ 12,5 kg und 20 mg für > 12,5 bis
Neugeborene bis zu einem Alter von weniger als einem Jahr
PROTONIX 20 mg erwies sich in einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Absetzstudie mit 129 pädiatrischen Patienten im Alter von 1 bis 11 Monaten als nicht wirksam. Patienten wurden aufgenommen, wenn sie basierend auf der Krankengeschichte symptomatische GERD hatten und zwei Wochen lang nicht auf nicht-pharmakologische Interventionen für GERD angesprochen hatten. Die Patienten erhielten PROTONIX täglich vier Wochen lang in einer offenen Phase, dann wurden die Patienten zu gleichen Teilen randomisiert, um in den folgenden vier Wochen doppelblind eine Behandlung mit PROTONIX 40 mg oder ein Placebo zu erhalten. Die Wirksamkeit wurde durch Beobachtung der Zeit von der Randomisierung bis zum Studienabbruch aufgrund einer Symptomverschlechterung während der vierwöchigen Behandlungsabbruchphase beurteilt. Es gab keinen statistisch signifikanten Unterschied zwischen PROTONIX 20 mg und Placebo in der Abbruchrate.
In dieser Studie waren die häufiger berichteten Nebenwirkungen (Unterschied von ≥ 4 %) in der behandelten Population im Vergleich zur Placebo-Population erhöhte CK, Mittelohrentzündung, Rhinitis und Laryngitis.
In einer populationspharmakokinetischen Analyse war die systemische Exposition bei Patienten unter 1 Jahr mit GERD höher als bei Erwachsenen, die eine Einzeldosis von 40 mg erhielten (der geometrische Mittelwert der AUC war bei Frühgeborenen und Neugeborenen, die eine Einzeldosis von 2,5 mg erhielten, um 103 % höher). von PROTONIX und um 23 % höher bei Säuglingen im Alter von 1 bis 11 Monaten, die eine Einzeldosis von etwa 1,2 mg/kg erhalten). Bei diesen Patienten nahm die scheinbare Clearance (CL/F) mit dem Alter zu (mediane Clearance: 0,6 l/h, Bereich: 0,03 bis 3,2 l/h).
Diese Dosen führten zu pharmakodynamischen Wirkungen auf den pH-Wert des Magens, aber nicht des Ösophagus. Nach einmal täglicher Gabe von 2,5 mg PROTONIX 20 mg bei Frühgeborenen und Neugeborenen kam es zu einem Anstieg des mittleren Magen-pH-Werts (von 4,3 zu Studienbeginn auf 5,2 im Steady-State) und in der mittleren prozentualen Zeit, in der der Magen-pH-Wert > 4 war ( von 60 % zu Studienbeginn auf 80 % im Steady-State). Nach einmal täglicher Gabe von etwa 1,2 mg/kg PROTONIX 20 mg bei Säuglingen im Alter von 1 bis 11 Monaten kam es zu einem Anstieg des mittleren Magen-pH-Werts (von 3,1 bei Baseline auf 4,2 im Steady-State) und in der mittleren prozentualen Zeit davon Der Magen-pH-Wert war > 4 (von 32 % zu Studienbeginn bis 60 % im Steady-State). Es wurden jedoch keine signifikanten Veränderungen des mittleren intraösophagealen pH-Werts oder der prozentualen Zeit, in der der ösophageale pH-Wert
Da sich PROTONIX 20 mg in der randomisierten, placebokontrollierten Studie in dieser Altersgruppe nicht als wirksam erwiesen hat, ist die Anwendung von PROTONIX zur Behandlung der symptomatischen GERD bei Säuglingen unter 1 Jahr nicht indiziert.
Tiertoxizitätsdaten
In einer prä- und postnatalen Entwicklungsstudie an Ratten erhielten die Welpen orale Pantoprazol-Dosen von 5, 15 und 30 mg/kg/Tag (etwa das 1-, 2,3- und 3,2-fache der Exposition (AUC) bei älteren Kindern). 6 bis 11 Jahre in einer Dosis von 40 mg) am postnatalen Tag (PND 4) bis PND 21, zusätzlich zur Laktationsexposition durch Milch. Am PND 21 wurden bei den Nachkommen unter 5 mg/kg/Tag (ungefähr gleiche Expositionen (AUC) bei Kindern im Alter von 6 bis 11 Jahren bei der 40-mg-Dosis) eine verringerte mittlere Femurlänge und -gewicht sowie Veränderungen der Femurknochenmasse und -geometrie beobachtet. und höhere Dosen. Veränderungen der Knochenparameter waren nach einer Erholungsphase teilweise reversibel.
Bei neugeborenen/juvenilen Tieren (Ratten und Hunden) waren die Toxizitäten ähnlich denen, die bei erwachsenen Tieren beobachtet wurden, einschließlich Magenveränderungen, Abnahme der Erythrozytenmasse, Erhöhung der Lipide, Enzyminduktion und hepatozelluläre Hypertrophie. In Studien mit wiederholter Gabe wurde in der Fundusschleimhaut des Magens eine erhöhte Inzidenz eosinophiler Hauptzellen bei erwachsenen und neugeborenen/juvenilen Ratten und eine Atrophie der Hauptzellen bei erwachsenen Ratten und bei neugeborenen/juvenilen Hunden beobachtet. Eine vollständige bis teilweise Erholung dieser Wirkungen wurde bei Tieren beider Altersgruppen nach einer Erholungsphase festgestellt.
Geriatrische Verwendung
In klinischen Kurzzeitstudien in den USA waren die EE-Heilungsraten bei den 107 älteren Patienten (≥ 65 Jahre alt), die mit PROTONIX behandelt wurden, ähnlich denen bei Patienten unter 65 Jahren. Die Häufigkeitsraten von Nebenwirkungen und Laboranomalien bei älteren Patienten 65 Jahre und älter waren ähnlich wie bei Patienten unter 65 Jahren.
ÜBERDOSIS
Die Erfahrung bei Patienten, die sehr hohe Dosen von PROTONIX (mehr als 240 mg) einnehmen, ist begrenzt. Spontane Post-Marketing-Berichte über eine Überdosierung liegen im Allgemeinen innerhalb des bekannten Sicherheitsprofils von PROTONIX.
Pantoprazol wird nicht durch Hämodialyse entfernt. Im Falle einer Überdosierung sollte die Behandlung symptomatisch und unterstützend erfolgen.
Orale Einzeldosen von Pantoprazol mit 709 mg/kg, 798 mg/kg und 887 mg/kg waren für Mäuse, Ratten bzw. Hunde tödlich. Die Symptome der akuten Toxizität waren Hypoaktivität, Ataxie, gebeugtes Sitzen, gespreizte Gliedmaßen, Seitenlage, Segregation, fehlender Ohrreflex und Tremor.
Wenn es zu einer Überexposition gegenüber PROTONIX 20 mg kommt, rufen Sie Ihre Giftinformationszentrale unter 1-800-222-1222 an, um aktuelle Informationen zum Umgang mit Vergiftungen oder Überdosierungen zu erhalten.
KONTRAINDIKATIONEN
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Pantoprazol ist ein PPI, das den letzten Schritt der Magensäureproduktion durch kovalente Bindung an das (H+, K+)-ATPase-Enzymsystem an der sekretorischen Oberfläche der Belegzellen des Magens unterdrückt. Dieser Effekt führt unabhängig vom Stimulus zu einer Hemmung sowohl der basalen als auch der stimulierten Magensäuresekretion. Die Bindung an die (H+, K+)-ATPase führt zu einer Dauer der antisekretorischen Wirkung, die für alle getesteten Dosen (20 mg bis 120 mg) länger als 24 Stunden anhält.
Pharmakodynamik
PROTONIX 20 mg zur oralen Suspension mit verzögerter Freisetzung, 40 mg hat sich bei der Unterdrückung von Pentagastrin-stimulierter MAO bei Patienten (n = 49) mit GERD und EE in der Anamnese als vergleichbar mit PROTONIX-Tabletten mit verzögerter Freisetzung erwiesen. In dieser multizentrischen, pharmakodynamischen Crossover-Studie wurde eine 40-mg-Dosis von PROTONIX zur oralen Suspension mit verzögerter Freisetzung, verabreicht in einem Teelöffel Apfelmus, mit einer oralen 40-mg-Dosis von PROTONIX-Tabletten mit verzögerter Freisetzung nach einmal täglicher Verabreichung jeder Formulierung für 7 Tage. Beide Medikamente wurden 30 Minuten vor dem Frühstück verabreicht. Pentagastrin-stimuliert (MAO) wurde von Stunde 23 bis 24 im Steady State beurteilt.
Antisekretorische Aktivität
Unter maximal säurestimulierenden Bedingungen mit Pentagastrin tritt bei gesunden Probanden eine dosisabhängige Abnahme der Magensäureproduktion nach einer oralen (20–80 mg) Einzeldosis oder einer intravenösen (20–120 mg) Einzeldosis Pantoprazol auf. Die einmal tägliche Gabe von Pantoprazol führt zu einer zunehmenden Hemmung der Magensäuresekretion. Nach der oralen Initialdosis von 40 mg Pantoprazol wurde nach 2,5 Stunden eine mittlere Hemmung von 51 % erreicht. Bei einmal täglicher Gabe über 7 Tage wurde die mittlere Hemmung auf 85 % erhöht. Pantoprazol unterdrückte bei der Hälfte der Probanden die Säuresekretion um mehr als 95 %. Die Säuresekretion hatte sich innerhalb einer Woche nach der letzten Pantoprazol-Dosis wieder normalisiert; es gab keinen Hinweis auf eine Rebound-Hypersekretion.
In einer Reihe von Dosis-Wirkungs-Studien verursachte Pantoprazol bei oralen Dosen im Bereich von 20 bis 120 mg dosisabhängige Erhöhungen des mittleren basalen Magen-pH-Werts und des Prozentsatzes der Zeit, in der der Magen-pH-Wert > 3 und > 4 war. Die Behandlung mit 40 mg Pantoprazol führte zu signifikant stärkeren Anstiegen des Magen-pH-Werts als die 20-mg-Dosis. Dosen über 40 mg (60, 80, 120 mg) führten nicht zu weiteren signifikanten Anstiegen des mittleren Magen-pH. Die Wirkungen von Pantoprazol auf den mittleren pH-Wert aus einer doppelblinden Crossover-Studie sind in Tabelle 5 dargestellt.
Serum-Gastrin-Effekte
Die Serum-Gastrinspiegel im Nüchternzustand wurden in zwei Doppelblindstudien zur akuten Heilung von EE bewertet, in denen 682 Patienten mit gastroösophagealer Refluxkrankheit (GERD) 10, 20 oder 40 mg PROTONIX 20 mg für bis zu 8 Wochen erhielten. Nach 4 Behandlungswochen gab es in den 10-, 20- bzw. 40-mg-Behandlungsgruppen einen Anstieg der mittleren Gastrinspiegel um 7 %, 35 % und 72 % gegenüber den Werten vor der Behandlung. Ein ähnlicher Anstieg der Gastrinspiegel im Serum wurde bei der 8-wöchigen Visite mit mittleren Anstiegen von 3 %, 26 % und 84 % für die drei Pantoprazol-Dosisgruppen festgestellt. Während der Erhaltungstherapie mit PROTONIX Retardtabletten blieben die mittleren Gastrinspiegel im Serum innerhalb der normalen Grenzen.
In internationalen Langzeitstudien mit über 800 Patienten wurde in den ersten Monaten der Behandlung mit Pantoprazol in Dosen von 40 mg pro Tag während GERD-Erhaltungsstudien und 40 ein 2- bis 3-facher mittlerer Anstieg des Gastrinspiegels im Nüchtern-Serum vor der Behandlung beobachtet mg oder höher pro Tag bei Patienten mit refraktärer GERD. Die Serum-Gastrinspiegel im Nüchternzustand blieben bei regelmäßiger Nachbeobachtung in klinischen Studien über einen Zeitraum von bis zu 4 Jahren im Allgemeinen beim etwa 2- bis 3-fachen Ausgangswert.
Nach einer Kurzzeitbehandlung mit PROTONIX 20 mg normalisieren sich erhöhte Gastrinspiegel nach mindestens 3 Monaten wieder.
Enterochromaffin-ähnliche (ECL) Zelleffekte
Bei 39 Patienten, die mit oralem Pantoprazol 40 mg bis 240 mg täglich (die Mehrheit erhielt 40 mg bis 80 mg) über einen Zeitraum von bis zu 5 Jahren behandelt wurden, kam es, beginnend nach dem ersten Jahr der Anwendung, zu einem moderaten Anstieg der ECL-Zelldichte, was anscheinend der Fall war Plateau nach 4 Jahren.
In einer nichtklinischen Studie an Sprague-Dawley-Ratten führte eine lebenslange Exposition (24 Monate) gegenüber Pantoprazol in Dosen von 0,5 bis 200 mg/kg/Tag zu einer dosisabhängigen Zunahme der ECL-Zellproliferation im Magen und zu neuroendokrinen (NE)-Zelltumoren im Magen . Magen-NE-Zell-Tumoren bei Ratten können aus einer chronischen Erhöhung der Gastrinkonzentrationen im Serum resultieren. Die hohe Dichte von ECL-Zellen im Rattenmagen macht diese Spezies sehr anfällig für die proliferativen Wirkungen erhöhter Gastrinkonzentrationen, die von PPIs produziert werden. Es wurden jedoch keine Erhöhungen des Gastrins im Serum nach der Verabreichung von Pantoprazol in einer Dosis von 0,5 mg/kg/Tag beobachtet. In einer separaten Studie wurde bei 1 weiblichen Ratte nach 12-monatiger Gabe von 5 mg/kg/Tag Pantoprazol und einer 9-monatigen Erholung nach der Einnahme ein Magen-NE-Zell-Tumor ohne gleichzeitige proliferative Veränderungen der ECL-Zellen beobachtet [siehe Nichtklinische Toxikologie ].
Endokrine Wirkungen
In einer klinisch-pharmakologischen Studie hatte PROTONIX 40 mg einmal täglich über 2 Wochen keine Wirkung auf die Spiegel der folgenden Hormone: Cortisol, Testosteron, Triiodthyronin (T3), Thyroxin (T4), Schilddrüsen-stimulierendes Hormon (TSH), Thyronin- Bindungsprotein, Parathormon, Insulin, Glukagon, Renin, Aldosteron, follikelstimulierendes Hormon, luteinisierendes Hormon, Prolaktin und Wachstumshormon.
In einer 1-jährigen Studie mit GERD-Patienten, die mit PROTONIX 40 mg oder 20 mg behandelt wurden, gab es keine Veränderungen der Gesamtwerte von T3, T4 und TSH gegenüber dem Ausgangswert.
Pharmakokinetik
PROTONIX 40 mg Retardtabletten werden als magensaftresistente Tabletten zubereitet, sodass die Resorption von Pantoprazol erst beginnt, nachdem die Tablette den Magen verlassen hat. Die maximale Serumkonzentration (Cmax) und die Fläche unter der Serumkonzentrations-Zeit-Kurve (AUC) steigen proportional zu den oralen und intravenösen Dosen von 10 mg bis 80 mg an. Pantoprazol akkumuliert nicht, und seine Pharmakokinetik bleibt bei mehrfacher täglicher Gabe unverändert. Nach oraler oder intravenöser Verabreichung nimmt die Serumkonzentration von Pantoprazol biexponentiell ab, mit einer terminalen Eliminationshalbwertszeit von etwa einer Stunde.
Bei schnellen Metabolisierern mit normaler Leberfunktion, die eine orale Dosis der magensaftresistenten 40-mg-Pantoprazol-Tablette erhalten, beträgt die Spitzenkonzentration (Cmax) 2,5 μg/ml; die Zeit bis zum Erreichen der Spitzenkonzentration (tmax) beträgt 2,5 h, und die mittlere Gesamtfläche unter der Plasmakonzentrations-Zeit-Kurve (AUC) beträgt 4,8 μg·h/ml (Bereich 1,4 bis 13,3 μg·h/ml). Nach intravenöser Verabreichung von Pantoprazol an schnelle Metabolisierer beträgt seine Gesamtclearance 7,6 – 14,0 l/h und sein scheinbares Verteilungsvolumen 11,0 – 23,6 l.
Eine orale Einzeldosis von PROTONIX zur oralen Suspension mit verzögerter Freisetzung, 40 mg, erwies sich als bioäquivalent, wenn es gesunden Probanden (N = 22) als Granulat, das über einen Teelöffel Apfelmus gestreut, als Granulat mit Apfelsaft gemischt oder damit verabreicht wurde, verabreicht wurde Apfelsaft, gefolgt von der Verabreichung über eine Magensonde. Die Plasma-Pharmakokinetik-Parameter aus einer Crossover-Studie bei gesunden Probanden sind in Tabelle 6 zusammengefasst.
Absorption
Nach Verabreichung einer einzelnen oder mehrerer oraler 40-mg-Dosen von PROTONIX 20 mg Retardtabletten wurde die maximale Plasmakonzentration von Pantoprazol nach etwa 2,5 Stunden erreicht und Cmax betrug 2,5 μg/ml. Pantoprazol unterliegt einem geringen First-Pass-Metabolismus, was zu einer absoluten Bioverfügbarkeit von etwa 77 % führt. Die Resorption von Pantoprazol wird durch die gleichzeitige Verabreichung von Antazida nicht beeinflusst.
Die Einnahme von PROTONIX Retardtabletten mit Nahrung kann die Resorption um bis zu 2 Stunden oder länger verzögern; Cmax und das Ausmaß der Pantoprazol-Resorption (AUC) werden jedoch nicht verändert. Daher können PROTONIX 40 mg Retardtabletten unabhängig vom Zeitpunkt der Mahlzeiten eingenommen werden.
Die Einnahme von Pantoprazol-Granulat, 40 mg, mit einer fettreichen Mahlzeit verzögerte die mediane Zeit bis zum Erreichen der maximalen Plasmakonzentration um 2 Stunden. Bei gleichzeitiger fettreicher Mahlzeit verringerten sich Cmax und AUC von Pantoprazol-Granulat, 40 mg, auf Apfelmus gestreut, um 51 % bzw. 29 %. Daher sollte PROTONIX 20 mg als Suspension zum Einnehmen mit verzögerter Freisetzung etwa 30 Minuten vor einer Mahlzeit eingenommen werden.
Verteilung
Das scheinbare Verteilungsvolumen von Pantoprazol beträgt etwa 11 bis 23,6 l und verteilt sich hauptsächlich in der extrazellulären Flüssigkeit. Die Serumproteinbindung von Pantoprazol beträgt etwa 98 %, hauptsächlich an Albumin.
Beseitigung
Stoffwechsel
Pantoprazol wird weitgehend in der Leber durch das Cytochrom P450 (CYP)-System metabolisiert. Der Metabolismus von Pantoprazol ist unabhängig vom Verabreichungsweg (intravenös oder oral). Der Hauptstoffwechselweg ist die Demethylierung durch CYP2C19 mit anschließender Sulfatierung; Andere Stoffwechselwege umfassen die Oxidation durch CYP3A4. Es gibt keine Hinweise darauf, dass einer der Metaboliten von Pantoprazol eine signifikante pharmakologische Aktivität aufweist.
Ausscheidung
Nach einer oralen oder intravenösen Einzeldosis von 14C-markiertem Pantoprazol an gesunde, normal metabolisierende Probanden wurden etwa 71 % der Dosis mit dem Urin und 18 % über die Galle mit den Fäzes ausgeschieden. Es gab keine renale Ausscheidung von unverändertem Pantoprazol.
Spezifische Populationen
Geriatrische Patienten
Bei älteren Probanden (im Alter von 64 bis 76 Jahren) wurden im Vergleich zu jüngeren Probanden nach wiederholter oraler Verabreichung nur leichte bis mäßige Anstiege der AUC (43 %) und Cmax (26 %) von Pantoprazol festgestellt [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Pädiatrische Patienten
Die Pharmakokinetik von Pantoprazol wurde bei Kindern unter 16 Jahren in vier randomisierten, offenen klinischen Studien an pädiatrischen Patienten mit vermuteter/bewiesener GERD untersucht. Eine pädiatrische Granulatformulierung wurde bei Kindern bis zum Alter von 5 Jahren untersucht, und PROTONIX 40 mg Tabletten mit verzögerter Freisetzung wurden bei Kindern über 5 Jahren untersucht.
In einer populationspharmakokinetischen Analyse nahm die Gesamtclearance mit zunehmendem Körpergewicht in nichtlinearer Weise zu. Auch die Gesamtclearance nahm mit zunehmendem Alter nur bei Kindern unter 3 Jahren zu.
Neugeborene bis zum Alter von 5 Jahren
[sehen Verwendung in bestimmten Bevölkerungsgruppen ]
Kinder und Jugendliche im Alter von 6 bis 16 Jahren
Die Pharmakokinetik von PROTONIX Retardtabletten wurde bei Kindern im Alter von 6 bis 16 Jahren mit der klinischen Diagnose GERD untersucht. Die PK-Parameter nach einer oralen Einzeldosis von 20 mg oder 40 mg PROTONIX 40 mg Tabletten bei Kindern im Alter von 6 bis 16 Jahren waren sehr unterschiedlich (%CV reicht von 40 bis 80 %). Der aus einer populationspharmakokinetischen Analyse geschätzte geometrische Mittelwert der AUC nach einer 40-mg-Tablette PROTONIX 40 mg bei pädiatrischen Patienten war bei 6- bis 11- und 12- bis 16-jährigen Kindern um etwa 39 % bzw. 10 % höher als bei Erwachsenen (Tabelle 7). .
Männliche und weibliche Patienten
Es gibt einen leichten Anstieg der AUC und Cmax von Pantoprazol bei Frauen im Vergleich zu Männern. Allerdings sind die gewichtsnormalisierten Clearance-Werte bei Frauen und Männern ähnlich.
Bei pädiatrischen Patienten im Alter von 1 bis 16 Jahren gab es keine klinisch relevanten Auswirkungen des Geschlechts auf die Clearance von Pantoprazol, wie eine populationspharmakokinetische Analyse gezeigt hat.
Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit schwerer Nierenfunktionsstörung waren die pharmakokinetischen Parameter von Pantoprazol denen gesunder Probanden ähnlich.
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit leichter bis schwerer Leberfunktionsstörung (Child-Pugh A- bis C-Zirrhose) stiegen die maximalen Pantoprazol-Konzentrationen im Vergleich zu gesunden Probanden nur leicht (1,5-fach) an. Obwohl die Serumhalbwertszeit bei Patienten mit eingeschränkter Leberfunktion auf 7-9 Stunden und die AUC-Werte um das 5- bis 7-Fache anstiegen, waren diese Anstiege nicht größer als die bei langsamen CYP2C19-Metabolisierern beobachteten, bei denen keine Dosisanpassung erforderlich ist. Diese pharmakokinetischen Veränderungen bei Patienten mit eingeschränkter Leberfunktion führen zu einer minimalen Arzneimittelakkumulation nach einmal täglicher Mehrfachgabe. Dosen über 40 mg/Tag wurden bei Patienten mit eingeschränkter Leberfunktion nicht untersucht.
Arzneimittelwechselwirkungsstudien
Wirkung anderer Medikamente auf Pantoprazol
Pantoprazol wird hauptsächlich durch CYP2C19 und in geringem Umfang durch die CYPs 3A4, 2D6 und 2C9 metabolisiert. In-vivo-Arzneimittelwechselwirkungsstudien mit CYP2C19-Substraten (Diazepam [ebenfalls ein CYP3A4-Substrat] und Phenytoin [ebenfalls ein CYP3A4-Induktor] und Clopidogrel), Nifedipin, Midazolam und Clarithromycin (CYP3A4-Substrate), Metoprolol (ein CYP2D6-Substrat), Diclofenac , Naproxen und Piroxicam (CYP2C9-Substrate) und Theophyllin (ein CYP1A2-Substrat) bei gesunden Probanden war die Pharmakokinetik von Pantoprazol nicht signifikant verändert.
Wirkung von Pantoprazol auf andere Medikamente
Clopidogrel
Clopidogrel wird teilweise durch CYP2C19 zu seinem aktiven Metaboliten metabolisiert. In einer klinischen Crossover-Studie wurde 66 gesunden Probanden 5 Tage lang Clopidogrel (300 mg Aufsättigungsdosis, gefolgt von 75 mg pro Tag) allein und mit Pantoprazol (80 mg gleichzeitig mit Clopidogrel) verabreicht. An Tag 5 war die mittlere AUC des aktiven Metaboliten von Clopidogrel bei gleichzeitiger Gabe von Pantoprazol und Clopidogrel im Vergleich zur alleinigen Gabe von Clopidogrel um etwa 14 % verringert (Verhältnis im geometrischen Mittelwert betrug 86 %, mit einem 90 %-KI von 79 bis 93 %). Pharmakodynamische Parameter wurden ebenfalls gemessen und zeigten, dass die Veränderung der Hemmung der Thrombozytenaggregation (induziert durch 5 μM ADP) mit der Veränderung der Exposition gegenüber dem aktiven Metaboliten von Clopidogrel korrelierte. Die klinische Bedeutung dieses Befundes ist nicht klar.
Mycophenolatmofetil (MMF)
Die Verabreichung von 40 mg Pantoprazol zweimal täglich über 4 Tage und einer Einzeldosis von 1000 mg MMF etwa eine Stunde nach der letzten Pantoprazol-Dosis an 12 gesunde Probanden in einer Cross-Over-Studie führte zu einer 57 %igen Verringerung der Cmax und einer 27 %igen Verringerung in der AUC von MPA. Transplantationspatienten, die ungefähr 2000 mg MMF pro Tag erhielten (n = 12), wurden mit Transplantationspatienten verglichen, die ungefähr die gleiche Dosis von MMF und 40 mg Pantoprazol pro Tag erhielten (n = 21). Bei Patienten, die sowohl Pantoprazol als auch MMF erhielten, kam es zu einer 78 %igen Verringerung der Cmax und einer 45 %igen Verringerung der AUC von MPA [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Andere Drogen
In-vivo-Studien deuten auch darauf hin, dass Pantoprazol die Kinetik der folgenden Arzneimittel nicht signifikant beeinflusst (Cisaprid, Theophyllin, Diazepam [und sein aktiver Metabolit, Desmethyldiazepam], Phenytoin, Metoprolol, Nifedipin, Carbamazepin, Midazolam, Clarithromycin, Diclofenac, Naproxen, Piroxicam, und orale Kontrazeptiva [Levonorgestrel/Ethinylestradiol]). In anderen In-vivo-Studien zeigten Digoxin, Ethanol, Glyburid, Antipyrin, Koffein, Metronidazol und Amoxicillin keine klinisch relevanten Wechselwirkungen mit Pantoprazol.
Obwohl in klinischen Studien keine signifikanten Arzneimittelwechselwirkungen beobachtet wurden, wurde das Potenzial für signifikante Arzneimittelwechselwirkungen bei mehr als einmal täglicher Gabe hoher Pantoprazol-Dosen bei langsamen Metabolisierern oder Personen mit eingeschränkter Leberfunktion nicht untersucht.
Antazida
Es gab auch keine Wechselwirkung mit gleichzeitig verabreichten Antazida.
Pharmakogenomik
CYP2C19 zeigt einen bekannten genetischen Polymorphismus aufgrund seines Mangels in einigen Subpopulationen (z. B. etwa 3 % der Kaukasier und Afroamerikaner und 17 % bis 23 % der Asiaten sind schlechte Metabolisierer). Obwohl diese Subpopulationen von langsamen Metabolisierern von Pantoprazol Eliminationshalbwertszeiten von 3,5 bis 10 Stunden bei Erwachsenen aufweisen, kommt es bei einmal täglicher Gabe immer noch zu einer minimalen Akkumulation (23 % oder weniger). Bei erwachsenen Patienten, die langsame CYP2C19-Metabolisierer sind, ist keine Dosisanpassung erforderlich.
Ähnlich wie bei Erwachsenen zeigten pädiatrische Patienten mit dem Genotyp „poor metabolizer“ von CYP2C19 (CYP2C19 *2/*2) einen mehr als 6-fachen Anstieg der AUC im Vergleich zu pädiatrischen Patienten mit extensiver (CYP2C19 *1/*1) und intermediärer Behandlung (CYP2C19 *1). /*x) Metabolisierer. Langsame Metabolisierer zeigten im Vergleich zu schnellen Metabolisierern eine ungefähr 10-fach niedrigere scheinbare orale Clearance.
Bei bekannten pädiatrischen langsamen Metabolisierern sollte eine Dosisreduktion in Betracht gezogen werden.
Klinische Studien
PROTONIX 20 mg Tabletten mit verzögerter Freisetzung wurden in den folgenden klinischen Studien verwendet.
Erosive Ösophagitis (EE) im Zusammenhang mit gastroösophagealer Refluxkrankheit (GERD)
Erwachsene Patienten
Eine multizentrische, doppelblinde, placebokontrollierte US-Studie mit PROTONIX 10 mg, 20 mg oder 40 mg einmal täglich wurde an 603 Patienten mit Refluxsymptomen und endoskopisch diagnostizierter EE von Grad 2 oder höher (Hetzel-Dent-Skala) durchgeführt. In diese Studie hatten ungefähr 25 % der eingeschlossenen Patienten eine schwere EE Grad 3 und 10 % hatten Grad 4. Die Prozentsätze der geheilten Patienten (gemäß Protokoll, n = 541) in dieser Studie sind in Tabelle 8 dargestellt.
In dieser Studie hatten alle PROTONIX-Behandlungsgruppen signifikant höhere Heilungsraten als die Placebo-Gruppe. Dies galt unabhängig vom H. pylori-Status für die Behandlungsgruppen mit 40 mg und 20 mg PROTONIX 40 mg. Die 40-mg-Dosis von PROTONIX 20 mg führte zu deutlich höheren Heilungsraten als die, die entweder mit der 20-mg- oder der 10-mg-Dosis gefunden wurden.
Ein signifikant größerer Anteil der Patienten, die PROTONIX 40 mg einnahmen, erlebte im Vergleich zu Placebo ab dem ersten Behandlungstag eine vollständige Linderung des Sodbrennens am Tag und in der Nacht und das Ausbleiben von Regurgitation. Patienten, die PROTONIX einnahmen, nahmen deutlich weniger Antazida-Tabletten pro Tag ein als diejenigen, die Placebo einnahmen.
PROTONIX 40 mg und 20 mg einmal täglich wurden auch mit Nizatidin 150 mg zweimal täglich in einer US-amerikanischen multizentrischen, doppelblinden Studie mit 243 Patienten mit Refluxsymptomen und endoskopisch diagnostizierter EE von Grad 2 oder höher verglichen. Die Prozentsätze der geheilten Patienten (pro Protokoll, n = 212) sind in Tabelle 9 dargestellt.
Die einmal tägliche Behandlung mit PROTONIX 40 mg oder 20 mg führte zu signifikant besseren Heilungsraten sowohl nach 4 als auch nach 8 Wochen im Vergleich zur zweimal täglichen Behandlung mit 150 mg Nizatidin. Bei der 40-mg-Behandlungsgruppe wurden unabhängig vom H.-pylori-Status signifikant höhere Heilungsraten im Vergleich zu Nizatidin erreicht.
Ein signifikant größerer Anteil der Patienten in den PROTONIX-Behandlungsgruppen erlebte eine vollständige Linderung von nächtlichem Sodbrennen und Aufstoßen, beginnend am ersten Tag und von tagsüber auftretendem Sodbrennen am zweiten Tag, verglichen mit denen, die zweimal täglich 150 mg Nizatidin einnahmen. Patienten, die PROTONIX einnahmen, nahmen signifikant weniger Antazida-Tabletten pro Tag ein als Patienten, die Nizatidin einnahmen.
Pädiatrische Patienten im Alter von 5 bis 16 Jahren
Die Wirksamkeit von PROTONIX bei der Behandlung von EE im Zusammenhang mit GERD bei pädiatrischen Patienten im Alter von 5 bis 16 Jahren wurde aus angemessenen und gut durchgeführten Studien bei Erwachsenen extrapoliert, da angenommen wird, dass die Pathophysiologie dieselbe ist. Vier pädiatrische Patienten mit endoskopisch diagnostiziertem EE wurden in multizentrischen, randomisierten, doppelblinden Parallelbehandlungsstudien untersucht. Kinder mit endoskopisch diagnostizierter EE (definiert als endoskopischer Hetzel-Dent-Score ≥2) wurden 8 Wochen lang einmal täglich mit einer von zwei Dosierungsstufen von PROTONIX (20 mg oder 40 mg) behandelt. Alle 4 Patienten mit EE waren nach 8 Wochen geheilt (Hetzel-Dent-Score von 0 oder 1).
Langfristige Aufrechterhaltung der Heilung der erosiven Ösophagitis
Zwei unabhängige, multizentrische, randomisierte, doppelblinde, komparatorkontrollierte Studien mit identischem Design wurden bei erwachsenen GERD-Patienten mit endoskopisch bestätigter geheilter EE durchgeführt, um die Wirksamkeit von PROTONIX bei der langfristigen Aufrechterhaltung der Heilung nachzuweisen. In die beiden US-Studien wurden 386 bzw. 404 Patienten aufgenommen, die entweder 10 mg, 20 mg oder 40 mg PROTONIX 40 mg Retardtabletten einmal täglich oder 150 mg Ranitidin zweimal täglich erhielten. Wie in Tabelle 10 gezeigt, waren PROTONIX 40 mg und 20 mg Ranitidin zu jedem Zeitpunkt in Bezug auf die Aufrechterhaltung der Heilung signifikant überlegen. Darüber hinaus war PROTONIX 40 mg allen anderen untersuchten Behandlungen überlegen.
PROTONIX 40 mg war Ranitidin bei der Verringerung der Anzahl der Sodbrennen-Episoden am Tag und in der Nacht vom ersten bis zum zwölften Behandlungsmonat überlegen. PROTONIX 20 mg, einmal täglich verabreicht, war in einer Studie auch wirksam bei der Verringerung von Sodbrennen am Tag und in der Nacht, wie in Tabelle 11 dargestellt.
Pathologische hypersekretorische Zustände einschließlich Zollinger-Ellison-Syndrom
In einer multizentrischen Open-Label-Studie mit 35 Patienten mit pathologischen hypersekretorischen Zuständen wie dem Zollinger-Ellison-Syndrom mit oder ohne multiple endokrine Neoplasie Typ I kontrollierte PROTONIX erfolgreich die Magensäuresekretion. Dosen im Bereich von 80 mg täglich bis 240 mg täglich hielten die Magensäureproduktion unter 10 mEq/h bei Patienten ohne vorherige säurereduzierende Operation und unter 5 mEq/h bei Patienten mit vorheriger säurereduzierender Operation.
Die Dosen wurden anfänglich auf die individuellen Bedürfnisse des Patienten titriert und bei einigen Patienten basierend auf dem klinischen Ansprechen im Laufe der Zeit angepasst [siehe DOSIERUNG UND ANWENDUNG ]. PROTONIX 40 mg wurde bei diesen Dosierungen über einen längeren Zeitraum (mehr als 2 Jahre bei einigen Patienten) gut vertragen.
INFORMATIONEN ZUM PATIENTEN
PROTONIX (pro-TAH-nix) (Pantoprazol-Natrium) Tabletten mit verzögerter Freisetzung und PROTONIX (pro-TAH-nix) (Pantoprazol-Natrium) zur Herstellung einer Suspension zum Einnehmen mit verzögerter Freisetzung
Was sind die wichtigsten Informationen, die ich über PROTONIX wissen sollte?
Sie sollten PROTONIX 20 mg genau wie verschrieben einnehmen, in der geringstmöglichen Dosis und für die kürzest benötigte Zeit.
PROTONIX kann bei Ihren säurebedingten Symptomen helfen, aber Sie könnten trotzdem ernsthafte Magenprobleme haben. Sprechen Sie mit Ihrem Arzt.
PROTONIX kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Sprechen Sie mit Ihrem Arzt über Ihr Risiko für diese schwerwiegenden Nebenwirkungen.
PROTONIX kann andere schwerwiegende Nebenwirkungen haben. Sehen „Was sind die möglichen Nebenwirkungen von PROTONIX?“
Was ist PROTONIX 20 mg?
Ein verschreibungspflichtiges Medikament namens Protonenpumpenhemmer (PPI), das verwendet wird, um die Menge an Säure in Ihrem Magen zu reduzieren.
Bei Erwachsenen PROTONIX wird verwendet für:
Bei Kindern ab 5 Jahren, PROTONIX wird verwendet für:
PROTONIX 20 mg ist nicht zur Anwendung bei Kindern unter 5 Jahren bestimmt. Es ist nicht bekannt, ob PROTONIX 40 mg bei Kindern für andere Behandlungen als EE sicher und wirksam ist.
Nehmen Sie PROTONIX 20 mg nicht ein, wenn Sie:
Informieren Sie Ihren Arzt vor der Einnahme von PROTONIX über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen. Informieren Sie Ihren Arzt insbesondere, wenn Sie es einnehmen Methotrexat (Otrexup, Rasuvo, Trexall, XATMEP), Digoxin (LANOXIN) oder eine Wasserpille (Diuretikum).
Wie sollte ich PROTONIX 20 mg einnehmen?
PROTONIX Tabletten mit verzögerter Freisetzung (PROTONIX 20 mg Tabletten):
PROTONIX 40 mg zur Herstellung einer Suspension zum Einnehmen mit verzögerter Freisetzung (PROTONIX zur Herstellung einer Suspension zum Einnehmen):
Was sind die möglichen Nebenwirkungen von PROTONIX 40mg?
PROTONIX 20 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Zu den häufigsten Nebenwirkungen von PROTONIX 40 mg bei Erwachsenen gehören: Kopfschmerzen, Durchfall, Übelkeit, Bauchschmerzen, Erbrechen, Blähungen, Schwindel und Gelenkschmerzen.
Zu den häufigsten Nebenwirkungen von PROTONIX 40 mg bei Kindern gehören: Infektion der oberen Atemwege, Kopfschmerzen, Fieber, Durchfall, Erbrechen, Hautausschlag und Bauchschmerzen. Dies sind nicht alle möglichen Nebenwirkungen von PROTONIX. Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie sollte ich PROTONIX 40 mg aufbewahren?
Lagern Sie PROTONIX 20 mg bei Raumtemperatur zwischen 20 °C und 25 °C (68 °F bis 77 °F).
Bewahren Sie PROTONIX und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von PROTONIX.
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie PROTONIX nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie PROTONIX 20 mg nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden. Sie können Ihren Arzt oder Apotheker um Informationen zu PROTONIX 20 mg bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Welche Inhaltsstoffe enthält PROTONIX?
Wirkstoff: Pantoprazol-Natrium-Sesquihydrat
Inaktive Inhaltsstoffe in PROTONIX-Tabletten mit verzögerter Freisetzung: Calciumstearat, Crospovidon, Hypromellose, Eisenoxid, Mannit, Methacrylsäure-Copolymer, Polysorbat 80, Povidon, Propylenglycol, Natriumcarbonat, Natriumlaurylsulfat, Titandioxid und Triethylcitrat.
Inaktive Bestandteile in PROTONIX 40 mg zur Herstellung einer Suspension zum Einnehmen mit verzögerter Freisetzung: Crospovidon, Hypromellose, Methacrylsäure-Copolymer, mikrokristalline Cellulose, Polysorbat 80, Povidon, Natriumcarbonat, Natriumlaurylsulfat, Talk, Titandioxid, Triethylcitrat und gelbes Eisenoxid.
Gebrauchsanweisung
PROTONIX (pro-TAH-nix) (Pantoprazol-Natrium) zur Herstellung einer Suspension zum Einnehmen mit verzögerter Freisetzung
PROTONIX 40 mg zur verzögerten Freisetzung Suspension zum Einnehmen (PROTONIX 40 mg zur Herstellung einer Suspension zum Einnehmen):
Wichtige Informationen:
Einnahme von PROTONIX 20 mg zur Herstellung einer Suspension zum Einnehmen mit Apfelmus:
Einnahme von PROTONIX 40 mg zur oralen Suspension mit Apfelsaft:
Gabe von PROTONIX 40 mg zur Herstellung einer Suspension zum Einnehmen über eine Magensonde (NG) oder eine Gastrostomiesonde:
Wie ist PROTONIX 20 mg aufzubewahren?
Lagern Sie PROTONIX 20 mg bei Raumtemperatur zwischen 20 °C und 25 °C (68 °F bis 77 °F).
Bewahren Sie PROTONIX 40 mg und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Dieser Medikationsleitfaden und die Gebrauchsanweisung wurden von der US Food and Drug Administration genehmigt.