Anafranil 10mg, 25mg, 50mg Clomipramine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Anafranil 10 mg und wie wird es angewendet?
Anafranil 50 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Zwangsstörungen. Anafranil 50 mg kann allein oder mit anderen Medikamenten verwendet werden.
Anafranil gehört zu einer Klasse von Medikamenten namens Antidepressiva, TCAs.
Es ist nicht bekannt, ob Anafranil 50 mg bei Kindern unter 10 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Anafranil 25 mg haben?
Anafranil 50 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Anafranil gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Anafranil. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
Suizidalität und Antidepressiva
Antidepressiva erhöhten im Vergleich zu Placebo das Risiko für suizidales Denken und Verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen in Kurzzeitstudien zu Major Depression (MDD) und anderen psychiatrischen Erkrankungen. Jeder, der die Anwendung von Clomipraminhydrochlorid oder anderen Antidepressiva bei einem Kind, Jugendlichen oder jungen Erwachsenen in Betracht zieht, muss dieses Risiko mit der klinischen Notwendigkeit abwägen. Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; Bei Erwachsenen ab 65 Jahren war das Risiko unter Antidepressiva im Vergleich zu Placebo geringer. Depressionen und bestimmte andere psychiatrische Störungen sind selbst mit einem erhöhten Suizidrisiko verbunden. Patienten jeden Alters, die mit einer antidepressiven Therapie begonnen werden, sollten angemessen überwacht und engmaschig auf klinische Verschlechterung, Suizidalität oder ungewöhnliche Verhaltensänderungen beobachtet werden. Familien und Betreuer sollten auf die Notwendigkeit einer genauen Beobachtung und Kommunikation mit dem verschreibenden Arzt hingewiesen werden. Clomipraminhydrochlorid ist nicht für die Anwendung bei pädiatrischen Patienten zugelassen, mit Ausnahme von Patienten mit Zwangsstörungen (OCD) (siehe WARNUNGEN , Klinische Verschlechterung und Suizidrisiko ; INFORMATIONEN ZUM PATIENTEN ; und VORSICHTSMASSNAHMEN , Pädiatrische Verwendung ).
BEZEICHNUNG
Anafranil™ (Clomipraminhydrochlorid) Kapseln USP ist ein Medikament gegen Zwangsstörungen, das zur Klasse (Dibenzazepin) von pharmakologischen Wirkstoffen gehört, die als trizyklische Antidepressiva bekannt sind. Anafranil ist als Kapseln mit 25, 50 und 75 mg zur oralen Verabreichung erhältlich.
Clomipraminhydrochlorid USP ist 3-Chlor-5-[3-(dimethylamino)propyl]-10,11-dihydro5H-dibenz[b,f]azepinmonohydrochlorid und seine Strukturformel ist:
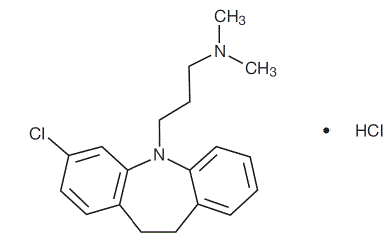
C19H23ClN2 • HCl MW = 351,31
Clomipraminhydrochlorid USP ist ein weißes bis cremefarbenes kristallines Pulver. Es ist frei löslich in Wasser, Methanol und Methylenchlorid und unlöslich in Ethylether und Hexan.
Inaktive Zutaten. D&C Red No. 33 (nur 25-mg-Kapseln), D&C Yellow No. 10, FD&C Blue No. 1 (nur 50-mg-Kapseln), FD&C Yellow No. 6, Gelatine, Magnesiumstearat, Methylparaben, Propylparaben, Stärke (Mais), und Titandioxid.
INDIKATIONEN
Anafranil™ (Clomipraminhydrochlorid) Kapseln USP ist für die Behandlung von Zwangsgedanken und Zwangshandlungen bei Patienten mit Zwangsstörungen (OCD) indiziert. Die Zwangsgedanken oder Zwangshandlungen müssen deutlichen Stress verursachen, zeitraubend sein oder das soziale oder berufliche Funktionieren erheblich beeinträchtigen, um der DSM-III-R-Diagnose (ca. 1989) einer Zwangsstörung gerecht zu werden.
Obsessionen sind wiederkehrende, anhaltende Ideen, Gedanken, Bilder oder Impulse, die ich-dyston sind. Zwänge sind sich wiederholende, zielgerichtete und absichtliche Verhaltensweisen, die als Reaktion auf eine Besessenheit oder in stereotyper Weise ausgeführt werden und von der Person als übertrieben oder unvernünftig erkannt werden.
Die Wirksamkeit von Anafranil 25 mg zur Behandlung von Zwangsstörungen wurde in multizentrischen, placebokontrollierten Parallelgruppenstudien nachgewiesen, darunter zwei 10-wöchige Studien mit Erwachsenen und eine 8-wöchige Studie mit Kindern und Jugendlichen im Alter von 10 bis 17 Jahren. Die Patienten in allen Studien hatten eine mittelschwere bis schwere Zwangsstörung (DSM-III) mit mittleren Ausgangswerten auf der Yale-Brown Obsessive Compulsive Scale (YBOCS) von 26 bis 28 und einem mittleren Ausgangswert von 10 auf der NIMH Clinical Global Obsessive Zwangsskala (NIMH-OC). Patienten, die CMI einnahmen, erlebten eine durchschnittliche Verringerung des YBOCS um etwa 10, was einer durchschnittlichen Verbesserung auf dieser Skala von 35 % bis 42 % bei Erwachsenen und 37 % bei Kindern und Jugendlichen entspricht. CMI-behandelte Patienten erfuhren eine Abnahme des NIMH-OC um 3,5 Einheiten. Patienten unter Placebo zeigten auf keiner der beiden Skalen ein signifikantes klinisches Ansprechen. Die Höchstdosis betrug 250 mg/Tag für die meisten Erwachsenen und 3 mg/kg/Tag (bis zu 200 mg) für alle Kinder und Jugendlichen.
Die Wirksamkeit von Anafranil 25 mg bei Langzeitanwendung (dh über mehr als 10 Wochen) wurde nicht systematisch in placebokontrollierten Studien untersucht. Der Arzt, der sich für die Anwendung von Anafranil 10 mg über einen längeren Zeitraum entscheidet, sollte den langfristigen Nutzen des Arzneimittels für den einzelnen Patienten regelmäßig neu bewerten (siehe DOSIERUNG UND ANWENDUNG ).
DOSIERUNG UND ANWENDUNG
Die unten beschriebenen Behandlungsschemata basieren auf denen, die in kontrollierten klinischen Studien mit Anafranil 50 mg bei 520 Erwachsenen und 91 Kindern und Jugendlichen mit Zwangsstörungen angewendet wurden. Während der anfänglichen Titration sollte Anafranil in geteilten Dosen zu den Mahlzeiten gegeben werden, um gastrointestinale Nebenwirkungen zu reduzieren. Das Ziel dieser anfänglichen Titrationsphase besteht darin, Nebenwirkungen zu minimieren, indem eine Toleranz gegenüber Nebenwirkungen entwickelt wird oder dem Patienten Zeit gegeben wird, sich anzupassen, wenn sich keine Toleranz entwickelt.
Da sowohl CMI als auch sein aktiver Metabolit DMI lange Eliminationshalbwertszeiten haben, sollte der verschreibende Arzt die Tatsache berücksichtigen, dass Steady-State-Plasmaspiegel möglicherweise nicht vor 2 bis 3 Wochen nach einer Dosisänderung erreicht werden (siehe KLINISCHE PHARMAKOLOGIE ). Daher kann es nach der anfänglichen Titration angebracht sein, zwischen weiteren Dosisanpassungen 2 bis 3 Wochen zu warten.
Erstbehandlung/Dosisanpassung (Erwachsene)
Die Behandlung mit Anafranil 25 mg sollte mit einer Dosierung von 25 mg täglich begonnen und während der ersten 2 Wochen je nach Verträglichkeit schrittweise auf etwa 100 mg gesteigert werden. Während der anfänglichen Titration sollte Anafranil 50 mg in geteilten Dosen zu den Mahlzeiten gegeben werden, um gastrointestinale Nebenwirkungen zu reduzieren. Danach kann die Dosis in den nächsten Wochen schrittweise bis zu einer Höchstdosis von 250 mg täglich erhöht werden. Nach der Titration kann die gesamte Tagesdosis einmal täglich vor dem Schlafengehen verabreicht werden, um die Tagessedierung zu minimieren.
Erstbehandlung/Dosisanpassung (Kinder und Jugendliche)
Wie bei Erwachsenen beträgt die Anfangsdosis 25 mg täglich und sollte während der ersten 2 Wochen je nach Verträglichkeit schrittweise bis zu einem täglichen Maximum von 3 mg/kg erhöht werden (ebenfalls in geteilten Dosen zu den Mahlzeiten gegeben, um gastrointestinale Nebenwirkungen zu reduzieren). 100 mg, je nachdem, welcher Wert kleiner ist. Danach kann die Dosierung in den nächsten Wochen schrittweise bis zu einer Tageshöchstdosis von 3 mg/kg oder 200 mg gesteigert werden, je nachdem, welcher Wert geringer ist (siehe VORSICHTSMASSNAHMEN , Pädiatrische Verwendung ). Wie bei Erwachsenen kann nach der Titration die gesamte Tagesdosis einmal täglich vor dem Schlafengehen gegeben werden, um die Tagessedierung zu minimieren.
Erhaltungs-/Fortsetzungsbehandlung (Erwachsene, Kinder und Jugendliche)
Obwohl es keine systematischen Studien gibt, die die Frage beantworten, wie lange Anafranil 10 mg fortgesetzt werden sollte, ist OCD ein chronischer Zustand und es ist vernünftig, eine Fortsetzung für einen ansprechenden Patienten in Betracht zu ziehen. Obwohl die Wirksamkeit von Anafranil 50 mg nach 10 Wochen nicht in kontrollierten Studien dokumentiert wurde, wurde die Therapie bei Patienten unter doppelblinden Bedingungen bis zu 1 Jahr ohne Nutzenverlust fortgesetzt. Es sollten jedoch Dosisanpassungen vorgenommen werden, um den Patienten auf der niedrigsten wirksamen Dosis zu halten, und die Patienten sollten regelmäßig neu untersucht werden, um die Notwendigkeit einer Behandlung festzustellen. Während der Erhaltungstherapie kann die gesamte Tagesdosis einmal täglich vor dem Schlafengehen gegeben werden.
Umstellung eines Patienten auf oder von einem Monoaminoxidase-Hemmer (MAOI) zur Behandlung psychiatrischer Störungen
Zwischen dem Absetzen eines MAO-Hemmers zur Behandlung psychiatrischer Erkrankungen und dem Beginn einer Therapie mit Anafranil sollten mindestens 14 Tage vergehen. Umgekehrt sollten nach dem Absetzen von Anafranil mindestens 14 Tage vergehen, bevor mit einem MAO-Hemmer zur Behandlung psychiatrischer Erkrankungen begonnen wird (vgl KONTRAINDIKATIONEN ).
Verwendung von Anafranil 25 mg mit anderen MAO-Hemmern wie Linezolid oder Methylenblau
Beginnen Sie die Behandlung mit Anafranil 50 mg nicht bei einem Patienten, der mit Linezolid oder Methylenblau intravenös behandelt wird, da ein erhöhtes Risiko für ein Serotonin-Syndrom besteht. Bei einem Patienten, der eine dringendere Behandlung einer psychiatrischen Erkrankung benötigt, sollten andere Interventionen, einschließlich eines Krankenhausaufenthalts, in Betracht gezogen werden (siehe KONTRAINDIKATIONEN ).
In einigen Fällen kann ein Patient, der bereits mit Anafranil 25 mg behandelt wird, eine dringende Behandlung mit Linezolid oder intravenösem Methylenblau benötigen. Wenn keine akzeptablen Alternativen zur Behandlung mit Linezolid oder intravenösem Methylenblau verfügbar sind und der potenzielle Nutzen einer Behandlung mit Linezolid oder intravenösem Methylenblau die Risiken eines Serotonin-Syndroms bei einem bestimmten Patienten überwiegen, sollte Anafranil unverzüglich abgesetzt und Linezolid oder Methylenblau intravenös verabreicht werden verwaltet werden können. Der Patient sollte zwei Wochen lang oder bis 24 Stunden nach der letzten Dosis von Linezolid oder intravenösem Methylenblau, je nachdem, was zuerst eintritt, auf Symptome des Serotonin-Syndroms überwacht werden. Die Therapie mit Anafranil kann 24 Stunden nach der letzten Dosis von Linezolid oder intravenösem Methylenblau wieder aufgenommen werden (siehe WARNUNGEN ).
Das Risiko der Verabreichung von Methylenblau auf nicht-intravenösem Weg (z. B. als Tabletten zum Einnehmen oder durch lokale Injektion) oder in intravenösen Dosen von viel weniger als 1 mg/kg mit Anafranil 50 mg ist unklar. Der Arzt sollte sich jedoch der Möglichkeit bewusst sein, dass bei einer solchen Anwendung Symptome des Serotonin-Syndroms auftreten können (siehe WARNUNGEN ).
WIE GELIEFERT
Anafranil™ (Clomipraminhydrochlorid) Kapseln USP
Kapseln 25 mg – elfenbeinfarbenes Unterteil mit schwarzem Aufdruck „M“ und melonengelbes Oberteil mit schwarzem Aufdruck „ANAFRANIL 25 mg“
Flaschen zu 30…………………………………………………… … NDC 0406-9906-03
Kapseln 50 mg – elfenbeinfarbenes Unterteil mit schwarzem Aufdruck „M“ und aquablaues Oberteil mit schwarzem Aufdruck „ANAFRANIL 50 mg“
Flaschen zu 30………………………………………………………………………………………………………………………………………………… ..… NDC 0406-9907-03
Kapseln 75 mg – elfenbeinfarbenes Unterteil mit schwarzem Aufdruck „M“ und gelbes Oberteil mit schwarzem Aufdruck „ANAFRANIL 75 mg“
Flaschen zu 30…………………………………………………………………………………………………………………………… ..… NDC 0406-9908-03
Lagerung
Bei 20° bis 25°C (68° bis 77°F) lagern [siehe USP kontrollierte Raumtemperatur ].
In gut verschlossenen Behältern mit kindersicherem Verschluss abgeben. Vor Feuchtigkeit schützen.
Tiertoxikologie
Unter Anafranil wurden Phospholipidose und Hodenveränderungen beobachtet, die häufig mit trizyklischen Verbindungen in Verbindung gebracht werden. In Studien mit chronischen Ratten bestanden die Veränderungen im Zusammenhang mit Anafranil 50 mg aus systemischer Phospholipidose, Veränderungen in den Hoden (Atrophie, Mineralisierung) und sekundären Veränderungen in anderen Geweben. Darüber hinaus wurden Herzthrombose und Dermatitis/Keratitis bei Ratten beobachtet, die 2 Jahre lang mit Dosen behandelt wurden, die dem 24- bzw. 10-fachen der maximal empfohlenen Tagesdosis beim Menschen (MRHD) auf mg/kg-Basis und dem 4- bzw. 1,5-fachen der MRHD entsprachen bzw. auf mg/m²-Basis.
Mallinckrodt, das Markenzeichen „M“, das Logo von Mallinckrodt Pharmaceuticals, M Â und andere Marken sind Warenzeichen eines Unternehmens von Mallinckrodt.
Hergestellt von: Patheon Inc., Whitby, Ontario, Kanada, L1N 5Z5 für SpecGx LLC, Webster Groves, MO 63119 USA. Überarbeitet: März 2019
NEBENWIRKUNGEN
Häufig beobachtet
Die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von Anafranil 10 mg, die bei mit Placebo behandelten Patienten nicht in gleicher Häufigkeit auftraten, waren Magen-Darm-Beschwerden, einschließlich Mundtrockenheit, Verstopfung, Übelkeit, Dyspepsie und Anorexie; Beschwerden des Nervensystems, einschließlich Somnolenz, Zittern, Schwindel, Nervosität und Myoklonus; Urogenitalbeschwerden, einschließlich veränderter Libido, Ejakulationsversagen, Impotenz und Miktionsstörung; und andere verschiedene Beschwerden, einschließlich Müdigkeit, Schwitzen, gesteigerter Appetit, Gewichtszunahme und Sehstörungen.
zum Abbruch der Behandlung führt
Ungefähr 20 % von 3616 Patienten, die Anafranil in klinischen Studien vor der Markteinführung in den USA erhielten, brachen die Behandlung wegen eines unerwünschten Ereignisses ab. Ungefähr die Hälfte der Patienten, die die Behandlung abbrachen (9 % der Gesamtzahl), hatte mehrere Beschwerden, von denen keine als primär eingestuft werden konnte. Wo ein primärer Grund für das Absetzen identifiziert werden konnte, brachen die meisten Patienten die Behandlung aufgrund von Beschwerden des Nervensystems (5,4 %), hauptsächlich Somnolenz, ab. Der zweithäufigste Abbruchgrund waren Verdauungsbeschwerden (1,3 %), vor allem Erbrechen und Übelkeit.
Es gab keinen offensichtlichen Zusammenhang zwischen den unerwünschten Ereignissen und erhöhten Arzneimittelkonzentrationen im Plasma.
Inzidenz in kontrollierten klinischen Studien
Die folgende Tabelle listet unerwünschte Ereignisse auf, die mit einer Inzidenz von 1 % oder mehr bei Patienten mit Zwangsstörungen auftraten, die Anafranil 10 mg in Placebo-kontrollierten klinischen Studien mit Erwachsenen oder Kindern erhielten. Die Häufigkeiten wurden aus gepoolten Daten klinischer Studien erhalten, an denen entweder Erwachsene, die Anafranil (N = 322) oder Placebo (N = 319) erhielten, oder Kinder, die mit Anafranil (N = 46) oder Placebo (N = 44) behandelt wurden, teilnahmen. Der verschreibende Arzt sollte sich darüber im Klaren sein, dass diese Zahlen nicht verwendet werden können, um das Auftreten von Nebenwirkungen im Rahmen der üblichen medizinischen Praxis vorherzusagen, bei der sich die Patientencharakteristika und andere Faktoren von denen unterscheiden, die in den klinischen Studien vorherrschten. Ebenso können die angegebenen Häufigkeiten nicht mit Zahlen verglichen werden, die aus anderen klinischen Studien mit unterschiedlichen Behandlungen, Anwendungen und Prüfärzten stammen. Die zitierten Zahlen liefern dem Arzt jedoch eine Grundlage für die Abschätzung des relativen Beitrags von medikamentösen und nichtmedikamentösen Faktoren zum Auftreten von Nebenwirkungen in den untersuchten Populationen.
Inzidenz behandlungsbedingter Nebenwirkungen in placebokontrollierten klinischen Studien (Prozentsatz der Patienten, die ein Ereignis melden)
Andere Ereignisse, die während der Premarketing-Evaluierung von Anafranil beobachtet wurden
Während klinischer Tests in den USA wurden ungefähr 3600 Probanden Mehrfachdosen von 50 mg Anafranil verabreicht. Unerwünschte Ereignisse im Zusammenhang mit dieser Exposition wurden von klinischen Prüfern unter Verwendung einer Terminologie ihrer eigenen Wahl aufgezeichnet. Folglich ist es nicht möglich, eine aussagekräftige Schätzung des Anteils der Personen anzugeben, bei denen unerwünschte Ereignisse auftreten, ohne zunächst ähnliche Arten von unerwünschten Ereignissen in eine kleinere Anzahl standardisierter Ereigniskategorien einzuteilen.
In den folgenden Tabellen wurde ein modifiziertes Terminologiewörterbuch der Weltgesundheitsorganisation verwendet, um gemeldete unerwünschte Ereignisse zu klassifizieren. Die dargestellten Häufigkeiten stellen daher den Anteil der 3525 Anafranil-exponierten Personen dar, bei denen während der Behandlung mit Anafranil mindestens einmal ein Ereignis der genannten Art aufgetreten ist. Alle Ereignisse sind eingeschlossen, mit Ausnahme der bereits in der vorherigen Tabelle aufgeführten, derer, die so allgemein gehalten sind, dass sie nicht aussagekräftig sind, und derer, bei denen eine Assoziation mit dem Medikament entfernt war. Es ist wichtig zu betonen, dass die berichteten Ereignisse zwar während der Behandlung mit Anafranil auftraten, aber nicht unbedingt dadurch verursacht wurden.
Ereignisse werden weiter nach Körpersystemen kategorisiert und in der Reihenfolge abnehmender Häufigkeit gemäß den folgenden Definitionen aufgelistet: häufige unerwünschte Ereignisse sind solche, die bei mindestens 1/100 Patienten einmal oder mehrmals auftreten; seltene unerwünschte Ereignisse treten bei 1/100 bis 1/1000 Patienten auf; Seltene Ereignisse sind solche, die bei weniger als 1/1000 Patienten auftreten.
Körper als Ganzes - Selten - allgemeines Ödem, erhöhte Anfälligkeit für Infektionen, Unwohlsein. Selten - abhängiges Ödem, Entzugssyndrom.
Herz-Kreislauf-System - Selten - abnormales EKG, Arrhythmie, Bradykardie, Herzstillstand, Extrasystolen, Blässe. Selten - Aneurysma, Vorhofflattern, Schenkelblock, Herzinsuffizienz, Hirnblutung, Herzblock, Myokardinfarkt, Myokardischämie, periphere Ischämie, Thrombophlebitis, Vasospasmus, ventrikuläre Tachykardie.
Verdauungstrakt - Selten - abnorme Leberfunktion, Blut im Stuhl, Colitis, Duodenitis, Magengeschwür, Gastritis, gastroösophagealer Reflux, Gingivitis, Glossitis, Hämorrhoiden, Hepatitis, erhöhter Speichelfluss, Reizdarmsyndrom, Magengeschwür, rektale Blutung, Zungengeschwür, Zahnkaries. Selten - Cheilitis, chronische Enteritis, verfärbter Kot, Magendilatation, Zahnfleischbluten, Schluckauf, Darmverschluss, Mund-/Rachenödem, paralytischer Ileus, Speicheldrüsenvergrößerung.
Hormonsystem - Selten - Hypothyreose. Selten - Kropf, Gynäkomastie, Hyperthyreose.
Hämisches und lymphatisches System - Selten - Lymphadenopathie. Selten - leukämoide Reaktion, Lymphom-ähnliche Störung, Markdepression.
Stoffwechsel- und Ernährungsstörung - Selten - Dehydration, Diabetes mellitus, Gicht, Hypercholesterinämie, Hyperglykämie, Hyperurikämie, Hypokaliämie. Selten - Fettunverträglichkeit, Glykosurie.
Bewegungsapparat - Selten - Arthrose. Selten - Dystonie, Exostose, Lupus erythematodes Hautausschlag, Blutergüsse, Myopathie, Myositis, Polyarteritis nodosa, Torticollis.
Nervöses System - Häufig - abnormes Denken, Schwindel. Selten - abnorme Koordination, abnormes EEG, abnormer Gang, Apathie, Ataxie, Koma, Krämpfe, Delirium, Wahn, Dyskinesie, Dysphonie, Enzephalopathie, Euphorie, extrapyramidale Störung, Halluzinationen, Feindseligkeit, Hyperkinesie, hypnagogische Halluzinationen, Hypokinesie, Beinkrämpfe, manische Reaktion , Neuralgie, Paranoia, phobische Störung, Psychose, Sensibilitätsstörung, Somnambulismus, Stimulation, Suizidgedanken, Suizidversuch, Zähneknirschen. Selten - anticholinerges Syndrom, Aphasie, Apraxie, Katalepsie, cholinerges Syndrom, Choreoathetose, generalisierter Krampf, Hemiparese, Hyperästhesie, Hyperreflexie, Hypästhesie, Illusion, gestörte Impulskontrolle, Unentschlossenheit, Mutismus, Neuropathie, Nystagmus, Augenkrise, Lähmung des N. oculomotorius, schizophrene Reaktion , Stupor, Selbstmord.
Atmungssystem - Selten - Bronchitis, Hyperventilation, erhöhter Auswurf, Lungenentzündung. Selten - Zyanose, Hämoptyse, Hypoventilation, Laryngismus.
Haut und Anhängsel - Selten - Alopezie, Zellulitis, Zyste, Ekzem, erythematöser Ausschlag, Pruritus im Genitalbereich, makulopapulöser Ausschlag, Lichtempfindlichkeitsreaktion, Psoriasis, pustulöser Ausschlag, Hautverfärbung. Selten - Chloasma, Follikulitis, Hypertrichose, Piloerektion, Seborrhoe, Hauthypertrophie, Hautgeschwüre.
Besondere Sinne - Selten - abnormale Akkommodation, Taubheit, Diplopie, Ohrenschmerzen, Augenschmerzen, Fremdkörpergefühl, Hyperakusis, Parosmie, Photophobie, Skleritis, Geschmacksverlust. Selten - Blepharitis, Chromatopsie, Bindehautblutung, Exophthalmus, Glaukom, Keratitis, Labyrinthstörung, Nachtblindheit, Netzhauterkrankung, Strabismus, Gesichtsfelddefekt.
Urogenitalsystem - Selten - Endometriose, Nebenhodenentzündung, Hämaturie, Nykturie, Oligurie, Ovarialzyste, Dammschmerzen, Polyurie, Prostataerkrankung, Nierenstein, Nierenschmerzen, Harnröhrenerkrankung, Harninkontinenz, Uterusblutung, Vaginalblutung. Selten – Albuminurie, Anorgasmie, Milchstau, Brustfibroadenose, zervikale Dysplasie, Endometriumhyperplasie, vorzeitige Ejakulation, Pyelonephritis, Pyurie, Nierenzyste, Uterusentzündung, Vulvaerkrankung.
Postmarketing-Erfahrung
Die folgende Nebenwirkung wurde während der Anwendung von Anafranil nach der Zulassung berichtet. Da diese Reaktion freiwillig von einer Population unbekannter Größe gemeldet wird, ist es nicht immer möglich, die Häufigkeit zuverlässig abzuschätzen.
Augenerkrankungen - Engwinkelglaukom.
Erkrankungen des Immunsystems - Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS).
Stoffwechsel- und Ernährungsstörungen - Hyponatriämie.
Endokrine Störungen - Syndrom der inadäquaten ADH-Sekretion (SIADH).
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Die Risiken der Anwendung von Anafranil in Kombination mit anderen Arzneimitteln wurden nicht systematisch bewertet. Angesichts der primären ZNS-Wirkungen von Anafranil ist bei der gleichzeitigen Anwendung mit anderen ZNS-aktiven Arzneimitteln Vorsicht geboten (siehe GEDULDIG INFORMATION ). Anafranil sollte nicht mit MAO-Hemmern verwendet werden (siehe KONTRAINDIKATIONEN ).
Eine engmaschige Überwachung und sorgfältige Dosisanpassung sind erforderlich, wenn Anafranil zusammen mit Anticholinergika oder Sympathomimetika verabreicht wird.
Es wurde berichtet, dass mehrere trizyklische Antidepressiva die pharmakologischen Wirkungen von Guanethidin, Clonidin oder ähnlichen Wirkstoffen blockieren, und eine solche Wirkung kann bei CMI wegen seiner strukturellen Ähnlichkeit mit anderen trizyklischen Antidepressiva erwartet werden.
Es wurde berichtet, dass die Plasmakonzentration von CMI durch die gleichzeitige Gabe von Haloperidol erhöht wird; Es wurde berichtet, dass die Plasmaspiegel mehrerer eng verwandter trizyklischer Antidepressiva durch die gleichzeitige Verabreichung von Methylphenidat oder Leberenzym-Hemmern (z. B. Cimetidin, Fluoxetin) erhöht und durch die gleichzeitige Verabreichung von Leberenzym-Induktoren (z. B. Barbiturate, Phenytoin) verringert wurden ein solcher Effekt ist auch bei CMI zu erwarten. Es wurde berichtet, dass die Verabreichung von CMI die Plasmaspiegel von Phenobarbital erhöht, wenn es gleichzeitig gegeben wird (siehe KLINISCHE PHARMAKOLOGIE , Interaktionen ).
Medikamente, die von P450 2D6 metabolisiert werden
Die biochemische Aktivität des Arzneimittel metabolisierenden Isozyms Cytochrom P450 2D6 (Debrisoquin-Hydroxylase) ist bei einer Untergruppe der kaukasischen Bevölkerung reduziert (etwa 7 % bis 10 % der Kaukasier sind sogenannte „poor metabolizers“); Zuverlässige Schätzungen der Prävalenz von reduzierter P450-2D6-Isozym-Aktivität bei asiatischen, afrikanischen und anderen Bevölkerungsgruppen sind noch nicht verfügbar. Langsame Metabolisierer haben höhere als erwartete Plasmakonzentrationen von trizyklischen Antidepressiva (TCAs), wenn sie übliche Dosen erhalten. Abhängig von der durch P450 2D6 metabolisierten Fraktion des Arzneimittels kann der Anstieg der Plasmakonzentration gering oder ziemlich groß sein (8-facher Anstieg der Plasma-AUC des TCA). Darüber hinaus hemmen bestimmte Arzneimittel die Aktivität dieses Isozyms und lassen normale Metabolisierer langsamen Metabolisierern ähneln. Eine Person, die mit einer gegebenen TCA-Dosis stabil ist, kann abrupt toxisch werden, wenn sie eines dieser hemmenden Arzneimittel als Begleittherapie erhält. Zu den Arzneimitteln, die Cytochrom P450 2D6 hemmen, gehören einige, die nicht durch das Enzym verstoffwechselt werden (Chinidin; Cimetidin), und viele, die Substrate für P450 2D6 sind (viele andere Antidepressiva, Phenothiazine und die Typ-1C-Antiarrhythmika Propafenon und Flecainid). Während alle selektiven Serotonin-Wiederaufnahmehemmer (SSRIs), z. B. Fluoxetin, Sertralin, Paroxetin und Fluvoxamin, P450 2D6 hemmen, können sie im Ausmaß der Hemmung variieren. Es wurde auch gezeigt, dass Fluvoxamin P450 1A2 hemmt, eine Isoform, die ebenfalls am TCA-Metabolismus beteiligt ist. Das Ausmaß, in dem SSRI-TCA-Wechselwirkungen klinische Probleme aufwerfen können, hängt vom Grad der Hemmung und der Pharmakokinetik der beteiligten SSRI ab. Dennoch ist bei der gleichzeitigen Verabreichung von TCAs mit einem der SSRIs und auch beim Wechsel von einer Klasse zur anderen Vorsicht geboten. Besonders wichtig ist, dass bei einem Patienten, der Fluoxetin abgesetzt wird, angesichts der langen Halbwertszeit des Ausgangsstoffs und des aktiven Metaboliten ausreichend Zeit verstreichen muss, bevor mit der Behandlung mit TCA begonnen wird (mindestens 5 Wochen können erforderlich sein). Die gleichzeitige Anwendung von Arzneimitteln aus der Klasse der trizyklischen Antidepressiva (einschließlich Anafranil) mit Arzneimitteln, die Cytochrom P450 2D6 hemmen können, kann niedrigere Dosen als die üblicherweise verschriebenen entweder für das trizyklische Antidepressivum oder das andere Arzneimittel erfordern. Darüber hinaus kann eine erhöhte Dosis des trizyklischen Antidepressivums erforderlich sein, wenn eines dieser Arzneimittel aus der Co-Therapie abgesetzt wird. Es ist wünschenswert, die TCA-Plasmaspiegel zu überwachen, wann immer ein Mittel der trizyklischen Antidepressiva-Klasse, einschließlich Anafranil, zusammen mit einem anderen Medikament verabreicht wird, von dem bekannt ist, dass es ein Inhibitor von P450 2D6 (und/oder P450 1A2) ist.
Da Anafranil stark an Serumproteine gebunden ist, kann die Verabreichung von Anafranil an Patienten, die andere Arzneimittel einnehmen, die stark an Proteine gebunden sind (z. B. Warfarin, Digoxin), einen Anstieg der Plasmakonzentrationen dieser Arzneimittel verursachen, was möglicherweise zu Nebenwirkungen führen kann. Umgekehrt können unerwünschte Wirkungen aus der Verdrängung von proteingebundenem Anafranil durch andere stark gebundene Arzneimittel resultieren (vgl KLINISCHE PHARMAKOLOGIE , Verteilung ).
Monoaminoxidase-Hemmer (MAO-Hemmer)
(Sehen KONTRAINDIKATIONEN , WARNUNGEN , und DOSIERUNG UND ANWENDUNG .)
Serotonerge Medikamente
(Sehen KONTRAINDIKATIONEN , WARNUNGEN , und DOSIERUNG UND ANWENDUNG .)
Drogenmissbrauch und -abhängigkeit
Anafranil wurde nicht systematisch an Tieren oder Menschen auf sein Potenzial für Missbrauch, Toleranz oder körperliche Abhängigkeit untersucht. Während im Zusammenhang mit dem Absetzen von Anafranil 50 mg eine Vielzahl von Entzugserscheinungen beschrieben wurden (siehe VORSICHTSMASSNAHMEN , Entzugserscheinungen gibt es keine Hinweise auf Drogensuchtverhalten, mit Ausnahme eines einzelnen Berichts über einen möglichen Anafranil-Missbrauch durch einen Patienten mit einer Vorgeschichte von Abhängigkeit von Codein, Benzodiazepinen und mehreren psychoaktiven Drogen. Der Patient erhielt Anafranil gegen Depressionen und Panikattacken und schien nach der Entlassung aus dem Krankenhaus abhängig zu werden.
Trotz des Fehlens von Beweisen, die auf eine Missbrauchshaftung von Anafranil bei der Vermarktung im Ausland hindeuten, ist es nicht möglich, das Ausmaß vorherzusagen, in dem Anafranil missbraucht oder missbraucht werden könnte, sobald es in den USA vermarktet wird. Folglich sollten Ärzte Patienten sorgfältig auf eine Vorgeschichte von Drogenmissbrauch untersuchen und Beobachten Sie solche Patienten genau.
WARNUNGEN
Klinische Verschlechterung und Suizidrisiko
Bei Patienten mit schwerer depressiver Störung (MDD), sowohl bei Erwachsenen als auch bei Kindern, kann es zu einer Verschlechterung ihrer Depression und/oder zum Auftreten von Suizidgedanken und -verhalten (Suizidalität) oder zu ungewöhnlichen Verhaltensänderungen kommen, unabhängig davon, ob sie Antidepressiva einnehmen oder nicht Das Risiko kann bestehen bleiben, bis eine signifikante Remission eintritt. Selbstmord ist ein bekanntes Risiko für Depressionen und bestimmte andere psychiatrische Störungen, und diese Störungen selbst sind die stärksten Prädiktoren für Selbstmord. Es besteht jedoch seit langem die Sorge, dass Antidepressiva bei bestimmten Patienten in den frühen Phasen der Behandlung eine Rolle bei der Induktion einer Verschlechterung der Depression und dem Auftreten von Suizidalität spielen könnten. Gepoolte Analysen von Placebo-kontrollierten Kurzzeitstudien mit Antidepressiva (SSRIs und andere) zeigten, dass diese Medikamente das Risiko für suizidales Denken und Verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen (im Alter von 18 bis 24) mit Major Depression erhöhen Störung (MDD) und andere psychiatrische Störungen. Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; bei Erwachsenen ab 65 Jahren kam es unter Antidepressiva im Vergleich zu Placebo zu einer Reduktion.
Die gepoolten Analysen placebokontrollierter Studien bei Kindern und Jugendlichen mit MDD, Zwangsstörungen (OCD) oder anderen psychiatrischen Erkrankungen umfassten insgesamt 24 Kurzzeitstudien mit 9 Antidepressiva bei über 4400 Patienten. Die gepoolten Analysen placebokontrollierter Studien bei Erwachsenen mit MDD oder anderen psychiatrischen Erkrankungen umfassten insgesamt 295 Kurzzeitstudien (mediane Dauer von 2 Monaten) mit 11 Antidepressiva bei über 77.000 Patienten. Es gab beträchtliche Schwankungen des Suizidalitätsrisikos zwischen den Medikamenten, aber bei fast allen untersuchten Medikamenten eine Tendenz zu einem Anstieg bei den jüngeren Patienten. Es gab Unterschiede im absoluten Suizidalitätsrisiko zwischen den verschiedenen Indikationen, mit der höchsten Inzidenz bei MDD. Die Risikounterschiede (Medikament vs. Placebo) waren jedoch innerhalb der Altersschichten und über Indikationen hinweg relativ stabil. Diese Risikounterschiede (Arzneimittel-Placebo-Unterschied in der Anzahl der Fälle von Suizidalität pro 1000 behandelten Patienten) sind in Tabelle 1 aufgeführt.
In keiner der pädiatrischen Studien kam es zu Suiziden. In den Studien mit Erwachsenen gab es Suizide, aber die Anzahl reichte nicht aus, um zu einer Schlussfolgerung über die Wirkung des Medikaments auf Suizide zu gelangen.
Es ist nicht bekannt, ob sich das Suizidrisiko auf eine längerfristige Anwendung erstreckt, dh über mehrere Monate hinaus. Es gibt jedoch erhebliche Hinweise aus placebokontrollierten Erhaltungsstudien bei Erwachsenen mit Depressionen, dass die Anwendung von Antidepressiva das Wiederauftreten von Depressionen verzögern kann.
Alle Patienten, die mit Antidepressiva aus beliebigen Indikationen behandelt werden, sollten angemessen überwacht und engmaschig auf eine klinische Verschlechterung, Suizidalität und ungewöhnliche Verhaltensänderungen beobachtet werden, insbesondere während der ersten Monate einer medikamentösen Therapie oder bei Dosisänderungen oder -steigerungen oder abnimmt.
Die folgenden Symptome, Angst, Agitiertheit, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Ruhelosigkeit), Hypomanie und Manie, wurden bei erwachsenen und pädiatrischen Patienten berichtet, die ebenfalls mit Antidepressiva wegen schwerer depressiver Störung behandelt wurden wie für andere Indikationen, sowohl psychiatrische als auch nichtpsychiatrische. Obwohl ein kausaler Zusammenhang zwischen dem Auftreten solcher Symptome und entweder der Verschlechterung einer Depression und/oder dem Auftreten suizidaler Impulse nicht hergestellt werden konnte, besteht die Sorge, dass solche Symptome Vorboten einer aufkommenden Suizidalität sein könnten.
Bei Patienten, deren Depression sich anhaltend verschlimmert oder die an Suizidalität oder Symptomen leiden, die Vorboten einer Verschlechterung der Depression oder Suizidalität sein könnten, sollte eine Änderung des therapeutischen Schemas, einschließlich eines möglichen Absetzens der Medikation, in Betracht gezogen werden, insbesondere wenn diese Symptome schwerwiegend und abrupt sind zu Beginn oder waren nicht Teil der Symptome des Patienten.
Familien und Betreuer von Patienten, die wegen einer schweren depressiven Störung oder anderen Indikationen, sowohl psychiatrischen als auch nichtpsychiatrischen, mit Antidepressiva behandelt werden, sollten auf die Notwendigkeit aufmerksam gemacht werden, Patienten auf das Auftreten von Unruhe, Reizbarkeit, ungewöhnlichen Verhaltensänderungen und den anderen oben beschriebenen Symptomen zu überwachen , sowie das Auftreten von Suizidalität, und solche Symptome unverzüglich dem Gesundheitsdienstleister zu melden. Eine solche Überwachung sollte die tägliche Beobachtung durch Familien und Betreuer umfassen. Rezepte für Clomipraminhydrochlorid sollten für die kleinste Menge an Kapseln im Einklang mit einem guten Patientenmanagement ausgestellt werden, um das Risiko einer Überdosierung zu verringern.
Screening von Patienten auf bipolare Störungen
Eine schwere depressive Episode kann die anfängliche Präsentation einer bipolaren Störung sein. Es wird allgemein angenommen (obwohl dies nicht in kontrollierten Studien nachgewiesen wurde), dass die Behandlung einer solchen Episode mit einem Antidepressivum allein die Wahrscheinlichkeit des Auftretens einer gemischten/manischen Episode bei Patienten mit einem Risiko für eine bipolare Störung erhöhen kann. Ob eines der oben beschriebenen Symptome eine solche Konversion darstellt, ist unbekannt. Vor Beginn der Behandlung mit einem Antidepressivum sollten Patienten mit depressiven Symptomen jedoch angemessen untersucht werden, um festzustellen, ob bei ihnen ein Risiko für eine bipolare Störung besteht; Ein solches Screening sollte eine detaillierte psychiatrische Vorgeschichte umfassen, einschließlich einer Familienanamnese von Selbstmord, bipolarer Störung und Depression. Es sollte beachtet werden, dass Clomipraminhydrochlorid nicht zur Behandlung von bipolarer Depression zugelassen ist.
Serotonin-Syndrom
Die Entwicklung eines potenziell lebensbedrohlichen Serotoninsyndroms wurde mit SNRIs und SSRIs, einschließlich Anafranil 50 mg, allein, aber insbesondere bei gleichzeitiger Anwendung anderer serotonerger Arzneimittel (einschließlich Triptane, trizyklische Antidepressiva, Fentanyl, Lithium, Tramadol, Tryptophan, Buspiron usw.) berichtet Johanniskraut) und mit Arzneimitteln, die den Serotoninstoffwechsel beeinträchtigen (insbesondere MAO-Hemmer, sowohl solche, die zur Behandlung psychiatrischer Erkrankungen bestimmt sind, als auch andere, wie Linezolid und intravenöses Methylenblau).
Zu den Symptomen des Serotonin-Syndroms können Veränderungen des mentalen Status (z. B. Unruhe, Halluzinationen, Delirium und Koma), autonome Instabilität (z. B. Tachykardie, labiler Blutdruck, Schwindel, Diaphorese, Hitzewallungen, Hyperthermie), neuromuskuläre Veränderungen (z. B. Tremor, Steifheit, Myoklonus, Hyperreflexie, Koordinationsstörungen), Krampfanfälle und/oder gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Durchfall). Die Patienten sollten auf das Auftreten eines Serotonin-Syndroms überwacht werden.
Die gleichzeitige Anwendung von Anafranil 10 mg mit MAO-Hemmern zur Behandlung psychiatrischer Erkrankungen ist kontraindiziert. Anafranil 50 mg sollte auch nicht bei einem Patienten begonnen werden, der mit MAO-Hemmern wie Linezolid oder intravenösem Methylenblau behandelt wird. Alle Berichte mit Methylenblau, die Informationen zum Verabreichungsweg enthielten, betrafen die intravenöse Verabreichung im Dosisbereich von 1 mg/kg bis 8 mg/kg. Es gab keine Berichte über die Verabreichung von Methylenblau auf anderem Wege (wie z. B. Tabletten zum Einnehmen oder lokale Gewebeinjektion) oder in niedrigeren Dosen. Es kann Umstände geben, unter denen es notwendig ist, bei einem Patienten, der Anafranil einnimmt, eine Behandlung mit einem MAO-Hemmer wie Linezolid oder intravenösem Methylenblau einzuleiten. Anafranil sollte abgesetzt werden, bevor eine Behandlung mit dem MAO-Hemmer begonnen wird (siehe KONTRAINDIKATIONEN und DOSIERUNG UND ANWENDUNG ).
Wenn die gleichzeitige Anwendung von Anafranil 10 mg mit anderen serotonergen Arzneimitteln, einschließlich Triptanen, trizyklischen Antidepressiva, Fentanyl, Lithium, Tramadol, Buspiron, Tryptophan und Johanniskraut, klinisch gerechtfertigt ist, sollten die Patienten auf ein potenziell erhöhtes Risiko aufmerksam gemacht werden Serotonin-Syndrom, insbesondere zu Beginn der Behandlung und bei Dosiserhöhungen.
Die Behandlung mit Anafranil 10 mg und allen begleitenden serotonergen Arzneimitteln sollte sofort abgebrochen werden, wenn die oben genannten Ereignisse auftreten, und eine unterstützende symptomatische Behandlung eingeleitet werden.
Engwinkelglaukom
Die Pupillenerweiterung, die nach der Anwendung vieler Antidepressiva, einschließlich Anafranil, auftritt, kann bei einem Patienten mit anatomisch engen Winkeln, der keine offene Iridektomie hat, eine Winkelverschlussattacke auslösen.
Krampfanfälle
Während der Bewertung vor dem Inverkehrbringen wurden Krampfanfälle als das bedeutendste Risiko der Anwendung von Anafranil identifiziert.
Die beobachtete kumulative Inzidenz von Anfällen bei Patienten, die Anafranil 25 mg in Dosen von bis zu 300 mg/Tag erhielten, betrug 0,64 % nach 90 Tagen, 1,12 % nach 180 Tagen und 1,45 % nach 365 Tagen. Die kumulativen Raten korrigieren die rohe Rate von 0,7 % (25 von 3519 Patienten) um die variable Expositionsdauer in klinischen Studien.
Obwohl die Dosis ein Prädiktor für Krampfanfälle zu sein scheint, gibt es eine Verwechslung von Dosis und Expositionsdauer, was es schwierig macht, die Wirkung jedes Faktors allein unabhängig zu beurteilen. Die Fähigkeit, das Auftreten von Krampfanfällen bei Probanden vorherzusagen, die CMI-Dosen von mehr als 250 mg ausgesetzt waren, ist begrenzt, da die Plasmakonzentration von CMI dosisabhängig sein kann und zwischen Probanden, denen dieselbe Dosis verabreicht wurde, variieren kann. Dennoch wird den verschreibenden Ärzten empfohlen, die Tagesdosis auf maximal 250 mg bei Erwachsenen und 3 mg/kg (oder 200 mg) bei Kindern und Jugendlichen zu begrenzen (vgl DOSIERUNG UND ANWENDUNG ).
Bei der Verabreichung von Anafranil 50 mg an Patienten mit Anfällen in der Vorgeschichte oder anderen prädisponierenden Faktoren, z. B. Hirnschäden unterschiedlicher Ätiologie, Alkoholismus und gleichzeitiger Anwendung mit anderen Arzneimitteln, die die Krampfschwelle senken, ist Vorsicht geboten.
Seltene Berichte über Todesfälle im Zusammenhang mit Krampfanfällen wurden von ausländischen Postmarketing-Überwachungen gemeldet, jedoch nicht in klinischen Studien in den USA. In einigen dieser Fälle wurde Anafranil zusammen mit anderen epileptogenen Mitteln verabreicht; in anderen hatten die betroffenen Patienten möglicherweise prädisponierende Erkrankungen. Daher wurde kein kausaler Zusammenhang zwischen der Behandlung mit Anafranil 25 mg und diesen Todesfällen festgestellt.
Ärzte sollten mit Patienten das Risiko der Einnahme von Anafranil bei Aktivitäten besprechen, bei denen ein plötzlicher Bewusstseinsverlust zu schweren Verletzungen des Patienten oder anderer führen könnte, z. B. das Bedienen komplexer Maschinen, Autofahren, Schwimmen, Klettern.
KLEID
Bei der Anwendung von Clomipramin wurden seltene Fälle von Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS) berichtet. Bei schweren akuten Reaktionen wie DRESS ist die Behandlung mit Clomipramin sofort abzubrechen und eine geeignete Behandlung einzuleiten.
VORSICHTSMASSNAHMEN
Allgemein
Selbstmord
Da Depression ein häufig assoziiertes Merkmal von Zwangsstörungen ist, muss das Suizidrisiko berücksichtigt werden. Rezepte für Anafranil sollten für die kleinste Menge an Kapseln im Einklang mit einem guten Patientenmanagement ausgestellt werden, um das Risiko einer Überdosierung zu verringern.
Kardiovaskuläre Wirkungen
Leichter orthostatischer Blutdruckabfall und leichte Tachykardie wurden jeweils bei etwa 20 % der Patienten beobachtet, die Anafranil 10 mg in klinischen Studien einnahmen; aber die Patienten waren häufig asymptomatisch. Von ungefähr 1400 Patienten, die in der Premarketing-Erfahrung mit CMI behandelt wurden und EKGs hatten, entwickelten 1,5 % Anomalien während der Behandlung, verglichen mit 3,1 % der Patienten, die aktive Kontrollmedikamente erhielten, und 0,7 % der Patienten, die Placebo erhielten. Die häufigsten EKG-Veränderungen waren VES, ST-T-Wellen-Veränderungen und intraventrikuläre Leitungsanomalien. Diese Veränderungen waren selten mit signifikanten klinischen Symptomen verbunden. Dennoch ist bei der Behandlung von Patienten mit bekannter Herz-Kreislauf-Erkrankung Vorsicht geboten und eine schrittweise Dosistitration wird empfohlen.
Psychose, Verwirrung und andere neuropsychiatrische Phänomene
Es wurde berichtet, dass Patienten, die mit Anafranil 10 mg behandelt wurden, eine Vielzahl von neuropsychiatrischen Anzeichen und Symptomen zeigten, darunter Wahnvorstellungen, Halluzinationen, psychotische Episoden, Verwirrtheit und Paranoia. Aufgrund des unkontrollierten Charakters vieler Studien ist es unmöglich, eine genaue Abschätzung des Risikoausmaßes einer Behandlung mit Anafranil vorzunehmen. Wie trizyklische Antidepressiva, mit denen es eng verwandt ist, kann Anafranil 25 mg bei Patienten mit unerkannter Schizophrenie eine akute psychotische Episode auslösen.
Manie/Hypomanie
Während Premarketing-Tests mit Anafranil 10 mg bei Patienten mit affektiven Störungen trat bei mehreren Patienten Hypomanie oder Manie auf. Bei einem kleinen Teil der Patienten mit affektiven Störungen, die mit handelsüblichen trizyklischen Antidepressiva behandelt wurden, die eng mit Anafranil verwandt sind, wurde auch über die Aktivierung von Manie oder Hypomanie berichtet.
Leberveränderungen
Während der Tests vor der Markteinführung wurde Anafranil gelegentlich mit Erhöhungen der SGOT und SGPT (gepoolte Inzidenz von etwa 1 % bzw. 3 %) von potenzieller klinischer Bedeutung in Verbindung gebracht (dh Werte, die das 3-fache der Obergrenze des Normalwerts überstiegen). In den allermeisten Fällen waren diese Enzymanstiege nicht mit anderen klinischen Befunden verbunden, die auf eine Leberschädigung hindeuteten; außerdem war keiner gelbsüchtig. Seltene Berichte über schwerere Leberschäden, einige davon mit tödlichem Ausgang, wurden im Rahmen ausländischer Postmarketing-Erfahrungen berichtet. Bei der Behandlung von Patienten mit bekannter Lebererkrankung ist Vorsicht geboten, und bei solchen Patienten wird eine regelmäßige Überwachung der Leberenzymwerte empfohlen.
Hämatologische Veränderungen
Obwohl in den Erfahrungen vor der Markteinführung mit Anafranil 25 mg keine Fälle von schwerer hämatologischer Toxizität beobachtet wurden, gab es nach der Markteinführung Berichte über Leukopenie, Agranulozytose, Thrombozytopenie, Anämie und Panzytopenie im Zusammenhang mit der Anwendung von Anafranil 50 mg. Wie bei trizyklischen Antidepressiva, mit denen Anafranil 25 mg eng verwandt ist, sollten bei Patienten, die während der Behandlung mit Anafranil Fieber und Halsschmerzen entwickeln, Leukozyten- und Differentialblutbilder erstellt werden.
Zentrales Nervensystem
Mehr als 30 Fälle von Hyperthermie wurden von nicht-häuslichen Postmarketing-Überwachungssystemen registriert. Die meisten Fälle traten auf, wenn Anafranil in Kombination mit anderen Arzneimitteln angewendet wurde. Bei gleichzeitiger Anwendung von Anafranil 25 mg und einem Neuroleptikum wurden die Fälle manchmal als Beispiele für ein malignes neuroleptisches Syndrom angesehen.
Sexuelle Funktionsstörung
Die Rate sexueller Dysfunktion bei männlichen Patienten mit Zwangsstörungen, die mit Anafranil in der Premarketing-Erfahrung behandelt wurden, war im Vergleich zu Placebo-Kontrollen deutlich erhöht (d. h. 42 % erlebten Ejakulationsversagen und 20 % Impotenz, verglichen mit 2,0 % bzw. 2,6 %). in der Placebogruppe). Ungefähr 85 % der Männer mit sexueller Dysfunktion entschieden sich für eine Fortsetzung der Behandlung.
Hyponatriämie
Hyponatriämie ist als Folge der Behandlung mit Clomipramin aufgetreten. In vielen Fällen scheint Hyponatriämie das Ergebnis des Syndroms der inadäquaten Sekretion des antidiuretischen Hormons (SIADH) zu sein. Ältere Patienten können unter einem serotonergen Antidepressivum einem höheren Risiko ausgesetzt sein, eine Hyponatriämie zu entwickeln. Auch Patienten, die Diuretika einnehmen oder anderweitig an Volumenmangel leiden, können einem höheren Risiko ausgesetzt sein. Das Absetzen von Anafranil bei Patienten mit symptomatischer Hyponatriämie und eine angemessene medizinische Intervention sollten eingeleitet werden. Anzeichen und Symptome einer Hyponatriämie sind Kopfschmerzen, Konzentrationsschwierigkeiten, Gedächtnisstörungen, Verwirrtheit, Schwäche und Unsicherheit, die zu Stürzen führen können. Zu schwereren und/oder akuteren Fällen gehörten Halluzinationen, Synkopen, Krampfanfälle, Koma, Atemstillstand und Tod.
Gewichtsänderungen
In kontrollierten Studien zu Zwangsstörungen wurde bei 18 % der Patienten, die Anafranil erhielten, eine Gewichtszunahme berichtet, verglichen mit 1 % der Patienten, die Placebo erhielten. In diesen Studien hatten 28 % der Patienten, die Anafranil 25 mg erhielten, eine Gewichtszunahme von mindestens 7 % ihres anfänglichen Körpergewichts, verglichen mit 4 % der Patienten, die Placebo erhielten. Mehrere Patienten hatten eine Gewichtszunahme von mehr als 25 % ihres anfänglichen Körpergewichts. Umgekehrt hatten 5 % der Patienten, die Anafranil erhielten, und 1 % der Patienten, die Placebo erhielten, Gewichtsverluste von mindestens 7 % ihres anfänglichen Körpergewichts.
Elektroschock-Therapie
Wie bei eng verwandten trizyklischen Antidepressiva kann die gleichzeitige Verabreichung von Anafranil mit einer Elektrokrampftherapie die Risiken erhöhen; eine solche Behandlung sollte auf die Patienten beschränkt werden, für die sie unerlässlich ist, da nur begrenzte klinische Erfahrungen vorliegen.
Chirurgie
Vor einem geplanten chirurgischen Eingriff mit Vollnarkose sollte die Therapie mit Anafranil 50 mg so lange wie klinisch möglich unterbrochen und der Anästhesist informiert werden.
Anwendung bei Begleiterkrankungen
Patienten mit erheblich eingeschränkter Nierenfunktion.
Entzugserscheinungen
Im Zusammenhang mit dem abrupten Absetzen von Anafranil 50 mg wurde über eine Vielzahl von Entzugssymptomen berichtet, darunter Schwindel, Übelkeit, Erbrechen, Kopfschmerzen, Unwohlsein, Schlafstörungen, Hyperthermie und Reizbarkeit. Darüber hinaus kann es bei solchen Patienten zu einer Verschlechterung des psychiatrischen Zustands kommen. Obwohl die Entzugserscheinungen von Anafranil 10 mg nicht systematisch in kontrollierten Studien untersucht wurden, sind sie bei eng verwandten trizyklischen Antidepressiva gut bekannt, und es wird empfohlen, die Dosierung schrittweise zu verringern und den Patienten während des Absetzens sorgfältig zu überwachen (siehe Drogenmissbrauch und -abhängigkeit ).
Informationen für Patienten
Verschreibende Ärzte oder andere Angehörige der Gesundheitsberufe sollten Patienten, ihre Familien und ihre Betreuer über die Vorteile und Risiken einer Behandlung mit Clomipraminhydrochlorid informieren und sie bezüglich der angemessenen Anwendung beraten. Für Clomipraminhydrochlorid ist ein Medikationsleitfaden für Patienten über „Antidepressiva, Depressionen und andere schwere psychische Erkrankungen sowie Selbstmordgedanken oder -handlungen“ verfügbar. Der verschreibende Arzt oder medizinisches Fachpersonal sollte Patienten, ihre Familien und ihre Betreuer anweisen, den Medikationsleitfaden zu lesen, und ihnen helfen, seinen Inhalt zu verstehen. Den Patienten sollte Gelegenheit gegeben werden, den Inhalt des Medikationsleitfadens zu diskutieren und Antworten auf eventuelle Fragen zu erhalten. Der vollständige Text des Medikationsleitfadens ist am Ende dieses Dokuments abgedruckt.
Die Patienten sollten auf die folgenden Probleme hingewiesen und gebeten werden, ihren verschreibenden Arzt zu informieren, wenn diese während der Einnahme von Clomipraminhydrochlorid auftreten.
Klinische Verschlechterung und Suizidrisiko
Patienten, ihre Familien und ihre Betreuer sollten ermutigt werden, auf das Auftreten von Angstzuständen, Unruhe, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Unruhe), Hypomanie, Manie und anderen ungewöhnlichen Verhaltensänderungen zu achten , Verschlechterung von Depressionen und Suizidgedanken, besonders früh während der Behandlung mit Antidepressiva und wenn die Dosis nach oben oder unten angepasst wird. Familien und Betreuer von Patienten sollten angewiesen werden, täglich auf das Auftreten solcher Symptome zu achten, da Änderungen abrupt sein können. Solche Symptome sollten dem verschreibenden Arzt oder medizinischen Fachpersonal des Patienten gemeldet werden, insbesondere wenn sie schwerwiegend sind, abrupt einsetzen oder nicht zu den Symptomen des Patienten gehörten. Symptome wie diese können mit einem erhöhten Risiko für Suizidgedanken und -verhalten verbunden sein und weisen auf die Notwendigkeit einer sehr engmaschigen Überwachung und möglicherweise einer Änderung der Medikation hin.
Ärzten wird geraten, die folgenden Punkte mit Patienten zu besprechen, denen sie Anafranil verschreiben:
Die Patienten sollten darauf hingewiesen werden, dass die Einnahme von Anafranil eine leichte Pupillenerweiterung verursachen kann, die bei empfindlichen Personen zu einem Engwinkelglaukom führen kann. Ein vorbestehendes Glaukom ist fast immer ein Offenwinkelglaukom, da ein Engwinkelglaukom, wenn es diagnostiziert wird, definitiv mit einer Iridektomie behandelt werden kann. Das Offenwinkelglaukom ist kein Risikofaktor für das Engwinkelglaukom. Patienten möchten möglicherweise untersucht werden, um festzustellen, ob sie für Winkelverschluss anfällig sind, und sich einem prophylaktischen Verfahren (z. B. Iridektomie) unterziehen, wenn sie anfällig sind.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In zwei 2-Jahres-Bioassays an Ratten mit Dosen bis zu 100 mg/kg, was dem 24- bzw. 4-fachen der maximal empfohlenen Tagesdosis beim Menschen (MRHD) auf mg/kg- bzw. mg/m²-Basis entspricht, wurden keine Hinweise auf Karzinogenität gefunden oder in einem 2-Jahres-Bioassay an Mäusen in Dosen von bis zu 80 mg/kg, was dem 20- bzw. 1,5-fachen der MRHD auf mg/kg- bzw. mg/m²-Basis entspricht.
In Reproduktionsstudien wurden bei Ratten, denen bis zu 24 mg/kg verabreicht wurden, keine Auswirkungen auf die Fertilität festgestellt, was dem 6-fachen und ungefähr dem MRHD auf mg/kg- bzw. mg/m²-Basis entspricht.
Schwangerschaftskategorie C
Keine teratogenen Wirkungen wurden in Studien an Ratten und Mäusen bei Dosen bis zu 100 mg/kg beobachtet, was dem 24-Fachen der maximal empfohlenen Tagesdosis beim Menschen (MRHD) auf mg/kg-Basis und dem 4-Fachen (Ratten) und dem 2-Fachen ( Mäuse) die MRHD auf mg/m²-Basis. Leichte unspezifische embryo-/fetotoxische Wirkungen wurden bei den Nachkommen von behandelten Ratten, die 50 und 100 mg/kg erhielten, und von behandelten Mäusen, die 100 mg/kg erhielten, beobachtet.
Es liegen keine adäquaten oder gut kontrollierten Studien bei Schwangeren vor. Bei Neugeborenen, deren Mütter Anafranil 50 mg bis zur Entbindung eingenommen hatten, wurde über Entzugserscheinungen wie Nervosität, Zittern und Krampfanfälle berichtet. Anafranil 10 mg sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Stillende Mutter
Anafranil wurde in der Muttermilch gefunden. Wegen möglicher Nebenwirkungen sollte unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter entschieden werden, ob das Stillen beendet oder das Medikament abgesetzt werden soll.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit bei Kindern und Jugendlichen mit Ausnahme von pädiatrischen Patienten mit Zwangsstörungen wurde nicht nachgewiesen (siehe KASTENWARNUNG und WARNUNGEN , Klinische Verschlechterung und Suizidrisiko ). Jeder, der die Anwendung von Anafranil bei einem Kind oder Jugendlichen in Betracht zieht, muss die potenziellen Risiken mit der klinischen Notwendigkeit abwägen.
In einer kontrollierten klinischen Studie mit Kindern und Jugendlichen (im Alter von 10 bis 17 Jahren) erhielten 46 ambulante Patienten Anafranil 50 mg für bis zu 8 Wochen. Darüber hinaus haben 150 jugendliche Patienten Anafranil 10 mg in offenen Protokollen über Zeiträume von mehreren Monaten bis zu mehreren Jahren erhalten. Von den 196 untersuchten Jugendlichen waren 50 13 Jahre oder jünger und 146 14 bis 17 Jahre alt. Das Nebenwirkungsprofil in dieser Altersgruppe (vgl NEBENWIRKUNGEN ) ist ähnlich wie bei Erwachsenen.
Die Risiken, die gegebenenfalls mit der ausgedehnten Anwendung von Anafranil bei Kindern und Jugendlichen mit Zwangsstörungen verbunden sind, wurden nicht systematisch bewertet. Die Belege für die Schlussfolgerung, dass Anafranil 50 mg für die Anwendung bei Kindern und Jugendlichen sicher ist, stammen aus relativ kurzfristigen klinischen Studien und aus der Extrapolation von Erfahrungen mit erwachsenen Patienten. Insbesondere gibt es keine Studien, die die Wirkungen einer Langzeitanwendung von Anafranil 25 mg auf das Wachstum, die Entwicklung und die Reifung von Kindern und Jugendlichen direkt bewerten. Obwohl es keine Hinweise darauf gibt, dass Anafranil 10 mg das Wachstum, die Entwicklung oder die Reifung negativ beeinflusst, reicht das Fehlen solcher Befunde nicht aus, um ein Potenzial für solche Auswirkungen bei chronischer Anwendung auszuschließen.
Die Sicherheit und Wirksamkeit bei pädiatrischen Patienten unter 10 Jahren wurde nicht nachgewiesen. Daher können keine spezifischen Empfehlungen für die Anwendung von Anafranil bei pädiatrischen Patienten unter 10 Jahren gegeben werden.
Geriatrische Verwendung
Klinische Studien mit Anafranil 50 mg schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagieren als jüngere Probanden; 152 Patienten im Alter von mindestens 60 Jahren, die an verschiedenen klinischen Studien in den USA teilnahmen, erhielten Anafranil über einen Zeitraum von mehreren Monaten bis zu mehreren Jahren. In dieser Population wurden keine ungewöhnlichen altersbedingten unerwünschten Ereignisse festgestellt. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
Anafranil wurde mit Fällen von klinisch signifikanter Hyponatriämie in Verbindung gebracht. Ältere Patienten können ein höheres Risiko für diese Nebenwirkung haben (siehe VORSICHTSMASSNAHMEN , Hyponatriämie ).
ÜBERDOSIS
Todesfälle können durch Überdosierung mit dieser Klasse von Medikamenten auftreten. Die Einnahme mehrerer Drogen (einschließlich Alkohol) ist bei einer absichtlichen trizyklischen Überdosierung üblich. Da die Behandlung komplex ist und sich ändert, wird empfohlen, dass sich der Arzt an eine Giftinformationszentrale wendet, um aktuelle Informationen zur Behandlung zu erhalten. Anzeichen und Symptome einer Toxizität entwickeln sich schnell nach trizyklischer Überdosierung. Daher ist eine schnellstmögliche Überwachung im Krankenhaus erforderlich.
Menschliche Erfahrung
In klinischen Studien in den USA traten 2 Todesfälle in 12 gemeldeten Fällen einer akuten Überdosierung mit Anafranil entweder allein oder in Kombination mit anderen Arzneimitteln auf. Ein Todesfall betraf einen Patienten, der verdächtigt wurde, eine Dosis von 7000 mg eingenommen zu haben. Der zweite Todesfall betraf einen Patienten, der verdächtigt wurde, eine Dosis von 5750 mg eingenommen zu haben. Die 10 nicht tödlichen Fälle betrafen Dosen von bis zu 5000 mg, begleitet von Plasmaspiegeln von bis zu 1010 ng/ml. Alle 10 Patienten erholten sich vollständig. Unter Berichten aus anderen Ländern über eine Überdosierung mit Anafranil betrug die niedrigste mit einem Todesfall verbundene Dosis 750 mg. Basierend auf Postmarketing-Berichten im Vereinigten Königreich wird die Letalität von CMI bei Überdosierung als ähnlich angesehen wie die für eng verwandte trizyklische Verbindungen, die als Antidepressiva vermarktet werden.
Manifestationen
Die Schwere der Anzeichen und Symptome variiert in Abhängigkeit von Faktoren wie der aufgenommenen Arzneimittelmenge, dem Alter des Patienten und der seit der Arzneimitteleinnahme verstrichenen Zeit. Zu den kritischen Manifestationen einer Überdosierung gehören Herzrhythmusstörungen, schwere Hypotonie, Krämpfe und ZNS-Depression einschließlich Koma. Veränderungen im Elektrokardiogramm, insbesondere in der QRS-Achse oder -Breite, sind klinisch signifikante Indikatoren für eine trizyklische Toxizität. Andere ZNS-Manifestationen können Schläfrigkeit, Benommenheit, Ataxie, Ruhelosigkeit, Agitiertheit, Delirium, starkes Schwitzen, hyperaktive Reflexe, Muskelstarre und athetoide und choreiforme Bewegungen umfassen. Herzanomalien können Tachykardie, Anzeichen einer dekompensierten Herzinsuffizienz und in sehr seltenen Fällen Herzstillstand umfassen. Atemdepression, Zyanose, Schock, Erbrechen, Hyperpyrexie, Mydriasis und Oligurie oder Anurie können ebenfalls vorhanden sein.
Management
Erhalten Sie ein EKG und leiten Sie sofort eine Herzüberwachung ein. Schützen Sie die Atemwege des Patienten, legen Sie einen intravenösen Zugang an und leiten Sie eine Magendekontamination ein. Eine mindestens 6-stündige Beobachtung mit Herzüberwachung und Beobachtung auf Anzeichen von ZNS- oder Atemdepression, Hypotonie, Herzrhythmusstörungen und/oder Reizleitungsblockaden und Krampfanfällen ist erforderlich.
Wenn zu irgendeinem Zeitpunkt während dieses Zeitraums Anzeichen einer Toxizität auftreten, ist eine erweiterte Überwachung erforderlich. Es gibt Fallberichte von Patienten, die spät nach einer Überdosierung tödlichen Rhythmusstörungen erlagen; Diese Patienten hatten klinische Anzeichen einer signifikanten Vergiftung vor dem Tod und die meisten erhielten eine unzureichende Magen-Darm-Dekontamination. Die Überwachung der Arzneimittelspiegel im Plasma sollte nicht das Management des Patienten leiten.
Magen-Darm-Dekontamination
Alle Patienten mit Verdacht auf trizyklische Überdosierung sollten eine gastrointestinale Dekontamination erhalten. Dies sollte eine großvolumige Magenspülung gefolgt von Aktivkohle umfassen. Bei Bewusstseinsstörungen sollten die Atemwege vor der Spülung gesichert werden. Erbrechen ist kontraindiziert.
Herz-Kreislauf
Eine maximale Extremitäten-Ableitungs-QRS-Dauer von ≥ 0,10 Sekunden kann der beste Hinweis auf die Schwere der Überdosierung sein. Natriumbicarbonat sollte intravenös verabreicht werden, um den Serum-pH-Wert im Bereich von 7,45 bis 7,55 zu halten. Wenn die pH-Reaktion unzureichend ist, kann auch Hyperventilation verwendet werden. Die gleichzeitige Anwendung von Hyperventilation und Natriumbikarbonat sollte mit äußerster Vorsicht und häufiger pH-Überwachung erfolgen. Ein pH > 7,60 oder ein pCO2
In seltenen Fällen kann die Hämoperfusion bei akuter refraktärer kardiovaskulärer Instabilität bei Patienten mit akuter Toxizität von Vorteil sein. Allerdings wurde berichtet, dass Hämodialyse, Peritonealdialyse, Austauschtransfusionen und forcierte Diurese im Allgemeinen bei trizyklischen Vergiftungen unwirksam sind.
ZNS
Bei Patienten mit ZNS-Depression wird wegen der Möglichkeit einer abrupten Verschlechterung eine frühzeitige Intubation empfohlen. Krampfanfälle sollten mit Benzodiazepinen oder, falls diese unwirksam sind, anderen Antikonvulsiva (z. B. Phenobarbital, Phenytoin) kontrolliert werden. Physostigmin wird nicht empfohlen, außer zur Behandlung von lebensbedrohlichen Symptomen, die auf andere Therapien nicht angesprochen haben, und dann nur in Absprache mit einem Giftinformationszentrum.
Psychiatrische Nachsorge
Da eine Überdosierung oft vorsätzlich erfolgt, können Patienten während der Genesungsphase einen Suizidversuch auf andere Weise unternehmen. Eine psychiatrische Überweisung kann angebracht sein.
Pädiatrisches Management
Die Grundsätze der Behandlung von Überdosierungen bei Kindern und Erwachsenen sind ähnlich. Es wird dringend empfohlen, dass sich der Arzt für eine spezifische pädiatrische Behandlung an das örtliche Giftinformationszentrum wendet.
KONTRAINDIKATIONEN
Anafranil ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegenüber Anafranil 25 mg oder anderen trizyklischen Antidepressiva.
Monoaminoxidase-Hemmer (MAO-Hemmer)
Die Anwendung von MAO-Hemmern zur Behandlung psychiatrischer Erkrankungen mit Anafranil oder innerhalb von 14 Tagen nach Beendigung der Behandlung mit Anafranil ist aufgrund eines erhöhten Risikos für ein Serotonin-Syndrom kontraindiziert. Die Anwendung von Anafranil 10 mg innerhalb von 14 Tagen nach Absetzen eines MAO-Hemmers zur Behandlung psychiatrischer Erkrankungen ist ebenfalls kontraindiziert (siehe WARNUNGEN und DOSIERUNG UND ANWENDUNG ).
Die Einleitung von Anafranil bei einem Patienten, der mit Linezolid oder intravenösem Methylenblau behandelt wird, ist ebenfalls kontraindiziert, da ein erhöhtes Risiko für ein Serotonin-Syndrom besteht (siehe Abschnitt 4.4). WARNUNGEN und DOSIERUNG UND ANWENDUNG ).
Herzinfarkt
Anafranil ist während der akuten Erholungsphase nach einem Myokardinfarkt kontraindiziert.
KLINISCHE PHARMAKOLOGIE
Pharmakodynamik
Es wird angenommen, dass Clomipramin (CMI) obsessives und zwanghaftes Verhalten durch seine Wirkung auf die serotonerge neuronale Übertragung beeinflusst. Der eigentliche neurochemische Mechanismus ist unbekannt, aber es wird angenommen, dass die Fähigkeit von CMI, die Wiederaufnahme von Serotonin (5-HT) zu hemmen, wichtig ist.
Pharmakokinetik
Resorption/Bioverfügbarkeit
CMI aus Anafranil 25 mg Kapseln ist genauso bioverfügbar wie CMI aus einer Lösung. Die Bioverfügbarkeit von CMI aus Kapseln wird durch Nahrung nicht wesentlich beeinflusst.
In einer Dosisproportionalitätsstudie mit mehreren CMI-Dosen waren Steady-State-Plasmakonzentrationen (Css) und Fläche-unter-Plasma-Konzentrations-Zeit-Kurven (AUC) von CMI und des aktiven Hauptmetaboliten von CMI, Desmethylclomipramin (DMI), nicht proportional zur Dosis über die bewerteten Bereiche, dh zwischen 25 bis 100 mg/Tag und zwischen 25 bis 150 mg/Tag, obwohl Css und AUC ungefähr linear mit der Dosis zwischen 100 bis 150 mg/Tag zusammenhängen. Die Beziehung zwischen Dosis und CMI/DMI-Konzentrationen bei höheren Tagesdosen wurde nicht systematisch untersucht, aber wenn eine signifikante Dosisabhängigkeit bei Dosen über 150 mg/Tag besteht, besteht das Potenzial für dramatisch höhere Css und AUC, selbst bei Patienten, denen eine Dosis innerhalb von empfohlener Bereich. Dies kann für einige Patienten ein potenzielles Risiko darstellen (siehe WARNUNGEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
Nach einer oralen Einzeldosis von 50 mg treten maximale Plasmakonzentrationen von CMI innerhalb von 2 bis 6 Stunden (Mittelwert 4,7 h) auf und liegen im Bereich von 56 ng/ml bis 154 ng/ml (Mittelwert 92 ng/ml). Nach mehrfacher täglicher Gabe von 150 mg Anafranil 25 mg reichen die maximalen Plasmakonzentrationen im Steady State von 94 ng/ml bis 339 ng/ml (Mittelwert 218 ng/ml) für CMI und von 134 ng/ml bis 532 ng/ml ( Mittelwert 274 ng/ml) für DMI. Zusätzliche Informationen aus einer Studie mit steigender Dosis von Dosen bis zu 250 mg deuten darauf hin, dass DMI über den üblichen Dosierungsbereich hinweg möglicherweise eine nichtlineare Pharmakokinetik aufweist. Bei einer Anafranil-Dosis von 200 mg wiesen Probanden, denen etwa 9 bis 22 Stunden (Median 16 Stunden) nach der Dosis eine einzelne Blutprobe entnommen wurde, Plasmakonzentrationen von bis zu 605 ng/ml für CMI und 781 ng/ml für DMI auf und 1386 ng/ml für beide.
Verteilung
CMI verteilt sich in die Zerebrospinalflüssigkeit (CSF) und das Gehirn sowie in die Muttermilch. DMI verteilt sich auch im Liquor mit einem mittleren Liquor/Plasma-Verhältnis von 2,6. Die Proteinbindung von CMI beträgt ungefähr 97 %, hauptsächlich an Albumin, und ist unabhängig von der CMI-Konzentration. Die Wechselwirkung zwischen CMI und anderen stark proteingebundenen Arzneimitteln wurde nicht vollständig untersucht, kann aber wichtig sein (siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
Stoffwechsel
CMI wird umfassend zu DMI und anderen Metaboliten und ihren Glucuronid-Konjugaten biotransformiert. DMI ist pharmakologisch aktiv, aber seine Auswirkungen auf Zwangsstörungen sind unbekannt. Diese Metaboliten werden nach biliärer Ausscheidung mit Urin und Kot ausgeschieden. Nach einer radioaktiv markierten Dosis von 25 mg CMI bei zwei Probanden wurden 60 % bzw. 51 % der Dosis im Urin und 32 % bzw. 24 % im Stuhl wiedergefunden. In derselben Studie betrug die kombinierte Wiederfindung von CMI und DMI im Urin nur etwa 0,8 % bis 1,3 % der verabreichten Dosis. CMI induziert keine arzneimittelmetabolisierenden Enzyme, gemessen anhand der Antipyrin-Halbwertszeit.
Beseitigung
Hinweise darauf, dass die Css und AUC für CMI und DMI mit steigenden oralen Dosen überproportional ansteigen können, deuten darauf hin, dass der Metabolismus von CMI und DMI möglicherweise kapazitätsbeschränkt ist. Diese Tatsache muss bei der Beurteilung der unten angegebenen Schätzungen der pharmakokinetischen Parameter berücksichtigt werden, da diese bei Personen ermittelt wurden, die Dosen von 150 mg ausgesetzt waren. Wenn die Pharmakokinetik von CMI und DMI bei Dosen über 150 mg nichtlinear ist, können ihre Eliminationshalbwertszeiten bei Dosen am oberen Ende des empfohlenen Dosierungsbereichs (dh 200 mg/Tag bis 250 mg/Tag) erheblich verlängert werden. Folglich können CMI und DMI akkumulieren, und diese Akkumulation kann das Auftreten von dosis- oder plasmakonzentrationsabhängigen Nebenwirkungen, insbesondere Krampfanfällen, erhöhen (siehe WARNUNGEN ).
Nach einer Dosis von 150 mg reicht die Halbwertszeit von CMI von 19 Stunden bis 37 Stunden (Mittelwert 32 Stunden) und die von DMI von 54 Stunden bis 77 Stunden (Mittelwert 69 Stunden). Steady-State-Spiegel nach Mehrfachdosierung werden bei CMI typischerweise innerhalb von 7 bis 14 Tagen erreicht. Die Plasmakonzentrationen des Metaboliten übersteigen die Ausgangssubstanz bei Mehrfachdosierung. Nach Mehrfachgabe von 150 mg/Tag beträgt der Akkumulationsfaktor für CMI etwa 2,5 und für DMI 4,6. Wichtig ist, dass es aufgrund der relativ langen Eliminationshalbwertszeit von CMI und DMI zwei Wochen oder länger dauern kann, bis dieses Ausmaß der Akkumulation bei konstanter Dosierung erreicht ist (siehe DOSIERUNG UND ANWENDUNG ). Die Auswirkungen einer Leber- und Nierenfunktionsstörung auf die Disposition von Anafranil wurden nicht bestimmt.
Interaktionen
Die gleichzeitige Anwendung von Haloperidol mit CMI erhöht die Plasmakonzentrationen von CMI. Die gleichzeitige Verabreichung von CMI mit Phenobarbital erhöht die Plasmakonzentrationen von Phenobarbital (siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ). Jüngere Probanden (im Alter von 18 bis 40 Jahren) vertrugen CMI besser und hatten im Vergleich zu Probanden über 65 Jahren signifikant niedrigere Steady-State-Plasmakonzentrationen. Kinder unter 15 Jahren hatten im Vergleich zu Erwachsenen signifikant niedrigere Plasmakonzentration/Dosis-Verhältnisse. Die Plasmakonzentrationen von CMI waren bei Rauchern signifikant niedriger als bei Nichtrauchern.
INFORMATIONEN ZUM PATIENTEN
Anafranil™ (Clomipraminhydrochlorid) Kapseln USP
Antidepressiva, Depressionen und andere schwere psychische Erkrankungen sowie Selbstmordgedanken oder -handlungen
Lesen Sie den Medikationsleitfaden, der mit dem Antidepressivum von Ihnen oder Ihrem Familienmitglied geliefert wird. In diesem Medikationsleitfaden geht es nur um das Risiko von Selbstmordgedanken und -handlungen mit Antidepressiva. Sprechen Sie mit Ihrem Gesundheitsdienstleister oder dem Ihres Familienmitglieds über:
Was sind die wichtigsten Informationen, die ich über Antidepressiva, Depressionen und andere schwere psychische Erkrankungen sowie Selbstmordgedanken oder -handlungen wissen sollte?
1. Antidepressiva können bei manchen Kindern, Teenagern und jungen Erwachsenen in den ersten Behandlungsmonaten Suizidgedanken oder -handlungen verstärken.
2. Depressionen und andere schwere psychische Erkrankungen sind die wichtigsten Ursachen für Selbstmordgedanken und -handlungen. Bei manchen Menschen besteht ein besonders hohes Risiko für Suizidgedanken oder -handlungen. Dazu gehören Menschen, die eine bipolare Erkrankung (auch manisch-depressive Erkrankung genannt) oder Suizidgedanken oder -handlungen haben (oder in deren Familienanamnese aufgetreten sind).
3. Wie kann ich Suizidgedanken und -handlungen bei mir oder einem Familienmitglied beobachten und versuchen zu verhindern?
Rufen Sie sofort einen Arzt an, wenn Sie oder Ihr Familienmitglied eines der folgenden Symptome haben, insbesondere wenn sie neu oder schlimmer sind oder Sie beunruhigen:
Niedriger Salz- (Natrium-)Spiegel im Blut. Ältere Menschen sind möglicherweise einem höheren Risiko ausgesetzt. Zu den Symptomen können gehören:
Visuelle Probleme
Nur einige Menschen sind für diese Probleme gefährdet. Möglicherweise möchten Sie sich einer Augenuntersuchung unterziehen, um festzustellen, ob Sie gefährdet sind, und eine vorbeugende Behandlung erhalten, wenn dies der Fall ist.
Wer sollte Anafranil nicht einnehmen?
Nehmen Sie Anafranil nicht ein, wenn Sie:
Was muss ich sonst noch über Antidepressiva wissen?
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.