Buspar 5mg, 10mg Buspirone Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Buspar und wie wird es angewendet?
Buspar 5 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Angststörungen. Buspar 5 mg kann allein oder mit anderen Medikamenten verwendet werden.
Buspar gehört zu einer Klasse von Medikamenten, die Antiangstmittel, Anxiolytika, Nichtbenzodiazepine genannt werden.
Welche Nebenwirkungen kann Buspar haben?
Welche Nebenwirkungen kann Buspar 5mg haben?
Buspar kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Buspar gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Buspar. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Buspironhydrochlorid-Tabletten, USP, sind ein Antiangstmittel, das chemisch oder pharmakologisch nicht mit Benzodiazepinen, Barbituraten oder anderen Beruhigungsmitteln/Anxiolytika verwandt ist.
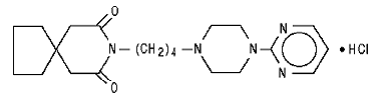
Buspironhydrochlorid, USP ist ein weißes kristallines Pulver. Es ist sehr gut wasserlöslich; frei löslich in Methanol und in Methylenchlorid; schwer löslich in Ethanol und Acetonitril; sehr wenig löslich in Ethylacetat und praktisch unlöslich in Hexanen. Sein Molekulargewicht beträgt 422. Buspironhydrochlorid ist chemisch 8-[4-[4-(2-Pyrimidinyl)-1-piperazinyl]butyl]-8-azaspiro[4.5]decan-7,9-dionmonohydrochlorid. Die Summenformel C21H31N5O2·HCl wird durch die folgende Strukturformel dargestellt:
Jede zur oralen Verabreichung bestimmte Buspironhydrochlorid-Tablette enthält 5 mg oder 10 mg oder 15 mg oder 30 mg Buspironhydrochlorid (entsprechend 4,6 mg, 9,1 mg, 13,7 mg bzw. 27,4 mg der freien Base von Buspiron). Darüber hinaus enthält jede Tablette die folgenden Hilfsstoffe: kolloidales Siliciumdioxid, Lactose-Monohydrat, Magnesiumstearat, mikrokristalline Cellulose und Natriumstärkeglykolat. Die 5-mg- und 10-mg-Tabletten sind eingekerbt, sodass sie halbiert werden können. Somit kann die 5-mg-Tablette auch eine 2,5-mg-Dosis bereitstellen, und die 10-mg-Tablette kann eine 5-mg-Dosis bereitstellen. Die 15-mg- und 30-mg-Tabletten sind eingekerbt, sodass sie entweder halbiert oder dreigeteilt werden können. Somit kann eine einzelne 15-mg-Tablette die folgenden Dosen bereitstellen: 15 mg (ganze Tablette), 10 mg (zwei Drittel einer Tablette), 7,5 mg (eine halbe Tablette) oder 5 mg (ein Drittel einer Tablette). . Eine einzelne 30-mg-Tablette kann die folgenden Dosen enthalten: 30 mg (ganze Tablette), 20 mg (zwei Drittel einer Tablette), 15 mg (eine halbe Tablette) oder 10 mg (ein Drittel einer Tablette).
INDIKATIONEN
Buspironhydrochlorid-Tabletten sind angezeigt zur Behandlung von Angststörungen oder zur kurzzeitigen Linderung von Angstsymptomen. Angst oder Anspannung im Zusammenhang mit dem Stress des Alltags erfordern in der Regel keine Behandlung mit einem Anxiolytikum.
Die Wirksamkeit von Buspironhydrochlorid-Tabletten wurde in kontrollierten klinischen Studien an ambulanten Patienten nachgewiesen, deren Diagnose in etwa der generalisierten Angststörung (GAD) entspricht. Viele der in diese Studien aufgenommenen Patienten hatten auch gleichzeitig bestehende depressive Symptome, und Buspironhydrochlorid-Tabletten linderten die Angst bei Vorliegen dieser gleichzeitig bestehenden depressiven Symptome. Die in diesen Studien untersuchten Patienten hatten vor der Studie über Zeiträume von 1 Monat bis über 1 Jahr Symptome mit einer durchschnittlichen Symptomdauer von 6 Monaten. Generalisierte Angststörung (300.02) wird im Diagnostic and Statistical Manual III1 der American Psychiatric Association wie folgt beschrieben:
Generalisierte, anhaltende Angst (von mindestens 1 Monat ununterbrochener Dauer), die sich durch Symptome aus drei der vier folgenden Kategorien manifestiert:
Motorspannung
Zittern, Nervosität, Sprunghaftigkeit, Zittern, Anspannung, Muskelschmerzen, Ermüdbarkeit, Unfähigkeit sich zu entspannen, Augenlidzucken, gerunzelte Stirn, angespanntes Gesicht, Zappeln, Unruhe, leichtes Erschrecken.
Autonome Hyperaktivität
Schwitzen, Herzklopfen oder -rasen, Erkältung, feuchte Hände, Mundtrockenheit, Schwindel, Benommenheit, Parästhesien (Kribbeln in Händen oder Füßen), Magenverstimmung, Hitze- oder Kälteanfälle, häufiges Wasserlassen, Durchfall, Beschwerden in der Magengrube, Knoten im Hals, Hitzewallungen, Blässe, hoher Ruhepuls und hohe Atemfrequenz.
Besorgte Erwartung
Angst, Sorge, Angst, Grübeln und Erwartung von Unglück für sich selbst oder andere.
Wachsamkeit und Scannen
Hyperaufmerksamkeit, die zu Ablenkbarkeit, Konzentrationsschwierigkeiten, Schlaflosigkeit, Nervosität, Reizbarkeit, Ungeduld führt.
Die oben genannten Symptome würden nicht auf eine andere psychische Störung, wie z. B. eine depressive Störung oder Schizophrenie, zurückzuführen sein. Leichte depressive Symptome sind jedoch bei GAD häufig.
Die Wirksamkeit von Buspironhydrochlorid-Tabletten bei Langzeitanwendung, d. h. länger als 3 bis 4 Wochen, wurde in kontrollierten Studien nicht nachgewiesen. Es gibt keine verfügbare Evidenz, die sich systematisch mit der angemessenen Behandlungsdauer für GAD befasst. In einer Langzeitanwendungsstudie wurden jedoch 264 Patienten 1 Jahr lang ohne Nebenwirkungen mit Buspironhydrochlorid-Tabletten behandelt. Daher sollte der Arzt, der sich für die Anwendung von Buspironhydrochlorid-Tabletten über einen längeren Zeitraum entscheidet, den Nutzen des Arzneimittels für den einzelnen Patienten regelmäßig neu bewerten.
DOSIERUNG UND ANWENDUNG
Die empfohlene Anfangsdosis beträgt 15 mg täglich (7,5 mg 2-mal täglich). Um ein optimales therapeutisches Ansprechen zu erzielen, kann die Dosis je nach Bedarf in Abständen von 2 bis 3 Tagen um 5 mg pro Tag erhöht werden. Die maximale Tagesdosis sollte 60 mg pro Tag nicht überschreiten. In klinischen Studien, die eine Dosistitration ermöglichten, wurden üblicherweise geteilte Dosen von 20 mg bis 30 mg pro Tag angewendet.
Die Bioverfügbarkeit von Buspiron ist bei Einnahme mit Nahrung im Vergleich zum nüchternen Zustand erhöht (vgl KLINISCHE PHARMAKOLOGIE ). Folglich sollten Patienten Buspiron hinsichtlich des Dosierungszeitpunkts konsequent einnehmen; Entweder immer mit oder immer ohne Essen.
Wenn Buspiron zusammen mit einem potenten CYP3A4-Inhibitor verabreicht werden soll, gelten die Dosierungsempfehlungen, die in beschrieben sind WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN Abschnitt befolgt werden.
WIE GELIEFERT
Buspironhydrochlorid-Tabletten USP, 5 mg sind weiße bis cremefarbene, kapselförmige, flache Tabletten mit abgeschrägten Kanten und halbierter Prägung auf einer Seite; Eine Seite der Halbierung ist mit „ZE“ geprägt, die andere mit „36“ und die andere Seite ist glatt
Angaben zum Hersteller: N/A. Überarbeitet: Mai 2016
NEBENWIRKUNGEN
Keine Informationen bereitgestellt.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Psychotrope Wirkstoffe
MAO-Hemmer
Es wird empfohlen, Buspironhydrochlorid-Tabletten nicht gleichzeitig mit MAO-Hemmern einzunehmen (siehe WARNUNGEN ).
Amitriptylin
Nach Zugabe von Buspiron zum Amitriptylin-Dosierungsschema wurden keine statistisch signifikanten Unterschiede in den Steady-State-Pharmakokinetikparametern (Cmax, AUC und Cmin) von Amitriptylin oder seinem Metaboliten Nortriptylin beobachtet.
Diazepam
Nach Zugabe von Buspiron zum Diazepam-Dosierungsschema wurden für Diazepam keine statistisch signifikanten Unterschiede in den pharmakokinetischen Steady-State-Parametern (Cmax, AUC und Cmin) beobachtet, aber für Nordiazepam wurden Anstiege von etwa 15 % und geringfügige unerwünschte klinische Wirkungen beobachtet (Schwindel, Kopfschmerzen und Übelkeit) wurden beobachtet.
Haloperidol
In einer Studie mit gesunden Freiwilligen führte die gleichzeitige Verabreichung von Buspiron und Haloperidol zu erhöhten Haloperidol-Konzentrationen im Serum. Die klinische Bedeutung dieses Befundes ist nicht klar.
Nefazodon
[sehen Inhibitoren und Induktoren von Cytochrom P450 3A4 (CYP3A4) ].
Trazodon
Es gibt einen Bericht, der darauf hindeutet, dass die gleichzeitige Anwendung von Desyrel®# (Trazodonhydrochlorid) und Buspiron bei einigen Patienten zu 3- bis 6-fachen Erhöhungen der SGPT (ALT) geführt haben könnte. In einer ähnlichen Studie, in der versucht wurde, diesen Befund zu replizieren, wurde keine Wechselwirkung mit hepatischen Transaminasen festgestellt.
Triazolam/Flurazepam
Die gleichzeitige Verabreichung von Buspiron mit entweder Triazolam oder Flurazepam schien die sedierende Wirkung von keinem der Benzodiazepine zu verlängern oder zu verstärken.
Andere Psychopharmaka
Da die Wirkungen der gleichzeitigen Verabreichung von Buspiron mit den meisten anderen Psychopharmaka nicht untersucht wurden, sollte die gleichzeitige Anwendung von Buspiron mit anderen ZNS-aktiven Arzneimitteln mit Vorsicht angegangen werden.
Inhibitoren und Induktoren von Cytochrom P450 3A4 (CYP3A4)
In vitro wurde gezeigt, dass Buspiron durch CYP3A4 metabolisiert wird. Dieser Befund steht im Einklang mit den in vivo beobachteten Wechselwirkungen zwischen Buspiron und den folgenden:
Diltiazem und Verapamil
In einer Studie mit neun gesunden Freiwilligen erhöhte die gleichzeitige Verabreichung von Buspiron (10 mg als Einzeldosis) mit Verapamil (80 mg dreimal täglich) oder Diltiazem (60 mg dreimal täglich) die Buspiron-Plasmakonzentrationen (Verapamil erhöhte die AUC und Cmax von Buspiron um das 3,4-Fache, während Diltiazem erhöhte AUC und Cmax um das 5,5-Fache bzw. 4-Fache.) Nebenwirkungen, die auf Buspiron zurückzuführen sind, können bei gleichzeitiger Verabreichung mit entweder Diltiazem oder Verapamil wahrscheinlicher sein. Eine spätere Dosisanpassung kann erforderlich sein und sollte auf der Grundlage einer klinischen Beurteilung erfolgen.
Erythromycin
In einer Studie mit gesunden Probanden erhöhte die gleichzeitige Verabreichung von Buspiron (10 mg als Einzeldosis) mit Erythromycin (1,5 g/Tag über 4 Tage) die Plasmakonzentrationen von Buspiron (5-facher Anstieg der Cmax und 6-facher Anstieg der AUC). Diese pharmakokinetischen Wechselwirkungen wurden von einer erhöhten Inzidenz von Nebenwirkungen begleitet, die auf Buspiron zurückzuführen sind. Wenn die beiden Medikamente in Kombination angewendet werden sollen, wird eine niedrige Buspiron-Dosis (z. B. 2,5 mg zweimal täglich) empfohlen. Die nachfolgende Dosisanpassung beider Arzneimittel sollte auf der Grundlage einer klinischen Beurteilung erfolgen.
Grapefruitsaft
In einer Studie mit gesunden Probanden erhöhte die gleichzeitige Verabreichung von Buspiron (10 mg als Einzeldosis) mit Grapefruitsaft (200 ml doppelte Dosis dreimal täglich für 2 Tage) die Buspiron-Plasmakonzentrationen (4,3-facher Anstieg der Cmax; 9,2-facher Anstieg der AUC). ). Patienten, die Buspiron erhalten, sollte geraten werden, das Trinken von so großen Mengen Grapefruitsaft zu vermeiden.
Itraconazol
In einer Studie mit gesunden Freiwilligen erhöhte die gleichzeitige Verabreichung von Buspiron (10 mg als Einzeldosis) mit Itraconazol (200 mg/Tag über 4 Tage) die Plasmakonzentrationen von Buspiron (13-fache Erhöhung der Cmax und 19-fache Erhöhung der AUC). Diese pharmakokinetischen Wechselwirkungen wurden von einer erhöhten Inzidenz von Nebenwirkungen begleitet, die auf Buspiron zurückzuführen sind. Wenn die beiden Medikamente in Kombination angewendet werden sollen, wird eine niedrige Buspiron-Dosis (z. B. 2,5 mg qd) empfohlen. Die nachfolgende Dosisanpassung beider Arzneimittel sollte auf der Grundlage einer klinischen Beurteilung erfolgen.
Nefazodon
In einer Studie zur Steady-State-Pharmakokinetik bei gesunden Probanden führte die gleichzeitige Verabreichung von Buspiron (2,5 oder 5 mg zweimal täglich) mit Nefazodon (250 mg zweimal täglich) zu einem deutlichen Anstieg der Buspiron-Plasmakonzentrationen (Anstiege bis zum 20-fachen von Cmax und bis zu 50 -Fache der AUC) und statistisch signifikante Abnahmen (etwa 50 %) der Plasmakonzentrationen des Buspiron-Metaboliten 1-PP. Bei 2-mal täglicher Gabe von 5 mg Buspiron wurden leichte Anstiege der AUC für Nefazodon (23 %) und seine Metaboliten Hydroxynefazodon (HO-NEF) (17 %) und meta-Chlorphenylpiperazin (9 %) beobachtet. Für Nefazodon (8 %) und seinen Metaboliten HO-NEF (11 %) wurden leichte Anstiege der Cmax beobachtet.
Bei Patienten, die Buspiron 5 mg zweimal täglich und Nefazodon 250 mg zweimal täglich erhielten, traten Benommenheit, Asthenie, Schwindel und Schläfrigkeit auf, Nebenwirkungen, die auch mit beiden Arzneimitteln allein beobachtet wurden. Wenn die beiden Medikamente in Kombination angewendet werden sollen, wird eine niedrige Buspiron-Dosis (z. B. 2,5 mg qd) empfohlen. Die nachfolgende Dosisanpassung beider Arzneimittel sollte auf der Grundlage einer klinischen Beurteilung erfolgen.
Rifampin
In einer Studie mit gesunden Probanden verringerte die gleichzeitige Verabreichung von Buspiron (30 mg als Einzeldosis) mit Rifampin (600 mg/Tag für 5 Tage) die Plasmakonzentrationen (83,7 % Abnahme der Cmax; 89,6 % Abnahme der AUC) und die pharmakodynamischen Wirkungen von Buspiron. Wenn die beiden Arzneimittel in Kombination verwendet werden sollen, muss die Dosierung von Buspiron möglicherweise angepasst werden, um die anxiolytische Wirkung aufrechtzuerhalten.
Andere Inhibitoren und Induktoren von CYP3A4
Substanzen, die CYP3A4 hemmen, wie Ketoconazol oder Ritonavir, können den Metabolismus von Buspiron hemmen und die Plasmakonzentrationen von Buspiron erhöhen, während Substanzen, die CYP3A4 induzieren, wie Dexamethason oder bestimmte Antikonvulsiva (Phenytoin, Phenobarbital, Carbamazepin), die Metabolisierungsrate von Buspiron erhöhen können. Wenn ein Patient auf eine stabile Dosis von Buspiron titriert wurde, kann eine Dosisanpassung von Buspiron erforderlich sein, um Nebenwirkungen zu vermeiden, die auf Buspiron oder eine verminderte anxiolytische Aktivität zurückzuführen sind. Daher wird bei gleichzeitiger Verabreichung mit einem potenten CYP3A4-Inhibitor eine vorsichtige Anwendung einer niedrigen Buspiron-Dosis empfohlen. Bei Anwendung in Kombination mit einem starken Induktor von CYP3A4 muss die Dosierung von Buspiron möglicherweise angepasst werden, um die anxiolytische Wirkung aufrechtzuerhalten.
Andere Drogen
Cimetidin
Es wurde festgestellt, dass die gleichzeitige Verabreichung von Buspiron mit Cimetidin Cmax (40 %) und Tmax (2-fach) erhöht, aber nur minimale Auswirkungen auf die AUC von Buspiron hatte.
Proteinbindung
In vitro verdrängt Buspiron fest gebundene Arzneimittel wie Phenytoin, Propranolol und Warfarin nicht aus Serumproteinen. Es gab jedoch einen Bericht über eine verlängerte Prothrombinzeit, als Buspiron zum Regime eines mit Warfarin behandelten Patienten hinzugefügt wurde. Der Patient erhielt außerdem chronisch Phenytoin, Phenobarbital, Digoxin und Synthroid®*. In vitro kann Buspiron weniger fest gebundene Arzneimittel wie Digoxin verdrängen. Die klinische Bedeutung dieser Eigenschaft ist unbekannt.
Therapeutische Konzentrationen von Aspirin, Desipramin, Diazepam, Flurazepam, Ibuprofen, Propranolol, Thioridazin und Tolbutamid hatten nur eine begrenzte Wirkung auf das Ausmaß der Bindung von Buspiron an Plasmaproteine (vgl KLINISCHE PHARMAKOLOGIE ).
Arzneimittel-/Labortest-Wechselwirkungen
Buspironhydrochlorid kann den Metanephrin/Katecholamin-Test im Urin beeinträchtigen. Es wurde während routinemäßiger Assaytests auf Phäochromozytom fälschlicherweise als Metanephrin abgelesen, was zu einem falsch positiven Laborergebnis führte. Buspironhydrochlorid sollte daher mindestens 48 Stunden lang abgesetzt werden, bevor eine Urinsammlung auf Katecholamine durchgeführt wird.
Drogenmissbrauch und -abhängigkeit
Klasse der kontrollierten Substanz
Buspironhydrochlorid ist keine kontrollierte Substanz.
Physische und psychische Abhängigkeit
In Studien an Menschen und Tieren hat Buspiron kein Potenzial für Missbrauch oder Ablenkung gezeigt, und es gibt keine Hinweise darauf, dass es Toleranz oder physische oder psychische Abhängigkeit verursacht. Menschliche Freiwillige mit einer Vorgeschichte von Freizeitdrogen oder Alkoholkonsum wurden in zwei doppelblinden klinischen Untersuchungen untersucht. Keiner der Probanden war in der Lage, zwischen Buspironhydrochlorid-Tabletten und Placebo zu unterscheiden. Im Gegensatz dazu zeigten die Probanden eine statistisch signifikante Präferenz für Methaqualon und Diazepam. Studien an Affen, Mäusen und Ratten haben gezeigt, dass Buspiron kein Missbrauchspotential hat. Nach chronischer Verabreichung bei Ratten führte das abrupte Absetzen von Buspiron nicht zu einem Körpergewichtsverlust, der üblicherweise bei Substanzen beobachtet wird, die eine körperliche Abhängigkeit verursachen.
Obwohl es keine direkten Beweise dafür gibt, dass Buspiron-Hydrochlorid-Tabletten eine körperliche Abhängigkeit oder ein Drogensuchverhalten verursachen, ist es schwierig, anhand von Experimenten vorherzusagen, inwieweit ein ZNS-aktives Medikament missbraucht, abgezweigt und/oder missbraucht wird, sobald es auf den Markt kommt. Folglich sollten Ärzte Patienten sorgfältig auf Drogenmissbrauch in der Vorgeschichte untersuchen und diese Patienten engmaschig überwachen und sie auf Anzeichen von Buspironhydrochlorid-Tabletten-Missbrauch oder -Missbrauch (z. B. Entwicklung einer Toleranz, Erhöhung der Dosis, Suchtverhalten) beobachten.
Klasse der kontrollierten Substanz
Buspironhydrochlorid ist keine kontrollierte Substanz.
Physische und psychische Abhängigkeit
In Studien an Menschen und Tieren hat Buspiron kein Potenzial für Missbrauch oder Ablenkung gezeigt, und es gibt keine Hinweise darauf, dass es Toleranz oder physische oder psychische Abhängigkeit verursacht. Menschliche Freiwillige mit einer Vorgeschichte von Freizeitdrogen oder Alkoholkonsum wurden in zwei doppelblinden klinischen Untersuchungen untersucht. Keiner der Probanden war in der Lage, zwischen Buspironhydrochlorid-Tabletten und Placebo zu unterscheiden. Im Gegensatz dazu zeigten die Probanden eine statistisch signifikante Präferenz für Methaqualon und Diazepam. Studien an Affen, Mäusen und Ratten haben gezeigt, dass Buspiron kein Missbrauchspotential hat. Nach chronischer Verabreichung bei Ratten führte das abrupte Absetzen von Buspiron nicht zu einem Körpergewichtsverlust, der üblicherweise bei Substanzen beobachtet wird, die eine körperliche Abhängigkeit verursachen.
Obwohl es keine direkten Beweise dafür gibt, dass Buspiron-Hydrochlorid-Tabletten eine körperliche Abhängigkeit oder ein Drogensuchverhalten verursachen, ist es schwierig, anhand von Experimenten vorherzusagen, inwieweit ein ZNS-aktives Medikament missbraucht, abgezweigt und/oder missbraucht wird, sobald es auf den Markt kommt. Folglich sollten Ärzte Patienten sorgfältig auf Drogenmissbrauch in der Vorgeschichte untersuchen und diese Patienten engmaschig überwachen und sie auf Anzeichen von Buspironhydrochlorid-Tabletten-Missbrauch oder -Missbrauch (z. B. Entwicklung einer Toleranz, Erhöhung der Dosis, Suchtverhalten) beobachten.
WARNUNGEN
Die Verabreichung von Buspironhydrochlorid-Tabletten an einen Patienten, der einen Monoaminoxidase-Hemmer (MAO-Hemmer) einnimmt, kann eine Gefahr darstellen. Es gibt Berichte über das Auftreten von erhöhtem Blutdruck, wenn Buspironhydrochlorid-Tabletten zu einem Regime hinzugefügt wurden, das einen MAO-Hemmer enthält. Daher wird empfohlen, Buspironhydrochlorid-Tabletten nicht gleichzeitig mit einem MAO-Hemmer einzunehmen.
Da Buspironhydrochlorid-Tabletten keine nachgewiesene antipsychotische Wirkung haben, sollte es nicht anstelle einer angemessenen antipsychotischen Behandlung eingesetzt werden.
VORSICHTSMASSNAHMEN
Allgemein
Beeinträchtigung der kognitiven und motorischen Leistung
Studien zeigen, dass Buspironhydrochlorid-Tabletten weniger sedierend wirken als andere Anxiolytika und dass es keine signifikante funktionelle Beeinträchtigung hervorruft. Die Auswirkungen auf das ZNS bei einzelnen Patienten sind jedoch möglicherweise nicht vorhersagbar. Daher sollten Patienten davor gewarnt werden, ein Auto zu führen oder komplexe Maschinen zu bedienen, bis sie hinreichend sicher sind, dass die Behandlung mit Buspiron sie nicht nachteilig beeinflusst.
Obwohl formelle Studien zur Wechselwirkung von Buspironhydrochlorid mit Alkohol darauf hindeuten, dass Buspiron die alkoholinduzierte Beeinträchtigung der motorischen und geistigen Leistungsfähigkeit nicht verstärkt, ist es ratsam, die gleichzeitige Anwendung von Alkohol und Buspiron zu vermeiden.
Potenzial für Entzugsreaktionen bei sedierenden/hypnotischen/anxiolytischen medikamentenabhängigen Patienten
Da Buspironhydrochlorid-Tabletten keine Kreuztoleranz mit Benzodiazepinen und anderen gebräuchlichen Beruhigungsmitteln/Hypnotika aufweisen, wird es das Entzugssyndrom, das häufig bei Beendigung der Therapie mit diesen Arzneimitteln auftritt, nicht blockieren. Daher ist es ratsam, Patienten vor Beginn der Behandlung mit Buspironhydrochlorid-Tabletten schrittweise von ihrer vorherigen Behandlung abzusetzen, insbesondere bei Patienten, die chronisch ein ZNS-dämpfendes Arzneimittel angewendet haben. Rebound- oder Entzugserscheinungen können über unterschiedliche Zeiträume auftreten, teilweise abhängig von der Art des Arzneimittels und seiner effektiven Eliminationshalbwertszeit.
Das Entzugssyndrom von Beruhigungsmitteln/Hypnotika/Anxiolytika kann als jede Kombination von Reizbarkeit, Angst, Unruhe, Schlaflosigkeit, Zittern, Bauchkrämpfen, Muskelkrämpfen, Erbrechen, Schwitzen, grippeähnlichen Symptomen ohne Fieber und gelegentlich sogar als Krampfanfälle auftreten .
Mögliche Bedenken im Zusammenhang mit der Bindung von Buspiron an Dopaminrezeptoren
Da Buspiron an zentrale Dopaminrezeptoren binden kann, wurde die Frage gestellt, ob es möglicherweise akute und chronische Veränderungen der Dopamin-vermittelten neurologischen Funktion (z. B. Dystonie, Pseudoparkinsonismus, Akathisie und tardive Dyskinesie) verursachen kann. Die klinische Erfahrung in kontrollierten Studien hat keine signifikante neuroleptikaähnliche Aktivität identifiziert; Bei einem kleinen Teil der mit Buspiron behandelten Patienten wurde jedoch über ein Syndrom der Unruhe berichtet, das kurz nach Behandlungsbeginn auftrat. Das Syndrom kann auf verschiedene Weise erklärt werden. Beispielsweise kann Buspiron die zentrale noradrenerge Aktivität erhöhen; alternativ kann die Wirkung auf dopaminerge Wirkungen zurückzuführen sein (dh Akathisie darstellen). Sehen NEBENWIRKUNGEN : Postmarketing-Erfahrung .
Informationen für Patienten
Um eine sichere und wirksame Anwendung von Buspironhydrochlorid-Tabletten zu gewährleisten, sollten Patienten die folgenden Informationen und Anweisungen gegeben werden:
Informieren Sie Ihren Arzt über alle verschreibungspflichtigen oder nicht verschreibungspflichtigen Medikamente, Alkohol oder Arzneimittel, die Sie derzeit einnehmen oder während Ihrer Behandlung mit Buspironhydrochlorid-Tabletten einnehmen möchten.
Informieren Sie Ihren Arzt, wenn Sie schwanger sind oder beabsichtigen, schwanger zu werden, oder wenn Sie während der Einnahme von Buspironhydrochlorid-Tabletten schwanger werden.
Informieren Sie Ihren Arzt, wenn Sie ein Kind stillen.
Bis Sie feststellen, wie sich dieses Medikament auf Sie auswirkt, fahren Sie kein Auto und bedienen Sie keine potenziell gefährlichen Maschinen.
Sie sollten Buspironhydrochlorid konsequent einnehmen, entweder immer mit oder immer ohne Nahrung.
Vermeiden Sie es, während Ihrer Behandlung mit Buspironhydrochlorid-Tabletten große Mengen Grapefruitsaft zu trinken.
Labortests
Es werden keine spezifischen Labortests empfohlen.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Während einer 24-monatigen Studie mit etwa dem 133-Fachen der maximal empfohlenen oralen Dosis beim Menschen wurden bei Ratten keine Hinweise auf ein karzinogenes Potenzial beobachtet; oder bei Mäusen während einer 18-monatigen Studie mit etwa dem 167-Fachen der maximal empfohlenen oralen Dosis für den Menschen.
Mit oder ohne metabolische Aktivierung induzierte Buspiron weder Punktmutationen in fünf Stämmen von Salmonella typhimurium (Ames-Test) oder Mauslymphom L5178YTK+-Zellkulturen, noch wurden DNA-Schäden mit Buspiron in menschlichen Wi-38-Zellen beobachtet. Chromosomenaberrationen oder -anomalien traten nicht in Knochenmarkszellen von Mäusen auf, denen eine oder fünf Tagesdosen Buspiron verabreicht wurden.
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie B
In Reproduktionsstudien an Ratten und Kaninchen mit Buspiron-Dosen, die etwa dem 30-Fachen der maximal empfohlenen Dosis beim Menschen entsprachen, wurde keine Beeinträchtigung der Fertilität oder Schädigung des Fötus beobachtet. Beim Menschen wurden jedoch keine angemessenen und gut kontrollierten Studien während der Schwangerschaft durchgeführt. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Arbeit und Lieferung
Die Wirkung von Buspironhydrochlorid auf Wehen und Geburt bei Frauen ist nicht bekannt. In Reproduktionsstudien an Ratten wurden keine Nebenwirkungen festgestellt.
Stillende Mutter
Das Ausmaß der Ausscheidung von Buspiron oder seinen Metaboliten in die Muttermilch ist nicht bekannt. Bei Ratten werden Buspiron und seine Metaboliten jedoch in die Milch ausgeschieden. Wenn es klinisch möglich ist, sollte die Verabreichung von Buspironhydrochlorid-Tabletten an stillende Frauen vermieden werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von Buspiron wurden in zwei placebokontrollierten 6-wöchigen Studien mit insgesamt 559 pädiatrischen Patienten (im Alter von 6 bis 17 Jahren) mit GAS untersucht. Die untersuchten Dosen waren 7,5 mg bis 30 mg zweimal täglich (15 bis 60 mg/Tag). Es gab keine signifikanten Unterschiede zwischen Buspiron und Placebo in Bezug auf die Symptome von GAD nach den für die Behandlung von GAD bei Erwachsenen empfohlenen Dosen. Pharmakokinetische Studien haben gezeigt, dass bei identischen Dosen die Plasmaexposition von Buspiron und seinem aktiven Metaboliten 1-PP bei pädiatrischen Patienten gleich oder höher ist als bei Erwachsenen. In diesen Studien wurden keine unerwarteten Sicherheitsbefunde mit Buspiron in Verbindung gebracht. Es liegen keine Langzeitdaten zur Sicherheit oder Wirksamkeit in dieser Population vor.
Geriatrische Verwendung
In einer Studie mit 6632 Patienten, die Buspiron zur Behandlung von Angstzuständen erhielten, waren 605 Patienten ≥ 65 Jahre und 41 ≥ 75 Jahre alt; Die Sicherheits- und Wirksamkeitsprofile dieser 605 älteren Patienten (Durchschnittsalter = 70,8 Jahre) waren ähnlich denen der jüngeren Population (Durchschnittsalter = 43,3 Jahre). Die Überprüfung spontan gemeldeter unerwünschter klinischer Ereignisse hat keine Unterschiede zwischen älteren und jüngeren Patienten ergeben, aber eine größere Empfindlichkeit einiger älterer Patienten kann nicht ausgeschlossen werden.
Es gab keine Auswirkungen des Alters auf die Pharmakokinetik von Buspiron (siehe KLINISCHE PHARMAKOLOGIE , Besondere Populationen ).
Anwendung bei Patienten mit eingeschränkter Leber- oder Nierenfunktion
Buspiron wird von der Leber metabolisiert und von den Nieren ausgeschieden. Eine pharmakokinetische Studie bei Patienten mit eingeschränkter Leber- oder Nierenfunktion zeigte erhöhte Plasmaspiegel und eine verlängerte Halbwertszeit von Buspiron. Daher kann die Verabreichung von Buspironhydrochlorid-Tabletten an Patienten mit schwerer Leber- oder Nierenfunktionsstörung nicht empfohlen werden (siehe KLINISCHE PHARMAKOLOGIE ).
ÜBERDOSIS
Keine Informationen bereitgestellt.
KONTRAINDIKATIONEN
Buspironhydrochlorid-Tabletten sind bei Patienten kontraindiziert, die auf Buspironhydrochlorid überempfindlich reagieren.
KLINISCHE PHARMAKOLOGIE
Der Wirkungsmechanismus von Buspiron ist unbekannt. Buspiron unterscheidet sich von typischen Benzodiazepin-Anxiolytika dadurch, dass es keine krampflösenden oder muskelrelaxierenden Wirkungen ausübt. Es fehlt auch die ausgeprägte beruhigende Wirkung, die mit typischeren Anxiolytika verbunden ist. Präklinische In-vitro-Studien haben gezeigt, dass Buspiron eine hohe Affinität zu Serotonin (5-HT1A)-Rezeptoren hat. Buspiron hat keine signifikante Affinität zu Benzodiazepin-Rezeptoren und beeinflusst die GABA-Bindung in vitro oder in vivo nicht, wenn es in präklinischen Modellen getestet wird.
Buspiron hat eine mäßige Affinität zu D2-Dopamin-Rezeptoren im Gehirn. Einige Studien deuten darauf hin, dass Buspiron indirekte Auswirkungen auf andere Neurotransmittersysteme haben kann.
Buspironhydrochlorid wird vom Menschen schnell resorbiert und unterliegt einem intensiven First-Pass-Metabolismus. In einer radioaktiv markierten Studie machte unverändertes Buspiron im Plasma nur etwa 1 % der Radioaktivität im Plasma aus. Nach oraler Verabreichung sind die Plasmakonzentrationen von unverändertem Buspiron sehr niedrig und von Patient zu Patient unterschiedlich. Spitzenplasmaspiegel von 1 ng/ml bis 6 ng/ml wurden 40 bis 90 Minuten nach einer oralen Einzeldosis von 20 mg beobachtet. Die Bioverfügbarkeit einer Einzeldosis von unverändertem Buspiron bei Einnahme als Tablette beträgt im Durchschnitt etwa 90 % einer äquivalenten Lösungsdosis, es gibt jedoch große Schwankungen.
Die Auswirkungen von Nahrungsmitteln auf die Bioverfügbarkeit von Buspironhydrochlorid-Tabletten wurden bei acht Probanden untersucht. Sie erhielten eine Dosis von 20 mg mit und ohne Nahrung; die Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC) und die maximale Plasmakonzentration (Cmax) von unverändertem Buspiron nahmen um 84 % bzw. 116 % zu, aber die Gesamtmenge des immunreaktiven Materials von Buspiron änderte sich nicht. Dies deutet darauf hin, dass Nahrung das Ausmaß der präsystemischen Clearance von Buspiron verringern kann (vgl DOSIERUNG UND ANWENDUNG ).
Eine Mehrfachdosisstudie, die an 15 Probanden durchgeführt wurde, deutet darauf hin, dass Buspiron eine nichtlineare Pharmakokinetik aufweist. Daher können Dosiserhöhungen und wiederholte Dosierungen zu etwas höheren Blutspiegeln von unverändertem Buspiron führen, als dies aufgrund der Ergebnisse von Einzeldosisstudien vorhergesagt werden würde.
Eine In-vitro-Proteinbindungsstudie zeigte, dass etwa 86 % von Buspiron an Plasmaproteine gebunden sind. Es wurde auch beobachtet, dass Aspirin die Plasmaspiegel von freiem Buspiron um 23 % erhöhte, während Flurazepam die Plasmaspiegel von freiem Buspiron um 20 % senkte. Es ist jedoch nicht bekannt, ob diese Arzneimittel ähnliche Wirkungen auf die Plasmaspiegel von freiem Buspiron in vivo haben oder ob solche Veränderungen, falls sie auftreten, klinisch signifikante Unterschiede im Behandlungsergebnis verursachen. Eine In-vitro-Studie zeigte, dass Buspiron stark proteingebundene Arzneimittel wie Phenytoin, Warfarin und Propranolol nicht aus Plasmaprotein verdrängt, und dass Buspiron Digoxin verdrängen kann.
Buspiron wird hauptsächlich durch Oxidation metabolisiert, die in vitro nachweislich durch Cytochrom P450 3A4 (CYP3A4) vermittelt wird (vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ). Es werden mehrere hydroxylierte Derivate und ein pharmakologisch aktiver Metabolit, 1-Pyrimidinylpiperazin (1-PP), hergestellt. In Tiermodellen, die ein anxiolytisches Potenzial vorhersagen, hat 1-PP etwa ein Viertel der Aktivität von Buspiron, ist aber in bis zu 20-fach größeren Mengen vorhanden. Dies ist jedoch beim Menschen wahrscheinlich nicht wichtig: Blutproben von Menschen, die chronisch Buspironhydrochlorid ausgesetzt waren, weisen keine hohen Konzentrationen von 1-PP auf; Die mittleren Werte liegen bei etwa 3 ng/ml, und der höchste menschliche Blutspiegel, der bei 108 chronisch dosierten Patienten gemessen wurde, betrug 17 ng/ml, weniger als 1/200 der 1-PP-Spiegel, die bei Tieren gefunden wurden, denen große Dosen von Buspiron ohne Anzeichen von Toxizität verabreicht wurden.
In einer Einzeldosisstudie mit 14C-markiertem Buspiron wurden 29 % bis 63 % der Dosis innerhalb von 24 Stunden im Urin ausgeschieden, hauptsächlich als Metaboliten; die fäkale Ausscheidung machte 18 % bis 38 % der Dosis aus. Die durchschnittliche Eliminationshalbwertszeit von unverändertem Buspiron nach Einzeldosen von 10 mg bis 40 mg beträgt etwa 2 bis 3 Stunden.
Besondere Populationen
Alters- und Geschlechtseffekte
Nach Einzel- oder Mehrfachdosen bei Erwachsenen wurden keine signifikanten Unterschiede in der Pharmakokinetik von Buspiron (AUC und Cmax) zwischen älteren und jüngeren Probanden oder zwischen Männern und Frauen beobachtet.
Leberfunktionsstörung
Nach Mehrfachgabe von Buspiron an Patienten mit eingeschränkter Leberfunktion erhöhte sich die AUC von Buspiron im Steady-State im Vergleich zu gesunden Probanden um das 13-Fache (vgl VORSICHTSMASSNAHMEN ).
Nierenfunktionsstörung
Nach Mehrfachgabe von Buspiron an Patienten mit eingeschränkter Nierenfunktion (Clcr = 10 bis 70 ml/min/1,73 m2) erhöhte sich die AUC von Buspiron im Steady-State im Vergleich zu gesunden Probanden (Clcr ≥ 80 ml/min/1,73 m2) um das 4-Fache (sehen VORSICHTSMASSNAHMEN ).
Renneffekte
Die Auswirkungen der Rasse auf die Pharmakokinetik von Buspiron wurden nicht untersucht.
INFORMATIONEN ZUM PATIENTEN
Buspironhydrochlorid Tabletten, USP Für 15 mg und 30 mg Tabletten
WIE BENUTZT MAN
Die Reaktion auf Buspiron ist von Person zu Person unterschiedlich. Ihr Arzt kann es für erforderlich halten, Ihre Dosierung anzupassen, um die richtige Wirkung zu erzielen.
Jede Tablette ist eingekerbt und kann genau gebrochen werden.
Um eine Tablette genau und einfach zu brechen, halten Sie die Tablette zwischen Daumen und Zeigefinger nahe an der entsprechenden Tablettenkerbe (Rille). Wenden Sie dann mit der Bruchrille der Tablette zu Ihnen gerichteten Druck an und brechen Sie die Tablettensegmente auseinander (segmente, die falsch brechen, sollten nicht verwendet werden).
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.