Clozaril 25mg, 50mg, 100mg Clozapine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Clozaril und wie wird es angewendet?
Clozaril 100 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Schizophrenie. Clozaril 50 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Clozaril 100 mg gehört zu einer Klasse von Arzneimitteln, die als Antipsychotika der 2. Generation bezeichnet werden.
Es ist nicht bekannt, ob Clozaril 25 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Clozaril haben?
Clozaril kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Clozaril sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Clozaril. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
SCHWERE NEUTROPENIE; Orthostatische Hypotonie, Bradykardie und Synkope; KRAMPFANFALL; MYOKARDITIS UND KARDIOMYOPATHIE; ERHÖHTE STERBLICHKEIT BEI ÄLTEREN PATIENTEN MIT PSYCHOSE IM ZUSAMMENHANG MIT DEMENZ
Schwere Neutropenie
Die Behandlung mit CLOZARIL hat eine schwere Neutropenie verursacht, die als absolute Neutrophilenzahl (ANC) von weniger als 500/μl definiert ist. Eine schwere Neutropenie kann zu schweren Infektionen und zum Tod führen. Vor Beginn der Behandlung mit CLOZARIL muss ein ANC-Ausgangswert von mindestens 1500/μl für die Allgemeinbevölkerung betragen; und muss bei Patienten mit dokumentierter benigner ethnischer Neutropenie (BEN) mindestens 1000/μl betragen. Während der Behandlung müssen die Patienten einer regelmäßigen ANC-Überwachung unterzogen werden. Weisen Sie die Patienten an, Symptome, die einer schweren Neutropenie oder Infektion entsprechen (z. B. Fieber, Schwäche, Lethargie oder Halsschmerzen), unverzüglich zu melden [siehe DOSIERUNG UND ANWENDUNG und WARNHINWEISE UND VORSICHTSMASSNAHMEN].
Aufgrund des Risikos einer schweren Neutropenie ist CLOZARIL nur über ein eingeschränktes Programm im Rahmen einer Risk Evaluation Mitigation Strategy (REMS) namens Clozapine REMS Program erhältlich. [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
Orthostatische Hypotonie, Bradykardie, Synkope
Orthostatische Hypotonie, Bradykardie, Synkope und Herzstillstand sind unter der Behandlung mit CLOZARIL aufgetreten. Das Risiko ist während der anfänglichen Titrationsphase am höchsten, insbesondere bei schneller Dosissteigerung. Diese Reaktionen können bereits bei der ersten Dosis mit Dosen von nur 12,5 mg pro Tag auftreten. Beginnen Sie die Behandlung mit 12,5 mg ein- oder zweimal täglich; langsam titrieren; und verwenden Sie geteilte Dosierungen. Wenden Sie CLOZARIL bei Patienten mit kardiovaskulären oder zerebrovaskulären Erkrankungen oder Zuständen, die für Hypotonie prädisponieren (z. B. Dehydration, Einnahme von blutdrucksenkenden Medikamenten) mit Vorsicht an [siehe DOSIERUNG UND ANWENDUNG und WARNHINWEISE UND VORSICHTSMASSNAHMEN].
Krampfanfälle
Unter der Behandlung mit CLOZARIL 25 mg sind Krampfanfälle aufgetreten. Das Risiko ist dosisabhängig. Beginnen Sie die Behandlung mit 12,5 mg, titrieren Sie schrittweise und verwenden Sie geteilte Dosierungen. Seien Sie vorsichtig bei der Verabreichung von CLOZARIL 50 mg an Patienten mit Krampfanfällen in der Vorgeschichte oder anderen prädisponierenden Risikofaktoren für Krampfanfälle (ZNS-Pathologie, Medikamente, die die Krampfschwelle senken, Alkoholmissbrauch). Warnen Sie die Patienten davor, sich an Aktivitäten zu beteiligen, bei denen ein plötzlicher Bewusstseinsverlust ein ernsthaftes Risiko für sie selbst oder andere darstellen könnte [siehe DOSIERUNG UND ANWENDUNG, WARNHINWEISE UND VORSICHTSMASSNAHMEN].
Myokarditis und Kardiomyopathie
Unter der Behandlung mit CLOZARIL sind tödliche Myokarditis und Kardiomyopathie aufgetreten. Setzen Sie CLOZARIL 25 mg ab und holen Sie bei Verdacht auf diese Reaktionen eine kardiale Untersuchung ein. Im Allgemeinen sollten Patienten mit Clozaril-bedingter Myokarditis oder Kardiomyopathie nicht erneut mit CLOZARIL behandelt werden. Ziehen Sie die Möglichkeit einer Myokarditis oder Kardiomyopathie in Betracht, wenn Brustschmerzen, Tachykardie, Palpitationen, Dyspnoe, Fieber, grippeähnliche Symptome, Hypotonie oder EKG-Veränderungen auftreten [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
Erhöhte Sterblichkeit bei älteren Patienten mit demenzbedingter Psychose
Ältere Patienten mit demenzbedingter Psychose, die mit Antipsychotika behandelt werden, haben ein erhöhtes Sterberisiko. CLOZARIL ist nicht für die Anwendung bei Patienten mit demenzbedingter Psychose zugelassen [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
BEZEICHNUNG
CLOZARIL® (Clozapin), ein atypisches Antipsychotikum, ist ein trizyklisches Dibenzodiazepin-Derivat, 8-Chlor-11-(4-methyl-1-piperazinyl)-5H-dibenzo[b,e][1,4]diazepin. Die Strukturformel lautet
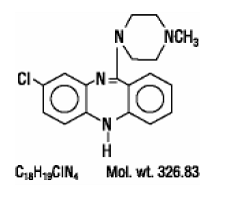
CLOZARIL ist in blassgelben Tabletten zu 25 mg und 100 mg zur oralen Verabreichung erhältlich.
Wirkstoff: Clozapin
Inaktive Inhaltsstoffe sind kolloidales Siliziumdioxid, Laktose, Magnesiumstearat, Povidon, Stärke (Mais) und Talk.
INDIKATIONEN
Behandlungsresistente Schizophrenie
CLOZARIL 50 mg ist indiziert für die Behandlung schwerkranker Patienten mit Schizophrenie, die nicht ausreichend auf eine antipsychotische Standardbehandlung ansprechen. Wegen der mit seiner Anwendung verbundenen Risiken einer schweren Neutropenie und Krampfanfällen sollte CLOZARIL nur bei Patienten angewendet werden, die auf eine antipsychotische Standardbehandlung nicht ausreichend angesprochen haben [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die Wirksamkeit von CLOZARIL bei behandlungsresistenter Schizophrenie wurde in einer 6-wöchigen, randomisierten, doppelblinden, aktiv kontrollierten Studie nachgewiesen, in der CLOZARIL und Chlorpromazin bei Patienten verglichen wurden, bei denen andere Antipsychotika versagt hatten [siehe Klinische Studien ].
Verringerung des Risikos für wiederkehrendes suizidales Verhalten bei Schizophrenie oder schizoaffektiver Störung
CLOZARIL ist indiziert zur Verringerung des Risikos für wiederkehrendes suizidales Verhalten bei Patienten mit Schizophrenie oder schizoaffektiven Störungen, bei denen aufgrund der Anamnese und des jüngsten klinischen Zustands ein chronisches Risiko für erneutes suizidales Verhalten eingeschätzt wird. Suizidalität bezieht sich auf Handlungen eines Patienten, die sich selbst einem Todesrisiko aussetzen.
Die Wirksamkeit von CLOZARIL bei der Verringerung des Risikos von wiederkehrendem Suizidverhalten wurde über einen zweijährigen Behandlungszeitraum in der InterSePT™-Studie nachgewiesen [siehe Klinische Studien ].
DOSIERUNG UND ANWENDUNG
Erforderliche Labortests vor Beginn und während der Therapie
Vor Beginn der Behandlung mit CLOZARIL muss ein ANC-Ausgangswert ermittelt werden. Die Ausgangs-ANC muss mindestens 1500/μl für die Allgemeinbevölkerung und mindestens 1000/μl für Patienten mit dokumentierter benigner ethnischer Neutropenie (BEN) betragen. Um die Behandlung fortzusetzen, muss die ANC regelmäßig überwacht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Dosierungsinformationen
Die Anfangsdosis beträgt 12,5 mg einmal täglich oder zweimal täglich. Die tägliche Gesamtdosis kann bei guter Verträglichkeit in Schritten von 25 mg bis 50 mg pro Tag erhöht werden, um eine Zieldosis von 300 mg bis 450 mg pro Tag (verabreicht in geteilten Dosen) am Ende von 2 Wochen zu erreichen. Anschließend kann die Dosis einmal wöchentlich oder zweimal wöchentlich in Schritten von bis zu 100 mg erhöht werden. Die Höchstdosis beträgt 900 mg pro Tag. Um das Risiko einer orthostatischen Hypotonie, Bradykardie und Synkope zu minimieren, ist es notwendig, diese niedrige Anfangsdosis, ein schrittweises Titrationsschema und geteilte Dosierungen anzuwenden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
CLOZARIL kann mit oder ohne Nahrung eingenommen werden [siehe Pharmakokinetik ].
Erhaltungsbehandlung
Im Allgemeinen sollten Patienten, die auf CLOZARIL ansprechen, die Erhaltungstherapie mit ihrer wirksamen Dosis über die akute Episode hinaus fortsetzen.
Abbruch der Behandlung
Die Methode des Behandlungsabbruchs hängt von der letzten ANC des Patienten ab:
Wiederaufnahme der Behandlung
Bei Wiederaufnahme der Behandlung mit CLOZARIL bei Patienten, die CLOZARIL abgesetzt haben (dh 2 Tage oder länger seit der letzten Dosis), ist die Behandlung mit 12,5 mg einmal täglich oder zweimal täglich wieder aufzunehmen. Dies ist notwendig, um das Risiko von Hypotonie, Bradykardie und Synkope zu minimieren [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Wenn diese Dosis gut vertragen wird, kann die Dosis schneller als für die Erstbehandlung empfohlen auf die vorherige therapeutische Dosis erhöht werden.
Dosisanpassungen bei gleichzeitiger Anwendung von CYP1A2-, CYP2D6-, CYP3A4-Inhibitoren oder CYP1A2-, CYP3A4-Induktoren
Bei Patienten mit gleichzeitiger Anwendung von: starken CYP1A2-Hemmern (z. B. Fluvoxamin, Ciprofloxacin oder Enoxacin); moderate oder schwache CYP1A2-Hemmer (z. B. orale Kontrazeptiva oder Koffein); CYP2D6- oder CYP3A4-Inhibitoren (z. B. Cimetidin, Escitalopram, Erythromycin, Paroxetin, Bupropion, Fluoxetin, Chinidin, Duloxetin, Terbinafin oder Sertralin); CYP3A4-Induktoren (z. B. Phenytoin, Carbamazepin, Johanniskraut und Rifampin); oder CYP1A2-Induktoren (z. B. Tabakrauchen) (Tabelle 1) [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Eingeschränkte Nieren- oder Leberfunktion oder CYP2D6-Metabolisierer
Es kann erforderlich sein, die Dosis von CLOZARIL 50 mg bei Patienten mit erheblich eingeschränkter Nieren- oder Leberfunktion oder bei langsamen CYP2D6-Metabolisierern zu reduzieren [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
WIE GELIEFERT
Darreichungsformen und Stärken
CLOZARIL (Clozapin) ist als 25 mg, 50 mg und 100 mg runde, blassgelbe, unbeschichtete Tabletten mit einer erleichterten Bruchkerbe auf einer Seite erhältlich. Clozaril (Clozapin) 200 mg Tabletten sind kapselförmige, blassgelbe, unbeschichtete Tabletten mit einer erleichterten Bruchkerbe auf einer Seite.
CLOZARIL® (Clozapin) Tabletten
25mg
Runde, blassgelbe, unbeschichtete Tablette. Prägung „CLOZARIL“ einmal am Umfang einer Seite. Geprägt mit erleichterter Kerbe und „25“ einmal auf der anderen Seite. 100er Flasche .......... NDC 69809-0126-05
50mg
Runde, blassgelbe, unbeschichtete Tablette. Prägung „CLOZARIL“ einmal am Umfang einer Seite. Prägung „50“, eine erleichterte Kerbe und „mg“ auf der anderen Seite. 100er Flasche .......... NDC 69809-0130-05
100mg
Runde, blassgelbe, unbeschichtete Tablette. Prägung „CLOZARIL“ einmal am Umfang einer Seite. Prägung mit erleichterter Kerbe und einmal „100“ auf der anderen Seite. 100er Flasche .......... NDC 69809-0127-05
200mg
Kapselförmige, hellgelbe, unbeschichtete Tablette. Prägung „CLOZARIL“ einmal auf einer Seite. Geprägt mit „200“, einer erleichterten Kerbe und „mg“ auf der anderen Seite. 100er Flasche .......... NDC 69809-0135-05
Lagerung und Handhabung
Die Lagertemperatur sollte 30°C (86°F) nicht überschreiten.
Außerhalb der Reichweite von Kindern aufbewahren.
Vertrieb durch: HLS Therapeutics (USA), Inc., Rosemont, PA 19010, (844) 457-8721. Überarbeitet: Februar 2021
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden in anderen Abschnitten der Kennzeichnung ausführlicher erörtert:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Die am häufigsten berichteten Nebenwirkungen (≥ 5 %) in den klinischen Studien mit CLOZARIL waren: ZNS-Reaktionen, einschließlich Sedierung, Schwindel/Vertigo, Kopfschmerzen und Zittern; kardiovaskuläre Reaktionen, einschließlich Tachykardie, Hypotonie und Synkope; Reaktionen des autonomen Nervensystems, einschließlich Hypersalivation, Schwitzen, Mundtrockenheit und Sehstörungen; gastrointestinale Reaktionen, einschließlich Verstopfung und Übelkeit; und Fieber. Tabelle 9 fasst die am häufigsten berichteten Nebenwirkungen (≥5 %) bei mit CLOZARIL behandelten Patienten (im Vergleich zu mit Chlorpromazin behandelten Patienten) in der zulassungsrelevanten, 6-wöchigen, kontrollierten Studie zu behandlungsresistenter Schizophrenie zusammen.
Tabelle 10 fasst die Nebenwirkungen zusammen, die bei mit CLOZARIL behandelten Patienten mit einer Häufigkeit von 2 % oder mehr in allen CLOZARIL-Studien (mit Ausnahme der 2-jährigen InterSePT™-Studie) berichtet wurden. Diese Raten werden nicht an die Expositionsdauer angepasst.
Tabelle 11 fasst die am häufigsten berichteten Nebenwirkungen (> 10 % der CLOZARIL- oder Olanzapin-Gruppe) in der InterSePT™-Studie zusammen. Dies war eine adäquate und gut kontrollierte zweijährige Studie zur Bewertung der Wirksamkeit von CLOZARIL im Vergleich zu Olanzapin bei der Verringerung des Suizidrisikos bei Patienten mit Schizophrenie oder schizoaffektiven Störungen. Die Raten werden nicht an die Expositionsdauer angepasst.
Dystonie
Klasseneffekt
Bei empfindlichen Personen können in den ersten Tagen der Behandlung Symptome einer Dystonie, verlängerte abnorme Kontraktionen von Muskelgruppen, auftreten. Zu den dystonischen Symptomen gehören: Krämpfe der Nackenmuskulatur, die sich manchmal zu einem Engegefühl im Hals entwickeln, Schluckbeschwerden, Atembeschwerden und/oder Heraustreten der Zunge. Während diese Symptome bei niedrigen Dosen auftreten können, treten sie häufiger und mit größerer Schwere bei hochpotenten und höheren Dosen von Antipsychotika der ersten Generation auf. Ein erhöhtes Risiko einer akuten Dystonie wird bei Männern und jüngeren Altersgruppen beobachtet.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von Clozapin nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Zentrales Nervensystem
Delirium, anormales EEG, Myoklonus, Parästhesie, mögliche Kataplexie, Status epilepticus, Zwangssymptome, Restless-Legs-Syndrom und cholinerge Rebound-Nebenwirkungen nach Absetzen.
Herz-Kreislauf-System
Vorhofflimmern oder Kammerflimmern, ventrikuläre Tachykardie, Palpitationen, Verlängerung des QT-Intervalls, Torsades de Pointes, Mitralklappeninsuffizienz in Verbindung mit Clozapin-bedingter Kardiomyopathie, Myokardinfarkt, Herzstillstand, Myokarditis und periorbitales Ödem.
Hormonsystem
Pseudopheochromozytom
Magen-Darm-System
Akute Pankreatitis, Dysphagie, Speicheldrüsenschwellung, Kolitis, Megakolon, intestinale Ischämie oder Infarkt.
Hepatobiliäres System
Cholestase, Hepatitis, Gelbsucht, Hepatotoxizität, Lebersteatose, Lebernekrose, Leberfibrose, Leberzirrhose, Leberschädigung (hepatisch, cholestatisch und gemischt) und Leberversagen.
Erkrankungen des Immunsystems
Angioödem, leukozytoklastische Vaskulitis.
Urogenitalsystem
Akute interstitielle Nephritis, nächtliches Einnässen, Priapismus, Nierenversagen und retrograde Ejakulation.
Erkrankungen der Haut und des Unterhautgewebes
Überempfindlichkeitsreaktionen: Lichtempfindlichkeit, Vaskulitis, Erythema multiforme, Hautpigmentierungsstörung und Stevens-Johnson-Syndrom.
Erkrankungen des Bewegungsapparates und des Bindegewebes
Myasthenisches Syndrom, Rhabdomyolyse und systemischer Lupus erythematodes.
Atmungssystem
Aspiration, Pleuraerguss, Lungenentzündung, Infektion der unteren Atemwege, Schlafapnoe.
Hämisches und lymphatisches System
Leichte, mittelschwere oder schwere Leukopenie, Agranulozytose, Granulozytopenie, verminderte WBC, tiefe Venenthrombose, erhöhter Hämoglobin-/Hämatokritwert, erhöhte Blutsenkungsgeschwindigkeit (ESR), Sepsis, Thrombozytose und Thrombozytopenie.
Sehstörungen
Engwinkelglaukom.
Sonstig
Kreatin-Phosphokinase-Erhöhung, Hyperurikämie, Hyponatriämie, Polyserositis und Gewichtsverlust.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Mögliche Beeinflussung von CLOZARIL durch andere Arzneimittel
Clozapin ist ein Substrat für viele Cytochrom-P450-Isozyme, insbesondere CYP1A2, CYP3A4 und CYP2D6. Seien Sie vorsichtig, wenn Sie CLOZARIL 100 mg gleichzeitig mit Arzneimitteln verabreichen, die Induktoren oder Inhibitoren dieser Enzyme sind.
CYP1A2-Inhibitoren
Die gleichzeitige Anwendung von CLOZARIL und CYP1A2-Inhibitoren kann die Plasmaspiegel von Clozapin erhöhen, was möglicherweise zu Nebenwirkungen führen kann. Reduzieren Sie die CLOZARIL-Dosis auf ein Drittel der ursprünglichen Dosis, wenn CLOZARIL zusammen mit starken CYP1A2-Inhibitoren (z. B. Fluvoxamin, Ciprofloxacin oder Enoxacin) verabreicht wird. Die CLOZARIL-Dosis sollte auf die ursprüngliche Dosis erhöht werden, wenn die gleichzeitige Anwendung starker CYP1A2-Hemmer beendet wird [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ].
Moderate oder schwache CYP1A2-Hemmer umfassen orale Kontrazeptiva und Koffein. Patienten engmaschig überwachen, wenn CLOZARIL zusammen mit diesen Inhibitoren verabreicht wird. Erwägen Sie, falls erforderlich, die Dosierung von CLOZARIL 25 mg zu reduzieren [siehe DOSIERUNG UND ANWENDUNG ].
CYP2D6- und CYP3A4-Inhibitoren
Die gleichzeitige Behandlung mit CLOZARIL und CYP2D6- oder CYP3A4-Inhibitoren (z. B. Cimetidin, Escitalopram, Erythromycin, Paroxetin, Bupropion, Fluoxetin, Chinidin, Duloxetin, Terbinafin oder Sertralin) kann die Clozapinspiegel erhöhen und zu Nebenwirkungen führen [siehe KLINISCHE PHARMAKOLOGIE ]. Seien Sie vorsichtig und überwachen Sie die Patienten engmaschig, wenn Sie solche Inhibitoren anwenden. Erwägen Sie, die Dosis von CLOZARIL 100 mg zu reduzieren [siehe DOSIERUNG UND ANWENDUNG ].
CYP1A2- und CYP3A4-Induktoren
Die gleichzeitige Behandlung mit Arzneimitteln, die CYP1A2 oder CYP3A4 induzieren, kann die Plasmakonzentration von Clozapin verringern, was zu einer verringerten Wirksamkeit von CLOZARIL führt. Tabakrauch ist ein moderater Induktor von CYP1A2. Zu den starken CYP3A4-Induktoren gehören Carbamazepin, Phenytoin, Johanniskraut und Rifampin. Bei gleichzeitiger Anwendung mit Induktoren dieser Enzyme kann es erforderlich sein, die Dosis von CLOZARIL 50 mg zu erhöhen. Die gleichzeitige Anwendung von CLOZARIL und starken CYP3A4-Induktoren wird jedoch nicht empfohlen [siehe DOSIERUNG UND ANWENDUNG ].
Erwägen Sie, die Dosierung von CLOZARIL 50 mg zu reduzieren, wenn Sie gleichzeitig angewendete Enzyminduktoren absetzen; da das Absetzen von Induktoren zu erhöhten Clozapin-Plasmaspiegeln und einem erhöhten Risiko für Nebenwirkungen führen kann [siehe DOSIERUNG UND ANWENDUNG ].
Anticholinergika
Die gleichzeitige Behandlung mit Clozapin und anderen Arzneimitteln mit anticholinerger Wirkung (z. B. Benztropin, Cyclobenzaprin, Diphenhydramin) kann das Risiko einer anticholinergen Toxizität und schwerer gastrointestinaler Nebenwirkungen im Zusammenhang mit Hypomotilität erhöhen. Vermeiden Sie nach Möglichkeit die gleichzeitige Anwendung von CLOZARIL mit Anticholinergika [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Medikamente, die eine Verlängerung des QT-Intervalls verursachen
Seien Sie vorsichtig, wenn Sie gleichzeitig Arzneimittel verabreichen, die das QT-Intervall verlängern oder den Metabolismus von Clozapin hemmen. Zu den Arzneimitteln, die eine QT-Verlängerung verursachen, gehören: spezifische Antipsychotika (z. B. Ziprasidon, Iloperidon, Chlorpromazin, Thioridazin, Mesoridazin, Droperidol und Pimozid), spezifische Antibiotika (z. B. Erythromycin, Gatifloxacin, Moxifloxacin, Sparfloxacin), Antiarrhythmika der Klasse 1A (z. B. Chinidin, Procainamid) oder Antiarrhythmika der Klasse III (z. B. Amiodaron, Sotalol) und andere (z. B. Pentamidin, Levomethadylacetat, Methadon, Halofantrin, Mefloquin, Dolasetronmesylat, Probucol oder Tacrolimus) [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Potenzielle Auswirkungen von CLOZARIL auf andere Arzneimittel
Die gleichzeitige Anwendung von CLOZARIL 25 mg mit anderen Arzneimitteln, die durch CYP2D6 metabolisiert werden, kann die Spiegel dieser CYP2D6-Substrate erhöhen. Seien Sie vorsichtig bei der gleichzeitigen Verabreichung von CLOZARIL 50 mg mit anderen Arzneimitteln, die durch CYP2D6 metabolisiert werden. Es kann erforderlich sein, niedrigere Dosen dieser Arzneimittel als die normalerweise verschriebenen zu verwenden. Zu diesen Medikamenten gehören spezifische Antidepressiva, Phenothiazine, Carbamazepin und Typ-1C-Antiarrhythmika (z. B. Propafenon, Flecainid und Encainid).
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Schwere Neutropenie
Hintergrund
CLOZARIL kann Neutropenie (eine niedrige absolute Neutrophilenzahl (ANC)) verursachen, definiert als eine Verringerung der Neutrophilenspiegel im Blut unter die normalen Werte vor der Behandlung. Die ANC ist in der Regel als Bestandteil des kompletten Blutbildes (CBC), einschließlich Differenzialblutbild, verfügbar und ist für eine arzneimittelinduzierte Neutropenie relevanter als das Zählen der weißen Blutkörperchen (WBC). Die ANC kann auch unter Verwendung der folgenden Formel berechnet werden: ANC ist gleich der gesamten WBC-Zahl multipliziert mit dem Gesamtprozentsatz der Neutrophilen, die aus dem Differential erhalten wurden (Neutrophilen-„Segmente“ plus Neutrophilen-„Banden“). Andere Granulozyten (Basophile und Eosinophile) tragen minimal zur Neutropenie bei und ihre Messung ist nicht erforderlich [vgl NEBENWIRKUNGEN ]. Neutropenie kann leicht, mäßig oder schwer sein (siehe Tabellen 2 und 3). Um das Verständnis zu verbessern und zu standardisieren, ersetzt „schwere Neutropenie“ die früheren Begriffe schwere Leukopenie, schwere Granulozytopenie oder Agranulozytose.
Schwere Neutropenie, ANC unter (
Im Folgenden werden zwei getrennte Behandlungsalgorithmen bereitgestellt, der erste für Patienten in der Allgemeinbevölkerung und der zweite für Patienten, bei denen zu Beginn eine Neutropenie festgestellt wurde.
Behandlung und Überwachung mit CLOZARIL in der allgemeinen Patientenpopulation (siehe Tabelle 2)
Lassen Sie vor Beginn der Behandlung mit CLOZARIL 25 mg ein Blutbild, einschließlich des ANC-Werts, erhalten, um das Vorhandensein einer normalen Neutrophilenzahl zu Beginn (gleich oder größer als 1500/μl) sicherzustellen und spätere Vergleiche zu ermöglichen. Patienten in der Allgemeinbevölkerung mit einer ANC von mindestens (≥) 1500/μl gelten als im Normalbereich (Tabelle 2) und sind für den Beginn der Behandlung geeignet. Während der ersten 6 Behandlungsmonate ist bei allen Patienten eine wöchentliche ANC-Überwachung erforderlich. Wenn die ANC eines Patienten in den ersten 6 Monaten der Behandlung gleich oder größer als 1500/μl bleibt, kann die Überwachungshäufigkeit für die nächsten 6 Monate auf alle 2 Wochen reduziert werden. Wenn die ANC in den zweiten 6 Monaten der kontinuierlichen Therapie gleich oder größer als 1500/μl bleibt, kann die Häufigkeit der ANC-Überwachung danach auf einmal alle 4 Wochen reduziert werden.
CLOZARIL Behandlung und Überwachung bei Patienten mit benigner ethnischer Neutropenie (siehe Tabelle 3)
Benigne ethnische Neutropenie (BEN) ist eine Erkrankung, die bei bestimmten ethnischen Gruppen beobachtet wird, deren durchschnittliche ANC-Werte niedriger sind als die „Standard“-Laborbereiche für Neutrophile. Es wird am häufigsten bei Personen afrikanischer Abstammung (ungefähre Prävalenz von 25-50%), einigen ethnischen Gruppen des Nahen Ostens und anderen nicht-kaukasischen ethnischen Gruppen mit dunklerer Haut beobachtet. BEN ist häufiger bei Männern. Patienten mit BEN haben eine normale Anzahl hämatopoetischer Stammzellen und eine normale myeloische Reifung, sind gesund und leiden nicht an wiederholten oder schweren Infektionen. Sie haben kein erhöhtes Risiko, eine CLOZARIL-induzierte Neutropenie zu entwickeln. Eine zusätzliche Untersuchung kann erforderlich sein, um festzustellen, ob die Neutropenie bei Studienbeginn auf BEN zurückzuführen ist. Erwägen Sie bei Bedarf eine hämatologische Beratung vor Beginn oder während der Behandlung mit CLOZARIL 50 mg.
Patienten mit BEN benötigen aufgrund ihrer niedrigeren ANC-Ausgangswerte einen anderen ANC-Algorithmus für das CLOZARIL-Management. Tabelle 3 enthält Richtlinien für das Management der Behandlung mit CLOZARIL 100 mg und die ANC-Überwachung bei Patienten mit BEN.
Allgemeine Richtlinien für die Behandlung aller Patienten mit Fieber oder Neutropenie
Rechallenge nach einer ANC von weniger als 500/μl (schwere Neutropenie)
Bei manchen Patienten, bei denen eine schwere CLOZARIL-bedingte Neutropenie auftritt, kann das Risiko einer schweren psychiatrischen Erkrankung durch das Absetzen der Behandlung mit CLOZARIL größer sein als das Risiko einer erneuten Provokation (z. B. Patienten mit einer schweren schizophrenen Erkrankung, die außer CLOZARIL keine Behandlungsoptionen haben). Eine hämatologische Beratung kann hilfreich sein, um zu entscheiden, einen Patienten erneut herauszufordern. Im Allgemeinen sollten Patienten, die eine schwere Neutropenie entwickeln, jedoch nicht erneut mit CLOZARIL oder einem Clozapin-Produkt behandelt werden.
Wenn bei einem Patienten eine erneute Provokation durchgeführt wird, sollte der Kliniker die in den Tabellen 2 und 3 angegebenen Schwellenwerte, die medizinische und psychiatrische Vorgeschichte des Patienten, ein Gespräch mit dem Patienten und seiner/ihrer Pflegekraft über Nutzen und Risiken einer erneuten Provokation mit CLOZARIL 50 mg und berücksichtigen die Schwere und Merkmale der neutropenischen Episode.
Verwendung von CLOZARIL mit anderen Arzneimitteln im Zusammenhang mit Neutropenie
Es ist unklar, ob die gleichzeitige Anwendung anderer Arzneimittel, von denen bekannt ist, dass sie Neutropenie verursachen, das Risiko oder den Schweregrad einer CLOZARIL-induzierten Neutropenie erhöht. Es gibt keine überzeugende wissenschaftliche Begründung dafür, die Behandlung mit CLOZARIL bei Patienten, die gleichzeitig mit diesen Arzneimitteln behandelt werden, zu vermeiden. Wenn CLOZARIL 100 mg gleichzeitig mit einem Wirkstoff angewendet wird, von dem bekannt ist, dass er Neutropenie verursacht (z. B. einige Chemotherapeutika), erwägen Sie eine Überwachung der Patienten, die über die in den Tabellen 2 und 3 angegebenen Behandlungsrichtlinien hinausgeht. Wenden Sie sich bei Patienten, die gleichzeitig eine Chemotherapie erhalten, an den behandelnden Onkologen.
Clozapin-REMS-Programm
CLOZARIL ist aufgrund des Risikos einer schweren Neutropenie nur über ein eingeschränktes Programm im Rahmen eines REMS namens Clozapine REMS Program erhältlich.
Zu den bemerkenswerten Anforderungen des Clozapin-REMS-Programms gehören:
Weitere Informationen sind unter www.clozapinerems.com oder 1-844-267-8678 erhältlich.
Orthostatische Hypotonie, Bradykardie und Synkope
Bei der Behandlung mit Clozapin sind Hypotonie, Bradykardie, Synkope und Herzstillstand aufgetreten. Das Risiko ist während der anfänglichen Titrationsphase am höchsten, insbesondere bei schneller Dosissteigerung. Diese Reaktionen können bei der ersten Dosis auftreten, bei Dosen von nur 12,5 mg. Diese Reaktionen können tödlich sein. Das Syndrom stimmt mit einer neural vermittelten Reflexbradykardie (NMRB) überein.
Die Behandlung muss mit einer Höchstdosis von 12,5 mg einmal täglich oder zweimal täglich beginnen. Die tägliche Gesamtdosis kann bei guter Verträglichkeit in Schritten von 25 mg bis 50 mg pro Tag bis zum Ende von 2 Wochen auf eine Zieldosis von 300 mg bis 450 mg pro Tag (verabreicht in geteilten Dosen) erhöht werden. Anschließend kann die Dosis wöchentlich oder zweimal wöchentlich in Schritten von bis zu 100 mg erhöht werden. Die Höchstdosis beträgt 900 mg pro Tag. Verwenden Sie eine vorsichtige Titration und ein geteiltes Dosierungsschema, um das Risiko schwerwiegender kardiovaskulärer Reaktionen zu minimieren [siehe DOSIERUNG UND ANWENDUNG ]. Erwägen Sie, die Dosis zu reduzieren, wenn Hypotonie auftritt. Bei Wiederaufnahme der Behandlung mit Patienten, die CLOZARIL auch nur kurz abgesetzt haben (dh 2 Tage oder länger seit der letzten Dosis), ist die Behandlung mit 12,5 mg einmal täglich oder zweimal täglich wieder aufzunehmen [siehe DOSIERUNG UND ANWENDUNG ].
Verwenden Sie CLOZARIL vorsichtig bei Patienten mit kardiovaskulären Erkrankungen (Myokardinfarkt oder Ischämie in der Vorgeschichte, Herzinsuffizienz oder Leitungsstörungen), zerebrovaskulären Erkrankungen und Zuständen, die Patienten für Hypotonie prädisponieren würden (z. B. gleichzeitige Anwendung von Antihypertensiva, Dehydratation und Hypovolämie).
Stürze
CLOZARIL 25 mg kann Somnolenz, orthostatische Hypotonie, motorische und sensorische Instabilität verursachen, was zu Stürzen und folglich zu Knochenbrüchen oder anderen Verletzungen führen kann. Führen Sie bei Patienten mit Krankheiten, Zuständen oder Medikamenten, die diese Wirkungen verschlimmern könnten, zu Beginn einer antipsychotischen Behandlung und wiederholt bei Patienten unter einer langfristigen antipsychotischen Therapie eine Sturzrisikobewertung durch.
Krampfanfälle
Es wurde geschätzt, dass Krampfanfälle im Zusammenhang mit der Anwendung von Clozapin mit einer kumulativen Inzidenz nach einem Jahr von etwa 5 % auftreten, basierend auf dem Auftreten von einem oder mehreren Krampfanfällen bei 61 von 1743 Patienten, die Clozapin während seiner klinischen Tests vor der Inlandsvermarktung (d. h , ein roher Steuersatz von 3,5 %). Das Krampfrisiko ist dosisabhängig. Beginnen Sie die Behandlung mit einer niedrigen Dosis (12,5 mg), titrieren Sie langsam und verwenden Sie geteilte Dosierungen.
Seien Sie vorsichtig bei der Verabreichung von CLOZARIL 50 mg an Patienten mit Krampfanfällen in der Vorgeschichte oder anderen prädisponierenden Risikofaktoren für Krampfanfälle (z. B. Kopftrauma oder andere ZNS-Erkrankungen, Einnahme von Medikamenten, die die Krampfschwelle senken, oder Alkoholmissbrauch). Wegen des erheblichen Anfallsrisikos im Zusammenhang mit der Anwendung von CLOZARIL sollten Patienten davor gewarnt werden, sich an Aktivitäten zu beteiligen, bei denen ein plötzlicher Bewusstseinsverlust ein ernsthaftes Risiko für sie selbst oder andere darstellen könnte (z. B. Autofahren, Bedienen komplexer Maschinen, Schwimmen, Klettern).
Myokarditis, Kardiomyopathie und Mitralklappeninsuffizienz
Bei der Anwendung von CLOZARIL sind Myokarditis und Kardiomyopathie aufgetreten. Diese Reaktionen können tödlich sein. CLOZARIL 25 mg absetzen und bei Verdacht auf Myokarditis oder Kardiomyopathie eine Herzuntersuchung durchführen lassen. Im Allgemeinen sollten Patienten mit Clozapin-assoziierter Myokarditis oder Kardiomyopathie in der Vorgeschichte nicht erneut mit CLOZARIL behandelt werden. Wenn jedoch der Nutzen der Behandlung mit CLOZARIL 25 mg die potenziellen Risiken einer rezidivierenden Myokarditis oder Kardiomyopathie überwiegt, kann der Arzt in Absprache mit einem Kardiologen, nach einer vollständigen kardiologischen Untersuchung und unter engmaschiger Überwachung eine erneute Provokation mit CLOZARIL in Betracht ziehen.
Erwägen Sie die Möglichkeit einer Myokarditis oder Kardiomyopathie bei Patienten, die CLOZARIL erhalten und Brustschmerzen, Dyspnoe, anhaltende Tachykardie im Ruhezustand, Palpitationen, Fieber, grippeähnliche Symptome, Hypotonie, andere Anzeichen oder Symptome einer Herzinsuffizienz oder elektrokardiographische Befunde (niedrige Spannung, ST-T-Anomalien, Arrhythmien, Abweichung der rechten Achse und schlechte R-Zacken-Progression). Myokarditis tritt am häufigsten innerhalb der ersten 2 Monate der Behandlung mit Clozapin auf. Die Symptome einer Kardiomyopathie treten im Allgemeinen später als eine Clozapin-assoziierte Myokarditis auf und normalerweise nach 8-wöchiger Behandlung. Myokarditis und Kardiomyopathie können jedoch zu jedem Zeitpunkt während der Behandlung mit CLOZARIL auftreten. Es ist üblich, dass unspezifische grippeähnliche Symptome wie Unwohlsein, Myalgie, pleuritischer Brustschmerz und leichtes Fieber offensichtlicheren Anzeichen einer Herzinsuffizienz vorausgehen. Typische Laborbefunde sind erhöhtes Troponin I oder T, erhöhte Kreatininkinase-MB, periphere Eosinophilie und erhöhtes C-reaktives Protein (CRP). Röntgenaufnahmen des Brustkorbs können eine Vergrößerung der Herzsilhouette zeigen, und bildgebende Verfahren des Herzens (Echokardiogramm, Radionukleotidstudien oder Herzkatheteruntersuchung) können Hinweise auf eine linksventrikuläre Dysfunktion zeigen. Bei Patienten, bei denen während der Einnahme von CLOZARIL 50 mg eine Kardiomyopathie diagnostiziert wurde, wurde über Mitralklappeninsuffizienz berichtet. Diese Fälle berichteten entweder leichte oder mittelschwere Mitralinsuffizienz in der zweidimensionalen Echokardiographie. Erwägen Sie bei Patienten mit Verdacht auf Kardiomyopathie eine 2D-Echo-Doppler-Untersuchung, um eine Mitralklappeninsuffizienz festzustellen.
Erhöhte Sterblichkeit bei älteren Patienten mit demenzbedingter Psychose
Ältere Patienten mit demenzbedingter Psychose, die mit Antipsychotika behandelt werden, haben ein erhöhtes Sterberisiko. Analysen von 17 placebokontrollierten Studien (modale Dauer von 10 Wochen), hauptsächlich bei Patienten, die atypische Antipsychotika einnahmen, ergaben ein Todesrisiko bei mit Arzneimitteln behandelten Patienten, das zwischen dem 1,6- und 1,7-fachen des Todesrisikos bei mit Placebo behandelten Patienten lag. Im Verlauf einer typischen 10-wöchigen kontrollierten Studie betrug die Todesrate bei mit Arzneimitteln behandelten Patienten etwa 4,5 %, verglichen mit einer Rate von etwa 2,6 % in der Placebogruppe. Obwohl die Todesursachen unterschiedlich waren, schienen die meisten Todesfälle entweder kardiovaskulärer (z. B. Herzinsuffizienz, plötzlicher Tod) oder infektiöser (z. B. Lungenentzündung) Natur zu sein. Beobachtungsstudien deuten darauf hin, dass die Behandlung mit konventionellen Antipsychotika, ähnlich wie bei atypischen Antipsychotika, die Sterblichkeit in dieser Population erhöhen kann. Inwieweit die Befunde einer erhöhten Sterblichkeit in Beobachtungsstudien auf das Antipsychotikum im Gegensatz zu einigen Merkmalen der Patienten zurückgeführt werden können, ist nicht klar. CLOZARIL ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen [siehe Eingerahmte Warnung ].
Gastrointestinale Hypomotilität mit schweren Komplikationen
Bei der Anwendung von CLOZARIL sind schwere gastrointestinale Nebenwirkungen aufgetreten, hauptsächlich aufgrund seiner starken anticholinergen Wirkung und der daraus resultierenden gastrointestinalen Hypomotilität. Nach der Markteinführung reichen die berichteten Wirkungen von Verstopfung bis hin zu paralytischem Ileus. Eine erhöhte Häufigkeit von Verstopfung und eine verzögerte Diagnose und Behandlung erhöhten das Risiko schwerer Komplikationen der gastrointestinalen Hypomotilität, die zu Darmverschluss, Kotstau, Megakolon und intestinaler Ischämie oder Infarkt führten [siehe NEBENWIRKUNG ]. Diese Reaktionen führten zu Krankenhausaufenthalten, Operationen und zum Tod. Das Risiko schwerer Nebenwirkungen wird durch Anticholinergika (und andere Medikamente, die die Magen-Darm-Peristaltik verringern) weiter erhöht; daher sollte die gleichzeitige Anwendung nach Möglichkeit vermieden werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Vor Beginn der Behandlung mit CLOZARIL 50 mg auf Verstopfung untersuchen und gegebenenfalls behandeln. Subjektive Verstopfungssymptome spiegeln den Grad der gastrointestinalen Hypomotilität bei mit CLOZARIL behandelten Patienten möglicherweise nicht genau wider. Überprüfen Sie daher regelmäßig die Darmfunktion und achten Sie sorgfältig auf Veränderungen in der Häufigkeit oder Art des Stuhlgangs sowie auf Anzeichen und Symptome von Komplikationen der Hypomotilität (z. B. Übelkeit, Erbrechen, aufgeblähter Bauch, Bauchschmerzen). Wenn Obstipation oder gastrointestinale Hypomotilität festgestellt werden, ist eine engmaschige Überwachung durchzuführen und bei Bedarf unverzüglich mit geeigneten Abführmitteln zu behandeln, um schwere Komplikationen zu vermeiden. Erwägen Sie prophylaktische Abführmittel bei Hochrisikopatienten.
Eosinophilie
Eosinophilie, definiert als Bluteosinophilenzahl von mehr als 700/μl, ist unter der Behandlung mit CLOZARIL 100 mg aufgetreten. In klinischen Studien entwickelte etwa 1 % der Patienten eine Eosinophilie. Clozapin-assoziierte Eosinophilie tritt gewöhnlich im ersten Behandlungsmonat auf. Bei einigen Patienten wurde es mit Myokarditis, Pankreatitis, Hepatitis, Colitis und Nephritis in Verbindung gebracht. Eine solche Organbeteiligung könnte mit einer Arzneimittelreaktion mit Eosinophilie und systemischem Symptomsyndrom (DRESS), auch bekannt als arzneimittelinduziertes Überempfindlichkeitssyndrom (DIHS), vereinbar sein. Wenn sich während der Behandlung mit CLOZARIL eine Eosinophilie entwickelt, ist unverzüglich auf Anzeichen und Symptome systemischer Reaktionen wie Hautausschlag oder andere allergische Symptome, Myokarditis oder andere organspezifische Erkrankungen im Zusammenhang mit Eosinophilie zu untersuchen. Bei Verdacht auf eine CLOZARIL-bedingte systemische Erkrankung ist CLOZARIL 50 mg sofort abzusetzen.
Wenn eine Ursache der Eosinophilie identifiziert wird, die nicht mit CLOZARIL 50 mg zusammenhängt (z. B. Asthma, Allergien, Kollagenose, parasitäre Infektionen und spezifische Neubildungen), behandeln Sie die zugrunde liegende Ursache und setzen Sie die Behandlung mit CLOZARIL fort.
Eine Clozapin-bedingte Eosinophilie ist auch ohne Organbeteiligung aufgetreten und kann ohne Intervention verschwinden. Es gibt Berichte über eine erfolgreiche Rechallenge nach Absetzen von Clozapin ohne Wiederauftreten der Eosinophilie. Wenn keine Organbeteiligung vorliegt, setzen Sie die Behandlung mit CLOZARIL unter sorgfältiger Überwachung fort. Wenn die Gesamtzahl der Eosinophilen über mehrere Wochen hinweg weiter ansteigt, ohne dass eine systemische Erkrankung vorliegt, sollte die Entscheidung, die Therapie mit CLOZARIL 25 mg zu unterbrechen und nach Abnahme der Zahl der Eosinophilen erneut zu provozieren, auf der Grundlage der klinischen Gesamtbeurteilung in Absprache mit einem Internisten oder Hämatologen getroffen werden.
Verlängerung des QT-Intervalls
QT-Verlängerung, Torsade de Pointes und andere lebensbedrohliche ventrikuläre Arrhythmien, Herzstillstand und plötzlicher Tod sind unter der Behandlung mit CLOZARIL 100 mg aufgetreten. Berücksichtigen Sie bei der Verschreibung von CLOZARIL das Vorhandensein zusätzlicher Risikofaktoren für eine QT-Verlängerung und schwerwiegende kardiovaskuläre Reaktionen. Bedingungen, die diese Risiken erhöhen, umfassen die folgenden: QT-Verlängerung in der Anamnese, Long-QT-Syndrom, Familienanamnese mit Long-QT-Syndrom oder plötzlichem Herztod, signifikante Herzrhythmusstörungen, kürzlich aufgetretener Myokardinfarkt, unkompensierte Herzinsuffizienz, Behandlung mit anderen Medikamenten, die eine QT-Verlängerung verursachen, Behandlung mit Medikamenten, die den Metabolismus von Clozapin hemmen, und Elektrolytanomalien.
Führen Sie vor Beginn der Behandlung mit CLOZARIL 25 mg eine sorgfältige körperliche Untersuchung, Anamnese und Begleitmedikation durch. Erwägen Sie, ein Ausgangs-EKG und ein Serumchemie-Panel zu erstellen. Korrigieren Sie Elektrolytanomalien. CLOZARIL 25 mg absetzen, wenn das QTc-Intervall 500 ms überschreitet. Wenn bei Patienten Symptome auftreten, die mit Torsades de Pointes oder anderen Arrhythmien (z. B. Synkope, Präsynkope, Schwindel oder Herzklopfen) übereinstimmen, lassen Sie eine Herzuntersuchung durchführen und setzen Sie CLOZARIL ab.
Seien Sie vorsichtig, wenn Sie gleichzeitig Arzneimittel verabreichen, die das QT-Intervall verlängern oder den Metabolismus von CLOZARIL hemmen. Zu den Medikamenten, die eine QT-Verlängerung verursachen, gehören: spezifische Antipsychotika (z. B. Ziprasidon, Iloperidon, Chlorpromazin, Thioridazin, Mesoridazin, Droperidol, Pimozid), spezifische Antibiotika (z. B. Erythromycin, Gatifloxacin, Moxifloxacin, Sparfloxacin), Antiarrhythmika der Klasse 1A (z. B. Chinidin, Procainamid) oder Antiarrhythmika der Klasse III (z. B. Amiodaron, Sotalol) und andere (z. B. Pentamidin, Levomethadylacetat, Methadon, Halofantrin, Mefloquin, Dolasetronmesylat, Probucol oder Tacrolimus). Clozapin wird hauptsächlich durch die CYP-Isoenzyme 1A2, 2D6 und 3A4 metabolisiert. Die gleichzeitige Behandlung mit Inhibitoren dieser Enzyme kann die Konzentration von CLOZARIL erhöhen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
Hypokaliämie und Hypomagnesiämie erhöhen das Risiko einer QT-Verlängerung. Eine Hypokaliämie kann aus einer diuretischen Therapie, Durchfall und anderen Ursachen resultieren. Seien Sie vorsichtig bei der Behandlung von Patienten mit einem Risiko für signifikante Elektrolytstörungen, insbesondere Hypokaliämie. Erhalten Sie Basislinienmessungen der Kalium- und Magnesiumspiegel im Serum und überwachen Sie regelmäßig die Elektrolyte. Korrigieren Sie Elektrolytanomalien, bevor Sie mit der Behandlung mit CLOZARIL beginnen.
Stoffwechselveränderungen
Atypische Antipsychotika, einschließlich CLOZARIL 50 mg, wurden mit Stoffwechselveränderungen in Verbindung gebracht, die das kardiovaskuläre und zerebrovaskuläre Risiko erhöhen können. Diese metabolischen Veränderungen umfassen Hyperglykämie, Dyslipidämie und Körpergewichtszunahme. Während atypische Antipsychotika einige metabolische Veränderungen hervorrufen können, hat jedes Medikament in der Klasse sein eigenes spezifisches Risikoprofil.
Hyperglykämie und Diabetes mellitus
Hyperglykämie, in einigen Fällen extrem und verbunden mit Ketoazidose oder hyperosmolarem Koma oder Tod, wurde bei Patienten berichtet, die mit atypischen Antipsychotika einschließlich CLOZARIL behandelt wurden. Die Beurteilung des Zusammenhangs zwischen der atypischen Anwendung von Antipsychotika und Glukoseanomalien wird durch die Möglichkeit eines erhöhten Hintergrundrisikos für Diabetes mellitus bei Patienten mit Schizophrenie und die zunehmende Inzidenz von Diabetes mellitus in der Allgemeinbevölkerung erschwert. Angesichts dieser Confounder ist die Beziehung zwischen der atypischen Anwendung von Antipsychotika und Hyperglykämie-bedingten Nebenwirkungen nicht vollständig geklärt. Epidemiologische Studien deuten jedoch auf ein erhöhtes Risiko für behandlungsbedingte, Hyperglykämie-bedingte Nebenwirkungen bei Patienten hin, die mit atypischen Antipsychotika behandelt werden. Präzise Risikoabschätzungen für Hyperglykämie-bedingte Nebenwirkungen bei Patienten, die mit atypischen Antipsychotika behandelt werden, sind nicht verfügbar.
Patienten mit einer gesicherten Diagnose von Diabetes mellitus, die mit CLOZARIL 100 mg begonnen werden, sollten regelmäßig auf eine Verschlechterung der Glukosekontrolle überwacht werden. Patienten mit Risikofaktoren für Diabetes mellitus (z. B. Fettleibigkeit, Diabetes in der Familienanamnese), die eine Behandlung mit atypischen Antipsychotika beginnen, sollten zu Beginn der Behandlung und in regelmäßigen Abständen während der Behandlung einer Nüchtern-Blutzuckermessung unterzogen werden. Jeder Patient, der mit atypischen Antipsychotika behandelt wird, sollte auf Symptome einer Hyperglykämie einschließlich Polydipsie, Polyurie, Polyphagie und Schwäche überwacht werden. Patienten, die während der Behandlung mit atypischen Antipsychotika Symptome einer Hyperglykämie entwickeln, sollten sich einer Nüchtern-Blutzuckermessung unterziehen. In einigen Fällen klang die Hyperglykämie ab, wenn das atypische Antipsychotikum abgesetzt wurde; Einige Patienten benötigten jedoch trotz Absetzens des verdächtigen Medikaments eine Fortsetzung der antidiabetischen Behandlung.
In einer gepoolten Datenanalyse von 8 Studien an erwachsenen Probanden mit Schizophrenie betrugen die mittleren Veränderungen der Glukosekonzentration im Nüchternzustand in der CLOZARIL 50 mg- und der Chlorpromazin-Gruppe +11 mg/dl bzw. +4 mg/dl. Ein größerer Anteil der CLOZARIL-Gruppe zeigte im Vergleich zur Chlorpromazin-Gruppe einen kategorischen Anstieg der Nüchtern-Glukosekonzentrationen gegenüber dem Ausgangswert (Tabelle 4). Die Dosen von CLOZARIL 25 mg betrugen 100–900 mg pro Tag (mittlere modale Dosis: 512 mg pro Tag). Die maximale Chlorpromazin-Dosis betrug 1800 mg pro Tag (mittlere modale Dosis: 1029 mg pro Tag). Die mediane Expositionsdauer betrug 42 Tage für CLOZARIL und Chlorpromazin.
Dyslipidämie
Unerwünschte Lipidveränderungen sind bei Patienten aufgetreten, die mit atypischen Antipsychotika, einschließlich CLOZARIL, behandelt wurden. Bei Patienten, die CLOZARIL anwenden, wird eine klinische Überwachung, einschließlich Baseline- und regelmäßiger Follow-up-Lipidbewertungen, empfohlen.
In einer gepoolten Datenanalyse von 10 Studien an erwachsenen Probanden mit Schizophrenie war die Behandlung mit CLOZARIL mit einem Anstieg des Gesamtcholesterins im Serum verbunden. Es wurden keine Daten zu LDL- und HDL-Cholesterin erhoben. Der mittlere Anstieg des Gesamtcholesterins betrug 13 mg/dl in der CLOZARIL-25-mg-Gruppe und 15 mg/dl in der Chlorpromazin-Gruppe. In einer gepoolten Datenanalyse von 2 Studien an erwachsenen Probanden mit Schizophrenie war die Behandlung mit CLOZARIL 50 mg mit einem Anstieg der Nüchtern-Serumtriglyceride verbunden. Der mittlere Anstieg der Nüchtern-Triglyceride betrug 71 mg/dl (54 %) in der CLOZARIL-100-mg-Gruppe und 39 mg/dl (35 %) in der Chlorpromazin-Gruppe (Tabelle 5). Darüber hinaus war die Behandlung mit CLOZARIL mit einem kategorischen Anstieg des Gesamtcholesterins und der Triglyceride im Serum verbunden, wie in Tabelle 6 dargestellt. Der Anteil der Patienten mit einem kategorischen Anstieg des Gesamtcholesterins oder der Nüchtern-Triglyceride nahm mit der Dauer der Exposition zu. Die mediane Dauer der Exposition gegenüber CLOZARIL 50 mg und Chlorpromazin betrug 45 Tage bzw. 38 Tage. Der Dosisbereich von CLOZARIL lag zwischen 100 mg und 900 mg täglich; die maximale Chlorpromazin-Dosis betrug 1800 mg täglich.
Gewichtszunahme
Bei der Anwendung von Antipsychotika, einschließlich CLOZARIL, ist eine Gewichtszunahme aufgetreten. Überwachen Sie das Gewicht während der Behandlung mit CLOZARIL. Tabelle 7 fasst die Daten zur Gewichtszunahme nach Expositionsdauer zusammen, die aus 11 Studien mit CLOZARIL und aktiven Vergleichspräparaten gepoolt wurden. Die mediane Expositionsdauer betrug 609, 728 bzw. 42 Tage in der CLOZARIL-25-mg-, Olanzapin- bzw. Chlorpromazin-Gruppe.
Tabelle 8 fasst gepoolte Daten aus 11 Studien an erwachsenen Probanden mit Schizophrenie zusammen, die eine Gewichtszunahme von ≥ 7 % des Körpergewichts relativ zum Ausgangswert zeigten. Die mediane Expositionsdauer betrug 609, 728 bzw. 42 Tage in der CLOZARIL-, Olanzapin- bzw. Chlorpromazin-Gruppe.
Malignes neuroleptisches Syndrom
Antipsychotische Arzneimittel, einschließlich CLOZARIL 50 mg, können einen potenziell tödlichen Symptomkomplex hervorrufen, der als malignes neuroleptisches Syndrom (NMS) bezeichnet wird. Klinische Manifestationen von NMS umfassen Hyperpyrexie, Muskelrigidität, veränderten Geisteszustand und autonome Instabilität (unregelmäßiger Puls oder Blutdruck, Tachykardie, Diaphorese und Herzrhythmusstörungen). Begleitende Befunde können erhöhte Kreatinphosphokinase (CPK), Myoglobinurie, Rhabdomyolyse und akutes Nierenversagen umfassen.
Die diagnostische Beurteilung von Patienten mit diesem Syndrom ist kompliziert. Es ist wichtig, das Vorhandensein anderer schwerwiegender Erkrankungen (z. B. schwere Neutropenie, Infektion, Hitzschlag, primäre ZNS-Pathologie, zentrale anticholinerge Toxizität, extrapyramidale Symptome und Arzneimittelfieber) zu berücksichtigen.
Das Management von NMS sollte (1) das sofortige Absetzen von Antipsychotika und anderen Arzneimitteln, die für die gleichzeitige Therapie nicht unbedingt erforderlich sind, (2) eine intensive symptomatische Behandlung und medizinische Überwachung und (3) die Behandlung von komorbiden Erkrankungen umfassen. Es gibt keine allgemeine Vereinbarung über spezifische pharmakologische Behandlungen für NMS.
Wenn ein Patient nach Genesung von NMS eine antipsychotische medikamentöse Behandlung benötigt, sollte die mögliche Wiederaufnahme der medikamentösen Therapie sorgfältig erwogen werden. NMS kann wiederkehren. Bei Wiederaufnahme der Behandlung mit Antipsychotika engmaschig überwachen.
NMS ist bei der CLOZARIL-Monotherapie und bei gleichzeitiger ZNS-aktiver Medikation, einschließlich Lithium, aufgetreten.
Hepatotoxizität
Schwere, lebensbedrohliche und in einigen Fällen tödliche Hepatotoxizität, einschließlich Leberversagen, Lebernekrose und Hepatitis, wurden in Post-Marketing-Studien bei mit Clozapin behandelten Patienten berichtet [siehe NEBENWIRKUNGEN ]. Überwachen Sie das Auftreten von Anzeichen und Symptomen einer Hepatotoxizität wie Müdigkeit, Unwohlsein, Anorexie, Übelkeit, Gelbsucht, Bilirubinämie, Koagulopathie und hepatische Enzephalopathie. Führen Sie Serumtests auf Leberschäden durch und erwägen Sie ein dauerhaftes Absetzen der Behandlung, wenn Hepatitis oder Transaminasenerhöhungen in Kombination mit anderen systemischen Symptomen auf Clozapin zurückzuführen sind.
Fieber
Während der Clozapin-Therapie kam es bei Patienten zu vorübergehendem Clozapin-bedingtem Fieber. Die höchste Inzidenz liegt innerhalb der ersten 3 Behandlungswochen. Obwohl dieses Fieber im Allgemeinen gutartig und selbstlimitierend ist, kann es erforderlich sein, die Behandlung abzubrechen. Das Fieber kann mit einer Zunahme oder Abnahme der Leukozytenzahl einhergehen. Untersuchen Sie Patienten mit Fieber sorgfältig, um eine schwere Neutropenie oder Infektion auszuschließen. Betrachten Sie die Möglichkeit von NMS [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Lungenembolie
Bei Patienten, die mit CLOZARIL behandelt wurden, sind Lungenembolien und tiefe Venenthrombosen aufgetreten. Berücksichtigen Sie die Möglichkeit einer Lungenembolie bei Patienten mit tiefer Venenthrombose, akuter Dyspnoe, Brustschmerzen oder anderen respiratorischen Anzeichen und Symptomen. Ob Lungenembolie und tiefe Venenthrombose auf Clozapin oder auf bestimmte Merkmale der Patienten zurückzuführen sind, ist nicht klar.
Anticholinerge Toxizität
CLOZARIL 50 mg hat starke anticholinerge Wirkungen. Die Behandlung mit CLOZARIL kann zu ZNS- und peripherer anticholinerger Toxizität führen, insbesondere bei höheren Dosierungen oder in Überdosierungssituationen [siehe ÜBERDOSIERUNG ]. Bei Patienten mit aktueller Diagnose oder Vorgeschichte von Verstopfung, Harnverhalt, klinisch signifikanter Prostatahypertrophie oder anderen Erkrankungen, bei denen anticholinerge Wirkungen zu erheblichen Nebenwirkungen führen können, ist Vorsicht geboten. Vermeiden Sie nach Möglichkeit die gleichzeitige Anwendung mit anderen Anticholinergika, da das Risiko einer anticholinergen Toxizität oder schwerer gastrointestinaler Nebenwirkungen erhöht ist [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Beeinträchtigung der kognitiven und motorischen Leistung
CLOZARIL kann Sedierung und Beeinträchtigung der kognitiven und motorischen Leistungsfähigkeit verursachen. Warnen Sie die Patienten vor dem Bedienen gefährlicher Maschinen, einschließlich Autos, bis sie hinreichend sicher sind, dass CLOZARIL keine nachteiligen Auswirkungen auf sie hat. Diese Reaktionen können dosisabhängig sein. Erwägen Sie, die Dosis zu reduzieren, wenn sie auftreten.
Tardive Dyskinesie
Spätdyskinesie (TD) ist bei Patienten aufgetreten, die mit Antipsychotika, einschließlich CLOZARIL, behandelt wurden. Das Syndrom besteht aus potenziell irreversiblen, unwillkürlichen, dyskinetischen Bewegungen. Es wird angenommen, dass das Risiko einer TD und die Wahrscheinlichkeit, dass sie irreversibel wird, mit längerer Behandlungsdauer und höheren kumulativen Gesamtdosen zunimmt. Das Syndrom kann sich jedoch nach relativ kurzen Behandlungszeiten bei niedrigen Dosen entwickeln. Verschreiben Sie CLOZARIL in einer Weise, die das Risiko der Entwicklung einer TD am wahrscheinlichsten minimiert. Verwenden Sie die niedrigste wirksame Dosis und die kürzeste Behandlungsdauer, die zur Kontrolle der Symptome erforderlich ist. Überprüfen Sie regelmäßig die Notwendigkeit einer Fortsetzung der Behandlung. Erwägen Sie, die Behandlung abzubrechen, wenn TD auftritt. Einige Patienten können jedoch trotz des Vorliegens des Syndroms eine Behandlung mit CLOZARIL 100 mg benötigen.
Es gibt keine bekannte Behandlung für TD. Das Syndrom kann jedoch teilweise oder vollständig zurückgehen, wenn die Behandlung abgesetzt wird. Die antipsychotische Behandlung selbst kann die Anzeichen und Symptome unterdrücken (oder teilweise unterdrücken) und hat das Potenzial, den zugrunde liegenden Prozess zu maskieren. Die Auswirkung der Symptomunterdrückung auf den Langzeitverlauf von TD ist nicht bekannt.
Zerebrovaskuläre Nebenwirkungen
In kontrollierten Studien hatten ältere Patienten mit demenzbedingter Psychose, die mit einigen atypischen Antipsychotika behandelt wurden, ein erhöhtes Risiko (im Vergleich zu Placebo) für zerebrovaskuläre Nebenwirkungen (z. B. Schlaganfall, transitorische ischämische Attacke), einschließlich Todesfällen. Der Mechanismus für dieses erhöhte Risiko ist nicht bekannt. Ein erhöhtes Risiko für CLOZARIL oder andere Antipsychotika oder andere Patientenpopulationen kann nicht ausgeschlossen werden. CLOZARIL 50 mg sollte bei Patienten mit Risikofaktoren für zerebrovaskuläre Nebenwirkungen mit Vorsicht angewendet werden.
Wiederauftreten von Psychosen und cholinergischem Rebound nach abruptem Absetzen von CLOZARIL
Wenn ein abruptes Absetzen von CLOZARIL erforderlich ist (z. B. aufgrund einer schweren Neutropenie oder einer anderen Erkrankung) [siehe DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN ], überwachen Sie sorgfältig das Wiederauftreten psychotischer Symptome und Nebenwirkungen im Zusammenhang mit einem cholinergen Rebound, wie z. B. starkes Schwitzen, Kopfschmerzen, Übelkeit, Erbrechen und Durchfall.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
In Langzeitstudien an Mäusen und Ratten mit Dosen bis zum 0,3-Fachen bzw. 0,4-Fachen der maximal empfohlenen Humandosis (MRHD) von 900 mg/Tag, bezogen auf mg/m² Körperoberfläche, wurde kein karzinogenes Potenzial nachgewiesen.
Mutagenese
Clozapin war nicht genotoxisch, wenn es in den folgenden Genmutations- und Chromosomenaberrationstests getestet wurde: dem bakteriellen Ames-Test, dem In-vitro-Säugetier-V79-Test in chinesischen Hamsterzellen, der außerplanmäßigen In-vitro-DNA-Synthese in Rattenhepatozyten oder dem In-vivo-Mikronukleus-Assay in Mäusen.
Beeinträchtigung der Fruchtbarkeit
Clozapin hatte keinen Einfluss auf Fertilitätsparameter, Trächtigkeit, fötales Gewicht oder postnatale Entwicklung, wenn es männlichen Ratten 70 Tage vor der Paarung und weiblichen Ratten 14 Tage vor der Paarung in Dosen bis zum 0,4-Fachen der MRHD von 900 mg/Tag oral verabreicht wurde auf Basis von mg/m² Körperoberfläche.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie B
Zusammenfassung der Risiken
Es liegen keine adäquaten oder gut kontrollierten Studien zu Clozapin bei Schwangeren vor.
Reproduktionsstudien wurden an Ratten und Kaninchen mit Dosierungen bis zum 0,4- bzw. 0,9-Fachen der maximal empfohlenen Humandosis (MRHD) von 900 mg/Tag auf Basis von mg/m² Körperoberfläche durchgeführt. Die Studien ergaben keine Hinweise auf eine Beeinträchtigung der Fertilität oder eine Schädigung des Fötus durch Clozapin. Da Reproduktionsstudien an Tieren nicht immer aussagekräftig für die menschliche Reaktion sind, sollte CLOZARIL während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Klinische Überlegungen
Berücksichtigen Sie das Risiko einer Verschlimmerung der Psychose, wenn Sie die Behandlung mit Antipsychotika während der Schwangerschaft und nach der Geburt abbrechen oder ändern. Erwägen Sie ein frühes Screening auf Schwangerschaftsdiabetes bei Patientinnen, die mit Antipsychotika behandelt werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Neugeborene, die während des dritten Schwangerschaftstrimesters antipsychotischen Arzneimitteln ausgesetzt waren, haben ein erhöhtes Risiko für extrapyramidale und/oder Entzugssymptome nach der Entbindung. Überwachen Sie Neugeborene auf Symptome wie Unruhe, Hypertonie, Hypotonie, Tremor, Somnolenz, Atemnot und Schwierigkeiten beim Füttern. Die Schwere der Komplikationen kann von selbstlimitierenden Symptomen bis hin zu einigen Neugeborenen reichen, die eine Intensivpflege und einen längeren Krankenhausaufenthalt erfordern.
Tierdaten
In Studien zur embryofetalen Entwicklung hatte Clozapin bei oraler Verabreichung an trächtige Ratten und Kaninchen während der Organogenese in Dosen bis zum 0,4- bzw. 0,9-Fachen der MRHD von 900 mg/Tag keine Auswirkungen auf maternale Parameter, Wurfgröße oder fetale Parameter auf Basis von mg/m² Körperoberfläche.
In peri-/postnatalen Entwicklungsstudien wurde trächtigen weiblichen Ratten Clozapin im letzten Trächtigkeitsdrittel und bis zum 21. Tag nach der Geburt verabreicht. Beobachtungen wurden an Föten bei der Geburt und während der Zeit nach der Geburt gemacht; Die Nachkommen durften die Geschlechtsreife erreichen und sich paaren. Clozapin verursachte eine Abnahme des mütterlichen Körpergewichts, hatte aber keine Auswirkungen auf die Wurfgröße oder das Körpergewicht der F1- oder F2-Generationen bei Dosen bis zum 0,4-fachen der MRHD von 900 mg/Tag auf Basis von mg/m² Körperoberfläche.
Stillende Mutter
CLOZARIL 50 mg ist in der Muttermilch enthalten. Aufgrund der Möglichkeit schwerwiegender Nebenwirkungen von CLOZARIL bei gestillten Säuglingen sollte unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter eine Entscheidung getroffen werden, ob das Stillen beendet oder das Arzneimittel abgesetzt werden soll.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Verwendung
Es gab keine ausreichende Anzahl von geriatrischen Patienten in klinischen Studien, in denen CLOZARIL 50 mg angewendet wurde, um festzustellen, ob sich Personen über 65 Jahren in ihrem Ansprechen auf CLOZARIL von jüngeren Personen unterscheiden.
Orthostatische Hypotonie und Tachykardie können unter der Behandlung mit CLOZARIL 50 mg auftreten [siehe Eingerahmte Warnung und WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Ältere Patienten, insbesondere solche mit eingeschränkter Herz-Kreislauf-Funktion, können anfälliger für diese Wirkungen sein.
Ältere Patienten können besonders anfällig für die anticholinergen Wirkungen von CLOZARIL sein, wie z. B. Harnverhalt und Verstopfung [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Wählen Sie CLOZARIL 50 mg-Dosen bei älteren Patienten sorgfältig aus und berücksichtigen Sie die häufigere Abnahme der Leber-, Nieren- oder Herzfunktion sowie andere Begleiterkrankungen und andere medikamentöse Therapien. Klinische Erfahrungen deuten darauf hin, dass die Prävalenz der tardiven Dyskinesie bei älteren Menschen am höchsten zu sein scheint; besonders ältere Frauen [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Patienten mit eingeschränkter Nieren- oder Leberfunktion
Bei Patienten mit erheblich eingeschränkter Nieren- oder Leberfunktion kann eine Dosisreduktion erforderlich sein. Die Konzentrationen von Clozapin können bei diesen Patienten erhöht sein, da Clozapin fast vollständig metabolisiert und dann ausgeschieden wird [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ].
CYP2D6 Schlechte Metabolisierer
Bei Patienten mit langsamen CYP2D6-Metabolisierern kann eine Dosisreduktion erforderlich sein. Die Konzentrationen von Clozapin können bei diesen Patienten erhöht sein, da Clozapin fast vollständig metabolisiert und dann ausgeschieden wird [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ].
Hospizpatienten
Bei Hospizpatienten (dh unheilbar kranken Patienten mit einer geschätzten Lebenserwartung von sechs Monaten oder weniger) kann der verschreibende Arzt die Häufigkeit der ANC-Überwachung nach Rücksprache mit dem Patienten und seiner/ihrer Pflegekraft auf einmal alle 6 Monate reduzieren. Individuelle Behandlungsentscheidungen sollten die Bedeutung der Überwachung von ANC im Zusammenhang mit der Notwendigkeit, psychiatrische Symptome und die unheilbare Erkrankung des Patienten zu kontrollieren, abwägen.
ÜBERDOSIS
Erfahrung mit Überdosierung
Die am häufigsten berichteten Anzeichen und Symptome im Zusammenhang mit einer Clozapin-Überdosierung sind: Sedierung, Delirium, Koma, Tachykardie, Hypotonie, Atemdepression oder -versagen; und Hypersalivation. Es gibt Berichte über Aspirationspneumonie, Herzrhythmusstörungen und Krampfanfälle. Tödliche Überdosierungen wurden mit Clozapin berichtet, im Allgemeinen bei Dosen über 2500 mg. Es gibt auch Berichte über Patienten, die sich von Überdosierungen von weit über 4 g erholten.
Management einer Überdosierung
Es gibt kein spezifisches Antidot für eine Überdosierung von CLOZARIL. Erstellen und erhalten Sie einen Atemweg; sorgen Sie für eine ausreichende Sauerstoffversorgung und Belüftung. Überwachen Sie den Herzstatus und die Vitalzeichen. Verwenden Sie allgemeine symptomatische und unterstützende Maßnahmen. Berücksichtigen Sie die Möglichkeit einer multiplen Drogenbeteiligung.
Wenden Sie sich an ein zertifiziertes Giftnotrufzentrum, um die aktuellsten Informationen zum Umgang mit einer Überdosierung zu erhalten (1-800-222-1222).
KONTRAINDIKATIONEN
CLOZARIL ist kontraindiziert bei Patienten mit bekannter schwerer Überempfindlichkeit gegenüber Clozapin (z. B. Lichtempfindlichkeit, Vaskulitis, Erythema multiforme oder Stevens-Johnson-Syndrom) oder einem anderen Bestandteil von CLOZARIL [siehe NEBENWIRKUNGEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Der Wirkungsmechanismus von Clozapin ist unbekannt. Es wurde jedoch vorgeschlagen, dass die therapeutische Wirksamkeit von Clozapin bei Schizophrenie durch Antagonismus der Dopamin-Typ-2- (D2) und Serotonin-Typ-2A- (5ÂHT2A)-Rezeptoren vermittelt wird. CLOZARIL wirkt auch als Antagonist an adrenergen, cholinergen, histaminergen und anderen dopaminergen und serotonergen Rezeptoren.
Pharmakodynamik
Clozapin zeigte Bindungsaffinität zu den folgenden Rezeptoren: Histamin H1 (Ki 1,1 nM), adrenerges α1A (Ki 1,6 nM), Serotonin 5-HT6 (Ki 4 nM), Serotonin 5-HT2A (Ki 5,4 nM), Muscarin M1 (Ki 6,2 nM), Serotonin 5-HT7 (Ki 6,3 nM), Serotonin 5-HT2C (Ki 9,4 nM), Dopamin D4 (Ki 24 nM), adrenerges α2A (Ki 90 nM), Serotonin 5-HT3 (Ki 95 nM), Serotonin 5-HT1A (Ki 120 nM), Dopamin D2 (Ki 160 nM), Dopamin D1 (Ki 270 nM), Dopamin D5 (Ki 454 nM) und Dopamin D3 (Ki 555 nM).
Clozapin verursacht wenig oder keine Prolaktinerhöhung.
Klinische Elektroenzephalogramm (EEG)-Studien zeigten, dass Clozapin die Delta- und Theta-Aktivität erhöht und dominante Alpha-Frequenzen verlangsamt. Es erfolgt eine verbesserte Synchronisation. Es können sich auch scharfe Wellenaktivität und Spike-and-Wave-Komplexe entwickeln. Patienten haben über eine Intensivierung der Traumaktivität während der Clozapin-Therapie berichtet. Es wurde festgestellt, dass der REM-Schlaf auf 85% der gesamten Schlafzeit erhöht wurde. Bei diesen Patienten trat der REM-Schlaf fast unmittelbar nach dem Einschlafen auf.
Pharmakokinetik
Absorption
Beim Menschen sind CLOZARIL-Tabletten (25 mg und 100 mg) genauso bioverfügbar wie eine CLOZARIL-Lösung. Nach oraler Gabe von CLOZARIL 100 mg zweimal täglich betrug die durchschnittliche maximale Plasmakonzentration im Steady-State 319 ng/ml (Bereich: 102 bis 771 ng/ml), die durchschnittlich 2,5 Stunden (Bereich: 1 bis 6 Stunden) danach auftrat Dosierung. Die durchschnittliche Mindestkonzentration im Steady State betrug 122 ng/ml (Bereich: 41 bis 343 ng/ml) nach einer Dosis von 100 mg zweimal täglich. Nahrungsmittel scheinen die systemische Bioverfügbarkeit von CLOZARIL nicht zu beeinflussen. Daher kann CLOZARIL 50 mg mit oder ohne Nahrung verabreicht werden.
Verteilung
Clozapin ist zu etwa 97 % an Serumproteine gebunden. Die Wechselwirkung zwischen Clozapin und anderen stark proteingebundenen Arzneimitteln wurde nicht vollständig untersucht, kann aber wichtig sein [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Stoffwechsel und Ausscheidung
Clozapin wird vor der Ausscheidung fast vollständig metabolisiert, und nur Spuren des unveränderten Arzneimittels werden im Urin und im Kot nachgewiesen. Clozapin ist ein Substrat für viele Cytochrom-P450-Isoenzyme, insbesondere CYP1A2, CYP2D6 und CYP3A4. Ungefähr 50 % der verabreichten Dosis werden im Urin und 30 % im Stuhl ausgeschieden. Die demethylierten, hydroxylierten und N-Oxid-Derivate sind Bestandteile sowohl im Urin als auch im Kot. Pharmakologische Tests haben gezeigt, dass der Desmethyl-Metabolit (Norclozapin) nur eine begrenzte Aktivität hat, während die hydroxylierten und N-Oxid-Derivate inaktiv waren. Die mittlere Eliminationshalbwertszeit von Clozapin nach einer Einzeldosis von 75 mg betrug 8 Stunden (Bereich: 4 bis 12 Stunden), verglichen mit einer mittleren Eliminationshalbwertszeit von 12 Stunden (Bereich: 4 bis 66 Stunden) nach Erreichen des Steady State mit 100 mg zweimal täglicher Dosierung.
Ein Vergleich zwischen Einzeldosis- und Mehrfachdosis-Gabe von Clozapin zeigte, dass die Eliminationshalbwertszeit nach Mehrfachgabe im Vergleich zu der nach Einzeldosis-Gabe signifikant ansteigt, was auf die Möglichkeit einer konzentrationsabhängigen Pharmakokinetik hindeutet. Im Steady State wurden jedoch ungefähr dosisproportionale Veränderungen in Bezug auf die AUC (Fläche unter der Kurve), die maximalen und minimalen Clozapin-Plasmakonzentrationen nach Verabreichung von 37,5, 75 und 150 mg zweimal täglich beobachtet.
Arzneimittelwechselwirkungsstudien
Fluvoxamin
An 16 schizophrenen Patienten, die Clozapin unter Steady-State-Bedingungen erhielten, wurde eine pharmakokinetische Studie durchgeführt. Nach gleichzeitiger Gabe von Fluvoxamin über 14 Tage waren die mittleren Talkonzentrationen von Clozapin und seinen Metaboliten, N-Desmethylclozapin und Clozapin-N-oxid, im Vergleich zu den Ausgangskonzentrationen im Steady-State um etwa das Dreifache erhöht.
Paroxetin, Fluoxetin und Sertralin
In einer Studie mit schizophrenen Patienten (n = 14), die Clozapin unter Steady-State-Bedingungen erhielten, führte die gleichzeitige Verabreichung von Paroxetin nur zu geringfügigen Veränderungen der Spiegel von Clozapin und seinen Metaboliten. Andere veröffentlichte Berichte beschreiben jedoch geringfügige Erhöhungen (weniger als das Zweifache) der Clozapin- und Metabolitenkonzentrationen, wenn Clozapin zusammen mit Paroxetin, Fluoxetin und Sertralin eingenommen wurde.
Spezifische Bevölkerungsstudien
Nieren- oder Leberfunktionsstörung
Es wurden keine spezifischen pharmakokinetischen Studien durchgeführt, um die Auswirkungen einer Nieren- oder Leberfunktionsstörung auf die Pharmakokinetik von Clozapin zu untersuchen. Höhere Clozapin-Plasmakonzentrationen sind bei Patienten mit erheblich eingeschränkter Nieren- oder Leberfunktion wahrscheinlich, wenn sie die üblichen Dosen erhalten.
CYP2D6 Schlechte Metabolisierer
Eine Untergruppe (3 %–10 %) der Bevölkerung hat eine reduzierte Aktivität von CYP2D6 (CYP2D6-Low-Metabolizers). Diese Personen können höhere als erwartete Plasmakonzentrationen von Clozapin entwickeln, wenn sie übliche Dosen erhalten.
Klinische Studien
Behandlungsresistente Schizophrenie
Die Wirksamkeit von CLOZARIL 100 mg bei behandlungsresistenter Schizophrenie wurde in einer multizentrischen, randomisierten, doppelblinden, aktiv kontrollierten (Chlorpromazin)-Studie bei Patienten mit einer DSM-III-Diagnose von Schizophrenie nachgewiesen, die unzureichend auf mindestens 3 verschiedene Antipsychotika ansprachen ( aus mindestens 2 verschiedenen Chemikalienklassen) in den letzten 5 Jahren. Die antipsychotischen Studien müssen als angemessen beurteilt worden sein; Die Antipsychotika-Dosierung muss mindestens 1000 mg Chlorpromazin pro Tag über einen Zeitraum von mindestens 6 Wochen betragen haben, jeweils ohne signifikante Verringerung der Symptome. In den vorangegangenen 5 Jahren darf es keine Periode der guten Funktionsfähigkeit gegeben haben. Die Patienten müssen einen Baseline-Score von mindestens 45 auf der Prüfer-bewerteten Brief Psychiatric Rating Scale (BPRS) gehabt haben. Auf dem BPRS mit 18 Punkten zeigt 1 das Fehlen von Symptomen und 7 schwere Symptome an; der maximal mögliche BPRS-Gesamtwert beträgt 126. Zu Studienbeginn betrug der mittlere BPRS-Wert 61. Darüber hinaus müssen die Patienten bei mindestens zwei der folgenden vier einzelnen BPRS-Elemente einen Wert von mindestens 4 erreicht haben: konzeptionelle Desorganisation, Misstrauen, Halluzinationen Verhalten und ungewöhnliche Gedankeninhalte. Die Patienten müssen einen Clinical Global Impressions-Severity Scale-Score von mindestens 4 (mäßig krank) gehabt haben.
In der prospektiven Lead-in-Phase der Studie erhielten alle Patienten (N = 305) anfänglich eine einfach verblindete Behandlung mit Haloperidol (die mittlere Dosis betrug 61 mg pro Tag) für 6 Wochen. Mehr als 80 % der Patienten beendeten die 6-wöchige Studie. Patienten mit unzureichendem Ansprechen auf Haloperidol (n = 268) wurden randomisiert einer doppelblinden Behandlung mit CLOZARIL (N = 126) oder Chlorpromazin (N = 142) zugeteilt. Die maximale Tagesdosis von CLOZARIL betrug 900 mg; die mittlere Tagesdosis betrug >600 mg. Die maximale Chlorpromazin-Tagesdosis betrug 1800 mg; die mittlere Tagesdosis betrug > 1200 mg.
Der primäre Endpunkt war das Ansprechen auf die Behandlung, definiert als Abnahme des BPRS-Scores um mindestens 20 % und entweder (1) ein CGI-S-Score von
Wiederkehrendes suizidales Verhalten bei Schizophrenie oder schizoaffektiver Störung
Die Wirksamkeit von CLOZARIL bei der Verringerung des Risikos wiederholten Suizidverhaltens wurde in der International Suicide Prevention Trial (InterSePT™, eine Marke der Novartis Pharmaceuticals Corporation) bewertet. Dies war ein prospektiver, randomisierter, offener, aktiv kontrollierter, multizentrischer, internationaler Parallelgruppenvergleich von CLOZARIL versus Olanzapin (*Zyprexa®, ein eingetragenes Warenzeichen von Eli Lilly and Company) bei 956 Patienten mit Schizophrenie oder schizoaffektiver Störung ( DSM-IV), bei denen ein Risiko für wiederkehrendes Suizidverhalten festgestellt wurde. Nur etwa ein Viertel dieser Patienten (27 %) galt als resistent gegen eine Standardtherapie mit Antipsychotika. Um an der Studie teilnehmen zu können, müssen die Patienten eines der folgenden Kriterien erfüllen:
Die Dosierungsschemata für jede Behandlungsgruppe wurden von einzelnen Prüfärzten bestimmt und wurden vom Patienten individualisiert. Die Dosierung war flexibel, mit einem Dosisbereich von 200–900 mg/Tag für CLOZARIL und 5–20 mg/Tag für Olanzapin. Bei den 956 Patienten, die in dieser Studie CLOZARIL oder Olanzapin erhielten, gab es eine umfangreiche begleitende Anwendung von Psychopharmaka: 84 % mit Antipsychotika, 65 % mit Anxiolytika, 53 % mit Antidepressiva und 28 % mit Stimmungsstabilisatoren. Bei den Patienten in der Olanzapin-Gruppe wurde signifikant häufiger gleichzeitig mit Psychopharmaka behandelt.
Der primäre Wirksamkeitsmaßstab war die Zeit bis (1) einem signifikanten Suizidversuch, einschließlich eines vollendeten Suizids; (2) Krankenhausaufenthalt aufgrund eines unmittelbar bevorstehenden Suizidrisikos, einschließlich verstärkter Überwachung auf Suizidalität bei bereits stationären Patienten; oder (3) Verschlechterung des Schweregrads der Suizidalität, wie durch „sehr starke Verschlechterung“ oder „sehr starke Verschlechterung“ gegenüber dem Ausgangswert im Clinical Global Impression of Severity of Suicidality, bewertet durch die Skala „Blinded Psychiater  (CGI-SS-BP)“, gezeigt. Eine Feststellung, ob ein gemeldetes Ereignis die Kriterien 1 oder 2 oben erfüllt, wurde vom Suicide Monitoring Board (SMB) vorgenommen, einer Expertengruppe, die gegenüber Patientendaten blind ist.
Insgesamt wurden 980 Patienten für die Studie randomisiert und 956 erhielten die Studienmedikation. Bei 62 % der Patienten wurde Schizophrenie diagnostiziert, und bei den übrigen (38 %) wurde eine schizoaffektive Störung diagnostiziert. Nur etwa ein Viertel der gesamten Patientenpopulation (27 %) wurde zu Studienbeginn als „behandlungsresistent“ identifiziert. An der Studie nahmen mehr Männer als Frauen teil (61 % aller Patienten waren Männer). Das Durchschnittsalter der Patienten, die an der Studie teilnahmen, betrug 37 Jahre (Bereich 18–69). Die meisten Patienten waren Kaukasier (71 %), 15 % waren Schwarze, 1 % Asiaten und 13 % wurden als Angehörige „anderer“ Rassen eingestuft.
Patienten, die mit CLOZARIL 100 mg behandelt wurden, hatten im Vergleich zu Olanzapin eine statistisch signifikant längere Verzögerung in der Zeit bis zum erneuten Suizidverhalten. Dieses Ergebnis sollte nur als Beweis für die Wirksamkeit von CLOZARIL bei der Verzögerung des Wiederauftretens von Suizidverhalten interpretiert werden und nicht als Beweis für die überlegene Wirksamkeit von CLOZARIL 50 mg gegenüber Olanzapin.
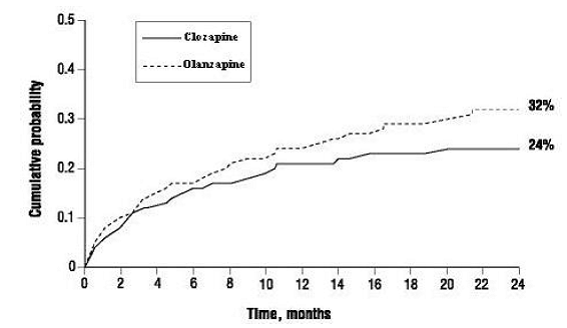
Die Wahrscheinlichkeit (1) eines signifikanten Suizidversuchs, einschließlich eines vollendeten Suizids, oder (2) eines Krankenhausaufenthalts aufgrund eines unmittelbar bevorstehenden Suizidrisikos, einschließlich einer verstärkten Überwachung auf Suizidalität bei bereits stationären Patienten, war bei Patienten mit CLOZARIL geringer als bei Patienten mit Olanzapin Woche 104: CLOZARIL 24 % versus Olanzapin 32 %; 95 % KI der Differenz: 2 %, 14 % (Abbildung 1).
Abbildung 1: Kumulative Wahrscheinlichkeit eines signifikanten Suizidversuchs oder Krankenhausaufenthalts zur Suizidprävention bei Patienten mit Schizophrenie oder schizoaffektiver Störung mit hohem Suizidalitätsrisiko
INFORMATIONEN ZUM PATIENTEN
Besprechen Sie die folgenden Probleme mit Patienten und Pflegekräften: