Proair Inhaler 100mcg Salbutamol Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist ProAir und wie wird es angewendet?
ProAir ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von akutem, schwerem oder anstrengungsinduziertem Asthma (Bronchospasmus). ProAir kann allein oder mit anderen Medikamenten verwendet werden.
ProAir gehört zu einer Klasse von Medikamenten namens PAH, PDE-5-Hemmer, Phosphodiesterase-5-Enzym-Hemmer.
Es ist nicht bekannt, ob ProAir bei Kindern unter 4 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann ProAir haben?
ProAir kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von ProAir gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von ProAir. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Der Wirkstoff von ProAir HFA (Albuterolsulfat) Inhalationsaerosol ist Albuterolsulfat, ein racemisches Salz von Albuterol. Albuterolsulfat hat den chemischen Namen α-[(tert-Butylamino)methyl]-4-hydroxy-m-xylen-α,α'-diolsulfat (2:1) (Salz) und hat die folgende chemische Struktur:
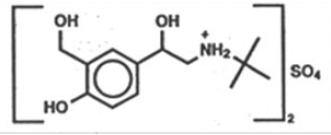
Das Molekulargewicht von Albuterolsulfat beträgt 576,7 und die empirische Formel lautet (C13H21NO3)2 •H2SO4. Albuterolsulfat ist ein weißes bis cremefarbenes kristallines Pulver. Es ist wasserlöslich und leicht löslich in Ethanol. Albuterolsulfat ist der offizielle generische Name in den Vereinigten Staaten, und Salbutamolsulfat ist der von der Weltgesundheitsorganisation empfohlene generische Name. Das ProAir HFA Inhalationsaerosol ist ein unter Druck stehendes Dosieraerosol mit einem Dosiszähler. ProAir HFA ist nur zur oralen Inhalation bestimmt. Es enthält eine mikrokristalline Suspension von Albuterolsulfat in Treibmittel HFA-134a (1, 1, 1, 2-Tetrafluorethan) und Ethanol.
Bereiten Sie den Inhalator vor der ersten Anwendung und in Fällen, in denen der Inhalator länger als 2 Wochen nicht verwendet wurde, vor, indem Sie drei Sprühstöße in die Luft abgeben, weg vom Gesicht. Nach dem Vorfüllen werden bei jedem Sprühstoß 108 µg Albuterolsulfat aus dem Mundstück des Auslösers abgegeben (entsprechend 90 µg Albuterolbase). Jeder Kanister bietet 200 Sprühstöße (Inhalationen).
Dieses Produkt enthält keine Fluorchlorkohlenwasserstoffe (FCKW) als Treibmittel.
INDIKATIONEN
Bronchospasmus
PROAIR HFA Inhalationsaerosol ist angezeigt zur Behandlung oder Vorbeugung von Bronchospasmen bei Patienten ab 4 Jahren mit reversibler obstruktiver Atemwegserkrankung.
Belastungsinduzierter Bronchospasmus
PROAIR HFA Inhalationsaerosol ist angezeigt zur Vorbeugung von belastungsinduzierten Bronchospasmen bei Patienten ab 4 Jahren.
DOSIERUNG UND ANWENDUNG
Bronchospasmus
Zur Behandlung akuter Episoden von Bronchospasmen oder zur Vorbeugung von Symptomen im Zusammenhang mit Bronchospasmen beträgt die übliche Dosierung für Erwachsene und Kinder ab 4 Jahren zwei Inhalationen alle 4 bis 6 Stunden. Eine häufigere Verabreichung oder eine größere Anzahl von Inhalationen wird nicht empfohlen. Bei manchen Patienten kann eine Inhalation alle 4 Stunden ausreichend sein.
Belastungsinduzierter Bronchospasmus
Die übliche Dosierung für Erwachsene und Kinder ab 4 Jahren beträgt zwei Inhalationen 15 bis 30 Minuten vor dem Training.
Verwaltungsinformationen
PROAIR HFA nur durch orale Inhalation verabreichen. Vor jedem Sprühen gut schütteln. Um die ordnungsgemäße Verwendung dieses Produkts zu gewährleisten und die Ansammlung und Verstopfung durch Medikamente zu verhindern, ist es wichtig, die Reinigungsanweisungen sorgfältig zu befolgen.
Grundierung
Bereiten Sie den Inhalator vor der ersten Anwendung und in Fällen, in denen der Inhalator länger als 2 Wochen nicht verwendet wurde, vor, indem Sie drei Sprühstöße in die Luft abgeben, weg vom Gesicht.
Reinigung
Wie bei allen HFA-haltigen Albuterol-Inhalatoren ist es wichtig, das Kunststoff-Mundstück regelmäßig zu reinigen, um die ordnungsgemäße Verwendung dieses Produkts zu gewährleisten und eine Ansammlung und Verstopfung des Medikaments zu verhindern. Der Inhalator kann die Medikamentenabgabe einstellen, wenn das Kunststoff-Mundstück des Auslösers nicht ordnungsgemäß gereinigt und getrocknet wird. Reinigung: Waschen Sie das Kunststoff-Mundstück 30 Sekunden lang unter fließendem warmem Wasser, schütteln Sie überschüssiges Wasser ab und lassen Sie es mindestens einmal pro Woche gründlich an der Luft trocknen. Wenn der Patient mehr als einen PROAIR HFA-Inhalator hat, sollte der Patient jeden einzeln waschen, um zu verhindern, dass der falsche Kanister an den falschen Kunststoffbetätiger angeschlossen wird. Auf diese Weise kann der Patient sicher sein, immer die richtige Anzahl der verbleibenden Dosen zu kennen. Schließen Sie niemals einen Medikamentenkanister eines anderen Inhalators an den PROAIR HFA-Aktuator an und befestigen Sie den PROAIR HFA-Kanister niemals an einem Aktuator eines anderen Inhalators. Wenn das Mundstück verstopft ist, wird die Verstopfung durch Waschen des Mundstücks entfernt. Wenn es notwendig ist, den Inhalator zu verwenden, bevor er vollständig trocken ist, schütteln Sie überschüssiges Wasser ab, ersetzen Sie den Kanister, sprühen Sie zweimal in die Luft, weg vom Gesicht, und nehmen Sie die verschriebene Dosis ein. Nach einer solchen Verwendung sollte das Mundstück erneut gewaschen und gründlich an der Luft getrocknet werden. [sehen Von der FDA zugelassene Patientenkennzeichnung ].
Dosiszähler
PROAIR HFA hat einen am Auslöser angebrachten Dosiszähler. Wenn der Patient den Inhalator erhält, erscheint ein schwarzer Punkt im Sichtfenster, bis er 3 Mal gezündet wurde, dann wird die Zahl 200 angezeigt. Der Dosiszähler zählt jedes Mal herunter, wenn ein Sprühstoß abgegeben wird. Wenn der Dosiszähler 20 erreicht, ändert sich die Farbe der Zahlen zu Rot, um den Patienten daran zu erinnern, sich an seinen Apotheker zu wenden, um Medikamente nachzufüllen, oder sich an seinen Arzt zu wenden, um ein Rezept nachzufüllen.
Wenn der Dosiszähler 0 erreicht, ändert sich der Hintergrund zu durchgehend rot. Der PROAIR HFA-Inhalator sollte entsorgt werden, wenn der Dosiszähler 0 anzeigt oder nach dem Verfallsdatum auf dem Produkt, je nachdem, was zuerst eintritt.
WIE GELIEFERT
Darreichungsformen & Stärken
PROAIR HFA ist ein Inhalationsaerosol. PROAIR HFA wird als 8,5-g/200-Sprühstöße-Aluminium-Druckbehälter mit einem roten Kunststoffbetätiger mit einem Dosiszähler und einer weißen Staubschutzkappe geliefert, jeweils in Schachteln zu einem Stück. Jeder Sprühstoß gibt 120 µg Albuterolsulfat aus dem Kanisterventil und 108 µg Albuterolsulfat aus dem Mundstück des Auslösers ab (entspricht 90 µg Albuterolbase).
Lagerung & Handhabung
PROAIR HFA (Albuterolsulfat) Aerosol zur Inhalation wird als Druckbehälter aus Aluminium mit einem roten Kunststoffbetätiger mit einem Dosiszähler und einer weißen Staubschutzkappe geliefert, jeweils in Schachteln zu 1 Stück. Jeder Kanister enthält 8,5 g der Formulierung und reicht für 200 Sprühstöße ( NDC 59310-579-22). Jeder Sprühstoß gibt 120 µg Albuterolsulfat aus dem Kanisterventil und 108 µg Albuterolsulfat aus dem Mundstück des Auslösers ab (entspricht 90 µg Albuterolbase).
VOR GEBRAUCH GUT SCHÜTTELN. Zwischen 15° und 25°C (59° und 77°F) lagern. Inhalt unter Druck. Nicht durchstechen oder verbrennen. Vor Frost und längerer direkter Sonneneinstrahlung schützen. Temperaturen über 120 °F können zum Platzen führen. Für beste Ergebnisse sollte der Kanister vor Gebrauch Raumtemperatur haben. Nicht in die Augen sprühen. Außerhalb der Reichweite von Kindern aufbewahren.
Sehen Von der FDA zugelassene Patientenkennzeichnung für Grundierungs- und Reinigungsanweisungen.
Der mit PROAIR HFA Inhalationsaerosol gelieferte rote Auslöser sollte nicht mit dem Kanister anderer Inhalationsaerosolprodukte verwendet werden. Der PROAIR HFA Inhalationsaerosolbehälter sollte nicht mit dem Auslöser von anderen Inhalationsaerosolprodukten verwendet werden.
Der PROAIR HFA-Inhalator hat einen am Betätigungselement angebrachten Dosiszähler. Patienten sollten niemals versuchen, die Zahlen für den Dosiszähler zu ändern oder den Stiftmechanismus im Inneren des Auslösers zu manipulieren. Entsorgen Sie den PROAIR HFA-Inhalator, wenn der Zähler 0 anzeigt oder nach dem Verfallsdatum auf dem Produkt, je nachdem, was zuerst eintritt. Die etikettierte Medikamentenmenge bei jeder Betätigung kann nicht garantiert werden, nachdem der Zähler 0 anzeigt, selbst wenn der Kanister nicht vollständig leer ist und weiter funktioniert. Tauchen Sie den Kanister niemals in Wasser, um festzustellen, wie voll der Kanister ist („Schwimmtest“).
PROAIR HFA Inhalationsaerosol enthält keine Fluorchlorkohlenwasserstoffe (FCKW) als Treibmittel.
Hergestellt von: Teva Respiratory, LLC, Frazer, PA 19355. Hergestellt von: IVAX Pharmaceuticals Ireland Waterford, Irland. Überarbeitet: Februar 2019
NEBENWIRKUNGEN
Die Anwendung von PROAIR HFA kann mit Folgendem verbunden sein:
Erfahrung mit klinischen Studien
Insgesamt 1090 Probanden wurden während des weltweiten klinischen Entwicklungsprogramms mit PROAIR HFA Inhalationsaerosol oder mit der gleichen Formulierung von Albuterol wie in PROAIR HFA Inhalationsaerosol behandelt.
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Erwachsene und Jugendliche ab 12 Jahren
Die in der nachstehenden Tabelle aufgeführten Informationen zu Nebenwirkungen in Bezug auf PROAIR HFA-Inhalationsaerosol stammen aus einer 6-wöchigen, verblindeten Studie, in der PROAIR HFA-Inhalationsaerosol (180 mcg viermal täglich) mit einem doppelblinden, passenden Placebo-HFA-Inhalationsaerosol und einem verglichen wurde Evaluator-blind vermarkteter aktiver Vergleichsinhalator HFA-134a Albuterol bei 172 Asthmapatienten im Alter von 12 bis 76 Jahren. Die Tabelle listet die Inzidenz aller unerwünschten Ereignisse (ob vom Prüfarzt als medikamentenbedingt oder medikamentenunabhängig betrachtet) aus dieser Studie auf, die in der PROAIR HFA-Inhalationsaerosol-Behandlungsgruppe mit einer Rate von 3 % oder mehr und häufiger in der PROAIR HFA-Gruppe auftraten Inhalationsaerosol-Behandlungsgruppe als in der angepassten Placebo-Gruppe. Insgesamt waren Inzidenz und Art der Nebenwirkungen, die für PROAIR HFA Inhalation Aerosol und den vermarkteten aktiven Vergleichsinhalator HFA-134a Albuterol berichtet wurden, vergleichbar.
Auftreten von Nebenwirkungen (% der Patienten) in einer sechswöchigen klinischen Studie*
Unerwünschte Ereignisse, die von weniger als 3 % der Patienten berichtet wurden, die PROAIR HFA-Inhalationsaerosol erhielten, aber von einem größeren Anteil der PROAIR HFA-Inhalationsaerosol-Patienten als die entsprechenden Placebo-Patienten, die möglicherweise mit PROAIR HFA-Inhalationsaerosol in Zusammenhang stehen, einschließlich Brustschmerzen, Infektion, Durchfall, Glossitis, unfallbedingte Verletzung (Nervensystem), Angstzustände, Dyspnoe, Ohrenerkrankungen, Ohrenschmerzen und Harnwegsinfektionen.
In Studien mit kleinen kumulativen Dosen waren Tremor, Nervosität und Kopfschmerzen die am häufigsten auftretenden unerwünschten Ereignisse.
Pädiatrische Patienten im Alter von 4 bis 11 Jahren
Nebenwirkungen, die in einer 3-wöchigen pädiatrischen klinischen Studie berichtet wurden, in der dieselbe Formulierung von Albuterol wie in PROAIR HFA-Inhalationsaerosol (180 mcg Albuterol viermal täglich) mit einem passenden Placebo-HFA-Inhalationsaerosol verglichen wurde, traten mit einer niedrigen Inzidenzrate auf (nicht mehr als 2 % in der aktiven Behandlungsgruppe) und waren ähnlich denen, die in Studien mit Erwachsenen und Jugendlichen beobachtet wurden.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von PROAIR HFA nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen. Zu den Berichten gehörten seltene Fälle von verschlimmertem Bronchospasmus, mangelnder Wirksamkeit, Asthma-Exazerbation (in einem Fall mit tödlichem Ausgang), Muskelkrämpfen und verschiedenen oropharyngealen Nebenwirkungen wie Rachenreizung, verändertem Geschmack, Glossitis, Zungengeschwüren und Würgen.
Die folgenden Nebenwirkungen wurden bei der Anwendung von inhaliertem Albuterol nach der Zulassung beobachtet: Urtikaria, Angioödem, Hautausschlag, Bronchospasmus, Heiserkeit, oropharyngeale Ödeme und Arrhythmien (einschließlich Vorhofflimmern, supraventrikuläre Tachykardie, Extrasystolen). Darüber hinaus kann Albuterol, wie andere Sympathomimetika, Nebenwirkungen hervorrufen wie: Angina pectoris, Bluthochdruck oder Hypotonie, Herzklopfen, Stimulation des zentralen Nervensystems, Schlaflosigkeit, Kopfschmerzen, Nervosität, Zittern, Muskelkrämpfe, Austrocknung oder Reizung des Oropharynx, Hypokaliämie, Hyperglykämie und metabolische Azidose.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Andere kurzwirksame sympathomimetische Aerosol-Bronchodilatatoren sollten nicht gleichzeitig mit PROAIR HFA Inhalationsaerosol angewendet werden. Wenn zusätzliche adrenerge Arzneimittel auf irgendeine Weise verabreicht werden sollen, sollten sie mit Vorsicht angewendet werden, um schädliche kardiovaskuläre Wirkungen zu vermeiden.
Betablocker
Betarezeptorenblocker blockieren nicht nur die pulmonale Wirkung von Beta-Agonisten wie PROAIR HFA Inhalationsaerosol, sondern können bei Asthmapatienten schwere Bronchospasmen hervorrufen. Daher sollten Patienten mit Asthma normalerweise nicht mit Betablockern behandelt werden. Unter bestimmten Umständen, z. B. als Prophylaxe nach Myokardinfarkt, gibt es jedoch möglicherweise keine akzeptablen Alternativen zur Anwendung von Betarezeptorenblockern bei Patienten mit Asthma. Ziehen Sie in diesem Fall kardioselektive Betablocker in Betracht, obwohl sie mit Vorsicht verabreicht werden sollten.
Diuretika
Die EKG-Veränderungen und/oder Hypokaliämie, die aus der Verabreichung von nicht kaliumsparenden Diuretika (wie Schleifen- oder Thiaziddiuretika) resultieren können, können durch Beta-Agonisten akut verschlechtert werden, insbesondere wenn die empfohlene Dosis des Beta-Agonisten überschritten wird. Obwohl die klinische Bedeutung dieser Wirkungen nicht bekannt ist, ist bei der gleichzeitigen Verabreichung von Beta-Agonisten mit nicht kaliumsparenden Diuretika Vorsicht geboten. Erwägen Sie die Überwachung des Kaliumspiegels.
Digoxin
Bei gesunden Probanden, die 10 Tage lang Digoxin erhalten hatten, wurde nach intravenöser bzw. oraler Einzeldosisgabe von Albuterol eine mittlere Abnahme der Digoxinspiegel im Serum von 16 % bzw. 22 % nachgewiesen. Die klinische Bedeutung dieser Ergebnisse für Patienten mit obstruktiver Atemwegserkrankung, die Albuterol und Digoxin auf chronischer Basis erhalten, ist unklar. Dennoch wäre es ratsam, die Digoxinspiegel im Serum bei Patienten, die derzeit Digoxin und PROAIR HFA-Inhalationsaerosol erhalten, sorgfältig zu bestimmen.
Monoaminoxidase-Hemmer oder trizyklische Antidepressiva
PROAIR HFA Inhalationsaerosol sollte bei Patienten, die mit Monoaminooxidasehemmern oder trizyklischen Antidepressiva behandelt werden, mit äußerster Vorsicht oder innerhalb von 2 Wochen nach Absetzen solcher Mittel verabreicht werden, da die Wirkung von Albuterol auf das Herz-Kreislauf-System verstärkt werden kann. Erwägen Sie eine alternative Therapie bei Patienten, die MAO-Hemmer oder trizyklische Antidepressiva einnehmen.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Paradoxer Bronchospasmus
PROAIR HFA Inhalationsaerosol kann paradoxe Bronchospasmen hervorrufen, die lebensbedrohlich sein können. Wenn ein paradoxer Bronchospasmus auftritt, sollte PROAIR HFA Inhalationsaerosol sofort abgesetzt und eine alternative Therapie eingeleitet werden. Es sollte beachtet werden, dass paradoxer Bronchospasmus, wenn er mit inhalierten Formulierungen verbunden ist, häufig bei der ersten Verwendung eines neuen Kanisters auftritt.
Verschlechterung von Asthma
Asthma kann sich akut über einen Zeitraum von Stunden oder chronisch über mehrere Tage oder länger verschlechtern. Wenn der Patient mehr Dosen PROAIR HFA Inhalationsaerosol als üblich benötigt, kann dies ein Hinweis auf eine Destabilisierung von Asthma sein und erfordert eine Neubewertung des Patienten und des Behandlungsschemas, wobei die mögliche Notwendigkeit einer entzündungshemmenden Behandlung besonders berücksichtigt werden muss, z. Kortikosteroide.
Verwendung von entzündungshemmenden Mitteln
Die Anwendung von beta-adrenergen Agonisten als Bronchodilatatoren allein ist bei vielen Patienten möglicherweise nicht ausreichend, um Asthma zu kontrollieren. Es sollte frühzeitig erwogen werden, dem therapeutischen Schema entzündungshemmende Mittel, z. B. Kortikosteroide, hinzuzufügen.
Kardiovaskuläre Wirkungen
PROAIR HFA Inhalationsaerosol kann, wie andere beta-adrenerge Agonisten, bei einigen Patienten klinisch signifikante kardiovaskuläre Wirkungen hervorrufen, gemessen an Pulsfrequenz, Blutdruck und/oder Symptomen. Obwohl solche Wirkungen nach Verabreichung von PROAIR HFA Inhalationsaerosol in den empfohlenen Dosierungen gelegentlich auftreten, muss das Arzneimittel möglicherweise abgesetzt werden, wenn sie auftreten. Darüber hinaus wurde von Beta-Agonisten berichtet, dass sie EKG-Veränderungen wie eine Abflachung der T-Welle, eine Verlängerung des QTc-Intervalls und eine ST-Streckensenkung hervorrufen. Die klinische Bedeutung dieser Befunde ist nicht bekannt. Daher sollte PROAIR HFA Inhalationsaerosol, wie alle sympathomimetischen Amine, bei Patienten mit Herz-Kreislauf-Erkrankungen, insbesondere Koronarinsuffizienz, Herzrhythmusstörungen und Bluthochdruck, mit Vorsicht angewendet werden.
Überschreiten Sie nicht die empfohlene Dosis
Todesfälle wurden im Zusammenhang mit der übermäßigen Anwendung von inhalativen Sympathomimetika bei Patienten mit Asthma berichtet. Die genaue Todesursache ist unbekannt, aber es wird ein Herzstillstand nach einer unerwarteten Entwicklung einer schweren akuten asthmatischen Krise und anschließender Hypoxie vermutet.
Sofortige Überempfindlichkeitsreaktionen
Unmittelbare Überempfindlichkeitsreaktionen können nach Verabreichung von Albuterolsulfat auftreten, wie in seltenen Fällen von Urtikaria, Angioödem, Hautausschlag, Bronchospasmus, Anaphylaxie und oropharyngealem Ödem gezeigt wurde. Das Potenzial für Überempfindlichkeit muss bei der klinischen Bewertung von Patienten berücksichtigt werden, bei denen es während der Anwendung von PROAIR HFA Inhalationsaerosol zu sofortigen Überempfindlichkeitsreaktionen kommt.
Koexistenzbedingungen
PROAIR HFA Inhalationsaerosol sollte, wie alle sympathomimetischen Amine, bei Patienten mit Herz-Kreislauf-Erkrankungen, insbesondere Koronarinsuffizienz, Herzrhythmusstörungen und Bluthochdruck, mit Vorsicht angewendet werden; bei Patienten mit Krampfanfällen, Schilddrüsenüberfunktion oder Diabetes mellitus; und bei Patienten, die ungewöhnlich auf sympathomimetische Amine ansprechen. Klinisch signifikante Veränderungen des systolischen und diastolischen Blutdrucks wurden bei einzelnen Patienten beobachtet und es ist zu erwarten, dass sie bei einigen Patienten nach Anwendung eines beta-adrenergen Bronchodilatators auftreten. Es wurde berichtet, dass große Dosen von intravenösem Albuterol einen vorbestehenden Diabetes mellitus und eine Ketoazidose verschlimmern.
Hypokaliämie
Wie andere Beta-Agonisten kann PROAIR HFA-Aerosol zur Inhalation bei manchen Patienten eine signifikante Hypokaliämie hervorrufen, möglicherweise durch intrazellulären Shunt, der potenziell nachteilige kardiovaskuläre Wirkungen hervorrufen kann. Die Abnahme ist normalerweise vorübergehend und erfordert keine Ergänzung.
Informationen zur Patientenberatung
Sehen Von der FDA zugelassene Patientenkennzeichnung
Die Patienten sollten die folgenden Informationen erhalten:
Häufigkeit der Nutzung
Die Wirkung von PROAIR HFA Inhalationsaerosol sollte 4 bis 6 Stunden anhalten. Verwenden Sie PROAIR HFA Inhalationsaerosol nicht häufiger als empfohlen. Weisen Sie die Patienten an, die Dosis oder Häufigkeit der Dosen von PROAIR HFA Inhalationsaerosol nicht ohne Rücksprache mit dem Arzt zu erhöhen. Wenn Patienten feststellen, dass die Behandlung mit PROAIR HFA Inhalationsaerosol zur Linderung der Symptome weniger wirksam wird, sich die Symptome verschlimmern und/oder sie das Produkt häufiger als gewöhnlich anwenden müssen, sollten sie sofort einen Arzt aufsuchen.
Grundierung und Reinigung
Grundierung
Das Priming ist unerlässlich, um bei jedem Sprühstoß einen angemessenen Albuterolgehalt sicherzustellen. Weisen Sie die Patienten an, den Inhalator vor der ersten Anwendung und in Fällen, in denen der Inhalator länger als 2 Wochen nicht verwendet wurde, vorzubereiten, indem sie drei Sprühstöße in die Luft abgeben, weg vom Gesicht.
Reinigung
Um eine ordnungsgemäße Dosierung zu gewährleisten und eine Verstopfung der Aktuatoröffnung zu verhindern, weisen Sie die Patienten an, das rote Kunststoff-Mundstück des Aktuators mindestens einmal pro Woche zu waschen und gründlich abzutrocknen. Weisen Sie die Patienten darauf hin, dass sie, wenn sie mehr als einen PROAIR HFA-Inhalator haben, jeden zu unterschiedlichen Zeiten waschen sollten, um zu verhindern, dass der falsche Kanister an den falschen Kunststoffbetätiger angeschlossen wird. Auf diese Weise können sie sicher sein, dass sie immer die richtige Anzahl der verbleibenden Dosen kennen. Die Patienten sollten angewiesen werden, niemals einen Kanister mit Medikamenten eines anderen Inhalators an den PROAIR HFA-Betätiger anzubringen und den PROAIR HFA-Behälter niemals an einen Betätiger eines anderen Inhalators anzubringen. Patienten sollten den Kanister nicht vom Auslöser entfernen, außer während der Reinigung, da durch das erneute Anbringen eine Dosis in die Luft freigesetzt werden kann und der Dosiszähler jedes Mal herunterzählt, wenn ein Spray abgegeben wird. Ausführliche Reinigungshinweise sind in der bebilderten Information für die Patientenbroschüre enthalten.
Dosiszähler
Die Patienten sollten darüber informiert werden, dass PROAIR HFA über einen Dosiszähler verfügt, der am Aktuator angebracht ist. Wenn der Patient den Inhalator erhält, erscheint ein schwarzer Punkt im Sichtfenster, bis er 3 Mal gezündet wurde, dann wird die Zahl 200 angezeigt. Der Dosiszähler zählt jedes Mal herunter, wenn ein Sprühstoß abgegeben wird. Das Dosiszählerfenster zeigt die Anzahl der im Inhalator verbleibenden Sprühstöße in Zweiereinheiten an (z. B. 200, 198, 196 usw.). Wenn der Zähler 20 anzeigt, ändert sich die Farbe der Zahlen zu Rot, um den Patienten daran zu erinnern, seinen Apotheker für eine Nachfüllung von Medikamenten zu kontaktieren oder seinen Arzt für eine Nachfüllung von Rezepten zu konsultieren. Wenn der Dosiszähler 0 erreicht, ändert sich der Hintergrund zu durchgehend rot. Die Patienten sollten darüber informiert werden, den PROAIR HFA-Inhalator zu entsorgen, wenn der Dosiszähler 0 anzeigt oder nach dem Verfallsdatum auf dem Produkt, je nachdem, was zuerst eintritt.
Paradoxer Bronchospasmus
Informieren Sie die Patienten darüber, dass PROAIR HFA Inhalationsaerosol paradoxe Bronchospasmen hervorrufen kann. Weisen Sie die Patienten an, PROAIR HFA Inhalationsaerosol abzusetzen, wenn ein paradoxer Bronchospasmus auftritt.
Begleitender Drogenkonsum
Während Patienten PROAIR HFA Inhalationsaerosol einnehmen, sollten andere Inhalationsmedikamente und Asthmamedikamente nur nach Anweisung eines Arztes eingenommen werden.
Häufige Nebenwirkungen
Häufige Nebenwirkungen der Behandlung mit inhaliertem Albuterol sind Herzklopfen, Brustschmerzen, schneller Herzschlag, Zittern oder Nervosität.
Schwangerschaft
Schwangere oder stillende Patientinnen sollten sich bezüglich der Anwendung von PROAIR HFA Inhalationsaerosol an ihren Arzt wenden.
Es gibt ein Schwangerschaftsexpositionsregister, das die Schwangerschaftsausgänge bei Frauen überwacht, die während der Schwangerschaft Asthmamedikamenten ausgesetzt waren [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Allgemeine Informationen zur Verwendung
Zur wirksamen und sicheren Anwendung des PROAIR HFA-Inhalationsaerosols gehört das Verständnis der Art und Weise, wie es verabreicht werden sollte.
Vor jedem Sprühen gut schütteln.
Verwenden Sie PROAIR HFA Inhalationsaerosol nur mit dem mitgelieferten Betätiger. Entsorgen Sie den PROAIR HFA-Inhalator, wenn der Dosiszähler 0 anzeigt oder nach dem Verfallsdatum auf dem Produkt, je nachdem, was zuerst eintritt. Tauchen Sie den Kanister niemals in Wasser, um festzustellen, wie voll der Kanister ist („Schwimmtest“).
Im Allgemeinen ist die Technik zur Verabreichung von PROAIR HFA Inhalationsaerosol bei Kindern ähnlich wie bei Erwachsenen. Kinder sollten PROAIR HFA Inhalationsaerosol unter Aufsicht eines Erwachsenen verwenden, wie vom Arzt des Patienten angewiesen.
Von der FDA zugelassene Patientenkennzeichnung
Siehe Abrissbild Informationen für den Patienten Flugblatt.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einer 2-Jahres-Studie an Sprague-Dawley-Ratten verursachte Albuterolsulfat einen dosisabhängigen Anstieg der Inzidenz gutartiger Leiomyome des Mesovariums bei und über Nahrungsdosen von 2 mg/kg (ungefähr das 15-Fache und das 6-Fache der maximal empfohlenen Humandosis). tägliche Inhalationsdosis (MRHDID) für Erwachsene bzw. Kinder auf mg/m²-Basis). In einer anderen Studie wurde dieser Effekt durch die gleichzeitige Verabreichung von Propranolol, einem nicht-selektiven beta-adrenergen Antagonisten, blockiert. In einer 18-monatigen Studie an CD-1-Mäusen zeigte Albuterolsulfat in Dosen von bis zu 500 mg/kg (etwa das 1.900-Fache bzw Basis). In einer 22-monatigen Studie an Goldhamstern zeigte Albuterolsulfat bei Futterdosen von bis zu 50 mg/kg (etwa das 250-fache bzw. .
Albuterolsulfat war im Ames-Test oder einem Mutationstest in Hefe nicht mutagen. Albuterolsulfat war in einem humanen peripheren Lymphozyten-Assay oder in einem AH1-Mäuse-Mikronukleus-Assay nicht klastogen.
Reproduktionsstudien an Ratten ergaben bei oralen Dosen von bis zu 50 mg/kg (etwa das 380-fache der MRHDID für Erwachsene auf mg/m²-Basis) keine Hinweise auf eine Beeinträchtigung der Fertilität.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschafts-Expositionsregister
Es gibt ein Schwangerschaftsexpositionsregister, das die Schwangerschaftsergebnisse bei Frauen überwacht, die während der Schwangerschaft Asthmamedikamenten ausgesetzt waren. Weitere Informationen erhalten Sie von Mothers To Baby Pregnancy Studies, die von der Organisation of Teratology Information Specialists unter 1-877-311-8972 durchgeführt werden, oder besuchen Sie http://mothertobaby.org/pregnancystudies/.
Zusammenfassung der Risiken
Es gibt keine randomisierten klinischen Studien zur Anwendung von Albuterol während der Schwangerschaft. Verfügbare Daten aus veröffentlichten epidemiologischen Studien und Postmarketing-Fallberichten über Schwangerschaftsausgänge nach der Anwendung von inhaliertem Albuterol zeigen nicht durchgängig ein Risiko für schwere Geburtsfehler oder Fehlgeburten. Es gibt klinische Überlegungen zur Anwendung von Albuterol bei schwangeren Frauen [siehe Klinische Überlegungen ]. In Reproduktionsstudien an Tieren gab es nach subkutaner Verabreichung von Albuterolsulfat an trächtige Mäuse Hinweise auf eine Gaumenspalte bei weniger als und bis zum 9-Fachen der maximal empfohlenen täglichen Inhalationsdosis beim Menschen (MRHDID) [siehe Daten ].
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene(n) Population(en) ist nicht bekannt. In der US-Allgemeinbevölkerung liegt das geschätzte Risiko schwerer Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2 bis 4 % bzw. 15 bis 20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryonale/fetales Risiko
Bei Frauen mit schlecht oder mäßig kontrolliertem Asthma besteht ein erhöhtes Risiko für Präeklampsie bei der Mutter und für Frühgeburtlichkeit, niedriges Geburtsgewicht und geringes Gestationsalter beim Neugeborenen. Schwangere Frauen sollten engmaschig überwacht und die Medikation nach Bedarf angepasst werden, um eine optimale Kontrolle zu gewährleisten.
Arbeit oder Lieferung
Aufgrund der möglichen Beeinträchtigung der Uteruskontraktilität durch Beta-Agonisten sollte die Anwendung von PROAIR HFA Inhalationsaerosol zur Linderung von Bronchospasmen während der Wehen auf Patientinnen beschränkt werden, bei denen der Nutzen das Risiko eindeutig überwiegt. PROAIR HFA Inhalationsaerosol ist nicht für die Behandlung vorzeitiger Wehen zugelassen. Schwerwiegende Nebenwirkungen, einschließlich Lungenödem, wurden während oder nach der Behandlung vorzeitiger Wehen mit Beta2-Agonisten, einschließlich Albuterol, berichtet.
Daten
Tierdaten
In einer Reproduktionsstudie an Mäusen führte subkutan verabreichtes Albuterolsulfat bei 5 von 111 (4,5 %) Föten zu Gaumenspalten bei einer Exposition von neun Zehnteln der MRHDID für Erwachsene (auf mg/m²-Basis bei einer maternalen Dosis von 0,25 mg/kg ) und bei 10 von 108 (9,3 %) Föten mit etwa dem 9-Fachen der MRHDID (auf mg/m²-Basis bei einer mütterlichen Dosis von 2,5 mg/kg). Ähnliche Wirkungen wurden bei etwa einem Elftel der MRHDID für Erwachsene (auf mg/m²-Basis bei einer mütterlichen Dosis von 0,025 mg/kg) nicht beobachtet. Gaumenspalten traten auch bei 22 von 72 (30,5 %) Föten weiblicher Frauen auf, die subkutan mit Isoproterenol behandelt wurden (positive Kontrolle).
In einer Reproduktionsstudie an Kaninchen induzierte oral verabreichtes Albuterolsulfat bei 7 von 19 Föten (37 %) eine Kranioschisis bei etwa dem 750-Fachen der MRHDID (auf mg/m²-Basis bei einer maternalen Dosis von 50 mg/kg).
In einer Reproduktionsstudie an Ratten verursachte eine durch Inhalation verabreichte Albuterolsulfat/HFA-134a-Formulierung keine teratogenen Wirkungen bei Expositionen, die etwa dem 80-fachen der MRHDID (auf mg/m²-Basis bei einer maternalen Dosis von 10,5 mg/kg) entsprachen.
Eine Studie, in der trächtigen Ratten radioaktiv markiertes Albuterolsulfat verabreicht wurde, zeigte, dass arzneimittelbezogenes Material aus dem mütterlichen Kreislauf auf den Fötus übertragen wird.
Stillzeit
Zusammenfassung der Risiken
Es liegen keine Daten über das Vorhandensein von Albuterol in der Muttermilch, die Auswirkungen auf das gestillte Kind oder die Auswirkungen auf die Milchproduktion vor. Die Plasmaspiegel von Albuterol nach inhalierten therapeutischen Dosen sind jedoch beim Menschen niedrig, und wenn es in der Muttermilch vorhanden ist, hat Albuterol eine geringe orale Bioverfügbarkeit [siehe KLINISCHE PHARMAKOLOGIE ].
Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an Albuterol und allen potenziellen Nebenwirkungen von Albuterol oder der zugrunde liegenden Erkrankung der Mutter auf das gestillte Kind berücksichtigt werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von PROAIR HFA Inhalationsaerosol zur Behandlung oder Vorbeugung von Bronchospasmus bei Kindern ab 12 Jahren mit reversibler obstruktiver Atemwegserkrankung basiert auf einer 6-wöchigen klinischen Studie mit 116 Patienten ab 12 Jahren mit Asthma im Vergleich Dosen von 180 µg viermal täglich mit Placebo und eine Einzeldosis-Crossover-Studie, in der Dosen von 90, 180 und 270 µg mit Placebo bei 58 Patienten verglichen wurden [siehe Klinische Studien ]. Die Sicherheit und Wirksamkeit von PROAIR HFA Inhalationsaerosol zur Behandlung von anstrengungsinduziertem Bronchospasmus bei Kindern ab 12 Jahren basiert auf einer Einzeldosis-Crossover-Studie an 24 Erwachsenen und Jugendlichen mit anstrengungsinduziertem Bronchospasmus, in der Dosen von 180 µg mit Placebo verglichen wurden [sehen Klinische Studien ].
Die Sicherheit von PROAIR HFA-Inhalationsaerosol bei Kindern im Alter von 4 bis 11 Jahren basiert auf einer 3-wöchigen klinischen Studie mit 50 Patienten im Alter von 4 bis 11 Jahren mit Asthma, in der dieselbe Albuterol-Formulierung wie in PROAIR HFA-Inhalationsaerosol verwendet wurde, wobei Dosen von verglichen wurden 180 mcg viermal täglich mit Placebo. Die Wirksamkeit von PROAIR HFA Inhalationsaerosol bei Kindern im Alter von 4 bis 11 Jahren wurde aus klinischen Studien bei Patienten ab 12 Jahren mit Asthma und anstrengungsinduziertem Bronchospasmus extrapoliert, basierend auf Daten aus einer Einzeldosisstudie, in der die bronchodilatatorische Wirkung von verglichen wurde PROAIR HFA 90 mcg und 180 mcg mit Placebo bei 55 Patienten mit Asthma und eine 3-wöchige klinische Studie mit der gleichen Formulierung von Albuterol wie in PROAIR HFA Inhalationsaerosol bei 95 asthmatischen Kindern im Alter von 4 bis 11 Jahren, wobei eine Dosis von 180 mcg Albuterol verglichen wurde viermal täglich mit Placebo [vgl Klinische Studien ].
Die Sicherheit und Wirksamkeit von PROAIR HFA Inhalationsaerosol bei pädiatrischen Patienten unter 4 Jahren ist nicht erwiesen.
Geriatrische Verwendung
Klinische Studien mit PROAIR HFA Inhalationsaerosol schlossen keine ausreichende Anzahl von Patienten ab 65 Jahren ein, um festzustellen, ob sie anders ansprechen als jüngere Patienten. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Von allen beta2-adrenergen Agonisten, einschließlich Albuterol, ist bekannt, dass sie im Wesentlichen über die Nieren ausgeschieden werden, und das Risiko toxischer Reaktionen kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da bei älteren Patienten mit größerer Wahrscheinlichkeit eine eingeschränkte Nierenfunktion vorliegt, sollte die Dosis sorgfältig ausgewählt werden, und es kann sinnvoll sein, die Nierenfunktion zu überwachen.
ÜBERDOSIS
Die zu erwartenden Symptome bei Überdosierung sind übermäßige betaadrenerge Stimulation und/oder Auftreten oder Verstärkung eines der unter NEBENWIRKUNGEN aufgeführten Symptome, z. B. Krampfanfälle, Angina pectoris, Bluthochdruck oder Hypotonie, Tachykardie mit Frequenzen bis zu 200 Schlägen pro Minute, Arrhythmien, Nervosität , Kopfschmerzen, Zittern, Mundtrockenheit, Herzklopfen, Übelkeit, Schwindel, Müdigkeit, Unwohlsein und Schlaflosigkeit.
Es kann auch eine Hypokaliämie auftreten. Wie bei allen sympathomimetischen Arzneimitteln kann der Missbrauch von PROAIR HFA Inhalationsaerosol Herzstillstand und sogar den Tod verursachen.
Die Behandlung besteht aus dem Absetzen von PROAIR HFA Inhalationsaerosol zusammen mit einer geeigneten symptomatischen Therapie. Die vernünftige Anwendung eines kardioselektiven Betarezeptorenblockers kann in Betracht gezogen werden, wobei zu berücksichtigen ist, dass solche Medikamente Bronchospasmen hervorrufen können. Es gibt keine ausreichenden Beweise, um festzustellen, ob eine Dialyse bei einer Überdosierung von PROAIR HFA Inhalationsaerosol vorteilhaft ist.
Die orale mediane letale Dosis von Albuterolsulfat bei Mäusen ist größer als 2.000 mg/kg (etwa das 6.800-fache der maximal empfohlenen täglichen Inhalationsdosis für Erwachsene auf mg/m²-Basis und etwa das 3.200-fache der maximal empfohlenen täglichen Inhalationsdosis für Kinder auf mg/m²-Basis). /m² Basis). Bei ausgewachsenen Ratten beträgt die subkutane mittlere letale Dosis von Albuterolsulfat etwa 450 mg/kg (etwa das 3.000-fache der maximal empfohlenen täglichen Inhalationsdosis für Erwachsene auf mg/m²-Basis und etwa das 1.400-fache der maximal empfohlenen täglichen Inhalationsdosis für Kinder auf a mg/m² Basis). Bei jungen Ratten beträgt die subkutane mittlere letale Dosis etwa 2.000 mg/kg (etwa das 14.000-fache der maximal empfohlenen täglichen Inhalationsdosis für Erwachsene auf einer mg/m²-Basis und etwa das 6.400-fache der maximal empfohlenen täglichen Inhalationsdosis für Kinder auf einer mg/m²-Basis). Basis). Die mittlere tödliche Inhalationsdosis wurde bei Tieren nicht bestimmt.
KONTRAINDIKATIONEN
PROAIR HFA Inhalationsaerosol ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegenüber Albuterol und anderen Komponenten des PROAIR HFA Inhalationsaerosols. Seltene Fälle von Überempfindlichkeitsreaktionen, einschließlich Urtikaria, Angioödem und Hautausschlag, wurden nach der Anwendung von Albuterolsulfat berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Albuterolsulfat ist ein Beta-2-adrenerger Agonist. Die pharmakologischen Wirkungen von Albuterolsulfat sind auf die Aktivierung von beta-2-adrenergen Rezeptoren auf der glatten Muskulatur der Atemwege zurückzuführen. Die Aktivierung von beta2-adrenergen Rezeptoren führt zur Aktivierung von Adenylcyclase und zu einem Anstieg der intrazellulären Konzentration von zyklischem 3', 5'-Adenosinmonophosphat (zyklisches AMP). Dieser Anstieg von zyklischem AMP ist mit der Aktivierung von Proteinkinase A verbunden, die wiederum die Phosphorylierung von Myosin hemmt und die intrazellulären ionischen Calciumkonzentrationen senkt, was zu einer Muskelentspannung führt. Albuterol entspannt die glatte Muskulatur aller Atemwege, von der Luftröhre bis zu den terminalen Bronchiolen. Albuterol wirkt als funktioneller Antagonist zur Entspannung der Atemwege unabhängig vom beteiligten Spasmogen und schützt so vor allen bronchokonstriktorischen Herausforderungen. Erhöhte Konzentrationen von zyklischem AMP sind auch mit der Hemmung der Freisetzung von Mediatoren aus Mastzellen in den Atemwegen verbunden. Obwohl anerkannt ist, dass beta2-adrenerge Rezeptoren die vorherrschenden Rezeptoren auf der glatten Muskulatur der Bronchien sind, weisen Daten darauf hin, dass es Beta-Rezeptoren im menschlichen Herzen gibt, von denen 10 % bis 50 % kardiale beta2-adrenerge Rezeptoren sind. Die genaue Funktion dieser Rezeptoren wurde nicht festgestellt [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Albuterol hat in den meisten kontrollierten klinischen Studien eine stärkere Wirkung auf die Atemwege in Form einer Entspannung der bronchialen glatten Muskulatur gezeigt als Isoproterenol bei vergleichbaren Dosen, während es weniger kardiovaskuläre Wirkungen hervorruft. Allerdings kann inhaliertes Albuterol, wie andere beta-adrenerge Agonisten, bei manchen Patienten eine signifikante kardiovaskuläre Wirkung hervorrufen, gemessen anhand von Pulsfrequenz, Blutdruck, Symptomen und/oder elektrokardiographischen Veränderungen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Pharmakokinetik
Die systemischen Spiegel von Albuterol sind nach Inhalation der empfohlenen Dosen niedrig. In einer Crossover-Studie, die an gesunden männlichen und weiblichen Probanden durchgeführt wurde, ergaben hohe kumulative Dosen von PROAIR HFA-Inhalationsaerosol (1.080 µg Albuterol-Basis, verabreicht über eine Stunde) mittlere Spitzenplasmakonzentrationen (Cmax) und systemische Exposition (AUCinf) von etwa 4.100 pg/ ml bzw. 28.426 pg/ml*h verglichen mit etwa 3.900 pg/ml bzw. 28.395 pg/ml*h nach der gleichen Dosis eines aktiven HFA-134a-Albuterol-Inhalator-Vergleichspräparats. Die terminale Plasmahalbwertszeit von Albuterol, das von PROAIR HFA Inhalation Aerosol abgegeben wird, betrug etwa 6 Stunden. Der Vergleich der pharmakokinetischen Parameter zeigte keine Unterschiede zwischen den Produkten.
Das pharmakokinetische Profil von PROAIR HFA Inhalationsaerosol wurde in einer zweifachen Crossover-Studie an 11 gesunden pädiatrischen Freiwilligen im Alter von 4 bis 11 Jahren bewertet. Eine Einzeldosis-Verabreichung von PROAIR HFA-Inhalationsaerosol (180 mcg Albuterol-Basis) ergab einen Mittelwert der kleinsten Quadrate (SE) von Cmax und AUC0-∞ von 1.100 (1,18) pg/ml bzw. 5.120 (1,15) pg/ml*h. Die mittlere terminale Plasmahalbwertszeit der kleinsten Quadrate (SE) von Albuterol, das durch das PROAIR HFA-Inhalationsaerosol abgegeben wurde, betrug 166 (7,8) Minuten.
Stoffwechsel und Ausscheidung
Die in der veröffentlichten Literatur verfügbaren Informationen deuten darauf hin, dass SULTIA3 (Sulfotransferase) das primäre Enzym ist, das für den Metabolismus von Albuterol beim Menschen verantwortlich ist. Wenn racemisches Albuterol entweder intravenös oder durch Inhalation nach oraler Gabe von Aktivkohle verabreicht wurde, gab es einen 3- bis 4-fachen Unterschied in der Fläche unter den Konzentrations-Zeit-Kurven zwischen den (R)- und (S)-Albuterol-Enantiomeren, wobei (S )-Albuterol-Konzentrationen durchweg höher. Ohne Aktivkohle-Vorbehandlung waren die Unterschiede nach oraler oder inhalativer Verabreichung jedoch 8- bis 24-fach, was darauf hindeutet, dass das (R)-Albuterol vorzugsweise im Gastrointestinaltrakt metabolisiert wird, vermutlich durch SULTIA3.
Der primäre Eliminationsweg von Albuterol ist die renale Ausscheidung (80 % bis 100 %) entweder der Muttersubstanz oder des primären Metaboliten. Weniger als 20 % des Arzneimittels werden im Kot nachgewiesen. Nach intravenöser Verabreichung von racemischem Albuterol wurden zwischen 25 % und 46 % der (R)-Albuterol-Fraktion der Dosis als unverändertes (R)-Albuterol im Urin ausgeschieden.
Geriatrie, Pädiatrie, Leber-/Niereninsuffizienz
Es wurden keine pharmakokinetischen Studien für PROAIR HFA Inhalationsaerosol bei Neugeborenen oder älteren Probanden durchgeführt.
Die Auswirkung einer Leberfunktionsstörung auf die Pharmakokinetik von PROAIR HFA Inhalationsaerosol wurde nicht untersucht.
Die Auswirkung einer Nierenfunktionsstörung auf die Pharmakokinetik von Albuterol wurde bei 5 Probanden mit einer Kreatinin-Clearance von 7 bis 53 ml/min bewertet und die Ergebnisse wurden mit denen von gesunden Freiwilligen verglichen. Eine Nierenerkrankung hatte keinen Einfluss auf die Halbwertszeit, aber die Albuterol-Clearance nahm um 67 % ab. Bei der Verabreichung hoher Dosen von PROAIR HFA Inhalationsaerosol an Patienten mit eingeschränkter Nierenfunktion ist Vorsicht geboten [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Tiertoxikologie und/oder Pharmakologie
Präklinisch
Intravenöse Studien an Ratten mit Albuterolsulfat haben gezeigt, dass Albuterol die Blut-Hirn-Schranke passiert und Gehirnkonzentrationen von etwa 5 % der Plasmakonzentration erreicht. In Strukturen außerhalb der Blut-Hirn-Schranke (Zirbeldrüse und Hypophyse) wurden 100-mal höhere Albuterol-Konzentrationen als im gesamten Gehirn gefunden.
Studien an Labortieren (Minischweine, Nagetiere und Hunde) haben das Auftreten von Herzrhythmusstörungen und plötzlichem Herztod (mit histologischem Nachweis einer Myokardnekrose) gezeigt, wenn β-Agonisten und Methylxanthine gleichzeitig verabreicht wurden. Die klinische Bedeutung dieser Befunde ist nicht bekannt.
Das Treibmittel HFA-134a hat keine pharmakologische Aktivität, außer bei sehr hohen Dosen bei Tieren (380- bis 1300-mal die maximale menschliche Exposition basierend auf Vergleichen der AUC-Werte), was hauptsächlich Ataxie, Zittern, Dyspnoe oder Speicheln verursacht. Diese ähneln den Effekten, die von den strukturell verwandten Fluorchlorkohlenwasserstoffen (FCKW) hervorgerufen werden, die ausgiebig in Dosieraerosolen verwendet wurden.
Bei Tieren und Menschen wurde festgestellt, dass das Treibmittel HFA-134a schnell absorbiert und schnell ausgeschieden wird, mit einer Eliminationshalbwertszeit von 3–27 Minuten bei Tieren und 5–7 Minuten beim Menschen. Die Zeit bis zur maximalen Plasmakonzentration (Tmax) und die mittlere Verweilzeit sind beide extrem kurz, was zu einem vorübergehenden Auftreten von HFA-134a im Blut ohne Anzeichen einer Akkumulation führt.
Klinische Studien
Bronchospasmus im Zusammenhang mit Asthma
Erwachsene und jugendliche Patienten ab 12 Jahren
In einer 6-wöchigen, randomisierten, doppelblinden, Placebo-kontrollierten Studie wurde PROAIR HFA-Inhalationsaerosol (58 Patienten) bei Asthmapatienten im Alter von 12 bis 76 Jahren in einer Dosis mit einem passenden Placebo-HFA-Inhalationsaerosol (58 Patienten) verglichen von 180 mcg Albuterol viermal täglich. Ein evaluator-blind vermarkteter aktiver Vergleichsarm mit HFA-134a-Albuterol-Inhalator (56 Patienten) wurde eingeschlossen.
Serielle FEV1-Messungen, unten als prozentuale Veränderung gegenüber dem Ausgangswert am Testtag an Tag 1 und an Tag 43 gezeigt, zeigten, dass zwei Inhalationen von PROAIR HFA-Inhalationsaerosol eine signifikant größere Verbesserung des FEV1 gegenüber dem Wert vor der Behandlung als das passende Placebo sowie a vergleichbare bronchodilatatorische Wirkung wie der vermarktete aktive Vergleichsinhalator HFA-134a Albuterol.
FEV1 als mittlere prozentuale Veränderung gegenüber dem Testtag vor der Dosis in einer 6-wöchigen klinischen Studie am Tag 1
INFORMATIONEN ZUM PATIENTEN
PROAIR® HFA (pro' ar) (Albuterolsulfat) Inhalation Aerosol
Lesen Sie diese Patienteninformation, bevor Sie mit der Anwendung von PROAIR HFA beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Arzt über Ihren Gesundheitszustand oder Ihre Behandlung.
Was ist PROAIR HFA?
PROAIR HFA ist ein verschreibungspflichtiges Arzneimittel, das bei Personen ab 4 Jahren angewendet wird, um:
Es ist nicht bekannt, ob PROAIR HFA bei Kindern unter 4 Jahren sicher und wirksam ist.
Wer sollte PROAIR HFA nicht verwenden?
Verwenden Sie PROAIR HFA nicht, wenn Sie allergisch gegen Albuterolsulfat oder einen der Inhaltsstoffe von PROAIR HFA sind. Eine vollständige Liste der Inhaltsstoffe von PROAIR HFA finden Sie am Ende dieser Packungsbeilage.
Was sollte ich meinem Arzt sagen, bevor ich PROAIR HFA anwende?
Informieren Sie vor der Anwendung von PROAIR HFA Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen.
PROAIR HFA und andere Arzneimittel können sich gegenseitig beeinflussen und Nebenwirkungen verursachen. PROAIR HFA kann die Wirkungsweise anderer Arzneimittel beeinflussen, und andere Arzneimittel können die Wirkungsweise von PROAIR HFA beeinflussen.
Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Fragen Sie Ihren Arzt oder Apotheker nach einer Liste dieser Arzneimittel, wenn Sie sich nicht sicher sind.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste davon, um sie Ihrem Arzt und Apotheker zu zeigen, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich PROAIR HFA verwenden?
Welche Nebenwirkungen kann PROAIR HFA haben?
PROAIR HFA kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Zu den häufigsten Nebenwirkungen von PROAIR HFA gehören:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von PROAIR HFA. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist PROAIR HFA aufzubewahren?
Bewahren Sie PROAIR HFA und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und effektiven Anwendung von PROAIR HFA
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie PROAIR HFA nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie PROAIR HFA nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Diese Patienteninformation fasst die wichtigsten Informationen zu PROAIR HFA zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt. Sie können Ihren Apotheker oder Arzt um Informationen über PROAIR HFA bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Weitere Informationen erhalten Sie unter www.ProAirHFA.com oder telefonisch unter 1-888-482-9522.
Welche Inhaltsstoffe enthält PROAIR HFA?
Wirkstoff: Albuterolsulfat
Inaktive Inhaltsstoffe: Treibmittel HFA-134a und Ethanol.
Gebrauchsanweisung
PROAIR® HFA (pro' ar) (Albuterolsulfat) Inhalation Aerosol
Lesen Sie diese Gebrauchsanweisung, bevor Sie mit der Anwendung von PROAIR HFA beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Arzt über Ihren Gesundheitszustand oder Ihre Behandlung.
Die Teile Ihres PROAIR HFA-Inhalationsgeräts:
Es gibt 2 Hauptteile Ihres PROAIR HFA-Inhalationsgeräts, darunter:
Es gibt auch einen Metallkanister, der das Medikament enthält. Siehe Abbildung A.
Auf der Rückseite des Auslösers befindet sich auch ein Dosiszähler mit einem Sichtfenster, das Ihnen anzeigt, wie viele Sprühstöße des Arzneimittels Sie noch haben. Siehe Abbildung B.
Bis zum 3-maligen Füllen des Gerätes sehen Sie im Sichtfenster des Stellantriebs einen schwarzen Punkt. Siehe Abbildung B und „Vorbereiten Ihres PROAIR HFA-Geräts“ unten.
Abbildung A und Abbildung B 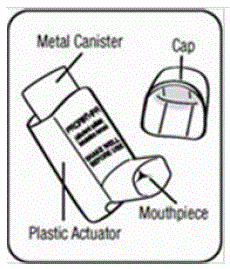
Vorbereiten Ihres PROAIR HFA-Geräts:
Ihr PROAIR-Gerät muss vorbereitet werden, bevor Sie es zum ersten Mal verwenden oder wenn Ihr Gerät länger als 14 Tage hintereinander nicht verwendet wurde. Unterlassen Sie Grundieren Sie Ihr PROAIR HFA-Gerät täglich.
Abbildung C 
Abbildung D 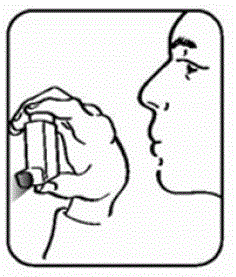
Jedes Mal, wenn Sie Ihr PROAIR HFA-Gerät verwenden:
Ablesen des Dosiszählers an Ihrem PROAIR HFA-Aktuator
Verwendung Ihres PROAIR HFA-Geräts:
Schritt 1. Schütteln Sie den Inhalator gut vor jedem Spritzen. Nehmen Sie die Kappe vom Mundstück des Auslösers ab.
Schritt 2. Halten Sie den Inhalator mit dem Mundstück nach unten. Siehe Abbildung E.
Abbildung E 
Schritt 3. Atme durch deinen Mund aus und drücken Sie so viel Luft wie möglich aus Ihren Lungen. Nehmen Sie das Mundstück in den Mund und schließen Sie Ihre Lippen darum. Siehe Abbildung F.
Schritt 4. Drücken Sie die Oberseite des Behälters ganz nach unten, während Sie tief und langsam durch den Mund einatmen. Siehe Abbildung F.
Abbildung F 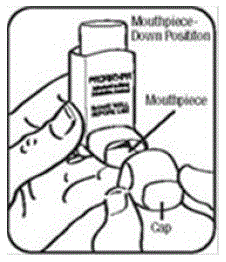
Schritt 5. Unmittelbar nachdem das Spray austritt, nehmen Sie Ihren Finger vom Kanister. Nachdem Sie vollständig eingeatmet haben, nehmen Sie den Inhalator aus dem Mund und schließen Sie den Mund.
Schritt 6. Halten Sie den Atem an, solange Sie können, bis zu 10 Sekunden, dann normal atmen.
Wenn Ihr Arzt Ihnen gesagt hat, dass Sie mehr Sprühstöße verwenden sollen, Warten Sie 1 Minute und schütteln Sie den Inhalator erneut. Wiederholen Sie die Schritte 2 bis 6.
Schritt 7. Setzen Sie die Kappe nach jeder Anwendung des Inhalators wieder auf das Mundstück. Achten Sie darauf, dass die Kappe fest einrastet.
Reinigung Ihres PROAIR HFA-Geräts:
Es ist sehr wichtig, den Kunststoffauslöser sauber zu halten, damit sich das Arzneimittel nicht ansammelt und das Spray blockiert. Siehe Abbildung G und Abbildung H.
Abbildung G und Abbildung H 
Abbildung I 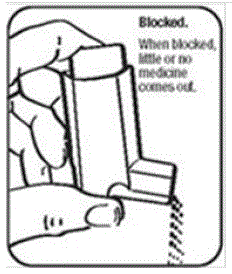
Abbildung J 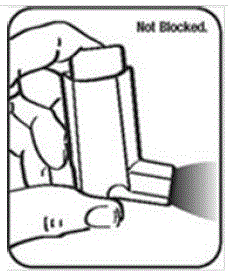
Abbildung K 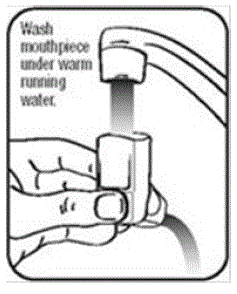
Wenn Sie Ihren Inhalator verwenden müssen, bevor der Auslöser vollständig trocken ist:
Ersetzen Ihres PROAIR HFA-Geräts
Diese Patienteninformation und Gebrauchsanweisung wurde von der US Food and Drug Administration genehmigt.