Symbicort 160/4.5mcg Budesonide Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Symbicort 4,5 mcg und wie wird es angewendet?
Symbicort 4,5 mcg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Asthma und chronisch obstruktiver Lungenerkrankung. Symbicort kann allein oder mit anderen Medikamenten verwendet werden.
Symbicort gehört zu einer Klasse von Medikamenten, die Respiratory Inhalant Combos genannt werden.
Es ist nicht bekannt, ob Symbicort 4,5 µg bei Kindern unter 6 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Symbicort 4,5 mcg haben?
Symbicort kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Symbicort gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Symbicort. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
SYMBICORT 80/4.5 und SYMBICORT 160/4.5 enthalten jeweils mikronisiertes Budesonid und mikronisiertes Formoterolfumarat-Dihydrat nur zur oralen Inhalation.
Jeder SYMBICORT 80/4.5- und SYMBICORT 160/4.5-Kanister ist als ein mit Hydrofluoralkan (HFA 227; 1,1,1,2,3,3,3-Heptafluorpropan) angetriebener, unter Druck stehender Dosierinhalator formuliert, der entweder 60 oder 120 Sprühstöße enthält [siehe Darreichungsformen und Stärken und WIE GELIEFERT / Lagerung und Handhabung ]. Nach dem Vorfüllen dosiert jede Betätigung entweder 91/5,1 µg oder 181/5,1 µg vom Ventil und gibt entweder 80/4,5 µg oder 160/4,5 µg (mikronisiertes Budesonid/mikronisiertes Formoterolfumarat-Dihydrat) vom Auslöser ab. Die tatsächliche an die Lunge abgegebene Arzneimittelmenge kann von Faktoren des Patienten abhängen, wie z. B. der Koordination zwischen der Betätigung der Vorrichtung und dem Einatmen durch das Abgabesystem. SYMBICORT 160 mg enthält außerdem Povidon K25 USP als Suspendiermittel und Polyethylenglykol 1000 NF als Gleitmittel.
SYMBICORT 160 mg sollte vor der ersten Anwendung vorbereitet werden, indem zwei Testsprühstöße vom Gesicht weg in die Luft abgegeben werden und vor jedem Sprühstoß 5 Sekunden lang gut geschüttelt wird. In Fällen, in denen der Inhalator länger als 7 Tage nicht verwendet wurde oder wenn er fallen gelassen wurde, bereiten Sie den Inhalator erneut vor, indem Sie ihn vor jedem Sprühstoß 5 Sekunden lang gut schütteln und zwei Testsprühstöße vom Gesicht weg in die Luft abgeben.
Ein Wirkstoff von SYMBICORT 4,5 µg ist Budesonid, ein Kortikosteroid, das chemisch als (RS)11β, 16α, 17,21-Tetrahydroxypregna-1,4-dien-3,20-dion zyklisches 16,17-acetal mit Butyraldehyd bezeichnet wird. Budesonid wird als Mischung aus zwei Epimeren (22R und 22S) bereitgestellt. Die Summenformel von Budesonid ist C25H34O6 und sein Molekulargewicht beträgt 430,5. Seine Strukturformel lautet:
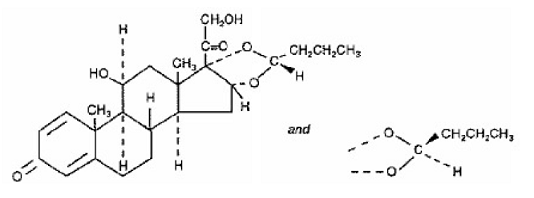
Budesonid ist ein weißes bis cremefarbenes, geschmacks- und geruchloses Pulver, das in Wasser und Heptan praktisch unlöslich, in Ethanol schwer löslich und in Chloroform gut löslich ist. Sein Verteilungskoeffizient zwischen Octanol und Wasser bei pH 7,4 beträgt 1,6 x 103.
Der andere Wirkstoff von SYMBICORT 160 mg ist Formoterolfumarat-Dihydrat, ein selektiver Beta2-Agonist, der chemisch als (R*,R*)-(±)-N-[2-Hydroxy-5-[1-Hydroxy-2-[[ 2-(4-Methoxyphenyl)-1-methylethyl]amino]ethyl]phenyl]formamid, (E)-2-Butendioat (2:1), Dihydrat. Die Summenformel von Formoterol ist C42H56N4O14 und sein Molekulargewicht beträgt 840,9. Seine Strukturformel lautet:
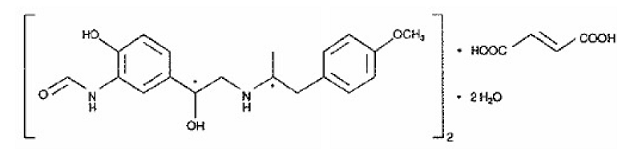
Formoterolfumarat-Dihydrat ist ein leicht wasserlösliches Pulver. Sein Octanol-Wasser-Verteilungskoeffizient bei pH 7,4 beträgt 2,6. Der pKa-Wert von Formoterolfumarat-Dihydrat bei 25°C beträgt 7,9 für die Phenolgruppe und 9,2 für die Aminogruppe.
INDIKATIONEN
Behandlung von Asthma
SYMBICORT 4,5 µg ist angezeigt zur Behandlung von Asthma bei Patienten ab 6 Jahren.
SYMBICORT sollte bei Patienten angewendet werden, die mit einem Langzeitmedikament zur Asthmakontrolle, wie z. B. einem inhalativen Kortikosteroid (ICS), nicht ausreichend kontrolliert werden können oder deren Erkrankung den Beginn einer Behandlung mit einem inhalativen Kortikosteroid und einem langwirksamen beta2-adrenergen Agonisten (LABA) rechtfertigt.
Wichtige Nutzungsbeschränkungen
Erhaltungstherapie der chronisch obstruktiven Lungenerkrankung
SYMBICORT 160/4.5 ist indiziert für die Erhaltungstherapie der Atemwegsobstruktion bei Patienten mit chronisch obstruktiver Lungenerkrankung (COPD), einschließlich chronischer Bronchitis und/oder Emphysem. SYMBICORT 160/4.5 ist auch angezeigt, um Exazerbationen von COPD zu reduzieren. SYMBICORT 160/4,5 ist die einzige Stärke, die für die Behandlung von COPD angezeigt ist.
Wichtige Nutzungsbeschränkungen
DOSIERUNG UND ANWENDUNG
Verwaltungsinformationen
SYMBICORT 160 mg sollte als 2 Inhalationen zweimal täglich (morgens und abends im Abstand von etwa 12 Stunden) jeden Tag nur oral inhaliert verabreicht werden. Nach der Inhalation sollte der Patient den Mund mit Wasser ausspülen, ohne zu schlucken.
Bereiten Sie SYMBICORT 4,5 mcg vor der ersten Anwendung vor, indem Sie zwei Testsprühstöße vom Gesicht weg in die Luft geben und vor jedem Sprühstoß 5 Sekunden lang gut schütteln. In Fällen, in denen der Inhalator länger als 7 Tage nicht verwendet wurde oder wenn er fallen gelassen wurde, bereiten Sie den Inhalator erneut vor, indem Sie ihn vor jedem Sprühstoß gut schütteln und zwei Testsprühstöße vom Gesicht weg in die Luft abgeben.
Eine häufigere Verabreichung oder eine größere Anzahl von Inhalationen (mehr als 2 Inhalationen zweimal täglich) der verschriebenen Stärke von SYMBICORT wird nicht empfohlen, da bei manchen Patienten mit höherer Formoterol-Dosierung eher Nebenwirkungen auftreten. Patienten, die SYMBICORT anwenden, sollten aus keinem Grund zusätzliches LABA verwenden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Asthma
Wenn in der Zeit zwischen den Dosen Asthmasymptome auftreten, sollte zur sofortigen Linderung ein inhalativer, kurz wirksamer Beta2-Agonist eingenommen werden.
Erwachsene und jugendliche Patienten ab 12 Jahren
Für Patienten ab 12 Jahren beträgt die Dosierung 2 Inhalationen von SYMBICORT 80/4,5 oder SYMBICORT 160/4,5 zweimal täglich.
Die empfohlenen Anfangsdosierungen für SYMBICORT für Patienten im Alter von 12 Jahren und älter basieren auf dem Schweregrad des Asthmas des Patienten oder dem Grad der Kontrolle der Asthmasymptome und dem Risiko von Exazerbationen unter gegenwärtigen inhalativen Kortikosteroiden.
Die empfohlene Höchstdosis für erwachsene und jugendliche Patienten ab 12 Jahren beträgt SYMBICORT 160/4,5, zwei Inhalationen zweimal täglich.
Eine Verbesserung der Asthmakontrolle nach inhalativer Verabreichung von SYMBICORT kann innerhalb von 15 Minuten nach Beginn der Behandlung eintreten, obwohl der maximale Nutzen möglicherweise erst 2 Wochen oder länger nach Beginn der Behandlung erreicht wird. Einzelne Patienten werden eine unterschiedliche Zeit bis zum Einsetzen und Grad der Symptomlinderung erfahren.
Bei Patienten, die nach 1-2-wöchiger Therapie mit SYMBICORT 80/4,5 nicht ausreichend auf die Anfangsdosis ansprechen, kann die Substitution mit SYMBICORT 160/4,5 eine zusätzliche Asthmakontrolle bewirken.
Wenn ein zuvor wirksames Dosierungsschema von SYMBICORT 4,5 µg keine ausreichende Asthmakontrolle bietet, sollte das therapeutische Schema neu bewertet und zusätzliche therapeutische Optionen (z. B. Ersetzen der niedrigeren Stärke von SYMBICORT 4,5 µg durch die höhere Stärke, Hinzufügen zusätzlicher inhalativer Dosen) empfohlen werden Kortikosteroid oder die Einleitung oraler Kortikosteroide) sollte in Erwägung gezogen werden.
Pädiatrische Patienten im Alter von 6 bis unter 12 Jahren
Für Patienten im Alter von 6 bis unter 12 Jahren beträgt die Dosierung 2 Inhalationen von SYMBICORT 80/4,5 zweimal täglich.
Chronisch obstruktive Lungenerkrankung
Für Patienten mit COPD ist die empfohlene Dosis SYMBICORT 160/4,5, zwei Inhalationen zweimal täglich.
Wenn in der Zeit zwischen den Dosen Kurzatmigkeit auftritt, sollte zur sofortigen Linderung ein inhalativer, kurz wirksamer Beta2-Agonist eingenommen werden.
WIE GELIEFERT
Darreichungsformen und Stärken
SYMBICORT ist als Dosieraerosol mit einer Kombination aus Budesonid (80 oder 160 µg) und Formoterol (4,5 µg) als Inhalationsaerosol in den folgenden zwei Stärken erhältlich: 80/4,5 und 160/4,5. Jede Dosisstärke enthält 60 oder 120 Sprühstöße pro Kanister. Jede Stärke von SYMBICORT 160 mg wird mit einem roten Kunststoffbetätiger mit einer grauen Staubkappe geliefert.
Lagerung und Handhabung
SYMBICORT ist in zwei Stärken erhältlich und wird in folgenden Packungsgrößen geliefert:
Darreichungsformen und Stärken
Jede Stärke wird als druckbeaufschlagter Aluminiumkanister mit aufgesetztem Zählgerät, einem roten Kunststoff-Betätigergehäuse mit weißem Mundstück und aufgesetzter grauer Staubkappe geliefert. Jeder 120er Inhalationsbehälter hat ein Nettofüllgewicht von 10,2 Gramm und jeder 60er Inhalationsbehälter hat ein Nettofüllgewicht von 6,9 Gramm (SYMBICORT 80/4,5) oder 6 Gramm (SYMBICORT 160/4,5). Jeder Kanister ist in einem Folienbeutel mit Trockenmittelbeutel verpackt und in einen Karton gelegt. Jeder Karton enthält einen Kanister und eine Packungsbeilage.
Der SYMBICORT 4,5-mcg-Behälter sollte nur mit dem SYMBICORT 4,5-mcg-Betätiger verwendet werden, und der SYMBICORT-Betätiger sollte nicht mit anderen Arzneimitteln zur Inhalation verwendet werden.
Die richtige Menge des Medikaments bei jeder Inhalation kann nicht gewährleistet werden, nachdem die angegebene Anzahl von Inhalationen aus dem Kanister verwendet wurde, auch wenn sich der Inhalator möglicherweise nicht vollständig leer anfühlt und weiter funktioniert. Der Inhalator sollte entsorgt werden, wenn die angegebene Anzahl von Inhalationen verwendet wurde oder innerhalb von 3 Monaten nach Entnahme aus dem Folienbeutel. Tauchen Sie den Kanister niemals in Wasser, um die verbleibende Menge im Kanister zu bestimmen („Schwimmtest“).
Bei kontrollierter Raumtemperatur von 20 °C bis 25 °C (68 °F bis 77 °F) lagern [siehe USP]. Bewahren Sie den Inhalator mit dem Mundstück nach unten auf.
Für beste Ergebnisse sollte der Kanister vor Gebrauch Raumtemperatur haben. Vor Gebrauch 5 Sekunden gut schütteln.
Von Kindern fern halten. Nicht in die Augen sprühen.
INHALT UNTER DRUCK.
Nicht durchstechen oder verbrennen. Nicht in der Nähe von Hitze oder offenem Feuer lagern. Temperaturen über 120 °F können zum Platzen führen. Behälter niemals ins Feuer oder in die Verbrennungsanlage werfen.
Hergestellt für: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850 Von: AstraZeneca Dunkerque Production, Dunkerque, Frankreich. Überarbeitet: Dezember 2017
NEBENWIRKUNGEN
Die Verwendung von LABA kann zu Folgendem führen:
Die systemische und inhalative Anwendung von Kortikosteroiden kann zu Folgendem führen:
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Erfahrung in klinischen Studien bei Asthma
Erwachsene und jugendliche Patienten ab 12 Jahren
Die Gesamtsicherheitsdaten bei Erwachsenen und Jugendlichen basieren auf 10 aktiv- und placebokontrollierten klinischen Studien, in denen 3393 Patienten ab 12 Jahren (2052 Frauen und 1341 Männer) mit Asthma unterschiedlichen Schweregrades mit SYMBICORT 80/4,5 oder 160 behandelt wurden /4,5 12 bis 52 Wochen lang ein- oder zweimal täglich 2 Inhalationen eingenommen. In diesen Studien waren die Patienten unter SYMBICORT im Mittel 38 Jahre alt und überwiegend Kaukasier (82 %).
Die Häufigkeit häufiger Nebenwirkungen in Tabelle 2 unten basiert auf gepoolten Daten aus drei 12-wöchigen, doppelblinden, placebokontrollierten klinischen Studien, an denen 401 erwachsene und jugendliche Patienten (148 Männer und 253 Frauen) im Alter von 12 Jahren und älter teilnahmen mit 2 Inhalationen von SYMBICORT 80/4,5 oder SYMBICORT 160/4,5 zweimal täglich behandelt. Die SYMBICORT-Gruppe bestand aus überwiegend kaukasischen (84 %) Patienten mit einem Durchschnittsalter von 38 Jahren und einem mittleren Prozentsatz des vorhergesagten FEV1 zu Studienbeginn von 76 bzw. 68 für die Behandlungsgruppen mit 80/4,5 µg bzw. 160/4,5 µg. Kontrollarme zum Vergleich umfassten 2 Inhalationen von Budesonid HFA Dosieraerosol (MDI) 80 oder 160 µg, Formoterol Trockenpulverinhalator (DPI) 4,5 µg oder Placebo (MDI und DPI) zweimal täglich. Tabelle 2 enthält alle unerwünschten Ereignisse, die mit einer Inzidenz von > 3 % in einer beliebigen SYMBICORT-Gruppe und häufiger als in der Placebo-Gruppe bei zweimal täglicher Gabe auftraten. Bei der Berücksichtigung dieser Daten sollte die längere durchschnittliche Dauer der Patientenexposition bei SYMBICORT-Patienten berücksichtigt werden, da die Inzidenzen nicht für ein Ungleichgewicht der Behandlungsdauer angepasst werden.
Langzeitsicherheit – Klinische Studien zu Asthma bei Patienten ab 12 Jahren
Langzeitstudien zur Sicherheit bei jugendlichen und erwachsenen Patienten ab 12 Jahren, die bis zu 1 Jahr lang mit Dosen von bis zu 1280/36 µg/Tag (640/18 µg zweimal täglich) behandelt wurden, zeigten keine klinisch bedeutsamen Änderungen der Inzidenz noch neue Arten von unerwünschten Ereignissen, die nach längerer Behandlungsdauer auftreten. Ebenso wurden bis zu 1 Jahr lang keine signifikanten oder unerwarteten Muster von Anomalien bei Sicherheitsmaßnahmen beobachtet, einschließlich Chemie, Hämatologie, EKG, Holter-Monitor und HPA-Achsen-Bewertungen.
Pädiatrische Patienten im Alter von 6 bis unter 12 Jahren
Die Sicherheitsdaten für pädiatrische Patienten im Alter von 6 bis unter 12 Jahren basieren auf 1 Studie mit einer Behandlungsdauer von 12 Wochen. Patienten (79 Frauen und 105 Männer), die bei Studieneintritt inhalative Kortikosteroide erhielten, wurden randomisiert SYMBICORT 80/4,5 (n = 92) oder Budesonid pMDI 80 mcg (n = 92), 2 Inhalationen zweimal täglich, zugeteilt. Das allgemeine Sicherheitsprofil dieser Patienten war ähnlich dem, das bei Patienten ab 12 Jahren beobachtet wurde, die SYMBICORT 80/4,5 zweimal täglich in Studien mit ähnlichem Design erhielten. Häufige Nebenwirkungen, die bei mit SYMBICORT 80/4,5 behandelten Patienten mit einer Häufigkeit von ≥ 3 % und häufiger auftraten als bei Patienten, die nur mit Budesonid pMDI 80 mcg behandelt wurden, waren Infektionen der oberen Atemwege, Pharyngitis, Kopfschmerzen und Rhinitis.
Erfahrung aus klinischen Studien bei chronisch obstruktiver Lungenerkrankung
Die unten beschriebenen Sicherheitsdaten spiegeln die Exposition gegenüber SYMBICORT 160/4,5 bei 1783 Patienten wider. SYMBICORT 160/4.5 wurde in zwei placebokontrollierten Lungenfunktionsstudien (Dauer 6 und 12 Monate) und zwei aktiv kontrollierten Exazerbationsstudien (Dauer 6 und 12 Monate) bei Patienten mit COPD untersucht.
Die Inzidenz häufiger unerwünschter Ereignisse in Tabelle 3 unten basiert auf gepoolten Daten aus zwei doppelblinden, placebokontrollierten klinischen Studien zur Lungenfunktion (Dauer 6 und 12 Monate), an denen 771 erwachsene COPD-Patienten (496 Männer und 275 Frauen) teilnahmen 40 Jahren und älter wurden mit SYMBICORT 160/4,5 behandelt, zwei Inhalationen zweimal täglich. Von diesen Patienten wurden 651 für 6 Monate und 366 für 12 Monate behandelt. Die SYMBICORT-Gruppe bestand aus überwiegend kaukasischen (93 %) Patienten mit einem mittleren Alter von 63 Jahren und einem mittleren Prozentsatz des vorhergesagten FEV1 zu Studienbeginn von 33 %. Kontrollarme zum Vergleich umfassten 2 Inhalationen von Budesonid HFA (MDI) 160 mcg, Formoterol (DPI) 4,5 mcg oder Placebo (MDI und DPI) zweimal täglich. Tabelle 3 enthält alle unerwünschten Ereignisse, die in der SYMBICORT-Gruppe mit einer Inzidenz von ≥ 3 % und häufiger als in der Placebo-Gruppe auftraten. Bei der Berücksichtigung dieser Daten sollte die längere durchschnittliche Expositionsdauer des Patienten gegenüber SYMBICORT 4,5 µg berücksichtigt werden, da die Inzidenzen nicht für ein Ungleichgewicht der Behandlungsdauer angepasst werden.
Andere Lungeninfektionen als Pneumonie (hauptsächlich Bronchitis) traten bei einem größeren Prozentsatz der mit SYMBICORT 160/4,5 behandelten Patienten im Vergleich zu Placebo auf (7,9 % vs. 5,1 %). Es wurden keine klinisch bedeutsamen oder unerwarteten Muster von Anomalien beobachtet, die bis zu 1 Jahr lang in Chemie, Hämatologie, EKG, EKG (Holter)-Überwachung, HPA-Achse, Knochenmineraldichte und ophthalmologischen Beurteilungen beobachtet wurden.
Die Sicherheitsergebnisse aus den beiden doppelblinden, aktiv kontrollierten Exazerbationsstudien (Dauer 6 und 12 Monate), in denen 1012 erwachsene COPD-Patienten (616 Männer und 396 Frauen) im Alter von 40 Jahren und älter mit SYMBICORT 160/4,5 behandelt wurden, zwei Inhalationen zweimal täglich stimmten mit den Lungenfunktionsstudien überein.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von SYMBICORT nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen. Einige dieser Nebenwirkungen wurden möglicherweise auch in klinischen Studien mit SYMBICORT beobachtet.
Herzerkrankungen: Angina pectoris, Tachykardie, atriale und ventrikuläre Tachyarrhythmien, Vorhofflimmern, Extrasystolen, Herzklopfen
Endokrine Störungen: Hyperkortizismus, Verringerung der Wachstumsgeschwindigkeit bei pädiatrischen Patienten
Augenerkrankungen: Katarakt, Glaukom, erhöhter Augeninnendruck
Gastrointestinale Störungen: oropharyngeale Candidiasis, Übelkeit
Erkrankungen des Immunsystems: Sofortige und verzögerte Überempfindlichkeitsreaktionen wie anaphylaktische Reaktion, Angioödem, Bronchospasmus, Urtikaria, Exanthem, Dermatitis, Juckreiz
Stoffwechsel- und Ernährungsstörungen: Hyperglykämie, Hypokaliämie
Erkrankungen des Bewegungsapparates, des Bindegewebes und der Knochen: Muskelkrämpfe
Erkrankungen des Nervensystems: Zittern, Schwindel
Psychische Störungen: Verhaltensstörungen, Schlafstörungen, Nervosität, Erregung, Depression, Unruhe
Erkrankungen der Atemwege, des Brustraums und Mediastinums: Dysphonie, Husten, Rachenreizung
Erkrankungen der Haut und des Unterhautzellgewebes: Hautblutungen
Gefäßerkrankungen: Hypotonie, Bluthochdruck
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
In klinischen Studien hat die gleichzeitige Verabreichung von SYMBICORT und anderen Arzneimitteln wie kurzwirksamen Beta2-Agonisten, intranasalen Kortikosteroiden und Antihistaminika/Abschwellmitteln nicht zu einer erhöhten Häufigkeit von Nebenwirkungen geführt. Mit SYMBICORT wurden keine formellen Wechselwirkungsstudien durchgeführt.
Inhibitoren von Cytochrom P4503A4
Der Hauptstoffwechselweg von Kortikosteroiden, einschließlich Budesonid, einem Bestandteil von SYMBICORT, verläuft über das Isoenzym 3A4 (CYP3A4) von Cytochrom P450 (CYP). Nach oraler Verabreichung von Ketoconazol, einem starken Inhibitor von CYP3A4, stieg die mittlere Plasmakonzentration von oral verabreichtem Budesonid an. Die gleichzeitige Verabreichung von CYP3A4 kann den Metabolismus von Budesonid hemmen und die systemische Exposition gegenüber Budesonid erhöhen. Vorsicht ist geboten, wenn die gleichzeitige Anwendung von SYMBICORT 4,5 µg mit Langzeit-Ketoconazol und anderen bekannten starken CYP3A4-Inhibitoren (z. B. Ritonavir, Atazanavir, Clarithromycin, Indinavir, Itraconazol, Nefazodon, Nelfinavir, Saquinavir, Telithromycin) in Betracht gezogen wird [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Monoaminoxidase-Hemmer und trizyklische Antidepressiva
SYMBICORT sollte bei Patienten, die mit Monoaminoxidase-Hemmern oder trizyklischen Antidepressiva behandelt werden, oder innerhalb von 2 Wochen nach Absetzen solcher Arzneimittel mit Vorsicht verabreicht werden, da die Wirkung von Formoterol, einem Bestandteil von SYMBICORT 160 mg, auf das Gefäßsystem durch diese Arzneimittel verstärkt werden kann . In klinischen Studien mit SYMBICORT erhielt eine begrenzte Anzahl von COPD- und Asthmapatienten trizyklische Antidepressiva, weshalb keine klinisch aussagekräftigen Schlussfolgerungen zu unerwünschten Ereignissen gezogen werden können.
Beta-adrenerge Rezeptorblocker
Betablocker (einschließlich Augentropfen) blockieren möglicherweise nicht nur die pulmonale Wirkung von Beta-Agonisten wie Formoterol, einem Bestandteil von SYMBICORT, sondern können bei Patienten mit Asthma schwere Bronchospasmen hervorrufen. Daher sollten Patienten mit Asthma normalerweise nicht mit Betablockern behandelt werden. Unter bestimmten Umständen gibt es jedoch möglicherweise keine akzeptablen Alternativen zur Anwendung von Betarezeptorenblockern bei Patienten mit Asthma. In dieser Situation könnten kardioselektive Betablocker in Betracht gezogen werden, obwohl sie mit Vorsicht verabreicht werden sollten.
Diuretika
Die EKG-Veränderungen und/oder Hypokaliämie, die aus der Verabreichung von nicht kaliumsparenden Diuretika (wie Schleifen- oder Thiaziddiuretika) resultieren können, können durch Beta-Agonisten akut verschlechtert werden, insbesondere wenn die empfohlene Dosis des Beta-Agonisten überschritten wird. Obwohl die klinische Bedeutung dieser Wirkungen nicht bekannt ist, ist bei der gleichzeitigen Verabreichung von SYMBICORT mit nicht kaliumsparenden Diuretika Vorsicht geboten.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Schwerwiegende Asthma-bezogene Ereignisse – Krankenhausaufenthalte, Intubationen und Tod
Die Anwendung von LABA als Monotherapie (ohne ICS) gegen Asthma ist mit einem erhöhten Asthma-assoziierten Todesrisiko verbunden [siehe Salmeterol Multicenter Asthma Research Trial (SMART)]. Verfügbare Daten aus kontrollierten klinischen Studien deuten auch darauf hin, dass die Anwendung von LABA als Monotherapie das Risiko einer Asthma-bedingten Krankenhauseinweisung bei pädiatrischen und jugendlichen Patienten erhöht. Diese Befunde werden als Klasseneffekt von LABA angesehen. Wenn LABA in Fixdosis-Kombination mit ICS angewendet wird, zeigen Daten aus großen klinischen Studien keinen signifikanten Anstieg des Risikos schwerwiegender Asthma-bedingter Ereignisse (Krankenhauseinweisungen, Intubationen, Tod) im Vergleich zu ICS allein (siehe Schwerwiegende Asthma-bedingte Ereignisse). mit ICS/LABA).
Schwerwiegende Asthma-bezogene Ereignisse mit ICS/LABA
Vier große, 26-wöchige, randomisierte, verblindete, aktiv kontrollierte klinische Sicherheitsstudien wurden durchgeführt, um das Risiko schwerwiegender Asthma-bedingter Ereignisse zu bewerten, wenn LABA in Kombination mit fester Dosis mit ICS im Vergleich zu ICS allein bei Patienten mit Asthma angewendet wurde. Drei Studien schlossen erwachsene und jugendliche Patienten im Alter von ≥ 12 Jahren ein: Eine Studie verglich Budesonid/Formoterol (SYMBICORT) mit Budesonid [siehe Klinische Studien ]; eine Studie verglich Fluticasonpropionat/Salmeterol-Pulver zur Inhalation mit Fluticasonpropionat-Pulver zur Inhalation; und eine Studie verglich Mometasonfuroat/Formoterol mit Mometasonfuroat. Die vierte Studie umfasste pädiatrische Patienten im Alter von 4 bis 11 Jahren und verglich Fluticasonpropionat/Salmeterol-Pulver zur Inhalation mit Fluticasonpropionat-Pulver zur Inhalation. Der primäre Sicherheitsendpunkt für alle vier Studien waren schwerwiegende Asthma-bezogene Ereignisse (Krankenhausaufenthalte, Intubationen und Tod). Ein verblindeter Bewertungsausschuss stellte fest, ob die Ereignisse mit Asthma in Verbindung standen.
Die drei Studien mit Erwachsenen und Jugendlichen wurden so konzipiert, dass eine Risikospanne von 2,0 ausgeschlossen wurde, und die pädiatrische Studie wurde so konzipiert, dass ein Risiko von 2,7 ausgeschlossen wurde. Jede einzelne Studie erreichte ihr vorgegebenes Ziel und zeigte die Nicht-Unterlegenheit von ICS/LABA gegenüber ICS allein. Eine Metaanalyse der drei Studien mit Erwachsenen und Jugendlichen zeigte keinen signifikanten Anstieg des Risikos eines schwerwiegenden Asthma-bedingten Ereignisses mit ICS/LABA-Festdosiskombination im Vergleich zu ICS allein (Tabelle 1). Diese Studien waren nicht darauf ausgelegt, alle Risiken für schwerwiegende Asthma-bedingte Ereignisse mit ICS/LABA im Vergleich zu ICS auszuschließen.
Die pädiatrische Sicherheitsstudie umfasste 6208 pädiatrische Patienten im Alter von 4 bis 11 Jahren, die ICS/LABA (Fluticasonpropionat/Salmeterol-Pulver zur Inhalation) oder ICS (Fluticasonpropionat-Pulver zur Inhalation) erhielten. In dieser Studie erlitten 27/3.107 (0,9 %) Patienten, die zu ICS/LABA randomisiert wurden, und 21/3.101 (0,7 %) Patienten, die zu ICS randomisiert wurden, ein schwerwiegendes Asthma-bedingtes Ereignis. Es gab keine asthmabedingten Todesfälle oder Intubationen. ICS/LABA zeigte kein signifikant erhöhtes Risiko für ein schwerwiegendes Asthma-bezogenes Ereignis im Vergleich zu ICS, basierend auf der vorab festgelegten Risikospanne (2,7), mit einem geschätzten Risikoverhältnis von Zeit bis zum ersten Ereignis von 1,29 (95 % KI: 0,73 , 2.27).
Salmeterol Multizentrische Asthma-Forschungsstudie (SMART)
Eine 28-wöchige, placebokontrollierte US-Studie, in der die Sicherheit von Salmeterol mit Placebo verglichen wurde, jeweils zusätzlich zu einer üblichen Asthmatherapie, zeigte eine Zunahme asthmabedingter Todesfälle bei Patienten, die Salmeterol erhielten (13/13.176 bei mit Salmeterol behandelten Patienten gegenüber 3 /13.179 bei mit Placebo behandelten Patienten; relatives Risiko: 4,37 [95 % KI 1,25; 15,34]). Die Verwendung von Hintergrund-ICS war in SMART nicht erforderlich. Das erhöhte Asthma-bedingte Todesrisiko wird als Klasseneffekt der LABA-Monotherapie angesehen.
Formoterol-Monotherapie-Studien
Klinische Studien mit Formoterol als Monotherapie deuteten auf eine höhere Inzidenz schwerer Asthma-Exazerbationen bei Patienten hin, die Formoterol erhielten, als bei Patienten, die Placebo erhielten. Der Umfang dieser Studien war nicht ausreichend, um den Unterschied bei schwerwiegenden Asthma-Exazerbationen zwischen den Behandlungsgruppen genau zu quantifizieren.
Verschlechterung der Krankheit und akute Episoden
Die Behandlung mit SYMBICORT 4,5 µg sollte bei Patienten während sich schnell verschlechternder oder potenziell lebensbedrohlicher Asthma- oder COPD-Episoden nicht begonnen werden. SYMBICORT wurde bei Patienten mit sich akut verschlechterndem Asthma oder COPD nicht untersucht. Die Einleitung von SYMBICORT 4,5 mcg in dieser Einstellung ist nicht angemessen.
Die zunehmende Anwendung von inhalativen, kurz wirksamen Beta2-Agonisten ist ein Marker für eine Verschlechterung des Asthmas. In dieser Situation benötigt der Patient eine sofortige Neubewertung mit Neubewertung des Behandlungsschemas, wobei besonders berücksichtigt werden muss, ob die derzeitige Stärke von SYMBICORT durch eine höhere Stärke ersetzt, zusätzliches inhalatives Kortikosteroid hinzugefügt oder systemische Kortikosteroide eingeleitet werden müssen. Die Patienten sollten nicht mehr als 2 Inhalationen zweimal täglich (morgens und abends) von SYMBICORT anwenden.
SYMBICORT 160 mg sollte nicht zur Linderung akuter Symptome, dh als Notfalltherapie zur Behandlung akuter Episoden von Bronchospasmen, angewendet werden. Ein inhalativer, kurz wirksamer Beta2-Agonist, nicht SYMBICORT, sollte verwendet werden, um akute Symptome wie Atemnot zu lindern.
Zu Beginn der Behandlung mit SYMBICORT 4,5 µg sollten Patienten, die regelmäßig (z. B. 4-mal täglich) kurz wirkende Beta2-Agonisten oral oder inhalativ eingenommen haben, angewiesen werden, die regelmäßige Einnahme dieser Arzneimittel einzustellen.
Übermäßige Verwendung von SYMBICORT 4,5 mcg und Verwendung mit anderen langwirksamen Beta2-Agonisten
Wie andere inhalative Arzneimittel, die beta2-adrenerge Wirkstoffe enthalten, sollte SYMBICORT 4,5 µg nicht häufiger als empfohlen, in höheren Dosen als empfohlen oder in Verbindung mit anderen Arzneimitteln, die LABA enthalten, angewendet werden, da dies zu einer Überdosierung führen kann. Klinisch signifikante kardiovaskuläre Wirkungen und Todesfälle wurden im Zusammenhang mit der übermäßigen Anwendung von inhalativen Sympathomimetika berichtet. Patienten, die SYMBICORT anwenden, sollten aus keinem Grund ein zusätzliches LABA (z. B. Salmeterol, Formoterolfumarat, Arformoteroltartrat) anwenden, einschließlich der Vorbeugung von belastungsinduziertem Bronchospasmus (EIB) oder der Behandlung von Asthma oder COPD.
Lokale Effekte
In klinischen Studien traten bei Patienten, die mit SYMBICORT behandelt wurden, lokalisierte Infektionen des Mundes und des Rachens mit Candida albicans auf. Wenn sich eine solche Infektion entwickelt, sollte sie mit einer geeigneten lokalen oder systemischen (dh oralen Antimykotika) Therapie behandelt werden, während die Behandlung mit SYMBICORT 160 mg fortgesetzt wird, aber manchmal muss die Therapie mit SYMBICORT 4,5 µg unterbrochen werden. Weisen Sie den Patienten an, seinen Mund nach der Inhalation mit Wasser auszuspülen, ohne es herunterzuschlucken, um das Risiko einer oropharyngealen Candidiasis zu verringern.
Lungenentzündung und andere Infektionen der unteren Atemwege
Ärzte sollten bei Patienten mit COPD auf die mögliche Entwicklung einer Lungenentzündung achten, da sich die klinischen Merkmale von Lungenentzündung und Exazerbationen häufig überschneiden. Nach der inhalativen Verabreichung von Kortikosteroiden wurde über Infektionen der unteren Atemwege, einschließlich Lungenentzündung, berichtet.
In einer 6-monatigen Lungenfunktionsstudie mit 1704 COPD-Patienten gab es eine höhere Inzidenz von anderen Lungeninfektionen als Pneumonie (z. B. Bronchitis, virale Infektionen der unteren Atemwege usw.) bei Patienten, die SYMBICORT 160/4,5 erhielten (7,6 %). als bei denen, die SYMBICORT 80/4,5 (3,2 %), Formoterol 4,5 µg (4,6 %) oder Placebo (3,3 %) erhielten. Pneumonien traten in der SYMBICORT 160/4,5-Gruppe (1,1 %) im Vergleich zu Placebo (1,3 %) nicht häufiger auf. In einer 12-monatigen Lungenfunktionsstudie mit 1964 COPD-Patienten traten bei Patienten, die SYMBICORT 160/4,5 erhielten (8,1 %), auch andere Lungeninfektionen als Pneumonie häufiger auf als bei Patienten, die SYMBICORT 80/4,5 (6,9 %) erhielten. Formoterol 4,5 µg (7,1 %) oder Placebo (6,2 %). Ähnlich wie in der 6-monatigen Studie trat eine Pneumonie nicht häufiger in der SYMBICORT 160/4,5-Gruppe (4,0 %) im Vergleich zu Placebo (5,0 %) auf.
Immunsuppression
Patienten, die Medikamente einnehmen, die das Immunsystem unterdrücken, sind anfälliger für Infektionen als gesunde Personen. Windpocken und Masern beispielsweise können bei empfindlichen Kindern oder Erwachsenen, die Kortikosteroide einnehmen, einen schwereren oder sogar tödlichen Verlauf nehmen. Bei solchen Kindern oder Erwachsenen, die diese Krankheiten nicht hatten oder ordnungsgemäß geimpft wurden, sollte besonders darauf geachtet werden, eine Exposition zu vermeiden. Wie sich Dosis, Art und Dauer der Kortikosteroidverabreichung auf das Risiko der Entwicklung einer disseminierten Infektion auswirken, ist nicht bekannt. Der Beitrag der zugrunde liegenden Erkrankung und/oder einer vorherigen Behandlung mit Kortikosteroiden zum Risiko ist ebenfalls nicht bekannt. Bei Exposition kann gegebenenfalls eine Therapie mit Varizella-Zoster-Immunglobulin (VZIG) oder gepooltem intravenösen Immunglobulin (IVIG) angezeigt sein. Bei Exposition gegenüber Masern kann eine Prophylaxe mit gepooltem intramuskulärem Immunglobulin (IG) angezeigt sein (siehe die jeweiligen Packungsbeilagen für vollständige VZIG- und IG-Verschreibungsinformationen). Wenn sich Windpocken entwickeln, kann eine Behandlung mit antiviralen Mitteln in Betracht gezogen werden. Die Immunantwort auf Varizellen-Impfstoff wurde bei pädiatrischen Patienten mit Asthma im Alter von 12 Monaten bis 8 Jahren mit Budesonid-Inhalationssuspension untersucht.
Eine offene, nicht randomisierte klinische Studie untersuchte die Immunantwort auf Varizellen-Impfstoff bei 243 Asthmapatienten im Alter von 12 Monaten bis 8 Jahren, die mit Budesonid-Inhalationssuspension 0,25 mg bis 1 mg täglich (n = 151) oder einer nicht-kortikosteroidischen Asthmatherapie (n =92) (dh Beta2-Agonisten, Leukotrienrezeptorantagonisten, Cromone). Der Prozentsatz der Patienten, die als Reaktion auf die Impfung einen seroprotektiven Antikörpertiter von > 5,0 (gpELISA-Wert) entwickelten, war ähnlich bei Patienten, die mit Budesonid-Inhalationssuspension behandelt wurden (85 %), im Vergleich zu Patienten, die mit einer Asthmatherapie ohne Kortikosteroide behandelt wurden (90 %). Kein Patient, der mit Budesonid-Inhalationssuspension behandelt wurde, entwickelte infolge der Impfung Windpocken.
Inhalative Kortikosteroide sollten bei Patienten mit aktiven oder ruhenden Tuberkuloseinfektionen der Atemwege, wenn überhaupt, mit Vorsicht angewendet werden; unbehandelte systemische Pilz-, Bakterien-, Virus- oder Parasiteninfektionen; oder okulärer Herpes simplex.
Überführung von Patienten aus der systemischen Kortikosteroidtherapie
Besondere Vorsicht ist bei Patienten geboten, die von systemisch wirksamen Kortikosteroiden auf inhalative Kortikosteroide umgestellt wurden, da bei Patienten mit Asthma während und nach der Umstellung von systemischen Kortikosteroiden auf weniger systemisch verfügbare inhalative Kortikosteroide Todesfälle aufgrund von Nebenniereninsuffizienz aufgetreten sind. Nach dem Absetzen von systemischen Kortikosteroiden dauert es einige Monate, bis sich die Hypothalamus-Hypophysen-Nebennierenfunktion (HPA) erholt hat.
Patienten, die zuvor mit 20 mg oder mehr Prednison (oder einem Äquivalent) pro Tag behandelt wurden, sind möglicherweise am anfälligsten, insbesondere wenn ihre systemischen Kortikosteroide fast vollständig abgesetzt wurden. Während dieser Phase der HPA-Unterdrückung können Patienten Anzeichen und Symptome einer Nebenniereninsuffizienz zeigen, wenn sie einem Trauma, einer Operation oder einer Infektion (insbesondere Gastroenteritis) oder anderen Erkrankungen ausgesetzt sind, die mit einem schweren Elektrolytverlust einhergehen. Obwohl SYMBICORT während dieser Episoden zur Kontrolle der Asthmasymptome führen kann, liefert es in den empfohlenen Dosen systemisch weniger als die normalen physiologischen Mengen an Glucocorticoid und liefert NICHT die Mineralocorticoid-Aktivität, die zur Bewältigung dieser Notfälle erforderlich ist.
In Zeiten von Stress, einem schweren Asthmaanfall oder einer schweren COPD-Exazerbation sollten Patienten, die von systemischen Kortikosteroiden abgesetzt wurden, angewiesen werden, die oralen Kortikosteroide (in großen Dosen) sofort wieder aufzunehmen und sich für weitere Anweisungen an ihren Arzt zu wenden. Diese Patienten sollten auch angewiesen werden, einen Warnhinweis mit sich zu führen, der darauf hinweist, dass sie in Stressphasen, bei einem schweren Asthmaanfall oder bei einer schweren COPD-Exazerbation möglicherweise zusätzliche systemische Kortikosteroide benötigen.
Patienten, die orale Kortikosteroide benötigen, sollten nach der Umstellung auf SYMBICORT langsam von der Anwendung systemischer Kortikosteroide entwöhnt werden. Eine Prednison-Reduktion kann erreicht werden, indem die tägliche Prednison-Dosis während der Therapie mit SYMBICORT wöchentlich um 2,5 mg reduziert wird. Während des Absetzens von oralen Kortikosteroiden sollten die Lungenfunktion (mittleres forciertes exspiratorisches Volumen in 1 Sekunde [FEV1] oder morgendlicher maximaler expiratorischer Fluss [PEF]), die Anwendung von Beta-Agonisten und Asthma- oder COPD-Symptome sorgfältig überwacht werden. Darüber hinaus sollten Patienten auf Anzeichen und Symptome einer Nebenniereninsuffizienz wie Müdigkeit, Abgeschlagenheit, Schwäche, Übelkeit und Erbrechen sowie Hypotonie beobachtet werden.
Die Umstellung von Patienten von einer systemischen Kortikosteroidtherapie auf inhalative Kortikosteroide oder SYMBICORT kann Zustände demaskieren, die zuvor durch die systemische Kortikosteroidtherapie unterdrückt wurden (z. B. Rhinitis, Konjunktivitis, Ekzem, Arthritis, eosinophile Erkrankungen). Bei manchen Patienten können trotz Aufrechterhaltung oder sogar Verbesserung der Atemfunktion Symptome eines Entzugs von systemisch wirksamen Kortikosteroiden auftreten (z. B. Gelenk- und/oder Muskelschmerzen, Abgeschlagenheit, Depression).
Hyperkortizismus und Nebennierensuppression
Budesonid, ein Bestandteil von SYMBICORT, hilft häufig bei der Kontrolle von Asthma- und COPD-Symptomen mit einer geringeren Unterdrückung der HPA-Funktion als therapeutisch äquivalente orale Dosen von Prednison. Da Budesonid in den Kreislauf aufgenommen wird und in höheren Dosen systemisch aktiv sein kann, sind die vorteilhaften Wirkungen von SYMBICORT zur Minimierung der HPA-Dysfunktion nur dann zu erwarten, wenn die empfohlenen Dosierungen nicht überschritten werden und einzelne Patienten auf die niedrigste wirksame Dosis titriert werden.
Wegen der Möglichkeit einer systemischen Resorption von inhalativen Kortikosteroiden sollten Patienten, die mit SYMBICORT 160 mg behandelt werden, sorgfältig auf Hinweise auf systemische Kortikosteroidwirkungen beobachtet werden. Besondere Sorgfalt sollte bei der Beobachtung von Patienten postoperativ oder während Stressphasen auf Anzeichen einer unzureichenden Nebennierenreaktion angewendet werden.
Es ist möglich, dass bei einer kleinen Anzahl von Patienten systemische Kortikosteroidwirkungen wie Hyperkortizismus und Nebennierensuppression (einschließlich Nebennierenkrise) auftreten, insbesondere wenn Budesonid über längere Zeiträume in höheren als den empfohlenen Dosen verabreicht wird. Wenn solche Wirkungen auftreten, sollte die Dosierung von SYMBICORT langsam reduziert werden, im Einklang mit anerkannten Verfahren zur Reduzierung systemischer Kortikosteroide und zur Behandlung von Asthmasymptomen.
Arzneimittelwechselwirkungen mit starken Cytochrom P450 3A4-Inhibitoren
Vorsicht ist geboten, wenn die gleichzeitige Anwendung von SYMBICORT 4,5 µg mit Ketoconazol und anderen bekannten starken CYP3A4-Hemmern (z. B. Ritonavir, Atazanavir, Clarithromycin, Indinavir, Itraconazol, Nefazodon, Nelfinavir, Saquinavir, Telithromycin) in Betracht gezogen wird, da Nebenwirkungen mit einer erhöhten systemischen Exposition zusammenhängen zu Budesonid kann auftreten [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
Paradoxer Bronchospasmus und Symptome der oberen Atemwege
Wie andere inhalative Medikamente kann SYMBICORT 160 mg paradoxe Bronchospasmen hervorrufen, die lebensbedrohlich sein können. Wenn nach der Gabe von SYMBICORT 160 mg ein paradoxer Bronchospasmus auftritt, sollte dieser sofort mit einem inhalativen, kurzwirksamen Bronchodilatator behandelt werden, SYMBICORT sollte sofort abgesetzt und eine alternative Therapie eingeleitet werden.
Sofortige Überempfindlichkeitsreaktionen
Unmittelbare Überempfindlichkeitsreaktionen können nach Verabreichung von SYMBICORT 160 mg auftreten, wie Fälle von Urtikaria, Angioödem, Hautausschlag und Bronchospasmus zeigen.
Auswirkungen auf das Herz-Kreislauf-System und das zentrale Nervensystem
Übermäßige beta-adrenerge Stimulation wurde mit Krampfanfällen, Angina pectoris, Bluthochdruck oder Hypotonie, Tachykardie mit Frequenzen von bis zu 200 Schlägen/min, Arrhythmien, Nervosität, Kopfschmerzen, Zittern, Herzklopfen, Übelkeit, Schwindel, Müdigkeit, Unwohlsein und Schlaflosigkeit in Verbindung gebracht [siehe ÜBERDOSIERUNG ]. Daher sollte SYMBICORT 160 mg, wie alle Produkte, die sympathomimetische Amine enthalten, bei Patienten mit Herz-Kreislauf-Erkrankungen, insbesondere Koronarinsuffizienz, Herzrhythmusstörungen und Bluthochdruck, mit Vorsicht angewendet werden.
Formoterol, ein Bestandteil von SYMBICORT, kann bei manchen Patienten einen klinisch signifikanten kardiovaskulären Effekt hervorrufen, gemessen anhand der Pulsfrequenz, des Blutdrucks und/oder der Symptome. Obwohl solche Wirkungen nach Verabreichung von Formoterol in den empfohlenen Dosen gelegentlich auftreten, muss das Arzneimittel möglicherweise abgesetzt werden, wenn sie auftreten. Darüber hinaus wurde von Beta-Agonisten berichtet, dass sie EKG-Veränderungen wie eine Abflachung der T-Welle, eine Verlängerung des QTc-Intervalls und eine ST-Streckensenkung hervorrufen. Die klinische Bedeutung dieser Befunde ist nicht bekannt. Todesfälle wurden im Zusammenhang mit dem übermäßigen Gebrauch von inhalativen Sympathomimetika berichtet.
Verringerung der Knochenmineraldichte
Bei Langzeitanwendung von Produkten, die inhalative Kortikosteroide enthalten, wurde eine Abnahme der Knochenmineraldichte (BMD) beobachtet. Die klinische Bedeutung kleiner BMD-Veränderungen im Hinblick auf Langzeitfolgen wie Fraktur ist unbekannt. Patienten mit wichtigen Risikofaktoren für einen verringerten Knochenmineralgehalt, wie z. B. längere Immobilisierung, Osteoporose in der Familienanamnese, postmenopausaler Status, Tabakkonsum, fortgeschrittenes Alter, schlechte Ernährung oder chronische Einnahme von Arzneimitteln, die die Knochenmasse reduzieren können (z. B. Antikonvulsiva, orale Kortikosteroide). ) sollten überwacht und mit etablierten Behandlungsstandards behandelt werden. Da Patienten mit COPD häufig mehrere Risikofaktoren für eine reduzierte BMD haben, wird eine Beurteilung der BMD vor Beginn der Behandlung mit SYMBICORT 160 mg und danach in regelmäßigen Abständen empfohlen. Wenn eine signifikante Reduzierung der BMD beobachtet wird und SYMBICORT immer noch als medizinisch wichtig für die COPD-Therapie dieses Patienten angesehen wird, sollte die Verwendung von Medikamenten zur Behandlung oder Vorbeugung von Osteoporose dringend in Betracht gezogen werden.
Die Auswirkungen der Behandlung mit SYMBICORT 160/4,5, SYMBICORT 80/4,5, Formoterol 4,5 µg oder Placebo auf die BMD wurden bei einer Untergruppe von 326 Patienten (Frauen und Männer im Alter von 41 bis 88 Jahren) mit COPD in der 12-Monats-Lungenfunktion untersucht lernen. BMD-Bewertungen der Hüft- und Lendenwirbelsäulenregionen wurden zu Studienbeginn und nach 52 Wochen unter Verwendung von Dual-Energy-Röntgen-Absorptiometrie (DEXA)-Scans durchgeführt. Die mittleren Veränderungen der BMD vom Ausgangswert bis zum Ende der Behandlung waren gering (mittlere Veränderungen reichten von -0,01 bis 0,01 g/cm²). Die ANCOVA-Ergebnisse für die BMD der gesamten Wirbelsäule und der gesamten Hüfte, basierend auf dem Zeitpunkt am Ende der Behandlung, zeigten, dass alle geometrischen LS-Mittelwerte für die paarweisen Vergleiche der Behandlungsgruppen nahe bei 1 lagen, was darauf hindeutet, dass die Gesamt-BMD für die gesamten Hüft- und gesamten Wirbelsäulenregionen für die 12 -Monats-Zeitpunkt waren über den gesamten Behandlungszeitraum stabil.
Auswirkung auf das Wachstum
Oral inhalierte Kortikosteroide können bei der Verabreichung an pädiatrische Patienten zu einer Verringerung der Wachstumsgeschwindigkeit führen. Überwachen Sie das Wachstum von pädiatrischen Patienten, die SYMBICORT routinemäßig erhalten (z. B. mittels Stadiometrie). Um die systemischen Wirkungen von oral inhalativen Kortikosteroiden, einschließlich SYMBICORT, zu minimieren, titrieren Sie die Dosis jedes Patienten auf die niedrigste Dosis, die seine/ihre Symptome wirksam kontrolliert [siehe DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ].
Glaukom und Katarakte
Glaukom, erhöhter Augeninnendruck und Katarakte wurden bei Patienten mit Asthma und COPD nach Langzeitanwendung von inhalativen Kortikosteroiden, einschließlich Budesonid, einem Bestandteil von SYMBICORT, berichtet. Daher ist eine engmaschige Überwachung bei Patienten mit Sehstörungen oder erhöhtem Augeninnendruck in der Anamnese, Glaukom und/oder Katarakt angezeigt.
Die Auswirkungen der Behandlung mit SYMBICORT 160/4,5, SYMBICORT 80/4,5, Formoterol 4,5 µg oder Placebo auf die Entwicklung von Katarakt oder Glaukom wurden in einer Untergruppe von 461 Patienten mit COPD in der 12-monatigen Lungenfunktionsstudie untersucht. Augenärztliche Untersuchungen wurden zu Studienbeginn, nach 24 Wochen und nach 52 Wochen durchgeführt. Es gab 26 Probanden (6 %) mit einem Anstieg des posterioren subkapsulären Scores vom Ausgangswert bis zum Maximalwert (> 0,7) während des randomisierten Behandlungszeitraums. Veränderungen der posterioren subkapsulären Scores von > 0,7 vom Ausgangswert bis zum Behandlungsmaximum traten bei 11 Patienten (9,0 %) in der SYMBICORT 160/4,5-Gruppe, 4 Patienten (3,8 %) in der SYMBICORT 80/4,5-Gruppe und 5 Patienten (4,2 %) auf der Formoterol-Gruppe und 6 Patienten (5,2 %) in der Placebo-Gruppe.
Eosinophile Zustände und Churg-Strauss-Syndrom
In seltenen Fällen können sich Patienten unter inhalativen Kortikosteroiden mit systemischen eosinophilen Erkrankungen vorstellen. Einige dieser Patienten weisen klinische Merkmale einer Vaskulitis auf, die mit dem Churg-Strauss-Syndrom übereinstimmen, einer Erkrankung, die häufig mit einer systemischen Kortikosteroidtherapie behandelt wird. Diese Ereignisse wurden in der Regel, aber nicht immer, mit der Reduzierung und/oder dem Absetzen der oralen Kortikosteroidtherapie nach der Einführung inhalativer Kortikosteroide in Verbindung gebracht. Ärzte sollten bei ihren Patienten auf Eosinophilie, vaskulitischen Hautausschlag, sich verschlechternde Lungensymptome, kardiale Komplikationen und/oder Neuropathie achten. Ein kausaler Zusammenhang zwischen Budesonid und diesen Grunderkrankungen wurde nicht hergestellt.
Koexistenzbedingungen
SYMBICORT 4,5 mcg sollte wie alle Medikamente, die sympathomimetische Amine enthalten, bei Patienten mit Krampfanfällen oder Thyreotoxikose und bei Patienten, die ungewöhnlich auf sympathomimetische Amine ansprechen, mit Vorsicht angewendet werden. Es wurde berichtet, dass Dosen des verwandten Beta2-Adrenozeptor-Agonisten Albuterol bei intravenöser Verabreichung einen vorbestehenden Diabetes mellitus und eine Ketoazidose verschlimmern.
Hypokaliämie und Hyperglykämie
Beta-adrenerge Agonisten-Medikamente können bei manchen Patienten eine signifikante Hypokaliämie hervorrufen, möglicherweise durch intrazellulären Shunt, der potenziell nachteilige kardiovaskuläre Wirkungen hervorrufen kann [siehe KLINISCHE PHARMAKOLOGIE ]. Die Abnahme des Serumkaliums ist normalerweise vorübergehend und erfordert keine Supplementierung. Klinisch signifikante Veränderungen des Blutzuckers und/oder des Serumkaliums wurden in klinischen Studien mit SYMBICORT in den empfohlenen Dosierungen selten beobachtet.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( PATIENTENINFORMATION und Gebrauchsanweisung ).
Schwerwiegende Ereignisse im Zusammenhang mit Asthma
Informieren Sie Patienten mit Asthma darüber, dass LABA bei alleiniger Anwendung das Risiko einer asthmabedingten Krankenhauseinweisung oder eines asthmabedingten Todes erhöht. Verfügbare Daten zeigen, dass bei gemeinsamer Anwendung von ICS und LABA, wie z. B. mit SYMBICORT, das Risiko für diese Ereignisse nicht signifikant erhöht wird.
Nicht für akute Symptome
Informieren Sie die Patienten darüber, dass SYMBICORT 160 mg nicht dazu bestimmt ist, akute Symptome von Asthma oder COPD zu lindern, und dass zu diesem Zweck keine zusätzlichen Dosen verwendet werden sollten. Raten Sie den Patienten, akute Symptome mit einem inhalativen, kurz wirksamen Beta2-Agonisten wie Albuterol zu behandeln. Versorgen Sie Patienten mit solchen Medikamenten und weisen Sie den Patienten in die Anwendung ein.
Weisen Sie die Patienten an, sofort einen Arzt aufzusuchen, wenn bei ihnen eines der folgenden Symptome auftritt:
Sagen Sie den Patienten, dass sie die Therapie mit SYMBICORT nicht ohne ärztliche/ärztliche Anleitung abbrechen sollten, da die Symptome nach dem Absetzen wieder auftreten können.
Verwenden Sie keine zusätzlichen langwirksamen Beta2-Agonisten
Weisen Sie die Patienten an, keine anderen LABA für Asthma und COPD zu verwenden.
Lokale Effekte
Informieren Sie die Patienten darüber, dass bei einigen Patienten lokalisierte Infektionen mit Candida albicans im Mund und Rachen aufgetreten sind. Wenn sich eine oropharyngeale Candidiasis entwickelt, sollte sie mit einer geeigneten lokalen oder systemischen (dh oralen) Antimykotikatherapie behandelt werden, während die Therapie mit SYMBICORT 4,5 µg fortgesetzt wird, aber manchmal muss die Therapie mit SYMBICORT unter engmaschiger ärztlicher Überwachung vorübergehend unterbrochen werden. Es wird empfohlen, den Mund nach der Inhalation mit Wasser zu spülen, ohne ihn herunterzuschlucken, um das Risiko einer Soorinfektion zu verringern.
Lungenentzündung
Patienten mit COPD haben ein höheres Lungenentzündungsrisiko; Weisen Sie sie an, sich an ihren Arzt zu wenden, wenn sie Symptome einer Lungenentzündung entwickeln.
Immunsuppression
Warnen Sie Patienten, die immunsuppressive Dosen von Kortikosteroiden erhalten, davor, sich Windpocken oder Masern auszusetzen und im Falle einer Exposition unverzüglich ihren Arzt aufzusuchen. Informieren Sie die Patienten über eine mögliche Verschlechterung bestehender Tuberkulose, Pilz-, Bakterien-, Virus- oder Parasiteninfektionen oder Herpes simplex am Auge.
Hyperkortizismus und Nebennierensuppression
Weisen Sie die Patienten darauf hin, dass SYMBICORT systemische kortikosteroide Wirkungen von Hyperkortizismus und Nebennierensuppression verursachen kann. Informieren Sie die Patienten außerdem darüber, dass Todesfälle aufgrund von Nebenniereninsuffizienz während und nach der Umstellung von systemischen Kortikosteroiden aufgetreten sind. Patienten sollten systemische Kortikosteroide langsam ausschleichen, wenn sie auf SYMBICORT umgestellt werden.
Verringerung der Knochenmineraldichte
Weisen Sie Patienten mit einem erhöhten Risiko für eine verringerte BMD darauf hin, dass die Anwendung von Kortikosteroiden ein zusätzliches Risiko darstellen kann.
Reduzierte Wachstumsgeschwindigkeit
Informieren Sie die Patienten darüber, dass oral inhalierte Kortikosteroide, ein Bestandteil von SYMBICORT, bei pädiatrischen Patienten eine Verringerung der Wachstumsgeschwindigkeit verursachen können. Ärzte sollten das Wachstum von Kindern und Jugendlichen, die Kortikosteroide auf beliebige Weise einnehmen, genau beobachten.
Okulare Wirkungen
Die Langzeitanwendung von inhalativen Kortikosteroiden kann das Risiko einiger Augenprobleme (Katarakt oder Glaukom) erhöhen; erwägen Sie regelmäßige Augenuntersuchungen.
Risiken im Zusammenhang mit der Beta-Agonisten-Therapie
Informieren Sie die Patienten über Nebenwirkungen im Zusammenhang mit Beta2-Agonisten, wie z. B. Herzklopfen, Brustschmerzen, schneller Herzschlag, Zittern oder Nervosität.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Budesonid
Zur Bewertung des kanzerogenen Potenzials von Budesonid wurden Langzeitstudien an Ratten und Mäusen mit oraler Verabreichung durchgeführt.
In einer 2-jährigen Studie an Sprague-Dawley-Ratten verursachte Budesonid bei männlichen Ratten bei einer oralen Dosis von 50 µg/kg (entspricht ungefähr der MRHDID bei Erwachsenen und Kindern unter einer µg/m²-Dosis) einen statistisch signifikanten Anstieg der Inzidenz von Gliomen Basis). Bei männlichen und weiblichen Ratten wurde bei oralen Dosen von bis zu 25 bzw. 50 µg/kg (ungefähr äquivalent zu der MRHDID bei Erwachsenen und Kindern auf µg/m²-Basis) keine Tumorigenität beobachtet. In zwei weiteren 2-Jahres-Studien an männlichen Fischer- und Sprague-Dawley-Ratten verursachte Budesonid bei einer oralen Dosis von 50 µg/kg (ungefähr äquivalent zu der MRHDID bei Erwachsenen und Kindern auf µg/m²-Basis) keine Gliome. Bei männlichen Sprague-Dawley-Ratten verursachte Budesonid jedoch bei einer oralen Dosis von 50 µg/kg (entspricht etwa der MRHDID bei Erwachsenen und Kindern auf µg/m²-Basis) einen statistisch signifikanten Anstieg der Inzidenz hepatozellulärer Tumore. Die gleichzeitigen Referenzkortikosteroide (Prednisolon und Triamcinolonacetonid) in diesen beiden Studien zeigten ähnliche Ergebnisse.
In einer 91-wöchigen Studie an Mäusen verursachte Budesonid bei oralen Dosen von bis zu 200 µg/kg (etwa das 2-fache der MRHDID bei Erwachsenen und Kindern auf µg/m²-Basis) keine behandlungsbedingte Karzinogenität.
Budesonid war in sechs verschiedenen Testsystemen nicht mutagen oder klastogen: Ames-Salmonella/Mikrosomenplattentest, Maus-Mikrokerntest, Maus-Lymphomtest, Chromosomenaberrationstest in menschlichen Lymphozyten, geschlechtsgebundener rezessiver Letaltest in Drosophila melanogaster und DNA-Reparaturanalyse in Ratten Hepatozytenkultur.
Fertilität und Reproduktionsleistung wurden bei Ratten bei subkutanen Dosen von bis zu 80 µg/kg (ungefähr gleich der MRHDID auf µg/m²-Basis) nicht beeinträchtigt. Bei subkutanen Dosen von 20 µg/kg und mehr (weniger als die MRHDID auf µg/m²-Basis) führte es jedoch zu einer Abnahme der pränatalen Lebensfähigkeit und der Lebensfähigkeit der Jungtiere bei der Geburt und während der Laktation, zusammen mit einer Abnahme der Körpergewichtszunahme des Muttertiers ). Bei 5 µg/kg (weniger als der MRHDID auf µg/m²-Basis) wurden keine derartigen Wirkungen festgestellt.
Formoterol
Zur Bewertung des kanzerogenen Potenzials von Formoterolfumarat wurden Langzeitstudien an Mäusen mit oraler Verabreichung und Ratten mit Inhalationsverabreichung durchgeführt.
In einer 24-monatigen Kanzerogenitätsstudie an CD-1-Mäusen verursachte Formoterol in oralen Dosen von 100 µg/kg und mehr (ungefähr das 30- bzw. 15-fache der MRHDID bei Erwachsenen und Kindern auf µg/m²-Basis) eine Dosis- damit verbundene Zunahme der Inzidenz von Uterus-Leiomyomen.
In einer 24-monatigen Karzinogenitätsstudie an Sprague-Dawley-Ratten wurde eine erhöhte Inzidenz von mesovarischen Leiomyomen und uterinen Leiomyosarkomen bei einer inhalierten Dosis von 130 µg/kg (ungefähr das 70- bzw mcg/m²-Basis). Bei 22 µg/kg (etwa das 12- bzw. 6-fache der MRHDID bei Erwachsenen und Kindern auf µg/m²-Basis) wurden keine Tumore beobachtet.
Andere Beta-Agonisten haben in ähnlicher Weise eine Zunahme von Leiomyomen des Genitaltrakts bei weiblichen Nagetieren gezeigt. Die Relevanz dieser Ergebnisse für die Anwendung beim Menschen ist nicht bekannt.
Formoterol war im Ames-Salmonella/Mikrosomen-Plattentest, im Maus-Lymphom-Test, im Chromosomenaberrationstest in menschlichen Lymphozyten und im Ratten-Mikrokerntest nicht mutagen oder klastogen.
Bei männlichen Ratten, die mit Formoterol in einer oralen Dosis von 15.000 µg/kg (etwa das 2200-fache der MRHDID auf AUC-Basis) behandelt wurden, wurde eine Verringerung der Fertilität und/oder Fortpflanzungsfähigkeit festgestellt. Bei 3000 mcg/kg (etwa das 1600-fache der MRHDID auf mcg/m²-Basis) wurde keine solche Wirkung beobachtet. In einer separaten Studie mit männlichen Ratten, die mit einer oralen Dosis von 15.000 mcg/kg (ungefähr das 8000-fache der MRHDID auf mcg/m²-Basis) behandelt wurden, gab es Befunde von testikulärer tubulärer Atrophie und Spermatrümmern in den Hoden und Oligospermie in den Nebenhoden. Bei weiblichen Ratten wurde bei Dosen bis zu 15.000 mcg/kg (etwa das 1100-fache der MRHDID auf AUC-Basis) keine Wirkung auf die Fertilität festgestellt.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Es liegen keine angemessenen und gut kontrollierten Studien zu SYMBICORT 160 mg oder einem seiner Einzelbestandteile, Formoterolfumarat, bei Schwangeren vor; für den anderen Bestandteil Budesonid liegen jedoch Studien vor. In Reproduktionsstudien an Tieren wirkte SYMBICORT 4,5 µg, verabreicht durch Inhalation, teratogen, embryozid und reduzierte das fötale Gewicht bei Ratten bei weniger als der maximal empfohlenen täglichen Inhalationsdosis beim Menschen (MRHDID) auf µg/m²-Basis. Budesonid allein, subkutan verabreicht, war teratogen, embryozid und reduzierte das fötale Gewicht bei Ratten und Kaninchen bei weniger als der MRHDID, aber diese Wirkungen wurden nicht bei Ratten beobachtet, die inhalierte Dosen bis zum 4-fachen der MRHDID erhielten. Studien an schwangeren Frauen haben nicht gezeigt, dass inhaliertes Budesonid allein das Risiko von Anomalien erhöht, wenn es während der Schwangerschaft verabreicht wird. Erfahrungen mit oralen Kortikosteroiden legen nahe, dass Nagetiere anfälliger für teratogene Wirkungen einer Kortikosteroid-Exposition sind als Menschen. Formoterolfumarat allein, oral verabreicht, war bei Ratten und Kaninchen beim 1600- bzw. 65.000-fachen der MRHDID teratogen. Formoterolfumarat war auch embryozid, erhöhte den Verlust der Jungtiere bei der Geburt und während der Laktation und verringerte das Gewicht der Jungtiere bei Ratten beim 110-fachen der MRHDID. Diese Nebenwirkungen traten im Allgemeinen bei großen Vielfachen der MRHDID auf, wenn Formoterolfumarat oral verabreicht wurde, um hohe systemische Expositionen zu erreichen. Bei Ratten, die Inhalationsdosen bis zum 375-fachen der MRHDID erhielten, wurden keine teratogenen, embryoziden oder entwicklungsschädigenden Wirkungen beobachtet.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten der angegebenen Populationen ist unbekannt. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 % bis 4 % bzw. 15 % bis 20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryonale/fetales Risiko
Bei Frauen mit schlecht oder mäßig kontrolliertem Asthma besteht ein erhöhtes Risiko für verschiedene perinatale Nebenwirkungen wie Präeklampsie bei der Mutter und Frühgeburtlichkeit, niedriges Geburtsgewicht und geringes Gestationsalter beim Neugeborenen. Schwangere Frauen mit Asthma sollten engmaschig überwacht und die Medikation nach Bedarf angepasst werden, um eine optimale Asthmakontrolle aufrechtzuerhalten.
Arbeit oder Lieferung
Es gibt keine gut kontrollierten Studien am Menschen, die die Auswirkungen von SYMBICORT 4,5 mcg während der Wehen und der Geburt untersucht haben. Wegen der möglichen Beeinträchtigung der Uteruskontraktilität durch Beta-Agonisten sollte die Anwendung von SYMBICORT 4,5 µg während der Wehen auf Patientinnen beschränkt werden, bei denen der Nutzen das Risiko eindeutig überwiegt.
Daten
Menschliche Daten
Studien an schwangeren Frauen haben nicht gezeigt, dass inhaliertes Budesonid das Risiko von Anomalien erhöht, wenn es während der Schwangerschaft verabreicht wird. Die Ergebnisse einer großen bevölkerungsbasierten prospektiven epidemiologischen Kohortenstudie, in der Daten aus drei schwedischen Registern überprüft wurden, die etwa 99 % der Schwangerschaften von 1995-1997 abdecken (dh schwedisches medizinisches Geburtsregister; Register für angeborene Fehlbildungen; Register für Kinderkardiologie), weisen auf kein erhöhtes Risiko hin bei angeborenen Fehlbildungen durch die Anwendung von inhalativem Budesonid während der Frühschwangerschaft. Angeborene Fehlbildungen wurden 2014 bei Säuglingen untersucht, die von Müttern geboren wurden, die über die Anwendung von inhalativem Budesonid gegen Asthma in der Frühschwangerschaft (normalerweise 10–12 Wochen nach der letzten Monatsblutung) berichteten, dem Zeitraum, in dem die meisten größeren Organfehlbildungen auftreten. Die Rate der registrierten angeborenen Fehlbildungen war im Vergleich zur allgemeinen Bevölkerungsrate ähnlich (3,8 % vs. 3,5 %). Darüber hinaus war die Zahl der Säuglinge, die mit orofazialen Spalten geboren wurden, nach Exposition gegenüber inhaliertem Budesonid ähnlich der erwarteten Zahl in der Normalbevölkerung (4 Kinder vs. 3,3).
Dieselben Daten wurden in einer zweiten Studie verwendet, die die Gesamtzahl auf 2534 Säuglinge brachte, deren Mütter inhaliertem Budesonid ausgesetzt waren. In dieser Studie unterschied sich die Rate angeborener Missbildungen bei Säuglingen, deren Mütter während der Frühschwangerschaft inhalativem Budesonid ausgesetzt waren, nicht von der Rate aller Neugeborenen im gleichen Zeitraum (3,6 %).
Tierdaten
SYMBIKORT
In einer Studie zur embryofetalen Entwicklung bei trächtigen Ratten, denen während der Organogenese vom 6. bis 16. Trächtigkeitstag verabreicht wurde, verursachte SYMBICORT 160 mg Nabelbrüche bei Föten bei Dosen unterhalb der MRHDID (auf mcg/m²-Basis bei maternal inhalierten Dosen von 12/ 0,66 mcg/kg/Tag und mehr). Das fötale Gewicht war um etwa das 5- bzw. 3-fache der MRHDID reduziert (auf AUC-Basis bei einer inhalierten Dosis der Mutter von 80/4,4 µg/kg (Budesonid/Formoterol)). Bei Dosen unterhalb der MRHDID (auf mcg/m²-Basis bei einer von der Mutter inhalierten Dosis von 2,5/0,14 mcg/kg/Tag) wurden keine teratogenen oder embryoziden Wirkungen festgestellt.
Budesonid
In einer Fertilitäts- und Reproduktionsstudie wurde männlichen Ratten 9 Wochen lang und weiblichen 2 Wochen lang vor der Paarung und während der Paarungszeit eine subkutane Dosis verabreicht. Weibchen wurden bis zum Absetzen ihrer Nachkommen dosiert. Budesonid verursachte bei Dosen unterhalb der MRHDID (auf mcg/m²-Basis bei subkutanen Dosen von 20 mcg/ kg/Tag und mehr). Bei einer Dosis unterhalb der MRHDID (auf Mikrogramm/m²-Basis bei einer mütterlichen subkutanen Dosis von 5 Mikrogramm/kg/Tag) wurden keine derartigen Wirkungen festgestellt.
In einer Studie zur embryofetalen Entwicklung bei trächtigen Kaninchen, denen während der Organogenese vom 6. bis 18. Trächtigkeitstag verabreicht wurde, führte Budesonid bei Dosen unterhalb der MRHDID (auf mcg/m²-Basis bei a mütterliche subkutane Dosis von 25 mcg/kg/Tag). In einer Studie zur embryofetalen Entwicklung an trächtigen Ratten, denen während der Organogenese vom 6. bis 15. Trächtigkeitstag eine Dosis verabreicht wurde, verursachte Budesonid ähnliche nachteilige fetale Wirkungen bei Dosen, die etwa dem 8-fachen der MRHDID (auf mcg/m²-Basis bei einer maternalen subkutanen Dosis von 500 µg/kg/Tag). In einer anderen Studie zur embryofetalen Entwicklung bei trächtigen Ratten wurden keine teratogenen oder embryoziden Wirkungen bei Dosen bis zum 4-Fachen der MRHDID (auf einer mcg/m²-Basis bei maternalen Inhalationsdosen von bis zu 250 mcg/kg/Tag) beobachtet.
In einer peri- und postnatalen Entwicklungsstudie mit Ratten, denen vom 15. Tag der Trächtigkeit bis zum 21. Tag nach der Geburt eine Dosis verabreicht wurde, hatte Budesonid keine Auswirkungen auf die Geburt, hatte jedoch eine Auswirkung auf das Wachstum und die Entwicklung der Nachkommen. Bei Dosen unterhalb der MRHDID und höher (auf mcg/m²-Basis bei mütterlichen subkutanen Dosen von 20 mcg/kg/Tag und höher) war die Überlebensrate der Nachkommen verringert und das mittlere Körpergewicht der überlebenden Nachkommen war bei der Geburt und während der Laktation verringert. Diese Befunde traten in Gegenwart maternaler Toxizität auf.
Formoterol
In einer Fertilitäts- und Reproduktionsstudie erhielten männliche Ratten 9 Wochen lang und weibliche 2 Wochen lang vor der Paarung und während der Paarungszeit eine orale Dosis. Weibchen wurden entweder bis zum 19. Trächtigkeitstag oder bis zum Absetzen ihrer Nachkommen dosiert. Männchen wurden bis zu 25 Wochen dosiert. Nabelbrüche wurden bei Rattenföten bei oralen Dosen beobachtet, die das 1600-fache und mehr der MRHDID (auf mcg/m²-Basis bei maternalen oralen Dosen von 3000 mcg/kg/Tag und höher) betrugen. Brachygnathie wurde bei Rattenföten bei einer Dosis beobachtet, die das 8000-fache der MRHDID betrug (auf mcg/m²-Basis bei einer maternalen oralen Dosis von 15.000 mcg/kg/Tag). Die Schwangerschaft wurde bei einer Dosis verlängert, die das 8000-fache der MRHDID betrug (auf Mikrogramm/m²-Basis bei einer mütterlichen oralen Dosis von 15.000 Mikrogramm/kg/Tag). Todesfälle bei Föten und Jungtieren traten während der Trächtigkeit bei Dosen auf, die etwa dem 1600-Fachen der MRHDID und höher (auf einer mcg/m²-Basis bei oralen Dosen von 3000 mcg/kg/Tag und höher) entsprachen.
In einer Studie zur embryofetalen Entwicklung bei trächtigen Ratten, denen während der Organogenese vom 6. bis 15. Trächtigkeitstag eine Dosis verabreicht wurde, wurden bei Dosen bis zum 375-Fachen der MRHDID (auf mcg/m²-Basis bei Inhalation durch die Mutter) keine teratogenen, embryoziden oder entwicklungsschädigenden Wirkungen beobachtet Dosen bis zu 690 mcg/kg/Tag).
In einer Studie zur embryofetalen Entwicklung bei trächtigen Kaninchen, denen während der Organogenese vom 6. bis 18. Trächtigkeitstag eine Dosis verabreicht wurde, wurden subkapsuläre Zysten auf der Leber bei den Föten bei einer Dosis beobachtet, die dem 65.000-fachen der MRHDID (auf mcg/m²-Basis bei einer mütterlichen Dosis) entsprach orale Dosis von 60.000 mcg/kg/Tag). Bei Dosen bis zum 3800-fachen der MRHDID (auf mcg/m²-Basis bei maternalen oralen Dosen von bis zu 3500 mcg/kg/Tag) wurden keine teratogenen Wirkungen beobachtet.
In einer prä- und postnatalen Entwicklungsstudie erhielten trächtige weibliche Ratten Formoterol in oralen Dosen von 0, 210, 840 und 3400 mcg/kg/Tag vom 6. Trächtigkeitstag bis zur Laktation. Die Überlebensrate der Jungtiere war von der Geburt bis zum 26. Tag nach der Geburt bei Dosen, die das 110-fache der MRHDID und höher betrugen (auf mcg/m²-Basis bei maternalen oralen Dosen von 210 mcg/kg/Tag und höher), obwohl es keine Hinweise auf eine Dosis-Wirkungs-Beziehung gab Beziehung. Es gab keine behandlungsbedingten Auswirkungen auf die körperliche, funktionelle und Verhaltensentwicklung von Rattenwelpen.
Stillzeit
Zusammenfassung der Risiken
Es liegen keine Daten zu den Wirkungen von SYMBICORT 4,5 µg, Budesonid oder Formoterolfumarat auf das gestillte Kind oder auf die Milchproduktion vor. Budesonid ist wie andere inhalative Kortikosteroide in der Muttermilch vorhanden [siehe Daten ]. Es liegen keine Daten zum Vorhandensein von Formoterolfumarat in der Muttermilch vor. Formoterolfumarat ist in Rattenmilch vorhanden [vgl Daten ]. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an SYMBICORT 4,5 µg und möglichen Nebenwirkungen von SYMBICORT 160 mg auf den gestillten Säugling oder aufgrund des zugrunde liegenden Zustands der Mutter berücksichtigt werden.
Daten
Humandaten mit Budesonid, das über einen Trockenpulverinhalator verabreicht wird, weisen darauf hin, dass die gesamte tägliche orale Dosis von Budesonid, die dem Säugling in der Muttermilch zur Verfügung steht, etwa 0,3 % bis 1 % der von der Mutter inhalierten Dosis beträgt [siehe KLINISCHE PHARMAKOLOGIE ]. Für SYMBICORT 4,5 µg ist die Budesonid-Dosis, die dem Säugling in der Muttermilch als Prozentsatz der mütterlichen Dosis zur Verfügung steht, erwartungsgemäß ähnlich.
In der Fertilitäts- und Reproduktionsstudie an Ratten wurden die Plasmaspiegel von Formoterol bei Jungtieren am 15. Tag nach der Geburt gemessen [vgl Verwendung in bestimmten Bevölkerungsgruppen ]. Es wurde geschätzt, dass die maximale Plasmakonzentration, die die Jungtiere vom mütterlichen Tier bei der höchsten Dosis von 15 mg/kg nach dem Stillen erhielten, 4,4 % betrug (0,24 nmol/l für einen Wurf gegenüber 5,5 nmol/l für die Mutter). .
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von SYMBICORT bei Asthmapatienten ab 12 Jahren wurde in Studien mit einer Dauer von bis zu 12 Monaten nachgewiesen. In den beiden 12-wöchigen, doppelblinden, placebokontrollierten Zulassungsstudien in den USA wurden 25 Patienten im Alter von 12 bis 17 Jahren zweimal täglich mit SYMBICORT behandelt [siehe Klinische Studien ]. Die Wirksamkeitsergebnisse in dieser Altersgruppe waren ähnlich denen, die bei Patienten ab 18 Jahren beobachtet wurden. Es gab keine offensichtlichen Unterschiede in der Art oder Häufigkeit der berichteten Nebenwirkungen in dieser Altersgruppe im Vergleich zu Patienten ab 18 Jahren.
Die Sicherheit und Wirksamkeit von SYMBICORT 80/4,5 bei Asthmapatienten im Alter von 6 bis unter 12 Jahren wurde in Studien mit einer Dauer von bis zu 12 Wochen nachgewiesen [siehe Klinische Studien ]. Das Sicherheitsprofil bei diesen Patienten entsprach dem bei Patienten ab 12 Jahren, die ebenfalls SYMBICORT erhielten [siehe NEBENWIRKUNGEN ].
Die Sicherheit und Wirksamkeit von SYMBICORT 160 mg bei Asthmapatienten unter 6 Jahren ist nicht erwiesen.
Kontrollierte klinische Studien haben gezeigt, dass oral inhalative Kortikosteroide, einschließlich Budesonid, ein Bestandteil von SYMBICORT, eine Verringerung der Wachstumsgeschwindigkeit bei pädiatrischen Patienten verursachen können. Dieser Effekt wurde in Abwesenheit von Labornachweisen für eine Unterdrückung der HPA-Achse beobachtet, was darauf hindeutet, dass die Wachstumsgeschwindigkeit ein empfindlicherer Indikator für die systemische Kortikosteroid-Exposition bei pädiatrischen Patienten ist als einige häufig verwendete Tests der HPA-Achsenfunktion. Die Langzeitwirkung dieser Verringerung der Wachstumsgeschwindigkeit im Zusammenhang mit oral inhalierten Kortikosteroiden, einschließlich der Auswirkungen auf die endgültige Körpergröße, ist nicht bekannt. Das Potenzial für ein „aufholendes“ Wachstum nach Absetzen der Behandlung mit oral inhalativen Kortikosteroiden wurde nicht ausreichend untersucht.
In einer Studie mit asthmatischen Kindern im Alter von 5 bis 12 Jahren hatten diejenigen, die zweimal täglich 200 mcg Budesonid DPI (n = 311) erhielten, am Ende eines Jahres eine 1,1-cm-Wachstumsminderung im Vergleich zu denen, die Placebo erhielten (n = 418). ; der Unterschied zwischen diesen beiden Behandlungsgruppen nahm über drei Jahre zusätzlicher Behandlung nicht weiter zu. Am Ende von 4 Jahren hatten Kinder, die mit Budesonid DPI behandelt wurden, und Kinder, die mit Placebo behandelt wurden, ähnliche Wachstumsgeschwindigkeiten. Die aus dieser Studie gezogenen Schlussfolgerungen können durch die ungleiche Verwendung von Kortikosteroiden in den Behandlungsgruppen und die Einbeziehung von Daten von Patienten, die im Verlauf der Studie die Pubertät erreichten, verfälscht werden.
Das Wachstum von pädiatrischen Patienten, die oral inhalative Kortikosteroide, einschließlich SYMBICORT, erhalten, sollte überwacht werden. Wenn bei einem Kind oder Jugendlichen, das Kortikosteroide einnimmt, eine Wachstumshemmung auftritt, sollte die Möglichkeit in Betracht gezogen werden, dass er/sie besonders empfindlich auf diese Wirkung reagiert. Die potenziellen Wachstumseffekte einer längeren Behandlung sollten gegen den erzielten klinischen Nutzen abgewogen werden. Um die systemischen Wirkungen von oral inhalativen Kortikosteroiden, einschließlich SYMBICORT, zu minimieren, sollte jeder Patient auf die niedrigste Stärke titriert werden, die sein Asthma wirksam kontrolliert [siehe DOSIERUNG UND ANWENDUNG ].
Geriatrische Verwendung
Von der Gesamtzahl der Asthmapatienten, die in zwei 12-wöchigen Studien und einer 26-wöchigen Postmarketing-Studie zweimal täglich mit SYMBICORT 160 mg behandelt wurden, waren 791 65 Jahre oder älter, davon 141 75 Jahre oder älter.
In den COPD-Studien mit einer Dauer von 6 bis 12 Monaten waren 810 Patienten, die mit SYMBICORT 160/4,5 behandelt wurden, zwei Inhalationen zweimal täglich, 65 Jahre und älter, und davon waren 177 Patienten 75 Jahre und älter. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Patienten und jüngeren Patienten beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt.
Wie bei anderen Produkten, die Beta2-Agonisten enthalten, ist bei der Anwendung von SYMBICORT bei geriatrischen Patienten mit gleichzeitiger kardiovaskulärer Erkrankung, die durch Beta2-Agonisten beeinträchtigt werden könnte, besondere Vorsicht geboten.
Basierend auf den verfügbaren Daten für SYMBICORT oder seine Wirkstoffe ist keine Anpassung der Dosierung von SYMBICORT 4,5 µg bei geriatrischen Patienten gerechtfertigt.
Leberfunktionsstörung
Formale pharmakokinetische Studien mit SYMBICORT wurden bei Patienten mit eingeschränkter Leberfunktion nicht durchgeführt. Da jedoch sowohl Budesonid als auch Formoterolfumarat überwiegend durch Leberstoffwechsel ausgeschieden werden, kann eine Beeinträchtigung der Leberfunktion zu einer Akkumulation von Budesonid und Formoterolfumarat im Plasma führen. Daher sollten Patienten mit Lebererkrankungen engmaschig überwacht werden.
Nierenfunktionsstörung
Formale pharmakokinetische Studien mit SYMBICORT wurden bei Patienten mit eingeschränkter Nierenfunktion nicht durchgeführt.
ÜBERDOSIS
SYMBIKORT
SYMBICORT enthält sowohl Budesonid als auch Formoterol; daher gelten für SYMBICORT die nachfolgend beschriebenen Risiken einer Überdosierung der einzelnen Bestandteile. In pharmakokinetischen Studien wurden Patienten mit COPD Einzeldosen von 960/54 Mikrogramm (12 Sprühstöße SYMBICORT 80/4,5) und 1280/36 Mikrogramm (8 Sprühstöße 160/4,5) verabreicht. Insgesamt 1920/54 Mikrogramm (12 Sprühstöße von SYMBICORT 160/4,5) wurden als Einzeldosis sowohl gesunden Probanden als auch Patienten mit Asthma verabreicht. In einer aktiv kontrollierten Langzeitstudie zur Sicherheit bei jugendlichen und erwachsenen Asthmapatienten ab 12 Jahren wurde SYMBICORT 160/4.5 bis zu 12 Monate lang in Dosen bis zum Doppelten der höchsten empfohlenen Tagesdosis verabreicht. In keiner dieser Studien wurden klinisch signifikante Nebenwirkungen beobachtet.
Budesonid
Das Potenzial für akute toxische Wirkungen nach einer Überdosierung von Budesonid ist gering. Bei Anwendung überhöhter Dosen über einen längeren Zeitraum können systemische Kortikosteroidwirkungen wie Hyperkortizismus auftreten [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Budesonid, das fünfmal so hoch wie die empfohlene Höchstdosis (3200 mcg täglich) über 6 Wochen an Menschen verabreicht wurde, verursachte eine signifikante Verringerung (27 %) der Cortisolreaktion im Plasma auf eine 6-stündige ACTH-Infusion im Vergleich zu Placebo (+1 %). Die entsprechende Wirkung von 10 mg Prednison täglich war eine 35 %ige Reduktion der Plasma-Cortisol-Reaktion auf ACTH.
Formoterol
Eine Überdosierung von Formoterol würde wahrscheinlich zu einer Verstärkung der für Beta2-Agonisten typischen Wirkungen führen: Krampfanfälle, Angina pectoris, Bluthochdruck, Hypotonie, Tachykardie, atriale und ventrikuläre Tachyarrhythmien, Nervosität, Kopfschmerzen, Zittern, Herzklopfen, Muskelkrämpfe, Übelkeit, Schwindel, Schlafstörungen , metabolische Azidose, Hyperglykämie, Hypokaliämie. Wie bei allen sympathomimetischen Medikamenten kann der Missbrauch von Formoterol zu Herzstillstand und sogar zum Tod führen. Es wurden keine klinisch signifikanten Nebenwirkungen beobachtet, wenn Formoterol erwachsenen Patienten mit akuter Bronchokonstriktion in einer Dosis von 90 Mikrogramm/Tag über 3 Stunden oder stabilen Asthmatikern dreimal täglich in einer Gesamtdosis von 54 Mikrogramm/Tag über 3 Tage verabreicht wurde.
Die Behandlung einer Formoterol-Überdosierung besteht aus dem Absetzen des Medikaments zusammen mit der Einleitung einer geeigneten symptomatischen und/oder unterstützenden Therapie. Die vernünftige Anwendung eines kardioselektiven Betarezeptorenblockers kann in Betracht gezogen werden, wobei zu berücksichtigen ist, dass solche Medikamente Bronchospasmen hervorrufen können. Es gibt keine ausreichenden Beweise, um festzustellen, ob eine Dialyse bei einer Überdosierung von Formoterol vorteilhaft ist. Im Falle einer Überdosierung wird eine Herzüberwachung empfohlen.
KONTRAINDIKATIONEN
Die Anwendung von SYMBICORT ist unter folgenden Bedingungen kontraindiziert:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
SYMBIKORT
SYMBICORT enthält sowohl Budesonid als auch Formoterol; daher gelten für SYMBICORT die nachfolgend für die einzelnen Komponenten beschriebenen Wirkmechanismen. Diese Medikamente stellen zwei Klassen von Medikamenten dar (ein synthetisches Kortikosteroid und ein langwirksamer selektiver Beta2-Adrenozeptor-Agonist), die unterschiedliche Wirkungen auf die klinischen, physiologischen und entzündlichen Indizes von COPD und Asthma haben.
Budesonid
Budesonid ist ein entzündungshemmendes Corticosteroid, das eine starke Glucocorticoid-Aktivität und eine schwache Mineralocorticoid-Aktivität aufweist. In standardmäßigen In-vitro- und Tiermodellen hat Budesonid eine etwa 200-fach höhere Affinität zum Glukokortikoidrezeptor und eine 1000-fach höhere topische entzündungshemmende Wirkung als Cortisol (Ratten-Crotonöl-Ohrödem-Assay). Als Maß für die systemische Aktivität ist Budesonid 40-mal wirksamer als Cortisol, wenn es subkutan verabreicht wird, und 25-mal wirksamer, wenn es oral verabreicht wird, im Ratten-Thymus-Involutions-Assay.
In Glucocorticoid-Rezeptor-Affinitätsstudien war die 22R-Form von Budesonid zweimal so aktiv wie das 22S-Epimer. In-vitro-Studien zeigten, dass sich die beiden Formen von Budesonid nicht ineinander umwandeln.
Entzündung ist eine wichtige Komponente in der Pathogenese von COPD und Asthma. Kortikosteroide haben ein breites Spektrum an inhibitorischen Aktivitäten gegen mehrere Zelltypen (z. B. Mastzellen, Eosinophile, Neutrophile, Makrophagen und Lymphozyten) und Mediatoren (z. B. Histamin, Eicosanoide, Leukotriene und Zytokine), die an allergischen und nicht-allergischen Reaktionen beteiligt sind Entzündung. Diese entzündungshemmenden Wirkungen von Kortikosteroiden können zu ihrer Wirksamkeit bei COPD und Asthma beitragen.
Studien an Asthmapatienten haben ein günstiges Verhältnis zwischen topischer entzündungshemmender Aktivität und systemischer Kortikosteroidwirkung über einen weiten Dosisbereich von Budesonid gezeigt. Dies wird durch eine Kombination aus einer relativ hohen lokalen entzündungshemmenden Wirkung, einem ausgedehnten hepatischen First-Pass-Abbau des oral absorbierten Arzneimittels (85 %–95 %) und der geringen Potenz der gebildeten Metaboliten erklärt.
Formoterol
Formoterolfumarat ist ein langwirksamer selektiver beta2-adrenerger Agonist (beta2-Agonist) mit schnellem Wirkungseintritt. Inhaliertes Formoterolfumarat wirkt lokal in der Lunge als Bronchodilatator. In-vitro-Studien haben gezeigt, dass Formoterol eine mehr als 200-mal stärkere agonistische Aktivität an Beta2-Rezeptoren als an Beta1-Rezeptoren hat. Die In-vitro-Bindungsselektivität für Beta2- gegenüber Beta1-Adrenozeptoren ist für Formoterol höher als für Albuterol (5-mal), während Salmeterol ein höheres (3-mal) Beta2-Selektivitätsverhältnis als Formoterol aufweist.
Obwohl Beta2-Rezeptoren die vorherrschenden adrenergen Rezeptoren in der glatten Muskulatur der Bronchien und Beta1-Rezeptoren die vorherrschenden Rezeptoren im Herzen sind, gibt es auch Beta2-Rezeptoren im menschlichen Herzen, die 10 % bis 50 % der gesamten Beta-adrenergen Rezeptoren ausmachen. Die genaue Funktion dieser Rezeptoren ist nicht bekannt, aber sie lassen die Möglichkeit vermuten, dass sogar hochselektive Beta2-Agonisten kardiale Wirkungen haben können.
Die pharmakologischen Wirkungen von Beta2-Adrenozeptor-Agonisten, einschließlich Formoterol, sind zumindest teilweise auf die Stimulierung der intrazellulären Adenylcyclase zurückzuführen, dem Enzym, das die Umwandlung von Adenosintriphosphat (ATP) in zyklisches 3',5'-Adenosinmonophosphat katalysiert ( zyklisches AMP). Erhöhte zyklische AMP-Spiegel bewirken eine Entspannung der glatten Bronchialmuskulatur und eine Hemmung der Freisetzung von Mediatoren der unmittelbaren Überempfindlichkeit aus Zellen, insbesondere aus Mastzellen.
In-vitro-Tests zeigen, dass Formoterol die Freisetzung von Mastzellmediatoren wie Histamin und Leukotrienen aus der menschlichen Lunge hemmt. Formoterol hemmt auch die Histamin-induzierte Plasmaalbumin-Extravasation bei anästhesierten Meerschweinchen und hemmt den Allergen-induzierten Einstrom von Eosinophilen bei Hunden mit Hyperreaktivität der Atemwege. Die Relevanz dieser In-vitro- und Tierbefunde für den Menschen ist nicht bekannt.
Pharmakodynamik
Asthma
Kardiovaskuläre Wirkungen
In einer Einzeldosis-Crossover-Studie mit 201 Patienten mit persistierendem Asthma wurden Einzeldosisbehandlungen mit 4,5, 9 und 18 Mikrogramm Formoterol in Kombination mit 320 Mikrogramm Budesonid, verabreicht über SYMBICORT, mit Budesonid 320 Mikrogramm allein verglichen. Im Vergleich zu Budesonid wurden dosisabhängige Verbesserungen des FEV1 nachgewiesen. EKGs und Blutproben für Glukose und Kalium wurden nach der Dosis erhalten. Bei SYMBICORT 4,5 µg wurden bei steigenden Formoterol-Dosen im Vergleich zu Budesonid geringfügige mittlere Anstiege der Serumglukose und Abnahmen des Serumkaliums (+0,44 mmol/l bzw. -0,18 mmol/l bei der höchsten Dosis) beobachtet. In EKGs führte SYMBICORT im Vergleich zu Budesonid allein zu einer geringen dosisabhängigen mittleren Erhöhung der Herzfrequenz (ungefähr 3 bpm bei der höchsten Dosis) und der QTc-Intervalle (3-6 ms). Kein Proband hatte einen QT- oder QTc-Wert ≥500 ms.
In den Vereinigten Staaten wurden in fünf 12-wöchigen aktiv- und placebokontrollierten Studien und einer 6-monatigen aktiv-kontrollierten Studie 2976 Patienten mit Asthma im Alter von 6 Jahren und älter untersucht. Die systemischen pharmakodynamischen Wirkungen von Formoterol (Herz-/Pulsfrequenz, Blutdruck, QTc-Intervall, Kalium und Glukose) waren bei mit SYMBICORT behandelten Patienten ähnlich, verglichen mit Patienten, die mit Formoterol-Trockeninhalationspulver 4,5 µg, 2 Inhalationen zweimal täglich, behandelt wurden. Kein Patient hatte während der Behandlung einen QT- oder QTc-Wert von ≥ 500 ms.
In drei placebokontrollierten Studien mit Jugendlichen und Erwachsenen mit Asthma ab 12 Jahren wurde bei insgesamt 1232 Patienten (553 Patienten in der SYMBICORT 160 mg-Gruppe) eine auswertbare kontinuierliche 24-Stunden-EKG-Überwachung durchgeführt. Insgesamt gab es in der Gruppe mit SYMBICORT 160 mg im Vergleich zu Placebo keine wesentlichen Unterschiede beim Auftreten von ventrikulärer oder supraventrikulärer Ektopie und keinen Hinweis auf ein erhöhtes Risiko für klinisch signifikante Rhythmusstörungen.
HPA-Achsen-Effekte
Insgesamt wurden bei mit SYMBICORT behandelten erwachsenen oder jugendlichen Patienten in Dosen von bis zu 640/18 µg/Tag im Vergleich zu Budesonid keine klinisch bedeutsamen Wirkungen auf die HPA-Achse, gemessen anhand von 24-Stunden-Cortisol im Urin, beobachtet.
Chronisch obstruktive Lungenerkrankung
Kardiovaskuläre Wirkungen
In zwei COPD-Lungenfunktionsstudien mit einer Dauer von 6 Monaten und 12 Monaten mit 3668 COPD-Patienten wurden keine klinisch bedeutsamen Unterschiede bei Pulsfrequenz, Blutdruck, Kalium und Glukose zwischen SYMBICORT, den einzelnen Bestandteilen von SYMBICORT 160 mg und Placebo festgestellt [siehe Klinische Studien ].
EKGs, die bei mehreren Klinikbesuchen während der Behandlung in beiden Studien aufgezeichnet wurden, zeigten keine klinisch bedeutsamen Unterschiede hinsichtlich Herzfrequenz, PR-Intervall, QRS-Dauer, Herzfrequenz, Anzeichen einer kardialen Ischämie oder Arrhythmien zwischen SYMBICORT 160/4,5 als Monopräparat und Placebo, die alle als 2 Inhalationen verabreicht wurden zweimal täglich. Basierend auf den EKGs trat bei 6 Patienten, die mit SYMBICORT 160/4,5 behandelt wurden, 6 Patienten, die mit Formoterol 4,5 µg behandelt wurden, und 6 Patienten in der Placebogruppe ein Vorhofflimmern oder -flattern auf, das zu Studienbeginn nicht vorhanden war. Es gab keine Fälle von nicht anhaltender ventrikulärer Tachykardie in den Gruppen mit SYMBICORT 160/4,5, Formoterol 4,5 µg oder Placebo.
In der 12-monatigen Studie wurde bei 520 Patienten eine auswertbare kontinuierliche 24-Stunden-EKG-Überwachung (Holter) vor der ersten Dosis und nach ungefähr 1 und 4 Behandlungsmonaten durchgeführt. Es wurden keine klinisch bedeutsamen Unterschiede bei ventrikulären oder supraventrikulären Arrhythmien, ventrikulären oder supraventrikulären ektopischen Schlägen oder der Herzfrequenz zwischen den Gruppen beobachtet, die mit SYMBICORT 160/4,5, Formoterol oder Placebo, eingenommen als 2 Inhalationen zweimal täglich, behandelt wurden. Basierend auf der EKG (Holter)-Überwachung kam es bei einem Patienten unter SYMBICORT 160/4,5, bei keinem Patienten unter Formoterol 4,5 mcg und bei drei Patienten in der Placebogruppe zu Vorhofflimmern oder -flattern, das zu Studienbeginn nicht vorhanden war.
HPA-Achsen-Effekte
Bei einer gepoolten Untergruppe (n = 616) von Patienten aus zwei COPD-Lungenfunktionsstudien wurden 24-Stunden-Urinkortisolmessungen durchgeführt. Die Daten zeigten ungefähr 30 % niedrigere mittlere 24-Stunden-Werte von freiem Cortisol im Urin nach chronischer Verabreichung (> 6 Monate) von SYMBICORT im Vergleich zu Placebo. SYMBICORT 4,5 µg zeigte eine vergleichbare Cortisolsuppression wie Budesonid 160 µg allein oder die gleichzeitige Gabe von Budesonid 160 µg und Formoterol 4,5 µg. Bei Patienten, die bis zu 12 Monate lang mit SYMBICORT 160 mg oder Placebo behandelt wurden, war der Prozentsatz der Patienten, die bei dieser Messung von normal auf niedrig wechselten, im Allgemeinen vergleichbar.
Andere Budesonid-Produkte
Um zu bestätigen, dass die systemische Absorption kein signifikanter Faktor für die klinische Wirksamkeit von inhaliertem Budesonid ist, wurde eine klinische Studie an Patienten mit Asthma durchgeführt, in der 400 µg Budesonid, das über einen unter Druck stehenden Dosieraerosol mit einem Abstandshalter verabreicht wurde, mit 1400 µg oralem Budesonid und Placebo verglichen wurden . Die Studie zeigte trotz vergleichbarer systemischer Spiegel die Wirksamkeit von inhaliertem Budesonid, nicht aber von oral eingenommenem Budesonid. Somit wird die therapeutische Wirkung herkömmlicher Dosen von oral inhaliertem Budesonid weitgehend durch seine direkte Wirkung auf die Atemwege erklärt.
Es wurde gezeigt, dass inhaliertes Budesonid die Reaktivität der Atemwege gegenüber verschiedenen Provokationsmodellen, einschließlich Histamin, Methacholin, Natriummetabisulfit und Adenosinmonophosphat, bei Patienten mit hyperreaktiven Atemwegen verringert. Die klinische Relevanz dieser Modelle ist nicht sicher.
Die Vorbehandlung mit inhaliertem Budesonid, 1600 µg täglich (800 µg zweimal täglich) über 2 Wochen reduzierte die akute (Frühphasenreaktion) und verzögerte (Spätphasenreaktion) Abnahme des FEV1 nach inhalativer Allergenprovokation.
Die systemischen Wirkungen von inhalativen Kortikosteroiden hängen mit der systemischen Exposition gegenüber solchen Arzneimitteln zusammen. Pharmakokinetische Studien haben gezeigt, dass sowohl bei Erwachsenen als auch bei Kindern mit Asthma die systemische Exposition gegenüber Budesonid bei SYMBICORT 160 mg niedriger ist als bei inhaliertem Budesonid, das in der gleichen verabreichten Dosis über einen Trockenpulverinhalator verabreicht wird [siehe KLINISCHE PHARMAKOLOGIE ]. Daher ist zu erwarten, dass die systemischen Wirkungen (HPA-Achse und Wachstum) von Budesonid, das von SYMBICORT abgegeben wird, nicht größer sind als die, die für inhalatives Budesonid berichtet werden, wenn es in vergleichbaren Dosen über den Trockenpulverinhalator verabreicht wird [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
HPA-Achsen-Effekte
Die Wirkung von inhaliertem Budesonid, das über einen Trockenpulverinhalator verabreicht wurde, auf die HPA-Achse wurde bei 905 Erwachsenen und 404 pädiatrischen Patienten mit Asthma untersucht. Bei den meisten Patienten blieb die Fähigkeit, die Cortisolproduktion als Reaktion auf Stress zu erhöhen, wie durch den Cosyntropin (ACTH)-Stimulationstest festgestellt, bei der Behandlung mit Budesonid in den empfohlenen Dosen erhalten. Bei erwachsenen Patienten, die mit 100, 200, 400 oder 800 µg zweimal täglich über 12 Wochen behandelt wurden, zeigten 4 %, 2 %, 6 % bzw. 13 % eine anormale stimulierte Cortisol-Reaktion (Spitzen-Cortisol
Andere Formoterol-Produkte
Während die pharmakodynamische Wirkung über die Stimulation von beta-adrenergen Rezeptoren erfolgt, führt eine übermäßige Aktivierung dieser Rezeptoren häufig zu Skelettmuskelzittern und -krämpfen, Schlaflosigkeit, Tachykardie, Abnahme des Plasmakaliums und Anstieg der Plasmaglukose. Inhaliertes Formoterol kann wie andere beta2-adrenerge Agonisten dosisabhängige kardiovaskuläre Wirkungen und Auswirkungen auf den Blutzucker und/oder das Serumkalium haben [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Für SYMBICORT 160 mg werden diese Wirkungen im Abschnitt Klinische Pharmakologie, Pharmakodynamik, SYMBICORT (12.2) detailliert beschrieben.
Die Anwendung von LABA-Medikamenten kann zu einer Toleranz gegenüber bronchoprotektiven und bronchodilatatorischen Wirkungen führen.
Ein Rebound der bronchialen Hyperreagibilität nach Absetzen einer chronisch langwirksamen Beta-Agonisten-Therapie wurde nicht beobachtet.
Pharmakokinetik
SYMBIKORT
Absorption
Budesonid
Gesunde Probanden
Oral inhaliertes Budesonid wird schnell in die Lunge resorbiert und die Spitzenkonzentration wird typischerweise innerhalb von 20 Minuten erreicht. Nach oraler Gabe von Budesonid wurde die maximale Plasmakonzentration nach etwa 1 bis 2 Stunden erreicht, und die absolute systemische Verfügbarkeit betrug aufgrund des ausgedehnten First-Pass-Metabolismus 6 % bis 13 %. Im Gegensatz dazu wurde das meiste an die Lungen abgegebene Budesonid systemisch absorbiert. Bei gesunden Probanden wurden 34 % der abgemessenen Dosis in der Lunge abgelagert (bestimmt durch Plasmakonzentrationsmethode und unter Verwendung eines Budesonid-haltigen Trockenpulverinhalators) mit einer absoluten systemischen Verfügbarkeit von 39 % der abgemessenen Dosis.
Nach Verabreichung von SYMBICORT 160/4.5, zwei oder vier Inhalationen zweimal täglich über 5 Tage bei gesunden Probanden, stieg die Plasmakonzentration von Budesonid im Allgemeinen proportional zur Dosis an. Der Akkumulationsindex für die Gruppe, die zweimal täglich 2 Inhalationen erhielt, betrug 1,32 für Budesonid.
Asthmapatienten
In einer Einzeldosisstudie wurden Patienten mit mittelschwerem Asthma höhere als die empfohlenen Dosen von SYMBICORT (12 Inhalationen von SYMBICORT 160/4,5) verabreicht. Die maximale Budesonid-Plasmakonzentration von 4,5 nmol/l trat 20 Minuten nach der Einnahme auf. Diese Studie zeigte, dass die systemische Gesamtexposition von Budesonid durch SYMBICORT 4,5 mcg etwa 30 % niedriger war als durch inhaliertes Budesonid über einen Trockenpulverinhalator (DPI) bei derselben verabreichten Dosis. Nach Verabreichung von SYMBICORT betrug die Halbwertszeit der Budesonid-Komponente 4,7 Stunden.
In einer Studie mit wiederholter Gabe wurde die höchste empfohlene Dosis von SYMBICORT (160/4,5, zwei Inhalationen zweimal täglich) Patienten mit mittelschwerem Asthma und gesunden Probanden 1 Woche lang verabreicht. Die maximale Budesonid-Plasmakonzentration von 1,2 nmol/l trat bei Asthmapatienten nach 21 Minuten auf. Die maximale Budesonid-Plasmakonzentration war bei Asthmapatienten um 27 % niedriger als bei gesunden Probanden. Die systemische Gesamtexposition von Budesonid war jedoch mit der bei Asthmapatienten vergleichbar.
Die maximalen Steady-State-Plasmakonzentrationen von Budesonid, das mit DPI verabreicht wurde, lagen bei Erwachsenen mit Asthma im Durchschnitt bei 0,6 bzw. 1,6 nmol/l bei Dosierungen von 180 µg bzw. 360 µg zweimal täglich. Bei Asthmapatienten zeigte Budesonid einen linearen Anstieg der AUC und Cmax mit zunehmender Dosis, sowohl nach einmaliger als auch nach wiederholter Gabe von inhaliertem Budesonid.
COPD-Patienten
In einer Einzeldosisstudie wurden Patienten mit COPD 12 Inhalationen von SYMBICORT 80/4,5 (Gesamtdosis 960/54 Mikrogramm) verabreicht. Eine mittlere Budesonid-Spitzenplasmakonzentration von 3,3 nmol/l trat 30 Minuten nach der Einnahme auf. Die systemische Budesonid-Exposition war zwischen SYMBICORT pMDI und der gleichzeitigen Verabreichung von Budesonid über einen Dosierinhalator und Formoterol über einen Trockenpulverinhalator (960 µg Budesonid und 54 µg Formoterol) vergleichbar. In derselben Studie erhielt eine offene Gruppe von Patienten mit mittelschwerem Asthma ebenfalls die gleiche höhere Dosis von SYMBICORT. Bei Budesonid zeigten COPD-Patienten im Vergleich zu Asthmapatienten eine um 12 % größere AUC und eine um 10 % niedrigere Cmax.
In der 6-monatigen zulassungsrelevanten klinischen Studie zur Lungenfunktion wurden Steady-State-Pharmakokinetikdaten von Budesonid bei einer Untergruppe von COPD-Patienten mit den Behandlungsarmen SYMBICORT 4,5 µg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5, Budesonid 160 µg, Budesonid erhoben 160 µg und Formoterol 4,5 µg zusammen gegeben, alle verabreicht als 2 Inhalationen zweimal täglich. Die systemische Budesonid-Exposition (AUC und Cmax) stieg proportional mit Dosen von 80 µg bis 160 µg und war im Allgemeinen ähnlich zwischen den 3 Behandlungsgruppen, die dieselbe Budesonid-Dosis erhielten (SYMBICORT 4,5 µg pMDI 160/4,5, Budesonid 160 µg, Budesonid 160 µg und Formoterol 4,5 µg zusammen verabreicht).
Formoterol
Inhaliertes Formoterol wird schnell resorbiert; Spitzenplasmakonzentrationen werden typischerweise zum Zeitpunkt der ersten Plasmaentnahme innerhalb von 5-10 Minuten nach der Verabreichung erreicht. Wie bei vielen Arzneimitteln zur oralen Inhalation ist es wahrscheinlich, dass der Großteil des inhalierten Formoterols geschluckt und dann aus dem Magen-Darm-Trakt resorbiert wird.
Gesunde Probanden
Nach Verabreichung von SYMBICORT (160/4,5, zwei oder vier Inhalationen zweimal täglich) über 5 Tage bei gesunden Probanden stieg die Plasmakonzentration von Formoterol im Allgemeinen proportional zur Dosis an. Der Akkumulationsindex für die Gruppe, die zweimal täglich 2 Inhalationen erhielt, betrug 1,77 für Formoterol.
Asthmapatienten
In einer Einzeldosisstudie wurden Patienten mit mittelschwerem Asthma höhere als die empfohlenen Dosen von SYMBICORT (12 Inhalationen von SYMBICORT 160/4,5) verabreicht. Die maximale Plasmakonzentration von Formoterol von 136 pmol wurde 10 Minuten nach der Einnahme erreicht. Ungefähr 8 % der verabreichten Formoterol-Dosis wurden im Urin als unveränderter Wirkstoff wiedergefunden.
In einer Studie mit wiederholter Gabe wurde die höchste empfohlene Dosis von SYMBICORT (160/4,5, zwei Inhalationen zweimal täglich) Patienten mit mittelschwerem Asthma und gesunden Probanden 1 Woche lang verabreicht. Bei Asthmapatienten trat nach 10 Minuten eine maximale Formoterol-Plasmakonzentration von 28 pmol/l auf. Die maximale Formoterol-Plasmakonzentration war bei Asthmapatienten etwa 42 % niedriger als bei gesunden Probanden. Die systemische Gesamtexposition von Formoterol war jedoch mit der bei Asthmapatienten vergleichbar.
COPD-Patienten
Nach Gabe einer Einzeldosis von 12 Inhalationen von SYMBICORT 80/4,5 wurde 15 Minuten nach der Gabe rasch eine mittlere maximale Formoterol-Plasmakonzentration von 167 pmol/l erreicht. Die Formoterol-Exposition war bei SYMBICORT 160 mg pMDI etwas höher (~16-18 %) im Vergleich zur gleichzeitigen Verabreichung von Budesonid über einen Dosierinhalator und Formoterol über einen Trockenpulverinhalator (Gesamtdosis von Budesonid 960 µg und Formoterol 54 µg). In derselben Studie erhielt eine Open-Label-Gruppe von Patienten mit mittelschwerem Asthma dieselbe Dosis SYMBICORT. COPD-Patienten wiesen im Vergleich zu Asthmapatienten eine um 12-15 % höhere AUC und Cmax für Formoterol auf.
In der 6-monatigen zulassungsrelevanten klinischen Studie zur Lungenfunktion wurden Steady-State-Pharmakokinetikdaten von Formoterol bei einer Untergruppe von COPD-Patienten mit Behandlungsarmen mit SYMBICORT 160 mg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5, Formoterol 4,5 µg, Budesonid 160 erhoben mcg und Formoterol 4,5 mcg zusammen gegeben, alle verabreicht als 2 Inhalationen zweimal täglich. Die systemische Formoterol-Exposition, nachgewiesen durch die AUC, war etwa 30 % bzw. 16 % höher bei SYMBICORT pMDI im Vergleich zum Behandlungsarm mit Formoterol allein bzw. zur gleichzeitigen Verabreichung einzelner Komponenten von Budesonid bzw. zum Behandlungsarm mit Formoterol.
Verteilung
Budesonid
Das Verteilungsvolumen von Budesonid betrug etwa 3 l/kg. Es war zu 85 % bis 90 % an Plasmaproteine gebunden. Die Proteinbindung war über den Konzentrationsbereich (1–100 nmol/l) konstant, der mit und über den empfohlenen inhalativen Dosen erreicht wurde. Budesonid zeigte wenig oder keine Bindung an Corticosteroid-bindendes Globulin. Budesonid äquilibrierte schnell mit roten Blutkörperchen in einer konzentrationsunabhängigen Weise mit einem Blutplasmaverhältnis von etwa 0,8.
Formoterol
Über den Konzentrationsbereich von 10-500 nmol/l betrug die Plasmaproteinbindung für die RR- und SS-Enantiomere von Formoterol 46 % bzw. 58 %. Die Konzentrationen von Formoterol, die zur Beurteilung der Plasmaproteinbindung verwendet wurden, waren höher als diejenigen, die im Plasma nach Inhalation einer Einzeldosis von 54 Mikrogramm erreicht wurden.
Stoffwechsel
Budesonid
In-vitro-Studien mit humanen Leberhomogenaten haben gezeigt, dass Budesonid schnell und umfassend metabolisiert wird. Zwei Hauptmetaboliten, die durch Cytochrom P450 (CYP)-Isoenzym 3A4 (CYP3A4)-katalysierte Biotransformation gebildet werden, wurden isoliert und als 16α-Hydroxyprednisolon und 6ß-Hydroxybudesonid identifiziert. Die Corticosteroid-Aktivität jedes dieser beiden Metaboliten betrug weniger als 1 % der Aktivität der Ausgangssubstanz. Es wurden keine qualitativen Unterschiede zwischen den Stoffwechselmustern in vitro und in vivo festgestellt. In menschlichen Lungen- und Serumpräparaten wurde eine vernachlässigbare metabolische Inaktivierung beobachtet.
Formoterol
Der primäre Metabolismus von Formoterol erfolgt durch direkte Glucuronidierung und durch O-Demethylierung, gefolgt von Konjugation an inaktive Metaboliten. Sekundäre Stoffwechselwege umfassen Deformylierung und Sulfatkonjugation. CYP2D6 und CYP2C wurden als primär für die Odemethylierung verantwortlich identifiziert.
Beseitigung
Budesonid
Budesonid wurde in Form von Metaboliten im Urin und im Stuhl ausgeschieden. Ungefähr 60 % einer intravenösen radioaktiv markierten Dosis wurden im Urin wiedergefunden.
Im Urin wurde kein unverändertes Budesonid nachgewiesen. Die 22R-Form von Budesonid wurde vorzugsweise von der Leber mit einer systemischen Clearance von 1,4 l/min gegenüber 1,0 l/min für die 22S-Form ausgeschieden. Die terminale Halbwertszeit, 2 bis 3 Stunden, war für beide Epimere gleich und dosisunabhängig.
Formoterol
Die Ausscheidung von Formoterol wurde bei vier gesunden Probanden nach gleichzeitiger oraler und intravenöser Verabreichung von radioaktiv markiertem Formoterol untersucht. In dieser Studie wurden 62 % des radioaktiv markierten Formoterols mit dem Urin ausgeschieden, während 24 % mit den Faeces ausgeschieden wurden.
Besondere Populationen
Geriatrie
Die Pharmakokinetik von SYMBICORT 4,5 µg bei geriatrischen Patienten wurde nicht speziell untersucht.
Pädiatrie
Die Plasmakonzentrationen von Budesonid wurden nach Verabreichung von vier Inhalationen von SYMBICORT 160/4,5 in einer Einzeldosisstudie bei pädiatrischen Patienten mit Asthma im Alter von 6 bis unter 12 Jahren gemessen. Spitzenkonzentrationen von Budesonid von 1,4 nmol/l traten 20 Minuten nach der Einnahme auf. Diese Studie zeigte auch, dass die gesamte systemische Budesonid-Exposition von SYMBICORT 4,5 mcg etwa 30 % niedriger war als die von inhaliertem Budesonid über einen Trockenpulverinhalator, der ebenfalls mit der gleichen verabreichten Dosis bewertet wurde. Die dosisnormalisierte Cmax und AUC0-inf von Budesonid nach Inhalation einer Einzeldosis bei Kindern im Alter von 6 bis unter 12 Jahren waren numerisch niedriger als bei Erwachsenen.
Nach 2 Inhalationen von SYMBICORT 160/4,5 zweimal täglich waren die Cmax und AUC0-6 von Formoterol im Steady State bei Kindern im Alter von 6 bis unter 12 Jahren vergleichbar mit denen, die bei Erwachsenen beobachtet wurden.
Geschlecht/Rasse
Spezifische Studien zur Untersuchung der Auswirkungen von Geschlecht und ethnischer Zugehörigkeit auf die Pharmakokinetik von SYMBICORT wurden nicht durchgeführt. Die populationspharmakokinetische Analyse der Daten von SYMBICORT 4,5 µg weist darauf hin, dass das Geschlecht die Pharmakokinetik von Budesonid und Formoterol nicht beeinflusst. Aufgrund der geringen Anzahl von Nicht-Kaukasiern, die auf PK untersucht wurden, können keine Rückschlüsse auf die Auswirkung der Rasse gezogen werden.
Stillende Mutter
Die Disposition von Budesonid nach Verabreichung durch Inhalation aus einem Trockenpulverinhalator in Dosen von 200 oder 400 Mikrogramm zweimal täglich für mindestens 3 Monate wurde bei acht stillenden Frauen mit Asthma im Zeitraum von 1 bis 6 Monaten nach der Geburt untersucht. Die systemische Budesonid-Exposition bei diesen Frauen scheint mit derjenigen bei nicht-stillenden Frauen mit Asthma aus anderen Studien vergleichbar zu sein. Muttermilch, die über acht Stunden nach der Einnahme gewonnen wurde, ergab, dass die maximale Konzentration von Budesonid für die Tagesgesamtdosen von 400 und 800 Mikrogramm 0,39 bzw. 0,78 nmol/l betrug und innerhalb von 45 Minuten nach der Einnahme auftrat. Die geschätzte orale Tagesdosis von Budesonid aus der Muttermilch an den Säugling beträgt ungefähr 0,007 und 0,014 µg/kg/Tag für die beiden in dieser Studie verwendeten Dosierungsschemata, was ungefähr 0,3 % bis 1 % der von der Mutter inhalierten Dosis entspricht. Budesonidspiegel in Plasmaproben von fünf Säuglingen etwa 90 Minuten nach dem Stillen (und etwa 140 Minuten nach Verabreichung des Arzneimittels an die Mutter) lagen unter quantifizierbaren Spiegeln ( Verwendung in bestimmten Bevölkerungsgruppen ].
Nieren- oder Leberinsuffizienz
Es liegen keine Daten zur spezifischen Anwendung von SYMBICORT bei Patienten mit eingeschränkter Leber- oder Nierenfunktion vor. Eine eingeschränkte Leberfunktion kann die Ausscheidung von Kortikosteroiden beeinträchtigen. Die Pharmakokinetik von Budesonid wurde durch eine beeinträchtigte Leberfunktion beeinflusst, was durch eine doppelte systemische Verfügbarkeit nach oraler Einnahme belegt wurde. Die Pharmakokinetik von intravenösem Budesonid war jedoch bei Patienten mit Zirrhose und bei gesunden Probanden ähnlich. Spezifische Daten zu Formoterol sind nicht verfügbar, aber da Formoterol hauptsächlich über den Leberstoffwechsel ausgeschieden wird, ist bei Patienten mit schwerer Leberfunktionsstörung mit einer erhöhten Exposition zu rechnen.
Arzneimittelwechselwirkungen
Eine Einzeldosis-Crossover-Studie wurde durchgeführt, um die Pharmakokinetik von acht Inhalationen der folgenden Substanzen zu vergleichen: Budesonid, Formoterol und gleichzeitig verabreichtes Budesonid plus Formoterol. Die Ergebnisse der Studie deuteten darauf hin, dass es keine Hinweise auf eine pharmakokinetische Wechselwirkung zwischen den beiden Bestandteilen von SYMBICORT gab.
Inhibitoren von Cytochrom-P450-Enzymen
Ketoconazol
Ketoconazol, ein starker Inhibitor des Isoenzyms 3A4 (CYP3A4) von Cytochrom P450 (CYP), dem wichtigsten Stoffwechselenzym für Kortikosteroide, erhöhte die Plasmaspiegel von oral eingenommenem Budesonid.
Cimetidin
Bei empfohlener Dosierung hatte Cimetidin, ein unspezifischer Inhibitor von CYP-Enzymen, eine leichte, aber klinisch unbedeutende Wirkung auf die Pharmakokinetik von oralem Budesonid.
Spezifische Arzneimittelwechselwirkungsstudien mit Formoterol wurden nicht durchgeführt.
Tiertoxikologie und/oder Pharmakologie
Präklinisch
Studien an Labortieren (Minischweine, Nagetiere und Hunde) haben das Auftreten von Herzrhythmusstörungen und plötzlichem Herztod (mit histologischem Nachweis einer Myokardnekrose) gezeigt, wenn Beta-Agonisten und Methylxanthine gleichzeitig verabreicht wurden. Die klinische Bedeutung dieser Befunde ist nicht bekannt.
Klinische Studien
Asthma
Patienten mit Asthma im Alter von 12 Jahren und älter
In zwei klinischen Studien, in denen SYMBICORT 4,5 µg mit den einzelnen Bestandteilen verglichen wurde, waren die Verbesserungen bei den meisten Wirksamkeitsendpunkten bei SYMBICORT größer als bei der alleinigen Anwendung von entweder Budesonid oder Formoterol. Darüber hinaus zeigte eine klinische Studie ähnliche Ergebnisse zwischen SYMBICORT und der gleichzeitigen Anwendung von Budesonid und Formoterol in entsprechenden Dosen aus separaten Inhalatoren.
Die Sicherheit und Wirksamkeit von SYMBICORT 160 mg wurden in zwei randomisierten, doppelblinden, placebokontrollierten klinischen Studien in den USA mit 1076 Patienten ab 12 Jahren nachgewiesen. Fixe SYMBICORT-Dosierungen von 160/9 µg und 320/9 µg zweimal täglich (jede Dosis verabreicht als 2 Inhalationen der Stärken 80/4,5 bzw. 160/4,5 µg) wurden mit den Monokomponenten (Budesonid und Formoterol) und Placebo verglichen Informationen zur angemessenen Dosierung zur Verfügung stellen, um eine Reihe von Asthma-Schweregraden abzudecken.
Studie 1: Klinische Studie mit SYMBICORT 160/4.5
In dieser 12-wöchigen Studie wurden 596 Patienten im Alter von 12 Jahren und älter untersucht, indem SYMBICORT 160/4,5, die freie Kombination aus Budesonid 160 µg plus Formoterol 4,5 µg in separaten Inhalatoren, Budesonid 160 µg, Formoterol 4,5 µg und Placebo; jeweils als 2 Inhalationen zweimal täglich verabreicht. Die Studie umfasste eine 2-wöchige Einlaufphase mit Budesonid 80 mcg, 2 Inhalationen zweimal täglich. Die meisten Patienten hatten mittelschweres bis schweres Asthma und verwendeten vor Studienbeginn mäßige bis hohe Dosen inhalativer Kortikosteroide. Die Randomisierung wurde nach vorheriger Behandlung mit inhalativen Kortikosteroiden stratifiziert (71,6 % mit mäßig dosiertem und 28,4 % mit hoch dosiertem inhalativem Kortikosteroid). Der mittlere Prozentsatz des vorhergesagten FEV1 zu Studienbeginn betrug 68,1 % und war in allen Behandlungsgruppen ähnlich. Die co-primären Wirksamkeitsendpunkte waren der 12-Stunden-Durchschnitt des Postdosis-FEV1 in Woche 2 und der Prädosis-FEV1, gemittelt über den Verlauf der Studie. Die Studie erforderte auch, dass Patienten, die ein vordefiniertes Asthma-Verschlechterungskriterium erfüllten, aus der Studie ausgeschlossen wurden. Die vordefinierten Asthma-Verschlimmerungskriterien waren eine klinisch relevante Abnahme von FEV1 oder PEF, eine Erhöhung der Albuterol-Notfallanwendung, nächtliches Erwachen aufgrund von Asthma, Notfallmaßnahmen oder Krankenhausaufenthalt aufgrund von Asthma oder die Notwendigkeit einer Asthmamedikation, die laut Protokoll nicht zulässig ist. Für das Kriterium des nächtlichen Erwachens aufgrund von Asthma durften die Patienten nach Ermessen des Prüfarztes in der Studie bleiben, wenn keines der anderen Asthma-verschlechternden Kriterien erfüllt war. Der prozentuale Anteil der Patienten, die aufgrund von oder Erfüllung vordefinierter Kriterien für eine Verschlechterung des Asthmas abbrachen, ist in Tabelle 4 dargestellt.
Die mittlere prozentuale Veränderung des FEV1 gegenüber dem Ausgangswert, gemessen unmittelbar vor der Verabreichung (vor der Dosis) über 12 Wochen, ist in Abbildung 1 dargestellt. Dosis-FEV1-Ergebnisse beim letzten verfügbaren Studienbesuch (Ende der Behandlung, EOT) werden ebenfalls bereitgestellt. Patienten, die SYMBICORT 160/4,5 erhielten, zeigten am Ende der Behandlung signifikant stärkere mittlere Verbesserungen des FEV1 vor der Dosisgabe gegenüber dem Ausgangswert (0,19 l, 9,4 %) im Vergleich zu Budesonid 160 µg (0,10 l, 4,9 %), Formoterol 4,5 µg (-0,12 L, -4,8 %) und Placebo (-0,17 L, -6,9 %).
Abbildung 1: Mittlere prozentuale Veränderung des FEV1 vor der Dosisgabe gegenüber dem Ausgangswert über 12 Wochen (Studie 1)
INFORMATIONEN ZUM PATIENTEN
SYMBIKORT (SIM-bi-kort) (Budesonid 80 µg und Formoterolfumarat-Dihydrat 4,5 µg) Aerosol zur Inhalation
SYMBIKORT (SIM-bi-kort) (Budesonid 160 µg und Formoterolfumarat-Dihydrat 4,5 µg) Aerosol zur Inhalation
Was ist SYMBICORT?
SYMBICORT kombiniert ein inhalatives Kortikosteroid-Arzneimittel (ICS), Budesonid und ein langwirksames Beta2-adrenerge Agonist (LABA)-Arzneimittel, Formoterol.
SYMBICORT 4,5 µg wird nicht zur Linderung plötzlicher Atemprobleme verwendet und ersetzt keinen Notfallinhalator. SYMBICORT wird bei Asthma und COPD wie folgt angewendet:
Verwenden Sie SYMBICORT nicht:
Informieren Sie vor der Anwendung von SYMBICORT Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und pflanzlicher Nahrungsergänzungsmittel. SYMBICORT und bestimmte andere Arzneimittel können miteinander interagieren. Dies kann schwerwiegende Nebenwirkungen verursachen. Informieren Sie Ihren Arzt insbesondere, wenn Sie Antimykotika oder Anti-HIV-Arzneimittel einnehmen.
Kennen Sie alle Medikamente, die Sie einnehmen. Führen Sie eine Liste und zeigen Sie sie Ihrem Arzt und Apotheker jedes Mal, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich SYMBICORT verwenden?
Siehe Schritt-für-Schritt-Anleitung zur Anwendung von SYMBICORT am Ende dieser Packungsbeilage. Verwenden Sie SYMBICORT 4,5 mcg nicht, es sei denn, Ihr medizinischer Betreuer hat es Ihnen beigebracht und Sie verstehen alles. Wenden Sie sich bei Fragen an Ihren Arzt oder Apotheker.
Welche Nebenwirkungen kann SYMBICORT haben?
SYMBICORT 4,5 mcg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Zu den häufigsten Nebenwirkungen von SYMBICORT gehören:
Menschen mit Asthma:
Menschen mit COPD:
Informieren Sie Ihren Arzt über jede Nebenwirkung, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von SYMBICORT.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Sie können Nebenwirkungen auch an AstraZeneca unter 1-800-236-9933 melden.
Wie ist SYMBICORT aufzubewahren?
Allgemeine Informationen zur sicheren und wirksamen Anwendung von SYMBICORT.
Arzneimittel werden manchmal zu anderen als den in der Packungsbeilage aufgeführten Zwecken verschrieben. Verwenden Sie SYMBICORT 4,5 mcg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie SYMBICORT nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Sie können Ihren Arzt oder Apotheker um Informationen zu SYMBICORT 4,5 mcg bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Welche Inhaltsstoffe enthält SYMBICORT 4,5 mcg?
Wirkstoffe: mikronisiertes Budesonid und mikronisiertes Formoterolfumarat-Dihydrat
Inaktive Inhaltsstoffe: Hydrofluoralkan (HFA 227), Povidon K25 USP und Polyethylenglykol 1000 NF
Gebrauchsanweisung
SYMBIKORT (SIM-bi-kort)(Budesonid 80 mcg und Formoterolfumarat-Dihydrat 4,5 mcg) Aerosol zur Inhalation
SYMBIKORT (SIM-bi-kort) (Budesonid 160 µg und Formoterolfumarat-Dihydrat 4,5 µg) Aerosol zur Inhalation
Abbildung 1  Aufrechte Position
Aufrechte Position
So verwenden Sie SYMBICORT
Befolgen Sie die nachstehenden Anweisungen zur Verwendung von SYMBICORT. Sie werden das Arzneimittel einatmen (inhalieren). Wenn Sie Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
Vorbereiten Ihres SYMBICORT-Inhalators für die Anwendung
Figur 2 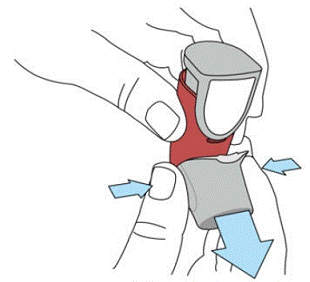
5. Vorbereiten Ihres SYMBICORT-Inhalators
Bevor Sie SYMBICORT zum ersten Mal verwenden, müssen Sie es vorbereiten. Um SYMBICORT 160 mg zu entlüften, halten Sie es in aufrechter Position. Siehe Abbildung 1. Schütteln Sie den SYMBICORT 4,5-mcg-Inhalator 5 Sekunden lang gut. Halten Sie Ihren SYMBICORT 160 mg-Inhalator von sich weg gerichtet und drücken Sie fest und vollständig auf die Oberseite des Zählers auf dem SYMBICORT 160 mg-Inhalator, um einen Testspray freizusetzen. Schütteln Sie es dann erneut für 5 Sekunden und geben Sie einen zweiten Testsprühstoß ab. Ihr SYMBICORT 160 mg-Inhalator ist jetzt vorbereitet und gebrauchsfertig. Nachdem Sie den SYMBICORT-Inhalator zum ersten Mal gefüllt haben, zeigt der Zähler entweder 120 oder 60 an, je nachdem, welche Größe Sie erhalten haben.
Wenn Sie Ihren SYMBICORT-Inhalator länger als 7 Tage nicht verwenden oder wenn Sie ihn fallen lassen, müssen Sie ihn erneut entlüften.
Möglichkeiten, den SYMBICORT 160-mg-Inhalator für die Anwendung zu halten
Figur 3 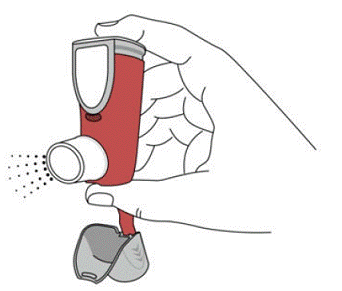
ODER
Figur 4 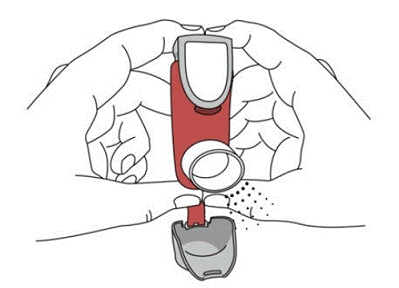
Anwendung Ihres SYMBICORT-Inhalators
6. Schütteln Sie Ihren SYMBICORT 160 mg Inhalator 5 Sekunden lang gut. Entfernen Sie die Mundstückabdeckung. Überprüfen Sie das Mundstück auf Fremdkörper.
7. Atmen Sie vollständig aus (ausatmen). Halten Sie den SYMBICORT-Inhalator an Ihren Mund. Setzen Sie das weiße Mundstück vollständig in Ihren Mund ein und schließen Sie Ihre Lippen darum. Stellen Sie sicher, dass der SYMBICORT 4,5-mcg-Inhalator aufrecht steht und dass die Öffnung des Mundstücks in Richtung Ihres Rachens zeigt (siehe Abbildung 5).
Abbildung 5 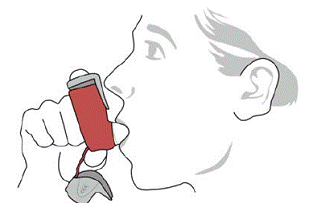
8. Atmen Sie tief und langsam durch den Mund ein (einatmen). Drücken Sie fest und vollständig auf die Oberseite des Zählers am SYMBICORT-Inhalator, um das Arzneimittel freizusetzen (siehe Abbildungen 3 und 4).
9. Atmen Sie weiter ein (einatmen) und halten Sie den Atem etwa 10 Sekunden oder so lange an, wie es angenehm ist. Bevor Sie ausatmen (ausatmen), lösen Sie Ihren Finger von der Oberseite des Zählers. Halten Sie den SYMBICORT-Inhalator aufrecht und nehmen Sie ihn aus dem Mund.
10. Schütteln Sie den SYMBICORT-Inhalator erneut 5 Sekunden lang und wiederholen Sie die Schritte 7 bis 9.
Nach der Anwendung Ihres SYMBICORT-Inhalators
11. Schließen Sie nach Gebrauch die Mundstückabdeckung, indem Sie sie drücken, bis sie einrastet.
12. Nachdem Sie die Einnahme von SYMBICORT (2 Sprühstöße) beendet haben, spülen Sie Ihren Mund mit Wasser aus. Spucke das Wasser aus. Schlucken Sie es nicht.
Ablesen des Zählers
ZÄHLER 
ZÄHLER 
So reinigen Sie Ihren SYMBICORT-Inhalator
Reinigen Sie das weiße Mundstück Ihres SYMBICORT 4,5-µg-Inhalators alle 7 Tage. So reinigen Sie das Mundstück:
Diese Patienteninformation und Gebrauchsanweisung wurde von der US Food and Drug Administration genehmigt.