Spiriva 9mcg Tiotropium Bromide Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Spiriva 9 mcg HandiHaler und wie wird es angewendet?
Spiriva HandiHaler (Tiotropiumbromid) Inhalationspulver ist ein Anticholinergikum, das zur Vorbeugung von Bronchospasmus (Verengung der Atemwege in der Lunge) bei Menschen mit Bronchitis, Emphysem oder COPD (chronisch obstruktive Lungenerkrankung) angewendet wird.
Welche Nebenwirkungen hat Spiriva 9mcg HandiHaler?
Häufige Nebenwirkungen von Spiriva 9 mcg HandiHaler sind:
Informieren Sie Ihren Arzt, wenn Sie schwerwiegende Nebenwirkungen von Spiriva 9 mcg HandiHaler haben, einschließlich:
BEZEICHNUNG
SPIRIVA 9mcg HANDIHALER besteht aus SPIRIVA-Kapseln und einem HANDIHALER-Gerät. Jede hellgrüne SPIRIVA-Hartgelatinekapsel 9 µg enthält ein Trockenpulver bestehend aus 18 µg Tiotropium (entsprechend 22,5 µg Tiotropiumbromid-Monohydrat), gemischt mit Lactose-Monohydrat (das Milchproteine enthalten kann).
Der Inhalt der SPIRIVA-Kapseln ist nur zur oralen Inhalation und nur zur Verabreichung mit dem HANDIHALER-Gerät bestimmt.
Der Wirkstoff von SPIRIVA HANDIHALER ist Tiotropium. Der Wirkstoff, Tiotropiumbromid-Monohydrat, ist ein Anticholinergikum mit Spezifität für Muskarinrezeptoren. Es wird chemisch beschrieben als (1α, 2β, 4β, 5α, 7β)-7-[(Hydroxydi-2-thienylacetyl)oxy]-9,9-dimethyl-3-oxa-9-azoniatricyclo[3.3.1.02,4] Nonanbromidmonohydrat. Es ist eine synthetische, nicht-chirale, quartäre Ammoniumverbindung. Tiotropiumbromid ist ein weißes oder gelblich weißes Pulver. Es ist schwer löslich in Wasser und löslich in Methanol.
Die Strukturformel lautet:
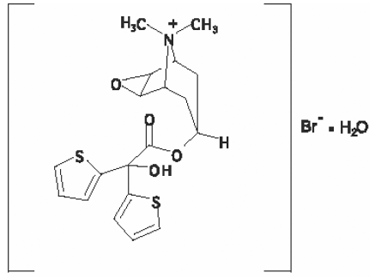
Tiotropiumbromid (Monohydrat) hat eine Molekülmasse von 490,4 und eine Summenformel von C19H22NO4S2Br • H2O.
Das HANDIHALER-Gerät ist ein Inhalationsgerät zum Inhalieren des Trockenpulvers, das in der SPIRIVA 9-mcg-Kapsel enthalten ist. Das Trockenpulver wird vom HANDIHALER-Gerät mit Durchflussraten von nur 20 l/min abgegeben. Bei standardisierten In-vitro-Tests gibt das HANDIHALER-Gerät durchschnittlich 10,4 mcg Tiotropium ab, wenn es bei einer Flussrate von 39 l/min für 3,1 Sekunden (insgesamt 2 l) getestet wird. In einer Studie mit 26 erwachsenen Patienten mit COPD und stark eingeschränkter Lungenfunktion [mittleres FEV1 1,02 l (Bereich 0,45 bis 2,24 l); 37,6 % des Sollwerts (Bereich 16 % bis 65 %)] betrug der mediane Spitzeninspirationsfluss (PIF) durch das HANDIHALER-Gerät 30,0 l/min (Bereich 20,4 bis 45,6 l/min). Die Menge des an die Lunge abgegebenen Arzneimittels hängt von Faktoren des Patienten ab, wie z. B. Inspirationsfluss und maximaler Inspirationsfluss durch das HANDIHALER-Gerät, die von Patient zu Patient und mit der Expositionszeit der SPIRIVA 9-mcg-Kapsel außerhalb der Blisterpackung variieren können Pack.
INDIKATIONEN
SPIRIVA HANDIHALER (Tiotropiumbromid-Pulver zur Inhalation) ist indiziert zur einmal täglichen Langzeitbehandlung von Bronchospasmen im Zusammenhang mit chronisch obstruktiver Lungenerkrankung (COPD), einschließlich chronischer Bronchitis und Emphysem. SPIRIVA 9mcg HANDIHALER ist angezeigt, um Exazerbationen bei COPD-Patienten zu reduzieren.
DOSIERUNG UND ANWENDUNG
Nur zur oralen Inhalation. Schlucken Sie SPIRIVA 9 mcg Kapseln nicht, da die beabsichtigte Wirkung auf die Lunge nicht erreicht wird. Der Inhalt der SPIRIVA-Kapseln sollte nur mit dem HANDIHALER-Gerät verwendet werden [sehen ÜBERDOSIS ].
Die empfohlene Dosis von SPIRIVA HANDIHALER besteht aus zwei Inhalationen des Pulverinhalts einer SPIRIVA-Kapsel einmal täglich mit dem HANDIHALER-Gerät [siehe INFORMATIONEN ZUM PATIENTEN ]. Nehmen Sie nicht mehr als eine Dosis in 24 Stunden ein.
Zur Verabreichung von SPIRIVA HANDIHALER wird eine 9-mcg-SPIRIVA-Kapsel in die mittlere Kammer des HANDIHALER-Geräts gegeben. Die SPIRIVA 9mcg-Kapsel wird durch Drücken und Loslassen der grünen Anstechtaste an der Seite des HANDIHALER-Geräts durchstochen. Die Tiotropium-Formulierung wird im Luftstrom dispergiert, wenn der Patient durch das Mundstück einatmet [siehe INFORMATIONEN ZUM PATIENTEN ].
Bei geriatrischen, hepatisch oder nierenbeeinträchtigten Patienten ist keine Dosisanpassung erforderlich. Patienten mit mäßiger bis schwerer Nierenfunktionsstörung, die SPIRIVA 9 µg HANDIHALER erhalten, sollten jedoch engmaschig auf anticholinerge Wirkungen überwacht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , Verwendung in bestimmten Bevölkerungsgruppen , und KLINISCHE PHARMAKOLOGIE ].
WIE GELIEFERT
Darreichungsformen und Stärken
Pulver zur Inhalation
SPIRIVA 9 µg HANDIHALER besteht aus SPIRIVA-Kapseln mit Tiotropium-Pulver zur oralen Inhalation und einem HANDIHALER-Gerät. SPIRIVA 9 µg Kapseln enthalten 18 µg Tiotropium in einer hellgrünen Hartgelatinekapsel mit dem Aufdruck TI 01 auf einer Seite und dem Firmenlogo von Boehringer Ingelheim auf der anderen Seite. Das HANDIHALER-Gerät ist nur für die Verwendung mit den SPIRIVA-Kapseln vorgesehen.
Lagerung und Handhabung
SPIRIVA HANDIHALER besteht aus SPIRIVA 9mcg-Kapseln und dem HANDIHALER-Gerät. SPIRIVA 9 µg Kapseln enthalten 18 µg Tiotropium und sind hellgrün, mit dem Firmenlogo von Boehringer Ingelheim auf der SPIRIVA Kapselkappe und TI 01 auf dem SPIRIVA Kapselunterteil oder umgekehrt.
Das HANDIHALER-Gerät ist grau mit einem grünen Durchstechknopf. Es ist mit SPIRIVA HANDIHALER (Tiotropiumbromid-Pulver zur Inhalation), dem Firmenlogo von Boehringer Ingelheim, bedruckt. Es ist auch aufgedruckt, um darauf hinzuweisen, dass SPIRIVA-Kapseln nicht im HANDIHALER-Gerät aufbewahrt werden sollten und dass das HANDIHALER-Gerät nur mit SPIRIVA-9-mcg-Kapseln verwendet werden darf.
SPIRIVA 9 µg Kapseln sind in einer Aluminium/Aluminium-Blisterkarte verpackt und entlang einer perforierten Schnittlinie verbunden. SPIRIVA 9 mcg Kapseln sollten immer in der Blisterpackung aufbewahrt und erst unmittelbar vor der Anwendung entnommen werden. Das Medikament sollte sofort verwendet werden, nachdem die Verpackung über einer einzelnen SPIRIVA-Kapsel geöffnet wurde.
Folgende Pakete sind verfügbar:
Außerhalb der Reichweite von Kindern aufbewahren. Puder nicht in die Augen bringen.
Lagerung
Bei 25 °C (77 °F) lagern; Abweichungen bis 15° bis 30°C (59° bis 86°F) zulässig [siehe USP Controlled Room Temperature].
Die SPIRIVA-Kapseln sollten keinen extremen Temperaturen oder Feuchtigkeit ausgesetzt werden. Bewahren Sie SPIRIVA 9 mcg-Kapseln nicht im HANDIHALER-Gerät auf.
Vertrieb durch: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Überarbeitet: Februar 2018
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden in anderen Abschnitten beschrieben oder ausführlicher beschrieben:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, kann die Inzidenz von Nebenwirkungen, die in klinischen Studien mit einem Medikament beobachtet wurden, nicht direkt mit der Inzidenz in klinischen Studien mit einem anderen Medikament verglichen werden und spiegelt möglicherweise nicht die in der Praxis beobachteten Inzidenzen wider.
6-monatige bis 1-jährige Testversionen
Die unten beschriebenen Daten spiegeln die Exposition gegenüber SPIRIVA 9 mcg HANDIHALER bei 2663 Patienten wider. SPIRIVA 9mcg HANDIHALER wurde in zwei 1-jährigen placebokontrollierten Studien, zwei 1-jährigen aktiv-kontrollierten Studien und zwei 6-monatigen placebokontrollierten Studien bei Patienten mit COPD untersucht. In diesen Studien wurden 1308 Patienten mit SPIRIVA HANDIHALER in der empfohlenen Dosis von 18 µg einmal täglich behandelt. Die Bevölkerung war zwischen 39 und 87 Jahre alt, wobei 65 % bis 85 % Männer, 95 % Kaukasier waren, und COPD mit einem mittleren prognostizierten FEV1-Prozentsatz von 39 % bis 43 % hatte. Patienten mit Engwinkelglaukom oder symptomatischer Prostatahypertrophie oder Obstruktion des Blasenausgangs wurden von diesen Studien ausgeschlossen. Eine zusätzliche 6-monatige Studie, die in einer Umgebung für Veteranenangelegenheiten durchgeführt wurde, ist in dieser Sicherheitsdatenbank nicht enthalten, da nur schwerwiegende unerwünschte Ereignisse erfasst wurden.
Die am häufigsten berichtete Nebenwirkung war Mundtrockenheit. Mundtrockenheit war in der Regel leicht und verschwand oft während der fortgesetzten Behandlung. Andere bei einzelnen Patienten berichtete Reaktionen, die mit möglichen anticholinergen Wirkungen vereinbar sind, waren Verstopfung, Tachykardie, verschwommenes Sehen, Glaukom (neues Auftreten oder Verschlechterung), Dysurie und Harnverhalt.
Vier multizentrische placebokontrollierte und aktivkontrollierte Einjahresstudien untersuchten SPIRIVA HANDIHALER bei Patienten mit COPD. Tabelle 1 zeigt alle Nebenwirkungen, die mit einer Häufigkeit von ≥ 3 % in der SPIRIVA 9 mcg HANDIHALER-Gruppe in den placebokontrollierten 1-Jahres-Studien auftraten, in denen die Raten in der SPIRIVA HANDIHALER-Gruppe um ≥ 1 % über Placebo lagen. Zum Vergleich ist die Häufigkeit entsprechender Reaktionen in den Ipratropium-kontrollierten Studien enthalten.
Arthritis, Husten und grippeähnliche Symptome traten in der Behandlungsgruppe mit SPIRIVA 9 mcg HANDIHALER mit einer Rate von ≥ 3 % auf, waren jedoch
Andere Reaktionen, die in der SPIRIVA HANDIHALER-Gruppe mit einer Häufigkeit von 1 % bis 3 % in den Placebo-kontrollierten Studien auftraten, in denen die Raten höher waren als in der Placebo-Gruppe, sind:
Körper als Ganzes: allergische Reaktion, Beinschmerzen;
Zentrales und peripheres Nervensystem: Dysphonie, Parästhesien;
Erkrankungen des Magen-Darm-Trakts: gastrointestinale Störung nicht anders angegeben (NOS), gastroösophagealer Reflux, Stomatitis (einschließlich ulzerativer Stomatitis);
Stoffwechsel- und Ernährungsstörungen: Hypercholesterinämie, Hyperglykämie;
Erkrankungen des Bewegungsapparates: Skelettschmerzen;
Herzereignisse: Angina pectoris (einschließlich verschlimmerter Angina pectoris);
Psychische Störung: Depression; Infektionen: Herpes zoster;
Erkrankung des Atmungssystems (oben): Laryngitis;
Sehstörung: Katarakt.
Zu den in den klinischen Studien beobachteten Nebenwirkungen mit einer Inzidenz von
In den 1-Jahres-Studien nahm die Inzidenz von Mundtrockenheit, Obstipation und Harnwegsinfektionen mit dem Alter zu [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Zwei multizentrische, 6-monatige, kontrollierte Studien untersuchten SPIRIVA 9 mcg HANDIHALER bei Patienten mit COPD. Die Nebenwirkungen und Inzidenzraten waren ähnlich denen, die in den kontrollierten 1-Jahres-Studien beobachtet wurden.
4-Jahres-Testversion
Die unten beschriebenen Daten spiegeln die Exposition gegenüber SPIRIVA 9 mcg HANDIHALER bei 5992 COPD-Patienten in einer 4-jährigen placebokontrollierten Studie wider. In dieser Studie wurden 2986 Patienten mit SPIRIVA 9 µg HANDIHALER in der empfohlenen Dosis von 18 µg einmal täglich behandelt. Die Population war zwischen 40 und 88 Jahre alt, war zu 75 % männlich, zu 90 % Kaukasier und hatte COPD mit einem erwarteten mittleren FEV1-Prozentsatz vor Bronchodilatation von 40 %. Patienten mit Engwinkelglaukom oder symptomatischer Prostatahypertrophie oder Obstruktion des Blasenausgangs wurden von diesen Studien ausgeschlossen. Als die Nebenwirkungen mit einer Häufigkeit von ≥ 3 % in der SPIRIVA 9 µg HANDIHALER-Gruppe analysiert wurden, wobei die Raten in der SPIRIVA 9 µg HANDIHALER-Gruppe die Placebo-Rate um ≥ 1 % überstiegen, schlossen die Nebenwirkungen ein (SPIRIVA 9 µg HANDIHALER, Placebo): Pharyngitis (12,5 % , 10,8 %), Sinusitis (6,5 %, 5,3 %), Kopfschmerzen (5,7 %, 4,5 %), Verstopfung (5,1 %, 3,7 %), Mundtrockenheit (5,1 %, 2,7 %), Depression (4,4 %, 3,3 %) , Schlaflosigkeit (4,4 %, 3,0 %) und Arthralgie (4,2 %, 3,1 %).
Zusätzliche Nebenwirkungen
Andere bisher nicht aufgeführte Nebenwirkungen, die bei COPD-Patienten, die mit SPIRIVA 9 mcg HANDIHALER behandelt wurden, häufiger berichtet wurden als Placebo, sind: Dehydratation, Hautgeschwür, Stomatitis, Gingivitis, oropharyngeale Candidiasis, trockene Haut, Hautinfektion und Gelenkschwellung.
Postmarketing-Erfahrung
Bei der weltweiten Verwendung von SPIRIVA HANDIHALER nach der Zulassung wurden Nebenwirkungen festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen. Diese Nebenwirkungen sind: Reizungen an der Applikationsstelle (Glossitis, Geschwürbildung im Mund und pharyngolaryngeale Schmerzen), Schwindel, Dysphagie, Heiserkeit, Darmverschluss einschließlich Lähmung des Ileus, erhöhter Augeninnendruck, orale Candidiasis, Herzklopfen, Pruritus, Tachykardie, Rachenreizung und Urtikaria.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Sympathomimetika, Methylxanthine, Steroide
SPIRIVA 9 µg HANDIHALER wurde gleichzeitig mit kurz und lang wirksamen sympathomimetischen (Beta-Agonisten), Bronchodilatatoren, Methylxanthinen und oralen und inhalativen Steroiden ohne Zunahme von Nebenwirkungen angewendet.
Anticholinergika
Es besteht die Möglichkeit einer additiven Wechselwirkung mit gleichzeitig angewendeten Anticholinergika. Vermeiden Sie daher die gleichzeitige Anwendung von SPIRIVA 9 µg HANDIHALER mit anderen Anticholinergika-haltigen Arzneimitteln, da dies zu einer Zunahme von anticholinergen Nebenwirkungen führen kann [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ].
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Nicht für den akuten Gebrauch
SPIRIVA 9mcg HANDIHALER ist als einmal tägliche Erhaltungstherapie bei COPD vorgesehen und sollte nicht zur Linderung akuter Symptome, dh als Notfalltherapie zur Behandlung akuter Episoden von Bronchospasmen, angewendet werden.
Sofortige Überempfindlichkeitsreaktionen
Unmittelbare Überempfindlichkeitsreaktionen, einschließlich Urtikaria, Angioödem (einschließlich Schwellung der Lippen, der Zunge oder des Rachens), Hautausschlag, Bronchospasmus, Anaphylaxie oder Juckreiz, können nach Verabreichung von SPIRIVA 9 mcg HANDIHALER auftreten. Wenn eine solche Reaktion auftritt, sollte die Behandlung mit SPIRIVA 9 mcg HANDIHALER sofort abgebrochen und alternative Behandlungen in Betracht gezogen werden. Angesichts der ähnlichen Strukturformel von Atropin und Tiotropium sollten Patienten mit einer Vorgeschichte von Überempfindlichkeitsreaktionen auf Atropin oder seine Derivate engmaschig auf ähnliche Überempfindlichkeitsreaktionen auf SPIRIVA HANDIHALER überwacht werden. Darüber hinaus sollte SPIRIVA HANDIHALER bei Patienten mit schwerer Überempfindlichkeit gegen Milchproteine mit Vorsicht angewendet werden.
Paradoxer Bronchospasmus
Inhalative Arzneimittel, einschließlich SPIRIVA HANDIHALER, können paradoxe Bronchospasmen verursachen. Wenn dies auftritt, sollte es sofort mit einem inhalativen kurz wirksamen Beta2-Agonisten wie Albuterol behandelt werden. Die Behandlung mit SPIRIVA HANDIHALER sollte abgebrochen und andere Behandlungen in Betracht gezogen werden.
Verschlechterung des Engwinkelglaukoms
SPIRIVA 9mcg HANDIHALER sollte bei Patienten mit Engwinkelglaukom mit Vorsicht angewendet werden. Verschreibende Ärzte und Patienten sollten auf Anzeichen und Symptome eines akuten Engwinkelglaukoms achten (z. B. Augenschmerzen oder -beschwerden, verschwommenes Sehen, Lichthöfe oder Farbbilder in Verbindung mit roten Augen aufgrund einer konjunktivalen Kongestion und Hornhautödem). Weisen Sie die Patienten an, sofort einen Arzt aufzusuchen, wenn eines dieser Anzeichen oder Symptome auftritt.
Verschlechterung der Harnverhaltung
SPIRIVA HANDIHALER sollte bei Patienten mit Harnverhalt mit Vorsicht angewendet werden. Verschreibende Ärzte und Patienten sollten auf Anzeichen und Symptome einer Harnverhaltung achten (z. B. Schwierigkeiten beim Wasserlassen, schmerzhaftes Wasserlassen), insbesondere bei Patienten mit Prostatahyperplasie oder Blasenhalsobstruktion. Weisen Sie die Patienten an, sofort einen Arzt aufzusuchen, wenn eines dieser Anzeichen oder Symptome auftritt.
Nierenfunktionsstörung
Da es sich um ein überwiegend renal ausgeschiedenes Arzneimittel handelt, sollten Patienten mit mäßiger bis schwerer Nierenfunktionsstörung (Kreatinin-Clearance KLINISCHE PHARMAKOLOGIE ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( PATIENTENINFORMATION und Gebrauchsanweisung ).
Nicht für den akuten Gebrauch
Weisen Sie die Patienten darauf hin, dass SPIRIVA HANDIHALER ein einmal täglich zu verabreichender Erhaltungs-Bronchodilatator ist und nicht zur sofortigen Linderung von Atemproblemen (dh als Notfallmedikation) verwendet werden sollte.
Sofortige Überempfindlichkeitsreaktionen
Informieren Sie die Patienten darüber, dass nach der Verabreichung von SPIRIVA 9 mcg HANDIHALER Anaphylaxie, Angioödem (einschließlich Schwellung der Lippen, der Zunge oder des Rachens), Urtikaria, Hautausschlag, Bronchospasmus oder Juckreiz auftreten können. Weisen Sie den Patienten an, die Behandlung sofort abzubrechen und einen Arzt aufzusuchen, wenn eines dieser Anzeichen oder Symptome auftritt.
Paradoxer Bronchospasmus
Informieren Sie die Patienten darüber, dass SPIRIVA HANDIHALER paradoxe Bronchospasmen hervorrufen kann. Weisen Sie die Patienten darauf hin, dass sie SPIRIVA HANDIHALER absetzen sollten, wenn ein paradoxer Bronchospasmus auftritt.
Verschlechterung des Engwinkelglaukoms
Weisen Sie die Patienten an, auf Anzeichen und Symptome eines Engwinkelglaukoms zu achten (z. B. Augenschmerzen oder -beschwerden, verschwommenes Sehen, Lichthöfe oder Farbbilder in Verbindung mit roten Augen aufgrund einer konjunktivalen Verstopfung und eines Hornhautödems). Weisen Sie die Patienten an, sofort einen Arzt aufzusuchen, wenn eines dieser Anzeichen und Symptome auftritt.
Informieren Sie die Patienten darüber, dass darauf geachtet werden muss, dass das Pulver nicht in die Augen gelangt, da dies zu verschwommenem Sehen und erweiterten Pupillen führen kann.
Da bei der Anwendung von SPIRIVA HANDIHALER Schwindel und verschwommenes Sehen auftreten können, sollten Patienten davor gewarnt werden, sich an Aktivitäten wie dem Führen eines Fahrzeugs oder dem Bedienen von Geräten oder Maschinen zu beteiligen.
Verschlechterung der Harnverhaltung
Weisen Sie die Patienten an, auf Anzeichen und Symptome einer Harnverhaltung (z. B. Schwierigkeiten beim Wasserlassen, Schmerzen beim Wasserlassen) zu achten. Weisen Sie die Patienten an, sofort einen Arzt aufzusuchen, wenn eines dieser Anzeichen oder Symptome auftritt.
Anweisungen zur Verabreichung von SPIRIVA HANDIHALER
Unterweisen Sie die Patienten in der korrekten Verabreichung von SPIRIVA 9 mcg-Kapseln mit dem HANDIHALER-Gerät [siehe INFORMATIONEN ZUM PATIENTEN ]. Weisen Sie die Patienten darauf hin, dass SPIRIVA 9 mcg-Kapseln nur über das HANDIHALER-Gerät verabreicht werden sollten und das HANDIHALER-Gerät nicht zur Verabreichung anderer Medikamente verwendet werden sollte. Erinnern Sie die Patienten daran, dass der Inhalt von SPIRIVA 9 mcg-Kapseln nur zur oralen Inhalation bestimmt ist und nicht geschluckt werden darf.
Weisen Sie die Patienten an, SPIRIVA 9 mcg-Kapseln immer in versiegelten Blisterpackungen aufzubewahren und unmittelbar vor der Anwendung nur eine SPIRIVA-Kapsel zu entnehmen, da sonst die Wirksamkeit verringert werden kann. Weisen Sie die Patienten an, unbenutzte zusätzliche SPIRIVA-Kapseln, die der Luft ausgesetzt waren (dh nicht für den sofortigen Gebrauch bestimmt sind), zu entsorgen.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einer 104-wöchigen Inhalationsstudie an Ratten mit Tiotropium-Dosen von bis zu 59 µg/kg/Tag, in einer 83-wöchigen Inhalationsstudie an weiblichen Mäusen mit Dosen von bis zu 145 µg/kg/Tag und in eine 101-wöchige Inhalationsstudie an männlichen Mäusen mit Dosen von bis zu 2 mcg/kg/Tag. Diese Dosen entsprechen etwa dem 30-, 40- bzw. 0,5-fachen der empfohlenen täglichen Inhalationsdosis beim Menschen (MRHDID) auf µg/m2-Basis.
Tiotropiumbromid zeigte in den folgenden Assays keine Hinweise auf Mutagenität oder Klastogenität: dem bakteriellen Genmutationsassay, dem V79-Zellmutageneseassay des chinesischen Hamsters, den Chromosomenaberrationsassays in humanen Lymphozyten in vitro und der Bildung von Mikrokernen in der Maus in vivo sowie der außerplanmäßigen DNA-Synthese in primärer Rattenhepatozyten-in-vitro-Assay.
Bei Ratten wurde bei inhalativen Tiotropium-Dosen von 78 µg/kg/Tag oder mehr (etwa das 40-fache der MRHDID auf µg/m2-Basis) eine Abnahme der Anzahl der Corpora lutea und des Prozentsatzes der Implantate festgestellt. Bei 9 µg/kg/Tag (ungefähr das 5-fache der MRHDID auf µg/m2-Basis) wurden keine derartigen Wirkungen beobachtet. Der Fertilitätsindex wurde jedoch bei Inhalationsdosen von bis zu 1689 µg/kg/Tag (ungefähr das 910-fache der MRHDID auf µg/m2-Basis) nicht beeinflusst.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Die begrenzten Humandaten zur Anwendung von SPIRIVA 9mcg HANDIHALER während der Schwangerschaft reichen nicht aus, um über ein arzneimittelbedingtes Risiko unerwünschter schwangerschaftsbedingter Folgen zu informieren. Basierend auf Reproduktionsstudien an Tieren wurden keine strukturellen Anomalien beobachtet, wenn Tiotropium trächtigen Ratten und Kaninchen während der Organogenese in Dosen verabreicht wurde, die das 790- bzw. 8-fache der maximal empfohlenen täglichen Inhalationsdosis beim Menschen (MRHDID) betrugen. Bei Ratten und Kaninchen, denen Tiotropium in für das Muttertier toxischen Dosen verabreicht wurde, die das 430-Fache bzw. das 40-Fache der MRHDID betrugen, wurde ein erhöhter Verlust nach der Implantation beobachtet [vgl Daten ].
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere unerwünschte Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 % bis 4 % bzw. 15 % bis 20 %.
Daten
Tierdaten
In 2 getrennten Studien zur embryofetalen Entwicklung erhielten trächtige Ratten und Kaninchen Tiotropium während der Organogenese in Dosen bis zu etwa dem 790- bzw. 8-fachen der MRHDID (auf Mikrogramm/m2-Basis bei Inhalationsdosen von 1471 und 7 Mikrogramm/kg). /Tag bei Ratten bzw. Kaninchen). Bei Ratten oder Kaninchen wurden keine Hinweise auf strukturelle Anomalien beobachtet. Bei Ratten verursachte Tiotropium jedoch fötale Resorption, Wurfverlust, eine Abnahme der Anzahl lebender Jungtiere bei der Geburt und des mittleren Gewichts der Jungtiere sowie eine Verzögerung der sexuellen Reifung der Jungtiere bei Tiotropium-Dosen von etwa dem 40-fachen der MRHDID (bei einem mcg/m2 basierend auf einer mütterlichen Inhalationsdosis von 78 mcg/kg/Tag). Bei Kaninchen verursachte Tiotropium bei einer Tiotropium-Dosis von etwa dem 430-Fachen der MRHDID (auf einer mcg/m2-Basis bei einer maternalen Inhalationsdosis von 400 mcg/kg/Tag) einen Anstieg des Postimplantationsverlusts. Solche Wirkungen wurden bei etwa dem 5- bzw. 95-Fachen der MRHDID nicht beobachtet (auf Mikrogramm/m2-Basis bei Inhalationsdosen von 9 bzw. 88 Mikrogramm/kg/Tag bei Ratten bzw. Kaninchen).
Stillzeit
Zusammenfassung der Risiken
Es liegen keine Daten über das Vorhandensein von Tiotropium in der Muttermilch, die Auswirkungen auf den gestillten Säugling oder die Auswirkungen auf die Milchproduktion vor. Tiotropium ist in der Milch säugender Ratten vorhanden; aufgrund artspezifischer Unterschiede in der Laktationsphysiologie ist die klinische Relevanz dieser Daten jedoch nicht klar [vgl Daten ]. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an SPIRIVA 9 mcg HANDIHALER und möglichen Nebenwirkungen von SPIRIVA HANDIHALER auf das gestillte Kind oder von der zugrunde liegenden Erkrankung der Mutter berücksichtigt werden.
Daten
Die Verteilung von Tiotropiumbromid in die Milch wurde nach einmaliger intravenöser Verabreichung von 10 mg/kg an laktierende Ratten untersucht. Tiotropium und/oder seine Metaboliten sind in der Milch säugender Ratten in höheren Konzentrationen als im Plasma vorhanden.
Pädiatrische Verwendung
SPIRIVA HANDIHALER ist nicht für die Anwendung bei Kindern angezeigt. Die Sicherheit und Wirksamkeit von SPIRIVA 9mcg HANDIHALER bei pädiatrischen Patienten wurde nicht nachgewiesen.
Geriatrische Verwendung
Basierend auf den verfügbaren Daten ist keine Anpassung der SPIRIVA HANDIHALER-Dosierung bei geriatrischen Patienten gerechtfertigt [siehe KLINISCHE PHARMAKOLOGIE ].
Von der Gesamtzahl der Patienten, die SPIRIVA 9 mcg HANDIHALER in den 1-jährigen klinischen Studien erhielten, waren 426
Nierenfunktionsstörung
Patienten mit mittelschwerer bis schwerer Nierenfunktionsstörung (Kreatinin-Clearance DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN , und KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Die Auswirkungen einer Leberfunktionsstörung auf die Pharmakokinetik von Tiotropium wurden nicht untersucht.
ÜBERDOSIS
Hohe Dosen von Tiotropium können zu anticholinergen Anzeichen und Symptomen führen. Allerdings traten bei 6 gesunden Probanden nach einer inhalierten Einzeldosis von bis zu 282 µg Tiotropium keine systemischen anticholinergen Nebenwirkungen auf. In einer Studie mit 12 gesunden Probanden wurden nach wiederholter einmal täglicher Inhalation von 141 µg Tiotropium bilaterale Konjunktivitis und Mundtrockenheit beobachtet.
Die Behandlung einer Überdosierung besteht aus dem Absetzen von SPIRIVA HANDIHALER zusammen mit der Einleitung einer geeigneten symptomatischen und/oder unterstützenden Therapie.
Versehentliche Einnahme
Eine akute Vergiftung durch versehentliche orale Einnahme von SPIRIVA-Kapseln ist unwahrscheinlich, da es systemisch nicht gut resorbiert wird.
Aus Erfahrungen nach Markteinführung wurde ein Fall von Überdosierung berichtet. Es wurde berichtet, dass eine Patientin 30 Kapseln über einen Zeitraum von 2,5 Tagen inhaliert hatte und einen veränderten Geisteszustand, Zittern, Bauchschmerzen und schwere Verstopfung entwickelte. Der Patient wurde ins Krankenhaus eingeliefert, SPIRIVA HANDIHALER wurde abgesetzt und die Verstopfung mit einem Einlauf behandelt. Der Patient erholte sich und wurde noch am selben Tag entlassen.
KONTRAINDIKATIONEN
SPIRIVA 9mcg HANDIHALER ist kontraindiziert bei Patienten mit einer Überempfindlichkeit gegen Tiotropium, Ipratropium oder einen der Bestandteile dieses Produkts [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. In klinischen Studien und Erfahrungen nach der Markteinführung mit SPIRIVA 9 mcg HANDIHALER wurden unmittelbare Überempfindlichkeitsreaktionen, einschließlich Angioödem (einschließlich Schwellung der Lippen, Zunge oder Rachen), Juckreiz oder Hautausschlag berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Tiotropium ist ein lang wirkendes Antimuskarinikum, das oft als Anticholinergikum bezeichnet wird. Es hat eine ähnliche Affinität zu den Subtypen der Muskarinrezeptoren M1 bis M5. In den Atemwegen zeigt es pharmakologische Wirkungen durch Hemmung von M3-Rezeptoren an der glatten Muskulatur, was zu einer Bronchodilatation führt. Die kompetitive und reversible Natur des Antagonismus wurde mit Rezeptoren menschlichen und tierischen Ursprungs und isolierten Organpräparaten gezeigt. In präklinischen In-vitro- und In-vivo-Studien war die Verhinderung von Methacholin-induzierten Bronchokonstriktionseffekten dosisabhängig und hielt länger als 24 Stunden an. Die Bronchodilatation nach Inhalation von Tiotropium ist überwiegend ein ortsspezifischer Effekt.
Pharmakodynamik
Herzelektrophysiologie
In einer multizentrischen, randomisierten, doppelblinden Studie mit Tiotropium-Trockenpulver zur Inhalation, an der 198 Patienten mit COPD teilnahmen, war die Anzahl der Studienteilnehmer mit Abweichungen vom korrigierten QT-Intervall von 30 bis 60 ms zu Studienbeginn in der SPIRIVA 9 mcg HANDIHALER-Gruppe höher als im Vergleich mit Placebo. Dieser Unterschied war offensichtlich, wenn sowohl die Bazett (QTcB) [20 (20 %) Patienten vs. 12 (12 %) Patienten] als auch die Fredericia (QTcF) [16 (16 %) Patienten vs. 1 (1 %) Patient] Korrekturen von vorgenommen wurden QT für Herzfrequenz. Kein Patient in beiden Gruppen hatte entweder ein QTcB oder ein QTcF von > 500 ms. Andere klinische Studien mit SPIRIVA HANDIHALER zeigten keine Wirkung des Arzneimittels auf die QTc-Intervalle.
Die Wirkung von Tiotropium-Trockenpulver zur Inhalation auf das QT-Intervall wurde auch in einer randomisierten, placebo- und positiv-kontrollierten Crossover-Studie mit 53 gesunden Freiwilligen untersucht. Die Probanden erhielten Tiotropium-Trockenpulver zur Inhalation 18 µg, 54 µg (das Dreifache der empfohlenen Dosis) oder Placebo für 12 Tage. EKG-Bewertungen wurden zu Studienbeginn und während des gesamten Dosierungsintervalls nach der ersten und letzten Dosis der Studienmedikation durchgeführt. Im Vergleich zu Placebo betrug die maximale mittlere Veränderung des studienspezifischen QTc-Intervalls gegenüber dem Ausgangswert 3,2 ms bzw. 0,8 ms für Tiotropium-Trockenpulver zur Inhalation 18 µg bzw. 54 µg. Kein Patient zeigte einen neuen Beginn von QTc > 500 ms oder QTc-Veränderungen von ≥ 60 ms gegenüber dem Ausgangswert.
Pharmakokinetik
Tiotropium wird durch Trockenpulverinhalation verabreicht. Einige der unten beschriebenen pharmakokinetischen Daten wurden mit höheren Dosen als für die Therapie empfohlen erhalten. Eine spezielle pharmakokinetische Studie bei Patienten mit COPD, in der einmal täglich Tiotropium aus dem RESPIMAT-Inhalator (5 µg) und als Inhalationspulver (18 µg) aus dem HANDIHALER-Gerät untersucht wurde, ergab eine ähnliche systemische Exposition zwischen den beiden Produkten.
Absorption
Nach Inhalation des Trockenpulvers durch junge gesunde Freiwillige deutet die absolute Bioverfügbarkeit von 19,5 % darauf hin, dass die Fraktion, die die Lunge erreicht, hochgradig bioverfügbar ist. Orale Lösungen von Tiotropium haben eine absolute Bioverfügbarkeit von 2-3 %. Es ist nicht zu erwarten, dass Nahrung die Resorption von Tiotropium beeinflusst. Maximale Tiotropium-Plasmakonzentrationen wurden 7 Minuten nach der Inhalation beobachtet.
Verteilung
Tiotropium wird zu 72 % an Plasmaproteine gebunden und hatte nach intravenöser Verabreichung an junge gesunde Probanden ein Verteilungsvolumen von 32 l/kg. Lokale Konzentrationen in der Lunge sind nicht bekannt, aber die Art der Verabreichung lässt auf wesentlich höhere Konzentrationen in der Lunge schließen. Studien an Ratten haben gezeigt, dass Tiotropium die Blut-Hirn-Schranke nicht leicht durchdringt.
Beseitigung
Die terminale Halbwertszeit von Tiotropium bei COPD-Patienten nach einmal täglicher Inhalation von 5 µg Tiotropium betrug etwa 25 Stunden. Die Gesamtclearance betrug nach intravenöser Verabreichung bei jungen gesunden Probanden 880 ml/min. Nach chronischer einmal täglicher Trockenpulverinhalation bei COPD-Patienten wurde der pharmakokinetische Steady State am Tag 7 erreicht, ohne dass es danach zu einer Akkumulation kam.
Stoffwechsel
Der Umfang des Stoffwechsels ist gering. Dies geht aus einer Urinausscheidung von 74 % unveränderter Substanz nach intravenöser Gabe an junge gesunde Probanden hervor. Tiotropium, ein Ester, wird nichtenzymatisch in den Alkohol N-Methylscopin und Dithienylglykolsäure gespalten, die beide nicht an Muskarinrezeptoren binden.
In-vitro-Experimente mit menschlichen Lebermikrosomen und menschlichen Hepatozyten deuten darauf hin, dass ein Bruchteil der verabreichten Dosis (74 % einer intravenösen Dosis werden unverändert im Urin ausgeschieden, 25 % verbleiben für den Metabolismus) durch Cytochrom-P450-abhängige Oxidation und anschließende Glutathion-Konjugation metabolisiert wird zu einer Vielzahl von Phase-II-Metaboliten. Dieser enzymatische Weg kann durch CYP450 2D6- und 3A4-Inhibitoren wie Chinidin, Ketoconazol und Gestoden gehemmt werden. Somit sind CYP450 2D6 und 3A4 an dem Stoffwechselweg beteiligt, der für die Elimination eines kleinen Teils der verabreichten Dosis verantwortlich ist. In-vitro-Studien mit menschlichen Lebermikrosomen zeigten, dass Tiotropium in supratherapeutischen Konzentrationen CYP450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 oder 3A4 nicht hemmte.
Ausscheidung
Intravenös verabreichtes Tiotropiumbromid wird hauptsächlich unverändert im Urin ausgeschieden (74 %). Nach Inhalation von Trockenpulver bei COPD-Patienten im Steady State betrug die Urinausscheidung 7 % (1,3 Mikrogramm) der unveränderten Dosis über 24 Stunden. Die renale Clearance von Tiotropium übersteigt die Kreatinin-Clearance, was auf eine Ausscheidung in den Urin hindeutet.
Spezifische Populationen
Geriatrische Patienten
Wie für alle überwiegend renal ausgeschiedenen Arzneimittel zu erwarten, war mit fortschreitendem Alter eine Abnahme der renalen Clearance von Tiotropium verbunden (365 ml/min bei COPD-Patienten
Nierenfunktionsstörung
Nach 4-wöchiger Gabe von SPIRIVA 9 µg HANDIHALER oder SPIRIVA 9 µg RESPIMAT einmal täglich bei Patienten mit COPD führte eine leichte Nierenfunktionsstörung (Kreatinin-Clearance 60-
Leberfunktionsstörung
Die Auswirkungen einer Leberfunktionsstörung auf die Pharmakokinetik von Tiotropium wurden nicht untersucht.
Wechselwirkungen mit anderen Medikamenten
Es wurde eine Wechselwirkungsstudie mit Tiotropium (14,4 µg intravenöse Infusion über 15 Minuten) und Cimetidin 400 mg dreimal täglich oder Ranitidin 300 mg einmal täglich durchgeführt. Die gleichzeitige Gabe von Cimetidin und Tiotropium führte zu einem Anstieg der AUC0-4h um 20 %, einer Abnahme der renalen Clearance von Tiotropium um 28 % und keiner signifikanten Veränderung der Cmax und der über 96 Stunden im Urin ausgeschiedenen Menge. Die gleichzeitige Anwendung von Tiotropium mit Ranitidin hatte keinen Einfluss auf die Pharmakokinetik von Tiotropium.
Häufige Begleitmedikationen (langwirksame beta2-adrenerge Agonisten (LABA), inhalative Kortikosteroide (ICS)), die von Patienten mit COPD angewendet wurden, veränderten die Tiotropium-Exposition nicht.
Klinische Studien
Das klinische Entwicklungsprogramm von SPIRIVA 9 µg HANDIHALER (Tiotropiumbromid-Pulver zur Inhalation) bestand aus sechs Phase-3-Studien mit 2.663 Patienten mit COPD (1.308 erhielten SPIRIVA 9 µg HANDIHALER): zwei placebokontrollierte Studien über 1 Jahr, zwei placebokontrollierte Studien über 6 Monate Studien und zwei 1-jährige, Ipratropium-kontrollierte Studien. In diese Studien wurden Patienten aufgenommen, die eine klinische COPD-Diagnose hatten, 40 Jahre oder älter waren, in der Vorgeschichte mehr als 10 Packungsjahre geraucht hatten und ein forciertes Ausatmungsvolumen in einer Sekunde (FEV1) von weniger als oder gleich 60 % aufwiesen. oder 65 % des Sollwerts und ein Verhältnis von FEV1/FVC von kleiner oder gleich 0,7.
In diesen Studien bewirkte SPIRIVA HANDIHALER, einmal täglich morgens verabreicht, eine Verbesserung der Lungenfunktion (FEV1), wobei die maximale Wirkung innerhalb von 3 Stunden nach der ersten Dosis eintrat.
Zwei weitere Studien untersuchten Exazerbationen: eine 6-monatige, randomisierte, doppelblinde, placebokontrollierte, multizentrische klinische Studie mit 1829 COPD-Patienten in einer US-amerikanischen Veterans Affairs-Umgebung und eine 4-jährige, randomisierte, doppelblinde, placebokontrollierte, multizentrische, klinische Studie mit 5992 COPD-Patienten. Langzeitwirkungen auf die Lungenfunktion und andere Ergebnisse wurden ebenfalls in der 4-jährigen multizentrischen Studie bewertet.
Auswirkungen von 6 Monaten bis 1 Jahr auf die Lungenfunktion
In den placebokontrollierten 1-Jahres-Studien betrug die mittlere Verbesserung des FEV1 nach 30 Minuten 0,13 Liter (13 %) mit einer Spitzenverbesserung von 0,24 Liter (24 %) im Vergleich zum Ausgangswert nach der ersten Dosis (Tag 1). Weitere Verbesserungen des FEV1 und der forcierten Vitalkapazität (FVC) wurden mit einem pharmakodynamischen Steady State beobachtet, der bei einmal täglicher Behandlung an Tag 8 erreicht wurde. Die mittlere maximale Verbesserung des FEV1 im Vergleich zum Ausgangswert betrug 0,28 bis 0,31 Liter (28 % bis 31 %) nach 1 Woche (Tag 8) einmal täglicher Behandlung. Die Verbesserung der Lungenfunktion wurde nach einer Einzeldosis 24 Stunden lang aufrechterhalten und über den 1-jährigen Behandlungszeitraum durchgehend ohne Anzeichen einer Toleranz aufrechterhalten.
In den beiden 6-monatigen placebokontrollierten Studien wurden serielle spirometrische Auswertungen während der Tageszeit in Studie A (12 Stunden) durchgeführt und in Studie B auf 3 Stunden begrenzt. Die seriellen FEV1-Werte über 12 Stunden (Studie A) werden in angezeigt Abbildung 1. Diese Studien untermauern die Verbesserung der Lungenfunktion (FEV1) mit SPIRIVA 9 mcg HANDIHALER, die über den spirometrischen Beobachtungszeitraum anhielt. Die Wirksamkeit wurde für 24 Stunden nach der Verabreichung über den 6-monatigen Behandlungszeitraum aufrechterhalten.
Abbildung 1: Mittleres FEV1 im Zeitverlauf (vor und nach Verabreichung des Studienmedikaments) an den Tagen 1 und 169 für Studie A (eine sechsmonatige placebokontrollierte Studie)* 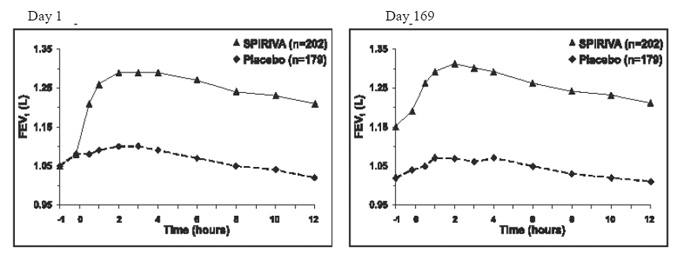
*Mittelwerte, bereinigt um Zentrum, Behandlung und Basislinieneffekt. An Tag 169 schlossen insgesamt 183 bzw. 149 Patienten in der SPIRIVA HANDIHALER- bzw. Placebo-Gruppe die Studie ab. Die Daten für die verbleibenden Patienten wurden unter Verwendung der letzten Beobachtung oder der ungünstigsten Beobachtung, die fortgeschrieben wurde, imputiert.
Die Ergebnisse jeder der Ipratropium-kontrollierten 1-Jahres-Studien waren den Ergebnissen der 1-Jahres-Placebo-kontrollierten Studien ähnlich. Die Ergebnisse einer dieser Studien sind in Abbildung 2 dargestellt.
Abbildung 2: Mittleres FEV1 über die Zeit (0 bis 6 Stunden nach der Dosis) an den Tagen 1 und 92, jeweils für eine der beiden Ipratropium-kontrollierten Studien* 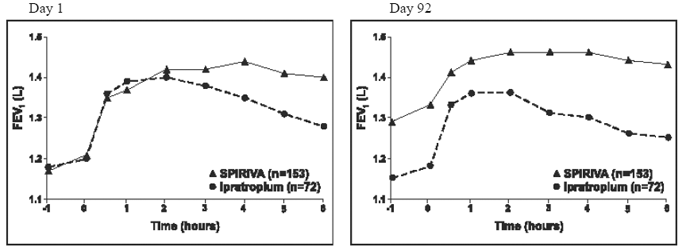
*Mittelwerte, bereinigt um Zentrum, Behandlung und Basislinieneffekt. An Tag 92 (primärer Endpunkt) schlossen insgesamt 151 bzw. 69 Patienten in der SPIRIVA HANDIHALER- bzw. Ipratropium-Gruppe die 3-monatige Beobachtung ab. Die Daten für die verbleibenden Patienten wurden unter Verwendung der letzten Beobachtung oder der ungünstigsten Beobachtung, die fortgeschrieben wurde, imputiert.
Eine randomisierte, placebokontrollierte klinische Studie an 105 COPD-Patienten zeigte, dass die Bronchodilatation im Vergleich zu Placebo über das gesamte 24-stündige Dosierungsintervall aufrechterhalten wurde, unabhängig davon, ob SPIRIVA 9 µg HANDIHALER morgens oder abends verabreicht wurde.
In den beiden Placebo-kontrollierten Studien hatten die Patienten, die SPIRIVA 9 mcg HANDIHALER einnahmen, in jeder Woche des einjährigen Behandlungszeitraums einen geringeren Bedarf an kurz wirkenden Beta2-Agonisten zur Notfallbehandlung. In einer der beiden 6-Monats-Studien wurde im Vergleich zu Placebo eine Verringerung der Anwendung kurz wirksamer Beta2-Agonisten als Notfallbehandlung nachgewiesen.
4-Jahres-Auswirkungen auf die Lungenfunktion
Eine 4-jährige, randomisierte, doppelblinde, placebokontrollierte, multizentrische klinische Studie mit 5992 COPD-Patienten wurde durchgeführt, um die langfristigen Wirkungen von SPIRIVA HANDIHALER auf das Fortschreiten der Krankheit (Abnahmerate von FEV1) zu bewerten. Die Patienten durften alle Atemwegsmedikamente (einschließlich kurz- und langwirksamer Beta-Agonisten, inhalative und systemische Steroide und Theophylline) mit Ausnahme von inhalativen Anticholinergika verwenden. Die Patienten waren 40 bis 88 Jahre alt, 75 % männlich und zu 90 % Kaukasier mit einer COPD-Diagnose und einem mittleren FEV1 vor Bronchodilatation von 39 % (Bereich = 9 % bis 76 %) bei Studieneintritt. Es gab keinen Unterschied zwischen den Gruppen bei einem der co-primären Wirksamkeitsendpunkte, der jährlichen Abnahmerate des FEV1 vor und nach der Bronchodilatation, wie durch ähnliche Steigungen der FEV1-Abnahme im Laufe der Zeit gezeigt wurde (Abbildung 3).
SPIRIVA HANDIHALER hielt die Verbesserungen des FEV1-Talwerts (vor der Verabreichung) (angepasster Mittelwert im Laufe der Zeit: 87 bis 103 ml) während der 4 Jahre der Studie aufrecht (Abbildung 3).
Abbildung 3: FEV1-Mittelwerte (vor der Dosis) zu jedem Zeitpunkt 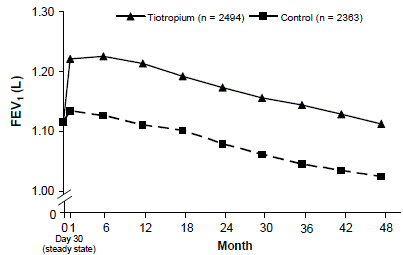
ANOVA mit wiederholter Messung wurde verwendet, um Mittelwerte abzuschätzen. Die Mittelwerte werden für Basislinienmessungen angepasst. Baseline-Tal-FEV1 (beobachteter Mittelwert) = 1,12. Patienten mit ≥3 akzeptablen Lungenfunktionstests nach Tag 30 und einem nicht fehlenden Ausgangswert wurden in die Analyse eingeschlossen.
Exazerbationen
Die Wirkung von SPIRIVA 9 mcg HANDIHALER auf COPD-Exazerbationen wurde in zwei klinischen Studien untersucht: einer oben beschriebenen 4-jährigen klinischen Studie und einer 6-monatigen klinischen Studie mit 1829 COPD-Patienten in einer Veterans Affairs-Umgebung. In der 6-monatigen Studie wurden COPD-Exazerbationen als ein Komplex von respiratorischen Symptomen (Zunahme oder Neuauftreten) von mehr als einem der folgenden definiert: Husten, Auswurf, Keuchen, Dyspnoe oder Engegefühl in der Brust mit einer Dauer von mindestens 3 Tagen die eine Behandlung mit Antibiotika, systemischen Steroiden oder einen Krankenhausaufenthalt erfordern. Die Bevölkerung war zwischen 40 und 90 Jahre alt, wobei 99 % Männer, 91 % Kaukasier waren, und hatte COPD mit einem erwarteten mittleren FEV1-Prozentsatz vor Bronchodilatation von 36 % (Bereich = 8 % bis 93 %). Die Patienten durften neben inhalativen Anticholinergika auch Atemwegsmedikamente (einschließlich kurz- und langwirksamer Beta-Agonisten, inhalative und systemische Steroide und Theophylline) anwenden. In der 6-monatigen Studie waren die co-primären Endpunkte der Anteil der Patienten mit einer COPD-Exazerbation und der Anteil der Patienten mit Krankenhausaufenthalt aufgrund einer COPD-Exazerbation. SPIRIVA 9 mcg HANDIHALER reduzierte den Anteil der COPD-Patienten, bei denen Exazerbationen auftraten, im Vergleich zu Placebo signifikant (27,9 % vs. 32,3 %; Odds Ratio (OR) (Tiotropium/Placebo) = 0,81; 95 %-KI = 0,66; 0,99; p = 0,037). ). Der Anteil der Patienten, die aufgrund von COPD-Exazerbationen ins Krankenhaus eingeliefert wurden, betrug bei Patienten, die SPIRIVA 9 mcg HANDIHALER verwendeten, im Vergleich zu Placebo 7,0 % vs. 9,5 %; ODER = 0,72; 95 % KI = 0,51, 1,01; p = 0,056.
Exazerbationen wurden als sekundärer Endpunkt in der 4-jährigen multizentrischen Studie ausgewertet. In dieser Studie wurden COPD-Exazerbationen definiert als eine Zunahme oder ein erneutes Auftreten von mehr als einem der folgenden Atemwegssymptome (Husten, Auswurf, Auswurfeiterung, Keuchen, Atemnot) mit einer Dauer von drei oder mehr Tagen, die eine Behandlung mit Antibiotika und/oder erfordern systemische (orale, intramuskuläre oder intravenöse) Steroide. SPIRIVA HANDIHALER reduzierte signifikant das Risiko einer Exazerbation um 14 % (Hazard Ratio (HR) = 0,86; 95 % KI = 0,81, 0,91; p
Gesamtmortalität
In der oben beschriebenen 4-jährigen placebokontrollierten Lungenfunktionsstudie wurde die Gesamtmortalität im Vergleich zu Placebo bewertet. Es gab keine signifikanten Unterschiede in der Gesamtsterblichkeitsrate zwischen SPIRIVA 9 mcg HANDIHALER und Placebo.
Die Gesamtmortalität von SPIRIVA HANDIHALER wurde auch mit Tiotropium-Inhalationsspray 5 µg (SPIRIVA RESPIMAT 5 µg) in einer zusätzlichen randomisierten, doppelblinden, aktiv kontrollierten Double-Dummy-Studie mit einem Beobachtungszeitraum von bis zu 3 Jahren verglichen. Die Gesamtmortalität war bei SPIRIVA 9 mcg HANDIHALER und SPIRIVA RESPIMAT ähnlich.
INFORMATIONEN ZUM PATIENTEN
SPIRIVA 9mcgR® (speh REE vah) HANDIHALER® (Tiotropiumbromid) Pulver zur Inhalation zur oralen Inhalation
SPIRIVA-Kapseln NICHT schlucken.
Wichtige Informationen: SPIRIVA-Kapseln nicht schlucken. SPIRIVA 9 mcg-Kapseln sollten nur mit dem HANDIHALER-Gerät verwendet und durch den Mund inhaliert werden (orale Inhalation).
Lesen Sie die Informationen, die Ihrem SPIRIVA HANDIHALER beiliegen, bevor Sie ihn verwenden und jedes Mal, wenn Sie Ihr Rezept nachfüllen. Möglicherweise gibt es neue Informationen. Diese Packungsbeilage ersetzt nicht das Gespräch mit Ihrem Arzt über Ihren Gesundheitszustand oder Ihre Behandlung.
Was ist SPIRIVA HANDIHALER?
SPIRIVA 9mcg HANDIHALER ist kein Notfallarzneimittel und sollte nicht zur Behandlung von plötzlichen Atemproblemen verwendet werden. Ihr Arzt kann Ihnen andere Arzneimittel zur Anwendung bei plötzlichen Atemproblemen verschreiben.
Es ist nicht bekannt, ob SPIRIVA 9mcg HANDIHALER bei Kindern sicher und wirksam ist.
Wer sollte SPIRIVA 9mcg HANDIHALER nicht einnehmen?
Verwenden Sie SPIRIVA 9mcg HANDIHALER nicht, wenn Sie:
Zu den Symptomen einer schweren allergischen Reaktion auf SPIRIVA 9mcg HANDIHALER können gehören:
Wenn Sie diese Symptome einer allergischen Reaktion haben, beenden Sie die Einnahme von SPIRIVA HANDIHALER und rufen Sie sofort Ihren Arzt an oder suchen Sie die Notaufnahme des nächstgelegenen Krankenhauses auf.
Was sollte ich meinem Arzt vor der Anwendung von SPIRIVA HANDIHALER mitteilen?
Informieren Sie Ihren Arzt vor der Einnahme von SPIRIVA HANDIHALER über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel und Augentropfen, Vitamine und Kräuterergänzungen. Einige Ihrer anderen Arzneimittel oder Nahrungsergänzungsmittel können die Wirkungsweise von SPIRIVA HANDIHALER beeinflussen. SPIRIVA 9mcg HANDIHALER ist ein Anticholinergikum. Sie sollten während der Anwendung von SPIRIVA 9mcg HANDIHALER keine anderen Anticholinergika einnehmen, einschließlich Ipratropium. Fragen Sie Ihren Arzt oder Apotheker, wenn Sie sich nicht sicher sind, ob eines Ihrer Arzneimittel ein Anticholinergikum ist.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste Ihrer Arzneimittel mit sich, damit Sie sie Ihrem Arzt und Apotheker zeigen können, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich SPIRIVA 9mcg HANDIHALER einnehmen?
Was sollte ich bei der Anwendung von SPIRIVA 9mcg HANDIHALER vermeiden?
Welche Nebenwirkungen kann SPIRIVA HANDIHALER haben?
SPIRIVA 9mcg HANDIHALER kann schwerwiegende Nebenwirkungen hervorrufen, darunter: Allergische Reaktionen. Zu den Symptomen können gehören:
Wenn Sie diese Symptome einer allergischen Reaktion haben, beenden Sie die Einnahme von SPIRIVA HANDIHALER und rufen Sie sofort Ihren Arzt an oder suchen Sie die Notaufnahme des nächstgelegenen Krankenhauses auf.
Wenn Sie diese Symptome eines Bronchospasmus haben, beenden Sie die Einnahme von SPIRIVA 9 mcg HANDIHALER und rufen Sie sofort Ihren Arzt an oder suchen Sie die Notaufnahme des nächstgelegenen Krankenhauses auf.
Die alleinige Anwendung von Augentropfen zur Behandlung dieser Symptome funktioniert möglicherweise nicht. Wenn Sie diese Symptome haben, beenden Sie die Einnahme von SPIRIVA HANDIHALER und rufen Sie sofort Ihren Arzt an.
Wenn Sie diese Symptome einer Harnverhaltung haben, beenden Sie die Einnahme von SPIRIVA HANDIHALER und wenden Sie sich sofort an Ihren Arzt.
Andere Nebenwirkungen von SPIRIVA 9mcg HANDIHALER umfassen:
Dies sind nicht alle möglichen Nebenwirkungen von SPIRIVA HANDIHALER. Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist SPIRIVA HANDIHALER aufzubewahren?
Fragen Sie Ihren Arzt oder Apotheker, wenn Sie Fragen zur Aufbewahrung Ihrer SPIRIVA 9mcg-Kapseln haben.
Bewahren Sie SPIRIVA HANDIHALER, SPIRIVA 9-mcg-Kapseln und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen über SPIRIVA HANDIHALER
Arzneimittel werden manchmal für andere als die in den Packungsbeilagen aufgeführten Zwecke verschrieben. Verwenden Sie SPIRIVA 9mcg HANDIHALER nicht für einen Zweck, für den es nicht verschrieben wurde. Geben Sie SPIRIVA HANDIHALER nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Für weitere Informationen über SPIRIVA HANDIHALER sprechen Sie mit Ihrem Arzt. Sie können Ihren Arzt oder Apotheker um Informationen über SPIRIVA 9mcg HANDIHALER bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Weitere Informationen über SPIRIVA 9mcg HANDIHALER erhalten Sie unter www.SPIRIVA.com, oder scannen Sie den Code unten oder rufen Sie Boehringer Ingelheim Pharmaceuticals, Inc. unter 1-800-542-6257 oder (TTY) 1-800-459-9906 an.
Was sind die Inhaltsstoffe von SPIRIVA 9mcg HANDIHALER?
Wirkstoff: Tiotropium
Inaktiver Inhaltsstoff: Lactose-Monohydrat
Was ist COPD (chronisch obstruktive Lungenerkrankung)?
COPD ist eine schwere Lungenerkrankung, die chronische Bronchitis, Emphysem oder beides umfasst. Die meisten COPD werden durch Rauchen verursacht. Wenn Sie COPD haben, verengen sich Ihre Atemwege. Die Luft strömt also langsamer aus Ihren Lungen. Dadurch wird das Atmen erschwert.
Diese Patienteninformation wurde von der US Food and Drug Administration genehmigt.
GEBRAUCHSANWEISUNGSPIRIVA® (speh REE vah) HANDIHALER® (Tiotropiumbromid) Pulver zur Inhalation zur oralen Inhalation
SPIRIVA-Kapseln nicht schlucken.
Wichtige Informationen zur Verwendung Ihres SPIRIVA HANDIHALER
Lesen Sie zuerst die Patienteninformationen und dann diese Gebrauchsanweisung, bevor Sie mit der Anwendung von SPIRIVA HANDIHALER beginnen und jedes Mal, wenn Sie Ihr Rezept nachfüllen. Möglicherweise gibt es neue Informationen.
Machen Sie sich mit Ihrem HANDIHALER-Gerät und den SPIRIVA-Kapseln vertraut:
Ihr SPIRIVA HANDIHALER wird mit SPIRIVA 9 mcg-Kapseln in Blisterverpackung und einem HANDIHALER-Gerät geliefert. Verwenden Sie das mit Ihrem Arzneimittel gelieferte neue HANDIHALER-Gerät.
Zu den Teilen Ihres HANDIHALER-Geräts gehören:
(Siehe Abbildung A)
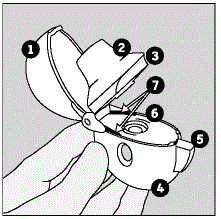
Abbildung A
Jede SPIRIVA 9mcg-Kapsel ist in einer Blisterpackung verpackt. (Siehe Abbildung B)
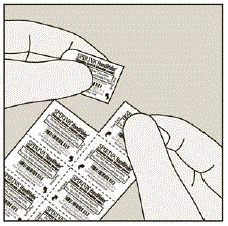
Abbildung B

Abbildung C
Die Einnahme Ihrer vollständigen Tagesdosis des Arzneimittels erfordert 4 Hauptschritte.
Schritt 1. Öffnen Ihres HANDIHALER-Geräts:
Nachdem Sie Ihr HANDIHALER-Gerät aus dem Beutel genommen haben:
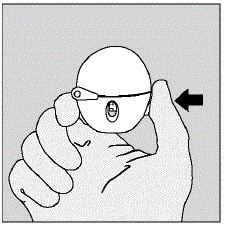
Abbildung D
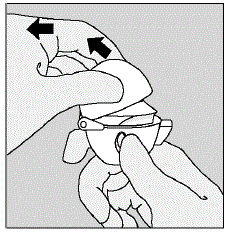
Abbildung E

Abbildung F
Schritt 2. Einsetzen der SPIRIVA 9mcg-Kapsel in Ihr HANDIHALER-Gerät:
Trennen Sie jeden Tag nur 1 Blister von der Blisterkarte, indem Sie ihn entlang der perforierten Linie abreißen. (Siehe Abbildung G)
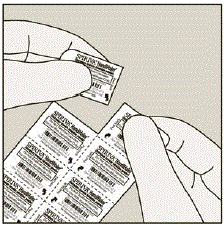
Abbildung G
Entfernen Sie die SPIRIVA-Kapsel aus der Blisterpackung:
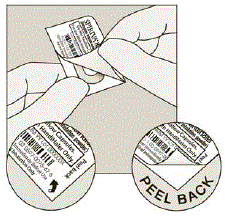
Abbildung H
Legen Sie die SPIRIVA-9-mcg-Kapsel in die mittlere Kammer Ihres HANDIHALER-Geräts. (Siehe Abbildung I)
Abbildung I
Schließen Sie das Mundstück fest gegen die graue Basis, bis Sie ein Klicken hören. Lassen Sie die Staubkappe (Deckel) geöffnet. (Siehe Abbildung J)
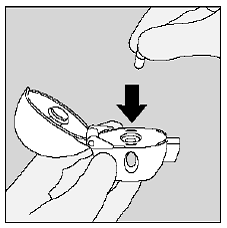
Abbildung J
Schritt 3. Durchstechen der SPIRIVA 9mcg-Kapsel:
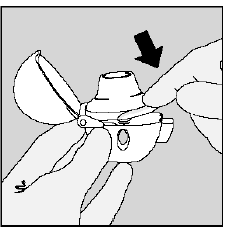
Abbildung K
Schritt 4. Einnahme Ihrer vollen Tagesdosis (2 Inhalationen aus derselben SPIRIVA 9-mcg-Kapsel):
Atmen Sie in einem Atemzug vollständig aus, Entleeren Sie Ihre Lungen von jeglicher Luft. (Siehe Abbildung L)
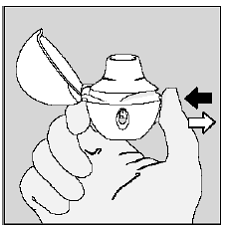
Abbildung L
Wichtig: Nicht Atmen Sie in Ihr HANDIHALER-Gerät ein.
Nehmen Sie mit Ihrem nächsten Atemzug Ihre Medizin ein:
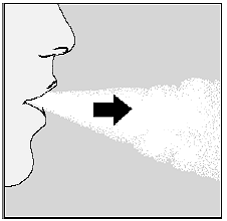
Abbildung M
Die Rassel signalisiert Ihnen, dass Sie richtig eingeatmet haben. Wenn Sie kein Rasseln hören oder fühlen, lesen Sie den Abschnitt „Wenn Sie beim Einatmen Ihres Arzneimittels kein Rasseln der SPIRIVA-Kapsel hören oder fühlen“.
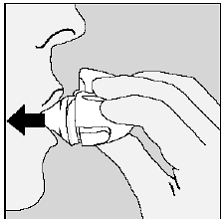
Abbildung N
Um Ihre volle Tagesdosis zu erhalten, müssen Sie aus derselben SPIRIVA-Kapsel erneut vollständig ausatmen (siehe Abbildung N) und ein zweites Mal einatmen (siehe Abbildung O).
Wichtig: Nicht Drücken Sie erneut die grüne Durchstechtaste.
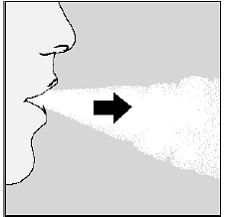
Abbildung O
Denken Sie daran: Um Ihre volle Arzneimitteldosis jeden Tag zu erhalten, müssen Sie zweimal aus derselben SPIRIVA 9-mcg-Kapsel einatmen. Achten Sie darauf, dass Sie jedes Mal vollständig ausatmen, bevor Sie mit Ihrem HANDIHALER-Gerät einatmen.
Pflege und Aufbewahrung Ihres SPIRIVA HANDIHALER:
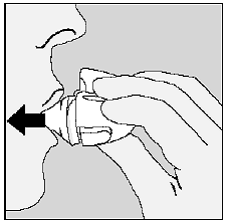
Abbildung P
Wenn Sie die SPIRIVA 9mcg-Kapsel beim Einatmen Ihres Arzneimittels nicht hören oder fühlen:
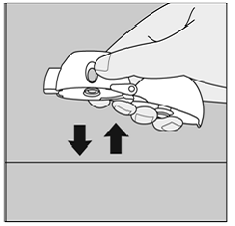
Abbildung Q
Unterlassen Sie Drücken Sie erneut die grüne Durchstechtaste.
Halten Sie Ihr HANDIHALER-Gerät mit dem Mundstück nach oben und klopfen Sie Ihr HANDIHALER-Gerät sanft auf einen Tisch. (Siehe Abbildung Q)
Überprüfen Sie, ob das Mundstück vollständig geschlossen ist. Atmen Sie vollständig aus, bevor Sie mit dem Mundstück im Mund wieder tief einatmen. (Siehe Abbildung O)
Wenn Sie nach Wiederholung der obigen Schritte immer noch kein Rasseln der SPIRIVA-Kapsel hören oder fühlen:
Reinigung Ihres HANDIHALER-Geräts:
Reinigen Sie Ihr HANDIHALER-Gerät nach Bedarf. (Siehe Abbildung R)
Reinigungsschritte:
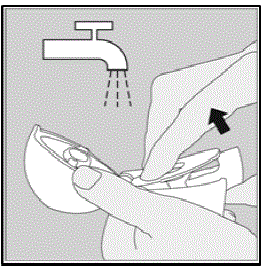
Abbildung R
Hilfreiche Tipps, um sicherzustellen, dass Sie Ihre volle Tagesdosis SPIRIVA 9 mcg HANDIHALER richtig einnehmen:
Wenden Sie sich für weitere Informationen an Ihren Arzt oder Apotheker oder gehen Sie zu www.spiriva.com, scannen Sie den Code unten oder rufen Sie 1-800-542-6257 oder (TTY) 1-800-459-9906 an.
Diese Gebrauchsanweisung wurde von der US Food and Drug Administration genehmigt.