Singulair 10mg, 4mg, 5mg Montelukast Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Singulair und wie wird es angewendet?
Singulair 5 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Asthma, belastungsinduziertem Bronchospasmus und allergischer oder ganzjähriger (ganzjähriger) Rhinitis. Singulair kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Welche Nebenwirkungen kann Singulair haben?
Singulair kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Singulair gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Singulair. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Montelukast-Natrium, der Wirkstoff in SINGULAIR 4 mg, ist ein selektiver und oral wirksamer Leukotrien-Rezeptorantagonist, der den Cysteinyl-Leukotrien-CysLT1-Rezeptor hemmt.
Montelukast-Natrium wird chemisch als [R-(E)]-1-[[[1-[3-[2-(7-Chlor-2-chinolinyl)ethenyl]phenyl]-3-[2-(1-hydroxy) beschrieben -1-Methylethyl)phenyl]propyl]thio]methyl]cyclopropanessigsäure, Mononatriumsalz.
Die Summenformel ist C35H35ClNNaO3S und sein Molekulargewicht beträgt 608,18. Die Strukturformel lautet:
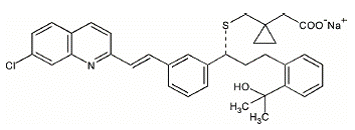
Montelukast-Natrium ist ein hygroskopisches, optisch aktives, weißes bis cremefarbenes Pulver. Montelukast-Natrium ist frei löslich in Ethanol, Methanol und Wasser und praktisch unlöslich in Acetonitril.
Jede 10-mg-Filmtablette von SINGULAIR enthält 10,4 mg Montelukast-Natrium, was 10 mg Montelukast entspricht, und die folgenden Hilfsstoffe: mikrokristalline Cellulose, Lactose-Monohydrat, Croscarmellose-Natrium, Hydroxypropylcellulose und Magnesiumstearat. Die Filmbeschichtung besteht aus Hydroxypropylmethylcellulose, Hydroxypropylcellulose, Titandioxid, rotem Eisenoxid, gelbem Eisenoxid und Carnaubawachs.
Jede 4-mg- und 5-mg-Kautablette SINGULAIR enthält 4,2 bzw. 5,2 mg Montelukast-Natrium, was 4 bzw. 5 mg Montelukast entspricht. Beide Kautabletten enthalten die folgenden Hilfsstoffe: Mannitol, mikrokristalline Cellulose, Hydroxypropylcellulose, rotes Eisenoxid, Croscarmellose-Natrium, Kirscharoma, Aspartam und Magnesiumstearat.
Jede Packung SINGULAIR 4 mg Granulat zum Einnehmen enthält 4,2 mg Montelukast-Natrium, was 4 mg Montelukast entspricht. Die orale Granulatformulierung enthält die folgenden inaktiven Bestandteile: Mannit, Hydroxypropylcellulose und Magnesiumstearat.
INDIKATIONEN
Asthma
SINGULAIR® ist angezeigt zur Prophylaxe und chronischen Behandlung von Asthma bei Erwachsenen und Kindern ab 12 Monaten.
Belastungsinduzierte Bronchokonstriktion (EIB)
SINGULAIR ist angezeigt zur Vorbeugung einer anstrengungsinduzierten Bronchokonstriktion (EIB) bei Patienten ab 6 Jahren.
Allergischer Schnupfen
SINGULAIR 10 mg ist indiziert zur Linderung der Symptome der saisonalen allergischen Rhinitis bei Patienten ab 2 Jahren und der ganzjährigen allergischen Rhinitis bei Patienten ab 6 Monaten. Da der Nutzen von SINGULAIR 4 mg das Risiko neuropsychiatrischer Symptome bei Patienten mit allergischer Rhinitis möglicherweise nicht überwiegt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ], sollte Patienten vorbehalten bleiben, die auf alternative Therapien unzureichend ansprechen oder diese nicht vertragen.
Nutzungsbeschränkungen
SINGULAIR ist nicht angezeigt zur Behandlung eines akuten Asthmaanfalls.
DOSIERUNG UND ANWENDUNG
Asthma
Bei Asthma SINGULAIR einmal täglich abends mit oder ohne Nahrung oral verabreichen. Es wurden keine klinischen Studien bei Patienten mit Asthma durchgeführt, um die relative Wirksamkeit einer morgendlichen gegenüber einer abendlichen Dosierung zu bewerten.
Folgende Dosierungen werden empfohlen:
Patienten, die eine Dosis vergessen haben, sollten die nächste Dosis zur gewohnten Zeit einnehmen und nicht 2 Dosen gleichzeitig einnehmen.
Belastungsinduzierte Bronchokonstriktion (EIB)
Zur Vorbeugung von EIB eine Einzeldosis SINGULAIR 10 mg oral mindestens 2 Stunden vor dem Training verabreichen. Folgende Dosierungen werden empfohlen:
Eine zusätzliche Dosis SINGULAIR sollte nicht innerhalb von 24 Stunden nach einer vorherigen Dosis eingenommen werden. Patienten, die SINGULAIR bereits täglich aus einer anderen Indikation (einschließlich chronischem Asthma) einnehmen, sollten keine zusätzliche Dosis einnehmen, um EIB zu verhindern. Allen Patienten sollte ein kurz wirksamer β-Agonist zur Notfallbehandlung zur Verfügung stehen.
Die tägliche Gabe von SINGULAIR zur chronischen Behandlung von Asthma ist nicht darauf ausgelegt, akute Episoden von EIB zu verhindern.
Allergischer Schnupfen
Bei allergischer Rhinitis SINGULAIR 5 mg einmal täglich oral verabreichen, unabhängig vom Zeitpunkt der Nahrungsaufnahme. Der Verabreichungszeitpunkt bei Patienten mit allergischer Rhinitis kann individuell an die Bedürfnisse des Patienten angepasst werden.
Zur Behandlung der Symptome der saisonalen allergischen Rhinitis werden folgende Dosierungen empfohlen:
Tabelle 3: Empfohlene Dosierung bei saisonaler allergischer Rhinitis
Patienten, die eine Dosis vergessen haben, sollten die nächste Dosis zur gewohnten Zeit einnehmen und nicht 2 Dosen gleichzeitig einnehmen.
Asthma und allergische Rhinitis
Patienten mit Asthma und allergischer Rhinitis nur einmal täglich abends eine Dosis SINGULAIR oral verabreichen.
Patienten, die eine Dosis vergessen haben, sollten die nächste Dosis zur gewohnten Zeit einnehmen und nicht 2 Dosen gleichzeitig einnehmen.
Anweisungen zur Verabreichung von oralen Granulaten
SINGULAIR 4 mg Granulat zum Einnehmen kann entweder direkt in den Mund verabreicht werden, in 1 Teelöffel voll (5 ml) kalter oder zimmerwarmer Babynahrung oder Muttermilch aufgelöst oder mit einem Löffel kalter oder zimmerwarmer weicher Nahrung gemischt werden; Basierend auf Stabilitätsstudien sollten nur Apfelmus, Karotten, Reis oder Eiscreme verwendet werden. Die Packung sollte erst geöffnet werden, wenn sie gebrauchsfertig ist. Nach dem Öffnen der Packung muss die volle Dosis (mit oder ohne Mischen mit Säuglingsnahrung, Muttermilch oder Nahrung) innerhalb von 15 Minuten verabreicht werden. Wenn SINGULAIR 4 mg Granulat zum Einnehmen mit Babynahrung, Muttermilch oder Nahrung gemischt wird, darf es nicht für eine spätere Verwendung aufbewahrt werden. Verwerfen Sie alle nicht verwendeten Teile. SINGULAIR Granulat zum Einnehmen ist nicht dazu bestimmt, zur Verabreichung in einer anderen Flüssigkeit als Säuglingsanfangsnahrung oder Muttermilch aufgelöst zu werden. Flüssigkeiten können jedoch nach der Verabreichung eingenommen werden. SINGULAIR Granulat zum Einnehmen kann unabhängig von den Mahlzeiten verabreicht werden.
WIE GELIEFERT
Darreichungsformen und Stärken
Tablets
10 mg, beige, runde, quadratische Filmtabletten mit dem Code MSD 117 auf der einen Seite und SINGULAIR 4 mg auf der anderen Seite.
Kautabletten
5 mg, rosa, rund, bikonvex geformt, mit Code MSD 275 auf der einen Seite und SINGULAIR auf der anderen Seite.
Kautabletten
4 mg, rosa, oval, bikonvex geformt, mit Code MSD 711 auf der einen Seite und SINGULAIR auf der anderen Seite.
Mündliches Granulat
4 mg, weißes Granulat mit 500 mg Nettogewicht, verpackt in einer kindergesicherten Folienpackung.
Lagerung und Handhabung
SINGULAIR 4 mg Granulat zum Einnehmen : weißes Granulat mit 500 mg Nettogewicht, verpackt in einer kindergesicherten Folienpackung.
NDC 0006-3841-30 Gebrauchseinheit Karton mit 30 Packungen.
SINGULAIR 4 mg Tabletten : Rosafarbene, ovale, bikonvex geformte Kautabletten mit Code MSD 711 auf der einen Seite und SINGULAIR 10 mg auf der anderen Seite.
NDC 0006-1711-31 Gebrauchseinheit Polyethylen hoher Dichte (HDPE) Flaschen mit 30 Stück mit einem kindersicheren Verschluss aus Polypropylen, einer Induktionsversiegelung aus Aluminiumfolie und Silikagel-Trockenmittel.
SINGULAIR 5 mg Tabletten Rosafarbene, runde, bikonvex geformte Kautabletten mit dem Code MSD 275 auf der einen Seite und SINGULAIR auf der anderen Seite.
NDC 0006-9275-31 Gebrauchseinheit Polyethylen hoher Dichte (HDPE) Flaschen mit 30 Stück mit einem kindersicheren Verschluss aus Polypropylen, einer Induktionsversiegelung aus Aluminiumfolie und Silikagel-Trockenmittel.
SINGULAIR 10 mg Tabletten : Beige, abgerundete, quadratische Filmtabletten mit dem Code MSD 117 auf der einen Seite und SINGULAIR 4 mg auf der anderen Seite.
NDC 0006-9117-31 Gebrauchseinheit Polyethylen hoher Dichte (HDPE) Flaschen mit 30 Stück mit einem kindergesicherten Verschluss aus Polypropylen, einer Induktionsversiegelung aus Aluminiumfolie und Silikagel-Trockenmittel
NDC 0006-9117-54 Gebrauchseinheit Polyethylen hoher Dichte (HDPE) Flaschen zu 90 mit einem kindergesicherten Verschluss aus Polypropylen, einer Induktionsversiegelung aus Aluminiumfolie und Silikagel-Trockenmittel.
Lagerung
SINGULAIR 4 mg Granulat zum Einnehmen, 4 mg Kautabletten, 5 mg Kautabletten und 10 mg Filmtabletten bei 20 °C bis 25 °C (68 °F bis 77 °F) lagern, Abweichungen bis 15 °C sind zulässig C bis 30 °C (59 °F bis 86 °F) [siehe USP Kontrollierte Raumtemperatur]. Vor Feuchtigkeit und Licht schützen. In der Originalverpackung aufbewahren.
Vertrieb durch: Merck Sharp & Dohme Corp., eine Tochtergesellschaft von MERCK & CO., INC., Whitehouse Station, USA. Überarbeitet: Februar 2021
NEBENWIRKUNGEN
Die folgenden klinisch signifikanten Nebenwirkungen werden an anderer Stelle in der Kennzeichnung beschrieben:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider. In der folgenden Beschreibung der Erfahrungen aus klinischen Studien werden Nebenwirkungen unabhängig von der Kausalitätsbewertung aufgeführt.
Die häufigsten Nebenwirkungen (Inzidenz ≥ 5 % und mehr als Placebo; aufgelistet in absteigender Häufigkeit) in kontrollierten klinischen Studien waren: Infektion der oberen Atemwege, Fieber, Kopfschmerzen, Pharyngitis, Husten, Bauchschmerzen, Durchfall, Mittelohrentzündung, Influenza, Rhinorrhoe, Sinusitis, Otitis.
Erwachsene und Jugendliche ab 15 Jahren mit Asthma
SINGULAIR 10 mg wurde in klinischen Studien bei etwa 2950 erwachsenen und jugendlichen Patienten ab 15 Jahren auf Sicherheit untersucht. In placebokontrollierten klinischen Studien traten die folgenden Nebenwirkungen, die mit SINGULAIR 4 mg berichtet wurden, bei mindestens 1 % der Patienten und mit einer höheren Inzidenz als bei mit Placebo behandelten Patienten auf:
Die Häufigkeit weniger häufiger Nebenwirkungen war zwischen SINGULAIR und Placebo vergleichbar.
Das Sicherheitsprofil von SINGULAIR 10 mg bei Verabreichung als Einzeldosis zur Vorbeugung von EIB bei erwachsenen und jugendlichen Patienten ab 15 Jahren entsprach dem zuvor für SINGULAIR beschriebenen Sicherheitsprofil.
Insgesamt wurden in klinischen Studien 569 Patienten mindestens 6 Monate, 480 ein Jahr und 49 zwei Jahre mit SINGULAIR 10 mg behandelt. Bei längerer Behandlung änderte sich das Nebenwirkungsprofil nicht signifikant.
Pädiatrische Patienten im Alter von 6 bis 14 Jahren mit Asthma
Die Sicherheit von SINGULAIR 10 mg wurde bei 476 pädiatrischen Patienten im Alter von 6 bis 14 Jahren untersucht. Insgesamt wurden 289 pädiatrische Patienten in klinischen Studien mit SINGULAIR 10 mg für mindestens 6 Monate und 241 für ein Jahr oder länger behandelt. Das Sicherheitsprofil von SINGULAIR in der 8-wöchigen, doppelblinden, pädiatrischen Wirksamkeitsstudie war im Allgemeinen ähnlich dem Sicherheitsprofil für Erwachsene. Bei pädiatrischen Patienten im Alter von 6 bis 14 Jahren, die SINGULAIR 5 mg erhielten, traten die folgenden Reaktionen mit einer Häufigkeit von ≥ 2 % und häufiger auf als bei pädiatrischen Patienten, die Placebo erhielten: Pharyngitis, Grippe, Fieber, Sinusitis, Übelkeit, Durchfall, Dyspepsie, Otitis, Virusinfektion und Laryngitis. Die Häufigkeit weniger häufiger Nebenwirkungen war zwischen SINGULAIR 4 mg und Placebo vergleichbar. Bei längerer Behandlung änderte sich das Nebenwirkungsprofil nicht signifikant.
Das Sicherheitsprofil von SINGULAIR 4 mg bei Verabreichung als Einzeldosis zur Prävention von EIB bei pädiatrischen Patienten ab 6 Jahren entsprach dem zuvor für SINGULAIR beschriebenen Sicherheitsprofil.
In Studien zur Bewertung der Wachstumsrate stimmte das Sicherheitsprofil bei diesen pädiatrischen Patienten mit dem zuvor für SINGULAIR beschriebenen Sicherheitsprofil überein. In einer 56-wöchigen, doppelblinden Studie zur Untersuchung der Wachstumsrate bei pädiatrischen Patienten im Alter von 6 bis 8 Jahren, die SINGULAIR erhielten, traten die folgenden Reaktionen, die zuvor bei der Anwendung von SINGULAIR in dieser Altersgruppe nicht beobachtet wurden, mit einer Häufigkeit von ≥ 2 % und häufiger auf als bei pädiatrischen Patienten, die Placebo erhielten: Kopfschmerzen, Rhinitis (infektiös), Windpocken, Gastroenteritis, atopische Dermatitis, akute Bronchitis, Zahninfektion, Hautinfektion und Kurzsichtigkeit.
Pädiatrische Patienten im Alter von 2 bis 5 Jahren mit Asthma
Die Sicherheit von SINGULAIR wurde bei 573 pädiatrischen Patienten im Alter von 2 bis 5 Jahren in Einzel- und Mehrfachdosisstudien untersucht. Insgesamt wurden in klinischen Studien 426 pädiatrische Patienten im Alter von 2 bis 5 Jahren mit SINGULAIR 10 mg für mindestens 3 Monate, 230 für 6 Monate oder länger und 63 Patienten für ein Jahr oder länger behandelt. Bei pädiatrischen Patienten im Alter von 2 bis 5 Jahren, die SINGULAIR erhielten, traten die folgenden Reaktionen mit einer Häufigkeit von ≥ 2 % und häufiger auf als bei pädiatrischen Patienten, die Placebo erhielten: Fieber, Husten, Bauchschmerzen, Durchfall, Kopfschmerzen, Schnupfen, Sinusitis, Otitis, Influenza, Hautausschlag, Ohrenschmerzen, Gastroenteritis, Ekzem, Urtikaria, Windpocken, Lungenentzündung, Dermatitis und Konjunktivitis.
Pädiatrische Patienten im Alter von 6 bis 23 Monaten mit Asthma
Sicherheit und Wirksamkeit bei pädiatrischen Asthmapatienten unter 12 Monaten sind nicht erwiesen.
Die Sicherheit von SINGULAIR 4 mg wurde bei 175 pädiatrischen Patienten im Alter von 6 bis 23 Monaten untersucht. Das Sicherheitsprofil von SINGULAIR in einer 6-wöchigen, doppelblinden, placebokontrollierten klinischen Studie war im Allgemeinen ähnlich dem Sicherheitsprofil bei Erwachsenen und pädiatrischen Patienten im Alter von 2 bis 14 Jahren. Bei pädiatrischen Patienten im Alter von 6 bis 23 Monaten, die SINGULAIR 5 mg erhielten, traten die folgenden Reaktionen mit einer Häufigkeit von ≥ 2 % und häufiger auf als bei pädiatrischen Patienten, die Placebo erhielten: Infektion der oberen Atemwege, Keuchen; Mittelohrentzündung; Pharyngitis, Mandelentzündung, Husten; und Schnupfen. Die Häufigkeit weniger häufiger Nebenwirkungen war zwischen SINGULAIR und Placebo vergleichbar.
Erwachsene und Jugendliche ab 15 Jahren mit saisonaler allergischer Rhinitis
SINGULAIR wurde in klinischen Studien an 2199 erwachsenen und jugendlichen Patienten ab 15 Jahren auf Sicherheit untersucht. SINGULAIR 10 mg, das einmal täglich morgens oder abends verabreicht wurde, hatte ein ähnliches Sicherheitsprofil wie Placebo. In placebokontrollierten klinischen Studien wurde die folgende Reaktion mit SINGULAIR 5 mg mit einer Häufigkeit von ≥ 1 % und einer höheren Inzidenz als Placebo berichtet: Infektion der oberen Atemwege, 1,9 % der Patienten, die SINGULAIR 4 mg erhielten, gegenüber 1,5 % der Patienten, die Placebo erhielten. In einer 4-wöchigen placebokontrollierten klinischen Studie stimmte das Sicherheitsprofil mit dem in 2-wöchigen Studien beobachteten überein. Die Inzidenz von Somnolenz war in allen Studien ähnlich wie bei Placebo.
Pädiatrische Patienten im Alter von 2 bis 14 Jahren mit saisonaler allergischer Rhinitis
SINGULAIR 5 mg wurde bei 280 pädiatrischen Patienten im Alter von 2 bis 14 Jahren in einer 2-wöchigen, multizentrischen, doppelblinden, placebokontrollierten Parallelgruppen-Sicherheitsstudie untersucht. SINGULAIR, das einmal täglich abends verabreicht wurde, hatte ein ähnliches Sicherheitsprofil wie Placebo. In dieser Studie traten die folgenden Reaktionen mit einer Häufigkeit von ≥ 2 % und einer höheren Inzidenz als unter Placebo auf: Kopfschmerzen, Mittelohrentzündung, Pharyngitis und Infektion der oberen Atemwege.
Erwachsene und Jugendliche ab 15 Jahren mit ganzjähriger allergischer Rhinitis
Die Sicherheit von SINGULAIR wurde bei 3357 erwachsenen und jugendlichen Patienten ab 15 Jahren mit perennialer allergischer Rhinitis untersucht, von denen 1632 SINGULAIR in zwei 6-wöchigen klinischen Studien erhielten. Einmal täglich verabreichtes SINGULAIR 10 mg hatte ein Sicherheitsprofil, das mit dem bei Patienten mit saisonaler allergischer Rhinitis beobachteten und dem von Placebo vergleichbar war. In diesen beiden Studien wurden die folgenden Reaktionen unter SINGULAIR mit einer Häufigkeit von ≥ 1 % und einer höheren Inzidenz als unter Placebo berichtet: Sinusitis, Infektion der oberen Atemwege, Sinuskopfschmerz, Husten, Nasenbluten und erhöhte ALT. Die Inzidenz von Somnolenz war ähnlich wie bei Placebo.
Pädiatrische Patienten im Alter von 6 Monaten bis 14 Jahren mit ganzjähriger allergischer Rhinitis
Die Sicherheit bei Patienten im Alter von 2 bis 14 Jahren mit ganzjähriger allergischer Rhinitis wird durch die Sicherheit bei Patienten im Alter von 2 bis 14 Jahren mit saisonaler allergischer Rhinitis gestützt. Die Sicherheit bei Patienten im Alter von 6 bis 23 Monaten wird durch Daten aus Pharmakokinetik- und Sicherheits- und Wirksamkeitsstudien bei Asthma in dieser pädiatrischen Population und aus Pharmakokinetikstudien bei Erwachsenen gestützt.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von SINGULAIR nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Erkrankungen des Blutes und des Lymphsystems erhöhte Blutungsneigung, Thrombozytopenie
Störungen des Immunsystems Überempfindlichkeitsreaktionen einschließlich Anaphylaxie, hepatische eosinophile Infiltration
Psychische Störungen einschließlich, aber nicht beschränkt auf Agitation, aggressives Verhalten oder Feindseligkeit, Ängstlichkeit, Depression, Orientierungslosigkeit, Aufmerksamkeitsstörungen, Traumanomalien, Dysphämie (Stottern), Halluzinationen, Schlaflosigkeit, Reizbarkeit, Gedächtnisstörungen, Zwangssymptome, Ruhelosigkeit, Somnambulismus, Suizidgedanken und -verhalten (einschließlich Suizid), Tic und Tremor [vgl Eingerahmte Warnung , WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Erkrankungen des Nervensystems Benommenheit, Parästhesie/Hypästhesie, Krampfanfälle
Herzerkrankungen Herzklopfen
Erkrankungen der Atemwege, des Brustraums und Mediastinums Nasenbluten, pulmonale Eosinophilie
Gastrointestinale Störungen Durchfall, Dyspepsie, Übelkeit, Pankreatitis, Erbrechen
Leber- und Gallenerkrankungen Fälle von cholestatischer Hepatitis, hepatozellulärer Leberschädigung und Leberschädigung gemischten Musters wurden bei mit SINGULAIR behandelten Patienten berichtet. Die meisten davon traten in Kombination mit anderen Störfaktoren auf, wie z. B. der Einnahme anderer Medikamente, oder wenn SINGULAIR Patienten verabreicht wurde, die ein zugrunde liegendes Potenzial für Lebererkrankungen wie Alkoholkonsum oder andere Formen von Hepatitis hatten.
Erkrankungen der Haut und des Unterhautgewebes Angioödem, Blutergüsse, Erythema multiforme, Erythema nodosum, Juckreiz, Stevens-Johnson-Syndrom/toxische epidermale Nekrolyse, Urtikaria
Erkrankungen des Bewegungsapparates und des Bindegewebes Arthralgie, Myalgie einschließlich Muskelkrämpfe
Erkrankungen der Nieren und Harnwege Enuresis bei Kindern
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Ödem
Patienten mit Asthma, die mit SINGULAIR behandelt werden, können eine systemische Eosinophilie aufweisen, die sich manchmal mit klinischen Merkmalen einer Vaskulitis präsentiert, die mit dem Churg-Strauss-Syndrom vereinbar ist, einer Erkrankung, die häufig mit einer systemischen Kortikosteroidtherapie behandelt wird. Diese Reaktionen wurden manchmal mit der Reduzierung der oralen Kortikosteroidtherapie in Verbindung gebracht. Ärzte sollten auf Eosinophilie, vaskulitischen Ausschlag, sich verschlechternde Lungensymptome, kardiale Komplikationen und/oder Neuropathie bei ihren Patienten achten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Es ist keine Dosisanpassung erforderlich, wenn SINGULAIR 5 mg zusammen mit Theophyllin, Prednison, Prednisolon, oralen Kontrazeptiva, Fexofenadin, Digoxin, Warfarin, Gemfibrozil, Itraconazol, Schilddrüsenhormonen, sedierenden Hypnotika, nichtsteroidalen entzündungshemmenden Mitteln, Benzodiazepinen, Dekongestiva, und Cytochrom P450 (CYP)-Enzyminduktoren [vgl KLINISCHE PHARMAKOLOGIE ].
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Neuropsychiatrische Ereignisse
Bei der Anwendung von SINGULAIR wurde über schwerwiegende neuropsychiatrische (NP) Ereignisse berichtet. Diese Postmarketing-Berichte waren sehr unterschiedlich und umfassten unter anderem Agitiertheit, aggressives Verhalten oder Feindseligkeit, Ängstlichkeit, Depression, Orientierungslosigkeit, Aufmerksamkeitsstörungen, Traumanomalien, Dysphämie (Stottern), Halluzinationen, Schlaflosigkeit, Reizbarkeit, Gedächtnisstörungen, Zwangssymptome, Unruhe, Somnambulismus, Selbstmordgedanken und -verhalten (einschließlich Selbstmord), Tic und Tremor. NP-Ereignisse wurden bei erwachsenen, jugendlichen und pädiatrischen Patienten mit und ohne psychiatrische Erkrankung in der Vorgeschichte berichtet. NP-Ereignisse wurden hauptsächlich während der Behandlung mit SINGULAIR 10 mg berichtet, aber einige wurden nach Absetzen von SINGULAIR 5 mg berichtet. Tierversuche zeigten, dass sich Montelukast bei Ratten im Gehirn verteilt [vgl KLINISCHE PHARMAKOLOGIE ]; Die Mechanismen, die SINGULAIR-assoziierten NP-Ereignissen zugrunde liegen, sind jedoch derzeit nicht gut verstanden. Basierend auf den verfügbaren Daten ist es schwierig, Risikofaktoren für NP-Ereignisse bei der Anwendung von SINGULAIR 10 mg zu identifizieren oder das Risiko zu quantifizieren.
Aufgrund des Risikos von NP-Ereignissen überwiegt der Nutzen von SINGULAIR die Risiken bei manchen Patienten möglicherweise nicht, insbesondere wenn die Krankheitssymptome leicht sind und mit alternativen Therapien angemessen behandelt werden können. Reservieren Sie die Anwendung von SINGULAIR 4 mg für Patienten mit allergischer Rhinitis, die unzureichend auf alternative Therapien ansprechen oder diese nicht vertragen [siehe INDIKATIONEN ]. Bei Patienten mit Asthma oder anstrengungsinduzierter Bronchokonstriktion sollten Sie Nutzen und Risiken abwägen, bevor Sie SINGULAIR verschreiben.
Besprechen Sie Nutzen und Risiken der Anwendung von SINGULAIR 10 mg mit Patienten und Pflegepersonal, wenn Sie SINGULAIR verschreiben. Weisen Sie Patienten und/oder Pflegekräfte an, bei der Einnahme von SINGULAIR auf Verhaltensänderungen oder neue NP-Symptome zu achten. Wenn Verhaltensänderungen beobachtet werden oder wenn neue NP-Symptome oder Suizidgedanken und/oder -verhalten auftreten, raten Sie den Patienten, SINGULAIR 10 mg abzusetzen und sich unverzüglich an einen Arzt zu wenden. In vielen Fällen verschwanden die Symptome nach Beendigung der Behandlung mit SINGULAIR; In einigen Fällen blieben die Symptome jedoch nach Absetzen von SINGULAIR bestehen. Daher weiterhin überwachen und unterstützend behandeln, bis die Symptome abgeklungen sind. Nutzen und Risiken einer Wiederaufnahme der Behandlung mit SINGULAIR 10 mg neu bewerten, wenn solche Ereignisse auftreten.
Akute Asthma
SINGULAIR ist nicht angezeigt zur Anwendung bei der Aufhebung von Bronchospasmen bei akuten Asthmaanfällen, einschließlich Status asthmaticus. Den Patienten sollte geraten werden, geeignete Notfallmedikamente bereitzuhalten. Bei akuten Exazerbationen des Asthmas kann die Therapie mit SINGULAIR 4 mg fortgesetzt werden. Patienten, die nach körperlicher Anstrengung Asthma-Exazerbationen erleiden, sollten zur Notfallbehandlung einen kurz wirksamen inhalativen β-Agonisten zur Verfügung haben.
Gleichzeitige Anwendung von Kortikosteroiden
Während die Dosis eines inhalativen Kortikosteroids unter ärztlicher Aufsicht schrittweise reduziert werden kann, sollte SINGULAIR nicht abrupt durch inhalative oder orale Kortikosteroide ersetzt werden.
Aspirin-Empfindlichkeit
Patienten mit bekannter Aspirin-Empfindlichkeit sollten Aspirin oder nicht-steroidale entzündungshemmende Mittel während der Einnahme von SINGULAIR weiterhin vermeiden. Obwohl SINGULAIR bei der Verbesserung der Atemwegsfunktion bei Asthmatikern mit dokumentierter Aspirin-Empfindlichkeit wirksam ist, wurde nicht gezeigt, dass es die Bronchokonstriktor-Reaktion auf Aspirin und andere nicht-steroidale entzündungshemmende Arzneimittel bei Aspirin-empfindlichen Asthmapatienten verkürzt [siehe Klinische Studien ].
Eosinophile Bedingungen
Patienten mit Asthma, die mit SINGULAIR behandelt werden, können eine systemische Eosinophilie aufweisen, die sich manchmal mit klinischen Merkmalen einer Vaskulitis präsentiert, die mit dem Churg-Strauss-Syndrom vereinbar ist, einer Erkrankung, die häufig mit einer systemischen Kortikosteroidtherapie behandelt wird. Diese Ereignisse wurden manchmal mit einer Reduktion der oralen Kortikosteroidtherapie in Verbindung gebracht. Ärzte sollten bei ihren Patienten auf Eosinophilie, vaskulitischen Hautausschlag, sich verschlechternde Lungensymptome, kardiale Komplikationen und/oder Neuropathie achten. Ein kausaler Zusammenhang zwischen SINGULAIR 10 mg und diesen Grunderkrankungen wurde nicht nachgewiesen [siehe NEBENWIRKUNGEN ].
Risiko bei Patienten mit Phenylketonurie
SINGULAIR 4 mg enthält Aspartam, eine Quelle für Phenylalanin. Phenylalanin kann für Patienten mit Phenylketonurie (PKU) schädlich sein. Jede 4-mg- und 5-mg-Kautablette enthält 0,674 mg bzw. 0,842 mg Phenylalanin. Bevor Sie einem Patienten mit PKU SINGULAIR verschreiben, berücksichtigen Sie die kombinierte tägliche Menge an Phenylalanin aus allen Quellen, einschließlich SINGULAIR.
Informationen zur Patientenberatung
Weisen Sie für die Tabletten und Kautabletten den Patienten und/oder die Pflegekraft an, die von der FDA zugelassene Patientenkennzeichnung zu lesen ( Leitfaden für Medikamente ).
Weisen Sie für das orale Granulat den Patienten und/oder die Pflegekraft an, die von der FDA zugelassene Patientenkennzeichnung zu lesen ( Medikationsleitfaden und Gebrauchsanweisung ).
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In Kanzerogenitätsstudien über 2 Jahre an Sprague-Dawley-Ratten oder 92 Wochen an Mäusen mit oralen Sondendosen von bis zu 200 mg/kg/Tag bzw. 100 mg/kg/Tag wurden keine Hinweise auf Tumorigenität gefunden. Die geschätzte Exposition bei Ratten betrug etwa das 120- bzw. 75-fache der AUC für Erwachsene bzw. Kinder bei der maximal empfohlenen oralen Tagesdosis. Die geschätzte Exposition bei Mäusen betrug etwa das 45- bzw. 25-fache der AUC für Erwachsene bzw. Kinder bei der maximal empfohlenen oralen Tagesdosis.
Montelukast zeigte in den folgenden Assays keine Hinweise auf mutagene oder klastogene Aktivität: dem mikrobiellen Mutagenese-Assay, dem V-79-Säugerzell-Mutagenese-Assay, dem alkalischen Elutions-Assay in Ratten-Hepatozyten, dem Chromosomenaberrations-Assay in Eierstockzellen des chinesischen Hamsters und im in vivo Knochenmark-Chromosomenaberrationsassay der Maus.
In Fertilitätsstudien an weiblichen Ratten führte Montelukast bei einer oralen Dosis von 200 mg/kg zu einer Verringerung der Fertilitäts- und Fruchtbarkeitsindizes (die geschätzte Exposition betrug etwa das 70-fache der AUC für Erwachsene bei der maximal empfohlenen oralen Tagesdosis). Bei einer oralen Dosis von 100 mg/kg wurden keine Auswirkungen auf die weibliche Fertilität oder Fertilität beobachtet (die geschätzte Exposition betrug etwa das 20-fache der AUC für Erwachsene bei der maximal empfohlenen oralen Tagesdosis). Montelukast hatte bei oralen Dosen von bis zu 800 mg/kg keine Auswirkungen auf die Fertilität männlicher Ratten (die geschätzte Exposition betrug etwa das 160-fache der AUC für Erwachsene bei der maximal empfohlenen oralen Tagesdosis).
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Verfügbare Daten aus veröffentlichten prospektiven und retrospektiven Kohortenstudien über Jahrzehnte mit der Anwendung von Montelukast bei schwangeren Frauen haben kein arzneimittelbedingtes Risiko schwerer Geburtsfehler festgestellt [siehe Daten ]. In Reproduktionsstudien an Tieren wurden bei oraler Gabe von Montelukast an trächtige Ratten und Kaninchen während der Organogenese in Dosen, die etwa dem 100- bzw. 110-Fachen der maximal empfohlenen täglichen oralen Dosis beim Menschen (MRHDOD) entsprachen, basierend auf den AUCs, keine nachteiligen Auswirkungen auf die Entwicklung beobachtet [siehe Daten ].
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In dem
In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwerwiegende Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2–4 % bzw. 15–20 %.
Klinische Überlegungen
Krankheitsbedingtes maternales und/oder embryo/fetales Risiko
Schlecht oder mäßig kontrolliertes Asthma in der Schwangerschaft erhöht das mütterliche Risiko für perinatale Nebenwirkungen wie Präeklampsie und Frühgeburtlichkeit, niedriges Geburtsgewicht und geringes Gestationsalter.
Daten
Menschliche Daten
Veröffentlichte Daten aus prospektiven und retrospektiven Kohortenstudien haben keinen Zusammenhang mit der Anwendung von SINGULAIR während der Schwangerschaft und schweren Geburtsfehlern festgestellt. Verfügbare Studien weisen methodische Einschränkungen auf, darunter eine kleine Stichprobengröße, teilweise retrospektive Datenerhebung und inkonsistente Vergleichsgruppen.
Tierdaten
In Studien zur embryofetalen Entwicklung verursachte Montelukast, das trächtigen Ratten und Kaninchen während der Organogenese (Tragzeit 6 bis 17 bei Ratten und 6 bis 18 bei Kaninchen) verabreicht wurde, bei maternalen oralen Dosen von bis zu 400 und 300 mg/kg keine nachteiligen Auswirkungen auf die Entwicklung /Tag bei Ratten bzw. Kaninchen (etwa das 100- bzw. 110-fache der AUC beim Menschen bei der MRHDOD).
Stillzeit
Zusammenfassung der Risiken
Eine veröffentlichte klinische Laktationsstudie berichtet über das Vorhandensein von Montelukast in der Muttermilch. Verfügbare Daten zu den Wirkungen des Medikaments auf Säuglinge, entweder direkt [siehe Pädiatrische Verwendung oder durch die Muttermilch, weisen nicht auf ein signifikantes Risiko von Nebenwirkungen durch die Exposition gegenüber SINGULAIR hin. Die Auswirkungen des Medikaments auf die Milchproduktion sind nicht bekannt. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an SINGULAIR 5 mg und möglichen Nebenwirkungen auf den gestillten Säugling durch SINGULAIR 10 mg oder aufgrund des zugrunde liegenden Zustands der Mutter berücksichtigt werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von SINGULAIR bei Asthma wurde bei pädiatrischen Patienten im Alter von 6 bis 14 Jahren nachgewiesen. Die Anwendung von SINGULAIR 4 mg für diese Indikation wird durch Belege aus gut kontrollierten Studien gestützt. Die Sicherheits- und Wirksamkeitsdaten in dieser Altersgruppe ähneln denen bei Erwachsenen [siehe NEBENWIRKUNGEN , KLINISCHE PHARMAKOLOGIE , Spezifische Populationen , und Klinische Studien ].
Die Wirksamkeit von SINGULAIR zur Behandlung von saisonaler allergischer Rhinitis bei pädiatrischen Patienten im Alter von 2 bis 14 Jahren und zur Behandlung von ganzjähriger allergischer Rhinitis bei pädiatrischen Patienten im Alter von 6 Monaten bis 14 Jahren wurde nachgewiesen und wird durch Extrapolation der nachgewiesenen Wirksamkeit gestützt bei Patienten ab 15 Jahren mit allergischer Rhinitis sowie der Annahme, dass der Krankheitsverlauf, die Pathophysiologie und die Wirkung des Arzneimittels in diesen Populationen im Wesentlichen ähnlich sind.
Die Sicherheit von SINGULAIR 4 mg Kautabletten bei pädiatrischen Patienten im Alter von 2 bis 5 Jahren mit Asthma wurde durch angemessene und gut kontrollierte Daten belegt [siehe NEBENWIRKUNGEN ]. Die Wirksamkeit von SINGULAIR 5 mg in dieser Altersgruppe wird aus der nachgewiesenen Wirksamkeit bei Patienten ab 6 Jahren mit Asthma extrapoliert und basiert auf ähnlichen pharmakokinetischen Daten sowie der Annahme, dass der Krankheitsverlauf, die Pathophysiologie und die Wirkung des Arzneimittels im Wesentlichen ähnlich sind unter diesen Populationen. Die Wirksamkeit in dieser Altersgruppe wird durch explorative Wirksamkeitsbewertungen aus einer großen, gut kontrollierten Sicherheitsstudie gestützt, die an Patienten im Alter von 2 bis 5 Jahren durchgeführt wurde.
Die Sicherheit von SINGULAIR 4 mg oralem Granulat bei pädiatrischen Patienten im Alter von 12 bis 23 Monaten mit Asthma wurde in einer Analyse von 172 pädiatrischen Patienten, von denen 124 mit SINGULAIR behandelt wurden, in einer 6-wöchigen, doppelblinden Placebo-Studie nachgewiesen -kontrollierte Studie [vgl NEBENWIRKUNGEN ]. Die Wirksamkeit von SINGULAIR in dieser Altersgruppe wird aus der nachgewiesenen Wirksamkeit bei Patienten ab 6 Jahren mit Asthma extrapoliert, basierend auf einer ähnlichen mittleren systemischen Exposition (AUC) und der Tatsache, dass der Krankheitsverlauf, die Pathophysiologie und die Wirkung des Arzneimittels bei diesen Populationen im Wesentlichen ähnlich sind , unterstützt durch Wirksamkeitsdaten aus einer Sicherheitsstudie, in der die Wirksamkeit eine explorative Bewertung war.
Die Sicherheit von SINGULAIR 4 mg und 5 mg Kautabletten bei pädiatrischen Patienten im Alter von 2 bis 14 Jahren mit allergischer Rhinitis wird durch Daten aus Studien gestützt, die an pädiatrischen Patienten im Alter von 2 bis 14 Jahren mit Asthma durchgeführt wurden. Eine Sicherheitsstudie bei pädiatrischen Patienten im Alter von 2 bis 14 Jahren mit saisonaler allergischer Rhinitis zeigte ein ähnliches Sicherheitsprofil [siehe NEBENWIRKUNGEN ]. Die Sicherheit von SINGULAIR 4 mg Granulat zum Einnehmen bei pädiatrischen Patienten im Alter von 6 Monaten mit perennialer allergischer Rhinitis wird durch Extrapolation von Sicherheitsdaten gestützt, die aus Studien an pädiatrischen Patienten im Alter von 6 bis 23 Monaten mit Asthma und aus pharmakokinetischen Daten gewonnen wurden Vergleich systemischer Expositionen bei Patienten im Alter von 6 bis 23 Monaten mit systemischen Expositionen bei Erwachsenen.
Die Sicherheit und Wirksamkeit bei pädiatrischen Patienten unter 12 Monaten mit Asthma, unter 6 Monaten mit ganzjähriger allergischer Rhinitis und unter 6 Jahren mit anstrengungsinduzierter Bronchokonstriktion wurde nicht nachgewiesen.
Wachstumsrate bei pädiatrischen Patienten
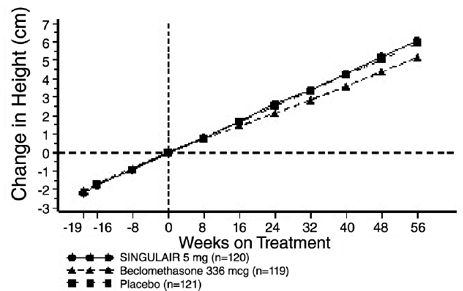
Eine 56-wöchige, multizentrische, doppelblinde, randomisierte, aktiv- und placebokontrollierte Parallelgruppenstudie wurde durchgeführt, um die Wirkung von SINGULAIR 4 mg auf die Wachstumsrate bei 360 Patienten mit leichtem Asthma im Alter von 6 bis 8 Jahren zu beurteilen. Die Behandlungsgruppen umfassten SINGULAIR 5 mg einmal täglich, Placebo und Beclomethasondipropionat, verabreicht als 168 µg zweimal täglich mit einem Spacer. Für jedes Subjekt wurde eine Wachstumsrate als Steigung einer linearen Regressionslinie definiert, die an die Größenmessungen über 56 Wochen angepasst war. Der primäre Vergleich war der Unterschied in den Wachstumsraten zwischen der SINGULAIR- und der Placebo-Gruppe. Wachstumsraten, ausgedrückt als Mittelwert der kleinsten Quadrate (LS) (95 % KI) in cm/Jahr, für die SINGULAIR-, Placebo- und Beclomethason-Behandlungsgruppen betrugen 5,67 (5,46; 5,88), 5,64 (5,42; 5,86) und 4,86 ( 4,64, 5,08). Die Unterschiede in den Wachstumsraten, ausgedrückt als Mittelwert der kleinsten Quadrate (LS) (95 %-KI) in cm/Jahr, für die Behandlungsgruppen mit SINGULAIR 5 mg minus Placebo, Beclomethason minus Placebo und SINGULAIR 5 mg minus Beclomethason betrugen 0,03 (-0,26; 0,31). , -0,78 (-1,06, -0,49); bzw. 0,81 (0,53, 1,09). Die Wachstumsrate (ausgedrückt als mittlere Veränderung der Körpergröße im Laufe der Zeit) für jede Behandlungsgruppe ist in ABBILDUNG 1 dargestellt.
Abbildung 1: Veränderung der Körpergröße (cm) vom Randomisierungsbesuch bis zur geplanten Woche (Mittelwert der Behandlungsgruppe ± Standardfehler* des Mittelwerts)
Geriatrische Verwendung
Von der Gesamtzahl der Studienteilnehmer in klinischen Studien zu Montelukast waren 3,5 % 65 Jahre und älter und 0,4 % 75 Jahre und älter. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden. Das pharmakokinetische Profil und die orale Bioverfügbarkeit einer oralen Einzeldosis von 10 mg Montelukast sind bei älteren und jüngeren Erwachsenen ähnlich. Die Plasmahalbwertszeit von Montelukast ist bei älteren Patienten etwas länger. Bei älteren Patienten ist keine Dosisanpassung erforderlich.
Leberfunktionsstörung
Bei Patienten mit leichter bis mittelschwerer Leberinsuffizienz wird keine Dosisanpassung empfohlen [siehe KLINISCHE PHARMAKOLOGIE ].
Nierenfunktionsstörung
Bei Patienten mit Niereninsuffizienz wird keine Dosisanpassung empfohlen [siehe KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Zur Behandlung einer Überdosierung mit SINGULAIR liegen keine spezifischen Informationen vor. Im Falle einer Überdosierung ist es sinnvoll, die üblichen unterstützenden Maßnahmen anzuwenden; B. nicht resorbiertes Material aus dem Gastrointestinaltrakt entfernen, klinisch überwachen und bei Bedarf eine unterstützende Therapie einleiten. Es ist nicht bekannt, ob Montelukast durch Peritonealdialyse oder Hämodialyse entfernt wird.
KONTRAINDIKATIONEN
SINGULAIR ist bei Patienten mit Überempfindlichkeit gegen einen seiner Bestandteile kontraindiziert.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Die Cysteinyl-Leukotriene (LTC4, LTD4, LTE4) sind Produkte des Arachidonsäure-Stoffwechsels und werden von verschiedenen Zellen, einschließlich Mastzellen und Eosinophilen, freigesetzt. Diese Eicosanoide binden an Cysteinyl-Leukotrien (CysLT)-Rezeptoren. Der CysLT-Typ-1 (CysLT1)-Rezeptor findet sich in den menschlichen Atemwegen (einschließlich glatter Atemwegsmuskelzellen und Atemwegsmakrophagen) und auf anderen entzündungsfördernden Zellen (einschließlich Eosinophilen und bestimmten myeloischen Stammzellen). CysLTs wurden mit der Pathophysiologie von Asthma und allergischer Rhinitis korreliert. Bei Asthma umfassen Leukotrien-vermittelte Wirkungen Atemwegsödeme, Kontraktion der glatten Muskulatur und veränderte Zellaktivität im Zusammenhang mit dem Entzündungsprozess. Bei allergischer Rhinitis werden CysLTs nach Allergenexposition sowohl während der Früh- als auch der Spätphasenreaktion aus der Nasenschleimhaut freigesetzt und sind mit Symptomen einer allergischen Rhinitis verbunden.
Montelukast ist eine oral wirksame Verbindung, die mit hoher Affinität und Selektivität an den CysLT1-Rezeptor bindet (vorzugsweise gegenüber anderen pharmakologisch wichtigen Atemwegsrezeptoren wie dem Prostanoid-, cholinergen oder β-adrenergen Rezeptor). Montelukast hemmt die physiologischen Wirkungen von LTD4 am CysLT1-Rezeptor ohne agonistische Aktivität.
Pharmakodynamik
Montelukast bewirkt eine Hemmung der Cysteinyl-Leukotrien-Rezeptoren der Atemwege, wie durch die Fähigkeit zur Hemmung der Bronchokonstriktion aufgrund von inhaliertem LTD4 bei Asthmatikern gezeigt wurde. So niedrige Dosen wie 5 mg verursachen eine erhebliche Blockade der LTD4-induzierten Bronchokonstriktion. In einer Placebo-kontrollierten Crossover-Studie (n=12) hemmte SINGULAIR 4 mg die Bronchokonstriktion in der Früh- und Spätphase aufgrund einer Antigenprovokation um 75 % bzw. 57 %.
Die Wirkung von SINGULAIR 5 mg auf Eosinophile im peripheren Blut wurde in klinischen Studien untersucht. Bei Patienten mit Asthma ab 2 Jahren, die SINGULAIR 10 mg erhielten, wurde im Vergleich zu Placebo während der doppelblinden Behandlungsperioden eine Abnahme der mittleren Eosinophilenzahl im peripheren Blut um 9 % bis 15 % festgestellt. Bei Patienten mit saisonaler allergischer Rhinitis im Alter von 15 Jahren und älter, die SINGULAIR 4 mg erhielten, wurde im Vergleich zur doppelblinden Behandlung eine mittlere Zunahme der Eosinophilenzahl im peripheren Blut um 0,2 % festgestellt, verglichen mit einer mittleren Zunahme von 12,5 % bei den mit Placebo behandelten Patienten Perioden; dies entspricht einer mittleren Differenz von 12,3 % zugunsten von SINGULAIR. Der Zusammenhang zwischen diesen Beobachtungen und den in den klinischen Studien festgestellten klinischen Vorteilen von Montelukast ist nicht bekannt [siehe Klinische Studien ].
Pharmakokinetik
Absorption
Montelukast wird nach oraler Verabreichung schnell resorbiert. Nach Verabreichung der 10-mg-Filmtablette an nüchternen Erwachsenen wird die mittlere maximale Montelukast-Plasmakonzentration (Cmax) innerhalb von 3 bis 4 Stunden (Tmax) erreicht. Die mittlere orale Bioverfügbarkeit beträgt 64 %. Die orale Bioverfügbarkeit und Cmax werden durch eine Standardmahlzeit am Morgen nicht beeinflusst.
Bei der 5-mg-Kautablette wird die mittlere Cmax 2 bis 2,5 Stunden nach der Verabreichung bei Erwachsenen im nüchternen Zustand erreicht. Die mittlere orale Bioverfügbarkeit beträgt 73 % im nüchternen Zustand gegenüber 63 % bei Verabreichung mit einer Standardmahlzeit am Morgen.
Für die 4-mg-Kautablette wird die mittlere Cmax 2 Stunden nach der Verabreichung bei pädiatrischen Patienten im Alter von 2 bis 5 Jahren im nüchternen Zustand erreicht.
Die orale 4-mg-Granulatformulierung ist bioäquivalent zu der 4-mg-Kautablette, wenn sie Erwachsenen im nüchternen Zustand verabreicht wird. Die gleichzeitige Verabreichung der oralen Granulatformulierung mit Apfelmus hatte keine klinisch signifikante Wirkung auf die Pharmakokinetik von Montelukast. Eine fettreiche Mahlzeit am Morgen hatte keinen Einfluss auf die AUC von Montelukast Granulat zum Einnehmen; Die Mahlzeit verringerte jedoch Cmax um 35 % und verlängerte Tmax von 2,3 ± 1,0 Stunden auf 6,4 ± 2,9 Stunden.
Die Sicherheit und Wirksamkeit von SINGULAIR bei Patienten mit Asthma wurde in klinischen Studien nachgewiesen, in denen die 10-mg-Filmtabletten und die 5-mg-Kautabletten-Formulierungen abends unabhängig vom Zeitpunkt der Nahrungsaufnahme verabreicht wurden. Die Sicherheit von SINGULAIR 4 mg bei Patienten mit Asthma wurde auch in klinischen Studien nachgewiesen, in denen die 4-mg-Kautablette und die orale 4-mg-Granulatformulierung abends unabhängig vom Zeitpunkt der Nahrungsaufnahme verabreicht wurden. Die Sicherheit und Wirksamkeit von SINGULAIR bei Patienten mit saisonaler allergischer Rhinitis wurden in klinischen Studien nachgewiesen, in denen die 10-mg-Filmtablette morgens oder abends unabhängig vom Zeitpunkt der Nahrungsaufnahme eingenommen wurde.
Die vergleichende Pharmakokinetik von Montelukast bei Verabreichung als zwei 5-mg-Kautabletten gegenüber einer 10-mg-Filmtablette wurde nicht untersucht.
Verteilung
Montelukast wird zu mehr als 99 % an Plasmaproteine gebunden. Das Verteilungsvolumen von Montelukast im Steady State beträgt durchschnittlich 8 bis 11 Liter. Oral verabreichtes Montelukast verteilt sich bei Ratten im Gehirn.
Beseitigung
Die Plasma-Clearance von Montelukast beträgt bei gesunden Erwachsenen durchschnittlich 45 ml/min. Nach einer oralen Dosis von radioaktiv markiertem Montelukast wurden 86 % der Radioaktivität in 5-tägigen Stuhlsammlungen und
In mehreren Studien lag die mittlere Plasmahalbwertszeit von Montelukast bei gesunden jungen Erwachsenen zwischen 2,7 und 5,5 Stunden. Die Pharmakokinetik von Montelukast ist bei oralen Dosen bis zu 50 mg nahezu linear. Bei einmal täglicher Gabe von 10 mg Montelukast kommt es zu einer geringen Akkumulation der Muttersubstanz im Plasma (14 %).
Stoffwechsel
Montelukast wird extensiv metabolisiert. In Studien mit therapeutischen Dosen waren Plasmakonzentrationen von Montelukast-Metaboliten bei Erwachsenen und pädiatrischen Patienten im Steady State nicht nachweisbar.
In-vitro-Studien mit menschlichen Lebermikrosomen weisen darauf hin, dass CYP3A4, 2C8 und 2C9 am Metabolismus von Montelukast beteiligt sind. In klinisch relevanten Konzentrationen scheint 2C8 eine wichtige Rolle im Metabolismus von Montelukast zu spielen.
Spezifische Populationen
Patienten mit eingeschränkter Leberfunktion
Patienten mit leichter bis mittelschwerer Leberinsuffizienz und klinischem Nachweis einer Zirrhose zeigten Hinweise auf eine verminderte Metabolisierung von Montelukast, was zu einer um 41 % (90 % KI = 7 %, 85 %) höheren mittleren AUC von Montelukast nach einer Einzeldosis von 10 mg führte. Die Elimination von Montelukast war im Vergleich zu gesunden Probanden leicht verlängert (mittlere Halbwertszeit 7,4 Stunden). Bei Patienten mit leichter bis mittelschwerer Leberinsuffizienz ist keine Dosisanpassung erforderlich. Die Pharmakokinetik von SINGULAIR bei Patienten mit schwerer Leberfunktionsstörung oder Hepatitis wurde nicht untersucht.
Patienten mit eingeschränkter Nierenfunktion
Da Montelukast und seine Metaboliten nicht im Urin ausgeschieden werden, wurde die Pharmakokinetik von Montelukast bei Patienten mit Niereninsuffizienz nicht untersucht. Bei diesen Patienten wird keine Dosisanpassung empfohlen.
Männliche und weibliche Patienten
Die Pharmakokinetik von Montelukast ist bei Männern und Frauen ähnlich.
Rassengruppen
Unterschiede in der Pharmakokinetik aufgrund der Rasse wurden nicht untersucht.
Jugendliche und pädiatrische Patienten
Pharmakokinetische Studien untersuchten die systemische Exposition der oralen 4-mg-Granulatformulierung bei pädiatrischen Patienten im Alter von 6 bis 23 Monaten, der 4-mg-Kautabletten bei pädiatrischen Patienten im Alter von 2 bis 5 Jahren und der 5-mg-Kautabletten bei pädiatrischen Patienten 6 bis 14 Jahre und die 10-mg-Filmtabletten bei jungen Erwachsenen und Jugendlichen ≥ 15 Jahren.
Das Plasmakonzentrationsprofil von Montelukast nach Verabreichung der 10-mg-Filmtablette ist bei Jugendlichen ≥ 15 Jahren und jungen Erwachsenen ähnlich. Die 10-mg-Filmtablette wird zur Anwendung bei Patienten im Alter von ≥ 15 Jahren empfohlen.
Die mittlere systemische Exposition der 4-mg-Kautablette bei pädiatrischen Patienten im Alter von 2 bis 5 Jahren und der 5-mg-Kautablette bei pädiatrischen Patienten im Alter von 6 bis 14 Jahren ist ähnlich der mittleren systemischen Exposition der 10-mg-Filmtablette. überzogene Tablette bei Erwachsenen. Die 5-mg-Kautablette sollte bei pädiatrischen Patienten im Alter von 6 bis 14 Jahren und die 4-mg-Kautablette sollte bei pädiatrischen Patienten im Alter von 2 bis 5 Jahren angewendet werden.
Bei Kindern im Alter von 6 bis 11 Monaten waren die systemische Montelukast-Exposition und die Variabilität der Montelukast-Plasmakonzentrationen höher als bei Erwachsenen. Basierend auf Populationsanalysen war die mittlere AUC (4296 ng•h/ml [Bereich 1200 bis 7153]) um 60 % höher und die mittlere Cmax (667 ng/ml [Bereich 201 bis 1058]) um 89 % höher als die in beobachteten Erwachsene (mittlere AUC 2689 ng•h/ml [Bereich 1521 bis 4595]) und mittlere Cmax (353 ng/ml [Bereich 180 bis 548]). Die systemische Exposition bei Kindern im Alter von 12 bis 23 Monaten war weniger variabel, aber immer noch höher als bei Erwachsenen. Die mittlere AUC (3574 ng•h/ml [Bereich 2229 bis 5408]) war 33 % höher und die mittlere Cmax (562 ng/ml [Bereich 296 bis 814]) war 60 % höher als bei Erwachsenen. Sicherheit und Verträglichkeit von Montelukast in einer pharmakokinetischen Studie mit Einzeldosis bei 26 Kindern im Alter von 6 bis 23 Monaten waren ähnlich wie bei Patienten ab zwei Jahren [siehe NEBENWIRKUNGEN ]. Die orale 4-mg-Granulatformulierung sollte bei pädiatrischen Patienten im Alter von 12 bis 23 Monaten zur Behandlung von Asthma oder bei pädiatrischen Patienten im Alter von 6 bis 23 Monaten zur Behandlung von ganzjähriger allergischer Rhinitis angewendet werden. Da die orale 4-mg-Granulatformulierung mit der 4-mg-Kautablette bioäquivalent ist, kann sie bei pädiatrischen Patienten im Alter von 2 bis 5 Jahren auch als alternative Formulierung zur 4-mg-Kautablette verwendet werden.
Arzneimittelwechselwirkungsstudien
Theophyllin, Prednison und Prednisolon
SINGULAIR wurde zusammen mit anderen Therapien verabreicht, die routinemäßig zur Prophylaxe und chronischen Behandlung von Asthma eingesetzt werden, ohne erkennbare Zunahme von Nebenwirkungen. In Wechselwirkungsstudien hatte die empfohlene klinische Dosis von Montelukast keine klinisch bedeutsamen Auswirkungen auf die Pharmakokinetik der folgenden Arzneimittel: Theophyllin, Prednison und Prednisolon.
Montelukast in einer Dosis von 10 mg einmal täglich bis zum pharmakokinetischen Steady State verursachte keine klinisch signifikanten Veränderungen der Kinetik einer intravenösen Einzeldosis von Theophyllin [vorwiegend ein Cytochrom P450 (CYP) 1A2-Substrat]. Montelukast in Dosen von ≥ 100 mg täglich bis zum pharmakokinetischen Steady State verursachte keine klinisch signifikante Veränderung der Plasmaprofile von Prednison oder Prednisolon nach Verabreichung von entweder oralem Prednison oder intravenösem Prednisolon.
Orale Kontrazeptiva, Fexofenadin, Digoxin und Warfarin
In Wechselwirkungsstudien hatte die empfohlene klinische Dosis von Montelukast keine klinisch relevanten Auswirkungen auf die Pharmakokinetik der folgenden Arzneimittel: orale Kontrazeptiva (Norethindron 1 mg/Ethinylestradiol 35 mcg), Digoxin und Warfarin. Montelukast in Dosen von ≥ 100 mg täglich bis zum pharmakokinetischen Steady State veränderte die Plasmakonzentrationen der beiden Komponenten eines oralen Kontrazeptivums, das Norethindron 1 mg/Ethinylestradiol 35 µg enthielt, nicht signifikant. Montelukast in einer Dosis von 10 mg einmal täglich bis zum pharmakokinetischen Steady State veränderte das Plasmakonzentrationsprofil von Fexofenadin, das pharmakokinetische Profil oder die Urinausscheidung von immunreaktivem Digoxin nicht; veränderte weder das pharmakokinetische Profil von Warfarin (hauptsächlich ein Substrat von CYP2C9, 3A4 und 1A2) noch beeinflusste es die Wirkung einer oralen Einzeldosis von 30 mg Warfarin auf die Prothrombinzeit oder die International Normalized Ratio (INR).
Schilddrüsenhormone, beruhigende Hypnotika, nichtsteroidale Entzündungshemmer, Benzodiazepine und abschwellende Mittel
Obwohl keine zusätzlichen spezifischen Wechselwirkungsstudien durchgeführt wurden, wurde SINGULAIR in klinischen Studien gleichzeitig mit einer Vielzahl häufig verschriebener Arzneimittel angewendet, ohne dass es Hinweise auf unerwünschte klinische Wechselwirkungen gab. Zu diesen Medikamenten gehörten Schilddrüsenhormone, sedierende Hypnotika, nichtsteroidale entzündungshemmende Mittel, Benzodiazepine und abschwellende Mittel.
Cytochrom P450 (CYP) Enzyminduktoren
Phenobarbital, das den Leberstoffwechsel induziert, verringerte die Fläche unter der Plasmakonzentrationskurve (AUC) von Montelukast nach einer Einzeldosis von 10 mg Montelukast um etwa 40 %. Es wird keine Dosisanpassung für SINGULAIR empfohlen. Es ist sinnvoll, eine angemessene klinische Überwachung durchzuführen, wenn starke CYP-Enzyminduktoren wie Phenobarbital oder Rifampin zusammen mit SINGULAIR verabreicht werden.
Wirkung von Montelukast auf Cytochrom P450 (CYP) Enzyme
Montelukast ist in vitro ein starker Inhibitor von CYP2C8. Daten aus einer klinischen Wechselwirkungsstudie mit Montelukast und Rosiglitazon (ein Sondensubstrat, das repräsentativ für hauptsächlich durch CYP2C8 metabolisierte Arzneimittel ist) bei 12 gesunden Personen zeigten jedoch, dass die Pharmakokinetik von Rosiglitazon bei gleichzeitiger Verabreichung der Arzneimittel nicht verändert wird, was darauf hindeutet, dass Montelukast dies tut CYP2C8 in vivo nicht hemmen. Daher ist nicht zu erwarten, dass Montelukast den Metabolismus von Arzneimitteln verändert, die durch dieses Enzym metabolisiert werden (z. B. Paclitaxel, Rosiglitazon und Repaglinid). Basierend auf weiteren In-vitro-Ergebnissen in menschlichen Lebermikrosomen hemmen therapeutische Plasmakonzentrationen von Montelukast CYP 3A4, 2C9, 1A2, 2A6, 2C19 oder 2D6 nicht.
Cytochrom P450 (CYP) Enzyminhibitoren
In-vitro-Studien haben gezeigt, dass Montelukast ein Substrat von CYP 2C8, 2C9 und 3A4 ist. Die gleichzeitige Anwendung von Montelukast mit Itraconazol, einem starken CYP 3A4-Hemmer, führte zu keiner signifikanten Erhöhung der systemischen Exposition von Montelukast. Daten aus einer klinischen Wechselwirkungsstudie mit Montelukast und Gemfibrozil (einem Inhibitor von CYP 2C8 und 2C9) zeigten, dass Gemfibrozil in therapeutischer Dosis die systemische Exposition von Montelukast um das 4,4-Fache erhöhte. Die gleichzeitige Anwendung von Itraconazol, Gemfibrozil und Montelukast erhöhte die systemische Exposition von Montelukast nicht weiter. Basierend auf den verfügbaren klinischen Erfahrungen ist keine Dosisanpassung von Montelukast bei gleichzeitiger Anwendung mit Gemfibrozil erforderlich [siehe ÜBERDOSIS ].
Klinische Studien
Asthma
Erwachsene und Jugendliche ab 15 Jahren mit Asthma
Klinische Studien mit Erwachsenen und Jugendlichen ab 15 Jahren haben gezeigt, dass Montelukast-Dosen über 10 mg einmal täglich keinen zusätzlichen klinischen Nutzen bringen.
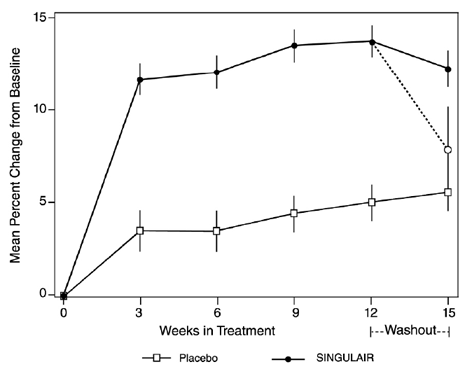
Die Wirksamkeit von SINGULAIR zur chronischen Behandlung von Asthma bei Erwachsenen und Jugendlichen ab 15 Jahren wurde in zwei (USA und multinationalen) ähnlich angelegten, randomisierten, 12-wöchigen, doppelblinden, placebokontrollierten Studien mit 1576 Patienten nachgewiesen ( 795 mit SINGULAIR behandelt, 530 mit Placebo behandelt und 251 mit aktiver Kontrolle behandelt). Das Durchschnittsalter betrug 33 Jahre (Bereich 15 bis 85); 56,8 % waren weiblich und 43,2 % männlich. Die ethnische/rassische Verteilung in diesen Studien war 71,6 % Kaukasier, 17,7 % Hispanoamerikaner, 7,2 % anderer Herkunft und 3,5 % Schwarze. Die Patienten hatten leichtes oder mittelschweres Asthma und waren Nichtraucher, die nach Bedarf etwa 5 Sprühstöße des inhalierten β-Agonisten pro Tag benötigten. Die Patienten hatten einen mittleren prozentualen Baseline-Prozentsatz des vorhergesagten forcierten Exspirationsvolumens in 1 Sekunde (FEV1) von 66 % (ungefährer Bereich 40 bis 90 %). Die co-primären Endpunkte in diesen Studien waren FEV1 und Asthmasymptome am Tag. In beiden Studien wurde nach 12 Wochen eine zufällig ausgewählte Untergruppe von Patienten, die SINGULAIR 5 mg erhielten, für weitere 3 Wochen einer doppelblinden Behandlung auf Placebo umgestellt, um mögliche Rebound-Effekte zu untersuchen.
Die Ergebnisse der US-Studie zum primären Endpunkt, dem morgendlichen FEV1, ausgedrückt als mittlere prozentuale Veränderung gegenüber dem Ausgangswert, gemittelt über den 12-wöchigen Behandlungszeitraum, sind in ABBILDUNG 2 dargestellt. Im Vergleich zu Placebo wurde die Behandlung mit einer SINGULAIR 10-mg-Tablette täglich in am Abend führte zu einem statistisch signifikanten Anstieg der FEV1-Veränderung in Prozent gegenüber dem Ausgangswert (13,0 %-Veränderung in der mit SINGULAIR 4 mg behandelten Gruppe vs. 4,2 %-Veränderung in der Placebogruppe, p
Abbildung 2: Mittlere prozentuale Veränderung des FEV1 gegenüber dem Ausgangswert (US-Studie: SINGULAIR 5 mg N = 406; Placebo N = 270) (ANOVA-Modell)
Die Wirkung von SINGULAIR 5 mg auf andere primäre und sekundäre Endpunkte der multinationalen Studie ist in TABELLE 6 dargestellt. Die Ergebnisse zu diesen Endpunkten waren in der US-Studie ähnlich.
Beide Studien bewerteten die Wirkung von SINGULAIR 4 mg auf sekundäre Ergebnisse, einschließlich Asthmaanfall (Inanspruchnahme von Gesundheitsversorgungsressourcen wie ein außerplanmäßiger Besuch in einer Arztpraxis, Notaufnahme oder einem Krankenhaus; oder Behandlung mit oralen, intravenösen oder intramuskuläres Kortikosteroid) und die Anwendung von oralen Kortikosteroiden zur Asthmarettung. In der multinationalen Studie erlitten signifikant weniger Patienten (15,6 % der Patienten) unter SINGULAIR Asthmaanfälle im Vergleich zu Patienten unter Placebo (27,3 %, p
Wirkungseintritt und Aufrechterhaltung der Wirkung
In jeder Placebo-kontrollierten Studie mit Erwachsenen wurde der Behandlungseffekt von SINGULAIR 4 mg, gemessen anhand der Parameter der täglichen Tagebuchkarte, einschließlich Symptom-Scores, bedarfsgerechter Anwendung von β-Agonisten und PEFR-Messungen, nach der ersten Dosis erreicht und hielt an während des gesamten Dosierungsintervalls (24 Stunden). In nicht placebokontrollierten Verlängerungsstudien über einen Zeitraum von bis zu einem Jahr wurde während der kontinuierlichen einmal täglichen abendlichen Verabreichung keine signifikante Veränderung des Behandlungseffekts beobachtet. Das Absetzen von SINGULAIR 4 mg bei Asthmapatienten nach 12-wöchiger kontinuierlicher Anwendung führte nicht zu einer Rebound-Verschlechterung des Asthmas.
Pädiatrische Patienten im Alter von 6 bis 14 Jahren mit Asthma
Die Wirksamkeit von SINGULAIR 5 mg bei pädiatrischen Patienten im Alter von 6 bis 14 Jahren wurde in einer 8-wöchigen, doppelblinden, placebokontrollierten Studie mit 336 Patienten (201 behandelt mit SINGULAIR und 135 behandelt mit Placebo) unter Verwendung eines inhalativen β-Agonisten nachgewiesen auf einer „nach Bedarf“-Basis. Die Patienten hatten einen mittleren prozentualen FEV1-Ausgangswert von 72 % (ungefährer Bereich 45 bis 90 %) und einen mittleren täglichen Bedarf an inhalativen β-Agonisten von 3,4 Sprühstößen Albuterol. Etwa 36 % der Patienten erhielten inhalative Kortikosteroide. Das Durchschnittsalter betrug 11 Jahre (Bereich 6 bis 15); 35,4 % waren weiblich und 64,6 % männlich. Die ethnische/rassische Verteilung in dieser Studie war 80,1 % Kaukasier, 12,8 % Schwarze, 4,5 % Hispanoamerikaner und 2,7 % anderer Herkunft.
Im Vergleich zu Placebo führte die Behandlung mit einer 5-mg-Kautablette SINGULAIR 4 mg täglich zu einer signifikanten Verbesserung der prozentualen Veränderung des mittleren morgendlichen FEV1 gegenüber dem Ausgangswert (8,7 % in der mit SINGULAIR 4 mg behandelten Gruppe gegenüber 4,2 % Veränderung gegenüber dem Ausgangswert in der Placebo-Gruppe). p
Ähnlich wie in den Studien mit Erwachsenen wurde in einer unverblindeten Verlängerungsstudie ohne gleichzeitige Placebogruppe über bis zu 6 Monate keine signifikante Veränderung des Behandlungseffekts bei kontinuierlicher einmal täglicher Verabreichung beobachtet.
Pädiatrische Patienten im Alter von 2 bis 5 Jahren mit Asthma
Die Wirksamkeit von SINGULAIR zur chronischen Behandlung von Asthma bei pädiatrischen Patienten im Alter von 2 bis 5 Jahren wurde in einer 12-wöchigen placebokontrollierten Sicherheits- und Verträglichkeitsstudie mit 689 Patienten untersucht, von denen 461 mit SINGULAIR behandelt wurden. Das Durchschnittsalter betrug 4 Jahre (Bereich 2 bis 6); 41,5 % waren weiblich und 58,5 % männlich. Die ethnische/rassische Verteilung in dieser Studie war 56,5 % Kaukasier, 20,9 % Hispanoamerikaner, 14,4 % anderer Herkunft und 8,3 % Schwarze.
Während das primäre Ziel darin bestand, die Sicherheit und Verträglichkeit von SINGULAIR 10 mg in dieser Altersgruppe zu bestimmen, umfasste die Studie explorative Wirksamkeitsbewertungen, einschließlich Asthmasymptom-Scores am Tag und über Nacht, Anwendung von β-Agonisten, orale Kortikosteroid-Rescue und eine umfassende Bewertung durch den Arzt. Die Ergebnisse dieser explorativen Wirksamkeitsbewertungen zusammen mit der Pharmakokinetik und Extrapolation von Wirksamkeitsdaten älterer Patienten stützen die Gesamtschlussfolgerung, dass SINGULAIR bei der Erhaltungsbehandlung von Asthma bei Patienten im Alter von 2 bis 5 Jahren wirksam ist.
Wirkungen bei Patienten mit gleichzeitiger inhalativer Kortikosteroide
In separaten Studien an Erwachsenen wurde die Fähigkeit von SINGULAIR 10 mg untersucht, die klinische Wirkung von inhalativen Kortikosteroiden zu verstärken und das Ausschleichen der inhalativen Kortikosteroide bei gleichzeitiger Anwendung zu ermöglichen.
In eine randomisierte, placebokontrollierte Parallelgruppenstudie (n = 226) wurden Erwachsene mit stabilem Asthma mit einem mittleren FEV1 von etwa 84 % des Sollwerts aufgenommen, die zuvor verschiedene inhalative Kortikosteroide (verabreicht durch Dosieraerosole oder Trockenpulverinhalatoren) erhalten hatten ). Das Durchschnittsalter betrug 41,5 Jahre (Bereich 16 bis 70); 52,2 % waren weiblich und 47,8 % männlich. Die ethnische/rassische Verteilung in dieser Studie war 92,0 % Kaukasier, 3,5 % Schwarze, 2,2 % Hispanoamerikaner und 2,2 % Asiaten. Die Arten von inhalativen Kortikosteroiden und ihr mittlerer Ausgangsbedarf umfassten Beclomethasondipropionat (mittlere Dosis 1203 Mikrogramm/Tag), Triamcinolonacetonid (mittlere Dosis 2004 Mikrogramm/Tag), Flunisolid (mittlere Dosis 1971 Mikrogramm/Tag), Fluticasonpropionat (mittlere Dosis 1971 Mikrogramm/Tag). Dosis 1083 µg/Tag) oder Budesonid (mittlere Dosis 1192 µg/Tag). Bei einigen dieser inhalativen Kortikosteroide handelte es sich um nicht in den USA zugelassene Formulierungen, und die angegebenen Dosen sind möglicherweise nicht ex-actuator. Der Bedarf an inhalativen Kortikosteroiden vor der Studie wurde während einer 5- bis 7-wöchigen Placebo-Run-in-Phase um etwa 37 % reduziert, um die Patienten auf ihre niedrigste wirksame inhalative Kortikosteroiddosis zu titrieren. Die Behandlung mit SINGULAIR 4 mg führte zu einer weiteren Reduktion der mittleren inhalativen Kortikosteroiddosis um 47 % im Vergleich zu einer mittleren Reduktion von 30 % in der Placebogruppe über den 12-wöchigen aktiven Behandlungszeitraum (p ≤ 0,05). Es ist nicht bekannt, ob die Ergebnisse dieser Studie auf Patienten mit Asthma verallgemeinert werden können, die höhere Dosen von inhalativen Kortikosteroiden oder systemischen Kortikosteroiden benötigen.
In einer anderen randomisierten, placebokontrollierten Parallelgruppenstudie (n = 642) in einer ähnlichen Population von erwachsenen Patienten, die zuvor mit inhalativen Kortikosteroiden (Beclomethason 336 µg/Tag) behandelt, aber nicht angemessen kontrolliert wurden, wurde SINGULAIR zusätzlich zu Beclomethason verabreicht in statistisch signifikanten Verbesserungen des FEV1 im Vergleich zu den Patienten, die Beclomethason allein weiter erhielten, oder den Patienten, die Beclomethason abgesetzt und in den letzten 10 Wochen der 16-wöchigen, verblindeten Behandlungsphase nur mit Montelukast oder Placebo behandelt wurden. Patienten, die randomisiert den Behandlungsarmen mit Beclomethason zugeteilt wurden, hatten eine statistisch signifikant bessere Asthmakontrolle als die Patienten, die randomisiert SINGULAIR allein oder Placebo allein erhielten, wie durch FEV1, Asthmasymptome am Tag, PEFR, nächtliches Erwachen aufgrund von Asthma und „nach Bedarf“-β- angezeigt. agonistische Anforderungen.
Bei erwachsenen Patienten mit Asthma mit dokumentierter Aspirin-Empfindlichkeit, die fast alle gleichzeitig inhalative und/oder orale Kortikosteroide erhielten, zeigte eine 4-wöchige, randomisierte Parallelgruppenstudie (n=80), dass SINGULAIR 10 mg im Vergleich zu Placebo zu Ergebnissen führte zu einer signifikanten Verbesserung der Parameter der Asthmakontrolle. Das Ausmaß der Wirkung von SINGULAIR 4 mg bei Aspirin-empfindlichen Patienten war ähnlich der Wirkung, die bei der allgemeinen untersuchten Population von Asthmapatienten beobachtet wurde. Die Wirkung von SINGULAIR auf die bronchokonstriktorische Reaktion auf Aspirin oder andere nicht-steroidale entzündungshemmende Arzneimittel bei Aspirin-empfindlichen Asthmapatienten wurde nicht untersucht [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Belastungsinduzierte Bronchokonstriktion (EIB)
Belastungsinduzierte Bronchokonstriktion (Erwachsene, Jugendliche und pädiatrische Patienten ab 6 Jahren)
Die Wirksamkeit von SINGULAIR 5 mg, 10 mg bei Verabreichung als Einzeldosis 2 Stunden vor dem Training zur Vorbeugung von EIB wurde in drei (USA und multinationalen), randomisierten, doppelblinden, Placebo-kontrollierten Crossover-Studien mit insgesamt untersucht 160 erwachsene und jugendliche Patienten ab 15 Jahren mit EIB. Belastungstests wurden 2 Stunden, 8,5 oder 12 Stunden und 24 Stunden nach Verabreichung einer Einzeldosis des Studienmedikaments (SINGULAIR 10 mg oder Placebo) durchgeführt. Der primäre Endpunkt war in allen drei Studien (Studie A, Studie B und Studie C) der mittlere maximale prozentuale Abfall des FEV1 nach der Belastungsbelastung 2 Stunden nach der Dosisgabe. In Studie A zeigte eine Einzeldosis von SINGULAIR 10 mg einen statistisch signifikanten Schutzvorteil gegen EIB, wenn sie 2 Stunden vor dem Training eingenommen wurde. Einige Patienten waren 8,5 und 24 Stunden nach der Verabreichung vor EIB geschützt; Einige Patienten waren es jedoch nicht. Die Ergebnisse für den mittleren maximalen prozentualen Abfall zu jedem Zeitpunkt in Studie A sind in TABELLE 7 gezeigt und sind repräsentativ für die Ergebnisse der anderen beiden Studien.
Die Wirksamkeit von SINGULAIR 5-mg-Kautabletten bei Verabreichung als Einzeldosis 2 Stunden vor dem Training zur Vorbeugung von EIB wurde in einer multinationalen, randomisierten, doppelblinden, placebokontrollierten Crossover-Studie mit insgesamt 64 pädiatrischen Patienten untersucht Patienten im Alter von 6 bis 14 Jahren mit EIB. Belastungsbelastungstests wurden 2 Stunden und 24 Stunden nach Verabreichung einer Einzeldosis des Studienmedikaments (SINGULAIR 5 mg oder Placebo) durchgeführt. Der primäre Endpunkt war der mittlere maximale prozentuale Abfall des FEV1 nach der Belastungsbelastung 2 Stunden nach der Dosisgabe. Eine Einzeldosis von SINGULAIR 5 mg zeigte einen statistisch signifikanten Schutzvorteil gegen EIB, wenn sie 2 Stunden vor dem Training eingenommen wurde (TABELLE 8). Ähnliche Ergebnisse wurden 24 Stunden nach der Einnahme gezeigt (ein sekundärer Endpunkt). Einige Patienten waren 24 Stunden nach der Verabreichung vor EIB geschützt; Einige Patienten waren es jedoch nicht. Es wurden keine Zeitpunkte zwischen 2 und 24 Stunden nach der Verabreichung bewertet.
Die Wirksamkeit von SINGULAIR 5 mg zur Vorbeugung von EIB bei Patienten unter 6 Jahren wurde nicht nachgewiesen.
Die tägliche Verabreichung von SINGULAIR 4 mg zur chronischen Behandlung von Asthma ist nicht dafür geeignet, akute Episoden von EIB zu verhindern.
In einer 12-wöchigen, randomisierten, doppelblinden Parallelgruppenstudie mit 110 erwachsenen und jugendlichen Asthmatikern im Alter von 15 Jahren und älter mit einem mittleren FEV1-Prozentsatz von 83 % zu Studienbeginn und mit dokumentierter belastungsinduzierter Exazerbation von Asthma mit SINGULAIR, 10 mg, einmal täglich am Abend, führte zu einer statistisch signifikanten Verringerung des mittleren maximalen prozentualen Abfalls des FEV1 und der mittleren Zeit bis zur Erholung auf innerhalb von 5 % des FEV1 vor dem Training. Am Ende des Dosierungsintervalls (dh 20 bis 24 Stunden nach der vorhergehenden Dosis) wurde eine Belastungsbelastung durchgeführt. Diese Wirkung hielt während des 12-wöchigen Behandlungszeitraums an, was darauf hindeutet, dass keine Toleranz auftrat. SINGULAIR 4 mg verhinderte jedoch bei 52 % der untersuchten Patienten keine klinisch signifikante Verschlechterung des maximalen prozentualen Abfalls des FEV1 nach Belastung (dh ≥ 20 % Abnahme gegenüber dem Ausgangswert vor der Belastung). In einer separaten Crossover-Studie bei Erwachsenen wurde eine ähnliche Wirkung nach zweimal täglicher Gabe von 10 mg SINGULAIR beobachtet.
Bei pädiatrischen Patienten im Alter von 6 bis 14 Jahren, die die 5-mg-Kautablette einnahmen, zeigte eine 2-tägige Crossover-Studie ähnliche Wirkungen wie bei Erwachsenen, wenn am Ende des Dosierungsintervalls (d. h. 20 bis 24 Stunden nach der vorherigen Dosis).
Allergische Rhinitis (saisonal und mehrjährig)
Saisonale allergische Rhinitis
Die Wirksamkeit von SINGULAIR Tabletten zur Behandlung von saisonaler allergischer Rhinitis wurde in 5 ähnlich angelegten, randomisierten, doppelblinden, placebo- und wirkstoffkontrollierten (Loratadin) Parallelgruppenstudien untersucht, die in Nordamerika durchgeführt wurden. In die 5 Studien wurden insgesamt 5029 Patienten aufgenommen, von denen 1799 mit SINGULAIR-Tabletten behandelt wurden. Die Patienten waren 15 bis 82 Jahre alt und hatten bei Studienbeginn eine Vorgeschichte mit saisonaler allergischer Rhinitis, einen positiven Hauttest auf mindestens ein relevantes saisonales Allergen und aktive Symptome einer saisonalen allergischen Rhinitis.
Die Dauer der randomisierten Behandlung betrug 2 Wochen in 4 Studien und 4 Wochen in einer Studie. Die primäre Ergebnisvariable war die durchschnittliche Veränderung gegenüber dem Ausgangswert des Scores für nasale Symptome am Tag (der Durchschnitt der individuellen Scores für verstopfte Nase, Rhinorrhö, Nasenjucken, Niesen), die von den Patienten auf einer kategorialen Skala von 0 bis 3 bewertet wurden.
Vier der fünf Studien zeigten mit SINGULAIR 10-mg-Tabletten im Vergleich zu Placebo eine signifikante Verringerung der Scores für nasale Symptome am Tag. Die Ergebnisse eines Versuchs sind unten gezeigt. Das Durchschnittsalter in dieser Studie betrug 35,0 Jahre (Bereich 15 bis 81); 65,4 % waren weiblich und 34,6 % männlich. Die ethnische/rassische Verteilung in dieser Studie war 83,1 % Kaukasier, 6,4 % anderer Herkunft, 5,8 % Schwarze und 4,8 % Hispanoamerikaner. Die durchschnittlichen Veränderungen gegenüber dem Ausgangswert des Scores für nasale Symptome am Tag in den Behandlungsgruppen, die SINGULAIR 4 mg Tabletten, Loratadin und Placebo erhielten, sind in TABELLE 9 dargestellt. Die verbleibenden drei Studien, die die Wirksamkeit zeigten, zeigten ähnliche Ergebnisse. Die Wirksamkeit wurde bei saisonaler allergischer Rhinitis nachgewiesen, wenn Montelukast morgens oder abends verabreicht wurde.
Ganzjährige allergische Rhinitis
Die Wirksamkeit von SINGULAIR 5 mg Tabletten zur Behandlung von ganzjähriger allergischer Rhinitis wurde in zwei randomisierten, doppelblinden, placebokontrollierten Studien untersucht, die in Nordamerika und Europa durchgeführt wurden. In die beiden Studien wurden insgesamt 3357 Patienten aufgenommen, von denen 1632 SINGULAIR 10-mg-Tabletten erhielten. Patienten im Alter von 15 bis 82 Jahren mit ganzjähriger allergischer Rhinitis, bestätigt durch die Anamnese und einen positiven Hauttest auf mindestens ein relevantes ganzjähriges Allergen (Hausstaubmilben, Tierhaare und/oder Schimmelpilzsporen), die zum Zeitpunkt der Studie aktive Symptome hatten Eintrag, wurden eingeschrieben.
In der Studie, in der die Wirksamkeit nachgewiesen wurde, betrug das mediane Alter 35 Jahre (Bereich 15 bis 81); 64,1 % waren weiblich und 35,9 % männlich. Die ethnische/rassische Verteilung in dieser Studie war 83,2 % Kaukasier, 8,1 % Schwarze, 5,4 % Hispanoamerikaner, 2,3 % Asiaten und 1,0 % anderer Herkunft. Es wurde gezeigt, dass SINGULAIR 10 mg Tabletten einmal täglich die Symptome der ganzjährigen allergischen Rhinitis über einen Behandlungszeitraum von 6 Wochen signifikant reduziert (TABELLE 10); In dieser Studie war die primäre Ergebnisvariable die mittlere Veränderung des Scores für nasale Symptome am Tag (der Durchschnitt der individuellen Scores für verstopfte Nase, Rhinorrhoe und Niesen) gegenüber dem Ausgangswert.
In der anderen 6-wöchigen Studie wurden SINGULAIR 10 mg (n = 626), Placebo (n = 609) und eine aktive Kontrolle (Cetirizin 10 mg; n = 120) untersucht. Die primäre Analyse verglich die mittlere Veränderung gegenüber dem Ausgangswert des Tages-Scores für nasale Symptome für SINGULAIR vs. Placebo in den ersten 4 Behandlungswochen; Die Studie war nicht auf einen statistischen Vergleich zwischen SINGULAIR und der aktiven Kontrolle ausgelegt. Die primäre Ergebnisvariable umfasste Juckreiz in der Nase zusätzlich zu verstopfter Nase, Rhinorrhoe und Niesen. Der geschätzte Unterschied zwischen SINGULAIR und Placebo betrug -0,04 mit einem 95 %-KI von (-0,09; 0,01). Der geschätzte Unterschied zwischen der aktiven Kontrolle und dem Placebo betrug -0,10 mit einem 95 %-KI von (-0,19, -0,01).
INFORMATIONEN ZUM PATIENTEN
SINGULAIR® (SING-u-lair) (Montelukast-Natrium) Kautabletten
Was sind die wichtigsten Informationen, die ich über SINGULAIR 4 mg wissen sollte?Bei Personen, die SINGULAIR einnahmen, sind schwerwiegende psychische Gesundheitsprobleme aufgetreten oder sogar nach Beendigung der Behandlung.
Dies kann bei Menschen mit oder ohne Vorgeschichte von psychischen Gesundheitsproblemen passieren. Brechen Sie die Einnahme von SINGULAIR ab und informieren Sie unverzüglich Ihren Arzt, wenn Sie oder Ihr Kind ungewöhnliche Verhaltens- oder Denkänderungen feststellen, einschließlich eines der folgenden Symptome:
Was ist SINGULAIR 10mg?
SINGULAIR 4 mg ist ein verschreibungspflichtiges Arzneimittel, das Substanzen im Körper blockiert, die als Leukotriene bezeichnet werden. Dies kann helfen, die Symptome von Asthma und Entzündungen der Nasenschleimhaut (allergische Rhinitis) zu verbessern. SINGULAIR enthält kein Steroid. SINGULAIR wird verwendet für:
Unterlassen Sie Nehmen Sie SINGULAIR ein, wenn Sie gegen einen der Inhaltsstoffe allergisch sind. Eine vollständige Liste der Inhaltsstoffe von SINGULAIR finden Sie am Ende dieses Arzneimittelleitfadens.
Informieren Sie vor der Einnahme von SINGULAIR 4 mg Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und pflanzlicher Nahrungsergänzungsmittel. Einige Arzneimittel können die Wirkung von SINGULAIR beeinflussen, oder SINGULAIR 4 mg kann die Wirkung Ihrer anderen Arzneimittel beeinflussen.
Wie sollte ich SINGULAIR 10 mg einnehmen?
Zum jeder Wer nimmt SINGULAIR:
Für Erwachsene und Kinder ab 12 Monaten mit Asthma:
Für Personen ab 6 Jahren zur Vorbeugung von Belastungsasthma:
Für Personen ab 2 Jahren mit saisonaler allergischer Rhinitis oder für Personen ab 6 Monaten mit ganzjähriger allergischer Rhinitis:
Was sollte ich während der Einnahme von SINGULAIR 10 mg vermeiden?
Wenn Sie Asthma haben und Aspirin Ihre Asthmasymptome verschlimmert, vermeiden Sie weiterhin die Einnahme von Aspirin oder anderen Arzneimitteln, die als nichtsteroidale Antirheumatika (NSAIDs) bezeichnet werden, während Sie SINGULAIR einnehmen.
Welche Nebenwirkungen kann SINGULAIR haben?
SINGULAIR kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Informieren Sie sofort Ihren Arzt, wenn Sie eines oder mehrere dieser Symptome bemerken:
Zu den häufigsten Nebenwirkungen von SINGULAIR gehören:
Dies sind nicht alle möglichen Nebenwirkungen von SINGULAIR. Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist SINGULAIR aufzubewahren?
Allgemeine Informationen zur sicheren und wirksamen Anwendung von SINGULAIR.
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie SINGULAIR nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie SINGULAIR nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Sie können Ihren Apotheker oder Gesundheitsdienstleister nach Informationen zu SINGULAIR 10 mg fragen, die für Angehörige der Gesundheitsberufe bestimmt sind.
Was sind die Inhaltsstoffe von SINGULAIR?
Wirkstoff: Montelukast-Natrium
Inaktive Zutaten:
Gebrauchsanweisung
SINGULAIR® (SING-u-lair)(Montelukast-Natrium) Granulat zum Einnehmen
Diese Gebrauchsanweisung enthält Informationen zur Anwendung von SINGULAIR 10 mg Granulat zum Einnehmen.
Wichtige Informationen:
Wie kann ich meinem Kind SINGULAIR 4 mg Granulat zum Einnehmen geben?
Wie ist SINGULAIR 5 mg aufzubewahren?
Diese Gebrauchsanweisung wurde von der US Food and Drug Administration genehmigt