Pulmicort 100mcg, 200mcg Budesonide Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Pulmicort 100 µg Turbohaler und wie wird es angewendet?
Pulmicort 100 µg Turbohaler ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Asthma. Pulmicort 100 µg Turbohaler kann allein oder zusammen mit anderen Medikamenten angewendet werden.
Pulmicort Turbohaler gehört zu einer Klasse von Arzneimitteln namens Kortikosteroide, Inhalationsmittel.
Es ist nicht bekannt, ob Pulmicort Turbohaler bei Kindern unter 1 Jahr sicher und wirksam ist.
Welche Nebenwirkungen kann Pulmicort 200 µg Turbohaler haben?
Pulmicort 100 µg Turbohaler kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Pulmicort 100 µg Turbohaler gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Pulmicort Turbohaler. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Nur zur oralen Inhalation.
BEZEICHNUNG
Budesonid, der Wirkstoff von PULMICORT TURBUHALER (Budesonid) 200 mcg, ist ein Corticosteroid, das chemisch als (RS)-11β, 16α, 17,21-Tetrahydroxypregna-1,4-dien-3,20-dion zyklisches 16,17- Acetal mit Butyraldehyd. Budesonid wird als Mischung aus zwei Epimeren (22R und 22S) bereitgestellt. Die Summenformel von Budesonid ist C25H34O6 und sein Molekulargewicht beträgt 430,5. Seine Strukturformel lautet:
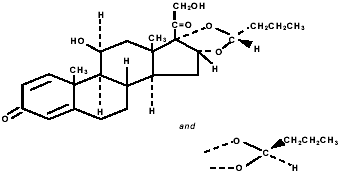
Budesonid ist ein weißes bis cremefarbenes, geschmacks- und geruchloses Pulver, das praktisch unlöslich in Wasser und Heptan, schwer löslich in Ethanol und frei löslich in Chloroform ist. Sein Verteilungskoeffizient zwischen Octanol und Wasser bei pH 7,4 beträgt 1,6 x 103.
PULMICORT 100 mcg TURBUHALER (Budesonid) ist ein inhalationsgesteuerter Mehrdosis-Trockenpulverinhalator, der nur mikronisiertes Budesonid enthält. Jeder Sprühstoß von PULMICORT 100 mcg TURBUHALER liefert 200 mcg Budesonid pro abgemessener Dosis, wodurch ungefähr 160 mcg Budesonid aus dem Mundstück abgegeben werden (basierend auf In-vitro-Tests bei 60 l/min für 2 Sekunden).
In-vitro-Tests haben gezeigt, dass die Dosisabgabe für PULMICORT 100 mcg TURBUHALER (Budesonid) wesentlich vom Luftstrom durch das Gerät abhängt. Patientenfaktoren wie inspiratorische Flussraten wirken sich auch auf die Dosis aus, die bei der tatsächlichen Anwendung an die Lungen von Patienten abgegeben wird (siehe Gebrauchsanweisung des Patienten ). Bei erwachsenen Patienten mit Asthma (mittleres FEV1 2,9 l [0,8–5,1 l]) betrug der mittlere inspiratorische Spitzenfluss (PIF) durch PULMICORT TURBUHALER (Budesonid) 78 (40–111) l/min. Ähnliche Ergebnisse (mittlerer PIF 82 [43–125] l/min) wurden bei asthmatischen Kindern (6 bis 15 Jahre, mittlerer FEV1 2,1 l [0,9–5,4 l]) erzielt. Die Patienten sollten sorgfältig in die Anwendung dieses Arzneimittels eingewiesen werden, um eine optimale Dosisabgabe sicherzustellen.
INDIKATIONEN
PULMICORT TURBUHALER (Budesonid) ist für die Dauerbehandlung von Asthma als prophylaktische Therapie bei erwachsenen und pädiatrischen Patienten ab sechs Jahren indiziert. Es ist auch für Patienten indiziert, die eine orale Kortikosteroidtherapie gegen Asthma benötigen. Viele dieser Patienten können ihren Bedarf an oralen Kortikosteroiden im Laufe der Zeit reduzieren oder eliminieren.
PULMICORT 100 mcg TURBUHALER (Budesonid) ist NICHT zur Linderung akuter Bronchospasmen indiziert.
DOSIERUNG UND ANWENDUNG
PULMICORT 200 µg TURBUHALER (Budesonid) sollte Asthmapatienten ab 6 Jahren oral inhaliert verabreicht werden. Einzelne Patienten werden einen unterschiedlichen Beginn und Grad der Symptomlinderung erfahren. Im Allgemeinen hat PULMICORT TURBUHALER (Budesonid) einen relativ schnellen Wirkungseintritt für ein inhalatives Kortikosteroid. Eine Verbesserung der Asthmakontrolle nach inhalativer Verabreichung von PULMICORT 200 µg TURBUHALER (Budesonid) kann innerhalb von 24 Stunden nach Beginn der Behandlung eintreten, obwohl der maximale Nutzen möglicherweise erst nach 1 bis 2 Wochen oder länger erreicht wird. Die Sicherheit und Wirksamkeit von PULMICORT TURBUHALER (Budesonid) bei Verabreichung über die empfohlenen Dosen hinaus wurde nicht nachgewiesen.
Die empfohlene Anfangsdosis und die höchste empfohlene Dosis von PULMICORT TURBUHALER (Budesonid) auf der Grundlage einer vorherigen Asthmatherapie sind in der folgenden Tabelle aufgeführt.
*Bei Patienten mit leichtem bis mittelschwerem Asthma, die mit inhalativen Kortikosteroiden gut eingestellt sind, kann die Gabe von PULMICORT 100 µg TURBUHALER (Budesonid) 200 µg oder 400 µg einmal täglich in Erwägung gezogen werden. PULMICORT 200 µg TURBUHALER (Budesonid) kann einmal täglich entweder morgens oder abends verabreicht werden.
Wenn die einmal tägliche Behandlung mit PULMICORT 200 mcg TURBUHALER (Budesonid) keine ausreichende Kontrolle der Asthmasymptome bewirkt, sollte die Tagesgesamtdosis erhöht und/oder als geteilte Dosis verabreicht werden.
Patienten, die auf chronischen oralen Kortikosteroiden gehalten werden
Anfänglich sollte PULMICORT TURBUHALER (Budesonid) gleichzeitig mit der üblichen systemischen Kortikosteroid-Erhaltungsdosis des Patienten angewendet werden. Nach etwa einer Woche wird mit dem schrittweisen Absetzen des systemischen Kortikosteroids begonnen, indem die tägliche oder alternierende Tagesdosis reduziert wird. Die nächste Reduktion erfolgt je nach Ansprechen des Patienten im Abstand von ein bis zwei Wochen. Im Allgemeinen sollten diese Abnahmen 2,5 mg Prednison oder dessen Äquivalent nicht überschreiten. Eine langsame Entzugsrate wird dringend empfohlen. Während der Reduktion oraler Kortikosteroide sollten die Patienten sorgfältig auf Asthmainstabilität, einschließlich objektiver Messungen der Atemwegsfunktion, und auf Nebenniereninsuffizienz überwacht werden (siehe WARNUNGEN ). Während des Absetzens können bei manchen Patienten Symptome eines systemischen Kortikosteroid-Entzugs auftreten, z. B. Gelenk- und/oder Muskelschmerzen, Abgeschlagenheit und Depression, trotz Erhaltung oder sogar Verbesserung der Lungenfunktion. Solche Patienten sollten ermutigt werden, die Behandlung mit PULMICORT TURBUHALER (Budesonid) fortzusetzen, sollten jedoch auf objektive Anzeichen einer Nebenniereninsuffizienz überwacht werden. Bei Anzeichen einer Nebenniereninsuffizienz sollten die systemischen Kortikosteroiddosen vorübergehend erhöht und danach langsamer abgesetzt werden. In Zeiten von Stress oder einem schweren Asthmaanfall können Transferpatienten eine zusätzliche Behandlung mit systemischen Kortikosteroiden benötigen.
HINWEIS: Bei allen Patienten ist es wünschenswert, auf die niedrigste wirksame Dosis zu titrieren, sobald die Asthmastabilität erreicht ist.
Gebrauchsanweisung
Illustrierte Patientenanweisungen zur Verwendung liegt jeder Packung PULMICORT 200 mcg TURBUHALER (Budesonid) bei.
Die Patienten sollten angewiesen werden, PULMICORT TURBUHALER (Budesonid) vor der ersten Anwendung zu entlüften und bei jeder Verwendung des Geräts tief und kräftig zu inhalieren. Es wird auch empfohlen, den Mund nach der Inhalation zu spülen.
WIE GELIEFERT
PULMICORT TURBUHALER (Budesonid) besteht aus einer Reihe zusammengesetzter Kunststoffteile, wobei die Hauptteile der Dosiermechanismus, die Aufbewahrungseinheit für die Arzneimittelsubstanz und das Mundstück sind. Der Inhalator ist durch eine weiße äußere röhrenförmige Abdeckung geschützt, die auf den Inhalator geschraubt wird. Das Gehäuse des Inhalators ist weiß und der Drehgriff ist braun. Auf dem Griff ist in erhabener Schrift der folgende Wortlaut aufgedruckt: „Pulmicort™ 200 mcg“. Der TURBUHALER-Inhalator kann nicht nachgefüllt werden und sollte entsorgt werden, wenn er leer ist.
PULMICORT TURBUHALER (Budesonid) ist als 200 mcg/Dosis, 200 Dosen (NDC 0186-0915-42) erhältlich und hat ein Zielfüllgewicht von 104 mg.
Wenn noch 20 Dosen PULMICORT 200 mcg TURBUHALER (Budesonid) übrig sind, erscheint eine rote Markierung im Indikatorfenster. Wenn das Gerät über den Punkt hinaus verwendet wird, an dem die rote Markierung am unteren Rand des Fensters erscheint, wird möglicherweise nicht die richtige Medikamentenmenge erhalten. Das Gerät sollte entsorgt werden.
Mit festgezogenem Deckel an einem trockenen Ort bei kontrollierter Raumtemperatur von 20-25°C (68-77°F) lagern [siehe USP]. Von Kindern fern halten.
Alle Marken sind Eigentum der AstraZeneca-Unternehmensgruppe. ©AstraZeneca 2001, 2006. Hergestellt für: AstraZeneca LP, Wilmington, DE 19850 Von: AstraZeneca AB, Sodertälje, Schweden 33020-00. Rev. 10/06. Revisionsdatum der FDA: 20.08.2007
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen wurden bei Patienten berichtet, die mit PULMICORT 100 µg TURBUHALER (Budesonid) behandelt wurden.
Die Häufigkeit häufiger Nebenwirkungen basiert auf doppelblinden, placebokontrollierten klinischen Studien in den USA, in denen 1116 erwachsene und pädiatrische Patienten im Alter von 6 bis 70 Jahren (472 Frauen und 644 Männer) mit PULMICORT TURBUHALER (Budesonid) behandelt wurden (200 bis 800 mcg zweimal täglich für 12 bis 20 Wochen) oder Placebo.
Die folgende Tabelle zeigt die Inzidenz unerwünschter Ereignisse bei Patienten, die zuvor Bronchodilatatoren und/oder inhalative Kortikosteroide in kontrollierten klinischen Studien in den USA erhalten hatten. Diese Population umfasste 232 männliche und 62 weibliche pädiatrische Patienten (im Alter von 6 bis 17 Jahren) und 332 männliche und 331 weibliche erwachsene Patienten (im Alter von 18 Jahren und älter).
Unerwünschte Ereignisse mit einer Inzidenz von ≥ 3 %, die von Patienten unter PULMICORT 100 mcg TURBUHALER (Budesonid) berichtet wurden
Die obige Tabelle enthält alle Ereignisse (unabhängig davon, ob sie von den Prüfärzten als arzneimittelbedingt oder nicht arzneimittelbedingt angesehen wurden), die in einer beliebigen PULMICORT TURBUHALER (Budesonid)-Gruppe mit einer Rate von ≥ 3 % auftraten und häufiger auftraten als in der Placebo-Gruppe. Bei der Berücksichtigung dieser Daten sollte die verlängerte durchschnittliche Expositionsdauer für Patienten mit PULMICORT 200 µg TURBUHALER (Budesonid) berücksichtigt werden.
Die folgenden anderen Nebenwirkungen traten in diesen klinischen Studien mit PULMICORT 100 µg TURBUHALER (Budesonid) mit einer Inzidenz von 1 bis 3 % auf und traten unter PULMICORT 200 µg TURBUHALER (Budesonid) häufiger auf als unter Placebo.
Körper als Ganzes: Nackenschmerzen
Herz-Kreislauf: Synkope
Verdauungs: Bauchschmerzen, Mundtrockenheit, Erbrechen
Stoffwechsel und Ernährung: Gewichtszunahme
Bewegungsapparat: Fraktur, Myalgie
Nervös: Hypertonie, Migräne
Blutplättchen, Blutung und Gerinnung: Ekchymose
Psychiatrie: Schlaflosigkeit
Widerstandsmechanismen: Infektion
Besondere Sinne: Geschmacksperversion
In einer 20-wöchigen Studie mit erwachsenen Asthmatikern, die zuvor orale Kortikosteroide benötigten, wurden die Wirkungen von PULMICORT TURBUHALER (Budesonid) 400 µg zweimal täglich (N = 53) und 800 µg zweimal täglich (N = 53) mit Placebo (N = 53) verglichen ) zur Häufigkeit gemeldeter unerwünschter Ereignisse. Unerwünschte Ereignisse, die von den Prüfärzten als arzneimittelbedingt oder nicht arzneimittelbedingt angesehen wurden und bei mehr als fünf Patienten in der Gruppe mit PULMICORT 200 mcg TURBUHALER (Budesonid) berichtet wurden und die unter PULMICORT TURBUHALER (Budesonid) häufiger auftraten als unter Placebo, sind nachstehend aufgeführt ( % PULMICORT TURBUHALER (Budesonid) und % Placebo). Bei der Berücksichtigung dieser Daten sollte die verlängerte durchschnittliche Expositionsdauer für Patienten mit PULMICORT 200 µg TURBUHALER (Budesonid) (78 Tage für PULMICORT TURBUHALER (Budesonid) gegenüber 41 Tagen für Placebo) berücksichtigt werden.
Patienten, die PULMICORT TURBUHALER (Budesonid) einmal täglich erhalten
Das Nebenwirkungsprofil der einmal täglichen Verabreichung von PULMICORT 100 µg TURBUHALER (Budesonid) 200 µg und 400 µg und Placebo wurde bei 309 erwachsenen Asthmapatienten in einer 18-wöchigen Studie untersucht. Die Studienpopulation umfasste sowohl Patienten, die zuvor mit inhalativen Kortikosteroiden behandelt wurden, als auch Patienten, die zuvor keine Kortikosteroidtherapie erhalten hatten. Es gab keinen klinisch relevanten Unterschied im Muster der Nebenwirkungen nach einmal täglicher Gabe von PULMICORT 200 µg TURBUHALER (Budesonid) im Vergleich zu zweimal täglicher Gabe.
Pädiatrische Studien: In einer 12-wöchigen placebokontrollierten Studie mit 404 pädiatrischen Patienten im Alter von 6 bis 18 Jahren, die zuvor inhalative Kortikosteroide erhalten hatten, war die Häufigkeit von Nebenwirkungen für jede Alterskategorie (6 bis 12 Jahre, 13 bis 18 Jahre) für PULMICORT TURBUHALER vergleichbar (Budesonid) (mit 100, 200 und 400 mcg zweimal täglich) und Placebo. Es gab keine klinisch relevanten Unterschiede im Muster oder Schweregrad der Nebenwirkungen bei Kindern im Vergleich zu denen, die bei Erwachsenen berichtet wurden.
Berichte über unerwünschte Ereignisse aus anderen Quellen: Zu den seltenen unerwünschten Ereignissen, die in der veröffentlichten Literatur oder aus weltweiten Marketingerfahrungen mit einer Formulierung von inhalativem Budesonid berichtet wurden, gehören: sofortige und verzögerte Überempfindlichkeitsreaktionen einschließlich Hautausschlag, Kontaktdermatitis, Urtikaria, Angioödem und Bronchospasmus; Symptome von Hypokortizismus und Hyperkortizismus; Glaukom, Katarakte; psychiatrische Symptome einschließlich Depression, aggressive Reaktionen, Reizbarkeit, Angst und Psychose.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
In klinischen Studien hat die gleichzeitige Gabe von Budesonid und anderen Arzneimitteln, die üblicherweise zur Behandlung von Asthma eingesetzt werden, nicht zu einer erhöhten Häufigkeit von Nebenwirkungen geführt. Der Hauptmetabolisierungsweg von Budesonid sowie anderen Kortikosteroiden verläuft über das Isoenzym 3A4 (CYP3A4) von Cytochrom P450 (CYP). Nach oraler Verabreichung von Ketoconazol, einem potenten CYP3A4-Inhibitor, stieg die mittlere Plasmakonzentration von oral verabreichtem Budesonid an. Die gleichzeitige Verabreichung anderer bekannter CYP3A4-Inhibitoren (z. B. Itraconazol, Clarithromycin, Erythromycin usw.) kann den Metabolismus von Budesonid hemmen und die systemische Exposition gegenüber Budesonid erhöhen. Vorsicht ist geboten, wenn Budesonid gleichzeitig mit Ketoconazol und anderen bekannten CYP3A4-Inhibitoren zur Langzeitanwendung verabreicht wird.
WARNUNGEN
Besondere Vorsicht ist bei Patienten geboten, die von systemisch wirksamen Kortikosteroiden auf PULMICORT 200 mcg TURBUHALER (Budesonid) umgestellt werden, da bei Asthmapatienten während und nach der Umstellung von systemisch wirksamen Kortikosteroiden auf weniger systemisch verfügbare inhalative Kortikosteroide Todesfälle aufgrund von Nebenniereninsuffizienz aufgetreten sind. Nach dem Absetzen von systemischen Kortikosteroiden dauert es einige Monate, bis sich die Hypothalamus-Hypophysen-Nebennierenfunktion (HPA) erholt hat.
Patienten, die zuvor mit 20 mg oder mehr Prednison (oder einem Äquivalent) pro Tag behandelt wurden, sind möglicherweise am anfälligsten, insbesondere wenn ihre systemischen Kortikosteroide fast vollständig abgesetzt wurden. Während dieser Phase der HPA-Unterdrückung können Patienten Anzeichen und Symptome einer Nebenniereninsuffizienz zeigen, wenn sie einem Trauma, einer Operation oder einer Infektion (insbesondere Gastroenteritis) oder anderen Erkrankungen ausgesetzt sind, die mit einem schweren Elektrolytverlust einhergehen. Obwohl PULMICORT TURBUHALER (Budesonid) die Asthmasymptome während dieser Episoden kontrollieren kann, liefert es in den empfohlenen Dosen systemisch weniger als die normalen physiologischen Mengen an Glucocorticoid und liefert NICHT die Mineralocorticoid-Aktivität, die zur Bewältigung dieser Notfälle erforderlich ist.
In Zeiten von Stress oder einem schweren Asthmaanfall sollten Patienten, die von systemischen Kortikosteroiden abgesetzt wurden, angewiesen werden, die oralen Kortikosteroide (in hohen Dosen) sofort wieder aufzunehmen und sich für weitere Anweisungen an ihren Arzt zu wenden. Diese Patienten sollten auch angewiesen werden, einen ärztlichen Ausweis mit sich zu führen, aus dem hervorgeht, dass sie in Stressphasen oder bei einem schweren Asthmaanfall möglicherweise zusätzliche systemische Kortikosteroide benötigen.
Patienten, die orale Kortikosteroide benötigen, sollten nach der Umstellung auf PULMICORT 100 µg TURBUHALER (Budesonid) langsam von der Anwendung systemischer Kortikosteroide entwöhnt werden. Die Lungenfunktion (FEV1 oder AM PEF), die Anwendung von Beta-Agonisten und Asthmasymptome sollten während des Absetzens von oralen Kortikosteroiden sorgfältig überwacht werden. Zusätzlich zur Überwachung der Asthmazeichen und -symptome sollten die Patienten auf Zeichen und Symptome einer Nebenniereninsuffizienz wie Müdigkeit, Abgeschlagenheit, Schwäche, Übelkeit und Erbrechen sowie Hypotonie beobachtet werden.
Die Umstellung von Patienten von einer systemischen Kortikosteroidtherapie auf PULMICORT 200 µg TURBUHALER (Budesonid) kann allergische Zustände aufdecken, die zuvor durch die systemische Kortikosteroidtherapie unterdrückt wurden, z. B. Rhinitis, Konjunktivitis, Arthritis, eosinophile Erkrankungen und Ekzeme (siehe DOSIERUNG UND ANWENDUNG ).
Patienten, die Medikamente einnehmen, die das Immunsystem unterdrücken, sind anfälliger für Infektionen als gesunde Personen. Windpocken und Masern beispielsweise können bei empfindlichen pädiatrischen Patienten oder Erwachsenen unter immunsuppressiven Dosen von Kortikosteroiden einen schwerwiegenderen oder sogar tödlichen Verlauf nehmen. Bei pädiatrischen oder erwachsenen Patienten, die diese Erkrankungen noch nicht hatten, sollte besonders darauf geachtet werden, eine Exposition zu vermeiden. Wie sich Dosis, Art und Dauer der Kortikosteroidverabreichung auf das Risiko der Entwicklung einer disseminierten Infektion auswirken, ist nicht bekannt. Der Beitrag der zugrunde liegenden Erkrankung und/oder einer vorherigen Behandlung mit Kortikosteroiden zum Risiko ist ebenfalls nicht bekannt. Bei Exposition kann gegebenenfalls eine Therapie mit Varizella-Zoster-Immunglobulin (VZIG) oder gepooltem intravenösen Immunglobulin (IVIG) angezeigt sein. Bei Exposition gegenüber Masern kann eine Prophylaxe mit gepooltem intramuskulärem Immunglobulin (IG) angezeigt sein. (Siehe die jeweiligen Packungsbeilagen für vollständige VZIG- und IG-Verschreibungsinformationen.) Wenn sich Windpocken entwickeln, kann eine Behandlung mit antiviralen Mitteln in Betracht gezogen werden.
PULMICORT 200 mcg TURBUHALER (Budesonid) ist kein Bronchodilatator und nicht zur schnellen Linderung von Bronchospasmen oder anderen akuten Asthmaanfällen indiziert.
Wie bei anderen inhalativen Asthmamedikamenten kann es nach der Einnahme zu Bronchospasmen mit einer sofortigen Zunahme von Keuchen kommen. Wenn nach der Anwendung von PULMICORT TURBUHALER (Budesonid) ein Bronchospasmus auftritt, sollte dieser sofort mit einem schnell wirkenden inhalativen Bronchodilatator behandelt werden. Die Behandlung mit PULMICORT TURBUHALER (Budesonid) sollte abgebrochen und eine alternative Therapie eingeleitet werden.
Die Patienten sollten angewiesen werden, sich unverzüglich an ihren Arzt zu wenden, wenn während der Behandlung mit PULMICORT TURBUHALER (Budesonid) Asthmaanfälle auftreten, die nicht auf ihre üblichen Dosen von Bronchodilatatoren ansprechen. Während solcher Episoden benötigen die Patienten möglicherweise eine Therapie mit oralen Kortikosteroiden.
VORSICHTSMASSNAHMEN
Allgemein
Während des Absetzens von oralen Kortikosteroiden können bei manchen Patienten trotz Aufrechterhaltung oder sogar Verbesserung der Atemfunktion Symptome eines systemisch wirksamen Kortikosteroid-Entzugs auftreten, z DOSIERUNG UND ANWENDUNG ).
Bei ansprechenden Patienten kann PULMICORT TURBUHALER (Budesonid) die Kontrolle von Asthmasymptomen mit einer geringeren Unterdrückung der HPA-Achsenfunktion ermöglichen als therapeutisch äquivalente orale Dosen von Prednison. Da Budesonid in den Kreislauf aufgenommen wird und systemisch aktiv sein kann, sind die vorteilhaften Wirkungen von PULMICORT 100 µg TURBUHALER (Budesonid) zur Minimierung der HPA-Dysfunktion nur dann zu erwarten, wenn die empfohlenen Dosierungen nicht überschritten werden und einzelne Patienten auf die niedrigste wirksame Dosis titriert werden. Da eine individuelle Empfindlichkeit gegenüber Auswirkungen auf die Cortisolproduktion besteht, sollten Ärzte diese Informationen berücksichtigen, wenn sie PULMICORT 100 mcg TURBUHALER (Budesonid) verschreiben.
Wegen der Möglichkeit einer systemischen Resorption von inhalativen Kortikosteroiden sollten Patienten, die mit PULMICORT 200 µg TURBUHALER (Budesonid) behandelt werden, sorgfältig auf Hinweise auf systemische Kortikosteroidwirkungen überwacht werden. Besondere Sorgfalt sollte bei der Beobachtung von Patienten postoperativ oder während Stressphasen auf Anzeichen einer unzureichenden Nebennierenreaktion angewendet werden.
Es ist möglich, dass systemische Kortikosteroidwirkungen wie Hyperkortizismus, reduzierte Knochenmineraldichte und Nebennierensuppression bei einer kleinen Anzahl von Patienten auftreten können, insbesondere bei höheren Dosen. Wenn solche Veränderungen auftreten, sollte PULMICORT 100 µg TURBUHALER (Budesonid) langsam reduziert werden, im Einklang mit anerkannten Verfahren zur Behandlung von Asthmasymptomen und zum Ausschleichen systemischer Steroide.
Oral inhalierte Kortikosteroide, einschließlich Budesonid, können bei pädiatrischen Patienten zu einer Verringerung der Wachstumsgeschwindigkeit führen. Als Folge einer unzureichenden Asthmakontrolle oder der Anwendung von Kortikosteroiden zur Behandlung kann es zu einer Verringerung der Wachstumsgeschwindigkeit kommen. Die potenziellen Auswirkungen einer verlängerten Behandlung auf die Wachstumsgeschwindigkeit sollten gegen den erzielten klinischen Nutzen und die mit alternativen Therapien verbundenen Risiken abgewogen werden. Um die systemischen Wirkungen von oral inhalativen Kortikosteroiden, einschließlich PULMICORT 200 mcg TURBUHALER (Budesonid), zu minimieren, sollte jeder Patient auf seine/ihre niedrigste wirksame Dosis titriert werden (siehe VORSICHTSMASSNAHMEN, pädiatrische Verwendung ).
Obwohl Patienten in klinischen Studien PULMICORT TURBUHALER (Budesonid) kontinuierlich über Zeiträume von 1 bis 2 Jahren erhalten haben, sind die langfristigen lokalen und systemischen Wirkungen von PULMICORT 200 µg TURBUHALER (Budesonid) bei Menschen nicht vollständig bekannt. Insbesondere die Auswirkungen einer chronischen Anwendung von PULMICORT TURBUHALER (Budesonid) auf Entwicklungs- oder immunologische Prozesse in Mund, Rachen, Luftröhre und Lunge sind nicht bekannt.
In klinischen Studien mit PULMICORT TURBUHALER (Budesonid) traten bei einigen Patienten lokalisierte Infektionen mit Candida albicans im Mund und Rachen auf. Diese Infektionen können eine Behandlung mit einem geeigneten Antimykotikum und/oder ein Absetzen der Behandlung mit PULMICORT TURBUHALER (Budesonid) erfordern.
Inhalative Kortikosteroide sollten bei Patienten mit aktiver oder ruhender Tuberkulose-Infektion der Atemwege, unbehandelten systemischen Pilzinfektionen, bakteriellen, viralen oder parasitären Infektionen oder okulärem Herpes simplex, wenn überhaupt, mit Vorsicht angewendet werden.
Nach der inhalativen Verabreichung von Kortikosteroiden wurde über seltene Fälle von Glaukom, erhöhtem Augeninnendruck und Katarakt berichtet.
Informationen für Patienten
Patienten, die mit PULMICORT TURBUHALER (Budesonid) behandelt werden, sollten die folgenden Informationen und Anweisungen erhalten. Diese Informationen sollen den Patienten bei der sicheren und wirksamen Anwendung des Medikaments unterstützen. Es handelt sich nicht um eine Offenlegung aller möglichen nachteiligen oder beabsichtigten Wirkungen. Für die ordnungsgemäße Anwendung von PULMICORT 200 mcg TURBUHALER (Budesonid) und um eine maximale Verbesserung zu erzielen, sollte der Patient die beiliegende Anleitung lesen und befolgen Anweisungen des Patienten vorsichtig verwenden.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Zur Bewertung des kanzerogenen Potenzials von Budesonid wurden Langzeitstudien an Ratten und Mäusen mit oraler Verabreichung durchgeführt.
In einer 104-wöchigen oralen Studie an Sprague-Dawley-Ratten wurde bei männlichen Ratten, die eine orale Dosis von 50 µg/kg/Tag (weniger als die maximal empfohlene tägliche Inhalationsdosis bei Erwachsenen und Kinder auf mcg/m2-Basis). Bei männlichen und weiblichen Ratten wurde bei oralen Dosen von bis zu 25 bzw. 50 µg/kg (weniger als die maximal empfohlene tägliche Inhalationsdosis bei Erwachsenen und Kindern auf µg/m2-Basis) keine Tumorigenität beobachtet. In zwei weiteren zweijährigen Studien an männlichen Fischer- und Sprague-Dawley-Ratten verursachte Budesonid bei einer oralen Dosis von 50 µg/kg (weniger als die maximal empfohlene tägliche Inhalationsdosis bei Erwachsenen und Kindern auf µg/m2-Basis) keine Gliome. Bei männlichen Sprague-Dawley-Ratten verursachte Budesonid jedoch bei einer oralen Dosis von 50 µg/kg (weniger als die maximal empfohlene tägliche Inhalationsdosis bei Erwachsenen und Kindern auf µg/m2-Basis) einen statistisch signifikanten Anstieg der Inzidenz von hepatozellulären Tumoren ). Die gleichzeitigen Referenzkortikosteroide (Prednison und Triamcinolonacetonid) in diesen beiden Studien zeigten ähnliche Ergebnisse.
Es gab keine Hinweise auf eine krebserzeugende Wirkung, wenn Budesonid Mäusen 91 Wochen lang oral in Dosen von bis zu 200 µg/kg/Tag verabreicht wurde (weniger als die maximal empfohlene tägliche Inhalationsdosis bei Erwachsenen und Kindern auf µg/m2-Basis).
Budesonid war in sechs verschiedenen Testsystemen nicht mutagen oder klastogen: Ames-Salmonella/Mikrosomenplattentest, Maus-Mikrokerntest, Maus-Lymphomtest, Chromosomenaberrationstest in menschlichen Lymphozyten, geschlechtsgebundener rezessiver Letaltest in Drosophila melanogaster und DNA-Reparaturanalyse in Ratten Hepatozytenkultur.
Bei Ratten hatte Budesonid bei subkutanen Dosen von bis zu 80 µg/kg (weniger als die maximal empfohlene tägliche Inhalationsdosis beim Menschen auf µg/m2-Basis) keine Wirkung auf die Fertilität.
Bei 20 µg/kg/Tag (weniger als die maximal empfohlene tägliche Inhalationsdosis beim Menschen auf µg/m2-Basis) wurde eine Abnahme der Körpergewichtszunahme der Mutter, der pränatalen Lebensfähigkeit und der Lebensfähigkeit der Jungen bei der Geburt und während der Laktation beobachtet. Bei 5 µg/kg (weniger als die maximal empfohlene tägliche Inhalationsdosis für Erwachsene auf µg/m2-Basis) wurden keine derartigen Wirkungen festgestellt.
Schwangerschaft: Teratogene Wirkungen
Schwangerschaftskategorie B: Wie andere Glucocorticoide führte Budesonid bei subkutanen Dosen von 25 µg/kg/Tag bei Kaninchen (weniger als die maximal empfohlene tägliche Inhalationsdosis beim Menschen auf µg/m2-Basis) zu fötalen Verlusten, verringertem Gewicht der Jungtiere und Skelettanomalien. und 500 Mikrogramm/kg/Tag bei Ratten (ungefähr das Dreifache der maximal empfohlenen täglichen Inhalationsdosis beim Menschen auf Mikrogramm/m2-Basis).
Bei Ratten wurden keine teratogenen oder embryoziden Wirkungen beobachtet, wenn Budesonid durch Inhalation in Dosen von bis zu 250 µg/kg/Tag verabreicht wurde (entsprechend der maximal empfohlenen täglichen Inhalationsdosis beim Menschen auf µg/m2-Basis).
Die Erfahrung mit oralen Kortikosteroiden seit ihrer Einführung in pharmakologische im Gegensatz zu physiologischen Dosen legt nahe, dass Nagetiere anfälliger für teratogene Wirkungen von Kortikosteroiden sind als Menschen.
Studien an schwangeren Frauen haben jedoch nicht gezeigt, dass PULMICORT TURBUHALER (Budesonid) das Risiko von Anomalien erhöht, wenn es während der Schwangerschaft verabreicht wird. Die Ergebnisse einer großen bevölkerungsbasierten prospektiven epidemiologischen Kohortenstudie, in der Daten aus drei schwedischen Registern überprüft wurden, die etwa 99 % der Schwangerschaften von 1995-1997 abdecken (dh schwedisches medizinisches Geburtsregister; Register für angeborene Fehlbildungen; Register für Kinderkardiologie), weisen auf kein erhöhtes Risiko hin bei angeborenen Fehlbildungen durch die Anwendung von inhalativem Budesonid während der Frühschwangerschaft. Angeborene Fehlbildungen wurden bei 2.014 Säuglingen von Müttern untersucht, die über die Anwendung von inhalativem Budesonid gegen Asthma in der Frühschwangerschaft (normalerweise 10-12 Wochen nach der letzten Monatsblutung) berichteten, dem Zeitraum, in dem die meisten größeren Organfehlbildungen auftreten. Die Rate der erfassten angeborenen Fehlbildungen war im Vergleich zur Allgemeinbevölkerung ähnlich (3,8 % vs. 3,5 %). Darüber hinaus war die Zahl der Säuglinge, die mit orofazialen Spalten geboren wurden, nach Exposition gegenüber inhaliertem Budesonid ähnlich der erwarteten Zahl in der Normalbevölkerung (4 Kinder vs. 3,3).
Dieselben Daten wurden in einer zweiten Studie verwendet, die die Gesamtzahl auf 2.534 Säuglinge brachte, deren Mütter inhaliertem Budesonid ausgesetzt waren. In dieser Studie unterschied sich die Rate angeborener Missbildungen bei Säuglingen, deren Mütter während der Frühschwangerschaft inhalativem Budesonid ausgesetzt waren, nicht von der Rate aller Neugeborenen im gleichen Zeitraum (3,6 %).
Trotz der Tierbefunde scheint es, dass die Möglichkeit einer fetalen Schädigung gering ist, wenn das Medikament während der Schwangerschaft verwendet wird. Da die Studien am Menschen jedoch die Möglichkeit einer Schädigung nicht ausschließen können, sollte PULMICORT TURBUHALER (Budesonid) während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.

Nicht teratogene Wirkungen
Hypoadrenalismus kann bei Säuglingen auftreten, deren Mütter während der Schwangerschaft Kortikosteroide erhalten haben. Solche Säuglinge sollten sorgfältig beobachtet werden.
Stillende Mutter
Kortikosteroide werden in die Muttermilch ausgeschieden. Aufgrund des Potenzials von Nebenwirkungen bei gestillten Säuglingen durch Kortikosteroide sollte eine Entscheidung getroffen werden, ob das Stillen oder das Medikament abgesetzt werden soll, wobei die Bedeutung des Medikaments für die Mutter zu berücksichtigen ist. Aktuelle Daten für Budesonid fehlen.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von PULMICORT 100 µg TURBUHALER (Budesonid) bei pädiatrischen Patienten unter 6 Jahren wurde nicht nachgewiesen.
Bei pädiatrischen Asthmapatienten war die Häufigkeit der unter PULMICORT 100 µg TURBUHALER (Budesonid) beobachteten Nebenwirkungen in der Altersgruppe der 6- bis 12-Jährigen (N = 172) ähnlich wie in der Altersgruppe der 13- bis 17-Jährigen (N = 124). .
Kontrollierte klinische Studien haben gezeigt, dass oral inhalierte Kortikosteroide bei pädiatrischen Patienten zu einer Verringerung der Wachstumsgeschwindigkeit führen können. Dieser Effekt wurde in Abwesenheit von Labornachweisen für eine Unterdrückung der Hypothalamus-Hypophysen-Nebennieren-Achse (HPA) beobachtet, was darauf hindeutet, dass die Wachstumsgeschwindigkeit ein empfindlicherer Indikator für die systemische Kortikosteroid-Exposition bei pädiatrischen Patienten ist als einige häufig verwendete Tests der HPA-Achsenfunktion. Die langfristigen Auswirkungen dieser Verringerung der Wachstumsgeschwindigkeit im Zusammenhang mit oral inhalativen Kortikosteroiden, einschließlich der Auswirkungen auf die Endgröße des Erwachsenen, sind nicht bekannt. Das Potenzial für ein „aufholendes“ Wachstum nach Absetzen der Behandlung mit oral inhalativen Kortikosteroiden wurde nicht ausreichend untersucht.
In einer Studie mit asthmatischen Kindern im Alter von 5 bis 12 Jahren hatten diejenigen, die mit PULMICORT 200 µg TURBUHALER (Budesonid) 200 µg zweimal täglich (n = 311) behandelt wurden, eine 1,1-Zentimeter-Verringerung des Wachstums im Vergleich zu denen, die Placebo erhielten (n = 418). am Ende eines Jahres; der Unterschied zwischen diesen beiden Behandlungsgruppen nahm über drei Jahre zusätzlicher Behandlung nicht weiter zu. Am Ende von vier Jahren hatten Kinder, die mit PULMICORT TURBUHALER (Budesonid) behandelt wurden, und Kinder, die mit Placebo behandelt wurden, ähnliche Wachstumsgeschwindigkeiten. Die aus dieser Studie gezogenen Schlussfolgerungen können durch die ungleiche Verwendung von Kortikosteroiden in den Behandlungsgruppen und die Einbeziehung von Daten von Patienten, die im Verlauf der Studie die Pubertät erreichten, verfälscht werden.
Das Wachstum von pädiatrischen Patienten, die oral inhalative Kortikosteroide, einschließlich PULMICORT TURBUHALER (Budesonid), erhalten, sollte routinemäßig überwacht werden (z. B. mittels Stadiometrie). Die potenziellen Wachstumseffekte einer verlängerten Behandlung sollten gegen den erzielten klinischen Nutzen und die mit alternativen Therapien verbundenen Risiken und Vorteile abgewogen werden. Um die systemischen Wirkungen von inhalativen Kortikosteroiden, einschließlich PULMICORT 100 mcg TURBUHALER (Budesonid), zu minimieren, sollte jeder Patient auf seine/ihre niedrigste wirksame Dosis titriert werden.
Geriatrische Verwendung
Einhundert Patienten, die 65 Jahre oder älter waren, wurden in die kontrollierten klinischen Studien in den USA und außerhalb der USA mit PULMICORT 100 mcg TURBUHALER (Budesonid) eingeschlossen. Es gab keine Unterschiede in der Sicherheit und Wirksamkeit des Medikaments im Vergleich zu denen, die bei jüngeren Patienten beobachtet wurden.
Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
ÜBERDOSIS
Das Potenzial für akute toxische Wirkungen nach einer Überdosierung von PULMICORT 100 µg TURBUHALER (Budesonid) ist gering. Bei Anwendung überhöhter Dosen über einen längeren Zeitraum können systemische Kortikosteroidwirkungen wie Hyperkortizismus auftreten (vgl VORSICHTSMASSNAHMEN ). PULMICORT TURBUHALER in der doppelten empfohlenen Höchstdosis (3200 mcg täglich), die über 6 Wochen verabreicht wurde, verursachte eine signifikante Verringerung (27 %) der Cortisolreaktion im Plasma auf eine 6-stündige ACTH-Infusion im Vergleich zu Placebo (+1 %). Die entsprechende Wirkung von 10 mg Prednison täglich war eine 35 %ige Reduktion der Plasma-Cortisol-Reaktion auf ACTH.
Die minimale tödliche Inhalationsdosis bei Mäusen betrug 100 mg/kg (ungefähr das 320-fache der maximal empfohlenen täglichen Inhalationsdosis bei Erwachsenen und ungefähr das 380-fache der maximal empfohlenen täglichen Inhalationsdosis bei Kindern, auf Mikrogramm/m2-Basis). Es gab keine Todesfälle nach Verabreichung einer Inhalationsdosis von 68 mg/kg bei Ratten (ungefähr das 430-fache der maximal empfohlenen täglichen Inhalationsdosis bei Erwachsenen und ungefähr das 510-fache der maximal empfohlenen täglichen Inhalationsdosis bei Kindern auf Mikrogramm/m2-Basis). Die minimale orale tödliche Dosis betrug 200 mg/kg bei Mäusen (ungefähr das 630-fache der maximal empfohlenen täglichen Inhalationsdosis bei Erwachsenen und ungefähr das 750-fache der maximal empfohlenen täglichen Inhalationsdosis bei Kindern auf einer mcg/m2-Basis) und weniger als 100 mg/kg bei Ratten (etwa das 630-fache der maximal empfohlenen täglichen Inhalationsdosis bei Erwachsenen und etwa das 750-fache der maximal empfohlenen täglichen Inhalationsdosis bei Kindern, basierend auf µg/m2).
Erfahrungen nach der Markteinführung zeigten, dass Patienten mit akuter Überdosierung von inhaliertem Budesonid häufig asymptomatisch blieben. Die Anwendung überhöhter Dosen (bis zu 6400 mcg täglich) über einen längeren Zeitraum zeigte systemische Kortikosteroidwirkungen wie Hyperkortizismus.
KONTRAINDIKATIONEN
PULMICORT TURBUHALER (Budesonid) ist kontraindiziert bei der Erstbehandlung des Status asthmaticus oder anderer akuter Asthmaanfälle, bei denen intensive Maßnahmen erforderlich sind.
Überempfindlichkeit gegen Budesonid kontraindiziert die Anwendung von PULMICORT TURBUHALER (Budesonid).
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Budesonid ist ein entzündungshemmendes Corticosteroid, das eine starke Glucocorticoid-Aktivität und eine schwache Mineralocorticoid-Aktivität aufweist. In standardmäßigen In-vitro- und Tiermodellen hat Budesonid eine etwa 200-fach höhere Affinität zum Glukokortikoidrezeptor und eine 1000-fach höhere topische entzündungshemmende Wirkung als Cortisol (Ratten-Crotonöl-Ohrödem-Assay). Als Maß für die systemische Aktivität ist Budesonid 40-mal wirksamer als Cortisol, wenn es subkutan verabreicht wird, und 25-mal wirksamer, wenn es oral verabreicht wird, im Ratten-Thymus-Involutions-Assay.
Die Aktivität von PULMICORT 100 µg TURBUHALER ist auf die Ausgangssubstanz Budesonid zurückzuführen. In Glucocorticoid-Rezeptor-Affinitätsstudien war die 22R-Form zweimal so aktiv wie das 22S-Epimer. In-vitro-Studien zeigten, dass sich die beiden Formen von Budesonid nicht ineinander umwandeln.
Der genaue Wirkmechanismus von Kortikosteroiden auf Entzündungen bei Asthma ist nicht bekannt. Entzündung ist eine wichtige Komponente in der Pathogenese von Asthma. Es wurde gezeigt, dass Kortikosteroide ein breites Spektrum an inhibitorischen Aktivitäten gegen mehrere Zelltypen (z. B. Mastzellen, Eosinophile, Neutrophile, Makrophagen und Lymphozyten) und Mediatoren (z. B. Histamin, Eicosanoide, Leukotriene und Zytokine) haben, die an allergischen und nicht allergischen Reaktionen beteiligt sind -allergisch bedingte Entzündung. Diese entzündungshemmenden Wirkungen von Kortikosteroiden können zu ihrer Wirksamkeit bei Asthma beitragen.
Studien an Asthmapatienten haben ein günstiges Verhältnis zwischen topischer entzündungshemmender Aktivität und systemischer Kortikosteroidwirkung über einen weiten Dosisbereich von PULMICORT 200 mcg TURBUHALER (Budesonid) gezeigt. Dies erklärt sich durch eine Kombination aus einer relativ hohen lokalen entzündungshemmenden Wirkung, einem ausgedehnten hepatischen First-Pass-Abbau des oral absorbierten Arzneimittels (85–95 %) und der geringen Potenz der gebildeten Metaboliten (siehe unten).
Pharmakokinetik
Absorption:
Nach oraler Gabe von Budesonid wurde die maximale Plasmakonzentration nach etwa 1 bis 2 Stunden erreicht und die absolute systemische Verfügbarkeit betrug 6-13 %. Im Gegensatz dazu wird der größte Teil des in die Lungen abgegebenen Budesonids systemisch absorbiert. Bei gesunden Probanden wurden 34 % der abgemessenen Dosis in der Lunge abgelagert (bestimmt durch die Plasmakonzentrationsmethode) mit einer absoluten systemischen Verfügbarkeit von 39 % der abgemessenen Dosis. Die Pharmakokinetik von Budesonid unterscheidet sich bei gesunden Probanden und Asthmapatienten nicht signifikant. Spitzenplasmakonzentrationen von Budesonid traten innerhalb von 30 Minuten nach der Inhalation von PULMICORT 200 µg TURBUHALER auf.Bei Asthmapatienten zeigte Budesonid einen linearen Anstieg der AUC und Cmax mit zunehmender Dosis sowohl nach einer Einzeldosis als auch nach wiederholter Gabe von PULMICORT 200 µg TURBUHALER (Budesonid).
Verteilung:
Das Verteilungsvolumen von Budesonid betrug etwa 3 l/kg. Es war zu 85-90 % an Plasmaproteine gebunden. Die Proteinbindung war über den Konzentrationsbereich (1-100 nmol/l), der mit und über den empfohlenen Dosen von PULMICORT TURBUHALER erreicht wurde, konstant. Budesonid zeigte wenig oder keine Bindung an Corticosteroid-bindendes Globulin. Budesonid äquilibrierte schnell mit roten Blutkörperchen in einer konzentrationsunabhängigen Weise mit einem Blut/Plasma-Verhältnis von etwa 0,8.Stoffwechsel:
In-vitro-Studien mit humanen Leberhomogenaten haben gezeigt, dass Budesonid schnell und extensiv metabolisiert wird. Zwei Hauptmetaboliten, die durch Cytochrom P450 (CYP)-Isoenzym 3A4 (CYP3A4)-katalysierte Biotransformation gebildet werden, wurden isoliert und als 16α-Hydroxyprednisolon und 6β-Hydroxybudesonid identifiziert. Die Corticosteroid-Aktivität jedes dieser beiden Metaboliten beträgt weniger als 1 % der Aktivität der Ausgangssubstanz. Es wurden keine qualitativen Unterschiede zwischen den Stoffwechselmustern in vitro und in vivo festgestellt. In menschlichen Lungen- und Serumpräparaten wurde eine vernachlässigbare metabolische Inaktivierung beobachtet.Ausscheidung/Elimination:
Die 22R-Form von Budesonid wurde vorzugsweise von der Leber mit einer systemischen Clearance von 1,4 l/min gegenüber 1,0 l/min für die 22S-Form ausgeschieden. Die terminale Halbwertszeit, 2 bis 3 Stunden, war für beide Epimere gleich und dosisunabhängig. Budesonid wurde in Form von Metaboliten im Urin und im Stuhl ausgeschieden. Ungefähr 60 % einer intravenösen radioaktiv markierten Dosis wurden im Urin wiedergefunden. Im Urin wurde kein unverändertes Budesonid nachgewiesen.Besondere Populationen:
Es wurden keine pharmakokinetischen Unterschiede aufgrund von Rasse, Geschlecht oder fortgeschrittenem Alter festgestellt.Pädiatrie:
Nach intravenöser Gabe bei pädiatrischen Patienten im Alter von 10-14 Jahren war die Plasmahalbwertszeit kürzer als bei Erwachsenen (1,5 Stunden vs. 2,0 Stunden bei Erwachsenen). In der gleichen Population war die absolute systemische Verfügbarkeit nach Inhalation von Budesonid über einen unter Druck stehenden Dosierinhalator ähnlich wie bei Erwachsenen.Leberinsuffizienz:
Eine eingeschränkte Leberfunktion kann die Ausscheidung von Kortikosteroiden beeinträchtigen. Die Pharmakokinetik von Budesonid wurde durch eine beeinträchtigte Leberfunktion beeinflusst, was durch eine doppelte systemische Verfügbarkeit nach oraler Einnahme belegt wurde. Die intravenöse Pharmakokinetik von Budesonid war jedoch bei Patienten mit Zirrhose und bei gesunden Probanden ähnlich.Arzneimittelwechselwirkungen:
Ketoconazol, ein starker Inhibitor des Isoenzyms 3A4 (CYP3A4) von Cytochrom P450 (CYP), dem wichtigsten Stoffwechselenzym für Kortikosteroide, erhöhte die Plasmaspiegel von oral eingenommenem Budesonid. Bei empfohlener Dosierung hatte Cimetidin eine leichte, aber klinisch unbedeutende Wirkung auf die Pharmakokinetik von oralem Budesonid.Pharmakodynamik
Um zu bestätigen, dass die systemische Resorption kein signifikanter Faktor für die klinische Wirksamkeit von inhaliertem Budesonid ist, wurde eine klinische Studie an Patienten mit Asthma durchgeführt, in der 400 µg Budesonid, das über einen unter Druck stehenden Dosierinhalator mit einem Abstandshalter verabreicht wurde, mit 1400 µg oralem Budesonid verglichen wurden Placebo. Die Studie zeigte trotz vergleichbarer systemischer Spiegel die Wirksamkeit von inhaliertem Budesonid, nicht aber von oral eingenommenem Budesonid. Somit wird die therapeutische Wirkung herkömmlicher Dosen von oral inhaliertem Budesonid weitgehend durch seine direkte Wirkung auf die Atemwege erklärt.
Im Allgemeinen hat PULMICORT TURBUHALER (Budesonid) einen relativ schnellen Wirkungseintritt für ein inhalatives Kortikosteroid. Eine Verbesserung der Asthmakontrolle nach Inhalation von PULMICORT TURBUHALER (Budesonid) kann innerhalb von 24 Stunden nach Beginn der Behandlung eintreten, obwohl der maximale Nutzen möglicherweise erst nach 1 bis 2 Wochen oder länger erreicht wird.
Es wurde gezeigt, dass PULMICORT TURBUHALER (Budesonid) die Atemwegsreaktivität in verschiedenen Belastungsmodellen, einschließlich Histamin, Methacholin, Natriummetabisulfit und Adenosinmonophosphat, bei Patienten mit hyperreaktiven Atemwegen verringert. Die klinische Relevanz dieser Modelle ist nicht sicher.
Die Vorbehandlung mit PULMICORT 200 mcg TURBUHALER (Budesonid) 1600 mcg täglich (800 mcg zweimal täglich) für 2 Wochen reduzierte die akute (Frühphasenreaktion) und verzögerte (Spätphasenreaktion) Abnahme von FEV1 nach inhalativer Allergenprovokation.
Die Wirkungen von PULMICORT 200 µg TURBUHALER (Budesonid) auf die Hypothalamus-Hypophysen-Nebennieren-Achse (HPA) wurden bei 905 Erwachsenen und 404 pädiatrischen Patienten mit Asthma untersucht. Bei den meisten Patienten blieb die Fähigkeit, die Cortisolproduktion als Reaktion auf Stress zu erhöhen, gemessen durch den Cosyntropin (ACTH)-Stimulationstest, bei der Behandlung mit PULMICORT TURBUHALER (Budesonid) in den empfohlenen Dosen erhalten. Bei erwachsenen Patienten, die mit 100, 200, 400 oder 800 µg zweimal täglich über 12 Wochen behandelt wurden, zeigten 4 %, 2 %, 6 % bzw. 13 % eine anormale stimulierte Cortisol-Reaktion (Spitzen-Cortisol
Die Verabreichung von Budesonid über PULMICORT 200 µg TURBUHALER (Budesonid) in Dosen von bis zu 800 µg/Tag (mittlere Tagesdosis 445 µg/Tag) oder über einen unter Druck stehenden Dosieraerosol in Dosen von bis zu 1200 µg/Tag (mittlere Tagesdosis 620 µg /Tag) an 216 pädiatrische Patienten (im Alter von 3 bis 11 Jahren) über 2 bis 6 Jahre hatte keine signifikante Wirkung auf das Körperwachstum im Vergleich zu einer Therapie ohne Kortikosteroide bei 62 entsprechenden Kontrollpatienten. Die Langzeitwirkung von PULMICORT TURBUHALER (Budesonid) auf das Wachstum ist jedoch nicht vollständig bekannt.
Klinische Studien
Die therapeutische Wirksamkeit von PULMICORT 100 mcg TURBUHALER (Budesonid) wurde in kontrollierten klinischen Studien mit mehr als 1300 Patienten (ab 6 Jahren) mit Asthma unterschiedlicher Dauer ( 20 Jahre) und Schweregrades untersucht.
Doppelblinde, parallele, placebokontrollierte klinische Studien mit einer Dauer von 12 Wochen und länger haben gezeigt, dass PULMICORT TURBUHALER (Budesonid) im Vergleich zu Placebo die Lungenfunktion (gemessen an PEF und FEV1) signifikant verbesserte und die morgendlichen und abendlichen Asthmasymptome signifikant verringerte und reduzierte signifikant den Bedarf an inhalativen β2-Agonisten bei Bedarf in Dosen von 400 µg bis 1600 µg pro Tag (200 µg bis 800 µg zweimal täglich) bei Erwachsenen und 400 µg bis 800 µg pro Tag (200 µg bis 400 µg zweimal täglich) bei pädiatrischen Patienten ab 6 Jahren.
Eine verbesserte Lungenfunktion (morgendlicher PEF) wurde innerhalb von 24 Stunden nach Beginn der Behandlung sowohl bei erwachsenen als auch bei pädiatrischen Patienten ab 6 Jahren beobachtet, obwohl der maximale Nutzen 1 bis 2 Wochen oder länger nach Beginn der Behandlung nicht erreicht wurde. Die verbesserte Lungenfunktion wurde während der 12 Wochen des doppelblinden Teils der Studien aufrechterhalten.
Patienten, die keine Kortikosteroidtherapie erhalten
In einer 12-wöchigen klinischen Studie mit 273 Patienten mit leichtem bis mittelschwerem Asthma (mittlerer FEV1-Ausgangswert 2,27 l), die mit Bronchodilatatoren allein nicht gut eingestellt waren, wurde PULMICORT 200 µg TURBUHALER (Budesonid) in Dosen von zweimal täglich 200 µg und zweimal täglich 400 µg untersucht täglich versus Placebo. Die FEV1-Ergebnisse aus dieser Studie sind in der folgenden Abbildung dargestellt. Die Lungenfunktion verbesserte sich bei beiden Dosierungen von PULMICORT 100 µg TURBUHALER (Budesonid) im Vergleich zu Placebo signifikant.
Eine 12-wöchige Studie bei Patienten, die vor Studieneintritt keine Kortikosteroidtherapie erhalten haben
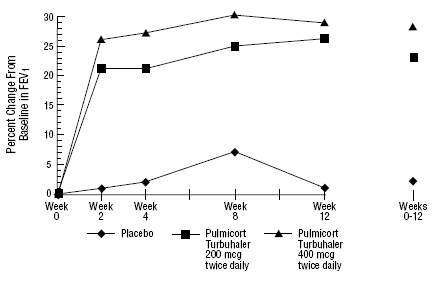
In einer 12-monatigen kontrollierten Studie mit 75 Patienten, die zuvor keine Kortikosteroide erhalten hatten, führte PULMICORT TURBUHALER (Budesonid) mit 200 µg zweimal täglich zu einer verbesserten Lungenfunktion (gemessen anhand des PEF) und einer verringerten bronchialen Hyperreaktivität im Vergleich zu Placebo.
Patienten, die zuvor mit inhalativen Kortikosteroiden behandelt wurden
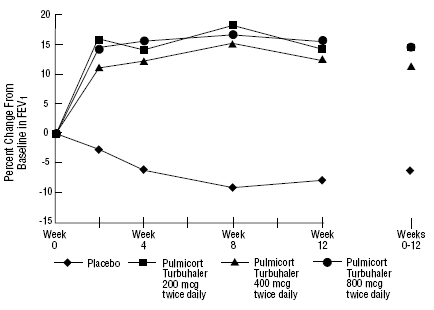
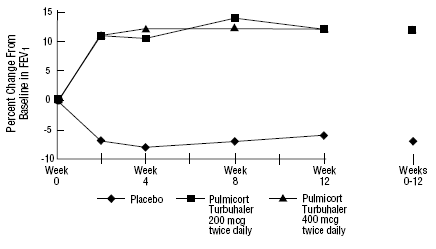
Die Sicherheit und Wirksamkeit von PULMICORT 200 µg TURBUHALER (Budesonid) wurde auch bei erwachsenen und pädiatrischen Patienten (im Alter von 6 bis 18 Jahren) untersucht, die zuvor mit inhalativen Kortikosteroiden behandelt wurden (Erwachsene: N = 473, mittlerer FEV1-Ausgangswert 2,04 l, Ausgangsdosen von Beclomethasondipropionat 126). -1008 µg/Tag, Pädiatrie: N=404, mittlerer FEV1-Ausgangswert 2,09 l, Ausgangsdosen von Beclomethasondipropionat 126-672 µg/Tag oder Triamcinolonacetonid 300-1800 µg/Tag). Die FEV1-Ergebnisse dieser beiden Studien, die beide 12 Wochen dauerten, sind in den folgenden Abbildungen dargestellt. Die Lungenfunktion verbesserte sich in beiden Studien mit allen Dosierungen von PULMICORT TURBUHALER (Budesonid) im Vergleich zu Placebo signifikant.
Erwachsene Patienten, die zuvor mit inhalativen Kortikosteroiden behandelt wurden
Pädiatrische Patienten im Alter von 6 bis 18 Jahren, die zuvor mit inhalativen Kortikosteroiden behandelt wurden
Patienten, die PULMICORT TURBUHALER (Budesonid) einmal täglich erhalten
Die Wirksamkeit und Sicherheit der einmal täglichen Verabreichung von PULMICORT 100 mcg TURBUHALER (Budesonid) 200 mcg und 400 mcg und Placebo wurden auch bei 309 erwachsenen Asthmapatienten (mittlerer Ausgangs-FEV1 2,7 l) in einer 18-wöchigen Studie untersucht. Verglichen mit Placebo zeigten Patienten, die Pulmicort 200 oder 400 µg einmal täglich erhielten, eine signifikant bessere Asthmastabilität, gemessen anhand von PEF und FEV1, über einen anfänglichen 6-wöchigen Behandlungszeitraum, der mit einer Tagesdosis von 200 µg über die folgenden 12 Wochen aufrechterhalten wurde. Obwohl die Studienpopulation sowohl Patienten umfasste, die zuvor mit inhalativen Kortikosteroiden behandelt wurden, als auch Patienten, die zuvor keine Kortikosteroidtherapie erhalten hatten, zeigten die Ergebnisse, dass die einmal tägliche Gabe am deutlichsten bei den Patienten wirksam war, die zuvor mit oral inhalativen Kortikosteroiden behandelt wurden (siehe DOSIERUNG UND ANWENDUNG ).
Patienten, die zuvor mit oralen Kortikosteroiden behandelt wurden
In einer klinischen Studie mit 159 Patienten mit schwerem Asthma, die eine chronische orale Prednisontherapie benötigten (mittlere Ausgangsdosis von Prednison 19,3 mg/Tag), wurde PULMICORT TURBUHALER (Budesonid) in Dosen von 400 µg zweimal täglich und 800 µg zweimal täglich mit Placebo über 20 Wochen verglichen Zeitraum. Ungefähr zwei Drittel (68 % bei 400 µg zweimal täglich und 64 % bei 800 µg zweimal täglich) der mit PULMICORT TURBUHALER (Budesonid) behandelten Patienten konnten ein anhaltendes (mindestens 2 Wochen) Absetzen der oralen Kortikosteroide erreichen (im Vergleich zu 8 % der mit 800 µg zweimal täglich behandelten Patienten). Placebo-behandelte Patienten) und verbesserte Asthmakontrolle. Die durchschnittliche orale Kortikosteroiddosis wurde bei mit PULMICORT TURBUHALER (Budesonid) behandelten Patienten um 83 % bei 400 µg zweimal täglich und um 79 % bei 800 µg zweimal täglich reduziert, verglichen mit 27 % bei Placebo. Darüber hinaus blieben 58 von 64 Patienten (91 %), die orale Kortikosteroide während der doppelblinden Phase der Studie vollständig eliminiert hatten, für weitere 12 Monate ohne orale Kortikosteroide, während sie PULMICORT 200 µg TURBUHALER (Budesonid) erhielten.
INFORMATIONEN ZUM PATIENTEN
Gebrauchsanweisung des Patienten
Bitte lesen Sie diese Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme Ihres Arzneimittels beginnen. Es enthält eine Zusammenfassung von Informationen zu Ihrem Arzneimittel. Das Befolgen dieser Anweisungen hilft sicherzustellen, dass Sie das Medikament richtig inhalieren.
FÜR WEITERE INFORMATIONEN FRAGEN SIE IHREN ARZT ODER APOTHEKER.
WAS SIE ÜBER PULMICORT TURBUHALER (Budesonid) WISSEN SOLLTEN
Ihr Arzt hat Ihnen PULMICORT TURBUHALER 200 mcg verschrieben. Es enthält ein Medikament namens Budesonid, das ein synthetisches Kortikosteroid ist. Kortikosteroide sind natürliche Substanzen, die im Körper vorkommen und helfen, Entzündungen zu bekämpfen. Sie werden zur Behandlung von Asthma eingesetzt, da sie Schwellungen und Reizungen in den Wänden der kleinen Luftwege in der Lunge reduzieren und Atemprobleme lindern. Bei regelmäßiger Inhalation helfen Kortikosteroide auch, Asthmaanfällen vorzubeugen.
PULMICORT TURBUHALER (Budesonid) behandelt die Entzündung – den „ruhigen Teil“ von Asthma, den Sie nicht hören, sehen oder fühlen können. Wenn die Entzündung unbehandelt bleibt, können Ihre Asthmasymptome und -anfälle zunehmen. PULMICORT 200 mcg TURBUHALER (Budesonid) wirkt, um Ihre Asthmasymptome und -anfälle zu verhindern und zu lindern.
WICHTIGE HINWEISE ZU PULMICORT TURBUHALER (Budesonid)
STELLEN SIE SICHER, dass dieses Arzneimittel für Sie geeignet ist (siehe „BEVOR SIE IHREN PULMICORT TURBUHALER (Budesonid) ANWENDEN“).
Es ist wichtig, dass Sie jede Dosis wie von Ihrem Arzt verordnet inhalieren.
Verwenden Sie Ihren Turbohaler wie von Ihrem Arzt verordnet. BEENDEN SIE DIE BEHANDLUNG NICHT UND REDUZIEREN SIE IHRE DOSIS AUCH NICHT, WENN SIE SICH BESSER FÜHLEN, es sei denn, Ihr Arzt hat Sie dazu aufgefordert.
UNTERLASSEN SIE Inhalieren Sie mehr Dosen oder verwenden Sie Ihren Turbohaler häufiger als von Ihrem Arzt verordnet.
Dieses Medikament ist NICHT zur schnellen Linderung Ihrer Atembeschwerden während eines Asthmaanfalls. Es muss in regelmäßigen Abständen, wie von Ihrem Arzt empfohlen, und nicht als Notfallmaßnahme eingenommen werden.
Ihr Arzt kann Ihnen im akuten Notfall zusätzliche Medikamente (z. B. Bronchodilatatoren) zur Notfallbehandlung verschreiben
Wenn Sie auch ein anderes Arzneimittel zur Inhalation anwenden, sollten Sie Ihren Arzt um Rat fragen, wann es in Bezug auf die Anwendung Ihres PULMICORT 100 mcg TURBUHALER (Budesonid) anzuwenden ist.
VOR DER ANWENDUNG IHRES PULMICORT TURBUHALERS (Budesonid)
INFORMIEREN SIE IHREN ARZT, BEVOR SIE MIT DER EINNAHME DIESES ARZNEIMITTELS BEGINNEN, WENN SIE:
Unter bestimmten Umständen ist dieses Arzneimittel möglicherweise nicht geeignet und Ihr Arzt möchte Ihnen möglicherweise ein anderes Arzneimittel verschreiben. Stellen Sie sicher, dass Ihr Arzt weiß, welche anderen Arzneimittel Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, sowie alle Vitamine oder Nahrungs- und Kräuterzusätze.
WAS SIND DIE MÖGLICHEN NEBENWIRKUNGEN VON PULMICORT TURBUHALER (Budesonid)?
Wie bei allen inhalativen Kortikosteroiden sollten Sie sich der folgenden Nebenwirkungen bewusst sein:
Basierend auf klinischen Studien sind die häufigsten Nebenwirkungen, die von Patienten bei der Anwendung von PULMICORT 100 mcg TURBUHALER (Budesonid) berichtet wurden:
Dies sind nicht alle möglichen Nebenwirkungen von PULMICORT TURBUHALER (Budesonid). Weitere Informationen erhalten Sie von Ihrem Arzt, medizinischem Fachpersonal oder Apotheker.
ANWENDUNG IHRES PULMICORT TURBUHALERS (Budesonid)
DOSIERUNG
WIE IST IHR PULMICORT TURBUHALER (Budesonid) ZU BENUTZEN?
Lesen Sie die vollständigen Anweisungen sorgfältig durch und verwenden Sie sie nur wie angegeben.
GRUNDANLEITUNG:
Bevor Sie zum ersten Mal einen neuen PULMICORT 200 mcg TURBUHALER (Budesonid) verwenden, sollten Sie ihn vorbereiten. Dazu den Deckel drehen und abheben. Halten Sie PULMICORT TURBUHALER (Budesonid) aufrecht (mit dem Mundstück nach oben), drehen Sie dann den braunen Griff ganz nach rechts und wieder zurück nach links. Wiederholen. Jetzt können Sie Ihre erste Dosis einnehmen (siehe Anleitung „EINNEHMEN EINER DOSIS“). Danach müssen Sie ihn nicht mehr grundieren, auch wenn Sie ihn längere Zeit nicht verwenden.
EINE DOSIS EINNEHMEN:
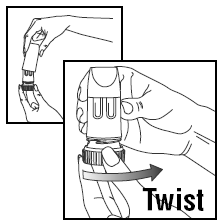
LADEN EINER DOSIS
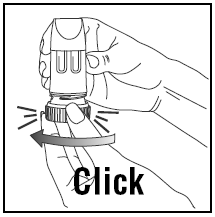
INHALIEREN DER DOSIS
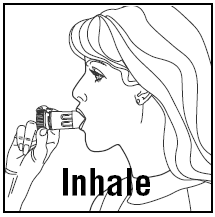
AUFBEWAHRUNG IHRES PULMICORT TURBUHALERS (Budesonid)
WIE ERKENNEN SIE, WENN IHR PULMICORT TURBUHALER (Budesonid) LEER IST?
Das Etikett auf der Schachtel oder dem Umschlag sagt Ihnen, wie viele Dosen sich in Ihrem PULMICORT TURBUHALER befinden. Ihr PULMICORT TURBUHALER (Budesonid) hat ein praktisches Dosisanzeigefenster direkt unter dem Mundstück.
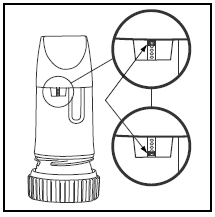
WEITERE INFORMATIONEN ZU PULMICORT TURBUHALER (Budesonid)
Diese Packungsbeilage enthält nicht alle Informationen zu Ihrem Arzneimittel. Wenn Sie Fragen haben oder sich bei etwas nicht sicher sind, wenden Sie sich an Ihren Arzt oder Apotheker.
Vielleicht möchten Sie diese Broschüre noch einmal lesen. Bitte WERFEN SIE ES NICHT WEG, bis Sie Ihr Arzneimittel aufgebraucht haben.
Denken Sie daran: Dieses Arzneimittel wurde Ihnen von Ihrem Arzt verschrieben. Geben Sie dieses Arzneimittel NICHT an Dritte weiter.
VERWENDEN SIE DIESES PRODUKT WIE VORGESEHEN, SOFERN IHR ARZT NICHT ANDERS ANWEIST.
Wenn Sie weitere Fragen zur Anwendung von PULMICORT 100 mcg TURBUHALER (Budesonid) haben, rufen Sie an: 1-800-236-9933.