Ventolin Inhaler 100mcg Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Ventolin und wie wird es angewendet?
Ventolin HFA ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von akutem oder schwerem Asthma (Bronkospasmus) oder belastungsinduziertem Asthma. Ventolin HFA kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Ventolin HFA gehört zu einer Klasse von Arzneimitteln, die als Beta2-Agonisten bezeichnet werden.
Es ist nicht bekannt, ob Ventolin HFA bei Kindern unter 4 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Ventolin haben?
Ventolin kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Ventolin gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Ventolin. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Die aktive Komponente von VENTOLIN HFA ist Albuterolsulfat, USP, die racemische Form von Albuterol und ein relativ selektiver beta-adrenerger Bronchodilatator. Albuterolsulfat hat den chemischen Namen α1 - [(tert-Butylamino)methyl]-4-hydroxy-m-xylene-α, α'-diolsulfat (2:1)(Salz) und die folgende chemische Struktur:
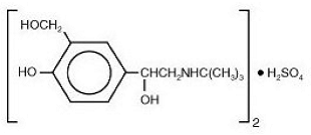
Albuterolsulfat ist ein weißes kristallines Pulver mit einem Molekulargewicht von 576,7, und die empirische Formel ist (C13H21NO3)2·H2SO4. Es ist wasserlöslich und leicht löslich in Ethanol.
Der von der Weltgesundheitsorganisation empfohlene Name für die Albuterolbasis ist Salbutamol.
VENTOLIN HFA ist ein blauer Inhalator aus Kunststoff mit einer blauen Verschlusskappe, der einen unter Druck stehenden Aerosolbehälter mit Dosiereinheit enthält, der mit einem Zählwerk ausgestattet ist. Jeder Kanister enthält eine mikrokristalline Suspension von Albuterolsulfat in Treibmittel HFA-134a (1,1,1,2-Tetrafluorethan). Es enthält keine weiteren Hilfsstoffe.
Nach dem Vorfüllen gibt jeder Sprühstoß des Inhalators 120 µg Albuterolsulfat, USP in 75 mg Suspension aus dem Ventil und 108 µg Albuterolsulfat, USP aus dem Mundstück ab (entsprechend 90 µg Albuterolbase aus dem Mundstück).
Entlüften Sie VENTOLIN HFA vor der ersten Anwendung, wenn der Inhalator länger als 2 Wochen nicht verwendet wurde oder wenn der Inhalator fallen gelassen wurde. Zur Grundierung von VENTOLIN HFA 4 Sprühstöße vom Gesicht weg in die Luft geben und vor jedem Sprühstoß gut schütteln.
INDIKATIONEN
Bronchospasmus
VENTOLIN® HFA Inhalationsaerosol ist angezeigt zur Behandlung oder Vorbeugung von Bronchospasmen bei Patienten ab 4 Jahren mit reversibler obstruktiver Atemwegserkrankung.
Belastungsinduzierter Bronchospasmus
VENTOLIN HFA ist angezeigt zur Vorbeugung von belastungsinduzierten Bronchospasmen bei Patienten ab 4 Jahren.
DOSIERUNG UND ANWENDUNG
Bronchospasmus
Zur Behandlung akuter Episoden von Bronchospasmen oder zur Vorbeugung von Symptomen im Zusammenhang mit Bronchospasmen beträgt die übliche Dosierung für Erwachsene und Kinder 2 Inhalationen, die alle 4 bis 6 Stunden wiederholt werden; Bei manchen Patienten kann 1 Inhalation alle 4 Stunden ausreichend sein. Eine häufigere Verabreichung oder eine größere Anzahl von Inhalationen wird nicht empfohlen.
Belastungsinduzierter Bronchospasmus
Zur Vorbeugung von belastungsinduzierten Bronchospasmen beträgt die übliche Dosierung für Erwachsene und Kinder ab 4 Jahren 2 Inhalationen 15 bis 30 Minuten vor dem Training.
Verwaltungsinformationen
VENTOLIN HFA sollte nur oral inhaliert verabreicht werden.
Grundierung
Das Vorfüllen von VENTOLIN HFA ist unerlässlich, um bei jedem Sprühstoß einen angemessenen Albuterolgehalt sicherzustellen. Entlüften Sie VENTOLIN HFA vor der ersten Anwendung, wenn der Inhalator länger als 2 Wochen nicht verwendet wurde oder wenn der Inhalator fallen gelassen wurde. Zur Grundierung von VENTOLIN HFA 4 Sprühstöße vom Gesicht weg in die Luft geben und vor jedem Sprühstoß gut schütteln.
Reinigung
Um eine ordnungsgemäße Dosierung zu gewährleisten und eine Verstopfung der Aktuatoröffnung zu vermeiden, waschen Sie den Aktuator mit warmem Wasser und lassen Sie ihn mindestens einmal pro Woche vollständig an der Luft trocknen.
WIE GELIEFERT
Darreichungsformen und Stärken
Aerosol zum Einatmen. Blauer Inhalator aus Kunststoff mit einer blauen Umreifungskappe, der einen unter Druck stehenden Aerosolbehälter für abgemessene Dosen enthält, der 60 oder 200 abgemessene Inhalationen enthält und mit einem Zähler ausgestattet ist. Jeder Sprühstoß gibt 108 µg Albuterolsulfat (90 µg Albuterolbase) aus dem Mundstück ab.
Lagerung und Handhabung
VENTOLIN HFA Inhalationsspray wird in den folgenden 1er-Kartons als druckbeaufschlagter Aluminiumkanister geliefert, der mit einem Zählwerk ausgestattet ist und mit einem blauen Kunststoffbetätiger mit einer blauen Verschlusskappe geliefert wird:
NDC 0173-0682-20 18-g-Kanister mit 200 Sprühstößen NDC 0173-0682-21 8-g-Kanister mit 60 Sprühstößen NDC 0173-0682-24 8-g-Kanister für institutionelle Anwendungen mit 60 Sprühstößen
Jeder Inhalator ist in einem vor Feuchtigkeit schützenden Folienbeutel mit einem Trockenmittel versiegelt, das nach dem Öffnen des Beutels entsorgt werden sollte. Jedem Inhalator liegt eine Packungsbeilage für Patienten bei.
Der mit VENTOLIN HFA gelieferte blaue Aktuator sollte nicht mit anderen Produktkanistern verwendet werden, und Aktuatoren anderer Produkte sollten nicht mit einem VENTOLIN HFA-Kanister verwendet werden.
VENTOLIN HFA hat einen am Kanister angebrachten Zähler. Der Zähler beginnt bei 204 oder 64 und zählt jedes Mal herunter, wenn ein Spray abgegeben wird. Die richtige Menge des Medikaments bei jeder Betätigung kann nicht garantiert werden, nachdem der Zähler 000 anzeigt, selbst wenn der Kanister nicht vollständig leer ist und weiter funktioniert. Der Inhalator sollte entsorgt werden, wenn der Zähler 000 anzeigt oder 12 Monate nach der Entnahme aus dem Beutel mit Feuchtigkeitsschutzfolie, je nachdem, was zuerst eintritt.
Außerhalb der Reichweite von Kindern aufbewahren. Nicht in die Augen sprühen.
Inhalt unter Druck: Nicht durchstechen. Nicht in der Nähe von Hitze oder offenem Feuer verwenden oder lagern. Temperaturen über 120 °F können zum Platzen führen. Kanister niemals ins Feuer oder in die Verbrennungsanlage werfen.
Bei Raumtemperatur zwischen 20 °C und 25 °C (68 °F und 77 °F) lagern; Exkursionen erlaubt von 59 ° F bis 86 ° F (15 ° C bis 30 ° C) [Siehe USP kontrollierte Raumtemperatur ]. Bewahren Sie den Inhalator mit dem Mundstück nach unten auf. Um beste Ergebnisse zu erzielen, sollte der Inhalator vor Gebrauch Raumtemperatur haben. VOR JEDEM SPRÜHEN GUT SCHÜTTELN.
GlaxoSmithKline, Research Triangle Park, NC 27709. Überarbeitet: Dezember 2014
NEBENWIRKUNGEN
Die Anwendung von VENTOLIN HFA kann mit Folgendem verbunden sein:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die unten beschriebenen Sicherheitsdaten spiegeln die Exposition gegenüber VENTOLIN HFA bei 248 mit VENTOLIN HFA behandelten Patienten in 3 placebokontrollierten klinischen Studien mit einer Dauer von 2 bis 12 Wochen wider. Die Daten von Erwachsenen und Jugendlichen basieren auf 2 klinischen Studien, in denen 202 Asthmatiker ab 12 Jahren 12 Wochen lang 4-mal täglich mit VENTOLIN HFA 2-Inhalationen behandelt wurden. Die Population der Erwachsenen/Jugendlichen bestand aus 92 Frauen, 110 Männern und 163 Weißen, 19 Schwarzen, 18 Hispanoamerikanern und 2 anderen. Die Daten von pädiatrischen Probanden basieren auf 1 klinischen Studie, in der 46 Probanden mit Asthma im Alter von 4 bis 11 Jahren mit VENTOLIN HFA 2-Inhalationen 4-mal täglich über 2 Wochen behandelt wurden. Die Bevölkerung bestand aus 21 Frauen, 25 Männern und 25 Weißen, 17 Schwarzen, 3 Hispanoamerikanern und 1 anderen.
Erwachsene und jugendliche Probanden ab 12 Jahren: Die zwei 12-wöchigen, randomisierten, doppelblinden Studien mit 610 erwachsenen und jugendlichen Probanden mit Asthma, in denen VENTOLIN HFA, ein CFC 11/12-betriebener Albuterol-Inhalator, und ein HFA-134a-Placebo-Inhalator verglichen wurden. Insgesamt waren Inzidenz und Art der Nebenwirkungen, die für VENTOLIN HFA und einen mit FCKW 11/12 angetriebenen Albuterol-Inhalator berichtet wurden, vergleichbar. Tabelle 1 listet die Inzidenz aller Nebenwirkungen (ob vom Prüfarzt als mit oder ohne Zusammenhang mit dem Medikament betrachtet) aus diesen Studien auf, die mit einer Rate von 3 % oder mehr in der mit VENTOLIN HFA behandelten Gruppe und häufiger in der behandelten Gruppe auftraten mit VENTOLIN HFA als in der HFA-134a-Placebo-Inhalator-Gruppe.
Nebenwirkungen, die von weniger als 3 % der erwachsenen und jugendlichen Probanden berichtet wurden, die VENTOLIN HFA erhielten, und von einem größeren Anteil der Probanden, die VENTOLIN HFA erhielten, als die HFA-134a-Placebo-Inhalatoren, und die potenziell mit VENTOLIN HFA in Zusammenhang stehen könnten, umfassen Durchfall, Laryngitis, oropharyngeale Ödeme, Husten, Lungenerkrankungen, Tachykardie und Extrasystolen. Auch Herzklopfen und Schwindel wurden unter VENTOLIN HFA beobachtet.
Pädiatrische Probanden im Alter von 4 bis 11 Jahren: Die Ergebnisse der 2-wöchigen klinischen Studie an pädiatrischen Probanden mit Asthma im Alter von 4 bis 11 Jahren zeigten, dass diese pädiatrische Population ein Nebenwirkungsprofil aufwies, das dem von Erwachsenen und Jugendlichen ähnelte.
Drei Studien wurden durchgeführt, um die Sicherheit und Wirksamkeit von VENTOLIN HFA bei Personen zwischen der Geburt und 4 Jahren zu bewerten. Die Ergebnisse dieser Studien belegten die Wirksamkeit von VENTOLIN HFA in dieser Altersgruppe nicht [siehe Verwendung in bestimmten Populationen ]. Da die Wirksamkeit von VENTOLIN HFA bei Kindern zwischen der Geburt und dem Alter von 48 Monaten nicht nachgewiesen wurde, kann die Sicherheit von VENTOLIN HFA in dieser Altersgruppe nicht nachgewiesen werden. Das Sicherheitsprofil, das bei Kindern und Jugendlichen unter 4 Jahren beobachtet wurde, war jedoch vergleichbar mit dem bei älteren Kindern und Jugendlichen sowie bei Erwachsenen und Jugendlichen. Wenn die Inzidenzraten von Nebenwirkungen bei Probanden unter 4 Jahren höher waren als bei älteren Probanden, wurden die höheren Inzidenzraten in allen Behandlungsarmen, einschließlich Placebo, festgestellt. Diese Nebenwirkungen umfassten Infektionen der oberen Atemwege, Nasopharyngitis, Pyrexie und Tachykardie.
Postmarketing-Erfahrung
Zusätzlich zu den aus klinischen Studien berichteten Nebenwirkungen wurden die folgenden Nebenwirkungen während der Anwendung von Albuterolsulfat nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen. Diese Ereignisse wurden entweder aufgrund ihres Schweregrads, ihrer Meldehäufigkeit oder ihres kausalen Zusammenhangs mit Albuterol oder einer Kombination dieser Faktoren für die Aufnahme ausgewählt.
Fälle von paradoxem Bronchospasmus, Heiserkeit, Arrhythmien (einschließlich Vorhofflimmern, supraventrikuläre Tachykardie) und Überempfindlichkeitsreaktionen (einschließlich Urtikaria, Angioödem, Hautausschlag) wurden nach der Anwendung von VENTOLIN HFA berichtet.
Darüber hinaus kann Albuterol, wie andere Sympathomimetika, Nebenwirkungen wie Hypokaliämie, Bluthochdruck, periphere Vasodilatation, Angina, Tremor, Stimulation des zentralen Nervensystems, Hyperaktivität, Schlaflosigkeit, Kopfschmerzen, Muskelkrämpfe, Austrocknung oder Reizung des Oropharynx und Stoffwechsel verursachen Azidose.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Andere kurzwirksame sympathomimetische Aerosol-Bronchodilatatoren sollten nicht gleichzeitig mit Albuterol angewendet werden. Wenn zusätzliche adrenerge Arzneimittel auf irgendeine Weise verabreicht werden sollen, sollten sie mit Vorsicht angewendet werden, um schädliche kardiovaskuläre Wirkungen zu vermeiden.
Beta-adrenerge Rezeptorblocker
Betablocker blockieren nicht nur die pulmonale Wirkung von Beta-Agonisten wie VENTOLIN HFA, sondern können bei Patienten mit Asthma auch schwere Bronchospasmen hervorrufen. Daher sollten Patienten mit Asthma normalerweise nicht mit Betablockern behandelt werden. Unter bestimmten Umständen gibt es für diese Patienten jedoch möglicherweise keine akzeptablen Alternativen zur Anwendung von Betarezeptorenblockern; kardioselektive Betablocker könnten in Erwägung gezogen werden, sollten aber mit Vorsicht verabreicht werden.
Nicht kaliumsparende Diuretika
Die EKG-Veränderungen und/oder Hypokaliämie, die aus der Verabreichung von nichtkaliumsparenden Diuretika (wie Schleifen- oder Thiaziddiuretika) resultieren können, können durch Beta-Agonisten akut verschlechtert werden, insbesondere wenn die empfohlene Dosis des Beta-Agonisten überschritten wird. Obwohl die klinische Bedeutung dieser Wirkungen nicht bekannt ist, ist bei der gleichzeitigen Anwendung von VENTOLIN HFA mit nicht kaliumsparenden Diuretika Vorsicht geboten.
Digoxin
Bei gesunden Probanden, die 10 Tage lang Digoxin erhalten hatten, wurde nach intravenöser bzw. oraler Einzeldosisgabe von Albuterol eine mittlere Abnahme der Digoxinspiegel im Serum um 16 % bis 22 % nachgewiesen. Die klinische Relevanz dieser Ergebnisse für Patienten mit obstruktiver Atemwegserkrankung, die chronisch inhaliertes Albuterol und Digoxin erhalten, ist unklar. Dennoch wäre es ratsam, die Digoxinspiegel im Serum bei Patienten, die derzeit Digoxin und Albuterol erhalten, sorgfältig zu bestimmen.
Monoaminoxidase-Hemmer und trizyklische Antidepressiva
VENTOLIN HFA sollte bei Patienten, die mit Monoaminoxidase-Hemmern oder trizyklischen Antidepressiva behandelt werden, mit äußerster Vorsicht oder innerhalb von 2 Wochen nach Absetzen solcher Arzneimittel verabreicht werden, da die Wirkung von Albuterol auf das Gefäßsystem verstärkt werden kann.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Paradoxer Bronchospasmus
VENTOLIN HFA kann paradoxe Bronchospasmen hervorrufen, die lebensbedrohlich sein können. Wenn nach der Gabe von VENTOLIN HFA ein paradoxer Bronchospasmus auftritt, sollte es sofort abgesetzt und eine alternative Therapie eingeleitet werden. Es sollte beachtet werden, dass paradoxer Bronchospasmus, wenn er mit inhalierten Formulierungen verbunden ist, häufig bei der ersten Verwendung eines neuen Kanisters auftritt.
Verschlechterung von Asthma
Asthma kann sich akut über einen Zeitraum von Stunden oder chronisch über mehrere Tage oder länger verschlechtern. Wenn der Patient mehr Dosen von VENTOLIN HFA als üblich benötigt, kann dies ein Zeichen für eine Destabilisierung von Asthma sein und erfordert eine Neubewertung des Patienten und des Behandlungsschemas, wobei die mögliche Notwendigkeit einer entzündungshemmenden Behandlung, z. B. Kortikosteroide, besonders zu berücksichtigen ist.
Verwendung von entzündungshemmenden Mitteln
Die Anwendung von beta-adrenergen Agonisten als Bronchodilatatoren allein ist bei vielen Patienten möglicherweise nicht ausreichend, um Asthma zu kontrollieren. Es sollte frühzeitig erwogen werden, dem therapeutischen Schema entzündungshemmende Mittel, z. B. Kortikosteroide, hinzuzufügen.
Kardiovaskuläre Wirkungen
VENTOLIN HFA kann, wie alle anderen beta2 -adrenergen Agonisten, bei einigen Patienten klinisch signifikante kardiovaskuläre Wirkungen wie Veränderungen der Pulsfrequenz oder des Blutdrucks hervorrufen. Wenn solche Wirkungen auftreten, muss VENTOLIN HFA möglicherweise abgesetzt werden. Darüber hinaus wurde von Beta-Agonisten berichtet, dass sie Veränderungen im Elektrokardiogramm (EKG) hervorrufen, wie z. B. eine Abflachung der T-Welle, Verlängerung des QTc-Intervalls und Senkung der ST-Strecke. Die klinische Relevanz dieser Befunde ist nicht bekannt. Daher sollte VENTOLIN HFA, wie alle anderen sympathomimetischen Amine, bei Patienten mit kardiovaskulären Grunderkrankungen, insbesondere Koronarinsuffizienz, Herzrhythmusstörungen und Bluthochdruck, mit Vorsicht angewendet werden.
Überschreiten Sie nicht die empfohlene Dosis
Todesfälle wurden im Zusammenhang mit der übermäßigen Anwendung von inhalativen Sympathomimetika bei Patienten mit Asthma berichtet. Die genaue Todesursache ist unbekannt, aber es wird ein Herzstillstand nach einer unerwarteten Entwicklung einer schweren akuten asthmatischen Krise und anschließender Hypoxie vermutet.
Sofortige Überempfindlichkeitsreaktionen
Unmittelbare Überempfindlichkeitsreaktionen (z. B. Urtikaria, Angioödem, Hautausschlag, Bronchospasmus, Hypotonie), einschließlich Anaphylaxie, können nach Verabreichung von VENTOLIN HFA auftreten [siehe KONTRAINDIKATIONEN ].
Koexistenzbedingungen
VENTOLIN HFA sollte wie andere sympathomimetische Amine bei Patienten mit Krampfanfällen, Hyperthyreose oder Diabetes mellitus und bei Patienten, die ungewöhnlich auf sympathomimetische Amine ansprechen, mit Vorsicht angewendet werden. Es wurde berichtet, dass große Dosen von intravenösem Albuterol einen vorbestehenden Diabetes mellitus und eine Ketoazidose verschlimmern.
Hypokaliämie
Arzneimittel mit Beta-adrenergen Agonisten können bei manchen Patienten eine signifikante Hypokaliämie hervorrufen, möglicherweise durch intrazellulären Shunt, der potenziell nachteilige kardiovaskuläre Wirkungen hervorrufen kann [siehe KLINISCHE PHARMAKOLOGIE ]. Die Abnahme des Serumkaliums ist normalerweise vorübergehend und erfordert keine Supplementierung.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( PATIENTENINFORMATION und Gebrauchsanweisung ).
Häufigkeit der Nutzung
Informieren Sie die Patienten darüber, dass die Wirkung von VENTOLIN HFA bis zu 4 bis 6 Stunden anhalten sollte. Verwenden Sie VENTOLIN HFA nicht häufiger als empfohlen. Weisen Sie die Patienten an, die Dosis oder Häufigkeit der Dosen von VENTOLIN HFA nicht ohne Rücksprache mit dem Arzt zu erhöhen. Weisen Sie die Patienten an, sofort einen Arzt aufzusuchen, wenn die Behandlung mit VENTOLIN HFA zur Linderung der Symptome nachlässt, sich die Symptome verschlimmern und/oder sie das Produkt häufiger als gewöhnlich anwenden müssen.
Grundierung
Weisen Sie die Patienten an, VENTOLIN HFA vor der ersten Anwendung zu entlüften, wenn der Inhalator länger als 2 Wochen nicht verwendet wurde oder wenn der Inhalator heruntergefallen ist. Zur Grundierung von VENTOLIN HFA 4 Sprühstöße vom Gesicht weg in die Luft geben und vor jedem Sprühstoß gut schütteln.
Reinigung
Um eine ordnungsgemäße Dosierung sicherzustellen und eine Verstopfung der Aktuatoröffnung zu verhindern, weisen Sie die Patienten an, den Aktuator mindestens einmal pro Woche mit warmem Wasser zu waschen und vollständig an der Luft trocknen zu lassen. Informieren Sie die Patienten darüber, dass detaillierte Reinigungsanweisungen in der Packungsbeilage enthalten sind.
Paradoxer Bronchospasmus
Informieren Sie die Patienten darüber, dass VENTOLIN HFA paradoxe Bronchospasmen hervorrufen kann. Weisen Sie sie an, VENTOLIN HFA abzusetzen, wenn ein paradoxer Bronchospasmus auftritt.
Begleitender Drogenkonsum
Weisen Sie die Patienten darauf hin, dass während der Anwendung von VENTOLIN HFA andere Inhalationsmedikamente und Asthmamedikamente nur nach Anweisung des Arztes eingenommen werden sollten.
Häufige Nebenwirkungen
Häufige Nebenwirkungen der Behandlung mit inhaliertem Albuterol sind Herzklopfen, Brustschmerzen, schneller Herzschlag, Zittern und Nervosität.
Schwangerschaft
Weisen Sie schwangere oder stillende Patientinnen darauf hin, sich bezüglich der Anwendung von VENTOLIN HFA an ihren Arzt zu wenden.
VENTOLIN ist eine eingetragene Marke der GSK-Unternehmensgruppe. Die anderen aufgeführten Marken sind Warenzeichen ihrer jeweiligen Eigentümer und keine Warenzeichen der GSK-Unternehmensgruppe. Die Hersteller dieser Marken sind nicht mit der GSK-Unternehmensgruppe oder ihren Produkten verbunden und unterstützen diese nicht.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einer 2-Jahres-Studie an Sprague-Dawley-Ratten verursachte Albuterolsulfat einen dosisabhängigen Anstieg der Inzidenz von gutartigen Leiomyomen des Mesovariums bei und über Nahrungsdosen von 2,0 mg/kg (ungefähr das 14- und 6-fache der MRHDID für Erwachsene und Kinder bzw. auf mg/m-Basis). In einer anderen Studie wurde dieser Effekt durch die gleichzeitige Gabe von Propranolol, einem nicht-selektiven betaadrenergen Antagonisten, blockiert. In einer 18-monatigen Studie an CD-1-Mäusen zeigte Albuterolsulfat in Dosen von bis zu 500 mg/kg (etwa das 1.700- bzw. 800-fache der MRHDID für Erwachsene bzw. Kinder, auf mg/m²-Basis) keine Hinweise auf eine tumorerzeugende Wirkung ). In einer 22-monatigen Studie an Goldhamstern zeigte Albuterolsulfat bei Futterdosen von bis zu 50 mg/kg (ca. das 225- bzw. 110-fache der MRHDID für Erwachsene bzw. Kinder auf mg/m²-Basis) keine Hinweise auf eine Tumorigenität.
Albuterolsulfat war im Ames-Test oder einem Mutationstest in Hefe nicht mutagen. Albuterolsulfat war in einem humanen peripheren Lymphozyten-Assay oder in einem AH1-Mäuse-Mikronukleus-Assay nicht klastogen.
Reproduktionsstudien an Ratten zeigten keine Hinweise auf eine Beeinträchtigung der Fertilität bei oralen Dosen von Albuterolsulfat bis zu 50 mg/kg (etwa das 340-fache der MRHDID für Erwachsene auf mg/m-Basis).
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie C. Es gibt keine ausreichenden und gut kontrollierten Studien mit VENTOLIN HFA oder Albuterolsulfat bei Schwangeren. Während der weltweiten Vermarktungserfahrung wurde über verschiedene angeborene Anomalien, einschließlich Gaumenspalten und Gliedmaßendefekte, bei den Nachkommen von Patienten berichtet, die mit Albuterol behandelt wurden. Einige der Mütter nahmen während ihrer Schwangerschaft mehrere Medikamente ein. Es kann kein konsistentes Muster von Defekten erkannt werden, und ein Zusammenhang zwischen der Verwendung von Albuterol und angeborenen Anomalien wurde nicht hergestellt. Tierische Reproduktionsstudien an Mäusen und Kaninchen ergaben Hinweise auf Teratogenität. VENTOLIN HFA sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt. Frauen sollte geraten werden, sich an ihren Arzt zu wenden, wenn sie während der Einnahme von VENTOLIN HFA schwanger werden.
In einer Reproduktionsstudie an Mäusen führte subkutan verabreichtes Albuterolsulfat bei 5 von 111 (4,5 %) Föten zu Gaumenspalten bei Expositionen unterhalb der maximal empfohlenen täglichen Inhalationsdosis beim Menschen (MRHDID) für Erwachsene auf mg/m²-Basis und bei 10 von 108 (9,3 %) Föten bei etwa dem 8-fachen der MRHDID. Ähnliche Wirkungen wurden bei etwa einem Elftel der MRHDID nicht beobachtet. Gaumenspalten traten auch bei 22 von 72 (30,5 %) Föten weiblicher Frauen auf, die subkutan mit Isoproterenol behandelt wurden (positive Kontrolle).
In einer Reproduktionsstudie an Kaninchen führte oral verabreichtes Albuterolsulfat bei 7 von 19 Föten (37 %) zu Kranioschisis bei etwa dem 680-Fachen der MRHDID.
In einer anderen Kaninchenstudie führte eine durch Inhalation verabreichte Albuterolsulfat/HFA-134a-Formulierung zu einer Vergrößerung des vorderen Teils der fötalen Fontanellen bei etwa einem Drittel der MRHDID.
Nicht teratogene Wirkungen
Eine Studie, in der trächtigen Ratten radioaktiv markiertes Albuterolsulfat verabreicht wurde, zeigte, dass arzneimittelbezogenes Material aus dem mütterlichen Kreislauf auf den Fötus übertragen wird.
Arbeit und Lieferung
Es gibt keine gut kontrollierten Studien am Menschen, die die Auswirkungen von VENTOLIN HFA auf vorzeitige oder termingerechte Wehen untersucht haben. Wegen der möglichen Beeinträchtigung der Uteruskontraktilität durch Beta-Agonisten sollte die Anwendung von VENTOLIN HFA während der Wehen auf Patientinnen beschränkt werden, bei denen der Nutzen das Risiko eindeutig überwiegt.
Stillende Mutter
Die Plasmaspiegel von Albuterolsulfat und HFA-134a nach inhalativen therapeutischen Dosen sind beim Menschen sehr niedrig, aber es ist nicht bekannt, ob die Bestandteile von VENTOLIN HFA in die Muttermilch übergehen. Aufgrund des in Tierstudien für Albuterol nachgewiesenen tumorerzeugenden Potenzials und fehlender Erfahrung mit der Anwendung von VENTOLIN HFA bei stillenden Müttern sollte unter Berücksichtigung der Bedeutung des Arzneimittels entschieden werden, ob das Stillen beendet oder das Arzneimittel abgesetzt werden soll die Mutter. Vorsicht ist geboten, wenn VENTOLIN HFA einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von VENTOLIN HFA bei Kindern ab 4 Jahren wurde auf Grundlage von zwei 12-wöchigen klinischen Studien mit Asthmatikern ab 12 Jahren und einer 2-wöchigen klinischen Studie mit Asthmatikern im Alter von 4 bis 11 Jahren nachgewiesen [sehen NEBENWIRKUNGEN , Klinische Studien ]. Die Sicherheit und Wirksamkeit von VENTOLIN HFA bei Kindern unter 4 Jahren ist nicht erwiesen. Drei Studien wurden durchgeführt, um die Sicherheit und Wirksamkeit von VENTOLIN HFA bei Personen unter 4 Jahren zu bewerten, und die Ergebnisse werden nachstehend beschrieben.
Zwei 4-wöchige randomisierte, doppelblinde, placebokontrollierte Studien wurden mit 163 pädiatrischen Probanden im Alter von der Geburt bis 48 Monate mit Symptomen von Bronchospasmus im Zusammenhang mit obstruktiven Atemwegserkrankungen durchgeführt (zu den Symptomen gehörten: Keuchen, Husten, Atemnot oder Engegefühl in der Brust). . VENTOLIN HFA oder Placebo HFA wurde entweder mit einer AeroChamber Plus® Haltekammer mit Ventil oder einer Optichamber® Haltekammer mit Ventil und Maske 3-mal täglich verabreicht. In einer Studie wurden Kindern im Alter zwischen 24 und 48 Monaten VENTOLIN HFA 90 µg (n = 26), VENTOLIN HFA 180 µg (n = 25) und Placebo HFA (n = 26) verabreicht. In der zweiten Studie wurden Kindern im Alter zwischen der Geburt und 24 Monaten VENTOLIN HFA 90 µg (n = 29), VENTOLIN HFA 180 µg (n = 29) und Placebo HFA (n = 28) verabreicht. Während des 4-wöchigen Behandlungszeitraums gab es in beiden Studien keine Behandlungsunterschiede bei den Asthmasymptom-Scores zwischen den Gruppen, die VENTOLIN HFA 90 mcg, VENTOLIN HFA 180 mcg und Placebo erhielten.
In einer dritten Studie wurde VENTOLIN HFA bei 87 pädiatrischen Probanden unter 24 Monaten zur Behandlung von akutem Giemen untersucht. VENTOLIN HFA wurde in dieser Studie mit einer AeroChamber Plus Valved Holding Chamber geliefert. Zwischen VENTOLIN HFA 180 mcg und VENTOLIN HFA 360 mcg gab es keine signifikanten Unterschiede in den Asthmasymptom-Scores und der mittleren Veränderung gegenüber dem Ausgangswert in einem Asthmasymptom-Score.
In-vitro-Dosierungsstudien wurden durchgeführt, um die Abgabe von VENTOLIN HFA über Haltekammern mit angebrachten Masken zu bewerten. Die Studien wurden mit 2 verschiedenen Haltekammern mit Masken (kleine und mittlere Größe) durchgeführt. Die In-vitro-Studiendaten bei der Simulation der Patientenatmung deuten darauf hin, dass die Dosis von VENTOLIN HFA, die zur Inhalation über eine Haltekammer mit Ventil und Maske verabreicht wird, mit der Dosis vergleichbar ist, die Erwachsenen ohne Abstandshalter und Maske pro Kilogramm Körpergewicht verabreicht wird (Tabelle 2). Die oben beschriebenen klinischen Studien mit Kindern unter 4 Jahren deuten jedoch darauf hin, dass entweder die optimale Dosis von VENTOLIN HFA in dieser Altersgruppe nicht definiert wurde oder VENTOLIN HFA in dieser Altersgruppe nicht wirksam ist. Die Sicherheit und Wirksamkeit von VENTOLIN HFA, verabreicht mit oder ohne Abstandshalter, bei Kindern unter 4 Jahren wurde nicht nachgewiesen.
Geriatrische Verwendung
Klinische Studien mit VENTOLIN HFA schlossen keine ausreichende Anzahl von Probanden im Alter von 65 Jahren und älter ein, um festzustellen, ob ältere Probanden anders ansprechen als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
ÜBERDOSIS
Die erwarteten Anzeichen und Symptome bei einer Überdosierung von Albuterol sind die einer übermäßigen beta-adrenergen Stimulation und/oder des Auftretens oder der Übertreibung von Anzeichen und Symptomen einer beta-adrenergen Stimulation (z. B. Krampfanfälle, Angina pectoris, Hypertonie oder Hypotonie, Tachykardie mit erhöhten Frequenzen). bis 200 Schläge/min, Arrhythmien, Nervosität, Kopfschmerzen, Zittern, Muskelkrämpfe, Mundtrockenheit, Herzklopfen, Übelkeit, Schwindel, Müdigkeit, Unwohlsein, Schlaflosigkeit, Hyperglykämie, Hypokaliämie, metabolische Azidose).
Wie bei allen inhalativen Sympathomimetika kann eine Überdosierung von VENTOLIN HFA Inhalationsaerosol zu Herzstillstand und sogar zum Tod führen.
Die Behandlung besteht aus dem Absetzen von VENTOLIN HFA zusammen mit einer geeigneten symptomatischen Therapie. Die vernünftige Anwendung eines kardioselektiven Betarezeptorenblockers kann in Betracht gezogen werden, wobei zu berücksichtigen ist, dass solche Medikamente Bronchospasmen hervorrufen können. Es liegen keine ausreichenden Beweise vor, um festzustellen, ob eine Dialyse bei einer Überdosierung von VENTOLIN HFA von Vorteil ist.
KONTRAINDIKATIONEN
VENTOLIN HFA ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegen einen der Inhaltsstoffe [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , BEZEICHNUNG ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
In-vitro-Studien und pharmakologische In-vivo-Studien haben gezeigt, dass Albuterol im Vergleich zu Isoproterenol eine bevorzugte Wirkung auf beta2-adrenerge Rezeptoren hat. Obwohl Beta2-Adrenozeptoren die vorherrschenden adrenergen Rezeptoren in der glatten Bronchialmuskulatur sind und Beta1-Adrenozeptoren die vorherrschenden Rezeptoren im Herzen sind, gibt es auch Beta2-Adrenozeptoren im menschlichen Herzen, die 10 % bis 50 % der gesamten Beta-Adrenozeptoren ausmachen. Die genaue Funktion dieser Rezeptoren ist noch nicht bekannt, aber ihre Anwesenheit erhöht die Möglichkeit, dass sogar selektive Beta2-Agonisten kardiale Wirkungen haben können.
Die Aktivierung von beta2-adrenergen Rezeptoren auf der glatten Muskulatur der Atemwege führt zur Aktivierung der Adenylcyclase und zu einem Anstieg der intrazellulären Konzentration von zyklischem 3',5'-Adenosinmonophosphat (zyklisches AMP). Dieser Anstieg von zyklischem AMP führt zur Aktivierung von Proteinkinase A, die die Phosphorylierung von Myosin hemmt und die intrazellulären ionischen Calciumkonzentrationen senkt, was zu einer Entspannung führt. Albuterol entspannt die glatte Muskulatur aller Atemwege, von der Luftröhre bis zu den terminalen Bronchiolen. Albuterol wirkt als funktioneller Antagonist zur Entspannung der Atemwege unabhängig vom beteiligten Spasmogen und schützt so vor allen bronchokonstriktorischen Herausforderungen. Erhöhte Konzentrationen von zyklischem AMP sind auch mit der Hemmung der Freisetzung von Mediatoren aus Mastzellen in den Atemwegen verbunden.
Albuterol hat in den meisten kontrollierten klinischen Studien eine stärkere Wirkung auf die Atemwege in Form einer Entspannung der bronchialen glatten Muskulatur gezeigt als Isoproterenol bei vergleichbaren Dosen, während es weniger kardiovaskuläre Wirkungen hervorruft. Kontrollierte klinische Studien und andere klinische Erfahrungen haben gezeigt, dass inhaliertes Albuterol, wie andere beta-adrenerge Agonisten, bei einigen Patienten eine signifikante kardiovaskuläre Wirkung hervorrufen kann, gemessen anhand von Pulsfrequenz, Blutdruck, Symptomen und/oder elektrokardiographischen Veränderungen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Pharmakokinetik
Die systemischen Spiegel von Albuterol sind nach Inhalation der empfohlenen Dosen niedrig. Eine an 12 gesunden männlichen und weiblichen Probanden durchgeführte Studie mit einer höheren Dosis (1.080 mcg Albuterol-Base) zeigte, dass mittlere maximale Plasmakonzentrationen von etwa 3 ng/ml nach der Dosierung auftraten, wenn Albuterol mit dem Treibmittel HFA-134a verabreicht wurde. Die mittlere Zeit bis zum Erreichen der Spitzenkonzentrationen (Tmax) war nach Verabreichung von VENTOLIN HFA (Tmax = 0,42 Stunden) im Vergleich zu Albuterol-Inhalatoren mit FCKW-Antrieb (Tmax = 0,17 Stunden) verzögert. Die scheinbare terminale Plasmahalbwertszeit von Albuterol beträgt etwa 4,6 Stunden. Es wurden keine weiteren pharmakokinetischen Studien zu VENTOLIN HFA bei Neugeborenen, Kindern oder älteren Probanden durchgeführt.
Tiertoxikologie und/oder Pharmakologie
Präklinisch
Intravenöse Studien mit Albuterolsulfat an Ratten haben gezeigt, dass Albuterol die Blut-Hirn-Schranke passiert und Gehirnkonzentrationen von etwa 5,0 % der Plasmakonzentration erreicht. In Strukturen außerhalb der Blut-Hirn-Schranke (Zirbeldrüse und Hypophyse) wurden 100-mal höhere Albuterol-Konzentrationen als im gesamten Gehirn gefunden.
Studien an Labortieren (Minischweine, Nagetiere und Hunde) haben das Auftreten von Herzrhythmusstörungen und plötzlichem Herztod (mit histologischem Nachweis einer Myokardnekrose) gezeigt, wenn Beta-Agonisten und Methylxanthine gleichzeitig verabreicht wurden. Die klinische Relevanz dieser Befunde ist nicht bekannt.
Treibmittel HFA-134a
Bei Tieren und Menschen wurde festgestellt, dass das Treibmittel HFA-134a schnell absorbiert und schnell ausgeschieden wird, mit einer Eliminationshalbwertszeit von 3 bis 27 Minuten bei Tieren und 5 bis 7 Minuten beim Menschen. Die Zeit bis zur maximalen Plasmakonzentration (Tmax) und die mittlere Verweilzeit sind beide extrem kurz, was zu einem vorübergehenden Auftreten von HFA-134a im Blut ohne Anzeichen einer Akkumulation führt.
Das Treibmittel HFA-134a hat keine pharmakologische Aktivität, außer bei sehr hohen Dosen bei Tieren (d. h. 380- bis 1.300-mal die maximale menschliche Exposition, basierend auf Vergleichen der Fläche unter den Werten der Plasmakonzentration gegenüber der Zeitkurve [AUC]), was hauptsächlich zu Ataxie und Zittern führt , Dyspnoe oder Speichelfluss. Diese Ereignisse ähneln den Effekten, die durch die strukturell verwandten FCKW hervorgerufen werden, die ausgiebig in Dosieraerosolen verwendet wurden.
Klinische Studien
Bronchospasmus im Zusammenhang mit Asthma
Erwachsene und jugendliche Probanden ab 12 Jahren
Die Wirksamkeit von VENTOLIN HFA wurde in zwei 12-wöchigen, randomisierten, doppelblinden, placebokontrollierten Studien bei Patienten ab 12 Jahren mit leichtem bis mittelschwerem Asthma untersucht. Diese Studien umfassten insgesamt 610 Probanden (323 Männer, 287 Frauen). In jeder Studie erhielten die Probanden über einen Zeitraum von 12 Wochen 2 Inhalationen von VENTOLIN HFA, CFC 11/12-getriebenem Albuterol oder HFA-134a-Placebo 4-mal täglich. Patienten, die den HFA-134a-Placebo-Inhalator einnahmen, nahmen nach Bedarf auch VENTOLIN HFA zur Linderung der Asthmasymptome ein. Einige Patienten, die an diesen klinischen Studien teilnahmen, verwendeten gleichzeitig eine inhalative Steroidtherapie. Die Wirksamkeit wurde durch serielles forciertes Ausatmungsvolumen in 1 Sekunde (FEV) bewertet. In jeder dieser Studien führten 2 Inhalationen von VENTOLIN HFA zu einer signifikant größeren Verbesserung des FEV1 gegenüber dem Wert vor der Behandlung als Placebo. Die Ergebnisse der 2 klinischen Studien sind unten beschrieben.
In einer 12-wöchigen, randomisierten, doppelblinden Studie wurde VENTOLIN HFA (101 Probanden) mit CFC 11/12-getriebenem Albuterol (99 Probanden) und einem HFA-134a-Placebo-Inhalator (97 Probanden) bei jugendlichen und erwachsenen Probanden im Alter verglichen 12 bis 76 Jahre mit leichtem bis mittelschwerem Asthma. Serielle FEV1-Messungen [unten als prozentuale Veränderung gegenüber dem Ausgangswert am Testtag an Tag 1 (n = 297) und in Woche 12 (n = 249) gezeigt] zeigten, dass 2 Inhalationen von VENTOLIN HFA eine signifikant größere Verbesserung des FEV1 gegenüber dem Wert vor der Behandlung bewirkten als Placebo.
FEV1 als prozentuale Veränderung gegenüber der Vordosis in einer großen, 12-wöchigen klinischen Studie an Tag 1 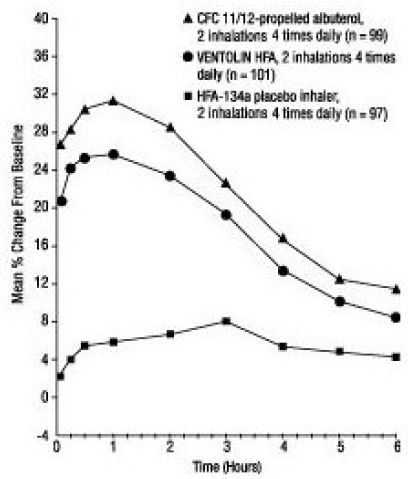
Woche 12 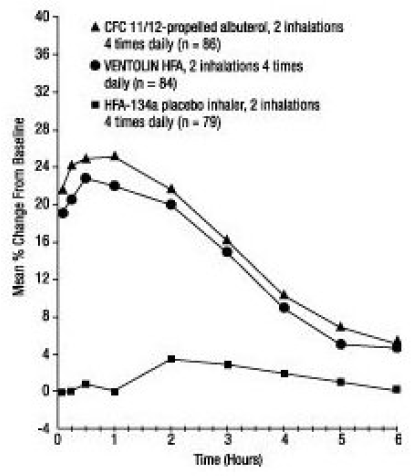
In der Responder-Population (größer oder gleich 15 % Anstieg des FEV1 innerhalb von 30 Minuten nach der Einnahme), die mit VENTOLIN HFA behandelt wurde, betrug die mittlere Zeit bis zum Einsetzen eines 15 %igen Anstiegs des FEV1 gegenüber dem Wert vor der Behandlung 5,4 Minuten und die mittlere Zeit bis Spitzenwirkung war 56 Minuten. Die mittlere Wirkungsdauer, gemessen an einem Anstieg des FEV1 um 15 % gegenüber dem Wert vor der Behandlung, betrug etwa 4 Stunden. Bei einigen Probanden betrug die Wirkungsdauer bis zu 6 Stunden.
Die zweite 12-wöchige randomisierte, doppelblinde Studie wurde durchgeführt, um die Wirksamkeit und Sicherheit der Umstellung von Probanden von CFC 11/12-getriebenem Albuterol auf VENTOLIN HFA zu bewerten. Während der 3-wöchigen Einlaufphase der Studie erhielten alle Probanden Albuterol mit CFC 11/12-Antrieb. Während der doppelblinden Behandlungsphase wurde VENTOLIN HFA (91 Probanden) mit CFC 11/12-getriebenem Albuterol (100 Probanden) und einem HFA-134a-Placebo-Inhalator (95 Probanden) bei erwachsenen und jugendlichen Probanden mit leichtem bis mittelschwerem Asthma verglichen. Serielle FEV1-Messungen zeigten, dass 2 Inhalationen von VENTOLIN HFA zu einer signifikant stärkeren Verbesserung der Lungenfunktion führten als Placebo. Die Umstellung von FCKW 11/12-getriebenem Albuterol-Inhalator auf VENTOLIN HFA zeigte keine klinisch signifikanten Änderungen des Wirksamkeitsprofils.
In den 2 Studien mit Erwachsenen waren die Wirksamkeitsergebnisse von VENTOLIN HFA signifikant höher als die von Placebo und klinisch vergleichbar mit denen, die mit CFC 11/12-getriebenem Albuterol erzielt wurden, obwohl kleine numerische Unterschiede in der mittleren FEV-Reaktion und anderen Messgrößen beobachtet wurden. Ärzte sollten sich darüber im Klaren sein, dass individuelle Reaktionen auf beta-adrenerge Agonisten, die über verschiedene Treibmittel verabreicht werden, unterschiedlich sein können und dass nicht von äquivalenten Reaktionen bei einzelnen Patienten ausgegangen werden sollte.
Pädiatrische Probanden im Alter von 4 bis 11 Jahren
Die Wirksamkeit von VENTOLIN HFA wurde in einer 2-wöchigen, randomisierten, doppelblinden, placebokontrollierten Studie an 135 pädiatrischen Probanden im Alter von 4 bis 11 Jahren mit leichtem bis mittelschwerem Asthma untersucht. In dieser Studie erhielten die Probanden VENTOLIN HFA, CFC 11/12-getriebenes Albuterol oder HFA-134a-Placebo. Serielle Lungenfunktionsmessungen zeigten, dass 2 Inhalationen von VENTOLIN HFA zu einer signifikant stärkeren Verbesserung der Lungenfunktion als Placebo führten und dass es keine signifikanten Unterschiede zwischen den mit VENTOLIN HFA und CFC 11/12-getriebenem Albuterol behandelten Gruppen gab. Bei der mit VENTOLIN HFA behandelten Responder-Population betrug die mittlere Zeit bis zum Einsetzen einer 15 %igen Erhöhung der exspiratorischen Spitzenflussrate (PEFR) gegenüber dem Wert vor der Behandlung 7,8 Minuten, und die mittlere Zeit bis zum Erreichen der maximalen Wirkung betrug etwa 90 Minuten. Die mittlere Wirkungsdauer, gemessen an einer 15 %igen Erhöhung des PEFR gegenüber dem Wert vor der Behandlung, betrug mehr als 3 Stunden. Bei einigen Probanden betrug die Wirkungsdauer bis zu 6 Stunden.
Belastungsinduzierter Bronchospasmus
Eine kontrollierte klinische Studie mit erwachsenen Asthmatikern (N = 24) zeigte, dass 2 Inhalationen von VENTOLIN HFA, die ungefähr 30 Minuten vor dem Training eingenommen wurden, im Vergleich zu einem HFA-134a belastungsinduzierten Bronchospasmen (gemessen am maximalen prozentualen Abfall des FEV1 nach dem Training) signifikant vorbeugten Placebo-Inhalator. Darüber hinaus wurde gezeigt, dass VENTOLIN HFA für diese Indikation klinisch mit einem CFC 11/12-betriebenen Albuterol-Inhalator vergleichbar ist.
INFORMATIONEN ZUM PATIENTEN
VENTOLIN® [vent' o-lin] HFA (Albuterolsulfat) Inhalation Aerosol
Lesen Sie die Patienteninformation, die VENTOLIN HFA Inhalationsaerosol beiliegt, bevor Sie damit beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Patienteninformation ersetzt nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung.
Was ist VENTOLIN HFA?
VENTOLIN HFA ist ein verschreibungspflichtiges Arzneimittel zur Inhalation, das bei Personen ab 4 Jahren angewendet wird, um:
Es ist nicht bekannt, ob VENTOLIN HFA bei Kindern unter 4 Jahren sicher und wirksam ist.
Wer sollte VENTOLIN HFA nicht anwenden?
Verwenden Sie VENTOLIN HFA nicht wenn Sie allergisch gegen Albuterolsulfat oder einen der sonstigen Bestandteile von VENTOLIN HFA sind. Siehe „Welche Inhaltsstoffe enthält VENTOLIN HFA?“ unten für eine vollständige Liste der Zutaten.
Was sollte ich meinem Arzt vor der Anwendung von VENTOLIN HFA mitteilen?
Informieren Sie Ihren Arzt über alle Ihre Gesundheitsprobleme, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen. VENTOLIN HFA und bestimmte andere Arzneimittel können miteinander interagieren. Dies kann schwerwiegende Nebenwirkungen verursachen.
Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Fragen Sie Ihren Arzt oder Apotheker nach einer Liste dieser Arzneimittel, wenn Sie sich nicht sicher sind.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste davon, um sie Ihrem Arzt und Apotheker zu zeigen, wenn Sie ein neues Arzneimittel erhalten.
Wie ist VENTOLIN HFA anzuwenden?
Lesen Sie die Schritt-für-Schritt-Anleitung zur Anwendung von VENTOLIN HFA am Ende dieser Patienteninformation.
Welche Nebenwirkungen kann VENTOLIN HFA haben?
VENTOLIN HFA kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Häufige Nebenwirkungen von VENTOLIN HFA sind:
Informieren Sie Ihren Arzt über jede Nebenwirkung, die Sie stört oder die nicht abklingt.
Dies sind nicht alle Nebenwirkungen von VENTOLIN HFA. Fragen Sie Ihren Arzt oder Apotheker nach weiteren Informationen.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist VENTOLIN HFA aufzubewahren?
Allgemeine Informationen zur sicheren und wirksamen Anwendung von VENTOLIN HFA
Arzneimittel werden manchmal für Zwecke verschrieben, die nicht in einer Packungsbeilage angegeben sind. Verwenden Sie VENTOLIN HFA nicht für eine Erkrankung, für die es nicht verschrieben wurde. Geben Sie Ihr VENTOLIN HFA nicht an andere Personen weiter, selbst wenn sie an derselben Erkrankung leiden wie Sie. Es kann ihnen schaden.
Diese Packungsbeilage fasst die wichtigsten Informationen zu VENTOLIN HFA zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt oder Apotheker. Sie können Ihren Arzt oder Apotheker um Informationen zu VENTOLIN HFA bitten, die für medizinisches Fachpersonal geschrieben wurden.
Weitere Informationen zu VENTOLIN HFA erhalten Sie telefonisch unter 1-888-825-5249 oder auf unserer Website unter www.ventolin.com.
Welche Inhaltsstoffe enthält VENTOLIN HFA?
Wirkstoff: Albuterolsulfat
Inaktiver Inhaltsstoff: Treibmittel HFA-134a
Gebrauchsanweisung
Nur zur oralen Inhalation
Ihr VENTOLIN HFA-Inhalator
Abbildung A 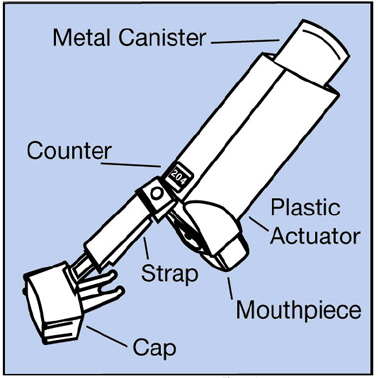
Abbildung B 
Vor der Anwendung Ihres VENTOLIN HFA-Inhalators
Vorbereiten Ihres VENTOLIN HFA-Inhalators
Abbildung C 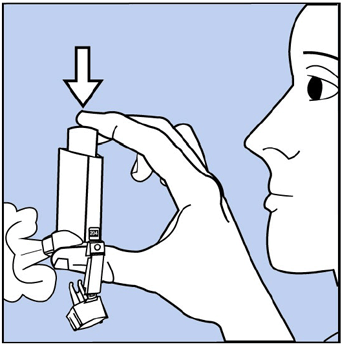
Abbildung D 
Wie ist Ihr VENTOLIN HFA-Inhalator anzuwenden?
Befolgen Sie diese Schritte bei jeder Anwendung von VENTOLIN HFA.
Schritt 1. Stellen Sie sicher, dass der Kanister fest im Aktuator sitzt. Der Zähler sollte durch das Fenster im Aktuator sichtbar sein.
Schütteln Sie den Inhalator gut vor jedem Spritzen.
Nehmen Sie die Kappe vom Mundstück des Auslösers ab. Suchen Sie im Inneren des Mundstücks nach Fremdkörpern und nehmen Sie alle heraus, die Sie sehen.
Schritt 2. Halten Sie den Inhalator mit dem Mundstück nach unten. Sehen Abbildung E .
Abbildung E 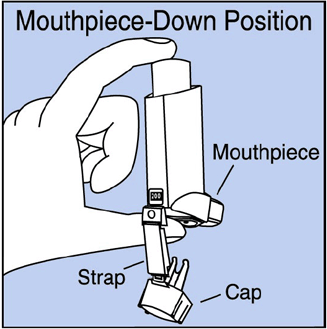
Schritt 3. Atme durch den Mund aus und drücke so viel Luft wie möglich aus deiner Lunge. Nehmen Sie das Mundstück in den Mund und schließen Sie Ihre Lippen darum. Siehe Abbildung F .
Abbildung F 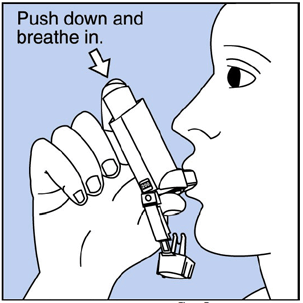
Schritt 4. Drücken Sie die Oberseite des Behälters ganz nach unten, während Sie tief und langsam durch den Mund einatmen. Sehen Abbildung F .
Schritt 5. Nachdem das Spray austritt, nehmen Sie Ihren Finger vom Kanister. Nachdem Sie vollständig eingeatmet haben, nehmen Sie den Inhalator aus dem Mund und schließen Sie den Mund.
Schritt 6. Halten Sie den Atem für etwa 10 Sekunden oder so lange an, wie es angenehm ist. Atmen Sie so lange wie möglich langsam aus.
Wenn Ihr medizinischer Betreuer Ihnen gesagt hat, dass Sie weitere Gebete anwenden sollen, warten Sie 1 Minute und schütteln Sie den Inhalator erneut. Wiederholen Sie die Schritte 2 bis 6.
Schritt 7. Setzen Sie die Kappe nach jeder Anwendung des Inhalators wieder auf das Mundstück. Stellen Sie sicher, dass es fest einrastet.
Reinigung Ihres VENTOLIN HFA-Inhalators
Reinigen Sie Ihren Inhalator mindestens 1 Mal pro Woche. Möglicherweise sehen Sie auf dem Inhalator keine Medikamentenablagerungen, aber es ist wichtig, ihn sauber zu halten, damit die Medikamentenablagerungen das Spray nicht blockieren. Siehe Abbildung G.
Abbildung G 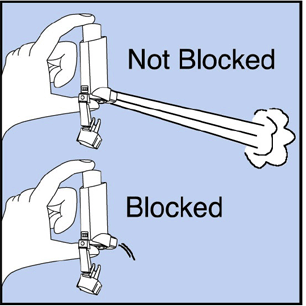
Schritt 8. Nehmen Sie den Kanister aus dem Auslöser und entfernen Sie die Kappe vom Mundstück. Der Riemen an der Kappe bleibt am Aktuator befestigt.
Schritt 9. Halten Sie den Auslöser unter den Wasserhahn und lassen Sie etwa 30 Sekunden lang warmes Wasser hindurchlaufen. Sehen Abbildung H.
Abbildung H 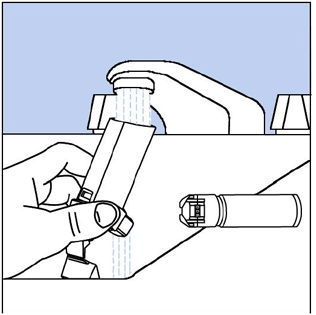
Schritt 10. Drehen Sie den Auslöser um und lassen Sie etwa 30 Sekunden lang warmes Wasser durch das Mundstück laufen. Sehen Abbildung I .
Abbildung I 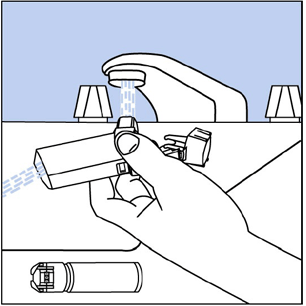
Schritt 11. Schütteln Sie so viel Wasser wie möglich vom Aktuator ab. Schauen Sie in das Mundstück, um sicherzustellen, dass alle Arzneimittelablagerungen vollständig weggespült wurden. Wenn sich Ablagerungen gebildet haben, wiederholen Sie die Schritte 9 und 10.
Schritt 12. Lassen Sie den Antrieb über Nacht an der Luft trocknen. Siehe Abbildung J.
Abbildung J 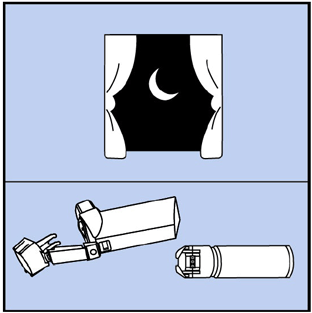
Schritt 13. Wenn der Auslöser trocken ist, setzen Sie die Schutzkappe auf das Mundstück und setzen Sie dann den Kanister in den Auslöser und stellen Sie sicher, dass er fest sitzt. Schütteln Sie den Inhalator gut, entfernen Sie die Kappe und sprühen Sie den Inhalator einmal von Ihrem Gesicht weg in die Luft. (Der Zähler zählt um 1 Zahl herunter.) Setzen Sie die Kappe wieder auf das Mundstück.
Wenn Sie Ihren Inhalator verwenden müssen, bevor der Auslöser vollständig trocken ist:
Austausch Ihres VENTOLIN HFA-Inhalators:
Denken Sie für die korrekte Anwendung Ihres VENTOLIN HFA-Inhalators an Folgendes:
Wenn Sie Fragen zu VENTOLIN HFA oder zur Anwendung Ihres Inhalators haben, rufen Sie GlaxoSmithKline (GSK) unter 1-888-825-5249 an oder besuchen Sie www.ventolin.com.
Diese Patienteninformation und Gebrauchsanweisung wurde von der US Food and Drug Administration genehmigt.