Proventil 100mcg Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
NUR ZUR ORALEN INHALATION
Was ist Proventil und wie wird es angewendet?
Proventil ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von akutem oder anstrengungsinduziertem Asthma (Bronchospasmus). Proventil 100 mcg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Proventil 100 mcg gehört zu einer Klasse von Arzneimitteln, die als Beta2-Agonisten bezeichnet werden.
Es ist nicht bekannt, ob Proventil bei Kindern unter 4 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Proventil haben?
Proventil kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Proventil gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Proventil. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
BEZEICHNUNG
Der Wirkstoff von PROVENTIL® HFA (Albuterolsulfat) Inhalationsaerosol ist Albuterolsulfat, USP racemisches α1 [(tert-Butylamino)methyl]-4-hydroxy-w-xylene- α,α '-diolsulfat (2: l) (Salz), ein relativ selektiver beta2-adrenerger Bronchodilatator mit der folgenden chemischen Struktur:
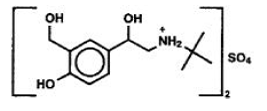
Alberolsulfat ist der offizielle generische Name in den Vereinigten Staaten. Der von der Weltgesundheitsorganisation empfohlene Name für das Medikament ist Salbutamolsulfat. Das Molekulargewicht von Albuterolsulfat beträgt 576,7 und die empirische Formel lautet (C13H21NO3)2*H2SO4. Albuterolsulfat ist ein weißer bis cremefarbener kristalliner Feststoff. Es ist wasserlöslich und leicht löslich in Ethanol. PROVENTIL HFA Inhalationsaerosol ist ein unter Druck stehendes Dosieraerosol zur oralen Inhalation. Es enthält eine mikrokristalline Suspension von Albuterolsulfat in Treibmittel HFA-134a (1,1,1,2-Tetrafluorethan), Ethanol und Ölsäure.
Jeder Sprühstoß gibt 120 µg Albuterolsulfat, USP aus dem Ventil und 108 µg Albuterolsulfat, USP aus dem Mundstück ab (entspricht 90 µg Albuterolbase aus dem Mundstück). Jeder Kanister bietet 200 Inhalationen. Es wird empfohlen, den Inhalator vor der erstmaligen Anwendung und in Fällen, in denen der Inhalator länger als 2 Wochen nicht verwendet wurde, durch Abgabe von vier „Testsprühstößen“ in die Luft, weg vom Gesicht, vorzubereiten.
Dieses Produkt enthält keine Fluorchlorkohlenwasserstoffe (FCKW) als Treibmittel.
INDIKATIONEN
PROVENTIL 100 µg HFA-Aerosol zur Inhalation ist angezeigt bei Erwachsenen und Kindern ab 4 Jahren zur Behandlung oder Vorbeugung von Bronchospasmen bei reversibler obstruktiver Atemwegserkrankung und zur Vorbeugung von belastungsinduzierten Bronchospasmen.
DOSIERUNG UND ANWENDUNG
Zur Behandlung akuter Bronchospasmus-Episoden oder zur Vorbeugung asthmatischer Symptome beträgt die übliche Dosierung für Erwachsene und Kinder ab 4 Jahren zwei Inhalationen alle 4 bis 6 Stunden. Eine häufigere Verabreichung oder eine größere Anzahl von Inhalationen wird nicht empfohlen. Bei manchen Patienten kann eine Inhalation alle 4 Stunden ausreichend sein. Jeder Sprühstoß von PROVENTIL 100 µg HFA-Inhalationsaerosol gibt 108 µg Albuterolsulfat (entsprechend 90 µg Albuterolbase) aus dem Mundstück ab. Es wird empfohlen, den Inhalator vor der erstmaligen Anwendung und in Fällen, in denen der Inhalator länger als 2 Wochen nicht verwendet wurde, durch Abgabe von vier „Testsprühstößen“ in die Luft, weg vom Gesicht, vorzubereiten.
PROVENTIL 100 mcg HFA-Inhalationsaerosol enthält 200 Inhalationen pro Kanister. Der Kanister hat eine angebrachte Dosisanzeige, die anzeigt, wie viele Inhalationen verbleiben. Die Dosisanzeige bewegt sich nach jeder zehnten Betätigung. Wenn sich das Ende der verwendbaren Inhalationen nähert, wechselt der Hintergrund hinter der Zahl im Anzeigefenster der Dosisanzeige bei 20 Sprühstößen oder weniger zu Rot. PROVENTIL HFA Inhalationsaerosol sollte verworfen werden, wenn das Anzeigefenster der Dosisanzeige Null anzeigt.
Prävention von belastungsinduziertem Bronchospasmus
Die übliche Dosierung für Erwachsene und Kinder ab 4 Jahren beträgt zwei Inhalationen 15 bis 30 Minuten vor dem Training.
Um die ordnungsgemäße Verwendung dieses Produkts zu gewährleisten, ist es wichtig, dass das Mundstück mindestens einmal pro Woche gründlich gewaschen und getrocknet wird. Der Inhalator kann die Medikamentenabgabe einstellen, wenn er nicht ordnungsgemäß gereinigt und gründlich getrocknet wird (siehe INFORMATIONEN ZUM PATIENTEN ). Es ist sehr wichtig, das Kunststoff-Mundstück sauber zu halten, um Medikamentenansammlungen und Verstopfungen zu vermeiden. Der Inhalator gibt möglicherweise kein Medikament mehr ab, wenn er nicht ordnungsgemäß gereinigt und gründlich an der Luft getrocknet wird. Wenn das Mundstück verstopft ist, wird die Verstopfung durch Waschen des Mundstücks entfernt.
Wenn ein zuvor wirksames Dosierungsschema nicht die übliche Wirkung zeigt, kann dies ein Zeichen für eine Destabilisierung von Asthma sein und erfordert eine Neubewertung des Patienten und des Behandlungsschemas, wobei der möglichen Notwendigkeit einer entzündungshemmenden Behandlung, z. B. Kortikosteroiden, besondere Beachtung zu schenken ist.
WIE GELIEFERT
PROVENTIL 100 mcg HFA (Albuterolsulfat) Inhalationsaerosol wird als Aluminium-Druckbehälter mit angebrachtem Dosisindikator, einem gelben Kunststoffbetätiger und einer orangefarbenen Staubkappe jeweils in Einzelkartons geliefert. Jeder Sprühstoß gibt 120 µg Albuterolsulfat aus dem Ventil und 108 µg Albuterolsulfat aus dem Mundstück ab (entspricht 90 µg Albuterol-Base). Kanister mit einem gekennzeichneten Nettogewicht von 6,7 g enthalten 200 Inhalationen ( NDC 0085-1132-04).
Zwischen 15° - 25°C (59° - 77°F) lagern. Bewahren Sie den Inhalator mit dem Mundstück nach unten auf. Für beste Ergebnisse sollte der Kanister vor Gebrauch Raumtemperatur haben.
VOR GEBRAUCH GUT SCHÜTTELN.
Der mit PROVENTIL 100 µg HFA-Inhalationsaerosol gelieferte gelbe Betätiger sollte nicht mit anderen Produktkanistern verwendet werden, und der Betätiger anderer Produkte sollte nicht mit einem PROVENTIL HFA-Inhalationsaerosol verwendet werden. Die korrekte Medikamentenmenge in jedem Kanister kann nach 200 Betätigungen und wenn das Anzeigefenster der Dosisanzeige Null anzeigt, nicht gewährleistet werden, obwohl der Kanister nicht vollständig leer ist. Der Kanister sollte entsorgt werden, wenn die angegebene Anzahl von Sprühstößen verwendet wurde.
WARNUNG: Nicht in die Augen sprühen. Inhalt unter Druck. Nicht durchstechen oder verbrennen. Temperaturen über 120 °F können zum Platzen führen. Außerhalb der Reichweite von Kindern aufbewahren.
PROVENTIL HFA Inhalationsaerosol enthält keine Fluorchlorkohlenwasserstoffe (FCKW) als Treibmittel.
Hergestellt für: Merck Sharp & Dohme Corp„eine Tochtergesellschaft von MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Entwickelt und hergestellt von: 3M Health Care Limited Loughborough UK oder 3M Drug Delivery Systems Northridge, CA 91324, USA. Überarbeitet: September 2017
NEBENWIRKUNGEN
Die Informationen zu Nebenwirkungen von PROVENTIL HFA Aerosol zur Inhalation stammen aus einer 12-wöchigen, doppelblinden Double-Dummy-Studie, in der PROVENTIL HFA Aerosol zur Inhalation, ein Albuterol-Inhalator mit CFC-11/12-Antrieb und ein HFA-134a-Placebo-Inhalator bei 565 Asthmatikern verglichen wurden Patienten. Die folgende Tabelle listet die Inzidenz aller Nebenwirkungen (ob vom Prüfarzt als medikamentenbedingt oder nicht medikamentenbedingt betrachtet) aus dieser Studie auf, die in der Behandlungsgruppe mit PROVENTIL 100 µg HFA-Aerosol zur Inhalation mit einer Rate von 3 % oder mehr und häufiger in der Behandlungsgruppe auftraten PROVENTIL 100 µg HFA-Inhalationsaerosol in der Behandlungsgruppe als in der Placebogruppe. Insgesamt waren Inzidenz und Art der Nebenwirkungen, die für PROVENTIL 100 µg HFA-Aerosol zur Inhalation berichtet wurden, und ein Albuterol-Inhalator mit CFC 11/12-Antrieb vergleichbar.
Auftreten von Nebenwirkungen (% der Patienten) in einer großen 12-wöchigen klinischen Studie*
Zu den Nebenwirkungen, die von weniger als 3 % der Patienten, die PROVENTIL HFA-Inhalationsaerosol erhielten, und von einem größeren Anteil der Patienten mit PROVENTIL 100 µg HFA-Inhalationsaerosol als Placebo-Patienten berichtet wurden, die möglicherweise mit PROVENTIL 100 µg HFA-Inhalationsaerosol in Zusammenhang stehen, gehören: Dysphonie, vermehrtes Schwitzen, Mundtrockenheit, Brustschmerzen, Ödeme, Schüttelfrost, Ataxie, Beinkrämpfe, Hyperkinesie, Aufstoßen, Blähungen, Ohrensausen, Diabetes mellitus, Angst, Depression, Somnolenz, Hautausschlag. Herzklopfen und Schwindel wurden auch mit PROVENTIL HFA Inhalationsaerosol beobachtet.
Nebenwirkungen, die in einer 4-wöchigen pädiatrischen klinischen Studie zum Vergleich von PROVENTIL 100 mcg HFA-Aerosol zur Inhalation und einem Albuterol-Inhalator mit FCKW 11/12 berichtet wurden, traten mit einer geringen Inzidenzrate auf und waren ähnlich denen, die in den Studien mit Erwachsenen beobachtet wurden.
In Studien mit kleinen kumulativen Dosen schienen Tremor, Nervosität und Kopfschmerzen dosisabhängig zu sein.
Seltene Fälle von Urtikaria, Angioödem, Hautausschlag, Bronchospasmus und oropharyngealem Ödem wurden nach der Anwendung von inhaliertem Albuterol berichtet. Darüber hinaus kann Albuterol, wie andere Sympathomimetika, Nebenwirkungen wie Bluthochdruck, Angina pectoris, Schwindel, Stimulation des zentralen Nervensystems, Schlaflosigkeit, Kopfschmerzen, metabolische Azidose und Austrocknung oder Reizung des Oropharynx verursachen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Betablocker
Betarezeptorenblocker blockieren nicht nur die pulmonale Wirkung von Beta-Agonisten wie PROVENTIL 100 µg HFA-Aerosol zur Inhalation, sondern können bei Asthmapatienten schwere Bronchospasmen hervorrufen. Daher sollten Patienten mit Asthma normalerweise nicht mit Betablockern behandelt werden. Unter bestimmten Umständen, z. B. als Prophylaxe nach Myokardinfarkt, gibt es jedoch möglicherweise keine akzeptablen Alternativen zum Einsatz von Betarezeptorenblockern bei Patienten mit Asthma. In dieser Situation sollten kardioselektive Betablocker in Betracht gezogen werden, obwohl sie mit Vorsicht verabreicht werden sollten.
Diuretika
Die EKG-Veränderungen und/oder Hypokaliämie, die aus der Verabreichung von nichtkaliumsparenden Diuretika (wie Schleifen- oder Thiaziddiuretika) resultieren können, können durch Beta-Agonisten akut verschlechtert werden, insbesondere wenn die empfohlene Dosis des Beta-Agonisten überschritten wird. Obwohl die klinische Bedeutung dieser Wirkungen nicht bekannt ist, ist bei der gleichzeitigen Verabreichung von Beta-Agonisten mit nichtkaliumsparenden Diuretika Vorsicht geboten.
Albuterol-Digoxin
Bei gesunden Probanden, die 10 Tage lang Digoxin erhalten hatten, wurde nach intravenöser bzw. oraler Einzeldosisgabe von Albuterol eine mittlere Abnahme der Digoxinspiegel im Serum um 16 % bzw. 22 % nachgewiesen. Die klinische Bedeutung dieser Ergebnisse für Patienten mit obstruktiver Atemwegserkrankung, die Albuterol und Digoxin auf chronischer Basis erhalten, ist unklar; dennoch wäre es ratsam, die Digoxinspiegel im Serum bei Patienten, die derzeit Digoxin und Albuterol erhalten, sorgfältig zu bestimmen.
Monoaminoxidase-Hemmer oder trizyklische Antidepressiva
PROVENTIL HFA Aerosol zur Inhalation sollte bei Patienten, die mit Monoaminoxidasehemmern oder trizyklischen Antidepressiva behandelt werden, mit äußerster Vorsicht oder innerhalb von 2 Wochen nach Absetzen solcher Mittel verabreicht werden, da die Wirkung von Albuterol auf das Herz-Kreislauf-System verstärkt werden kann.
WARNUNGEN
Paradoxer Bronchospasmus
Inhaliertes Albuterolsulfat kann paradoxe Bronchospasmen hervorrufen, die lebensbedrohlich sein können. Wenn ein paradoxer Bronchospasmus auftritt, sollte PROVENTIL HFA Inhalationsaerosol sofort abgesetzt und eine alternative Therapie eingeleitet werden. Es sollte beachtet werden, dass paradoxer Bronchospasmus, wenn er mit inhalierten Formulierungen verbunden ist, häufig bei der ersten Verwendung eines neuen Kanisters auftritt.
Verschlechterung von Asthma
Asthma kann sich akut über einen Zeitraum von Stunden oder chronisch über mehrere Tage oder länger verschlechtern. Wenn der Patient mehr Dosen von PROVENTIL HFA Inhalationsaerosol als üblich benötigt, kann dies ein Hinweis auf eine Destabilisierung des Asthmas sein und erfordert eine Neubewertung des Patienten und des Behandlungsschemas unter besonderer Berücksichtigung der möglichen Notwendigkeit einer entzündungshemmenden Behandlung, z. Kortikosteroide.
Verwendung von entzündungshemmenden Mitteln
Die Anwendung von beta-adrenergen Agonisten als Bronchodilatatoren allein ist bei vielen Patienten möglicherweise nicht ausreichend, um Asthma zu kontrollieren. Es sollte frühzeitig erwogen werden, dem therapeutischen Schema entzündungshemmende Mittel, z. B. Kortikosteroide, hinzuzufügen.
Kardiovaskuläre Wirkungen
PROVENTIL 100 µg HFA-Aerosol zur Inhalation kann wie andere beta-adrenerge Agonisten bei einigen Patienten klinisch signifikante kardiovaskuläre Wirkungen hervorrufen, gemessen an Pulsfrequenz, Blutdruck und/oder Symptomen. Obwohl solche Wirkungen nach Verabreichung von PROVENTIL 100 µg HFA-Aerosol zur Inhalation in den empfohlenen Dosierungen gelegentlich auftreten, muss das Arzneimittel gegebenenfalls abgesetzt werden, wenn sie auftreten. Darüber hinaus wurde von Beta-Agonisten berichtet, dass sie EKG-Veränderungen wie eine Abflachung der T-Welle, eine Verlängerung des QTc-Intervalls und eine ST-Streckensenkung hervorrufen. Die klinische Bedeutung dieser Befunde ist nicht bekannt. Daher sollte PROVENTIL HFA Inhalationsaerosol, wie alle sympathomimetischen Amine, bei Patienten mit Herz-Kreislauf-Erkrankungen, insbesondere Koronarinsuffizienz, Herzrhythmusstörungen und Bluthochdruck, mit Vorsicht angewendet werden.
Überschreiten Sie nicht die empfohlene Dosis
Todesfälle wurden im Zusammenhang mit der übermäßigen Anwendung von inhalativen Sympathomimetika bei Patienten mit Asthma berichtet. Die genaue Todesursache ist unbekannt, aber es wird ein Herzstillstand nach einer unerwarteten Entwicklung einer schweren akuten asthmatischen Krise und anschließender Hypoxie vermutet.
Sofortige Überempfindlichkeitsreaktionen
Unmittelbare Überempfindlichkeitsreaktionen können nach Verabreichung von Albuterolsulfat auftreten, wie in seltenen Fällen von Urtikaria, Angioödem, Hautausschlag, Bronchospasmus, Anaphylaxie und oropharyngealem Ödem gezeigt wurde.
VORSICHTSMASSNAHMEN
Allgemein
Wie alle sympathomimetischen Amine sollte Albuterolsulfat bei Patienten mit Herz-Kreislauf-Erkrankungen, insbesondere Koronarinsuffizienz, Herzrhythmusstörungen und Bluthochdruck, mit Vorsicht angewendet werden; bei Patienten mit Krampfanfällen, Schilddrüsenüberfunktion oder Diabetes mellitus; und bei Patienten, die ungewöhnlich auf sympathomimetische Amine ansprechen. Klinisch signifikante Veränderungen des systolischen und diastolischen Blutdrucks wurden bei einzelnen Patienten beobachtet und es ist zu erwarten, dass sie bei einigen Patienten nach Anwendung eines beta-adrenergen Bronchodilatators auftreten.
Es wurde berichtet, dass große Dosen von intravenösem Albuterol einen vorbestehenden Diabetes mellitus und eine Ketoazidose verschlimmern. Wie andere Beta-Agonisten kann Albuterol bei manchen Patienten eine signifikante Hypokaliämie hervorrufen, möglicherweise durch intrazellulären Shunt, der das Potenzial hat, nachteilige kardiovaskuläre Wirkungen hervorzurufen. Die Abnahme ist normalerweise vorübergehend und erfordert keine Ergänzung.
Informationen für Patienten
Siehe Abbildung Gebrauchsanweisung des Patienten VOR GEBRAUCH GUT SCHÜTTELN. Die Patienten sollten die folgenden Informationen erhalten:
Es wird empfohlen, den Inhalator vor der erstmaligen Anwendung und in Fällen, in denen der Inhalator länger als 2 Wochen nicht verwendet wurde, durch Abgabe von vier „Testsprühstößen“ in die Luft, weg vom Gesicht, vorzubereiten.
ES IST SEHR WICHTIG, DAS KUNSTSTOFF-MUNDSTÜCK SAUBER ZU HALTEN, UM EINE ANLAGE UND BLOCKIERUNG VON MEDIKAMENTEN ZU VERHINDERN. DAS MUNDSTÜCK SOLLTE MINDESTENS EINMAL PRO WOCHE GEWASCHEN, GESCHÜTTELT WERDEN, UM ÜBERSCHÜSSIGES WASSER ZU ENTFERNEN, UND GRÜNDLICH AN DER LUFT GETROCKNET WERDEN. DER INHALER KANN KEINE MEDIKAMENTE ABGEBEN, WENN ER NICHT ORDNUNGSGEMÄSS REINIGT IST.
Das Mundstück sollte gereinigt werden (bei entferntem Kanister), indem Sie mindestens einmal pro Woche 30 Sekunden lang warmes Wasser durch die Ober- und Unterseite laufen lassen. Das Mundstück muss geschüttelt werden, um überschüssiges Wasser zu entfernen, und dann gründlich an der Luft getrocknet werden (z. B. über Nacht). Wenn das Mundstück nicht gründlich an der Luft getrocknet wird, kann es zu einer Verstopfung durch Medikamentenansammlungen oder eine unsachgemäße Medikamentenabgabe kommen.
Wenn das Mundstück verstopft sein sollte (es kommt wenig oder kein Medikament aus dem Mundstück), kann die Verstopfung durch Waschen wie oben beschrieben entfernt werden.
Wenn es notwendig ist, den Inhalator zu verwenden, bevor er vollständig trocken ist, überschüssiges Wasser abschütteln, den Kanister ersetzen, das Spray zweimal vom Gesicht weg testen und die verschriebene Dosis einnehmen. Nach einer solchen Verwendung sollte das Mundstück erneut gewaschen und gründlich an der Luft getrocknet werden.
Die Wirkung von PROVENTIL HFA Inhalationsaerosol sollte bis zu 4 bis 6 Stunden anhalten. PROVENTIL HFA Inhalationsaerosol sollte nicht häufiger als empfohlen angewendet werden. Erhöhen Sie die Dosis oder Häufigkeit der Dosen von PROVENTIL HFA Inhalationsaerosol nicht ohne Rücksprache mit Ihrem Arzt. Wenn Sie feststellen, dass die Behandlung mit PROVENTIL 100 µg HFA-Aerosol zur Inhalation zur Linderung der Symptome nachlässt, Ihre Symptome sich verschlimmern und/oder Sie das Produkt häufiger als gewöhnlich anwenden müssen, sollten Sie sofort einen Arzt aufsuchen. Während Sie PROVENTIL 100 µg HFA-Inhalationsaerosol einnehmen, sollten andere Inhalationsmedikamente und Asthmamedikamente nur nach Anweisung Ihres Arztes eingenommen werden.
Häufige Nebenwirkungen der Behandlung mit inhaliertem Albuterol sind Herzklopfen, Brustschmerzen, schneller Herzschlag, Zittern oder Nervosität. Wenn Sie schwanger sind oder stillen, wenden Sie sich wegen der Anwendung von PROVENTIL 100 µg HFA-Aerosol zur Inhalation an Ihren Arzt. Zur wirksamen und sicheren Anwendung von PROVENTIL 100 µg HFA-Aerosol zur Inhalation gehört das Verständnis der Art und Weise, wie es verabreicht werden sollte. Verwenden Sie PROVENTIL HFA Inhalationsaerosol nur mit dem mitgelieferten Betätiger. Entsorgen Sie den Kanister nach 200 Sprühstößen.
Im Allgemeinen ist die Technik zur Verabreichung von PROVENTIL HFA Inhalationsaerosol bei Kindern ähnlich wie bei Erwachsenen. Kinder sollten PROVENTIL HFA Inhalationsaerosol unter Aufsicht eines Erwachsenen anwenden, wie vom Arzt des Patienten angewiesen. (Siehe Gebrauchsanweisung des Patienten.)
Karzinogenese, Mutagenese und Beeinträchtigung der Fruchtbarkeit
In einer 2-Jahres-Studie an SPRAGUE-DAWLEY®-Ratten verursachte Albuterolsulfat bei den oben genannten Futterdosen von 2 mg/kg (etwa das 15-fache der maximal empfohlenen täglichen Inhalationsdosis) einen dosisabhängigen Anstieg der Inzidenz gutartiger Leiomyome des Mesovariums für Erwachsene auf einer mg/m²-Basis und etwa das 6-fache der maximal empfohlenen täglichen Inhalationsdosis für Kinder auf einer mg/m²-Basis). In einer anderen Studie wurde dieser Effekt durch die gleichzeitige Gabe von Propranolol, einem nichtselektiven beta-adrenergen Antagonisten, blockiert. In einer 18-monatigen Studie an CD-1-Mäusen zeigte Albuterolsulfat in Dosen von bis zu 500 mg/kg (etwa dem 1700-fachen der maximal empfohlenen täglichen Inhalationsdosis für Erwachsene auf mg/m²-Basis und etwa dem 800-Fachen der maximal empfohlenen täglichen Inhalationsdosis für Erwachsene) keine Hinweise auf eine tumorerzeugende Wirkung mal die maximal empfohlene tägliche Inhalationsdosis für Kinder auf mg/m²-Basis). In einer 22-monatigen Studie an Goldhamstern zeigte Albuterolsulfat bei Futterdosen von bis zu 50 mg/kg (ungefähr das 225-fache der maximal empfohlenen täglichen Inhalationsdosis für Erwachsene auf mg/m²-Basis und ungefähr das 110-fache der maximalen empfohlenen täglichen Inhalationsdosis für Erwachsene) keine Hinweise auf eine tumorerzeugende Wirkung maximal empfohlene tägliche Inhalationsdosis für Kinder auf mg/m²-Basis).
Albuterolsulfat war im Ames-Test oder einem Mutationstest in Hefe nicht mutagen. Albuterolsulfat war in einem humanen peripheren Lymphozyten-Assay oder in einem AH1-Mäuse-Mikronukleus-Assay nicht klastogen.
Reproduktionsstudien an Ratten ergaben keine Hinweise auf eine Beeinträchtigung der Fertilität bei oralen Dosen bis zu 50 mg/kg (etwa das 340-fache der maximal empfohlenen täglichen Inhalationsdosis für Erwachsene auf mg/m²-Basis).
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie C
Albuterolsulfat hat sich bei Mäusen als teratogen erwiesen. Eine Studie an CD-1-Mäusen, denen Albuterolsulfat subkutan verabreicht wurde, zeigte Gaumenspalten bei 5 von 111 (4,5 %) Föten bei 0,25 mg/kg (weniger als die maximal empfohlene tägliche Inhalationsdosis für Erwachsene auf mg/m²-Basis) und bei 10 von 108 (9,3 %) Föten mit 2,5 mg/kg (ungefähr das Achtfache der maximal empfohlenen täglichen Inhalationsdosis für Erwachsene auf mg/m²-Basis). Das Arzneimittel induzierte bei einer Dosis von 0,025 mg/kg (weniger als die maximal empfohlene tägliche Inhalationsdosis für Erwachsene auf mg/m²-Basis) keine Gaumenspaltenbildung. Gaumenspalten traten auch bei 22 von 72 (30,5 %) Föten von weiblichen Tieren auf, die subkutan mit 2,5 mg/kg Isoproterenol behandelt wurden (positive Kontrolle).
Eine Reproduktionsstudie an holländischen Stride-Kaninchen zeigte eine Kranioschisis bei 7 von 19 (37 %) Föten, wenn Albuterolsulfat oral in einer Dosis von 50 mg/kg verabreicht wurde (etwa das 680-fache der maximal empfohlenen täglichen Inhalationsdosis für Erwachsene auf mg/m²-Basis).
In einer Inhalations-Reproduktionsstudie an SPRAGUE-DAWLEY-Ratten zeigte die Albuterolsulfat/HFA-134a-Formulierung keine teratogenen Wirkungen bei 10,5 mg/kg (etwa dem 70-Fachen der maximal empfohlenen täglichen Inhalationsdosis für Erwachsene auf mg/m²-Basis).
Eine Studie, in der trächtigen Ratten radioaktiv markiertes Albuterolsulfat verabreicht wurde, zeigte, dass arzneimittelbezogenes Material aus dem mütterlichen Kreislauf auf den Fötus übertragen wird.
Es liegen keine ausreichenden und gut kontrollierten Studien zu PROVENTIL 100 µg HFA-Aerosol zur Inhalation oder Albuterolsulfat bei Schwangeren vor. PROVENTIL 100 µg HFA-Aerosol zur Inhalation sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Während der weltweiten Vermarktungserfahrung wurde über verschiedene angeborene Anomalien, einschließlich Gaumenspalten und Gliedmaßendefekte, bei den Nachkommen von Patienten berichtet, die mit Albuterol behandelt wurden. Einige der Mütter nahmen während ihrer Schwangerschaft mehrere Medikamente ein. Da kein konsistentes Muster von Defekten erkennbar ist, wurde kein Zusammenhang zwischen der Verwendung von Albuterol und angeborenen Anomalien hergestellt.
Verwendung bei Wehen und Entbindung
Aufgrund der möglichen Beeinträchtigung der Uteruskontraktilität durch Beta-Agonisten sollte die Anwendung von PROVENTIL HFA Inhalationsaerosol zur Linderung von Bronchospasmen während der Wehen auf Patientinnen beschränkt werden, bei denen der Nutzen das Risiko eindeutig überwiegt.
Tokolyse
Albuterol ist nicht für die Behandlung vorzeitiger Wehen zugelassen. Das Nutzen-Risiko-Verhältnis bei Verabreichung von Albuterol zur Tokolyse wurde nicht ermittelt. Schwerwiegende Nebenwirkungen, einschließlich Lungenödem, wurden während oder nach der Behandlung vorzeitiger Wehen mit Beta2-Agonisten, einschließlich Albuterol, berichtet.
Stillende Mutter
Die Plasmaspiegel von Albuterolsulfat und HFA-134a nach inhalativen therapeutischen Dosen sind beim Menschen sehr niedrig, aber es ist nicht bekannt, ob die Bestandteile von PROVENTIL 100 µg HFA-Aerosol zur Inhalation in die Muttermilch übergehen.
Aufgrund des in Tierversuchen nachgewiesenen tumorerzeugenden Potenzials von Albuterol und fehlender Erfahrung mit der Anwendung von PROVENTIL HFA Inhalationsaerosol durch stillende Mütter sollte eine Entscheidung getroffen werden, ob das Stillen oder das Medikament unter Berücksichtigung der Bedeutung des Medikaments beendet werden sollen Medikament für die Mutter. Vorsicht ist geboten, wenn Albuterolsulfat einer stillenden Frau verabreicht wird.
Pädiatrie
Die Sicherheit und Wirksamkeit von PROVENTIL HFA Inhalationsaerosol bei pädiatrischen Patienten unter 4 Jahren ist nicht erwiesen.
Geriatrie
PROVENTIL HFA Aerosol zur Inhalation wurde nicht an einer geriatrischen Population untersucht. Wie bei anderen Beta2-Agonisten ist bei der Anwendung von PROVENTIL HFA Inhalationsaerosol bei älteren Patienten mit gleichzeitiger kardiovaskulärer Erkrankung, die durch diese Arzneimittelklasse beeinträchtigt werden könnte, besondere Vorsicht geboten.
ÜBERDOSIS
Die zu erwartenden Symptome bei einer Überdosierung sind übermäßige beta-adrenerge Stimulation und/oder Auftreten oder Verstärkung eines der unter NEBENWIRKUNGEN aufgeführten Symptome, z. B. Krampfanfälle, Angina pectoris, Bluthochdruck oder Hypotonie, Tachykardie mit Frequenzen von bis zu 200 Schlägen pro Minute, Arrhythmien , Nervosität, Kopfschmerzen, Zittern, Mundtrockenheit, Herzklopfen, Übelkeit, Schwindel, Müdigkeit, Unwohlsein und Schlaflosigkeit.
Es kann auch eine Hypokaliämie auftreten. Wie bei allen sympathomimetischen Arzneimitteln kann der Missbrauch von PROVENTIL 100 µg HFA-Aerosol zur Inhalation zu Herzstillstand und sogar zum Tod führen. Die Behandlung besteht aus dem Absetzen von PROVENTIL HFA Inhalationsaerosol zusammen mit einer geeigneten symptomatischen Therapie. Die vernünftige Anwendung eines kardioselektiven Betarezeptorenblockers kann in Betracht gezogen werden, wobei zu berücksichtigen ist, dass solche Medikamente Bronchospasmen hervorrufen können. Es liegen keine ausreichenden Beweise vor, um festzustellen, ob eine Dialyse bei einer Überdosierung von PROVENTIL HFA Inhalationsaerosol vorteilhaft ist.
Die orale mediane tödliche Dosis von Albuterolsulfat bei Mäusen ist größer als 2000 mg/kg (ungefähr das 6800-fache der maximal empfohlenen täglichen Inhalationsdosis für Erwachsene auf einer mg/m²-Basis und ungefähr das 3200-fache der maximal empfohlenen täglichen Inhalationsdosis für Kinder auf einer mg-Basis). /m² Basis). Bei ausgewachsenen Ratten beträgt die subkutane mittlere letale Dosis von Albuterolsulfat etwa 450 mg/kg (etwa das 3000-fache der maximal empfohlenen täglichen Inhalationsdosis für Erwachsene auf mg/m²-Basis und etwa das 1400-fache der maximal empfohlenen täglichen Inhalationsdosis für Kinder auf a mg/m² Basis). Bei jungen Ratten beträgt die subkutane mittlere tödliche Dosis etwa 2000 mg/kg (etwa das 14.000-fache der maximal empfohlenen täglichen Inhalationsdosis für Erwachsene auf einer mg/m²-Basis und etwa das 6400-fache der maximal empfohlenen täglichen Inhalationsdosis für Kinder auf einer mg/m²-Basis). Basis). Die mittlere tödliche Inhalationsdosis wurde bei Tieren nicht bestimmt.
KONTRAINDIKATIONEN
PROVENTIL 100 mcg HFA Aerosol zur Inhalation ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegenüber Albuterol oder anderen PROVENTIL HFA-Bestandteilen.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
In-vitro-Studien und pharmakologische In-vivo-Studien haben gezeigt, dass Albuterol im Vergleich zu Isoproterenol eine bevorzugte Wirkung auf beta2-adrenerge Rezeptoren hat. Obwohl anerkannt ist, dass beta2-adrenerge Rezeptoren die vorherrschenden Rezeptoren auf der glatten Muskulatur der Bronchien sind, weisen Daten darauf hin, dass es eine Population von beta2-Rezeptoren im menschlichen Herzen gibt, die in einer Konzentration zwischen 10 % und 50 % der kardialen beta-adrenergen Rezeptoren vorhanden sind. Die genaue Funktion dieser Rezeptoren ist nicht bekannt. (Sehen WARNUNGEN , Kardiovaskuläre Wirkungen Sektion.)
Die Aktivierung von beta2-adrenergen Rezeptoren auf der glatten Muskulatur der Atemwege führt zur Aktivierung von Adenylcyclase und zu einem Anstieg der intrazellulären Konzentration von zyklischem 3',5'-Adenosinmonophosphat (zyklisches AMP). Dieser Anstieg von zyklischem AMP führt zur Aktivierung von Proteinkinase A, die die Phosphorylierung von Myosin hemmt und die intrazellulären ionischen Calciumkonzentrationen senkt, was zu einer Entspannung führt. Albuterol entspannt die glatte Muskulatur aller Atemwege, von der Luftröhre bis zu den terminalen Bronchiolen. Albuterol wirkt als funktioneller Antagonist zur Entspannung der Atemwege unabhängig vom beteiligten Spasmogen und schützt so vor allen bronchokonstriktorischen Herausforderungen. Erhöhte Konzentrationen von zyklischem AMP sind auch mit der Hemmung der Freisetzung von Mediatoren aus Mastzellen in den Atemwegen verbunden.
Albuterol hat in den meisten klinischen Studien gezeigt, dass es eine stärkere Wirkung auf die Atemwege in Form einer Entspannung der glatten Bronchialmuskulatur hat als Isoproterenol bei vergleichbaren Dosen, während es weniger kardiovaskuläre Wirkungen hervorruft. Kontrollierte klinische Studien und andere klinische Erfahrungen haben gezeigt, dass inhaliertes Albuterol, wie andere beta-adrenerge Agonisten, bei einigen Patienten eine signifikante kardiovaskuläre Wirkung hervorrufen kann, gemessen an Pulsfrequenz, Blutdruck, Symptomen und/oder elektrokardiographischen Veränderungen.
Präklinisch
Intravenöse Studien an Ratten mit Albuterolsulfat haben gezeigt, dass Albuterol die Blut-Hirn-Schranke passiert und Gehirnkonzentrationen von etwa 5 % der Plasmakonzentration erreicht. In Strukturen außerhalb der Blut-Hirn-Schranke (Zirbeldrüse und Hypophyse) wurden 100-mal höhere Albuterol-Konzentrationen als im gesamten Gehirn gefunden.
Studien an Labortieren (Minischweine, Nagetiere und Hunde) haben das Auftreten von Herzrhythmusstörungen und plötzlichem Tod (mit histologischem Nachweis einer Myokardnekrose) gezeigt, wenn Beta2-Agonist und Methylxanthine gleichzeitig verabreicht wurden. Die klinische Bedeutung dieser Befunde ist nicht bekannt.
Das Treibmittel HFA-134a hat keine pharmakologische Aktivität, außer bei sehr hohen Dosen bei Tieren (380- bis 1300-mal die maximale menschliche Exposition basierend auf Vergleichen von AUC-Werten), was hauptsächlich Ataxie, Zittern, Dyspnoe oder Speicheln verursacht. Diese ähneln den Effekten, die von den strukturell verwandten Fluorchlorkohlenwasserstoffen (FCKW) erzeugt werden, die ausgiebig in Dosieraerosolen verwendet wurden.
Bei Tieren und Menschen wurde festgestellt, dass das Treibmittel HFA-134a schnell absorbiert und schnell ausgeschieden wird, mit einer Eliminationshalbwertszeit von 3 bis 27 Minuten bei Tieren und 5 bis 7 Minuten beim Menschen. Die Zeit bis zur maximalen Plasmakonzentration (Tmax) und die mittlere Verweilzeit sind beide extrem kurz, was zu einem vorübergehenden Auftreten von HFA-134a im Blut ohne Anzeichen einer Akkumulation führt.
Pharmakokinetik
In einer Bioverfügbarkeitsstudie mit Einzeldosis, an der sechs gesunde, männliche Probanden teilnahmen, wurden vorübergehend niedrige Albuterolspiegel (nahe der unteren Bestimmungsgrenze) nach Verabreichung von zwei Sprühstößen sowohl von PROVENTIL HFA Inhalationsaerosol als auch von einem Albuterol-Inhalator mit CFC 11/12-Antrieb beobachtet . Für beide Behandlungen waren keine formalen pharmakokinetischen Analysen möglich, aber die systemischen Albuterolspiegel schienen ähnlich zu sein.
Klinische Versuche
In einer 12-wöchigen, randomisierten, doppelblinden, aktiv- und placebokontrollierten Double-Dummy-Studie wurde die bronchodilatatorische Wirksamkeit von PROVENTIL 100 µg HFA-Inhalationsaerosol (193 Patienten) bei 565 Patienten mit Asthma im Vergleich zu CFC 11 untersucht /12 Albuterol-Inhalator mit Antrieb (186 Patienten) und ein HFA-134a-Placebo-Inhalator (186 Patienten).
Serielle FEV1-Messungen (unten als prozentuale Veränderung gegenüber dem Ausgangswert am Testtag dargestellt) zeigten, dass zwei Inhalationen von PROVENTIL HFA Inhalationsaerosol zu einer signifikant stärkeren Verbesserung der Lungenfunktion führten als Placebo und zu Ergebnissen führten, die klinisch mit denen eines Albuterol-Inhalators mit FCKW 11/12 vergleichbar waren.
Die durchschnittliche Zeit bis zum Einsetzen eines 15 %igen Anstiegs des FEV1 betrug 6 Minuten und die durchschnittliche Zeit bis zum Erreichen der maximalen Wirkung 50 bis 55 Minuten. Die durchschnittliche Wirkungsdauer, gemessen an einem Anstieg des FEV1 um 15 %, betrug 3 Stunden. Bei einigen Patienten betrug die Wirkungsdauer bis zu 6 Stunden.
In einer anderen klinischen Studie mit Erwachsenen verhinderten zwei Inhalationen von PROVENTIL HFA Inhalationsaerosol, die 30 Minuten vor dem Training eingenommen wurden, einen durch Anstrengung verursachten Bronchospasmus, wie durch die Aufrechterhaltung von FEV1 innerhalb von 80 % der Ausgangswerte bei der Mehrzahl der Patienten gezeigt wurde.
In einer 4-wöchigen, randomisierten, unverblindeten Studie wurde die bronchodilatatorische Wirksamkeit von PROVENTIL HFA Inhalationsaerosol (33 pädiatrische Patienten) bei 63 Kindern im Alter von 4 bis 11 Jahren mit Asthma im Vergleich zu einem CFC 11/12-Propeller untersucht Albuterol-Inhalator (30 pädiatrische Patienten).
FEV1 als prozentuale Veränderung gegenüber der Vordosis in einer großen 12-wöchigen klinischen Studie
INFORMATIONEN ZUM PATIENTEN
GEBRAUCHSANWEISUNG
PROVENTIL® HFA (pro-vent-il) (albuterolsulfat) Inhalationsaerosol mit Dosisanzeige
Lesen Sie diese Gebrauchsanweisung, bevor Sie mit der Anwendung von PROVENTIL 100 mcg HFA beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Arzt über Ihren Gesundheitszustand oder Ihre Behandlung. Ihr Arzt sollte Ihnen zeigen, wie Ihr Kind PROVENTIL 100 µg HFA anwenden soll.
Wichtige Informationen:
PROVENTIL® HFA Inhalationsaerosol wird als Kanister mit Dosisanzeige geliefert. Die Dosisanzeige befindet sich oben auf dem Kanister, der in einen Auslöser passt (siehe Abbildung A). Das Anzeigefenster der Dosisanzeige zeigt Ihnen, wie viele Sprühstöße des Arzneimittels Sie noch haben. Jedes Mal, wenn Sie auf die Mitte der Dosisanzeige drücken, wird ein Sprühstoß freigesetzt.
Abbildung A 
Bevor Sie PROVENTIL HFA zum ersten Mal anwenden Stellen Sie sicher, dass der Zeiger auf der Dosisanzeige auf die rechte Seite der Inhalationsmarkierung „200“ im Anzeigefenster der Dosisanzeige zeigt (siehe Abbildung A).
Jede Dose PROVENTIL HFA enthält 200 Sprühstöße des Arzneimittels. Dies umfasst nicht die Sprühstöße des Arzneimittels, die zum Vorfüllen Ihres Inhalators verwendet werden.
Abbildung B 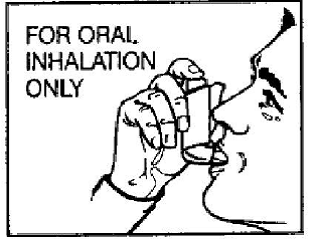
Vorbereitung Ihres PROVENTIL HFA-Inhalators:
Bevor Sie PROVENTIL HFA zum ersten Mal anwenden, sollten Sie Ihren Inhalator entlüften. Wenn Sie Ihr PROVENTIL HFA länger als 2 Wochen nicht verwenden, sollten Sie es vor der Anwendung erneut entlüften.
Anwendung Ihres PROVENTIL 100 mcg HFA-Inhalators:
Schritt 1: Schütteln Sie den Inhalator vor jedem Gebrauch gut. Entfernen Sie die Kappe vom Mundstück (siehe Abbildung C). Prüfen Sie vor Gebrauch das Innere des Mundstücks auf Fremdkörper. Stellen Sie sicher, dass der Kanister vollständig in den Aktuator eingeführt ist.
Abbildung C 
Schritt 2: Atmen Sie so vollständig wie möglich durch den Mund aus. Halten Sie den Inhalator aufrecht mit dem Mundstück zu Ihnen gerichtet und führen Sie das Mundstück vollständig in den Mund ein (siehe Abbildung D). Schließen Sie Ihre Lippen um das Mundstück.
Abbildung D 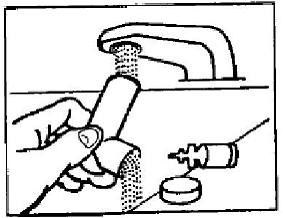
Schritt 3: Während Sie tief und langsam einatmen, drücken Sie mit Ihrem Zeigefinger auf die Mitte der Dosisanzeige, bis sich der Kanister im Betätigungselement nicht mehr bewegt und ein Sprühstoß des Arzneimittels abgegeben wurde (siehe Abbildung D). Hören Sie dann auf, auf die Dosisanzeige zu drücken.
Schritt 4: Halten Sie den Atem so lange an, wie Sie es bequem können, bis zu 10 Sekunden. Nehmen Sie den Inhalator aus dem Mund und atmen Sie dann aus.
Schritt 5: Wenn Ihr Arzt zusätzliche Sprühstöße von PROVENTIL 100 µg HFA verschrieben hat, warten Sie 1 Minute und schütteln Sie dann den Inhalator gut. Wiederholen Sie die Schritte 3 bis 5 im Abschnitt „Anwendung Ihres PROVENTIL HFA-Inhalators“.
Schritt 6: Ersetzen Sie die Kappe sofort nach Gebrauch.
Reinigung Ihres PROVENTIL HFA-Inhalators:
Es ist sehr wichtig, dass Sie das Mundstück sauber halten, damit sich das Medikament nicht ansammelt und das Spray durch das Mundstück blockiert. Reinigen Sie das Mundstück 1 Mal pro Woche oder wenn Ihr Mundstück verstopft ist. (siehe Bild F)
Schritt 1 : Entfernen Sie den Kanister vom Auslöser und nehmen Sie die Kappe vom Mundstück ab. Reinigen Sie den Metallkanister nicht und lassen Sie ihn nicht nass werden.
Schritt 2: Waschen Sie das Mundstück von oben und unten 30 Sekunden lang mit warmem, fließendem Wasser (siehe Abbildung E).
Abbildung E 
Schritt 3: Schütteln Sie so viel Wasser wie möglich aus dem Mundstück.
Schritt 4: Schauen Sie in das Mundstück, um sicherzustellen, dass alle Arzneimittelablagerungen vollständig weggespült wurden. Wenn das Mundstück durch Ablagerungen verstopft ist, tritt wenig bis gar kein Medikament aus dem Mundstück aus (siehe Abbildung F). Falls Ablagerungen vorhanden sind, wiederholen Sie die Schritte 2 bis 4 im Abschnitt „Reinigung Ihres PROVENTIL 100-mcg-HFA-Inhalators“.
Abbildung F 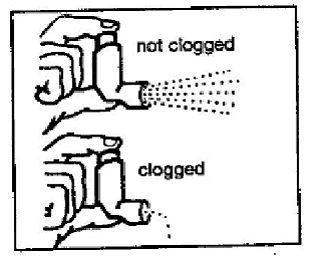
Schritt 5: Lassen Sie das Mundstück beispielsweise über Nacht an der Luft trocknen (siehe Abbildung G). Setzen Sie den Kanister nicht wieder in den Stellantrieb ein, wenn er noch nass ist.
Abbildung G 
Schritt 6: Wenn das Mundstück trocken ist, setzen Sie den Kanister wieder in den Auslöser und setzen Sie die Kappe auf das Mundstück.
Hinweis: Wenn Sie Ihren PROVENTIL 100 mcg HFA-Inhalator verwenden müssen, bevor er vollständig trocken ist, Setzen Sie den Kanister wieder in den Auslöser ein und schütteln Sie den Inhalator gut. Drücken Sie zweimal auf die Mitte der Dosisanzeige, um insgesamt 2 Sprühstöße in die Luft abzugeben, weg von Ihrem Gesicht. Nehmen Sie Ihre Dosis wie verschrieben ein und reinigen und trocknen Sie Ihren Inhalator dann an der Luft, wie im Abschnitt „Reinigung Ihres PROVENTIL HFA-Inhalators“ beschrieben.
Wie ist PROVENTIL HFA aufzubewahren?
Diese Gebrauchsanweisung wurde von der US Food and Drug Administration genehmigt.