Psychiatrische Behandlung: Strattera 10mg, 18mg, 25mg, 40mg Atomoxetine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Strattera 40 mg und wie wird es angewendet?
Strattera ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome der Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS). Strattera 18 mg kann allein oder mit anderen Medikamenten verwendet werden.
Strattera 10 mg ist ein selektiver Noradrenalin-Wiederaufnahmehemmer.
Es ist nicht bekannt, ob Strattera bei Kindern unter 2 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Strattera haben?
Strattera 25 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Strattera 40 mg gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Strattera. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
SELBSTMORDGEDANKEN BEI KINDERN UND JUGENDLICHEN
STRATTERA (Atomoxetin) erhöhte das Risiko von Suizidgedanken in Kurzzeitstudien bei Kindern oder Jugendlichen mit Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS). Jeder, der die Anwendung von STRATTERA 18 mg bei einem Kind oder Jugendlichen in Betracht zieht, muss dieses Risiko mit der klinischen Notwendigkeit abwägen. Komorbiditäten, die bei ADHS auftreten, können mit einem erhöhten Risiko für Suizidgedanken und/oder -verhalten verbunden sein. Patienten, die mit einer Therapie begonnen werden, sollten engmaschig auf Suizidalität (Suizidgedanken und -verhalten), klinische Verschlechterung oder ungewöhnliche Verhaltensänderungen überwacht werden. Familien und Betreuer sollten auf die Notwendigkeit einer genauen Beobachtung und Kommunikation mit dem verschreibenden Arzt hingewiesen werden. STRATTERA 10 mg ist für ADHS bei pädiatrischen und erwachsenen Patienten zugelassen. STRATTERA 40 mg ist nicht für schwere depressive Störungen zugelassen. Gepoolte Analysen von Placebo-kontrollierten Kurzzeitstudien (6 bis 18 Wochen) mit STRATTERA 10 mg bei Kindern und Jugendlichen (insgesamt 12 Studien mit über 2200 Patienten, darunter 11 Studien zu ADHS und 1 Studie zu Enuresis) haben ein größeres Risiko ergeben Suizidgedanken früh während der Behandlung bei Patienten, die STRATTERA erhielten, im Vergleich zu Placebo. Das durchschnittliche Risiko für Suizidgedanken bei Patienten, die STRATTERA 25 mg erhielten, betrug 0,4 % (5/1357 Patienten), verglichen mit keinem Risiko bei den mit Placebo behandelten Patienten (851 Patienten). In diesen Studien kam es zu keinen Suiziden [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
BEZEICHNUNG
STRATTERA® (Atomoxetin) ist ein selektiver Noradrenalin-Wiederaufnahmehemmer. Atomoxetin-HCl ist das R(-)-Isomer, wie durch Röntgenbeugung bestimmt. Die chemische Bezeichnung lautet (-)-N-Methyl-3-phenyl-3-(o-tolyloxy)-propylaminhydrochlorid. Die Summenformel lautet C17H21NO•HCl, was einem Molekulargewicht von 291,82 entspricht. Die chemische Struktur ist:
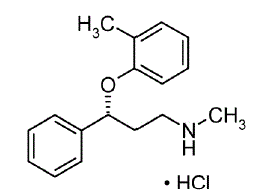
Atomoxetin-HCl ist ein weißer bis praktisch weißer Feststoff mit einer Löslichkeit von 27,8 mg/ml in Wasser.
STRATTERA-Kapseln sind nur zur oralen Verabreichung bestimmt.
Jede Kapsel enthält Atomoxetin-HCl entsprechend 10, 18, 25, 40, 60, 80 oder 100 mg Atomoxetin. Die Kapseln enthalten außerdem Quellstärke und Dimethicon. Die Kapselhüllen enthalten Gelatine, Natriumlaurylsulfat und andere inaktive Inhaltsstoffe. Die Kapselhüllen enthalten außerdem einen oder mehrere der folgenden Stoffe:
FD&C Blau Nr. 2, synthetisches gelbes Eisenoxid, Titandioxid, rotes Eisenoxid. Die Kapseln sind mit essbarer schwarzer Tinte bedruckt.
INDIKATIONEN
Aufmerksamkeitsdefizit-Hyperaktivitätsstörung (ADHS)
STRATTERA 25 mg ist angezeigt zur Behandlung von Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS).
Die Wirksamkeit von STRATTERA-Kapseln wurde in sieben klinischen Studien bei ambulanten Patienten mit ADHS nachgewiesen: vier 6- bis 9-wöchige Studien mit pädiatrischen Patienten (im Alter von 6 bis 18 Jahren), zwei 10-wöchige Studien mit Erwachsenen und eine Erhaltungsstudie in der Pädiatrie (im Alter von 6 zu 15) [vgl Klinische Studien ].
Diagnostische Überlegungen
Eine Diagnose von ADHS (DSM-IV) impliziert das Vorhandensein von hyperaktiv-impulsiven oder unaufmerksamen Symptomen, die eine Beeinträchtigung verursachen und vor dem Alter von 7 Jahren vorhanden waren. Die Symptome müssen anhaltend sein, schwerer sein als typischerweise bei Personen auf einem vergleichbaren Entwicklungsstand beobachtet, müssen eine klinisch signifikante Beeinträchtigung verursachen, z. zB Schule (oder Arbeit) und zu Hause. Die Symptome dürfen nicht besser durch eine andere psychische Störung erklärt werden.
Die spezifische Ätiologie von ADHS ist unbekannt, und es gibt keinen einzigen diagnostischen Test. Eine adäquate Diagnostik erfordert nicht nur den Einsatz medizinischer, sondern auch spezieller psychologischer, pädagogischer und sozialer Ressourcen. Das Lernen kann beeinträchtigt sein oder auch nicht. Die Diagnose muss auf einer vollständigen Anamnese und Beurteilung des Patienten beruhen und nicht nur auf dem Vorhandensein der erforderlichen Anzahl von DSM-IV-Merkmalen.
Beim unaufmerksamen Typ müssen mindestens 6 der folgenden Symptome seit mindestens 6 Monaten bestehen: Mangel an Aufmerksamkeit für Details/Falschfehler, Mangel an nachhaltiger Aufmerksamkeit, schlechtes Zuhören, Nichtbefolgen von Aufgaben, schlechte Organisation, vermeidet Aufgaben erfordert anhaltende geistige Anstrengung, verliert Dinge, ist leicht ablenkbar, vergesslich. Beim hyperaktiv-impulsiven Typ müssen mindestens 6 der folgenden Symptome seit mindestens 6 Monaten bestehen: Zappeln/Winden, Verlassen des Sitzes, unangemessenes Laufen/Klettern, Schwierigkeiten bei leisen Aktivitäten, „unterwegs“, übermäßiges Reden, Platzen antwortet, kann es kaum erwarten, an der Reihe zu sein, aufdringlich. Für eine Diagnose des kombinierten Typs müssen sowohl die Kriterien für Unaufmerksamkeit als auch für Hyperaktivität und Impulsivität erfüllt sein.
Notwendigkeit eines umfassenden Behandlungsprogramms
STRATTERA 18 mg ist als integraler Bestandteil eines Gesamtbehandlungsprogramms für ADHS indiziert, das andere (psychologische, erzieherische, soziale) Maßnahmen für Patienten mit diesem Syndrom umfassen kann. Eine medikamentöse Behandlung ist möglicherweise nicht für alle Patienten mit diesem Syndrom indiziert. Die medikamentöse Behandlung ist nicht für die Anwendung bei Patienten bestimmt, die Symptome aufweisen, die auf Umweltfaktoren und/oder andere primäre psychiatrische Störungen, einschließlich Psychosen, zurückzuführen sind. Eine angemessene schulische Unterbringung ist bei Kindern und Jugendlichen mit dieser Diagnose unerlässlich, und psychosoziale Interventionen sind oft hilfreich. Wenn Heilmaßnahmen allein nicht ausreichen, hängt die Entscheidung über die Verschreibung von Medikamenten zur medikamentösen Behandlung von der Einschätzung des Arztes über die Chronizität und Schwere der Symptome des Patienten ab.
DOSIERUNG UND ANWENDUNG
Akute Behandlung
Dosierung von Kindern und Jugendlichen bis 70 kg Körpergewicht
STRATTERA 40 mg sollte mit einer täglichen Gesamtdosis von etwa 0,5 mg/kg begonnen und nach mindestens 3 Tagen auf eine angestrebte tägliche Gesamtdosis von etwa 1,2 mg/kg erhöht werden, verabreicht entweder als einzelne Tagesdosis am Morgen oder gleichmäßig verteilt Dosen morgens und am späten Nachmittag/frühen Abend. Für Dosen über 1,2 mg/kg/Tag wurde kein zusätzlicher Nutzen nachgewiesen [siehe Klinische Studien ].
Die tägliche Gesamtdosis bei Kindern und Jugendlichen sollte 1,4 mg/kg oder 100 mg nicht überschreiten, je nachdem, welcher Wert geringer ist.
Dosierung von Kindern und Jugendlichen über 70 kg Körpergewicht und Erwachsenen
STRATTERA 18 mg sollte mit einer täglichen Gesamtdosis von 40 mg begonnen und nach mindestens 3 Tagen auf eine angestrebte tägliche Gesamtdosis von etwa 80 mg erhöht werden, die entweder als einzelne Tagesdosis morgens oder in gleichmäßig verteilten Dosen morgens und morgens verabreicht wird später Nachmittag/früher Abend. Nach 2 bis 4 weiteren Wochen kann die Dosis bei Patienten, die kein optimales Ansprechen erreicht haben, auf maximal 100 mg erhöht werden. Es gibt keine Daten, die eine erhöhte Wirksamkeit bei höheren Dosen unterstützen [siehe Klinische Studien ].
Die maximal empfohlene Tagesgesamtdosis bei Kindern und Jugendlichen über 70 kg und Erwachsenen beträgt 100 mg.
Wartung/Erweiterte Behandlung
Es besteht allgemein Einigkeit darüber, dass eine pharmakologische Behandlung von ADHS über einen längeren Zeitraum erforderlich sein kann. In einer kontrollierten Studie wurde der Nutzen einer Erhaltungstherapie mit STRATTERA 18 mg bei pädiatrischen Patienten (Alter 6-15 Jahre) mit ADHS nach Erreichen eines Ansprechens in einem Dosisbereich von 1,2 bis 1,8 mg/kg/Tag nachgewiesen. Patienten, die STRATTERA in der Erhaltungsphase zugewiesen wurden, erhielten im Allgemeinen dieselbe Dosis, die verwendet wurde, um in der unverblindeten Phase ein Ansprechen zu erzielen. Der Arzt, der sich für die Anwendung von STRATTERA über einen längeren Zeitraum entscheidet, sollte den langfristigen Nutzen des Arzneimittels für den einzelnen Patienten regelmäßig neu bewerten [siehe Klinische Studien ].
Allgemeine Dosierungsinformationen
STRATTERA kann mit oder ohne Nahrung eingenommen werden.
STRATTERA 40 mg kann ohne Ausschleichen abgesetzt werden.
STRATTERA-Kapseln sind nicht zum Öffnen bestimmt, sie sollten unzerkaut eingenommen werden [siehe INFORMATIONEN ZUM PATIENTEN ].
Die Sicherheit von Einzeldosen über 120 mg und Tagesgesamtdosen über 150 mg wurde nicht systematisch untersucht.
Dosierung in bestimmten Populationen
Dosisanpassung für Patienten mit eingeschränkter Leberfunktion
Für ADHS-Patienten mit Leberinsuffizienz (HI) wird eine Dosisanpassung wie folgt empfohlen: Bei Patienten mit mittelschwerer HI (Child-Pugh-Klasse B) sollten Anfangs- und Zieldosis auf 50 % der normalen Dosis reduziert werden (bei Patienten ohne HALLO). Bei Patienten mit schwerer HI (Child-Pugh-Klasse C) sollten Anfangsdosis und Zieldosis auf 25 % des Normalwertes reduziert werden [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Dosisanpassung zur Anwendung mit einem starken CYP2D6-Inhibitor oder bei Patienten, die bekanntermaßen CYP2D6-PMs sind
Bei Kindern und Jugendlichen mit einem Körpergewicht bis zu 70 kg, denen starke CYP2D6-Inhibitoren, z. B. Paroxetin, Fluoxetin und Chinidin, verabreicht werden, oder bei Patienten, bei denen bekannt ist, dass sie CYP2D6-PMs sind, sollte STRATTERA mit 0,5 mg/kg/Tag begonnen und nur auf diese Dosis erhöht werden die übliche Zieldosis von 1,2 mg/kg/Tag, wenn sich die Symptome nach 4 Wochen nicht bessern und die Anfangsdosis gut vertragen wird.
Bei Kindern und Jugendlichen über 70 kg Körpergewicht und Erwachsenen, denen starke CYP2D6-Inhibitoren, z. B. Paroxetin, Fluoxetin und Chinidin, verabreicht werden, sollte STRATTERA mit 40 mg/Tag begonnen und nur dann auf die übliche Zieldosis von 80 mg/Tag erhöht werden, wenn die Symptome ausbleiben Besserung nach 4 Wochen und die Anfangsdosis wird gut vertragen.
WIE GELIEFERT
Darreichungsformen und Stärken
Jede Kapsel enthält Atomoxetin-HCl entsprechend 10 mg (Opaque White, Opaque White), 18 mg (Gold, Opaque White), 25 mg (Opaque Blue, Opaque White), 40 mg (Opaque Blue, Opaque Blue), 60 mg (Opaque Blau, Gold), 80 mg (Opaque Brown, Opaque White) oder 100 mg (Opaque Brown, Opaque Brown) Atomoxetin.
Lagerung und Handhabung
Bei 25 °C (77 °F) lagern; Abweichungen bis 15° bis 30°C (59° bis 86°F) zulässig [siehe USP Controlled Room Temperature].
Vertrieben durch: Lilly USA, LLC Indianapolis, IN 46285, USA. Überarbeitet: Mai 2017.
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
STRATTERA 10 mg wurde in klinischen Studien 5382 Kindern oder Jugendlichen mit ADHS und 1007 Erwachsenen mit ADHS verabreicht. Während der klinischen ADHS-Studien wurden 1625 Kinder und jugendliche Patienten länger als 1 Jahr und 2529 Kinder und jugendliche Patienten länger als 6 Monate behandelt.
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Klinische Studien mit Kindern und Jugendlichen
Gründe für den Abbruch der Behandlung aufgrund von Nebenwirkungen in klinischen Studien mit Kindern und Jugendlichen
In akuten placebokontrollierten Studien bei Kindern und Jugendlichen brachen 3,0 % (48/1613) der Atomoxetin-Patienten und 1,4 % (13/945) der Placebo-Patienten die Behandlung wegen Nebenwirkungen ab. Bei allen Studien (einschließlich offener und Langzeitstudien) brachen 6,3 % der Patienten mit schneller Metabolisierung (EM) und 11,2 % der Patienten mit langsamer Metabolisierung (PM) die Behandlung wegen einer Nebenwirkung ab. Bei den mit STRATTERA behandelten Patienten Reizbarkeit (0,3 %, N = 5); Schläfrigkeit (0,3 %, N = 5); Aggression (0,2 %, N=4); Übelkeit (0,2 %, N = 4); Erbrechen (0,2 %, N=4); Bauchschmerzen (0,2 %, N = 4); Verstopfung (0,1 %, N=2); Müdigkeit (0,1 %, N=2); Unwohlsein (0,1 %, N=2); und Kopfschmerzen (0,1 %, N = 2) waren die Gründe für den Abbruch, die von mehr als 1 Patient angegeben wurden.
Krampfanfälle
STRATTERA wurde bei pädiatrischen Patienten mit Anfallsleiden nicht systematisch untersucht, da diese Patienten während der Premarket-Tests des Produkts von klinischen Studien ausgeschlossen wurden. Im klinischen Entwicklungsprogramm wurden Krampfanfälle bei 0,2 % (12/5073) der Kinder mit einem Durchschnittsalter von 10 Jahren (Bereich 6 bis 16 Jahre) berichtet. In diesen klinischen Studien betrug das Anfallsrisiko bei langsamen Metabolisierern 0,3 % (1/293) im Vergleich zu 0,2 % (11/4741) bei schnellen Metabolisierern.
Häufig beobachtete Nebenwirkungen in Placebo-kontrollierten Studien bei akuten Kindern und Jugendlichen
Häufig beobachtete Nebenwirkungen im Zusammenhang mit der Anwendung von STRATTERA (Inzidenz von 2 % oder mehr) und nicht mit gleicher Inzidenz bei mit Placebo behandelten Patienten (Inzidenz von STRATTERA 40 mg höher als Placebo) sind in Tabelle 2 aufgeführt. Die Ergebnisse waren bei der BID ähnlich und die QD-Studie, außer wie in Tabelle 3 gezeigt, die sowohl BID- als auch QD-Ergebnisse für ausgewählte Nebenwirkungen basierend auf statistisch signifikanten Breslow-Day-Tests zeigt. Die am häufigsten beobachteten Nebenwirkungen bei Patienten, die mit STRATTERA behandelt wurden (Inzidenz von 5 % oder mehr und mindestens doppelt so häufig wie bei Placebo-Patienten, entweder bei BID- oder QD-Dosierung) waren: Übelkeit, Erbrechen, Müdigkeit, verminderter Appetit, Bauchschmerzen und Somnolenz (siehe Tabellen 2 und 3).
Zusätzliche Daten aus klinischen ADHS-Studien (kontrolliert und unkontrolliert) haben gezeigt, dass bei etwa 5 bis 10 % der pädiatrischen Patienten potenziell klinisch bedeutsame Veränderungen der Herzfrequenz (≥ 20 Schläge pro Minute) oder des Blutdrucks (≥ 15 bis 20 mmHg) auftraten [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die folgenden Nebenwirkungen traten bei mindestens 2 % der kindlichen und jugendlichen CYP2D6-PM-Patienten auf und waren bei PM-Patienten statistisch signifikant häufiger als bei CYP2D6-EM-Patienten: Schlaflosigkeit (11 % der PMs, 6 % der EMs); Gewicht verringert (7 % der PMs, 4 % der EMs); Verstopfung (7 % der PMs, 4 % der EMs); Depression1 (7 % der PMs, 4 % der EMs); Zittern (5 % der PMs, 1 % der EMs); Excoriation (4 % der PMs, 2 % der EMs); mittlere Schlaflosigkeit (3 % der PMs, 1 % der EMs); Konjunktivitis (3 % der PMs, 1 % der EMs); Synkope (3 % der PMs, 1 % der EMs); frühes Erwachen am Morgen (2 % der PMs, 1 % der EMs); Mydriasis (2 % der PMs, 1 % der EMs); Sedierung (4 % der PMs, 2 % der EMs).
1Depression umfasst die folgenden Begriffe: Depression, Major Depression, depressive Symptome, depressive Stimmung, Dysphorie.
Klinische Studien für Erwachsene
Gründe für den Abbruch der Behandlung aufgrund von Nebenwirkungen in placebokontrollierten Studien mit akuten Erwachsenen
In den akuten Placebo-kontrollierten Studien mit Erwachsenen brachen 11,3 % (61/541) der Atomoxetin-Patienten und 3,0 % (12/405) der Placebo-Patienten die Behandlung wegen Nebenwirkungen ab. Bei den mit STRATTERA behandelten Patienten traten Schlaflosigkeit (0,9 %, N=5); Übelkeit (0,9 %, N = 5); Brustschmerzen (0,6 %, N = 3); Müdigkeit (0,6 %, N=3); Angst (0,4 %, N=2); erektile Dysfunktion (0,4 %, N=2); Stimmungsschwankungen (0,4 %, N=2); Nervosität (0,4 %, N=2); Herzklopfen (0,4 %, N=2); und Harnverhalt (0,4 %, N = 2) waren die Gründe für den Abbruch, die von mehr als 1 Patient angegeben wurden.
Krampfanfälle
STRATTERA wurde bei erwachsenen Patienten mit Anfallsleiden nicht systematisch untersucht, da diese Patienten während der Premarket-Tests des Produkts von klinischen Studien ausgeschlossen wurden. Im klinischen Entwicklungsprogramm wurden bei 0,1 % (1/748) der erwachsenen Patienten Krampfanfälle gemeldet. In diesen klinischen Studien berichtete kein langsamer Metabolisierer (0/43) über Anfälle, verglichen mit 0,1 % (1/705) bei schnellen Metabolisierern.
Häufig beobachtete Nebenwirkungen in akuten Placebo-kontrollierten Studien mit Erwachsenen
Häufig beobachtete Nebenwirkungen im Zusammenhang mit der Anwendung von STRATTERA (Inzidenz von 2 % oder mehr) und nicht mit gleicher Inzidenz bei mit Placebo behandelten Patienten (Inzidenz von STRATTERA 25 mg höher als bei Placebo) sind in Tabelle 4 aufgeführt. Die am häufigsten beobachteten Nebenwirkungen bei Patienten, die mit STRATTERA behandelt wurden (Inzidenz von 5 % oder mehr und mindestens doppelt so häufig wie bei Placebo-Patienten): Verstopfung, Mundtrockenheit, Übelkeit, verminderter Appetit, Schwindel, erektile Dysfunktion und verzögertes Wasserlassen (siehe Tabelle 4). Zusätzliche Daten aus klinischen ADHS-Studien (kontrolliert und unkontrolliert) haben gezeigt, dass bei ungefähr 5 bis 10 % der erwachsenen Patienten potenziell klinisch bedeutsame Veränderungen der Herzfrequenz (≥ 20 Schläge pro Minute) oder des Blutdrucks (≥ 15 bis 20 mmHg) auftraten [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die folgenden unerwünschten Ereignisse traten bei mindestens 2 % der erwachsenen CYP2D6-Patienten mit langsamem Metabolisierer (PM) auf und waren statistisch signifikant häufiger bei PM-Patienten im Vergleich zu CYP2D6-Patienten mit schnellem Metabolisierer (EM): verschwommenes Sehen (4 % der PMs, 1 % der EMs). ); trockener Mund (35 % der PMs, 17 % der EMs); Verstopfung (11 % der PMs, 7 % der EMs); Nervosität (5 % der PMs, 2 % der EMs); verminderter Appetit (23 % der PMs, 15 % der EMs); Zittern (5 % der PMs, 1 % der EMs); Schlaflosigkeit (19 % der PMs, 11 % der EMs); Schlafstörung (7 % der PMs, 3 % der EMs); mittlere Schlaflosigkeit (5 % der PMs, 3 % der EMs); unheilbare Schlaflosigkeit (3 % der PMs, 1 % der EMs); Harnverhalt (6 % der PMs, 1 % der EMs); erektile Dysfunktion (21 % der PMs, 9 % der EMs); Ejakulationsstörung (6 % der PMs, 2 % der EMs); Hyperhidrose (15 % der PMs, 7 % der EMs); periphere Kälte (3 % der PMs, 1 % der EMs).
Männliche und weibliche sexuelle Dysfunktion
Atomoxetin scheint bei einigen Patienten die sexuelle Funktion zu beeinträchtigen. Veränderungen des sexuellen Verlangens, der sexuellen Leistung und der sexuellen Befriedigung werden in den meisten klinischen Studien nicht gut bewertet, weil sie besonderer Aufmerksamkeit bedürfen und weil Patienten und Ärzte möglicherweise zögern, darüber zu sprechen. Dementsprechend ist es wahrscheinlich, dass Schätzungen der Häufigkeit von unerwünschten sexuellen Erfahrungen und Verhaltensweisen, die in der Produktkennzeichnung angegeben werden, die tatsächliche Häufigkeit unterschätzen. Tabelle 4 oben zeigt die Inzidenz sexueller Nebenwirkungen, die von mindestens 2 % der erwachsenen Patienten, die STRATTERA in placebokontrollierten Studien einnahmen, berichtet wurden.
Es gibt keine adäquaten und gut kontrollierten Studien, die sexuelle Funktionsstörungen bei der Behandlung mit STRATTERA 40 mg untersuchten. Obwohl es schwierig ist, das genaue Risiko einer sexuellen Funktionsstörung im Zusammenhang mit der Anwendung von STRATTERA 40 mg abzuschätzen, sollten sich Ärzte routinemäßig nach solchen möglichen Nebenwirkungen erkundigen.
Postmarketing-Spontanberichte
Die folgenden Nebenwirkungen wurden während der Anwendung von STRATTERA nach der Zulassung festgestellt. Sofern nicht anders angegeben, sind diese Nebenwirkungen bei Erwachsenen und Kindern und Jugendlichen aufgetreten. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Herz-Kreislauf-System - QT-Verlängerung, Synkope.
Periphere vaskuläre Effekte - Raynaud-Phänomen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort - Lethargie.
Bewegungsapparat - Rhabdomyolyse.
Erkrankungen des Nervensystems - Hypästhesie; Parästhesien bei Kindern und Jugendlichen; sensorische Störungen; Tics.
Psychische Störungen - Depression und depressive Stimmung; Angst, Libido verändert sich.
Krampfanfälle In der Zeit nach Markteinführung wurden Krampfanfälle gemeldet. Zu den Anfallsfällen nach der Markteinführung gehören Patienten mit vorbestehenden Anfallsleiden und solche mit identifizierten Risikofaktoren für Anfälle sowie Patienten, bei denen weder in der Vorgeschichte noch Risikofaktoren für Anfälle identifiziert wurden. Die genaue Beziehung zwischen STRATTERA 40 mg und Krampfanfällen ist aufgrund der Ungewissheit über das Hintergrundrisiko von Krampfanfällen bei ADHS-Patienten schwer zu beurteilen.
Erkrankungen der Haut und des Unterhautgewebes - Alopezie, Hyperhidrose.
Urogenitalsystem - Beckenschmerzen bei Männern; Harnverzögerung bei Kindern und Jugendlichen; Harnverhalt bei Kindern und Jugendlichen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Monoaminoxidase-Inhibitoren
Bei anderen Arzneimitteln, die die Monoaminkonzentrationen im Gehirn beeinflussen, liegen Berichte über schwerwiegende, manchmal tödliche Reaktionen vor (einschließlich Hyperthermie, Starrheit, Myoklonus, autonome Instabilität mit möglichen schnellen Schwankungen der Vitalfunktionen und Veränderungen des mentalen Status, einschließlich extremer Erregung bis hin zu Delirium und Koma). ) bei Einnahme in Kombination mit einem MAOI. Einige Fälle zeigten Merkmale, die dem malignen neuroleptischen Syndrom ähneln. Solche Reaktionen können auftreten, wenn diese Arzneimittel gleichzeitig oder in unmittelbarer Nähe gegeben werden [siehe KONTRAINDIKATIONEN ].
Wirkung von CYP2D6-Inhibitoren auf Atomoxetin
Bei schnellen Metabolisierern (EMs) erhöhen Inhibitoren von CYP2D6 (z. B. Paroxetin, Fluoxetin und Chinidin) die Steady-State-Plasmakonzentrationen von Atomoxetin auf ähnliche Expositionen wie bei langsamen Metabolisierern (PMs). Bei EM-Personen, die mit Paroxetin oder Fluoxetin behandelt werden, ist die AUC von Atomoxetin etwa 6- bis 8-fach und Css,max etwa 3- bis 4-fach größer als die von Atomoxetin allein.
In-vitro-Studien deuten darauf hin, dass die gleichzeitige Verabreichung von Cytochrom-P450-Inhibitoren an PMs die Plasmakonzentrationen von Atomoxetin nicht erhöht.
Antihypertensiva und blutdrucksenkende Mittel
Wegen möglicher Auswirkungen auf den Blutdruck sollte STRATTERA mit Vorsicht zusammen mit blutdrucksenkenden Arzneimitteln und blutdruckerhöhenden Mitteln (z. B. Dopamin, Dobutamin) oder anderen blutdrucksteigernden Arzneimitteln angewendet werden.
Alberol
STRATTERA sollte Patienten, die mit systemisch verabreichtem (oral oder intravenös) Albuterol (oder anderen Beta2-Agonisten) behandelt werden, mit Vorsicht verabreicht werden, da die Wirkung von Albuterol auf das Herz-Kreislauf-System verstärkt werden kann, was zu einem Anstieg der Herzfrequenz und des Blutdrucks führen kann. Albuterol (600 mcg iv über 2 Stunden) führte zu einem Anstieg der Herzfrequenz und des Blutdrucks. Diese Wirkungen wurden durch Atomoxetin (60 mg BID für 5 Tage) verstärkt und waren am ausgeprägtesten nach der anfänglichen gleichzeitigen Verabreichung von Albuterol und Atomoxetin. Diese Wirkungen auf die Herzfrequenz und den Blutdruck wurden jedoch in einer anderen Studie nach gleichzeitiger Verabreichung einer inhalativen Dosis von Albuterol (200-800 mcg) und Atomoxetin (80 mg einmal täglich für 5 Tage) bei 21 gesunden asiatischen Probanden, die wegen schlechter Behandlung ausgeschlossen wurden, nicht beobachtet Metabolisiererstatus.
Wirkung von Atomoxetin auf P450-Enzyme
Atomoxetin verursachte keine klinisch bedeutsame Hemmung oder Induktion von Cytochrom-P450-Enzymen, einschließlich CYP1A2, CYP3A, CYP2D6 und CYP2C9.
CYP3A-Substrat (z. B. Midazolam)
Die gleichzeitige Verabreichung von STRATTERA (60 mg zweimal täglich für 12 Tage) mit Midazolam, einer Modellverbindung für Arzneimittel, die durch CYP3A4 metabolisiert werden (Einzeldosis von 5 mg), führte zu einem Anstieg der AUC von Midazolam um 15 %. Für Arzneimittel, die durch CYP3A metabolisiert werden, wird keine Dosisanpassung empfohlen.
CYP2D6-Substrat (z. B. Desipramin)
Die gleichzeitige Verabreichung von STRATTERA (40 oder 60 mg zweimal täglich über 13 Tage) mit Desipramin, einer Modellverbindung für CYP2D6-metabolisierte Arzneimittel (Einzeldosis von 50 mg), veränderte die Pharmakokinetik von Desipramin nicht. Für Arzneimittel, die durch CYP2D6 metabolisiert werden, wird keine Dosisanpassung empfohlen.
Alkohol
Der Konsum von Ethanol mit STRATTERA 18 mg veränderte die berauschende Wirkung von Ethanol nicht.
Methylphenidat
Die gleichzeitige Verabreichung von Methylphenidat mit STRATTERA 18 mg verstärkte die kardiovaskulären Wirkungen nicht über die mit Methylphenidat allein beobachteten Wirkungen hinaus.
Arzneimittel, die stark an Plasmaproteine gebunden sind
In-vitro-Studien zur Arzneimittelverdrängung wurden mit Atomoxetin und anderen stark gebundenen Arzneimitteln in therapeutischen Konzentrationen durchgeführt. Atomoxetin hatte keinen Einfluss auf die Bindung von Warfarin, Acetylsalicylsäure, Phenytoin oder Diazepam an Humanalbumin. In ähnlicher Weise beeinflussten diese Verbindungen die Bindung von Atomoxetin an Humanalbumin nicht.
Medikamente, die den pH-Wert des Magens beeinflussen
Arzneimittel, die den Magen-pH-Wert erhöhen (Magnesiumhydroxid/Aluminiumhydroxid, Omeprazol) hatten keinen Einfluss auf die Bioverfügbarkeit von STRATTERA.
Drogenmissbrauch und -abhängigkeit
Kontrollierte Substanz
STRATTERA ist keine kontrollierte Substanz.
Missbrauch
In einer randomisierten, doppelblinden, placebokontrollierten Studie zum Missbrauchspotenzial bei Erwachsenen, in der die Wirkungen von STRATTERA und Placebo verglichen wurden, war STRATTERA nicht mit einem Reaktionsmuster verbunden, das auf stimulierende oder euphorisierende Eigenschaften hindeutete.
Abhängigkeit
Klinische Studiendaten bei über 2000 Kindern, Jugendlichen und Erwachsenen mit ADHS und über 1200 Erwachsenen mit Depressionen zeigten nur vereinzelte Vorfälle von Medikamentenabzweigung oder unsachgemäßer Selbstverabreichung im Zusammenhang mit STRATTERA. Es gab keine Hinweise auf ein Wiederauftreten der Symptome oder Nebenwirkungen, die auf ein Absetzen des Arzneimittels oder ein Entzugssyndrom hindeuteten.
Tierische Erfahrung
Studien zur Arzneimitteldiskriminierung bei Ratten und Affen zeigten eine inkonsistente Stimulus-Generalisierung zwischen Atomoxetin und Kokain.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Suizidgedanken
STRATTERA erhöhte das Risiko von Suizidgedanken in Kurzzeitstudien bei Kindern und Jugendlichen mit Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS). Gepoolte Analysen von Placebo-kontrollierten Kurzzeitstudien (6 bis 18 Wochen) mit STRATTERA bei Kindern und Jugendlichen haben ein höheres Risiko für Suizidgedanken zu einem frühen Zeitpunkt der Behandlung bei denjenigen gezeigt, die STRATTERA erhielten. Es gab insgesamt 12 Studien (11 zu ADHS und 1 zu Enuresis) mit mehr als 2200 Patienten (einschließlich 1357 Patienten, die STRATTERA erhielten, und 851, die Placebo erhielten). Das durchschnittliche Risiko für Suizidgedanken bei Patienten, die STRATTERA erhielten, betrug 0,4 % (5/1357 Patienten), verglichen mit keinem Risiko bei den mit Placebo behandelten Patienten. Unter diesen etwa 2200 Patienten gab es 1 Suizidversuch bei einem mit STRATTERA behandelten Patienten. In diesen Studien kam es zu keinen Suiziden. Alle Reaktionen traten bei Kindern im Alter von 12 Jahren oder jünger auf. Alle Reaktionen traten während des ersten Behandlungsmonats auf. Es ist nicht bekannt, ob sich das Risiko von Suizidgedanken bei pädiatrischen Patienten auch auf eine längerfristige Anwendung erstreckt. Eine ähnliche Analyse bei erwachsenen Patienten, die entweder wegen ADHS oder einer Major Depression (MDD) mit STRATTERA behandelt wurden, ergab kein erhöhtes Risiko für Suizidgedanken oder -verhalten im Zusammenhang mit der Anwendung von STRATTERA.
Alle pädiatrischen Patienten, die mit STRATTERA behandelt werden, sollten angemessen überwacht und engmaschig auf eine klinische Verschlechterung, Suizidalität und ungewöhnliche Verhaltensänderungen beobachtet werden, insbesondere während der ersten Monate einer medikamentösen Therapie oder bei Dosisänderungen, entweder Erhöhungen oder Verringerungen .
Die folgenden Symptome wurden bei STRATTERA berichtet: Angst, Unruhe, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Unruhe), Hypomanie und Manie. Obwohl ein kausaler Zusammenhang zwischen dem Auftreten solcher Symptome und dem Auftreten suizidaler Impulse nicht hergestellt werden konnte, besteht die Sorge, dass solche Symptome Vorboten einer aufkommenden Suizidalität darstellen könnten. Daher sollten Patienten, die mit STRATTERA 40 mg behandelt werden, auf das Auftreten solcher Symptome hin beobachtet werden.
Bei Patienten, bei denen eine aufkommende Suizidalität oder Symptome auftreten, die Vorboten einer aufkommenden Suizidalität sein könnten, sollte eine Änderung des therapeutischen Schemas in Betracht gezogen werden, einschließlich eines möglichen Absetzens der Medikation, insbesondere wenn diese Symptome schwerwiegend oder plötzlich auftreten oder nicht Teil der Suizidalität waren die Symptome des Patienten.
Familien und Betreuer von pädiatrischen Patienten, die mit STRATTERA 10 mg behandelt werden, sollten auf die Notwendigkeit aufmerksam gemacht werden, Patienten auf das Auftreten von Unruhe, Reizbarkeit, ungewöhnlichen Verhaltensänderungen und den anderen oben beschriebenen Symptomen sowie auf das Auftreten von Suizidalität zu überwachen Melden Sie solche Symptome unverzüglich dem Gesundheitsdienstleister. Eine solche Überwachung sollte die tägliche Beobachtung durch Familien und Betreuer umfassen.
Schwere Leberschädigung
Postmarketing-Berichte weisen darauf hin, dass STRATTERA schwere Leberschäden verursachen kann. Obwohl in klinischen Studien mit etwa 6000 Patienten keine Hinweise auf eine Leberschädigung festgestellt wurden, gab es seltene Fälle von klinisch signifikanten Leberschädigungen, die nach der Markteinführung als wahrscheinlich oder möglicherweise mit der Anwendung von STRATTERA 40 mg zusammenhängend erachtet wurden. Seltene Fälle von Leberversagen wurden ebenfalls berichtet, darunter ein Fall, der zu einer Lebertransplantation führte. Aufgrund einer wahrscheinlichen Unterberichterstattung ist es unmöglich, eine genaue Schätzung der tatsächlichen Inzidenz dieser Reaktionen zu liefern. Gemeldete Fälle von Leberschäden traten in den meisten Fällen innerhalb von 120 Tagen nach Beginn der Atomoxetin-Behandlung auf, und einige Patienten zeigten deutlich erhöhte Leberenzyme [>20 x Obergrenze des Normalwerts (ULN)] und Gelbsucht mit signifikant erhöhten Bilirubinspiegeln (>2 X ULN), gefolgt von Erholung nach Absetzen von Atomoxetin. Bei einem Patienten trat die Leberschädigung, die sich durch erhöhte Leberenzyme bis zum 40-fachen des oberen Normwertes und Gelbsucht mit Bilirubin bis zum 12-fachen des oberen Normwertes manifestierte, bei einer erneuten Provokation erneut auf und erholte sich nach Absetzen des Medikaments, was den Nachweis erbrachte, dass STRATTERA wahrscheinlich die Leberschädigung verursachte. Solche Reaktionen können mehrere Monate nach Beginn der Therapie auftreten, aber Laboranomalien können sich noch mehrere Wochen nach Absetzen des Arzneimittels verschlechtern. Der oben beschriebene Patient erholte sich von seiner Leberverletzung und benötigte keine Lebertransplantation.
STRATTERA sollte bei Patienten mit Gelbsucht oder Laborbefunden einer Leberschädigung abgesetzt und nicht wieder aufgenommen werden. Labortests zur Bestimmung der Leberenzymwerte sollten beim ersten Symptom oder Anzeichen einer Leberfunktionsstörung (z. B. Juckreiz, dunkler Urin, Gelbsucht, Druckschmerz im rechten oberen Quadranten oder unerklärliche „grippeähnliche“ Symptome) durchgeführt werden [siehe Labortests , INFORMATIONEN ZUM PATIENTEN ].
Schwerwiegende kardiovaskuläre Ereignisse
Plötzlicher Tod und bereits bestehende strukturelle Herzfehler oder andere schwerwiegende Herzprobleme
Kinder und Jugendliche
Plötzlicher Herztod wurde im Zusammenhang mit der Behandlung mit Atomoxetin in üblichen Dosen bei Kindern und Jugendlichen mit strukturellen Herzanomalien oder anderen schweren Herzproblemen berichtet. Obwohl einige schwerwiegende Herzprobleme allein ein erhöhtes Risiko für einen plötzlichen Tod mit sich bringen, sollte Atomoxetin im Allgemeinen nicht bei Kindern oder Jugendlichen mit bekannten schwerwiegenden strukturellen Herzanomalien, Kardiomyopathie, schwerwiegenden Herzrhythmusstörungen oder anderen schwerwiegenden Herzproblemen angewendet werden, die sie einer erhöhten Anfälligkeit aussetzen können zu den noradrenergen Wirkungen von Atomoxetin.
Erwachsene
Plötzliche Todesfälle, Schlaganfall und Myokardinfarkt wurden bei Erwachsenen berichtet, die Atomoxetin in üblichen Dosen gegen ADHS einnahmen. Obwohl die Rolle von Atomoxetin in diesen Fällen bei Erwachsenen ebenfalls unbekannt ist, haben Erwachsene eine größere Wahrscheinlichkeit als Kinder, an schweren strukturellen Herzanomalien, Kardiomyopathie, schweren Herzrhythmusstörungen, koronarer Herzkrankheit oder anderen schweren Herzproblemen zu leiden. Es sollte erwogen werden, Erwachsene mit klinisch signifikanten Herzfehlern nicht zu behandeln.
Beurteilung des kardiovaskulären Status bei Patienten, die mit Atomoxetin behandelt werden
Kinder, Jugendliche oder Erwachsene, die für eine Behandlung mit Atomoxetin in Betracht gezogen werden, sollten eine sorgfältige Anamnese (einschließlich Beurteilung einer Familienanamnese mit plötzlichem Tod oder ventrikulärer Arrhythmie) und eine körperliche Untersuchung haben, um das Vorliegen einer Herzerkrankung zu beurteilen, und sollten weitere kardiologische Untersuchungen erhalten Auswertung, wenn die Befunde auf eine solche Erkrankung hindeuten (z. B. Elektrokardiogramm und Echokardiogramm). Patienten, die während der Behandlung mit Atomoxetin Symptome wie Brustschmerzen bei Belastung, unerklärliche Synkopen oder andere Symptome entwickeln, die auf eine Herzerkrankung hindeuten, sollten sich umgehend einer kardiologischen Untersuchung unterziehen.
Auswirkungen auf Blutdruck und Herzfrequenz
STRATTERA sollte mit Vorsicht bei Patienten angewendet werden, deren Grunderkrankungen sich durch einen Anstieg des Blutdrucks oder der Herzfrequenz verschlechtern könnten, wie z. B. bestimmte Patienten mit Bluthochdruck, Tachykardie oder kardiovaskulären oder zerebrovaskulären Erkrankungen. Es sollte nicht bei Patienten mit schweren Herz- oder Gefäßerkrankungen angewendet werden, von denen zu erwarten ist, dass sich ihr Zustand verschlechtert, wenn sie einen klinisch bedeutsamen Anstieg des Blutdrucks oder der Herzfrequenz erfahren [siehe KONTRAINDIKATIONEN ]. Puls und Blutdruck sollten zu Studienbeginn, nach Erhöhung der STRATTERA-Dosis und in regelmäßigen Abständen während der Therapie gemessen werden, um mögliche klinisch bedeutsame Anstiege zu erkennen.
Die folgende Tabelle enthält Daten aus placebokontrollierten Kurzzeitstudien aus klinischen Studien für die Anteile von Patienten mit einem Anstieg von: diastolischem Blutdruck ≥ 15 mm Hg; systolischer Blutdruck ≥20 mm Hg; Herzfrequenz größer oder gleich 20 bpm, sowohl bei Kindern als auch bei Erwachsenen (siehe Tabelle 1).
In placebokontrollierten Zulassungsstudien mit pädiatrischen Patienten wurde Tachykardie als unerwünschtes Ereignis bei 0,3 % (5/1597) dieser mit STRATTERA 10 mg behandelten Patienten identifiziert, verglichen mit 0 % (0/934) der Placebo-Patienten. Der mittlere Anstieg der Herzfrequenz bei Patienten mit schneller Metabolisierung (EM) betrug 5,0 Schläge/Minute und bei Patienten mit langsamer Metabolisierung (PM) 9,4 Schläge/Minute.
In klinischen Studien mit Erwachsenen, in denen der EM/PM-Status verfügbar war, war der mittlere Anstieg der Herzfrequenz bei PM-Patienten signifikant höher als bei EM-Patienten (11 Schläge/Minute gegenüber 7,5 Schlägen/Minute). Die Auswirkungen auf die Herzfrequenz könnten bei einigen PM-Patienten klinisch bedeutsam sein.
In placebokontrollierten Zulassungsstudien mit erwachsenen Patienten wurde bei 1,5 % (8/540) der mit STRATTERA 25 mg behandelten Patienten Tachykardie als Nebenwirkung festgestellt, verglichen mit 0,5 % (2/402) der Placebo-Patienten.
In klinischen Studien mit Erwachsenen, in denen der EM/PM-Status verfügbar war, war die mittlere Veränderung des diastolischen Blutdrucks gegenüber dem Ausgangswert bei PM-Patienten höher als bei EM-Patienten (4,21 gegenüber 2,13 mm Hg), ebenso wie die mittlere Veränderung des systolischen Blutdrucks (PM : 2,75 versus EM: 2,40 mm Hg). Die Blutdruckeffekte könnten bei einigen PM-Patienten klinisch bedeutsam sein.
Bei Patienten, die STRATTERA einnahmen, wurde über orthostatische Hypotonie und Synkope berichtet. In Zulassungsstudien für Kinder und Jugendliche traten bei 0,2 % (12/5596) der mit STRATTERA behandelten Patienten eine orthostatische Hypotonie und bei 0,8 % (46/5596) eine Synkope auf. In Kurzzeit-Zulassungsstudien bei Kindern und Jugendlichen trat bei 1,8 % (6/340) der mit STRATTERA behandelten Patienten eine orthostatische Hypotonie auf, verglichen mit 0,5 % (1/207) der mit Placebo behandelten Patienten. Synkopen wurden während der placebokontrollierten ADHS-Zulassungsstudien bei Kindern und Jugendlichen über einen kurzen Zeitraum nicht berichtet. STRATTERA 10 mg sollte bei allen Erkrankungen, die Patienten für Hypotonie prädisponieren könnten, oder bei Erkrankungen, die mit plötzlichen Herzfrequenz- oder Blutdruckänderungen einhergehen, mit Vorsicht angewendet werden.
Auftreten neuer psychotischer oder manischer Symptome
Behandlung Auftretende psychotische oder manische Symptome, z. B. Halluzinationen, wahnhaftes Denken oder Manie bei Kindern und Jugendlichen ohne Vorgeschichte einer psychotischen Erkrankung oder Manie, können durch Atomoxetin in üblichen Dosen verursacht werden. Wenn solche Symptome auftreten, sollte eine mögliche kausale Rolle von Atomoxetin in Betracht gezogen und ein Absetzen der Behandlung in Betracht gezogen werden. In einer gepoolten Analyse mehrerer placebokontrollierter Kurzzeitstudien traten solche Symptome bei etwa 0,2 % (4 Patienten mit Reaktionen von 1939, die mehrere Wochen lang Atomoxetin in üblichen Dosen erhielten) der mit Atomoxetin behandelten Patienten auf, verglichen mit 0 von 0 1056 mit Placebo behandelte Patienten.
Screening von Patienten auf bipolare Störungen
Im Allgemeinen sollte bei der Behandlung von ADHS bei Patienten mit komorbider bipolarer Störung besondere Vorsicht walten, da Bedenken hinsichtlich einer möglichen Induktion einer gemischten/manischen Episode bei Patienten mit einem Risiko für eine bipolare Störung bestehen. Ob eines der oben beschriebenen Symptome eine solche Konversion darstellt, ist nicht bekannt. Vor Beginn der Behandlung mit STRATTERA 40 mg sollten Patienten mit komorbiden depressiven Symptomen jedoch angemessen untersucht werden, um festzustellen, ob bei ihnen ein Risiko für eine bipolare Störung besteht; Ein solches Screening sollte eine detaillierte psychiatrische Vorgeschichte umfassen, einschließlich einer Familienanamnese von Selbstmord, bipolarer Störung und Depression.
Aggressives Verhalten oder Feindseligkeit
Patienten, die mit der Behandlung von ADHS beginnen, sollten auf das Auftreten oder die Verschlechterung von aggressivem Verhalten oder Feindseligkeit überwacht werden. Aggressives Verhalten oder Feindseligkeit wird häufig bei Kindern und Jugendlichen mit ADHS beobachtet. In pädiatrischen kontrollierten Kurzzeitstudien berichteten 21/1308 (1,6 %) der mit Atomoxetin behandelten Patienten im Vergleich zu 9/806 (1,1 %) der mit Placebo behandelten Patienten spontan über behandlungsbedingte feindselige unerwünschte Ereignisse (Gesamtrisikoverhältnis von 1,33 [95 % KI 0,67-2,64 – nicht statistisch signifikant]). In placebokontrollierten klinischen Studien mit Erwachsenen berichteten 6/1697 (0,35 %) der mit Atomoxetin behandelten Patienten gegenüber 4/1560 (0,26 %) der mit Placebo behandelten Patienten spontan über behandlungsbedingte feindselige unerwünschte Ereignisse (Gesamtrisikoverhältnis von 1,38 [95 % KI 0,39-4,88 – statistisch nicht signifikant]). Obwohl dies kein schlüssiger Beweis dafür ist, dass STRATTERA 10 mg aggressives Verhalten oder Feindseligkeit auslöst, wurden diese Verhaltensweisen in klinischen Studien bei Kindern, Jugendlichen und Erwachsenen, die mit STRATTERA behandelt wurden, häufiger beobachtet als mit Placebo.
Allergische Ereignisse
Obwohl gelegentlich, wurde bei Patienten, die STRATTERA einnahmen, über allergische Reaktionen berichtet, darunter anaphylaktische Reaktionen, angioneurotisches Ödem, Urtikaria und Hautausschlag.
Auswirkungen auf den Urinabfluss aus der Blase
In kontrollierten ADHS-Studien mit Erwachsenen waren die Raten von Harnverhalt (1,7 %, 9/540) und zögerlichem Wasserlassen (5,6 %, 30/540) bei Atomoxetin-Patienten im Vergleich zu Placebo-Patienten (0 %, 0/402; 0,5 %, 2/402). Zwei erwachsene Atomoxetin-Probanden und keine Placebo-Probanden brachen die kontrollierten klinischen Studien wegen Harnverhaltung ab. Eine Beschwerde über Harnverhalt oder Harnverhalt sollte als potenziell im Zusammenhang mit Atomoxetin angesehen werden.
Priapismus
Seltene Postmarketing-Fälle von Priapismus, definiert als schmerzhafte und nicht schmerzhafte Erektion des Penis, die länger als 4 Stunden anhält, wurden bei pädiatrischen und erwachsenen Patienten berichtet, die mit STRATTERA behandelt wurden. Die Erektionen verschwanden in Fällen, in denen Nachbeobachtungsinformationen verfügbar waren, einige nach Absetzen von STRATTERA. Bei Verdacht auf Priapismus ist eine sofortige ärztliche Behandlung erforderlich.
Auswirkungen auf das Wachstum
Die Daten zu den Langzeitwirkungen von STRATTERA 25 mg auf das Wachstum stammen aus offenen Studien, und Gewichts- und Größenänderungen werden mit normativen Bevölkerungsdaten verglichen. Im Allgemeinen bleibt die Gewichts- und Größenzunahme von mit STRATTERA behandelten pädiatrischen Patienten etwa in den ersten 9 bis 12 Behandlungsmonaten hinter den Prognosen aus normativen Bevölkerungsdaten zurück. Anschließend kommt es zu einer erneuten Gewichtszunahme, und nach etwa 3 Behandlungsjahren haben die mit STRATTERA behandelten Patienten durchschnittlich 17,9 kg zugenommen, 0,5 kg mehr als aufgrund ihrer Ausgangsdaten vorhergesagt. Nach etwa 12 Monaten stabilisiert sich die Zunahme der Körpergröße, und nach 3 Jahren haben die mit STRATTERA 40 mg behandelten Patienten durchschnittlich 19,4 cm zugenommen, 0,4 cm weniger als von ihren Ausgangsdaten vorhergesagt (siehe Abbildung 1 unten).
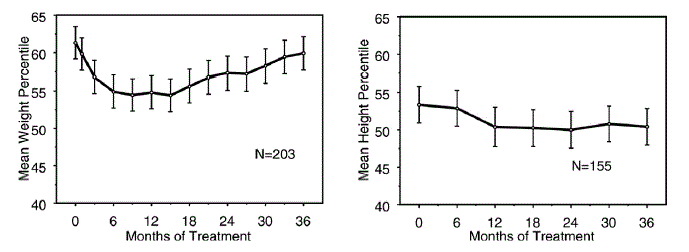
Abbildung 1: Durchschnittliche Gewichts- und Größenperzentile im Zeitverlauf für Patienten mit dreijähriger Behandlung mit STRATTERA 40 mg
Dieses Wachstumsmuster war im Allgemeinen unabhängig vom Pubertätsstatus zum Zeitpunkt des Behandlungsbeginns ähnlich. Patienten, die zu Beginn der Behandlung präpubertär waren (Mädchen ≤ 8 Jahre, Jungen ≤ 9 Jahre), nahmen nach drei Jahren durchschnittlich 2,1 kg und 1,2 cm weniger zu als vorhergesagt. Pubertätspatienten (Mädchen > 8 bis ≤ 13 Jahre, Jungen > 9 bis ≤ 14 Jahre) oder spätpubertär (Mädchen > 13 Jahre, Jungen > 14 Jahre) hatten eine durchschnittliche Gewichts- und Größenzunahme, die nahe bei oder lag übertraf die nach dreijähriger Behandlung vorhergesagten.
Das Wachstum folgte sowohl bei schnellen als auch bei langsamen Metabolisierern (EMs, PMs) einem ähnlichen Muster. PMs, die mindestens zwei Jahre lang behandelt wurden, nahmen durchschnittlich 2,4 kg und 1,1 cm weniger zu als vorhergesagt, während EMs durchschnittlich 0,2 kg und 0,4 cm weniger zunahmen als vorhergesagt.
In kontrollierten Kurzzeitstudien (bis zu 9 Wochen) verloren die mit STRATTERA behandelten Patienten durchschnittlich 0,4 kg und nahmen durchschnittlich 0,9 cm zu, verglichen mit einer Zunahme von 1,5 kg und 1,1 cm bei den mit Placebo behandelten Patienten. In einer kontrollierten Studie mit fester Dosis verloren 1,3 %, 7,1 %, 19,3 % und 29,1 % der Patienten in den Gruppen mit Placebo, 0,5, 1,2 und 1,8 mg/kg/Tag mindestens 3,5 % ihres Körpergewichts.
Das Wachstum sollte während der Behandlung mit STRATTERA überwacht werden.
Labortests
Routinelaboruntersuchungen sind nicht erforderlich.
CYP2D6-Metabolismus
Langsame Metabolisierer (PMs) von CYP2D6 haben eine 10-fach höhere AUC und eine 5-fach höhere Spitzenkonzentration bei einer gegebenen Dosis von STRATTERA 25 mg im Vergleich zu schnellen Metabolisierern (EMs). Ungefähr 7 % der kaukasischen Bevölkerung sind PMs. Labortests sind verfügbar, um CYP2D6-PMs zu identifizieren. Die Blutspiegel bei PMs ähneln denen, die durch die Einnahme starker Inhibitoren von CYP2D6 erreicht werden. Die höheren Blutspiegel in PMs führen zu einer höheren Rate einiger Nebenwirkungen von STRATTERA [siehe NEBENWIRKUNGEN ].
Gleichzeitige Anwendung von starken CYP2D6-Inhibitoren oder Anwendung bei Patienten, die bekanntermaßen CYP2D6-PMs sind
Atomoxetin wird hauptsächlich über den CYP2D6-Weg zu 4-Hydroxyatomoxetin metabolisiert. Bei gleichzeitiger Anwendung mit starken CYP2D6-Inhibitoren (z. B. Paroxetin, Fluoxetin und Chinidin) oder bei Verabreichung an CYP2D6-PMs kann eine Dosisanpassung von STRATTERA erforderlich sein. [Sehen DOSIERUNG UND ANWENDUNG und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Informationen zur Patientenberatung
Siehe FDA-zugelassen INFORMATIONEN ZUM PATIENTEN .
Allgemeine Informationen
Ärzte sollten ihre Patienten anweisen, den Medikationsleitfaden vor Beginn der Therapie mit STRATTERA zu lesen und ihn jedes Mal erneut zu lesen, wenn die Verschreibung verlängert wird.
Verschreibende Ärzte oder andere Angehörige der Gesundheitsberufe sollten Patienten, ihre Familien und ihre Betreuer über die Vorteile und Risiken einer Behandlung mit STRATTERA informieren und sie bezüglich der angemessenen Anwendung beraten. Der verschreibende Arzt oder medizinisches Fachpersonal sollte Patienten, ihre Familien und ihre Betreuer anweisen, den Medikationsleitfaden zu lesen, und ihnen helfen, seinen Inhalt zu verstehen. Den Patienten sollte Gelegenheit gegeben werden, den Inhalt des Medikationsleitfadens zu diskutieren und Antworten auf eventuelle Fragen zu erhalten.
Die Patienten sollten auf die folgenden Probleme hingewiesen und gebeten werden, ihren verschreibenden Arzt zu informieren, wenn diese während der Einnahme von STRATTERA auftreten.
Selbstmordrisiko
Patienten, ihre Familien und ihre Betreuer sollten ermutigt werden, auf das Auftreten von Angstzuständen, Unruhe, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Unruhe), Hypomanie, Manie und anderen ungewöhnlichen Verhaltensänderungen zu achten , Depression und Suizidgedanken, insbesondere zu Beginn der STRATTERA-Behandlung und bei Dosisanpassung. Familien und Betreuer von Patienten sollten darauf hingewiesen werden, täglich auf das Auftreten solcher Symptome zu achten, da Änderungen plötzlich auftreten können. Solche Symptome sollten dem verschreibenden Arzt oder medizinischen Fachpersonal des Patienten gemeldet werden, insbesondere wenn sie schwerwiegend sind, abrupt einsetzen oder nicht zu den Symptomen des Patienten gehörten. Symptome wie diese können mit einem erhöhten Risiko für Suizidgedanken und -verhalten verbunden sein und weisen auf die Notwendigkeit einer sehr engmaschigen Überwachung und möglicherweise einer Änderung der Medikation hin.
Schwere Leberschädigung
Patienten, die mit STRATTERA beginnen, sollten darauf hingewiesen werden, dass sich eine schwere Leberschädigung entwickeln kann. Die Patienten sollten angewiesen werden, sich sofort an ihren Arzt zu wenden, wenn sie Juckreiz, dunklen Urin, Gelbsucht, Druckschmerz im rechten oberen Quadranten oder unerklärliche „grippeähnliche“ Symptome entwickeln [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Aggression oder Feindseligkeit
Die Patienten sollten angewiesen werden, so schnell wie möglich ihren Arzt anzurufen, wenn sie eine Zunahme der Aggression oder Feindseligkeit bemerken.
Priapismus
Seltene Postmarketing-Fälle von Priapismus, definiert als schmerzhafte und nicht schmerzhafte Erektion des Penis, die länger als 4 Stunden anhält, wurden bei pädiatrischen und erwachsenen Patienten berichtet, die mit STRATTERA behandelt wurden. Die Eltern oder Erziehungsberechtigten von pädiatrischen Patienten, die STRATTERA 25 mg einnehmen, und von erwachsenen Patienten, die STRATTERA einnehmen, sollten darüber informiert werden, dass Priapismus eine sofortige ärztliche Behandlung erfordert.
Augenreizend
STRATTERA ist ein Augenreizmittel. STRATTERA-Kapseln sind nicht zum Öffnen bestimmt. Bei Kontakt des Kapselinhalts mit dem Auge ist das betroffene Auge sofort mit Wasser zu spülen und ärztlicher Rat einzuholen. Hände und alle möglicherweise kontaminierten Oberflächen sollten so schnell wie möglich gewaschen werden.
Arzneimittelwechselwirkung
Die Patienten sollten angewiesen werden, einen Arzt zu konsultieren, wenn sie verschreibungspflichtige oder rezeptfreie Arzneimittel, Nahrungsergänzungsmittel oder pflanzliche Heilmittel einnehmen oder einnehmen möchten.
Schwangerschaft
Patienten sollten angewiesen werden, einen Arzt zu konsultieren, wenn sie stillen, schwanger sind oder beabsichtigen, während der Einnahme von STRATTERA schwanger zu werden.
Essen
Die Patienten können STRATTERA 25 mg mit oder ohne Nahrung einnehmen.
Verpasste Dosis
Wenn Patienten eine Dosis vergessen haben, sollten sie angewiesen werden, diese so bald wie möglich einzunehmen, aber sie sollten innerhalb von 24 Stunden nicht mehr als die verschriebene Tagesgesamtdosis von STRATTERA einnehmen.
Beeinträchtigung der psychomotorischen Leistung
Die Patienten sollten angewiesen werden, beim Autofahren oder beim Bedienen gefährlicher Maschinen vorsichtig zu sein, bis sie hinreichend sicher sind, dass Atomoxetin ihre Leistungsfähigkeit nicht beeinträchtigt.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Atomoxetin-HCl war bei Ratten und Mäusen nicht karzinogen, wenn es 2 Jahre lang mit der Nahrung in zeitgewichteten Durchschnittsdosen von bis zu 47 bzw. 458 mg/kg/Tag verabreicht wurde. Die höchste Dosis, die bei Ratten verwendet wird, beträgt ungefähr das 8- bzw. 5-fache der maximalen Humandosis bei Kindern bzw. Erwachsenen, auf mg/m2-Basis. Die Plasmaspiegel (AUC) von Atomoxetin bei dieser Dosis bei Ratten werden auf das 1,8-fache (schnelle Metabolisierer) oder 0,2-fache (langsame Metabolisierer) derjenigen beim Menschen geschätzt, der die maximale Humandosis erhält. Die höchste Dosis, die bei Mäusen verwendet wird, beträgt etwa das 39- bzw. 26-fache der maximalen Humandosis bei Kindern bzw. Erwachsenen, auf mg/m2-Basis.
Mutagenese
Atomoxetin-HCl war in einer Reihe von Genotoxizitätsstudien negativ, darunter ein Reverse-Point-Mutation-Assay (Ames-Test), ein In-vitro-Maus-Lymphom-Assay, ein Chromosomenaberrationstest in Eierstockzellen des chinesischen Hamsters, ein außerplanmäßiger DNA-Synthesetest in Rattenhepatozyten und ein In-vivo-Mikrokerntest bei Mäusen. Es gab jedoch einen leichten Anstieg im Prozentsatz der Ovarialzellen des chinesischen Hamsters mit Diplochromosomen, was auf eine Endoreduplikation (numerische Aberration) hindeutet.
Der Metabolit N-Desmethylatomoxetin-HCl war im Ames-Test, Maus-Lymphom-Assay und außerplanmäßigen DNA-Synthesetest negativ.
Beeinträchtigung der Fruchtbarkeit
Atomoxetin-HCl beeinträchtigte die Fertilität von Ratten nicht, wenn es mit dem Futter in Dosen von bis zu 57 mg/kg/Tag verabreicht wurde, was etwa dem 6-fachen der maximalen Humandosis auf mg/m2-Basis entspricht.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie C
Trächtige Kaninchen wurden während der Organogenese mit bis zu 100 mg/kg/Tag Atomoxetin per Schlundsonde behandelt. Bei dieser Dosis wurde in 1 von 3 Studien eine Abnahme der lebenden Föten und eine Zunahme der frühen Resorptionen beobachtet. Es wurde ein leichter Anstieg der Inzidenzen von atypischem Ursprung der Halsschlagader und fehlender A. subclavia beobachtet. Diese Befunde wurden bei Dosen beobachtet, die eine leichte maternale Toxizität verursachten. Die Dosis ohne Wirkung für diese Befunde betrug 30 mg/kg/Tag. Die Dosis von 100 mg/kg entspricht etwa dem 23-fachen der maximalen Humandosis auf mg/m2-Basis; Plasmaspiegel (AUC) von Atomoxetin in dieser Dosis bei Kaninchen werden auf das 3,3-fache (schnelle Metabolisierer) oder 0,4-fache (langsame Metabolisierer) derjenigen beim Menschen geschätzt, der die maximale Humandosis erhält.
Ratten wurden 2 Wochen (Weibchen) oder 10 Wochen (Männchen) vor der Paarung mit bis zu etwa 50 mg/kg/Tag Atomoxetin (etwa das 6-fache der maximalen Humandosis auf mg/m2-Basis) im Futter behandelt Perioden der Organogenese und Laktation. In 1 von 2 Studien wurde eine Verringerung des Gewichts der Jungtiere und der Überlebensrate der Jungtiere beobachtet. Das verringerte Überleben der Jungtiere wurde auch bei 25 mg/kg (aber nicht bei 13 mg/kg) beobachtet. In einer Studie, in der Ratten ab 2 Wochen (Weibchen) bzw. 10 Wochen (Männchen) vor der Paarung mit Atomoxetin im Futter behandelt wurden, kam es während der gesamten Organogenese zu einer Abnahme des fötalen Gewichts (nur bei Weibchen) und einem Anstieg der Inzidenz von Eine unvollständige Ossifikation des Wirbelbogens bei Föten wurde bei 40 mg/kg/Tag (etwa das 5-fache der maximalen Humandosis auf mg/m2-Basis) beobachtet, jedoch nicht bei 20 mg/kg/Tag.
Es wurden keine unerwünschten Wirkungen auf den Fötus beobachtet, wenn trächtige Ratten während der Organogenese mit bis zu 150 mg/kg/Tag (etwa das 17-fache der maximalen Humandosis auf mg/m2-Basis) per Schlundsonde behandelt wurden. Es wurden keine angemessenen und gut kontrollierten Studien bei schwangeren Frauen durchgeführt. STRATTERA 18 mg sollte während der Schwangerschaft nicht angewendet werden, es sei denn, der potenzielle Nutzen rechtfertigt das potenzielle Risiko für den Fötus.
Arbeit und Lieferung
Die Geburt bei Ratten wurde durch Atomoxetin nicht beeinflusst. Die Wirkung von STRATTERA auf Wehen und Entbindung beim Menschen ist nicht bekannt.
Stillende Mutter
Atomoxetin und/oder seine Metaboliten wurden in die Milch von Ratten ausgeschieden. Es ist nicht bekannt, ob Atomoxetin in die Muttermilch übergeht. Vorsicht ist geboten, wenn STRATTERA einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Jeder, der die Anwendung von STRATTERA bei einem Kind oder Jugendlichen in Betracht zieht, muss die potenziellen Risiken mit der klinischen Notwendigkeit abwägen [siehe KASTENWARNUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Die Pharmakokinetik von Atomoxetin bei Kindern und Jugendlichen ist ähnlich wie bei Erwachsenen. Die Sicherheit, Wirksamkeit und Pharmakokinetik von STRATTERA bei pädiatrischen Patienten unter 6 Jahren wurde nicht untersucht.
An jungen Ratten wurde eine Studie durchgeführt, um die Wirkungen von Atomoxetin auf das Wachstum und die neurologische und sexuelle Entwicklung zu bewerten. Ratten wurden ab der frühen postnatalen Phase (Tag 10 Jahre) bis ins Erwachsenenalter. Leichte Verzögerungen beim Einsetzen der vaginalen Durchgängigkeit (alle Dosen) und Präputialtrennung (10 und 50 mg/kg), leichte Abnahme des Nebenhodengewichts und der Spermienzahl (10 und 50 mg/kg) und eine leichte Abnahme der Corpora lutea (50 mg/kg). /kg) wurden beobachtet, aber es gab keine Auswirkungen auf die Fruchtbarkeit oder Fortpflanzungsfähigkeit. Bei 50 mg/kg wurde eine leichte Verzögerung des Ausbruchs der Schneidezähne beobachtet. Eine leichte Zunahme der motorischen Aktivität wurde am 15. Tag (Männer bei 10 und 50 mg/kg und Frauen bei 50 mg/kg) und am 30. Tag (Frauen bei 50 mg/kg) beobachtet, jedoch nicht am 60. Lebenstag. Es gab keine Auswirkungen auf Lern- und Gedächtnistests. Die Bedeutung dieser Befunde für den Menschen ist unbekannt.
Geriatrische Verwendung
Die Sicherheit, Wirksamkeit und Pharmakokinetik von STRATTERA 10 mg bei geriatrischen Patienten wurde nicht untersucht.
Leberinsuffizienz
Die Atomoxetin-Exposition (AUC) ist im Vergleich zu gesunden Probanden bei EM-Probanden mit mäßiger (Child-Pugh-Klasse B) (2-facher Anstieg) und schwerer (Child-Pugh-Klasse C) (4-facher Anstieg) Leberinsuffizienz erhöht. Bei Patienten mit mittelschwerer oder schwerer Leberinsuffizienz wird eine Dosisanpassung empfohlen [siehe DOSIERUNG UND ANWENDUNG ].
Niereninsuffizienz
EM-Patienten mit Nierenerkrankungen im Endstadium hatten eine höhere systemische Atomoxetin-Exposition als gesunde Probanden (ca. 65 % Anstieg), aber es gab keinen Unterschied, wenn die Exposition auf die mg/kg-Dosis korrigiert wurde. STRATTERA 25 mg kann daher ADHS-Patienten mit einer Nierenerkrankung im Endstadium oder geringerer Niereninsuffizienz unter Verwendung des normalen Dosierungsschemas verabreicht werden.
Geschlecht
Das Geschlecht hatte keinen Einfluss auf die Atomoxetin-Disposition.
Ethnischer Ursprung
Die ethnische Herkunft hatte keinen Einfluss auf die Atomoxetin-Disposition (mit der Ausnahme, dass PMs häufiger bei Kaukasiern auftreten).
Patienten mit Begleiterkrankungen
Tics bei Patienten mit ADHS und komorbidem Tourette-Syndrom
Atomoxetin, das in einem flexiblen Dosisbereich von 0,5 bis 1,5 mg/kg/Tag (mittlere Dosis von 1,3 mg/kg/Tag) verabreicht wurde, und Placebo wurden bei 148 randomisierten pädiatrischen Probanden (Alter 717 Jahre) mit einer DSM-IV-Diagnose von ADHS und verglichen komorbide Tic-Störung in einer 18-wöchigen, doppelblinden, placebokontrollierten Studie, in der die Mehrheit (80 %) an dieser Studie mit Tourette-Krankheit teilnahmen (Tourette-Krankheit: 116 Probanden; chronische motorische Tic-Störung: 29 Probanden). Eine Nicht-Unterlegenheitsanalyse ergab, dass STRATTERA 10 mg die Tics bei diesen Patienten nicht verschlimmerte, wie anhand des Yale Global Tic Severity Scale Total Score (YGTSS) bestimmt wurde. Von 148 Patienten, die in die akute Behandlungsphase eintraten, brachen 103 (69,6 %) Patienten die Studie ab. Der Hauptgrund für das Absetzen sowohl in der Atomoxetin- (38 von 76 Patienten, 50,0 %) als auch in der Placebo-Behandlungsgruppe (45 von 72 Patienten, 62,5 %) wurde als mangelnde Wirksamkeit identifiziert, wobei die meisten Patienten die Behandlung in Woche 12 abbrachen erster Besuch, bei dem Patienten mit einem CGI-S≥4 auch die Kriterien für „klinischen Non-Responder“ (CGI-S blieb gleich oder erhöht gegenüber dem Ausgangswert der Studie) erfüllen und für die Teilnahme an einer unverblindeten Verlängerungsstudie mit Atomoxetin infrage kommen könnten. Es gab Postmarketing-Berichte über Tics [siehe NEBENWIRKUNGEN ].
Angst bei Patienten mit ADHS und komorbiden Angststörungen
In zwei doppelblinden, placebokontrollierten Studien nach der Markteinführung wurde gezeigt, dass die Behandlung von Patienten mit ADHS und komorbiden Angststörungen mit STRATTERA 10 mg ihre Angstzustände nicht verschlimmert.
In einer 12-wöchigen doppelblinden, placebokontrollierten Studie wurden 176 Patienten im Alter von 8-17 Jahren, die die DSM-IV-Kriterien für ADHS erfüllten und mindestens eine der Angststörungen Trennungsangststörung, generalisierte Angststörung oder soziale Phobie waren, untersucht zufällig. Nach einer 2-wöchigen doppelblinden Placebo-Einleitung wurde mit STRATTERA 25 mg mit 0,8 mg/kg/Tag begonnen, mit Steigerung auf eine Zieldosis von 1,2 mg/kg/Tag (mediane Dosis 1,30 mg/kg/Tag +/-0,29 mg/kg/Tag). STRATTERA verschlimmerte die Angst bei diesen Patienten nicht, wie anhand der Pediatric Anxiety Rating Scale (PARS) bestimmt wurde. Von den 158 Patienten, die die doppelblinde Placebo-Lead-in-Studie beendeten, brachen 26 (16 %) Patienten die Studie ab.
In einer separaten 16-wöchigen, doppelblinden, placebokontrollierten Studie wurden 442 Patienten im Alter von 18 bis 65 Jahren, die die DSM-IV-Kriterien für ADHS und soziale Angststörung bei Erwachsenen erfüllten (von denen 23 % auch eine generalisierte Angststörung hatten), randomisiert. Nach einer 2-wöchigen doppelblinden Placebo-Einleitung wurde mit STRATTERA 10 mg mit 40 mg/Tag bis zu einer Höchstdosis von 100 mg/Tag begonnen (mittlere Tagesdosis 83 mg/Tag +/- 19,5 mg/Tag). STRATTERA 18 mg verschlimmerte die Angst bei diesen Patienten nicht, wie anhand der Liebowitz Social Anxiety Scale (LSAS) bestimmt wurde. Von den 413 Patienten, die die doppelblinde Placebo-Lead-in-Studie beendeten, brachen 149 (36,1 %) Patienten die Studie ab. Es gab Postmarketing-Berichte über Angstzustände [siehe NEBENWIRKUNGEN ] .
ÜBERDOSIS
Menschliche Erfahrung
Es liegen nur begrenzte Erfahrungen aus klinischen Studien mit einer Überdosierung von STRATTERA vor. Nach der Markteinführung wurden Todesfälle im Zusammenhang mit einer gemischten Einnahme einer Überdosis von STRATTERA 10 mg und mindestens einem anderen Arzneimittel gemeldet. Es gibt keine Berichte über Todesfälle im Zusammenhang mit einer Überdosierung von STRATTERA allein, einschließlich absichtlicher Überdosierung von Mengen bis zu 1400 mg. In einigen Fällen einer Überdosierung von STRATTERA wurde über Krampfanfälle berichtet. Die am häufigsten berichteten Symptome im Zusammenhang mit akuten und chronischen Überdosierungen von STRATTERA waren gastrointestinale Symptome, Somnolenz, Schwindel, Zittern und abnormales Verhalten. Hyperaktivität und Agitiertheit wurden ebenfalls berichtet. Anzeichen und Symptome, die mit einer leichten bis mittelschweren Aktivierung des sympathischen Nervensystems einhergehen (z. B. Tachykardie, erhöhter Blutdruck, Mydriasis, Mundtrockenheit), wurden ebenfalls beobachtet. Die meisten Ereignisse waren leicht bis mittelschwer. Weniger häufig gab es Berichte über QT-Verlängerung und mentale Veränderungen, einschließlich Orientierungslosigkeit und Halluzinationen [siehe KLINISCHE PHARMAKOLOGIE ].
Management einer Überdosierung
Wenden Sie sich an ein zertifiziertes Giftinformationszentrum, um aktuelle Anleitungen und Ratschläge zu erhalten. Da Atomoxetin stark an Proteine gebunden ist, ist eine Dialyse bei der Behandlung einer Überdosierung wahrscheinlich nicht sinnvoll.
KONTRAINDIKATIONEN
Überempfindlichkeit
STRATTERA ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegenüber Atomoxetin oder anderen Bestandteilen des Arzneimittels [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Monoaminoxidase-Hemmer (MAOI)
STRATTERA sollte nicht zusammen mit einem MAO-Hemmer oder innerhalb von 2 Wochen nach Absetzen eines MAO-Hemmers eingenommen werden. Die Behandlung mit einem MAO-Hemmer sollte nicht innerhalb von 2 Wochen nach Absetzen von STRATTERA begonnen werden. Bei anderen Arzneimitteln, die die Monoaminkonzentrationen im Gehirn beeinflussen, gab es Berichte über schwerwiegende, manchmal tödliche Reaktionen (einschließlich Hyperthermie, Starrheit, Myoklonus, autonome Instabilität mit möglichen schnellen Schwankungen der Vitalfunktionen und Veränderungen des Geisteszustands, einschließlich extremer Erregung bis hin zu Delirium und Koma), wenn es in Kombination mit einem MAOI eingenommen wird. Einige Fälle zeigten Merkmale, die dem malignen neuroleptischen Syndrom ähneln. Solche Reaktionen können auftreten, wenn diese Arzneimittel gleichzeitig oder in unmittelbarer Nähe gegeben werden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Engwinkelglaukom
In klinischen Studien war die Anwendung von STRATTERA mit einem erhöhten Mydriasis-Risiko verbunden, weshalb die Anwendung bei Patienten mit Engwinkelglaukom nicht empfohlen wird.
Phäochromozytom
Schwerwiegende Reaktionen, einschließlich erhöhter Blutdruck und Tachyarrhythmie, wurden bei Patienten mit Phäochromozytom oder Phäochromozytom in der Vorgeschichte, die STRATTERA erhielten, berichtet. Daher sollte STRATTERA 18 mg nicht von Patienten mit Phäochromozytom oder Phäochromozytom in der Vorgeschichte eingenommen werden.
Schwere Herz-Kreislauf-Erkrankungen
STRATTERA 40 mg sollte nicht bei Patienten mit schweren Herz- oder Gefäßerkrankungen angewendet werden, deren Zustand sich voraussichtlich verschlechtern würde, wenn sie einen Anstieg des Blutdrucks oder der Herzfrequenz erfahren, der klinisch bedeutsam sein könnte (z Schläge pro Minute bei der Herzfrequenz). [Sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Der genaue Mechanismus, durch den Atomoxetin seine therapeutischen Wirkungen bei der Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) entfaltet, ist unbekannt, es wird jedoch angenommen, dass er mit der selektiven Hemmung des präsynaptischen Noradrenalin-Transporters zusammenhängt, wie in Ex-vivo-Aufnahme- und Neurotransmitter-Depletionsstudien festgestellt wurde .
Pharmakodynamik
Eine Expositions-Wirkungs-Analyse, die Atomoxetin-Dosen (0,5, 1,2 oder 1,8 mg/kg/Tag) oder Placebo umfasste, zeigte, dass die Atomoxetin-Exposition mit der Wirksamkeit korreliert, gemessen anhand der Aufmerksamkeits-Defizit-/Hyperaktivitäts-Störungs-Bewertungsskala-IV-Elternversion: Vom Prüfarzt verabreicht und erzielt. Die Beziehung zwischen Exposition und Wirksamkeit war ähnlich der zwischen Dosis und Wirksamkeit beobachteten, wobei die medianen Expositionen bei den beiden höchsten Dosen zu nahezu maximalen Veränderungen gegenüber dem Ausgangswert führten [siehe Klinische Studien ].
Herzelektrophysiologie
Die Wirkung von STRATTERA auf die QTc-Verlängerung wurde in einer randomisierten, doppelblinden, positiven (Moxifloxacin 400 mg) und Placebo-kontrollierten Crossover-Studie an gesunden männlichen CYP2D6-Low-Metabolizern untersucht. Insgesamt 120 gesunden Probanden wurde STRATTERA (20 mg und 60 mg) zweimal täglich über 7 Tage verabreicht. In der Studie wurden keine großen Veränderungen des QTc-Intervalls (dh Zunahmen > 60 ms gegenüber dem Ausgangswert, absolutes QTc > 480 ms) beobachtet. Kleine Änderungen des QTc-Intervalls können jedoch nicht aus der aktuellen Studie ausgeschlossen werden, da die Studie die Assay-Sensitivität nicht nachweisen konnte. Es gab eine leichte Verlängerung des QTc-Intervalls mit erhöhter Atomoxetin-Konzentration.
Pharmakokinetik
Atomoxetin wird nach oraler Gabe gut resorbiert und durch Nahrung nur minimal beeinflusst. Es wird hauptsächlich durch oxidativen Metabolismus über den enzymatischen Cytochrom P450 2D6 (CYP2D6)-Weg und anschließende Glucuronidierung eliminiert. Atomoxetin hat eine Halbwertszeit von etwa 5 Stunden. Ein Bruchteil der Bevölkerung (etwa 7 % der Kaukasier und 2 % der Afroamerikaner) sind schlechte Metabolisierer (PMs) von CYP2D6-metabolisierten Arzneimitteln. Diese Personen haben eine verringerte Aktivität auf diesem Weg, was zu 10-fach höheren AUCs, 5-fach höheren maximalen Plasmakonzentrationen und einer langsameren Elimination (Plasmahalbwertszeit von etwa 24 Stunden) von Atomoxetin im Vergleich zu Personen mit normaler Aktivität führt [extensive metabolizers (EMs )]. Medikamente, die CYP2D6 hemmen, wie Fluoxetin, Paroxetin und Chinidin, verursachen ähnliche Erhöhungen der Exposition.
Die Pharmakokinetik von Atomoxetin wurde bei mehr als 400 Kindern und Jugendlichen in ausgewählten klinischen Studien untersucht, hauptsächlich unter Verwendung von populationspharmakokinetischen Studien. Einzelne pharmakokinetische Daten zur Einzeldosis und zum Steady-State wurden auch bei Kindern, Jugendlichen und Erwachsenen erhoben. Wenn die Dosen auf eine mg/kg-Basis normalisiert wurden, wurden bei Kindern, Jugendlichen und Erwachsenen ähnliche Halbwertszeit-, Cmax- und AUC-Werte beobachtet. Clearance und Verteilungsvolumen nach Anpassung an das Körpergewicht waren ebenfalls ähnlich.
Absorption und Verteilung
Atomoxetin wird nach oraler Verabreichung schnell resorbiert, mit einer absoluten Bioverfügbarkeit von etwa 63 % bei EMs und 94 % bei PMs. Maximale Plasmakonzentrationen (Cmax) werden etwa 1 bis 2 Stunden nach der Einnahme erreicht.
STRATTERA 18 mg kann mit oder ohne Nahrung verabreicht werden. Die Verabreichung von STRATTERA zusammen mit einer fettreichen Standardmahlzeit bei Erwachsenen hatte keinen Einfluss auf das Ausmaß der oralen Resorption von Atomoxetin (AUC), verringerte jedoch die Resorptionsrate, was zu einer um 37 % niedrigeren Cmax und einer um 3 Stunden verzögerten Tmax führte. In klinischen Studien mit Kindern und Jugendlichen führte die Einnahme von STRATTERA zusammen mit Nahrung zu einer um 9 % niedrigeren Cmax.
Das Verteilungsvolumen im Steady State nach intravenöser Verabreichung beträgt 0,85 l/kg, was darauf hinweist, dass sich Atomoxetin hauptsächlich im gesamten Körperwasser verteilt. Das Verteilungsvolumen ist nach Normalisierung auf das Körpergewicht über den Gewichtsbereich des Patienten ähnlich.
Bei therapeutischen Konzentrationen sind 98 % von Atomoxetin im Plasma an Protein, hauptsächlich Albumin, gebunden.
Stoffwechsel und Ausscheidung
Atomoxetin wird hauptsächlich über den enzymatischen Weg CYP2D6 metabolisiert. Menschen mit reduzierter Aktivität in diesem Signalweg (PMs) haben höhere Plasmakonzentrationen von Atomoxetin im Vergleich zu Menschen mit normaler Aktivität (EMs). Bei PMs ist die AUC von Atomoxetin etwa 10-mal größer und Css,max etwa 5-mal größer als bei EMs. Labortests sind verfügbar, um CYP2D6-PMs zu identifizieren. Die gleichzeitige Anwendung von STRATTERA mit potenten CYP2D6-Inhibitoren wie Fluoxetin, Paroxetin oder Chinidin führt zu einem erheblichen Anstieg der Atomoxetin-Plasmaexposition und eine Dosisanpassung kann erforderlich sein [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Atomoxetin hemmte oder induziert den CYP2D6-Signalweg nicht.
Der wichtigste oxidative Metabolit, der unabhängig vom CYP2D6-Status gebildet wird, ist 4-Hydroxyatomoxetin, das glucuronidiert ist. 4-Hydroxyatomoxetin ist als Inhibitor des Norepinephrin-Transporters gleich wirksam wie Atomoxetin, zirkuliert jedoch im Plasma in viel geringeren Konzentrationen (1 % der Atomoxetin-Konzentration in EMs und 0,1 % der Atomoxetin-Konzentration in PMs). 4-Hydroxyatomoxetin wird hauptsächlich von CYP2D6 gebildet, aber bei PMs wird 4-Hydroxyatomoxetin langsamer von mehreren anderen Cytochrom-P450-Enzymen gebildet. N-Desmethylatomoxetin wird von CYP2C19 und anderen Cytochrom-P450-Enzymen gebildet, hat aber im Vergleich zu Atomoxetin eine wesentlich geringere pharmakologische Aktivität und zirkuliert im Plasma in geringeren Konzentrationen (5 % der Atomoxetin-Konzentration in EMs und 45 % der Atomoxetin-Konzentration in PMs).
Die mittlere scheinbare Plasma-Clearance von Atomoxetin nach oraler Gabe bei erwachsenen EM beträgt 0,35 l/h/kg und die mittlere Halbwertszeit 5,2 Stunden. Nach oraler Verabreichung von Atomoxetin an PMs beträgt die mittlere scheinbare Plasmaclearance 0,03 l/h/kg und die mittlere Halbwertszeit 21,6 Stunden. Bei PMs ist die AUC von Atomoxetin etwa 10-mal größer und Css,max etwa 5-mal größer als bei EMs. Die Eliminationshalbwertszeit von 4-Hydroxyatomoxetin ist bei EM-Patienten ähnlich der von N-Desmethylatomoxetin (6 bis 8 Stunden), während die Halbwertszeit von N-Desmethylatomoxetin bei PM-Patienten viel länger ist (34 bis 40 Stunden).
Atomoxetin wird hauptsächlich als 4-Hydroxyatomoxetin-O-glucuronid ausgeschieden, hauptsächlich im Urin (mehr als 80 % der Dosis) und in geringerem Maße im Stuhl (weniger als 17 % der Dosis). Nur ein kleiner Teil der 40-mg-Dosis von STRATTERA wird als unverändertes Atomoxetin ausgeschieden (weniger als 3 % der Dosis), was auf eine umfangreiche Biotransformation hinweist.
[Sehen Verwendung in bestimmten Bevölkerungsgruppen ].
Klinische Studien
ADHS-Studien bei Kindern und Jugendlichen
Akutstudien
Die Wirksamkeit von STRATTERA 40 mg bei der Behandlung von ADHS wurde in 4 randomisierten, doppelblinden, placebokontrollierten Studien mit pädiatrischen Patienten (im Alter von 6 bis 18 Jahren) nachgewiesen. Ungefähr ein Drittel der Patienten erfüllte die DSM-IV-Kriterien für den unaufmerksamen Subtyp und zwei Drittel erfüllten die Kriterien sowohl für den unaufmerksamen als auch den hyperaktiven/impulsiven Subtyp.
Anzeichen und Symptome von ADHS wurden durch einen Vergleich der mittleren Veränderung vom Ausgangswert bis zum Endpunkt für mit STRATTERA und Placebo behandelte Patienten unter Verwendung einer Intent-to-treat-Analyse des primären Zielparameters, der vom Prüfarzt verabreichten und bewerteten ADHS-Bewertungsskala-IV- bewertet. Gesamtpunktzahl der Elternversion (ADHDRS), einschließlich hyperaktiver/impulsiver und unaufmerksamer Subskalen. Jedes Element auf ADHDRS wird direkt einem Symptomkriterium für ADHS im DSM-IV zugeordnet.
In Studie 1, einer 8-wöchigen randomisierten, doppelblinden, placebokontrollierten Dosis-Wirkungs-Akutbehandlungsstudie mit Kindern und Jugendlichen im Alter von 8 bis 18 Jahren (N = 297), erhielten die Patienten entweder eine feste Dosis STRATTERA (0,5, 1,2 oder 1,8 mg/kg/Tag) oder Placebo. STRATTERA 10 mg wurde als aufgeteilte Dosis am frühen Morgen und am späten Nachmittag/frühen Abend verabreicht. Bei den 2 höheren Dosen waren die Verbesserungen der ADHS-Symptome bei den mit STRATTERA behandelten Patienten statistisch signifikant besser als bei den mit Placebo behandelten Patienten, gemessen anhand der ADHDRS-Skala. Die Dosis von 1,8 mg/kg/Tag STRATTERA 25 mg brachte keinen zusätzlichen Nutzen gegenüber der Dosis von 1,2 mg/kg/Tag. Die Dosis von 0,5 mg/kg/Tag STRATTERA war Placebo nicht überlegen.
In Studie 2, einer 6-wöchigen randomisierten, doppelblinden, placebokontrollierten Akutbehandlungsstudie mit Kindern und Jugendlichen im Alter von 6 bis 16 Jahren (N = 171), erhielten die Patienten entweder STRATTERA 40 mg oder Placebo. STRATTERA wurde als Einzeldosis am frühen Morgen verabreicht und entsprechend dem klinischen Ansprechen gewichtsangepasst bis zu einer Höchstdosis von 1,5 mg/kg/Tag titriert. Die mittlere Enddosis von STRATTERA 10 mg betrug ungefähr 1,3 mg/kg/Tag. ADHS-Symptome wurden unter STRATTERA im Vergleich zu Placebo statistisch signifikant gebessert, gemessen anhand der ADHDRS-Skala. Diese Studie zeigt, dass STRATTERA wirksam ist, wenn es einmal täglich morgens verabreicht wird.
In zwei identischen, 9-wöchigen, akuten, randomisierten, doppelblinden, placebokontrollierten Studien mit Kindern im Alter von 7 bis 13 Jahren (Studie 3, N = 147; Studie 4, N = 144) wurden STRATTERA 40 mg und Methylphenidat mit Placebo verglichen . STRATTERA 18 mg wurde als aufgeteilte Dosis am frühen Morgen und am späten Nachmittag (nach der Schule) verabreicht und entsprechend dem klinischen Ansprechen gewichtsangepasst titriert. Die maximal empfohlene STRATTERA-Dosis betrug 2,0 mg/kg/Tag. Die mittlere Enddosis von STRATTERA 18 mg betrug in beiden Studien etwa 1,6 mg/kg/Tag. In beiden Studien verbesserten sich die ADHS-Symptome unter STRATTERA 10 mg statistisch signifikant stärker als unter Placebo, gemessen auf der ADHDRS-Skala.
Die Untersuchung von Bevölkerungsuntergruppen basierend auf Geschlecht und Alter (
Wartungsstudie
Die Wirksamkeit von STRATTERA 18 mg bei der Erhaltungstherapie von ADHS wurde in einer ambulanten Studie mit Kindern und Jugendlichen (Alter 6-15 Jahre) nachgewiesen. Patienten, die die DSM-IV-Kriterien für ADHS erfüllten und während einer anfänglichen 10-wöchigen offenen Behandlungsphase mit STRATTERA (1,2 bis 1,8 mg/kg/Tag) über etwa 4 Wochen ein kontinuierliches Ansprechen zeigten, wurden randomisiert auf die Fortsetzung ihrer aktuellen Dosis von STRATTERA (N =292) oder Placebo (N=124) unter doppelblinder Behandlung zur Beobachtung eines Rückfalls. Das Ansprechen während der Open-Label-Phase wurde definiert als CGI-ADHD-S-Score ≤ 2 und eine Reduktion des ADHDRS-IV-Parent:Inv-Gesamtscores um mindestens 25 % gegenüber dem Ausgangswert. Patienten, die STRATTERA zugewiesen wurden und während der ersten doppelblinden Behandlungsphase für etwa 8 Monate ein kontinuierliches Ansprechen zeigten, wurden erneut randomisiert und erhielten doppelblind die Fortsetzung ihrer aktuellen STRATTERA-Dosis (N = 81) oder Placebo (N = 82). Behandlung zur Beobachtung eines Rückfalls. Ein Rückfall während der doppelblinden Phase wurde als Anstieg des CGI-ADHD-S-Scores um mindestens 2 ab dem Ende der Open-Label-Phase definiert und der ADHDRS-IV-Parent:Inv-Gesamtscore kehrte für 2 auf ≥ 90 % des Studieneintrittsscores zurück aufeinanderfolgende Besuche. In beiden doppelblinden Phasen traten bei Patienten, die die STRATTERA-Behandlung fortsetzten, signifikant längere Zeiten bis zum Rückfall auf als bei Patienten, die Placebo erhielten.
ADHS-Studien bei Erwachsenen
Die Wirksamkeit von STRATTERA bei der Behandlung von ADHS wurde in 2 randomisierten, doppelblinden, placebokontrollierten klinischen Studien mit erwachsenen Patienten ab 18 Jahren nachgewiesen, die die DSM-IV-Kriterien für ADHS erfüllten.
Anzeichen und Symptome von ADHS wurden anhand der vom Prüfarzt verabreichten Conners Adult ADHD Rating Scale Screening Version (CAARS), einer 30-Punkte-Skala, bewertet. Der primäre Wirksamkeitsmaßstab war der 18-Punkte-Gesamt-ADHS-Symptom-Score (die Summe der Unterskalen für Unaufmerksamkeit und Hyperaktivität/Impulsivität aus dem CAARS), der durch einen Vergleich der mittleren Veränderung vom Ausgangswert zum Endpunkt unter Verwendung einer Intent-to-treat-Analyse bewertet wurde.
In 2 identischen, 10-wöchigen, randomisierten, doppelblinden, placebokontrollierten Akutbehandlungsstudien (Studie 5, N = 280; Studie 6, N = 256) erhielten die Patienten entweder STRATTERA 25 mg oder Placebo. STRATTERA wurde als aufgeteilte Dosis am frühen Morgen und am späten Nachmittag/frühen Abend verabreicht und entsprechend dem klinischen Ansprechen in einem Bereich von 60 bis 120 mg/Tag titriert. Die mittlere Enddosis von STRATTERA 40 mg betrug in beiden Studien etwa 95 mg/Tag. In beiden Studien verbesserten sich die ADHS-Symptome unter STRATTERA statistisch signifikant, gemessen am ADHS-Symptom-Score der CAARS-Skala.
Die Untersuchung von Bevölkerungsuntergruppen basierend auf Geschlecht und Alter (
INFORMATIONEN ZUM PATIENTEN
STRATTERA® (Stra-TAIR-a) (Atomoxetin) Kapseln
Lesen Sie den mit STRATTERA® gelieferten Medikationsleitfaden, bevor Sie oder Ihr Kind mit der Einnahme beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Dieser Medikationsleitfaden ersetzt nicht das Gespräch mit Ihrem Arzt über Ihre Behandlung oder die Behandlung Ihres Kindes mit STRATTERA.
Was sind die wichtigsten Informationen, die ich über STRATTERA 18 mg wissen sollte?
Folgendes wurde bei der Anwendung von STRATTERA berichtet:
Kinder und Jugendliche denken manchmal an Selbstmord, und viele berichten, dass sie versucht haben, sich das Leben zu nehmen. Ergebnisse klinischer Studien zu STRATTERA mit über 2200 ADHS-Patienten im Kindes- und Jugendalter deuten darauf hin, dass bei manchen Kindern und Jugendlichen ein höheres Risiko für Selbstmordgedanken oder -handlungen besteht. Obwohl in diesen Studien keine Suizide auftraten, entwickelten 4 von 1000 Patienten Suizidgedanken. Informieren Sie den Arzt Ihres Kindes oder Jugendlichen, wenn bei Ihrem Kind oder Jugendlichen (oder in der Familienanamnese):
Die Wahrscheinlichkeit für Selbstmordgedanken und -handlungen kann höher sein:
Verhindern Sie Suizidgedanken und -handlungen bei Ihrem Kind oder Teenager, indem Sie:
Achten Sie während der Behandlung mit STRATTERA 25 mg auf die folgenden Anzeichen bei Ihrem Kind oder Teenager:
Rufen Sie sofort den Arzt Ihres Kindes oder Teenagers an, wenn eines der oben genannten Anzeichen auftritt, insbesondere wenn es neu, plötzlich oder schwerwiegend ist. Ihr Kind oder Teenager muss möglicherweise engmaschig auf Selbstmordgedanken und -handlungen überwacht werden oder es muss eine Änderung der Medizin vorgenommen werden.
STRATTERA kann bei manchen Patienten Leberschäden verursachen. Rufen Sie sofort Ihren Arzt an, wenn Sie oder Ihr Kind die folgenden Anzeichen von Leberproblemen haben:
Informieren Sie Ihren Arzt, wenn Sie oder Ihr Kind Herzprobleme, Herzfehler, Bluthochdruck oder eine Familienanamnese dieser Probleme haben. Ihr Arzt sollte Sie oder Ihr Kind vor Beginn der Behandlung mit STRATTERA sorgfältig auf Herzprobleme untersuchen.
Ihr Arzt sollte Ihren Blutdruck oder den Blutdruck und die Herzfrequenz Ihres Kindes während der Behandlung mit STRATTERA regelmäßig kontrollieren.
Rufen Sie sofort Ihren Arzt an, wenn bei Ihnen oder Ihrem Kind während der Einnahme von STRATTERA Anzeichen von Herzproblemen wie Brustschmerzen, Kurzatmigkeit oder Ohnmacht auftreten.
Rufen Sie bei neuen psychischen Symptomen sofort den Arzt Ihres Kindes oder Jugendlichen an da eine Anpassung oder Beendigung der Behandlung mit STRATTERA 40 mg möglicherweise in Betracht gezogen werden muss.
Was ist STRATTERA 18 mg?
STRATTERA ist ein selektiver Noradrenalin-Wiederaufnahmehemmer. Es wird zur Behandlung der Aufmerksamkeitsdefizit- und Hyperaktivitätsstörung (ADHS) eingesetzt. STRATTERA kann helfen, die Aufmerksamkeit zu erhöhen und Impulsivität und Hyperaktivität bei Patienten mit ADHS zu verringern.
STRATTERA 10 mg sollte als Teil eines Gesamtbehandlungsprogramms für ADHS verwendet werden, das Beratung oder andere Therapien umfassen kann.
STRATTERA wurde bei Kindern unter 6 Jahren nicht untersucht.
Wer sollte STRATTERA nicht einnehmen?
STRATTERA darf nicht eingenommen werden, wenn Sie oder Ihr Kind:
STRATTERA ist möglicherweise nicht das Richtige für Sie oder Ihr Kind. Bevor Sie mit STRATTERA beginnen, informieren Sie Ihren Arzt oder den Arzt Ihres Kindes über alle Gesundheitszustände (oder eine Familienanamnese), einschließlich:
Kann STRATTERA mit anderen Arzneimitteln eingenommen werden?
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie oder Ihr Kind einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und pflanzlicher Nahrungsergänzungsmittel. STRATTERA und einige Arzneimittel können miteinander interagieren und schwerwiegende Nebenwirkungen verursachen. Ihr Arzt wird entscheiden, ob STRATTERA zusammen mit anderen Arzneimitteln eingenommen werden kann.
Informieren Sie Ihren Arzt insbesondere, wenn Sie oder Ihr Kind Folgendes einnehmen:
Informieren Sie sich über die Arzneimittel, die Sie oder Ihr Kind einnehmen. Führen Sie eine Liste Ihrer Arzneimittel mit sich, um sie Ihrem Arzt und Apotheker zu zeigen.
Beginnen Sie während der Einnahme von STRATTERA mit keinem neuen Arzneimittel, ohne vorher mit Ihrem Arzt gesprochen zu haben.
Wie sollte STRATTERA eingenommen werden?
Welche Nebenwirkungen kann STRATTERA haben?
Sehen „Was sind die wichtigsten Informationen, die ich über STRATTERA 10 mg wissen sollte?“ Informationen zu gemeldeten Selbstmordgedanken und -handlungen, anderen psychischen Problemen, schweren Leberschäden und Herzproblemen.
Andere schwerwiegende Nebenwirkungen sind:
Häufige Nebenwirkungen bei Kindern und Jugendlichen sind:
Häufige Nebenwirkungen bei Erwachsenen sind:
Weitere Informationen für Kinder, Jugendliche und Erwachsene:
Dies ist keine vollständige Liste möglicher Nebenwirkungen. Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist STRATTERA aufzubewahren?
Allgemeine Informationen zu STRATTERA
Arzneimittel werden manchmal für andere als die in einem Arzneimittelleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie STRATTERA 25 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie STRATTERA nicht an andere Personen, selbst wenn sie die gleiche Erkrankung haben. Es kann ihnen schaden.
Dieser Arzneimittelleitfaden fasst die wichtigsten Informationen zu STRATTERA zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt. Sie können Ihren Arzt oder Apotheker um Informationen über STRATTERA bitten, die für medizinisches Fachpersonal geschrieben wurden. Weitere Informationen zu STRATTERA erhalten Sie telefonisch unter 1-800-Lilly-Rx (1-800-545-5979) oder unter www.strattera.com.
Was sind die Inhaltsstoffe von STRATTERA 40 mg?
Wirkstoff: Atomoxetinhydrochlorid.
Inaktive Zutaten: vorgelatinierte Stärke, Dimethicon, Gelatine, Natriumlaurylsulfat, FD&CBlue Nr. 2, synthetisches gelbes Eisenoxid, Titandioxid, rotes Eisenoxid und essbare schwarze Tinte.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.