Copegus 100mg Ribavirin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Copegus 100 mg und wie wird es angewendet?
Copegus 100 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von chronischer Hepatitis C. Copegus 100 mg kann allein oder zusammen mit anderen Medikamenten angewendet werden.
Copegus gehört zu einer Klasse von Arzneimitteln, die Hepatitis-B-/Hepatitis-C-Mittel genannt werden; RSV-Agenten.
Welche Nebenwirkungen kann Copegus haben?
Copegus kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Copegus gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Copegus. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
RISIKO SCHWERER ERKRANKUNGEN UND RIBAVIRIN-ASSOZIIERTER WIRKUNGEN
COPEGUS (Ribavirin)-Monotherapie ist zur Behandlung einer chronischen Hepatitis-C-Virusinfektion nicht wirksam und sollte bei dieser Indikation nicht allein angewendet werden.
Die primäre klinische Toxizität von Ribavirin ist hämolytische Anämie. Die mit der Ribavirin-Therapie verbundene Anämie kann zu einer Verschlechterung der Herzerkrankung und zu tödlichen und nicht tödlichen Myokardinfarkten führen. Patienten mit einer signifikanten oder instabilen Herzerkrankung in der Vorgeschichte sollten nicht mit COPEGUS behandelt werden [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN, NEBENWIRKUNGEN und DOSIERUNG UND ANWENDUNG].
Signifikante teratogene und/oder embryozide Wirkungen wurden bei allen Tierarten nachgewiesen, die Ribavirin ausgesetzt waren. Darüber hinaus hat Ribavirin eine Halbwertszeit bei Mehrfachgabe von 12 Tagen und kann bis zu 6 Monate in Nicht-Plasma-Kompartimenten verbleiben. Daher ist Ribavirin, einschließlich COPEGUS 100 mg, bei schwangeren Frauen und bei männlichen Partnern schwangerer Frauen kontraindiziert. Sowohl bei weiblichen Patienten als auch bei weiblichen Partnern von männlichen Patienten, die eine Ribavirin-Therapie erhalten, muss während der Therapie und für 6 Monate nach Abschluss der Therapie äußerste Sorgfalt darauf verwendet werden, eine Schwangerschaft zu vermeiden. Während der Behandlung und während der 6-monatigen Nachbeobachtungszeit nach der Behandlung müssen mindestens zwei zuverlässige Formen der wirksamen Empfängnisverhütung angewendet werden [siehe GEGENANZEIGEN, WARNHINWEISE UND VORSICHTSMASSNAHMEN und Anwendung bei bestimmten Patientengruppen].
BEZEICHNUNG
COPEGUS 100 mg, Ribavirin, ist ein Nukleosid-Analogon mit antiviraler Aktivität. Der chemische Name von Ribavirin lautet 1-β-Dribofuranosyl-1H-1,2,4-triazol-3-carboxamid und hat die folgende Strukturformel:
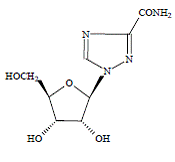
Die empirische Formel von Ribavirin ist C8H12N4O5 und das Molekulargewicht beträgt 244,2. Ribavirin ist ein weißes bis cremefarbenes Pulver. Es ist leicht löslich in Wasser und leicht löslich in wasserfreiem Alkohol.
COPEGUS (Ribavirin) ist als hellrosa bis rosafarbene, flache, ovale Filmtablette zur oralen Verabreichung erhältlich. Jede Tablette enthält 200 mg Ribavirin und die folgenden Hilfsstoffe: vorverkleisterte Stärke, mikrokristalline Cellulose, Carboxymethylstärke-Natrium, Maisstärke und Magnesiumstearat. Die Beschichtung der Tablette enthält Chromatone-P oder Opadry Pink (hergestellt unter Verwendung von Hydroxypropylmethylcellulose, Talk, Titandioxid, synthetischem gelbem Eisenoxid und synthetischem rotem Eisenoxid), Ethylcellulose (ECD-30) und Triacetin.
INDIKATIONEN
COPEGUS 100 mg in Kombination mit PEGASYS (Peginterferon alfa-2a) ist angezeigt für die Behandlung von Patienten ab 5 Jahren mit chronischer Hepatitis-C-(CHC)-Virusinfektion, die eine kompensierte Lebererkrankung haben und zuvor nicht mit Interferon alpha behandelt wurden.
Zu Beginn einer Kombinationstherapie mit COPEGUS 100 mg und PEGASYS sollten die folgenden Punkte berücksichtigt werden:
DOSIERUNG UND ANWENDUNG
COPEGUS 100 mg sollte mit einer Mahlzeit eingenommen werden. COPEGUS sollte in Kombination mit PEGASYS gegeben werden; Es ist wichtig zu beachten, dass COPEGUS 100 mg niemals als Monotherapie gegeben werden sollte. Sehen PEGASYS-Packungsbeilage für alle Anweisungen zur PEGASYS-Dosierung und -Verabreichung.
Chronische Hepatitis-C-Monoinfektion
Erwachsene Patienten
Die empfohlene Dosis von COPEGUS 100 mg Tabletten ist in Tabelle 1 angegeben. Die empfohlene Behandlungsdauer für Patienten, die zuvor nicht mit Ribavirin und Interferon behandelt wurden, beträgt 24 bis 48 Wochen.
Die Tagesdosis von COPEGUS 100 mg beträgt 800 mg bis 1200 mg, oral verabreicht in zwei getrennten Dosen. Die Dosis sollte individuell auf den Patienten abgestimmt werden, abhängig von Krankheitsmerkmalen zu Studienbeginn (z. B. Genotyp), Ansprechen auf die Therapie und Verträglichkeit des Regimes (siehe ).
Pädiatrische Patienten
PEGASYS wird als 180 µg/1,73 m² x BSA einmal wöchentlich subkutan bis zu einer Höchstdosis von 180 µg verabreicht und sollte in Kombination mit Ribavirin verabreicht werden. Die empfohlene Behandlungsdauer für Patienten mit Genotyp 2 oder 3 beträgt 24 Wochen und für andere Genotypen 48 Wochen.
COPEGUS sollte in Kombination mit PEGASYS verabreicht werden. COPEGUS 100 mg ist nur als 200-mg-Tablette erhältlich und daher sollte der Arzt entscheiden, ob diese Tablettengröße von einem pädiatrischen Patienten geschluckt werden kann. Die empfohlenen Dosen für COPEGUS sind in Tabelle 2 angegeben. Patienten, die vor ihrem 18. Geburtstag mit der Behandlung beginnen, sollten die pädiatrische Dosierung bis zum Abschluss der Therapie beibehalten.
Chronische Hepatitis C mit HIV-Koinfektion
Erwachsene Patienten
Die empfohlene Dosis zur Behandlung der chronischen Hepatitis C bei Patienten mit HIV-Koinfektion beträgt PEGASYS 180 µg subkutan einmal wöchentlich und COPEGUS 800 mg oral täglich für eine Gesamtdauer von 48 Wochen, unabhängig vom HCV-Genotyp.
Dosisänderungen
Erwachsene und pädiatrische Patienten
Wenn während der COPEGUS/PEGASYS-Kombinationstherapie schwere Nebenwirkungen oder anormale Laborwerte auftreten, sollte die Dosis gegebenenfalls angepasst oder abgesetzt werden, bis die Nebenwirkungen abklingen oder der Schweregrad abnimmt. Wenn die Unverträglichkeit nach einer Dosisanpassung fortbesteht, sollte die COPEGUS/PEGASYS-Therapie abgebrochen werden. Tabelle 3 enthält Richtlinien für Dosisanpassungen und -abbrüche basierend auf der Hämoglobinkonzentration und dem Herzstatus des Patienten.
COPEGUS 100 mg sollte Patienten mit vorbestehender Herzerkrankung mit Vorsicht verabreicht werden. Die Patienten sollten vor Beginn der Therapie untersucht und während der Therapie angemessen überwacht werden. Wenn es zu einer Verschlechterung des kardiovaskulären Status kommt, sollte die Therapie abgebrochen werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die Richtlinien für Dosisanpassungen von COPEGUS 100 mg, die in dieser Tabelle aufgeführt sind, gelten auch für andere Laboranomalien oder Nebenwirkungen als eine Abnahme der Hämoglobinwerte.
Erwachsene Patienten
Sobald COPEGUS 100 mg aufgrund einer Laboranomalie oder einer klinischen Nebenwirkung ausgesetzt wurde, kann ein Versuch unternommen werden, COPEGUS 100 mg mit 600 mg täglich wieder aufzunehmen und die Dosis weiter auf 800 mg täglich zu erhöhen. Es wird jedoch nicht empfohlen, COPEGUS auf die ursprünglich zugewiesene Dosis (1000 mg bis 1200 mg) zu erhöhen.
Pädiatrische Patienten
Nach Abklingen einer Laboranomalie oder einer klinischen Nebenwirkung kann je nach Einschätzung des Arztes versucht werden, die COPEGUS-Dosis von 100 mg auf die ursprüngliche Dosis zu erhöhen. Wenn COPEGUS aufgrund einer Laboranomalie oder einer klinischen Nebenwirkung ausgesetzt wurde, kann versucht werden, COPEGUS 100 mg mit der Hälfte der vollen Dosis wieder aufzunehmen.
Nierenfunktionsstörung
Die tägliche Gesamtdosis von COPEGUS sollte bei Patienten mit einer Kreatinin-Clearance von weniger als oder gleich 50 ml/min reduziert werden; und die wöchentliche PEGASYS-Dosis sollte bei einer Kreatinin-Clearance von weniger als 30 ml/min wie folgt in Tabelle 4 reduziert werden [siehe Verwendung in bestimmten Bevölkerungsgruppen , Pharmakokinetik , und PEGASYS-Packungsbeilage ].
Die Dosis von COPEGUS 100 mg sollte bei Patienten mit eingeschränkter Nierenfunktion nicht weiter modifiziert werden. Wenn schwerwiegende Nebenwirkungen oder Laboranomalien auftreten, sollte COPEGUS gegebenenfalls abgesetzt werden, bis die Nebenwirkungen abklingen oder der Schweregrad abnimmt. Wenn die Unverträglichkeit nach der Wiederaufnahme von COPEGUS 100 mg fortbesteht, sollte die COPEGUS/PEGASYS-Therapie abgebrochen werden.
Für pädiatrische Patienten mit eingeschränkter Nierenfunktion liegen keine Daten vor.
Absetzen der Dosierung
Ein Abbruch der Therapie mit PEGASYS/COPEGUS 100 mg sollte in Betracht gezogen werden, wenn der Patient nach 12 Wochen Therapie keine Reduktion der HCV-RNA um mindestens 2 log10 gegenüber dem Ausgangswert oder nach 24 Wochen Therapie keine HCV-RNA-Spiegel nachweisbar hat.
Die Therapie mit PEGASYS/COPEGUS 100 mg sollte bei Patienten, die während der Behandlung eine Leberdekompensation entwickeln, abgesetzt werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
WIE GELIEFERT
Darreichungsformen und Stärken
COPEGUS (Ribavirin) ist als hellrosa bis rosafarbene, flache, ovale Filmtablette zur oralen Verabreichung erhältlich. Jede Tablette enthält 200 mg Ribavirin.
COPEGUS® (Ribavirin) ist als Tabletten zur oralen Verabreichung erhältlich. Jede Tablette enthält 200 mg Ribavirin und ist hellrosa bis rosafarben, flach, oval, filmbeschichtet und mit der Prägung RIB 200 auf der einen Seite und ROCHE auf der anderen Seite versehen. Sie sind als Flasche mit 168 Tabletten verpackt ( NDC 0004-0086-94).
Lagerung und Handhabung
Lagern Sie die COPEGUS® Tablets-Flasche bei 25 °C (77 °F); Exkursionen sind zwischen 15°C und 30°C (59°F und 86°F) erlaubt [siehe USP kontrollierte Raumtemperatur ]. Flasche fest verschlossen halten.
Hergestellt von: Hoffmann-La Roche, Inc. c/o Genentech, Inc. Ein Mitglied der Roche-Gruppe, 1 DNA Way, South San Francisco, CA 94080-4990. Überarbeitet: August 2015
NEBENWIRKUNGEN
PEGASYS in Kombination mit COPEGUS verursacht eine Vielzahl schwerwiegender Nebenwirkungen [siehe Eingerahmte Warnung und WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Zu den häufigsten schwerwiegenden oder lebensbedrohlichen Nebenwirkungen, die durch COPEGUS/PEGASYS ausgelöst oder verschlimmert werden, gehören Depression, Suizid, Rückfall von Drogenmissbrauch/Überdosis und bakterielle Infektionen, die jeweils mit einer Häufigkeit von weniger als 1 % auftreten. Leberdekompensation trat bei 2 % (10/574) CHC/HIV-Patienten auf [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Klinische Studienerfahrung
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Erwachsene Patienten
In den zulassungsrelevanten Zulassungsstudien NV15801 und NV15942 erhielten 886 Patienten 48 Wochen lang COPEGUS in Dosen von 1000/1200 mg, basierend auf dem Körpergewicht. In diesen Studien traten bei 10 % der CHC-Monoinfizierten und bei 19 % der CHC/HIV-Patienten, die PEGASYS allein oder in Kombination mit COPEGUS erhielten, eine oder mehrere schwerwiegende Nebenwirkungen auf. Die häufigste schwerwiegende Nebenwirkung (3 % bei CHC und 5 % bei CHC/HIV) war eine bakterielle Infektion (z. B. Sepsis, Osteomyelitis, Endokarditis, Pyelonephritis, Lungenentzündung).
Andere schwerwiegende Nebenwirkungen traten mit einer Häufigkeit von weniger als 1 % auf und umfassten: Suizid, Suizidgedanken, Psychose, Aggression, Angstzustände, Drogenmissbrauch und Arzneimittelüberdosierung, Angina pectoris, Leberfunktionsstörung, Fettleber, Cholangitis, Arrhythmie, Diabetes mellitus, Autoimmunphänomene (z. B. Hyperthyreose, Hypothyreose, Sarkoidose, systemischer Lupus erythematodes, rheumatoide Arthritis), periphere Neuropathie, aplastische Anämie, Magengeschwür, gastrointestinale Blutung, Pankreatitis, Colitis, Hornhautgeschwür, Lungenembolie, Koma, Myositis, Hirnblutung, thrombotisch-thrombozytopenische Purpura, psychotische Störungen und Halluzinationen.
Der Prozentsatz der Patienten in klinischen Studien, bei denen ein oder mehrere unerwünschte Ereignisse auftraten, betrug 98 %. Die am häufigsten berichteten Nebenwirkungen waren psychiatrische Reaktionen, einschließlich Depression, Schlaflosigkeit, Reizbarkeit, Angst und grippeähnliche Symptome wie Müdigkeit, Fieber, Myalgie, Kopfschmerzen und Schüttelfrost. Andere häufige Reaktionen waren Anorexie, Übelkeit und Erbrechen, Durchfall, Arthralgien, Reaktionen an der Injektionsstelle, Alopezie und Juckreiz.
zeigt Raten von unerwünschten Ereignissen, die bei mindestens 5 % der Patienten auftraten, die in der klinischen CHC-Studie NV15801 eine Kombinationstherapie mit pegyliertem Interferon und Ribavirin erhielten.
Zehn Prozent der CHC-monoinfizierten Patienten, die eine 48-wöchige Therapie mit PEGASYS in Kombination mit COPEGUS 100 mg erhielten, brachen die Therapie ab; 16 % der CHC/HIV-koinfizierten Patienten brachen die Therapie ab. Die häufigsten Gründe für einen Therapieabbruch waren psychiatrische Erkrankungen, grippeähnliche Syndrome (z. B. Lethargie, Müdigkeit, Kopfschmerzen), dermatologische und gastrointestinale Erkrankungen sowie Laboranomalien (Thrombozytopenie, Neutropenie und Anämie).
Insgesamt benötigten 39 % der Patienten mit CHC oder CHC/HIV eine Modifikation der PEGASYS- und/oder COPEGUS-Therapie. Der häufigste Grund für eine Dosisanpassung von PEGASYS bei CHC- und CHC/HIV-Patienten waren Laboranomalien; Neutropenie (20 % bzw. 27 %) und Thrombozytopenie (4 % bzw. 6 %). Der häufigste Grund für eine Dosisanpassung von COPEGUS bei CHC- und CHC/HIV-Patienten war Anämie (22 % bzw. 16 %).
Die PEGASYS-Dosis wurde bei 12 % der Patienten, die 48 Wochen lang 1000 mg auf 1200 mg COPEGUS erhielten, und bei 7 % der Patienten, die 24 Wochen lang 800 mg COPEGUS erhielten, reduziert. Die COPEGUS-Dosis wurde bei 21 % der Patienten, die 48 Wochen lang 1000 mg auf 1200 mg COPEGUS 100 mg erhielten, und bei 12 % der Patienten, die 24 Wochen lang 800 mg COPEGUS 100 mg erhielten, reduziert.
Bei Patienten mit chronischer Hepatitis-C-Monoinfektion, die 24 Wochen lang mit PEGASYS und 800 mg COPEGUS 100 mg behandelt wurden, wurde eine geringere Inzidenz schwerwiegender unerwünschter Ereignisse (3 % vs. 10 %) und ein Hämoglobinwert von weniger als 10 g/dl (3 % vs. 15 %) beobachtet. , Dosisanpassung von PEGASYS (30 % vs. 36 %) und COPEGUS (19 % vs. 38 %) und Abbruch der Behandlung (5 % vs. 15 %) im Vergleich zu Patienten, die 48 Wochen lang mit PEGASYS und 1000 mg oder behandelt wurden 1200 mg COPEGUS. Andererseits schien die Gesamtinzidenz unerwünschter Ereignisse in den beiden Behandlungsgruppen ähnlich zu sein.
Pädiatrische Patienten
In einer klinischen Studie mit 114 pädiatrischen Probanden (im Alter von 5 bis 17 Jahren), die mit PEGASYS allein oder in Kombination mit COPEGUS 100 mg behandelt wurden, waren bei etwa einem Drittel der Probanden Dosisanpassungen erforderlich, am häufigsten wegen Neutropenie und Anämie. Im Allgemeinen war das bei pädiatrischen Probanden beobachtete Sicherheitsprofil ähnlich dem bei Erwachsenen. In der pädiatrischen Studie waren die häufigsten unerwünschten Ereignisse bei Patienten, die mit der Kombinationstherapie PEGASYS und COPEGUS 100 mg für bis zu 48 Wochen behandelt wurden, grippeähnliche Erkrankungen (91 %), Infektionen der oberen Atemwege (60 %), Kopfschmerzen (64 %), Magen-Darm-Erkrankungen (56 %), Hauterkrankungen (47 %) und Reaktionen an der Injektionsstelle (45 %). Sieben Patienten, die eine 48-wöchige Kombinationsbehandlung aus PEGASYS und COPEGUS erhielten, brachen die Therapie aus Sicherheitsgründen ab (Depression, anormale psychiatrische Beurteilung, vorübergehende Erblindung, retinale Exsudate, Hyperglykämie, Typ-1-Diabetes mellitus und Anämie). Schwere unerwünschte Ereignisse wurden bei 2 Patienten in der Gruppe der Kombinationstherapie mit PEGASYS plus COPEGUS 100 mg berichtet (Hyperglykämie und Cholezystektomie).
Bei pädiatrischen Studienteilnehmern, die randomisiert der Kombinationstherapie zugeteilt wurden, war die Inzidenz der meisten Nebenwirkungen während des gesamten Behandlungszeitraums (bis zu 48 Wochen plus 24 Wochen Nachbeobachtung) im Vergleich zu den ersten 24 Wochen ähnlich und stieg bei Kopfschmerzen und gastrointestinalen Störungen nur leicht an , Reizbarkeit und Hautausschlag. Die meisten Nebenwirkungen traten in den ersten 24 Behandlungswochen auf.
Wachstumshemmung bei pädiatrischen Probanden
[sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Pädiatrische Patienten, die mit der Kombinationstherapie PEGASYS plus Ribavirin behandelt wurden, zeigten eine Verzögerung der Gewichts- und Größenzunahme nach bis zu 48 Wochen Therapie im Vergleich zum Ausgangswert. Sowohl das Gewicht für das Alter als auch die Größe für das Alter der Z-Scores sowie die Perzentile der normativen Population für das Gewicht und die Größe der Probanden nahmen während der Behandlung ab. Am Ende der 2-jährigen Nachbeobachtung nach der Behandlung waren die meisten Probanden zu den Perzentilen der normativen Basislinie für Gewicht (64. mittleres Perzentil zu Studienbeginn, 60. mittleres Perzentil 2 Jahre nach der Behandlung) und Körpergröße (54. mittleres Perzentil zu Studienbeginn, 56. Perzentile) zurückgekehrt mittleres Perzentil 2 Jahre nach der Behandlung). Am Ende der Behandlung zeigten 43 % (23 von 53) der Probanden eine Gewichtsperzentilabnahme von mehr als 15 Perzentilen und 25 % (13 von 53) eine Größenperzentilabnahme von mehr als 15 Perzentilen auf den normativen Wachstumskurven. 2 Jahre nach der Behandlung lagen 16 % (6 von 38) der Probanden mehr als 15 Perzentile unter ihrer Ausgangsgewichtskurve und 11 % (4 von 38) lagen mehr als 15 Perzentile unter ihrer Ausgangsgrößenkurve.
38 der 114 Probanden nahmen an der Langzeit-Follow-up-Studie teil, die sich bis zu 6 Jahre nach der Behandlung erstreckte. Bei den meisten Probanden blieb die Erholung des Wachstums nach der Behandlung 2 Jahre nach der Behandlung bis 6 Jahre nach der Behandlung erhalten.
Häufige Nebenwirkungen bei CHC mit HIV-Koinfektion (Erwachsene)
Das Nebenwirkungsprofil von koinfizierten Patienten, die in Studie NR15961 mit PEGASYS/COPEGUS behandelt wurden, war im Allgemeinen ähnlich dem, das für monoinfizierte Patienten in Studie NV15801 gezeigt wurde (Tabelle 5). Ereignisse, die häufiger bei koinfizierten Patienten auftraten, waren Neutropenie (40 %), Anämie (14 %), Thrombozytopenie (8 %), Gewichtsabnahme (16 %) und Stimmungsschwankungen (9 %).
Anomalien bei Labortests
Erwachsene Patienten
Anämie aufgrund von Hämolyse ist die bedeutendste Toxizität der Ribavirin-Therapie. Anämie (Hämoglobin unter 10 g/dl) wurde in klinischen Studien bei 13 % aller mit COPEGUS und PEGASYS in Kombination behandelten Patienten beobachtet. Der maximale Abfall des Hämoglobins trat während der ersten 8 Wochen nach Beginn der Ribavirin-Therapie auf [siehe DOSIERUNG UND ANWENDUNG ].
Pädiatrische Patienten
Abnahmen von Hämoglobin, Neutrophilen und Blutplättchen können eine Dosisreduktion oder ein dauerhaftes Absetzen der Behandlung erforderlich machen [siehe DOSIERUNG UND ANWENDUNG ]. Die meisten Laboranomalien, die während der klinischen Studie festgestellt wurden, kehrten kurz nach Absetzen der Behandlung auf die Ausgangswerte zurück.
Bei Patienten, die für die Kombinationstherapie randomisiert wurden, stieg die Inzidenz von Anomalien während der gesamten Behandlungsphase (bis zu 48 Wochen plus 24 Wochen Nachbeobachtung) im Vergleich zu den ersten 24 Wochen für Neutrophile zwischen 500 und 1.000 Zellen/mm³ und Hämoglobinwerten dazwischen leicht an 8,5 und 10 g/dl. Die Mehrzahl der hämatologischen Anomalien trat in den ersten 24 Behandlungswochen auf.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung der PEGASYS/COPEGUS 100 mg-Kombinationstherapie nach der Zulassung festgestellt und berichtet. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Erkrankungen des Blutes und des Lymphsystems
Aplasie der reinen Erythrozyten
Erkrankungen des Ohrs und des Labyrinths
Schwerhörigkeit, Hörverlust
Augenerkrankungen
Seröse Netzhautablösung
Immunerkrankungen
Abstoßung von Leber- und Nierentransplantaten
Stoffwechsel- und Ernährungsstörungen
Austrocknung
Erkrankungen der Haut und des Unterhautgewebes
Stevens-Johnson-Syndrom (SJS)
Toxische epidermale Nekrolyse (TEN)
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Die Ergebnisse einer pharmakokinetischen Teilstudie zeigten keine pharmakokinetische Wechselwirkung zwischen PEGASYS (Peginterferon alfa-2a) und Ribavirin.
Nukleosidische Reverse-Transkriptase-Inhibitoren (NRTIs)
In-vitro-Daten weisen darauf hin, dass Ribavirin die Phosphorylierung von Lamivudin, Stavudin und Zidovudin reduziert. Es wurden jedoch keine pharmakokinetischen (z. B. Plasmakonzentrationen oder Konzentrationen von intrazellulären triphosphorylierten aktiven Metaboliten) oder pharmakodynamischen (z. B. Verlust der virologischen HIV/HCV-Suppression) Wechselwirkungen beobachtet, wenn Ribavirin und Lamivudin (n = 18), Stavudin (n = 10) oder Zidovudin (n = 6) wurden gleichzeitig als Teil einer Kombinationstherapie mit HCV/HIV-koinfizierten Patienten verabreicht.
In Studie NR15961 wurden bei CHC/HIV-koinfizierten Zirrhosepatienten, die NRTIs erhielten, Fälle von Leberdekompensation (einige mit tödlichem Ausgang) beobachtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Patienten, die PEGASYS/COPEGUS 100 mg und NRTIs erhalten, sollten engmaschig auf behandlungsassoziierte Toxizitäten überwacht werden. Ärzte sollten sich auf die Verschreibungsinformationen der jeweiligen NRTIs beziehen, um eine Anleitung zum Toxizitätsmanagement zu erhalten. Darüber hinaus sollte auch eine Dosisreduktion oder das Absetzen von PEGASYS, COPEGUS 100 mg oder beiden in Betracht gezogen werden, wenn eine Verschlechterung der Toxizität beobachtet wird, einschließlich hepatischer Dekompensation (z. B. Child-Pugh größer oder gleich 6) [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und DOSIERUNG UND ANWENDUNG ].
Didanosin
Die gleichzeitige Anwendung von COPEGUS und Didanosin ist kontraindiziert. Die Konzentrationen von Didanosin oder seinem aktiven Metaboliten (Dideoxyadenosin-5'-triphosphat) sind erhöht, wenn Didanosin zusammen mit Ribavirin verabreicht wird, was klinische Toxizitäten verursachen oder verschlimmern könnte. In klinischen Studien wurde über Fälle von tödlichem Leberversagen sowie peripherer Neuropathie, Pankreatitis und symptomatischer Hyperlaktatämie/Laktazidose berichtet [siehe KONTRAINDIKATIONEN ].
Zidovudin
In Studie NR15961 entwickelten Patienten, denen Zidovudin in Kombination mit PEGASYS/COPEGUS verabreicht wurde, häufiger schwere Neutropenie (ANC unter 500) und schwere Anämie (Hämoglobin unter 8 g/dl) als vergleichbare Patienten, die kein Zidovudin erhielten (Neutropenie 15 % vs. 9 %) (Anämie 5 % vs. 1 %). Das Absetzen von Zidovudin sollte als medizinisch angemessen angesehen werden.
Medikamente, die durch Cytochrom P450 metabolisiert werden
In-vitro-Studien weisen darauf hin, dass Ribavirin CYP 2C9, CYP 2C19, CYP 2D6 oder CYP 3A4 nicht hemmt.
Azathioprin
Es wurde berichtet, dass die Anwendung von Ribavirin zur Behandlung der chronischen Hepatitis C bei Patienten, die Azathioprin erhalten, eine schwere Panzytopenie hervorruft und das Risiko einer Azathioprin-bedingten Myelotoxizität erhöhen kann. Inosinmonophosphatdehydrogenase (IMDH) wird für einen der Stoffwechselwege von Azathioprin benötigt. Es ist bekannt, dass Ribavirin IMDH hemmt, was zur Akkumulation eines Azathioprin-Metaboliten, 6-Methylthioinosinmonophosphat (6-MTITP), führt, der mit Myelotoxizität (Neutropenie, Thrombozytopenie und Anämie) assoziiert ist. Bei Patienten, die Azathioprin mit Ribavirin erhalten, sollte ein vollständiges Blutbild, einschließlich Thrombozytenzahl, im ersten Monat wöchentlich, im zweiten und dritten Behandlungsmonat zweimal monatlich, dann monatlich oder häufiger, wenn Dosis- oder andere Therapieänderungen erforderlich sind, kontrolliert werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Zu den signifikanten Nebenwirkungen im Zusammenhang mit der COPEGUS/PEGASYS-Kombinationstherapie gehören schwere Depressionen und Suizidgedanken, hämolytische Anämie, Unterdrückung der Knochenmarkfunktion, Autoimmun- und Infektionserkrankungen, Augenerkrankungen, zerebrovaskuläre Erkrankungen, Lungenfunktionsstörungen, Colitis, Pankreatitis und Diabetes.
Die Packungsbeilage von PEGASYS sollte vor Beginn einer Kombinationsbehandlung vollständig auf zusätzliche Sicherheitsinformationen überprüft werden.
Schwangerschaft
COPEGUS 100 mg kann Geburtsfehler und/oder den Tod des exponierten Fötus verursachen. Ribavirin hat bei allen Tierarten, bei denen entsprechende Studien durchgeführt wurden, signifikante teratogene und/oder embryozide Wirkungen gezeigt. Diese Wirkungen traten bereits bei Dosen von nur einem Zwanzigstel der für den Menschen empfohlenen Ribavirin-Dosis auf.
Mit der COPEGUS-Therapie sollte nicht begonnen werden, es sei denn, unmittelbar vor dem geplanten Therapiebeginn wurde ein Bericht über einen negativen Schwangerschaftstest eingeholt. Es muss äußerste Sorgfalt darauf verwendet werden, eine Schwangerschaft bei weiblichen Patienten und bei weiblichen Partnern von männlichen Patienten zu vermeiden. Die Patientinnen sollten angewiesen werden, während der Behandlung und für 6 Monate nach Beendigung der Behandlung mindestens zwei Formen wirksamer Empfängnisverhütung anzuwenden. Schwangerschaftstests sollten monatlich während der Therapie mit COPEGUS 100 mg und für 6 Monate nach Beendigung der Therapie durchgeführt werden [siehe Eingerahmte Warnung , KONTRAINDIKATIONEN , Verwendung in bestimmten Populationen , und INFORMATIONEN ZUM PATIENTEN ].
Anämie
Die primäre Toxizität von Ribavirin ist die hämolytische Anämie, die in klinischen Studien bei etwa 13 % aller mit COPEGUS/PEGASYS behandelten Patienten beobachtet wurde. Anämie im Zusammenhang mit COPEGUS 100 mg tritt innerhalb von 1 bis 2 Wochen nach Beginn der Therapie auf. Da der anfängliche Abfall des Hämoglobins signifikant sein kann, wird empfohlen, Hämoglobin oder Hämatokrit vor der Behandlung und in Woche 2 und Woche 4 der Therapie oder häufiger, wenn klinisch indiziert, zu erhalten. Die Patienten sollten dann wie klinisch angemessen überwacht werden. Vorsicht ist geboten bei der Einleitung der Behandlung bei jedem Patienten mit Ausgangsrisiko einer schweren Anämie (z. B. Sphärozytose, Magen-Darm-Blutungen in der Anamnese) [siehe DOSIERUNG UND ANWENDUNG ].
Bei Patienten mit durch COPEGUS verursachter Anämie wurde über tödliche und nicht tödliche Myokardinfarkte berichtet. Die Patienten sollten vor Beginn der Ribavirin-Therapie auf zugrunde liegende Herzerkrankungen untersucht werden. Bei Patienten mit vorbestehender Herzerkrankung sollten vor der Behandlung Elektrokardiogramme erstellt und während der Therapie angemessen überwacht werden. Wenn sich der kardiovaskuläre Zustand verschlechtert, sollte die Therapie ausgesetzt oder abgebrochen werden [siehe DOSIERUNG UND ANWENDUNG ]. Da eine Herzerkrankung durch eine arzneimittelinduzierte Anämie verschlimmert werden kann, sollten Patienten mit einer signifikanten oder instabilen Herzerkrankung in der Vorgeschichte COPEGUS nicht anwenden [siehe Eingerahmte Warnung und DOSIERUNG UND ANWENDUNG ].
Leberversagen
Bei Patienten mit chronischer Hepatitis C (CHC) und Zirrhose besteht möglicherweise das Risiko einer hepatischen Dekompensation und des Todes, wenn sie mit alpha-Interferonen, einschließlich PEGASYS, behandelt werden. CHC-Patienten mit Zirrhose und HIV-Koinfektion, die eine hochaktive antiretrovirale Therapie (HAART) und Interferon alfa-2a mit oder ohne Ribavirin erhalten, scheinen im Vergleich zu Patienten, die keine HAART erhalten, ein erhöhtes Risiko für die Entwicklung einer Leberdekompensation zu haben. In Studie NR15961 [vgl Klinische Studien entwickelten unter 129 Patienten mit CHC/HIV-Zirrhose, die HAART erhielten, 14 (11 %) dieser Patienten in allen Behandlungsarmen eine hepatische Dekompensation, die zu 6 Todesfällen führte. Alle 14 Patienten waren auf NRTIs, einschließlich Stavudin, Didanosin, Abacavir, Zidovudin und Lamivudin. Diese kleine Patientenzahl erlaubt keine Unterscheidung zwischen spezifischen NRTIs oder dem damit verbundenen Risiko. Während der Behandlung sollten der klinische Zustand und die Leberfunktion der Patienten engmaschig auf Anzeichen und Symptome einer Leberdekompensation überwacht werden. Die Behandlung mit PEGASYS/COPEGUS 100 mg sollte bei Patienten mit Leberdekompensation sofort abgebrochen werden [siehe KONTRAINDIKATIONEN ].
Überempfindlichkeit
Während der Therapie mit Alpha-Interferon und Ribavirin wurden schwere akute Überempfindlichkeitsreaktionen (z. B. Urtikaria, Angioödem, Bronchokonstriktion und Anaphylaxie) beobachtet. Wenn eine solche Reaktion auftritt, sollte die Therapie mit PEGASYS und COPEGUS 100 mg sofort abgebrochen und eine geeignete medizinische Therapie eingeleitet werden. Schwerwiegende Hautreaktionen einschließlich vesikulobullöse Eruptionen, Reaktionen im Spektrum des Stevens-Johnson-Syndroms (Erythema multiforme major) mit Haut- und Schleimhautbeteiligung in unterschiedlichem Ausmaß und exfoliative Dermatitis (Erythrodermie) wurden bei Patienten berichtet, die PEGASYS mit und ohne Ribavirin erhielten. Patienten, die Anzeichen oder Symptome schwerer Hautreaktionen entwickeln, müssen die Therapie abbrechen [siehe NEBENWIRKUNGEN ].
Lungenerkrankungen
Dyspnoe, Lungeninfiltrate, Pneumonitis, pulmonale Hypertonie und Pneumonie wurden während der Therapie mit Ribavirin und Interferon berichtet. Gelegentliche Fälle von tödlicher Lungenentzündung sind aufgetreten. Darüber hinaus wurde über Sarkoidose oder die Exazerbation einer Sarkoidose berichtet. Bei Anzeichen von Lungeninfiltraten oder einer Beeinträchtigung der Lungenfunktion sollten die Patienten engmaschig überwacht und gegebenenfalls die COPEGUS/PEGASYS-Kombinationsbehandlung abgebrochen werden.
Knochenmarksunterdrückung
In der Literatur wurde über das Auftreten von Panzytopenie (deutliche Abnahme der Erythrozyten, Neutrophilen und Blutplättchen) und Knochenmarksuppression innerhalb von 3 bis 7 Wochen nach gleichzeitiger Verabreichung von pegyliertem Interferon/Ribavirin und Azathioprin berichtet. Bei dieser begrenzten Anzahl von Patienten (n = 8) war die Myelotoxizität innerhalb von 4 bis 6 Wochen nach Absetzen sowohl der antiviralen HCV-Therapie als auch der begleitenden Azathioprin-Therapie reversibel und trat bei Wiederaufnahme einer der beiden Behandlungen allein nicht wieder auf. PEGASYS, COPEGUS 100 mg und Azathioprin sollten bei Panzytopenie abgesetzt werden, und pegyliertes Interferon/Ribavirin sollte nicht zusammen mit Azathioprin wieder eingeführt werden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Pankreatitis
Die COPEGUS- und PEGASYS-Therapie sollte bei Patienten mit Anzeichen und Symptomen einer Pankreatitis ausgesetzt und bei Patienten mit bestätigter Pankreatitis abgesetzt werden.
Auswirkungen auf das Wachstum bei pädiatrischen Patienten
Während einer bis zu 48-wöchigen Kombinationstherapie mit PEGASYS plus Ribavirin wurde bei Kindern und Jugendlichen im Alter von 5 bis 17 Jahren eine Wachstumshemmung beobachtet. Im Vergleich zum Ausgangswert wurde eine Abnahme des Alters-Z-Scores des Gewichts und der Alters-Z-Scores der Körpergröße bis zu 48 Wochen Therapie beobachtet. 2 Jahre nach der Behandlung lagen 16 % der pädiatrischen Probanden mehr als 15 Perzentile unter ihrer Ausgangsgewichtskurve und 11 % lagen mehr als 15 Perzentile unter ihrer Ausgangsgrößenkurve.
Die verfügbaren längerfristigen Daten zu Patienten, die bis zu 6 Jahre nach der Behandlung nachbeobachtet wurden, sind zu begrenzt, um das Risiko einer reduzierten Erwachsenengröße bei einigen Patienten zu bestimmen [siehe Klinische Studienerfahrung ].
Labortests
Vor Beginn der PEGASYS/COPEGUS-Kombinationstherapie werden bei allen Patienten standardmäßige hämatologische und biochemische Labortests empfohlen. Bei Frauen im gebärfähigen Alter muss ein Schwangerschaftsscreening durchgeführt werden. Bei Patienten mit vorbestehenden Herzfehlern sollte vor der Behandlung mit PEGASYS/COPEGUS ein Elektrokardiogramm erstellt werden.
Nach Beginn der Therapie sollten hämatologische Tests nach 2 Wochen und 4 Wochen und biochemische Tests nach 4 Wochen durchgeführt werden. Zusätzliche Tests sollten regelmäßig während der Therapie durchgeführt werden. In klinischen Studien mit Erwachsenen wurden das große Blutbild (einschließlich Hämoglobinspiegel und Anzahl weißer Blutkörperchen und Blutplättchen) und chemische Werte (einschließlich Leberfunktionstests und Harnsäure) nach 1, 2, 4, 6 und 8 Wochen und dann alle 4 bis 7 Wochen gemessen 6 Wochen oder häufiger, wenn Anomalien festgestellt wurden. In der pädiatrischen klinischen Studie wurden hämatologische und chemische Untersuchungen nach 1, 3, 5 und 8 Wochen und dann alle 4 Wochen durchgeführt. Das Schilddrüsen-stimulierende Hormon (TSH) wurde alle 12 Wochen gemessen. Monatliche Schwangerschaftstests sollten während der Kombinationstherapie und für 6 Monate nach Beendigung der Therapie durchgeführt werden.
Die für die klinischen Studien mit COPEGUS 100 mg und PEGASYS verwendeten Eingangskriterien können als Richtlinie für akzeptable Ausgangswerte für den Behandlungsbeginn angesehen werden:
Informationen zur Patientenberatung
Schwangerschaft
Die Patienten müssen darüber informiert werden, dass Ribavirin Geburtsfehler und/oder den Tod des exponierten Fötus verursachen kann. Die COPEGUS 100 mg-Therapie darf nicht von schwangeren Frauen oder von Männern mit schwangeren Partnerinnen angewendet werden. Es muss äußerste Sorgfalt darauf verwendet werden, eine Schwangerschaft bei weiblichen Patienten und weiblichen Partnern von männlichen Patienten, die eine COPEGUS-Therapie erhalten, und für 6 Monate nach der Therapie zu vermeiden. Patientinnen sollten während der COPEGUS-Therapie und für 6 Monate nach der Therapie zwei zuverlässige Verhütungsmethoden anwenden. Die COPEGUS-Therapie sollte nicht begonnen werden, bis unmittelbar vor Beginn der Therapie ein Bericht über einen negativen Schwangerschaftstest vorliegt. Die Patientinnen müssen während der Therapie und für 6 Monate nach der Therapie monatlich einen Schwangerschaftstest durchführen.
Weibliche Patienten im gebärfähigen Alter und männliche Patienten mit Partnerinnen im gebärfähigen Alter müssen auf die teratogenen/embryoziden Risiken hingewiesen und angewiesen werden, während der COPEGUS-Therapie und für 6 Monate nach der Therapie eine wirksame Verhütungsmethode anzuwenden. Patientinnen sollte geraten werden, im Falle einer Schwangerschaft unverzüglich den Arzt zu benachrichtigen [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Anämie
Die häufigste Nebenwirkung im Zusammenhang mit Ribavirin ist Anämie, die schwerwiegend sein kann [siehe Eingerahmte Warnung , WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ]. Die Patienten sollten darauf hingewiesen werden, dass vor Beginn der COPEGUS-Therapie und danach in regelmäßigen Abständen Laboruntersuchungen erforderlich sind [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Es wird empfohlen, dass die Patienten gut hydriert sind, insbesondere während der Anfangsphase der Behandlung.
Patienten, die Schwindel, Verwirrtheit, Schläfrigkeit und Müdigkeit entwickeln, sollten davor gewarnt werden, ein Fahrzeug zu führen oder Maschinen zu bedienen.
Den Patienten sollte geraten werden, COPEGUS 100 mg zusammen mit einer Mahlzeit einzunehmen.
Die Patienten sollten vor Beginn der Behandlung mit COPEGUS/PEGASYS über Drogenmissbrauch in der Vorgeschichte befragt werden, da bei Patienten, die mit Interferonen behandelt wurden, über Rückfälle der Drogenabhängigkeit und Arzneimittelüberdosierungen berichtet wurde.
Den Patienten sollte geraten werden, keinen Alkohol zu trinken, da Alkohol eine chronische Hepatitis-C-Infektion verschlimmern kann.
Die Patienten sollten darüber informiert werden, was zu tun ist, falls sie eine Dosis COPEGUS vergessen. Die vergessene Dosis sollte so schnell wie möglich noch am selben Tag eingenommen werden. Patienten sollten die nächste Dosis nicht verdoppeln. Patienten sollten angewiesen werden, bei Fragen ihren Arzt anzurufen.
Die Patienten sollten darüber aufgeklärt werden, dass die Wirkung der PEGASYS/COPEGUS-Behandlung einer Hepatitis-C-Infektion auf die Übertragung nicht bekannt ist und dass geeignete Vorsichtsmaßnahmen getroffen werden sollten, um eine Übertragung des Hepatitis-C-Virus während der Behandlung oder im Falle eines Therapieversagens zu verhindern.
Die Patienten sollten über die potenziellen Vorteile und Risiken im Zusammenhang mit der Anwendung von COPEGUS aufgeklärt werden. Es sollten Anweisungen zur angemessenen Verwendung gegeben werden, einschließlich einer Überprüfung des Inhalts der Beilage ARZNEIMITTEL-LEITFADEN , die keine Offenlegung aller oder möglicher Nebenwirkungen darstellt.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
In einer p53 (+/-) Karzinogenitätsstudie an Mäusen war Ribavirin bis zur maximal tolerierten Dosis von 100 mg/kg/Tag nicht onkogen. Ribavirin war auch in einer 2-Jahres-Karzinogenitätsstudie an Ratten in Dosen bis zur maximal tolerierten Dosis von 60 mg/kg/Tag nicht onkogen. Auf Basis der Körperoberfläche entsprechen diese Dosen etwa dem 0,5- bzw. 0,6-Fachen der maximal empfohlenen Tagesdosis von Ribavirin für den Menschen.
Mutagenese
Ribavirin zeigte im In-vitro-Maus-Lymphom-Assay mutagene Aktivität. In einem In-vivo-Maus-Mikronukleus-Assay wurde bei Dosen bis zu 2000 mg/kg keine klastogene Aktivität beobachtet. Ergebnisse aus in der Literatur veröffentlichten Studien zeigen jedoch eine klastogene Aktivität im In-vivo-Maus-Mikronukleus-Assay bei oralen Dosen von bis zu 2000 mg/kg. Ein Dominant-Letal-Assay bei Ratten war negativ, was darauf hinweist, dass Mutationen, die bei Ratten auftraten, nicht durch männliche Gameten übertragen wurden.
Beeinträchtigung der Fruchtbarkeit
In einer Fertilitätsstudie an Ratten zeigte Ribavirin eine geringfügige Verringerung der Spermienzahl bei einer Dosis von 100 mg/kg/Tag ohne Auswirkung auf die Fertilität. Nach Beendigung der Behandlung trat nach 1 Spermatogenesezyklus eine vollständige Genesung ein. Anomalien der Spermien wurden in Studien an Mäusen beobachtet, die darauf abzielten, den zeitlichen Verlauf und die Reversibilität der durch Ribavirin induzierten Hodendegeneration bei verabreichten Dosen von 15 bis 150 mg/kg/Tag (etwa das 0,1- bis 0,8-Fache der maximal empfohlenen Tagesdosis von Ribavirin für den Menschen) zu bewerten für 3 bis 6 Monate. Nach Beendigung der Behandlung war innerhalb von 1 oder 2 Spermatogenesezyklen im Wesentlichen eine vollständige Genesung von der Ribavirin-induzierten testikulären Toxizität erkennbar.
Weibliche Patienten im gebärfähigen Alter und männliche Patienten mit gebärfähigen Partnerinnen sollten COPEGUS nicht erhalten, es sei denn, der Patient und sein Partner wenden eine wirksame Empfängnisverhütung an (zwei zuverlässige Formen). Basierend auf einer Mehrfachdosis-Halbwertszeit (t½) von Ribavirin von 12 Tagen muss eine wirksame Empfängnisverhütung für 6 Monate nach der Therapie angewendet werden (dh 15 Halbwertszeiten der Clearance für Ribavirin).
Es wurden keine reproduktionstoxikologischen Studien mit PEGASYS in Kombination mit COPEGUS durchgeführt. Peginterferon alfa-2a und Ribavirin haben jedoch bei separater Verabreichung jeweils nachteilige Auswirkungen auf die Fortpflanzung. Es ist davon auszugehen, dass die Wirkungen der beiden Wirkstoffe allein auch durch die Kombination der beiden Wirkstoffe verursacht würden.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Kategorie X [sehen KONTRAINDIKATIONEN ]. Ribavirin hat bei allen Tierarten, bei denen entsprechende Studien durchgeführt wurden, signifikante embryozide und/oder teratogene Wirkungen hervorgerufen. Fehlbildungen des Schädels, des Gaumens, des Auges, des Kiefers, der Gliedmaßen, des Skeletts und des Gastrointestinaltrakts wurden festgestellt. Die Inzidenz und Schwere teratogener Wirkungen nahmen mit steigender Dosis des Arzneimittels zu. Das Überleben von Föten und Nachkommen war reduziert [vgl KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
In konventionellen Embryotoxizitäts-/Teratogenitätsstudien an Ratten und Kaninchen lagen die beobachteten Dosen ohne Wirkung weit unter denen für die vorgeschlagene klinische Anwendung (0,3 mg/kg/Tag für Ratte und Kaninchen; etwa das 0,06-Fache der empfohlenen Tagesdosis von Ribavirin für den Menschen). . In einer peri-/postnatalen Toxizitätsstudie an Ratten, denen bis zu 1 mg/kg/Tag (etwa das 0,01-Fache der maximal empfohlenen Tagesdosis von Ribavirin für den Menschen) oral verabreicht wurde, wurden keine maternale Toxizität oder Auswirkungen auf die Nachkommen beobachtet.
Behandlung und Nachbehandlung: Potentielles Risiko für den Fötus
Es ist bekannt, dass sich Ribavirin in intrazellulären Komponenten anreichert, aus denen es sehr langsam ausgeschieden wird. Es ist nicht bekannt, ob Ribavirin in Spermien enthalten ist und, wenn ja, eine potentielle teratogene Wirkung auf die Befruchtung der Eizellen ausüben wird. Aufgrund der möglichen humanteratogenen Wirkungen von Ribavirin sollten männliche Patienten jedoch angewiesen werden, alle Vorsichtsmaßnahmen zu treffen, um das Risiko einer Schwangerschaft für ihre Partnerinnen zu vermeiden.
COPEGUS sollte nicht von schwangeren Frauen oder Männern mit schwangeren Partnerinnen angewendet werden. Weibliche Patienten im gebärfähigen Alter und männliche Patienten mit Partnerinnen im gebärfähigen Alter sollten COPEGUS nicht erhalten, es sei denn, der Patient und sein Partner wenden während der Therapie und für 6 Monate nach der Therapie eine wirksame Empfängnisverhütung (zwei zuverlässige Formen) an [siehe KONTRAINDIKATIONEN ].
Ribavirin-Schwangerschaftsregister
Ein Ribavirin-Schwangerschaftsregister wurde eingerichtet, um den mütterlich-fötalen Ausgang von Schwangerschaften weiblicher Patienten und weiblicher Partner männlicher Patienten zu überwachen, die während der Behandlung und für 6 Monate nach Beendigung der Behandlung Ribavirin ausgesetzt waren. Gesundheitsdienstleister und Patienten werden ermutigt, solche Fälle telefonisch unter 1-800-593-2214 zu melden.
Stillende Mutter
Es ist nicht bekannt, ob Ribavirin in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch ausgeschieden werden und um mögliche schwerwiegende Nebenwirkungen von Ribavirin beim gestillten Säugling zu vermeiden, sollte je nach Bedeutung der Therapie für die Mutter entschieden werden, entweder das Stillen oder die Therapie mit COPEGUS 100 mg abzubrechen.
Pädiatrische Verwendung
Pharmakokinetische Untersuchungen bei pädiatrischen Patienten wurden nicht durchgeführt.
Die Sicherheit und Wirksamkeit von COPEGUS wurde bei Patienten unter 5 Jahren nicht nachgewiesen.
Geriatrische Verwendung
Klinische Studien mit COPEGUS 100 mg und PEGASYS schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagieren als jüngere Probanden. Spezifische pharmakokinetische Untersuchungen für Ribavirin bei älteren Patienten wurden nicht durchgeführt. Das Risiko toxischer Reaktionen auf dieses Arzneimittel kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Die Dosis von COPEGUS 100 mg sollte bei Patienten mit einer Kreatinin-Clearance von weniger als oder gleich 50 ml/min reduziert werden; und die Dosis von PEGASYS sollte bei Patienten mit einer Kreatinin-Clearance von weniger als 30 ml/min reduziert werden [siehe DOSIERUNG UND ANWENDUNG ; Verwendung in bestimmten Bevölkerungsgruppen ].
Wettrennen
Eine pharmakokinetische Studie mit 42 Probanden zeigte, dass es keinen klinisch signifikanten Unterschied in der Pharmakokinetik von Ribavirin zwischen schwarzen (n=14), hispanischen (n=13) und kaukasischen (n=15) Probanden gibt.
Nierenfunktionsstörung
Die Nierenfunktion sollte bei allen Patienten vor Beginn der Behandlung mit COPEGUS durch Bestimmung der Kreatinin-Clearance des Patienten beurteilt werden.
In einer klinischen Studie wurde die Behandlung mit COPEGUS und PEGASYS bei 50 CHC-Patienten mit mittelschwerer (Kreatinin-Clearance 30 – 50 ml/min) oder schwerer (Kreatinin-Clearance weniger als 30 ml/min) Nierenfunktionsstörung oder terminaler Niereninsuffizienz (ESRD), die eine chronische Hämodialyse erforderten, untersucht (HD). Bei 18 Probanden mit ESRD, die eine chronische Huntington-Krankheit erhielten, wurde COPEGUS in einer Dosis von 200 mg täglich verabreicht, ohne erkennbaren Unterschied im Nebenwirkungsprofil im Vergleich zu Probanden mit normaler Nierenfunktion. Dosisreduktionen und vorübergehende Unterbrechungen von COPEGUS (aufgrund von COPEGUS-bedingten Nebenwirkungen, hauptsächlich Anämie) wurden bei bis zu einem Drittel der Patienten mit ESRD/HD während der Behandlung beobachtet; und nur ein Drittel dieser Probanden erhielt COPEGUS für 48 Wochen. Die Ribavirin-Plasmaexposition war bei Patienten mit ESRD unter HD etwa 20 % niedriger als bei Patienten mit normaler Nierenfunktion, die die tägliche Standarddosis von 1000/1200 mg COPEGUS erhielten.
Patienten mit mäßiger (n = 17) oder schwerer (n = 14) Nierenfunktionsstörung vertrugen aufgrund von COPEGUS-bedingten Nebenwirkungen, hauptsächlich Anämie, eine Tagesdosis von 600 mg bzw. 400 mg COPEGUS nicht und zeigten 20 % bis 30 % höhere Ribavirin-Plasmaexposition (trotz häufiger Dosisanpassungen) im Vergleich zu Probanden mit normaler Nierenfunktion (Kreatinin-Clearance größer als 80 ml/min), die die Standarddosis von COPEGUS erhielten. Die Abbruchraten waren bei Patienten mit schwerer Nierenfunktionsstörung höher als bei Patienten mit mittelschwerer Nierenfunktionsstörung oder normaler Nierenfunktion. Pharmakokinetische Modellierung und Simulation weisen darauf hin, dass eine Dosis von 200 mg täglich bei Patienten mit schwerer Nierenfunktionsstörung und eine Dosis von 200 mg täglich im Wechsel mit 400 mg am folgenden Tag bei Patienten mit mittelschwerer Nierenfunktionsstörung zu einer Plasma-Ribavirin-Exposition ähnlich wie bei Patienten mit normaler Nierenfunktion führt das zugelassene COPEGUS-Regime erhalten. Diese Dosierungen wurden bei Patienten nicht untersucht [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
Basierend auf den pharmakokinetischen und Sicherheitsergebnissen dieser Studie sollten Patienten mit einer Kreatinin-Clearance von weniger als oder gleich 50 ml/min eine reduzierte Dosis von COPEGUS erhalten; und Patienten mit einer Kreatinin-Clearance von weniger als 30 ml/min sollten eine reduzierte PEGASYS-Dosis erhalten. Der klinische und hämatologische Zustand von Patienten mit einer Kreatinin-Clearance von weniger als oder gleich 50 ml/min, die COPEGUS 100 mg erhalten, sollte sorgfältig überwacht werden. Bei Patienten mit klinisch signifikanten Laborwertabweichungen oder Nebenwirkungen, die anhaltend schwerwiegend sind oder sich verschlimmern, sollte die Therapie abgesetzt werden [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE , und PEGASYS-Packungsbeilage ].
Leberfunktionsstörung
Die Auswirkung einer Leberfunktionsstörung auf die Pharmakokinetik von Ribavirin nach Verabreichung von COPEGUS wurde nicht untersucht. Die klinischen Studien mit COPEGUS 100 mg waren auf Patienten mit Child-Pugh-Krankheit der Klasse A beschränkt.
Geschlecht
Zwischen männlichen und weiblichen Probanden wurden keine klinisch signifikanten Unterschiede in der Pharmakokinetik von Ribavirin beobachtet.
Die Pharmakokinetik von Ribavirin ist nach Gewichtskorrektur bei männlichen und weiblichen Patienten ähnlich.
Empfänger von Organtransplantationen
Die Sicherheit und Wirksamkeit der Behandlung mit PEGASYS und COPEGUS 100 mg wurde bei Patienten mit Leber- und anderen Transplantationen nicht nachgewiesen. Wie bei anderen Alpha-Interferonen wurde unter PEGASYS allein oder in Kombination mit COPEGUS über Abstoßungen von Leber- und Nierentransplantaten berichtet [vgl NEBENWIRKUNGEN ].
ÜBERDOSIS
In klinischen Studien wurden keine Fälle von Überdosierung mit COPEGUS berichtet. Hypokalzämie und Hypomagnesiämie wurden bei Personen beobachtet, denen Ribavirin in einer höheren als der empfohlenen Dosis verabreicht wurde. In den meisten dieser Fälle wurde Ribavirin intravenös in Dosierungen verabreicht, die bis zum Vierfachen der empfohlenen maximalen oralen Tagesdosis reichten und in einigen Fällen darüber hinausgingen.
KONTRAINDIKATIONEN
COPEGUS (Ribavirin) ist kontraindiziert bei:
Die Kombinationstherapie aus COPEGUS und PEGASYS ist kontraindiziert bei Patienten mit:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Ribavirin ist ein antivirales Medikament [siehe Mikrobiologie ].
Pharmakokinetik
Für HCV-Patienten, die Ribavirin in Kombination mit Peginterferon alfa-2a erhielten, liegen pharmakokinetische Daten zu Mehrfachdosen von Ribavirin vor. Nach Verabreichung von 1200 mg/Tag mit Nahrung über 12 Wochen betrug der Mittelwert ± Standardabweichung (n = 39; Körpergewicht über 75 kg) die AUC0-12h 25.361 ± 7.110 ng·h/ml und die Cmax 2.748 ± 818 ng/ml. Die durchschnittliche Zeit bis zum Erreichen von Cmax betrug 2 Stunden. Die Plasma-Talspiegel von Ribavirin nach 12-wöchiger Einnahme zusammen mit Nahrung betrugen 1662±545 ng/ml bei HCV-infizierten Patienten, die 800 mg/Tag erhielten (n=89), und 2112±810 ng/ml bei Patienten, die 1200 mg/Tag erhielten ( n=75; Körpergewicht über 75 kg).
Die terminale Halbwertszeit von Ribavirin nach Verabreichung einer oralen Einzeldosis COPEGUS beträgt etwa 120 bis 170 Stunden. Die scheinbare Gesamtclearance nach Gabe einer oralen Einzeldosis von COPEGUS 100 mg beträgt etwa 26 l/h. Nach Mehrfachgabe (zweimal täglich) kommt es zu einer starken Akkumulation von Ribavirin, so dass die Cmax im Steady State viermal höher war als bei einer Einzeldosis.
Wirkung von Nahrung auf die Resorption von Ribavirin
Die Bioverfügbarkeit einer oralen Einzeldosis Ribavirin wurde durch die gleichzeitige Einnahme mit einer fettreichen Mahlzeit erhöht. Die Resorption war verlangsamt (Tmax wurde verdoppelt) und die AUC0-192h und Cmax stiegen um 42 % bzw. 66 %, wenn COPEGUS im Vergleich zu nüchternen Bedingungen mit einer fettreichen Mahlzeit eingenommen wurde [siehe DOSIERUNG UND ANWENDUNG und INFORMATIONEN ZUM PATIENTEN ].
Ausscheidung und Stoffwechsel
Der Beitrag der renalen und hepatischen Wege zur Elimination von Ribavirin nach Verabreichung von COPEGUS 100 mg ist nicht bekannt. In-vitro-Studien weisen darauf hin, dass Ribavirin kein Substrat von CYP450-Enzymen ist.
Nierenfunktionsstörung
In einer klinischen Studie wurden 50 CHC-Patienten mit entweder mäßiger (Kreatinin-Clearance 30 bis 50 ml/min) oder schwerer (Kreatinin-Clearance weniger als 30 ml/min) Nierenfunktionsstörung oder terminaler Niereninsuffizienz (ESRD), die eine chronische Hämodialyse (HD) erforderte, bewertet. Die scheinbare Clearance von Ribavirin war bei Probanden mit einer Kreatinin-Clearance von weniger als oder gleich 50 ml/min, einschließlich Probanden mit ESRD bei HD, verringert und wies etwa 30 % des Werts auf, der bei Probanden mit normaler Nierenfunktion gefunden wurde. Pharmakokinetische Modellierung und Simulation deuten darauf hin, dass eine Dosis von 200 mg täglich bei Patienten mit schwerer Nierenfunktionsstörung und eine Dosis von 200 mg täglich im Wechsel mit 400 mg am folgenden Tag bei Patienten mit mittelschwerer Nierenfunktionsstörung zu Ribavirin-Plasmaspiegeln führt, die denen ähnlich sind, die bei Patienten mit beobachtet wurden normaler Nierenfunktion, die die Standard-Tagesdosis von 1000/1200 mg COPEGUS erhalten. Diese Dosierungen wurden bei Patienten nicht untersucht.
Bei 18 Probanden mit ESRD, die chronische Huntington-Krankheit erhielten, wurde COPEGUS in einer Dosis von 200 mg täglich verabreicht. Die Ribavirin-Plasmaexposition war bei diesen Probanden etwa 20 % niedriger im Vergleich zu Probanden mit normaler Nierenfunktion, die die Standard-Tagesdosis von 1000/1200 mg COPEGUS erhielten [siehe DOSIERUNG UND ANWENDUNG , Verwendung in bestimmten Bevölkerungsgruppen ].
Ribavirin aus Plasma wird durch Hämodialyse mit einem Extraktionsverhältnis von ungefähr 50 % entfernt; Aufgrund des großen Verteilungsvolumens von Ribavirin ist jedoch nicht zu erwarten, dass sich die Plasmaexposition durch die Hämodialyse ändert.
Mikrobiologie
Wirkmechanismus
Der Mechanismus, durch den Ribavirin zu seiner antiviralen Wirksamkeit in der Klinik beiträgt, ist noch nicht vollständig geklärt. Ribavirin hat in Gewebekultur eine direkte antivirale Aktivität gegen viele RNA-Viren. Ribavirin erhöht die Mutationshäufigkeit im Genom mehrerer RNA-Viren und Ribavirintriphosphat hemmt die HCV-Polymerase in einer biochemischen Reaktion.
Antivirale Aktivität in der Zellkultur
Im stabilen HCV-Zellkulturmodellsystem (HCV-Replikon) hemmte Ribavirin die autonome HCV-RNA-Replikation mit einem 50 %-Effektivkonzentrationswert (EC50) von 11–21 mcM. Im selben Modell hemmte PEG-IFN α-2a auch die HCV-RNA-Replikation mit einem EC50-Wert von 0,1–3 ng/ml. Die Kombination von PEG-IFN α-2a und Ribavirin war bei der Hemmung der HCV-RNA-Replikation wirksamer als jedes Mittel allein.
Widerstand
Verschiedene HCV-Genotypen weisen eine beträchtliche klinische Variabilität in ihrer Reaktion auf eine PEG-IFN-α- und Ribavirin-Therapie auf. Virale genetische Determinanten, die mit der variablen Reaktion assoziiert sind, wurden nicht endgültig identifiziert.
Kreuzresistenz
Eine Kreuzresistenz zwischen IFN α und Ribavirin wurde nicht beobachtet.
Tiertoxikologie
In einer Studie an Ratten wurde der Schluss gezogen, dass durch Ribavirin bei Dosen von bis zu 200 mg/kg für 5 Tage (bis zum 1,7-Fachen der maximal empfohlenen Ribavirin-Dosis beim Menschen) keine dominante Letalität induziert wurde.
Langzeitstudien an Mäusen und Ratten (18 bis 24 Monate; Dosis 20 bis 75 bzw. 10 bis 40 mg/kg/Tag, etwa das 0,1- bis 0,4-Fache der maximalen menschlichen Tagesdosis von Ribavirin) haben einen Zusammenhang zwischen gezeigt chronische Ribavirin-Exposition und eine erhöhte Inzidenz von vaskulären Läsionen (Mikroblutungen) bei Mäusen. Bei Ratten trat bei Kontrollen eine Netzhautdegeneration auf, aber die Inzidenz war bei mit Ribavirin behandelten Ratten erhöht.
Klinische Studien
Patienten mit chronischer Hepatitis C
Erwachsene Patienten
Die Sicherheit und Wirksamkeit von PEGASYS in Kombination mit COPEGUS zur Behandlung einer Hepatitis-C-Virusinfektion wurden in zwei randomisierten, kontrollierten klinischen Studien untersucht. Alle Patienten waren Erwachsene, hatten eine kompensierte Lebererkrankung, ein nachweisbares Hepatitis-C-Virus, eine Leberbiopsie-Diagnose einer chronischen Hepatitis und wurden zuvor nicht mit Interferon behandelt. Etwa 20 % der Patienten in beiden Studien hatten eine kompensierte Zirrhose (Child-Pugh-Klasse A). Patienten mit HIV-Koinfektion wurden von diesen Studien ausgeschlossen.
In der Studie NV15801 wurden die Patienten randomisiert und erhielten entweder PEGASYS 180 µg subkutan einmal wöchentlich mit einem oralen Placebo, PEGASYS 180 µg einmal wöchentlich mit COPEGUS 1000 mg zum Einnehmen (Körpergewicht unter 75 kg) oder 1200 mg zum Einnehmen (Körpergewicht über oder gleich 75 kg) oder Interferon alfa-2b 3 Mio. I.E. subkutan dreimal wöchentlich plus Ribavirin 1000 mg oder 1200 mg zum Einnehmen. Alle Patienten erhielten eine 48-wöchige Therapie, gefolgt von einer 24-wöchigen behandlungsfreien Nachbeobachtung. Die Zuweisung der COPEGUS- oder Placebo-Behandlung erfolgte verblindet. Anhaltendes virologisches Ansprechen wurde definiert als nicht nachweisbare (weniger als 50 IE/ml) HCV-RNA in oder nach Studienwoche 68. PEGASYS in Kombination mit COPEGUS 100 mg führte zu einem höheren SVR im Vergleich zu PEGASYS allein oder Interferon alfa-2b und Ribavirin (Tabelle 9). . In allen Behandlungsarmen hatten Patienten mit viralem Genotyp 1, unabhängig von der Viruslast, eine geringere Ansprechrate auf PEGASYS in Kombination mit COPEGUS 100 mg im Vergleich zu Patienten mit anderen viralen Genotypen.
Der Unterschied im Gesamtansprechen auf die Behandlung (PEGASYS/COPEGUS – Interferon alfa-2b/Ribavirin) betrug 9 % (95 % KI 2,3, 15,3).
In der Studie NV15942 erhielten alle Patienten PEGASYS 180 µg subkutan einmal wöchentlich und wurden randomisiert einer Behandlung für entweder 24 oder 48 Wochen und einer COPEGUS-Dosis von entweder 800 mg oder 1000 mg/1200 mg (bei einem Körpergewicht von weniger als 75 kg/mehr als oder gleich 75 kg). Die Zuordnung zu den vier Behandlungsarmen erfolgte stratifiziert nach viralem Genotyp und HCV-Virustiter zu Studienbeginn. Patienten mit Genotyp 1 und hohem Virustiter (definiert als mehr als 2 x 106 HCV-RNA-Kopien/ml Serum) wurden vorzugsweise einer 48-wöchigen Behandlung zugewiesen.
Anhaltende virologische Reaktion (SVR) und HCV-Genotyp
HCV 1 und 4 — Unabhängig vom Virustiter zu Studienbeginn führte die 48-wöchige Behandlung mit PEGASYS und 1000 mg oder 1200 mg COPEGUS zu einem höheren SVR (definiert als nicht nachweisbare HCV-RNA am Ende der 24-wöchigen behandlungsfreien Nachbeobachtungszeit) im Vergleich zu einer kürzeren Behandlung (24 Wochen) und/oder 800 mg COPEGUS.
HCV 2 und 3 — Unabhängig vom Virustiter zu Studienbeginn führte die 24-wöchige Behandlung mit PEGASYS und 800 mg COPEGUS zu einer ähnlichen SVR im Vergleich zu einer längeren Behandlung (48 Wochen) und/oder 1000 mg oder 1200 mg COPEGUS (siehe Tabelle 10).
Die Zahl der Patienten mit Genotyp 5 und 6 war zu gering, um eine aussagekräftige Bewertung zu ermöglichen.
Pädiatrische Patienten
Zuvor unbehandelte pädiatrische Patienten im Alter von 5 bis 17 Jahren (55 % unter 12 Jahren) mit chronischer Hepatitis C, kompensierter Lebererkrankung und nachweisbarer HCV-RNA wurden mit COPEGUS 100 mg, etwa 15 mg/kg/Tag, plus PEGASYS 180 µg/1,73 m² behandelt x Körperoberfläche einmal wöchentlich für 48 Wochen. Alle Probanden wurden 24 Wochen nach der Behandlung beobachtet. Anhaltendes virologisches Ansprechen (SVR) war definiert als nicht nachweisbare (weniger als 50 IE/ml) HCV-RNA in oder nach Studienwoche 68. Insgesamt 114 Patienten wurden randomisiert, um entweder eine Kombinationsbehandlung aus COPEGUS plus PEGASYS oder eine PEGASYS-Monotherapie zu erhalten; Patienten, bei denen die PEGASYS-Monotherapie nach 24 Wochen oder später fehlschlug, konnten COPEGUS plus PEGASYS offen erhalten. Die anfänglich randomisierten Arme wurden hinsichtlich demografischer Faktoren ausbalanciert; 55 Patienten erhielten eine anfängliche Kombinationsbehandlung mit COPEGUS 100 mg plus PEGASYS und 59 erhielten PEGASYS plus Placebo; in der gesamten Intent-to-Treat-Population waren 45 % weiblich, 80 % Kaukasier und 81 % waren mit HCV-Genotyp 1 infiziert. Die SVR-Ergebnisse sind in Tabelle 11 zusammengefasst.
Andere Prädiktoren für das Ansprechen auf die Behandlung
Die Ansprechraten auf die Behandlung sind niedriger bei Patienten mit schlechten Prognosefaktoren, die eine Therapie mit pegyliertem Interferon alpha erhalten. In den Studien NV15801 und NV15942 waren die Ansprechraten auf die Behandlung niedriger bei Patienten über 40 Jahren (50 % vs. 66 %), bei Patienten mit Zirrhose (47 % vs. 59 %), bei Patienten mit einem Körpergewicht über 85 kg (49 % vs. 60 %) und bei Patienten mit Genotyp 1 mit hoher vs. niedriger Viruslast (43 % vs. 56 %). Afroamerikanische Patienten hatten im Vergleich zu Kaukasiern niedrigere Ansprechraten.
In den Studien NV15801 und NV15942 war das Fehlen eines frühen virologischen Ansprechens nach 12 Wochen (definiert als HCV-RNA nicht nachweisbar oder mehr als 2 log10 niedriger als der Ausgangswert) ein Grund für den Abbruch der Behandlung. Von den Patienten, die nach 12 Wochen keine frühe virale Reaktion zeigten und einen empfohlenen Therapieverlauf trotz einer im Protokoll definierten Option zum Absetzen der Therapie abschlossen, erreichten 5/39 (13 %) eine SVR. Von den Patienten, denen nach 24 Wochen eine frühe virale Reaktion fehlte, schlossen 19 einen vollständigen Therapiezyklus ab und keiner erreichte eine SVR.
Patienten mit chronischer Hepatitis C/HIV-Koinfektion
In der Studie NR15961 wurden Patienten mit CHC/HIV randomisiert und erhielten entweder PEGASYS 180 µg subkutan einmal wöchentlich plus ein orales Placebo, PEGASYS 180 µg einmal wöchentlich plus COPEGUS 800 mg oral täglich oder Interferon alfa-2a, 3 Mio. I.E. subkutan dreimal wöchentlich plus COPEGUS 800 mg täglich zum Einnehmen. Alle Patienten erhielten eine 48-wöchige Therapie, und das anhaltende virologische Ansprechen (SVR) wurde nach 24 Wochen behandlungsfreier Nachbeobachtung beurteilt. COPEGUS 100 mg oder Placebo-Behandlungszuordnung war in den PEGASYS-Behandlungsarmen verblindet. Alle Patienten waren Erwachsene, hatten eine kompensierte Lebererkrankung, ein nachweisbares Hepatitis-C-Virus, eine Leberbiopsie-Diagnose einer chronischen Hepatitis C und wurden zuvor nicht mit Interferon behandelt. Die Patienten hatten auch eine CD4+-Zellzahl von mindestens 200 Zellen/mm³ oder eine CD4+-Zellzahl von mindestens 100 Zellen/mm³, aber weniger als 200 Zellen/mm³ und eine HIV-1-RNA von weniger als 5000 Kopien/ml und einen stabilen Status von HIV. Ungefähr 15 % der Patienten in der Studie hatten Zirrhose. Die Ergebnisse sind in Tabelle 12 gezeigt.
Die Ansprechraten auf die Behandlung waren bei CHC/HIV-Patienten mit schlechten Prognosefaktoren (einschließlich HCV-Genotyp 1, HCV-RNA größer als 800.000 IE/ml und Zirrhose), die eine Therapie mit pegyliertem Interferon alpha erhielten, niedriger.
Von den Patienten, die nach 12-wöchiger Kombinationstherapie aus PEGASYS und COPEGUS weder eine nicht nachweisbare HCV-RNA noch eine Verringerung des HCV-RNA-Titers um mindestens 2 log10 gegenüber dem Ausgangswert aufwiesen, erreichten 2 % (2/85) eine SVR.
Bei CHC-Patienten mit HIV-Koinfektion, die 48 Wochen lang PEGASYS allein oder in Kombination mit COPEGUS 100 mg erhielten, stiegen die mittleren und medianen HIV-RNA-Titer während der Behandlung oder 24 Wochen nach der Behandlung nicht über den Ausgangswert an.
INFORMATIONEN ZUM PATIENTEN
COPEGUS® (Co-PEG-UHS) (Ribavirin) Tabletten
Lesen Sie diesen Arzneimittelleitfaden sorgfältig durch, bevor Sie mit der Einnahme von COPEGUS 100 mg beginnen, und lesen Sie den Arzneimittelleitfaden jedes Mal, wenn Sie mehr COPEGUS erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung.
Lesen Sie auch den Medikationsleitfaden für PEGASYS (Peginterferon alfa-2a).
Was sind die wichtigsten Informationen, die ich über COPEGUS wissen sollte?
Was ist COPEGUS 100 mg?
COPEGUS 100 mg ist ein verschreibungspflichtiges Arzneimittel, das zusammen mit einem anderen Arzneimittel namens PEGASYS (Peginterferon alfa-2a) zur Behandlung einer chronischen (langfristigen) Hepatitis-C-Infektion bei Personen ab 5 Jahren angewendet wird, deren Leber noch normal funktioniert und die zuvor noch nicht behandelt wurden ein Medikament namens Interferon alpha. Es ist nicht bekannt, ob COPEGUS sicher ist und bei Kindern unter 5 Jahren wirkt.
Wer sollte COPEGUS 100 mg nicht einnehmen?
Sehen „Was sind die wichtigsten Informationen, die ich über COPEGUS 100 mg wissen sollte?“
Nehmen Sie COPEGUS nicht ein, wenn Sie:
Sprechen Sie mit Ihrem Arzt, bevor Sie mit der Behandlung mit COPEGUS 100 mg beginnen, wenn Sie an einer dieser Erkrankungen leiden.
Was sollte ich meinem Arzt vor der Einnahme von COPEGUS 100 mg mitteilen?
Informieren Sie vor der Einnahme von COPEGUS Ihren Arzt, wenn Sie Folgendes haben oder hatten:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen. Einige Arzneimittel können schwerwiegende Nebenwirkungen haben, wenn sie gleichzeitig mit COPEGUS eingenommen werden. Einige Arzneimittel können die Wirkung von COPEGUS 100 mg beeinflussen oder COPEGUS 100 mg kann die Wirkung Ihrer anderen Arzneimittel beeinflussen.
Informieren Sie Ihren Arzt insbesondere, wenn Sie Arzneimittel zur Behandlung von HIV einnehmen, einschließlich Didanosin (Videx oder Videx EC), oder wenn Sie Azathioprin (Imuran oder Azasan) einnehmen.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste davon, um sie Ihrem Arzt oder Apotheker zu zeigen, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich COPEGUS 100 mg einnehmen?
Was sollte ich während der Einnahme von COPEGUS vermeiden?
COPEGUS 100 mg kann Müdigkeit, Schwindel oder Verwirrtheit hervorrufen. Sie sollten kein Fahrzeug führen oder Maschinen bedienen, wenn Sie eines dieser Symptome haben.
Trinke keinen Alkohol, einschließlich Bier, Wein und Spirituosen. Dies kann Ihre Lebererkrankung verschlimmern.
Welche Nebenwirkungen kann COPEGUS haben?
COPEGUS 100 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Siehe „Was sind die wichtigsten Informationen, die ich über COPEGUS 100 mg wissen sollte?“
Rufen Sie Ihren Arzt an oder holen Sie sich sofort medizinische Hilfe, wenn Sie eines der oben aufgeführten Symptome haben. Dies können Anzeichen einer schwerwiegenden Nebenwirkung der Behandlung mit COPEGUS 100 mg sein.
Zu den häufigen Nebenwirkungen von COPEGUS, die zusammen mit PEGASYS eingenommen werden, gehören:
Informieren Sie Ihren Arzt über jede Nebenwirkung, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen der COPEGUS-Behandlung. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Sie können Genentech Nebenwirkungen auch unter 1-888-835-2555 melden.
Wie soll ich COPEGUS 100 mg aufbewahren?
Bewahren Sie COPEGUS 100 mg und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von COPEGUS
Es ist nicht bekannt, ob die Behandlung mit COPEGUS 100 mg in Kombination mit PEGASYS verhindert, dass eine infizierte Person während der Behandlung das Hepatitis-C-Virus auf eine andere Person überträgt.
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie COPEGUS 100 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie COPEGUS nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Dieser Arzneimittelleitfaden fasst die wichtigsten Informationen zu COPEGUS zusammen. Wenn Sie weitere Informationen wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Arzt oder Apotheker um Informationen über COPEGUS bitten, die für medizinisches Fachpersonal geschrieben sind.
Welche Inhaltsstoffe enthält COPEGUS 100 mg?
Wirkstoff: Ribavirin
Inaktive Inhaltsstoffe: Der Kern der Tablette enthält vorgelatinierte Stärke, mikrokristalline Zellulose, Natriumstärkeglykolat, Maisstärke und Magnesiumstearat. Die Beschichtung der Tablette enthält Chromatone-P oder Opadry Pink (hergestellt unter Verwendung von Hydroxypropylmethylcellulose, Talk, Titandioxid, synthetischem gelbem Eisenoxid und synthetischem rotem Eisenoxid), Ethylcellulose (ECD-30) und Triacetin.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.