Epivir 150mg Lamivudine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Epivir und wie wird es angewendet?
Epivir 150 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome einer HIV-Infektion und chronischer Hepatitis B. Epivir 150 mg kann allein oder zusammen mit anderen Medikamenten angewendet werden.
Epivir gehört zu einer Klasse von Arzneimitteln, die Hepatitis-B-/Hepatitis-C-Mittel genannt werden; HIV, NRTIs.
Es ist nicht bekannt, ob Epivir bei Kindern unter 3 Monaten sicher und wirksam ist.
Welche Nebenwirkungen kann Epivir 150 mg haben?
Epivir kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Epivir gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Epivir. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
EXAZERBATIONEN VON HEPATITIS B und UNTERSCHIEDLICHE FORMULIERUNGEN VON EPIVIR.
Exazerbationen von Hepatitis B
Schwere akute Exazerbationen von Hepatitis B wurden bei Patienten berichtet, die mit dem Hepatitis-B-Virus (HBV) und dem humanen Immunschwächevirus (HIV-1) koinfiziert waren und EPIVIR abgesetzt hatten. Bei Patienten, die EPIVIR absetzen und gleichzeitig mit HIV-1 und HBV infiziert sind, sollte die Leberfunktion mindestens mehrere Monate lang engmaschig sowohl klinisch als auch im Labor überwacht werden. Gegebenenfalls kann die Einleitung einer Anti-Hepatitis-B-Therapie gerechtfertigt sein [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
Wichtige Unterschiede zwischen Lamivudin-haltigen Produkten
EPIVIR 150 mg Tabletten und Lösung zum Einnehmen (zur Behandlung einer HIV-1-Infektion) enthalten eine höhere Dosis des Wirkstoffs (Lamivudin) als EPIVIR-HBV Tabletten und Lösung zum Einnehmen (zur Behandlung einer chronischen HBV-Infektion). Patienten mit einer HIV-1-Infektion sollten nur Dosierungsformen erhalten, die für die Behandlung von HIV-1 geeignet sind [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
BEZEICHNUNG
EPIVIR (auch bekannt als 3TC) ist ein Markenname für Lamivudin, ein synthetisches Nukleosid-Analogon mit Aktivität gegen HIV-1 und HBV. Der chemische Name von Lamivudin lautet (2R,cis)-4-Amino-1(2-hydroxymethyl-1,3-oxathiolan-5-yl)-(1H)-pyrimidin-2-on. Lamivudin ist das (-)Enantiomer eines Didesoxy-Analogons von Cytidin. Lamivudin wird auch als (-)2',3'-Didesoxy, 3'Thiacytidin bezeichnet. Es hat die Summenformel C8H11N3O3S und ein Molekulargewicht von 229,3 g pro Mol. Es hat die folgende Strukturformel:
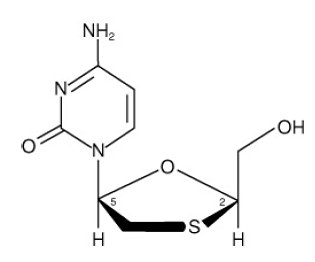
Lamivudin ist ein weißer bis cremefarbener kristalliner Feststoff mit einer Löslichkeit von etwa 70 mg pro ml in Wasser bei 20 °C.
EPIVIR 150 mg Tabletten sind zur oralen Verabreichung bestimmt. Jede 150-mg-Filmtablette mit Bruchrille enthält 150 mg Lamivudin und die sonstigen Bestandteile Hypromellose, Magnesiumstearat, mikrokristalline Cellulose, Polyethylenglykol, Polysorbat 80, Natriumstärkeglykolat und Titandioxid.
Jede 300-mg-Filmtablette enthält 300 mg Lamivudin und die sonstigen Bestandteile schwarzes Eisenoxid, Hypromellose, Magnesiumstearat, mikrokristalline Cellulose, Polyethylenglykol, Polysorbat 80, Natriumstärkeglykolat und Titandioxid.
EPIVIR Lösung zum Einnehmen ist zur oralen Verabreichung bestimmt. Ein Milliliter (1 ml) EPIVIR Lösung zum Einnehmen enthält 10 mg Lamivudin (10 mg pro ml) in einer wässrigen Lösung und die inaktiven Bestandteile künstliche Erdbeer- und Bananenaromen, Zitronensäure (wasserfrei), Methylparaben, Propylenglycol, Propylparaben, Natriumcitrat (Dihydrat) und Saccharose (200 mg).
INDIKATIONEN
EPIVIR 150 mg ist ein Nukleosid-Analogon, das in Kombination mit anderen antiretroviralen Wirkstoffen zur Behandlung einer Infektion mit dem humanen Immunschwächevirus Typ 1 (HIV-1) indiziert ist.
Nutzungsbeschränkungen
DOSIERUNG UND ANWENDUNG
Empfohlene Dosierung für erwachsene Patienten
Die empfohlene Dosierung von EPIVIR 150 mg bei HIV-1-infizierten Erwachsenen beträgt 300 mg täglich, verabreicht entweder als 150 mg oral zweimal täglich oder 300 mg oral einmal täglich mit oder ohne Nahrung. Wenn Lamivudin einem mit HIV-1 und HBV infizierten Patienten verabreicht wird, sollte die für die HIV-1-Therapie angegebene Dosierung als Teil eines geeigneten Kombinationsschemas angewendet werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Empfohlene Dosierung für pädiatrische Patienten
EPIVIR 150 mg Tablette mit Bruchrille ist die bevorzugte Formulierung für HIV-1-infizierte pädiatrische Patienten, die mindestens 14 kg wiegen und für die eine feste Darreichungsform geeignet ist. Vor der Verschreibung von EPIVIR-Tabletten mit Bruchrille sollten pädiatrische Patienten auf ihre Fähigkeit, Tabletten zu schlucken, untersucht werden. Patienten, die EPIVIR 150 mg Tabletten nicht sicher und zuverlässig schlucken können, kann die orale Lösungsformulierung verschrieben werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Die empfohlene orale Dosierung von EPIVIR 150 mg Tabletten für HIV-1-infizierte pädiatrische Patienten ist in Tabelle 1 dargestellt.
Mündliche Lösung
Die empfohlene Dosierung von EPIVIR 150 mg Lösung zum Einnehmen bei HIV-1-infizierten pädiatrischen Patienten ab 3 Monaten beträgt 5 mg pro kg oral zweimal täglich oder 10 mg pro kg oral einmal täglich (bis zu einer Höchstdosis von 300 mg täglich). in Kombination mit anderen antiretroviralen Mitteln verabreicht [siehe KLINISCHE PHARMAKOLOGIE ]. Berücksichtigen Sie bei der Auswahl des Dosierungsintervalls für Patienten, die eine Behandlung mit Lösung zum Einnehmen beginnen, die HIV-1-Viruslast und die CD4+-Zellzahl/Prozentsatz [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , KLINISCHE PHARMAKOLOGIE ].
Patienten mit eingeschränkter Nierenfunktion
Die Dosierung von EPIVIR 150 mg wird entsprechend der Nierenfunktion angepasst. Dosisanpassungen sind in Tabelle 2 aufgeführt [siehe KLINISCHE PHARMAKOLOGIE ].
Nach einer routinemäßigen (4-stündigen) Hämodialyse oder Peritonealdialyse ist keine zusätzliche Dosis von EPIVIR 150 mg erforderlich.
Obwohl keine ausreichenden Daten vorliegen, um eine spezifische Dosisanpassung von EPIVIR bei pädiatrischen Patienten mit eingeschränkter Nierenfunktion zu empfehlen, sollte eine Verringerung der Dosis und/oder eine Verlängerung des Dosierungsintervalls in Betracht gezogen werden.
WIE GELIEFERT
Darreichungsformen und Stärken
EPIVIR Tabletten mit Bruchrille
EPIVIR Tabletten mit Bruchrille enthalten 150 mg Lamivudin. Die Tabletten sind weiße, rautenförmige Filmtabletten mit Bruchkerbe und der Prägung „GX CJ7“ auf beiden Seiten.
EPIVIR-Tabletten
EPIVIR Tabletten enthalten 300 mg Lamivudin. Die Tabletten sind grau, modifiziert rautenförmig, filmbeschichtet und auf einer Seite mit der Prägung „GX EJ7“ und auf der Rückseite glatt.
EPIVIR Lösung zum Einnehmen
EPIVIR Lösung zum Einnehmen enthält 10 mg Lamivudin pro 1 ml. Die Lösung ist eine klare, farblose bis blassgelbe Flüssigkeit mit Erdbeer-Bananen-Geschmack.
Lagerung und Handhabung
EPIVIR Tabletten mit Bruchrille enthalten 150 mg Lamivudin, sind weiß, rautenförmig, filmbeschichtet und auf beiden Seiten mit der Prägung „GX CJ7“ versehen. Verpackt wie folgt:
Flasche mit 60 Tabletten ( NDC 49702-203-18) mit kindergesichertem Verschluss.
EPIVIR Tabletten enthalten 300 mg Lamivudin, sind grau, modifiziert rautenförmig, filmbeschichtet und mit der Prägung „GX EJ7“ auf einer Seite und glatt auf der Rückseite. Verpackt wie folgt:
Flasche mit 30 Tabletten ( NDC 49702-204-13) mit kindergesichertem Verschluss.
Empfohlene Lagerung
Lagern Sie EPIVIR-Tabletten bei 25 °C (77 °F); Exkursionen erlaubt bis 15° bis 30°C (59° bis 86°F) [siehe USP kontrollierte Raumtemperatur ].
EPIVIR Lösung zum Einnehmen ist eine klare, farblose bis blassgelbe Flüssigkeit mit Erdbeer-Bananen-Geschmack. Jeder ml der Lösung enthält 10 mg Lamivudin. Verpackt wie folgt:
Kunststoffflasche mit 240 ml (NDC 49702-205-48) mit kindergesichertem Verschluss. Dieses Produkt erfordert keine Rekonstitution.
In fest verschlossenen Flaschen bei 25 °C (77 °F) lagern [siehe USP kontrollierte Raumtemperatur ].
Hergestellt für: ViiV Healthcare Research Triangle Park, NC 27709. von: GlaxoSmithKline Research Triangle Park, NC 27709, Hergestellt im Auftrag von Shire Pharmaceuticals Group plc. Überarbeitet: April 2018
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden in anderen Abschnitten der Kennzeichnung besprochen:
Erfahrung mit klinischen Studien
Erfahrung mit klinischen Studien bei erwachsenen Probanden
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Das Sicherheitsprofil von EPIVIR 150 mg bei Erwachsenen basiert hauptsächlich auf 3.568 HIV-1-infizierten Probanden in 7 klinischen Studien.
Die häufigsten Nebenwirkungen sind Kopfschmerzen, Übelkeit, Unwohlsein, Müdigkeit, nasale Anzeichen und Symptome, Durchfall und Husten.
Ausgewählte klinische Nebenwirkungen bei mindestens 5 % der Patienten während der Therapie mit EPIVIR 150 mg zweimal täglich plus RETROVIR 200 mg dreimal täglich für bis zu 24 Wochen sind in Tabelle 3 aufgeführt.
Pankreatitis
Pankreatitis wurde bei 9 von 2.613 erwachsenen Probanden (0,3 %) beobachtet, die EPIVIR 150 mg in den kontrollierten klinischen Studien EPV20001, NUCA3001, NUCB3001, NUCA3002, NUCB3002 und NUCB3007 erhielten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
EPIVIR 300 mg einmal täglich
Die Arten und Häufigkeiten klinischer Nebenwirkungen, die bei Probanden berichtet wurden, die EPIVIR 300 mg einmal täglich oder EPIVIR 150 mg zweimal täglich (in Kombinationstherapien mit 3 Wirkstoffen in EPV20001 und EPV40001) über 48 Wochen erhielten, waren ähnlich.
Ausgewählte Laboranomalien, die während der Therapie beobachtet wurden, sind in Tabelle 4 zusammengefasst.
Die Häufigkeiten ausgewählter Laboranomalien, die bei Probanden berichtet wurden, die EPIVIR 300 mg einmal täglich oder EPIVIR 150 mg zweimal täglich (in Kombinationstherapien mit 3 Arzneimitteln in EPV20001 und EPV40001) erhielten, waren ähnlich.
Erfahrung mit klinischen Studien in der Pädiatrie
EPIVIR Lösung zum Einnehmen wurde in 3 klinischen Studien an 638 pädiatrischen Probanden im Alter von 3 Monaten bis 18 Jahren untersucht.
Ausgewählte klinische Nebenwirkungen und körperliche Befunde mit einer Häufigkeit von größer oder gleich 5 % während der Therapie mit EPIVIR 4 mg pro kg zweimal täglich plus RETROVIR 160 mg pro m² 3-mal täglich bei therapienaiver Behandlung (weniger als oder gleich 56 Tage antiretroviraler Behandlung). Therapie) pädiatrische Patienten sind in Tabelle 5 aufgeführt.
Pankreatitis
Pankreatitis, die in einigen Fällen tödlich verlief, wurde bei mit antiretroviralen Nukleosiden vorbehandelten pädiatrischen Patienten beobachtet, die EPIVIR allein oder in Kombination mit anderen antiretroviralen Wirkstoffen erhielten. In einer offenen Dosiseskalationsstudie (NUCA2002) entwickelten 14 Patienten (14 %) eine Pankreatitis, während sie eine Monotherapie mit EPIVIR erhielten. Drei dieser Probanden starben an Komplikationen der Pankreatitis. In einer zweiten offenen Studie (NUCA2005) entwickelten 12 Probanden (18 %) eine Pankreatitis. In der Studie ACTG300 wurde bei 236 Patienten, die randomisiert EPIVIR 150 mg plus RETROVIR erhielten, keine Pankreatitis beobachtet. Pankreatitis wurde in dieser Studie bei 1 Probanden beobachtet, der unverblindet EPIVIR in Kombination mit RETROVIR und Ritonavir nach Absetzen der Didanosin-Monotherapie erhielt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Parästhesien und periphere Neuropathien
Parästhesien und periphere Neuropathien wurden bei 15 Patienten (15 %) in der Studie NUCA2002, 6 Patienten (9 %) in der Studie NUCA2005 und 2 Patienten (weniger als 1 %) in der Studie ACTG300 berichtet.
Ausgewählte Laboranomalien, die bei therapienaiven (weniger als oder gleich 56 Tagen antiretroviraler Therapie) pädiatrischen Probanden auftraten, sind in Tabelle 6 aufgeführt.
Pädiatrische Probanden einmal täglich vs. zweimal täglich Dosierung (COL105677)
Die Sicherheit einer einmal täglichen gegenüber einer zweimal täglichen Gabe von EPIVIR 150 mg wurde in der ARROW-Studie bewertet. Die primäre Sicherheitsbewertung in der ARROW-Studie basierte auf unerwünschten Ereignissen vom Grad 3 und Grad 4. Die Häufigkeit von unerwünschten Ereignissen 3. und 4. Grades war bei Studienteilnehmern, die auf eine einmal tägliche Einnahme randomisiert wurden, ähnlich wie bei Studienteilnehmern, die auf eine zweimal tägliche Einnahme randomisiert wurden. Ein Ereignis von Hepatitis Grad 4 in der Kohorte mit einmal täglicher Einnahme wurde vom Prüfarzt als unsichere Kausalität angesehen, und alle anderen unerwünschten Ereignisse vom Grad 3 oder 4 wurden vom Prüfarzt als nicht zusammenhängend betrachtet.
Neugeborene
Aus 2 kleinen, unkontrollierten Studien in Südafrika mit Neugeborenen, die Lamivudin mit oder ohne Zidovudin in der ersten Lebenswoche nach einer Behandlung der Mutter ab der 38. oder 36. Schwangerschaftswoche erhielten, liegen begrenzte kurzfristige Sicherheitsinformationen vor [siehe KLINISCHE PHARMAKOLOGIE ]. Ausgewählte Nebenwirkungen, die bei diesen Neugeborenen berichtet wurden, umfassten erhöhte Leberfunktionswerte, Anämie, Durchfall, Elektrolytstörungen, Hypoglykämie, Gelbsucht und Hepatomegalie, Hautausschlag, Atemwegsinfektionen und Sepsis; 3 Neugeborene starben (1 an Gastroenteritis mit Azidose und Krämpfen, 1 an traumatischer Verletzung und 1 an unbekannter Ursache). Zwei weitere Fälle von nicht tödlicher Gastroenteritis oder Durchfall wurden gemeldet, darunter einer mit Krämpfen; 1 Säugling hatte eine vorübergehende Niereninsuffizienz in Verbindung mit Dehydratation. Das Fehlen von Kontrollgruppen schränkt die Beurteilung der Kausalität ein, es sollte jedoch davon ausgegangen werden, dass bei perinatal exponierten Säuglingen ein vergleichbares Risiko für Nebenwirkungen bestehen kann wie bei pädiatrischen und erwachsenen HIV-1-infizierten Patienten, die mit Lamivudin-haltigen Kombinationsschemata behandelt wurden. Langzeitwirkungen einer Lamivudin-Exposition in utero und Säuglingen sind nicht bekannt.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von EPIVIR nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet wurden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen. Diese Reaktionen wurden aufgrund einer Kombination aus Schweregrad, Meldehäufigkeit oder möglichem kausalen Zusammenhang mit Lamivudin für die Aufnahme ausgewählt.
Körper als Ganzes
Umverteilung/Ansammlung von Körperfett.
Endokrine und metabolische
Hyperglykämie.
Allgemein
Die Schwäche. Hämische und lymphatische Anämie (einschließlich Erythrozytenaplasie und schwere Anämien im Verlauf der Therapie).
Leber und Bauchspeicheldrüse
Laktatazidose und hepatische Steatose [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ], Exazerbationen der Hepatitis B nach der Behandlung [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Überempfindlichkeit
Anaphylaxie, Urtikaria.
Bewegungsapparat
Muskelschwäche, CPK-Erhöhung, Rhabdomyolyse. Hautalopezie, Juckreiz.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Arzneimittel, die Transporter für organische Kationen hemmen
Lamivudin wird überwiegend durch aktive organische Kationensekretion mit dem Urin ausgeschieden. Die Möglichkeit von Wechselwirkungen mit anderen gleichzeitig verabreichten Arzneimitteln sollte in Betracht gezogen werden, insbesondere wenn ihr Hauptausscheidungsweg die aktive Nierensekretion über das Transportsystem für organische Kationen ist (z. B. Trimethoprim) [siehe KLINISCHE PHARMAKOLOGIE ]. Es liegen keine Daten zu Wechselwirkungen mit anderen Arzneimitteln vor, deren renale Clearance-Mechanismen ähnlich denen von Lamivudin sind.
Sorbit
Die gleichzeitige Gabe von Einzeldosen von Lamivudin und Sorbit führte zu einer von der Sorbit-Dosis abhängigen Verringerung der Lamivudin-Exposition. Vermeiden Sie nach Möglichkeit die Anwendung von sorbitolhaltigen Arzneimitteln zusammen mit Lamivudin [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , KLINISCHE PHARMAKOLOGIE ].
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Patienten mit Hepatitis-B-Virus-Koinfektion
Exazerbationen der Hepatitis nach der Behandlung
Nach Absetzen von Lamivudin sind klinische und laborchemische Hinweise auf Exazerbationen der Hepatitis aufgetreten. Diese Exazerbationen wurden neben dem erneuten Auftreten von HBV-DNA hauptsächlich durch Erhöhungen der Serum-ALT nachgewiesen. Obwohl die meisten Ereignisse scheinbar selbstlimitierend waren, wurden in einigen Fällen Todesfälle gemeldet. Ähnliche Ereignisse wurden aus Erfahrungen nach der Markteinführung nach Umstellungen von Lamivudin-haltigen HIV-1-Behandlungsschemata auf Nicht-Lamivudin-haltige Regimes bei Patienten berichtet, die sowohl mit HIV-1 als auch mit HBV infiziert waren. Der kausale Zusammenhang mit dem Absetzen der Lamivudin-Behandlung ist nicht bekannt. Die Patienten sollten mindestens mehrere Monate nach Beendigung der Behandlung sowohl klinisch als auch im Labor engmaschig überwacht werden.
Wichtige Unterschiede zwischen Lamivudin-haltigen Produkten
EPIVIR 150 mg Tabletten und Lösung zum Einnehmen enthalten eine höhere Dosis desselben Wirkstoffs (Lamivudin) als EPIVIR-HBV-Tabletten und EPIVIR-HBV-Lösung zum Einnehmen. EPIVIR-HBV wurde für Patienten mit chronischer Hepatitis B entwickelt. Die Formulierung und Dosierung von Lamivudin in EPIVIR-HBV sind nicht für Patienten geeignet, die gleichzeitig mit HIV-1 und HBV infiziert sind. Die Sicherheit und Wirksamkeit von Lamivudin für die Behandlung der chronischen Hepatitis B bei Patienten mit HIV-1- und HBV-Koinfektion wurden nicht nachgewiesen. Wenn einem Patienten mit einer unerkannten oder unbehandelten HIV-1-Infektion eine Behandlung mit EPIVIR-HBV bei chronischer Hepatitis B verschrieben wird, ist aufgrund der subtherapeutischen Dosis und der Unangemessenheit einer HIV-1-Monotherapie mit einer raschen Entstehung einer HIV-1-Resistenz zu rechnen. Wenn entschieden wird, Patienten mit einer HIV-1- und HBV-Koinfektion Lamivudin zu verabreichen, sollten EPIVIR 150 mg Tabletten, EPIVIR 150 mg Lösung zum Einnehmen oder ein anderes Produkt, das die höhere Lamivudin-Dosis enthält, als Teil eines geeigneten Kombinationsschemas verwendet werden.
Auftreten von Lamivudin-resistentem HBV
Die Sicherheit und Wirksamkeit von Lamivudin für die Behandlung von chronischer Hepatitis B bei Patienten, die mit HIV-1 und HBV doppelt infiziert sind, wurde nicht nachgewiesen (siehe vollständige Verschreibungsinformationen für EPIVIR-HBV). Das Auftreten von Hepatitis-B-Virusvarianten im Zusammenhang mit Lamivudinresistenz wurde auch bei HIV-1-infizierten Patienten berichtet, die Lamivudin enthaltende antiretrovirale Therapien bei gleichzeitiger Infektion mit dem Hepatitis-B-Virus erhalten hatten.
Laktatazidose und schwere Hepatomegalie mit Steatose
Laktatazidose und schwere Hepatomegalie mit Steatose, einschließlich tödlicher Fälle, wurden bei der Anwendung von Nukleosidanaloga, einschließlich EPIVIR, berichtet. Ein Großteil dieser Fälle betraf Frauen. Weibliches Geschlecht und Fettleibigkeit können Risikofaktoren für die Entwicklung einer Laktatazidose und einer schweren Hepatomegalie mit Steatose bei Patienten sein, die mit antiretroviralen Nukleosidanaloga behandelt werden. Die Behandlung mit EPIVIR sollte bei jedem Patienten ausgesetzt werden, der klinische oder Laborbefunde entwickelt, die auf eine Laktatazidose oder ausgeprägte Hepatotoxizität hindeuten, was Hepatomegalie und Steatose einschließen kann, auch wenn keine deutlichen Transaminasenerhöhungen vorliegen.
Verwenden Sie mit Interferon- und Ribavirin-basierten Therapien
In-vitro-Studien haben gezeigt, dass Ribavirin die Phosphorylierung von Pyrimidin-Nukleosidanaloga wie Lamivudin reduzieren kann. Obwohl keine Hinweise auf eine pharmakokinetische oder pharmakodynamische Wechselwirkung (z. B. Verlust der virologischen HIV-1/HCV-Suppression) zu sehen waren, wenn Ribavirin zusammen mit Lamivudin bei HIV-1/HCV-koinfizierten Patienten verabreicht wurde [siehe KLINISCHE PHARMAKOLOGIE kam es bei HIV-1/HCV-koinfizierten Patienten, die eine antiretrovirale Kombinationstherapie gegen HIV-1 und Interferon alfa mit oder ohne Ribavirin erhielten, zu Leberdekompensation (einige mit tödlichem Ausgang). Patienten, die Interferon alfa mit oder ohne Ribavirin und EPIVIR erhalten, sollten engmaschig auf behandlungsassoziierte Toxizitäten, insbesondere Leberdekompensation, überwacht werden. Das Absetzen von EPIVIR 150 mg sollte als medizinisch angemessen angesehen werden. Eine Dosisreduktion oder das Absetzen von Interferon alfa, Ribavirin oder beiden sollte ebenfalls in Erwägung gezogen werden, wenn eine Verschlechterung der klinischen Toxizität beobachtet wird, einschließlich Leberdekompensation (z. B. Child-Pugh größer als 6). Siehe die vollständigen Verschreibungsinformationen für Interferon und Ribavirin.
Pankreatitis
Bei pädiatrischen Patienten mit einer früheren Exposition gegenüber antiretroviralen Nukleosiden, einer Pankreatitis in der Vorgeschichte oder anderen signifikanten Risikofaktoren für die Entwicklung einer Pankreatitis sollte EPIVIR 150 mg mit Vorsicht angewendet werden. Die Behandlung mit EPIVIR 150 mg sollte sofort abgebrochen werden, wenn klinische Anzeichen, Symptome oder Laboranomalien auftreten, die auf eine Pankreatitis hindeuten [siehe NEBENWIRKUNGEN ].
Immunrekonstitutionssyndrom
Bei Patienten, die mit einer antiretroviralen Kombinationstherapie, einschließlich EPIVIR, behandelt wurden, wurde über ein Immunrekonstitutionssyndrom berichtet. Während der Anfangsphase einer antiretroviralen Kombinationsbehandlung können Patienten, deren Immunsystem anspricht, eine Entzündungsreaktion auf indolente oder verbleibende opportunistische Infektionen (wie Mycobacterium avium-Infektion, Cytomegalovirus, Pneumocystis-jirovecii-Pneumonie [PCP] oder Tuberkulose) entwickeln, die eine weitere Untersuchung erforderlich machen kann und Behandlung.
Autoimmunerkrankungen (wie Morbus Basedow, Polymyositis und Guillain-Barré-Syndrom) wurden ebenfalls im Zusammenhang mit der Immunrekonstitution berichtet, jedoch ist die Zeit bis zum Auftreten variabler und kann viele Monate nach Beginn der Behandlung auftreten.
Niedrigere virologische Suppressionsraten und erhöhtes Risiko einer Virusresistenz bei oraler Lösung
Pädiatrische Probanden, die EPIVIR 150 mg Lösung zum Einnehmen (in gewichtsabhängigen Dosen von etwa 8 mg pro kg pro Tag) gleichzeitig mit anderen antiretroviralen Lösungen zum Einnehmen zu irgendeinem Zeitpunkt in der ARROW-Studie erhielten, wiesen niedrigere Raten von virologischer Suppression, eine niedrigere Lamivudin-Plasmaexposition und eine niedrigere Lamivudin-Plasmakonzentration auf Virusresistenz häufiger als diejenigen, die EPIVIR-Tabletten erhalten [siehe KLINISCHE PHARMAKOLOGIE , Mikrobiologie , Klinische Studien ].
EPIVIR Tablette mit Bruchkerbe ist die bevorzugte Formulierung für HIV-1-infizierte pädiatrische Patienten, die mindestens 14 kg wiegen und für die eine feste Darreichungsform geeignet ist. Wenn möglich, sollte ein reines Tablettenregime angewendet werden, um eine potenzielle Wechselwirkung mit Sorbitol zu vermeiden [siehe KLINISCHE PHARMAKOLOGIE ]. Erwägen Sie bei der Behandlung mit EPIVIR 150 mg Lösung zum Einnehmen eine häufigere Überwachung der HIV-1-Viruslast.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung (Patienteninformationen) zu lesen.
Patienten mit einer Koinfektion mit Hepatitis B oder C
Informieren Sie Patienten mit HIV-1- und HBV-Koinfektion darüber, dass es in einigen Fällen zu einer Verschlechterung der Lebererkrankung gekommen ist, nachdem die Behandlung mit Lamivudin abgesetzt wurde. Weisen Sie die Patienten darauf hin, Änderungen des Regimes mit ihrem Arzt zu besprechen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Informieren Sie Patienten mit einer HIV-1/HCV-Koinfektion darüber, dass es bei HIV-1/HCV-koinfizierten Patienten, die eine antiretrovirale Kombinationstherapie gegen HIV-1 und Interferon alfa mit oder ohne Ribavirin erhielten, zu Leberdekompensation (einige mit tödlichem Ausgang) gekommen ist [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Unterschiede in den Formulierungen von EPIVIR
Weisen Sie die Patienten darauf hin, dass EPIVIR 150 mg Tabletten und Lösung zum Einnehmen eine höhere Dosis des gleichen Wirkstoffs (Lamivudin) wie EPIVIR-HBV-Tabletten und Lösung zum Einnehmen enthalten. Wenn entschieden wird, Lamivudin in das HIV-1-Behandlungsschema eines mit HIV-1 und HBV koinfizierten Patienten aufzunehmen, sollte die Formulierung und Dosierung von Lamivudin in EPIVIR (nicht EPIVIR-HBV) verwendet werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Laktatazidose/Hepatomegalie mit Steatose
Weisen Sie die Patienten darauf hin, dass Laktatazidose und schwere Hepatomegalie mit Steatose im Zusammenhang mit der Anwendung von Nukleosidanaloga und anderen antiretroviralen Arzneimitteln berichtet wurden. Weisen Sie die Patienten an, die Einnahme von EPIVIR zu beenden, wenn sie klinische Symptome entwickeln, die auf eine Laktatazidose oder eine ausgeprägte Hepatotoxizität hindeuten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Risiko einer Pankreatitis
Weisen Sie Eltern oder Erziehungsberechtigte an, pädiatrische Patienten auf Anzeichen und Symptome einer Pankreatitis zu überwachen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Immunrekonstitutionssyndrom
Weisen Sie die Patienten darauf hin, ihren Arzt unverzüglich über alle Anzeichen und Symptome einer Infektion zu informieren, da eine Entzündung aufgrund einer früheren Infektion bald nach einer antiretroviralen Kombinationstherapie auftreten kann, einschließlich zu Beginn von EPIVIR [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Niedrigere virologische Suppressionsraten und erhöhtes Risiko einer Virusresistenz bei oraler Lösung
Weisen Sie die Patienten darauf hin, dass nach Möglichkeit nur Tabletten verwendet werden sollten, da bei Kindern und Jugendlichen, die EPIVIR Lösung zum Einnehmen gleichzeitig mit anderen antiretroviralen Lösungen zum Einnehmen erhielten, eine erhöhte Rate an Behandlungsversagen auftritt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Saccharosegehalt von EPIVIR Lösung zum Einnehmen
Weisen Sie Diabetiker darauf hin, dass jede 15-ml-Dosis EPIVIR Lösung zum Einnehmen 3 Gramm Saccharose (1 ml = 200 mg Saccharose) enthält [siehe BEZEICHNUNG ].
Schwangerschaftsregister
Weisen Sie die Patientinnen darauf hin, dass es ein Schwangerschaftsexpositionsregister gibt, das die Schwangerschaftsausgänge bei Frauen überwacht, die während der Schwangerschaft EPIVIR ausgesetzt waren [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Stillzeit
Weisen Sie Frauen mit einer HIV-1-Infektion an, nicht zu stillen, da HIV-1 mit der Muttermilch auf das Baby übertragen werden kann [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Verpasste Dosierung
Weisen Sie die Patienten an, eine vergessene Dosis von EPIVIR 150 mg einzunehmen, sobald sie sich daran erinnern. Weisen Sie die Patienten darauf hin, ihre nächste Dosis nicht zu verdoppeln oder mehr als die verschriebene Dosis einzunehmen [siehe DOSIERUNG UND ANWENDUNG ].
EPIVIR und RETROVIR sind Warenzeichen der ViiV Healthcare Unternehmensgruppe oder an diese lizenziert.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Langzeitstudien zur Karzinogenität mit Lamivudin bei Mäusen und Ratten zeigten keine Hinweise auf ein karzinogenes Potenzial bei Expositionen, die bis zum 10-Fachen (Mäuse) und 58-Fachen (Ratten) der humanen Exposition bei der empfohlenen Dosis von 300 mg lagen.
Mutagenese
Lamivudin war in einem L5178Y-Maus-Lymphom-Assay mutagen und in einem zytogenetischen Assay mit kultivierten menschlichen Lymphozyten klastogen. Lamivudin war in einem mikrobiellen Mutagenitätstest, in einem In-vitro-Zelltransformationstest, in einem Ratten-Mikronukleustest, in einem zytogenetischen Test am Rattenknochenmark und in einem Test auf außerplanmäßige DNA-Synthese in Rattenleber nicht mutagen. Lamivudin zeigte in oralen Dosen von bis zu 2.000 mg pro kg bei Ratten keine Hinweise auf eine genotoxische Aktivität in vivo, was zu Plasmaspiegeln führte, die das 35- bis 45-fache der beim Menschen bei der für eine HIV-1-Infektion empfohlenen Dosis betragen.
Beeinträchtigung der Fruchtbarkeit
In einer Studie zur Reproduktionsleistung zeigte Lamivudin, das Ratten in Dosen von bis zu 4.000 mg pro kg pro Tag verabreicht wurde und Plasmaspiegel erzeugte, die 47- bis 70-mal so hoch waren wie beim Menschen, keine Hinweise auf eine Beeinträchtigung der Fertilität und keine Auswirkungen auf Überleben, Wachstum und Entwicklung zum Absetzen des Nachwuchses.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschafts-Expositionsregister
Es gibt ein Schwangerschafts-Expositionsregister, das die Schwangerschaftsausgänge bei Frauen überwacht, die während der Schwangerschaft EPIVIR ausgesetzt waren. Gesundheitsdienstleister werden ermutigt, Patienten zu registrieren, indem sie das Antiretroviral Pregnancy Registry (APR) unter 1-800-258-4263 anrufen.
Zusammenfassung der Risiken
Die verfügbaren Daten des APR zeigen keinen Unterschied im Gesamtrisiko für Geburtsfehler für Lamivudin im Vergleich zur Hintergrundrate für Geburtsfehler von 2,7 % in der Referenzpopulation des Metropolitan Atlanta Congenital Defects Program (MACDP) (siehe Daten ). Der APR verwendet den MACDP als US-Referenzpopulation für Geburtsfehler in der Allgemeinbevölkerung. Das MACDP bewertet Frauen und Säuglinge aus einem begrenzten geografischen Gebiet und enthält keine Ergebnisse für Geburten, die weniger als 20 Schwangerschaftswochen zurückliegen. Die Fehlgeburtsrate wird nicht im effektiven Jahreszins ausgewiesen. Die geschätzte Hintergrundrate von Fehlgeburten bei klinisch anerkannten Schwangerschaften in der US-Allgemeinbevölkerung beträgt 15 % bis 20 %. Das Hintergrundrisiko für schwerwiegende Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt.
In Reproduktionsstudien an Tieren führte die orale Verabreichung von Lamivudin an trächtige Kaninchen während der Organogenese zu einer Embryoletalität bei systemischer Exposition (AUC) ähnlich der empfohlenen klinischen Dosis; jedoch wurden bei oraler Gabe von Lamivudin an trächtige Ratten während der Organogenese in Plasmakonzentrationen (Cmax) des 35-Fachen der empfohlenen klinischen Dosis keine unerwünschten Wirkungen auf die Entwicklung beobachtet (siehe Daten ).
Daten
Menschliche Daten
Basierend auf prospektiven Berichten an den APR von über 11.000 Expositionen gegenüber Lamivudin während der Schwangerschaft, die zu Lebendgeburten führten (einschließlich über 4.500 Expositionen im ersten Trimenon), gab es keinen Unterschied zwischen dem Gesamtrisiko für Geburtsfehler für Lamivudin im Vergleich zur Hintergrund-Geburtsfehlerrate von 2,7 % in der US-Referenzpopulation des MACDP. Die Prävalenz von Fehlbildungen bei Lebendgeburten betrug 3,1 % (95 %-KI: 2,6 % bis 3,6 %) nach Exposition im ersten Trimenon mit Lamivudin-haltigen Regimen und 2,8 % (95 %-KI: 2,5 % bis 3,3 %) nach Exposition im zweiten/dritten Trimenon zu Lamivudin-haltigen Regimen.
Die Pharmakokinetik von Lamivudin wurde in zwei klinischen Studien in Südafrika bei schwangeren Frauen untersucht. In den Studien wurde die Pharmakokinetik bei 16 Frauen in der 36. Schwangerschaftswoche mit zweimal täglich 150 mg Lamivudin zusammen mit Zidovudin, bei 10 Frauen in der 38. Schwangerschaftswoche mit zweimal täglich 150 mg Lamivudin zusammen mit Zidovudin und bei 10 Frauen in der 38. Schwangerschaftswoche mit zweimal täglich 300 mg Lamivudin untersucht täglich ohne andere antiretrovirale Medikamente. Diese Studien wurden nicht entwickelt oder durchgeführt, um Informationen zur Wirksamkeit zu liefern. Die Lamivudin-Konzentrationen waren in Serumproben von Müttern, Neugeborenen und Nabelschnur im Allgemeinen ähnlich. Bei einer Untergruppe von Probanden wurden Fruchtwasserproben nach natürlichem Blasensprung entnommen und bestätigten, dass Lamivudin beim Menschen die Plazenta passiert. Basierend auf begrenzten Daten bei der Entbindung waren die medianen (Spanne) Fruchtwasserkonzentrationen von Lamivudin 3,9 (1,2 bis 12,8)-fach höher im Vergleich zur gepaarten mütterlichen Serumkonzentration (n = 8).
Tierdaten
Lamivudin wurde trächtigen Ratten (mit 90, 600 und 4.000 mg pro kg pro Tag) und Kaninchen (mit 90, 300 und 1.000 mg pro kg pro Tag und mit 15, 40 und 90 mg pro kg pro Tag) oral verabreicht. während der Organogenese (an den Trächtigkeitstagen 7 bis 16 [Ratte] und 8 bis 20 [Kaninchen]). Bei Ratten und Kaninchen wurden keine Hinweise auf fötale Missbildungen aufgrund von Lamivudin bei Dosen beobachtet, die zu Plasmakonzentrationen (Cmax) führten, die ungefähr 35-mal höher waren als die menschliche Exposition bei der empfohlenen Tagesdosis. Hinweise auf frühe Embryoletalität wurden bei Kaninchen bei systemischen Expositionen (AUC) beobachtet, die denen beim Menschen ähnlich waren, aber es gab keinen Hinweis auf diese Wirkung bei Ratten bei Plasmakonzentrationen (Cmax), die 35-mal höher waren als die humane Exposition bei der empfohlenen Tagesdosis . Studien an trächtigen Ratten zeigten, dass Lamivudin über die Plazenta auf den Fötus übertragen wird. In der Fertilitäts-/prä- und postnatalen Entwicklungsstudie an Ratten wurde Lamivudin oral in Dosen von 180, 900 und 4.000 mg pro kg pro Tag verabreicht (von vor der Paarung bis zum 20. Tag nach der Geburt). In der Studie wurde die Entwicklung der Nachkommen, einschließlich Fruchtbarkeit und Fortpflanzungsleistung, durch die maternale Verabreichung von Lamivudin nicht beeinträchtigt.
Stillzeit
Zusammenfassung der Risiken
Die Centers for Disease Control and Prevention empfehlen HIV-1-infizierten Müttern in den Vereinigten Staaten, ihre Säuglinge nicht zu stillen, um eine postnatale Übertragung der HIV-1-Infektion zu vermeiden. Lamivudin ist in der Muttermilch enthalten. Es liegen keine Informationen über die Auswirkungen von Lamivudin auf den gestillten Säugling oder die Auswirkungen der Arzneimittel auf die Milchproduktion vor. Aufgrund des Potenzials für (1) HIV-1-Übertragung (bei HIV-negativen Säuglingen), (2) Entwicklung einer Virusresistenz (bei HIV-positiven Säuglingen) und (3) Nebenwirkungen bei einem gestillten Säugling, weisen Sie Mütter an, nicht zu stillen wenn sie EPIVIR erhalten.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von EPIVIR 150 mg in Kombination mit anderen antiretroviralen Wirkstoffen wurde bei pädiatrischen Patienten ab 3 Monaten nachgewiesen. EPIVIR Tablette mit Bruchkerbe ist die bevorzugte Formulierung für HIV-1-infizierte pädiatrische Patienten, die mindestens 14 kg wiegen und für die eine feste Darreichungsform geeignet ist, da pädiatrische Patienten, die EPIVIR 150 mg Lösung zum Einnehmen erhielten, eine geringere Rate an virologischer Suppression und eine geringere Lamivudin-Plasmaexposition aufwiesen und entwickelten häufiger eine virale Resistenz als diejenigen, die EPIVIR 150 mg Tabletten in der ARROW-Studie erhielten [siehe DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN , NEBENWIRKUNGEN , KLINISCHE PHARMAKOLOGIE , Klinische Studien ].
Geriatrische Verwendung
Klinische Studien mit EPIVIR schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagieren als jüngere Probanden. Im Allgemeinen sollte bei der Verabreichung von EPIVIR an ältere Patienten Vorsicht walten, da eine verminderte Leber-, Nieren- oder Herzfunktion und eine Begleiterkrankung oder andere medikamentöse Therapie häufiger auftreten [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ].
Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit eingeschränkter Nierenfunktion wird eine Reduktion der Dosis von EPIVIR 150 mg empfohlen [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Es ist keine spezifische Behandlung einer Überdosierung mit EPIVIR bekannt. Im Falle einer Überdosierung sollte der Patient überwacht und bei Bedarf eine unterstützende Standardbehandlung durchgeführt werden. Da eine vernachlässigbare Menge Lamivudin durch (4-stündige) Hämodialyse, kontinuierliche ambulante Peritonealdialyse und automatisierte Peritonealdialyse entfernt wurde, ist nicht bekannt, ob eine kontinuierliche Hämodialyse bei einer Lamivudin-Überdosierung einen klinischen Nutzen bringen würde.
KONTRAINDIKATIONEN
EPIVIR 150 mg ist kontraindiziert bei Patienten mit einer früheren Überempfindlichkeitsreaktion auf Lamivudin.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Lamivudin ist ein antiretrovirales Mittel [siehe Mikrobiologie ].
Pharmakokinetik
Pharmakokinetik bei Erwachsenen
Die pharmakokinetischen Eigenschaften von Lamivudin wurden bei asymptomatischen, HIV-1-infizierten erwachsenen Probanden nach Verabreichung von intravenösen (i.v.) Einzeldosen im Bereich von 0,25 bis 8 mg pro kg sowie nach oraler Einzel- und Mehrfachgabe (zweimal täglich) untersucht im Bereich von 0,25 bis 10 mg pro kg.
Die pharmakokinetischen Eigenschaften von Lamivudin wurden auch als orale Einzel- und Mehrfachdosen im Bereich von 5 mg bis 600 mg pro Tag bei HBV-infizierten Patienten untersucht.
Die pharmakokinetischen Eigenschaften der EPIVIR 300-mg-Tablette einmal täglich über 7 Tage im Steady-State im Vergleich zu der EPIVIR 150-mg-Tablette zweimal täglich über 7 Tage wurden in einer Crossover-Studie an 60 gesunden Probanden untersucht. EPIVIR 300 mg einmal täglich führte zu einer ähnlichen Lamivudin-Exposition wie EPIVIR 150 mg zweimal täglich in Bezug auf die Plasma-AUC24,ss; Cmax,ss war jedoch um 66 % höher und der Talwert um 53 % niedriger als bei der zweimal täglichen Gabe von 150 mg. Die intrazelluläre Lamivudintriphosphat-Exposition in peripheren mononukleären Blutzellen war auch in Bezug auf AUC24,ss und Cmax24,ss ähnlich; die Talwerte waren jedoch niedriger als bei der zweimal täglichen Gabe von 150 mg. Die interindividuelle Variabilität war bei intrazellulären Lamivudintriphosphat-Konzentrationen größer als bei Lamivudin-Plasma-Talkonzentrationen.
Die Pharmakokinetik von Lamivudin wurde bei 12 erwachsenen HIV-1-infizierten Probanden untersucht, denen zweimal täglich 150 mg Lamivudin in Kombination mit anderen antiretroviralen Wirkstoffen verabreicht wurde. Das geometrische Mittel (95 % KI) für AUC(0-12) betrug 5,53 (4,58; 6,67) µg.h pro ml und für Cmax 1,40 (1,17; 1,69) µg pro ml.
Resorption und Bioverfügbarkeit
Die absolute Bioverfügbarkeit bei 12 erwachsenen Probanden betrug 86 % ± 16 % (Mittelwert ± Standardabweichung) für die 150-mg-Tablette und 87 % ± 13 % für die Lösung zum Einnehmen. Nach oraler Verabreichung von 2 mg pro kg zweimal täglich an 9 Erwachsene mit HIV-1 betrug die Spitzenkonzentration von Lamivudin im Serum (Cmax) 1,5 ± 0,5 µg pro ml (Mittelwert ± Standardabweichung). Die Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC) und Cmax nahmen im Bereich von 0,25 bis 10 mg pro kg proportional zur oralen Dosis zu.
Das Akkumulationsverhältnis von Lamivudin bei HIV-1-positiven asymptomatischen Erwachsenen mit normaler Nierenfunktion betrug 1,50 nach 15-tägiger oraler Verabreichung von 2 mg pro kg zweimal täglich.
Auswirkungen von Lebensmitteln auf die orale Absorption
EPIVIR 150 mg Tabletten und Lösung zum Einnehmen können mit oder ohne Nahrung eingenommen werden. Eine 25-mg-Darreichungsform von Lamivudin wurde 12 asymptomatischen, HIV-1-infizierten Probanden zweimal oral verabreicht, einmal im nüchternen Zustand und einmal mit Nahrung (1.099 kcal; 75 g Fett, 34 g Protein, 72 g Kohlenhydrate ). Die Resorption von Lamivudin war im nüchternen Zustand (Tmax: 3,2 ± 1,3 Stunden) langsamer als im nüchternen Zustand (Tmax: 0,9 ± 0,3 Stunden); Cmax war im nüchternen Zustand um 40 % ± 23 % (Mittelwert ± Standardabweichung) niedriger als im nüchternen Zustand. Es gab keinen signifikanten Unterschied in der systemischen Exposition (AUC∞) zwischen Nahrungsaufnahme und nüchternem Zustand.
Verteilung
Das scheinbare Verteilungsvolumen nach intravenöser Verabreichung von Lamivudin an 20 Probanden betrug 1,3 ± 0,4 l pro kg, was darauf hindeutet, dass sich Lamivudin in extravaskuläre Räume verteilt. Das Verteilungsvolumen war dosisunabhängig und korrelierte nicht mit dem Körpergewicht.
Die Bindung von Lamivudin an menschliche Plasmaproteine beträgt weniger als 36 %. In-vitro-Studien zeigten, dass über den Konzentrationsbereich von 0,1 bis 100 Mikrogramm pro ml die mit Erythrozyten assoziierte Lamivudin-Menge zwischen 53 % und 57 % lag und konzentrationsunabhängig war.
Stoffwechsel
Der Metabolismus von Lamivudin ist ein untergeordneter Eliminationsweg. Beim Menschen ist der einzige bekannte Metabolit von Lamivudin der trans-Sulfoxid-Metabolit (ungefähr 5 % einer oralen Dosis nach 12 Stunden). Serumkonzentrationen dieses Metaboliten wurden nicht bestimmt. Lamivudin wird nicht signifikant durch Cytochrom-P450-Enzyme metabolisiert.
Beseitigung
Der größte Teil von Lamivudin wird durch aktive Sekretion organischer Kationen unverändert im Urin ausgeschieden. Bei 9 gesunden Probanden, denen eine orale Einzeldosis von 300 mg Lamivudin verabreicht wurde, betrug die renale Clearance 199,7 ± 56,9 ml pro Minute (Mittelwert ± Standardabweichung). Bei 20 HIV-1-infizierten Probanden, die eine intravenöse Einzeldosis erhielten, betrug die renale Clearance 280,4 ± 75,2 ml pro Minute (Mittelwert ± SD), was 71 % ± 16 % (Mittelwert ± SD) der Gesamtclearance von Lamivudin entspricht.
In den meisten Einzeldosis-Studien mit HIV-1-infizierten Probanden, HBV-infizierten Probanden oder gesunden Probanden mit Serumentnahmen über 24 Stunden nach der Verabreichung lag die beobachtete mittlere Eliminationshalbwertszeit (t½) im Bereich von 5 bis 7 Stunden. Bei HIV-1-infizierten Probanden betrug die Gesamtclearance 398,5 ± 69,1 ml pro Minute (Mittelwert ± Standardabweichung). Die orale Clearance und die Eliminationshalbwertszeit waren über einen oralen Dosierungsbereich von 0,25 bis 10 mg pro kg dosis- und körpergewichtsunabhängig.
Spezifische Populationen
Patienten mit eingeschränkter Nierenfunktion
Die pharmakokinetischen Eigenschaften von Lamivudin wurden in einer kleinen Gruppe HIV-1-infizierter Erwachsener mit eingeschränkter Nierenfunktion bestimmt (Tabelle 7).
Tmax wurde durch die Nierenfunktion nicht signifikant beeinflusst. Basierend auf diesen Beobachtungen wird empfohlen, die Dosierung von Lamivudin bei Patienten mit eingeschränkter Nierenfunktion anzupassen [siehe DOSIERUNG UND ANWENDUNG ].
Basierend auf einer Studie mit ansonsten gesunden Probanden mit eingeschränkter Nierenfunktion erhöhte die Hämodialyse die Lamivudin-Clearance von durchschnittlich 64 auf 88 ml pro Minute; die Dauer der Hämodialyse (4 Stunden) reichte jedoch nicht aus, um die mittlere Lamivudin-Exposition nach Verabreichung einer Einzeldosis signifikant zu verändern. Kontinuierliche ambulante Peritonealdialyse und automatisierte Peritonealdialyse haben vernachlässigbare Auswirkungen auf die Lamivudin-Clearance. Daher wird empfohlen, nach einer Korrektur der Dosis für die Kreatinin-Clearance keine weitere Dosisanpassung nach einer routinemäßigen Hämodialyse oder Peritonealdialyse vorzunehmen.
Die Auswirkungen einer Nierenfunktionsstörung auf die Pharmakokinetik von Lamivudin bei pädiatrischen Patienten sind nicht bekannt.
Patienten mit eingeschränkter Leberfunktion
Die pharmakokinetischen Eigenschaften von Lamivudin wurden bei Erwachsenen mit eingeschränkter Leberfunktion bestimmt. Die pharmakokinetischen Parameter wurden durch die Verringerung der Leberfunktion nicht verändert. Sicherheit und Wirksamkeit von Lamivudin bei Vorliegen einer dekompensierten Lebererkrankung wurden nicht nachgewiesen.
Schwangere Frau
Die Pharmakokinetik von Lamivudin wurde bei 36 schwangeren Frauen in zwei klinischen Studien in Südafrika untersucht. Die Pharmakokinetik von Lamivudin bei schwangeren Frauen war ähnlich wie bei nicht schwangeren Erwachsenen und bei Frauen nach der Geburt. Die Lamivudin-Konzentrationen waren in Serumproben von Müttern, Neugeborenen und Nabelschnur im Allgemeinen ähnlich.
Pädiatrische Patienten
Die Pharmakokinetik von Lamivudin wurde nach einmaliger oder wiederholter Gabe von EPIVIR an 210 pädiatrischen Probanden untersucht. Kinder und Jugendliche, die Lamivudin-Lösung zum Einnehmen (in einer Dosis von etwa 8 mg pro kg pro Tag) erhielten, erreichten etwa 25 % niedrigere Plasmakonzentrationen von Lamivudin im Vergleich zu HIV-1-infizierten Erwachsenen. Kinder und Jugendliche, die Lamivudin-Tabletten zum Einnehmen erhielten, erreichten Plasmakonzentrationen, die mit denen bei Erwachsenen vergleichbar oder geringfügig höher waren. Die absolute Bioverfügbarkeit sowohl von EPIVIR Tabletten als auch der Lösung zum Einnehmen ist bei Kindern geringer als bei Erwachsenen. Die relative Bioverfügbarkeit von EPIVIR Lösung zum Einnehmen ist bei pädiatrischen Patienten etwa 40 % niedriger als bei Tabletten, die Lamivudin enthalten, obwohl es keinen Unterschied bei Erwachsenen gibt. Niedrigere Lamivudin-Expositionen bei pädiatrischen Patienten, die EPIVIR 150 mg Lösung zum Einnehmen erhalten, sind wahrscheinlich auf die Wechselwirkung zwischen Lamivudin und gleichzeitig angewendeten sorbitolhaltigen Lösungen (wie ZIAGEN) zurückzuführen. Die Modellierung der pharmakokinetischen Daten legt nahe, dass die Dosierung von EPIVIR Lösung zum Einnehmen auf 5 mg pro kg oral zweimal täglich oder 10 mg pro kg oral einmal täglich (bis zu einem Maximum von 300 mg täglich) erhöht werden muss, um ausreichende Konzentrationen von Lamivudin zu erreichen [siehe DOSIERUNG UND ANWENDUNG ]. Es liegen keine klinischen Daten bei HIV-1-infizierten pädiatrischen Patienten vor, die zusammen mit sorbitolhaltigen Arzneimitteln in dieser Dosis verabreicht wurden.
Die Pharmakokinetik von einmal täglich verabreichtem Lamivudin bei HIV-1-infizierten pädiatrischen Probanden im Alter von 3 Monaten bis 12 Jahren wurde in 3 Studien untersucht (PENTA-15 [n = 17], PENTA 13 [n = 19] und ARROW PK [n = 35]). Bei allen 3 Studien handelte es sich um offene pharmakokinetische Crossover-Studien über 2 Perioden mit zweimaliger versus einmal täglicher Gabe von Abacavir und Lamivudin. Diese 3 Studien zeigten, dass die einmal tägliche Gabe eine ähnliche AUC0-24 liefert wie die zweimal tägliche Gabe von Lamivudin bei derselben Gesamttagesdosis, wenn die Dosierungsschemata innerhalb derselben Formulierung (dh entweder der Lösung zum Einnehmen oder der Tablettenformulierung) verglichen wurden. Die mittlere Cmax war bei einmal täglicher Gabe von Lamivudin etwa 80 % bis 90 % höher als bei zweimal täglicher Gabe.
Die Verteilung von Lamivudin in die Zerebrospinalflüssigkeit (CSF) wurde bei 38 pädiatrischen Probanden nach mehrfacher oraler Gabe von Lamivudin untersucht. CSF-Proben wurden zwischen 2 und 4 Stunden nach der Verabreichung gesammelt. Bei einer Dosis von 8 mg pro kg pro Tag lagen die CSF-Lamivudinkonzentrationen bei 8 Probanden im Bereich von 5,6 % bis 30,9 % (Mittelwert ± Standardabweichung von 14,2 % ± 7,9 %) der Konzentration in einer gleichzeitigen Serumprobe, wobei die CSF-Lamivudinkonzentrationen im Bereich von 0,04 bis 0,3 mcg pro ml.
Es liegen begrenzte, unkontrollierte pharmakokinetische und Sicherheitsdaten zur Verabreichung von Lamivudin (und Zidovudin) an 36 Säuglinge im Alter von bis zu 1 Woche in 2 Studien in Südafrika vor. In diesen Studien war die Lamivudin-Clearance bei 1 Woche alten Neugeborenen im Vergleich zu zuvor untersuchten pädiatrischen Probanden (über 3 Monate) erheblich verringert. Es liegen keine ausreichenden Informationen vor, um den zeitlichen Verlauf der Veränderungen der Clearance zwischen der unmittelbaren Neugeborenenperiode und den Altersgruppen über 3 Monate festzustellen [siehe NEBENWIRKUNGEN ].
Geriatrische Patienten
Die Pharmakokinetik von Lamivudin nach Verabreichung von EPIVIR 150 mg an Personen über 65 Jahre wurde nicht untersucht [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Männliche und weibliche Patienten
Es gibt keine signifikanten oder klinisch relevanten geschlechtsspezifischen Unterschiede in der Pharmakokinetik von Lamivudin.
Rassengruppen
Es gibt keine signifikanten oder klinisch relevanten Rassenunterschiede in der Pharmakokinetik von Lamivudin.
Arzneimittelwechselwirkungsstudien
Wirkung von Lamivudin auf die Pharmakokinetik anderer Wirkstoffe
Basierend auf den Ergebnissen von In-vitro-Studien ist nicht zu erwarten, dass Lamivudin bei therapeutischer Arzneimittelexposition die Pharmakokinetik von Arzneimitteln beeinflusst, die Substrate der folgenden Transporter sind: Organic Anion Transporter Polypeptide 1B1/3 (OATP1B1/3), Breast Cancer Resistance Protein (BCRP), P-Glycoprotein (P-gp), Multidrug and Toxin Extrusion Protein 1 (MATE)1, MATE2-K, Transporter für organische Kationen 1 (OCT)1, OCT2 oder OCT3.
Wirkung anderer Wirkstoffe auf die Pharmakokinetik von Lamivudin
Lamivudin ist in vitro ein Substrat von MATE1, MATE2-K und OCT2. Es wurde gezeigt, dass Trimethoprim (ein Inhibitor dieser Arzneimitteltransporter) die Plasmakonzentrationen von Lamivudin erhöht. Diese Wechselwirkung wird nicht als klinisch signifikant angesehen, da keine Dosisanpassung von Lamivudin erforderlich ist.
Lamivudin ist ein Substrat von P-gp und BCRP; in Anbetracht seiner absoluten Bioverfügbarkeit (87 %) ist es jedoch unwahrscheinlich, dass diese Transporter eine signifikante Rolle bei der Resorption von Lamivudin spielen. Daher ist es unwahrscheinlich, dass die gleichzeitige Verabreichung von Arzneimitteln, die diese Efflux-Transporter hemmen, die Disposition und Elimination von Lamivudin beeinflusst.
Interferon Alfa
In einer Studie mit 19 gesunden männlichen Probanden gab es keine signifikante pharmakokinetische Wechselwirkung zwischen Lamivudin und Interferon alfa [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Ribavirin
In-vitro-Daten weisen darauf hin, dass Ribavirin die Phosphorylierung von Lamivudin, Stavudin und Zidovudin reduziert. Es wurden jedoch keine pharmakokinetischen (z. B. Plasmakonzentrationen oder intrazelluläre Konzentrationen von triphosphorylierten aktiven Metaboliten) oder pharmakodynamischen (z. B. Verlust der virologischen HIV-1/HCV-Suppression) Wechselwirkungen beobachtet, wenn Ribavirin und Lamivudin (n = 18), Stavudin (n = 10) , oder Zidovudin (n = 6) wurden als Teil einer Kombinationstherapie mit HIV-1/HCV-koinfizierten Probanden gleichzeitig verabreicht [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Sorbit (Hilfsstoff)
Lamivudin- und Sorbitollösungen wurden 16 gesunden erwachsenen Probanden in einer unverblindeten Crossover-Studie mit randomisierter Sequenz über 4 Perioden gleichzeitig verabreicht. Jeder Proband erhielt eine Einzeldosis von 300 mg Lamivudin-Lösung zum Einnehmen allein oder zusammen mit einer Einzeldosis von 3,2 Gramm, 10,2 Gramm oder 13,4 Gramm Sorbit in Lösung verabreicht. Die gleichzeitige Verabreichung von Lamivudin mit Sorbit führte zu einer dosisabhängigen Abnahme der AUC(0-24) um 20 %, 39 % und 44 %, der AUC(∞) um 14 %, 32 % und 36 % und um 28 %. 52 % und 55 % im Cmax; von Lamivudin bzw.
Trimethoprim/Sulfamethoxazol
Lamivudin und TMP/SMX wurden 14 HIV-1-positiven Probanden in einer monozentrischen, unverblindeten, randomisierten Crossover-Studie gleichzeitig verabreicht. Jeder Proband erhielt eine Behandlung mit einer Einzeldosis von 300 mg Lamivudin und TMP 160 mg/SMX 800 mg einmal täglich für 5 Tage bei gleichzeitiger Gabe von 300 mg Lamivudin mit der fünften Dosis in einem Crossover-Design. Die gleichzeitige Verabreichung von TMP/SMX mit Lamivudin führte zu einem Anstieg der AUC∞ von Lamivudin um 43 % ± 23 % (Mittelwert ± Standardabweichung), einer Abnahme der oralen Clearance von Lamivudin um 29 % ± 13 % und einer Abnahme der oralen Clearance von 30 % ± 36 % Renale Clearance von Lamivudin. Die pharmakokinetischen Eigenschaften von TMP und SMX wurden durch die gleichzeitige Verabreichung mit Lamivudin nicht verändert. Es liegen keine Informationen über die Wirkung auf die Pharmakokinetik von Lamivudin bei höheren Dosen von TMP/SMX vor, wie sie zur Behandlung von PCP verwendet werden.
Zidovudin
Bei 12 asymptomatischen HIV-1-infizierten erwachsenen Probanden, die eine Einzeldosis Zidovudin (200 mg) in Kombination mit mehreren Dosen Lamivudin (300 mg alle 12 Stunden) erhielten, wurden keine klinisch signifikanten Veränderungen der Pharmakokinetik von Lamivudin oder Zidovudin beobachtet.
Mikrobiologie
Wirkmechanismus
Lamivudin ist ein synthetisches Nukleosid-Analogon. Intrazellulär wird Lamivudin zu seinem aktiven 5'-Triphosphat-Metaboliten Lamivudintriphosphat (3TC-TP) phosphoryliert. Die Hauptwirkungsweise von 3TC-TP ist die Hemmung der reversen Transkriptase (RT) von HIV-1 über den DNA-Kettenabbruch nach Einbau des Nukleotidanalogons.
Antivirale Aktivität
Die antivirale Aktivität von Lamivudin gegen HIV-1 wurde in einer Reihe von Zelllinien, einschließlich Monozyten und frischen humanen peripheren Blutlymphozyten (PBMCs), unter Verwendung von Standard-Empfindlichkeitsassays untersucht. Die EC50-Werte lagen im Bereich von 0,003 bis 15 Mikromol (1 Mikromol = 0,23 Mikrogramm pro ml). Die mittleren EC50-Werte von Lamivudin waren 60 nM (Bereich: 20 bis 70 nM), 35 nM (Bereich: 30 bis 40 nM), 30 nM (Bereich: 20 bis 90 nM), 20 nM (Bereich: 3 bis 40 nM). , 30 nM (Bereich: 1 bis 60 nM), 30 nM (Bereich: 20 bis 70 nM), 30 nM (Bereich: 3 bis 70 nM) und 30 nM (Bereich: 20 bis 90 nM) gegen HIV-1-Kladen AG- bzw. Gruppe-O-Viren (n = 3 außer n = 2 für Klade B). Die EC50-Werte gegen HIV-2-Isolate (n = 4) reichten von 0,003 bis 0,120 Mikromol in PBMCs. Lamivudin war nicht antagonistisch gegenüber allen getesteten Anti-HIV-Mitteln. Ribavirin (50 microM), das zur Behandlung einer chronischen HCV-Infektion verwendet wurde, verringerte die Anti-HIV-1-Aktivität von Lamivudin in MT-4-Zellen um das 3,5-fache.
Widerstand
Lamivudin-resistente Varianten von HIV-1 wurden in Zellkultur selektiert. Die genotypische Analyse zeigte, dass die Resistenz auf eine spezifische Aminosäuresubstitution in der reversen Transkriptase von HIV-1 bei Codon 184 zurückzuführen war, die das Methionin entweder zu Valin oder zu Isoleucin (M184V/I) veränderte.
Bei Probanden wurden sowohl gegen Lamivudin als auch gegen Zidovudin resistente HIV-1-Stämme isoliert. Die Empfindlichkeit klinischer Isolate gegenüber Lamivudin und Zidovudin wurde in kontrollierten klinischen Studien überwacht. Bei Patienten, die eine Lamivudin-Monotherapie oder eine Kombinationstherapie mit Lamivudin plus Zidovudin erhielten, wurden die HIV-1-Isolate der meisten Patienten innerhalb von 12 Wochen phänotypisch und genotypisch resistent gegen Lamivudin.
Genotypische und phänotypische Analyse von HIV-1-Isolaten während der Therapie von Probanden mit virologischem Versagen
Versuch EPV20001
Dreiundfünfzig von 554 (10 %) Patienten, die in EPV20001 aufgenommen wurden, wurden bis Woche 48 als virologisches Versagen (Plasma-HIV-1-RNA-Spiegel größer oder gleich 400 Kopien pro ml) identifiziert. tägliche Behandlungsgruppe und 25 in der Lamivudin-Behandlungsgruppe zweimal täglich. Die medianen HIV-1-RNA-Plasmaspiegel zu Studienbeginn der Probanden in der Gruppe mit einmal täglicher Lamivudin-Einnahme und der Gruppe mit zweimal täglicher Lamivudin-Einnahme betrugen 4,9 log10 Kopien pro ml bzw. 4,6 log10 Kopien pro ml.
Die genotypische Analyse von Isolaten unter Therapie von 22 Probanden, die in der Gruppe mit einmal täglicher Lamivudin-Gabe als virologisches Versagen identifiziert wurden, zeigte, dass Isolate von 8 von 22 Probanden eine behandlungsbedingte Lamivudin-Resistenz-assoziierte Substitution (M184V oder M184I) aufwiesen, Isolate von 0 von 22 Patienten wiesen behandlungsbedingte Aminosäuresubstitutionen auf, die mit einer Zidovudin-Resistenz assoziiert waren (M41L, D67N, K70R, L210W, T215Y/F oder K219Q/E), und Isolate von 10 von 22 Studienteilnehmern enthielten behandlungsbedingte Aminosäuresubstitutionen, die mit einer Efavirenz-Resistenz assoziiert waren ( L100I, K101E, K103N, V108I oder Y181C).
Genotypische Analysen von Isolaten unter Therapie von Probanden (n = 22) in der Gruppe, die zweimal täglich mit Lamivudin behandelt wurde, zeigten, dass Isolate von 5 von 22 Probanden behandlungsbedingte Lamivudin-Resistenzsubstitutionen aufwiesen, Isolate von 1 von 22 Probanden behandlungsbedingte Zidovudin-Resistenz aufwiesen Substitutionen und Isolate von 7 von 22 Probanden enthielten behandlungsbedingte Efavirenz-Resistenz-Substitutionen.
Die phänotypische Analyse von HIV-1-Isolaten unter Therapie mit übereinstimmenden Ausgangswerten von Probanden (n = 13), die Lamivudin einmal täglich erhielten, zeigte, dass Isolate von 7 von 13 Probanden eine 85- bis 299-fache Abnahme der Empfindlichkeit gegenüber Lamivudin zeigten, Isolate von 12 von 13 Probanden waren empfindlich gegenüber Zidovudin und Isolate von 8 von 13 Probanden zeigten eine 25- bis 295-fache Abnahme der Empfindlichkeit gegenüber Efavirenz.
Die phänotypische Analyse von HIV-1-Isolaten mit Baseline-Matching unter Therapie von Probanden (n = 13), die zweimal täglich Lamivudin erhielten, zeigte, dass Isolate von 4 von 13 Probanden eine 29- bis 159-fache Abnahme der Empfindlichkeit gegenüber Lamivudin aufwiesen, Isolate von allen 13 Die Probanden waren empfindlich gegenüber Zidovudin, und Isolate von 3 von 13 Probanden zeigten eine 21- bis 342-fache Abnahme der Empfindlichkeit gegenüber Efavirenz.
Versuch EPV40001
Fünfzig Probanden erhielten Lamivudin 300 mg einmal täglich plus Zidovudin 300 mg zweimal täglich plus Abacavir 300 mg zweimal täglich und 50 Probanden erhielten Lamivudin 150 mg plus Zidovudin 300 mg plus Abacavir 300 mg alle zweimal täglich. Die medianen HIV-1-RNA-Plasmaspiegel zu Studienbeginn betrugen für die Probanden in den beiden Gruppen 4,79 log10 Kopien pro ml bzw. 4,83 log10 Kopien pro ml. Vierzehn von 50 Probanden in der Behandlungsgruppe mit einmal täglich Lamivudin und 9 von 50 Probanden in der Gruppe mit zweimal täglich Lamivudin wurden als virologisches Versagen identifiziert.
Die Genotypanalyse von HIV-1-Isolaten unter Therapie von Probanden (n = 9) in der einmal täglich mit Lamivudin behandelten Gruppe zeigte, dass Isolate von 6 Probanden eine Abacavir- und/oder Lamivudin-Resistenz-assoziierte Substitution M184V allein aufwiesen. Isolate unter Therapie von Probanden (n = 6), die zweimal täglich Lamivudin erhielten, zeigten, dass Isolate von 2 Probanden nur M184V aufwiesen und Isolate von 2 Probanden die M184V-Substitution in Kombination mit mit Zidovudinresistenz assoziierten Aminosäuresubstitutionen aufwiesen.
Die phänotypische Analyse von Isolaten unter Therapie von Probanden (n = 6), die einmal täglich Lamivudin erhielten, zeigte, dass HIV-1-Isolate von 4 Probanden eine 32- bis 53-fache Abnahme der Empfindlichkeit gegenüber Lamivudin aufwiesen. HIV-1-Isolate dieser 6 Probanden waren empfindlich gegenüber Zidovudin.
Die phänotypische Analyse von Isolaten unter Therapie von Probanden (n = 4), die zweimal täglich Lamivudin erhielten, zeigte, dass HIV-1-Isolate von 1 Proband eine 45-fache Abnahme der Empfindlichkeit gegenüber Lamivudin und eine 4,5-fache Abnahme der Empfindlichkeit gegenüber Zidovudin aufwiesen.
Pädiatrie
Kinder und Jugendliche, die Lamivudin-Lösung zum Einnehmen gleichzeitig mit anderen antiretroviralen Lösungen zum Einnehmen (Abacavir, Nevirapin/Efavirenz oder Zidovudin) in ARROW erhielten, entwickelten häufiger eine Virusresistenz als diejenigen, die Tabletten erhielten. Bei der Randomisierung auf einmal tägliche oder zweimal tägliche Dosierung von EPIVIR plus Abacavir hatten 13 % der Patienten, die mit Tabletten begannen, und 32 % der Patienten, die mit Lösung begannen, Resistenzsubstitutionen. Das in der Pädiatrie beobachtete Resistenzprofil ähnelt dem bei Erwachsenen beobachteten in Bezug auf die nachgewiesenen genotypischen Substitutionen und die relative Häufigkeit, wobei die am häufigsten nachgewiesenen Substitutionen bei M184 (V oder I) [siehe Klinische Studien ].
Kreuzresistenz
Bei nukleosidischen Reverse-Transkriptase-Hemmern (NRTIs) wurde Kreuzresistenz beobachtet. Lamivudin-resistente HIV-1-Mutanten waren in Zellkulturen kreuzresistent gegenüber Didanosin (ddI). Kreuzresistenz wird auch mit Abacavir und Emtricitabin erwartet, da diese M184V-Substitutionen auswählen.
Klinische Studien
Die Anwendung von EPIVIR basiert auf den Ergebnissen klinischer Studien bei HIV-1-infizierten Personen in Kombinationstherapien mit anderen antiretroviralen Wirkstoffen. Informationen aus Studien mit klinischen Endpunkten oder einer Kombination aus CD4+-Zellzahlen und HIV-1-RNA-Messungen sind unten als Dokumentation des Beitrags von Lamivudin zu einem Kombinationsschema in kontrollierten Studien enthalten.
Erwachsene Themen
Klinische Endpunktstudie
NUCB3007 (CAESAR) war eine multizentrische, doppelblinde, placebokontrollierte Studie, in der die Fortführung der derzeitigen Therapie (Zidovudin allein [62 % der Studienteilnehmer] oder Zidovudin mit Didanosin oder Zalcitabin [38 % der Studienteilnehmer]) mit der Zugabe von EPIVIR 150 mg oder EPIVIR verglichen wurde 150 mg plus ein nicht-nukleosidischer Reverse-Transkriptase-Inhibitor (NNRTI) in der Erprobungsphase, randomisiert 1:2:1. Insgesamt 1.816 HIV-1-infizierte Erwachsene mit 25 bis 250 CD4+-Zellen pro mm³ (Median = 122 Zellen pro mm³) zu Studienbeginn wurden in die Studie aufgenommen: Das mediane Alter betrug 36 Jahre, 87 % waren männlich, 84 % waren Nukleosid-erfahren und 16 % waren therapienaiv. Die mediane Dauer der Studie betrug 12 Monate. Die Ergebnisse sind in Tabelle 9 zusammengefasst.
Surrogat-Endpunkt-Studien
Duale Nukleosid-Analoga-Studien
In den wichtigsten klinischen Studien in der anfänglichen Entwicklung von Lamivudin wurden Lamivudin/Zidovudin-Kombinationen mit Zidovudin-Monotherapie oder mit Zidovudin plus Zalcitabin verglichen. Diese Studien zeigten die antivirale Wirkung von Lamivudin in einer 2-Arzneimittel-Kombination. Neuere Verwendungen von Lamivudin bei der Behandlung von HIV-1-Infektionen integrieren es in mehrere Arzneimittelschemata, die mindestens 3 antiretrovirale Arzneimittel zur verstärkten Virussuppression enthalten.
Surrogat-Endpunktstudien zum Vergleich von Dosierungsschemata bei therapienaiven Erwachsenen
EPV20001 war eine multizentrische, doppelblinde, kontrollierte Studie, in der die Probanden 1:1 randomisiert wurden und EPIVIR 300 mg einmal täglich oder EPIVIR 150 mg zweimal täglich in Kombination mit Zidovudin 300 mg zweimal täglich und Efavirenz 600 mg einmal täglich erhielten. Insgesamt wurden 554 antiretroviral vorbehandelte HIV-1-infizierte Erwachsene aufgenommen: männlich (79 %), weiß (50 %), Durchschnittsalter 35 Jahre, CD4+-Zellzahl zu Studienbeginn von 69 bis 1.089 Zellen pro mm³ (Median = 362 Zellen pro mm³) und einen medianen Baseline-Plasma-HIV-1-RNA-Wert von 4,66 log10 Kopien pro ml. Die Behandlungsergebnisse über 48 Wochen sind in Abbildung 1 und Tabelle 10 zusammengefasst.
Abbildung 1: Virologisches Ansprechen bis Woche 48, EPV20001a,b (Intent-to-Treat) 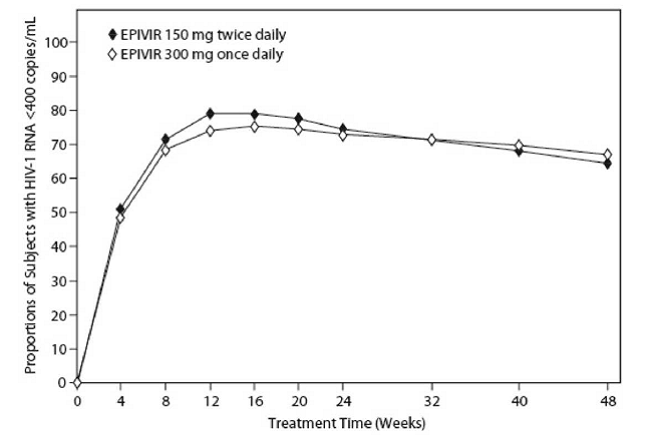
ein Roche AMPLICOR HIV-1 MONITOR. b Responder bei jedem Besuch sind Probanden, die bis zu diesem Besuch ohne Absetzen weniger als 400 HIV-1-RNA-Kopien pro ml erreicht und beibehalten haben.
Der Anteil der Patienten mit HIV-1-RNA von weniger als 50 Kopien pro ml (mittels Roche Ultrasensitive Assay) bis Woche 48 betrug 61 % bei Patienten, die EPIVIR 300 mg einmal täglich erhielten, und 63 % bei Patienten, die EPIVIR 150 mg zweimal täglich erhielten. Der mediane Anstieg der CD4+-Zellzahlen betrug 144 Zellen pro mm³ in Woche 48 bei Patienten, die EPIVIR 300 mg einmal täglich erhielten, und 146 Zellen pro mm³ bei Patienten, die EPIVIR 150 mg zweimal täglich erhielten.
Eine kleine, randomisierte, offene Pilotstudie, EPV40001, wurde in Thailand durchgeführt. Insgesamt 159 behandlungsnaive erwachsene Probanden (männlich 32 %, Asiaten 100 %, mittleres Alter 30 Jahre, mittlere CD4+-Zellzahl zu Studienbeginn 380 Zellen pro mm³, mittlere Plasma-HIV-1-RNA 4,8 log10 Kopien pro ml) wurden in die Studie aufgenommen. Zwei der Behandlungsarme in dieser Studie lieferten einen Vergleich zwischen Lamivudin 300 mg einmal täglich (n = 54) und Lamivudin 150 mg zweimal täglich (n = 52), jeweils in Kombination mit Zidovudin 300 mg zweimal täglich und Abacavir 300 mg zweimal täglich. In Intent-to-treat-Analysen von 48-Wochen-Daten betrug der Anteil der Probanden mit HIV-1-RNA unter 400 Kopien pro ml 61 % (33 von 54) in der Gruppe, die randomisiert Lamivudin einmal täglich erhielt, und 75 % (39 von 52) in der randomisierten Gruppe, die alle 3 Medikamente zweimal täglich erhielt; die Anteile mit HIV-1-RNA unter 50 Kopien pro ml betrugen 54 % (29 von 54) in der Gruppe mit Lamivudin einmal täglich und 67 % (35 von 52) in der Gruppe mit zweimal täglicher Gabe; und die medianen Anstiege der CD4+-Zellzahlen betrugen 166 Zellen pro mm³ in der Gruppe mit Lamivudin einmal täglich und 216 Zellen pro mm³ in der Gruppe mit zweimal täglicher Gabe.
Pädiatrische Fächer
Klinische Endpunktstudie
ACTG300 war eine multizentrische, randomisierte, doppelblinde Studie, die einen Vergleich von EPIVIR plus RETROVIR (Zidovudin) mit einer Didanosin-Monotherapie ermöglichte. Insgesamt 471 symptomatische, HIV-1-infizierte therapienaive (weniger als oder gleich 56 Tage antiretrovirale Therapie) pädiatrische Probanden wurden in diese 2 Behandlungsarme aufgenommen. Das Durchschnittsalter betrug 2,7 Jahre (Bereich: 6 Wochen bis 14 Jahre), 58 % waren weiblich und 86 % nicht-weiß. Die mittlere CD4+-Zellzahl zu Studienbeginn betrug 868 Zellen pro mm³ (Mittelwert: 1.060 Zellen pro mm³ und Bereich: 0 bis 4.650 Zellen pro mm³ für Personen im Alter von bis zu 5 Jahren; Mittelwert: 419 Zellen pro mm³ und Bereich: 0 bis 1.555). Zellen pro mm³ bei Probanden über 5 Jahren) und der mittlere Plasma-HIV-1-RNA-Ausgangswert betrug 5,0 log10 Kopien pro ml. Die mediane Dauer der Studie betrug 10,1 Monate für die Probanden, die EPIVIR 150 mg plus RETROVIR erhielten, und 9,2 Monate für die Probanden, die Didanosin-Monotherapie erhielten. Die Ergebnisse sind in Tabelle 11 zusammengefasst.
Einmal tägliche Dosierung
ARROW (COL105677) war eine 5-jährige randomisierte, multizentrische Studie, die mehrere Aspekte der klinischen Behandlung einer HIV-1-Infektion bei pädiatrischen Probanden untersuchte. HIV-1-infizierte, behandlungsnaive Probanden im Alter von 3 Monaten bis 17 Jahren wurden aufgenommen und mit einem Erstlinienschema behandelt, das EPIVIR 150 mg und Abacavir enthielt, dosiert zweimal täglich gemäß den Empfehlungen der Weltgesundheitsorganisation. Nach einer Behandlungsdauer von mindestens 36 Wochen erhielten die Probanden die Möglichkeit, an Randomisierung 3 der ARROW-Studie teilzunehmen, in der die Sicherheit und Wirksamkeit einer einmal täglichen Gabe mit einer zweimal täglichen Gabe von EPIVIR und Abacavir in Kombination mit einem dritten antiretroviralen Medikament verglichen wurde Medikament, für weitere 96 Wochen. Von den 1.206 ursprünglichen ARROW-Patienten nahmen 669 an Randomisierung 3 teil. Eine virologische Suppression war keine Voraussetzung für die Teilnahme: zu Studienbeginn für Randomisierung 3 (nach mindestens 36 Wochen zweimal täglicher Behandlung) 75 % der Patienten in der zweimal täglichen Behandlung Kohorte waren virologisch supprimiert, verglichen mit 71 % der Patienten in der einmal täglich verabreichten Kohorte.
Der Anteil der Studienteilnehmer mit HIV-1-RNA von weniger als 80 Kopien pro ml über 96 Wochen ist in Tabelle 12 dargestellt. Die Unterschiede zwischen dem virologischen Ansprechen in den beiden Behandlungsarmen waren über die Baseline-Merkmalen für Geschlecht und Alter hinweg vergleichbar.
Analysen nach Formulierung zeigten, dass der Anteil der Patienten mit HIV-1-RNA von weniger als 80 Kopien pro ml bei Randomisierung und in Woche 96 höher war bei Patienten, die Tablettenformulierungen von EPIVIR 150 mg und Abacavir erhalten hatten (75 % [458/610] und 72 % [434/601]) als bei denjenigen, die eine oder mehrere Lösungsformulierungen (mit EPIVIR 150 mg Lösung in gewichtsabhängigen Dosen von etwa 8 mg pro kg pro Tag) zu irgendeinem Zeitpunkt erhalten hatten (52 % [29/56] und 54 % [30/56]), bzw. [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Diese Unterschiede wurden in jeder bewerteten Altersgruppe beobachtet.
INFORMATIONEN ZUM PATIENTEN
EPIVIR (EP-i-veer) (Lamivudin) Tabletten
EPIVIR (EP-i-veer) (Lamivudin) Lösung zum Einnehmen
Was sind die wichtigsten Informationen, die ich über EPIVIR 150 mg wissen sollte?
EPIVIR kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Was ist EPIVIR?
EPIVIR ist ein verschreibungspflichtiges Arzneimittel, das zusammen mit anderen antiretroviralen Arzneimitteln zur Behandlung einer Infektion mit dem humanen Immunschwächevirus (HIV-1) angewendet wird.
HIV-1 ist das Virus, das das erworbene Immunschwächesyndrom (AIDS) verursacht.
EPIVIR Tabletten und Lösung zum Einnehmen (zur Behandlung einer HIV-1-Infektion) enthalten eine höhere Dosis des gleichen Wirkstoffs (Lamivudin) als das Arzneimittel EPIVIR-HBV Tabletten und Lösung zum Einnehmen (zur Behandlung von HBV). Wenn Sie sowohl HIV-1 als auch HBV haben, sollten Sie EPIVIR-HBV nicht zur Behandlung Ihrer Infektionen anwenden.
Die Sicherheit und Wirksamkeit von EPIVIR wurde bei Kindern unter 3 Monaten nicht nachgewiesen.
Wer sollte EPIVIR 150 mg nicht einnehmen?
Nehmen Sie EPIVIR nicht ein wenn Sie allergisch gegen Lamivudin oder einen der sonstigen Bestandteile von EPIVIR sind. Eine vollständige Liste der Inhaltsstoffe von EPIVIR finden Sie am Ende dieser Packungsbeilage.
Was sollte ich meinem Arzt vor der Einnahme von EPIVIR mitteilen?
Informieren Sie vor der Einnahme von EPIVIR 150 mg Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen.
Einige Medikamente interagieren mit EPIVIR. Führen Sie eine Liste Ihrer Arzneimittel und zeigen Sie diese Ihrem Arzt und Apotheker, wenn Sie ein neues Arzneimittel erhalten. Sie können Ihren Arzt oder Apotheker nach einer Liste von Arzneimitteln fragen, die mit EPIVIR interagieren.
Beginnen Sie nicht mit der Einnahme eines neuen Arzneimittels, ohne es Ihrem Arzt mitzuteilen. Ihr Arzt kann Ihnen sagen, ob es sicher ist, EPIVIR zusammen mit anderen Arzneimitteln einzunehmen.
Wie soll ich EPIVIR einnehmen?
Welche Nebenwirkungen kann EPIVIR 150 mg haben?
Es ist wahrscheinlicher, dass Sie eine Laktatazidose oder schwere Leberprobleme bekommen, wenn Sie eine Frau oder sehr übergewichtig (fettleibig) sind.
Rufen Sie sofort Ihren Arzt an, wenn Ihr Kind Anzeichen und Symptome einer Pankreatitis entwickelt, einschließlich schwerer Schmerzen im oberen Bauchbereich, mit oder ohne Übelkeit und Erbrechen. Ihr medizinischer Betreuer kann Sie anweisen, Ihrem Kind EPIVIR 150 mg nicht mehr zu verabreichen, wenn die Symptome und Bluttestergebnisse zeigen, dass Ihr Kind möglicherweise eine Pankreatitis hat.
Zu den häufigsten Nebenwirkungen von EPIVIR 150 mg bei Erwachsenen gehören:
Die häufigsten Nebenwirkungen von EPIVIR 150 mg bei Kindern sind Fieber und Husten.
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von EPIVIR. Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist EPIVIR aufzubewahren?
Bewahren Sie EPIVIR und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von EPIVIR.
Arzneimittel werden manchmal zu anderen als den in der Packungsbeilage aufgeführten Zwecken verschrieben. Verwenden Sie EPIVIR nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie EPIVIR nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Sie können Ihren Arzt oder Apotheker um Informationen zu EPIVIR 150 mg bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Weitere Informationen erhalten Sie unter www.viivhealthcare.com oder telefonisch unter 1-877-844-8872.
Welche Inhaltsstoffe enthält EPIVIR 150 mg?
Wirkstoff: Lamivudin
Inaktive Zutaten:
EPIVIR 150 mg erzielte 150-mg-Filmtabletten: Hypromellose, Magnesiumstearat, mikrokristalline Cellulose, Polyethylenglykol, Polysorbat 80, Natriumstärkeglykolat und Titandioxid.
EPIVIR 300 mg Filmtabletten: schwarzes Eisenoxid, Hypromellose, Magnesiumstearat, mikrokristalline Cellulose, Polyethylenglykol, Polysorbat 80, Natriumstärkeglykolat und Titandioxid.
EPIVIR 150 mg Lösung zum Einnehmen: künstliche Erdbeer- und Bananenaromen, Zitronensäure (wasserfrei), Methylparaben, Propylenglykol, Propylparaben, Natriumcitrat (Dihydrat) und Saccharose (200 mg pro ml).
Diese Patienteninformation wurde von der US Food and Drug Administration genehmigt.