Zovirax 200mg, 400mg, 800mg Acyclovir Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Zovirax 800 mg und wie wird es angewendet?
Zovirax ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Lippenherpes (Herpes labialis) und Herpes genitalis. Zovirax 800 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Zovirax 400 mg gehört zu einer Klasse von Arzneimitteln, die Virostatika, topisch genannt werden.
Es ist nicht bekannt, ob Zovirax 200 mg bei Kindern unter 12 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Zovirax 800 mg haben?
Zovirax 200 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Zovirax gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Zovirax. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
ZUSAMMENFASSENDE PRODUKTINFORMATIONEN
Wirkstoff
Eigenname: Aciclovir
Chemischer Name: 9-[(2-Hydroxyethoxy)methyl]guanin
Anderer Name: Acycloguanosin
Molekularformel: C8H11N503
Molekulare Masse: 225.2 Strukturformel:
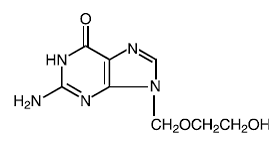
Physikalisch-chemische Eigenschaften: Aciclovir ist ein weißes, kristallines Pulver mit einer maximalen Löslichkeit in Wasser von 1,3 mg/ml bei 25 °C.
INDIKATIONEN
Indikationen und klinische Anwendung
ZOVIRAX® (Aciclovir) ist bei folgenden Erkrankungen indiziert:
Die Ergebnisse klinischer Studien deuten darauf hin, dass einige Patienten mit rezidivierendem Herpes genitalis einen klinischen Nutzen aus der oralen Verabreichung von ZOVIRAX® ziehen können, wenn es beim ersten Anzeichen einer bevorstehenden Episode eingenommen wird. Diejenigen, die am wahrscheinlichsten davon profitieren, sind Patienten, die schwere, anhaltende Rezidive erleiden; eine solche intermittierende Therapie kann angemessener sein als eine Suppressionstherapie, wenn diese Rezidive selten sind.
Eine frühzeitige Behandlung von akutem Herpes zoster (Gürtelrose) bei immunkompetenten Personen mit oral verabreichtem ZOVIRAX® führte zu einer verringerten Virusausscheidung; verkürzte Zeit bis zur Heilung; weniger Verbreitung; und Linderung akuter Schmerzen.
Die Behandlung von Varizellen (Windpocken) bei immunkompetenten Patienten mit oral verabreichtem ZOVIRAX® reduzierte die Gesamtzahl der Läsionen, beschleunigte das Fortschreiten der Läsionen in das verkrustete und geheilte Stadium und verringerte die Anzahl der verbleibenden hypopigmentierten Läsionen. Darüber hinaus verringerte ZOVIRAX® Fieber und konstitutionelle Symptome im Zusammenhang mit Windpocken.
Die prophylaktische Anwendung von Aciclovir bei Windpocken wurde nicht nachgewiesen.
Geriatrie (≥ 65 Jahre): Die Anwendung in der geriatrischen Population kann aufgrund altersbedingter Veränderungen der Nierenfunktion mit Unterschieden in der Sicherheit verbunden sein, und eine kurze Diskussion findet sich in den entsprechenden Abschnitten (siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ).
Pädiatrie ( Es sind keine Daten verfügbar.
DOSIERUNG UND ANWENDUNG
Überlegungen zur Dosierung
Empfohlene Dosis und Dosisanpassung
Behandlung einer Erstinfektion mit Herpes genitalis: 200 mg (eine 200-mg-Tablette oder ein Teelöffel Suspension [5 ml]) alle 4 Stunden, 5-mal täglich für insgesamt 1 g täglich für 10 Tage. Die Therapie sollte so früh wie möglich nach Auftreten der Anzeichen und Symptome begonnen werden.
Unterdrückungstherapie bei rezidivierendem Herpes genitalis
Die empfohlene Anfangsdosis beträgt 200 mg (eine 200-mg-Tablette oder ein Teelöffel Suspension [5 ml]) dreimal täglich. Diese kann erhöht werden, wenn ein Durchbruch auftritt, bis zu einer Dosis von einer 200-mg-Tablette oder einem Teelöffel [5 ml] Suspension fünfmal täglich. Falls erforderlich, kann eine Dosis von 400 mg (zwei 200-mg-Tabletten oder zwei Teelöffel Suspension [10 ml]) zweimal täglich in Erwägung gezogen werden. Eine regelmäßige Neubewertung der Notwendigkeit einer Therapie wird empfohlen.
Die Verabreichung von ZOVIRAX® für die intermittierende Therapie beträgt 200 mg (eine 200-mg-Tablette oder ein Teelöffel [5 ml] Suspension) alle 4 Stunden 5-mal täglich für 5 Tage. Die Therapie sollte beim frühesten Anzeichen oder Symptom (Prodrom) eines Rezidivs eingeleitet werden.
Behandlung von Herpes zoster
800 mg ZOVIRAX® oral, alle 4 Stunden, 5-mal täglich für 7 bis 10 Tage. Die Behandlung sollte innerhalb von 72 Stunden nach Auftreten der Läsionen begonnen werden. In klinischen Studien trat der größte Nutzen auf, wenn die Behandlung innerhalb von 48 Stunden nach Auftreten der Läsionen begonnen wurde.
Behandlung von Windpocken
20 mg/kg (nicht mehr als 800 mg) oral, 4-mal täglich für 5 Tage. Die Therapie sollte innerhalb von 24 Stunden nach Auftreten des Hautausschlags begonnen werden.
Patienten mit akuter oder chronischer Niereninsuffizienz
Bei der Verabreichung von Aciclovir an Patienten mit eingeschränkter Nierenfunktion ist Vorsicht geboten. Eine ausreichende Hydratation sollte beibehalten werden.
Umfassende pharmakokinetische Studien wurden nach intravenösen Aciclovir-Infusionen bei Patienten mit eingeschränkter Nierenfunktion durchgeführt.
Basierend auf diesen Studien werden in Tabelle 5 Dosierungsanpassungen für Herpes genitalis und Herpes zoster empfohlen.
Hämodialyse
Bei hämodialysepflichtigen Patienten beträgt die mittlere Plasmahalbwertszeit von Aciclovir während der Hämodialyse etwa 5 Stunden. Dies führt zu einer Abnahme der Plasmakonzentrationen um 60 % nach einer sechsstündigen Dialyseperiode. Daher sollte das Dosierungsschema des Patienten so angepasst werden, dass nach jeder Dialyse eine zusätzliche Dosis verabreicht wird.
Peritonealdialyse
Nach Anpassung des Dosierungsintervalls scheint keine zusätzliche Dosis erforderlich zu sein.
Verpasste Dosis
Wenn eine Dosis von ZOVIRAX® vergessen wird, sollte der Patient angewiesen werden, diese einzunehmen, sobald er/sie sich daran erinnert, und dann mit der nächsten Dosis im richtigen Zeitintervall fortzufahren.
WIE GELIEFERT
Lagerung und Stabilität
ZOVIRAX® Tabletten sollten bei kontrollierter Raumtemperatur (15 bis 25 °C) an einem trockenen Ort und vor Licht geschützt gelagert werden.
ZOVIRAX® Suspension sollte bei kontrollierter Raumtemperatur (15 bis 25 °C) gelagert werden.
Darreichungsformen, Zusammensetzung und Verpackung
Suspension: Jeder Teelöffel (5 ml) ZOVIRAX® Suspension enthält 200 mg Aciclovir und die nicht medizinischen Inhaltsstoffe Bananenaroma, Zellulose, Glycerin, Methylparaben, Propylparaben, Sorbitol, Vanillin und Wasser.
Jede ZOVIRAX® 200 Tablette enthält 200 mg Aciclovir und die nicht medizinischen Inhaltsstoffe Cellulose, Indigotin, Lactose, Magnesiumstearat, Povidon und Natriumstärkeglycolat.
ZOVIRAX® Suspension ist in Flaschen mit 125 ml* und 475 ml erhältlich. Jeder Teelöffel (5 ml) der cremefarbenen Suspension mit Bananengeschmack enthält 200 mg Aciclovir.
*125-ml-Flasche in Kanada nicht erhältlich
ZOVIRAX® 200 Tabletten sind in Flaschen mit 100 Tabletten erhältlich. Jede blaue, schildförmige, komprimierte Tablette mit abgeschrägten Kanten enthält 200 mg Aciclovir und ist auf einer Seite mit „ZOVIRAX“ und auf der Rückseite mit einem Dreieck bedruckt.
GlaxoSmithKline Inc., 7333 Mississauga Road, Mississauga, Ontario, L5N 6L4 1-800-387-7374. Überarbeitet: 10. November 2014
NEBENWIRKUNGEN
Übersicht über Nebenwirkungen von Arzneimitteln
Die häufigsten Nebenwirkungen im Zusammenhang mit der Anwendung von ZOVIRAX® (Aciclovir) sind Kopfschmerzen und Übelkeit.
In seltenen Fällen wurden auch neurologische Nebenwirkungen berichtet. Ältere Patienten und Patienten mit eingeschränkter Nierenfunktion in der Vorgeschichte haben ein erhöhtes Risiko, diese Wirkungen zu entwickeln. In den gemeldeten Fällen waren diese Reaktionen im Allgemeinen nach Absetzen der Behandlung reversibel (vgl WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN , Unerwünschte Arzneimittelwirkungen nach dem Inverkehrbringen ).
Unerwünschte Arzneimittelwirkungen in klinischen Studien
Da klinische Studien unter sehr spezifischen Bedingungen durchgeführt werden, spiegeln die in den klinischen Studien beobachteten Nebenwirkungsraten möglicherweise nicht die in der Praxis beobachteten Raten wider und sollten nicht mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden. Informationen zu unerwünschten Arzneimittelwirkungen aus klinischen Studien sind nützlich, um arzneimittelbedingte unerwünschte Ereignisse zu identifizieren und ungefähre Raten zu erhalten.
Behandlung von Herpes simplex
Kurzfristige Verabreichung (5-10 Tage): Die häufigsten Nebenwirkungen, die während klinischer Studien zur Behandlung von Herpes genitalis mit oralem ZOVIRAX® bei 298 Patienten berichtet wurden, sind in Tabelle 1 aufgeführt.
Unterdrückung von Herpes simplex
Langzeitanwendung: Die häufigsten unerwünschten Ereignisse, die in einer klinischen Studie zur Rezidivprophylaxe bei kontinuierlicher Verabreichung von 400 mg (zwei 200-mg-Kapseln) zweimal täglich berichtet wurden, sind in Tabelle 2 aufgeführt.
Die bisherige Evidenz aus klinischen Studien deutet darauf hin, dass die Schwere und Häufigkeit von unerwünschten Ereignissen wahrscheinlich keinen Abbruch der Therapie erforderlich machen.
Herpes zoster
Die häufigsten Nebenwirkungen, die in drei klinischen Studien zur Behandlung von Herpes zoster (Gürtelrose) mit 800 mg oralem ZOVIRAX® 5-mal täglich für 7 oder 10 Tage oder Placebo berichtet wurden, sind in Tabelle 3 aufgeführt.
Windpocken
Die häufigsten unerwünschten Ereignisse, die in drei klinischen Studien zur Behandlung von Windpocken mit oralem ZOVIRAX® oder Placebo berichtet wurden, sind in Tabelle 4 aufgeführt.
Weniger häufige unerwünschte Arzneimittelwirkungen in klinischen Studien (
Andere Nebenwirkungen, die bei weniger als 1 % der Patienten berichtet wurden, die ZOVIRAX® in einer klinischen Studie erhielten, waren: Bauchschmerzen, Anorexie, Verstopfung, Schwindel, Ödeme, Müdigkeit, Blähungen, Leistenadenopathie, Schlaflosigkeit, Beinschmerzen, Medikamentengeschmack, Hautausschlag, wunde Stellen Rachen, krampfartige Handbewegungen und Urtikaria.
Abnorme hämatologische und klinisch-chemische Befunde
In klinischen Studien zur Behandlung von Windpocken und Zoster sowie zur Behandlung und Unterdrückung von Herpes genitalis mit ZOVIRAX® wurden keine klinisch signifikanten Veränderungen der Laborwerte beobachtet.
Unerwünschte Arzneimittelwirkungen nach dem Inverkehrbringen
Die folgenden Ereignisse wurden freiwillig während der Anwendung von ZOVIRAX® nach Markteinführung in der klinischen Praxis gemeldet. Diese Ereignisse wurden entweder aufgrund ihres Schweregrads, ihrer Meldehäufigkeit, ihres möglichen kausalen Zusammenhangs mit ZOVIRAX® oder einer Kombination dieser Faktoren für die Aufnahme ausgewählt. Unerwünschte Ereignisse nach Markteinführung werden spontan von einer Population unbekannter Größe gemeldet, daher können keine Schätzungen der Häufigkeit vorgenommen werden.
Allgemein: Fieber, Kopfschmerzen, Schmerzen und periphere Ödeme.
Nervös: Schwindel, Parästhesien, Erregung, Verwirrtheit, Tremor, Ataxie, Dysarthrie, Halluzinationen, psychotische Symptome, Krämpfe, Somnolenz, Enzephalopathie und Koma wurden berichtet. Diese Ereignisse sind im Allgemeinen reversibel und werden normalerweise bei Patienten mit eingeschränkter Nierenfunktion oder mit anderen prädisponierenden Faktoren berichtet (siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ). Diese Symptome können besonders bei älteren Erwachsenen ausgeprägt sein.
Verdauungs: Durchfall, Magen-Darm-Beschwerden und Übelkeit.
Hämatologisch und lymphatisch: Anämie, Leukopenie, Lymphadenopathie und Thrombozytopenie.
Überempfindlichkeit und Haut: Alopezie, Erythema multiforme, Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, Hautausschläge einschließlich Lichtempfindlichkeit, Pruritus, Urtikaria, Dyspnoe, Angioödem und Anaphylaxie.
Hepatobiliärer Trakt und Bauchspeicheldrüse: Berichte über reversible Hyperbilirubinämie und erhöhte leberbezogene Enzyme. Hepatitis und Gelbsucht.
Bewegungsapparat: Myalgie.
Besondere Sinne: Visuelle Anomalien.
Urogenital: Erhöhtes Blut-Kreatinin und Blut-Harnstoff-Stickstoff (BUN). Über akutes Nierenversagen, Nierenschmerzen und Hämaturie wurde berichtet. Nierenschmerzen können mit Nierenversagen einhergehen (vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ).
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Arzneimittelwechselwirkungen
Es wurden keine klinisch signifikanten Wechselwirkungen festgestellt.
Aciclovir wird hauptsächlich unverändert über die aktive renale tubuläre Sekretion mit dem Urin ausgeschieden. Alle gleichzeitig verabreichten Arzneimittel, die mit diesem Mechanismus konkurrieren, können die Aciclovir-Plasmakonzentrationen erhöhen. Probenecid und Cimetidin erhöhen durch diesen Mechanismus die Fläche unter der Kurve (AUC) von Aciclovir und verringern die renale Clearance von Aciclovir. In ähnlicher Weise wurden Erhöhungen der Plasma-AUCs von Aciclovir und des inaktiven Metaboliten von Mycophenolatmofetil, einem Immunsuppressivum, das bei Transplantationspatienten verwendet wird, bei gleichzeitiger Verabreichung der Arzneimittel gezeigt. Aufgrund der breiten therapeutischen Breite von Aciclovir ist jedoch keine Dosisanpassung erforderlich.
Arzneimittel-Lebensmittel-Wechselwirkungen
Wechselwirkungen mit Lebensmitteln sind nicht bekannt (vgl Aktion und Klinische Pharmakologie , Pharmakokinetik ).
Arzneimittel-Kräuter-Wechselwirkungen
Wechselwirkungen mit pflanzlichen Produkten sind nicht bekannt.
Arzneimittel-Labortest-Wechselwirkungen
Wechselwirkungen mit Labortests wurden nicht festgestellt.
WARNUNGEN
ZOVIRAX (Aciclovir) Kapseln, Tabletten und Suspension sind nur zur oralen Einnahme bestimmt. Nierenversagen, in einigen Fällen mit Todesfolge, wurde unter Aciclovir-Therapie beobachtet (siehe NEBENWIRKUNGEN: Beobachtet während der klinischen Praxis und bei ÜBERDOSIERUNG ). Thrombotisch-thrombozytopenische Purpura/hämolytisch-urämisches Syndrom (TTP/HUS), das zum Tod führte, ist bei immungeschwächten Patienten aufgetreten, die eine Aciclovir-Therapie erhielten.
VORSICHTSMASSNAHMEN
Bei der Verabreichung von ZOVIRAX (Aciclovir) an Patienten mit eingeschränkter Nierenfunktion wird eine Dosisanpassung empfohlen (siehe DOSIERUNG UND ANWENDUNG ). Vorsicht ist auch geboten, wenn ZOVIRAX (Aciclovir) an Patienten verabreicht wird, die potenziell nephrotoxische Wirkstoffe erhalten, da dies das Risiko einer Nierenfunktionsstörung und/oder das Risiko reversibler Symptome des Zentralnervensystems erhöhen kann, wie sie bei Patienten berichtet wurden, die mit intravenösem Aciclovir behandelt wurden . Eine ausreichende Hydratation sollte beibehalten werden.
Herpes Zoster: Es liegen keine Daten zu einer Behandlung vor, die später als 72 Stunden nach Beginn des Zoster-Ausschlags begonnen wurde. Den Patienten sollte geraten werden, die Behandlung so bald wie möglich nach der Diagnose von Herpes zoster einzuleiten.
Genitale Herpesinfektionen: Die Patienten sollten darüber informiert werden, dass ZOVIRAX (Aciclovir) kein Heilmittel für Herpes genitalis ist. Es liegen keine Daten darüber vor, ob ZOVIRAX (Aciclovir) die Übertragung einer Infektion auf andere verhindert. Da Herpes genitalis eine sexuell übertragbare Krankheit ist, sollten Patienten den Kontakt mit Läsionen oder Geschlechtsverkehr vermeiden, wenn Läsionen und/oder Symptome vorhanden sind, um eine Ansteckung des Partners zu vermeiden. Herpes genitalis kann auch ohne Symptome durch asymptomatische Virusausscheidung übertragen werden. Wenn eine medizinische Behandlung eines Wiederauftretens von Herpes genitalis indiziert ist, sollten die Patienten angewiesen werden, die Therapie beim ersten Anzeichen oder Symptom einer Episode einzuleiten.
Windpocken: Windpocken bei ansonsten gesunden Kindern sind in der Regel eine selbstlimitierende Krankheit von leichter bis mittelschwerer Schwere. Jugendliche und Erwachsene haben tendenziell schwerere Erkrankungen. Die Behandlung wurde in den kontrollierten Studien innerhalb von 24 Stunden nach dem typischen Windpockenausschlag begonnen, und es liegen keine Informationen über die Auswirkungen einer später im Krankheitsverlauf begonnenen Behandlung vor.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Die unten aufgeführten Daten enthalten Hinweise auf Aciclovir-Spitzenkonzentrationen im Steady-State-Plasma, die bei Menschen beobachtet wurden, die mit 800 mg oral 5-mal täglich (Dosierung geeignet für die Behandlung von Herpes zoster) oder 200 mg oral 5-mal täglich (Dosierung geeignet für die Behandlung) behandelt wurden bei Herpes genitalis). Arzneimittelkonzentrationen im Plasma in Tierversuchen werden als Vielfaches der menschlichen Exposition gegenüber Aciclovir bei den höheren und niedrigeren Dosierungsplänen ausgedrückt (siehe KLINISCHE PHARMAKOLOGIE: Pharmakokinetik ).
Aciclovir wurde in lebenslangen Bioassays an Ratten und Mäusen mit täglichen Einzeldosen von bis zu 450 mg/kg, die per Schlundsonde verabreicht wurden, getestet. Es gab keinen statistisch signifikanten Unterschied im Auftreten von Tumoren zwischen behandelten und Kontrolltieren, noch verkürzte Aciclovir die Latenzzeit von Tumoren. Die maximalen Plasmakonzentrationen waren beim Maus-Bioassay 3- bis 6-mal höher als beim Menschen und beim Ratten-Bioassay 1- bis 2-mal höher als beim Menschen.
Aciclovir wurde in 16 In-vitro- und In-vivo-Gentoxizitätsassays getestet. Aciclovir war in 5 der Assays positiv.
Aciclovir beeinträchtigte weder die Fertilität noch die Reproduktion bei Mäusen (450 mg/kg/Tag, po) oder bei Ratten (25 mg/kg/Tag, sc). In der Mausstudie betrugen die Plasmaspiegel das 9- bis 18-fache der menschlichen Spiegel, während sie in der Rattenstudie das 8- bis 15-fache der menschlichen Spiegel waren. Bei höheren Dosen (50 mg/kg/Tag, sc) bei Ratten und Kaninchen (11- bis 22- bzw. 16- bis 31-fache Werte beim Menschen) war die Implantationswirksamkeit, aber nicht die Wurfgröße, verringert. In einer peri- und postnatalen Studie an Ratten mit 50 mg/kg/Tag, sc, gab es eine statistisch signifikante Abnahme der Gruppendurchschnittszahlen von Corpora lutea, Gesamtimplantationsstellen und lebenden Föten.
Bei Hunden, denen 50 mg/kg/Tag i.v. für 1 Monat (21- bis 41-faches menschliches Niveau) oder 60 mg/kg/Tag oral für 1 Jahr (6- bis 12-faches menschliches Niveau) verabreicht wurden, wurden keine Hodenanomalien beobachtet. Hodenatrophie und Aspermatogenese wurden bei Ratten und Hunden bei höheren Dosierungen beobachtet.
Schwangerschaft
Teratogene Wirkungen: Schwangerschaftskategorie B. Acyclovir, das während der Organogenese verabreicht wurde, war bei Maus (450 mg/kg/Tag, po), Kaninchen (50 mg/kg/Tag, subkutan und i.v.) oder Ratte (50 mg/kg/Tag, sc). Diese Expositionen führten zu Plasmaspiegeln, die 9- und 18-, 16- und 106- bzw. 11- und 22-mal so hoch waren wie beim Menschen.
Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. Ein prospektives epidemiologisches Register der Anwendung von Aciclovir während der Schwangerschaft wurde 1984 erstellt und im April 1999 fertiggestellt. Es wurden 749 Schwangerschaften bei Frauen beobachtet, die während des ersten Schwangerschaftstrimesters systemisch Aciclovir ausgesetzt waren, was zu 756 Ergebnissen führte. Die Häufigkeit des Auftretens von Geburtsfehlern entspricht in etwa der in der Allgemeinbevölkerung. Die geringe Größe des Registers reicht jedoch nicht aus, um das Risiko für weniger häufige Defekte zu bewerten oder zuverlässige oder definitive Schlussfolgerungen zur Sicherheit von Aciclovir bei schwangeren Frauen und ihren sich entwickelnden Föten zuzulassen. Aciclovir sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Stillende Mutter
Aciclovir-Konzentrationen wurden in der Muttermilch von 2 Frauen nach oraler Verabreichung von ZOVIRAX (Aciclovir) dokumentiert und lagen zwischen dem 0,6- und 4,1-Fachen der entsprechenden Plasmaspiegel. Diese Konzentrationen würden den gestillten Säugling potenziell einer Aciclovir-Dosis von bis zu 0,3 mg/kg/Tag aussetzen. ZOVIRAX (Aciclovir) sollte einer stillenden Mutter mit Vorsicht und nur bei entsprechender Indikation verabreicht werden.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit oraler Aciclovir-Formulierungen bei pädiatrischen Patienten unter 2 Jahren sind nicht erwiesen.
Geriatrische Verwendung
Von 376 Probanden, die ZOVIRAX (Aciclovir) in einer klinischen Studie zur Behandlung von Herpes zoster bei immunkompetenten Probanden im Alter von ¡Ý50 erhielten, waren 244 65 Jahre und älter, während 111 75 Jahre und älter waren. Zwischen geriatrischen Probanden und jüngeren erwachsenen Probanden wurden keine Gesamtunterschiede in der Wirksamkeit hinsichtlich der Zeit bis zur Beendigung der Bildung neuer Läsionen oder der Zeit bis zur Heilung berichtet. Die Dauer der Schmerzen nach Heilung war länger bei Patienten ab 65 Jahren. Übelkeit, Erbrechen und Schwindel wurden häufiger bei älteren Probanden berichtet. Ältere Patienten haben eher eine eingeschränkte Nierenfunktion und benötigen eine Dosisreduktion. Bei älteren Patienten treten auch häufiger renale oder ZNS-Nebenwirkungen auf. In Bezug auf ZNS-Nebenwirkungen, die während der klinischen Praxis beobachtet wurden, wurden Schläfrigkeit, Halluzinationen, Verwirrtheit und Koma häufiger bei älteren Patienten berichtet (siehe KLINISCHE PHARMAKOLOGIE, NEBENWIRKUNGEN: Beobachtet während der klinischen Praxis, und DOSIERUNG UND ANWENDUNG ).
ÜBERDOSIS
Wenden Sie sich zur Behandlung einer vermuteten Arzneimittelüberdosierung an Ihr regionales Giftinformationszentrum.
Aktivkohle kann verabreicht werden, um die Entfernung von nicht resorbiertem Arzneimittel zu unterstützen. Allgemeine unterstützende Maßnahmen werden empfohlen.
Aciclovir wird im Magen-Darm-Trakt nur teilweise resorbiert. Die Patienten haben einmalig bis zu 20 g Aciclovir eingenommen, ohne unerwartete Nebenwirkungen. In klinischen Studien betrug die höchste Plasmakonzentration, die bei einem einzelnen Patienten bei diesen Dosen beobachtet wurde, 10,0 μg/ml. Versehentliche, wiederholte Überdosierungen von oralem Aciclovir über mehrere Tage wurden mit gastrointestinalen Wirkungen (wie Übelkeit und Erbrechen) und neurologischen Wirkungen (Kopfschmerzen und Verwirrtheit) in Verbindung gebracht.
Menschen wurden bis zu 1.200 mg/m² (28 mg/kg) dreimal täglich für bis zu 2 Wochen intravenös verabreicht. Die maximalen Plasmakonzentrationen haben 80 μg/ml erreicht. Eine Überdosierung von intravenösem Aciclovir hat zu einem Anstieg des Serum-Kreatinins, des Blut-Harnstoff-Stickstoffs und in der Folge zu Nierenversagen geführt. Neurologische Effekte wie Verwirrtheit, Halluzinationen, Erregung, Krampfanfälle und Koma wurden im Zusammenhang mit einer intravenösen Überdosierung beschrieben.
Die Patienten sollten engmaschig auf Anzeichen von Toxizität überwacht werden. Die Hämodialyse verbessert die Entfernung von Aciclovir aus dem Blut erheblich und kann daher im Falle einer symptomatischen Überdosierung als Behandlungsoption in Betracht gezogen werden. Eine Ausfällung von Aciclovir in den Nierentubuli kann auftreten, wenn die Löslichkeit (2,5 mg/ml) in der intratubulären Flüssigkeit überschritten wird. Bei Nierenversagen und Anurie kann der Patient von einer Hämodialyse profitieren, bis die Nierenfunktion wiederhergestellt ist (siehe DOSIERUNG UND ANWENDUNG ).
KONTRAINDIKATIONEN
ZOVIRAX® (Aciclovir) ist kontraindiziert für Patienten, die eine Überempfindlichkeit entwickeln oder die überempfindlich gegen Aciclovir, Valacyclovir oder andere Bestandteile der Formulierungen von ZOVIRAX® sind. Eine vollständige Auflistung finden Sie unter Dosierungsformen , Zusammensetzung und Verpackung Teil der Produktmonographie .
KLINISCHE PHARMAKOLOGIE
Aktion und Klinische Pharmakologie
Wirkmechanismus
ZOVIRAX® (Acyclovir), ein synthetisches azyklisches Purin-Nukleosid-Analogon, ist ein Substrat mit hoher Spezifität für Herpes simplex- und Varizella-Zoster-spezifische Thymidinkinase. Aciclovir ist ein schlechtes Substrat für Wirtszell-spezifische Thymidinkinase. Herpes-simplex- und Varicella-Zoster-spezifische Thymidinkinase wandeln Acyclovir in sein Monophosphat um, das dann durch eine Reihe von zellulären Enzymen in Acyclovir-Diphosphat und Acyclovir-Triphosphat umgewandelt wird. Acyclovirtriphosphat ist sowohl ein Inhibitor als auch ein Substrat für Herpesvirus-spezifische DNA-Polymerase. Obwohl die zelluläre α-DNA-Polymerase in infizierten Zellen auch durch Aciclovirtriphosphat gehemmt werden kann, tritt dies nur bei Konzentrationen von Aciclovirtriphosphat auf, die höher sind als diejenigen, die die Herpesvirus-spezifische DNA-Polymerase hemmen. Aciclovir wird in Herpesvirus-infizierten Zellen selektiv in seine aktive Form umgewandelt und wird daher bevorzugt von diesen Zellen aufgenommen. Aciclovir hat in vitro ein sehr viel geringeres toxisches Potential für normale, nicht infizierte Zellen gezeigt, weil: 1) weniger aufgenommen wird; 2) Less wird in die aktive Form umgewandelt; und 3) zelluläre α-DNA-Polymerase hat eine geringere Empfindlichkeit gegenüber der Wirkung der aktiven Form des Arzneimittels. Eine Kombination aus Thymidinkinase-Spezifität, Hemmung der DNA-Polymerase und vorzeitiger Beendigung der DNA-Synthese führt zu einer Hemmung der Herpesvirus-Replikation. Es wurde keine Wirkung auf latente nicht-replizierende Viren nachgewiesen. Die Hemmung des Virus verringert die Dauer der Virusausscheidung, begrenzt den Grad der Ausbreitung und das Ausmaß der Pathologie und erleichtert dadurch die Heilung. Während der Suppression gibt es keine Hinweise darauf, dass Aciclovir die neurale Migration des Virus verhindert. Es bricht Episoden von rezidivierendem Herpes aufgrund der Hemmung der viralen Replikation nach der Reaktivierung ab.
Pharmakokinetik
Die Pharmakokinetik von Aciclovir nach oraler Verabreichung wurde in 6 klinischen Studien mit 110 erwachsenen Patienten untersucht.
Absorption
In einer Studie mit 35 immungeschwächten Patienten mit Herpes-simplex- oder Varizella-Zoster-Infektion, denen ZOVIRAX® Kapseln in Dosen von 200 bis 1.000 mg alle 4 Stunden, 6-mal täglich über 5 Tage verabreicht wurden, wurde die Bioverfügbarkeit auf 15 bis 20 % geschätzt. In dieser Studie wurden Steady-State-Plasmaspiegel am zweiten Tag der Dosierung erreicht. Die mittleren Spitzen- und Talkonzentrationen im Steady-State nach der letzten 200-mg-Dosis betrugen 0,49 μg/ml (0,47 bis 0,54 μg/ml) bzw. 0,31 μg/ml (0,18 bis 0,41 μg/ml) und nach der letzten 800-mg-Dosis 2,8 μg/ml (2,3 bis 3,1 μg/ml) und 1,8 μg/ml (1,3 bis 2,5 μg/ml). In einer anderen Studie erhielten 20 immunkompetente Patienten mit rezidivierenden genitalen Herpes-simplex-Infektionen ZOVIRAX®-Kapseln in einer Dosis von 800 mg alle 6 Stunden, 4-mal täglich für 5 Tage, die mittleren Spitzen- und Talkonzentrationen im Steady-State betrugen 1,4 μg/ml (0,66 bis 1,8 μg/ml) und 0,55 μg/ml (0,14 bis 1,1 μg/ml).
In einer Mehrfachdosis-Crossover-Studie, in der 23 Freiwillige ZOVIRAX® als eine 200-mg-Kapsel, eine 400-mg-Tablette und eine 800-mg-Tablette 6-mal täglich erhielten, nahm die Resorption mit zunehmender Dosis ab und die geschätzte Bioverfügbarkeit von Aciclovir betrug 20, 15 und 10 %. , beziehungsweise. Es wird angenommen, dass die Abnahme der Bioverfügbarkeit eine Funktion der Dosis und nicht der Dosierungsform ist. Es wurde gezeigt, dass Aciclovir über den Dosierungsbereich von 200 bis 800 mg nicht dosisproportional ist. In dieser Studie betrugen die Spitzen- und Talkonzentrationen von Aciclovir im Steady-State 0,83 und 0,46 μg/ml, 1,21 und 0,63 μg/ml und 1,61 und 0,83 μg/ml für die 200-, 400- bzw. 800-mg-Dosierungsschemata.
In einer anderen Studie mit 6 Probanden war der Einfluss der Nahrung auf die Resorption von Aciclovir nicht ersichtlich.
Eine Studie zur Bioverfügbarkeit einer oralen Einzeldosis an 23 gesunden Freiwilligen zeigte, dass ZOVIRAX® Kapseln 200 mg mit 200 mg Aciclovir in wässriger Lösung bioäquivalent sind. In einer separaten Studie mit 20 Freiwilligen wurde gezeigt, dass ZOVIRAX® Suspension bioäquivalent zu ZOVIRAX® Kapseln ist. In einer anderen Einzeldosis-Bioverfügbarkeits-/Bioäquivalenzstudie mit 24 Freiwilligen wurde gezeigt, dass eine ZOVIRAX® 800-mg-Tablette bioäquivalent zu vier ZOVIRAX® 200-mg-Kapseln ist.
Verteilung
Die Plasmaproteinbindung ist relativ gering (9 bis 33 %) und Arzneimittelwechselwirkungen, die eine Verschiebung der Bindungsstelle beinhalten, sind nicht zu erwarten.
Beseitigung
Nach oraler Gabe lag die mittlere Plasmahalbwertszeit von Aciclovir bei Probanden und Patienten mit normaler Nierenfunktion im Bereich von 2,5 bis 3,3 Stunden. Die mittlere renale Ausscheidung des unveränderten Arzneimittels macht 14,4 % (8,6 bis 19,8 %) der oral verabreichten Dosis aus. Der einzige Metabolit im Urin (identifiziert durch Hochleistungsflüssigkeitschromatographie) ist 9-[(Carboxymethoxy)methyl]guanin.
Besondere Populationen und Bedingungen
Pädiatrie
Im Allgemeinen ist die Pharmakokinetik von Aciclovir bei Kindern ähnlich wie bei Erwachsenen. Die mittlere Halbwertszeit nach oraler Gabe von 300 und 600 mg/m² betrug bei Kindern im Alter von 7 Monaten bis 7 Jahren 2,6 Stunden (Bereich 1,59 bis 3,74 Stunden).
Oral verabreichtes Aciclovir bei Kindern unter 2 Jahren wurde noch nicht vollständig untersucht.
Geriatrie
Bei älteren Menschen nimmt die Gesamtkörperclearance mit zunehmendem Alter ab, verbunden mit einer Abnahme der Kreatinin-Clearance, obwohl sich die terminale Plasmahalbwertszeit kaum verändert. Bei geriatrischen Patienten mit eingeschränkter Nierenfunktion kann eine Dosisreduktion erforderlich sein (vgl DOSIERUNG UND ANWENDUNG ).
Niereninsuffizienz
Die Halbwertszeit und die Gesamtkörperclearance von Aciclovir hängen von der Nierenfunktion ab.
Bei Patienten mit eingeschränkter Nierenfunktion wird eine Dosisanpassung empfohlen (s DOSIERUNG UND ANWENDUNG ).
Klinische Versuche
Anfänglicher genitaler Herpes
Placebo-kontrollierte Doppelblindstudien haben gezeigt, dass oral verabreichtes ZOVIRAX® die Dauer einer akuten Infektion und die Dauer der Wundheilung signifikant reduziert. Die Dauer der Schmerzen und der Bildung neuer Läsionen war bei einigen Patientengruppen verringert.
Wiederkehrender genitaler Herpes
In einer Studie mit Patienten, die ZOVIRAX® 400 mg zweimal täglich über 3 Jahre erhielten, blieben 45, 52 bzw. 63 % der Patienten im ersten, zweiten bzw. dritten Jahr rezidivfrei. Reihenanalysen der 3-Monats-Rezidivraten der Patienten zeigten, dass 71 bis 87 % in jedem Quartal rezidivfrei waren.
Herpes-Zoster-Infektionen
In einer doppelblinden, placebokontrollierten Studie an immunkompetenten Patienten mit lokalisierter kutaner Zoster-Infektion verkürzte ZOVIRAX® (800 mg 5-mal täglich für 10 Tage) die Zeit bis zur Schorfbildung, Heilung und vollständigen Schmerzfreiheit der Läsion und verkürzte die Dauer der Viruserkrankung Shedding und die Dauer der Bildung neuer Läsionen.
In einer ähnlichen doppelblinden, Placebo-kontrollierten Studie verkürzte ZOVIRAX® (800 mg 5-mal täglich für 7 Tage) die Zeit bis zur vollständigen Schorfbildung, Heilung und Beendigung der Schmerzen und reduzierte die Dauer der Bildung neuer Läsionen.
Die Behandlung wurde innerhalb von 72 Stunden nach Auftreten des Hautausschlags begonnen und war am wirksamsten, wenn sie innerhalb der ersten 48 Stunden begonnen wurde. Erwachsene über 50 Jahre zeigten einen größeren Nutzen.
Windpocken
Drei randomisierte, doppelblinde, placebokontrollierte Studien wurden mit 993 pädiatrischen Patienten im Alter von 2 bis 18 Jahren mit Windpocken durchgeführt. Alle Patienten wurden innerhalb von 24 Stunden nach Auftreten des Hautausschlags behandelt. In zwei Studien wurde ZOVIRAX® 5 Tage lang viermal täglich mit 20 mg/kg (bis zu 3.200 mg pro Tag) verabreicht. In der dritten Studie wurden Dosen von 10, 15 oder 20 mg/kg viermal täglich für 5 bis 7 Tage verabreicht. Die Behandlung mit ZOVIRAX® verkürzte die Heilungszeit auf 50 %, reduzierte die maximale Anzahl an Läsionen, reduzierte die mediane Anzahl an Bläschen, reduzierte die mediane Anzahl an Restläsionen an Tag 28 und verringerte den Anteil der Patienten mit Fieber, Anorexie und Lethargie bis zum 2. Tag. Die Behandlung mit ZOVIRAX® beeinflusste die Varizella-Zoster-Virus-spezifischen humoralen oder zellulären Immunantworten 1 Monat oder 1 Jahr nach der Behandlung nicht.
Ausführliche Pharmakologie
Sehen Aktion und Klinische Pharmakologie.
Virologie
Die quantitative Beziehung zwischen der In-vitro-Empfindlichkeit des Herpes-simplex-Virus (HSV) und der Varizella-Zoster-Viren (VZV) gegenüber Aciclovir und dem klinischen Ansprechen auf die Therapie wurde beim Menschen nicht nachgewiesen, und die Virusempfindlichkeitstests wurden nicht standardisiert. Die Ergebnisse der Sensitivitätstests, ausgedrückt als Konzentration des Arzneimittels, die erforderlich ist, um das Wachstum des Virus in der Zellkultur (ID50) um 50 % zu hemmen, variieren stark je nach dem jeweils verwendeten Assay, dem verwendeten Zelltyp und dem Labor, das den Test durchführt. Die ID50 von Aciclovir gegen HSV-1-Isolate kann von 0,02 μg/ml (Plaque-Reduktion in Vero-Zellen) bis 5,9–13,5 μg/ml (Plaque-Reduktion in Nierenzellen der grünen Meerkatze [GMK]) reichen. Der ID50-Wert gegen HSV-2 reicht von 0,01 bis 9,9 μg/ml (Plaque-Reduktion in Vero- bzw. GMK-Zellen).
Unter Verwendung einer Farbstoffaufnahmemethode in Vero-Zellen, die ID50-Werte liefert, die ungefähr 5- bis 10-mal höher sind als bei Plaque-Reduktionsassays, wurden 1.417 HSV-Isolate (553 HSV-1 und 864 HSV-2) von ungefähr 500 Patienten über einen Zeitraum von 5 Jahren untersucht. Jahr Zeitraum. Diese Assays ergaben, dass 90 % der HSV-1-Isolate gegenüber ≤ 0,9 μg/ml Aciclovir empfindlich waren und 50 % aller Isolate gegenüber ≤ 0,2 μg/ml Aciclovir empfindlich waren. 90 % der HSV-2-Isolate waren empfindlich gegenüber ≤ 2,2 μg/ml und 50 % aller Isolate waren empfindlich gegenüber ≤ 0,7 μg/ml Aciclovir. Bei 44 Patienten wurden Isolate mit signifikant verminderter Sensitivität gefunden. Es muss betont werden, dass weder die Patienten noch die Isolate zufällig ausgewählt wurden und daher nicht die allgemeine Bevölkerung repräsentieren. Die meisten der weniger empfindlichen klinischen HSV-Isolate weisen einen relativen Mangel an viraler Thymidinkinase (TK) auf. Es wurde auch über Stämme mit Veränderungen in viraler TK oder viraler DNA-Polymerase berichtet.
Die ID50 gegen VZV reicht von 0,17–1,53 μg/ml (Ertragsminderung, humane Vorhautfibroblasten) bis 1,85–3,98 μg/ml (Herdreduktion, humane Embryofibroblasten [HEF]). Die Reproduktion des EBV-Genoms wird in superinfizierten Raji-Zellen oder lymphoblastoiden P3HR-1-Zellen durch 1,5 μg/ml Aciclovir um 50 % unterdrückt. Cytomegalovirus (CMV) ist relativ resistent gegenüber Aciclovir mit ID50-Werten im Bereich von 2,3–17,6 μg/ml (Plaque-Reduktion, HEF-Zellen) bis 1,82–56,8 μg/ml (DNA-Hybridisierung, HEF-Zellen). Es ist nicht bekannt, dass der latente Zustand des Genoms irgendeines der menschlichen Herpesviren gegenüber Aciclovir empfindlich ist.
Widerstand
Eine längere Exposition von HSV gegenüber subinhibitorischen Konzentrationen (0,1 μg/ml) von Aciclovir in Zellkulturen hat zur Entstehung einer Vielzahl von Aciclovir-resistenten Stämmen geführt. Es wird angenommen, dass die Entstehung resistenter Stämme durch „Selektion“ natürlich vorkommender Viren mit relativ geringer Empfindlichkeit gegenüber Aciclovir erfolgt. Solche Stämme wurden in Isolaten vor der Therapie aus mehreren klinischen Studien berichtet.
Zwei Resistenzmechanismen mit viraler Thymidinkinase (erforderlich für die Aciclovir-Aktivierung) wurden beschrieben. Diese sind: (a) Selektion von Thymidinkinase-defizienten Mutanten, die wenig oder keine Enzymaktivität nach Infektion induzieren, und (b) Selektion von Mutanten, die eine Thymidinkinase mit veränderter Substratspezifität besitzen, die das natürliche Nukleosid Thymidin phosphorylieren kann, aber nicht Aciclovir. Die Mehrheit der weniger anfälligen Viren, die in vitro entstehen, sind vom Typ mit Thymidinkinase-Mangel, die eine verringerte Infektiosität und Pathogenität und eine geringere Wahrscheinlichkeit haben, bei Tieren eine Latenz zu induzieren.
Es wurde jedoch festgestellt, dass eine Aciclovir-resistente HSV-Infektion bei einem immunsupprimierten Empfänger einer Knochenmarktransplantation unter verlängerter Aciclovir-Therapie auf ein klinisches Isolat zurückzuführen war, das eine normale Thymidinkinase, aber eine veränderte DNA-Polymerase aufwies. Dieser dritte Resistenzmechanismus, an dem Herpes-simplex-Virus-DNA-Polymerase beteiligt ist, beruht auf der Selektion von Mutanten, die ein verändertes Enzym codieren, das gegen eine Inaktivierung durch Acyclovirtriphosphat resistent ist.
VZV scheint Resistenz gegen Aciclovir über ähnliche Mechanismen wie bei HSV zu zeigen.
Begrenzte klinische Untersuchungen haben jedoch keine Hinweise auf eine signifikante Änderung der In-vitro-Empfindlichkeit von VZV bei einer Aciclovir-Therapie ergeben, obwohl resistente Mutanten dieses Virus in vitro auf analoge Weise wie HSV isoliert werden können. Die Analyse einer kleinen Anzahl klinischer Isolate von Patienten, die orales Aciclovir oder Placebo gegen akuten Herpes zoster erhielten, legt nahe, dass das Auftreten von resistenten VZV in vivo selten auftreten kann. Eine längere Aciclovir-Behandlung von stark immungeschwächten Patienten mit erworbenem Immunschwächesyndrom und schwerem VZV kann zum Auftreten eines resistenten Virus führen.
Kreuzresistenz gegen andere Virostatika tritt in vitro bei Aciclovir-resistenten Mutanten auf. HSV-Mutanten, die aufgrund des Fehlens von viraler Thymidinkinase gegen Aciclovir resistent sind, sind kreuzresistent gegenüber anderen Mitteln, die durch Herpesvirus-Thymidinkinase phosphoryliert werden, wie etwa Bromvinyldeoxyuridin, Ganciclovir und die 2'-Fluorpyrimidinnucleoside, wie etwa 2'-Fluor -5-Iodarabinosyl-Cytosin (FIAC).
Das klinische Ansprechen auf die Behandlung mit Aciclovir war gewöhnlich gut bei Patienten mit normaler Immunität, bei denen HSV mit reduzierter Empfindlichkeit gegenüber Aciclovir wiederhergestellt wurde, entweder vor, während oder nach der Therapie. Es wurde jedoch festgestellt, dass bestimmte Patientengruppen, wie stark immungeschwächte (insbesondere Empfänger von Knochenmarktransplantationen) und solche, die sich chronisch unterdrückenden Therapien unterziehen, am häufigsten mit dem Auftreten resistenter Herpes-simplex-Stämme in Verbindung gebracht werden, die mit einem schlechten Ansprechen einhergehen können oder nicht zum Medikament. Bei der Behandlung solcher Patienten muss die Möglichkeit des Auftretens weniger empfindlicher Viren berücksichtigt werden, und die Empfindlichkeitsüberwachung klinischer Isolate dieser Patienten sollte gefördert werden.
Zusammenfassend lässt sich sagen, dass die quantitative Beziehung zwischen der In-vitro-Empfindlichkeit von HSV und VZV gegenüber Aciclovir und dem klinischen Ansprechen auf die Therapie beim Menschen nicht eindeutig nachgewiesen wurde. Standardisierte Verfahren zum Testen der Virussensitivität sind erforderlich, um genauere Korrelationen zwischen der In-vitro-Virussensitivität und dem klinischen Ansprechen auf die Aciclovir-Therapie zu ermöglichen.
Toxikologie
Akute Toxizitätsstudien
Erwachsene Mäuse und Ratten : Die akute Toxizität von oralem Aciclovir wurde wie in Tabelle 6 gezeigt bestimmt.
Neugeborene, unreife und erwachsene Ratten
Gruppen von 10 männlichen und 10 weiblichen Charles River CD (Sprague-Dawley)-Ratten erhielten im Alter von 3, 10, 28 und 71 Tagen einzelne große Dosen (5 verschiedene Dosisstufen) einer Aciclovir-Lösung (pH 11,0) durch subkutane Injektion des Alters. Sie wurden 14 Tage nach der Behandlung beobachtet und die LD50-Werte wurden nach dem Verfahren von Litchfield und Wilcoxon berechnet (siehe Tabelle 7 unten). Diese Studie wurde durchgeführt, um festzustellen, ob das Alter bei Exposition die akute Toxizität von Aciclovir beeinflusst; Es gab keine Hinweise darauf, dass junge Ratten gegenüber den akuten toxischen Wirkungen von Aciclovir empfindlicher waren als ältere Ratten.
Es gab keinen offensichtlichen Zusammenhang zwischen der Überlebensdauer nach der Behandlung und dem Alter, in dem die Behandlung gegeben wurde. Klinische Anzeichen für die im Alter von 3 und 10 Tagen behandelten Ratten umfassten rote und violette Hautblasen, blaue Bereiche, Schorf, Narben, nekrotische und abgestoßene Haut, offene Wunden, Körperzittern und Alopezie. Verminderte Aktivität, Tränenfluss, geschlossene Augenlider, rotbraunes oder braunes Material um Augen, Nase und Mund, Ataxie, Erschöpfung, Körperzittern, Urinflecken um den Bauch oder den Genitalbereich, schorfige oder nekrotische Bereiche und Alopezie wurden bei behandelten Ratten beobachtet 28 und 71 Tage alt.
Studie zur subchronischen oralen Toxizität
Mäuse
Vier Gruppen, die jeweils aus 28 männlichen und 28 weiblichen Charles River CD-1 (ICR)-Mäusen bestanden, wurden 33 Tage lang oral per Schlundsonde mit Aciclovir-Suspensionen dosiert. Die Tagesdosiswerte waren 0, 50, 150 und 450 mg/kg. Hämatologische und klinisch-chemische Messungen wurden an weiteren 8 männlichen und 8 weiblichen Mäusen pro Gruppe (in der gleichen Weise dosiert) nach der ersten und vierten Woche der Dosierung und während der 3. Woche nach der Dosierung durchgeführt.
Plasma-Wirkstoffkonzentrationen wurden in gepoolten Proben von weiteren 4 männlichen und 4 weiblichen Mäusen pro Gruppe an den Dosistagen 1, 15 und 30 gemessen.
Basierend auf vorläufigen Experimenten mit Ratten und Mäusen wurde die hohe Dosis von 450 mg/kg ausgewählt, um die höchsten Wirkstoff-Plasmaspiegel zu erzeugen, die auf praktische Weise durch orale Verabreichung bei einer Nagetierart erreichbar sind. Die durchschnittlichen Plasmakonzentrationen des Medikaments lagen eine Stunde nach der oralen Einnahme im Bereich von etwa 3,4 (bei niedriger Dosis) bis 11,0 (bei hoher Dosis) μg/ml Plasma.
Es traten keine Veränderungen des Gesundheitszustands, der Wachstumsrate, der Hämatologie und der klinisch-chemischen Messwerte auf, die definitiv auf die Dosierung mit Aciclovir zurückgeführt werden konnten. Makroskopische und histopathologische Untersuchungen von 16 männlichen und 16 weiblichen Ratten aus der Hochdosis- und Kontrollgruppe am Ende der Dosisperiode ergaben nichts Auffälliges.
Chronische Toxizitätsstudien
Lebenslange orale Toxizitätsstudie an Ratten, denen Aciclovir durch Magenintubation verabreicht wurde
Charles River CD (Sprague-Dawley)-Ratten erhielten Aciclovir-Suspensionen durch Sondenernährung. Es gab 50 männliche und 50 weibliche Ratten bei jeder der folgenden Dosierungen: 0, 50, 150 und 450 mg/kg. Nach 30 und 52 Behandlungswochen wurden 10 männliche und 10 weibliche Ratten aus jeder Gruppe seziert. Den verbleibenden Ratten wurde jeden Tag eine Dosis verabreicht, bis die natürliche Sterblichkeit eine Gruppengröße auf ungefähr 20 % der Anzahl von Tieren dieses Geschlechts verringerte, die in den Testgruppen zu Beginn der Studie vorhanden waren. Alle verbleibenden Ratten wurden getötet und obduziert, als der 20%-Grenzwert erreicht war. Dies war während Woche 110 für die männlichen Ratten und Woche 122 für die weiblichen Ratten. Gewebe von Kontrollratten und solchen in der Hochdosisgruppe wurden lichtmikroskopisch ausgewertet. Gewebe von Ratten in den Gruppen mit niedriger und mittlerer Dosis, die Raumforderungen, Knötchen oder ungewöhnliche Läsionen aufwiesen, wurden ebenfalls durch Lichtmikroskopie untersucht. Fixierte Gewebe von Ratten, die während der ersten 52 Wochen der Studie tot aufgefunden wurden, wurden ebenfalls lichtmikroskopisch ausgewertet.
Es wurden keine Anzeichen einer Toxikose beobachtet. Plasmaproben wurden 1,5 Stunden nach der Verabreichung an den Tagen 7, 90, 209, 369, 771 (nur Männer) und 852 (nur Frauen) entnommen. Die mittleren Plasmaspiegel, die bei Männern mit hoher Dosis (450 mg/kg/Tag) zu den oben angegebenen Zeiten gefunden wurden, waren wie folgt: 1,54, 1,63, 1,39, 1,60 und 1,70 μg/ml (6,84, 7,26, 6,17, 7,10 und 7,56 μM) . Die entsprechenden mittleren Plasmaspiegel für die Frauen mit hoher Dosis für die entsprechenden Zeiträume waren 1,76, 2,38, 2,12, 1,71 und 1,81 μg/ml (7,82, 10,58, 9,44, 7,62 und 8,03 μM). Die Plasmaspiegel sowohl bei Männern als auch bei Frauen waren bei allen Dosierungen nach einjähriger Behandlung im Allgemeinen vergleichbar mit Plasmaspiegeln, die bei früheren Probenentnahmen erhalten wurden. Die Werte für Laboruntersuchungen einschließlich Hämatologie, klinische Chemie und Augenspiegelung lagen alle im Normbereich. Es gab keine arzneimittelinduzierten groben oder mikroskopischen Läsionen und es gab keinen Hinweis darauf, dass Aciclovir das Überleben beeinträchtigte.
Studie zur lebenslangen oralen Karzinogenität bei Ratten
Es gab keine Anzeichen einer Toxikose bei Charles River CD (Sprague-Dawley)-Ratten (100 Ratten/Geschlecht/Dosisgruppe), denen Aciclovir per Schlundsonde in einer Dosis von 50, 150 und 450 mg/kg in einer lebenslangen oralen Karzinogenitätsstudie verabreicht wurde. Die mittleren Plasmaspiegel, die bei Männern mit hoher Dosis 1,5 Stunden nach der Verabreichung zu verschiedenen Probenahmezeitpunkten während der Studie erhalten wurden, waren wie folgt: 1,54, 1,63, 1,39, 1,60 und 1,70 μg/ml (6,84, 7,26, 6,17, 7,10 und 7,56 μM) an Tagen 7, 90, 209, 369 bzw. 771. Die entsprechenden Mittelwerte für die Frauen mit hoher Dosis waren 1,76, 2,38, 2,12, 1,71 und 1,81 μg/ml (7,82, 10,58, 9,44, 7,62 und 8,03 μM) an den Tagen 7, 90, 209, 369 bzw. 852.
Die Werte für klinische Labortests, einschließlich Hämatologie, klinische Chemie, Urinanalyse, Körpergewicht, Nahrungsaufnahme und Ophthalmoskopie, lagen alle im normalen Bereich. Es gab keine arzneimittelinduzierten groben oder mikroskopischen Läsionen und es gab keinen Hinweis darauf, dass Aciclovir das Überleben, zeitliche Muster der Tumorinzidenz oder Tumorzahlen für gutartige oder bösartige Neubildungen beeinflusste.
Die meisten der relativ wenigen Ratten, die während der ersten 52 Wochen dieser Studie tot oder moribund aufgefunden wurden, erlitten Dosierungsunfälle, wie durch postmortale Befunde einer Ösophagusperforation, die Pleuraerguss, Lungenentzündung oder Mediastinitis verursachten, belegt wurde.
Studie zur lebenslangen oralen Karzinogenität bei Mäusen
Es gab keine Anzeichen einer Toxikose bei Charles River CD-1 (ICR)-Mäusen (115 Mäuse/Geschlecht/Dosisgruppe), denen Aciclovir per Schlundsonde in einer Dosis von 50, 150 und 450 mg/kg/Tag in einer lebenslangen oralen Karzinogenitätsstudie verabreicht wurde. Die mittleren Plasmaspiegel, die bei Männern mit hoher Dosis 1,5 Stunden nach der Verabreichung zu verschiedenen Probenahmezeitpunkten während der Studie erhalten wurden, waren wie folgt: 2,83, 3,17 und 1,82 μg/ml (12,59, 14,10 und 8,10 μM) an den Tagen 90, 365 bzw. 541. Die entsprechenden Mittelwerte für die Frauen mit hoher Dosis waren 9,81, 5,85 und 4,0 μg/ml (43,60, 26,0 und 17,79 μM).
Die Werte für klinische Labortests, einschließlich Hämatologie, Körpergewicht und Nahrungsaufnahme, lagen alle innerhalb normaler Bereiche. Es gab keine arzneimittelinduzierten groben oder mikroskopischen Läsionen. Weibliche Mäuse, denen 150 und 450 mg/kg Aciclovir verabreicht wurden, überlebten signifikant länger als weibliche Kontrollmäuse; das Überleben der behandelten Männchen war vergleichbar mit dem Überleben der männlichen Kontrolltiere. Tumorinzidenzmuster und Tumorzahlen für gutartige oder bösartige Neubildungen wurden durch die Behandlung mit Aciclovir nicht beeinflusst.
Chronische 12-monatige orale Toxizitätsstudie bei Hunden
Reinrassige Beagle-Hunde erhielten in den ersten zwei Wochen einer einjährigen Studie täglich 0, 15, 45 oder 150 mg/kg/Tag Aciclovir. Es gab 9 männliche und 9 weibliche Hunde in jeder Testgruppe. Den Hunden wurden Gelatinekapseln verabreicht, die die entsprechende Dosis enthielten. Sie wurden 3-mal täglich behandelt, daher betrugen die Dosierungen, die in jeder der drei gleich beabstandeten Dosierungsperioden verabreicht wurden, 0, 5, 15 und 50 mg/kg. Die Dosierungen von 45 und 150 mg/kg induzierten während der ersten zwei Wochen der Studie sowohl bei männlichen als auch bei weiblichen Hunden Durchfall, Erbrechen, verringerte Futteraufnahme und Gewichtsverlust. Aus diesem Grund wurde in der dritten Studienwoche entschieden, die mittleren und hohen Dosierungen auf 30 und 60 mg/kg/Tag (10 und 20 mg/kg tid) zu senken. Die niedrige Dosis von 15 mg/kg/Tag (5 mg/kg tid) blieb unverändert. Hunde, denen 60 mg/kg/Tag verabreicht wurden, erbrachen gelegentlich und hatten gelegentlich Durchfall, schnitten aber während der Dauer des Tests gut ab, und die Werte für die Körpergewichtszunahme und die Futteraufnahme waren mit den Kontrollwerten vergleichbar.
Während der durch die größeren Aciclovir-Dosen induzierten Toxikose waren die Plasmaspiegel des Medikaments wahrscheinlich sehr hoch (wie durch anfängliche Mittelwerte von 24,0 μg/ml (106,6 μM) für Männer mit hoher Dosis und 17,4 μg/ml (77,2 μM) angezeigt). für Frauen mit hoher Dosis, bestimmt 1 Stunde nach der dritten Dosis am Tag 1 der Studie). Bei der Messung an Tag 15 waren die Plasmaspiegel von Aciclovir bei hochdosierten Hunden (150 mg/kg/Tag) immer noch sehr hoch, nahmen aber später ab, als die Dosierungen verringert wurden. Die Werte für die Plasmaspiegel nach 12 Behandlungsmonaten waren im Allgemeinen vergleichbar mit den Werten, die nach 1, 3 und 6 Behandlungsmonaten aufgezeichnet wurden. Somit gab es keinen Hinweis auf eine verstärkte Metabolisierung von Aciclovir als Ergebnis einer chronischen Behandlung.
Während der 13. Woche zeigten einige Rüden und Hündinnen sowohl bei mittleren als auch bei hohen Dosierungen die folgenden Anzeichen: Empfindlichkeit der Vorderpfoten, Erosion der Fußballen und Brechen und Lockern der Krallen. Die Regeneration verlorener Nägel begann einige Wochen später. Nach 6 Monaten (als 3 Männchen und 3 Weibchen aus jeder Gruppe für eine zwischenzeitliche Opferung getötet wurden) und am Ende der Studie regenerierte Nägel waren von allgemein guter Qualität. Bei Hunden in der niedrigen Dosisgruppe (15 mg/kg/Tag) gab es nie Anzeichen einer Wirkung auf Pfoten oder Krallen.
Es wird angenommen, dass eine Verletzung des Korialepithels, das Nagelkeratin produziert, zu einer Unterbrechung der Keratinproduktion und einer Produktion von abnormalem Keratin führen kann. Die vorübergehende Toxikose, die durch die großen Dosen (45 und 150 mg/kg/Tag) von Aciclovir, die während der ersten zwei Wochen der Studie verabreicht wurden, induziert wurde, könnte das Korialepithel beeinträchtigt haben. Wenn es eine vorübergehende Wirkung auf das Korialepithel gab (möglicherweise im Zusammenhang mit direkten Wirkungen oder als Folge einer arzneimittelinduzierten Erkrankung während der ersten zwei Wochen der Studie), könnte ein späterer Nagelverlust eine Folge sein. Es wurden keine erkennbaren Wirkungen auf andere keratinproduzierende oder keratinhaltige Gewebe beobachtet. Es sollte betont werden, dass die Veränderungen der Nägel anscheinend mit der vorübergehenden Toxikose in Zusammenhang standen, die durch die in den ersten zwei Wochen der Studie getesteten Dosisniveaus von 50 und 150 mg/kg/Tag und nicht mit 30 und 60 mg/kg induziert wurden /Tag-Dosisspiegel, die anschließend getestet wurden.
Es gab keine wesentlichen arzneimittelinduzierten Veränderungen der Werte für biochemische Serumtests, Urinanalysen und elektrokardiographische Tests, die während dieser Studie in angemessenen Abständen durchgeführt wurden. Die Werte für Serumalbumin und Gesamtprotein waren bei Hunden, die 6 und 12 Monate lang mit 30 und 60 mg/kg/Tag behandelt wurden, leicht erniedrigt. Alle Werte für diese Parameter blieben jedoch innerhalb der als normal akzeptierten Grenzen.
Mit Ausnahme von Restveränderungen in altem Keratin an den Krallenspitzen gab es in keinem der lichtmikroskopisch untersuchten Gewebe Anzeichen für behandlungsbedingte Effekte. Auch bei den Organen, die bei der Nekropsie gewogen wurden, gab es keine nennenswerten Veränderungen der Werte. Somit wurden Dosierungen bis zu 60 mg/kg/Tag ein Jahr lang gut vertragen. Die Dosis ohne Dosiseffekt von Aciclovir betrug 15 mg/kg/Tag (5 mg/kg dreimal täglich); Die einzigen Nebenwirkungen bei 30 oder 60 mg/kg/Tag waren jedoch Veränderungen an Nägeln und Fußballen (30 und 60 mg/kg/Tag) und leichte gastrointestinale Symptome (60 mg/kg/Tag).
Reproduktionsstudien
Teratologie – Ratten
Aciclovir wurde trächtigen weiblichen ARS-Sprague-Dawley-Ratten durch subkutane Injektion während der Organogenese (Tag 6 bis Tag 15 der Trächtigkeit) in Dosierungen von 0,0, 6,0, 12,5 und 25,0 mg/kg Körpergewicht zweimal täglich verabreicht.
Zu den Kriterien, die für den zusammengesetzten Effekt bewertet wurden, gehörten das Körpergewicht der Mutter, Gewichtszunahme, Aussehen und Verhalten, Überlebensraten, Augenveränderungen, Schwangerschaftsraten und Reproduktionsdaten. Die Lebensfähigkeit und Entwicklung der Nachkommen wurden ebenfalls bewertet.
Zusätzlich zu den obigen Messungen wurden bestimmte Tiere 1 Stunde nach der ersten Dosis am Tag 15 getötet, um Proben von mütterlichem Blut, Fruchtwasser und Föten für Messungen der Wirkstoffkonzentration zu sammeln. Mittelwerte aus diesen Proben sind in Tabelle 8 aufgelistet.
Die für das Plasma erhaltenen Werte würden etwa 30 % der anfänglichen Plasmaspiegel darstellen, wie anhand der Plasmahalbwertszeit bei Nagetieren beurteilt wird.
Bei Vergleichen der Körpergewichtswerte, des Aussehens und Verhaltens, der Überlebensraten, der Schwangerschaftsraten oder der Implantationseffizienz wurden keine der Verabreichung von Aciclovir zuzuschreibenden Wirkungen festgestellt. Darüber hinaus wurden bei der Bewertung der fötalen Größe, des Geschlechts und der Entwicklung keine verbindungsbedingten Unterschiede festgestellt.
Obwohl die Resorptionshäufigkeit und die fötale Lebensfähigkeit in allen Gruppen im Bereich der normalen Schwankungen lagen, wurde eine etwas höhere Resorptionshäufigkeit bei den Hochdosis-Tieren festgestellt, die an den Tagen 15 und 19 der Trächtigkeit getötet wurden; klare dosisabhängige Trends traten jedoch nicht auf.
Daher wurde Aciclovir nicht als teratogen oder embryotoxisch betrachtet, wenn es Ratten während der Organogenese in Mengen von bis zu 50,0 mg/kg Körpergewicht pro Tag verabreicht wurde.
Teratologie – Kaninchen
Eine teratologische Studie wurde an weißen Neuseeland-Kaninchen durchgeführt, wobei im Wesentlichen das gleiche experimentelle Design wie bei der Ratte verwendet wurde, mit der Ausnahme, dass die Dosierung von Tag 6 bis Tag 18 der Trächtigkeit erfolgte. Auch die Entnahme von Föten, Fruchtwasser und mütterlichen Blutproben erfolgte am 18. Tag statt am 15. Tag.
Bei keiner Dosis wurden Anzeichen maternaler Toxizität beobachtet, aber es gab eine statistisch signifikante (p
Konzentrationen von Aciclovir wurden in Plasma- und Fruchtwasserproben sowie in Homogenaten fötaler Gewebe nachgewiesen. Alle Proben wurden eine Stunde nach der ersten Dosis am 18. Trächtigkeitstag entnommen. Die Arzneimittelkonzentrationen im Fruchtwasser waren wesentlich höher als die im Plasma (siehe Tabelle 9).
Reproduktion – Fruchtbarkeit
In einer Zwei-Generationen-Fruchtbarkeitsstudie wurde gezeigt, dass Aciclovir die Fruchtbarkeit oder Fortpflanzung in Gruppen von 15 männlichen und 30 weiblichen Mäusen nicht beeinträchtigt. Den Mäusen in dieser Studie wurde Aciclovir durch Magenintubation in Dosierungsmengen von 50, 150 und 450 mg/kg/Tag verabreicht. Männchen wurden 64 aufeinanderfolgende Tage vor der Paarung und Weibchen 21 Tage vor der Paarung dosiert.
In einer Fertilitätsstudie an Ratten, in der Gruppen von 20 männlichen und 20 weiblichen Ratten 0, 12,5, 25,0 und 50,0 mg/kg/Tag durch subkutane Injektion erhielten, zeigte sich, dass Aciclovir keinen Einfluss auf die Paarung oder die Fertilität hatte. Die Männchen wurden 60 Tage lang vor der Paarung und bis zum Abschluss ihres Paarungsplans dosiert. Weibliche Ratten wurden 14 Tage vor der Paarung und bis zum 7. Tag der Trächtigkeit behandelt. Bei 50 mg/kg/Tag sc gab es einen statistisch signifikanten Anstieg des Postimplantationsverlusts, aber keine gleichzeitige Abnahme der Wurfgröße.
Bei 25 weiblichen Kaninchen, die an den Tagen 6 bis 18 der Trächtigkeit subkutan mit 50 mg/kg/Tag Aciclovir behandelt wurden, gab es eine statistisch signifikante Abnahme der Implantationseffizienz, aber keine gleichzeitige Abnahme der Wurfgröße. Es gab auch einen dosisabhängigen Anstieg der Anzahl von Feten mit überzähligen Rippen in allen mit Arzneimittel behandelten Gruppen. Dieser Anstieg war nicht dosisabhängig, wenn das Auftreten überzähliger Rippen pro Wurf untersucht wurde.
Bei 15 weiblichen Kaninchen, die an den Tagen 6 bis 18 der Trächtigkeit intravenös mit 50 mg/kg/Tag Aciclovir behandelt wurden, gab es weder eine Auswirkung auf die Implantationseffizienz noch auf die Wurfgröße.
In einer peri- und postnatalen Studie an Ratten (20 weibliche Ratten pro Gruppe) wurde Aciclovir subkutan mit 0, 12,5, 25 und 50 mg/kg/Tag vom 17. Tag der Trächtigkeit bis zum 21. Tag nach der Geburt verabreicht. Bei 50 mg/kg/Tag sc gab es in der F1-Generation eine statistisch signifikante Abnahme der Gruppenmittelwerte von Corpora lutea, Gesamtimplantationsstellen und lebenden Föten. Obwohl statistisch nicht signifikant, gab es bei 12,5 mg/kg/Tag und 25 mg/kg/Tag s.c. auch eine dosisabhängige Abnahme der gruppendurchschnittlichen Anzahl lebender Föten und Implantationsstellen
In einer Dosisfindungsstudie mit 5 weiblichen Kaninchen verursachte die intravenöse Verabreichung von Aciclovir in einer Dosis von 100 mg/kg/Tag an den Tagen 6 bis 8 der Trächtigkeit, einer Dosis, die bekanntermaßen eine obstruktive Nephropathie verursacht, einen signifikanten Anstieg der fetalen Resorptionen und eine entsprechende Abnahme der Wurfgröße. Bei einer maximal tolerierten intravenösen Dosis von 50 mg/kg/Tag bei Kaninchen traten keine arzneimittelbedingten Auswirkungen auf die Reproduktion auf.
In einer subchronischen Toxizitätsstudie, in der Gruppen von 20 männlichen und 20 weiblichen Ratten einen Monat lang intraperitoneale Dosen von Aciclovir mit 0, 20, 80 oder 320 mg/kg/Tag verabreicht und einen Monat nach der Verabreichung beobachtet wurden, traten Hoden auf Atrophie. Einige histologische Anzeichen einer Erholung der Spermienproduktion waren 30 Tage nach der Verabreichung offensichtlich, aber dies war nicht genügend Zeit, um eine vollständige Reversibilität zu zeigen.
Gruppen von 25 männlichen und 25 weiblichen Ratten wurden 6 Monate lang intraperitoneale Dosen von Aciclovir mit 0, 5, 20 oder 80 mg/kg/Tag verabreicht. 10 männliche und 10 weibliche Ratten in jeder Gruppe wurden 13 Wochen lang ohne Dosis verabreicht. Die Hodenatrophie war auf hochdosierte Ratten beschränkt, die 6 Monate lang 80 mg/kg/Tag erhielten. Organgewichtsdaten und Lichtmikroskopie definierten die vollständige Reversibilität der Hodenatrophie bis zum Ende der Erholungsphase nach der Dosisgabe.
In einer 31-tägigen Hundestudie (16 Rüden und 16 Hündinnen pro Gruppe), in der Aciclovir intravenös in Konzentrationen von 50, 100 und 200 mg/kg/Tag verabreicht wurde, waren die Hoden bei Hunden bei 50 mg/kg normal. Dosen von 100 oder 200 mg/kg/Tag verursachten bei einigen Hunden den Tod aufgrund zytostatischer Wirkungen (Knochenmark und Magen-Darm-Epithel) und aspermische Hoden oder Hoden mit verstreuten aspermischen Tubuli. Es kann nicht ausgeschlossen werden, dass die Hodenveränderung primär gewesen sein könnte, jedoch können ähnliche Veränderungen sekundär nach schwerem Stress bei moribunden Hunden beobachtet werden.
Studien zur Entwicklungstoxizität
Neugeborene Ratten – subchronische Studie
Aciclovir, gelöst in 0,4 % steriler Kochsalzlösung, wurde durch subkutane Injektion an neugeborene Charles-River-Ratten (Sprague-Dawley) an 19 aufeinanderfolgenden Tagen verabreicht, beginnend am 3. Tag nach der Geburt. Die getesteten Dosierungen waren 0, 5, 20 und 80 mg/kg Körpergewicht. Bei jeder Dosisstufe gab es 12 Würfe (jeweils bestehend aus 5 männlichen und 5 weiblichen Neugeborenen, die das natürliche Muttertier säugten). Die Dämme wurden nicht behandelt. Neugeborene wurden aus jeder Gruppe für eine Autopsie und mikroskopische Untersuchung einer Vielzahl von Geweben, einschließlich Augen und mehreren Gehirnschnitten, entfernt, nachdem sie 5, 12 oder 19 Tage lang behandelt worden waren und nach einer 3-wöchigen arzneimittelfreien Phase nach der Einnahme ( zu diesem Zeitpunkt waren sie 45 Tage alt). Hämatologische (Hämoglobin, gepacktes Zellvolumen, RBC, WBC und differentielle Zellzahlen) und klinisch-chemische (BUN) Tests wurden nach 16 Behandlungstagen durchgeführt und 18 Tage nach Verabreichung der letzten (19.) Dosis wiederholt.
Blut wurde von einigen Neugeborenen 30 Minuten nach der Behandlung am Tag 1, am Tag 9 und am Ende des Dosierungszeitraums zur Bestimmung der Konzentrationen von Aciclovir im Plasma entnommen. Die höchste Konzentration von Aciclovir im Plasma betrug 99,1 μg/ml (440,5 μM), die in gepooltem Plasma gefunden wurde, das 30 Minuten nach Verabreichung der ersten Dosis von 6 weiblichen hochdosierten (80 mg/kg) Neugeborenen entnommen wurde. Die Behandlung mit Aciclovir erhöhte die Sterblichkeit in der Neugeborenenperiode nicht.
Ratten in der Niedrigdosisgruppe nahmen genauso viel Körpergewicht zu wie die jeweiligen Kontrollratten. Signifikante (p
Augenuntersuchungen und Lichtmikroskopie zeigten keine negativen Auswirkungen auf die Augenentwicklung. Es sollte betont werden, dass es keine morphologischen oder funktionellen Hinweise auf nachteilige Auswirkungen auf die Entwicklung des Gehirns oder anderer Teile des Zentralnervensystems gab. Somit unterscheidet sich Aciclovir deutlich von Cytosinarabinosid, von dem berichtet wurde, dass es bei neugeborenen Ratten eine ausgeprägte zerebelläre und retinale Dysplasie hervorruft.
Mutagenität und andere Kurzzeitstudien
Aciclovir wurde in einer Reihe von In-vitro- und In-vivo-Systemen auf mutagenes Potenzial getestet: 10. November 2014 Seite 27 von 38
Mikrobiell
Aciclovir wurde im Ames-Salmonella-Plattentest auf mutagene Aktivität getestet; in einer Vorinkubationsmodifikation des Ames-Assays; im Rosenkrantz E. coli polA+/polA-DNA-Reparaturassay; und im Eukaryoten S. cerevisiae, D-4. Alle Studien wurden sowohl in Anwesenheit als auch in Abwesenheit von exogener metabolischer Aktivierung durch Säugetiere durchgeführt. Aciclovir gab in keinem dieser Systeme positive Reaktionen.
Die bisherigen Salmonella-Studien wurden auf extrem hohe Konzentrationen ausgeweitet, um Toxizität zu erreichen. Bei Konzentrationen von bis zu 300 mg/Platte oder 80 mg/ml Aciclovir wurden weder in An- noch in Abwesenheit einer exogenen metabolischen Aktivierung von Säugetieren positive Wirkungen beobachtet.
Säugetiersysteme
Aciclovir wurde in kultivierten L5178Y-Maus-Lymphomzellen, heterozygot am Thymidinkinase (TK)-Locus, auf mutagene Aktivität getestet, indem die Vorwärtsmutationsrate zu TK-Mangel (TK+/- → TK-/-) gemessen wurde; zusätzliche Studien wurden am HGPRT durchgeführt Locus und am Ouabain-Resistenzmarker in denselben Zellen. Alle Studien wurden in Anwesenheit und in Abwesenheit exogener metabolischer Aktivierung durch Säugetiere durchgeführt. Die Testverbindung war am TK-Locus in hohen Konzentrationen (400–2.400 μg/ml) mutagen. (Im Vergleich dazu beträgt die Obergrenze der Spitzenplasmaspiegel von Aciclovir nach oraler Gabe von 200 mg alle 4 Stunden 0,9 μg/ml.) Sie war am HGPRT-Locus und am Ouabain-Resistenzmarker negativ. Mit und ohne metabolische Aktivierung wurden identische Ergebnisse erzielt.
Bei der Untersuchung der Aciclovir-Mutagenität an jedem der 3 Loci (APRT, HGPRT und Ouabain-Resistenz) in Eierstockzellen des Chinesischen Hamsters (CHO) wurden nicht schlüssige Ergebnisse ohne offensichtliche dosisabhängige Wirkung erzielt, sowohl in Gegenwart als auch in Abwesenheit einer exogenen metabolischen Aktivierung.
Es wurde gezeigt, dass Aciclovir bei einer Konzentration von 50 μg/ml (222 μM) bei einer 72-stündigen Exposition eine statistisch signifikante Erhöhung der Inzidenz von morphologisch transformierten Herden verursacht, die aus der Behandlung von BALB/C-3T3-Zellen in vitro resultieren das Fehlen einer exogenen metabolischen Aktivierung. Es wurde gezeigt, dass die morphologisch transformierten Herde nach der Transplantation in immunsupprimierte, syngene, entwöhnte Mäuse als Tumore wachsen. Tumorgewebe wurden entweder als undifferenzierte Sarkome oder Lymphosarkome diagnostiziert.
Aciclovir induzierte in Konzentrationen zwischen 8 und 64 μg/ml bei 18-stündiger Exposition keine morphologisch transformierten Herde bei in vitro behandelten C3H/10T ½ -Zellen ohne exogene metabolische Aktivierung.
Aciclovir induzierte in Konzentrationen von 62,5 und 125 μg/ml bei einer 48-stündigen Exposition keine Chromosomenaberrationen in kultivierten menschlichen Lymphozyten ohne exogene metabolische Aktivierung. Bei höheren Konzentrationen, 250 und 500 μg/ml bei 48-stündiger Exposition, verursachte Aciclovir einen signifikanten Anstieg der Inzidenz von Chromosomenbrüchen. Es gab auch eine signifikante dosisabhängige Abnahme des mitotischen Index bei Exposition gegenüber Aciclovir.
Aciclovir hatte bei Dosen von 25 und 50 mg/kg/Tag ip an 5 aufeinanderfolgenden Tagen keine dominante letale Wirkung bei männlichen BKA (CPLP)-Mäusen. Darüber hinaus gab es keine Hinweise auf eine dominante letale Wirkung auf männliche und weibliche Charles River CD-1 (ICR)-Mäuse, die oral mit Dosierungen von 50, 150 und 450 mg/kg/Tag behandelt wurden, wie für die Zwei-Generationen-Reproduktions-/Fruchtbarkeitsstudie zusammengefasst .
Aciclovir induzierte bei intraperitonealen Einzeldosen von 25, 50 und 100 mg/kg keine Chromosomenaberrationen in Knochenmarkszellen chinesischer Hamster, wenn es 24 Stunden nach der Verabreichung untersucht wurde. Bei höheren nephrotoxischen Dosen (500 und 1.000 mg/kg) wurde eine blastogene Wirkung beobachtet. (Eine intraperitoneale Dosis von 500 mg/kg führt bei chinesischen Hamstern zu mittleren Spitzenplasmaspiegeln von 611 μg/ml (2,72 mM), was 680-mal höher ist als die Obergrenze der menschlichen Spitzenplasmaspiegel bei oraler Gabe von 200 mg alle 4 Stunden).
Aciclovir induzierte bei intravenösen Einzeldosen von 25, 50 und 100 mg/kg keine Chromosomenaberrationen in Knochenmarkzellen männlicher und weiblicher Ratten, wenn es 6, 24 und 48 Stunden nach der Behandlung untersucht wurde.
Somit zeigten alle diese Studien, dass Aciclovir keine Mutationen einzelner Gene verursacht, sondern in der Lage ist, Chromosomen zu brechen.
Immuntoxikologische Studien
Aciclovir wurde einer Reihe von immunologischen In-vitro- und In-vivo-Tests unterzogen.
In zwei In-vivo-Tests, lymphozytenvermittelter Zytotoxizität und Neutrophilen-Chemotaxis, zeigte Aciclovir keine hemmenden Wirkungen bei Konzentrationen von bis zu 135 μg/ml (600 μM). Die Verbindung hemmte bei 0,9 &mgr;g/ml (4 &mgr;M) die Rosettenbildung zu etwa 50 %.
In vier In-vivo-Tests an Mäusen, in denen die zellvermittelte Immunität (komplementabhängige zelluläre Zytotoxizität, komplementunabhängige zelluläre Zytotoxizität, verzögerte Überempfindlichkeit und Transplantat-gegen-Wirt-Reaktion) gemessen wurde, zeigte Aciclovir keine hemmende Wirkung bei Gabe von Einzeldosen bis zu 200 mg/kg am Tag 2 nach antigener Stimulation.
Vier Tagesdosen von 100 mg/kg/Tag hatten keine signifikante Wirkung auf Jerne-Hämolysin-Plaques oder zirkulierende Antikörper am Tag 7 nach der antigenen Stimulation. Als die Jerne-Hämolysin-Plaques und die Antikörpertiter vier Tage nach der Antigen-Challenge und einen Tag nach der letzten Arzneimitteldosis untersucht wurden, zeigten 100 mg/kg nur eine leichte supprimierende Wirkung. 200 mg/kg führten jedoch zu einem gewissen Gewichtsverlust (–2,2 g), einer moderaten Reduktion der Anzahl von Jerne-Hämolysin-Plaques (PFC/Milz wurden auf 33 % der Kontrolle, PFC/107 WBC auf 46,5 % der Kontrolle reduziert). Allerdings kam es bei 200 mg/kg nur zu einer geringen Verringerung des zirkulierenden Hämagglutinin-Titers (von 8,3 auf 6,5) und des zirkulierenden Hämolysin-Titers (von 9,5 auf 8,3).
In Experimenten an Mäusen, die darauf abzielten, zu testen, ob Aciclovir die immunsuppressive Wirkung von Azathioprin auf die Antikörperbildung verstärken würde, wurde festgestellt, dass die Wirkungen der beiden Medikamente nicht mehr als additiv waren. Nur die Dosis von 200 mg/kg Aciclovir zeigte eine verstärkte Unterdrückung der Antikörperantwort, wenn sie in Kombination mit Azathioprin in Dosen über 25 mg/kg verabreicht wurde.
Es wurden Studien durchgeführt, um den Einfluss von Aciclovir in vitro auf die menschliche Lymphozytenfunktion zu bewerten. Hemmende Wirkungen auf die Blastogenese wurden nur in Assays beobachtet, die Spitzenkonzentrationen von potenten Mitogenen, Phytohämagglutinin (PHA) und Concanavalin A (Con A) untersuchten, und nur bei Arzneimittelkonzentrationen über 50 μg/ml (222 μM) und waren viel geringer bei Monilia und Tetanus-Toxoid-Antigene, bei denen die blastogene Reaktion charakteristischerweise weniger kräftig ist. Außer bei Konzentrationen von 200 μg/ml (890 μM), bei denen bereits eine direkte zytotoxische Wirkung nachgewiesen wurde, gab es nur sehr geringe Auswirkungen auf die Zytotoxizität oder die LIF-Produktion. Diese Hemmkonzentrationen liegen weit über den erwarteten Konzentrationen von Dosen, die für die klinische Anwendung ausgewählt wurden, und über 1.000-mal höher als die Konzentration, die erforderlich ist, um die Vermehrung von Herpesviren in vitro zu hemmen.
Die Wirkung von Aciclovir auf menschliche Zellen wurde gemessen. Eine Konzentration von 11,2 - 22,5 µg/mL (50-100 µM) hemmt die Teilung von Fibroblasten in unterschiedlichem Ausmaß, je nach Versuchsdesign und Konfluenz der Monoschicht. Das Ausmaß dieses Effekts war geringer als derjenige, der durch Adeninarabinosid oder humanes Leukozyten-Interferon verursacht wurde, wenn diese drei antiviralen Wirkstoffe in klinisch relevanten Konzentrationen verglichen wurden. Aciclovir hemmte auch den Thymidineinbau durch periphere mononukleäre Blutzellen, die durch PHA oder drei verschiedene Herpesvirus-Antigene stimuliert wurden. Bei diesen Zellen wurde eine lineare Dosis-Wirkungs-Kurve beobachtet, und ihre Proliferation wurde durch 22,5 μg/ml (100 μM) Aciclovir zu 50 % gehemmt. Die Hemmung wurde auf die T-Zell-Proliferation ohne offensichtliche Auswirkung auf die Freisetzung von Lymphokinen oder auf die Monozytenfunktion ausgeübt.
Es sollte auch erwähnt werden, dass es in den detaillierten subchronischen und chronischen Tierversuchen, die weiter oben in dieser Zusammenfassung behandelt wurden, keine Hinweise auf schädliche Wirkungen auf das Immunsystem gab, außer bei übermäßig hohen Dosen (50 bis 100 mg/kg zweimal täglich) bei Hunden mit ausgeprägter lymphoider Hypoplasie aufgetreten.
VERWEISE
1. Balfour HH, Jr., Kelly JM, Suarez CS, Heussner RC, Englund JA, Crane DD et al. Aciclovir-Behandlung von Windpocken bei ansonsten gesunden Kindern. J Pediatr 1990; 116(4):633-639.
2. Balfour HH, Jr., Rotbart HA, Feldman S, Dunkle LM, Feder HM, Jr., Prober CG et al. Aciclovir-Behandlung von Windpocken bei ansonsten gesunden Jugendlichen. Die kollaborative Acyclovir-Varizellen-Studiengruppe. J Pediatr 1992; 120(4 Punkt 1):627-633.
3. Barry DW, Blum MR. Antivirale Medikamente: Aciclovir, in Recent Advances in Clinical Pharmacology. Turner P, Shand DG (Hrsg.) Churchill Livingstone, Edinburgh 1983.
4. Barry DW, Nusinoff-Lehrman S. Virusresistenz in der klinischen Praxis: Zusammenfassung von fünf Jahren Erfahrung mit Aciclovir. Pharmacological and Clinical Approaches to Herpesviruses and Virus Chemotherapy, Aiso, Japan, 10.-13. September 1984.
5. DW Barry, S. Nusinoff-Lehrman, MN Ellis, KK Biron, PA Furman. Virusresistenz, klinische Erfahrung. Scand J Infect Dis Suppl 1985; 47:155-164.
6. Barry DW, Nusinoff-Lehrman S. Virusresistenz in der klinischen Praxis: Zusammenfassung von fünf Jahren Erfahrung mit Aciclovir. Proceedings of the International Symposium on Pharmacological and Clinical Approches to Herpes Viruses and Virus Chemotherapy, Elsever, Amsterdam 1985;269-270.
7. Biron KK, Elion GB. Wirkung von Aciclovir in Kombination mit anderen Antiherpetika auf das Varizella-Zoster-Virus in vitro. Am J Med 1982; 73(1A):54-57.
8. Boelaert J., Schurgers M., Daneels R., Van Landuyt HW, Weatherley BC. Pharmakokinetik mehrerer Dosen von intravenösem Aciclovir bei Patienten mit kontinuierlicher ambulanter Peritonealdialyse. J Antimicrob Chemother 1987; 20(1):69-76.
9. Bryson YJ, Dillon M, Lovett M, Acuna G, Taylor S, Cherry JD et al. Behandlung der ersten Episoden einer genitalen Herpes-simplex-Virusinfektion mit oralem Aciclovir. Eine randomisierte, doppelblinde, kontrollierte Studie bei normalen Probanden. N. Engl. J. Med. 1983; 308(16):916-921.
10. Burns WH, Saral R., Santos GW, Laskin OL, Lietman PS, McLaren C. et al. Isolierung und Charakterisierung resistenter Herpes-simplex-Viren nach Aciclovir-Therapie. Lancet 1982; 1(8269):421-423.
11. Christophers J, Sutton RN. Charakterisierung von Aciclovir-resistenten und -sensitiven klinischen Herpes-simplex-Virus-Isolaten eines immungeschwächten Patienten. J Antimicrob Chemother 1987; 20(3):389-398.
12. Cole NL, Balfour HH, Jr. Das Varizella-Zoster-Virus wird während der Therapie nicht resistenter gegen Aciclovir. J Infect Dis 1986; 153(3):605-608.
13. Collins P, Bauer DJ. Die Aktivität in vitro gegen Herpesvirus von 9-(2-Hydroxyethoxymethyl)guanin (Acycloguanosin), einem neuen antiviralen Mittel. J Antimicrob Chemother 1979; 5(4):431-436.
14. Collins P, Oliver NM. Sensitivitätsüberwachung von Herpes-simplex-Virus-Isolaten von Patienten, die Aciclovir erhalten. J Antimicrob Chemother 1986; 18 Anhang B:103-112.
15. Collins P. Virale Empfindlichkeit nach der Einführung von Aciclovir. Am J Med 1988; 85(2A):129-134.
16. Collins P, Larder BA, Oliver NM, Kemp S, Smith IW, Darby G. Charakterisierung einer DNA-Polymerase-Mutante des Herpes-simplex-Virus von einem schwer immungeschwächten Patienten, der Aciclovir erhält. J Gen Virol 1989; 70 (Teil 2): 375-382.
17. Crumpacker CS, Schnipper LE, Zaia JA, Levin MJ. Wachstumshemmung durch Acycloguanosin von Herpesviren, die aus menschlichen Infektionen isoliert wurden. Antimicrob Agents Chemother 1979; 15(5):642-645.
18. Crumpacker CS, Schnipper LE, Marlowe SI, Kowalsky PN, Hershey BJ, Levin MJ. Resistenz gegen antivirale Medikamente des Herpes-simplex-Virus, isoliert von einem Patienten, der mit Aciclovir behandelt wurde. N. Engl. J. Med. 1982; 306(6):343-346.
19. Darby G., Inglis M. M., Larder BA. Mechanismen der Resistenz gegen nukleosidanaloge Inhibitoren des Herpes-simplex-Virus. 6. Int Congr Virol 1984; (Zusammenfassung Nr. W34-5).
20. E. De Clercq, J. Descamps, G. Verhelst, RT Walker, AS Jones, PF Torrence et al. Vergleichende Wirksamkeit von Antiherpes-Medikamenten gegen verschiedene Stämme des Herpes-simplex-Virus. J Infect Dis 1980; 141(5):563-574.
21. De Clercq E. Vergleichende Wirksamkeit von Antiherpes-Medikamenten in verschiedenen Zelllinien. Antimicrob Agents Chemother 1982; 21(4):661-663.
22. Dekker C, Ellis MN, McLaren C, Hunter G, Rogers J, Barry DW. Virusresistenz in der klinischen Praxis. J Antimicrob Chemother 1983; 12 Anhang B:137-152.
23. Douglas JM, Davis LG, Remington ML, Paulsen CA, Perrin EB, Goodman P et al. Eine doppelblinde, placebokontrollierte Studie zur Wirkung von chronisch verabreichtem oralem Aciclovir auf die Spermienproduktion bei Männern mit häufig wiederkehrendem Herpes genitalis. J Infect Dis März 1988; 157:588-93.
24. Douglas JM, Critchlow C, Benedetti J, Mertz GJ, Connor JD, Hintz MA et al. Eine doppelblinde Studie mit oralem Aciclovir zur Unterdrückung von Rezidiven einer genitalen Herpes-simplex-Virusinfektion. N. Engl. J. Med. 1984; 310(24):1551-1556.
25. Dunkle LM, Arvin AM, Whitley RJ, Rotbart HA, Feder HM, Jr., Feldman S et al. Eine kontrollierte Studie mit Aciclovir für Windpocken bei normalen Kindern. N. Engl. J. Med. 1991; 325(22):1539-1544.
26. Ellis MN, Keller PM, Martin JL, Strauss SE, Nusinoff-Lehrman S et al. Charakterisierung eines klinischen HSV-2-Isolats, das eine ACV-resistente Mutante enthält, die eine Thymidinkinase mit veränderter Substratspezifität produziert. 9. Internationaler Herpesvirus-Workshop, Seattle, Washington, 24.-29. August 1984.
27. Ellis MN, Keller PM, Fyfe JA, Martin JL, Rooney JF, Straus SE et al. Klinisches Isolat des Herpes-simplex-Virus Typ 2, das eine Thymidinkinase mit veränderter Substratspezifität induziert. Antimicrob Agents Chemother 1987; 31(7):1117-1125.
28. Englund JA, Zimmerman ME, Swierkosz EM, Goodman JL, Scholl DR, Balfour HH, Jr. Herpes-simplex-Virus resistent gegen Aciclovir. Eine Studie in einem tertiären Versorgungszentrum. Ann Intern Med 1990; 112(6):416-422.
29. Erlich KS, Jacobson MA, Koehler JE, Follansbee SE, Drennan DP, Gooze L et al. Foscarnet-Therapie bei schweren Aciclovir-resistenten Herpes-simplex-Virus-Typ-2-Infektionen bei Patienten mit erworbenem Immunschwächesyndrom (AIDS). Ein unkontrollierter Versuch. Ann Intern Med 1989; 110(9):710-713.
30. Erlich KS, Mills J, Chatis P, Mertz GJ, Busch DF, Follansbee SE et al. Aciclovir-resistente Herpes-simplex-Virus-Infektionen bei Patienten mit dem erworbenen Immunschwächesyndrom. N. Engl. J. Med. 1989; 320(5):293-296.
31. Field HJ, Darby G, Wildy P. Isolierung und Charakterisierung von Acyclovir-resistenten Mutanten des Herpes-simplex-Virus. J Gen Virol 1980; 49(1):115-124.
32. Feld HJ. Das Problem der arzneimittelinduzierten Resistenz bei Viren, in Probleme der antiviralen Therapie. Stuart-Harris CH, Oxford J (Hrsg.) Academic Press, London 1983.
33. Fyfe K. Rezidivmuster von Herpes genitalis nach Beendigung von mehr als 5 Jahren chronischer Aciclovir-Unterdrückung. VIII Int Conf AIDS/III Std World Cong 1992;(B240).
34. Huff JC, Bean B, Balfour HH, Jr., Laskin OL, Connor JD, Corey L et al. Therapie des Herpes zoster mit oralem Aciclovir. Am J Med 1988; 85(2A):84-89.
35. Jacobson MA, Berger TG, Fikrig S, Becherer P, Moohr JW, Stanat SC et al. Aciclovir-resistente Varizella-Zoster-Virus-Infektion nach chronischer oraler Aciclovir-Therapie bei Patienten mit erworbenem Immunschwächesyndrom (AIDS). Ann Intern Med 1990; 112(3):187-191.
36. LG Kaplowitz, D. Baker, L. Gelb, J. Blythe, R. Hale, P. Frost et al. Längere kontinuierliche Aciclovir-Behandlung normaler Erwachsener mit häufig wiederkehrender genitaler Herpes-simplex-Virusinfektion. Die Aciclovir-Studiengruppe. JAMA 1991; 265(6):747-751.
37. HC Krasny, SH Liao, P. de Miranda, OL Laskin, A. Whelton, PS Lietman. Einfluss der Hämodialyse auf die Pharmakokinetik von Aciclovir bei Patienten mit chronischer Niereninsuffizienz. Am J Med 1982; 73(1A):202-204.
38. Kurtz T. Sicherheit und Wirksamkeit einer unterdrückenden Langzeitbehandlung mit Ciclovir bei häufig wiederkehrendem Herpes genitalis: Ergebnisse aus Jahr 5. 30. Intersci Conf Antimicrob Agents Chemother 1990;270.
39. Laskin OL, Longstreth JA, Whelton A, Krasny HC, Keeney RE, Rocco L et al. Wirkung von Nierenversagen auf die Pharmakokinetik von Aciclovir. Am J Med 1982; 73(1A):197-201.
40. Lau RJ, Emery MG, Galinsky RE. Unerwartete Akkumulation von Aciclovir in der Muttermilch mit Schätzung der Exposition des Säuglings. Obstet Gynecol 1987; 69(3 Punkt 2):468-471.
41. Lehrman SN, Douglas JM, Corey L, Barry DW. Rezidivierender Herpes genitalis und unterdrückende orale Aciclovir-Therapie. Zusammenhang zwischen klinischem Ergebnis und In-vitro-Medikamentenempfindlichkeit. Ann Intern Med 1986; 104(6):786-790.
42. Marlowe S, Douglas J, Corey L, Schnipper L, Crumpacker C. Empfindlichkeit von HSV-Genitalisolaten nach oralem Aciclovir. 24. Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8.-10. Oktober 1984.
43. HR Mattison, RC Reichman, J. Benedetti, D. Bolgiano, LG Davis, A. Bailey-Farchione et al. Doppelblinde, placebokontrollierte Studie zum Vergleich einer unterdrückenden Langzeittherapie mit einer oralen Kurzzeittherapie mit Aciclovir zur Behandlung von rezidivierendem Herpes genitalis. Am J Med 1988; 85(2A):20-25.
44. McLaren C, Sibrack CD, Barry DW. Spektrum der Empfindlichkeit von Aciclovir von klinischen Isolaten des Herpes-simplex-Virus. Am J Med 1982; 73(1A):376-379.
45. McLaren C, Ellis MN, Hunter GA. Ein kolorimetrischer Assay zur Messung der Empfindlichkeit von Herpes-simplex-Viren gegenüber antiviralen Mitteln. Antiviral Res 1983; 3(4):223-234.
46. McLaren C, Corey L, Dekket C, Barry DW. In-vitro-Empfindlichkeit gegenüber Aciclovir bei genitalen Herpes-simplex-Viren von mit Aciclovir behandelten Patienten. J Infect Dis 1983; 148(5):868-875.
47. Mertz GJ, Critchlow CW, Benedetti J., Reichman RC, Dolin R., Connor J. et al. Doppelblinde, placebokontrollierte Studie mit oralem Aciclovir bei der ersten Episode einer genitalen Herpes-simplex-Virusinfektion. JAMA 1984; 252(9):1147-1151.
48. Mertz GJ, Jones CC, Mills J, Fife KH, Lemon SM, Stapleton JT et al. Langfristige Aciclovir-Unterdrückung häufig wiederkehrender genitaler Herpes-simplex-Virusinfektionen. Eine multizentrische Doppelblindstudie. JAMA 1988; 260(2):201-206.
49. G. J. Mertz, L. Eron, R. Kaufman, L. Goldberg, B. Raab, M. Conant et al. Längere kontinuierliche versus intermittierende orale Aciclovir-Behandlung bei normalen Erwachsenen mit häufig wiederkehrender genitaler Herpes-simplex-Virusinfektion. Am J Med 1988; 85(2A):14-19.
50. Meyer LJ, de Miranda P, Sheth N, Spruance S. Aciclovir in der menschlichen Muttermilch. Am J Obstet Gynecol 1988; 158(3 Punkt 1):586-588.
51. A. Mindel, IV. Weller, A. Faherty, S. Sutherland, D. Hindley, AP Fiddian et al. Prophylaktisches orales Aciclovir bei rezidivierendem Herpes genitalis. Lancet 1984; 2(8394):57-59.
52. Morton P, Thomson AN. Orales Aciclovir bei der Behandlung von Herpes zoster in der Allgemeinmedizin. NZ Med J 1989; 102(863):93-95.
53. Naib ZM, Nahmias AJ, Josey WE, Zaki SA. Beziehung der Zytohistopathologie der genitalen Herpesvirusinfektion zur zervikalen Anaplasie. CancerRes 1973; 33(6):1452-1463.
54. Nilsen AE, Aasen T, Halsos AM, Kinge BR, Tjotta EA, Wikstrom K et al. Wirksamkeit von oralem Aciclovir bei der Behandlung von initialem und rezidivierendem Herpes genitalis. Lancet 1982; 2(8298):571-573.
55. Nusinoff-Lehrman S, Hunter G, Rogers J, Corey L, Davis G. Die In-vitro-Aciclovir-Empfindlichkeit des Herpesvirus, die von Patienten ausgeschieden wird, die eine unterdrückende orale Therapie erhalten. 24. Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8.-10. Oktober 1984; (Abstract Nr. 1015).
56. O'Brien JJ, Campoli-Richards DM. Aciclovir. Ein aktualisierter Überblick über seine antivirale Aktivität, pharmakokinetischen Eigenschaften und therapeutische Wirksamkeit. Drogen 1989; 37(3):233-309.
57. Pahwa S., Biron K., Lim W., Swenson P., Kaplan MH, Sadick N. et al. Kontinuierliche Varicella-Zoster-Infektion im Zusammenhang mit Aciclovir-Resistenz bei einem Kind mit AIDS. JAMA 1988; 260(19):2879-2882.
58. Parker AC, Craig JI, Collins P, Oliver N, Smith I. Acyclovir-resistente Herpes-simplex-Virusinfektion aufgrund veränderter DNA-Polymerase. Lancet 1987; 2(8573):1461.
59. Parris DS, Harrington JE. Varianten des Herpes-simplex-Virus, die auf hohe Aciclovir-Konzentrationen beschränkt sind, existieren in klinischen Isolaten. Antimicrob Agents Chemother 1982; 22(1):71-77.
60. Preblud SR, Arbeter AM, Proctor EA, Starr SE, Plotkin SA. Empfindlichkeit von Impfstämmen des Varicella-Zoster-Virus gegenüber antiviralen Verbindungen. Antimicrob Agents Chemother 1984; 25(4):417-421.
61. Reichman RC, Badger GJ, Mertz GJ, Corey L, Richman DD, Connor JD et al. Behandlung rezidivierender genitaler Herpes-simplex-Infektionen mit oralem Aciclovir. Eine kontrollierte Studie. JAMA 1984; 251(16):2103-2107.
62. Shah GM, Winer RL, Krasny HC. Pharmakokinetik von Aciclovir bei einem Patienten mit kontinuierlicher ambulanter Peritonealdialyse. Am J Kidney Dis 1986; 7(6):507-510.
63. Sibrack CD, Gutman LT, Wilfert CM, McLaren C, St Clair MH, Keller PM et al. Pathogenität des Aciclovir-resistenten Herpes-simplex-Virus Typ 1 bei einem immungeschwächten Kind. J Infect Dis 1982; 146(5):673-682.
64. SE Straus, M. Seidlin, H. Takiff, D. Jacobs, D. Bowen, HA. Smith. Orales Aciclovir zur Unterdrückung wiederkehrender Herpes-simplex-Virusinfektionen bei immungeschwächten Patienten. Ann Intern Med 1984; 100(4):522-524.
65. Straus SE, Takiff HE, Seidlin M, Bachrach S, Lininger L, DiGiovanna JJ et al. Unterdrückung von häufig wiederkehrendem Herpes genitalis. Eine placebokontrollierte Doppelblindstudie mit oralem Aciclovir. N. Engl. J. Med. 1984; 310(24):1545-1550.
66. Straus SE, Croen KD, Sawyer MH, Freifeld AG, Felser JM, Dale JK et al. Aciclovir Unterdrückung von häufig wiederkehrendem Herpes genitalis. Wirksamkeit und abnehmender Bedarf in aufeinanderfolgenden Behandlungsjahren. JAMA 1988; 260(15):2227-2230.
67. Vinckier F, Boogaerts M, De Clerck D, De Clercq E. Chronische herpetische Infektion bei einem immungeschwächten Patienten: Bericht über einen Fall. J Oral Maxillofac Surg 1987; 45(8):723-728.
68. Wade JC, Newton B, McLaren C, Flournoy N, Keeney RE, Meyers JD. Intravenöses Aciclovir zur Behandlung einer mukokutanen Herpes-simplex-Virusinfektion nach Knochenmarktransplantation: eine Doppelblindstudie. Ann Intern Med 1982; 96(3):265-269.
69. Wade JC, McLaren C, Meyers JD. Häufigkeit und Bedeutung von Aciclovir-resistenten Herpes-simplex-Viren, die aus Knochenmarktransplantationspatienten isoliert wurden, die mehrere Behandlungszyklen mit Aciclovir erhielten. J Infect Dis 1983; 148(6):1077-1082.
INFORMATIONEN ZUM PATIENTEN
Patientinnen werden angewiesen, ihren Arzt zu konsultieren, wenn bei ihnen schwere oder störende Nebenwirkungen auftreten, sie schwanger werden oder beabsichtigen, schwanger zu werden, sie beabsichtigen, während der Einnahme von ZOVIRAX (Aciclovir) oral verabreicht zu stillen, oder sie andere Fragen haben.
Den Patienten sollte geraten werden, eine ausreichende Flüssigkeitszufuhr aufrechtzuerhalten.