Famvir 250mg, 500mg Famciclovir Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Famvir und wie wird es angewendet?
Famvir ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von akutem Herpes Zoster (Gürtelrose), Herpes labialis und Herpes genitalis. Famvir 250 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Famvir 250 mg gehört zu einer Klasse von Medikamenten namens Virostatika, andere.
Es ist nicht bekannt, ob Famvir bei Kindern unter 18 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Famvir 250 mg haben?
Famvir 250 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Famvir 500 mg gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Famvir. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Der Wirkstoff in FAMVIR 500 mg Tabletten ist Famciclovir, ein oral verabreichtes Prodrug des antiviralen Wirkstoffs Penciclovir. Chemisch ist Famciclovir als 2-[2-(2-Amino-9H-purin-9-yl)ethyl]-1,3-propandioldiacetat bekannt. Seine Summenformel ist C14H19N5O4; sein Molekulargewicht beträgt 321,3. Es ist ein synthetisches acyclisches Guaninderivat und hat die folgende Struktur
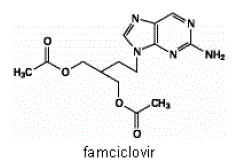
Famciclovir ist ein weißer bis blassgelber Feststoff. Es ist frei löslich in Aceton und Methanol und schwer löslich in Ethanol und Isopropanol. Bei 25 °C ist Famciclovir anfangs frei löslich (> 25 % w/v) in Wasser, fällt aber schnell als schwerlösliches (2 %-3 % w/v) Monohydrat aus. Famciclovir ist unter 85 % relativer Luftfeuchtigkeit nicht hygroskopisch. Verteilungskoeffizienten sind: Octanol/Wasser (pH 4,8) P=1,09 und Octanol/Phosphatpuffer (pH 7,4) P=2,08.
FAMVIR 250 mg Tabletten enthalten 125 mg, 250 mg oder 500 mg Famciclovir zusammen mit den folgenden inaktiven Bestandteilen: Hydroxypropylcellulose, Hydroxypropylmethylcellulose, Lactose, Magnesiumstearat, Polyethylenglykole, Natriumstärkeglykolat und Titandioxid.
INDIKATIONEN
Immunkompetente erwachsene Patienten
Herpes labialis (Fieberbläschen)
FAMVIR ist angezeigt zur Behandlung von rezidivierendem Herpes labialis.
Herpes genitalis
Wiederkehrende Episoden:
FAMVIR ist angezeigt zur Behandlung von wiederkehrenden Episoden von Herpes genitalis. Die Wirksamkeit von FAMVIR, wenn die Behandlung mehr als 6 Stunden nach dem Auftreten von Symptomen oder Läsionen begonnen wurde, wurde nicht nachgewiesen.
Unterdrückende Therapie:
FAMVIR 250 mg ist für die chronische unterdrückende Therapie wiederkehrender Episoden von Herpes genitalis indiziert. Die Wirksamkeit und Sicherheit von FAMVIR zur Unterdrückung von rezidivierendem Herpes genitalis über 1 Jahr hinaus wurde nicht nachgewiesen.
Herpes Zoster (Gürtelrose)
FAMVIR 500 mg ist zur Behandlung von Herpes zoster indiziert. Die Wirksamkeit von FAMVIR, wenn die Behandlung mehr als 72 Stunden nach Beginn des Hautausschlags begonnen wurde, wurde nicht nachgewiesen.
HIV-infizierte erwachsene Patienten
Wiederkehrender orolabieller oder genitaler Herpes
FAMVIR ist indiziert zur Behandlung wiederkehrender Episoden von Orolabial- oder Genitalherpes bei HIV-infizierten Erwachsenen. Die Wirksamkeit von FAMVIR, wenn die Behandlung mehr als 48 Stunden nach dem Auftreten von Symptomen oder Läsionen begonnen wurde, wurde nicht nachgewiesen.
Nutzungsbeschränkung
Die Wirksamkeit und Sicherheit von FAMVIR wurde nicht nachgewiesen für:
DOSIERUNG UND ANWENDUNG
FAMVIR 500 mg kann mit oder ohne Nahrung eingenommen werden.
Dosierungsempfehlung bei immunkompetenten erwachsenen Patienten
Herpes labialis (Fieberbläschen)
Die empfohlene Dosierung von FAMVIR 500 mg zur Behandlung von wiederkehrendem Herpes labialis beträgt 1500 mg als Einzeldosis. Die Therapie sollte beim ersten Anzeichen oder Symptom von Herpes labialis (z. B. Kribbeln, Juckreiz, Brennen, Schmerz oder Läsion) eingeleitet werden.
Herpes genitalis
Wiederkehrende Episoden
Die empfohlene Dosierung von FAMVIR zur Behandlung wiederkehrender Episoden von Herpes genitalis beträgt 1000 mg zweimal täglich für 1 Tag. Die Therapie sollte beim ersten Anzeichen oder Symptom einer wiederkehrenden Episode (z. B. Kribbeln, Juckreiz, Brennen, Schmerz oder Läsion) eingeleitet werden.
Unterdrückende Therapie
Die empfohlene Dosierung von FAMVIR 500 mg für die chronische unterdrückende Therapie wiederkehrender Episoden von Herpes genitalis beträgt 250 mg zweimal täglich.
Herpes Zoster (Gürtelrose)
Die empfohlene Dosierung von FAMVIR 250 mg zur Behandlung von Herpes zoster beträgt 500 mg alle 8 Stunden für 7 Tage. Die Therapie sollte eingeleitet werden, sobald Herpes zoster diagnostiziert wird.
Dosierungsempfehlung bei HIV-infizierten erwachsenen Patienten
Wiederkehrender orolabieller oder genitaler Herpes
Die empfohlene Dosierung von FAMVIR zur Behandlung von rezidivierendem orolabialen oder genitalen Herpes bei HIV-infizierten Patienten beträgt 500 mg zweimal täglich für 7 Tage. Die Therapie sollte beim ersten Anzeichen oder Symptom einer wiederkehrenden Episode (z. B. Kribbeln, Juckreiz, Brennen, Schmerz oder Läsion) eingeleitet werden.
Dosierungsempfehlung bei Patienten mit eingeschränkter Nierenfunktion
Dosierungsempfehlungen für erwachsene Patienten mit eingeschränkter Nierenfunktion sind in Tabelle 1 aufgeführt [siehe Verwendung in bestimmten Bevölkerungsgruppen , KLINISCHE PHARMAKOLOGIE ].
WIE GELIEFERT
Darreichungsformen und Stärken
FAMVIR Tabletten sind in 3 Stärken erhältlich:
Lagerung und Handhabung
FAMVIR Tabletten werden als Filmtabletten wie folgt geliefert: 125 mg in Flaschen mit 30; 250 mg in Flaschen zu 30; 500 mg in Flaschen mit 30 Stück und Einzelpackungen mit 50 Stück (nur für den institutionellen Gebrauch bestimmt).
Bei 25 °C (77 °F) lagern; Abweichungen bis 15-30°C (59-86°F) zulässig [siehe USP Controlled Room Temperature].
Vertrieb durch: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Überarbeitet: September 2016
NEBENWIRKUNGEN
Akute Niereninsuffizienz wird in anderen Abschnitten des Etiketts ausführlicher behandelt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die häufigsten unerwünschten Ereignisse, die bei mindestens 1 Indikation von > 10 % der mit FAMVIR 250 mg behandelten erwachsenen Patienten berichtet wurden, sind Kopfschmerzen und Übelkeit.
Erfahrung mit klinischen Studien bei erwachsenen Patienten
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Immunkompetente Patienten
Die Sicherheit von FAMVIR 250 mg wurde in wirkstoff- und placebokontrollierten klinischen Studien mit 816 mit FAMVIR behandelten Patienten mit Herpes zoster untersucht (FAMVIR, 250 mg dreimal täglich bis 750 mg dreimal täglich); 163 mit FAMVIR behandelte Patienten mit rezidivierendem Herpes genitalis (FAMVIR, 1000 mg zweimal täglich); 1.197 Patienten mit rezidivierendem Herpes genitalis, die mit FAMVIR 250 mg als Suppressionstherapie (125 mg einmal täglich bis 250 mg dreimal täglich) behandelt wurden, von denen 570 Patienten FAMVIR (offen und/oder doppelblind) für mindestens 10 Monate erhielten; und 447 mit FAMVIR behandelte Patienten mit Herpes labialis (FAMVIR 500 mg, 1500 mg einmal täglich oder 750 mg zweimal täglich). Tabelle 2 listet ausgewählte Nebenwirkungen auf.
Tabelle 3 listet ausgewählte Laboranomalien in Studien zur Unterdrückung von Herpes genitalis auf.
HIV-infizierte Patienten
Bei HIV-infizierten Patienten waren die am häufigsten berichteten Nebenwirkungen von FAMVIR (500 mg zweimal täglich; n=150) bzw. Aciclovir (400 mg, 5x/Tag; n=143) Kopfschmerzen (17 % vs. 15 % ), Übelkeit (11 % vs. 13 %), Durchfall (7 % vs. 11 %), Erbrechen (5 % vs. 4 %), Müdigkeit (4 % vs. 2 %) und Bauchschmerzen (3 % vs. 6 %).
Postmarketing-Erfahrung
Die unten aufgeführten unerwünschten Ereignisse wurden während der Anwendung von FAMVIR nach der Zulassung berichtet. Da diese Ereignisse freiwillig von einer Population ungewisser Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen:
Erkrankungen des Blutes und des Lymphsystems : Thrombozytopenie
Leber- und Gallenerkrankungen : Abnormale Leberfunktionstests, cholestatische Gelbsucht
Störungen des Immunsystems : Anaphylaktischer Schock, anaphylaktische Reaktion
Erkrankungen des Nervensystems : Schwindel, Schläfrigkeit, Krampfanfälle
Psychische Störungen Verwirrtheit (einschließlich Delirium, Orientierungslosigkeit und Verwirrtheitszustand, der vorwiegend bei älteren Menschen auftritt), Halluzinationen
Erkrankungen der Haut und des Unterhautgewebes : Urtikaria, Erythema multiforme, Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, Angioödem (z. B. Gesicht, Augenlid, periorbitales und pharyngeales Ödem), Überempfindlichkeitsvaskulitis
Herzerkrankungen : Herzklopfen
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Potenzielle Auswirkungen von FAMVIR 250 mg auf andere Medikamente
Die Steady-State-Pharmakokinetik von Digoxin wurde durch die gleichzeitige Gabe mehrerer Dosen Famciclovir (500 mg dreimal täglich) nicht verändert. Nach einer oralen Einzeldosis von 500 mg Famciclovir zusammen mit Zidovudin oder Emtricitabin wurde keine klinisch signifikante Wirkung auf die Pharmakokinetik von Zidovudin, seinem Metaboliten Zidovudin-Glucuronid oder Emtricitabin beobachtet.
Eine In-vitro-Studie mit menschlichen Lebermikrosomen weist darauf hin, dass Famciclovir kein Inhibitor von CYP3A4-Enzymen ist.
Potenzial für andere Medikamente, Penciclovir zu beeinflussen
Nach Gabe einer Einzeldosis von 500 mg Famciclovir nach Vorbehandlung mit mehreren Dosen Allopurinol, Cimetidin, Theophyllin, Zidovudin, Promethazin, kurz nach einem Antazidum (Magnesium- und Aluminiumhydroxid) oder gleichzeitig mit diesem wurden keine klinisch signifikanten Veränderungen der Pharmakokinetik von Penciclovir beobachtet Emtricitabin. Nach Mehrfachgabe (dreimal täglich) von Famciclovir (500 mg) mit Mehrfachdosen von Digoxin wurde keine klinisch signifikante Wirkung auf die Pharmakokinetik von Penciclovir beobachtet.
Die gleichzeitige Anwendung mit Probenecid oder anderen Arzneimitteln, die signifikant durch aktive renale tubuläre Sekretion eliminiert werden, kann zu erhöhten Plasmakonzentrationen von Penciclovir führen.
Die Umwandlung von 6-Desoxy-Penciclovir zu Penciclovir wird durch Aldehydoxidase katalysiert. Wechselwirkungen mit anderen Arzneimitteln, die von diesem Enzym metabolisiert werden und/oder dieses Enzym hemmen, könnten möglicherweise auftreten. Klinische Wechselwirkungsstudien von Famciclovir mit Cimetidin und Promethazin, In-vitro-Inhibitoren der Aldehydoxidase, zeigten keine relevanten Auswirkungen auf die Bildung von Penciclovir. Raloxifen, ein potenter Aldehydoxidase-Hemmer in vitro, könnte die Bildung von Penciclovir verringern. Es wurde jedoch keine klinische Arzneimittelwechselwirkungsstudie zur Bestimmung des Ausmaßes der Wechselwirkung zwischen Penciclovir und Raloxifen durchgeführt.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Akute Niereninsuffizienz
Fälle von akutem Nierenversagen wurden bei Patienten mit zugrunde liegender Nierenerkrankung berichtet, die für ihre Nierenfunktion unangemessen hohe Dosen von FAMVIR erhalten hatten. Bei der Verabreichung von FAMVIR an Patienten mit eingeschränkter Nierenfunktion wird eine Dosisreduktion empfohlen [siehe DOSIERUNG UND ANWENDUNG , Verwendung in bestimmten Bevölkerungsgruppen ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung (Patienteninformationen) zu lesen.
Es gibt keine Hinweise darauf, dass FAMVIR die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen eines Patienten beeinträchtigt. Patienten, bei denen während der Einnahme von FAMVIR 500 mg Schwindel, Schläfrigkeit, Verwirrtheit oder andere Störungen des zentralen Nervensystems auftreten, sollten jedoch kein Fahrzeug führen oder Maschinen bedienen.
Da FAMVIR Lactose enthält (FAMVIR 125 mg, 250 mg und 500 mg Tabletten enthalten Lactose 26,9 mg, 53,7 mg bzw. 107,4 mg), sollten Patienten mit der seltenen hereditären Galactose-Intoleranz, einem schweren Lactase-Mangel oder Glucose-Galactose-Malabsorption behandelt werden Es wird empfohlen, vor der Einnahme von FAMVIR mit ihrem Arzt zu sprechen.
Herpes labialis (Fieberbläschen)
Den Patienten sollte geraten werden, die Behandlung beim frühesten Anzeichen oder Symptom eines Wiederauftretens von Lippenherpes (z. B. Kribbeln, Jucken, Brennen, Schmerzen oder Läsion) einzuleiten. Die Patienten sollten angewiesen werden, dass die Behandlung von Lippenherpes 1 Dosis nicht überschreiten sollte. Die Patienten sollten darüber informiert werden, dass FAMVIR kein Heilmittel für Lippenherpes ist.
Herpes genitalis
Die Patienten sollten darüber informiert werden, dass FAMVIR kein Heilmittel für Herpes genitalis ist. Es gibt keine Daten darüber, ob FAMVIR die Übertragung einer Infektion auf andere verhindert. Da Herpes genitalis eine sexuell übertragbare Krankheit ist, sollten Patienten den Kontakt mit Läsionen oder Geschlechtsverkehr vermeiden, wenn Läsionen und/oder Symptome vorhanden sind, um eine Ansteckung des Partners zu vermeiden. Herpes genitalis wird häufig ohne Symptome durch asymptomatische Virusausscheidung übertragen. Daher sollten Patienten dazu angehalten werden, Safer-Sex-Praktiken anzuwenden.
Wenn eine episodische Therapie bei rezidivierendem Herpes genitalis indiziert ist, sollten die Patienten angewiesen werden, die Therapie beim ersten Anzeichen oder Symptom einer Episode einzuleiten.
Es liegen keine Daten zur Sicherheit oder Wirksamkeit einer chronischen Suppressionstherapie mit einer Dauer von mehr als 1 Jahr vor.
Herpes Zoster (Gürtelrose)
Es liegen keine Daten zu einer Behandlung vor, die später als 72 Stunden nach Beginn des Zoster-Ausschlags begonnen wurde. Den Patienten sollte geraten werden, die Behandlung so bald wie möglich nach der Diagnose von Herpes zoster einzuleiten.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Mit Famciclovir wurden zweijährige Kanzerogenitätsstudien mit der Nahrung an Ratten und Mäusen durchgeführt. Bei weiblichen Ratten, die die hohe Dosis von 600 mg/kg/Tag (das 1,1- bis 4,5-fache der systemischen Humanexposition bei der empfohlenen oralen Gesamtdosis) erhielten, wurde ein Anstieg der Inzidenz von Mamma-Adenokarzinom (ein häufiger Tumor bei Tieren dieses Stammes) beobachtet im Bereich zwischen 500 mg und 2000 mg, basierend auf der Fläche unter den Plasmakonzentrationskurvenvergleichen [24-Stunden-AUC] für Penciclovir). Bei männlichen Ratten, die mit Dosen bis zu 240 mg/kg/Tag (0,7- bis 2,7-fache AUC beim Menschen) behandelt wurden, oder bei männlichen und weiblichen Mäusen mit Dosen bis zu 600 mg/kg/Tag (0,3- bis 1,2-fache der humanen AUC).
Mutagenese
Famciclovir und Penciclovir (der aktive Metabolit von Famciclovir) wurden in einer Reihe von In-vitro- und In-vivo-Assays auf ihr genotoxisches Potenzial getestet. Famciclovir und Penciclovir waren in In-vitro-Tests auf Genmutationen in Bakterien (S. typhimurium und E. coli) und außerplanmäßige DNA-Synthese in Säuger-HeLa-83-Zellen (bei Dosen bis zu 10.000 bzw. 5.000 µg/Platte) negativ. Famciclovir war auch im L5178Y-Maus-Lymphom-Assay (5000 mcg/ml), im In-vivo-Maus-Mikrokerntest (4800 mg/kg) und in der Ratten-Dominant-Letal-Studie (5000 mg/kg) negativ. Famciclovir induzierte in vitro einen Anstieg der Polyploidie in menschlichen Lymphozyten ohne Chromosomenschädigung (1200 mcg/ml). Penciclovir war im L5178Y-Maus-Lymphom-Assay positiv auf Genmutation/Chromosomenaberrationen, mit und ohne metabolische Aktivierung (1000 mcg/ml). In menschlichen Lymphozyten verursachte Penciclovir Chromosomenaberrationen ohne metabolische Aktivierung (250 µg/ml). Penciclovir verursachte in vivo eine erhöhte Inzidenz von Mikrokernen im Knochenmark von Mäusen, wenn es intravenös in Dosen verabreicht wurde, die für das Knochenmark hoch toxisch waren (500 mg/kg), nicht jedoch bei oraler Verabreichung.
Beeinträchtigung der Fruchtbarkeit
Hodentoxizität wurde bei Ratten, Mäusen und Hunden nach wiederholter Verabreichung von Famciclovir oder Penciclovir beobachtet. Hodenveränderungen umfassten eine Atrophie der Hodenkanälchen, eine Verringerung der Spermienzahl und/oder ein erhöhtes Auftreten von Spermien mit abnormaler Morphologie oder verringerter Beweglichkeit. Der Grad der Toxizität für die männliche Reproduktion hing von Dosis und Dauer der Exposition ab. Bei männlichen Ratten wurde nach 10-wöchiger Gabe von 500 mg/kg/Tag (1,4- bis 5,7-fache AUC beim Menschen) eine verminderte Fertilität beobachtet. Die Konzentration ohne beobachtbare Wirkung für Spermien- und Hodentoxizität bei Ratten nach chronischer Verabreichung (26 Wochen) betrug 50 mg/kg/Tag (das 0,15- bis 0,6-fache der systemischen Exposition beim Menschen, basierend auf AUC-Vergleichen). Hodentoxizität wurde nach chronischer Verabreichung an Mäuse (104 Wochen) und Hunde (26 Wochen) in Dosen von 600 mg/kg/Tag (0,3- bis 1,2-fache AUC beim Menschen) und 150 mg/kg/Tag (1,3- bis 5,1-fache AUC) beobachtet menschliche AUC).
Famciclovir hatte bei weiblichen Ratten in Dosen von bis zu 1000 mg/kg/Tag (2,7- bis 10,8-fache AUC beim Menschen) keinen Einfluss auf die allgemeine Fortpflanzungsfähigkeit oder Fertilität.
Zwei placebokontrollierte Studien mit insgesamt 130 ansonsten gesunden Männern mit normalem Spermienprofil über einen 8-wöchigen Ausgangszeitraum und rezidivierendem Herpes genitalis, die orales FAMVIR (250 mg zweimal täglich) (n = 66) oder Placebo (n = 64) erhielten Therapie über 18 Wochen zeigte während der Behandlung oder während einer 8-wöchigen Nachbeobachtung keine Hinweise auf signifikante Auswirkungen auf die Spermienzahl, -motilität oder -morphologie.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie B
Nach oraler Verabreichung wird Famciclovir (Prodrug) in Penciclovir (Wirkstoff) umgewandelt. Es liegen keine adäquaten und gut kontrollierten Studien zur Anwendung von Famciclovir oder Penciclovir bei Schwangeren vor. In tierexperimentellen Reproduktionsstudien mit Famciclovir und Penciclovir in höheren Dosen als der maximal empfohlenen Humandosis (MRHD) und Exposition beim Menschen wurden keine nachteiligen Auswirkungen auf die embryofetale Entwicklung beobachtet. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte Famciclovir während der Schwangerschaft nur bei Bedarf angewendet werden.
In Reproduktionsstudien an Tieren erhielten trächtige Ratten und Kaninchen orales Famciclovir in Dosen (bis zu 1000 mg/kg/Tag), die das 2,7- bis 10,8-Fache (Ratten) und das 1,4- bis 5,4-Fache (Kaninchen) der systemischen Exposition beim Menschen basierend auf der AUC ergaben. Es wurden keine negativen Auswirkungen auf die embryofetale Entwicklung beobachtet. In anderen Studien erhielten trächtige Ratten und Kaninchen intravenös Famciclovir in Dosen (360 mg/kg/Tag) 1,5- bis 6-fach (Ratten) und (120 mg/kg/Tag) 1,1- bis 4,5-fach (Kaninchen) oder Penciclovir in Dosen (80 mg/kg/Tag) das 0,3- bis 1,3-fache (Ratten) und (60 mg/kg/Tag) das 0,5- bis 2,1-fache (Kaninchen) der MRHD, basierend auf Vergleichen der Körperoberfläche. Es wurden keine negativen Auswirkungen auf die embryofetale Entwicklung beobachtet.
Berichterstattung über Schwangerschaftsexposition
Zur Überwachung der mütterlich-fötalen Ergebnisse schwangerer Frauen, die FAMVIR 500 mg ausgesetzt waren, unterhält Novartis Pharmaceuticals Corporation ein FAMVIR-Schwangerschaftsmeldesystem. Ärzte werden ermutigt, ihre Patienten telefonisch unter 1-888-NOW-NOVA (669-6682) zu melden.
Stillende Mutter
Es ist nicht bekannt, ob Famciclovir (Prodrug) oder Penciclovir (Wirkstoff) in die Muttermilch übergehen. Nach oraler Gabe von Famciclovir an laktierende Ratten wurde Penciclovir in höherer Konzentration als im Plasma in die Muttermilch ausgeschieden. Es liegen keine Daten zur Sicherheit von FAMVIR 250 mg bei Säuglingen vor. FAMVIR 500 mg sollte bei stillenden Müttern nicht angewendet werden, es sei denn, der mögliche Nutzen überwiegt die mit der Behandlung verbundenen potenziellen Risiken.
Pädiatrische Verwendung
Die Wirksamkeit von FAMVIR 250 mg wurde bei pädiatrischen Patienten nicht nachgewiesen. Das pharmakokinetische Profil und die Sicherheit von Famciclovir (experimentelles Granulat gemischt mit OraSweet® oder Tabletten) wurden in 3 offenen Studien untersucht.
Studie 1 war eine Einzeldosis-Pharmakokinetik- und Sicherheitsstudie bei Säuglingen im Alter von 1 Monat bis
Studie 2 war eine unverblindete, pharmakokinetische Einzeldosis-Mehrfachdosis-Sicherheitsstudie mit experimentellem Famciclovir-Granulat gemischt mit OraSweet bei Kindern im Alter von 1 bis
Insgesamt 100 Patienten wurden in den Sicherheitsteil der Studie mit Mehrfachdosis aufgenommen; 47 Probanden mit aktiver oder latenter HSV-Infektion und 53 Probanden mit Windpocken. Patienten mit aktiver oder latenter HSV-Infektion erhielten 7 Tage lang zweimal täglich Famciclovir. Die Tagesdosis von Famciclovir lag je nach Körpergewicht des Patienten zwischen 150 mg und 500 mg zweimal täglich. Patienten mit Windpocken erhielten 7 Tage lang dreimal täglich Famciclovir. Die Tagesdosis von Famciclovir lag je nach Körpergewicht des Patienten zwischen 150 mg und 500 mg dreimal täglich. Die in dieser Studie beobachteten klinischen unerwünschten Ereignisse und Anomalien der Labortests waren ähnlich wie bei Erwachsenen. Die verfügbaren Daten reichen aus folgenden Gründen nicht aus, um die Anwendung von Famciclovir zur Behandlung von Kindern im Alter von 1 bis
Windpocken
Die Wirksamkeit von Famciclovir zur Behandlung von Windpocken wurde weder bei pädiatrischen noch bei erwachsenen Patienten nachgewiesen. Famciclovir ist für die Behandlung von Herpes zoster bei erwachsenen Patienten zugelassen. Eine Extrapolation der Wirksamkeitsdaten von Erwachsenen mit Herpes zoster auf Kinder mit Windpocken wäre jedoch nicht angemessen. Obwohl Windpocken und Herpes zoster durch das gleiche Virus verursacht werden, sind die Krankheiten unterschiedlich.
Herpes genitalis
Klinische Informationen zu Herpes genitalis bei Kindern sind begrenzt. Daher können Wirksamkeitsdaten von Erwachsenen nicht auf diese Population extrapoliert werden. Darüber hinaus wurde Famciclovir bei Kindern im Alter von 1 bis
Lippenherpes
Es liegen keine pharmakokinetischen und sicherheitsrelevanten Daten bei Kindern im Alter von 1 bis
Studie 3 war eine unverblindete, einarmige Studie zur Bewertung der Pharmakokinetik, Sicherheit und antiviralen Aktivität einer Einzeldosis von 1500 mg (drei 500-mg-Tabletten) von Famciclovir bei Kindern im Alter von 12 bis
In einer Phase-3-Studie mit Erwachsenen, in der Patienten eine Einzeldosis von 1500 mg Famciclovir oder Placebo erhielten, betrug die mediane Zeit bis zur Heilung bei Patienten mit nicht abortierten Läsionen 4,4 Tage in der Gruppe mit einer Einzeldosis von 1500 mg Famciclovir und 6,2 Tage in der Gruppe Placebo-Gruppe. Bemerkenswert ist, dass in der Erwachsenenstudie die Behandlung von den Patienten innerhalb von 1 Stunde nach dem Einsetzen der Symptome begonnen wurde [siehe Klinische Studien ]. Basierend auf den Wirksamkeitsergebnissen in Studie 3 wird Famciclovir bei Kindern im Alter von 12 bis
Geriatrische Verwendung
Von 816 Patienten mit Herpes zoster in klinischen Studien, die mit FAMVIR behandelt wurden, waren 248 (30,4 %) ≥ 65 Jahre und 103 (13 %) ≥ 75 Jahre alt. Insgesamt wurden keine Unterschiede in der Häufigkeit oder Art von unerwünschten Ereignissen zwischen jüngeren und älteren Patienten beobachtet. Von 610 Patienten mit rezidivierendem Herpes simplex (Typ 1 oder Typ 2) in klinischen Studien, die mit FAMVIR 500 mg behandelt wurden, waren 26 (4,3 %) > 65 Jahre und 7 (1,1 %) > 75 Jahre alt. Klinische Studien mit FAMVIR 500 mg bei Patienten mit rezidivierendem Herpes genitalis schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie im Vergleich zu jüngeren Probanden anders ansprechen.
Es wird keine altersabhängige Dosisanpassung von Famciclovir empfohlen, es sei denn, die Nierenfunktion ist beeinträchtigt [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ]. Im Allgemeinen sollte bei der Verabreichung und Überwachung von FAMVIR 250 mg bei älteren Patienten mit entsprechender Vorsicht vorgegangen werden, da eine verminderte Nierenfunktion und die gleichzeitige Anwendung anderer Arzneimittel häufiger auftreten.
Patienten mit eingeschränkter Nierenfunktion
Die scheinbare Plasmaclearance, die renale Clearance und die Geschwindigkeitskonstante der Plasmaelimination von Penciclovir nahmen linear mit der Abnahme der Nierenfunktion ab. Nach Verabreichung einer oralen Einzeldosis von 500 mg Famciclovir (n = 27) an gesunde Probanden und an Probanden mit Nierenfunktionsstörung unterschiedlichen Grades (CLCR im Bereich von 6,4 bis 138,8 ml/min) wurden die folgenden Ergebnisse erzielt (Tabelle 4):
In einer Mehrfachdosisstudie mit Famciclovir, die an Patienten mit Nierenfunktionsstörung unterschiedlichen Grades (n=18) durchgeführt wurde, war die Pharmakokinetik von Penciclovir vergleichbar mit der nach Einzeldosis.
Bei Patienten mit eingeschränkter Nierenfunktion wird eine Dosisanpassung empfohlen [siehe DOSIERUNG UND ANWENDUNG ].
Patienten mit eingeschränkter Leberfunktion
Eine leichte oder mäßige Leberfunktionsstörung (chronische Hepatitis [n=6], chronischer Ethanolmissbrauch [n=8] oder primäre biliäre Zirrhose [n=1]) hatte keine Auswirkung auf das Ausmaß der Verfügbarkeit (AUC) von Penciclovir nach einer Einzeldosis von 500 mg Famciclovir. Allerdings kam es bei Patienten mit eingeschränkter Leberfunktion im Vergleich zu gesunden Probanden zu einer Verringerung der mittleren maximalen Plasmakonzentration (Cmax) von Penciclovir um 44 %, und die Zeit bis zur maximalen Plasmakonzentration (tmax) war um 0,75 Stunden verlängert. Für Patienten mit leichter oder mittelschwerer Leberfunktionsstörung wird keine Dosisanpassung empfohlen. Die Pharmakokinetik von Penciclovir wurde bei Patienten mit schwerer Leberfunktionsstörung nicht untersucht. Die Umwandlung von Famciclovir in den aktiven Metaboliten Penciclovir kann bei diesen Patienten beeinträchtigt sein, was zu niedrigeren Penciclovir-Plasmakonzentrationen und damit möglicherweise zu einer Abnahme der Wirksamkeit von Famciclovir führt [siehe KLINISCHE PHARMAKOLOGIE ].
Schwarze und afroamerikanische Patienten
In einer randomisierten, doppelblinden, placebokontrollierten Studie, die an 304 immunkompetenten schwarzen und afroamerikanischen Erwachsenen mit rezidivierendem Herpes genitalis durchgeführt wurde, gab es keinen Unterschied in der medianen Zeit bis zur Heilung zwischen Patienten, die FAMVIR oder Placebo erhielten. Im Allgemeinen war das Nebenwirkungsprofil ähnlich dem, das in anderen klinischen FAMVIR-Studien bei erwachsenen Patienten beobachtet wurde [siehe NEBENWIRKUNGEN ]. Die Relevanz dieser Studienergebnisse für andere Indikationen bei schwarzen und afroamerikanischen Patienten ist nicht bekannt [siehe Klinische Studien ].
ÜBERDOSIS
Es sollte eine geeignete symptomatische und unterstützende Therapie erfolgen. Penciclovir wird durch Hämodialyse entfernt.
KONTRAINDIKATIONEN
FAMVIR 250 mg ist bei Patienten mit bekannter Überempfindlichkeit gegen das Produkt, seine Bestandteile oder Denavir® (Penciclovir-Creme) kontraindiziert.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Famciclovir ist ein oral verabreichtes Prodrug des antiviralen Wirkstoffs Penciclovir [vgl Mikrobiologie ].
Pharmakokinetik
Famciclovir ist das Diacetyl-6-desoxy-Analogon des antiviralen Wirkstoffs Penciclovir. Nach oraler Verabreichung wird Famciclovir schnell und umfassend zu Penciclovir metabolisiert, und im Plasma oder Urin wird wenig oder kein Famciclovir nachgewiesen. Penciclovir wird überwiegend unverändert über die Niere ausgeschieden. Daher muss die Dosis von FAMVIR 500 mg bei Patienten mit unterschiedlich stark eingeschränkter Nierenfunktion angepasst werden [siehe DOSIERUNG UND ANWENDUNG ].
Pharmakokinetik bei Erwachsenen
Resorption und Bioverfügbarkeit:
Die absolute Bioverfügbarkeit von Penciclovir beträgt 77 ± 8 %, bestimmt nach Verabreichung einer oralen Dosis von 500 mg Famciclovir und einer intravenösen Dosis von 400 mg Penciclovir an 12 gesunde männliche Probanden.
Die Konzentrationen von Penciclovir stiegen proportional zur Dosis über einen Famciclovir-Dosisbereich von 125 mg bis 1000 mg, verabreicht als Einzeldosis. Tabelle 5 zeigt die mittleren pharmakokinetischen Parameter von Penciclovir nach einmaliger Verabreichung von FAMVIR an gesunde männliche Probanden.
Nach oraler Gabe einer Einzeldosis von 500 mg Famciclovir an 7 Patienten mit Herpes zoster betrugen AUC (Mittelwert ± Standardabweichung), Cmax und tmax 12,1 ± 1,7 µg h/ml, 4,0 ± 0,7 µg/ml und 0,7 ± 0,2 Stunden , beziehungsweise. Die AUC von Penciclovir war bei Patienten mit Herpes zoster etwa 35 % höher als bei gesunden Probanden. Einige dieser Unterschiede können auf Unterschiede in der Nierenfunktion zwischen den beiden Gruppen zurückzuführen sein.
Nach Verabreichung von 500 mg Famciclovir dreimal täglich über 7 Tage kommt es zu keiner Akkumulation von Penciclovir.
Die Cmax von Penciclovir verringerte sich um etwa 50 % und tmax verzögerte sich um 1,5 Stunden, wenn eine Kapselformulierung von Famciclovir zusammen mit Nahrung verabreicht wurde (der Nährstoffgehalt betrug etwa 910 kcal und 26 % Fett). Es gab keine Auswirkung auf das Ausmaß der Verfügbarkeit (AUC) von Penciclovir. Es gab eine 18 %ige Abnahme von Cmax und eine Verzögerung von tmax von etwa 1 Stunde, wenn Famciclovir 2 Stunden nach einer Mahlzeit verabreicht wurde, im Vergleich zu seiner Verabreichung 2 Stunden vor einer Mahlzeit. Da das Ausmaß der systemischen Verfügbarkeit von Penciclovir nicht beeinflusst wurde, kann FAMVIR 250 mg unabhängig von den Mahlzeiten eingenommen werden.
Verteilung:
Das Verteilungsvolumen (Vdβ) betrug 1,08 ± 0,17 l/kg bei 12 gesunden männlichen Probanden nach einer intravenösen Einzeldosis von 400 mg Penciclovir, verabreicht als einstündige intravenöse Infusion. Penciclovir wird im Konzentrationsbereich von 0,1 bis 20 µg/ml zu
Stoffwechsel:
Nach oraler Verabreichung wird Famciclovir deacetyliert und zu Penciclovir oxidiert. Zu den inaktiven Metaboliten gehören 6-Desoxy-Penciclovir, monoacetyliertes Penciclovir und 6-Desoxy-monoacetyliertes Penciclovir (5 %, WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Beseitigung:
Nach Verabreichung von 5 mg/kg radioaktiv markiertem Penciclovir als 1-stündige Infusion an 3 gesunde männliche Probanden wurden etwa 94 % der verabreichten Radioaktivität über 24 Stunden im Urin wiedergefunden (83 % der Dosis wurden in den ersten 6 Stunden ausgeschieden). Penciclovir machte 91 % der im Urin ausgeschiedenen Radioaktivität aus.
Nach oraler Gabe einer Einzeldosis von 500 mg radioaktiv markiertem Famciclovir an 3 gesunde männliche Probanden wurden 73 % bzw. 27 % der verabreichten Radioaktivität im Urin bzw. im Stuhl innerhalb von 72 Stunden wiedergefunden. Penciclovir machte 82 % und 6-Desoxy-Penciclovir 7 % der im Urin ausgeschiedenen Radioaktivität aus. Etwa 60 % der verabreichten radioaktiv markierten Dosis wurden in den ersten 6 Stunden im Urin gesammelt.
Nach intravenöser Verabreichung von Penciclovir an 48 gesunde männliche Probanden betrug die mittlere ± Standardabweichung der Gesamtplasmaclearance von Penciclovir 36,6 ± 6,3 l/h (0,48 ± 0,09 l/h/kg). Die renale Clearance von Penciclovir machte 74,5 ± 8,8 % der gesamten Plasmaclearance aus.
Die renale Clearance von Penciclovir nach oraler Verabreichung einer Einzeldosis von 500 mg Famciclovir an 109 gesunde männliche Probanden betrug 27,7 ± 7,6 l/h. Die aktive tubuläre Sekretion trägt zur renalen Elimination von Penciclovir bei.
Die Plasmaeliminationshalbwertszeit von Penciclovir betrug 2,0 ± 0,3 Stunden nach intravenöser Verabreichung von Penciclovir an 48 gesunde männliche Probanden und 2,3 ± 0,4 Stunden nach oraler Verabreichung von 500 mg Famciclovir an 124 gesunde männliche Probanden. Die Halbwertszeit bei 17 Patienten mit Herpes zoster betrug 2,8 ± 1,0 Stunden bzw. 2,7 ± 1,0 Stunden nach einmaliger bzw. wiederholter Gabe.
Besondere Populationen
Geriatrische Patienten
Basierend auf einem studienübergreifenden Vergleich war die AUC von Penciclovir um 40 % höher und die renale Clearance von Penciclovir um 22 % niedriger bei älteren Probanden (n = 18, Alter 65-79 Jahre) im Vergleich zu jüngeren Probanden. Einige dieser Unterschiede können auf Unterschiede in der Nierenfunktion zwischen den beiden Gruppen zurückzuführen sein. Es wird keine altersabhängige Dosisanpassung von Famciclovir empfohlen, es sei denn, die Nierenfunktion ist beeinträchtigt [siehe DOSIERUNG UND ANWENDUNG , Verwendung in bestimmten Bevölkerungsgruppen ]
Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit Nierenfunktionsstörung unterschiedlichen Grades nahmen die scheinbare Plasma-Clearance, die renale Clearance und die Plasma-Eliminationsgeschwindigkeitskonstante von Penciclovir sowohl nach einmaliger als auch nach wiederholter Gabe linear mit der Verringerung der Nierenfunktion ab [siehe Verwendung in bestimmten Bevölkerungsgruppen ]. Bei Patienten mit eingeschränkter Nierenfunktion wird eine Dosisanpassung empfohlen [siehe DOSIERUNG UND ANWENDUNG ].
Patienten mit eingeschränkter Leberfunktion
Eine leichte oder mäßige Leberfunktionsstörung hatte keinen Einfluss auf das Ausmaß der Verfügbarkeit (AUC) von Penciclovir [siehe Verwendung in bestimmten Bevölkerungsgruppen ]. Für Patienten mit leichter oder mittelschwerer Leberfunktionsstörung wird keine Dosisanpassung empfohlen. Die Auswirkung einer schweren Leberfunktionsstörung auf die Pharmakokinetik von Penciclovir wurde nicht untersucht.
HIV-infizierte Patienten
Nach oraler Verabreichung einer Einzeldosis von 500 mg Famciclovir an HIV-positive Patienten waren die pharmakokinetischen Parameter von Penciclovir mit denen vergleichbar, die bei gesunden Probanden beobachtet wurden.
Geschlecht
Die Pharmakokinetik von Penciclovir wurde bei 18 gesunden männlichen und 18 gesunden weiblichen Probanden nach oraler Einzeldosis-Gabe von 500 mg Famciclovir untersucht. Die AUC von Penciclovir betrug 9,3 ± 1,9 µg h/ml bzw. 11,1 ± 2,1 µg h/ml bei Männern bzw. Frauen. Die renale Clearance von Penciclovir betrug 28,5 ± 8,9 l/h bzw. 21,8 ± 4,3 l/h. Diese Unterschiede wurden auf Unterschiede in der Nierenfunktion zwischen den beiden Gruppen zurückgeführt. Eine geschlechtsspezifische Dosisanpassung von Famciclovir wird nicht empfohlen.
Wettrennen
Es wurde eine retrospektive Bewertung durchgeführt, um die pharmakokinetischen Parameter zu vergleichen, die bei schwarzen und kaukasischen Probanden nach einmaliger und wiederholter einmal täglicher, zweimal täglicher oder dreimal täglicher Verabreichung von Famciclovir 500 mg erhalten wurden. Daten aus einer Studie an gesunden Probanden (Einzeldosis), einer Studie an Probanden mit unterschiedlich stark eingeschränkter Nierenfunktion (Einzeldosis und wiederholte Gabe) und einer Studie an Probanden mit eingeschränkter Leberfunktion (Einzeldosis) zeigten keine signifikanten Unterschiede in der Pharmakokinetik von Penciclovir zwischen schwarzen und kaukasischen Probanden.
Mikrobiologie
Wirkmechanismus
Famciclovir ist ein Prodrug von Penciclovir, das eine hemmende Aktivität gegen das Herpes-simplex-Virus Typ 1 (HSV-1) und 2 (HSV-2) und das Varizella-Zoster-Virus (VZV) gezeigt hat. In mit HSV-1, HSV-2 oder VZV infizierten Zellen phosphoryliert die virale Thymidinkinase Penciclovir zu einer Monophosphatform, die wiederum durch zelluläre Kinasen in die aktive Form Penciclovirtriphosphat umgewandelt wird. Biochemische Studien zeigen, dass Penciclovirtriphosphat die HSV-2-DNA-Polymerase kompetitiv mit Desoxyguanosintriphosphat hemmt. Folglich werden die Herpes-Virus-DNA-Synthese und damit die Replikation selektiv gehemmt. Penciclovirtriphosphat hat eine intrazelluläre Halbwertszeit von 10 Stunden in HSV-1-, 20 Stunden in HSV-2- und 7 Stunden in in Kultur gezüchteten VZV-infizierten Zellen. Die klinische Bedeutung der intrazellulären Halbwertszeit ist jedoch unbekannt.
Antivirale Aktivität
In Zellkulturstudien wirkt Penciclovir hemmend auf die folgenden Herpesviren: HSV-1, HSV-2 und VZV. Die antivirale Aktivität von Penciclovir gegen Wildtyp-Stämme, die auf menschlichen Vorhautfibroblasten gezüchtet wurden, wurde mit einem Plaque-Reduktionsassay und Färbung mit Kristallviolett 3 Tage nach der Infektion für HSV und 10 Tage nach der Infektion für VZV bewertet. Die medianen EC50-Werte von Penciclovir gegenüber Labor- und klinischen Isolaten von HSV-1, HSV-2 und VZV betrugen 2 μM (Bereich 1,2 bis 2,4 μM, n=7), 2,6 μM (Bereich 1,6 bis 11 μM, n=6) bzw. 34 μM (Bereich 6,7 bis 71 μM, n=6).
Widerstand
Penciclovir-resistente Mutanten von HSV und VZV können aus Mutationen in den Genen der viralen Thymidinkinase (TK) und der DNA-Polymerase resultieren. Mutationen im viralen TK-Gen können zu einem vollständigen Verlust der TK-Aktivität (TK-negativ), einer verringerten TK-Aktivität (partielle TK) oder einer Veränderung der Fähigkeit der viralen TK führen, das Arzneimittel zu phosphorylieren, ohne dass die Fähigkeit zur Phosphorylierung entsprechend verloren geht Thymidin (TK verändert). Die medianen EC50-Werte, die in einem Plaque-Reduktionsassay mit Penciclovir-resistentem HSV-1, HSV-2 und VZV beobachtet wurden, waren 69 μM (Bereich 14 bis 115 μM, n=6), 46 μM (Bereich 4 bis >395 μM, n= 9) bzw. 92 μM (Bereich 51 bis 148 μM, n=4). Bei Patienten, die während der Therapie nicht ansprechen oder eine rezidivierende Virusausscheidung erfahren, sollte die Möglichkeit einer Virusresistenz gegen Penciclovir in Betracht gezogen werden.
Kreuzresistenz
Bei HSV-DNA-Polymerase-Inhibitoren wurde Kreuzresistenz beobachtet. Die am häufigsten vorkommenden Aciclovir-resistenten Mutanten, die TK-negativ sind, sind auch gegen Penciclovir resistent.
Klinische Studien
Herpes labialis (Fieberbläschen)
Eine randomisierte, doppelblinde, Placebo-kontrollierte Studie wurde mit 701 immunkompetenten Erwachsenen mit rezidivierendem Herpes labialis durchgeführt. Die Patienten leiteten innerhalb von 1 Stunde nach dem ersten Auftreten von Anzeichen oder Symptomen einer rezidivierenden Herpes-labialis-Episode selbst eine Therapie mit FAMVIR 1500 mg als Einzeldosis (n = 227), FAMVIR 750 mg zweimal täglich (n = 220) oder Placebo (n = 254) für 1 Tag. Die mediane Zeit bis zur Heilung bei Patienten mit nicht abgebrochenen Läsionen (die über das Papelstadium hinausgingen) betrug 4,4 Tage in der FAMVIR-1500-mg-Einzeldosisgruppe (n = 152) im Vergleich zu 6,2 Tagen in der Placebogruppe (n = 168). . Der mediane Unterschied in der Zeit bis zur Heilung zwischen den mit Placebo und FAMVIR 1500 mg behandelten Gruppen betrug 1,3 Tage (95 % KI: 0,6–2,0). Zwischen Patienten, die FAMVIR 250 mg oder Placebo erhielten, wurden keine Unterschiede im Anteil der Patienten mit abortierten Läsionen (die nicht über das Papelstadium hinausgingen) beobachtet: 33 % bei FAMVIR 1500 mg Einzeldosis und 34 % bei Placebo. Die mediane Zeit bis zum Nachlassen von Schmerzen und Druckempfindlichkeit betrug 1,7 Tage bei mit FAMVIR 1500 mg Einzeldosis behandelten Patienten gegenüber 2,9 Tagen bei mit Placebo behandelten Patienten.
Herpes genitalis
Wiederkehrende Episoden
Eine randomisierte, doppelblinde, placebokontrollierte Studie wurde an 329 immunkompetenten Erwachsenen mit rezidivierendem Herpes genitalis durchgeführt. Die Patienten leiteten innerhalb von 6 Stunden nach dem ersten Anzeichen oder Symptom einer rezidivierenden Herpes genitalis-Episode selbst eine Therapie mit entweder FAMVIR 1000 mg zweimal täglich (n = 163) oder Placebo (n = 166) für 1 Tag ein. Die mediane Zeit bis zur Heilung bei Patienten mit nicht abgebrochenen Läsionen (die über das Papelstadium hinausgingen) betrug 4,3 Tage bei den mit FAMVIR behandelten Patienten (n = 125) im Vergleich zu 6,1 Tagen bei den mit Placebo behandelten Patienten (n = 145). Der mediane Unterschied in der Zeit bis zur Heilung zwischen den mit Placebo und FAMVIR behandelten Gruppen betrug 1,2 Tage (95 % KI: 0,5 bis 2,0). 23 % der mit FAMVIR behandelten Patienten hatten abortierte Läsionen (keine Läsionsentwicklung über Erythem hinaus) gegenüber 13 % der mit Placebo behandelten Patienten. Die mediane Zeit bis zum Verschwinden aller Symptome (z. B. Kribbeln, Jucken, Brennen, Schmerzen oder Empfindlichkeit) betrug 3,3 Tage bei den mit FAMVIR behandelten Patienten gegenüber 5,4 Tagen bei den mit Placebo behandelten Patienten.
Eine randomisierte (2:1), doppelblinde, placebokontrollierte Studie wurde mit 304 immunkompetenten schwarzen und afroamerikanischen Erwachsenen mit rezidivierendem Herpes genitalis durchgeführt. Die Patienten leiteten innerhalb von 6 Stunden nach dem ersten Anzeichen oder Symptom einer rezidivierenden Herpes genitalis-Episode selbst eine Therapie mit entweder FAMVIR 1000 mg zweimal täglich (n = 206) oder Placebo (n = 98) für 1 Tag ein. Die mediane Zeit bis zur Heilung bei Patienten mit nicht abgebrochenen Läsionen betrug 5,4 Tage bei mit FAMVIR behandelten Patienten (n = 152) im Vergleich zu 4,8 Tagen bei mit Placebo behandelten Patienten (n = 78). Der mediane Unterschied in der Zeit bis zur Heilung zwischen den mit Placebo und FAMVIR behandelten Gruppen betrug -0,26 Tage (95 % KI: -0,98 bis 0,40).
Unterdrückungstherapie
Zwei randomisierte, doppelblinde, placebokontrollierte 12-monatige Studien wurden mit 934 immunkompetenten Erwachsenen mit einer Vorgeschichte von 6 oder mehr Rezidiven von Genitalherpes-Episoden pro Jahr durchgeführt. Vergleiche umfassten FAMVIR 125 mg dreimal täglich, 250 mg zweimal täglich, 250 mg dreimal täglich und Placebo. Nach 12 Monaten erhielten 60 % bis 65 % der Patienten immer noch FAMVIR und 25 % eine Placebobehandlung. Die Rezidivraten nach 6 und 12 Monaten bei Patienten, die mit der Dosis von 250 mg zweimal täglich behandelt wurden, sind in Tabelle 6 aufgeführt.
Mit FAMVIR behandelte Patienten hatten etwa 1/5 der medianen Anzahl an Rezidiven im Vergleich zu mit Placebo behandelten Patienten. Höhere Dosen von FAMVIR 250 mg waren nicht mit einer Steigerung der Wirksamkeit verbunden.
Rezidivierender Orolabial- oder Genitalherpes bei HIV-infizierten Patienten
In einer randomisierten, doppelblinden Studie wurde Famciclovir 500 mg zweimal täglich für 7 Tage (n = 150) mit oralem Aciclovir 400 mg 5-mal täglich für 7 Tage (n = 143) bei HIV-infizierten Patienten mit rezidivierendem orolabialem oder genitalem Herpes verglichen, die innerhalb behandelt wurden 48 Stunden nach Beginn der Läsion. Ungefähr 40 % der Patienten hatten eine CD4 + -Zahl unter 200 Zellen/mm3, 54 % der Patienten hatten anogenitale Läsionen und 35 % hatten orolabiale Läsionen. Die Famciclovir-Therapie war hinsichtlich der Verringerung der Bildung neuer Läsionen und der Zeit bis zur vollständigen Heilung mit oralem Aciclovir vergleichbar.
Herpes Zoster (Gürtelrose)
An 964 immunkompetenten Erwachsenen mit unkompliziertem Herpes zoster wurden zwei randomisierte, doppelblinde Studien, 1 Placebo-kontrollierte und 1 aktiv-kontrollierte Studie, durchgeführt. Die Behandlung wurde innerhalb von 72 Stunden nach Auftreten der ersten Läsion begonnen und 7 Tage fortgesetzt.
In der placebokontrollierten Studie wurden 419 Patienten entweder mit FAMVIR 500 mg dreimal täglich (n = 138), FAMVIR 750 mg dreimal täglich (n = 135) oder Placebo (n = 146) behandelt. Die mediane Zeit bis zur vollständigen Krustenbildung betrug 5 Tage bei den mit FAMVIR 500 mg behandelten Patienten im Vergleich zu 7 Tagen bei den mit Placebo behandelten Patienten. Die Zeiten bis zur vollständigen Krustenbildung, zum Verlust von Vesikeln, zum Verlust von Geschwüren und zum Verlust von Krusten waren bei den mit FAMVIR 500 mg behandelten Patienten kürzer als bei den mit Placebo behandelten Patienten in der gesamten Studienpopulation. Die Wirkung von FAMVIR 500 mg war größer, wenn die Therapie innerhalb von 48 Stunden nach Auftreten des Hautausschlags begonnen wurde; es war auch bei Patienten im Alter von 50 Jahren oder älter ausgeprägter. Unter den 65,2 % der Patienten mit mindestens 1 positiver Viruskultur hatten die mit FAMVIR behandelten Patienten eine kürzere mediane Dauer der Virusausscheidung als die mit Placebo behandelten Patienten (1 Tag bzw. 2 Tage).
Es gab insgesamt keine Unterschiede in der Dauer der Schmerzen vor der Abheilung des Hautausschlags zwischen den mit FAMVIR und Placebo behandelten Gruppen. Darüber hinaus gab es zwischen den Behandlungsgruppen keinen Unterschied im Auftreten von Schmerzen nach Heilung des Hautausschlags (postherpetische Neuralgie). Bei den 186 Patienten (44,4 % der gesamten Studienpopulation), die eine postherpetische Neuralgie entwickelten, war die mediane Dauer der postherpetischen Neuralgie bei den mit FAMVIR 500 mg behandelten Patienten kürzer als bei den mit Placebo behandelten Patienten (63 Tage bzw. 119 Tage). Bei einer höheren Dosis von FAMVIR wurde keine zusätzliche Wirksamkeit nachgewiesen.
In der aktiv kontrollierten Studie wurden 545 Patienten mit 1 von 3 Dosen FAMVIR dreimal täglich oder mit Aciclovir 800 mg fünfmal täglich behandelt. Die Zeiten bis zur vollständigen Verkrustung der Läsion und die Zeiten bis zum Verschwinden der akuten Schmerzen waren für alle Gruppen vergleichbar und es gab keine statistisch signifikanten Unterschiede in der Zeit bis zum Verschwinden der postzosterischen Neuralgie zwischen den mit FAMVIR und den mit Aciclovir behandelten Gruppen.
INFORMATIONEN ZUM PATIENTEN
FAMVIR® (Fam'-veer) (Famciclovir) Tabletten
Lesen Sie diese Patienteninformation, bevor Sie mit der Einnahme von FAMVIR beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung.
Was ist FAMVIR?
Famvir ist ein verschreibungspflichtiges antivirales Arzneimittel, das verwendet wird, um:
Es ist nicht bekannt, ob FAMVIR 500 mg bei Kindern unter 18 Jahren sicher und wirksam ist.
FAMVIR 250mg ist kein Heilmittel für Herpes. Es ist nicht bekannt, ob FAMVIR die Übertragung von Herpes auf andere stoppen kann. Wenn Sie sexuell aktiv sind, können Sie Herpes auf Ihren Partner übertragen, auch wenn Sie FAMVIR einnehmen. Herpes kann auch übertragen werden, wenn Sie keine aktiven Symptome haben. Sie sollten weiterhin Safer Sex praktizieren, um die Wahrscheinlichkeit zu verringern, Herpes genitalis auf andere zu übertragen. Haben Sie während eines Ausbruchs von Herpes genitalis oder wenn Sie irgendwelche Symptome von Herpes genitalis haben, keinen sexuellen Kontakt mit Ihrem Partner. Verwenden Sie bei sexuellem Kontakt ein Kondom aus Latex oder Polyurethan. Fragen Sie Ihren Arzt nach weiteren Informationen zu Safer-Sex-Praktiken.
Wer sollte FAMVIR nicht einnehmen?
Nehmen Sie FAMVIR 250 mg nicht ein, wenn Sie allergisch gegen einen der Inhaltsstoffe oder gegen Denavir® (Penciclovir-Creme) sind. Eine vollständige Liste der Inhaltsstoffe von FAMVIR finden Sie am Ende dieser Packungsbeilage.
Was sollte ich meinem Arzt vor der Einnahme von FAMVIR 500 mg mitteilen?
Bevor Sie mit der Einnahme von FAMVIR 500 mg beginnen, informieren Sie Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und pflanzlicher Nahrungsergänzungsmittel. Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste mit ihnen, die Sie Ihrem Arzt und Apotheker jedes Mal zeigen können, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich FAMVIR einnehmen?
Welche Nebenwirkungen kann FAMVIR 250 mg haben?
Zu den häufigsten Nebenwirkungen von FAMVIR 500 mg gehören:
Sprechen Sie mit Ihrem Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht verschwindet.
Dies sind nicht alle möglichen Nebenwirkungen von FAMVIR. Fragen Sie Ihren Arzt oder Apotheker nach weiteren Informationen.
Rufen Sie Ihren Arzt an, um medizinischen Rat zu Nebenwirkungen zu erhalten. Sie können Nebenwirkungen der FDA unter 1-800-FDA1088 melden.
Wie sollte ich FAMVIR 500 mg aufbewahren?
Bewahren Sie FAMVIR und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zu FAMVIR
Arzneimittel werden manchmal für andere als die in den Packungsbeilagen aufgeführten Zwecke verschrieben. Verwenden Sie FAMVIR nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie FAMVIR 500 mg nicht an andere Personen, selbst wenn sie die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Diese Packungsbeilage fasst die wichtigsten Informationen zu FAMVIR zusammen. Wenn Sie weitere Informationen wünschen, wenden Sie sich an Ihren Arzt. Ihr Gesundheitsdienstleister oder Apotheker kann Ihnen Informationen über FAMVIR 500 mg geben, die für Angehörige der Gesundheitsberufe bestimmt sind. Weitere Informationen erhalten Sie unter www.FAMVIR.com oder telefonisch unter 1-888-669-6682.
Welche Inhaltsstoffe enthält FAMVIR?
Wirkstoff: Famciclovir
Inaktive Zutaten: Hydroxypropylcellulose, Hydroxypropylmethylcellulose, Lactose, Magnesiumstearat, Polyethylenglykole, Natriumstärkeglykolat und Titandioxid