Behandlung der Frauenkrankheiten: Clomid 100mg, 25mg, 50mg Clomiphene Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Clomid 50 mg und wie wird es angewendet?
Clomid 100 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome der Unfruchtbarkeit bei Frauen mit ovulatorischer Insuffizienz. Clomid kann allein oder mit anderen Medikamenten verwendet werden.
Clomid gehört zu einer Klasse von Medikamenten, die als selektive Östrogenrezeptor-Modulatoren bezeichnet werden.
Es ist nicht bekannt, ob Clomid bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Clomifen haben?
Clomid kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Clomid sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Clomid. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
CLOMID (Clomifencitrat-Tabletten USP) ist ein oral verabreichtes, nichtsteroidales Ovulationsstimulans, das chemisch als 2-[p-(2-Chlor-1,2-diphenylvinyl)phenoxy]triethylamincitrat (1:1) bezeichnet wird. Es hat die Summenformel C26H28ClNO • C6H8O7 und ein Molekulargewicht von 598,09. Es wird strukturell dargestellt als:
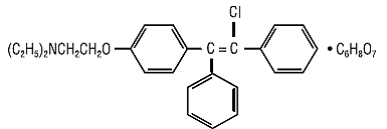
Clomifencitrat ist ein weißes bis blassgelbes, im Wesentlichen geruchloses, kristallines Pulver. Es ist in Methanol frei löslich; löslich in Ethanol; leicht löslich in Aceton, Wasser und Chloroform; und unlöslich in Ether.
CLOMID 50 mg ist eine Mischung aus zwei geometrischen Isomeren [cis (Zuclomiphen) und trans (Enclomiphen)], die zwischen 30 % und 50 % des cis-Isomers enthalten.
Jede weiße Tablette mit Bruchkerbe enthält 50 mg Clomifencitrat USP. Die Tablette enthält außerdem die folgenden Hilfsstoffe: Maisstärke, Lactose, Magnesiumstearat, vorverkleisterte Maisstärke und Saccharose.
INDIKATIONEN
CLOMID 100 mg ist angezeigt zur Behandlung von ovulatorischer Dysfunktion bei Frauen, die eine Schwangerschaft wünschen. Hindernisse für das Erreichen einer Schwangerschaft müssen ausgeschlossen oder angemessen behandelt werden, bevor mit der Behandlung mit CLOMID 50 mg begonnen wird. Zu den Patienten, die am ehesten Erfolge mit einer Clomifen-Therapie erzielen, gehören Patienten mit polyzystischem Ovarialsyndrom (vgl WARNUNGEN : Ovarielles Überstimulationssyndrom ), Amenorrhö-Galaktorrhö-Syndrom, psychogene Amenorrhö, postorale Kontrazeptiva-Amenorrhö und bestimmte Fälle von sekundärer Amenorrhö unbestimmter Ätiologie.
Der richtige Zeitpunkt des Koitus in Bezug auf den Eisprung ist wichtig. Eine Grafik der Basaltemperatur oder andere geeignete Tests können der Patientin und ihrem Arzt helfen festzustellen, ob ein Eisprung stattgefunden hat. Sobald der Eisprung eingetreten ist, sollte jede Behandlung mit CLOMID 100 mg am oder um den 5. Tag des Zyklus begonnen werden. Eine langfristige zyklische Therapie über insgesamt etwa sechs Zyklen (einschließlich drei Ovulationszyklen) hinaus wird nicht empfohlen. (Sehen DOSIERUNG UND ANWENDUNG und VORSICHTSMASSNAHMEN .)
CLOMID ist nur bei Patientinnen mit nachgewiesener ovulatorischer Dysfunktion indiziert, die die unten beschriebenen Bedingungen erfüllen:
Darüber hinaus sollten Patienten, die für eine CLOMID-Therapie ausgewählt wurden, in Bezug auf Folgendes bewertet werden:
Es gibt keine angemessenen oder gut kontrollierten Studien, die die Wirksamkeit von CLOMID 100 mg bei der Behandlung männlicher Unfruchtbarkeit belegen. Darüber hinaus wurde bei Männern, die Clomifen einnahmen, über Hodentumoren und Gynäkomastie berichtet. Die Ursache-Wirkungs-Beziehung zwischen Berichten über Hodentumoren und der Verabreichung von CLOMID 25 mg ist nicht bekannt.
Obwohl die medizinische Literatur verschiedene Methoden vorschlägt, gibt es kein allgemein akzeptiertes Standardschema für eine Kombinationstherapie (dh CLOMID in Verbindung mit anderen ovulationsinduzierenden Arzneimitteln). Ebenso gibt es kein Standard-CLOMID-Regime zur Ovulationsinduktion in In-vitro-Fertilisationsprogrammen, um Eizellen für die Befruchtung und Wiedereinführung zu produzieren. Daher wird CLOMID 50 mg für diese Anwendungen nicht empfohlen.
DOSIERUNG UND ANWENDUNG
allgemeine Überlegungen
Die Abklärung und Behandlung von Kandidaten für eine Therapie mit CLOMID 100 mg sollte von Ärzten überwacht werden, die Erfahrung in der Behandlung von gynäkologischen oder endokrinen Erkrankungen haben. Patienten sollten nur nach sorgfältiger diagnostischer Abklärung für eine Therapie mit CLOMID 50 mg ausgewählt werden (vgl INDIKATIONEN ). Der Therapieplan sollte im Voraus skizziert werden. Hindernisse für das Erreichen des Therapieziels müssen vor Beginn der Behandlung mit CLOMID ausgeschlossen oder adäquat behandelt werden. Das therapeutische Ziel sollte mit möglichen Risiken abgewogen und mit der Patientin und anderen am Erreichen einer Schwangerschaft Beteiligten besprochen werden.
Der Eisprung tritt am häufigsten 5 bis 10 Tage nach einer Behandlung mit CLOMID auf. Der Koitus sollte zeitlich auf den erwarteten Zeitpunkt des Eisprungs abgestimmt werden. Geeignete Tests zur Bestimmung des Eisprungs können während dieser Zeit hilfreich sein.
Empfohlene Dosierung
Die Behandlung des ausgewählten Patienten sollte mit einer niedrigen Dosis von 50 mg täglich (1 Tablette) für 5 Tage beginnen. Die Dosis sollte nur bei jenen Patientinnen erhöht werden, die als Reaktion auf die zyklische Gabe von 50 mg CLOMID keinen Eisprung haben. Eine niedrige Dosierung oder Behandlungsdauer wird besonders empfohlen, wenn eine ungewöhnliche Empfindlichkeit gegenüber hypophysärem Gonadotropin vermutet wird, wie z. B. bei Patienten mit polyzystischem Ovarsyndrom (siehe WARNUNGEN ; Ovarielles Überstimulationssyndrom ).
Zwischen jedem Behandlungszyklus sollte die Patientin sorgfältig untersucht werden, um eine Schwangerschaft, eine Ovarialvergrößerung oder die Bildung einer Ovarialzyste auszuschließen.
Wenn eine Gestagen-induzierte Blutung geplant ist oder wenn vor der Therapie eine spontane Uterusblutung auftritt, sollte das Regime von 50 mg täglich für 5 Tage am oder um den 5. Tag des Zyklus begonnen werden. Die Therapie kann jederzeit bei Patientinnen begonnen werden, die keine kürzlichen Uterusblutungen hatten. Wenn es bei dieser Dosierung zu einem Eisprung kommt, bringt es keinen Vorteil, die Dosis in nachfolgenden Behandlungszyklen zu erhöhen.
Wenn nach dem ersten Therapiezyklus kein Eisprung eingetreten zu sein scheint, sollte ein zweiter Zyklus mit 100 mg täglich (zwei 50-mg-Tabletten als tägliche Einzeldosis) über 5 Tage gegeben werden. Dieser Kurs kann frühestens 30 Tage nach dem vorherigen begonnen werden, nachdem Vorkehrungen zum Ausschluss einer Schwangerschaft getroffen wurden. Es wird nicht empfohlen, die Dosis oder die Therapiedauer über 100 mg/Tag für 5 Tage hinaus zu erhöhen.
Die Mehrheit der Patientinnen, die kurz vor dem Eisprung stehen, wird dies nach dem ersten Therapiezyklus tun. Wenn nach drei Behandlungszyklen kein Eisprung eintritt, wird eine weitere Behandlung mit CLOMID 50 mg nicht empfohlen und die Patientin sollte erneut untersucht werden. Wenn drei ovulatorische Reaktionen auftreten, aber keine Schwangerschaft erreicht wurde, wird eine weitere Behandlung nicht empfohlen. Wenn die Menstruation nach einer ovulatorischen Reaktion ausbleibt, sollte die Patientin erneut untersucht werden. Eine langfristige zyklische Therapie über insgesamt etwa sechs Zyklen hinaus wird nicht empfohlen (vgl VORSICHTSMASSNAHMEN ).
WIE GELIEFERT
NDC 0068-0226-30: 50-mg-Tabletten in Kartons mit 30 Tabletten sind rund, weiß, mit Bruchrille und Prägung CLOMID 50. Tabletten bei kontrollierter Raumtemperatur von 15-30 °C (59-86 °F) lagern. Vor Hitze, Licht und übermäßiger Feuchtigkeit schützen und in geschlossenen Behältern lagern.
Hergestellt von: A SANOFI COMPANY, sanofi-aventis US LLC, Bridgewater, NJ 08807. Überarbeitet: Juli 2017
NEBENWIRKUNGEN
Unerwünschte Ereignisse in klinischen Studien.
CLOMID wird in den empfohlenen Dosierungen im Allgemeinen gut vertragen. Die Nebenwirkungen waren in der Regel leicht und vorübergehend und die meisten verschwanden sofort nach Absetzen der Behandlung. Unerwünschte Erfahrungen, die bei Patienten berichtet wurden, die während klinischer Studien mit Clomifencitrat behandelt wurden, sind in Tabelle 2 aufgeführt.
Die folgenden unerwünschten Ereignisse wurden bei weniger als 1 % der Patienten in klinischen Studien berichtet: Akuter Bauch, gesteigerter Appetit, Verstopfung, Dermatitis oder Hautausschlag, Depression, Durchfall, Schwindel, Müdigkeit, Haarausfall/trockenes Haar, erhöhte Häufigkeit/Menge beim Wasserlassen, Schlaflosigkeit, Benommenheit, Nervosität, Scheidentrockenheit, Schwindel, Gewichtszunahme/-abnahme.
Patienten, die eine Langzeittherapie mit 25 mg CLOMID erhalten, können erhöhte Serumspiegel von Desmosterol aufweisen. Dies ist höchstwahrscheinlich auf eine direkte Beeinflussung der Cholesterinsynthese zurückzuführen. Die Serumsterole bei Patienten, die die empfohlene Dosis von 50 mg CLOMID erhalten, sind jedoch nicht signifikant verändert. Eierstockkrebs wurde selten bei Patientinnen berichtet, die Medikamente gegen Fruchtbarkeit erhalten hatten. Unfruchtbarkeit ist ein primärer Risikofaktor für Eierstockkrebs; epidemiologische Daten deuten jedoch darauf hin, dass eine längere Anwendung von Clomifen das Risiko eines grenzwertigen oder invasiven Ovarialtumors erhöhen kann.
Unerwünschte Ereignisse nach dem Marketing
Die folgenden Nebenwirkungen wurden während der Anwendung von Clomid nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Körper als Ganzes: Fieber, Tinnitus, Schwäche
Herz-Kreislauf: Arrhythmie, Brustschmerzen, Ödeme, Bluthochdruck, Herzklopfen, Phlebitis, Lungenembolie, Kurzatmigkeit, Tachykardie, Thrombophlebitis
Zentrales Nervensystem: Migräne, Parästhesien, Krampfanfälle, Schlaganfall, Synkope
Dermatologisch: Akne, allergische Reaktion, Erythem, Erythema multiforme, Erythema nodosum, Hypertrichose, Juckreiz, Urtikaria
Fetale/neonatale Anomalien:
Magen-Darm: Pankreatitis
Urogenital: Endometriose, Ovarialzyste (Ovarialvergrößerung oder -zysten könnten als solche durch eine Torsion der Adnexe kompliziert werden), Ovarialblutung, Eileiterschwangerschaft, Uterusblutung, verringerte Dicke des Endometriums
Leber: Transaminasen erhöht, Hepatitis
Stoffwechselstörungen: Hypertriglyzeridämie, in einigen Fällen mit Pankreatitis
Bewegungsapparat: Arthralgie, Rückenschmerzen, Myalgie
Neubildungen: Leber (hepatisches Hämangiosarkom, Leberzelladenom, hepatozelluläres Karzinom); Brust (fibrozystische Erkrankung, Brustkarzinom); Endometrium (Endometriumkarzinom); Nervensystem (Astrozytom, Hypophysentumor, Prolaktinom, Neurofibromatose, Glioblastoma multiforme, Gehirnabzess); Eierstock (Schwangerschaftsluteom, Dermoidzyste des Eierstocks, Eierstockkrebs); trophoblastisch (Blasenmole, Chorionkarzinom); Sonstiges (Melanom, Myelom, perianale Zysten, Nierenzellkarzinom, Hodgkin-Lymphom, Zungenkarzinom, Blasenkarzinom)
Psychiatrie: Angst, Reizbarkeit, Stimmungsschwankungen, Psychose
Sehstörungen: Abnorme Akkommodation, Katarakt, Augenschmerzen, Makulaödem, Optikusneuritis, Photopsie, hintere Glaskörperablösung, Netzhautblutung, Netzhautthrombose, Netzhautgefäßspasmus, vorübergehender oder anhaltender Verlust des Sehvermögens, möglicherweise irreversibel.
Sonstiges: Leukozytose, Schilddrüsenerkrankung
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Arzneimittelwechselwirkungen mit CLOMID wurden nicht dokumentiert.
Drogenmissbrauch und -abhängigkeit
Toleranz, Missbrauch oder Abhängigkeit von CLOMID wurde nicht gemeldet.
WARNUNGEN
Visuelle Symptome
Die Patienten sollten darauf hingewiesen werden, dass während der Therapie mit CLOMID gelegentlich verschwommenes Sehen oder andere visuelle Symptome wie Flecken oder Blitze (flimmernde Skotome) auftreten können. Diese visuellen Symptome nehmen mit zunehmender Gesamtdosis oder Behandlungsdauer zu. Diese Sehstörungen sind normalerweise reversibel; Es wurden jedoch Fälle von anhaltenden Sehstörungen berichtet, von denen einige nach Absetzen von Clomid 50 mg auftraten. Die Sehstörungen können irreversibel sein, insbesondere bei erhöhter Dosierung oder Therapiedauer. Die Patienten sollten gewarnt werden, dass diese visuellen Symptome Aktivitäten wie Autofahren oder Bedienen von Maschinen gefährlicher als gewöhnlich machen können, insbesondere bei wechselnden Lichtverhältnissen.
Diese visuellen Symptome scheinen auf eine Intensivierung und Verlängerung von Nachbildern zurückzuführen zu sein. Die Symptome treten oft zuerst auf oder werden verstärkt, wenn sie einer hell erleuchteten Umgebung ausgesetzt werden. Während die gemessene Sehschärfe normalerweise nicht beeinträchtigt wurde, entwickelte ein Studienpatient, der täglich 200 mg CLOMID einnahm, am 7. Behandlungstag eine Sehschwäche, die sich bis zum 10. Tag zu einer starken Verschlechterung der Sehschärfe entwickelte. Es wurden keine weiteren Anomalien festgestellt, und die Sehschärfe kehrte am 3. Tag nach Beendigung der Behandlung auf den Normalwert zurück.
Ophthalmologisch definierbare Skotome und Veränderungen der Netzhautzellfunktion (elektroretinographisch) wurden ebenfalls berichtet. Ein Patient, der während klinischer Studien behandelt wurde, entwickelte während einer längeren Verabreichung von CLOMID 50 mg Phosphene und Skotome, die am 32. Tag nach Beendigung der Therapie verschwanden.
Die Überwachung von unerwünschten Ereignissen nach der Markteinführung hat auch andere visuelle Anzeichen und Symptome während der CLOMID-Therapie ergeben (siehe NEBENWIRKUNGEN ).
Obwohl die Ätiologie dieser visuellen Symptome noch nicht geklärt ist, sollten Patienten mit visuellen Symptomen die Behandlung abbrechen und umgehend eine vollständige augenärztliche Untersuchung durchführen lassen.
Ovarielles Überstimulationssyndrom
Es wurde über das Auftreten des ovariellen Hyperstimulationssyndroms (OHSS) bei Patientinnen berichtet, die eine Clomifencitrat-Therapie zur Ovulationsinduktion erhielten. OHSS kann schnell fortschreiten (innerhalb von 24 Stunden bis zu mehreren Tagen) und zu einer ernsthaften medizinischen Störung werden. In einigen Fällen trat OHSS nach zyklischer Anwendung von Clomifencitrat auf oder wenn Clomifencitrat in Kombination mit Gonadotropinen angewendet wurde. Vorübergehende Anomalien der Leberfunktionstests, die auf eine Leberfunktionsstörung hindeuten, die von morphologischen Veränderungen bei der Leberbiopsie begleitet sein können, wurden im Zusammenhang mit OHSS berichtet.
OHSS ist ein medizinisches Ereignis, das sich von einer unkomplizierten Ovarialvergrößerung unterscheidet. Die klinischen Anzeichen dieses Syndroms können in schweren Fällen eine starke Ovarialvergrößerung, gastrointestinale Symptome, Aszites, Dyspnoe, Oligurie und Pleuraerguss umfassen. Darüber hinaus wurden die folgenden Symptome im Zusammenhang mit diesem Syndrom berichtet: Perikarderguss, Anasarka, Hydrothorax, akutes Abdomen, Hypotonie, Nierenversagen, Lungenödem, intraperitoneale und ovarielle Blutungen, tiefe Venenthrombose, Torsion der Eierstöcke und akute Atemwegserkrankungen Not. Die Frühwarnzeichen von OHSS sind Bauchschmerzen und Blähungen, Übelkeit, Erbrechen, Durchfall und Gewichtszunahme. Erhöhte Steroidspiegel im Urin, Elektrolytstörungen unterschiedlichen Ausmaßes, Hypovolämie, Hämokonzentration und Hypoproteinämie können auftreten. Tod aufgrund von hypovolämischem Schock, Hämokonzentration oder Thromboembolie ist aufgetreten. Aufgrund der Zerbrechlichkeit vergrößerter Eierstöcke in schweren Fällen sollte die Untersuchung des Abdomens und des Beckens sehr vorsichtig durchgeführt werden. Wenn es zu einer Empfängnis kommt, kann es zu einer raschen Progression zur schweren Form des Syndroms kommen.
Um das Risiko einer gelegentlichen abnormalen Vergrößerung der Eierstöcke im Zusammenhang mit der Therapie mit CLOMID 100 mg zu minimieren, sollte die niedrigste Dosis verwendet werden, die mit den erwarteten klinischen Ergebnissen vereinbar ist. Die maximale Vergrößerung der Eierstöcke, ob physiologisch oder anormal, kann erst mehrere Tage nach Absetzen der empfohlenen Dosis von CLOMID auftreten. Einige Patienten mit polyzystischem Ovarialsyndrom, die ungewöhnlich empfindlich auf Gonadotropin reagieren, können auf übliche Dosen von CLOMID übertrieben ansprechen. Daher sollten Patientinnen mit polyzystischem Ovarialsyndrom im ersten Behandlungszyklus mit der niedrigsten empfohlenen Dosis und kürzesten Behandlungsdauer begonnen werden (siehe DOSIERUNG UND ANWENDUNG ).
Wenn eine Vergrößerung der Eierstöcke auftritt, sollte keine zusätzliche CLOMID-Therapie gegeben werden, bis die Eierstöcke wieder auf die Größe vor der Behandlung zurückgekehrt sind, und die Dosierung oder Dauer des nächsten Behandlungszyklus sollte reduziert werden. Die Vergrößerung der Eierstöcke und die Bildung von Zysten im Zusammenhang mit einer Therapie mit 50 mg Clomid bilden sich in der Regel spontan innerhalb weniger Tage oder Wochen nach Absetzen der Behandlung zurück. Der potenzielle Nutzen einer anschließenden Therapie mit 25 mg CLOMID sollte in diesen Fällen das Risiko übersteigen. Sofern keine chirurgische Indikation zur Laparotomie besteht, sollte eine solche zystische Vergrößerung immer konservativ behandelt werden.
Ein kausaler Zusammenhang zwischen ovarieller Hyperstimulation und Eierstockkrebs wurde nicht festgestellt. Da jedoch eine Korrelation zwischen Eierstockkrebs und Nulliparität, Unfruchtbarkeit und Alter vermutet wurde, sollte eine gründliche Untersuchung durchgeführt werden, wenn sich Ovarialzysten nicht spontan zurückbilden, um das Vorhandensein einer Ovarialneoplasie auszuschließen.
VORSICHTSMASSNAHMEN
Allgemein
Der Auswahl von Kandidaten für eine CLOMID-Therapie sollte besondere Aufmerksamkeit geschenkt werden. Eine gynäkologische Untersuchung ist vor der Behandlung mit CLOMID und vor jeder weiteren Behandlung erforderlich (siehe KONTRAINDIKATIONEN und WARNUNGEN ).
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es wurden keine Langzeittoxizitätsstudien an Tieren durchgeführt, um das karzinogene oder mutagene Potenzial von Clomifencitrat zu bewerten.
Die orale Verabreichung von 25 mg CLOMID an männliche Ratten in Dosen von 0,3 oder 1 mg/kg/Tag verursachte eine verringerte Fertilität, während höhere Dosen vorübergehende Unfruchtbarkeit verursachten. Orale Dosen von 0,1 mg/kg/Tag bei weiblichen Ratten unterbrachen vorübergehend das normale zyklische Vaginalabstrichmuster und verhinderten eine Empfängnis. Dosen von 0,3 mg/kg/Tag verringerten leicht die Anzahl ovulierter Eizellen und Gelbkörper, während 3 mg/kg/Tag die Ovulation hemmten.
Schwangerschaft
Zusammenfassung des fetalen Risikos
Die Anwendung von CLOMID 100 mg bei schwangeren Frauen ist kontraindiziert, da die Behandlung mit CLOMID 25 mg bei dieser Patientengruppe keinen Nutzen bringt.
Die verfügbaren Humandaten weisen nicht auf ein erhöhtes Risiko für angeborene Anomalien hin, das über das Bevölkerungsgrundrisiko hinausgeht. Reproduktionstoxikologische Tierstudien zeigten jedoch einen erhöhten embryofötalen Verlust und strukturelle Missbildungen bei den Nachkommen. Wenn dieses Arzneimittel während der Schwangerschaft angewendet wird oder wenn die Patientin während der Einnahme dieses Arzneimittels schwanger wird, sollte die Patientin über die potenziellen Risiken für den Fötus informiert werden.
Klinische Überlegungen
Um eine versehentliche Verabreichung von CLOMID 25 mg während der Frühschwangerschaft zu vermeiden, sollten während jedes Behandlungszyklus geeignete Tests durchgeführt werden, um festzustellen, ob ein Eisprung und/oder eine Schwangerschaft eintritt. Die Patientinnen sollten zwischen jedem Behandlungszyklus sorgfältig untersucht werden, um eine Ovarialvergrößerung oder Ovarialzystenbildung auszuschließen. Der nächste Behandlungszyklus mit CLOMID sollte verschoben werden, bis diese Erkrankungen ausgeschlossen sind.
Menschliche Daten
Die verfügbaren Humandaten aus epidemiologischen Studien zeigen keine offensichtliche Ursache-Wirkungs-Beziehung zwischen der perikonzeptionellen Clomifencitrat-Exposition und einem erhöhten Risiko für Geburtsfehler insgesamt oder einer spezifischen Anomalie. Aufgrund der geringen Anzahl von Fällen angeborener Anomalien, die bei mit Clomifencitrat behandelten Frauen auftraten, konnten diese epidemiologischen Studien jedoch nur große Risikounterschiede ausschließen. Die Studien berücksichtigten keine Faktoren im Zusammenhang mit weiblicher Subfertilität und konnten andere wichtige Confounder nicht berücksichtigen. Darüber hinaus unterstützen die verfügbaren Daten keine erhöhte Rate spontaner Fehlgeburten bei subfertilen Frauen, die mit Clomifencitrat zur Ovulationsinduktion behandelt wurden.
Tierische Daten
Die orale Verabreichung von Clomifencitrat an trächtige Ratten während der Organogenese in Dosen von 1 bis 2 mg/kg/Tag führte zu Hydramnion und schwachen, ödematösen Föten mit gewellten Rippen und anderen vorübergehenden Knochenveränderungen. Dosen von 8 mg/kg/Tag oder mehr verursachten auch erhöhte Resorptionen und tote Föten, Dystokie und verzögerte Geburt, und 40 mg/kg/Tag führten zu erhöhter Müttersterblichkeit. Einzeldosen von 50 mg/kg verursachten fetale Katarakte, während 200 mg/kg Gaumenspalten verursachten. Nach Injektion von Clomifencitrat 2 mg/kg an Mäuse und Ratten während der Trächtigkeit zeigten die Nachkommen metaplastische Veränderungen des Reproduktionstraktes. Neugeborene Mäuse und Ratten, denen in den ersten Lebenstagen eine Injektion verabreicht wurde, entwickelten auch metaplastische Veränderungen der Uterus- und Vaginalschleimhaut sowie eine vorzeitige Vaginalöffnung und anovulatorische Ovarien. Diese Befunde ähneln dem abnormalen Fortpflanzungsverhalten und der Sterilität, die bei anderen Östrogenen und Antiöstrogenen beschrieben wurden.
Bei Kaninchen wurden einige vorübergehende Knochenveränderungen bei Föten von Muttertieren beobachtet, die während der Trächtigkeit orale Dosen von 20 oder 40 mg/kg/Tag erhielten, jedoch nicht nach 8 mg/kg/Tag. In diesen Studien wurden keine bleibenden Fehlbildungen beobachtet. Auch Rhesusaffen, denen orale Dosen von 1,5 bis 4,5 mg/kg/Tag für verschiedene Zeiträume während der Trächtigkeit verabreicht wurden, hatten keine anormalen Nachkommen.
Stillende Mutter
Es ist nicht bekannt, ob CLOMID in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch ausgeschieden werden, ist Vorsicht geboten, wenn CLOMID einer stillenden Frau verabreicht wird. Bei manchen Patienten kann CLOMID die Laktation verringern.
Eierstockkrebs
Eine längere Anwendung von Clomifencitrat-Tabletten USP kann das Risiko eines grenzwertigen oder invasiven Ovarialtumors erhöhen (siehe NEBENWIRKUNGEN ).
ÜBERDOSIS
Anzeichen und Symptome
Toxische Wirkungen im Zusammenhang mit einer akuten Überdosierung von CLOMID 50 mg wurden nicht berichtet. Anzeichen und Symptome einer Überdosierung als Folge der Anwendung von mehr als der empfohlenen Dosis während der Therapie mit CLOMID 100 mg sind Übelkeit, Erbrechen, vasomotorische Hitzewallungen, verschwommenes Sehen, Flecken oder Blitze, Skotome, Vergrößerung der Eierstöcke mit Becken- oder Bauchschmerzen. (Sehen KONTRAINDIKATIONEN : Eierstockzyste .)
Orale LD50
Die akute orale LD50 von CLOMID 25 mg beträgt 1700 mg/kg bei Mäusen und 5750 mg/kg bei Ratten. Die toxische Dosis beim Menschen ist nicht bekannt.
Dialyse
Es ist nicht bekannt, ob CLOMID dialysierbar ist.
Behandlung
Im Falle einer Überdosierung sollten zusätzlich zur gastrointestinalen Dekontamination geeignete unterstützende Maßnahmen ergriffen werden.
KONTRAINDIKATIONEN
Überempfindlichkeit
CLOMID 100 mg ist bei Patienten mit bekannter Überempfindlichkeit oder Allergie gegen Clomifencitrat oder einen seiner Inhaltsstoffe kontraindiziert.
Schwangerschaft
Die Anwendung von CLOMID bei schwangeren Frauen ist kontraindiziert, da CLOMID bei dieser Patientengruppe keinen Nutzen bringt.
Verfügbare Humandaten weisen bei bestimmungsgemäßer Anwendung nicht auf ein erhöhtes Risiko für angeborene Anomalien hin, das über das Bevölkerungsgrundrisiko hinausgeht. Reproduktionstoxikologische Tierstudien zeigten jedoch einen erhöhten embryofötalen Verlust und strukturelle Missbildungen bei den Nachkommen. Wenn dieses Arzneimittel während der Schwangerschaft angewendet wird oder wenn die Patientin während der Einnahme dieses Arzneimittels schwanger wird, sollte die Patientin über die potenziellen Risiken für den Fötus informiert werden. (Sehen VORSICHTSMASSNAHMEN : Schwangerschaft .)
Leber erkrankung
Die Therapie mit CLOMID 25 mg ist kontraindiziert bei Patienten mit Lebererkrankungen oder Leberfunktionsstörungen in der Vorgeschichte (siehe auch INDIKATIONEN und NEBENWIRKUNGEN ).
Abnorme Uterusblutung
CLOMID 25 mg ist kontraindiziert bei Patientinnen mit anormalen Uterusblutungen unklarer Ursache (siehe INDIKATIONEN ).
Eierstockzysten
CLOMID ist kontraindiziert bei Patientinnen mit Ovarialzysten oder -vergrößerung, die nicht auf ein polyzystisches Ovarialsyndrom zurückzuführen sind (siehe INDIKATIONEN und WARNUNGEN ).
Sonstiges
CLOMID ist kontraindiziert bei Patienten mit unkontrollierter Schilddrüsen- oder Nebennierenfunktionsstörung oder bei Vorliegen einer organischen intrakraniellen Läsion wie einem Hypophysentumor (siehe INDIKATIONEN ).
KLINISCHE PHARMAKOLOGIE
Aktion
CLOMID 25 mg ist ein Medikament von beträchtlicher pharmakologischer Wirksamkeit. Bei sorgfältiger Auswahl und ordnungsgemäßer Behandlung der Patientin hat sich CLOMID 100 mg als nützliche Therapie für anovulatorische Patientinnen mit Schwangerschaftswunsch erwiesen.
Clomifencitrat ist in der Lage, mit Geweben, die Östrogenrezeptoren enthalten, zu interagieren, einschließlich Hypothalamus, Hypophyse, Eierstock, Endometrium, Vagina und Gebärmutterhals. Es kann mit Östrogen um Östrogenrezeptor-Bindungsstellen konkurrieren und die Auffüllung intrazellulärer Östrogenrezeptoren verzögern. Clomifencitrat löst eine Reihe endokriner Ereignisse aus, die in einem präovulatorischen Gonadotropinanstieg und anschließendem Follikelbruch gipfeln. Das erste endokrine Ereignis als Reaktion auf eine Clomifen-Therapie ist eine Erhöhung der Freisetzung von Hypophysen-Gonadotropinen. Dies initiiert die Steroidogenese und Follikulogenese, was zum Wachstum des Ovarialfollikels und zu einem Anstieg des zirkulierenden Östradiolspiegels führt. Nach dem Eisprung steigen und fallen Plasmaprogesteron und Östradiol wie in einem normalen Ovulationszyklus.
Die verfügbaren Daten deuten darauf hin, dass sowohl die östrogenen als auch die antiöstrogenen Eigenschaften von Clomifen an der Auslösung des Eisprungs beteiligt sein können. Es wurde festgestellt, dass die beiden Clomiphen-Isomere gemischte östrogene und antiöstrogene Wirkungen haben, die von einer Spezies zur anderen variieren können. Einige Daten deuten darauf hin, dass Zuclomiphen eine größere östrogene Aktivität aufweist als Enclomiphen.
Clomifencitrat hat keine offensichtlichen gestagenen, androgenen oder antiandrogenen Wirkungen und scheint die Hypophysen-Nebennieren- oder Hypophysen-Schilddrüsen-Funktion nicht zu beeinträchtigen. Obwohl es keine Hinweise auf einen „Carryover-Effekt“ von CLOMID gibt, wurden bei einigen Patientinnen nach der Therapie mit 100 mg CLOMID spontane ovulatorische Menstruationen festgestellt.
Pharmakokinetik
Basierend auf frühen Studien mit 14C-markiertem Clomifencitrat wurde gezeigt, dass das Medikament beim Menschen leicht oral absorbiert und hauptsächlich mit dem Kot ausgeschieden wird. Die kumulative Urin- und Stuhlausscheidung des 14C betrug nach 5 Tagen im Durchschnitt etwa 50 % der oralen Dosis und 37 % einer intravenösen Dosis. Die mittlere Urinausscheidung betrug etwa 8 %, die fäkale Ausscheidung etwa 42 %.
Etwas 14C-Markierung war 6 Wochen nach der Verabreichung noch im Kot vorhanden. Nachfolgende Einzeldosisstudien an normalen Freiwilligen zeigten, dass Zuclomiphen (cis) eine längere Halbwertszeit als Enclomiphen (trans) hat. Nachweisbare Konzentrationen von Zuclomiphen hielten bei diesen Probanden länger als einen Monat an. Dies kann auf ein stereospezifisches enterohepatisches Recycling oder eine Sequestrierung des Zuclomiphens hindeuten. Daher ist es möglich, dass bei Frauen, die während der CLOMID-Therapie im Menstruationszyklus schwanger werden, während der frühen Schwangerschaft einige Wirkstoffe im Körper verbleiben.
Klinische Studien
Während klinischer Studien erhielten 7578 Patientinnen CLOMID, von denen einige andere Ovulationshindernisse als ovulatorische Dysfunktion aufwiesen (vgl INDIKATIONEN ). In diesen klinischen Studien trat bei etwa 30 % dieser Patientinnen eine erfolgreiche Therapie auf, die durch eine Schwangerschaft gekennzeichnet war.
Während des klinischen Studienzeitraums wurden insgesamt 2635 Schwangerschaften gemeldet. Von diesen Schwangerschaften waren nur für 2369 Fälle Informationen zum Ausgang verfügbar. Tabelle 1 fasst das Ergebnis dieser Fälle zusammen.
Von den gemeldeten Schwangerschaften betrug die Inzidenz von Mehrlingsschwangerschaften 7,98 %: 6,9 % Zwillings-, 0,5 % Drillings-, 0,3 % Vierlings- und 0,1 % Fünflingsschwangerschaften. Bei den 165 Zwillingsschwangerschaften, für die ausreichende Informationen vorlagen, lag das Verhältnis von eineiigen zu zweieiigen Zwillingen bei etwa 1:5. Tabelle 1 zeigt die Überlebensrate der lebenden Mehrlingsgeburten.
Nach Abschluss der ursprünglichen klinischen Studien wurde über eine Sechslingsgeburt berichtet; Keines der Sechslinge überlebte (jedes wog weniger als 400 g), obwohl jedes grob normal erschien.
Das Gesamtüberleben von Säuglingen aus Mehrlingsschwangerschaften einschließlich Spontanaborten, Totgeburten und Todesfällen bei Neugeborenen beträgt 73 %.
Fetale/neonatale Anomalien und Sterblichkeit
Die folgenden fötalen Anomalien wurden nach Schwangerschaften nach Ovulationsinduktionstherapie mit CLOMID während klinischer Studien berichtet. Jede der folgenden fötalen Anomalien wurde mit einer Rate von
Darüber hinaus sind während der Postmarketing-Überwachung von CLOMID Berichte über angeborene Anomalien eingegangen (siehe NEBENWIRKUNGEN ).
INFORMATIONEN ZUM PATIENTEN
Zweck und Risiken der CLOMID-Therapie sollten dem Patienten vor Behandlungsbeginn aufgezeigt werden. Es sollte betont werden, dass das Ziel der CLOMID-Therapie der Eisprung für eine spätere Schwangerschaft ist. Der Arzt sollte den Patienten unter besonderer Berücksichtigung der folgenden potenziellen Risiken beraten:
Visuelle Symptome
Weisen Sie darauf hin, dass während oder kurz nach der CLOMID-Therapie gelegentlich verschwommenes Sehen oder andere visuelle Symptome auftreten können. Dem Patienten sollte klar gemacht werden, dass Sehstörungen in manchen Fällen länger andauern und möglicherweise irreversibel sein können, insbesondere bei erhöhter Dosierung oder Therapiedauer. Warnen Sie davor, dass visuelle Symptome Aktivitäten wie das Autofahren oder das Bedienen von Maschinen gefährlicher als gewöhnlich machen können, insbesondere bei wechselnden Lichtverhältnissen (siehe WARNUNGEN ).
Der Patient sollte angewiesen werden, den Arzt zu informieren, wenn ungewöhnliche visuelle Symptome auftreten. Wenn der Patient irgendwelche visuellen Symptome hat, sollte die Behandlung abgebrochen und eine vollständige ophthalmologische Untersuchung durchgeführt werden.
Bauch-/Beckenschmerzen oder Dehnung
Während oder kurz nach der Therapie mit CLOMID kann es zu einer Vergrößerung der Eierstöcke kommen. Um die mit einer Ovarialvergrößerung verbundenen Risiken zu minimieren, sollte die Patientin angewiesen werden, den Arzt über Bauch- oder Beckenschmerzen, Gewichtszunahme, Beschwerden oder Aufblähung nach der Einnahme von CLOMID zu informieren (siehe WARNUNGEN ).
Multiple Schwangerschaft
Informieren Sie die Patientin darüber, dass im Zusammenhang mit der CLOMID-Therapie ein erhöhtes Risiko für eine Mehrlingsschwangerschaft besteht, einschließlich einer bilateralen Eileiterschwangerschaft und einer gleichzeitig bestehenden Eileiter- und intrauterinen Schwangerschaft, wenn eine Empfängnis eintritt. Die möglichen Komplikationen und Gefahren einer Mehrlingsschwangerschaft sollten erklärt werden.
Spontane Abtreibung und angeborene Anomalien
Informieren Sie die Patientin darüber, dass die verfügbaren Daten keinen Anstieg der Raten spontaner Aborte (Fehlgeburten) oder angeborener Anomalien bei Anwendung von mütterlichem Clomid 50 mg im Vergleich zu Raten in der Allgemeinbevölkerung nahelegen.
Während der klinischen Prüfung zeigt die Erfahrung von Patientinnen mit bekanntem Schwangerschaftsausgang (Tabelle 1) eine Spontanabortrate von 20,4 % und eine Totgeburtsrate von 1,0 %. (Sehen Klinische Studien ). Unter den Geburtsanomalien, die seit der kommerziellen Verfügbarkeit von Clomid spontan als Einzelfälle gemeldet wurden, war der Anteil von Neuralrohrdefekten bei Schwangerschaften im Zusammenhang mit einem durch Clomid induzierten Eisprung hoch, was jedoch nicht durch Daten aus bevölkerungsbezogenen Studien gestützt wurde.