Diflucan 50mg, 100mg, 150mg, 200mg Fluconazole Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Diflucan und wie wird es angewendet?
Diflucan ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Pilzinfektionen. Diflucan 50 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Diflucan 100 mg gehört zu einer Klasse von Medikamenten, die als Antimykotika bezeichnet werden.
Welche Nebenwirkungen hat Diflucan 150mg?
Diflucan 100 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Diflucan gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Diflucan. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
DIFLUCAN® (Fluconazol), das erste einer neuen Unterklasse synthetischer Triazol-Antimykotika, ist als Tabletten zur oralen Verabreichung oder als Pulver zur Herstellung einer Suspension zum Einnehmen erhältlich.
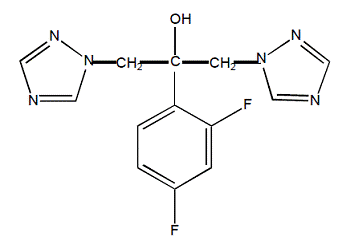
Fluconazol wird chemisch als 2,4-Difluor-α,α1-bis(1H-1,2,4-triazol-1-ylmethyl)benzylalkohol mit einer Summenformel von C13H12F2N6O und einem Molekulargewicht von 306,3 bezeichnet. Die Strukturformel lautet:
Fluconazol ist ein weißer kristalliner Feststoff, der in Wasser und Kochsalzlösung leicht löslich ist.
DIFLUCAN Tabletten enthalten 50, 100, 150 oder 200 mg Fluconazol und die folgenden inaktiven Bestandteile: mikrokristalline Zellulose, dibasisches Calciumphosphat wasserfrei, Povidon, Croscarmellose-Natrium, FD&C Red Nr. 40 Aluminiumfarbstoff und Magnesiumstearat.
DIFLUCAN zur oralen Suspension enthält 350 mg oder 1400 mg Fluconazol und die folgenden Hilfsstoffe: Saccharose, Natriumcitratdihydrat, wasserfreie Citronensäure, Natriumbenzoat, Titandioxid, kolloidales Siliciumdioxid, Xanthangummi und natürliches Orangenaroma. Nach der Rekonstitution mit 24 ml destilliertem Wasser oder gereinigtem Wasser (USP) enthält jeder ml der rekonstituierten Suspension 10 mg oder 40 mg Fluconazol.
INDIKATIONEN
DIFLUCAN (Fluconazol) ist angezeigt zur Behandlung von:
Prophylaxe
DIFLUCAN ist auch angezeigt, um das Auftreten von Candidiasis bei Patienten zu verringern, die sich einer Knochenmarktransplantation unterziehen und eine zytotoxische Chemotherapie und/oder Strahlentherapie erhalten.
Proben für Pilzkulturen und andere relevante Laboruntersuchungen (Serologie, Histopathologie) sollten vor der Therapie entnommen werden, um verursachende Organismen zu isolieren und zu identifizieren. Die Therapie kann eingeleitet werden, bevor die Ergebnisse der Kulturen und anderer Laboruntersuchungen bekannt sind; Sobald diese Ergebnisse vorliegen, sollte die antiinfektiöse Therapie jedoch entsprechend angepasst werden.
DOSIERUNG UND ANWENDUNG
Dosierung und Verabreichung bei Erwachsenen
Einzelne Dosis
Vaginale Candidose
Die empfohlene Dosierung von DIFLUCAN bei vaginaler Candidiasis beträgt 150 mg als orale Einzeldosis.
Mehrfache Dosis
DA DIE ORALE ABSORPTION SCHNELL UND FAST VOLLSTÄNDIG ERFOLGT, IST DIE TÄGLICHE DOSIS VON DIFLUCAN (FLUCONAZOL) FÜR DIE ORALE (TABLETTEN UND SUSPENSION) UND DIE INTRAVENÖSE VERABREICHUNG GLEICH. Im Allgemeinen wird am ersten Therapietag eine Aufsättigungsdosis in Höhe des Doppelten der Tagesdosis empfohlen, um am zweiten Therapietag Plasmakonzentrationen nahe dem Steady-State zu erreichen.
Die Tagesdosis von DIFLUCAN 100 mg zur Behandlung von anderen Infektionen als vaginaler Candidiasis sollte auf dem infizierenden Organismus und dem Ansprechen der Patientin auf die Therapie basieren. Die Behandlung sollte fortgesetzt werden, bis klinische Parameter oder Labortests anzeigen, dass die aktive Pilzinfektion abgeklungen ist. Eine unzureichende Behandlungsdauer kann zum Wiederauftreten einer aktiven Infektion führen. Patienten mit AIDS und Kryptokokken-Meningitis oder rezidivierender oropharyngealer Candidiasis benötigen normalerweise eine Erhaltungstherapie, um einen Rückfall zu verhindern.
Oropharyngeale Candidiasis
Die empfohlene Dosierung von DIFLUCAN bei oropharyngealer Candidiasis beträgt 200 mg am ersten Tag, gefolgt von 100 mg einmal täglich. Klinische Anzeichen einer oropharyngealen Candidiasis klingen im Allgemeinen innerhalb weniger Tage ab, aber die Behandlung sollte mindestens 2 Wochen fortgesetzt werden, um die Wahrscheinlichkeit eines Rückfalls zu verringern.
Ösophagus-Candidiasis
Die empfohlene Dosierung von DIFLUCAN 200 mg bei Ösophagus-Candidiasis beträgt 200 mg am ersten Tag, gefolgt von 100 mg einmal täglich. Je nach medizinischer Beurteilung des Ansprechens des Patienten auf die Therapie können Dosen von bis zu 400 mg/Tag verwendet werden. Patienten mit ösophagealer Candidiasis sollten mindestens drei Wochen und mindestens zwei Wochen nach Abklingen der Symptome behandelt werden.
Systemische Candida-Infektionen
Für systemische Candida-Infektionen, einschließlich Candidämie, disseminierter Candidiasis und Pneumonie, wurden die optimale therapeutische Dosierung und Therapiedauer nicht festgelegt. In offenen, nicht vergleichenden Studien mit einer kleinen Anzahl von Patienten wurden Dosen von bis zu 400 mg täglich verwendet.
Harnwegsinfektionen und Peritonitis
Zur Behandlung von Candida-Harnwegsinfektionen und Peritonitis wurden Tagesdosen von 50 bis 200 mg in offenen, nicht vergleichenden Studien an einer kleinen Anzahl von Patienten angewendet.
Kryptokokken-Meningitis
Die empfohlene Dosierung zur Behandlung einer akuten Kryptokokken-Meningitis beträgt 400 mg am ersten Tag, gefolgt von 200 mg einmal täglich. Basierend auf der medizinischen Beurteilung des Ansprechens des Patienten auf die Therapie kann eine Dosis von 400 mg einmal täglich angewendet werden. Die empfohlene Behandlungsdauer für die Initialtherapie der Kryptokokken-Meningitis beträgt 10 bis 12 Wochen, nachdem die Zerebrospinalflüssigkeit kulturnegativ geworden ist. Die empfohlene Dosierung von DIFLUCAN 150 mg zur Unterdrückung des Rückfalls einer Kryptokokken-Meningitis bei Patienten mit AIDS beträgt 200 mg einmal täglich.
Prophylaxe bei Patienten, die sich einer Knochenmarktransplantation unterziehen
Die empfohlene Tagesdosis von DIFLUCAN zur Vorbeugung von Candidiasis bei Patienten, die sich einer Knochenmarktransplantation unterziehen, beträgt 400 mg einmal täglich. Patienten, bei denen eine schwere Granulozytopenie (weniger als 500 neutrophile Zellen/mm³) zu erwarten ist, sollten mit der DIFLUCAN-Prophylaxe mehrere Tage vor dem erwarteten Einsetzen der Neutropenie beginnen und 7 Tage lang fortfahren, nachdem die Neutrophilenzahl auf über 1000 Zellen/mm³ angestiegen ist.
Dosierung und Verabreichung bei Kindern
Das folgende Dosisäquivalenzschema sollte im Allgemeinen eine äquivalente Exposition bei pädiatrischen und erwachsenen Patienten gewährleisten:
Die Erfahrungen mit DIFLUCAN bei Neugeborenen beschränken sich auf pharmakokinetische Studien bei Frühgeborenen. (Sehen KLINISCHE PHARMAKOLOGIE .) Aufgrund der verlängerten Halbwertszeit von Frühgeborenen (Gestationsalter 26 bis 29 Wochen) sollten diese Kinder in den ersten beiden Lebenswochen die gleiche Dosis (mg/kg) wie ältere Kinder erhalten, jedoch verabreicht werden alle 72 Stunden. Nach den ersten zwei Wochen sollten diese Kinder einmal täglich dosiert werden. Es liegen keine Informationen zur Pharmakokinetik von DIFLUCAN bei reifen Neugeborenen vor.
Oropharyngeale Candidiasis
Die empfohlene Dosierung von DIFLUCAN 150 mg bei oropharyngealer Candidiasis bei Kindern beträgt 6 mg/kg am ersten Tag, gefolgt von 3 mg/kg einmal täglich. Die Behandlung sollte mindestens 2 Wochen lang durchgeführt werden, um die Wahrscheinlichkeit eines Rückfalls zu verringern.
Ösophagus-Candidiasis
Zur Behandlung der ösophagealen Candidiasis beträgt die empfohlene Dosis von DIFLUCAN bei Kindern 6 mg/kg am ersten Tag, gefolgt von 3 mg/kg einmal täglich. Je nach medizinischer Beurteilung des Ansprechens des Patienten auf die Therapie können Dosen von bis zu 12 mg/kg/Tag verwendet werden. Patienten mit ösophagealer Candidiasis sollten für mindestens drei Wochen und für mindestens 2 Wochen nach Abklingen der Symptome behandelt werden.
Systemische Candida-Infektionen
Zur Behandlung von Candidämie und disseminierten Candida-Infektionen wurden in einer offenen, nicht vergleichenden Studie an einer kleinen Anzahl von Kindern Tagesdosen von 6 bis 12 mg/kg/Tag verwendet.
Kryptokokken-Meningitis
Für die Behandlung einer akuten Kryptokokken-Meningitis beträgt die empfohlene Dosierung 12 mg/kg am ersten Tag, gefolgt von 6 mg/kg einmal täglich. Basierend auf der medizinischen Beurteilung des Ansprechens des Patienten auf die Therapie kann eine Dosis von 12 mg/kg einmal täglich verwendet werden. Die empfohlene Behandlungsdauer für die Initialtherapie der Kryptokokken-Meningitis beträgt 10 bis 12 Wochen, nachdem die Zerebrospinalflüssigkeit kulturnegativ geworden ist. Zur Unterdrückung eines Rückfalls einer Kryptokokken-Meningitis bei Kindern mit AIDS beträgt die empfohlene Dosis von DIFLUCAN 6 mg/kg einmal täglich.
Dosierung bei Patienten mit eingeschränkter Nierenfunktion
Fluconazol wird hauptsächlich als unverändertes Arzneimittel renal ausgeschieden. Es besteht keine Notwendigkeit, die Einzeldosistherapie bei vaginaler Candidiasis aufgrund einer eingeschränkten Nierenfunktion anzupassen. Bei Patienten mit eingeschränkter Nierenfunktion, die mehrere Dosen DIFLUCAN erhalten, sollte eine Anfangsdosis von 50 mg bis 400 mg gegeben werden. Nach der Aufsättigungsdosis sollte sich die Tagesdosis (je nach Indikation) an der folgenden Tabelle orientieren:
Hämodialysepatienten sollten nach jeder Hämodialyse 100 % der empfohlenen Dosis erhalten; an dialysefreien Tagen sollten die Patienten entsprechend ihrer Kreatinin-Clearance eine reduzierte Dosis erhalten.
Dies sind vorgeschlagene Dosisanpassungen basierend auf der Pharmakokinetik nach Verabreichung mehrerer Dosen. Je nach klinischem Zustand kann eine weitere Anpassung erforderlich sein.
Wenn das Serum-Kreatinin das einzige verfügbare Maß für die Nierenfunktion ist, sollte die folgende Formel (basierend auf Geschlecht, Gewicht und Alter des Patienten) verwendet werden, um die Kreatinin-Clearance bei Erwachsenen abzuschätzen:
Männchen: Gewicht (kg) × (140 – Alter)/ 72 × Serumkreatinin (mg/100 ml)
Weibchen: 0,85 × über dem Wert
Obwohl die Pharmakokinetik von Fluconazol bei Kindern mit Niereninsuffizienz nicht untersucht wurde, sollte die Dosisreduktion bei Kindern mit Niereninsuffizienz der für Erwachsene empfohlenen entsprechen. Die folgende Formel kann verwendet werden, um die Kreatinin-Clearance bei Kindern abzuschätzen:
× lineare Länge oder Höhe (cm)/ Serumkreatinin (mg/100 ml)
(Wobei K = 0,55 für Kinder über 1 Jahr und 0,45 für Säuglinge.)
Verwaltung
DIFLUCAN 100 mg wird oral verabreicht. DIFLUCAN kann mit oder ohne Nahrung eingenommen werden.
Anleitung zum Mischen der Suspension zum Einnehmen
Bereiten Sie zum Zeitpunkt der Abgabe eine Suspension wie folgt vor: Klopfen Sie an die Flasche, bis das gesamte Pulver frei fließt. Zur Rekonstitution 24 ml destilliertes Wasser oder gereinigtes Wasser (USP) in die Fluconazol-Flasche geben und kräftig schütteln, um das Pulver zu suspendieren. Jede Flasche liefert 35 ml Suspension. Die Konzentrationen der rekonstituierten Suspensionen sind wie folgt:
Hinweis: Suspension zum Einnehmen vor Gebrauch gut schütteln. Die rekonstituierte Suspension zwischen 30 °C (86 °F) und 5 °C (41 °F) lagern und nicht verbrauchte Portionen nach 2 Wochen verwerfen. Vor Frost schützen.
WIE GELIEFERT
DIFLUCAN 100 mg Tabletten Rosa trapezförmige Tabletten mit 50, 100 oder 200 mg Fluconazol sind in Flaschen oder Blisterpackungen zur Abgabe von Einzeldosen verpackt. Die 150-mg-Fluconazol-Tabletten sind rosa und oval und in einer Einzeldosis-Blisterpackung verpackt.
DIFLUCAN Tabletten werden wie folgt geliefert:
DIFLUCAN 50 mg Tabletten : Graviert mit „DIFLUCAN“ und „50“ auf der Vorderseite und „ROERIG“ auf der Rückseite.
NDC 03410-30 30 Flaschen
DIFLUCAN 100 mg Tabletten : Graviert mit „DIFLUCAN“ und „100“ auf der Vorderseite und „ROERIG“ auf der Rückseite.
NDC 03420-30 30 Flaschen NDC 0049-3420-41 Einheitsdosis Packung mit 100 Stück
DIFLUCAN 150 mg Tabletten : Graviert mit „DIFLUCAN“ und „150“ auf der Vorderseite und „ROERIG“ auf der Rückseite.
NDC 0049-3500-79 Einzeldosis Packung mit 1 Stück
DIFLUCAN 200 mg Tabletten : Graviert mit „DIFLUCAN“ und „200“ auf der Vorderseite und „ROERIG“ auf der Rückseite.
NDC 03430-30 30 Flaschen NDC 0049-3430-41 Einzeldosis-Packung mit 100 Stück
Lagerung
Lagern Sie die Tabletten unter 30 °C (86 °F).
DIFLUCAN 100 mg zur oralen Suspension : DIFLUCAN zur Herstellung einer Suspension zum Einnehmen wird als Pulver mit Orangengeschmack geliefert, um 35 ml pro Flasche wie folgt bereitzustellen:
NDC 0049-3440-19 Fluconazol 350 mg pro Flasche NDC 0049-3450-19 Fluconazol 1400 mg pro Flasche
Lagerung
Trockenpulver unter 30 °C (86 °F) lagern. Die rekonstituierte Suspension zwischen 30 °C (86 °F) und 5 °C (41 °F) lagern und nicht verbrauchte Portionen nach 2 Wochen verwerfen. Vor Frost schützen.
Vertrieb durch: Roerig Division of Pfizer Inc., NY, NY 10017. Überarbeitet: Okt. 2021
NEBENWIRKUNGEN
DIFLUCAN wird im Allgemeinen gut vertragen.
Bei einigen Patienten, insbesondere solchen mit schweren Grunderkrankungen wie AIDS und Krebs, wurden während der Behandlung mit Fluconazol und Vergleichsmitteln Veränderungen der Ergebnisse von Nieren- und hämatologischen Funktionstests und Leberanomalien beobachtet, aber die klinische Bedeutung und der Zusammenhang mit der Behandlung sind ungewiss.
Bei Patienten, die eine Einzeldosis für vaginale Candidiasis erhalten
Während vergleichender klinischer Studien, die in den Vereinigten Staaten durchgeführt wurden, wurden 448 Patienten mit vaginaler Candidiasis mit DIFLUCAN, 150 mg Einzeldosis, behandelt. Die Gesamthäufigkeit von Nebenwirkungen, die möglicherweise mit DIFLUCAN zusammenhängen, betrug 26 %. Bei 422 Patienten, die aktive Vergleichspräparate erhielten, betrug die Inzidenz 16 %. Die häufigsten behandlungsbedingten Nebenwirkungen, die bei Patienten berichtet wurden, die eine Einzeldosis von 150 mg Fluconazol gegen Vaginitis erhielten, waren Kopfschmerzen (13 %), Übelkeit (7 %) und Bauchschmerzen (6 %). Andere Nebenwirkungen, die mit einer Inzidenz von 1 % oder mehr berichtet wurden, waren Durchfall (3 %), Dyspepsie (1 %), Schwindel (1 %) und Geschmacksstörungen (1 %). Die meisten der berichteten Nebenwirkungen waren leicht bis mittelschwer. In seltenen Fällen wurde in der Markterfahrung über Angioödeme und anaphylaktische Reaktionen berichtet.
Bei Patienten, die mehrere Dosen für andere Infektionen erhalten
Bei sechzehn Prozent von über 4000 Patienten, die in klinischen Studien über 7 Tage oder länger mit DIFLUCAN (Fluconazol) behandelt wurden, traten Nebenwirkungen auf. Die Behandlung wurde bei 1,5 % der Patienten aufgrund unerwünschter klinischer Ereignisse und bei 1,3 % der Patienten aufgrund von Laborwertabweichungen abgebrochen.
Klinische Nebenwirkungen wurden häufiger bei HIV-infizierten Patienten (21 %) als bei nicht HIV-infizierten Patienten (13 %) berichtet; die Muster bei HIV-infizierten und nicht-HIV-infizierten Patienten waren jedoch ähnlich. Der Anteil der Patienten, die die Therapie aufgrund klinischer Nebenwirkungen abbrachen, war in beiden Gruppen ähnlich (1,5 %).
Die folgenden behandlungsbedingten klinischen Nebenwirkungen traten bei 4048 Patienten, die DIFLUCAN 50 mg für 7 oder mehr Tage in klinischen Studien erhielten, mit einer Inzidenz von 1 % oder mehr auf: Übelkeit 3,7 %, Kopfschmerzen 1,9 %, Hautausschlag 1,8 %, Erbrechen 1,7 %, Bauchschmerzen Schmerzen 1,7 % und Durchfall 1,5 %.
Hepato-Biliär
In kombinierten klinischen Studien und Markterfahrungen gab es seltene Fälle von schweren hepatischen Reaktionen während der Behandlung mit DIFLUCAN. (Sehen WARNUNGEN .) Das Spektrum dieser Leberreaktionen reichte von leichten vorübergehenden Erhöhungen der Transaminasen bis hin zu klinischer Hepatitis, Cholestase und fulminantem Leberversagen, einschließlich Todesfällen. Es wurde festgestellt, dass Fälle von tödlichen Leberreaktionen hauptsächlich bei Patienten mit schwerwiegenden Grunderkrankungen (vorwiegend AIDS oder bösartige Erkrankungen) und häufig während der gleichzeitigen Einnahme mehrerer Medikamente auftraten. Vorübergehende hepatische Reaktionen, einschließlich Hepatitis und Gelbsucht, sind bei Patienten ohne andere identifizierbare Risikofaktoren aufgetreten. In jedem dieser Fälle kehrte die Leberfunktion nach Absetzen von DIFLUCAN auf den Ausgangswert zurück.
In zwei vergleichenden Studien zur Bewertung der Wirksamkeit von DIFLUCAN zur Unterdrückung von Rückfällen bei Kryptokokkenmeningitis wurde ein statistisch signifikanter Anstieg der medianen AST (SGOT)-Spiegel von einem Ausgangswert von 30 IE/l auf 41 IE/l in einer Studie und 34 beobachtet IU/L bis 66 IU/L im anderen. Die Gesamtrate von Serumtransaminase-Erhöhungen um mehr als das 8-fache der Obergrenze des Normalwerts betrug bei mit Fluconazol behandelten Patienten in klinischen Studien etwa 1 %. Diese Erhöhungen traten bei Patienten mit schweren Grunderkrankungen, überwiegend AIDS oder bösartigen Erkrankungen, auf, von denen die meisten mehrere Begleitmedikationen erhielten, darunter viele, die bekanntermaßen hepatotoxisch sind. Die Inzidenz abnormal erhöhter Serumtransaminasen war größer bei Patienten, die DIFLUCAN gleichzeitig mit einem oder mehreren der folgenden Medikamente einnahmen: Rifampin, Phenytoin, Isoniazid, Valproinsäure oder oral verabreichte hypoglykämische Sulfonylharnstoffe.
Post-Marketing-Erfahrung
Darüber hinaus sind die folgenden Nebenwirkungen nach Markteinführung aufgetreten.
Immunologisch: In seltenen Fällen wurde über Anaphylaxie (einschließlich Angioödem, Gesichtsödem und Juckreiz) berichtet.
Körper als Ganzes: Asthenie, Müdigkeit, Fieber, Unwohlsein.
Herz-Kreislauf: QT-Verlängerung, Torsade de Pointes. (Sehen VORSICHTSMASSNAHMEN .)
Zentrales Nervensystem: Krampfanfälle, Schwindel.
Hämatopoetisch und lymphatisch: Leukopenie, einschließlich Neutropenie und Agranulozytose, Thrombozytopenie.
Stoffwechsel: Hypercholesterinämie, Hypertriglyzeridämie, Hypokaliämie.
Magen-Darm: Cholestase, Mundtrockenheit, hepatozelluläre Schädigung, Dyspepsie, Erbrechen.
Andere Sinne: Probieren Sie Perversion.
Bewegungsapparat: Myalgie.
Nervöses System: Schlaflosigkeit, Parästhesien, Schläfrigkeit, Zittern, Schwindel.
Haut und Anhängsel: Akute generalisierte exanthematische Pustulose, Arzneimittelexanthem einschließlich fixem Arzneimittelexanthem, vermehrtes Schwitzen, exfoliative Hauterkrankungen einschließlich Stevens-Johnson-Syndrom und toxischer epidermaler Nekrolyse, Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS) (vgl WARNUNGEN ), Haarausfall.
Nebenwirkungen bei Kindern
Das Muster und die Inzidenz von unerwünschten Ereignissen und Laboranomalien, die während klinischer Studien mit Kindern aufgezeichnet wurden, sind vergleichbar mit denen, die bei Erwachsenen beobachtet wurden.
In klinischen Phase-II/III-Studien, die in den Vereinigten Staaten und in Europa durchgeführt wurden, wurden 577 pädiatrische Patienten im Alter von 1 Tag bis 17 Jahren mit DIFLUCAN in Dosen von bis zu 15 mg/kg/Tag für bis zu 1.616 Tage behandelt. Bei dreizehn Prozent der Kinder traten behandlungsbedingte Nebenwirkungen auf. Die am häufigsten berichteten Ereignisse waren Erbrechen (5 %), Bauchschmerzen (3 %), Übelkeit (2 %) und Durchfall (2 %). Die Behandlung wurde bei 2,3 % der Patienten aufgrund unerwünschter klinischer Ereignisse und bei 1,4 % der Patienten aufgrund von Laborwertabweichungen abgebrochen. Die Mehrzahl der behandlungsbedingten Laboranomalien waren Erhöhungen der Transaminasen oder der alkalischen Phosphatase.
Prozentsatz der Patienten mit behandlungsbedingten Nebenwirkungen
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
(Sehen KONTRAINDIKATIONEN .) Fluconazol ist ein moderater CYP2C9- und CYP3A4-Hemmer. Fluconazol ist auch ein starker Inhibitor von CYP2C19. Mit DIFLUCAN behandelte Patienten, die auch gleichzeitig mit Arzneimitteln mit enger therapeutischer Breite behandelt werden, die über CYP2C9 und CYP3A4 metabolisiert werden, sollten auf Nebenwirkungen im Zusammenhang mit den gleichzeitig verabreichten Arzneimitteln überwacht werden. Zusätzlich zu den unten erwähnten beobachteten/dokumentierten Wechselwirkungen besteht bei gleichzeitiger Anwendung mit Fluconazol das Risiko einer erhöhten Plasmakonzentration anderer Verbindungen, die durch CYP2C9, CYP2C19 und CYP3A4 metabolisiert werden. Daher ist bei der Anwendung dieser Kombinationen Vorsicht geboten und die Patienten sollten sorgfältig überwacht werden. Die enzymhemmende Wirkung von Fluconazol hält aufgrund der langen Halbwertszeit von Fluconazol 4 bis 5 Tage nach Absetzen der Fluconazol-Behandlung an. Klinisch oder potenziell signifikante Arzneimittelwechselwirkungen zwischen DIFLUCAN 200 mg und den folgenden Wirkstoffen/Klassen wurden beobachtet und werden nachstehend ausführlicher beschrieben:
Alfentanil
In einer Studie wurde eine Verringerung der Clearance und des Verteilungsvolumens sowie eine Verlängerung von t½ von Alfentanil nach gleichzeitiger Behandlung mit Fluconazol beobachtet. Ein möglicher Wirkmechanismus ist die Hemmung von CYP3A4 durch Fluconazol. Eine Dosisanpassung von Alfentanil kann erforderlich sein.
Amiodaron
Die gleichzeitige Verabreichung von Fluconazol mit Amiodaron kann die QT-Verlängerung verstärken. Vorsicht ist geboten, wenn die gleichzeitige Anwendung von Fluconazol und Amiodaron erforderlich ist, insbesondere bei hochdosiertem Fluconazol (800 mg).
Amitriptylin, Nortriptylin
Fluconazol verstärkt die Wirkung von Amitriptylin und Nortriptylin. 5-Nortriptylin und/oder S-Amitriptylin können zu Beginn der Kombinationstherapie und nach 1 Woche gemessen werden. Die Dosierung von Amitriptylin/Nortriptylin sollte gegebenenfalls angepasst werden.
Amphotericin B
Die gleichzeitige Verabreichung von Fluconazol und Amphotericin B bei infizierten normalen und immunsupprimierten Mäusen zeigte die folgenden Ergebnisse: eine geringe additive antimykotische Wirkung bei systemischer Infektion mit Candida albicans, keine Wechselwirkung bei intrakranieller Infektion mit Cryptococcus neoformans und Antagonismus der beiden Medikamente bei systemischer Infektion mit A .fumigatus. Die klinische Bedeutung der in diesen Studien erzielten Ergebnisse ist nicht bekannt.
Azithromycin
In einer unverblindeten, randomisierten Dreifach-Crossover-Studie an 18 gesunden Probanden wurden die Wirkung einer oralen Einzeldosis von 1200 mg Azithromycin auf die Pharmakokinetik einer oralen Einzeldosis von 800 mg Fluconazol sowie die Wirkung von Fluconazol auf die Pharmakokinetik untersucht von Azithromycin. Es gab keine signifikante pharmakokinetische Wechselwirkung zwischen Fluconazol und Azithromycin.
Kalziumkanalblocker
Bestimmte Calciumkanalantagonisten (Nifedipin, Isradipin, Amlodipin, Verapamil und Felodipin) werden durch CYP3A4 metabolisiert. Fluconazol hat das Potenzial, die systemische Exposition der Calciumkanalantagonisten zu erhöhen. Eine häufige Überwachung auf unerwünschte Ereignisse wird empfohlen.
Carbamazepin
Fluconazol hemmt den Carbamazepin-Metabolismus und es wurde ein Anstieg des Serum-Carbamazepins um 30 % beobachtet. Es besteht das Risiko der Entwicklung einer Carbamazepin-Toxizität. Je nach Konzentrationsmessungen/Wirkung kann eine Dosisanpassung von Carbamazepin erforderlich sein.
Celecoxib
Während der gleichzeitigen Behandlung mit Fluconazol (200 mg täglich) und Celecoxib (200 mg) stiegen Cmax und AUC von Celecoxib um 68 % bzw. 134 % an. Bei Kombination mit Fluconazol kann die Hälfte der Celecoxib-Dosis erforderlich sein.
Antikoagulantien vom Cumarin-Typ
Bei Patienten, die gleichzeitig DIFLUCAN 150 mg und Antikoagulantien vom Cumarin-Typ erhalten, kann die Prothrombinzeit verlängert sein. Wie bei anderen Azol-Antimykotika wurden nach Markteinführung Blutungsereignisse (Blutergüsse, Epistaxis, gastrointestinale Blutungen, Hämaturie und Meläna) im Zusammenhang mit einer Verlängerung der Prothrombinzeit bei Patienten berichtet, die Fluconazol gleichzeitig mit Warfarin erhielten. Eine sorgfältige Überwachung der Prothrombinzeit bei Patienten, die DIFLUCAN 50 mg und Antikoagulantien vom Cumarin-Typ erhalten, wird empfohlen. Eine Dosisanpassung von Warfarin kann erforderlich sein. (Sehen KLINISCHE PHARMAKOLOGIE : Arzneimittelwechselwirkungsstudien .)
Cyclophosphamid
Die Kombinationstherapie mit Cyclophosphamid und Fluconazol führt zu einem Anstieg von Serumbilirubin und Serumkreatinin. Die Kombination kann unter erhöhter Berücksichtigung des Risikos eines erhöhten Serumbilirubins und Serumkreatinins angewendet werden.
Cyclosporin
DIFLUCAN 100 mg erhöht die Ciclosporinspiegel bei nierentransplantierten Patienten mit oder ohne Nierenfunktionsstörung signifikant. Bei Patienten, die DIFLUCAN und Ciclosporin erhalten, wird eine sorgfältige Überwachung der Cyclosporinkonzentrationen und des Serumkreatinins empfohlen. (Sehen KLINISCHE PHARMAKOLOGIE : Arzneimittelwechselwirkungsstudien .) Diese Kombination kann verwendet werden, indem die Ciclosporin-Dosierung in Abhängigkeit von der Ciclosporin-Konzentration reduziert wird.
Fentanyl
Ein tödlicher Fall einer möglichen Fentanyl-Fluconazol-Wechselwirkung wurde berichtet. Der Autor urteilte, dass der Patient an einer Fentanylvergiftung gestorben sei. Darüber hinaus wurde in einer randomisierten Crossover-Studie mit 12 gesunden Probanden gezeigt, dass Fluconazol die Elimination von Fentanyl signifikant verzögert. Erhöhte Fentanylkonzentrationen können zu Atemdepression führen.
HMG-CoA-Reduktase-Inhibitoren
Das Risiko einer Myopathie und Rhabdomyolyse steigt, wenn Fluconazol zusammen mit HMG-CoA-Reduktase-Hemmern verabreicht wird, die über CYP3A4 wie Atorvastatin und Simvastatin oder über CYP2C9 wie Fluvastatin metabolisiert werden. Wenn eine Begleittherapie erforderlich ist, sollte der Patient auf Symptome einer Myopathie und Rhabdomyolyse beobachtet und die Kreatininkinase überwacht werden. HMG-CoA-Reduktase-Hemmer sollten abgesetzt werden, wenn ein deutlicher Anstieg der Kreatininkinase beobachtet wird oder eine Myopathie/Rhabdomyolyse diagnostiziert oder vermutet wird.
Hydrochlorothiazid
In einer pharmakokinetischen Wechselwirkungsstudie erhöhte die gleichzeitige Gabe von Hydrochlorothiazid in Mehrfachdosis an gesunde Freiwillige, die Fluconazol erhielten, die Plasmakonzentrationen von Fluconazol um 40 %. Eine Wirkung dieser Größenordnung sollte bei Patienten, die gleichzeitig Diuretika erhalten, keine Änderung des Fluconazol-Dosierungsschemas erforderlich machen.
Ibrutinib
Moderate Inhibitoren von CYP3A4 wie Fluconazol können die Plasmakonzentrationen von Ibrutinib erhöhen und das Risiko von Nebenwirkungen im Zusammenhang mit Ibrutinib erhöhen. Wenn Ibrutinib und Fluconazol gleichzeitig angewendet werden, reduzieren Sie die Ibrutinib-Dosis gemäß den Anweisungen in der Verschreibungsinformation zu Ibrutinib und der Patient sollte häufig auf Nebenwirkungen im Zusammenhang mit Ibrutinib überwacht werden.
Lemborexant
Die gleichzeitige Gabe von Fluconazol erhöhte die Cmax und AUC von Lemborexant um etwa das 1,6- bzw. 4,2-Fache, was voraussichtlich das Risiko von Nebenwirkungen wie Somnolenz erhöht. Vermeiden Sie die gleichzeitige Anwendung von DIFLUCAN mit Lemborexant.
Losartan
Fluconazol hemmt die Metabolisierung von Losartan zu seinem aktiven Metaboliten (E-31 74), der für den größten Teil des Angiotensin-II-Rezeptor-Antagonismus verantwortlich ist, der während der Behandlung mit Losartan auftritt. Patienten sollten ihren Blutdruck kontinuierlich überwachen lassen.
Methadon
Fluconazol kann die Serumkonzentration von Methadon erhöhen. Eine Dosisanpassung von Methadon kann erforderlich sein.
Nicht-steroidale entzündungshemmende Medikamente
Die Cmax und AUC von Flurbiprofen waren um 23 % bzw. 81 % erhöht, wenn sie zusammen mit Fluconazol verabreicht wurden, verglichen mit der Verabreichung von Flurbiprofen allein. In ähnlicher Weise waren die Cmax und AUC des pharmakologisch aktiven Isomers [S-(+)-Ibuprofen] um 15 % bzw. 82 % erhöht, wenn Fluconazol zusammen mit racemischem Ibuprofen (400 mg) verabreicht wurde, verglichen mit der Verabreichung von racemischem Ibuprofen allein.
Obwohl nicht speziell untersucht, hat Fluconazol das Potenzial, die systemische Exposition anderer nichtsteroidaler Antirheumatika (NSAIDs) zu erhöhen, die durch CYP2C9 metabolisiert werden (z. B. Naproxen, Lornoxicam, Meloxicam, Diclofenac). Eine häufige Überwachung auf Nebenwirkungen und Toxizität im Zusammenhang mit NSAIDs wird empfohlen. Eine Anpassung der Dosierung von NSAIDs kann erforderlich sein.
Olaparib
Moderate Inhibitoren von CYP3A4 wie Fluconazol erhöhen die Plasmakonzentrationen von Olaparib; die gleichzeitige Anwendung wird nicht empfohlen. Wenn die Kombination nicht vermieden werden kann, reduzieren Sie die Olaparib-Dosis, wie in der LYNPARZA® (Olaparib)-Verschreibungsinformation angegeben.
Orale Kontrazeptiva
Es wurden zwei pharmakokinetische Studien mit einem kombinierten oralen Kontrazeptivum mit Mehrfachdosen von Fluconazol durchgeführt. In der Studie mit 50 mg Fluconazol gab es keine relevanten Auswirkungen auf den Hormonspiegel, während bei 200 mg täglich die AUCs von Ethinylestradiol und Levonorgestrel um 40 % bzw. 24 % erhöht waren. Daher ist es unwahrscheinlich, dass die Mehrfachgabe von Fluconazol in diesen Dosierungen einen Einfluss auf die Wirksamkeit des kombinierten oralen Kontrazeptivums hat.
Orale Hypoglykämie
Eine klinisch signifikante Hypoglykämie kann durch die Anwendung von DIFLUCAN zusammen mit oralen Antidiabetika ausgelöst werden; Im Zusammenhang mit der kombinierten Anwendung von DIFLUCAN 150 mg und Glyburid wurde ein Todesfall aufgrund von Hypoglykämie berichtet. DIFLUCAN reduziert den Metabolismus von Tolbutamid, Glyburid und Glipizid und erhöht die Plasmakonzentration dieser Wirkstoffe. Wenn DIFLUCAN 100 mg gleichzeitig mit diesen oder anderen oralen blutzuckersenkenden Sulfonylharnstoffen angewendet wird, sollten die Blutzuckerspiegel sorgfältig überwacht und die Dosis des Sulfonylharnstoffs erforderlichenfalls angepasst werden. (Sehen KLINISCHE PHARMAKOLOGIE : Arzneimittelwechselwirkungsstudien .)
Phenytoin
DIFLUCAN erhöht die Plasmakonzentrationen von Phenytoin. Eine sorgfältige Überwachung der Phenytoinkonzentrationen bei Patienten, die DIFLUCAN 50 mg und Phenytoin erhalten, wird empfohlen. (Sehen KLINISCHE PHARMAKOLOGIE : Arzneimittelwechselwirkungsstudien .)
Pimozid
Obwohl nicht in vitro oder in vivo untersucht, kann die gleichzeitige Verabreichung von Fluconazol und Pimozid zu einer Hemmung des Pimozid-Metabolismus führen. Erhöhte Pimozid-Plasmakonzentrationen können zu einer QT-Verlängerung und dem seltenen Auftreten von Torsade de Pointes führen. Die gleichzeitige Anwendung von Fluconazol und Pimozid ist kontraindiziert.
Prednison
Es gab einen Fallbericht, dass ein lebertransplantierter Patient, der mit Prednison behandelt wurde, eine akute Nebennierenrindeninsuffizienz entwickelte, als eine 3-monatige Therapie mit Fluconazol abgesetzt wurde. Das Absetzen von Fluconazol verursachte vermutlich eine verstärkte CYP3A4-Aktivität, die zu einer erhöhten Metabolisierung von Prednison führte. Patienten unter Langzeitbehandlung mit Fluconazol und Prednison sollten sorgfältig auf Nebennierenrindeninsuffizienz überwacht werden, wenn Fluconazol abgesetzt wird.
Chinidin
Obwohl nicht in vitro oder in vivo untersucht, kann die gleichzeitige Verabreichung von Fluconazol mit Chinidin zu einer Hemmung des Chinidinstoffwechsels führen. Die Anwendung von Chinidin wurde mit einer QT-Verlängerung und dem seltenen Auftreten von Torsade de Pointes in Verbindung gebracht. Die gleichzeitige Anwendung von Fluconazol und Chinidin ist kontraindiziert. (Sehen KONTRAINDIKATIONEN .)
Rifabutin
Es wurde berichtet, dass eine Wechselwirkung besteht, wenn Fluconazol gleichzeitig mit Rifabutin verabreicht wird, was zu erhöhten Serumspiegeln von Rifabutin um bis zu 80 % führt. Es liegen Berichte über Uveitis bei Patienten vor, denen Fluconazol und Rifabutin gleichzeitig verabreicht wurden. Patienten, die gleichzeitig Rifabutin und Fluconazol erhalten, sollten sorgfältig überwacht werden. (Sehen KLINISCHE PHARMAKOLOGIE : Arzneimittelwechselwirkungsstudien .)
Rifampin
Rifampin verstärkt den Metabolismus von gleichzeitig verabreichtem DIFLUCAN. Abhängig von den klinischen Umständen sollte eine Erhöhung der Dosis von DIFLUCAN 200 mg in Betracht gezogen werden, wenn es zusammen mit Rifampin verabreicht wird. (Sehen KLINISCHE PHARMAKOLOGIE : Arzneimittelwechselwirkungsstudien .)
Saquinavir
Fluconazol erhöht die AUC von Saquinavir um etwa 50 %, Cmax um etwa 55 % und verringert die Clearance von Saquinavir um etwa 50 % aufgrund der Hemmung des hepatischen Metabolismus von Saquinavir durch CYP3A4 und der Hemmung von P-Glykoprotein. Eine Dosisanpassung von Saquinavir kann erforderlich sein.
Kurzwirksame Benzodiazepine
Nach oraler Gabe von Midazolam führte Fluconazol zu einem erheblichen Anstieg der Midazolam-Konzentration und zu psychomotorischen Wirkungen. Diese Wirkung auf Midazolam scheint nach oraler Gabe von Fluconazol ausgeprägter zu sein als bei intravenöser Gabe von Fluconazol. Wenn kurzwirksame Benzodiazepine, die durch das Cytochrom-P450-System metabolisiert werden, gleichzeitig mit Fluconazol verabreicht werden, sollte eine Verringerung der Benzodiazepin-Dosis in Betracht gezogen und die Patienten entsprechend überwacht werden. (Sehen KLINISCHE PHARMAKOLOGIE : Arzneimittelwechselwirkungsstudien .)
Sirolimus
Fluconazol erhöht die Plasmakonzentrationen von Sirolimus vermutlich durch Hemmung des Metabolismus von Sirolimus über CYP3A4 und P-Glykoprotein. Diese Kombination kann mit einer Dosisanpassung von Sirolimus in Abhängigkeit von den Wirkungs-/Konzentrationsmessungen verwendet werden.
Tacrolimus
Fluconazol kann die Serumkonzentrationen von oral verabreichtem Tacrolimus aufgrund der Hemmung des Tacrolimus-Metabolismus durch CYP3A4 im Darm bis auf das Fünffache erhöhen. Bei intravenöser Gabe von Tacrolimus wurden keine signifikanten pharmakokinetischen Veränderungen beobachtet. Erhöhte Tacrolimusspiegel wurden mit Nephrotoxizität in Verbindung gebracht. Die Dosierung von oral verabreichtem Tacrolimus sollte abhängig von der Tacrolimus-Konzentration verringert werden. (Sehen KLINISCHE PHARMAKOLOGIE : Arzneimittelwechselwirkungsstudien .)
Theophyllin
DIFLUCAN 50 mg erhöht die Serumkonzentration von Theophyllin. Eine sorgfältige Überwachung der Theophyllin-Serumkonzentrationen bei Patienten, die DIFLUCAN 100 mg und Theophyllin erhalten, wird empfohlen. (Sehen KLINISCHE PHARMAKOLOGIE : Arzneimittelwechselwirkungsstudien .)
Tofacitinib
Die systemische Tofacitinib-Exposition ist erhöht, wenn Tofacitinib zusammen mit Fluconazol verabreicht wird. Reduzieren Sie die Tofacitinib-Dosis bei gleichzeitiger Gabe mit Fluconazol (dh von 5 mg zweimal täglich auf 5 mg einmal täglich, wie in der Kennzeichnung von XELJANZ [Tofacitinib] angegeben). (Sehen KLINISCHE PHARMAKOLOGIE : Arzneimittelwechselwirkungsstudien .)
Tolvaptan
Die Tolvaptan-Plasmaexposition ist signifikant erhöht (200 % der AUC; 80 % der Cmax), wenn Tolvaptan, ein CYP3A4-Substrat, zusammen mit Fluconazol, einem mäßigen CYP3A4-Hemmer, verabreicht wird. Diese Wechselwirkung kann zu dem Risiko einer signifikanten Zunahme von Nebenwirkungen im Zusammenhang mit Tolvaptan führen, insbesondere von signifikanter Diurese, Dehydratation und akutem Nierenversagen. Wenn Tolvaptan und Fluconazol gleichzeitig verabreicht werden, sollte die Tolvaptan-Dosis gemäß den Anweisungen in der Verschreibungsinformation von Tolvaptan reduziert werden und der Patient sollte häufig auf Nebenwirkungen im Zusammenhang mit Tolvaptan überwacht werden.
Triazolam
Fluconazol erhöht die AUC von Triazolam (Einzeldosis) um etwa 50 %, Cmax um 20 % bis 32 % und erhöht t½ um 25 % bis 50 % aufgrund der Hemmung des Metabolismus von Triazolam. Dosisanpassungen von Triazolam können erforderlich sein.
Vinca-Alkaloide
Obwohl nicht untersucht, kann Fluconazol die Plasmaspiegel der Vinca-Alkaloide (z. B. Vincristin und Vinblastin) erhöhen und zu Neurotoxizität führen, was möglicherweise auf eine inhibitorische Wirkung auf CYP3A4 zurückzuführen ist.
Vitamin A
Basierend auf einem Fallbericht bei einem Patienten, der eine Kombinationstherapie mit all-trans-Retinsäure (einer Säureform von Vitamin A) und Fluconazol erhielt, haben sich zentralnervöse (ZNS) bedingte Nebenwirkungen in Form eines Pseudotumor cerebri entwickelt, der danach verschwand Absetzen der Fluconazol-Behandlung. Diese Kombination kann verwendet werden, aber das Auftreten von ZNS-bedingten Nebenwirkungen sollte berücksichtigt werden.
Voriconazol
Vermeiden Sie die gleichzeitige Verabreichung von Voriconazol und Fluconazol. Eine Überwachung auf unerwünschte Ereignisse und Toxizität im Zusammenhang mit Voriconazol wird empfohlen; insbesondere, wenn mit der Behandlung mit Voriconazol innerhalb von 24 Stunden nach der letzten Fluconazol-Dosis begonnen wird. (Sehen KLINISCHE PHARMAKOLOGIE : Arzneimittelwechselwirkungsstudien .)
Zidovudin
Fluconazol erhöht die Cmax und AUC von Zidovudin um 84 % bzw. 74 % aufgrund einer etwa 45 %igen Abnahme der oralen Zidovudin-Clearance. Die Halbwertszeit von Zidovudin war nach einer Kombinationstherapie mit Fluconazol ebenfalls um etwa 128 % verlängert. Patienten, die diese Kombination erhalten, sollten auf die Entwicklung von Zidovudin-bedingten Nebenwirkungen überwacht werden. Eine Dosisreduktion von Zidovudin kann in Betracht gezogen werden.

Ärzte sollten sich darüber im Klaren sein, dass Wechselwirkungsstudien mit anderen als den im Abschnitt KLINISCHE PHARMAKOLOGIE aufgeführten Medikamenten nicht durchgeführt wurden, aber solche Wechselwirkungen auftreten können.
WARNUNGEN
VORSICHTSMASSNAHMEN
Allgemein
Einige Azole, einschließlich Fluconazol, wurden mit einer Verlängerung des QT-Intervalls im Elektrokardiogramm in Verbindung gebracht. Fluconazol bewirkt eine QT-Verlängerung über die Hemmung des Gleichrichter-Kaliumkanalstroms (Ikr). Die durch andere Arzneimittel (z. B. Amiodaron) verursachte QT-Verlängerung kann durch die Hemmung von Cytochrom P450 (CYP) 3A4 verstärkt werden. (Sehen VORSICHTSMASSNAHMEN : Wechselwirkungen mit anderen Medikamenten .) Während der Überwachung nach Markteinführung gab es seltene Fälle von QT-Verlängerung und Torsade de Pointes bei Patienten, die Fluconazol einnahmen. Die meisten dieser Berichte betrafen schwerkranke Patienten mit mehreren verwirrenden Risikofaktoren, wie z. B. strukturelle Herzerkrankungen, Elektrolytanomalien und Begleitmedikationen, die dazu beigetragen haben könnten. Patienten mit Hypokaliämie und fortgeschrittener Herzinsuffizienz haben ein erhöhtes Risiko für das Auftreten lebensbedrohlicher ventrikulärer Arrhythmien und Torsade de Pointes.
Fluconazol sollte Patienten mit diesen potenziell proarrhythmischen Zuständen mit Vorsicht verabreicht werden.
Die gleichzeitige Anwendung von Fluconazol und Erythromycin kann das Risiko einer Kardiotoxizität (verlängertes QT-Intervall, Torsade de Pointes) und folglich eines plötzlichen Herztods erhöhen. Diese Kombination sollte vermieden werden.
Fluconazol sollte bei Patienten mit Nierenfunktionsstörung mit Vorsicht angewendet werden.
Bei Patienten, die Azole, einschließlich Fluconazol, erhielten, wurde über Nebenniereninsuffizienz berichtet. Reversible Fälle von Nebenniereninsuffizienz wurden bei Patienten berichtet, die Fluconazol erhielten.
DIFLUCAN 100 mg Pulver zur Herstellung einer Suspension zum Einnehmen enthält Saccharose und sollte nicht bei Patienten mit hereditärer Fructose-, Glucose-/Galactose-Malabsorption und Saccharase-Isomaltase-Mangel angewendet werden.
Beim Führen von Fahrzeugen oder Bedienen von Maschinen ist zu beachten, dass gelegentlich Schwindel oder Krampfanfälle auftreten können.
Einzelne Dosis
Die Zweckmäßigkeit und Wirksamkeit der oralen Einzeldosis-Fluconazol-Tablette zur Behandlung von vaginalen Hefeinfektionen sollte gegen die Akzeptanz einer höheren Inzidenz arzneimittelbedingter unerwünschter Ereignisse bei DIFLUCAN (26 %) im Vergleich zu intravaginalen Mitteln (16 %) in den USA abgewogen werden vergleichende klinische Studien. (Sehen NEBENWIRKUNGEN und Klinische Studien .)
Nichtklinische Toxikologie
Karzinogenese, Mutagenese und Beeinträchtigung der Fruchtbarkeit
Fluconazol zeigte bei Mäusen und Ratten, die 24 Monate lang oral mit Dosen von 2,5 mg/kg/Tag, 5 mg/kg/Tag oder 10 mg/kg/Tag (etwa das 2- bis 7-fache der empfohlenen Humandosis) oral behandelt wurden, keine Hinweise auf ein karzinogenes Potenzial ). Männliche Ratten, die mit 5 mg/kg/Tag und 10 mg/kg/Tag behandelt wurden, hatten eine erhöhte Inzidenz von hepatozellulären Adenomen.
Fluconazol, mit oder ohne metabolische Aktivierung, war in Mutagenitätstests an vier Stämmen von S. typhimurium und im Maus-Lymphom-L5178Y-System negativ. Zytogenetische Studien in vivo (Mäuse-Knochenmarkszellen nach oraler Gabe von Fluconazol) und in vitro (menschliche Lymphozyten, die Fluconazol bei 1000 mcg/ml ausgesetzt wurden) zeigten keine Hinweise auf chromosomale Mutationen.
Fluconazol hatte keinen Einfluss auf die Fertilität männlicher oder weiblicher Ratten, die oral mit täglichen Dosen von 5 mg/kg, 10 mg/kg oder 20 mg/kg oder mit parenteralen Dosen von 5 mg/kg, 25 mg/kg oder 75 mg behandelt wurden /kg, obwohl der Geburtsbeginn bei 20 mg/kg PO leicht verzögert war. In einer intravenösen perinatalen Studie an Ratten mit 5 mg/kg, 20 mg/kg und 40 mg/kg wurden bei einigen Muttertieren bei 20 mg/kg (ungefähr das 5- bis 15-fache der empfohlenen Humandosis) Dystokie und Verlängerung der Geburt beobachtet ) und 40 mg/kg, aber nicht bei 5 mg/kg. Die Geburtsstörungen spiegelten sich in einer leichten Zunahme der Anzahl totgeborener Jungtiere und einer Abnahme der neonatalen Überlebensrate bei diesen Dosierungen wider. Die Auswirkungen auf die Geburt bei Ratten stimmen mit der artspezifischen östrogensenkenden Eigenschaft überein, die durch hohe Dosen von Fluconazol hervorgerufen wird. Eine solche Hormonveränderung wurde bei Frauen, die mit Fluconazol behandelt wurden, nicht beobachtet. (Sehen KLINISCHE PHARMAKOLOGIE .)
Schwangerschaft
Teratogene Wirkungen
Potenzial für fetale Schäden
Die Anwendung während der Schwangerschaft sollte vermieden werden, außer bei Patientinnen mit schweren oder potenziell lebensbedrohlichen Pilzinfektionen, bei denen Fluconazol angewendet werden kann, wenn der erwartete Nutzen das mögliche Risiko für den Fötus überwiegt. Einige veröffentlichte Fallberichte beschreiben ein Muster unterschiedlicher angeborener Anomalien bei Säuglingen, die während des größten Teils oder des gesamten ersten Trimesters in utero hochdosiertem mütterlichem Fluconazol (400 bis 800 mg/Tag) ausgesetzt waren. Diese gemeldeten Anomalien ähneln denen, die in Tierversuchen beobachtet wurden. Bei Frauen im gebärfähigen Alter, die mit DIFLUCAN 400 bis 800 mg/Tag behandelt werden, sollten wirksame Verhütungsmaßnahmen in Betracht gezogen und während der gesamten Behandlungsdauer und für etwa 1 Woche (5 bis 6 Halbwertszeiten) nach der letzten Dosis fortgesetzt werden. Wenn DIFLUCAN während der Schwangerschaft angewendet wird oder wenn die Patientin während der Einnahme des Arzneimittels schwanger wird, sollte die Patientin über die potenzielle Gefahr für den Fötus informiert werden. Spontane Fehlgeburten und angeborene Anomalien wurden basierend auf retrospektiven epidemiologischen Studien als potenzielle Risiken im Zusammenhang mit 150 mg Fluconazol als Einzeldosis oder als wiederholte Gabe im ersten Trimenon der Schwangerschaft vorgeschlagen. Es liegen keine ausreichenden und gut kontrollierten Studien zu DIFLUCAN 150 mg bei Schwangeren vor. (Sehen WARNUNGEN : Potenzial für fetale Schäden .)
Menschliche Daten
Fallberichte beschreiben ein charakteristisches und seltenes Muster von Geburtsfehlern bei Säuglingen, deren Mütter während des größten Teils oder des gesamten ersten Schwangerschaftstrimesters hochdosiertes (400 bis 800 mg/Tag) Fluconazol erhielten. Zu den Merkmalen, die bei diesen Säuglingen zu sehen sind, gehören Brachyzephalie, abnormes Gesicht, abnorme Schädeldachentwicklung, Gaumenspalte, Femurkrümmung, dünne Rippen und lange Knochen, Arthrogryposis und angeborene Herzerkrankungen. Diese Wirkungen ähneln denen, die in Tierversuchen beobachtet wurden.
Epidemiologische Studien deuten auf ein potenzielles Risiko für spontane Fehlgeburten und angeborene Anomalien bei Säuglingen hin, deren Mütter im ersten Trimenon mit 150 mg Fluconazol als einmalige oder wiederholte Dosis behandelt wurden, aber diese epidemiologischen Studien weisen Einschränkungen auf und diese Ergebnisse wurden in kontrollierten klinischen Studien nicht bestätigt Versuche.
Tierdaten
Fluconazol wurde trächtigen Kaninchen während der Organogenese in zwei Studien in Dosen von 5 mg/kg, 10 mg/kg und 20 mg/kg bzw. 5 mg/kg, 25 mg/kg und 75 mg/kg oral verabreicht. Die Gewichtszunahme der Mutter war bei allen Dosierungen beeinträchtigt (etwa das 0,25- bis 4-fache der klinischen Dosis von 400 mg, basierend auf dem Vergleich der Körperoberfläche [KOF]), und Aborte traten bei 75 mg/kg auf (etwa das 4-fache der klinischen Dosis von 400 mg, basierend auf). BSA); es wurden keine unerwünschten Wirkungen auf den Fötus beobachtet.
In mehreren Studien, in denen trächtige Ratten während der Organogenese Fluconazol oral erhielten, war bei 25 mg/kg die Gewichtszunahme der Mutter beeinträchtigt und das Plazentagewicht erhöht. Es gab keine Auswirkungen auf den Fötus bei 5 mg/kg oder 10 mg/kg; Zunahmen an fötalen anatomischen Varianten (überzählige Rippen, Dilatation des Nierenbeckens) und Verzögerungen der Ossifikation wurden bei 25 mg/kg und 50 mg/kg und höheren Dosen beobachtet. Bei Dosen im Bereich von 80 bis 320 mg/kg (ungefähr das 2- bis 8-fache der klinischen Dosis von 400 mg, basierend auf BSA) war die Embryoletalität bei Ratten erhöht und fötale Anomalien umfassten gewellte Rippen, Gaumenspalten und abnormale kraniofaziale Ossifikation. Diese Wirkungen stimmen mit der Hemmung der Östrogensynthese bei Ratten überein und können das Ergebnis bekannter Wirkungen von erniedrigtem Östrogen auf Trächtigkeit, Organogenese und Geburt sein.
Stillende Mutter
Fluconazol war nach Verabreichung einer Einzeldosis von 150 mg in geringen Mengen in der Muttermilch vorhanden, basierend auf Daten aus einer Studie mit 10 stillenden Frauen, die das Stillen 5 Tage bis 19 Monate nach der Geburt vorübergehend oder dauerhaft abbrachen. Die geschätzte tägliche Säuglingsdosis von Fluconazol aus der Muttermilch (unter Annahme einer mittleren Milchaufnahme von 150 ml/kg/Tag) basierend auf der mittleren maximalen Milchkonzentration (2,61 µg/ml [Bereich: 1,57 bis 3,65 µg/ml] 5,2 Stunden nach der Dosis) betrug 0,39 mg/kg/Tag, was ungefähr 13 % der empfohlenen pädiatrischen Dosis für oropharyngeale Candidiasis entspricht. (Die angegebene pädiatrische Dosis beträgt 6 mg/kg/Tag am ersten Tag, gefolgt von 3 mg/kg/Tag; die geschätzte Säuglingsdosis beträgt 13 % der Erhaltungsdosis von 3 mg/kg/Tag). Es liegen keine Daten zum Fluconazol-Spiegel in der Milch nach wiederholter Anwendung oder nach hochdosierter Fluconazol-Gabe vor. Eine veröffentlichte Umfrage unter 96 stillenden Frauen, die jeden zweiten Tag mit Fluconazol 150 mg (durchschnittlich 7,3 Kapseln [Bereich 1 bis 29 Kapseln]) wegen stillzeitbedingter Candida der Brust behandelt wurden, berichtete keine schwerwiegenden Nebenwirkungen bei Säuglingen. Vorsicht ist geboten, wenn DIFLUCAN einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Eine unverblindete, randomisierte, kontrollierte Studie hat gezeigt, dass DIFLUCAN 100 mg bei der Behandlung von oropharyngealer Candidiasis bei Kindern im Alter von 6 Monaten bis 13 Jahren wirksam ist. (Sehen Klinische Studien .)
Die Anwendung von DIFLUCAN 200 mg bei Kindern mit Kryptokokken-Meningitis, Candida-Ösophagitis oder systemischen Candida-Infektionen wird durch die gezeigte Wirksamkeit für diese Indikationen bei Erwachsenen und durch die Ergebnisse mehrerer kleiner, nicht vergleichender klinischer Studien mit Kindern gestützt. Darüber hinaus wurden pharmakokinetische Studien bei Kindern (siehe KLINISCHE PHARMAKOLOGIE ) haben eine Dosisproportionalität zwischen Kindern und Erwachsenen festgestellt. (Sehen DOSIERUNG UND ANWENDUNG .)
In einer nicht vergleichenden Studie an Kindern mit schweren systemischen Pilzinfektionen, von denen die meisten Candidämie waren, war die Wirksamkeit von DIFLUCAN ähnlich derjenigen, die für die Behandlung von Candidämie bei Erwachsenen berichtet wurde. Von 17 Probanden mit kulturell bestätigter Candidämie hatten 11 von 14 (79 %) mit Ausgangssymptomen (3 waren asymptomatisch) eine klinische Heilung; 13/15 (87 %) der auswertbaren Patienten hatten am Ende der Behandlung eine mykologische Heilung, aber zwei dieser Patienten erlitten 10 bzw. 18 Tage nach Beendigung der Therapie einen Rückfall.
Die Wirksamkeit von DIFLUCAN zur Unterdrückung von Kryptokokken-Meningitis war bei 4 von 5 Kindern erfolgreich, die in einer Compassionate-Use-Studie mit Fluconazol zur Behandlung einer lebensbedrohlichen oder schweren Mykose behandelt wurden. Es liegen keine Informationen zur Wirksamkeit von Fluconazol zur Primärbehandlung der Kryptokokken-Meningitis bei Kindern vor.
Das Sicherheitsprofil von DIFLUCAN 200 mg bei Kindern wurde an 577 Kindern im Alter von 1 Tag bis 17 Jahren untersucht, die 1 bis 1.616 Tage lang Dosen von 1 bis 15 mg/kg/Tag erhielten. (Sehen NEBENWIRKUNGEN .)
Die Wirksamkeit von DIFLUCAN wurde bei Säuglingen unter 6 Monaten nicht nachgewiesen. (Sehen KLINISCHE PHARMAKOLOGIE .) Eine kleine Anzahl von Patienten (29) im Alter von 1 Tag bis 6 Monaten wurde sicher mit DIFLUCAN behandelt.
Geriatrische Verwendung
Bei Nicht-AIDS-Patienten wurden Nebenwirkungen, die möglicherweise im Zusammenhang mit der Fluconazol-Behandlung stehen, bei weniger Patienten im Alter von 65 Jahren und älter (9 %, n = 339) als bei jüngeren Patienten (14 %, n = 2.240) berichtet. Es gab jedoch keinen konsistenten Unterschied zwischen den älteren und jüngeren Patienten in Bezug auf einzelne Nebenwirkungen. Von den am häufigsten berichteten Nebenwirkungen (> 1 %) traten Hautausschlag, Erbrechen und Durchfall bei einem größeren Anteil älterer Patienten auf. Ähnliche Anteile älterer Patienten (2,4 %) und jüngerer Patienten (1,5 %) brachen die Fluconazol-Therapie wegen Nebenwirkungen ab. Nach der Markteinführung traten Spontanberichte über Anämie und akutes Nierenversagen bei Patienten im Alter von 65 Jahren oder älter häufiger auf als bei Patienten zwischen 12 und 65 Jahren. Aufgrund der Freiwilligkeit der Meldungen und der natürlichen Zunahme der Inzidenz von Anämie und Nierenversagen bei älteren Menschen ist es jedoch nicht möglich, einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Kontrollierte klinische Studien mit Fluconazol schlossen keine ausreichende Anzahl von Patienten im Alter von 65 Jahren und älter ein, um zu beurteilen, ob sie in jeder Indikation anders ansprechen als jüngere Patienten. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt.
Fluconazol wird hauptsächlich als unverändertes Arzneimittel renal ausgeschieden. Da ältere Patienten eher eine eingeschränkte Nierenfunktion haben, sollte darauf geachtet werden, die Dosis basierend auf der Kreatinin-Clearance anzupassen. Es kann sinnvoll sein, die Nierenfunktion zu überwachen. (Sehen KLINISCHE PHARMAKOLOGIE und DOSIERUNG UND ANWENDUNG .)
ÜBERDOSIS
Es gibt Berichte über eine Überdosierung mit Fluconazol, begleitet von Halluzinationen und paranoidem Verhalten.
Im Falle einer Überdosierung sollte eine symptomatische Behandlung (mit unterstützenden Maßnahmen und Magenspülung, falls klinisch angezeigt) eingeleitet werden.
Fluconazol wird größtenteils im Urin ausgeschieden. Eine 3-stündige Hämodialysesitzung senkt die Plasmaspiegel um etwa 50 %.
Bei Mäusen und Ratten, die sehr hohe Fluconazol-Dosen erhielten, umfassten die klinischen Wirkungen bei beiden Arten verminderte Beweglichkeit und Atmung, Ptosis, Tränenfluss, Speichelfluss, Harninkontinenz, Verlust des Stellreflexes und Zyanose; Dem Tod gingen manchmal klonische Krämpfe voraus.
KONTRAINDIKATIONEN
DIFLUCAN (Fluconazol) ist kontraindiziert bei Patienten, die eine Überempfindlichkeit gegenüber Fluconazol oder einem der sonstigen Bestandteile gezeigt haben. Es liegen keine Informationen zu Kreuzallergien zwischen Fluconazol und anderen Azol-Antimykotika vor. Bei der Verschreibung von DIFLUCAN an Patienten mit Überempfindlichkeit gegenüber anderen Azolen ist Vorsicht geboten. Die gleichzeitige Anwendung anderer Arzneimittel, von denen bekannt ist, dass sie das QT-Intervall verlängern und die über das Enzym CYP3A4 metabolisiert werden, wie Erythromycin, Pimozid und Chinidin, ist bei Patienten, die Fluconazol erhalten, kontraindiziert. (Sehen KLINISCHE PHARMAKOLOGIE : Arzneimittelwechselwirkungsstudien und VORSICHTSMASSNAHMEN .)
KLINISCHE PHARMAKOLOGIE
Pharmakokinetik und Stoffwechsel
Die pharmakokinetischen Eigenschaften von Fluconazol sind nach intravenöser oder oraler Verabreichung ähnlich. Bei gesunden Probanden beträgt die Bioverfügbarkeit von oral verabreichtem Fluconazol über 90 % im Vergleich zur intravenösen Verabreichung. Zwischen der 100-mg-Tablette und beiden Suspensionsstärken bei Verabreichung als 200-mg-Einzeldosis wurde eine Bioäquivalenz festgestellt.
Maximale Plasmakonzentrationen (Cmax) treten bei nüchternen gesunden Probanden zwischen 1 und 2 Stunden mit einer terminalen Plasmaeliminationshalbwertszeit von etwa 30 Stunden (Bereich: 20 bis 50 Stunden) nach oraler Verabreichung auf.
Bei nüchternen gesunden Freiwilligen führt die Verabreichung einer oralen Einzeldosis von 400 mg DIFLUCAN (Fluconazol) zu einer mittleren Cmax von 6,72 µg/ml (Bereich: 4,12 bis 8,08 µg/ml) und nach oraler Einzelgabe von 50 bis 400 mg Fluconazol Plasmakonzentrationen und Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC) sind dosisproportional.
Die Cmax- und AUC-Daten aus einer Lebensmittelwirkungsstudie, bei der gesunde Probanden DIFLUCAN (Fluconazol)-Tabletten unter nüchternen Bedingungen und mit einer fettreichen Mahlzeit verabreicht wurden, zeigten, dass die Exposition gegenüber dem Arzneimittel nicht durch Nahrung beeinflusst wird. Daher kann DIFLUCAN unabhängig von den Mahlzeiten eingenommen werden. (Sehen DOSIERUNG UND ANWENDUNG .)
Steady-State-Konzentrationen werden innerhalb von 5 bis 10 Tagen nach oraler Gabe von 50 bis 400 mg einmal täglich erreicht. Die Verabreichung einer Aufsättigungsdosis (an Tag 1) in Höhe des Doppelten der üblichen Tagesdosis führt am zweiten Tag zu Plasmakonzentrationen nahe dem Steady-State. Das scheinbare Verteilungsvolumen von Fluconazol entspricht ungefähr dem des gesamten Körperwassers. Die Plasmaproteinbindung ist gering (11 bis 12 %). Nach einmaliger oder mehrfacher oraler Gabe über einen Zeitraum von bis zu 14 Tagen dringt Fluconazol in alle untersuchten Körperflüssigkeiten ein (vgl Tabelle unten ). Bei gesunden Probanden waren die Speichelkonzentrationen von Fluconazol gleich oder geringfügig höher als die Plasmakonzentrationen, unabhängig von Dosis, Verabreichungsweg oder Verabreichungsdauer. Bei Patienten mit Bronchiektasen entsprachen die Sputumkonzentrationen von Fluconazol nach einer oralen Einzeldosis von 150 mg sowohl 4 als auch 24 Stunden nach der Dosisgabe den Plasmakonzentrationen. Bei Patienten mit Pilzmeningitis betragen die Fluconazol-Konzentrationen in der Zerebrospinalflüssigkeit (CSF) etwa 80 % der entsprechenden Plasmakonzentrationen.
Eine orale Einzeldosis von 150 mg Fluconazol, die 27 Patientinnen verabreicht wurde, drang in das Vaginalgewebe ein, was zu Gewebe-Plasma-Verhältnissen im Bereich von 0,94 bis 1,14 in den ersten 48 Stunden nach der Verabreichung führte.
Eine orale Einzeldosis von 150 mg Fluconazol, die 14 Patientinnen verabreicht wurde, drang in die Vaginalflüssigkeit ein, was zu Flüssigkeits-Plasma-Verhältnissen im Bereich von 0,36 bis 0,71 in den ersten 72 Stunden nach der Verabreichung führte.
Bei gesunden Probanden wird Fluconazol hauptsächlich renal ausgeschieden, wobei ungefähr 80 % der verabreichten Dosis als unveränderter Wirkstoff im Urin erscheinen. Etwa 11 % der Dosis werden als Metaboliten im Urin ausgeschieden.
Die Pharmakokinetik von Fluconazol wird durch eine Verringerung der Nierenfunktion deutlich beeinflusst. Es besteht eine umgekehrte Beziehung zwischen der Eliminationshalbwertszeit und der Kreatinin-Clearance. Bei Patienten mit eingeschränkter Nierenfunktion muss die Dosis von DIFLUCAN möglicherweise reduziert werden. (Sehen DOSIERUNG UND ANWENDUNG .) Eine 3-stündige Hämodialysesitzung senkt die Plasmakonzentrationen um etwa 50 %.
Bei normalen Probanden war die Verabreichung von DIFLUCAN (Dosen im Bereich von 200 mg bis 400 mg einmal täglich für bis zu 14 Tage) mit geringen und widersprüchlichen Wirkungen auf die Testosteronkonzentrationen, die endogenen Kortikosteroidkonzentrationen und die durch das adrenocorticotrope Hormon (ACTH) stimulierte Cortisolreaktion verbunden.
Pharmakokinetik bei Kindern
Bei Kindern wurden die folgenden pharmakokinetischen Daten {Mittelwert (% CV)} berichtet:
Die körpergewichtskorrigierte Clearance wurde in diesen Studien nicht durch das Alter beeinflusst. Die mittlere Körperclearance bei Erwachsenen wird mit 0,23 (17 %) ml/min/kg angegeben.
Bei Frühgeborenen (Gestationsalter 26 bis 29 Wochen) betrug die mittlere (VKV) Clearance innerhalb von 36 Stunden nach der Geburt 0,180 (35 %, N = 7) ml/min/kg, die mit der Zeit auf einen Mittelwert von 0,218 ( 31 %, N = 9) ml/min/kg sechs Tage später und 0,333 (56 %, N = 4) ml/min/kg 12 Tage später. Ähnlich betrug die Halbwertszeit 73,6 Stunden, die mit der Zeit auf einen Mittelwert von 53,2 Stunden sechs Tage später und 46,6 Stunden 12 Tage später abnahm.
Pharmakokinetik bei älteren Menschen
Eine pharmakokinetische Studie wurde mit 22 Probanden im Alter von 65 Jahren oder älter durchgeführt, die eine orale Einzeldosis von 50 mg Fluconazol erhielten. Zehn dieser Patienten erhielten gleichzeitig Diuretika. Die Cmax betrug 1,54 µg/ml und trat 1,3 Stunden nach der Einnahme auf. Die mittlere AUC betrug 76,4 ± 20,3 µg•h/ml und die mittlere terminale Halbwertszeit 46,2 Stunden. Diese pharmakokinetischen Parameterwerte sind höher als analoge Werte, die für normale junge männliche Freiwillige berichtet wurden. Die gleichzeitige Verabreichung von Diuretika veränderte die AUC oder Cmax nicht signifikant. Darüber hinaus waren die Kreatinin-Clearance (74 ml/min), der Prozentsatz des unverändert im Urin wiedergefundenen Arzneimittels (0 bis 24 Stunden, 22 %) und die geschätzte renale Clearance von Fluconazol (0,124 ml/min/kg) bei älteren Patienten im Allgemeinen niedriger als die jüngerer Freiwilliger. Somit scheint die Veränderung der Fluconazol-Disposition bei älteren Menschen mit der für diese Gruppe charakteristischen reduzierten Nierenfunktion in Zusammenhang zu stehen. Ein Diagramm der terminalen Eliminationshalbwertszeit jedes Probanden gegen die Kreatinin-Clearance im Vergleich zur vorhergesagten Halbwertszeit – Kreatinin-Clearance-Kurve, die von normalen Probanden und Probanden mit unterschiedlichem Grad an Niereninsuffizienz abgeleitet wurde, zeigte, dass 21 von 22 Probanden darunter fielen die 95%-Konfidenzgrenze der vorhergesagten Halbwertszeit-Kreatinin-Clearance-Kurven. Diese Ergebnisse stimmen mit der Hypothese überein, dass höhere Werte für die pharmakokinetischen Parameter, die bei älteren Probanden im Vergleich zu gesunden jungen männlichen Probanden beobachtet wurden, auf die bei älteren Personen zu erwartende verminderte Nierenfunktion zurückzuführen sind.
Arzneimittelwechselwirkungsstudien
(Sehen WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN )
Orale Kontrazeptiva
Orale Kontrazeptiva wurden als Einzeldosis sowohl vor als auch nach der oralen Verabreichung von DIFLUCAN 50 mg einmal täglich für 10 Tage bei 10 gesunden Frauen verabreicht. Es gab keinen signifikanten Unterschied in der AUC von Ethinylestradiol oder Levonorgestrel nach Verabreichung von 50 mg DIFLUCAN. Der mittlere Anstieg der Ethinylestradiol-AUC betrug 6 % (Bereich: –47 bis 108 %) und der Levonorgestrel-AUC stieg um 17 % (Bereich: –33 bis 141 %).
In einer zweiten Studie erhielten fünfundzwanzig gesunde Frauen tägliche Dosen von 200 mg DIFLUCAN 150 mg Tabletten oder Placebo für zwei Zeiträume von zehn Tagen. Die Behandlungszyklen lagen im Abstand von einem Monat, wobei alle Probanden in einem Zyklus DIFLUCAN und im anderen Placebo erhielten. Die Reihenfolge der Studienbehandlung war zufällig. Am letzten Behandlungstag (Tag 10) beider Zyklen wurden Einzeldosen einer oralen Kontrazeptivum-Tablette mit Levonorgestrel und Ethinylestradiol verabreicht. Nach Gabe von 200 mg DIFLUCAN betrug der mittlere prozentuale Anstieg der AUC für Levonorgestrel im Vergleich zu Placebo 25 % (Bereich: –12 bis 82 %) und der mittlere prozentuale Anstieg für Ethinylestradiol im Vergleich zu Placebo 38 % (Bereich: – 11 bis 101 %). Beide Anstiege waren statistisch signifikant verschieden von Placebo.
In einer dritten Studie wurde die potenzielle Wechselwirkung einer einmal wöchentlichen Gabe von 300 mg Fluconazol bei 21 gesunden Frauen untersucht, die ein orales Kontrazeptivum mit Ethinylestradiol und Norethindron einnahmen. In dieser placebokontrollierten, doppelblinden, randomisierten Zweiweg-Crossover-Studie, die über drei Zyklen oraler Kontrazeptiva durchgeführt wurde, führte die Fluconazol-Dosierung im Vergleich zu einer ähnlichen Placebo-Dosierung zu einem leichten Anstieg der mittleren AUCs von Ethinylestradiol und Norethindron. Die mittleren AUCs von Ethinylestradiol und Norethindron stiegen im Vergleich zu Placebo um 24 % (95 %-KI-Bereich: 18 bis 31 %) bzw. 13 % (95 %-KI-Bereich: 8 bis 18 %). Die Behandlung mit Fluconazol verursachte bei keinem einzelnen Probanden in dieser Studie eine Abnahme der Ethinylestradiol-AUC im Vergleich zur Placebo-Dosierung. Die individuellen AUC-Werte von Norethindron nahmen bei 3 der 21 Probanden nach der Behandlung mit Fluconazol sehr leicht (
Cimetidin
DIFLUCAN 100 mg wurde sechs gesunden männlichen Probanden als orale Einzeldosis allein und zwei Stunden nach einer Einzeldosis von 400 mg Cimetidin verabreicht. Nach der Verabreichung von Cimetidin kam es zu einer signifikanten Abnahme der AUC und Cmax von Fluconazol. Es gab eine mittlere ± SD-Abnahme der Fluconazol-AUC von 13 % ± 11 % (Bereich: –3,4 bis –31 %) und die Cmax verringerte sich um 19 % ± 14 % (Bereich: –5 bis –40). %). Die intravenöse Verabreichung von 600 mg bis 900 mg Cimetidin über einen Zeitraum von vier Stunden (eine Stunde vor bis 3 Stunden nach einer oralen Einzeldosis von DIFLUCAN 200 mg) hatte jedoch keinen Einfluss auf die Bioverfügbarkeit oder Pharmakokinetik von Fluconazol bei 24 gesunden männlichen Probanden .
Antazida
Die Verabreichung von Maalox® (20 ml) an 14 normale männliche Freiwillige unmittelbar vor einer Einzeldosis von DIFLUCAN 100 mg hatte keine Auswirkung auf die Resorption oder Elimination von Fluconazol.
Hydrochlorothiazid
Die gleichzeitige orale Verabreichung von 100 mg DIFLUCAN und 50 mg Hydrochlorothiazid über 10 Tage bei 13 gesunden Probanden führte zu einem signifikanten Anstieg der AUC und Cmax von Fluconazol im Vergleich zur alleinigen Gabe von DIFLUCAN. Es gab eine mittlere ± SD-Zunahme der AUC und Cmax von Fluconazol von 45 % ± 31 % (Bereich: 19 bis 114 %) bzw. 43 % ± 31 % (Bereich: 19 bis 122 %). Diese Veränderungen werden einer mittleren ± SD-Reduktion der renalen Clearance von 30 % ± 12 % (Bereich: –10 bis –50 %) zugeschrieben.
Rifampin
Die Verabreichung einer oralen Einzeldosis von 200 mg DIFLUCAN 200 mg nach 15 Tagen täglicher Rifampin-Gabe von 600 mg bei acht gesunden männlichen Probanden führte zu einer signifikanten Abnahme der Fluconazol-AUC und einer signifikanten Zunahme der scheinbaren oralen Clearance von Fluconazol. Es gab eine mittlere ± SD-Reduktion der Fluconazol-AUC von 23 % ± 9 % (Bereich: –13 bis –42 %). Die scheinbare orale Clearance von Fluconazol stieg um 32 % ± 17 % (Bereich: 16 bis 72 %). Die Halbwertszeit von Fluconazol verringerte sich von 33,4 ± 4,4 Stunden auf 26,8 ± 3,9 Stunden. (Sehen VORSICHTSMASSNAHMEN .)
Warfarin
Es gab einen signifikanten Anstieg der Prothrombinzeitreaktion (Fläche unter der Prothrombin-Zeit-Zeit-Kurve) nach einer Einzeldosis Warfarin (15 mg), die 13 normalen männlichen Freiwilligen nach täglicher oraler Gabe von 200 mg DIFLUCAN über 14 Tage verabreicht wurde, im Vergleich zur Verabreichung von Warfarin allein. Bei der Prothrombin-Zeit-Reaktion (Fläche unter der Prothrombin-Zeit-Zeit-Kurve) gab es eine mittlere ± SD-Zunahme von 7 % ± 4 % (Bereich: –2 bis 13 %). (Sehen VORSICHTSMASSNAHMEN .) Der Mittelwert basiert auf Daten von 12 Probanden, da bei einem von 13 Probanden eine 2-fache Erhöhung seiner Prothrombinzeitreaktion auftrat.
Phenytoin
Die Phenytoin-AUC wurde nach 4-tägiger Phenytoin-Dosierung (200 mg täglich, oral für 3 Tage, gefolgt von 250 mg intravenös für eine Dosis) sowohl mit als auch ohne Verabreichung von Fluconazol (oral DIFLUCAN 200 mg täglich für 16 Tage) bei 10 gesunden Männern bestimmt Freiwillige. Es gab einen signifikanten Anstieg der Phenytoin-AUC. Der mittlere ± SD-Anstieg der Phenytoin-AUC betrug 88 % ± 68 % (Bereich: 16 bis 247 %). Das absolute Ausmaß dieser Wechselwirkung ist aufgrund der intrinsisch nichtlinearen Disposition von Phenytoin unbekannt. (Sehen VORSICHTSMASSNAHMEN .)
Cyclosporin
AUC und Cmax von Cyclosporin wurden vor und nach der Verabreichung von täglich 200 mg Fluconazol über 14 Tage bei acht Nierentransplantationspatienten bestimmt, die mindestens 6 Monate lang mit Ciclosporin und mindestens 6 Wochen lang mit einer stabilen Ciclosporin-Dosis behandelt worden waren. Nach der Verabreichung von Fluconazol kam es zu einem signifikanten Anstieg der AUC, Cmax, Cmin (24-Stunden-Konzentration) von Ciclosporin und einer signifikanten Verringerung der scheinbaren oralen Clearance. Der mittlere Anstieg der AUC um ± SD betrug 92 % ± 43 % (Bereich: 18 bis 147 %). Die Cmax erhöhte sich um 60 % ± 48 % (Bereich: –5 bis 133 %). C stieg um 157 % ± 96 % (Bereich: 33 bis 360 %). Die scheinbare orale Clearance verringerte sich um 45 % ± 15 % (Bereich: –15 bis –60 %). (Sehen VORSICHTSMASSNAHMEN .)
Zidovudin
Die Zidovudin-Plasmakonzentrationen wurden bei 13 Freiwilligen mit AIDS oder ARC, die mindestens zwei Wochen lang eine stabile Zidovudin-Dosis erhielten, zweimal bestimmt (vor und nach Fluconazol 200 mg täglich für 15 Tage). Nach Verabreichung von Fluconazol kam es zu einem signifikanten Anstieg der AUC von Zidovudin. Der mittlere Anstieg der AUC um ± SD betrug 20 % ± 32 % (Bereich: –27 bis 104 %). Das Verhältnis von Metabolit GZDV zu Ausgangssubstanz nahm nach der Verabreichung von Fluconazol signifikant ab, von 7,6 ± 3,6 auf 5,7 ± 2,2.
Theophyllin
Die Pharmakokinetik von Theophyllin wurde anhand einer intravenösen Einzeldosis von Aminophyllin (6 mg/kg) vor und nach der oralen Verabreichung von täglich 200 mg Fluconazol über 14 Tage bei 16 gesunden männlichen Probanden bestimmt. Es gab einen signifikanten Anstieg der AUC, Cmax und Halbwertszeit von Theophyllin mit einer entsprechenden Abnahme der Clearance. Die mittlere AUC von Theophyllin ± Standardabweichung stieg um 21 % ± 16 % (Bereich: –5 bis 48 %). Die Cmax erhöhte sich um 13 % ± 17 % (Bereich: –13 bis 40 %). Die Theophyllin-Clearance verringerte sich um 16 % ± 11 % (Bereich: -32 bis 5 %). Die Halbwertszeit von Theophyllin erhöhte sich von 6,6 ± 1,7 Stunden auf 7,9 ± 1,5 Stunden. (Sehen VORSICHTSMASSNAHMEN .)
Chinidin
Obwohl nicht in vitro oder in vivo untersucht, kann die gleichzeitige Verabreichung von Fluconazol mit Chinidin zu einer Hemmung des Chinidinstoffwechsels führen. Die Anwendung von Chinidin wurde mit einer QT-Verlängerung und dem seltenen Auftreten von Torsade de Pointes in Verbindung gebracht. Die gleichzeitige Anwendung von Fluconazol und Chinidin ist kontraindiziert. (Sehen KONTRAINDIKATIONEN und VORSICHTSMASSNAHMEN .)
Orale Hypoglykämie
Die Wirkungen von Fluconazol auf die Pharmakokinetik der oralen Sulfonylharnstoff-Hypoglykämika Tolbutamid, Glipizid und Glyburid wurden in drei placebokontrollierten Studien an gesunden Freiwilligen untersucht. Alle Probanden erhielten den Sulfonylharnstoff allein als Einzeldosis und erneut als Einzeldosis nach der Verabreichung von DIFLUCAN 100 mg täglich über 7 Tage. In diesen drei Studien traten bei 22/46 (47,8 %) der mit DIFLUCAN behandelten Patienten und 9/22 (40,1 %) der mit Placebo behandelten Patienten Symptome auf, die einer Hypoglykämie entsprachen. (Sehen VORSICHTSMASSNAHMEN .)
Tolbutamid
Bei 13 gesunden männlichen Probanden kam es nach der Verabreichung von Fluconazol zu einem signifikanten Anstieg der AUC und Cmax von Tolbutamid (500-mg-Einzeldosis). Es gab eine mittlere ± SD-Zunahme der Tolbutamid-AUC von 26 % ± 9 % (Bereich: 12 bis 39 %). Die Cmax von Tolbutamid erhöhte sich um 11 % ± 9 % (Bereich: –6 bis 27 %). (Sehen VORSICHTSMASSNAHMEN .)
Glipizid
Die AUC und Cmax von Glipizid (2,5-mg-Einzeldosis) waren nach Verabreichung von Fluconazol bei 13 gesunden männlichen Probanden signifikant erhöht. Es gab eine mittlere ± SD-Zunahme der AUC von 49 % ± 13 % (Bereich: 27 bis 73 %) und eine Zunahme der Cmax von 19 % ± 23 % (Bereich: –11 bis 79 %). (Sehen VORSICHTSMASSNAHMEN .)
Glyburid
Die AUC und Cmax von Glyburid (5 mg Einzeldosis) waren nach Verabreichung von Fluconazol bei 20 gesunden männlichen Probanden signifikant erhöht. Es gab eine mittlere ± SD-Zunahme der AUC von 44 % ± 29 % (Bereich: –13 bis 115 %) und Cmax um 19 % ± 19 % (Bereich: –23 bis 62 %). Fünf Probanden benötigten orale Glukose nach Einnahme von Glyburid nach 7 Tagen Fluconazol-Verabreichung. (Sehen VORSICHTSMASSNAHMEN .)
Rifabutin
Es wurden Berichte veröffentlicht, dass eine Wechselwirkung besteht, wenn Fluconazol gleichzeitig mit Rifabutin verabreicht wird, was zu erhöhten Serumspiegeln von Rifabutin führt. (Sehen VORSICHTSMASSNAHMEN .)
Tacrolimus
Es wurden Berichte veröffentlicht, dass eine Wechselwirkung besteht, wenn Fluconazol gleichzeitig mit Tacrolimus verabreicht wird, was zu erhöhten Serumspiegeln von Tacrolimus führt. (Sehen VORSICHTSMASSNAHMEN .)
Midazolam
Die Wirkung von Fluconazol auf die Pharmakokinetik und Pharmakodynamik von Midazolam wurde in einer randomisierten Crossover-Studie an 12 Freiwilligen untersucht. In der Studie nahmen die Probanden an Tag 1 Placebo oder 400 mg Fluconazol ein, gefolgt von 200 mg täglich von Tag 2 bis Tag 6. Zusätzlich wurde eine 7,5-mg-Dosis Midazolam am ersten Tag oral eingenommen, 0,05 mg/kg wurden intravenös verabreicht am vierten Tag und 7,5 mg oral am sechsten Tag. Fluconazol verringerte die Clearance von i.v. Midazolam um 51 %. Am ersten Einnahmetag erhöhte Fluconazol die AUC und Cmax von Midazolam um 259 % bzw. 150 %. Am sechsten Tag der Einnahme erhöhte Fluconazol die AUC und Cmax von Midazolam um 259 % bzw. 74 %. Die psychomotorischen Wirkungen von Midazolam waren nach oraler Verabreichung von Midazolam signifikant erhöht, wurden jedoch nach intravenöser Midazolam-Gabe nicht signifikant beeinträchtigt.
Eine zweite randomisierte, Placebo-kontrollierte Crossover-Doppel-Dummy-Studie in drei Phasen wurde durchgeführt, um die Wirkung des Verabreichungswegs von Fluconazol auf die Wechselwirkung zwischen Fluconazol und Midazolam zu bestimmen. In jeder Phase erhielten die Probanden 400 mg Fluconazol oral und Kochsalzlösung intravenös; orales Placebo und intravenöses Fluconazol 400 mg; und orales Placebo und intravenöse Kochsalzlösung. Eine orale Dosis von 7,5 mg Midazolam wurde nach Fluconazol/Placebo eingenommen. Die AUC und Cmax von Midazolam waren nach oraler Gabe von Fluconazol signifikant höher als nach intravenöser Gabe. Oral verabreichtes Fluconazol erhöhte die AUC und Cmax von Midazolam um 272 % bzw. 129 %. IV Fluconazol erhöhte die AUC und Cmax von Midazolam um 244 % bzw. 79 %. Sowohl orales als auch intravenöses Fluconazol verstärkten die pharmakodynamischen Wirkungen von Midazolam. (Sehen VORSICHTSMASSNAHMEN .)
Azithromycin
In einer unverblindeten, randomisierten Dreifach-Crossover-Studie mit 18 gesunden Probanden wurde die Wirkung einer oralen Einzeldosis von 800 mg Fluconazol auf die Pharmakokinetik einer oralen Einzeldosis von 1200 mg Azithromycin sowie die Wirkung von Azithromycin auf die Pharmakokinetik untersucht von Fluconazol. Es gab keine signifikante pharmakokinetische Wechselwirkung zwischen Fluconazol und Azithromycin.
Voriconazol
Voriconazol ist ein Substrat für die Isoenzyme CYP2C9 und CYP3A4. Die gleichzeitige Verabreichung von oralem Voriconazol (400 mg alle 12 Stunden für 1 Tag, dann 200 mg alle 12 Stunden für 2,5 Tage) und oralem Fluconazol (400 mg an Tag 1, dann 200 mg alle 24 Stunden für 4 Tage) an 6 gesunde männliche Probanden führte zu einem Anstieg von Cmax und AUCτ von Voriconazol um durchschnittlich 57 % (90 % KI: 20 % bis 107 %) bzw. 79 % (90 % KI: 40 % bis 128 %). In einer klinischen Folgestudie mit 8 gesunden männlichen Probanden konnte diese Wirkung durch eine reduzierte Dosierung und/oder Häufigkeit von Voriconazol und Fluconazol nicht beseitigt oder verringert werden. Die gleichzeitige Anwendung von Voriconazol und Fluconazol wird in keiner Dosis empfohlen. Eine engmaschige Überwachung auf Nebenwirkungen im Zusammenhang mit Voriconazol wird empfohlen, wenn Voriconazol nacheinander nach Fluconazol angewendet wird, insbesondere innerhalb von 24 Stunden nach der letzten Fluconazol-Dosis. (Sehen VORSICHTSMASSNAHMEN .)
Tofacitinib
Die gleichzeitige Anwendung von Fluconazol (400 mg an Tag 1 und 200 mg einmal täglich für 6 Tage [Tage 2–7]) und Tofacitinib (30 mg Einzeldosis an Tag 5) bei gesunden Probanden führte zu erhöhten mittleren AUC- und Cmax-Werten von Tofacitinib von etwa 79 % (90 % KI: 64 % bis 96 %) bzw. 27 % (90 % KI: 12 % bis 44 %) im Vergleich zur Gabe von Tofacitinib allein. (Sehen VORSICHTSMASSNAHMEN .)
Mikrobiologie
Wirkmechanismus
Fluconazol ist ein hochselektiver Hemmer des Cytochrom-P450-abhängigen Enzyms Lanosterol 14-α-Demethylase aus Pilzen. Dieses Enzym wandelt Lanosterin in Ergosterin um. Der anschließende Verlust normaler Sterole korreliert mit der Akkumulation von 14-α-Methylsterolen in Pilzen und kann für die fungistatische Aktivität von Fluconazol verantwortlich sein. Die Demethylierung von Säugetierzellen ist viel weniger empfindlich gegenüber einer Hemmung durch Fluconazol.
Widerstand
Ein Potenzial für die Entwicklung einer Resistenz gegen Fluconazol ist bekannt. Pilzisolate, die eine verringerte Empfindlichkeit gegenüber anderen Azolen aufweisen, können auch eine verringerte Empfindlichkeit gegenüber Fluconazol aufweisen. Die Häufigkeit der Arzneimittelresistenzentwicklung für die verschiedenen Pilze, für die dieses Arzneimittel indiziert ist, ist nicht bekannt.
Eine Fluconazol-Resistenz kann aus einer Veränderung der Qualität oder Quantität des Zielenzyms (Lanosterol-14-α-Demethylase), einem eingeschränkten Zugang zum Wirkstoffziel oder einer Kombination dieser Mechanismen resultieren.
Punktmutationen im Gen (ERG11), das für das Zielenzym kodiert, führen zu einem veränderten Ziel mit verringerter Affinität für Azole. Die Überexpression von ERG11 führt zur Produktion hoher Konzentrationen des Zielenzyms, wodurch höhere intrazelluläre Wirkstoffkonzentrationen erforderlich werden, um alle Enzymmoleküle in der Zelle zu hemmen.
Der zweite Hauptmechanismus der Arzneimittelresistenz umfasst den aktiven Ausfluss von Fluconazol aus der Zelle durch die Aktivierung von zwei Arten von Multidrug-Efflux-Transportern; die Hauptfacilitatoren (kodiert durch MDR-Gene) und diejenigen der ATP-bindenden Kassetten-Superfamilie (kodiert durch CDR-Gene). Eine Hochregulierung des MDR-Gens führt zu einer Fluconazol-Resistenz, während eine Hochregulierung von CDR-Genen zu einer Resistenz gegen mehrere Azole führen kann.
Die Resistenz bei Candida glabrata beinhaltet normalerweise eine Hochregulierung von CDR-Genen, was zu einer Resistenz gegen mehrere Azole führt. Für ein Isolat, bei dem die minimale Hemmkonzentration (MHK) als mittel eingestuft ist (16 bis 32 µg/ml), wird die höchste Fluconazol-Dosis empfohlen.
Candida krusei sollte als resistent gegen Fluconazol betrachtet werden. Die Resistenz bei C. krusei scheint durch eine verringerte Empfindlichkeit des Zielenzyms gegenüber einer Hemmung durch das Mittel vermittelt zu werden.
Es liegen Fälle von Superinfektionen mit anderen Candida-Spezies als C. albicans vor, die häufig von Natur aus nicht empfindlich auf DIFLUCAN reagieren (z. B. Candida krusei). Solche Fälle können eine alternative antimykotische Therapie erfordern.
Antimikrobielle Aktivität
Es wurde gezeigt, dass Fluconazol gegen die meisten Isolate der folgenden Mikroorganismen aktiv ist sowohl in vitro als auch bei klinischen Infektionen.
Candida albicans Candida glabrata (Viele Isolate sind intermediär anfällig) Candida parapsilosis Candida tropicalis Cryptococcus neoformans
Die folgenden In-vitro-Daten sind verfügbar, aber ihre klinische Bedeutung ist unbekannt. Mindestens 90 % der folgenden Pilze weisen eine In-vitro-MHK auf, die kleiner oder gleich dem Empfindlichkeitsgrenzwert für Fluconazol (https://www.fda.gov/STIC) gegenüber Isolaten ähnlicher Gattungen oder Organismengruppen ist. Die Wirksamkeit von Fluconazol bei der Behandlung klinischer Infektionen durch diese Pilze wurde jedoch nicht in angemessenen und gut kontrollierten klinischen Studien nachgewiesen.
Candida dubliniensis Candida guilliermondii Candida kefyr Candida lusitaniae
Candida krusei sollte als resistent gegen Fluconazol betrachtet werden. Die Resistenz bei C. krusei scheint durch eine verringerte Empfindlichkeit des Zielenzyms gegenüber einer Hemmung durch das Mittel vermittelt zu werden.
Es liegen Fälle von Superinfektionen mit anderen Candida-Spezies als C. albicans vor, die häufig von Natur aus nicht empfindlich auf DIFLUCAN reagieren (z. B. Candida krusei). Solche Fälle können eine alternative antimykotische Therapie erfordern.
Empfindlichkeitsprüfung
Spezifische Informationen zu den Interpretationskriterien von Empfindlichkeitstests und zugehörigen Testmethoden und Qualitätskontrollstandards, die von der FDA für dieses Medikament anerkannt sind, finden Sie unter: https://www.fda.gov/STIC.
Klinische Studien
Kryptokokken-Meningitis
In einer multizentrischen Studie zum Vergleich von DIFLUCAN (200 mg/Tag) mit Amphotericin B (0,3 mg/kg/Tag) zur Behandlung von Kryptokokken-Meningitis bei Patienten mit AIDS ergab eine multivariate Analyse drei Vorbehandlungsfaktoren, die den Tod während des Therapieverlaufs vorhersagten: anormal Geisteszustand, Kryptokokken-Antigen-Titer der Zerebrospinalflüssigkeit größer als 1:1024 und Anzahl der weißen Blutkörperchen der Zerebrospinalflüssigkeit von weniger als 20 Zellen/mm³. Die Sterblichkeit unter Hochrisikopatienten betrug 33 % bzw. 40 % bei Amphotericin-B- und DIFLUCAN-Patienten (p = 0,58), mit einer Gesamttodesrate von 14 % (9 von 63 Patienten) und 18 % (24 von 131 Patienten) für die beiden Arme von der Studie (p=0,48). Optimale Dosierungen und Behandlungsschemata für Patienten mit akuter Kryptokokken-Meningitis und einem hohen Risiko für ein Therapieversagen müssen noch ermittelt werden. (Saag, et al. N. Engl. J. Med. 1992; 326:83-9.)
Vaginale Candidose
In den USA wurden zwei angemessene und gut kontrollierte Studien mit der 150-mg-Tablette durchgeführt. In beiden Fällen waren die Ergebnisse der Fluconazol-Behandlung mit der Kontrollbehandlung (Clotrimazol oder Miconazol intravaginal für 7 Tage) sowohl klinisch als auch statistisch bei der Bewertung nach einem Monat nach der Behandlung vergleichbar.
Die therapeutische Heilungsrate, definiert als vollständiges Verschwinden der Anzeichen und Symptome einer vaginalen Candidiasis (klinische Heilung), zusammen mit einer negativen KOH-Untersuchung und einer negativen Candida-Kultur (mikrobiologische Eradikation), betrug 55 % sowohl in der Fluconazol-Gruppe als auch bei den Vaginalprodukten Gruppe.
Ungefähr drei Viertel der eingeschlossenen Patientinnen hatten eine akute Vaginitis (
In der Fluconazol-Gruppe wurden wesentlich mehr gastrointestinale Ereignisse gemeldet als in der Vaginalprodukt-Gruppe. Die meisten Ereignisse waren leicht bis mittelschwer. Da Fluconazol als Einzeldosis verabreicht wurde, traten keine Behandlungsabbrüche auf.
Pädiatrische Studien
Oropharyngeale Candidiasis
Es wurde eine offene, vergleichende Studie zur Wirksamkeit und Sicherheit von DIFLUCAN (2 bis 3 mg/kg/Tag) und oralem Nystatin (400.000 IE 4-mal täglich) bei immungeschwächten Kindern mit oropharyngealer Candidiasis durchgeführt. Die klinischen und mykologischen Ansprechraten waren bei den mit Fluconazol behandelten Kindern höher.
Eine klinische Heilung am Ende der Behandlung wurde für 86 % der mit Fluconazol behandelten Patienten im Vergleich zu 46 % der mit Nystatin behandelten Patienten berichtet. Mykologisch wurde bei 76 % der mit Fluconazol behandelten Patienten der infektiöse Organismus ausgerottet, verglichen mit 11 % bei den mit Nystatin behandelten Patienten.
Der Anteil der Patienten mit einem klinischen Rückfall 2 Wochen nach Behandlungsende betrug 14 % bei den mit DIFLUCAN behandelten Patienten und 16 % bei den mit Nystatin behandelten Patienten. 4 Wochen nach Behandlungsende betrug der Prozentsatz der Patienten mit klinischem Rückfall 22 % für DIFLUCAN 150 mg und 23 % für Nystatin.
INFORMATIONEN ZUM PATIENTEN
DIFLUCAN® (Farbstoff-FLEW-kan) (Fluconazol) Tabletten
Diese Packungsbeilage enthält wichtige Informationen über DIFLUCAN. Sie soll die Anweisungen Ihres medizinischen Betreuers nicht ersetzen. Lesen Sie diese Informationen sorgfältig durch, bevor Sie DIFLUCAN einnehmen. Fragen Sie Ihren Arzt, wenn Sie eine dieser Informationen nicht verstehen oder wenn Sie mehr über DIFLUCAN wissen möchten.
Was ist DIFLUCAN 100 mg?
DIFLUCAN ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von vaginalen Hefeinfektionen, die durch einen Hefepilz namens Candida verursacht werden. DIFLUCAN 150 mg hilft, das Wachstum von zu viel Hefe in der Vagina zu stoppen, damit die Hefeinfektion verschwindet.
DIFLUCAN 150 mg unterscheidet sich von anderen Behandlungen für vaginale Hefeinfektionen, da es eine Tablette ist, die oral eingenommen wird. DIFLUCAN wird auch bei anderen Erkrankungen eingesetzt. In dieser Packungsbeilage geht es jedoch nur um die Anwendung von DIFLUCAN 50 mg bei vaginalen Hefeinfektionen. Informationen zur Verwendung von DIFLUCAN 200 mg aus anderen Gründen erhalten Sie von Ihrem Arzt. Informationen zu vaginalen Hefepilzinfektionen finden Sie im Abschnitt dieser Packungsbeilage.
Was ist eine vaginale Hefeinfektion?
Es ist normal, dass sich eine gewisse Menge Hefe in der Scheide befindet. Manchmal beginnt zu viel Hefe in der Vagina zu wachsen und dies kann eine Hefeinfektion verursachen. Vaginale Hefeinfektionen sind häufig. Etwa drei von vier erwachsenen Frauen haben im Laufe ihres Lebens mindestens eine vaginale Hefeinfektion.
Einige Medikamente und medizinische Bedingungen können Ihre Wahrscheinlichkeit erhöhen, eine Hefeinfektion zu bekommen. Wenn Sie schwanger sind, Diabetes haben, Antibabypillen verwenden oder Antibiotika einnehmen, können Sie häufiger Hefeinfektionen bekommen als andere Frauen. Persönliche Hygiene und bestimmte Arten von Kleidung können Ihre Chancen auf eine Hefeinfektion erhöhen. Fragen Sie Ihren Arzt nach Tipps, was Sie tun können, um vaginalen Hefepilzinfektionen vorzubeugen. Wenn Sie eine vaginale Hefeinfektion bekommen, können Sie eines der folgenden Symptome haben:
Nehmen Sie DIFLUCAN nicht ein, wenn Sie
Bevor Sie DIFLUCAN einnehmen, informieren Sie Ihren Arzt über alle Ihre Erkrankungen, wenn Sie:
Bevor Sie mit der Einnahme von DIFLUCAN beginnen, informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen. Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Da es viele Markennamen für diese Arzneimittel gibt, wenden Sie sich bei Fragen an Ihren Arzt oder Apotheker.
Wie soll ich DIFLUCAN einnehmen?
Was sollte ich während der Einnahme von DIFLUCAN 150 mg vermeiden?
DIFLUCAN kann Schwindel und Krampfanfälle verursachen. Führen Sie kein Fahrzeug und bedienen Sie keine Maschinen, bis Sie wissen, wie sich DIFLUCAN auf Sie auswirkt.
Welche Nebenwirkungen kann DIFLUCAN 150 mg haben?
DIFLUCAN 50 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Zu den häufigsten Nebenwirkungen von DIFLUCAN 200 mg gehören:
Andere Nebenwirkungen sind:
Dies sind nicht alle möglichen Nebenwirkungen von DIFLUCAN.
Rufen Sie Ihren Arzt an, um medizinischen Rat zu Nebenwirkungen zu erhalten. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist DIFLUCAN aufzubewahren?
Lagern Sie DIFLUCAN-Tabletten unter 30 °C (86 °F).
Bewahren Sie DIFLUCAN 50 mg und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von DIFLUCAN.
Arzneimittel werden manchmal zu anderen als den in der Packungsbeilage aufgeführten Zwecken verschrieben. Verwenden Sie DIFLUCAN 50 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie DIFLUCAN nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden. Sie können Ihren Arzt um Informationen zu DIFLUCAN 200 mg bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Welche Inhaltsstoffe enthält DIFLUCAN 150 mg?
Wirkstoff: Fluconazol
Inaktive Zutaten: mikrokristalline Zellulose, wasserfreies dibasisches Calciumphosphat, Povidon, Croscarmellose-Natrium, FD&C Red Nr. 40 Aluminiumfarbstoff und Magnesiumstearat.
Diese Patienteninformation wurde von der US Food and Drug Administration genehmigt