Fosamax 35mg, 70mg Alendronate Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Fosamax 70 mg und wie wird es angewendet?
Fosamax 35 mg ist ein verschreibungspflichtiges Arzneimittel zur Vorbeugung und Behandlung bestimmter Arten von Knochenschwund (Osteoporose) bei Erwachsenen. Fosamax 70 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Fosamax ist ein Calciumstoffwechsel-Modifikator, Bisphosphonat-Derivate.
Es ist nicht bekannt, ob Fosamax bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Fosamax haben?
Fosamax kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Fosamax gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Fosamax. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
FOSAMAX (Alendronat-Natrium) ist ein Bisphosphonat, das als spezifischer Inhibitor der Osteoklasten-vermittelten Knochenresorption wirkt. Bisphosphonate sind synthetische Analoga von Pyrophosphat, die an das im Knochen vorkommende Hydroxyapatit binden.
Alendronat-Natrium wird chemisch als (4-Amino-1-hydroxybutyliden)-bisphosphonsäure-Mononatriumsalz-Trihydrat beschrieben.
Die empirische Formel von Alendronatnatrium ist C4H12NNaO7P2·3H2O und sein Formelgewicht ist 325,12. Die Strukturformel lautet:
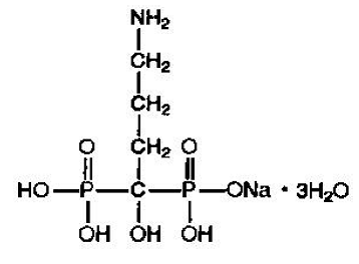
Alendronat-Natrium ist ein weißes, kristallines, nicht hygroskopisches Pulver. Es ist wasserlöslich, sehr wenig löslich in Alkohol und praktisch unlöslich in Chloroform.
FOSAMAX 70 mg Tabletten zur oralen Verabreichung enthalten 91,37 mg Alendronat-Mononatriumsalz-Trihydrat, was dem molaren Äquivalent von 70 mg freier Säure entspricht, und die folgenden Hilfsstoffe: mikrokristalline Cellulose, wasserfreie Lactose, Croscarmellose-Natrium und Magnesiumstearat.
INDIKATIONEN
Treatment® Of Osteoporose In Postmenopausal Women
FOSAMAX ist zur Behandlung von Osteoporose bei postmenopausalen Frauen indiziert. Bei postmenopausalen Frauen erhöht FOSAMAX 70 mg die Knochenmasse und verringert die Häufigkeit von Frakturen, einschließlich Hüft- und Wirbelsäulenfrakturen (Wirbelkompressionsfrakturen). [Sehen Klinische Studien ]
Prävention von Osteoporose bei postmenopausalen Frauen
FOSAMAX 70 mg ist angezeigt zur Vorbeugung von postmenopausaler Osteoporose [siehe Klinische Studien ].
Behandlung zur Erhöhung der Knochenmasse bei Männern mit Osteoporose
FOSAMAX ist indiziert zur Behandlung zur Erhöhung der Knochenmasse bei Männern mit Osteoporose [siehe Klinische Studien ].
Behandlung von Glucocorticoid-induzierter Osteoporose
FOSAMAX ist indiziert zur Behandlung von Glucocorticoid-induzierter Osteoporose bei Männern und Frauen, die Glucocorticoide in einer Tagesdosis erhalten, die 7,5 mg Prednison oder mehr entspricht, und die eine niedrige Knochenmineraldichte haben [siehe Klinische Studien ].
Behandlung der Paget-Knochenkrankheit
FOSAMAX 35 mg ist angezeigt zur Behandlung der Paget-Knochenkrankheit bei Männern und Frauen. Die Behandlung ist indiziert bei Patienten mit Morbus Paget des Knochens, deren alkalische Phosphatase mindestens das Zweifache der oberen Normgrenze beträgt, oder bei Patienten, die symptomatisch sind, oder bei Patienten, bei denen ein Risiko für zukünftige Komplikationen aufgrund ihrer Krankheit besteht. [Sehen Klinische Studien ]
Wichtige Nutzungsbeschränkungen
Die optimale Anwendungsdauer wurde nicht bestimmt. Die Sicherheit und Wirksamkeit von FOSAMAX zur Behandlung von Osteoporose basieren auf klinischen Daten über einen Zeitraum von vier Jahren. Bei allen Patienten unter Bisphosphonattherapie sollte die Notwendigkeit einer Fortsetzung der Therapie regelmäßig überprüft werden. Bei Patienten mit geringem Frakturrisiko sollte nach 3 bis 5 Jahren der Anwendung ein Absetzen des Arzneimittels in Erwägung gezogen werden. Bei Patienten, die die Therapie abbrechen, sollte das Frakturrisiko regelmäßig neu bewertet werden.
DOSIERUNG UND ANWENDUNG
Obwohl Alendronat-Tabletten mit 5 mg, 10 mg, 35 mg und 40 mg auf dem Markt erhältlich sind, wird FOSAMAX 35 mg nicht mehr in den Stärken 5 mg, 10 mg, 35 mg und 40 mg vermarktet.
Obwohl eine Lösung zum Einnehmen von Alendronat möglicherweise auf dem Markt erhältlich ist, wird FOSAMAX 35 mg Lösung zum Einnehmen nicht mehr vermarktet.
Behandlung von Osteoporose bei postmenopausalen Frauen
Die empfohlene Dosierung beträgt:
Prävention von Osteoporose bei postmenopausalen Frauen
Die empfohlene Dosierung beträgt:
Behandlung zur Erhöhung der Knochenmasse bei Männern mit Osteoporose
Die empfohlene Dosierung beträgt:
Behandlung von Glucocorticoid-induzierter Osteoporose
Die empfohlene Dosierung beträgt eine 5-mg-Tablette einmal täglich, mit Ausnahme von postmenopausalen Frauen, die kein Östrogen erhalten, für die die empfohlene Dosierung eine 10-mg-Tablette einmal täglich beträgt.
Behandlung der Paget-Knochenkrankheit
Das empfohlene Behandlungsschema beträgt 40 mg einmal täglich für sechs Monate.
Wiederbehandlung der Paget-Krankheit
Eine erneute Behandlung mit FOSAMAX 35 mg kann nach einer sechsmonatigen Bewertungsphase nach der Behandlung bei Patienten mit Rückfall in Betracht gezogen werden, basierend auf Anstiegen der alkalischen Phosphatase im Serum, die regelmäßig gemessen werden sollte. Eine erneute Behandlung kann auch bei Patienten in Betracht gezogen werden, die ihre alkalische Phosphatase im Serum nicht normalisieren konnten.
Wichtige Verwaltungsanweisungen
Weisen Sie die Patienten an, Folgendes zu tun:
Empfehlungen für die Supplementierung von Kalzium und Vitamin D
Weisen Sie die Patienten an, zusätzliches Kalzium einzunehmen, wenn die Nahrungsaufnahme unzureichend ist [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Patienten mit erhöhtem Risiko für Vitamin-D-Insuffizienz (z. B. über 70 Jahre alt, Pflegeheimgebunden oder chronisch krank) benötigen möglicherweise eine Vitamin-D-Ergänzung. Patienten mit gastrointestinalen Malabsorptionssyndromen benötigen möglicherweise höhere Vitamin-D-Dosen, und die Messung von 25-Hydroxyvitamin D sollte in Betracht gezogen werden.
Patienten, die mit Glukokortikoiden behandelt werden, sollten ausreichende Mengen an Calcium und Vitamin D erhalten.
Verabreichungsanweisungen für vergessene Dosen
Wenn eine einmal wöchentliche Dosis von FOSAMAX vergessen wird, weisen Sie die Patienten an, eine Dosis am Morgen einzunehmen, nachdem sie sich daran erinnern. Sie sollten nicht zwei Dosen am selben Tag einnehmen, sondern wieder einmal wöchentlich eine Dosis einnehmen, wie ursprünglich geplant an dem von ihnen gewählten Tag.
WIE GELIEFERT
Darreichungsformen und Stärken
Lagerung und Handhabung
Nr. 3814 – FOSAMAX Tabletten, 70 mg, sind weiße, ovale, unbeschichtete Tabletten mit dem Code 31 auf einer Seite und dem Umriss eines Knochenbildes auf der anderen Seite:
NDC 0006-0031-44 Gebrauchseinheit Blisterpackung zu 4 Stück.
Lagerung
FOSAMAX-Tabletten
In einem gut verschlossenen Behälter bei Raumtemperatur, 15-30°C (59-86°F) lagern.
Vertrieb durch: Merck Sharp & Dohme Corp., eine Tochtergesellschaft von MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Überarbeitet: August 2019
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Behandlung von Osteoporose bei postmenopausalen Frauen
Tägliche Dosierung
Die Sicherheit von FOSAMAX 35 mg bei der Behandlung von postmenopausaler Osteoporose wurde in vier klinischen Studien bewertet, an denen 7453 Frauen im Alter von 44 bis 84 Jahren teilnahmen. Studie 1 und Studie 2 waren identisch konzipierte, dreijährige, placebokontrollierte, doppelblinde, multizentrische Studien (Vereinigte Staaten und multinationale Unternehmen n=994); Studie 3 war die dreijährige Wirbelfraktur-Kohorte der Fracture Intervention Trial [FIT] (n=2027) und Studie 4 war die vierjährige klinische Fraktur-Kohorte der FIT (n=4432). Insgesamt wurden 3620 Patienten mit Placebo und 3432 Patienten mit FOSAMAX behandelt. Patienten mit vorbestehender Magen-Darm-Erkrankung und gleichzeitiger Anwendung von nicht-steroidalen entzündungshemmenden Arzneimitteln wurden in diese klinischen Studien eingeschlossen. In Studie 1 und Studie 2 erhielten alle Frauen 500 mg elementares Calcium als Carbonat. In Studie 3 und Studie 4 erhielten alle Frauen mit einer diätetischen Kalziumaufnahme von weniger als 1000 mg pro Tag 500 mg Kalzium und 250 Internationale Einheiten Vitamin D pro Tag.
Bei den Patienten, die in Studie 1 und Studie 2 mit Alendronat 10 mg oder Placebo behandelt wurden, und bei allen Patienten in Studie 3 und Studie 4 betrug die Inzidenz der Gesamtmortalität 1,8 % in der Placebogruppe und 1,8 % in der FOSAMAX 35 mg-Gruppe. Die Inzidenz schwerwiegender unerwünschter Ereignisse betrug 30,7 % in der Placebogruppe und 30,9 % in der FOSAMAX-Gruppe. Der Prozentsatz der Patienten, die die Studie aufgrund eines klinischen unerwünschten Ereignisses abbrachen, betrug 9,5 % in der Placebogruppe und 8,9 % in der FOSAMAX 70 mg-Gruppe. Nebenwirkungen aus diesen Studien, die von den Prüfärzten bei mindestens 1 % der Patienten, die entweder mit FOSAMAX 35 mg oder Placebo behandelt wurden, als möglicherweise, wahrscheinlich oder definitiv mit dem Arzneimittel in Zusammenhang stehend eingestuft wurden, sind in Tabelle 1 aufgeführt.
Hautausschlag und Erythem sind aufgetreten.
Magen-Darm-Nebenwirkungen
Ein mit FOSAMAX (10 mg/Tag) behandelter Patient, der an Magengeschwüren und Gastrektomien in der Vorgeschichte litt und gleichzeitig Aspirin einnahm, entwickelte ein Anastomosengeschwür mit leichter Blutung, das als arzneimittelbedingt angesehen wurde. Aspirin und FOSAMAX wurden abgesetzt und der Patient erholte sich. In den Populationen von Studie 1 und Studie 2 hatten 49–54 % zu Studienbeginn eine Vorgeschichte von gastrointestinalen Störungen und 54–89 % verwendeten zu irgendeinem Zeitpunkt während der Studien nichtsteroidale entzündungshemmende Arzneimittel oder Aspirin. [Sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Labortestbefunde
In doppelblinden, multizentrischen, kontrollierten Studien wurden bei ungefähr 18 % bzw. 10 % der Patienten, die FOSAMAX einnahmen, asymptomatische, leichte und vorübergehende Abnahmen des Serumkalziums und -phosphats beobachtet, im Vergleich zu ungefähr 12 % bzw. 3 % der Patienten, die Placebo einnahmen. Die Häufigkeit von Abnahmen des Serumcalciums auf weniger als 8,0 mg/dl (2,0 mM) und des Serumphosphats auf weniger als oder gleich 2,0 mg/dl (0,65 mM) war jedoch in beiden Behandlungsgruppen ähnlich.
Wöchentliche Dosierung
Die Sicherheit von FOSAMAX 70 mg einmal wöchentlich zur Behandlung von postmenopausaler Osteoporose wurde in einer einjährigen, doppelblinden, multizentrischen Studie bewertet, in der FOSAMAX 70 mg einmal wöchentlich und FOSAMAX 10 mg täglich verglichen wurden. Die allgemeinen Sicherheits- und Verträglichkeitsprofile von FOSAMAX 70 mg einmal wöchentlich und FOSAMAX 10 mg täglich waren ähnlich. Die Nebenwirkungen, die von den Prüfärzten bei mindestens 1 % der Patienten in beiden Behandlungsgruppen als möglicherweise, wahrscheinlich oder definitiv medikamentenbedingt eingestuft wurden, sind in Tabelle 2 aufgeführt.
Prävention von Osteoporose bei postmenopausalen Frauen
Tägliche Dosierung
Die Sicherheit von FOSAMAX 5 mg/Tag bei postmenopausalen Frauen im Alter von 40 bis 60 Jahren wurde in drei doppelblinden, placebokontrollierten Studien mit über 1.400 Patientinnen untersucht, die randomisiert entweder zwei oder drei Jahre lang FOSAMAX erhielten. In diesen Studien waren die allgemeinen Sicherheitsprofile von FOSAMAX 5 mg/Tag und Placebo ähnlich. Bei 7,5 % der 642 mit FOSAMAX 5 mg/Tag behandelten Patienten und bei 5,7 % der 648 mit Placebo behandelten Patienten kam es zu einem Abbruch der Therapie aufgrund von klinischen Nebenwirkungen.
Wöchentliche Dosierung
Die Sicherheit von FOSAMAX 35 mg einmal wöchentlich im Vergleich zu FOSAMAX 5 mg täglich wurde in einer einjährigen, doppelblinden, multizentrischen Studie mit 723 Patienten untersucht. Die allgemeinen Sicherheits- und Verträglichkeitsprofile von FOSAMAX 35 mg einmal wöchentlich und FOSAMAX 5 mg täglich waren ähnlich.
Die Nebenwirkungen aus diesen Studien, die von den Prüfärzten bei mindestens 1 % der Patienten, die entweder einmal wöchentlich mit FOSAMAX 35 mg, FOSAMAX 5 mg/Tag oder Placebo behandelt wurden, als möglicherweise, wahrscheinlich oder definitiv medikamentenbedingt eingestuft wurden, sind in Tabelle 3 aufgeführt .
Gleichzeitige Anwendung mit einer Östrogen-/Hormonersatztherapie
In zwei Studien (mit einer Dauer von einem und zwei Jahren) mit postmenopausalen Frauen mit Osteoporose (insgesamt: n = 853) war das Sicherheits- und Verträglichkeitsprofil der kombinierten Behandlung mit FOSAMAX 10 mg einmal täglich und Östrogen ± Gestagen (n = 354). mit denen der einzelnen Behandlungen übereinstimmen.
Osteoporose bei Männern
In zwei placebokontrollierten, doppelblinden, multizentrischen Studien bei Männern (eine zweijährige Studie mit FOSAMAX 10 mg/Tag und eine einjährige Studie mit einmal wöchentlich FOSAMAX 70 mg) wurde die Rate der Therapieabbrüche aufgrund von klinischen Nebenwirkungen erhöht Ereignisse waren 2,7 % für FOSAMAX 10 mg/Tag vs. 10,5 % für Placebo und 6,4 % für FOSAMAX 70 mg einmal wöchentlich vs. 8,6 % für Placebo. Die Nebenwirkungen, die von den Prüfärzten bei mindestens 2 % der Patienten, die entweder mit FOSAMAX 70 mg oder Placebo behandelt wurden, als möglicherweise, wahrscheinlich oder definitiv medikamentenbedingt eingestuft wurden, sind in Tabelle 4 aufgeführt.
Glucocorticoid-induzierte Osteoporose
In zwei einjährigen, placebokontrollierten, doppelblinden, multizentrischen Studien an Patienten, die eine Glukokortikoidbehandlung erhielten, waren die allgemeinen Sicherheits- und Verträglichkeitsprofile von FOSAMAX 5 und 10 mg/Tag im Allgemeinen ähnlich denen von Placebo. Die Nebenwirkungen, die von den Prüfärzten bei mindestens 1 % der Patienten, die entweder mit FOSAMAX 5 oder 10 mg/Tag oder mit Placebo behandelt wurden, als möglicherweise, wahrscheinlich oder definitiv medikamentenbedingt eingestuft wurden, sind in Tabelle 5 aufgeführt.
Das allgemeine Sicherheits- und Verträglichkeitsprofil in der Glucocorticoid-induzierten Osteoporose-Population, die die Therapie im zweiten Jahr der Studien fortsetzte (FOSAMAX: n = 147), stimmte mit dem im ersten Jahr beobachteten überein.
Morbus Paget des Knochens
In klinischen Studien (Osteoporose und Paget-Krankheit) waren die Nebenwirkungen, die bei 175 Patientinnen berichtet wurden, die FOSAMAX 40 mg/Tag für 3-12 Monate einnahmen, ähnlich denen bei postmenopausalen Frauen, die mit FOSAMAX 10 mg/Tag behandelt wurden. Bei Patienten, die FOSAMAX 40 mg/Tag einnahmen (17,7 % FOSAMAX vs. 10,2 % Placebo), traten jedoch offensichtlich vermehrt Nebenwirkungen im oberen Gastrointestinaltrakt auf. Ein Fall von Ösophagitis und zwei Fälle von Gastritis führten zum Abbruch der Behandlung.
Darüber hinaus wurden muskuloskelettale (Knochen-, Muskel- oder Gelenk-)Schmerzen, die bei mit anderen Bisphosphonaten behandelten Patienten mit Morbus Paget beschrieben wurden, von den Prüfärzten bei etwa 6 % der Patienten als möglicherweise, wahrscheinlich oder definitiv arzneimittelbedingt erachtet die mit FOSAMAX 40 mg/Tag behandelt wurden, verglichen mit etwa 1 % der mit Placebo behandelten Patienten, führten jedoch selten zu einem Therapieabbruch. Bei 6,4 % der mit FOSAMAX 40 mg/Tag behandelten Patienten mit Morbus Paget und bei 2,4 % der mit Placebo behandelten Patienten kam es zu einem Therapieabbruch aufgrund von klinischen Nebenwirkungen.
Post-Marketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von FOSAMAX nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Körper als Ganzes: Überempfindlichkeitsreaktionen einschließlich Urtikaria und Angioödem. Vorübergehende Symptome von Myalgie, Unwohlsein, Asthenie und Fieber wurden unter FOSAMAX berichtet, typischerweise im Zusammenhang mit dem Beginn der Behandlung. Es ist eine symptomatische Hypokalzämie aufgetreten, im Allgemeinen in Verbindung mit prädisponierenden Zuständen. Periphere Ödeme.
Magen-Darm: Ösophagitis, Ösophaguserosionen, Ösophagusgeschwüre, Ösophagusstriktur oder -perforation und oropharyngeale Ulzeration. Magen- oder Zwölffingerdarmgeschwüre, einige davon schwer und mit Komplikationen, wurden ebenfalls berichtet [siehe DOSIERUNG UND ANWENDUNG ; WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Lokalisierte Osteonekrose des Kiefers, im Allgemeinen verbunden mit Zahnextraktion und/oder lokaler Infektion mit verzögerter Heilung, wurde berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Bewegungsapparat: Knochen-, Gelenk- und/oder Muskelschmerzen, gelegentlich schwer und handlungsunfähig [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]; Gelenkschwellung; Niedrigenergie-Femurschaft und subtrochantäre Frakturen [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nervöses System: Schwindel und Schwindel.
Lungen: akute Asthma-Exazerbationen.
Haut: Hautausschlag (gelegentlich mit Lichtempfindlichkeit), Juckreiz, Alopezie, schwere Hautreaktionen, einschließlich Stevens-Johnson-Syndrom und toxische epidermale Nekrolyse.
Besondere Sinne: Uveitis, Skleritis oder Episkleritis. Cholesteatom des äußeren Gehörgangs (fokale Osteonekrose).
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Kalziumergänzungen/Antazida
Die gleichzeitige Verabreichung von FOSAMAX und Kalzium, Antazida oder oralen Medikamenten, die mehrwertige Kationen enthalten, wird die Resorption von FOSAMAX beeinträchtigen. Weisen Sie die Patienten daher an, mindestens eine halbe Stunde nach der Einnahme von FOSAMAX 35 mg zu warten, bevor Sie andere orale Medikamente einnehmen.
Aspirin
In klinischen Studien war die Inzidenz von unerwünschten Ereignissen im oberen Gastrointestinaltrakt bei Patienten erhöht, die eine Begleittherapie mit Tagesdosen von 35 mg FOSAMAX von mehr als 10 mg und aspirinhaltigen Produkten erhielten.
Nicht-steroidale entzündungshemmende Medikamente
FOSAMAX 35 mg kann Patienten verabreicht werden, die nichtsteroidale Antiphlogistika (NSAIDs) einnehmen. In einer 3-jährigen, kontrollierten klinischen Studie (n=2027), in der die Mehrheit der Patienten gleichzeitig NSAIDs erhielt, war die Inzidenz von unerwünschten Ereignissen im oberen Gastrointestinaltrakt bei Patienten, die FOSAMAX 5 oder 10 mg/Tag einnahmen, ähnlich wie bei Patienten, die Placebo einnahmen. Da die Anwendung von NSAR jedoch mit Magen-Darm-Reizungen einhergeht, ist bei gleichzeitiger Anwendung mit FOSAMAX Vorsicht geboten.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Nebenwirkungen im oberen Gastrointestinaltrakt
FOSAMAX 35 mg kann wie andere oral verabreichte Bisphosphonate lokale Reizungen der oberen Magen-Darm-Schleimhaut verursachen. Aufgrund dieser möglichen Reizwirkungen und einer potenziellen Verschlechterung der Grunderkrankung sollte FOSAMAX mit Vorsicht angewendet werden, wenn Patienten mit aktiven Problemen des oberen Gastrointestinaltrakts (wie bekannter Barrett-Ösophagus, Dysphagie, andere Erkrankungen der Speiseröhre, Gastritis, Zwölffingerdarmentzündung oder Geschwüre).
Ösophagus-Nebenwirkungen wie Ösophagitis, Ösophagus-Geschwüre und Ösophagus-Erosionen, gelegentlich mit Blutungen und selten gefolgt von Ösophagusstrikturen oder -perforationen, wurden bei Patienten berichtet, die eine Behandlung mit oralen Bisphosphonaten, einschließlich FOSAMAX, erhielten. In einigen Fällen waren diese schwerwiegend und erforderten einen Krankenhausaufenthalt. Ärzte sollten daher auf alle Anzeichen oder Symptome achten, die auf eine mögliche ösophageale Reaktion hindeuten, und die Patienten sollten angewiesen werden, FOSAMAX 70 mg abzusetzen und einen Arzt aufzusuchen, wenn sie Dysphagie, Odynophagie, retrosternale Schmerzen oder neu auftretendes oder sich verschlimmerndes Sodbrennen entwickeln.
Das Risiko schwerer ösophagealer Nebenwirkungen scheint bei Patienten größer zu sein, die sich nach der Einnahme von oralen Bisphosphonaten, einschließlich FOSAMAX 70 mg, hinlegen und/oder die es versäumen, orale Bisphosphonate, einschließlich FOSAMAX 35 mg, mit dem empfohlenen vollen Glas (6-8 Unzen) Wasser zu schlucken, und /oder die weiterhin orale Bisphosphonate einschließlich FOSAMAX 70 mg einnehmen, nachdem sie Symptome entwickelt haben, die auf eine Reizung der Speiseröhre hindeuten. Daher ist es sehr wichtig, dass dem Patienten die vollständigen Dosierungsanweisungen zur Verfügung gestellt und von ihm verstanden werden [siehe DOSIERUNG UND ANWENDUNG ]. Bei Patienten, die aufgrund einer geistigen Behinderung die Dosierungsanweisungen nicht einhalten können, sollte die Therapie mit FOSAMAX unter angemessener Überwachung erfolgen.
Nach der Markteinführung gab es Berichte über Magen- und Zwölffingerdarmgeschwüre bei der oralen Anwendung von Bisphosphonaten, einige davon schwer und mit Komplikationen, obwohl in kontrollierten klinischen Studien kein erhöhtes Risiko beobachtet wurde [siehe NEBENWIRKUNGEN ].
Mineralstoffwechsel
Hypokalzämie muss korrigiert werden, bevor eine Therapie mit FOSAMAX begonnen wird [siehe KONTRAINDIKATIONEN ]. Auch andere Störungen des Mineralstoffwechsels (z. B. Vitamin-D-Mangel) sollten wirksam behandelt werden. Bei Patienten mit diesen Erkrankungen sollten Serumkalzium und Symptome einer Hypokalzämie während der Therapie mit FOSAMAX überwacht werden.
Vermutlich aufgrund der Wirkung von FOSAMAX auf die Erhöhung des Knochenmineralgehalts kann es zu kleinen, asymptomatischen Abnahmen des Serumkalziums und -phosphats kommen, insbesondere bei Patienten mit Morbus Paget, bei denen die Rate des Knochenumsatzes vor der Behandlung stark erhöht sein kann Patienten, die Glucocorticoide erhalten, bei denen die Calciumresorption verringert sein kann.
Die Sicherstellung einer ausreichenden Calcium- und Vitamin-D-Zufuhr ist besonders wichtig bei Patienten mit Morbus Paget des Knochens und bei Patienten, die Glukokortikoide erhalten.
Muskel-Skelett-Schmerzen
Nach der Markteinführung wurde bei Patienten, die Bisphosphonate einnahmen, die zur Vorbeugung und Behandlung von Osteoporose zugelassen sind, über schwere und gelegentlich handlungsunfähige Knochen-, Gelenk- und/oder Muskelschmerzen berichtet [siehe NEBENWIRKUNGEN ]. Diese Kategorie von Arzneimitteln umfasst FOSAMAX (Alendronat). Die meisten Patienten waren postmenopausale Frauen. Die Zeit bis zum Auftreten der Symptome variierte von einem Tag bis zu mehreren Monaten nach Beginn des Medikaments. Beenden Sie die Anwendung, wenn sich schwere Symptome entwickeln. Bei den meisten Patienten kam es nach dem Absetzen zu einer Linderung der Symptome. Bei einer Untergruppe traten die Symptome erneut auf, wenn sie erneut mit demselben Medikament oder einem anderen Bisphosphonat behandelt wurden.
In placebokontrollierten klinischen Studien mit FOSAMAX war der Prozentsatz der Patienten mit diesen Symptomen in der FOSAMAX 35 mg- und der Placebo-Gruppe ähnlich.
Osteonekrose des Kiefers
Osteonekrose des Kiefers (ONJ), die spontan auftreten kann, ist im Allgemeinen mit einer Zahnextraktion und/oder einer lokalen Infektion mit verzögerter Heilung verbunden und wurde bei Patienten berichtet, die Bisphosphonate, einschließlich FOSAMAX, einnahmen. Bekannte Risikofaktoren für Osteonekrose des Kiefers sind invasive zahnärztliche Eingriffe (z. B. Zahnextraktion, Zahnimplantate, Knochenchirurgie), Krebsdiagnose, begleitende Therapien (z. B. Chemotherapie, Kortikosteroide, Angiogenese-Inhibitoren), schlechte Mundhygiene und Begleiterkrankungen Erkrankungen (z. B. parodontale und/oder andere vorbestehende Zahnerkrankungen, Anämie, Koagulopathie, Infektion, schlecht sitzender Zahnersatz). Das ONJ-Risiko kann mit der Dauer der Exposition gegenüber Bisphosphonaten ansteigen.
Bei Patienten, die invasive Zahnbehandlungen benötigen, kann das Absetzen der Bisphosphonatbehandlung das ONJ-Risiko verringern. Die klinische Beurteilung des behandelnden Arztes und/oder Oralchirurgen sollte den Behandlungsplan für jeden Patienten auf der Grundlage einer individuellen Nutzen-Risiko-Bewertung leiten.
Patienten, die während einer Bisphosphonattherapie eine Osteonekrose des Kiefers entwickeln, sollten von einem Oralchirurgen behandelt werden. Bei diesen Patienten kann eine ausgedehnte zahnärztliche Operation zur Behandlung von ONJ den Zustand verschlimmern. Ein Abbruch der Bisphosphonattherapie sollte auf der Grundlage einer individuellen Nutzen-Risiko-Bewertung in Betracht gezogen werden.
Atypische subtrochantäre und diaphysäre Femurfrakturen
Bei mit Bisphosphonat behandelten Patienten wurde über atypische, Niedrigenergie- oder Niedrigtraumafrakturen des Femurschafts berichtet. Diese Frakturen können überall im Femurschaft auftreten, von direkt unterhalb des kleinen Trochanters bis oberhalb des suprakondylären Fackels, und sind quer oder kurz schräg in der Orientierung ohne Anzeichen einer Zertrümmerung. Kausalität wurde nicht festgestellt, da diese Frakturen auch bei Patienten mit Osteoporose auftreten, die nicht mit Bisphosphonaten behandelt wurden.
Atypische Femurfrakturen treten am häufigsten mit minimalem oder keinem Trauma im betroffenen Bereich auf. Sie können bilateral sein und viele Patienten berichten von prodromalen Schmerzen im betroffenen Bereich, die sich in der Regel als dumpfer, schmerzender Oberschenkelschmerz Wochen bis Monate vor dem Auftreten einer vollständigen Fraktur äußern. Eine Reihe von Berichten weist darauf hin, dass die Patienten zum Zeitpunkt der Fraktur auch mit Glukokortikoiden (z. B. Prednison) behandelt wurden.
Bei jedem Patienten mit einer Vorgeschichte von Bisphosphonat-Exposition, der sich mit Oberschenkel- oder Leistenschmerzen vorstellt, sollte eine atypische Fraktur vermutet und untersucht werden, um eine inkomplette Femurfraktur auszuschließen. Patienten mit einer atypischen Fraktur sollten auch auf Symptome und Anzeichen einer Fraktur in der kontralateralen Extremität untersucht werden. Eine Unterbrechung der Bisphosphonattherapie sollte vorbehaltlich einer Nutzen-Risiko-Abwägung auf individueller Basis in Betracht gezogen werden.
Nierenfunktionsstörung
FOSAMAX 35 mg wird für Patienten mit einer Kreatinin-Clearance von weniger als 35 ml/min nicht empfohlen.
Glucocorticoid-induzierte Osteoporose
Das Nutzen-Risiko-Verhältnis von FOSAMAX zur Behandlung mit Glukokortikoid-Tagesdosen von weniger als 7,5 mg Prednison oder Äquivalent wurde nicht ermittelt [siehe INDIKATIONEN UND VERWENDUNG ]. Vor Beginn der Behandlung sollte der Gonadenhormonstatus sowohl bei Männern als auch bei Frauen festgestellt und ein geeigneter Ersatz in Betracht gezogen werden.
Eine Messung der Knochenmineraldichte sollte zu Beginn der Therapie durchgeführt und nach 6 bis 12 Monaten einer kombinierten Behandlung mit FOSAMAX und Glukokortikoiden wiederholt werden.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente ).
Weisen Sie die Patienten an, den Medikationsleitfaden vor Beginn der Therapie mit FOSAMAX zu lesen und ihn jedes Mal erneut zu lesen, wenn die Verschreibung verlängert wird.
Osteoporose-Empfehlungen, einschließlich Calcium- und Vitamin-D-Supplementierung
Weisen Sie die Patienten an, zusätzliches Calcium und Vitamin D einzunehmen, wenn die tägliche Nahrungsaufnahme unzureichend ist. Gewichtsbelastung sollte zusammen mit der Änderung bestimmter Verhaltensfaktoren, wie Zigarettenrauchen und/oder übermäßiger Alkoholkonsum, in Betracht gezogen werden, wenn diese Faktoren vorhanden sind.
Dosierungsanleitung
Weisen Sie die Patienten darauf hin, dass der erwartete Nutzen von FOSAMAX 70 mg nur erreicht werden kann, wenn es gleich nach dem Aufstehen mindestens 30 Minuten vor den ersten Speisen, Getränken oder Medikamenten des Tages mit klarem Wasser eingenommen wird. Auch die Gabe von Orangensaft oder Kaffee reduziert nachweislich die Resorption von FOSAMAX [vgl KLINISCHE PHARMAKOLOGIE ].
Weisen Sie die Patienten an, die Tablette nicht zu kauen oder zu lutschen, da die Gefahr von oropharyngealen Ulzerationen besteht.
Weisen Sie die Patienten an, jede Tablette FOSAMAX mit einem vollen Glas Wasser (6-8 Unzen) zu schlucken, um die Aufnahme in den Magen zu erleichtern und so das Risiko einer Reizung der Speiseröhre zu verringern. Weisen Sie die Patienten an, nach der Einnahme von FOSAMAX 70 mg Lösung zum Einnehmen mindestens 2 Unzen (eine viertel Tasse) Wasser zu trinken, um die Magenentleerung zu erleichtern.
Weisen Sie die Patienten an, sich mindestens 30 Minuten lang und bis nach der ersten Mahlzeit des Tages nicht hinzulegen.
Weisen Sie die Patienten an, FOSAMAX nicht vor dem Schlafengehen oder vor dem Aufstehen für den Tag einzunehmen. Die Patienten sollten darüber informiert werden, dass die Nichtbeachtung dieser Anweisungen das Risiko für Speiseröhrenprobleme erhöhen kann.
Weisen Sie die Patienten darauf hin, dass sie die Einnahme von FOSAMAX abbrechen und ihren Arzt konsultieren sollten, wenn sie Symptome einer Speiseröhrenerkrankung entwickeln (z. B. Schwierigkeiten oder Schmerzen beim Schlucken, retrosternale Schmerzen oder neu auftretendes oder sich verschlimmerndes Sodbrennen).
Wenn Patienten eine Dosis von FOSAMAX 70 mg einmal wöchentlich vergessen haben, weisen Sie die Patienten an, eine Dosis am Morgen einzunehmen, nachdem sie sich daran erinnern. Sie sollten nicht zwei Dosen am selben Tag einnehmen, sondern wieder einmal wöchentlich eine Dosis einnehmen, wie ursprünglich geplant an dem von ihnen gewählten Tag.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Adenome der Harderschen Drüse (eine retroorbitale Drüse, die beim Menschen nicht vorhanden ist) wurden in einer 92-wöchigen oralen Kanzerogenitätsstudie bei hochdosierten weiblichen Mäusen (p = 0,003) bei Alendronat-Dosen von 1, 3 und 10 mg/kg/ Tag (Männer) oder 1, 2 und 5 mg/kg/Tag (Frauen). Diese Dosen entsprechen ungefähr dem 0,1- bis 1-fachen der höchsten empfohlenen klinischen Tagesdosis von 40 mg, basierend auf der Oberfläche, mg/m². Die Relevanz dieses Befundes für den Menschen ist nicht bekannt.
Adenome parafollikulärer Zellen (Schilddrüse) wurden bei männlichen Hochdosis-Ratten (p = 0,003) in einer 2-jährigen oralen Kanzerogenitätsstudie bei Dosen von 1 und 3,75 mg/kg Körpergewicht erhöht. Diese Dosen entsprechen ungefähr dem 0,3- und 1-fachen der klinischen Tagesdosis von 40 mg, basierend auf der Oberfläche, mg/m². Die Relevanz dieses Befunds für den Menschen ist nicht bekannt.
Alendronat war im In-vitro-Assay zur mikrobiellen Mutagenese mit und ohne metabolische Aktivierung, in einem In-vitro-Mutageneseassay an Säugetierzellen, in einem In-vitro-Assay mit alkalischer Elution an Rattenhepatozyten und in einem In-vivo-Chromosomenaberrationsassay an Mäusen nicht genotoxisch. In einem In-vitro-Chromosomenaberrationstest in Ovarialzellen chinesischer Hamster ergab Alendronat jedoch zweideutige Ergebnisse.
Alendronat hatte keine Auswirkung auf die Fertilität (männlich oder weiblich) bei Ratten in oralen Dosen von bis zu 5 mg/kg/Tag (ungefähr das 1-fache der klinischen Tagesdosis von 40 mg, basierend auf der Oberfläche, mg/m²).
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Die verfügbaren Daten zur Anwendung von FOSAMAX bei schwangeren Frauen reichen nicht aus, um über ein arzneimittelbedingtes Risiko unerwünschter Folgen für Mutter oder Fötus zu informieren. Setzen Sie FOSAMAX 35 mg ab, wenn eine Schwangerschaft erkannt wird.
In Reproduktionsstudien an Tieren zeigte die tägliche orale Verabreichung von Alendronat an Ratten vor der Verpaarung bis zum Ende der Trächtigkeit oder Laktation ein verringertes Überleben nach der Implantation und eine verringerte Körpergewichtszunahme der Jungtiere, beginnend mit Dosen, die weniger als der Hälfte der höchsten empfohlenen klinischen Tagesdosis von 40 mg entsprachen. bezogen auf die Körperoberfläche, mg/m²). Die orale Verabreichung von Alendronat an Ratten während der Organogenese führte zu einer verringerten fötalen Ossifikation, beginnend mit Dosen, die dem Dreifachen der klinischen Tagesdosis von 40 mg entsprachen. Bei trächtigen Kaninchen, denen während der Organogenese Dosen verabreicht wurden, die etwa dem 10-Fachen der klinischen Tagesdosis von 40 mg entsprachen, wurden keine ähnlichen Auswirkungen auf den Fötus beobachtet.
Verzögerte oder ausbleibende Geburt von Nachkommen, verlängerte Geburt und Todesfälle bei Müttern und Föten in der Spätschwangerschaft aufgrund von mütterlicher Hypokalzämie traten bei Ratten bei oralen Dosen von nur einem Zehntel der klinischen Tagesdosis von 40 mg auf (siehe Daten ).
Bisphosphonate werden in die Knochenmatrix eingebaut, aus der sie über Jahre nach und nach freigesetzt werden. Die Menge an Bisphosphonat, die in den Knochen von Erwachsenen eingebaut wird und zur Freisetzung in den systemischen Kreislauf verfügbar ist, steht in direktem Zusammenhang mit der Dosis und Dauer der Anwendung von Bisphosphonat. Folglich besteht aufgrund des Wirkungsmechanismus von Bisphosphonaten ein potenzielles Risiko einer fetalen Schädigung, vorwiegend des Skeletts, wenn eine Frau nach Abschluss einer Bisphosphonattherapie schwanger wird. Der Einfluss von Variablen wie der Zeit zwischen dem Absetzen der Bisphosphonattherapie bis zur Empfängnis, dem jeweils verwendeten Bisphosphonat und dem Verabreichungsweg (intravenös versus oral) auf das Risiko wurde nicht untersucht.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene(n) Population(en) ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere unerwünschte Folgen. In der US-Allgemeinbevölkerung beträgt das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften 2-4 % bzw. 15-20 %.
Daten
Tierdaten
Reproduktionsstudien an Ratten, denen vor der Paarung bis zum Ende der Trächtigkeit oder Laktation eine orale Dosis verabreicht wurde, zeigten ein verringertes Überleben nach der Implantation ab 2 mg/kg/Tag und eine verringerte Körpergewichtszunahme ab 1 mg/kg/Tag, Dosen, die weniger als der Hälfte der 40 entsprechen mg klinische Tagesdosis basierend auf der Körperoberfläche, mg/m². Bei Ratten, denen während der Organogenese eine orale Dosis von 10 mg/kg/Tag (ungefähr das 3-fache der klinischen Tagesdosis von 40 mg) verabreicht wurde, war die Inzidenz einer unvollständigen fötalen Ossifikation in Wirbel-, Schädel- und Sternebralknochen erhöht. Bei trächtigen Kaninchen, denen während der Organogenese bis zu 35 mg/kg/Tag (entsprechend etwa dem 10-Fachen der klinischen Tagesdosis von 40 mg) oral verabreicht wurden, wurden keine ähnlichen Auswirkungen auf den Fötus beobachtet.
Bei trächtigen Ratten, denen 15 mg/kg/Tag Alendronat (etwa das Vierfache der klinischen Tagesdosis von 40 mg) oral verabreicht wurde, nahm sowohl das Gesamt- als auch das ionisierte Calcium ab, was zu Verzögerungen und Fehlgeburten führte. Bei Ratten, die von vor der Paarung bis zur Trächtigkeit mit 0,5 mg/kg/Tag (ungefähr ein Zehntel der klinischen Tagesdosis von 40 mg) behandelt wurden, wurde ein verlängerter Geburtsvorgang aufgrund mütterlicher Hypokalzämie beobachtet. Maternotoxizität (Todesfälle in der Spätschwangerschaft) trat auch bei weiblichen Ratten auf, die oral mit 15 mg/kg/Tag (ungefähr das 4-fache der klinischen Tagesdosis von 40 mg) über unterschiedliche Trächtigkeitsdauern behandelt wurden. Diese mütterlichen Todesfälle wurden durch die Beendigung der Behandlung verringert, aber nicht beseitigt. Eine Kalziumergänzung im Trinkwasser oder durch subkutane Minipumpe an Ratten, die oral mit 15 mg/kg/Tag Alendronat dosiert wurden, konnte die Hypokalzämie nicht verbessern oder die Dystokie-bedingten Todesfälle bei Müttern und Neugeborenen verhindern. Die intravenöse Kalziumergänzung verhinderte jedoch den Tod der Mutter, nicht aber den Tod des Neugeborenen.
Stillzeit
Zusammenfassung der Risiken
Es ist nicht bekannt, ob Alendronat in der Muttermilch vorhanden ist, die Milchbildung beim Menschen beeinflusst oder Auswirkungen auf den gestillten Säugling hat. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an FOSAMAX 70 mg und möglichen Nebenwirkungen von FOSAMAX oder der zugrunde liegenden Erkrankung der Mutter auf das gestillte Kind berücksichtigt werden.
Pädiatrische Verwendung
FOSAMAX 70 mg ist nicht für die Anwendung bei pädiatrischen Patienten indiziert.
Die Sicherheit und Wirksamkeit von FOSAMAX wurden in einer randomisierten, doppelblinden, placebokontrollierten Zweijahresstudie mit 139 pädiatrischen Patienten im Alter von 4 bis 18 Jahren mit schwerer Osteogenesis imperfecta (OI) untersucht. Einhundertneun Patienten wurden randomisiert auf 5 mg FOSAMAX 35 mg täglich (Gewicht unter 40 kg) oder 10 mg FOSAMAX 70 mg täglich (Gewicht größer oder gleich 40 kg) und 30 Patienten auf Placebo randomisiert. Der mittlere BMD-Z-Score der Lendenwirbelsäule zu Studienbeginn betrug -4,5. Die mittlere Veränderung des BMD Z-Scores der Lendenwirbelsäule vom Ausgangswert bis Monat 24 betrug 1,3 bei den mit FOSAMAX 35 mg behandelten Patienten und 0,1 bei den mit Placebo behandelten Patienten. Die Behandlung mit FOSAMAX 35 mg reduzierte das Frakturrisiko nicht. Sechzehn Prozent der FOSAMAX-Patienten, die bis zum 12. Monat der Studie eine radiologisch bestätigte Fraktur erlitten, zeigten eine verzögerte Frakturheilung (Kallusumbau) oder eine Pseudarthrose bei der röntgenologischen Beurteilung in Monat 24, verglichen mit 9 % der mit Placebo behandelten Patienten. Bei mit FOSAMAX behandelten Patienten zeigten die in Monat 24 erhaltenen Knochenhistomorphometriedaten einen verringerten Knochenumsatz und eine verzögerte Mineralisierungszeit; es gab jedoch keine Mineralisierungsdefekte. Es gab keine statistisch signifikanten Unterschiede zwischen der FOSAMAX 35 mg- und der Placebo-Gruppe bei der Verringerung der Knochenschmerzen. Die orale Bioverfügbarkeit bei Kindern war ähnlich wie bei Erwachsenen.
Das allgemeine Sicherheitsprofil von FOSAMAX bei Patienten mit Osteogenesis imperfecta, die bis zu 24 Monate behandelt wurden, war im Allgemeinen ähnlich dem von Erwachsenen mit Osteoporose, die mit FOSAMAX behandelt wurden. Allerdings trat bei Patienten mit Osteogenesis imperfecta, die mit FOSAMAX behandelt wurden, im Vergleich zu Placebo häufiger Erbrechen auf. Während des 24-monatigen Behandlungszeitraums wurde Erbrechen bei 32 von 109 (29,4 %) der mit FOSAMAX 70 mg behandelten Patienten und bei 3 von 30 (10 %) der mit Placebo behandelten Patienten beobachtet.
In einer pharmakokinetischen Studie entwickelten 6 von 24 pädiatrischen Patienten mit Osteogenesis imperfecta, die eine orale Einzeldosis von FOSAMAX 35 oder 70 mg erhielten, innerhalb von 24 bis 48 Stunden nach der Verabreichung Fieber, grippeähnliche Symptome und/oder leichte Lymphozytopenie. Diese Ereignisse, die nicht länger als 2 bis 3 Tage andauern und auf Paracetamol ansprechen, stimmen mit einer Akut-Phase-Reaktion überein, die bei Patienten berichtet wurde, die Bisphosphonate, einschließlich FOSAMAX, erhielten. [Sehen NEBENWIRKUNGEN ]
Geriatrische Verwendung
Von den Patienten, die FOSAMAX in der Fracture Intervention Trial (FIT) erhielten, waren 71 % (n = 2302) älter als oder gleich 65 Jahre und 17 % (n = 550) waren älter als oder gleich 75 Jahre alt. Von den Patienten, die FOSAMAX 70 mg in den Vereinigten Staaten und in multinationalen Osteoporose-Behandlungsstudien bei Frauen, Osteoporose-Studien bei Männern, Glukokortikoid-induzierten Osteoporose-Studien und Studien zur Paget-Krankheit erhielten [siehe Klinische Studien ] waren 45 %, 54 %, 37 % bzw. 70 % 65 Jahre oder älter. Insgesamt wurden keine Unterschiede in der Wirksamkeit oder Sicherheit zwischen diesen Patienten und jüngeren Patienten beobachtet, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Nierenfunktionsstörung
FOSAMAX 70 mg wird für Patienten mit einer Kreatinin-Clearance von weniger als 35 ml/min nicht empfohlen. Bei Patienten mit Kreatinin-Clearance-Werten zwischen 35-60 ml/min ist keine Dosisanpassung erforderlich [vgl KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Da es Hinweise darauf gibt, dass Alendronat nicht metabolisiert oder in die Galle ausgeschieden wird, wurden keine Studien bei Patienten mit eingeschränkter Leberfunktion durchgeführt. Eine Dosisanpassung ist nicht erforderlich [vgl KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Signifikante Letalität nach oraler Einzelgabe wurde bei weiblichen Ratten und Mäusen bei 552 mg/kg (3256 mg/m²) bzw. 966 mg/kg (2898 mg/m²) beobachtet. Bei Männern waren diese Werte etwas höher, 626 bzw. 1280 mg/kg. Bei Hunden trat bei oralen Dosen von bis zu 200 mg/kg (4000 mg/m²) keine Letalität auf.
Zur Behandlung einer Überdosierung mit FOSAMAX liegen keine spezifischen Informationen vor. Hypokalzämie, Hypophosphatämie und Nebenwirkungen im oberen Gastrointestinaltrakt wie Magenverstimmung, Sodbrennen, Ösophagitis, Gastritis oder Geschwüre können die Folge einer oralen Überdosierung sein. Milch oder Antazida sollten gegeben werden, um Alendronat zu binden. Aufgrund des Risikos einer Reizung der Speiseröhre sollte kein Erbrechen herbeigeführt werden und der Patient sollte vollständig aufrecht bleiben.
Eine Dialyse wäre nicht sinnvoll.
KONTRAINDIKATIONEN
FOSAMAX 35 mg ist kontraindiziert bei Patienten mit den folgenden Erkrankungen:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Tierstudien haben die folgende Wirkungsweise gezeigt. Auf zellulärer Ebene zeigt Alendronat eine bevorzugte Lokalisierung an Orten der Knochenresorption, insbesondere unter Osteoklasten. Die Osteoklasten haften normalerweise an der Knochenoberfläche, ihnen fehlt jedoch der gekräuselte Rand, der auf eine aktive Resorption hinweist. Alendronat beeinträchtigt nicht die Osteoklastenrekrutierung oder -anheftung, hemmt jedoch die Osteoklastenaktivität. Studien an Mäusen zur Lokalisation von radioaktivem [3H]Alendronat im Knochen zeigten eine etwa 10-fach höhere Aufnahme auf Osteoklastenoberflächen als auf Osteoblastenoberflächen. Knochen, die 6 und 49 Tage nach der [3H]Alendronat-Verabreichung bei Ratten bzw. Mäusen untersucht wurden, zeigten, dass sich auf dem Alendronat, das in die Matrix eingebaut war, normale Knochen bildeten. Während es in die Knochenmatrix eingebaut ist, ist Alendronat nicht pharmakologisch aktiv. Daher muss Alendronat kontinuierlich verabreicht werden, um Osteoklasten auf neu gebildeten Resorptionsoberflächen zu unterdrücken. Die Histomorphometrie bei Pavianen und Ratten zeigte, dass die Behandlung mit Alendronat den Knochenumsatz reduziert (dh die Anzahl der Stellen, an denen Knochen umgebaut wird). Darüber hinaus übersteigt die Knochenbildung die Knochenresorption an diesen Umbaustellen, was zu einem fortschreitenden Zuwachs an Knochenmasse führt.

Pharmakodynamik
Alendronat ist ein Bisphosphonat, das an Knochen-Hydroxylapatit bindet und spezifisch die Aktivität von Osteoklasten, den knochenresorbierenden Zellen, hemmt. Alendronat reduziert die Knochenresorption ohne direkten Einfluss auf die Knochenbildung, obwohl letzterer Prozess letztendlich reduziert wird, weil Knochenresorption und -bildung während des Knochenumsatzes gekoppelt sind.
Osteoporose bei postmenopausalen Frauen
Osteoporose ist durch eine geringe Knochenmasse gekennzeichnet, die zu einem erhöhten Frakturrisiko führt. Die Diagnose kann durch die Feststellung einer geringen Knochenmasse, Anzeichen einer Fraktur auf Röntgenbildern, einer Vorgeschichte von osteoporotischen Fraktur oder Höhenverlust oder Kyphose bestätigt werden, was auf eine Wirbel-(Wirbelsäulen-)Fraktur hinweist. Osteoporose tritt sowohl bei Männern als auch bei Frauen auf, tritt jedoch am häufigsten bei Frauen nach der Menopause auf, wenn der Knochenumsatz zunimmt und die Geschwindigkeit der Knochenresorption die der Knochenbildung übersteigt. Diese Veränderungen führen zu fortschreitendem Knochenschwund und bei einem erheblichen Anteil der Frauen über 50 zu Osteoporose. Frakturen, meist der Wirbelsäule, der Hüfte und des Handgelenks, sind die häufigen Folgen. Im Alter von 50 bis 90 Jahren steigt das Risiko einer Hüftfraktur bei weißen Frauen um das 50-fache und das Risiko einer Wirbelfraktur um das 15- bis 30-fache. Es wird geschätzt, dass etwa 40 % der 50-jährigen Frauen im Laufe ihres verbleibenden Lebens einen oder mehrere Osteoporose-bedingte Frakturen der Wirbelsäule, der Hüfte oder des Handgelenks erleiden. Insbesondere Hüftfrakturen sind mit erheblicher Morbidität, Behinderung und Mortalität verbunden.
Tägliche orale Dosen von Alendronat (5, 20 und 40 mg für sechs Wochen) bei postmenopausalen Frauen führten zu biochemischen Veränderungen, die auf eine dosisabhängige Hemmung der Knochenresorption hindeuten, einschließlich einer Abnahme des Kalziums im Urin und von Markern für den Abbau von Knochenkollagen im Urin (wie Deoxypyridinolin und Kreuz- verknüpfte N-Telopeptide von Kollagen Typ I). Diese biochemischen Veränderungen kehrten tendenziell bereits 3 Wochen nach Absetzen der Therapie mit Alendronat auf die Ausgangswerte zurück und unterschieden sich nach 7 Monaten nicht von Placebo.
Die Langzeitbehandlung von Osteoporose mit FOSAMAX 10 mg/Tag (für bis zu fünf Jahre) verringerte die Urinausscheidung von Markern für Knochenresorption, Deoxypyridinolin und quervernetzten N-Telopeptiden von Typ-I-Kollagen, um etwa 50 % bzw. 70 % , um Werte zu erreichen, die denen ähnlich sind, die bei gesunden prämenopausalen Frauen beobachtet werden. Ähnliche Abnahmen wurden bei Patienten in Osteoporose-Präventionsstudien beobachtet, die FOSAMAX 5 mg/Tag erhielten. Die durch diese Marker angezeigte Abnahme der Knochenresorptionsrate war bereits nach einem Monat offensichtlich und erreichte nach drei bis sechs Monaten ein Plateau, das für die gesamte Dauer der Behandlung mit FOSAMAX aufrechterhalten wurde. In Osteoporose-Behandlungsstudien verringerte FOSAMAX 10 mg/Tag die Marker der Knochenbildung, Osteocalcin und knochenspezifische alkalische Phosphatase um etwa 50 % und die gesamte alkalische Phosphatase im Serum um etwa 25 bis 30 %, um nach 6 bis 12 Monaten ein Plateau zu erreichen. In Osteoporose-Präventionsstudien verringerte FOSAMAX 5 mg/Tag Osteocalcin und die gesamte alkalische Phosphatase im Serum um etwa 40 % bzw. 15 %. Ähnliche Verringerungen des Knochenumsatzes wurden bei postmenopausalen Frauen während einjähriger Studien mit einmal wöchentlich FOSAMAX 70 mg zur Behandlung von Osteoporose und einmal wöchentlich FOSAMAX 35 mg zur Vorbeugung von Osteoporose beobachtet. Diese Daten zeigen, dass die Rate des Knochenumsatzes einen neuen Steady-State erreicht hat, trotz der fortschreitenden Zunahme der Gesamtmenge an im Knochen abgelagertem Alendronat.
Als Ergebnis der Hemmung der Knochenresorption wurden nach der Behandlung mit FOSAMAX auch asymptomatische Verringerungen der Calcium- und Phosphatkonzentrationen im Serum beobachtet. In den Langzeitstudien war im ersten Monat nach Beginn der Behandlung mit FOSAMAX 10 mg eine Verringerung des Serumkalziums (etwa 2 %) und des Phosphats (etwa 4 bis 6 %) gegenüber dem Ausgangswert erkennbar. Während der fünfjährigen Behandlungsdauer wurden keine weiteren Abnahmen des Serumcalciums beobachtet; jedoch kehrte das Serumphosphat in den Jahren drei bis fünf auf die Werte vor der Studie zurück. Ähnliche Reduktionen wurden mit FOSAMAX 5 mg/Tag beobachtet. In Einjahresstudien mit einmal wöchentlich FOSAMAX 35 und 70 mg wurden ähnliche Reduktionen nach 6 und 12 Monaten beobachtet. Die Verringerung des Serumphosphats kann nicht nur das positive Knochenmineralgleichgewicht aufgrund von FOSAMAX 70 mg widerspiegeln, sondern auch eine Verringerung der renalen Phosphatreabsorption.
Osteoporose bei Männern
Die Behandlung von Männern mit Osteoporose mit FOSAMAX 10 mg/Tag über zwei Jahre reduzierte die Urinausscheidung von vernetzten N-Telopeptiden des Typ-I-Kollagens um etwa 60 % und die knochenspezifische alkalische Phosphatase um etwa 40 %. Ähnliche Reduktionen wurden in einer einjährigen Studie bei Männern mit Osteoporose beobachtet, die einmal wöchentlich FOSAMAX 70 mg erhielten.
Glucocorticoid-induzierte Osteoporose
Die anhaltende Anwendung von Glucocorticoiden wird häufig mit der Entwicklung von Osteoporose und daraus resultierenden Frakturen (insbesondere Wirbel, Hüfte und Rippe) in Verbindung gebracht. Es tritt sowohl bei Männern als auch bei Frauen jeden Alters auf. Osteoporose tritt als Ergebnis einer gehemmten Knochenbildung und einer erhöhten Knochenresorption auf, was zu einem Netto-Knochenverlust führt. Alendronat verringert die Knochenresorption, ohne die Knochenbildung direkt zu hemmen.
In klinischen Studien von bis zu zwei Jahren' Dauer, FOSAMAX 5 und 10 mg/Tag reduzierte quervernetzte N-Telopeptide von Kollagen Typ I (ein Marker der Knochenresorption) um etwa 60 % und reduzierte die knochenspezifische alkalische Phosphatase und die gesamte alkalische Phosphatase im Serum (Marker der Knochenbildung) um etwa 15 bis 30 % bzw. 8 bis 18 %. Als Folge der Hemmung der Knochenresorption induzierten FOSAMAX 5 und 10 mg/Tag asymptomatische Abnahmen des Serumkalziums (etwa 1 bis 2 %) und des Serumphosphats (etwa 1 bis 8 %).
Morbus Paget des Knochens
Morbus Paget des Knochens ist eine chronische, fokale Skeletterkrankung, die durch einen stark erhöhten und ungeordneten Knochenumbau gekennzeichnet ist. Auf eine übermäßige osteoklastische Knochenresorption folgt eine osteoblastische Knochenneubildung, was zum Ersatz der normalen Knochenarchitektur durch eine desorganisierte, vergrößerte und geschwächte Knochenstruktur führt.
Klinische Manifestationen der Paget-Krankheit reichen von symptomlos bis hin zu schwerer Morbidität aufgrund von Knochenschmerzen, Knochendeformationen, pathologischen Frakturen sowie neurologischen und anderen Komplikationen. Alkalische Phosphatase im Serum, der am häufigsten verwendete biochemische Index der Krankheitsaktivität, liefert ein objektives Maß für die Schwere der Krankheit und das Ansprechen auf die Therapie.
FOSAMAX 70 mg verringert direkt die Knochenresorptionsrate, was zu einer indirekten Verringerung der Knochenbildung führt. In klinischen Studien führte FOSAMAX 40 mg einmal täglich über sechs Monate zu einer signifikanten Abnahme der alkalischen Phosphatase im Serum sowie der Marker für Knochenkollagenabbau im Urin. Als Ergebnis der Hemmung der Knochenresorption induzierte FOSAMAX im Allgemeinen eine leichte, vorübergehende und asymptomatische Abnahme des Serumkalziums und -phosphats.
Pharmakokinetik
Absorption
Bezogen auf eine intravenöse Referenzdosis betrug die mittlere orale Bioverfügbarkeit von Alendronat bei Frauen 0,64 % für Dosen im Bereich von 5 bis 70 mg, wenn es nach einer nächtlichen Fastenzeit und zwei Stunden vor einem standardisierten Frühstück verabreicht wurde. Die orale Bioverfügbarkeit der 10-mg-Tablette bei Männern (0,59 %) war ähnlich wie bei Frauen, wenn sie nach einer nächtlichen Fastenzeit und 2 Stunden vor dem Frühstück verabreicht wurde.
FOSAMAX 70 mg Lösung zum Einnehmen und FOSAMAX 70 mg Tablette sind gleichermaßen bioverfügbar.
An 49 postmenopausalen Frauen wurde eine Studie durchgeführt, in der die Auswirkung des Zeitpunkts einer Mahlzeit auf die Bioverfügbarkeit von Alendronat untersucht wurde. Die Bioverfügbarkeit war verringert (um etwa 40 %), wenn 10 mg Alendronat entweder 0,5 oder 1 Stunde vor einem standardisierten Frühstück verabreicht wurde, im Vergleich zu einer Verabreichung 2 Stunden vor dem Essen. In Studien zur Behandlung und Vorbeugung von Osteoporose war Alendronat wirksam, wenn es mindestens 30 Minuten vor dem Frühstück verabreicht wurde.
Die Bioverfügbarkeit war vernachlässigbar, unabhängig davon, ob Alendronat mit oder bis zu zwei Stunden nach einem standardisierten Frühstück verabreicht wurde. Die gleichzeitige Verabreichung von Alendronat mit Kaffee oder Orangensaft verringerte die Bioverfügbarkeit um etwa 60 %.
Verteilung
Präklinische Studien (an männlichen Ratten) zeigen, dass sich Alendronat nach intravenöser Gabe von 1 mg/kg vorübergehend in den Weichteilen verteilt, dann aber schnell in die Knochen umverteilt oder mit dem Urin ausgeschieden wird. Das mittlere Verteilungsvolumen im Steady State ohne Knochen beträgt beim Menschen mindestens 28 l. Arzneimittelkonzentrationen im Plasma nach therapeutischen oralen Dosen sind zu niedrig (weniger als 5 ng/ml) für einen analytischen Nachweis. Die Proteinbindung im menschlichen Plasma beträgt etwa 78 %.
Stoffwechsel
Es gibt keine Hinweise darauf, dass Alendronat in Tieren oder Menschen metabolisiert wird.
Ausscheidung
Nach einer intravenösen Einzeldosis von [14C]Alendronat wurden ungefähr 50 % der Radioaktivität innerhalb von 72 Stunden mit dem Urin ausgeschieden, und wenig oder keine Radioaktivität wurde im Stuhl wiedergefunden. Nach einer intravenösen Einzeldosis von 10 mg betrug die renale Clearance von Alendronat 71 ml/min (64, 78; 90 % Konfidenzintervall [KI]), und die systemische Clearance überschritt 200 ml/min nicht. Die Plasmakonzentrationen fielen innerhalb von 6 Stunden nach intravenöser Verabreichung um mehr als 95 %. Die terminale Halbwertszeit beim Menschen wird auf über 10 Jahre geschätzt, was wahrscheinlich die Freisetzung von Alendronat aus dem Skelett widerspiegelt. Auf der Grundlage des Vorstehenden wird geschätzt, dass nach 10 Jahren oraler Behandlung mit FOSAMAX (10 mg täglich) die täglich aus dem Skelett freigesetzte Menge an Alendronat etwa 25 % der aus dem Magen-Darm-Trakt resorbierten Menge beträgt.
Spezifische Populationen
Geschlecht
Die Bioverfügbarkeit und der im Urin ausgeschiedene Anteil einer intravenösen Dosis waren bei Männern und Frauen ähnlich.
Geriatrie
Bioverfügbarkeit und Disposition (Harnausscheidung) waren bei älteren und jüngeren Patienten ähnlich. Bei älteren Patienten ist keine Dosisanpassung erforderlich.
Wettrennen
Unterschiede in der Pharmakokinetik aufgrund der Rasse wurden nicht untersucht.
Nierenfunktionsstörung
Präklinische Studien zeigen, dass bei Ratten mit Nierenversagen zunehmende Wirkstoffmengen in Plasma, Niere, Milz und Schienbein vorhanden sind. Bei gesunden Kontrollen wird der nicht im Knochen abgelagerte Wirkstoff schnell mit dem Urin ausgeschieden. Nach 3-wöchiger Verabreichung von kumulativen intravenösen Dosen von 35 mg/kg bei jungen männlichen Ratten wurde kein Hinweis auf eine Sättigung der Knochenaufnahme gefunden. Obwohl keine formelle pharmakokinetische Studie bei Patienten mit eingeschränkter Nierenfunktion durchgeführt wurde, ist es wahrscheinlich, dass wie bei Tieren die Elimination von Alendronat über die Niere bei Patienten mit eingeschränkter Nierenfunktion verringert ist. Daher ist bei Patienten mit eingeschränkter Nierenfunktion mit einer etwas stärkeren Akkumulation von Alendronat im Knochen zu rechnen.
Bei Patienten mit einer Kreatinin-Clearance von 35 bis 60 ml/min ist keine Dosisanpassung erforderlich. FOSAMAX 35 mg wird für Patienten mit einer Kreatinin-Clearance von weniger als 35 ml/min aufgrund fehlender Erfahrung mit Alendronat bei Nierenversagen nicht empfohlen.
Leberfunktionsstörung
Da es Hinweise darauf gibt, dass Alendronat nicht metabolisiert oder in die Galle ausgeschieden wird, wurden keine Studien bei Patienten mit eingeschränkter Leberfunktion durchgeführt. Eine Dosisanpassung ist nicht erforderlich.
Wechselwirkungen mit anderen Medikamenten
Es wurde gezeigt, dass intravenöses Ranitidin die Bioverfügbarkeit von oralem Alendronat verdoppelt. Die klinische Bedeutung dieser erhöhten Bioverfügbarkeit und ob ähnliche Anstiege bei Patienten auftreten, denen orale H2-Antagonisten verabreicht werden, ist nicht bekannt.
Bei gesunden Probanden führte die orale Einnahme von Prednison (20 mg dreimal täglich über fünf Tage) zu keiner klinisch bedeutsamen Änderung der oralen Bioverfügbarkeit von Alendronat (eine mittlere Zunahme im Bereich von 20 bis 44 %).
Produkte, die Calcium und andere mehrwertige Kationen enthalten, beeinträchtigen wahrscheinlich die Resorption von Alendronat.
Tiertoxikologie und/oder Pharmakologie
Die relativen Hemmaktivitäten auf die Knochenresorption und -mineralisierung von Alendronat und Etidronat wurden im Schenk-Assay verglichen, der auf der histologischen Untersuchung der Epiphysen von wachsenden Ratten basiert. In diesem Assay war die niedrigste Dosis von Alendronat, die die Knochenmineralisierung störte (was zu Osteomalazie führte), das 6000-fache der antiresorptiven Dosis. Das entsprechende Verhältnis für Etidronat war eins zu eins. Diese Daten deuten darauf hin, dass es sehr unwahrscheinlich ist, dass Alendronat, das in therapeutischen Dosen verabreicht wird, Osteomalazie auslöst.
Klinische Studien
Behandlung von Osteoporose bei postmenopausalen Frauen
Tägliche Dosierung
Die Wirksamkeit von FOSAMAX 10 mg täglich wurde in vier klinischen Studien untersucht. Studie 1, eine dreijährige, multizentrische, doppelblinde, placebokontrollierte klinische Studie in den USA, umfasste 478 Patienten mit einem BMD-T-Score von minus 2,5 oder darunter mit oder ohne vorherige Wirbelfraktur; Studie 2, eine dreijährige, multizentrische, doppelblinde, placebokontrollierte, multinationale klinische Studie, umfasste 516 Patienten mit einem BMD-T-Score von minus 2,5 oder darunter mit oder ohne vorherige Wirbelfraktur; Studie 3, die dreijährige Studie der Fracture Intervention Trial (FIT), eine Studie, in die 2027 postmenopausale Patientinnen mit mindestens einer Wirbelfraktur zu Studienbeginn aufgenommen wurden; und Studie 4, die Vier-Jahres-Studie von FIT: eine Studie, an der 4432 postmenopausale Patientinnen mit geringer Knochenmasse, aber ohne Wirbelfraktur zu Studienbeginn teilnahmen.
Auswirkung auf die Frakturhäufigkeit
Um die Auswirkungen von FOSAMAX auf die Inzidenz von Wirbelfrakturen (erkannt durch digitalisierte Röntgenaufnahmen; etwa ein Drittel davon waren klinisch symptomatisch) zu bewerten, wurden die US-amerikanischen und multinationalen Studien in einer Analyse kombiniert, in der Placebo mit den gepoolten Dosierungsgruppen von FOSAMAX verglichen wurde (5 oder 10 mg für drei Jahre oder 20 mg für zwei Jahre gefolgt von 5 mg für ein Jahr). Es gab eine statistisch signifikante Verringerung des Anteils der mit FOSAMAX 70 mg behandelten Patienten, die eine oder mehrere neue Wirbelfrakturen erlitten, im Vergleich zu den mit Placebo behandelten Patienten (3,2 % vs. 6,2 %; eine relative Risikoreduktion von 48 %). Eine Verringerung der Gesamtzahl neuer Wirbelfrakturen (4,2 vs. 11,3 pro 100 Patienten) wurde ebenfalls beobachtet. In der gepoolten Analyse hatten die Patienten, die FOSAMAX erhielten, einen statistisch signifikant geringeren Größenverlust als bei den Patienten, die Placebo erhielten (-3,0 mm vs. -4,6 mm).
Die Fracture Intervention Trial (FIT) bestand aus zwei Studien mit postmenopausalen Frauen: der Drei-Jahres-Studie mit Patientinnen mit mindestens einer röntgenologischen Wirbelfraktur zu Studienbeginn und der Vier-Jahres-Studie mit Patienten mit geringer Knochenmasse, aber ohne Wirbelfraktur zu Studienbeginn. In beiden FIT-Studien schlossen 96 % der randomisierten Patienten die Studien ab (dh hatten einen Abschlussbesuch am geplanten Ende der Studie); ca. 80 % der Patienten nahmen nach Abschluss der Studie immer noch die Studienmedikation ein.
Fracture Intervention Trial: Dreijährige Studie (Patienten mit mindestens einer röntgenologischen Wirbelfraktur zu Studienbeginn)
Diese randomisierte, doppelblinde, placebokontrollierte Studie mit 2027 Patienten (FOSAMAX 70 mg, n = 1022; Placebo, n = 1005) zeigte, dass die Behandlung mit FOSAMAX zu einer statistisch signifikanten Verringerung der Frakturinzidenz nach drei Jahren führte, wie in Tabelle 6 gezeigt .
Darüber hinaus reduzierte die Behandlung mit FOSAMAX in dieser Population von Patienten mit Wirbelfraktur zu Studienbeginn signifikant die Häufigkeit von Krankenhauseinweisungen (25,0 % vs. 30,7 %).
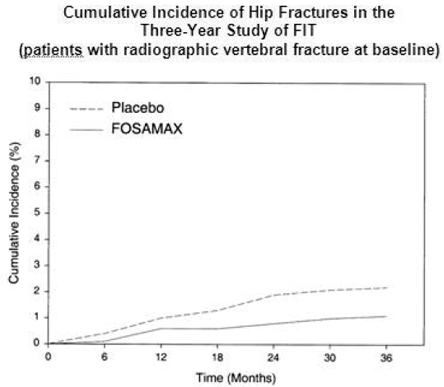
In der Dreijahresstudie zu FIT traten bei 22 (2,2 %) von 1005 Patienten unter Placebo und bei 11 (1,1 %) von 1022 Patienten unter FOSAMAX Hüftfrakturen auf, p = 0,047. Abbildung 1 zeigt die kumulative Inzidenz von Hüftfrakturen in dieser Studie.
Abbildung 1: Kumulative Inzidenz von Hüftfrakturen in der Drei-Jahres-Studie von FIT (Patienten mit röntgenologischer Wirbelfraktur zu Studienbeginn)
Fracture Intervention Trial: Vierjährige Studie (Patienten mit niedriger Knochenmasse, aber ohne röntgenologische Vertebralfraktur zu Studienbeginn)
Diese randomisierte, doppelblinde, placebokontrollierte Studie mit 4432 Patienten (FOSAMAX 70 mg, n = 2214; Placebo, n = 2218) untersuchte weiter die Verringerung der Frakturinzidenz aufgrund von FOSAMAX. Die Absicht der Studie war es, Frauen mit Osteoporose zu rekrutieren, definiert als Ausgangs-BMD des Oberschenkelhalses, die mindestens zwei Standardabweichungen unter dem Mittelwert für junge erwachsene Frauen liegt. Aufgrund späterer Überarbeitungen der normativen Werte für die BMD des Schenkelhalses wurde jedoch festgestellt, dass 31 % der Patienten dieses Eingangskriterium nicht erfüllten, und somit umfasste diese Studie sowohl Frauen mit Osteoporose als auch ohne Osteoporose. Die Ergebnisse sind in Tabelle 7 für Patienten mit Osteoporose gezeigt.
Frakturergebnisse in allen Studien
In der Drei-Jahres-Studie von FIT reduzierte FOSAMAX 35 mg den Prozentsatz der Frauen, die mindestens eine neue röntgenologische Wirbelfraktur erlitten, von 15,0 % auf 7,9 % (47 % relative Risikoreduktion, p
FOSAMAX reduzierte den Prozentsatz der Frauen, die mehrere (zwei oder mehr) neue Wirbelfrakturen erlitten, von 4,2 % auf 0,6 % (87 % relative Risikoreduktion, p
Somit verringerte FOSAMAX 35 mg die Inzidenz von röntgenologischen Wirbelfrakturen bei Frauen mit Osteoporose, unabhängig davon, ob sie zuvor eine röntgenologische Wirbelfraktur hatten oder nicht.
Auswirkung auf die Knochenmineraldichte
Die Wirksamkeit der Knochenmineraldichte von FOSAMAX 10 mg einmal täglich bei postmenopausalen Frauen im Alter von 44 bis 84 Jahren mit Osteoporose (Knochenmineraldichte der Lendenwirbelsäule [BMD] von mindestens 2 Standardabweichungen unter dem prämenopausalen Mittelwert) wurde in vier Doppel- blinde, placebokontrollierte klinische Studien über zwei oder drei Jahre' Dauer.
Abbildung 2 zeigt den mittleren Anstieg der BMD der Lendenwirbelsäule, des Oberschenkelhalses und des Trochanters bei Patienten, die FOSAMAX 10 mg/Tag erhielten, im Vergleich zu Placebo-behandelten Patienten nach drei Jahren für jede dieser Studien.
Abbildung 2: Osteoporose-Behandlungsstudien bei postmenopausalen Frauen Anstieg der BMD FOSAMAX 10 mg/Tag nach drei Jahren
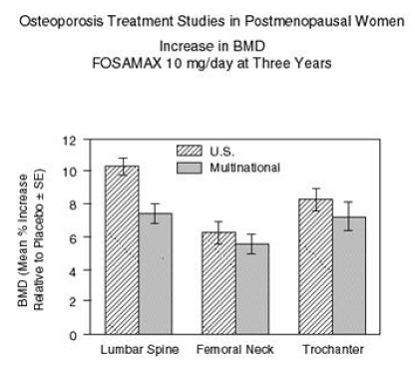
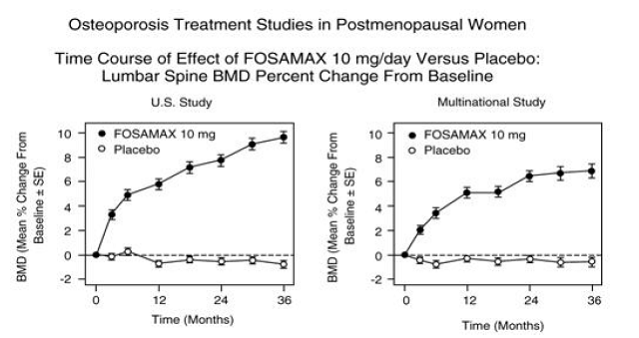
Nach drei Jahren wurde bei Patienten, die FOSAMAX 10 mg/Tag erhielten, ein signifikanter Anstieg der BMD sowohl im Vergleich zum Ausgangswert als auch im Vergleich zu Placebo an jeder Messstelle in jeder Studie beobachtet. Die Gesamtkörper-BMD nahm in jeder Studie ebenfalls signifikant zu, was darauf hindeutet, dass die Zunahme der Knochenmasse der Wirbelsäule und der Hüfte nicht auf Kosten anderer Skelettstellen erfolgte. Anstiege der BMD waren bereits nach drei Monaten offensichtlich und hielten während der dreijährigen Behandlung an. (Siehe Abbildung 3 für die Ergebnisse der Lendenwirbelsäule.) In der zweijährigen Verlängerung dieser Studien führte die Behandlung von 147 Patienten mit FOSAMAX 10 mg/Tag zu einem kontinuierlichen Anstieg der BMD an der Lendenwirbelsäule und am Trochanter (zusätzliche absolute Anstiege zwischen den Jahren 3 und 3). 5: Lendenwirbelsäule 0,94 %, Trochanter 0,88 %). BMD am Femurhals, Unterarm und Gesamtkörper wurden beibehalten. FOSAMAX war in dem untersuchten Bereich (mindestens 2 Standardabweichungen unter dem Mittelwert vor der Menopause) ähnlich wirksam, unabhängig von Alter, ethnischer Zugehörigkeit, Basislinienrate des Knochenumsatzes und Basislinien-BMD.
Abbildung 3: Osteoporose-Behandlungsstudien bei postmenopausalen Frauen Zeitverlauf der Wirkung von FOSAMAX 10 mg/Tag im Vergleich zu Placebo: Prozentuale Veränderung der BMD der Lendenwirbelsäule gegenüber dem Ausgangswert
Bei Patientinnen mit postmenopausaler Osteoporose, die ein oder zwei Jahre lang mit FOSAMAX 10 mg/Tag behandelt wurden, wurden die Auswirkungen eines Behandlungsabbruchs untersucht. Nach dem Absetzen gab es keine weitere Zunahme der Knochenmasse und die Raten des Knochenverlusts waren ähnlich denen der Placebo-Gruppen.
Knochenhistologie
Die Knochenhistologie bei 270 postmenopausalen Patientinnen mit Osteoporose, die ein, zwei oder drei Jahre lang mit FOSAMAX in Dosen von 1 bis 20 mg/Tag behandelt wurden, zeigte eine normale Mineralisierung und Struktur sowie die erwartete Abnahme des Knochenumsatzes im Vergleich zu Placebo. Diese Daten, zusammen mit der normalen Knochenhistologie und der erhöhten Knochenfestigkeit, die bei Ratten und Pavianen beobachtet wurden, die einer Langzeitbehandlung mit Alendronat ausgesetzt waren, stützen die Schlussfolgerung, dass der während der Therapie mit FOSAMAX 35 mg gebildete Knochen von normaler Qualität ist.
Auswirkung auf die Höhe
FOSAMAX war über einen Zeitraum von drei oder vier Jahren mit einer statistisch signifikanten Reduzierung des Größenverlusts im Vergleich zu Placebo bei Patienten mit und ohne röntgenologische Wirbelfrakturen zu Studienbeginn verbunden. Am Ende der FIT-Studien betrugen die Unterschiede zwischen den Behandlungsgruppen 3,2 mm in der Dreijahresstudie und 1,3 mm in der Vierjahresstudie.
Wöchentliche Dosierung
Die therapeutische Äquivalenz von FOSAMAX 70 mg einmal wöchentlich (n = 519) und FOSAMAX 10 mg täglich (n = 370) wurde in einer einjährigen, doppelblinden, multizentrischen Studie an postmenopausalen Frauen mit Osteoporose nachgewiesen. In der primären Analyse der Absolvierenden betrug der mittlere Anstieg der BMD der Lendenwirbelsäule gegenüber dem Ausgangswert nach einem Jahr 5,1 % (4,8; 5,4 %; 95 %-KI) in der Gruppe mit einmal wöchentlich 70 mg (n = 440) und 5,4 % ( 5,0, 5,8 %; 95 % KI) in der Gruppe mit 10 mg täglich (n = 330). Die beiden Behandlungsgruppen waren auch in Bezug auf BMD-Erhöhungen an anderen Skelettstellen ähnlich. Die Ergebnisse der Intention-to-treat-Analyse stimmten mit der primären Analyse der Absolvierenden überein.
Gleichzeitige Anwendung mit einer Östrogen-/Hormonersatztherapie (HET)
Die Auswirkungen auf die BMD einer Behandlung mit FOSAMAX 10 mg einmal täglich und konjugiertem Östrogen (0,625 mg/Tag), entweder allein oder in Kombination, wurden in einer zweijährigen, doppelblinden, placebokontrollierten Studie an hysterektomierten Frauen mit Osteoporose nach der Menopause (n= 425). Nach zwei Jahren war der Anstieg der BMD der Lendenwirbelsäule gegenüber dem Ausgangswert bei der Kombination (8,3 %) signifikant höher als bei entweder Östrogen oder FOSAMAX allein (beide 6,0 %).
Die Auswirkungen auf die BMD, wenn FOSAMAX 35 mg zu stabilen Dosen (für mindestens ein Jahr) einer HRT (Östrogen ± Progestin) hinzugefügt wurde, wurden in einer einjährigen, doppelblinden, placebokontrollierten Studie bei Frauen mit Osteoporose nach der Menopause (n = 428) untersucht. Die Zugabe von FOSAMAX 10 mg einmal täglich zu einer HRT führte nach einem Jahr zu signifikant stärkeren Anstiegen der BMD der Lendenwirbelsäule (3,7 %) im Vergleich zu HRT allein (1,1 %).
In diesen Studien wurden signifikante Anstiege oder günstige Trends der BMD für die Kombinationstherapie im Vergleich zur alleinigen HRT an der gesamten Hüfte, am Oberschenkelhals und am Trochanter beobachtet. Für die Ganzkörper-BMD wurde kein signifikanter Effekt beobachtet.
Histomorphometrische Studien von transiliakalen Biopsien bei 92 Probanden zeigten eine normale Knochenarchitektur. Im Vergleich zu Placebo kam es nach 18 Monaten kombinierter Behandlung mit FOSAMAX 35 mg und HRT zu einer 98 %igen Unterdrückung des Knochenumsatzes (gemessen anhand der mineralisierenden Oberfläche), zu 94 % unter FOSAMAX 35 mg allein und zu 78 % unter HRT allein. Die Langzeitwirkungen einer Kombination aus FOSAMAX 35 mg und HRT auf das Auftreten von Frakturen und die Frakturheilung wurden nicht untersucht.
Prävention von Osteoporose bei postmenopausalen Frauen
Tägliche Dosierung
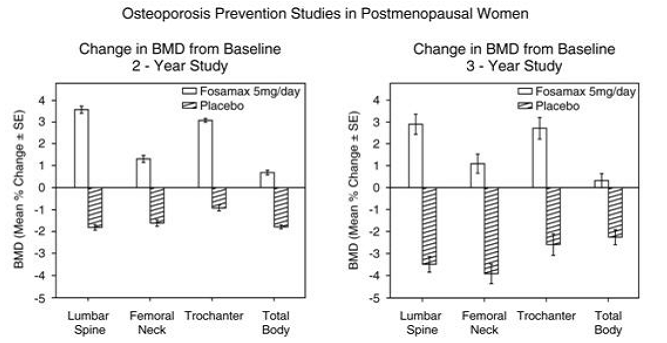
Die Verhinderung von Knochenschwund wurde in zwei doppelblinden, placebokontrollierten Studien mit postmenopausalen Frauen im Alter von 40 bis 60 Jahren nachgewiesen. Eintausendsechshundertneun Patientinnen (FOSAMAX 5 mg/Tag; n = 498), die mindestens sechs Monate nach der Menopause waren, wurden ohne Berücksichtigung ihrer Basis-BMD in eine zweijährige Studie aufgenommen. In der anderen Studie wurden 447 Patientinnen (FOSAMAX 5 mg/Tag; n = 88), die zwischen sechs Monaten und drei Jahren nach der Menopause waren, bis zu drei Jahre lang behandelt. Bei den mit Placebo behandelten Patienten wurden BMD-Verluste von etwa 1 % pro Jahr an der Wirbelsäule, Hüfte (Schenkelhals und Trochanter) und am ganzen Körper beobachtet. Im Gegensatz dazu verhinderte FOSAMAX 5 mg/Tag den Knochenverlust bei der Mehrzahl der Patienten und induzierte einen signifikanten Anstieg der mittleren Knochenmasse an jeder dieser Stellen (siehe Abbildung 4). Darüber hinaus reduzierte FOSAMAX 5 mg/Tag die Rate des Knochenverlusts am Unterarm im Vergleich zu Placebo um etwa die Hälfte. FOSAMAX 5 mg/Tag war bei dieser Population ähnlich wirksam, unabhängig von Alter, Zeit seit der Menopause, ethnischer Zugehörigkeit und Ausgangsrate des Knochenumsatzes.
Abbildung 4: Osteoporose-Präventionsstudien bei postmenopausalen Frauen
Knochenhistologie
Die Knochenhistologie war bei den 28 Patienten, die am Ende von drei Jahren, die FOSAMAX in Dosen von bis zu 10 mg/Tag erhielten, biopsiert wurden, normal.
Wöchentliche Dosierung
Die therapeutische Äquivalenz von einmal wöchentlich FOSAMAX 35 mg (n = 362) und FOSAMAX 5 mg täglich (n = 361) wurde in einer einjährigen, doppelblinden, multizentrischen Studie an postmenopausalen Frauen ohne Osteoporose nachgewiesen. In der primären Analyse der Absolvierenden betrug der mittlere Anstieg der BMD der Lendenwirbelsäule gegenüber dem Ausgangswert nach einem Jahr 2,9 % (2,6; 3,2 %; 95 %-KI) in der Gruppe mit 35 mg einmal wöchentlich (n = 307) und 3,2 % ( 2,9, 3,5 %; 95 % KI) in der Gruppe mit 5 mg täglich (n = 298). Die beiden Behandlungsgruppen waren auch in Bezug auf BMD-Erhöhungen an anderen Skelettstellen ähnlich. Die Ergebnisse der Intention-to-treat-Analyse stimmten mit der primären Analyse der Absolvierenden überein.
Behandlung zur Erhöhung der Knochenmasse bei Männern mit Osteoporose
Die Wirksamkeit von FOSAMAX 35 mg bei Männern mit hypogonadaler oder idiopathischer Osteoporose wurde in zwei klinischen Studien nachgewiesen.
Tägliche Dosierung
In eine zweijährige, doppelblinde, placebokontrollierte, multizentrische Studie mit FOSAMAX 10 mg einmal täglich wurden insgesamt 241 Männer im Alter zwischen 31 und 87 (Mittelwert 63) aufgenommen. Alle Patienten in der Studie hatten entweder einen BMD-T-Score von weniger als oder gleich -2 am Oberschenkelhals und weniger als oder gleich -1 an der Lendenwirbelsäule oder eine osteoporotische Fraktur und einen BMD-T-Score von weniger als oder gleich -1 am Schenkelhals. Nach zwei Jahren waren die mittleren BMD-Zunahmen im Vergleich zu Placebo bei Männern, die FOSAMAX 10 mg/Tag erhielten, an den folgenden Stellen signifikant: Lendenwirbelsäule, 5,3 %; Oberschenkelhals, 2,6 %; Trochanter, 3,1 %; und Gesamtkörper, 1,6%. Die Behandlung mit FOSAMAX 70 mg reduzierte auch den Höhenverlust (FOSAMAX, -0,6 mm vs. Placebo, -2,4 mm).
Wöchentliche Dosierung
In eine einjährige, doppelblinde, placebokontrollierte, multizentrische Studie mit einmal wöchentlich FOSAMAX 70 mg wurden insgesamt 167 Männer im Alter zwischen 38 und 91 (Mittelwert 66) aufgenommen. Die Patienten in der Studie hatten entweder einen BMD T-Score kleiner oder gleich -2 am Oberschenkelhals und kleiner oder gleich -1 an der Lendenwirbelsäule oder einen BMD T-Score kleiner oder gleich -2 an der Lendenwirbelsäule Lendenwirbelsäule und kleiner oder gleich -1 am Femurhals oder eine osteoporotische Fraktur zu Studienbeginn und ein BMD T-Score kleiner oder gleich -1 am Femurhals. Nach einem Jahr waren die mittleren Anstiege der BMD im Vergleich zu Placebo bei Männern, die FOSAMAX 70 mg einmal wöchentlich erhielten, an den folgenden Stellen signifikant: Lendenwirbelsäule, 2,8 %; Oberschenkelhals, 1,9 %; Trochanter, 2,0 %; und Gesamtkörper, 1,2%. Diese Anstiege der BMD waren ähnlich denen, die nach einem Jahr in der Studie mit einmal täglich 10 mg beobachtet wurden.
In beiden Studien war das BMD-Ansprechen unabhängig vom Alter (über oder gleich 65 Jahre vs. unter 65 Jahre), der Gonadenfunktion (Baseline-Testosteron unter 9 ng/dl vs. über oder gleich 9 ng/dl) ähnlich. , oder Baseline-BMD (Femurhals- und Lendenwirbelsäulen-T-Score kleiner oder gleich -2,5 vs. größer als -2,5).
Behandlung von Glucocorticoid-induzierter Osteoporose
Die Wirksamkeit von FOSAMAX 5 und 10 mg einmal täglich bei Männern und Frauen, die Glukokortikoide (mindestens 7,5 mg/Tag Prednison oder Äquivalent) erhielten, wurde in zwei einjährigen, doppelblinden, randomisierten, placebokontrollierten, multizentrischen Studien nachgewiesen praktisch identisches Design, eines wurde in den Vereinigten Staaten und das andere in 15 verschiedenen Ländern durchgeführt (Multinational [zu dem auch FOSAMAX 2,5 mg/Tag gehörte]). In diese Studien wurden 232 bzw. 328 Patienten im Alter zwischen 17 und 83 Jahren mit verschiedenen Glukokortikoid-erfordernden Erkrankungen aufgenommen. Die Patienten erhielten ergänzend Calcium und Vitamin D. Abbildung 5 zeigt die mittleren Anstiege der BMD der Lendenwirbelsäule, des Oberschenkelhalses und des Trochanters im Vergleich zu Placebo bei Patienten, die FOSAMAX 5 mg/Tag für jede Studie erhielten.
Abbildung 5: Studien an mit Glucocorticoid behandelten Patienten Anstieg der BMD FOSAMAX 5 mg/Tag nach einem Jahr
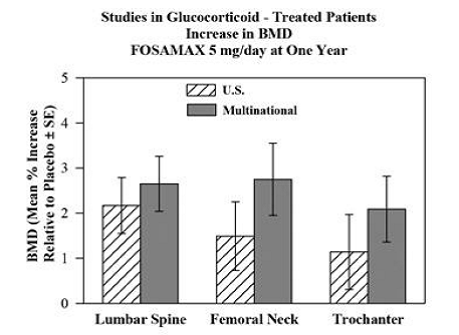
Nach einem Jahr wurden in den kombinierten Studien an jedem dieser Zentren bei Patienten, die FOSAMAX 5 mg/Tag erhielten, signifikante Anstiege der BMD im Vergleich zu Placebo beobachtet. Bei den mit Placebo behandelten Patienten trat eine signifikante Abnahme der BMD am Schenkelhals auf (-1,2 %), und kleinere Abnahmen wurden an der Lendenwirbelsäule und am Trochanter beobachtet. Die Gesamtkörper-BMD wurde mit FOSAMAX 5 mg/Tag aufrechterhalten. Die Anstiege der Knochenmineraldichte unter FOSAMAX 10 mg/Tag waren bei allen Patientinnen ähnlich wie unter FOSAMAX 5 mg/Tag, außer bei postmenopausalen Frauen, die keine Östrogentherapie erhielten. Bei diesen Frauen waren die Zunahmen (relativ zu Placebo) mit FOSAMAX 10 mg/Tag größer als die mit FOSAMAX 5 mg/Tag an der Lendenwirbelsäule (4,1 % vs. 1,6 %) und Trochanter (2,8 % vs. 1,7 %). aber nicht auf anderen Seiten. FOSAMAX 35 mg war unabhängig von der Dosis oder Dauer der Glukokortikoidanwendung wirksam. Darüber hinaus war FOSAMAX unabhängig von Alter (weniger als 65 Jahre vs. größer oder gleich 65 Jahre), Rasse (Kaukasier vs. andere Rassen), Geschlecht, Grunderkrankung, Ausgangs-BMD, Ausgangs-Knochenumsatz und Anwendung mit a Vielzahl gängiger Medikamente.
Die Knochenhistologie war bei den 49 Patienten, die am Ende eines Jahres biopsiert wurden und FOSAMAX in Dosen von bis zu 10 mg/Tag erhielten, normal.
Von den ursprünglich 560 Patienten in diesen Studien setzten 208 Patienten, die auf mindestens 7,5 mg/Tag Prednison oder einem Äquivalent blieben, eine einjährige doppelblinde Verlängerung fort. Nach zweijähriger Behandlung stieg die BMD der Wirbelsäule um 3,7 % bzw. 5,0 % im Vergleich zu Placebo mit FOSAMAX 5 bzw. 10 mg/Tag. Signifikante Erhöhungen der BMD (im Vergleich zu Placebo) wurden auch am Schenkelhals, am Trochanter und am gesamten Körper beobachtet.
Nach einem Jahr erlitten 2,3 % der mit FOSAMAX 5 oder 10 mg/Tag (gepoolt) behandelten Patienten im Vergleich zu 3,7 % der mit Placebo behandelten Patienten einen neuen Wirbelbruch (nicht signifikant). In der über zwei Jahre untersuchten Population reduzierte die Behandlung mit FOSAMAX (gepoolte Dosierungsgruppen: 5 oder 10 mg für zwei Jahre oder 2,5 mg für ein Jahr, gefolgt von 10 mg für ein Jahr) jedoch signifikant die Inzidenz von Patienten mit einer neuen Wirbelfraktur (FOSAMAX 0,7 % vs. Placebo 6,8 %).
Behandlung der Paget-Knochenkrankheit
Die Wirksamkeit von FOSAMAX 40 mg einmal täglich über sechs Monate wurde in zwei doppelblinden klinischen Studien an männlichen und weiblichen Patienten mit mittelschwerer bis schwerer Paget-Krankheit (alkalische Phosphatase mindestens doppelt so hoch wie die Obergrenze des Normalwerts) nachgewiesen: ein Placebo -kontrollierte, multinationale Studie und eine US-Vergleichsstudie mit Etidronat Dinatrium 400 mg/Tag. Abbildung 6 zeigt die mittleren prozentualen Veränderungen der alkalischen Phosphatase im Serum gegenüber dem Ausgangswert für bis zu sechs Monate randomisierter Behandlung.
Abbildung 6: Studien zur Wirkung von Morbus Paget auf die alkalische Phosphatase im Serum von FOSAMAX 40 mg/Tag im Vergleich zu Placebo oder Etidronat 400 mg/Tag
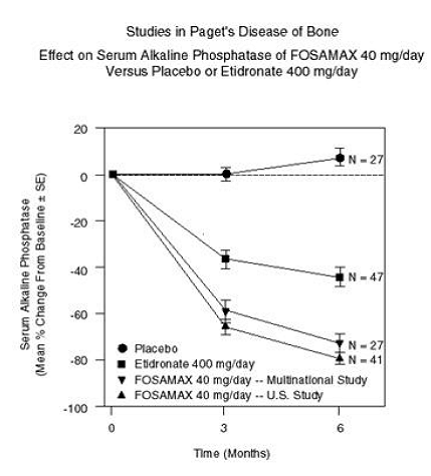
Nach sechs Monaten war die Unterdrückung der alkalischen Phosphatase bei mit FOSAMAX behandelten Patienten signifikant größer als die mit Etidronat erreichte und stand im Gegensatz zu dem völligen Fehlen einer Reaktion bei mit Placebo behandelten Patienten. Ein Ansprechen (entweder als Normalisierung der alkalischen Phosphatase im Serum oder Abnahme von mindestens 60 % gegenüber dem Ausgangswert) trat bei etwa 85 % der mit FOSAMAX behandelten Patienten in den kombinierten Studien auf, gegenüber 30 % in der Etidronat-Gruppe und 0 % in der Placebo-Gruppe Gruppe. FOSAMAX 70 mg war unabhängig von Alter, Geschlecht, Rasse, vorheriger Anwendung anderer Bisphosphonate oder basischer alkalischer Phosphatase innerhalb des untersuchten Bereichs (mindestens das Doppelte der Obergrenze des Normalwerts) ähnlich wirksam.
Die Knochenhistologie wurde bei 33 Patienten mit Morbus Paget untersucht, die 6 Monate lang mit FOSAMAX 40 mg/Tag behandelt wurden. Wie bei Patienten, die wegen Osteoporose behandelt werden [vgl Klinische Studien ], FOSAMAX beeinträchtigte die Mineralisierung nicht, und die erwartete Abnahme der Knochenumsatzrate wurde beobachtet. Während der Behandlung mit FOSAMAX wurde normaler Lamellenknochen produziert, selbst wenn bereits bestehender Knochen verwoben und desorganisiert war. Insgesamt stützen die Knochenhistologiedaten die Schlussfolgerung, dass der während der Behandlung mit FOSAMAX 35 mg gebildete Knochen von normaler Qualität ist.
INFORMATIONEN ZUM PATIENTEN
FOSAMAX® (FOSS-ah-max) (Alendronat-Natrium) Tabletten
Lesen Sie den mit FOSAMAX 70 mg gelieferten Medikationsleitfaden, bevor Sie mit der Einnahme beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Dieser Medikationsleitfaden ersetzt nicht das Gespräch mit Ihrem Arzt über Ihren Gesundheitszustand oder Ihre Behandlung. Sprechen Sie mit Ihrem Arzt, wenn Sie Fragen zu FOSAMAX haben.
Was sind die wichtigsten Informationen, die ich über FOSAMAX 70 mg wissen sollte?
FOSAMAX 70 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
1. Speiseröhrenprobleme.
Bei einigen Personen, die FOSAMAX 35 mg einnehmen, können Probleme in der Speiseröhre (dem Schlauch, der Mund und Magen verbindet) auftreten.
Zu diesen Problemen gehören Reizungen, Entzündungen oder Geschwüre der Speiseröhre, die manchmal bluten können.
2. Niedriger Kalziumspiegel in Ihrem Blut (Hypokalzämie).
FOSAMAX kann den Calciumspiegel in Ihrem Blut senken. Wenn Sie vor Beginn der Einnahme von FOSAMAX einen niedrigen Calciumspiegel im Blut haben, kann sich dieser während der Behandlung verschlechtern. Ihr niedriger Calciumspiegel im Blut muss behandelt werden, bevor Sie FOSAMAX einnehmen. Die meisten Menschen mit niedrigem Kalziumspiegel im Blut haben keine Symptome, aber einige Menschen können Symptome haben. Rufen Sie sofort Ihren Arzt an, wenn Sie Symptome eines niedrigen Kalziumspiegels im Blut haben, wie z.
Ihr Arzt kann Ihnen Kalzium und Vitamin D verschreiben, um einen niedrigen Kalziumspiegel in Ihrem Blut zu verhindern, während Sie FOSAMAX einnehmen. Nehmen Sie Calcium und Vitamin D nach Anweisung Ihres Arztes ein.
3. Knochen-, Gelenk- oder Muskelschmerzen.
Einige Personen, die FOSAMAX einnehmen, entwickeln schwere Knochen-, Gelenk- oder Muskelschmerzen.
4. Schwere Kieferknochenprobleme (Osteonekrose).
Schwere Kieferknochenprobleme können auftreten, wenn Sie FOSAMAX einnehmen. Ihr Arzt sollte Ihren Mund untersuchen, bevor Sie mit FOSAMAX beginnen. Ihr Arzt wird Sie möglicherweise anweisen, Ihren Zahnarzt aufzusuchen, bevor Sie mit FOSAMAX beginnen. Es ist wichtig, dass Sie während der Behandlung mit FOSAMAX auf eine gute Mundpflege achten.
5. Ungewöhnliche Oberschenkelknochenbrüche.
Manche Menschen haben ungewöhnliche Frakturen in ihrem Oberschenkelknochen entwickelt. Zu den Symptomen einer Fraktur können neue oder ungewöhnliche Schmerzen in Hüfte, Leiste oder Oberschenkel gehören.
Rufen Sie sofort Ihren Arzt an, wenn Sie eine dieser Nebenwirkungen haben.
Was ist FOSAMAX 70 mg?
Behandeln Sie bestimmte Männer und Frauen mit Morbus Paget des Knochens.
Es ist nicht bekannt, wie lange FOSAMAX 70 mg zur Behandlung und Vorbeugung von Osteoporose wirkt. Sie sollten Ihren Arzt regelmäßig aufsuchen, um festzustellen, ob FOSAMAX 70 mg noch für Sie geeignet ist.
FOSAMAX ist nicht zur Anwendung bei Kindern bestimmt.
Wer sollte FOSAMAX 70 mg nicht einnehmen?
Nehmen Sie FOSAMAX nicht ein, wenn Sie:
Was sollte ich meinem Arzt vor der Einnahme von FOSAMAX 35 mg mitteilen?
Bevor Sie mit FOSAMAX beginnen, sprechen Sie unbedingt mit Ihrem Arzt, wenn Sie:
Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen. Bestimmte Arzneimittel können die Wirkungsweise von FOSAMAX 70 mg beeinflussen.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste darüber und zeigen Sie sie Ihrem Arzt und Apotheker jedes Mal, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich FOSAMAX 35 mg einnehmen?
Warten Sie nach dem Schlucken von FOSAMAX 35 mg Tablette mindestens 30 Minuten:
Legen Sie sich nach der Einnahme von FOSAMAX und nach der ersten Mahlzeit des Tages mindestens 30 Minuten lang nicht hin.
Wenn Sie eine Dosis von FOSAMAX 70 mg vergessen haben, nehmen Sie sie nicht später am Tag ein. Nehmen Sie die vergessene Dosis am nächsten Morgen ein, nachdem Sie sich daran erinnern, und kehren Sie dann zu Ihrem normalen Zeitplan zurück. Nehmen Sie nicht 2 Dosen am selben Tag ein.
Wenn Sie zu viel FOSAMAX 70 mg eingenommen haben, wenden Sie sich an Ihren Arzt. Versuchen Sie nicht zu erbrechen. Legen Sie sich nicht hin.
Welche Nebenwirkungen kann FOSAMAX 70 mg haben?
FOSAMAX kann schwerwiegende Nebenwirkungen verursachen.
Die häufigsten Nebenwirkungen von FOSAMAX 70 mg sind:
Sie können allergische Reaktionen wie Nesselsucht oder Schwellungen von Gesicht, Lippen, Zunge oder Rachen bekommen.
Es wurde über eine Verschlechterung des Asthmas berichtet.
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von FOSAMAX. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist FOSAMAX aufzubewahren?
Bewahren Sie FOSAMAX und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von FOSAMAX.
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie FOSAMAX 35 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie FOSAMAX 35 mg nicht an andere Personen, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Dieser Arzneimittelleitfaden fasst die wichtigsten Informationen zu FOSAMAX zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt. Sie können Ihren Arzt oder Apotheker um Informationen über FOSAMAX bitten, die für Angehörige der Gesundheitsberufe bestimmt sind. Weitere Informationen erhalten Sie unter: www.FOSAMAX.com oder telefonisch unter 1-800-622-4477 (gebührenfrei).
Was sind die Inhaltsstoffe von FOSAMAX?
Wirkstoff: Alendronat-Natrium
Inaktive Inhaltsstoffe: mikrokristalline Zellulose, wasserfreie Laktose, Croscarmellose-Natrium, Magnesiumstearat.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.