Estrace 1mg, 2mg Estradiol Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Estrace und wie wird es angewendet?
Estrace ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von metastasierendem Brustkrebs, Osteoporose, Östrogenmangel (Hypoöstrogenismus), Vulva- und Vaginalatrophie in der Menopause. Estrace 1 mg kann allein oder mit anderen Medikamenten verwendet werden.
Estrace 1 mg gehört zu einer Klasse von Arzneimitteln, die als Östrogenderivate bezeichnet werden.
Es ist nicht bekannt, ob Estrace 1 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Estrace 1mg haben?
Estrace kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Estrace sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Estrace. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Östrogene erhöhen das Risiko von Endometriumkrebs
Eine engmaschige klinische Überwachung aller Frauen, die Östrogene einnehmen, ist wichtig. Angemessene diagnostische Maßnahmen, einschließlich Endometriumentnahmen, falls angezeigt, sollten durchgeführt werden, um Malignität in allen Fällen von nicht diagnostizierten anhaltenden oder wiederkehrenden abnormalen vaginalen Blutungen auszuschließen. Es gibt keine Hinweise darauf, dass die Anwendung von „natürlichen“ Östrogenen zu einem anderen endometrialen Risikoprofil führt als „synthetische“ Östrogene bei äquivalenten Östrogendosen. (Sehen WARNUNGEN , Bösartige Neubildungen , Endometriumkarzinom .)
KARDIOVASKULÄRE UND ANDERE RISIKEN
Östrogene mit oder ohne Gestagene sollten nicht zur Vorbeugung von Herz-Kreislauf-Erkrankungen verwendet werden. (Sehen WARNUNGEN , Herz-Kreislauf-Erkrankungen .)
Die Studie der Women's Health Initiative (WHI) berichtete über ein erhöhtes Risiko für Myokardinfarkt, Schlaganfall, invasiven Brustkrebs, Lungenembolie und tiefe Venenthrombose bei postmenopausalen Frauen (im Alter von 50 bis 79 Jahren) während einer 5-jährigen oralen Behandlung konjugierte Östrogene (CE 0,625 mg) in Kombination mit Medroxyprogesteronacetat (MPA 2,5 mg) im Vergleich zu Placebo. (Sehen KLINISCHE PHARMAKOLOGIE , Klinische Studien .)
Die Women’s Health Initiative Memory Study (WHIMS), eine Teilstudie von WHI, berichtete über ein erhöhtes Risiko für die Entwicklung einer wahrscheinlichen Demenz bei postmenopausalen Frauen im Alter von 65 Jahren oder älter während einer 4-jährigen Behandlung mit oralen konjugierten Östrogenen plus Medroxyprogesteronacetat im Vergleich zu Placebo . Es ist nicht bekannt, ob dieser Befund für jüngere postmenopausale Frauen oder für Frauen gilt, die eine Östrogen-Monotherapie erhalten. (Sehen KLINISCHE PHARMAKOLOGIE , Klinische Studien .)
Andere Dosen oraler konjugierter Östrogene mit Medroxyprogesteronacetat und andere Kombinationen und Dosierungsformen von Östrogenen und Gestagenen wurden in den klinischen WHI-Studien nicht untersucht, und mangels vergleichbarer Daten sollte davon ausgegangen werden, dass diese Risiken ähnlich sind. Aufgrund dieser Risiken sollten Östrogene mit oder ohne Gestagene in den niedrigsten wirksamen Dosen und für die kürzeste Dauer verschrieben werden, die mit den Behandlungszielen und Risiken für die jeweilige Frau vereinbar sind.
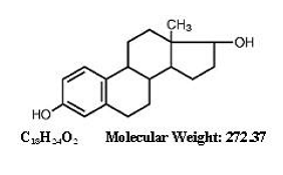
BEZEICHNUNG
ESTRACE ® (Estradiol-Tabletten, USP) zur oralen Verabreichung enthält 0,5, 1 oder 2 mg mikronisiertes Estradiol pro Tablette. Estradiol (17ß-Estradiol) ist ein weißer, kristalliner Feststoff, der chemisch als Estra-1,3,5,(10)-trien-3, 17ß-diol beschrieben wird. Die Strukturformel lautet:
Inaktive Zutaten : Kolloidales Siliciumdioxid, Maisstärke, dibasisches Calciumphosphat, Lactosemonohydrat, Magnesiumstearat und Natriumstärkeglykolat. Zusätzlich enthält das 1 mg auch FD&C blue no. 1 Alulack und D&C rot Nr. 27 Aluminiumlack. Die 2 mg enthalten auch FD&C blue no. 1 Alulack und FD&C gelb Nr. 5 (Tartrazin) Aluminiumlack.
INDIKATIONEN
ESTRACE (Estradiol-Tabletten, USP) ist indiziert bei:
DOSIERUNG UND ANWENDUNG
Wenn einer postmenopausalen Frau mit Gebärmutter Östrogen verschrieben wird, sollte auch ein Gestagen verabreicht werden, um das Risiko eines Endometriumkarzinoms zu verringern. Eine Frau ohne Gebärmutter braucht kein Gestagen. Die Anwendung von Östrogen, allein oder in Kombination mit einem Gestagen, sollte in der niedrigsten wirksamen Dosis und für die kürzeste Dauer erfolgen, die mit den Behandlungszielen und Risiken für die jeweilige Frau vereinbar ist. Die Patienten sollten je nach klinischer Notwendigkeit regelmäßig (z. B. in Abständen von 3 bis 6 Monaten) neu bewertet werden, um festzustellen, ob eine Behandlung noch erforderlich ist (siehe KASTENWARNUNGEN und WARNUNGEN ). Bei Frauen mit Uterus sollten geeignete diagnostische Maßnahmen, wie z. B. eine Endometriumentnahme, falls indiziert, durchgeführt werden, um bei nicht diagnostizierten anhaltenden oder wiederkehrenden abnormalen Vaginalblutungen eine Malignität auszuschließen.
Patienten sollten mit der niedrigsten Dosis für die Indikation begonnen werden.
1. Zur Behandlung von mittelschweren bis schweren vasomotorischen Symptomen, Vulva- und Vaginalatrophie im Zusammenhang mit der Menopause sollten die niedrigste Dosis und das niedrigste Regime gewählt werden, die die Symptome kontrollieren, und die Medikation sollte so schnell wie möglich abgesetzt werden.
Versuche, die Medikation abzusetzen oder auszuschleichen, sollten in Abständen von 3 bis 6 Monaten unternommen werden. Die übliche Anfangsdosis liegt bei 1 bis 2 mg Östradiol täglich, die nach Bedarf angepasst wird, um die auftretenden Symptome zu kontrollieren. Die minimal wirksame Dosis für die Erhaltungstherapie sollte durch Titration bestimmt werden. Die Verabreichung sollte zyklisch erfolgen (z. B. 3 Wochen an und 1 Woche ab).
2. Zur Behandlung von weiblichem Hypoöstrogenismus aufgrund von Hypogonadismus, Kastration oder primärer Ovarialinsuffizienz.
Die Behandlung wird üblicherweise mit einer Dosis von 1 bis 2 mg Östradiol pro Tag eingeleitet, die nach Bedarf angepasst wird, um die vorliegenden Symptome zu kontrollieren; die minimale wirksame Dosis für die Erhaltungstherapie sollte durch Titration bestimmt werden.
3. Zur Behandlung von Brustkrebs, nur zur Linderung, bei entsprechend ausgewählten Frauen und Männern mit Metastasen.
Die empfohlene Dosierung beträgt 10 mg dreimal täglich für einen Zeitraum von mindestens drei Monaten.
4. Zur Behandlung des fortgeschrittenen androgenabhängigen Prostatakarzinoms, nur zur Linderung.
Die empfohlene Dosierung beträgt 1 bis 2 mg dreimal täglich. Die Wirksamkeit der Therapie kann durch Phosphatase-Bestimmungen sowie durch symptomatische Besserung des Patienten beurteilt werden.
5. Zur Vorbeugung von Osteoporose.
Bei einer ausschließlichen Verschreibung zur Vorbeugung von postmenopausaler Osteoporose sollte eine Therapie nur für Frauen in Betracht gezogen werden, die ein signifikantes Osteoporoserisiko aufweisen und für die nicht-östrogene Medikamente als nicht geeignet erachtet werden.
Die niedrigste wirksame Dosis von ESTRACE 2 mg wurde nicht bestimmt.
WIE GELIEFERT
ESTRACE® (Estradiol-Tabletten, USP) sind erhältlich als:
0,5mg Weiße bis cremefarbene, ovale, flache Tablette mit abgeschrägten Kanten und Bruchrille. Geprägt mit 720 / ½ auf der gerillten Seite und Toilette auf der anderen Seite. Erhältlich in Flaschen von:
100 Tabletten NDC 0430-0720-24
1mg : Hellviolette, ovale, flache Tablette mit abgeschrägten Kanten und Bruchkerbe. Geprägt mit 721 / 1 auf der gerillten Seite und Toilette auf der anderen Seite. Erhältlich in Flaschen von:
100 Tabletten NDC 0430-0721-24
2 mg : Grüne, ovale, flache Tablette mit abgeschrägten Kanten und Bruchrille. Geprägt mit 722 / 2 auf der gerillten Seite und Toilette auf der anderen Seite. Erhältlich in Flaschen von:
100 Tabletten NDC 0430-0722-24
Bei 20° bis 25° C (68° bis 77°F) lagern [Siehe USP kontrollierte Raumtemperatur ].
In einem dichten, lichtbeständigen Behälter gemäß USP mit kindersicherem Verschluss (falls erforderlich) abgeben.
BEWAHREN SIE DIESES UND ALLE ARZNEIMITTEL AUSSERHALB DER REICHWEITE VON KINDERN AUF.
Hergestellt von: TEVA PHARMACEUTICALS USA Sellersville, PA 18960. Vertrieben von: Warner Chilcott (US), LLC, Rockaway, NJ 07866, 1-800-521-8813. Überarbeitet: September 2013
NEBENWIRKUNGEN
Sehen KASTENWARNUNGEN , WARNUNGEN und VORSICHTSMASSNAHMEN .
Die folgenden zusätzlichen Nebenwirkungen wurden unter Östrogen- und/oder Gestagentherapie berichtet.
Urogenitalsystem
Veränderungen des vaginalen Blutungsmusters und anormale Abbruchblutungen oder Blutungen; Durchbruchblutung, Schmierblutung, Dysmenorrhö Größenzunahme von Uterus-Leiomyomen Vaginitis, einschließlich vaginaler Candidiasis Veränderung der Zervixsekretion Veränderung des zervikalen Ektropiums Eierstockkrebs; Endometriumhyperplasie; Endometriumkarzinom
Brüste
Empfindlichkeit, Vergrößerung, Schmerzen, Brustwarzenausfluss, Galaktorrhoe; fibrozystische Brustveränderungen; Brustkrebs
Herz-Kreislauf
Tiefe und oberflächliche Venenthrombose; Lungenembolie; Thrombophlebitis; Herzinfarkt; streicheln; Anstieg des Blutdrucks
Magen-Darm
Übelkeit, Erbrechen Bauchkrämpfe, Blähungen Cholestatischer Ikterus Erhöhtes Auftreten von Erkrankungen der Gallenblase Pankreatitis Vergrößerung hepatischer Hämangiome
Haut
Chloasma oder Melasma, die nach Absetzen des Arzneimittels bestehen bleiben können Erythema multiforme Erythema nodosum Hämorrhagischer Ausschlag Haarausfall Hirsutismus Juckreiz, Hautausschlag
Augen
Retinale Gefäßthrombose Versteilerung der Hornhautkrümmung Unverträglichkeit von Kontaktlinsen
Zentrales Nervensystem
Kopfschmerzen, Migräne, Schwindel Mentale Depression Chorea Nervosität, Stimmungsschwankungen, Reizbarkeit Verschlimmerung einer Epilepsie Demenz
Sonstig
Gewichtszunahme oder -abnahme Reduzierte Kohlenhydrattoleranz Verschlimmerung der Porphyrie Ödeme Arthralgien; Beinkrämpfe Veränderungen der Libido Urtikaria Angioödem Anaphylaktoide/anaphylaktische Reaktionen Hypokalzämie Exazerbation von Asthma Erhöhte Triglyceride
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Arzneimittel-/Labortest-Wechselwirkungen
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
Sehen KASTENWARNUNGEN .
Herz-Kreislauf-Erkrankungen
Eine Östrogen- und Östrogen/Gestagen-Therapie wurde mit einem erhöhten Risiko für kardiovaskuläre Ereignisse wie Myokardinfarkt und Schlaganfall sowie für Venenthrombosen und Lungenembolien (venöse Thromboembolie oder VTE) in Verbindung gebracht. Sollte einer dieser Fälle auftreten oder vermutet werden, sollten Östrogene sofort abgesetzt werden.
Risikofaktoren für arterielle Gefäßerkrankungen (z. B. Bluthochdruck, Diabetes mellitus, Tabakkonsum, Hypercholesterinämie und Fettleibigkeit) und/oder venöse Thromboembolien (z. B. VTE in der persönlichen oder familiären Vorgeschichte, Fettleibigkeit und systemischer Lupus erythematodes) sollten angemessen behandelt werden.
Koronare Herzkrankheit und Schlaganfall
In der Studie der Women's Health Initiative (WHI) wurde bei Frauen, die CE erhielten, im Vergleich zu Placebo eine Zunahme der Anzahl von Myokardinfarkten und Schlaganfällen beobachtet. Diese Beobachtungen sind vorläufig, und die Studie wird fortgesetzt. (Sehen KLINISCHE PHARMAKOLOGIE , Klinische Studien .)
In der CE/MPA-Teilstudie von WHI wurde bei Frauen, die CE/MPA erhielten, im Vergleich zu Frauen, die Placebo erhielten, ein erhöhtes Risiko für koronare Herzkrankheiten (KHK) (definiert als nicht tödlicher Myokardinfarkt und KHK-Tod) beobachtet (37 vs. 30 pro 10.000 Personen). Jahre). Der Anstieg des Risikos wurde im ersten Jahr beobachtet und hielt an.
In derselben WHI-Unterstudie wurde bei Frauen, die CE/MPA erhielten, im Vergleich zu Frauen, die Placebo erhielten, ein erhöhtes Schlaganfallrisiko beobachtet (29 vs. 21 pro 10.000 Frauenjahre). Der Anstieg des Risikos wurde nach dem ersten Jahr beobachtet und hielt an.
Bei postmenopausalen Frauen mit nachgewiesener Herzerkrankung (n = 2.763, Durchschnittsalter 66,7 Jahre) wurde in einer kontrollierten klinischen Studie zur Sekundärprävention kardiovaskulärer Erkrankungen (Heart and Estrogen/Progestin Replacement Study; HERS) eine Behandlung mit CE/MPA (0,625 mg/2,5 mg pro Tag) zeigte keinen kardiovaskulären Nutzen. Während einer durchschnittlichen Nachbeobachtungszeit von 4,1 Jahren reduzierte die Behandlung mit CE/MPA die Gesamtrate von CHD-Ereignissen bei postmenopausalen Frauen mit bestehender koronarer Herzkrankheit nicht. Es gab mehr KHK-Ereignisse in der CE/MPA-behandelten Gruppe als in der Placebo-Gruppe in Jahr 1, aber nicht in den darauffolgenden Jahren. Zweitausenddreihunderteinundzwanzig Frauen aus der ursprünglichen HERS-Studie erklärten sich bereit, an einer Open-Label-Verlängerung von HERS, HERS II, teilzunehmen. Die durchschnittliche Nachbeobachtungszeit bei HERS II betrug weitere 2,7 Jahre, insgesamt also 6,8 Jahre. Die Raten von CHD-Ereignissen waren bei Frauen in der CE/MPA-Gruppe und der Placebo-Gruppe bei HERS, HERS II und insgesamt vergleichbar.
Hohe Östrogendosen (5 mg konjugierte Östrogene pro Tag), vergleichbar mit denen zur Behandlung von Prostata- und Brustkrebs, haben in einer großen prospektiven klinischen Studie bei Männern gezeigt, dass sie das Risiko für nicht tödlichen Myokardinfarkt, Lungenembolie und erhöhen Thrombophlebitis.
Venöse Thromboembolie (VTE).
In der Studie der Women's Health Initiative (WHI) wurde bei Frauen, die CE erhielten, im Vergleich zu Placebo ein Anstieg der VTE beobachtet. Diese Beobachtungen sind vorläufig, und die Studie wird fortgesetzt. (Sehen KLINISCHE PHARMAKOLOGIE , Klinische Studien .)
In der CE/MPA-Teilstudie von WHI wurde bei Frauen, die CE/MPA erhielten, im Vergleich zu Frauen, die Placebo erhielten, eine 2-mal höhere Rate an VTE, einschließlich tiefer Venenthrombose und Lungenembolie, beobachtet. Die VTE-Rate betrug 34 pro 10.000 Frauenjahre in der CE/MPA-Gruppe im Vergleich zu 16 pro 10.000 Frauenjahre in der Placebogruppe. Der Anstieg des VTE-Risikos wurde im ersten Jahr beobachtet und hielt an.
Wenn möglich, sollten Östrogene mindestens 4 bis 6 Wochen vor einem chirurgischen Eingriff, der mit einem erhöhten Thromboembolierisiko einhergeht, oder während längerer Ruhigstellungen abgesetzt werden.
Bösartige Neubildungen
Endometriumkarzinom
Die Anwendung von ungehinderten Östrogenen bei Frauen mit intaktem Uterus wurde mit einem erhöhten Risiko für Endometriumkarzinom in Verbindung gebracht. Das gemeldete Endometriumkarzinomrisiko bei Östrogenkonsumenten ohne Gegenmaßnahmen ist etwa 2- bis 12-mal höher als bei Nichtkonsumenten und scheint von der Behandlungsdauer und der Östrogendosis abhängig zu sein. Die meisten Studien zeigen kein signifikant erhöhtes Risiko im Zusammenhang mit der Anwendung von Östrogenen für weniger als ein Jahr. Das größte Risiko scheint mit einer längeren Anwendung verbunden zu sein – mit einem 15- bis 24-fach erhöhten Risiko für fünf bis zehn Jahre oder länger – und dieses Risiko bleibt 8 bis über 15 Jahre nach Absetzen der Östrogentherapie bestehen.
Eine klinische Überwachung aller Frauen, die Östrogen/Gestagen-Kombinationen einnehmen, ist wichtig (siehe VORSICHTSMASSNAHMEN ). Angemessene diagnostische Maßnahmen, einschließlich Endometriumentnahmen, falls angezeigt, sollten durchgeführt werden, um Malignität in allen Fällen von nicht diagnostizierten anhaltenden oder wiederkehrenden abnormalen vaginalen Blutungen auszuschließen. Es gibt keine Hinweise darauf, dass die Anwendung natürlicher Östrogene zu einem anderen endometrialen Risikoprofil führt als synthetische Östrogene mit äquivalenter Östrogendosis. Es hat sich gezeigt, dass die Zugabe eines Gestagens zur Östrogentherapie das Risiko einer Endometriumhyperplasie verringert, die eine Vorstufe von Endometriumkrebs sein kann.
Brustkrebs
Es wurde berichtet, dass die Anwendung von Östrogenen und Gestagenen bei postmenopausalen Frauen das Brustkrebsrisiko erhöht. Die wichtigste randomisierte klinische Studie, die Informationen zu diesem Thema liefert, ist die Teilstudie der Women's Health Initiative (WHI) von CE/MPA (vgl KLINISCHE PHARMAKOLOGIE , Klinische Studien ). Die Ergebnisse aus Beobachtungsstudien stimmen im Allgemeinen mit denen der klinischen WHI-Studie überein und zeigen keine signifikanten Unterschiede im Brustkrebsrisiko zwischen verschiedenen Östrogenen oder Gestagenen, Dosierungen oder Verabreichungswegen.
Die CE/MPA-Teilstudie von WHI berichtete über ein erhöhtes Brustkrebsrisiko bei Frauen, die CE/MPA für eine mittlere Nachbeobachtungszeit von 5,6 Jahren einnahmen. Beobachtungsstudien haben auch über ein erhöhtes Risiko für eine Östrogen/Gestagen-Kombinationstherapie und ein geringeres erhöhtes Risiko für eine Östrogen-Monotherapie nach mehrjähriger Anwendung berichtet. In der WHI-Studie und in Beobachtungsstudien stieg das Exzessrisiko mit der Anwendungsdauer. Aus Beobachtungsstudien geht hervor, dass das Risiko etwa fünf Jahre nach Beendigung der Behandlung auf den Ausgangswert zurückkehrt. Darüber hinaus deuten Beobachtungsstudien darauf hin, dass das Brustkrebsrisiko bei einer Östrogen/Gestagen-Kombinationstherapie größer war und früher auftrat als bei einer Östrogen-Monotherapie.
In der CE/MPA-Teilstudie gaben 26 % der Frauen an, zuvor eine Östrogen-Monotherapie und/oder eine Östrogen/Gestagen-Kombinationshormontherapie angewendet zu haben. Nach einer durchschnittlichen Nachbeobachtungszeit von 5,6 Jahren während der klinischen Studie betrug das relative Gesamtrisiko für invasiven Brustkrebs 1,24 (95 % Konfidenzintervall 1,01–1,54) und das absolute Gesamtrisiko 41 vs. 33 Fälle pro 10.000 Frauenjahre CE/MPA im Vergleich zu Placebo. Bei Frauen, die über eine vorherige Anwendung einer Hormontherapie berichteten, betrug das relative Risiko für invasiven Brustkrebs 1,86 und das absolute Risiko 46 vs. 25 Fälle pro 10.000 Frauenjahre für CE/MPA im Vergleich zu Placebo. Bei Frauen, die keine vorherige Anwendung einer Hormontherapie angaben, betrug das relative Risiko für invasiven Brustkrebs 1,09 und das absolute Risiko 40 vs. 36 Fälle pro 10.000 Frauenjahre für CE/MPA im Vergleich zu Placebo. In derselben Teilstudie waren invasive Brustkrebserkrankungen in der CE/MPA-Gruppe größer und wurden in einem fortgeschritteneren Stadium diagnostiziert als in der Placebo-Gruppe. Metastasen traten selten auf, ohne erkennbaren Unterschied zwischen den beiden Gruppen. Andere prognostische Faktoren wie histologischer Subtyp, Grad und Hormonrezeptorstatus unterschieden sich nicht zwischen den Gruppen.
Es wurde berichtet, dass die Anwendung von Östrogen plus Progestin zu einer Zunahme von abnormalen Mammogrammen führt, die einer weiteren Bewertung bedürfen. Alle Frauen sollten jährliche Brustuntersuchungen durch einen Gesundheitsdienstleister erhalten und monatliche Brustselbstuntersuchungen durchführen. Darüber hinaus sollten Mammographieuntersuchungen basierend auf dem Alter der Patientin, Risikofaktoren und früheren Mammographieergebnissen geplant werden.
Demenz
In der Women's Health Initiative Memory Study (WHIMS) wurden 4.532 allgemein gesunde postmenopausale Frauen im Alter von 65 Jahren und älter untersucht, von denen 35 % 70 bis 74 Jahre alt und 18 % 75 Jahre oder älter waren. Nach einer durchschnittlichen Nachbeobachtungszeit von 4 Jahren erhielten 40 mit CE/MPA behandelte Frauen (1,8 %, n = 2.229) und 21 Frauen in der Placebogruppe (0,9 %, n = 2.303) die Diagnose einer wahrscheinlichen Demenz. Das relative Risiko für CE/MPA im Vergleich zu Placebo betrug 2,05 (95 % Konfidenzintervall 1,21 – 3,48) und war ähnlich für Frauen mit und ohne Vorgeschichte von menopausalem Hormonkonsum vor WHIMS. Das absolute Risiko einer wahrscheinlichen Demenz für CE/MPA im Vergleich zu Placebo betrug 45 gegenüber 22 Fällen pro 10.000 Frauenjahre, und das absolute Exzessrisiko für CE/MPA betrug 23 Fälle pro 10.000 Frauenjahre. Es ist nicht bekannt, ob diese Ergebnisse für jüngere postmenopausale Frauen gelten. (Sehen KLINISCHE PHARMAKOLOGIE , Klinische Studien und VORSICHTSMASSNAHMEN , Geriatrische Verwendung .)
Es ist nicht bekannt, ob diese Ergebnisse für eine Östrogen-Monotherapie gelten.
Erkrankung der Gallenblase
Bei postmenopausalen Frauen, die Östrogene erhielten, wurde über eine 2- bis 4-fache Erhöhung des Risikos einer Gallenblasenerkrankung berichtet, die eine Operation erforderlich machte.
Hyperkalzämie
Die Verabreichung von Östrogen kann bei Patienten mit Brustkrebs und Knochenmetastasen zu schwerer Hyperkalzämie führen. Wenn eine Hyperkalzämie auftritt, sollte die Anwendung des Arzneimittels beendet und geeignete Maßnahmen ergriffen werden, um den Serumkalziumspiegel zu senken.
Visuelle Anomalien
Bei Patienten, die Östrogene erhielten, wurde über retinale Gefäßthrombosen berichtet. Setzen Sie die Medikation bis zur Untersuchung ab, wenn ein plötzlicher teilweiser oder vollständiger Sehverlust oder ein plötzliches Auftreten von Proptosis, Diplopie oder Migräne auftritt. Wenn die Untersuchung ein Papillenödem oder retinale Gefäßläsionen zeigt, sollten Östrogene dauerhaft abgesetzt werden.
VORSICHTSMASSNAHMEN
Allgemein
Zugabe eines Gestagens, wenn eine Frau keine Hysterektomie hatte
Studien über die Zugabe eines Gestagens über 10 oder mehr Tage eines Östrogenverabreichungszyklus oder täglich mit Östrogen in einem kontinuierlichen Regime haben über eine geringere Inzidenz von Endometriumhyperplasie berichtet, als sie durch eine Östrogenbehandlung allein induziert würde. Endometriumhyperplasie kann ein Vorläufer von Endometriumkrebs sein.
Es gibt jedoch mögliche Risiken, die mit der Anwendung von Gestagenen zusammen mit Östrogenen im Vergleich zu Östrogen-Monotherapien verbunden sein können. Dazu gehört ein möglicherweise erhöhtes Brustkrebsrisiko.
Erhöhter Blutdruck
In einer kleinen Anzahl von Fallberichten wurden erhebliche Blutdruckanstiege auf idiosynkratische Reaktionen auf Östrogene zurückgeführt. In einer großen, randomisierten, Placebo-kontrollierten klinischen Studie wurde keine allgemeine Wirkung von Östrogenen auf den Blutdruck beobachtet. Der Blutdruck sollte bei Östrogenanwendung in regelmäßigen Abständen überwacht werden.
Hypertriglyzeridämie
Bei Patienten mit vorbestehender Hypertriglyceridämie kann eine Östrogentherapie mit Erhöhungen der Plasmatriglyceride verbunden sein, was zu Pankreatitis und anderen Komplikationen führt.
Beeinträchtigte Leberfunktion und Vorgeschichte von cholestatischer Gelbsucht
Östrogene können bei Patienten mit eingeschränkter Leberfunktion schlecht metabolisiert werden. Bei Patienten mit cholestatischem Ikterus in der Vorgeschichte im Zusammenhang mit einer früheren Östrogenanwendung oder einer Schwangerschaft ist Vorsicht geboten und im Falle eines erneuten Auftretens sollte die Medikation abgesetzt werden.
Hypothyreose
Die Verabreichung von Östrogen führt zu erhöhten Spiegeln des Schilddrüsen-bindenden Globulins (TBG). Patienten mit normaler Schilddrüsenfunktion können das erhöhte TBG kompensieren, indem sie mehr Schilddrüsenhormon produzieren, wodurch die freien T4- und T3-Serumkonzentrationen im normalen Bereich gehalten werden. Patienten, die auf eine Schilddrüsenhormon-Ersatztherapie angewiesen sind und gleichzeitig Östrogene erhalten, benötigen möglicherweise höhere Dosen ihrer Schilddrüsen-Ersatztherapie. Diese Patienten sollten ihre Schilddrüsenfunktion überwachen lassen, um ihre freien Schilddrüsenhormonspiegel in einem akzeptablen Bereich zu halten.
Flüssigkeitsretention
Da Östrogene ein gewisses Maß an Flüssigkeitsretention verursachen können, müssen Patienten mit Zuständen, die durch diesen Faktor beeinflusst werden können, wie Asthma, Epilepsie, Migräne und Herz- oder Nierenfunktionsstörungen, sorgfältig überwacht werden, wenn Östrogene verschrieben werden.
Hypokalzämie
Östrogene sollten bei Personen mit schwerer Hypokalzämie mit Vorsicht angewendet werden.
Eierstockkrebs
Die CE/MPA-Substudie von WHI berichtete, dass Östrogen plus Gestagen das Risiko für Eierstockkrebs erhöht. Nach einer durchschnittlichen Nachbeobachtungszeit von 5,6 Jahren betrug das relative Risiko für Eierstockkrebs für CE/MPA im Vergleich zu Placebo 1,58 (95 % Konfidenzintervall 0,77 – 3,24), war aber statistisch nicht signifikant. Das absolute Risiko für CE/MPA gegenüber Placebo betrug 4,2 gegenüber 2,7 Fällen pro 10.000 Frauenjahre. In einigen epidemiologischen Studien wurde die Anwendung von Östrogen allein, insbesondere über zehn oder mehr Jahre, mit einem erhöhten Risiko für Eierstockkrebs in Verbindung gebracht. Andere epidemiologische Studien haben diese Assoziationen nicht gefunden.
Verschlimmerung der Endometriose
Endometriose kann durch die Verabreichung von Östrogenen verschlimmert werden. Bei Frauen, die nach einer Hysterektomie mit einer Östrogen-Monotherapie behandelt wurden, wurden einige wenige Fälle von bösartiger Transformation von Endometriumrestimplantaten berichtet. Bei Patientinnen mit bekannter Restendometriose nach Hysterektomie sollte die Zugabe von Gestagen in Erwägung gezogen werden.
Verschlimmerung anderer Bedingungen
Östrogene können eine Verschlimmerung von Asthma, Diabetes mellitus, Epilepsie, Migräne oder Porphyrie, systemischem Lupus erythematodes und hepatischen Hämangiomen verursachen und sollten bei Frauen mit diesen Erkrankungen mit Vorsicht angewendet werden.
ESTRACE (Estradiol-Tabletten, USP), 2 mg, enthält FD&C Yellow No. 5 (Tartrazin), das bei bestimmten empfindlichen Personen allergische Reaktionen (einschließlich Bronchialasthma) hervorrufen kann. Obwohl die Gesamtinzidenz der FD&C Yellow No. 5 (Tartrazin)-Empfindlichkeit in der allgemeinen Bevölkerung gering ist, wird sie häufig bei Patienten beobachtet, die auch eine Aspirin-Überempfindlichkeit haben.
Informationen zum Patienten
Ärzten wird empfohlen, dies zu besprechen INFORMATIONEN ZUM PATIENTEN Packungsbeilage mit Patienten, denen sie ESTRACE verschreiben.
Labortests
Die Östrogenverabreichung sollte mit der niedrigsten für die Indikation zugelassenen Dosis begonnen werden und sich dann eher nach dem klinischen Ansprechen als nach Serumhormonspiegeln (z. B. Östradiol, FSH) richten. (Sehen DOSIERUNG UND ANWENDUNG Sektion.)
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Die langfristige kontinuierliche Verabreichung von Östrogen mit und ohne Gestagen bei Frauen mit und ohne Gebärmutter hat ein erhöhtes Risiko für Endometriumkrebs, Brustkrebs und Eierstockkrebs gezeigt. (Sehen KASTENWARNUNGEN , WARNUNGEN und VORSICHTSMASSNAHMEN .)
Die langfristige kontinuierliche Verabreichung von natürlichen und synthetischen Östrogenen bei bestimmten Tierarten erhöht die Häufigkeit von Karzinomen der Brust, des Uterus, des Gebärmutterhalses, der Vagina, der Hoden und der Leber.
Schwangerschaftskategorie X
Estrace 2 mg sollte nicht während der Schwangerschaft angewendet werden. (Sehen KONTRAINDIKATIONEN .)
Stillende Mutter
Es hat sich gezeigt, dass die Verabreichung von Östrogen an stillende Mütter die Quantität und Qualität der Milch verringert. Nachweisbare Mengen an Östrogenen wurden in der Milch von Müttern identifiziert, die dieses Medikament erhielten. Vorsicht ist geboten, wenn ESTRACE 1 mg einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen. Es hat sich gezeigt, dass große und wiederholte Östrogendosen über einen längeren Zeitraum den Epiphysenschluss beschleunigen, was zu einer kleinen Erwachsenengröße führt, wenn die Behandlung vor Abschluss der physiologischen Pubertät bei sich normal entwickelnden Kindern begonnen wird. Bei Patienten, bei denen das Knochenwachstum nicht abgeschlossen ist, wird eine regelmäßige Überwachung der Knochenreifung und der Auswirkungen auf die Epiphysenzentren empfohlen.
Die Östrogenbehandlung von präpubertären Kindern induziert auch eine vorzeitige Brustentwicklung und eine vaginale Verhornung und kann möglicherweise vaginale Blutungen bei Mädchen hervorrufen. Bei Jungen kann eine Östrogenbehandlung den normalen Pubertätsprozess verändern. Alle anderen physiologischen Reaktionen und Nebenwirkungen, die nachweislich mit einer Östrogenbehandlung von Erwachsenen in Zusammenhang stehen, könnten möglicherweise bei Kindern und Jugendlichen auftreten, einschließlich thromboembolischer Erkrankungen und Wachstumsstimulation bestimmter Tumore. Daher sollten Östrogene nur bei eindeutiger Indikation bei pädiatrischen Patienten verabreicht werden, und es sollte immer die niedrigste wirksame Dosis angewendet werden.
Geriatrische Verwendung
Die Sicherheit und Wirksamkeit von ESTRACE Tabletten bei geriatrischen Patienten wurde nicht nachgewiesen. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, der die größte Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerspiegelt.
In der Gedächtnisstudie der Women's Health Initiative, an der 4.532 Frauen ab 65 Jahren teilnahmen, die durchschnittlich 4 Jahre lang beobachtet wurden, waren 82 % (n = 3.729) 65 bis 74 Jahre alt, während 18 % (n = 803) 75 Jahre und älter waren. Die meisten Frauen (80 %) hatten zuvor keine Hormontherapie angewendet. Es wurde berichtet, dass Frauen, die mit konjugierten Östrogenen plus Medroxyprogesteronacetat behandelt wurden, ein zweifach erhöhtes Risiko haben, wahrscheinlich eine Demenz zu entwickeln. Die Alzheimer-Krankheit war die häufigste Klassifikation einer wahrscheinlichen Demenz sowohl in der Gruppe mit konjugierten Östrogenen plus Medroxyprogesteronacetat als auch in der Placebo-Gruppe. Neunzig Prozent der Fälle von wahrscheinlicher Demenz traten bei den 54 % der Frauen auf, die älter als 70 Jahre waren. (Siehe WARNUNGEN , Demenz .)
Es ist nicht bekannt, ob diese Ergebnisse für eine Östrogen-Monotherapie gelten.
ÜBERDOSIS
Nach akuter Einnahme hoher Dosen östrogenhaltiger oraler Kontrazeptiva durch Kleinkinder wurden keine schwerwiegenden Nebenwirkungen berichtet. Eine Überdosierung von Östrogen kann Übelkeit und Erbrechen verursachen, und bei Frauen können Entzugsblutungen auftreten.
KONTRAINDIKATIONEN
Östrogene sollten nicht bei Personen mit einer der folgenden Erkrankungen angewendet werden:
KLINISCHE PHARMAKOLOGIE
Endogene Östrogene sind maßgeblich für die Entwicklung und Aufrechterhaltung des weiblichen Fortpflanzungssystems und der sekundären Geschlechtsmerkmale verantwortlich. Obwohl zirkulierende Östrogene in einem dynamischen Gleichgewicht metabolischer Umwandlungen existieren, ist Östradiol das hauptsächliche intrazelluläre menschliche Östrogen und auf Rezeptorebene wesentlich wirksamer als seine Metaboliten Östron und Östriol.
Die Hauptquelle für Östrogen bei erwachsenen Frauen mit normalem Zyklus ist der Ovarialfollikel, der je nach Phase des Menstruationszyklus täglich 70 bis 500 µg Östradiol absondert. Nach der Menopause wird das meiste endogene Östrogen durch Umwandlung von Androstendion, das von der Nebennierenrinde ausgeschieden wird, in Östron durch periphere Gewebe produziert. Somit sind Östron und die sulfatkonjugierte Form, Östronsulfat, die am häufigsten zirkulierenden Östrogene bei postmenopausalen Frauen.
Östrogene wirken durch Bindung an Kernrezeptoren in Östrogen-responsiven Geweben. Bisher wurden zwei Östrogenrezeptoren identifiziert. Diese variieren im Verhältnis von Gewebe zu Gewebe.
Zirkulierende Östrogene modulieren die hypophysäre Sekretion der Gonadotropine, des luteinisierenden Hormons (LH) und des follikelstimulierenden Hormons (FSH) durch einen negativen Rückkopplungsmechanismus. Östrogene wirken, um die erhöhten Spiegel dieser Hormone zu reduzieren, die bei postmenopausalen Frauen beobachtet werden.
Pharmakokinetik
Verteilung
Die Verteilung von exogenen Östrogenen ist ähnlich der von endogenen Östrogenen. Östrogene sind im Körper weit verbreitet und kommen in der Regel in höheren Konzentrationen in den Zielorganen der Sexualhormone vor. Östrogene zirkulieren im Blut, größtenteils gebunden an Sexualhormon-bindendes Globulin (SHBG) und Albumin.
Stoffwechsel
Exogene Östrogene werden auf die gleiche Weise wie endogene Östrogene metabolisiert. Zirkulierende Östrogene existieren in einem dynamischen Gleichgewicht metabolischer Umwandlungen. Diese Umwandlungen finden hauptsächlich in der Leber statt. Östradiol wird reversibel in Östron umgewandelt, und beide können in Östriol umgewandelt werden, das der Hauptmetabolit im Urin ist. Östrogene unterliegen auch einer enterohepatischen Rezirkulation über Sulfat- und Glucuronid-Konjugation in der Leber, Gallensekretion von Konjugaten in den Darm und Hydrolyse im Darm, gefolgt von Reabsorption. Bei postmenopausalen Frauen liegt ein erheblicher Anteil der zirkulierenden Östrogene als Sulfatkonjugate vor, insbesondere Östronsulfat, das als zirkulierendes Reservoir für die Bildung von aktiveren Östrogenen dient.
Ausscheidung
Estradiol, Estron und Estriol werden zusammen mit Glucuronid- und Sulfatkonjugaten im Urin ausgeschieden.
Besondere Populationen
Es wurden keine pharmakokinetischen Studien in speziellen Populationen, einschließlich Patienten mit eingeschränkter Nieren- oder Leberfunktion, durchgeführt.
Wechselwirkungen mit anderen Medikamenten
In-vitro- und In-vivo-Studien haben gezeigt, dass Östrogene teilweise durch Cytochrom P450 3A4 (CYP3A4) metabolisiert werden. Daher können Induktoren oder Inhibitoren von CYP3A4 den Metabolismus von Östrogenen beeinflussen. Induktoren von CYP3A4 wie Johanniskrautpräparate (Hypericum perforatum), Phenobarbital, Carbamazepin und Rifampin können die Plasmakonzentrationen von Östrogenen verringern, was möglicherweise zu einer Verringerung der therapeutischen Wirkung und/oder zu Veränderungen des uterinen Blutungsprofils führt. CYP3A4-Inhibitoren wie Erythromycin, Clarithromycin, Ketoconazol, Itraconazol, Ritonavir und Grapefruitsaft können die Plasmakonzentrationen von Östrogenen erhöhen und zu Nebenwirkungen führen.
Klinische Studien
Osteoporose
Die meisten prospektiven Wirksamkeitsstudien für diese Indikation wurden an weißen Frauen in den Wechseljahren ohne Stratifizierung nach anderen Risikofaktoren durchgeführt und zeigen tendenziell eine allgemein heilsame Wirkung auf die Knochen.
Die Ergebnisse einer zweijährigen, randomisierten, placebokontrollierten, doppelblinden Dosisfindungsstudie haben gezeigt, dass die Behandlung mit 0,5 mg Estradiol täglich über 23 Tage (in einem 28-Tage-Zyklus) den Verlust der vertebralen Knochenmasse bei postmenopausalen Frauen verhindert. Wenn die Östrogentherapie abgesetzt wird, nimmt die Knochenmasse mit einer Geschwindigkeit ab, die mit der unmittelbaren Zeit nach der Menopause vergleichbar ist. Es gibt keine Hinweise darauf, dass eine Östrogenersatztherapie die Knochenmasse auf das Niveau vor der Menopause wiederherstellt.
Studien der Frauengesundheitsinitiative
Die Women’s Health Initiative (WHI) hat insgesamt 27.000 überwiegend gesunde postmenopausale Frauen aufgenommen, um die Risiken und Vorteile entweder der oralen Anwendung von 0,625 mg konjugierter Östrogene (CE) pro Tag allein oder der oralen Anwendung von 0,625 mg konjugierter Östrogene zu bewerten Östrogene plus 2,5 mg Medroxyprogesteronacetat (MPA) pro Tag im Vergleich zu Placebo zur Vorbeugung bestimmter chronischer Erkrankungen. Der primäre Endpunkt war die Inzidenz der koronaren Herzkrankheit (KHK) (nicht tödlicher Myokardinfarkt und KHK-Tod), wobei invasiver Brustkrebs als primäre Nebenwirkung untersucht wurde. Ein „globaler Index“ umfasste das früheste Auftreten von KHK, invasivem Brustkrebs, Schlaganfall, Lungenembolie (PE), Gebärmutterschleimhautkrebs, Darmkrebs, Hüftfraktur oder Tod aus anderen Gründen. In der Studie wurden die Wirkungen von CE oder CE/MPA auf Wechseljahrsbeschwerden nicht bewertet.
Die CE/MPA-Teilstudie wurde vorzeitig beendet, da gemäß der vordefinierten Stoppregel das erhöhte Risiko für Brustkrebs und kardiovaskuläre Ereignisse den im „globalen Index“ enthaltenen spezifizierten Nutzen überstieg. Die Ergebnisse der CE/MPA-Unterstudie mit 16.608 Frauen (Durchschnittsalter 63 Jahre, Bereich 50 bis 79; 83,9 % Weiße, 6,5 % Schwarze, 5,5 % Hispanoamerikaner) nach einer durchschnittlichen Nachbeobachtungszeit von 5,2 Jahren sind in der Tabelle dargestellt 1 unten:
Für die im „globalen Index“ enthaltenen Ergebnisse waren die absoluten Exzessrisiken pro 10.000 Frauenjahre in der mit CE/MPA behandelten Gruppe 7 weitere KHK-Ereignisse, 8 weitere Schlaganfälle, 8 weitere PEs und 8 weitere invasive Brustkrebserkrankungen Die absolute Risikoreduktion pro 10.000 Frauenjahre betrug 6 weniger Darmkrebs und 5 weniger Hüftfrakturen. Das absolute Exzessrisiko von Ereignissen, die in den „globalen Index“ aufgenommen wurden, betrug 19 pro 10.000 Frauenjahre. Es gab keinen Unterschied zwischen den Gruppen in Bezug auf die Gesamtmortalität. (Sehen KASTENWARNUNGEN , WARNUNGEN , und VORSICHTSMASSNAHMEN .)
Gedächtnisstudie der Frauengesundheitsinitiative
In die Women’s Health Initiative Memory Study (WHIMS), eine Teilstudie von WHI, wurden 4.532 überwiegend gesunde postmenopausale Frauen im Alter von 65 Jahren und älter aufgenommen (47 % waren zwischen 65 und 69 Jahre alt, 35 % waren zwischen 70 und 74 Jahre alt und 18 Jahre alt). % waren 75 Jahre und älter), um die Auswirkungen von CE/MPA (0,625 mg konjugierte Östrogene plus 2,5 mg Medroxyprogesteronacetat) auf das Auftreten einer wahrscheinlichen Demenz (primärer Endpunkt) im Vergleich zu Placebo zu bewerten.
Nach einer durchschnittlichen Nachbeobachtungszeit von 4 Jahren wurde bei 40 Frauen in der Östrogen/Gestagen-Gruppe (45 pro 10.000 Frauenjahre) und 21 in der Placebogruppe (22 pro 10.000 Frauenjahre) eine wahrscheinliche Demenz diagnostiziert. Das relative Risiko einer wahrscheinlichen Demenz in der Hormontherapiegruppe betrug 2,05 (95 % KI, 1,21 bis 3,48) im Vergleich zu Placebo. Unterschiede zwischen den Gruppen zeigten sich im ersten Jahr der Behandlung. Es ist nicht bekannt, ob diese Ergebnisse für jüngere postmenopausale Frauen gelten. (Sehen Eingerahmte Warnung und WARNUNGEN , Demenz .)
INFORMATIONEN ZUM PATIENTEN
EINLEITUNG
Lesen Sie diese Patienteninformation, bevor Sie mit der Einnahme von ESTRACE 2 mg beginnen, und lesen Sie, was Sie jedes Mal erhalten, wenn Sie ESTRACE nachfüllen. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung.
WAS SIND DIE WICHTIGSTEN INFORMATIONEN, DIE ICH ÜBER ESTRACE (EIN ÖSTROGENHORMON) WISSEN SOLLTE?
Melden Sie jede ungewöhnliche vaginale Blutung sofort, während Sie Östrogene einnehmen. Vaginale Blutungen nach der Menopause können ein Warnzeichen für Gebärmutterkrebs sein. Ihr Arzt sollte jede ungewöhnliche vaginale Blutung untersuchen, um die Ursache herauszufinden.
Die Anwendung von Östrogenen mit oder ohne Gestagen kann Ihre Chancen auf Herzinfarkte, Schlaganfälle, Brustkrebs und Blutgerinnsel erhöhen. Die Anwendung von Östrogenen mit Gestagenen kann Ihr Demenzrisiko erhöhen. Sie und Ihr Arzt sollten regelmäßig darüber sprechen, ob Sie noch eine Behandlung mit ESTRACE benötigen.
WAS IST ESTRACE?
ESTRACE ist ein Arzneimittel, das Östrogenhormone enthält.
WOFÜR WIRD ESTRACE ANGEWENDET?
ESTRACE 1 mg wird angewendet zur:
Östrogene sind Hormone, die von den Eierstöcken einer Frau gebildet werden. Zwischen dem 45. und 55. Lebensjahr stellen die Eierstöcke normalerweise die Produktion von Östrogenen ein. Dies führt zu einem Abfall des Östrogenspiegels im Körper, der die „Lebensveränderung“ oder die Menopause (das Ende der monatlichen Menstruation) verursacht. Manchmal werden beide Eierstöcke während einer Operation entfernt, bevor die natürliche Menopause eintritt. Der plötzliche Abfall des Östrogenspiegels verursacht „chirurgische Wechseljahre“.
Wenn der Östrogenspiegel zu sinken beginnt, entwickeln manche Frauen sehr unangenehme Symptome, wie Wärmegefühle in Gesicht, Hals und Brust oder plötzlich starke Hitzegefühle und Schweißausbrüche („Hitzewallungen“ oder „Hitzewallungen“). Bei einigen Frauen sind die Symptome mild und sie benötigen keine Östrogene. Bei anderen Frauen können die Symptome schwerwiegender sein. Sie und Ihr Arzt sollten regelmäßig darüber sprechen, ob Sie noch eine Behandlung mit ESTRACE benötigen.
Belastungsübungen wie Gehen oder Laufen und die Einnahme von Kalzium mit Vitamin-D-Ergänzungen können ebenfalls Ihre Chancen auf eine postmenopausale Osteoporose verringern. Es ist wichtig, mit Ihrem Arzt über Bewegung und Nahrungsergänzungsmittel zu sprechen, bevor Sie damit beginnen.
Behandlung von Trockenheit, Juckreiz und Brennen in oder um die Vagina, Schwierigkeiten oder Brennen beim Wasserlassen im Zusammenhang mit der Menopause
Sie und Ihr Arzt sollten regelmäßig darüber sprechen, ob Sie noch eine Behandlung mit ESTRACE benötigen, um diese Probleme zu kontrollieren. Wenn Sie ESTRACE nur zur Behandlung von Trockenheit, Juckreiz und Brennen in und um Ihre Vagina verwenden, sprechen Sie mit Ihrem Arzt darüber, ob ein topisches Vaginalprodukt besser für Sie wäre.
Osteoporose in den Wechseljahren ist eine Ausdünnung der Knochen, die sie schwächer und leichter zu brechen macht. Wenn Sie ESTRACE 1 mg nur zur Vorbeugung von Osteoporose in den Wechseljahren anwenden, sprechen Sie mit Ihrem Arzt darüber, ob eine andere Behandlung oder ein Arzneimittel ohne Östrogene besser für Sie sein könnte. Sie und Ihr medizinisches Fachpersonal sollten regelmäßig darüber sprechen, ob Sie mit ESTRACE fortfahren sollten.
WER SOLLTE ESTRACE 2mg NICHT VERWENDEN?
Beginnen Sie nicht mit der Einnahme von ESTRACE 2 mg, wenn Sie:
Ungewöhnliche vaginale Blutungen können ein Warnzeichen für Gebärmutterkrebs sein, besonders wenn sie nach der Menopause auftreten. Ihr Arzt muss die Ursache der Blutung herausfinden, damit er die richtige Behandlung empfehlen kann. Die Einnahme von Östrogenen, ohne Ihren Arzt aufzusuchen, kann Ihnen ernsthaften Schaden zufügen, wenn Ihre Vaginalblutung durch Gebärmutterkrebs verursacht wird.
Östrogene können das Risiko für bestimmte Krebsarten, einschließlich Brust- oder Gebärmutterkrebs, erhöhen. Wenn Sie Krebs haben oder hatten, sprechen Sie mit Ihrem Arzt darüber, ob Sie ESTRACE einnehmen sollten.
(Bei bestimmten Patienten mit Brust- oder Prostatakrebs können Östrogene helfen.)
Eine Liste der Inhaltsstoffe von ESTRACE finden Sie am Ende dieser Packungsbeilage.
ESTRACE 2 mg Tabletten enthalten Tartrazin, das bei bestimmten empfindlichen Personen allergische Reaktionen (einschließlich Bronchialasthma) hervorrufen kann. Obwohl die Gesamtinzidenz der FD&C Yellow No. 5 (Tartrazin)-Empfindlichkeit in der allgemeinen Bevölkerung gering ist, wird sie häufig bei Patienten beobachtet, die auch eine Aspirin-Überempfindlichkeit haben.
Informieren Sie Ihren Arzt:
Das Hormon in ESTRACE 1 mg kann in Ihre Muttermilch übergehen
Ihr medizinischer Betreuer muss Sie möglicherweise sorgfältiger untersuchen, wenn Sie bestimmte Erkrankungen haben, wie z. B. Asthma (keuchende Atmung), Epilepsie (Krampfanfälle), Migräne, Endometriose, Lupus, Probleme mit Ihrem Herzen, Ihrer Leber, Ihrer Schilddrüse, Ihren Nieren oder einen hohen Kalziumspiegel in deinem Blut.
Dazu gehören verschreibungspflichtige und nicht verschreibungspflichtige Medikamente, Vitamine und pflanzliche Nahrungsergänzungsmittel. Einige Arzneimittel können die Wirkungsweise von ESTRACE 1 mg beeinflussen. ESTRACE 1 mg kann auch die Wirkung Ihrer anderen Arzneimittel beeinflussen.
Möglicherweise müssen Sie die Einnahme von Östrogenen abbrechen.
WIE SOLLTE ICH ESTRACE NEHMEN?
1. Beginnen Sie mit der niedrigsten Dosis und sprechen Sie mit Ihrem Arzt darüber, wie gut diese Dosis bei Ihnen wirkt.
2. Östrogene sollten nur so lange wie nötig in der geringstmöglichen Dosis für Ihre Behandlung angewendet werden. Sie und Ihr Arzt sollten regelmäßig (z. B. alle 3 bis 6 Monate) darüber sprechen, welche Dosis Sie einnehmen und ob Sie noch eine Behandlung mit ESTRACE benötigen.
WAS SIND DIE MÖGLICHEN NEBENWIRKUNGEN VON ÖSTROGENEN?
Weniger häufige, aber schwerwiegende Nebenwirkungen sind:
Dies sind einige der Warnzeichen für schwerwiegende Nebenwirkungen:
Rufen Sie sofort Ihren Arzt an, wenn Sie eines dieser Warnzeichen oder andere ungewöhnliche Symptome bemerken, die Sie beunruhigen.
Häufige Nebenwirkungen sind:
Andere Nebenwirkungen sind:
Dies sind nicht alle möglichen Nebenwirkungen von ESTRACE. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
WAS KANN ICH TUN, UM MEINE CHANCEN AUF SCHWERE NEBENWIRKUNGEN VON ESTRACE ZU VERRINGERN?
Wenn Sie Östrogene verwenden, können Sie Ihre Risiken verringern, indem Sie Folgendes tun:
Wenn eines dieser Warnsignale (oder andere ungewöhnliche Symptome) während der Anwendung von Östrogenen auftritt, wenden Sie sich sofort an Ihren Arzt:
Anormale Blutungen aus der Scheide (möglicher Gebärmutterkrebs)
Schmerzen in den Waden oder in der Brust, plötzliche Kurzatmigkeit oder Bluthusten (mögliches Gerinnsel in den Beinen oder Lungen)
Starke Kopfschmerzen oder Erbrechen, Schwindel, Ohnmacht, Seh- oder Sprachstörungen, Schwäche oder Taubheitsgefühl in einem Arm oder Bein (mögliches Gerinnsel im Gehirn oder Auge)
Knoten in der Brust (möglicherweise Brustkrebs; bitten Sie Ihren Arzt oder medizinisches Fachpersonal, Ihnen zu zeigen, wie Sie Ihre Brüste monatlich untersuchen können)
Gelbfärbung der Haut oder der Augen (mögliches Leberproblem)
Schmerzen, Schwellung oder Empfindlichkeit im Unterleib (mögliches Gallenblasenproblem)
ALLGEMEINE INFORMATIONEN ÜBER DIE SICHERE UND EFFEKTIVE VERWENDUNG VON ESTRACE
Medikamente werden manchmal für Erkrankungen verschrieben, die nicht in der Packungsbeilage erwähnt sind. Nehmen Sie ESTRACE 2 mg nicht bei Erkrankungen ein, für die es nicht verschrieben wurde. Geben Sie ESTRACE 1 mg nicht an andere Personen, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
HALTEN SIE ESTRACE AUSSERHALB DER REICHWEITE VON KINDERN AUF
Diese Packungsbeilage enthält eine Zusammenfassung der wichtigsten Informationen über ESTRACE. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt oder Apotheker. Sie können Informationen über ESTRACE anfordern, die für Angehörige der Gesundheitsberufe bestimmt sind. Weitere Informationen erhalten Sie unter der gebührenfreien Nummer 1-800-521-8813.
WAS SIND DIE INHALTSSTOFFE IN ESTRACE?
Inaktive Zutaten : Kolloidales Siliciumdioxid, Maisstärke, dibasisches Calciumphosphat, Lactosemonohydrat, Magnesiumstearat und Natriumstärkeglykolat. Zusätzlich enthält das 1 mg auch FD&C blue no. 1 Alulack und D&C rot Nr. 27 Aluminiumlack. Die 2 mg enthalten auch FD&C blue no. 1 Alulack und FD&C gelb Nr. 5 (Tartrazin) Aluminiumlack.