Provera 5mg, 10mg Medroxyprogesterone Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Provera und wie wird es angewendet?
Provera 10 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome starke Menstruationsblutung, ausbleibende oder unregelmäßige Menstruationsblutung und zur Empfängnisverhütung. Provera 10 mg kann allein oder mit anderen Medikamenten verwendet werden.
Provera 5mg gehört zu einer Klasse von Medikamenten namens Antineoplastika, Hormone, Gestagene.
Es ist nicht bekannt, ob Provera bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Provera 10mg haben?
Provera 5 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Provera 10 mg sind:
WARNUNG
KARDIOVASKULÄRE ERKRANKUNGEN, BRUSTKREBS UND WAHRSCHEINLICHE DEMENZ FÜR ÖSTROGEN PLUS PROGESTIN-THERAPIE
Herz-Kreislauf-Erkrankungen und wahrscheinliche Demenz
Eine Östrogen-plus-Gestagen-Therapie sollte nicht zur Vorbeugung von Herz-Kreislauf-Erkrankungen oder Demenz eingesetzt werden. (Sehen Klinische Studien und WARNUNGEN , Herz-Kreislauf-Erkrankungen und wahrscheinliche Demenz .)
Die Substudie Östrogen plus Progestin der Women's Health Initiative (WHI) berichtete über ein erhöhtes Risiko für tiefe Venenthrombose (TVT), Lungenembolie (LE), Schlaganfall und Myokardinfarkt (MI) bei postmenopausalen Frauen (50 bis 79 Jahre). ) während einer 5,6-jährigen Behandlung mit täglichen oralen konjugierten Östrogenen (CE) [0,625 mg] in Kombination mit Medroxyprogesteronacetat (MPA) [2,5 mg], relativ zu Placebo. (Sehen Klinische Studien und WARNUNGEN , Herz-Kreislauf-Erkrankungen .)
Die WHI Memory Study (WHIMS) Östrogen plus Progestin Zusatzstudie berichtete über ein erhöhtes Risiko für die Entwicklung einer wahrscheinlichen Demenz bei postmenopausalen Frauen im Alter von 65 Jahren oder älter während einer 4-jährigen Behandlung mit täglichem CE (0,625 mg) in Kombination mit MPA (2,5 mg), relativ zu Placebo. Es ist nicht bekannt, ob dieser Befund für jüngere postmenopausale Frauen gilt. (Sehen Klinische Studien und WARNUNGEN , Wahrscheinlich Demenz und VORSICHTSMASSNAHMEN , Geriatrische Verwendung .)
Brustkrebs
Die WHI-Substudie Östrogen plus Progestin zeigte ein erhöhtes Risiko für invasiven Brustkrebs. (Sehen Klinische Studien und WARNUNGEN , Bösartige Neubildung , Brustkrebs .)
In Ermangelung vergleichbarer Daten sollte davon ausgegangen werden, dass diese Risiken für andere Dosen von CE und MPA sowie andere Kombinationen und Darreichungsformen von Östrogenen und Progestinen ähnlich sind.
Gestagene mit Östrogenen sollten in den niedrigsten wirksamen Dosen und für die kürzeste Dauer verschrieben werden, die mit den Behandlungszielen und Risiken für die jeweilige Frau vereinbar sind.
BEZEICHNUNG
PROVERA® Tabletten enthalten Medroxyprogesteronacetat, das ein Derivat von Progesteron ist. Es ist ein weißes bis cremefarbenes, geruchloses, kristallines Pulver, das an der Luft stabil ist und zwischen 200 und 210 °C schmilzt. Es ist frei löslich in Chloroform, löslich in Aceton und Dioxan, schwer löslich in Alkohol und Methanol, wenig löslich in Ether und unlöslich in Wasser.
Der chemische Name für Medroxyprogesteronacetat ist Pregn-4-ene-3, 20-dion, 17-(acetyloxy)-6-methyl-, (6α)-. Die Strukturformel lautet:
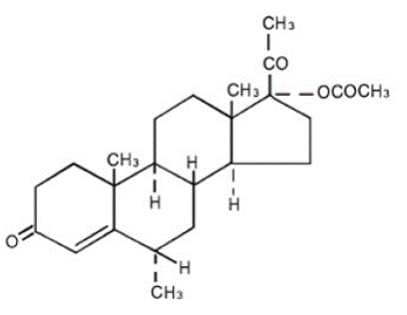
Jede Tablette PROVERA 5 mg zur oralen Verabreichung enthält 2,5 mg, 5 mg oder 10 mg Medroxyprogesteronacetat und die folgenden Hilfsstoffe: Calciumstearat, Maisstärke, Lactose, Mineralöl, Sorbinsäure, Saccharose und Talkum. Die 2,5-mg-Tablette enthält FD&C Yellow Nr. 6.
INDIKATIONEN
PROVERA 5 mg Tabletten sind angezeigt zur Behandlung von sekundärer Amenorrhoe und abnormen Uterusblutungen aufgrund eines hormonellen Ungleichgewichts ohne organische Pathologien wie Myome oder Gebärmutterkrebs. Sie sind auch zur Vorbeugung einer Endometriumhyperplasie bei postmenopausalen Frauen ohne Hysterektomie indiziert, die täglich 0,625-mg-Tabletten mit konjugierten Östrogenen oral erhalten.
DOSIERUNG UND ANWENDUNG
Sekundäre Amenorrhoe
PROVERA 10 mg Tabletten können in Dosierungen von 5 oder 10 mg täglich für 5 bis 10 Tage verabreicht werden. Eine Dosis zur Induktion einer optimalen sekretorischen Transformation eines Endometriums, das ausreichend entweder mit endogenem oder exogenem Östrogen vorbereitet wurde, beträgt 10 mg PROVERA 10 mg täglich für 10 Tage. Bei sekundärer Amenorrhoe kann jederzeit mit der Therapie begonnen werden. Gestagen-Entzugsblutungen treten in der Regel innerhalb von drei bis sieben Tagen nach Absetzen der Behandlung mit PROVERA 10 mg auf.
Anormale Uterusblutungen aufgrund eines hormonellen Ungleichgewichts in Abwesenheit einer organischen Pathologie
Beginnend am berechneten 16. oder 21. Tag des Menstruationszyklus können 5 oder 10 mg PROVERA 10 mg täglich für 5 bis 10 Tage gegeben werden. Um eine optimale sekretorische Transformation einer Gebärmutterschleimhaut zu erreichen, die entweder mit endogenem oder exogenem Östrogen ausreichend geprimt wurde, werden 10 mg PROVERA 10 mg täglich für 10 Tage, beginnend am 16. Tag des Zyklus, empfohlen. Gestagen-Entzugsblutungen treten in der Regel innerhalb von drei bis sieben Tagen nach Absetzen der Behandlung mit PROVERA auf. Patientinnen mit wiederkehrenden Episoden abnormaler Uterusblutungen in der Vorgeschichte können von einem geplanten Menstruationszyklus mit PROVERA profitieren.
Reduktion der Endometriumhyperplasie bei postmenopausalen Frauen, die täglich 0,625 mg konjugierte Östrogene erhalten
Wenn einer postmenopausalen Frau mit Gebärmutter Östrogen verschrieben wird, sollte auch ein Gestagen verabreicht werden, um das Risiko eines Endometriumkarzinoms zu verringern. Eine Frau ohne Gebärmutter braucht kein Gestagen. Die Anwendung von Östrogen, allein oder in Kombination mit einem Gestagen, sollte in der niedrigsten wirksamen Dosis und für die kürzeste Dauer erfolgen, die mit den Behandlungszielen und Risiken für die jeweilige Frau vereinbar ist. Die Patienten sollten je nach klinischer Notwendigkeit regelmäßig (z. B. in Abständen von 3 bis 6 Monaten) neu untersucht werden, um festzustellen, ob eine Behandlung noch erforderlich ist (siehe WARNUNGEN ). Bei Frauen mit Uterus sollten geeignete diagnostische Maßnahmen, wie z. B. eine Endometriumentnahme, falls indiziert, durchgeführt werden, um bei nicht diagnostizierten anhaltenden oder wiederkehrenden abnormalen Vaginalblutungen eine Malignität auszuschließen.
PROVERA Tabletten können an postmenopausalen Frauen, die täglich 0,625 mg konjugierte Östrogene erhalten, in Dosierungen von 5 oder 10 mg täglich an 12 bis 14 aufeinanderfolgenden Tagen pro Monat verabreicht werden, entweder beginnend am 1.
Patienten sollten mit der niedrigsten Dosis begonnen werden.
Die niedrigste wirksame Dosis von PROVERA wurde nicht bestimmt.
WIE GELIEFERT
PROVERA 10 mg Tabletten sind in folgenden Stärken und Packungsgrößen erhältlich:
2,5 mg (gekerbt, rund, orange)
Flaschen zu 30 NDC 0009-0064-06 Flaschen zu 100 NDC 0009-0064-04
5mg (geritzt, sechseckig, weiß)
Flaschen zu 100 NDC 0009-0286-03
10mg (gekerbt, rund, weiß)
Flaschen zu 100 NDC 0009-0050-02 Flaschen zu 500 NDC 0009-0050-11
Bei kontrollierter Raumtemperatur von 20° bis 25°C (68° bis 77°F) lagern [siehe USP ].
„Außer Reichweite von Kindern aufbewahren“
Vertrieb durch: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. Überarbeitet: August 2015
NEBENWIRKUNGEN
Sehen KASTENWARNUNGEN , WARNUNGEN , und VORSICHTSMASSNAHMEN .
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die folgenden Nebenwirkungen wurden bei Frauen berichtet, die PROVERA 10 mg Tabletten ohne begleitende Östrogenbehandlung einnahmen:
Urogenitalsystem
Anormale Uterusblutung (unregelmäßig, Zunahme, Abnahme), Veränderung des Menstruationsflusses, Durchbruchblutung, Schmierblutung, Amenorrhoe, Veränderungen der Zervixerosion und der Zervixsekretion.
Brüste
Brustspannen, Mastodynie oder Galaktorrhoe wurden berichtet.
Herz-Kreislauf
Thromboembolische Erkrankungen einschließlich Thrombophlebitis und Lungenembolie wurden berichtet.
Magen-Darm
Übelkeit, cholestatische Gelbsucht.
Haut
Überempfindlichkeitsreaktionen bestehend aus Urtikaria, Juckreiz, Ödemen und generalisiertem Hautausschlag sind aufgetreten. Akne, Empfindlichkeitsreaktionen bestehend aus Urtikaria, Juckreiz, Ödemen und generalisiertem Hautausschlag sind aufgetreten. Akne, Alopezie und Hirsutismus wurden berichtet.
Augen
Neurookulare Läsionen, zum Beispiel Netzhautthrombose und Optikusneuritis.
Zentrales Nervensystem
Psychische Depression, Schlaflosigkeit, Schläfrigkeit, Schwindel, Kopfschmerzen, Nervosität.
Sonstig
Überempfindlichkeitsreaktionen (z. B. Anaphylaxie und anaphylaktoide Reaktionen, Angioödem), Hautausschlag (allergisch) mit und ohne Juckreiz, Gewichtsveränderung (Zunahme oder Abnahme), Fieber, Ödeme/Flüssigkeitsretention, Müdigkeit, verminderte Glukosetoleranz.
Die folgenden Nebenwirkungen wurden bei einer Östrogen-plus-Gestagen-Therapie berichtet.
Urogenitalsystem
Abnorme Uterusblutungen/Schmierflecken oder Blutungen; Durchbruchblutung; Spotten; Dysmenorrhoe/Beckenschmerzen; Zunahme der Größe von Uterusleiomyomen; Vaginitis, einschließlich vaginaler Candidiasis; Veränderung der Zervixsekretion; Veränderungen des zervikalen Ektropiums; Eierstockkrebs; Endometriumhyperplasie; Endometriumkarzinom.
Brüste
Empfindlichkeit, Vergrößerung, Schmerzen, Brustwarzenausfluss, Galaktorrhoe; fibrozystische Brustveränderungen; Brustkrebs.
Herz-Kreislauf
Tiefe und oberflächliche Venenthrombose; Lungenembolie; Thrombophlebitis; Herzinfarkt; streicheln; Anstieg des Blutdrucks.
Magen-Darm
Übelkeit, Erbrechen; Bauchkrämpfe, Blähungen; Cholestatische Gelbsucht; erhöhte Inzidenz von Erkrankungen der Gallenblase; Pankreatitis; Vergrößerung hepatischer Hämangiome.
Haut
Chloasma oder Melasma, die bestehen bleiben können, wenn das Arzneimittel abgesetzt wird; Erythema multiforme; Erythema nodosum; hämorrhagischer Ausbruch; Verlust von Kopfhaaren; Hirsutismus; Juckreiz, Hautausschlag.
Augen
Gefäßthrombose der Netzhaut, Unverträglichkeit von Kontaktlinsen.
Zentrales Nervensystem
Kopfschmerzen; Migräne; Schwindel; mentale Depression; Chorea; Nervosität; Stimmungsstörungen; Reizbarkeit; Verschlimmerung von Epilepsie, Demenz.
Sonstig
Gewichtszunahme oder -abnahme; reduzierte Kohlenhydrattoleranz; Verschlimmerung von Porphyrie; Ödem; Arthalgien; Beinkrämpfe; Veränderungen der Libido; Urtikaria, Angioödem, anaphylaktoide/anaphylaktische Reaktionen; Hypokalzämie; Verschlimmerung von Asthma; erhöhte Triglyceride.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Arzneimittel-Labortest-Wechselwirkungen
Die folgenden Laborergebnisse können durch die Anwendung von Östrogen plus Progestin-Therapie verändert werden:
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
Sehen KASTENWARNUNGEN .
Herz-Kreislauf-Erkrankungen
Es wurde über ein erhöhtes Risiko für LE, TVT, Schlaganfall und Myokardinfarkt bei einer Östrogen-plus-Gestagen-Therapie berichtet. Wenn eines dieser Ereignisse auftritt oder vermutet wird, sollte die Behandlung mit Estrogen plus Gestagen sofort abgebrochen werden.
Risikofaktoren für arterielle Gefäßerkrankungen (z. B. Bluthochdruck, Diabetes mellitus, Tabakkonsum, Hypercholesterinämie und Fettleibigkeit) und/oder venöse Thromboembolien (VTE) (z. B. VTE in der eigenen oder familiären Vorgeschichte, Fettleibigkeit und systemischer Lupus erythematodes) sollten angemessen verwaltet werden.
Streicheln
In der Substudie WHI Östrogen plus Progestin wurde bei Frauen im Alter von 50 bis 79 Jahren, die CE (0,625 mg) plus MPA (2,5 mg) erhielten, ein statistisch signifikant erhöhtes Schlaganfallrisiko im Vergleich zu Frauen derselben Altersgruppe, die Placebo erhielten, berichtet (33 vs 25 pro 10.000 Frauenjahre). (Sehen Klinische Studien .) Der Anstieg des Risikos wurde nach dem ersten Jahr nachgewiesen und blieb bestehen. Wenn ein Schlaganfall auftritt oder vermutet wird, sollte die Estrogen-Gestagen-Therapie sofort abgesetzt werden.
Koronare Herzerkrankung
In der Substudie WHI Östrogen plus Progestin wurde bei Frauen, die täglich CE (0,625 mg) plus MPA (2,5 mg) erhielten, im Vergleich zu Frauen, die Placebo erhielten, ein statistisch nicht signifikant erhöhtes Risiko für KHK-Ereignisse berichtet (41 versus 34 pro 10.000 Frauenjahre). ). Ein Anstieg des relativen Risikos wurde in Jahr 1 nachgewiesen, und ein Trend zu einem abnehmenden relativen Risiko wurde in den Jahren 2 bis 5 gemeldet.
Bei postmenopausalen Frauen mit dokumentierter Herzerkrankung (n = 2.763, Durchschnittsalter 66,7 Jahre) wurde in einer kontrollierten klinischen Studie zur Sekundärprävention kardiovaskulärer Erkrankungen (Heart and Estrogen/Progestin Replacement Study [HERS]) die Behandlung mit täglich CE (0,625 mg ) plus MPA (2,5 mg) zeigten keinen kardiovaskulären Nutzen. Während einer durchschnittlichen Nachbeobachtungszeit von 4,1 Jahren reduzierte die Behandlung mit CE plus MPA die Gesamtrate von CHD-Ereignissen bei postmenopausalen Frauen mit bestehender koronarer Herzkrankheit nicht. In der mit CE plus MPA behandelten Gruppe traten in Jahr 1 mehr KHK-Ereignisse auf als in der Placebogruppe, aber nicht in den darauffolgenden Jahren. Zweitausenddreihunderteinundzwanzig (2.321) Frauen aus der ursprünglichen HERS-Studie erklärten sich bereit, an einer Open-Label-Verlängerung von HERS, HERS II, teilzunehmen. Die durchschnittliche Nachbeobachtungszeit bei HERS II betrug weitere 2,7 Jahre, insgesamt also 6,8 Jahre. Die Raten von CHD-Ereignissen waren bei Frauen in der CE plus MPA-Gruppe und der Placebo-Gruppe bei HERS, HERS II und insgesamt vergleichbar.
Venöse Thromboembolie
In der WHI-Substudie Östrogen plus Progestin wurde eine statistisch signifikante 2-fach höhere Rate von VTE (TVT und LE) bei Frauen berichtet, die täglich CE (0,625 mg) plus MPA (2,5 mg) erhielten, im Vergleich zu Frauen, die Placebo erhielten (35 gegenüber 17 pro 10.000 Frauenjahre). Statistisch signifikante Risikoerhöhungen sowohl für TVT (26 gegenüber 13 pro 10.000 Frauenjahre) als auch LE (18 gegenüber 8 pro 10.000 Frauenjahre) wurden ebenfalls nachgewiesen. Der Anstieg des VTE-Risikos wurde im ersten Jahr nachgewiesen und hielt an. (Sehen Klinische Studien .) Sollte eine VTE auftreten oder vermutet werden, sollte die Östrogen- plus Gestagentherapie sofort abgesetzt werden.
Wenn möglich, sollten Östrogene plus Gestagene mindestens 4 bis 6 Wochen vor einer Operation, die mit einem erhöhten Risiko für Thromboembolien einhergeht, oder während längerer Ruhigstellungen abgesetzt werden.
Bösartige Neubildungen
Brustkrebs
Die wichtigste randomisierte klinische Studie, die Informationen über Brustkrebs bei Anwenderinnen von Östrogen plus Gestagen liefert, ist die WHI-Substudie mit täglichem CE (0,625 mg) plus MPA (2,5 mg). Nach einer durchschnittlichen Nachbeobachtungszeit von 5,6 Jahren berichtete die Östrogen-plus-Progestin-Substudie über ein erhöhtes Risiko für invasiven Brustkrebs bei Frauen, die täglich CE plus MPA einnahmen.
In dieser Teilstudie berichteten 26 Prozent der Frauen über eine vorherige Anwendung einer Östrogen-Monotherapie oder einer Östrogen-plus-Gestagen-Therapie. Das relative Risiko für invasiven Brustkrebs betrug 1,24 und das absolute Risiko 41 versus 33 Fälle pro 10.000 Frauenjahre für CE plus MPA im Vergleich zu Placebo. Bei Frauen, die über eine vorherige Anwendung einer Hormontherapie berichteten, betrug das relative Risiko für invasiven Brustkrebs 1,86 und das absolute Risiko 46 versus 25 Fälle pro 10.000 Frauenjahre für CE plus MPA im Vergleich zu Placebo. Bei Frauen, die keine vorherige Anwendung einer Hormontherapie angaben, betrug das relative Risiko für invasiven Brustkrebs 1,09 und das absolute Risiko 40 gegenüber 36 Fällen pro 10.000 Frauenjahre für CE plus MPA im Vergleich zu Placebo. In derselben Teilstudie waren invasiver Brustkrebs in der Gruppe mit CE (0,625 mg) plus MPA (2,5 mg) größer, häufiger knotenpositiv und in einem fortgeschritteneren Stadium diagnostiziert als in der Placebogruppe. Metastasen traten selten auf, ohne erkennbaren Unterschied zwischen den beiden Gruppen. Andere prognostische Faktoren wie histologischer Subtyp, Grad und Hormonrezeptorstatus unterschieden sich nicht zwischen den Gruppen. (Sehen Klinische Studien .)
In Übereinstimmung mit der klinischen WHI-Studie haben Beobachtungsstudien auch ein erhöhtes Brustkrebsrisiko für eine Östrogen-plus-Gestagen-Therapie und ein geringeres Risiko für eine Östrogen-Monotherapie nach mehrjähriger Anwendung berichtet. Das Risiko nahm mit der Dauer der Anwendung zu und schien über etwa 5 Jahre nach Beendigung der Behandlung auf den Ausgangswert zurückzukehren (nur die Beobachtungsstudien verfügen über aussagekräftige Daten zum Risiko nach Beendigung der Behandlung). Beobachtungsstudien deuten auch darauf hin, dass das Brustkrebsrisiko bei einer Östrogen-plus-Gestagen-Therapie größer war und früher auftrat als bei einer Östrogen-Monotherapie. Diese Studien haben jedoch keine signifikanten Unterschiede im Brustkrebsrisiko zwischen verschiedenen Östrogen- und Progestin-Kombinationen oder Verabreichungswegen gefunden.
Es wurde berichtet, dass die Anwendung von Östrogen plus Progestin zu einer Zunahme von abnormalen Mammogrammen führt, die einer weiteren Bewertung bedürfen. Alle Frauen sollten jährliche Brustuntersuchungen durch einen Gesundheitsdienstleister erhalten und monatliche Brustselbstuntersuchungen durchführen. Darüber hinaus sollten Mammographieuntersuchungen basierend auf dem Alter der Patientin, Risikofaktoren und früheren Mammographieergebnissen geplant werden.
Endometriumkarzinom
Es wurde über ein erhöhtes Risiko für Gebärmutterschleimhautkrebs bei der Anwendung einer ungehinderten Östrogentherapie bei Frauen mit Gebärmutter berichtet. Das gemeldete Endometriumkarzinomrisiko bei Östrogenkonsumenten ohne Gegenmaßnahmen ist etwa 2- bis 12-mal höher als bei Nicht-Konsumenten und scheint von der Behandlungsdauer und der Östrogendosis abhängig zu sein. Die meisten Studien zeigen kein signifikant erhöhtes Risiko im Zusammenhang mit der Anwendung von Östrogenen für weniger als 1 Jahr. Das größte Risiko scheint bei längerem Gebrauch mit einem 15- bis 24-fach erhöhten Risiko für 5 bis 10 Jahre oder länger verbunden zu sein. Dieses Risiko besteht nachweislich mindestens 8 bis 15 Jahre nach Absetzen der Östrogentherapie.
Eine klinische Überwachung aller Frauen, die eine Östrogen-plus-Gestagen-Therapie anwenden, ist wichtig. In allen Fällen nicht diagnostizierter persistierender oder wiederkehrender abnormaler genitaler Blutungen sollten angemessene diagnostische Maßnahmen, einschließlich Endometriumentnahmen, falls angezeigt, durchgeführt werden, um Malignität auszuschließen. Es gibt keine Hinweise darauf, dass die Anwendung natürlicher Östrogene zu einem anderen endometrialen Risikoprofil führt als synthetische Östrogene mit äquivalenter Östrogendosis. Es hat sich gezeigt, dass die Zugabe eines Gestagens zur Östrogentherapie das Risiko einer Endometriumhyperplasie verringert, die eine Vorstufe von Endometriumkrebs sein kann.
Eierstockkrebs
Die WHI-Substudie Östrogen plus Progestin berichtete über ein statistisch nicht signifikant erhöhtes Risiko für Eierstockkrebs. Nach einer durchschnittlichen Nachbeobachtungszeit von 5,6 Jahren betrug das relative Risiko für Eierstockkrebs für CE plus MPA im Vergleich zu Placebo 1,58 (95-Prozent-KI, 0,77–3,24). Das absolute Risiko für CE plus MPA betrug 4 versus 3 Fälle pro 10.000 Frauenjahre. In einigen epidemiologischen Studien wurde die Anwendung von Östrogen plus Progestin und Östrogen-Monopräparaten, insbesondere über einen Zeitraum von 5 oder mehr Jahren, mit einem erhöhten Risiko für Eierstockkrebs in Verbindung gebracht. Die mit einem erhöhten Risiko verbundene Expositionsdauer ist jedoch nicht in allen epidemiologischen Studien konsistent, und einige berichten über keinen Zusammenhang.
Wahrscheinlich Demenz
In der WHIMS-Estrogen-plus-Gestagen-Zusatzstudie zu WHI wurde eine Population von 4.532 postmenopausalen Frauen im Alter von 65 bis 79 Jahren randomisiert und erhielt täglich CE (0,625 mg) plus MPA (2,5 mg) oder Placebo. Nach einer durchschnittlichen Nachbeobachtungszeit von 4 Jahren wurde bei 40 Frauen in der CE plus MPA-Gruppe und bei 21 Frauen in der Placebo-Gruppe eine wahrscheinliche Demenz diagnostiziert. Das relative Risiko einer wahrscheinlichen Demenz für CE plus MPA im Vergleich zu Placebo betrug 2,05 (95-Prozent-KI, 1,21–3,48). Das absolute Risiko einer wahrscheinlichen Demenz für CE plus MPA im Vergleich zu Placebo betrug 45 gegenüber 22 Fällen pro 10.000 Frauenjahre. Es ist nicht bekannt, ob diese Ergebnisse für jüngere postmenopausale Frauen gelten. (Sehen Klinische Studien und VORSICHTSMASSNAHMEN , Geriatrische Verwendung .)
Visuelle Anomalien
Beenden Sie die Östrogen- plus Gestagentherapie bis zur Untersuchung, wenn ein plötzlicher teilweiser oder vollständiger Verlust des Sehvermögens oder ein plötzliches Auftreten von Proptosis, Diplopie oder Migräne auftritt. Wenn die Untersuchung ein Papillenödem oder retinale Gefäßläsionen zeigt, sollte die Östrogen-Gestagen-Therapie dauerhaft abgesetzt werden.
VORSICHTSMASSNAHMEN
Allgemein
Zugabe eines Gestagens, wenn eine Frau keine Hysterektomie hatte
Studien über die Zugabe eines Gestagens über 10 oder mehr Tage eines Östrogenverabreichungszyklus oder täglich mit Östrogen in einem kontinuierlichen Regime haben über eine geringere Inzidenz von Endometriumhyperplasie berichtet, als sie durch eine Östrogenbehandlung allein induziert würde. Endometriumhyperplasie kann ein Vorläufer von Endometriumkrebs sein.
Es gibt jedoch mögliche Risiken, die mit der Anwendung von Gestagenen mit Östrogenen im Vergleich zu Östrogen-Monotherapien verbunden sein können. Dazu gehört ein erhöhtes Brustkrebsrisiko.
Unerwartete anormale Vaginalblutung
Bei unerwartet auftretenden Blutungen aus der Scheide sind adäquate diagnostische Maßnahmen angezeigt.
Erhöhter Blutdruck
Der Blutdruck sollte in regelmäßigen Abständen mit Östrogen plus Gestagentherapie überwacht werden.
Hypertriglyzeridämie
Bei Frauen mit vorbestehender Hypertriglyzeridämie kann eine Östrogen-plus-Gestagen-Therapie mit Erhöhungen der Plasmatriglyzeride einhergehen, die zu einer Pankreatitis führen. Erwägen Sie ein Absetzen der Behandlung, wenn eine Pankreatitis auftritt.
Leberfunktionsstörung und/oder frühere Vorgeschichte von cholestatischer Gelbsucht
Östrogene plus Gestagene können bei Frauen mit eingeschränkter Leberfunktion schlecht metabolisiert werden. Bei Frauen mit cholestatischem Ikterus in der Vorgeschichte im Zusammenhang mit einer früheren Östrogenanwendung oder einer Schwangerschaft ist Vorsicht geboten, und im Falle eines erneuten Auftretens sollte die Medikation abgesetzt werden.
Flüssigkeitsretention
Gestagene können ein gewisses Maß an Flüssigkeitsretention verursachen. Frauen mit Erkrankungen, die von diesem Faktor beeinflusst werden könnten, wie z. B. Herz- oder Nierenfunktionsstörungen, erfordern eine sorgfältige Überwachung, wenn Östrogen plus Gestagen verschrieben wird.
Hypokalzämie
Eine Östrogen-plus-Gestagen-Therapie sollte bei Frauen mit Hypoparathyreoidismus mit Vorsicht angewendet werden, da eine Östrogen-induzierte Hypokalzämie auftreten kann.
Verschlimmerung anderer Bedingungen
Eine Östrogen-plus-Gestagen-Therapie kann eine Verschlimmerung von Asthma, Diabetes mellitus, Epilepsie, Migräne, Porphyrie, systemischem Lupus erythematodes und hepatischen Hämangiomen verursachen und sollte bei Frauen mit diesen Erkrankungen mit Vorsicht angewendet werden.
Informationen zum Patienten
Ärzten wird empfohlen, dies zu besprechen INFORMATIONEN ZUM PATIENTEN Packungsbeilage mit Frauen, denen sie PROVERA verschreiben.
Bei Kindern, deren Mütter während des ersten Trimenons der Schwangerschaft Gestagenen ausgesetzt waren, kann ein erhöhtes Risiko für geringfügige Geburtsfehler bestehen. Das mögliche Risiko für das männliche Baby ist Hypospadie, ein Zustand, bei dem sich die Penisöffnung eher an der Unterseite als an der Penisspitze befindet. Dieser Zustand tritt auf natürliche Weise bei etwa 5 bis 8 von 1000 männlichen Geburten auf. Das Risiko kann durch Exposition gegenüber PROVERA erhöht sein. Bei weiblichen Babys kann es zu einer Vergrößerung der Klitoris und einer Verschmelzung der Schamlippen kommen. Ein eindeutiger Zusammenhang zwischen Hypospadie, Klitorisvergrößerung und Schamlippenfusion bei der Anwendung von PROVERA wurde jedoch nicht nachgewiesen.
Informieren Sie die Patientin darüber, wie wichtig es ist, den Kontakt mit PROVERA 5 mg in der Frühschwangerschaft zu melden.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenität
Es wurde gezeigt, dass die langfristige intramuskuläre Verabreichung von Medroxyprogesteronacetat bei Beagle-Hunden Brusttumoren hervorruft. Es gab keine Hinweise auf eine krebserzeugende Wirkung im Zusammenhang mit der oralen Verabreichung von Medroxyprogesteronacetat an Ratten und Mäuse.
Die langfristige kontinuierliche Verabreichung von Östrogen plus Gestagentherapie hat ein erhöhtes Risiko für Brustkrebs und Eierstockkrebs gezeigt. (Sehen WARNUNGEN und VORSICHTSMASSNAHMEN .)
Genotoxizität
Medroxyprogesteronacetat war in einer Reihe von In-vitro- oder In-vivo-Gentoxizitätstests nicht mutagen.
Fruchtbarkeit
Medroxyprogesteronacetat in hohen Dosen ist ein Arzneimittel gegen die Fruchtbarkeit, und es ist zu erwarten, dass hohe Dosen die Fruchtbarkeit bis zum Absetzen der Behandlung beeinträchtigen.
Schwangerschaft
Schwangerschaftskategorie X
PROVERA sollte nicht während der Schwangerschaft angewendet werden. (Sehen KONTRAINDIKATIONEN .)
Es kann ein erhöhtes Risiko für Hypospadie, Klitorisvergrößerung und Schamlippenfusion bei Kindern geben, deren Mütter während des ersten Schwangerschaftstrimesters PROVERA 10 mg ausgesetzt sind. Ein eindeutiger Zusammenhang zwischen diesen Erkrankungen und der Anwendung von PROVERA wurde jedoch nicht hergestellt.
Stillende Mutter
PROVERA sollte nicht während der Stillzeit angewendet werden. In der Muttermilch stillender Mütter, die Gestagene erhielten, wurden nachweisbare Mengen an Gestagen festgestellt.
Pädiatrische Verwendung
PROVERA 10 mg Tabletten sind bei Kindern nicht angezeigt. Es wurden keine klinischen Studien in der pädiatrischen Population durchgeführt.
Geriatrische Verwendung
Es war nicht genügend geriatrische Frauen an klinischen Studien beteiligt, in denen PROVERA allein verwendet wurde, um festzustellen, ob sich Personen über 65 Jahren in ihrer Reaktion auf PROVERA allein von jüngeren Probanden unterscheiden.
Die Studien der Frauengesundheitsinitiative
In der Substudie WHI Östrogen plus Gestagen (täglich CE [0,625 mg] plus MPA [2,5 mg] versus Placebo) bestand bei Frauen über 65 Jahren ein höheres relatives Risiko für nicht tödlichen Schlaganfall und invasiven Brustkrebs. (Sehen Klinische Studien .)
Die Gedächtnisstudie der Frauengesundheitsinitiative
In den ergänzenden WHIMS-Studien an postmenopausalen Frauen im Alter von 65 bis 79 Jahren bestand bei Frauen, die Östrogen allein oder Östrogen plus Gestagen erhielten, im Vergleich zu Placebo ein erhöhtes Risiko, wahrscheinlich eine Demenz zu entwickeln. (Sehen WARNUNGEN , Wahrscheinlich Demenz .)
Da beide Begleitstudien an Frauen im Alter von 65 bis 79 Jahren durchgeführt wurden, ist nicht bekannt, ob diese Ergebnisse auf jüngere postmenopausale Frauen zutreffen. (Sehen WARNUNGEN , Wahrscheinlich Demenz .)
ÜBERDOSIS
Eine Überdosierung von Östrogen plus Progestin-Therapie kann Übelkeit und Erbrechen, Brustspannen, Schwindel, Bauchschmerzen, Schläfrigkeit/Müdigkeit und Abbruchblutungen bei Frauen verursachen. Die Behandlung einer Überdosierung besteht aus dem Absetzen von CE plus MPA zusammen mit der Einleitung einer angemessenen symptomatischen Behandlung.
KONTRAINDIKATIONEN
PROVERA 10 mg ist bei Frauen mit einer der folgenden Erkrankungen kontraindiziert:
KLINISCHE PHARMAKOLOGIE
Oral oder parenteral verabreichtes Medroxyprogesteronacetat (MPA) in den empfohlenen Dosen an Frauen mit ausreichend endogenem Östrogen wandelt proliferatives in sekretorisches Endometrium um. Androgene und anabole Wirkungen wurden festgestellt, aber dem Medikament fehlt offensichtlich eine signifikante östrogene Aktivität. Während parenteral verabreichtes MPA die Gonadotropinproduktion hemmt, was wiederum die Follikelreifung und den Eisprung verhindert, weisen die verfügbaren Daten darauf hin, dass dies nicht auftritt, wenn die normalerweise empfohlene orale Dosis als einzelne Tagesdosis verabreicht wird.
Pharmakokinetik
Die Pharmakokinetik von MPA wurde bei 20 postmenopausalen Frauen nach einer Einzeldosis-Verabreichung von acht PROVERA 2,5-mg-Tabletten oder einer Einzelverabreichung von zwei PROVERA 10-mg-Tabletten unter nüchternen Bedingungen bestimmt. In einer anderen Studie wurde die Steady-State-Pharmakokinetik von MPA unter nüchternen Bedingungen bei 30 postmenopausalen Frauen nach täglicher Verabreichung einer Tablette PROVERA 10 mg über 7 Tage bestimmt. In beiden Studien wurde MPA im Serum unter Verwendung einer validierten Methode der Gaschromatographie-Massenspektrometrie (GC-MS) quantifiziert. Schätzungen der pharmakokinetischen Parameter von MPA nach Einzel- und Mehrfachgabe von PROVERA-Tabletten waren sehr unterschiedlich und sind in Tabelle 1 zusammengefasst.
Absorption
Es wurden keine spezifischen Untersuchungen zur absoluten Bioverfügbarkeit von MPA beim Menschen durchgeführt. MPA wird schnell aus dem Gastrointestinaltrakt resorbiert, und maximale MPA-Konzentrationen werden zwischen 2 und 4 Stunden nach oraler Verabreichung erreicht.
Die Einnahme von PROVERA zusammen mit Nahrung erhöht die Bioverfügbarkeit von MPA. Eine 10-mg-Dosis PROVERA 10 mg, unmittelbar vor oder nach einer Mahlzeit eingenommen, erhöhte die Cmax von MPA (50 bis 70 %) und die AUC (18 bis 33 %). Die Halbwertszeit von MPA wurde durch Nahrung nicht verändert.
Verteilung
MPA ist zu etwa 90 % proteingebunden, hauptsächlich an Albumin; keine MPA-Bindung tritt mit sexualhormonbindendem Globulin auf.
Stoffwechsel
Nach oraler Gabe wird MPA weitgehend in der Leber durch Hydroxylierung metabolisiert, mit anschließender Konjugation und Ausscheidung im Urin.
Ausscheidung
Die meisten MPA-Metaboliten werden als Glucuronid-Konjugate mit dem Urin ausgeschieden, nur geringe Mengen werden als Sulfate ausgeschieden.
Spezifische Populationen
Leberinsuffizienz
MPA wird fast ausschließlich über den hepatischen Metabolismus eliminiert. Bei 14 Patienten mit fortgeschrittener Lebererkrankung war die MPA-Disposition signifikant verändert (verringerte Elimination). Bei Patienten mit Fettleber betrug die mittlere prozentuale Dosis, die im 24-Stunden-Urin als intaktes MPA nach einer 10-mg- oder 100-mg-Dosis ausgeschieden wurde, 7,3 % bzw. 6,4 %.
Niereninsuffizienz
Die Auswirkung einer Nierenfunktionsstörung auf die Pharmakokinetik von PROVERA 5 mg wurde nicht untersucht.
Wechselwirkungen mit anderen Medikamenten
Medroxyprogesteronacetat (MPA) wird in vitro hauptsächlich durch Hydroxylierung über CYP3A4 metabolisiert. Es wurden keine spezifischen Arzneimittelwechselwirkungsstudien zur Bewertung der klinischen Wirkungen von CYP3A4-Induktoren oder -Inhibitoren auf MPA durchgeführt. Induktoren und/oder Inhibitoren von CYP3A4 können den Metabolismus von MPA beeinflussen.
Klinische Studien
Auswirkungen auf das Endometrium
In einer 3-jährigen, doppelblinden, placebokontrollierten Studie mit 356 postmenopausalen Frauen ohne Hysterektomie zwischen 45 und 64 Jahren, die randomisiert Placebo (n = 119), 0,625 mg konjugiertes Östrogen (n = 119) oder 0,625 erhielten mg konjugiertem Östrogen plus zyklischem PROVERA (n=118) zeigten die Ergebnisse ein verringertes Risiko einer Endometriumhyperplasie in der Behandlungsgruppe, die 10 mg PROVERA 5 mg plus 0,625 mg konjugierte Östrogene erhielt, im Vergleich zu der Gruppe, die nur 0,625 mg konjugierte Östrogene erhielt. Siehe Tabelle 2.
In einer zweiten 1-Jahres-Studie wurden 832 postmenopausale Frauen im Alter zwischen 45 und 65 Jahren mit täglich 0,625 mg konjugiertem Östrogen (Tage 1–28) plus entweder 5 mg zyklischem PROVERA oder 10 mg zyklischem PROVERA (Tage 15–28) behandelt. oder täglich nur 0,625 mg konjugiertes Östrogen. Die Behandlungsgruppen, die 5 oder 10 mg zyklisches PROVERA (Tage 15–28) plus täglich konjugierte Östrogene erhielten, zeigten eine signifikant niedrigere Hyperplasierate im Vergleich zu der Gruppe, die nur konjugierte Östrogene erhielt. Siehe Tabelle 3.
Studien der Frauengesundheitsinitiative
Das WHI hat etwa 27.000 überwiegend gesunde postmenopausale Frauen in zwei Teilstudien aufgenommen, um die Risiken und Vorteile von täglichem oralem CE (0,625 mg) allein oder in Kombination mit MPA (2,5 mg) im Vergleich zu Placebo bei der Prävention bestimmter chronischer Erkrankungen zu bewerten. Der primäre Endpunkt war die Inzidenz von koronarer Herzkrankheit (KHK) (definiert als nicht-tödlicher MI, stiller MI und KHK-Tod) mit invasivem Brustkrebs als primärem unerwünschtem Ergebnis. Ein „globaler Index“ umfasste das früheste Auftreten von KHK, invasivem Brustkrebs, Schlaganfall, LE, Gebärmutterschleimhautkrebs (nur in der CE plus MPA-Teilstudie), Darmkrebs, Hüftfraktur oder Tod aus anderen Gründen. Diese Teilstudien bewerteten nicht die Wirkungen von CE allein oder CE plus MPA auf menopausale Symptome.
WHI Östrogen plus Gestagen-Substudie
Die Substudie WHI Östrogen plus Progestin wurde vorzeitig abgebrochen. Gemäß der vordefinierten Abbruchregel überstieg nach einer durchschnittlichen Nachbeobachtungszeit von 5,6 Behandlungsjahren das erhöhte Risiko für invasiven Brustkrebs und kardiovaskuläre Ereignisse die im „globalen Index“ enthaltenen spezifischen Vorteile. Das absolute Exzessrisiko von Ereignissen, die in den „globalen Index“ aufgenommen wurden, betrug 19 pro 10.000 Frauenjahre.
Für die im WHI „Global Index“ enthaltenen Ergebnisse, die nach 5,6 Jahren Nachbeobachtung statistische Signifikanz erreichten, betrugen die absoluten Exzessrisiken pro 10.000 Frauenjahre in der mit CE plus MPA behandelten Gruppe 7 weitere KHK-Ereignisse, 8 weitere Schlaganfälle, 10 weitere PEs und 8 weitere invasive Brustkrebserkrankungen, während die absolute Risikoreduktion pro 10.000 Frauenjahre 6 weniger Darmkrebs und 5 weniger Hüftfrakturen betrug.
Die Ergebnisse der CE plus MPA-Unterstudie, die 16.608 Frauen umfasste (Durchschnittsalter 63 Jahre, Bereich 50 bis 79; 83,9 Prozent Weiße, 6,8 Prozent Schwarze, 5,4 Prozent Hispanoamerikaner, 3,9 Prozent andere) sind in Tabelle 4 dargestellt. Diese Ergebnisse spiegeln zentral wider Beurteilte Daten nach einer durchschnittlichen Nachbeobachtungszeit von 5,6 Jahren.
Der Zeitpunkt des Beginns einer Östrogen- plus Gestagentherapie relativ zum Beginn der Menopause kann das Gesamtrisiko-Nutzen-Profil beeinflussen. Die nach Alter stratifizierte Substudie WHI Östrogen plus Gestagen zeigte bei Frauen im Alter von 50 bis 59 Jahren einen nicht signifikanten Trend zu einem verringerten Risiko für die Gesamtmortalität [Hazard Ratio (HR) 0,69 (95 Prozent CI, 0,44–1,07)].
Gedächtnisstudie der Frauengesundheitsinitiative
In die WHIMS-Estrogen-plus-Gestagen-Zusatzstudie von WHI wurden 4.532 überwiegend gesunde postmenopausale Frauen im Alter von 65 Jahren und älter aufgenommen (47 Prozent waren 65 bis 69 Jahre alt, 35 Prozent waren 70 bis 74 Jahre alt und 18 Prozent waren 75 Jahre alt). Alter und älter), um die Auswirkungen von täglichem CE (0,625 mg) plus MPA (2,5 mg) auf das Auftreten einer wahrscheinlichen Demenz (primärer Endpunkt) im Vergleich zu Placebo zu bewerten.
Nach einer durchschnittlichen Nachbeobachtungszeit von 4 Jahren betrug das relative Risiko einer wahrscheinlichen Demenz für CE plus MPA im Vergleich zu Placebo 2,05 (95-Prozent-KI, 1,21–3,48). Das absolute Risiko einer wahrscheinlichen Demenz für CE plus MPA im Vergleich zu Placebo betrug 45 gegenüber 33 pro 10.000 Frauenjahre. Wahrscheinliche Demenz, wie in dieser Studie definiert, umfasste die Alzheimer-Krankheit (AD), vaskuläre Demenz (VaD) und gemischten Typ (mit Merkmalen sowohl von AD als auch von VaD). Die häufigste Klassifizierung einer wahrscheinlichen Demenz in der Behandlungsgruppe und der Placebogruppe war AD. Da die Zusatzstudie an Frauen im Alter von 65 bis 79 Jahren durchgeführt wurde, ist nicht bekannt, ob diese Ergebnisse auf jüngere postmenopausale Frauen zutreffen. (Sehen WARNUNGEN , Wahrscheinlich Demenz und VORSICHTSMASSNAHMEN , Geriatrische Verwendung ).
INFORMATIONEN ZUM PATIENTEN
PROVERA (pro-VE-rah) (Medroxyprogesteronacetat) Tabletten, USP
Lesen Sie diese Patienteninformation, bevor Sie mit der Einnahme von PROVERA beginnen, und lesen Sie, was Sie jedes Mal erhalten, wenn Sie Ihr PROVERA-Rezept auffüllen. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung.
Was sind die wichtigsten Informationen, die ich über PROVERA (ein Gestagenhormon) wissen sollte?
Was ist PROVERA 10 mg?
PROVERA ist ein Arzneimittel, das Medroxyprogesteronacetat, ein Gestagenhormon, enthält.
Wofür wird PROVERA 5 mg verwendet?
PROVERA wird verwendet, um:
Wer sollte PROVERA nicht einnehmen?
Beginnen Sie nicht mit der Einnahme von PROVERA, wenn Sie:
Was sollte ich meinem Arzt vor der Einnahme von PROVERA 10 mg mitteilen? Bevor Sie PROVERA 5 mg einnehmen, informieren Sie Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen. Einige Arzneimittel können die Wirkungsweise von PROVERA beeinflussen. PROVERA kann auch die Wirkung anderer Arzneimittel beeinflussen.
Wie sollte ich PROVERA 10 mg einnehmen?
Beginnen Sie mit der niedrigsten Dosis und sprechen Sie mit Ihrem Arzt darüber, wie gut diese Dosis bei Ihnen wirkt. Die niedrigste wirksame Dosis von PROVERA wurde nicht bestimmt. Sie und Ihr Arzt sollten regelmäßig (alle 3 bis 6 Monate) darüber sprechen, welche Dosis Sie einnehmen und ob Sie noch eine Behandlung mit PROVERA benötigen.
Welche Nebenwirkungen kann PROVERA haben?
Die folgenden Nebenwirkungen wurden bei der alleinigen Anwendung von PROVERA 10 mg berichtet:
Rufen Sie sofort Ihren Arzt an, wenn Sie Nesselsucht, Atemprobleme, Schwellungen von Gesicht, Mund, Zunge oder Hals bekommen
Die folgenden Nebenwirkungen wurden bei der Anwendung von PROVERA 5 mg mit einem Östrogen berichtet.
Nebenwirkungen werden danach gruppiert, wie schwerwiegend sie sind und wie oft sie auftreten, wenn Sie behandelt werden.
Schwerwiegende, aber weniger häufige Nebenwirkungen sind:
Rufen Sie sofort Ihren Arzt an, wenn Sie eines der folgenden Warnzeichen oder andere ungewöhnliche Symptome bemerken, die Sie beunruhigen:
Weniger schwerwiegende, aber häufige Nebenwirkungen sind:
Dies sind nicht alle möglichen Nebenwirkungen von PROVERA mit oder ohne Östrogen. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker um Rat zu Nebenwirkungen. Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder nicht abklingt. Sie können Nebenwirkungen Pfizer unter 1-800-438-1985 oder der FDA unter 1-800-FDA-1088 melden.
Was kann ich tun, um meine Wahrscheinlichkeit einer schwerwiegenden Nebenwirkung mit PROVERA 10 mg zu verringern?
Allgemeine Informationen zur sicheren und wirksamen Anwendung von PROVERA
Bewahren Sie PROVERA 10 mg außerhalb der Reichweite von Kindern auf.
Diese Packungsbeilage enthält eine Zusammenfassung der wichtigsten Informationen über PROVERA. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt oder Apotheker. Sie können Informationen über PROVERA 10 mg anfordern, die für Angehörige der Gesundheitsberufe bestimmt sind. Weitere Informationen erhalten Sie unter der gebührenfreien Nummer 1-800-438-1985.
Was sind die Inhaltsstoffe von PROVERA?
Jede Tablette PROVERA 5 mg zur oralen Verabreichung enthält 2,5 mg, 5 mg oder 10 mg Medroxyprogesteronacetat.
Inaktive Inhaltsstoffe: Calciumstearat, Maisstärke, Lactose, Mineralöl, Sorbinsäure, Saccharose, Talk. Die 2,5-mg-Tablette enthält FD&C Yellow Nr. 6.
Das Etikett dieses Produkts wurde möglicherweise aktualisiert. Für aktuelle vollständige Verschreibungsinformationen besuchen Sie bitte www.pfizer.com