Parlodel 2.5mg Bromocriptine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Parlodel und wie wird es angewendet?
Parlodel 2,5 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Hyperprolaktinämie-assoziierten Dysfunktionen, Parkinson-Krankheit und Akromegalie. Parlodel 2,5 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Parlodel 2,5 mg gehört zu einer Klasse von Arzneimitteln namens Antiparkinson-Mittel, Dopamin-Agonisten; Hyperprolaktinämie; Metabolisch und endokrine, andere.
Es ist nicht bekannt, ob Parlodel 2,5 mg bei Kindern unter 10 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Parlodel haben?
Parlodel kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Parlodel 2,5 mg gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Parlodel. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Parlodel® (Bromocriptinmesylat) ist ein Mutterkornderivat mit starker Wirkung als Dopaminrezeptor-Agonist. Jede Parlodel® (Bromocriptinmesylat) SnapTabs®-Tablette zur oralen Verabreichung enthält 2½ mg und jede Kapsel enthält 5 mg Bromocriptin (als Mesylat). Bromocriptinmesylat wird chemisch als Ergotaman-3',6',18-trion, 2-Bromo-12'-hydroxy-2'-(1-methylethyl)-5'-( 2-Methylpropyl)-, (5'α)-monomethansulfonat (Salz).
Die Strukturformel lautet:
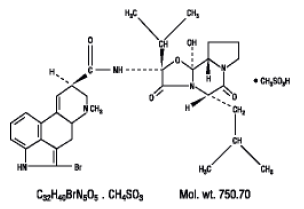
2½ mg SnapTabs®
Wirkstoff: Bromocriptinmesylat, USP
Inaktive Zutaten: kolloidales Siliziumdioxid, Lactose, Magnesiumstearat, Povidon, Stärke und ein weiterer Inhaltsstoff
5-mg-Kapseln
Wirkstoff: Bromocriptinmesylat, USP
Inaktive Zutaten: kolloidales Siliziumdioxid, Gelatine, Laktose, Magnesiumstearat, rotes Eisenoxid, Siliziumdioxid, Natriumlaurylsulfat, Stärke, Titandioxid, gelbes Eisenoxid und ein weiterer Inhaltsstoff
INDIKATIONEN
Hyperprolaktinämie-assoziierte Dysfunktionen
Parlodel (Bromocriptinmesylat) ist angezeigt zur Behandlung von Funktionsstörungen im Zusammenhang mit Hyperprolaktinämie einschließlich Amenorrhoe mit oder ohne Galaktorrhoe, Unfruchtbarkeit oder Hypogonadismus . Die Behandlung mit Parlodel 2,5 mg ist angezeigt bei Patienten mit Prolaktin-sezernierende Adenome , die die grundlegende zugrunde liegende Endokrinopathie sein kann, die zu den oben genannten klinischen Präsentationen beiträgt. Die Ermäßigung in Tumorgröße wurde sowohl bei männlichen als auch bei weiblichen Patienten mit Makroadenomen nachgewiesen. In Fällen, in denen eine Adenektomie gewählt wird, kann eine Behandlung mit Parlodel 2,5 mg durchgeführt werden, um die Tumormasse vor der Operation zu reduzieren.
Akromegalie
Parlodel 2,5 mg ist zur Behandlung der Akromegalie indiziert. Die Parlodel-Therapie, allein oder als Zusatztherapie mit einer Bestrahlung der Hypophyse oder einem chirurgischen Eingriff, senkt das Serum-Wachstumshormon bei etwa der Hälfte der behandelten Patienten um 50 % oder mehr, wenn auch normalerweise nicht auf normale Werte.
Da die Wirkungen einer externen Bestrahlung der Hypophyse möglicherweise mehrere Jahre lang nicht maximal werden, bietet eine Zusatztherapie mit Parlodel 2,5 mg einen potenziellen Nutzen, bevor sich die Wirkungen der Bestrahlung manifestieren.
Parkinson-Krankheit
Parlodel 2,5 mg SnapTabs oder Kapseln sind indiziert zur Behandlung der Anzeichen und Symptome der idiopathischen oder postenzephalitischen Parkinson-Krankheit. Als Zusatzbehandlung zu Levodopa (allein oder mit einem peripheren Decarboxylase-Hemmer) kann die Parlodel-Therapie zusätzlichen therapeutischen Nutzen bei jenen Patienten bieten, die derzeit mit optimalen Levodopa-Dosierungen behandelt werden, bei denen, die beginnen, sich gegenüber der Levodopa-Therapie zu verschlechtern (Toleranz entwickeln), und diejenigen, die unter einer Levodopa-Therapie ein „End-of-Dose-Mißerfolg“ erleiden. Die Behandlung mit Parlodel 2,5 mg kann eine Verringerung der Levodopa-Erhaltungsdosis ermöglichen und somit das Auftreten und/oder die Schwere von Nebenwirkungen im Zusammenhang mit einer Levodopa-Langzeittherapie wie anormale unwillkürliche Bewegungen (z Motorik („Ein-Aus“-Phänomen). Die anhaltende Wirksamkeit einer Behandlung mit Parlodel 2,5 mg während einer Behandlung von mehr als 2 Jahren wurde nicht nachgewiesen.
Die Daten reichen nicht aus, um den potenziellen Nutzen einer Behandlung der neu diagnostizierten Parkinson-Krankheit mit Parlodel zu bewerten. Studien haben jedoch signifikant mehr Nebenwirkungen (insbesondere Übelkeit, Halluzinationen, Verwirrtheit und Hypotonie) bei mit Parlodel behandelten Patienten gezeigt als bei mit Levodopa/Carbidopa behandelten Patienten. Patienten, die nicht auf Levodopa ansprechen, sind schlechte Kandidaten für eine Parlodel-Therapie.
DOSIERUNG UND ANWENDUNG
Allgemein
Es wird empfohlen, Parlodel (Bromocriptinmesylat) zusammen mit einer Mahlzeit einzunehmen. Die Patienten sollten während der Dosiseskalation häufig untersucht werden, um die niedrigste Dosis zu bestimmen, die eine therapeutische Reaktion hervorruft.
Hyperprolaktinämische Indikationen
Die Anfangsdosis von Parlodel SnapTabs bei Erwachsenen beträgt täglich eine ½ bis eine 2½-mg-Tablette mit Bruchrille. Dem Behandlungsschema kann je nach Verträglichkeit alle 2 bis 7 Tage eine zusätzliche 2½-mg-Tablette hinzugefügt werden, bis ein optimales therapeutisches Ansprechen erreicht ist. Die therapeutische Dosierung reichte von 2,5–15 mg täglich bei klinisch untersuchten Erwachsenen.
Basierend auf begrenzten Daten bei Kindern im Alter von 11 bis 15 Jahren (siehe Pädiatrische Verwendung ) Die Anfangsdosis beträgt täglich eine ½ bis eine 2½-mg-Tablette mit Bruchrille. Die Dosierung muss gegebenenfalls je nach Verträglichkeit erhöht werden, bis ein therapeutisches Ansprechen erreicht wird. Die therapeutische Dosierung reichte von 2,5–10 mg täglich bei Kindern mit Prolaktin-sezernierenden Hypophysenadenomen.
Um die Wahrscheinlichkeit einer längeren Exposition gegenüber Parlodel zu verringern, sollte im Falle einer unerwarteten Schwangerschaft ein mechanisches Kontrazeptivum in Verbindung mit Parlodel 2,5 mg angewendet werden, bis die normalen ovulatorischen Menstruationszyklen wiederhergestellt sind. Die Empfängnisverhütung kann dann bei Patienten, die eine Schwangerschaft wünschen, abgebrochen werden.
Wenn danach die Menstruation nicht innerhalb von 3 Tagen nach dem erwarteten Datum eintritt, sollte die Behandlung mit Parlodel 2,5 mg abgebrochen und ein Schwangerschaftstest durchgeführt werden.
Akromegalie
Praktisch alle Patienten mit Akromegalie, die therapeutischen Nutzen aus Parlodel 2,5 mg ziehen, weisen auch eine Verringerung der zirkulierenden Wachstumshormonspiegel auf. Daher dient die regelmäßige Bestimmung der zirkulierenden Wachstumshormonspiegel in den meisten Fällen als Richtlinie zur Bestimmung des therapeutischen Potenzials von Parlodel. Wenn nach einem kurzen Versuch mit der Parlodel-Therapie keine signifikante Senkung des Wachstumshormonspiegels eingetreten ist, sollten die klinischen Merkmale der Erkrankung sorgfältig beurteilt werden, und wenn keine Veränderung eingetreten ist, sollte eine Dosisanpassung oder ein Absetzen der Therapie in Erwägung gezogen werden .
Die empfohlene Anfangsdosis beträgt eine ½ bis eine 2½-mg-Tablette Parlodel SnapTabs vor dem Schlafengehen (mit Nahrung) für 3 Tage. Dem Behandlungsschema sollte je nach Verträglichkeit alle 3 bis 7 Tage eine weitere ½ bis 1 SnapTabs-Tablette hinzugefügt werden, bis der Patient einen optimalen therapeutischen Nutzen erzielt. Die Patienten sollten monatlich neu untersucht und die Dosierung basierend auf der Verringerung des Wachstumshormonspiegels oder dem klinischen Ansprechen angepasst werden. Der übliche optimale therapeutische Dosierungsbereich von Parlodel variiert bei den meisten Patienten zwischen 20 und 30 mg/Tag. Die Höchstdosis sollte 100 mg/Tag nicht überschreiten.
Patienten, die mit Hypophysenbestrahlung behandelt wurden, sollten jährlich von der Behandlung mit Parlodel 2,5 mg abgesetzt werden, um sowohl die klinischen Wirkungen der Bestrahlung auf den Krankheitsverlauf als auch die Wirkungen der Parlodel-Therapie zu beurteilen. In der Regel ist hierfür eine Wartezeit von 4 bis 8 Wochen ausreichend. Wiederauftreten der Anzeichen/Symptome oder Anstiege des Wachstumshormons weisen darauf hin, dass der Krankheitsprozess noch aktiv ist und weitere Behandlungen mit Parlodel in Betracht gezogen werden sollten.
Parkinson-Krankheit
Das Grundprinzip der Behandlung mit Parlodel 2,5 mg besteht darin, die Behandlung mit einer niedrigen Dosierung zu beginnen und die Tagesdosis individuell langsam zu erhöhen, bis ein maximales therapeutisches Ansprechen erreicht ist. Die Dosis von Levodopa sollte während dieser Einführungsphase nach Möglichkeit beibehalten werden. Die Anfangsdosis von Parlodel 2,5 mg beträgt eine ½ einer 2½-mg-SnapTabs-Tablette zweimal täglich zu den Mahlzeiten. Es wird empfohlen, während der Dosistitration in 2-Wochen-Intervallen Bewertungen vorzunehmen, um sicherzustellen, dass die niedrigste Dosis, die ein optimales therapeutisches Ansprechen hervorruft, nicht überschritten wird. Bei Bedarf kann die Dosis alle 14 bis 28 Tage um 2½ mg/Tag zu den Mahlzeiten erhöht werden. Sollte es ratsam sein, die Dosis von Levodopa aufgrund von Nebenwirkungen zu reduzieren, sollte die Tagesdosis von Parlodel, falls sie erhöht wird, schrittweise in kleinen Schritten (2½ mg) erreicht werden.
Die Sicherheit von Parlodel wurde in Dosierungen von mehr als 100 mg/Tag nicht nachgewiesen.
WIE GELIEFERT
Parlodel (Bromocriptinmesylat) SnapTabs
2½ mg
Parlodel ist in Flaschen mit 30 und 100 Tabletten zu 2 ½ mg erhältlich, jede Flasche enthält ein Trockenmittel.
Runde, grauweiße SnapTabs mit abgeschrägten Kanten, die jeweils 2½ mg Bromocriptin (als Mesylat) enthalten. Graviert „PARLODEL 2½“ auf einer Seite und „017“ auf der gerillten Seite. Erfüllt USP-Auflösungstest 1.
Pakete von 30 - NDC 30698-202-30 Packungen zu 100 - NDC 30698-202-01
Parlodel (Bromocriptinmesylat) Kapseln
5mg
Karamelfarbene und weiße Kapseln, die jeweils 5 mg Bromocriptin (als Mesylat) enthalten. Auf der einen Hälfte mit roter Tinte aufgedruckt „PARLODEL 5 mg“ und auf der anderen Hälfte „102“.
Pakete von 30 - NDC 30698-201-30 Packungen zu 100 - NDC 30698-201-01
Speichern und abgeben
Bei 20° bis 25°C (68° bis 77°F) lagern; Abweichungen bis 59° bis 86°F (15° bis 30°C) zulässig [Siehe USP Controlled Room Temperature].
In einen dichten, lichtbeständigen Behälter füllen.
Hergestellt für und vertrieben von: Validus Pharmaceuticals LLC Parsippany, NJ 07054. Überarbeitet: Juli 2021
NEBENWIRKUNGEN
Nebenwirkungen aus klinischen Studien
Hyperprolaktinämische Indikationen
Die Inzidenz von Nebenwirkungen ist ziemlich hoch (69 %), aber diese sind im Allgemeinen leicht bis mittelgradig. Bei etwa 5 % der Patienten wurde die Therapie wegen Nebenwirkungen abgebrochen. Diese sind in abnehmender Häufigkeit: Übelkeit (49 %), Kopfschmerzen (19 %), Schwindel (17 %), Müdigkeit (7 %), Benommenheit (5 %), Erbrechen (5 %), Bauchkrämpfe (4 %). , verstopfte Nase (3 %), Verstopfung (3 %), Durchfall (3 %) und Schläfrigkeit (3 %).
Eine leichte blutdrucksenkende Wirkung kann die Behandlung mit Parlodel (Bromocriptinmesylat) begleiten. Das Auftreten von Nebenwirkungen kann verringert werden, indem die Dosis vorübergehend auf ½ Tablette SnapTabs 2- oder 3-mal täglich reduziert wird. Bei Patienten, die Parlodel 2,5 mg zur Behandlung großer Prolaktinome erhielten, wurde über einige Fälle von Liquor-Rhinorrhoe berichtet. Dies ist selten aufgetreten, normalerweise nur bei Patienten, die zuvor eine transsphenoidale Operation, eine Bestrahlung der Hypophyse oder beides erhalten hatten und die Parlodel 2,5 mg wegen eines Tumorrezidivs erhielten. Es kann auch bei zuvor unbehandelten Patienten auftreten, deren Tumor sich in die Keilbeinhöhle erstreckt.
Akromegalie
Die häufigsten Nebenwirkungen, die bei mit Parlodel 2,5 mg behandelten Patienten mit Akromegalie auftraten, waren: Übelkeit (18 %), Obstipation (14 %), posturale/orthostatische Hypotonie (6 %), Anorexie (4 %), Mundtrockenheit/verstopfte Nase (4 %), Verdauungsstörungen/Dyspepsie (4 %), digitaler Vasospasmus (3 %), Schläfrigkeit/Müdigkeit (3 %) und Erbrechen (2 %).
Weniger häufige Nebenwirkungen (weniger als 2 %) waren: Magen-Darm-Blutungen, Schwindel, Verschlimmerung des Raynaud-Syndroms, Kopfschmerzen und Synkopen. Selten (weniger als 1 %) Haarausfall, Alkoholpotenzierung, Ohnmacht, Benommenheit, Arrhythmie, ventrikuläre Tachykardie, verringertes Schlafbedürfnis, visuelle Halluzinationen, Abgeschlagenheit, Kurzatmigkeit, Bradykardie, Schwindel, Parästhesien, Trägheit, vasovagale Attacke, wahnhafte Psychose, Paranoia , Schlaflosigkeit, Benommenheit, verminderte Kältetoleranz, Kribbeln in den Ohren, Blässe im Gesicht und Muskelkrämpfe wurden berichtet.
Parkinson-Krankheit
In klinischen Studien, in denen Parlodel 2,5 mg bei gleichzeitiger Dosisreduktion von Levodopa/Carbidopa verabreicht wurde, waren die häufigsten neu aufgetretenen Nebenwirkungen: Übelkeit, anormale unwillkürliche Bewegungen, Halluzinationen, Verwirrtheit, „Ein-Aus“-Phänomen, Schwindel, Benommenheit, Schwäche/Ohnmacht, Erbrechen, Asthenie, Bauchbeschwerden, Sehstörungen, Ataxie, Schlaflosigkeit, Depression, Hypotonie, Kurzatmigkeit, Verstopfung und Schwindel.
Weniger häufig auftretende Nebenwirkungen sind: Anorexie, Angst, Blepharospasmus, Mundtrockenheit, Dysphagie, Ödeme an Füßen und Knöcheln, Erythromelalgie, epileptiforme Anfälle, Müdigkeit, Kopfschmerzen, Lethargie, Fleckenbildung auf der Haut, verstopfte Nase, Nervosität, Alpträume, Parästhesien, Hautausschlag, häufiges Wasserlassen, Harninkontinenz, Harnverhalt und selten Anzeichen und Symptome von Ergotismus wie Kribbeln in den Fingern, kalte Füße, Taubheitsgefühl, Muskelkrämpfe in Füßen und Beinen oder Verschlimmerung des Raynaud-Syndroms.
Anomalien in Labortests können Erhöhungen von Blut-Harnstoff-Stickstoff, SGOT, SGPT, GGPT, CPK, alkalischer Phosphatase und Harnsäure umfassen, die normalerweise vorübergehend und nicht von klinischer Bedeutung sind.
Nebenwirkungen aus der Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von Parlodel (alle Indikationen kombiniert) nach der Zulassung berichtet. Da Nebenwirkungen aus Spontanmeldungen freiwillig von einer Population unbekannter Größe gemeldet werden, ist es im Allgemeinen nicht möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Psychische Störungen: Verwirrtheit, psychomotorische Unruhe/Erregung, Halluzinationen, psychotische Störungen, Schlaflosigkeit, gesteigerte Libido, Hypersexualität und Impulskontrolle/zwanghaftes Verhalten (einschließlich Glücksspiel, Geldausgaben und andere intensive Triebe).
Erkrankungen des Nervensystems: Kopfschmerzen, Benommenheit, Schwindel, Dyskinäsie, Somnolenz, Parästhesien, übermäßige Tagesmüdigkeit, plötzliches Einschlafen.
Augenerkrankungen: Sehstörung, verschwommenes Sehen.
Erkrankungen des Ohrs und des Labyrinths: Tinnitus.
Herzerkrankungen: Perikarderguss, konstriktive Perikarditis, Tachykardie, Bradykardie, Arrhythmie, Herzklappenfibrose.
Gefäßerkrankungen: Hypotonie, orthostatische Hypotonie (die sehr selten zu einer Synkope führt), reversible Blässe der Finger und Zehen durch Kälte (insbesondere bei Patienten mit Raynaud-Phänomen in der Anamnese).
Erkrankungen der Atemwege, des Brustraums und Mediastinums: Verstopfte Nase, Pleuraerguss, Pleurafibrose, Pleuritis, Lungenfibrose, Dyspnoe.
Gastrointestinale Störungen: Übelkeit, Verstopfung, Erbrechen, Mundtrockenheit, Durchfall, Bauchschmerzen, retroperitoneale Fibrose, Magen-Darm-Geschwür, Magen-Darm-Blutung.
Erkrankungen der Haut und des Unterhautzellgewebes: Allergische Hautreaktionen, Haarausfall.
Erkrankungen des Bewegungsapparates und des Bindegewebes: Beinkrämpfe.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort: Müdigkeit, peripheres Ödem, ein Syndrom, das dem malignen neuroleptischen Syndrom ähnelt, bei abruptem Absetzen von Parlodel, Absetzsymptome (einschließlich Apathie, Angst, Depression, Müdigkeit, Schlaflosigkeit, Schwitzen und Schmerzen) mit Ausschleichen oder nach Absetzen (siehe VORSICHTSMASSNAHMEN ).
Unerwünschte Ereignisse, die unter anderen Bedingungen beobachtet wurden
Postpartale Patientinnen (siehe oben WARNUNGEN )
In postpartalen Studien mit Parlodel 2,5 mg hatten 23 Prozent der behandelten postpartalen Patientinnen mindestens 1 Nebenwirkung, die jedoch im Allgemeinen leicht bis mäßig ausgeprägt waren. Bei etwa 3 % der Patienten wurde die Therapie abgebrochen. Die am häufigsten auftretenden Nebenwirkungen waren: Kopfschmerzen (10 %), Schwindel (8 %), Übelkeit (7 %), Erbrechen (3 %), Müdigkeit (1,0 %), Synkope (0,7 %), Durchfall (0,4 %). Krämpfe (0,4 %). Blutdruckabfall (≥ 20 mm Hg systolisch und ≥ 10 mm Hg diastolisch) trat bei 28 % der Patientinnen mindestens einmal während der ersten 3 Tage nach der Geburt auf; diese waren in der Regel vorübergehender Natur. Berichte über Ohnmachtsanfälle im Wochenbett können möglicherweise mit diesem Effekt zusammenhängen. Nach Markteinführung wurden in den USA 72 Fälle von Krampfanfällen (darunter 4 Fälle von Status epilepticus), 30 Fälle von Schlaganfall und 9 Fälle von Myokardinfarkt bei postpartalen Patienten als schwerwiegende Nebenwirkungen berichtet. Anfallsfälle waren nicht notwendigerweise von der Entwicklung von Bluthochdruck begleitet. Ein unaufhörlicher und oft fortschreitender starker Kopfschmerz, manchmal begleitet von Sehstörungen, dem oft Stunden bis Tage vorausgehen, vielen Fällen von Krampfanfällen und/oder Schlaganfällen. Die meisten Patientinnen hatten keine Hinweise auf eine der hypertensiven Schwangerschaftserkrankungen einschließlich Eklampsie, Präeklampsie oder schwangerschaftsinduzierter Hypertonie gezeigt. Ein Schlaganfallfall war mit einer Sagittalsinusthrombose verbunden, ein anderer mit zerebraler und zerebellärer Vaskulitis. Ein Fall von Myokardinfarkt war mit einer ungeklärten disseminierten intravaskulären Gerinnung verbunden, und ein zweiter trat in Verbindung mit der Anwendung eines anderen Mutterkornalkaloids auf. Der Zusammenhang dieser Nebenwirkungen mit der Verabreichung von Parlodel wurde nicht nachgewiesen.
In seltenen Fällen wurde bei Frauen nach der Geburt, die mit Parlodel behandelt wurden, über schwerwiegende unerwünschte Ereignisse, einschließlich Bluthochdruck, Myokardinfarkt, Krampfanfälle, Schlaganfall oder psychische Störungen, berichtet. Bei einigen Patienten gingen der Entwicklung von Krampfanfällen oder Schlaganfällen starke Kopfschmerzen und/oder vorübergehende Sehstörungen voraus. Obwohl der kausale Zusammenhang zwischen diesen Ereignissen und dem Arzneimittel ungewiss ist, ist eine regelmäßige Überwachung des Blutdrucks bei postpartalen Frauen, die Parlodel erhalten, ratsam. Wenn Bluthochdruck, schwere, fortschreitende oder anhaltende Kopfschmerzen (mit oder ohne Sehstörungen) oder Anzeichen einer ZNS-Toxizität auftreten, sollte die Verabreichung von Parlodel 2,5 mg abgebrochen und der Patient unverzüglich untersucht werden.
Besondere Vorsicht ist geboten bei Patienten, die vor kurzem mit Arzneimitteln behandelt wurden, die den Blutdruck verändern können, z. B. Vasokonstriktoren wie Sympathomimetika oder Mutterkornalkaloide, einschließlich Ergometrin oder Methylergometrin, oder die gleichzeitig mit Arzneimitteln behandelt werden, deren gleichzeitige Anwendung im Wochenbett nicht empfohlen wird.
Um VERMUTLICHE NEBENWIRKUNGEN zu melden, wenden Sie sich an Validus Pharmaceuticals LLC unter 1-866-982-5438 oder an die FDA unter 1-800-FDA-1088 oder www.fda.gov/medwatch.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Das Risiko der Anwendung von Parlodel in Kombination mit anderen Arzneimitteln wurde nicht systematisch bewertet, aber Alkohol kann die Nebenwirkungen von Parlodel verstärken. Parlodel 2,5 mg kann mit Dopaminantagonisten, Butyrophenonen und bestimmten anderen Wirkstoffen interagieren. Verbindungen in diesen Kategorien führen zu einer verminderten Wirksamkeit von Parlodel: Phenothiazine, Haloperidol, Metoclopramid und Pimozid. Bromocriptin ist ein Substrat von CYP3A4. Daher ist bei gleichzeitiger Anwendung von Arzneimitteln, die starke Inhibitoren dieses Enzyms sind (wie Azol-Antimykotika, HIV-Protease-Inhibitoren), Vorsicht geboten. Es wurde gezeigt, dass die gleichzeitige Anwendung von Makrolid-Antibiotika wie Erythromycin die Plasmaspiegel von Bromocriptin erhöht (die mittleren AUC- und Cmax-Werte erhöhten sich um das 3,7-Fache bzw Konzentrationen von Bromocriptin (die AUC von Bromocriptin erhöhte sich um etwa 38 %).4 Die gleichzeitige Anwendung von Parlodel mit anderen Mutterkornalkaloiden wird nicht empfohlen. In Fällen, in denen hohe Dosen von Bromocriptin angewendet werden (z. B. Indikation der Parkinson-Krankheit), kann eine Dosisanpassung erforderlich sein.
WARNUNGEN
Da bei Patienten mit Hypophysentumoren eine Hyperprolaktinämie mit Amenorrhö/Galaktorrhö und Unfruchtbarkeit festgestellt wurde, ist vor der Behandlung mit Parlodel (Bromocriptinmesylat) eine vollständige Untersuchung der Hypophyse indiziert.
Wenn während der Anwendung von Parlodel eine Schwangerschaft eintritt, ist eine sorgfältige Überwachung dieser Patientinnen zwingend erforderlich. Prolaktin-sezernierende Adenome können sich ausdehnen und eine Kompression des Sehnervs oder anderer Hirnnerven kann auftreten, sodass eine Notfall-Hypophysenoperation erforderlich wird. In den meisten Fällen löst sich die Komprimierung nach der Lieferung auf. Es wurde berichtet, dass die Wiederaufnahme der Behandlung mit Parlodel 2,5 mg zu einer Verbesserung der Gesichtsfelder von Patientinnen führt, bei denen während der Schwangerschaft eine Nervenkompression aufgetreten ist. Die Unbedenklichkeit einer Behandlung mit Parlodel 2,5 mg während der Schwangerschaft für Mutter und Fötus wurde nicht nachgewiesen.
Parlodel 2,5 mg wurde mit Somnolenz und Episoden plötzlichen Einschlafens in Verbindung gebracht, insbesondere bei Patienten mit Parkinson-Krankheit. Plötzliches Einschlafen bei täglichen Aktivitäten, in einigen Fällen ohne Bewusstsein oder Warnzeichen, wurde berichtet. Die Patienten müssen darüber informiert und darauf hingewiesen werden, während der Behandlung mit Bromocriptin kein Fahrzeug zu führen oder Maschinen zu bedienen. Patienten mit Somnolenz und/oder plötzlichem Einschlafen dürfen kein Fahrzeug führen oder Maschinen bedienen. Darüber hinaus kann eine Dosisreduktion oder ein Therapieabbruch erwogen werden.
Eine symptomatische Hypotonie kann bei Patienten auftreten, die mit Parlodel für jede Indikation behandelt werden. In postpartalen Studien mit Parlodel wurde bei fast 30 % der Patientinnen, die Parlodel erhielten, eine Abnahme des systolischen und diastolischen Drucks in Rückenlage um mehr als 20 mm bzw. 10 mm Hg beobachtet. Gelegentlich betrug der Abfall des systolischen Drucks in Rückenlage bis zu 50–59 mmHg.
Da insbesondere in den ersten Tagen der Behandlung gelegentlich blutdrucksenkende Reaktionen auftreten können, die zu einer verminderten Aufmerksamkeit führen, ist beim Führen eines Fahrzeugs oder beim Bedienen von Maschinen besondere Vorsicht geboten.
Während bei einigen Patientinnen zu Beginn der Therapie mit Parlodel 2,5 mg eine Hypotonie auftritt, wurden in seltenen Fällen schwerwiegende unerwünschte Ereignisse, einschließlich Bluthochdruck, Myokardinfarkt, Krampfanfälle, Schlaganfall, bei postpartalen Frauen berichtet, die mit Parlodel 2,5 mg zur Hemmung der Laktation behandelt wurden. Es wurde über Hypertonie berichtet, manchmal zu Beginn der Therapie, aber oft in der zweiten Behandlungswoche; Krampfanfälle wurden sowohl mit als auch ohne vorherige Entwicklung von Bluthochdruck berichtet; Schlaganfälle wurden hauptsächlich bei postpartalen Patientinnen berichtet, deren pränataler und geburtshilflicher Verlauf unkompliziert waren. Viele dieser Patienten mit Krampfanfällen (einschließlich Fällen von Status epilepticus) und/oder Schlaganfällen berichteten, Stunden bis Tage vor dem akuten Ereignis anhaltende und oft fortschreitende starke Kopfschmerzen zu entwickeln. Einigen Fällen von Schlaganfällen und Krampfanfällen gingen auch Sehstörungen (verschwommene Sicht und vorübergehende kortikale Blindheit) voraus. Fälle von akutem Myokardinfarkt wurden ebenfalls berichtet.
Obwohl kein kausaler Zusammenhang zwischen der Verabreichung von Parlodel und Bluthochdruck, Krampfanfällen, Schlaganfällen und Myokardinfarkt bei postpartalen Frauen nachgewiesen wurde, wird die Anwendung des Arzneimittels zur Vorbeugung einer physiologischen Laktation oder bei Patienten mit unkontrolliertem Bluthochdruck nicht empfohlen. Bei Patienten, die wegen Hyperprolaktinämie behandelt werden, sollte Parlodel 2,5 mg abgesetzt werden, wenn eine Schwangerschaft diagnostiziert wird (siehe VORSICHTSMASSNAHMEN , Hyperprolaktinämische Zustände ). Für den Fall, dass Parlodel 2,5 mg wieder aufgenommen wird, um ein sich schnell ausbreitendes Makroadenom zu kontrollieren (siehe VORSICHTSMASSNAHMEN , Hyperprolaktinämische Zustände und bei einer Patientin eine hypertensive Schwangerschaftsstörung auftritt, muss der Nutzen einer fortgesetzten Behandlung mit Parlodel gegen das mögliche Risiko der Anwendung während einer hypertensiven Schwangerschaftsstörung abgewogen werden. Wenn Parlodel zur Behandlung von Akromegalie oder Parkinson-Krankheit bei Patientinnen angewendet wird, die später schwanger werden, sollte entschieden werden, ob die Therapie weiterhin medizinisch notwendig ist oder abgesetzt werden kann. Wenn die Behandlung fortgeführt wird, sollte das Arzneimittel bei Patienten abgesetzt werden, bei denen es zu hypertensiven Schwangerschaftsstörungen kommen kann (einschließlich Eklampsie, Präeklampsie oder schwangerschaftsinduzierter Hypertonie), es sei denn, das Absetzen von Parlodel wird aus medizinischen Gründen als kontraindiziert erachtet. Aufgrund der Möglichkeit einer Wechselwirkung zwischen Parlodel und anderen Mutterkornalkaloiden wird die gleichzeitige Anwendung dieser Arzneimittel nicht empfohlen. Eine regelmäßige Überwachung des Blutdrucks, insbesondere in den ersten Behandlungswochen, ist ratsam. Wenn Bluthochdruck, schwere, fortschreitende oder anhaltende Kopfschmerzen (mit oder ohne Sehstörungen) oder Anzeichen einer ZNS-Toxizität auftreten, sollte die medikamentöse Therapie abgebrochen und der Patient unverzüglich untersucht werden. Besondere Aufmerksamkeit sollte Patienten geschenkt werden, die kürzlich mit Arzneimitteln behandelt wurden, die den Blutdruck verändern können, oder die gleichzeitig mit Arzneimitteln behandelt werden. Ihre gleichzeitige Anwendung im Wochenbett wird nicht empfohlen.
Bei Patienten unter Parlodel, insbesondere unter Langzeit- und Hochdosisbehandlung, wurde über Pleura- und Perikardergüsse sowie Pleura- und Lungenfibrose und konstriktive Perikarditis berichtet. Patienten mit ungeklärten pleuropulmonalen Erkrankungen sollten gründlich untersucht und ein Abbruch der Behandlung mit Parlodel 2,5 mg in Betracht gezogen werden. In den Fällen, in denen die Behandlung mit Parlodel 2,5 mg beendet wurde, normalisierten sich die Veränderungen langsam.
Bei einigen Patienten unter Parlodel, insbesondere unter Langzeit- und Hochdosisbehandlung, wurde über retroperitoneale Fibrose berichtet. Um sicherzustellen, dass eine retroperitoneale Fibrose in einem frühen reversiblen Stadium erkannt wird, wird empfohlen, ihre Manifestationen (z. B. Rückenschmerzen, Ödeme der unteren Gliedmaßen, eingeschränkte Nierenfunktion) bei dieser Patientenkategorie zu beobachten. Die Behandlung mit Parlodel sollte abgesetzt werden, wenn fibrotische Veränderungen im Retroperitoneum diagnostiziert oder vermutet werden.
VORSICHTSMASSNAHMEN
Allgemein
Es liegen Berichte über Patienten vor, die während der Einnahme eines oder mehrerer Medikamente, einschließlich Parlodel 2,5 mg, einen intensiven Spieldrang, einen gesteigerten sexuellen Drang, einen intensiven Drang, unkontrolliert Geld auszugeben, und/oder einen anderen intensiven Drang und die Unfähigkeit, diesen Drang zu kontrollieren, verspürten , die den zentralen dopaminergen Tonus erhöhen. In einigen Fällen, wenn auch nicht in allen Fällen, wurde berichtet, dass diese Triebe aufhörten, als die Dosis reduziert oder das Medikament abgesetzt wurde. Da Patienten diese Verhaltensweisen möglicherweise nicht als abnormal erkennen, ist es wichtig, dass verschreibende Ärzte Patienten oder ihre Betreuer speziell nach der Entwicklung neuer oder verstärkter Spieltriebe, sexueller Triebe, unkontrollierter Ausgaben oder anderer Triebe während der Behandlung mit Parlodel 2,5 mg gegen die Parkinson-Krankheit fragen oder Hyperprolaktinämie-assoziierte Dysfunktionen. Ärzte sollten eine Dosisreduktion oder das Absetzen des Medikaments in Betracht ziehen, wenn ein Patient während der Einnahme von Parlodel einen solchen Drang entwickelt.
Sicherheit und Wirksamkeit von Parlodel (Bromocriptinmesylat) wurden bei Patienten mit Nieren- oder Lebererkrankungen nicht nachgewiesen. Vorsicht ist geboten, wenn die Parlodel-Therapie gleichzeitig mit anderen Arzneimitteln verabreicht wird, von denen bekannt ist, dass sie den Blutdruck senken.
Das Medikament sollte bei Patienten mit einer Vorgeschichte von Psychosen oder Herz-Kreislauf-Erkrankungen mit Vorsicht angewendet werden. Wenn Patienten mit Akromegalie oder Patienten mit Prolaktinom oder Parkinson-Krankheit während der Schwangerschaft mit Parlodel 2,5 mg behandelt werden, sollten sie sorgfältig überwacht werden, insbesondere während der Zeit nach der Geburt, wenn sie eine Vorgeschichte von Herz-Kreislauf-Erkrankungen haben.
Patienten mit der seltenen hereditären Galactose-Intoleranz, schwerem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
Hyperprolaktinämische Zustände
Eine Beeinträchtigung des Gesichtsfeldes ist eine bekannte Komplikation des Makroprolaktinoms. Eine wirksame Behandlung mit Parlodel 2,5 mg führt zu einer Verringerung der Hyperprolaktinämie und häufig zu einer Auflösung der Sehbehinderung. Bei einigen Patienten kann sich jedoch trotz normalisierter Prolaktinspiegel und Tumorschrumpfung eine sekundäre Verschlechterung der Gesichtsfelder entwickeln, die durch Zug am Chiasma opticum verursacht werden kann, das in die jetzt teilweise leere Sella heruntergezogen wird. In diesen Fällen kann sich der Gesichtsfelddefekt bei einer Verringerung der Bromocriptin-Dosierung verbessern, während es zu einem gewissen Anstieg von Prolaktin und einer gewissen Tumor-Reexpansion kommt. Daher wird eine Überwachung der Gesichtsfelder bei Patienten mit Makroprolaktinom empfohlen, um einen sekundären Gesichtsfeldverlust aufgrund einer Chiasmaherniation frühzeitig zu erkennen und die Medikamentendosis anzupassen.
Die relative Wirksamkeit von Parlodel gegenüber einer Operation bei der Erhaltung des Gesichtsfelds ist nicht bekannt. Patienten mit schnell fortschreitendem Gesichtsfeldverlust sollten von einem Neurochirurgen untersucht werden, um bei der Entscheidung über die am besten geeignete Therapie zu helfen.
Da bei vielen hyperprolaktinämischen Patienten mit Amenorrhoe/Galaktorrhoe und Hypogonadismus (Unfruchtbarkeit) häufig eine Schwangerschaft das therapeutische Ziel ist, ist eine sorgfältige Untersuchung der Hypophyse unerlässlich, um das Vorhandensein eines Prolaktin-sezernierenden Adenoms zu erkennen. Patientinnen, die keine Schwangerschaft anstreben, oder solchen mit großen Adenomen, sollte geraten werden, während der Behandlung mit Parlodel andere Verhütungsmethoden als orale Kontrazeptiva anzuwenden. Da eine Schwangerschaft vor dem Wiedereinsetzen der Menstruation eintreten kann, wird während der amenorrhoischen Periode mindestens alle 4 Wochen ein Schwangerschaftstest empfohlen und nach Wiedereinsetzen der Menstruation jedes Mal, wenn eine Patientin eine Menstruation ausbleibt. Die Behandlung mit Parlodel SnapTabs oder Kapseln sollte abgebrochen werden, sobald eine Schwangerschaft festgestellt wurde. Die Patientinnen müssen während der gesamten Schwangerschaft engmaschig auf Anzeichen und Symptome überwacht werden, die auf die Vergrößerung eines zuvor unentdeckten oder bestehenden Prolaktin-sezernierenden Tumors hindeuten können. Das Absetzen der Behandlung mit Parlodel bei Patienten mit bekannten Makroadenomen wurde in den meisten Fällen mit einem raschen Wiederwachstum des Tumors und einem Anstieg des Serumprolaktins in Verbindung gebracht.
Bei manchen Patienten mit Prolaktin-sezernierenden Adenomen, die mit Parlodel behandelt wurden, wurde Rhinorrhoe der zerebrospinalen Flüssigkeit beobachtet.
Akromegalie
Bei einigen Patienten mit Akromegalie, die mit Parlodel behandelt wurden, wurde ein kälteempfindlicher digitaler Vasospasmus beobachtet. Die Reaktion, sollte sie auftreten, kann durch Verringerung der Dosis von Parlodel 2,5 mg rückgängig gemacht und durch Warmhalten der Finger verhindert werden. Fälle von schweren Magen-Darm-Blutungen aufgrund von Magengeschwüren wurden berichtet, einige davon mit tödlichem Ausgang. Obwohl es keine Hinweise darauf gibt, dass Parlodel 2,5 mg die Inzidenz von Magengeschwüren bei Patienten mit Akromegalie erhöht, sollten Symptome, die auf ein Magengeschwür hindeuten, gründlich untersucht und angemessen behandelt werden. Patienten mit Magengeschwüren oder gastrointestinalen Blutungen in der Vorgeschichte sollten während der Behandlung mit Parlodel sorgfältig überwacht werden.
Bei einigen wenigen Patienten wurde über eine mögliche Tumorausdehnung während der Behandlung mit Parlodel berichtet. Da der natürliche Verlauf von Wachstumshormon-sezernierenden Tumoren unbekannt ist, sollten alle Patienten sorgfältig überwacht und bei Anzeichen einer Tumorexpansion die Behandlung abgebrochen und alternative Verfahren in Betracht gezogen werden.
Parkinson-Krankheit
Die Sicherheit bei Langzeitanwendung über mehr als 2 Jahre in den für Parkinson erforderlichen Dosen wurde nicht nachgewiesen.
Wie bei jeder chronischen Therapie wird eine regelmäßige Überprüfung der hepatischen, hämatopoetischen, kardiovaskulären und renalen Funktion empfohlen. Eine symptomatische Hypotonie kann auftreten, daher ist bei der Behandlung von Patienten, die blutdrucksenkende Arzneimittel erhalten, Vorsicht geboten.
Hohe Dosen von Parlodel 2,5 mg können mit Verwirrtheit und psychischen Störungen einhergehen. Da Parkinson-Patienten leichte Demenzgrade aufweisen können, ist bei der Behandlung solcher Patienten Vorsicht geboten.
Parlodel, das allein oder gleichzeitig mit Levodopa verabreicht wird, kann Halluzinationen (visuelle oder akustische) hervorrufen. Halluzinationen lösen sich normalerweise mit einer Dosisreduktion auf; Gelegentlich ist ein Absetzen von Parlodel 2,5 mg erforderlich. In seltenen Fällen haben nach Absetzen von Parlodel nach hohen Dosen Halluzinationen mehrere Wochen lang angehalten.
Wie bei Levodopa ist bei der Verabreichung von Parlodel an Patienten mit Myokardinfarkt in der Anamnese und einer verbleibenden atrialen, nodalen oder ventrikulären Arrhythmie Vorsicht geboten.
Retroperitoneale Fibrose wurde bei einigen Patienten berichtet, die eine Langzeittherapie (2 bis 10 Jahre) mit Parlodel 2,5 mg in Dosen zwischen 30 und 140 mg täglich erhielten.
Epidemiologische Studien haben gezeigt, dass Patienten mit der Parkinson-Krankheit ein höheres Risiko (2 ungefähr 6-mal höher) haben, ein Melanom zu entwickeln, als die allgemeine Bevölkerung. Ob das beobachtete erhöhte Risiko auf die Parkinson-Krankheit oder andere Faktoren, wie Medikamente zur Behandlung der Parkinson-Krankheit, zurückzuführen war, ist unklar. Aus den oben genannten Gründen wird Patienten und Anbietern empfohlen, bei der Anwendung von Parlodel für jede Indikation häufig und regelmäßig auf Melanome zu achten. Idealerweise sollten regelmäßige Hautuntersuchungen von entsprechend qualifizierten Personen (z. B. Dermatologen) durchgeführt werden.
Das Absetzen von Parlodel sollte nach Möglichkeit schrittweise erfolgen, auch wenn der Patient weiterhin Levodopa erhalten soll. Ein Symptomkomplex, der dem malignen neuroleptischen Syndrom ähnelt (gekennzeichnet durch erhöhte Temperatur, Muskelsteifheit, verändertes Bewusstsein und autonome Instabilität), ohne andere offensichtliche Ätiologie, wurde im Zusammenhang mit einer raschen Dosisreduktion, dem Absetzen oder einer Änderung der Antiparkinsontherapie berichtet.
Während des Ausschleichens oder nach Absetzen von Dopaminagonisten, einschließlich Parlodel, wurde über Symptome wie Apathie, Angst, Depression, Müdigkeit, Schlaflosigkeit, Schwitzen und Schmerzen berichtet. Diese Symptome sprechen im Allgemeinen nicht auf Levodopa an. Vor dem Absetzen von Parlodel sollten die Patienten über mögliche Entzugssymptome informiert und während und nach dem Absetzen von Parlodel engmaschig überwacht werden. Bei schweren Entzugserscheinungen kann eine erneute Gabe eines Dopaminagonisten in der niedrigsten wirksamen Dosis in Betracht gezogen werden.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Eine 74-wöchige Studie wurde an Mäusen durchgeführt, wobei Bromocriptinmesylat-Konzentrationen in der Nahrung verwendet wurden, die oralen Dosen von 10 und 50 mg/kg/Tag entsprachen. Eine 100-wöchige Studie an Ratten wurde mit Nahrungsmengen durchgeführt, die oralen Dosen von 1,7, 9,8 und 44 mg/kg/Tag entsprachen. Die höchsten an Mäusen und Ratten getesteten Dosen waren etwa das 2,5- bzw. 4,4-fache der in kontrollierten klinischen Studien verabreichten maximalen Humandosis (100 mg/Tag), basierend auf der Körperoberfläche. Bösartige Uterustumore, Endometrium und Myometrium, wurden bei Ratten wie folgt gefunden: 0/50 weibliche Kontrolltiere, 2/50 weibliche Tiere erhielten täglich 1,7 mg/kg, 7/49 weibliche Tiere erhielten täglich 9,8 mg/kg und 9/50 weibliche Tiere erhielten 44 mg/kg täglich. Das Auftreten dieser Neoplasien ist wahrscheinlich auf das hohe Östrogen/Progesteron-Verhältnis zurückzuführen, das bei Ratten aufgrund der prolaktinhemmenden Wirkung von Bromocriptinmesylat auftritt. Die endokrinen Mechanismen, von denen angenommen wird, dass sie bei Ratten beteiligt sind, sind beim Menschen nicht vorhanden. Es gibt keine bekannte Korrelation zwischen malignen Uterustumoren, die bei mit Bromocriptin behandelten Ratten auftreten, und dem Risiko für den Menschen. Im Gegensatz zu den Befunden bei Ratten zeigten die Uteri von Mäusen, die nach 74-wöchiger Behandlung getötet wurden, keine Hinweise auf arzneimittelbedingte Veränderungen.
Bromocriptinmesylat wurde in einer Reihe von Tests auf mutagenes Potenzial untersucht, darunter Ames-Bakterienmutationsassay, mutagene Aktivität in vitro auf V79-Fibroblasten des chinesischen Hamsters, zytogenetische Analyse von Knochenmarkszellen des chinesischen Hamsters nach einer In-vivo-Behandlung und ein In-vivo-Mikrokerntest auf Mutagenität Potenzial bei Mäusen.
In keinem dieser Tests wurden mutagene Wirkungen festgestellt.
Fertilität und Reproduktionsleistung bei weiblichen Ratten wurden durch die Behandlung mit Bromocriptin über die vorhergesagte Abnahme des Gewichts der Jungtiere aufgrund der Unterdrückung der Laktation hinaus nicht nachteilig beeinflusst. Bei Männchen, die mit 50 mg/kg dieses Medikaments behandelt wurden, lagen Paarung und Fertilität im normalen Bereich. Ein erhöhter perinataler Verlust wurde in den Untergruppen von Muttertieren produziert, die am Tag 21 nach der Geburt (pp) nach der Paarung mit Männchen getötet wurden, die mit der höchsten Dosis (50 mg/kg) behandelt wurden.
Schwangerschaft
Kategorie B
Die Verabreichung von 10-30 mg/kg Bromocriptin an 2 Rattenstämme an den Tagen 6 bis 15 postcoitum (pc) sowie eine Einzeldosis von 10 mg/kg am Tag 5 pc störten die Nidation. 3 mg/kg, die an den Tagen 6 bis 15 gegeben wurden, waren ohne Wirkung auf die Nidation und erzeugten keine Anomalien. Bei Tieren, die von Tag 8 bis 15 pc behandelt wurden, dh nach der Implantation, führten 30 mg/kg zu einer erhöhten pränatalen Mortalität in Form einer erhöhten Inzidenz von embryonaler Resorption. Eine Anomalie, Aplasie der Wirbelsäule und der Rippen, wurde in der Gruppe von 262 Föten gefunden, die von Muttertieren stammten, die mit 30 mg/kg Bromocriptin behandelt wurden. Bei Nachkommen von Muttertieren, die während der peri- oder postnatalen Phase behandelt wurden, wurden keine fetotoxischen Wirkungen festgestellt.
Es wurden zwei Studien an Kaninchen (2 Stämme) durchgeführt, um das Potenzial zur Beeinträchtigung der Einnistung zu bestimmen. Dosierungen von 100 oder 300 mg/kg/Tag von Tag 1 bis Tag 6 pc wirkten sich nicht nachteilig auf die Nidation aus. Die hohe Dosis betrug etwa das 63-fache der maximalen Dosis beim Menschen, die in kontrollierten klinischen Studien verabreicht wurde (100 mg/Tag), basierend auf der Körperoberfläche. Bei weißen Neuseeland-Kaninchen trat eine gewisse Embryosterblichkeit bei 300 mg/kg auf, was eine offensichtliche maternale Toxizität widerspiegelte. Drei Studien wurden an 2 Kaninchenstämmen durchgeführt, um das teratologische Potenzial von Bromocriptin in Dosierungen von 3, 10, 30, 100 und 300 mg/kg zu bestimmen, verabreicht von Tag 6 bis Tag 18 pc. In 2 Studien mit dem Yellow-Silver-Stamm , Gaumenspalte wurde bei 3 und 2 Föten bei maternaltoxischen Dosen von 100 bzw. 300 mg/kg gefunden. Ein Kontrollfötus zeigte diese Anomalie ebenfalls. In der dritten Studie, die mit weißen Neuseeland-Kaninchen unter Verwendung eines identischen Protokolls durchgeführt wurde, wurden keine Gaumenspalten erzeugt.
Bei keinem der 6 Nachkommen von 6 Affen wurden bei einer Dosis von 2 mg/kg teratologische oder embryotoxische Wirkungen von Bromocriptin hervorgerufen.
Es wurden Informationen zu 1276 Schwangerschaften bei Frauen, die Parlodel einnahmen, gesammelt. In den meisten Fällen wurde Parlodel innerhalb von 8 Wochen nach Beginn der Schwangerschaft (im Mittel 28,7 Tage) abgesetzt, jedoch erhielten 8 Patientinnen das Medikament kontinuierlich während der gesamten Schwangerschaft. Die mittlere Tagesdosis für alle Patienten betrug 5,8 mg (Bereich 1-40 mg).
Von diesen 1276 Schwangerschaften gab es 1088 Vollgeburten (4 Totgeburten), 145 spontane Aborte (11,4 %) und 28 induzierte Aborte (2,2 %). Darüber hinaus verursachten 12 Extrauteringravitationen und 3 Blasenmolen (zweimal bei derselben Patientin) einen vorzeitigen Schwangerschaftsabbruch. Diese Daten lassen sich gut mit der Abtreibungsrate (11 %–25 %) vergleichen, die für durch Clomifencitrat, menopausales Gonadotropin und Choriongonadotropin induzierte Schwangerschaften angegeben wird.
Obwohl Spontanaborte häufig nicht gemeldet werden, insbesondere vor der 20. Schwangerschaftswoche, wurde ihre Häufigkeit auf 15 % geschätzt.
Die Inzidenz von Geburtsfehlern in der Bevölkerung liegt im Großen und Ganzen zwischen 2% und 4,5%. Die Inzidenz bei 1109 Lebendgeburten von Patienten, die Bromocriptin erhielten, beträgt 3,3 %.
Es gibt keinen Hinweis darauf, dass Parlodel 2,5 mg zur Art oder Inzidenz von Geburtsfehlern bei dieser Gruppe von Säuglingen beigetragen hat.
Stillende Mutter
Parlodel 2,5 mg sollte nicht während der Stillzeit bei postpartalen Frauen angewendet werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von Bromocriptin zur Behandlung von Prolaktin-sezernierenden Hypophysenadenomen wurde bei Patienten im Alter von 16 bis Erwachsenen nachgewiesen. Für die Anwendung von Bromocriptin bei pädiatrischen Patienten unter 8 Jahren liegen keine Daten vor. Es wurde über einen einzelnen 8-jährigen Patienten berichtet, der wegen eines Prolaktin-sezernierenden Hypophysen-Makroadenoms mit Bromocriptin behandelt wurde, ohne therapeutisches Ansprechen.
Die Anwendung von Bromocriptin zur Behandlung von Prolaktin-sezernierenden Adenomen bei pädiatrischen Patienten in der Altersgruppe von 11 bis unter 16 Jahren wird durch Beweise aus gut kontrollierten Studien bei Erwachsenen gestützt, mit zusätzlichen Daten bei einer begrenzten Anzahl (n = 14) von Kindern und Jugendliche im Alter von 11 bis 15 Jahren mit Prolaktin-sezernierenden Makro- und Mikroadenomen der Hypophyse, die mit Bromocriptin behandelt wurden. Von den 14 gemeldeten Patienten hatten 9 erfolgreiche Ergebnisse, 3 teilweise Ansprechen und 2 sprachen nicht auf die Behandlung mit Bromocriptin an. Chronischer Hypopituitarismus komplizierte die Makroadenombehandlung bei 5 der Responder, sowohl bei Patienten, die Bromocriptin allein erhielten, als auch bei Patienten, die Bromocriptin in Kombination mit einer chirurgischen Behandlung und/oder Hypophysenbestrahlung erhielten.
Die Sicherheit und Wirksamkeit von Bromocriptin bei pädiatrischen Patienten wurde für keine der anderen im Abschnitt INDIKATIONEN UND ANWENDUNG aufgeführten Indikationen nachgewiesen.
Geriatrische Verwendung
Klinische Studien zu Parlodel 2,5 mg schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob ältere Menschen anders reagieren als jüngere Probanden. Andere berichtete klinische Erfahrungen, einschließlich Meldungen nach Markteinführung von unerwünschten Ereignissen, haben jedoch keine Unterschiede im Ansprechen oder in der Verträglichkeit zwischen älteren und jüngeren Patienten festgestellt. Auch wenn bei geriatrischen Patienten, die Parlodel 2,5 mg einnehmen, keine Unterschiede in der Wirksamkeit oder im Nebenwirkungsprofil beobachtet wurden, kann eine größere Empfindlichkeit einiger älterer Personen nicht kategorisch ausgeschlossen werden. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und am unteren Ende des Dosisbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie in dieser Patientengruppe widerzuspiegeln.
ÜBERDOSIS
Die am häufigsten berichteten Anzeichen und Symptome im Zusammenhang mit einer akuten Überdosierung von Parlodel (Bromocriptinmesylat) sind: Übelkeit, Erbrechen, Verstopfung, Diaphorese, Schwindel, Blässe, schwere Hypotonie, Unwohlsein, Verwirrtheit, Lethargie, Schläfrigkeit, Wahnvorstellungen, Halluzinationen und wiederholtes Gähnen. Die tödliche Dosis wurde nicht ermittelt und das Medikament hat einen sehr großen Sicherheitsspielraum. Es kam jedoch zu einem Todesfall bei einem Patienten, der mit einer unbekannten Menge Parlodel 2,5 mg und Chloroquin Selbstmord beging.
Die Behandlung einer Überdosierung besteht aus der Entfernung des Arzneimittels durch Erbrechen (falls bei Bewusstsein), Magenspülung, Aktivkohle oder Kochsalzlösung. Eine sorgfältige Überwachung und Aufzeichnung der Flüssigkeitsaufnahme und -ausgabe ist unerlässlich. Hypotonie sollte behandelt werden, indem der Patient in die Trendelenburg-Position gebracht und intravenöse Flüssigkeiten verabreicht werden. Wenn eine zufriedenstellende Linderung der Hypotonie nicht erreicht werden kann, indem die oben genannten Maßnahmen in vollem Umfang angewendet werden, sollten Vasopressoren in Betracht gezogen werden.
Es gibt vereinzelte Berichte über Kinder, die Parlodel versehentlich eingenommen haben. Als Nebenwirkungen wurden Erbrechen, Somnolenz und Fieber berichtet. Die Patienten erholten sich entweder spontan innerhalb weniger Stunden oder nach entsprechender Behandlung.
KONTRAINDIKATIONEN
Überempfindlichkeit gegen Bromocriptin oder einen der sonstigen Bestandteile von Parlodel (Bromocriptinmesylat), unkontrollierter Bluthochdruck und Empfindlichkeit gegenüber Mutterkornalkaloiden. Bei Patienten, die wegen Hyperprolaktinämie behandelt werden, sollte Parlodel 2,5 mg abgesetzt werden, wenn eine Schwangerschaft diagnostiziert wird (siehe VORSICHTSMASSNAHMEN , Hyperprolaktinämische Zustände ). Für den Fall, dass Parlodel 2,5 mg wieder aufgenommen wird, um ein schnell expandierendes Makroadenom zu kontrollieren (siehe VORSICHTSMASSNAHMEN , Hyperprolaktinämische Zustände und bei einer Patientin eine hypertensive Schwangerschaftsstörung auftritt, muss der Nutzen einer fortgesetzten Behandlung mit Parlodel gegen das mögliche Risiko der Anwendung während einer hypertensiven Schwangerschaftsstörung abgewogen werden. Wenn Parlodel zur Behandlung von Akromegalie, Prolaktinom oder Parkinson-Krankheit bei Patientinnen angewendet wird, die später schwanger werden, sollte entschieden werden, ob die Therapie weiterhin medizinisch notwendig ist oder abgesetzt werden kann. Wenn die Behandlung fortgeführt wird, sollte das Arzneimittel bei Patienten abgesetzt werden, bei denen es zu hypertensiven Schwangerschaftsstörungen kommen kann (einschließlich Eklampsie, Präeklampsie oder schwangerschaftsinduzierter Hypertonie), es sei denn, das Absetzen von Parlodel wird aus medizinischen Gründen als kontraindiziert erachtet.
Das Medikament sollte nicht während der Zeit nach der Geburt bei Frauen mit einer Vorgeschichte von koronarer Herzkrankheit und anderen schweren kardiovaskulären Erkrankungen angewendet werden, es sei denn, ein Absetzen ist medizinisch kontraindiziert. Wenn das Medikament in der Zeit nach der Geburt verwendet wird, sollte die Patientin mit Vorsicht beobachtet werden.
KLINISCHE PHARMAKOLOGIE
Parlodel (Bromocriptinmesylat) ist ein Dopaminrezeptoragonist, der postsynaptische Dopaminrezeptoren aktiviert. Die dopaminergen Neuronen im Tuberoinfundibularfortsatz modulieren die Sekretion von Prolaktin aus dem Hypophysenvorderlappen, indem sie einen Prolaktin-Hemmfaktor (vermutlich Dopamin) sezernieren; im Corpus striatum sind die dopaminergen Neuronen an der Steuerung der Motorik beteiligt. Klinisch senkt Parlodel 2,5 mg signifikant die Plasmaspiegel von Prolaktin bei Patienten mit physiologisch erhöhtem Prolaktinspiegel sowie bei Patienten mit Hyperprolaktinämie. Die Hemmung der physiologischen Laktation sowie der Galaktorrhö bei pathologischen hyperprolaktinämischen Zuständen wird bei Dosierungen erreicht, die die Sekretion anderer tropischer Hormone aus dem Hypophysenvorderlappen nicht beeinflussen. Experimente haben gezeigt, dass Bromocriptin lang anhaltendes stereotypes Verhalten bei Nagetieren und Wendeverhalten bei Ratten mit einseitigen Läsionen in der Substantia nigra induziert. Diese Wirkungen, die für die von Dopamin erzeugten charakteristisch sind, werden durch Dopaminantagonisten gehemmt und legen eine direkte Wirkung von Bromocriptin auf striatale Dopaminrezeptoren nahe.
Bromocriptinmesylat ist ein nichthormonaler, nichttrogener Wirkstoff, der die Sekretion von Prolaktin beim Menschen hemmt, mit geringer oder keiner Wirkung auf andere Hypophysenhormone, außer bei Patienten mit Akromegalie, wo es bei der Mehrzahl der Patienten erhöhte Wachstumshormonspiegel im Blut senkt.
Bromocriptinmesylat entfaltet seine therapeutische Wirkung bei der Behandlung der Parkinson-Krankheit, einem klinischen Zustand, der durch einen fortschreitenden Mangel an Dopaminsynthese in der Substantia nigra gekennzeichnet ist, indem es die Dopaminrezeptoren im Corpus striatum direkt stimuliert. Im Gegensatz dazu entfaltet Levodopa seine therapeutische Wirkung erst nach Umwandlung in Dopamin durch die Neuronen der Substantia nigra, von denen bekannt ist, dass sie in dieser Patientenpopulation zahlenmäßig vermindert sind.
Pharmakokinetik
Absorption
Nach Gabe einer Einzeldosis von Parlodel 2,5 mg Tabletten, 2 x 2,5 mg an 5 gesunde Freiwillige unter nüchternen Bedingungen, betrugen die mittleren Spitzenplasmaspiegel von Bromocriptin, die Zeit bis zum Erreichen der Spitzenplasmakonzentrationen und die Eliminationshalbwertszeit 465 pg/ml ± 226, 2,5 Std. ± 2 bzw. 4,85 Std.1 Es wurde ein linearer Zusammenhang zwischen Einzeldosen von Parlodel 2,5 mg und Cmax und AUC im Dosisbereich von 1 bis 7,5 mg gefunden.2 Die Pharmakokinetik von Bromocriptin-Metaboliten wurde nicht berichtet.
Nahrung hatte keinen signifikanten Einfluss auf die systemische Bromocriptin-Exposition nach Verabreichung von Parlodel-Tabletten, 2,5 mg.3 Es wird empfohlen, Parlodel 2,5 mg zusammen mit Nahrung einzunehmen, da der hohe Prozentsatz von Patienten nach Einnahme von Bromocriptin unter nüchternen Bedingungen erbricht.
Nach zweimal täglicher Gabe von 5 mg Parlodel über 14 Tage betrugen die Cmax und AUC von Bromocriptin im Steady State 628 ± 375 pg/ml bzw. 2377 ± 1186 pg*h/ml.4
Verteilung
In-vitro-Experimente zeigten, dass Bromocriptin zu 90 % bis 96 % an Serumalbumin gebunden war.
Stoffwechsel
Bromocriptin unterliegt einer umfassenden First-Pass-Biotransformation, die sich in komplexen Metabolitenprofilen und in der fast vollständigen Abwesenheit der Muttersubstanz in Urin und Stuhl widerspiegelt.
In-vitro-Studien mit menschlichen Lebermikrosomen zeigten, dass Bromocriptin eine hohe Affinität zu CYP3A hat und Hydroxylierungen am Prolinring der Cyclopeptideinheit einen Hauptstoffwechselweg darstellten.5 Inhibitoren und/oder starke Substrate für CYP3A4 könnten daher die Clearance von Bromocriptin und Blei hemmen auf erhöhte Niveaus. (sehen VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN Sektion). Die Beteiligung anderer wichtiger CYP-Enzyme wie 2D6, 2C8 und 2C19 am Metabolismus von Bromocriptin wurde nicht untersucht. Bromocriptin ist auch ein Inhibitor von CYP3A4 mit einem berechneten IC50-Wert von 1,69 μM.6 Angesichts der niedrigen therapeutischen Konzentrationen von Bromocriptin bei Patienten (Cmax = 0,82 nM) sollte eine signifikante Veränderung des Metabolismus eines zweiten Arzneimittels, dessen Clearance durch CYP3A4 vermittelt wird, nicht auftreten erwartet werden. Die potenzielle Wirkung von Bromocriptin und seinen Metaboliten, als Induktoren von CYP-Enzymen zu wirken, wurde nicht berichtet.
Ausscheidung
Etwa 82 % bzw. 5,6 % der oral verabreichten radioaktiven Dosis wurden im Stuhl bzw. im Urin wiedergefunden. Bromolysergsäure und Bromisolysergsäure machten die Hälfte der Radioaktivität im Urin aus.5
Spezifische Populationen
Auswirkung einer Nierenfunktionsstörung
Die Auswirkung der Nierenfunktion auf die Pharmakokinetik von Bromocriptin wurde nicht untersucht.
Da die Muttersubstanz und ihre Metaboliten fast vollständig über den Metabolismus ausgeschieden werden und nur 6 % über die Niere eliminiert werden, hat eine eingeschränkte Nierenfunktion möglicherweise keinen signifikanten Einfluss auf die PK von Bromocriptin und seinen Metaboliten (siehe VORSICHTSMASSNAHMEN , Allgemein ).
Auswirkung einer Leberfunktionsstörung
Die Auswirkung einer Leberfunktionsstörung auf die PK von Parlodel und seinen Metaboliten wurde nicht untersucht. Da Parlodel hauptsächlich durch Metabolisierung eliminiert wird, kann eine Leberfunktionsstörung die Plasmaspiegel von Bromocriptin erhöhen, daher kann Vorsicht geboten sein (siehe VORSICHTSMASSNAHMEN , Allgemein ).
Die Auswirkungen von Alter, Rasse und Geschlecht auf die Pharmakokinetik von Bromocriptin und seinen Metaboliten wurden nicht untersucht.
Klinische Studien
In etwa 75 % der Fälle von Amenorrhoe und Galaktorrhoe unterdrückt die Behandlung mit Parlodel 2,5 mg die Galaktorrhoe vollständig oder fast vollständig und setzt normale ovulatorische Menstruationszyklen wieder in Gang.
Die Menstruation wird normalerweise vor der vollständigen Unterdrückung der Galaktorrhoe wieder eingesetzt; die Zeit dafür beträgt im Durchschnitt 6 bis 8 Wochen. Einige Patienten sprechen jedoch innerhalb weniger Tage an, bei anderen kann es bis zu 8 Monate dauern.
Je nach Stimulationsgrad des Brustgewebes vor der Therapie kann die Kontrolle der Galaktorrhoe länger dauern. Üblicherweise wird nach 8 bis 12 Wochen eine Verringerung der Sekretion um mindestens 75 % beobachtet. Einige Patienten sprechen möglicherweise auch nach 12 Monaten Therapie nicht an.
Bei vielen Patienten mit Akromegalie führt Parlodel 2,5 mg zu einer sofortigen und anhaltenden Senkung der zirkulierenden Serum-Wachstumshormonspiegel.
1 Nelson, M. et. Al. (1990). Pharmakokinetische Bewertung von Erythromycin und Koffein, verabreicht mit Bromocriptin. Clin Pharmacol Ther; 47(6):694-7.
Schran, HF, Bhuta, SI, Schwartz, et al. (1980). Die Pharmakokinetik von Bromocriptin beim Menschen. In: Golstein, M. Calne, DB, et. Al (Hrsg.). Mutterkornverbindung und Gehirnfunktion: Neuroendokrine und neuropsychiatrische Aspekte, S. 125-139, New York, Rave Press.
3 Kopitar, Z., Vrhovac, B., Povsic, L., Plavsic, F., Francetic, I., Urbancic, J. (1991). Die Wirkung von Nahrung und Metoclopramid auf die Pharmakokinetik und Nebenwirkungen von Bromocriptin. Eur J Drug Metab Pharmacokinet; 16(3):177-81
4 Flogstad, AK, Halse, J., Grass, P., Abisch, E., Djoseland, O., Kutz, K., Bodd, E. und Jervell, J., (1994). Ein Vergleich von Octreotid, Bromocriptin oder einer Kombination beider Medikamente bei Akromegalie. Journal of Clinical Endocrinology & Metabolism; Band 79, 461-465
5 MA Peyronneau, M. Delaforge, R. Riviere et al. 1994. High affinity of ergopeptides for CYP P450 3A. Bedeutung ihrer Peptideinheit für die P450-Erkennung und Hydroxylierung von Bromocriptin. Eur. J. Biochem. 223: 947-56.
Wynalda, MA, Wienkers, LC (1997). Bewertung potenzieller Wechselwirkungen zwischen Dopaminrezeptor-Agonisten und verschiedenen humanen Cytochrom-P450-Enzymen unter Verwendung eines einfachen In-vitro-Inhibitionsscreens. Drug Metab Dispos; 25:1211-14.
INFORMATIONEN ZUM PATIENTEN
Während klinischer Studien wurde früh im Verlauf der Behandlung mit Parlodel 2,5 mg über Schwindel, Schläfrigkeit, Ohnmacht, Ohnmacht und Synkope berichtet. In Postmarketing-Berichten wurde Parlodel mit Somnolenz und Episoden plötzlichen Einschlafens in Verbindung gebracht, insbesondere bei Patienten mit Parkinson-Krankheit. Sehr selten wurde über plötzliches Einschlafen bei täglichen Aktivitäten, in manchen Fällen ohne Bewusstsein oder Warnzeichen, berichtet. Alle Patienten, die Parlodel erhalten, sollten davor gewarnt werden, Aktivitäten nachzugehen, die schnelle und präzise Reaktionen erfordern, wie z. B. Autofahren oder Bedienen von Maschinen. Patienten, die mit Parlodel 2,5 mg behandelt werden und unter Somnolenz und/oder plötzlichen Schlafepisoden leiden, müssen darauf hingewiesen werden, kein Fahrzeug zu führen oder sich an Aktivitäten zu beteiligen, bei denen eine eingeschränkte Aufmerksamkeit sie selbst oder andere einem Risiko schwerer Verletzungen oder des Todes aussetzen könnte (z. B. Bedienen von Maschinen).
Patienten, die Parlodel 2,5 mg wegen hyperprolaktinämischer Zustände im Zusammenhang mit Makroadenomen erhalten, oder Patienten, die sich einer früheren transsphenoidalen Operation unterzogen haben, sollten angewiesen werden, ihrem Arzt jeden anhaltenden wässrigen Nasenausfluss zu melden. Patienten, die Parlodel 2,5 mg zur Behandlung eines Makroadenoms erhalten, sollten darüber informiert werden, dass das Absetzen des Arzneimittels mit einem schnellen Wiederwachstum des Tumors und dem Wiederauftreten ihrer ursprünglichen Symptome einhergehen kann.
Patienten und ihre Betreuer sollten auf die Möglichkeit aufmerksam gemacht werden, dass Patienten während der Einnahme von Parlodel einen intensiven Drang verspüren, unkontrolliert Geld auszugeben, einen intensiven Drang zu spielen, einen verstärkten sexuellen Drang und andere intensive Dränge und die Unfähigkeit, diesen Drang zu kontrollieren. Weisen Sie Patienten und ihre Betreuer an, ihren Arzt zu informieren, wenn sie während der Behandlung mit Parlodel neue oder verstärkte unkontrollierte Ausgaben, Spielsucht, sexuelles Verlangen oder andere Triebe entwickeln [siehe VORSICHTSMASSNAHMEN ].
Besonders in den ersten Tagen der Behandlung können gelegentlich blutdrucksenkende Reaktionen auftreten, die zu einer verminderten Aufmerksamkeit führen. Besondere Vorsicht ist geboten, wenn Sie ein Fahrzeug führen oder Maschinen bedienen.
Empfehlen Sie den Patienten, sich an ihren Arzt zu wenden, wenn sie Parlodel absetzen oder die Parlodel-Dosis verringern möchten. Weisen Sie Patienten, denen eine niedrigere Dosis verschrieben wurde oder denen das Medikament abgesetzt wurde, an, ihren Arzt zu benachrichtigen, wenn sie Entzugssymptome wie Fieber, Muskelsteifheit, Bewusstseinsstörungen, Apathie, Angst, Depression, Müdigkeit, Schlaflosigkeit, Schwitzen oder haben Schmerzen (vgl VORSICHTSMASSNAHMEN ).