Prometrium 100mg, 200mg Progesterone Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Prometrium 100 mg und wie wird es angewendet?
Prometrium 200 mg ist ein verschreibungspflichtiges Arzneimittel zur Vorbeugung und Behandlung der Symptome einer Endometriumhyperplasie und der Symptome einer sekundären Amenorrhoe (Ausbleiben der Menstruation oder Periode). Prometrium kann allein oder mit anderen Medikamenten verwendet werden.
Prometrium gehört zu einer Klasse von Arzneimitteln, die Gestagene genannt werden.
Es ist nicht bekannt, ob Prometrium 200 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Prometrium haben?
Prometrium kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Prometrium 100 mg gehören:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Prometrium. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
KARDIOVASKULÄRE ERKRANKUNGEN, BRUSTKREBS und WAHRSCHEINLICHE DEMENZ FÜR ÖSTROGEN-PLUS-PROGESTIN-THERAPIE
Herz-Kreislauf-Erkrankungen und wahrscheinliche Demenz
Östrogene plus Gestagentherapie sollten nicht zur Vorbeugung von Herz-Kreislauf-Erkrankungen oder Demenz eingesetzt werden. (Sehen Klinische Studien und WARNUNGEN , Herz-Kreislauf-Erkrankungen und wahrscheinliche Demenz. )
Die Substudie Östrogen plus Progestin der Women’s Health Initiative (WHI) berichtete über ein erhöhtes Risiko für tiefe Venenthrombose, Lungenembolie, Schlaganfall und Myokardinfarkt bei postmenopausalen Frauen (im Alter von 50 bis 79 Jahren) während einer 5,6-jährigen Behandlung mit täglicher oraler Konjugation Östrogene (CE) [0,625 mg] kombiniert mit Medroxyprogesteronacetat (MPA) [2,5 mg], relativ zu Placebo. (Sehen Klinische Studien und WARNUNGEN , Herz-Kreislauf-Erkrankungen. )
Die WHI Memory Study (WHIMS) Östrogen plus Gestagen Zusatzstudie der WHI berichtete über ein erhöhtes Risiko für die Entwicklung einer wahrscheinlichen Demenz bei postmenopausalen Frauen im Alter von 65 Jahren oder älter während einer 4-jährigen Behandlung mit täglich CE (0,625 mg) in Kombination mit MPA (2,5 mg). ), relativ zu Placebo. Es ist nicht bekannt, ob dieser Befund für jüngere postmenopausale Frauen gilt. (Sehen Klinische Studien und WARNUNGEN , Wahrscheinliche Demenz und VORSICHTSMASSNAHMEN , Geriatrische Verwendung .)
Brustkrebs
Die WHI-Substudie Östrogen plus Gestagen zeigte auch ein erhöhtes Risiko für invasiven Brustkrebs. (Sehen Klinische Studien und WARNUNGEN , Bösartige Neubildungen, Brustkrebs .)
In Ermangelung vergleichbarer Daten sollte davon ausgegangen werden, dass diese Risiken für andere Dosen von CE und MPA sowie andere Kombinationen und Darreichungsformen von Östrogenen und Progestinen ähnlich sind.
Gestagene mit Östrogenen sollten in den niedrigsten wirksamen Dosen und für die kürzeste Dauer verschrieben werden, die mit den Behandlungszielen und Risiken für die jeweilige Frau vereinbar sind.
BEZEICHNUNG
PROMETRIUM (Progesteron, USP) Kapseln enthalten mikronisiertes Progesteron zur oralen Verabreichung. Progesteron hat ein Molekulargewicht von 314,47 und eine Summenformel von C21H30O2. Progesteron (Pregn-4-en-3, 20-dion) ist ein weißes oder cremeweißes, geruchloses, kristallines Pulver, praktisch unlöslich in Wasser, löslich in Alkohol, Aceton und Dioxan und schwer löslich in Pflanzenölen, luftstabil, dazwischen schmelzend 126° und 131°C. Die Strukturformel lautet:
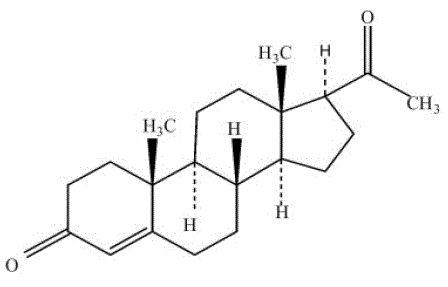
Progesteron wird aus einem Ausgangsmaterial aus einer pflanzlichen Quelle synthetisiert und ist chemisch identisch mit Progesteron aus menschlichen Eierstöcken. PROMETRIUM-Kapseln sind in mehreren Stärken erhältlich, um Dosierungsflexibilität für ein optimales Management zu bieten. PROMETRIUM-Kapseln enthalten 100 mg oder 200 mg mikronisiertes Progesteron.
Zu den inaktiven Bestandteilen von PROMETRIUM Kapseln 100 mg gehören: Erdnussöl NF, Gelatine NF, Glycerin USP, Lezithin NF, Titandioxid USP, FD&C Red Nr. 40 und D&C Yellow Nr. 10. Zu den inaktiven Bestandteilen von PROMETRIUM 100 mg Kapseln 200 mg gehören: : Erdnussöl NF, Gelatine NF, Glycerin USP, Lezithin NF, Titandioxid USP, D&C Gelb Nr. 10 und FD&C Gelb Nr. 6.
INDIKATIONEN
PROMETRIUM 200 mg Kapseln sind angezeigt zur Vorbeugung einer Endometriumhyperplasie bei postmenopausalen Frauen ohne Hysterektomie, die Tabletten mit konjugierten Östrogenen erhalten. Sie sind auch zur Anwendung bei sekundärer Amenorrhoe indiziert.
DOSIERUNG UND ANWENDUNG
Prävention von Endometriumhyperplasie
PROMETRIUM 100 mg Kapseln sollten einer postmenopausalen Frau mit Uterus, die täglich Tabletten mit konjugierten Östrogenen erhält, als tägliche Einzeldosis vor dem Schlafengehen, 200 mg oral für 12 Tage nacheinander in einem 28-Tage-Zyklus, verabreicht werden.
Behandlung der sekundären Amenorrhoe
PROMETRIUM 100 mg Kapseln können 10 Tage lang als tägliche Einzeldosis von 400 mg vor dem Schlafengehen verabreicht werden.
Einige Frauen können Schwierigkeiten beim Schlucken von PROMETRIUM-Kapseln haben. Für diese Frauen sollten PROMETRIUM-Kapseln im Stehen mit einem Glas Wasser eingenommen werden.
WIE GELIEFERT
PROMETRIUM (Progesteron, USP) Kapseln 100 mg sind runde, pfirsichfarbene Kapseln mit dem schwarzen Aufdruck „SV“.
NDC 0032-1708-01 (100er Flasche)
PROMETRIUM (Progesteron, USP) Kapseln 200 mg sind ovale, blassgelbe Kapseln mit dem schwarzen Aufdruck „SV2“.
NDC 0032-1711-01 (100er Flasche)
Bei 25 °C (77 °F) lagern; Abweichungen bis 15° bis 30°C (59° bis 86°F) zulässig [Siehe USP Controlled Room Temperature].
Vor übermäßiger Feuchtigkeit schützen.
In einem dichten, lichtbeständigen Behälter gemäß Definition in USP/NF zusammen mit einer Patientenbeilage abgeben.
Außerhalb der Reichweite von Kindern aufbewahren.
Hergestellt von: Catalent Pharma Solutions, St. Petersburg, FL 33716. Überarbeitet: September 2013
NEBENWIRKUNGEN
Sehen KASTENWARNUNG , WARNUNGEN und VORSICHTSMASSNAHMEN .
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
In einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten klinischen Studie wurden die Wirkungen von PROMETRIUM 100 mg Kapseln auf das Endometrium bei insgesamt 875 postmenopausalen Frauen untersucht. Tabelle 6 listet die Nebenwirkungen von mindestens 2 Prozent der Frauen auf, die täglich 200 mg PROMETRIUM-Kapseln (Zyklus an 12 Tagen pro Kalendermonat) mit 0,625 mg konjugierten Östrogenen oder Placebo erhielten.
TABELLE 6. Nebenwirkungen (≥ 2 %), die in einer placebokontrollierten Studie mit 875 Patienten bei postmenopausalen Frauen über einen Zeitraum von 3 Jahren berichtet wurden [Prozentsatz (%) der berichteten Patienten]
Auswirkungen auf die sekundäre Amenorrhoe
In einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten klinischen Studie wurden die Wirkungen von PROMETRIUM-Kapseln auf die sekundäre Amenorrhoe bei 49 mit Östrogen geprimten postmenopausalen Frauen untersucht. Tabelle 7 listet Nebenwirkungen auf, die bei mindestens 5 Prozent der Frauen auftraten, die PROMETRIUM 100 mg Kapseln oder Placebo erhielten.
TABELLE 7. Nebenwirkungen (≥ 5 %), die bei Patienten berichtet wurden, die 400 mg/Tag in einer Placebo-kontrollierten Studie bei Östrogen-geprimten postmenopausalen Frauen einnahmen
In einer multizentrischen, unverblindeten Postmarketing-Dosierungsstudie mit parallelen Gruppen, bestehend aus drei aufeinanderfolgenden 28-tägigen Behandlungszyklen, wurden 220 prämenopausale Frauen mit sekundärer Amenorrhoe randomisiert und erhielten täglich eine Therapie mit konjugierten Östrogenen (0,625 mg konjugierte Östrogene) und PROMETRIUM 100 mg Kapseln, 300 mg pro Tag (n = 113) oder PROMETRIUM-Kapseln, 400 mg pro Tag (n = 107) für 10 Tage jedes Behandlungszyklus. Insgesamt waren die am häufigsten berichteten behandlungsbedingten Nebenwirkungen, die bei mehr als oder gleich 5 Prozent der Probanden berichtet wurden, Übelkeit, Müdigkeit, Vaginalmykose, Nasopharyngitis, Infektion der oberen Atemwege, Kopfschmerzen, Schwindel, Brustspannen, aufgeblähter Bauch, Akne , Dysmenorrhoe, Stimmungsschwankungen und Harnwegsinfektionen.
Postmarketing-Erfahrung
Die folgenden zusätzlichen Nebenwirkungen wurden mit PROMETRIUM 200 mg Kapseln berichtet. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, die Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Urogenitalsystem
Endometriumkarzinom, Hypospadie, intrauteriner Tod, Menorrhagie, Menstruationsstörung, Metrorrhagie, Ovarialzyste, Spontanabort.
Herz-Kreislauf
Kreislaufkollaps, angeborene Herzfehler (einschließlich Ventrikelseptumdefekt und offener Ductus arteriosus), Bluthochdruck, Hypotonie, Tachykardie.
Magen-Darm
akute Pankreatitis, Cholestase, cholestatische Hepatitis, Dysphagie, Leberversagen, hepatische Nekrose, Hepatitis, erhöhte Leberfunktionswerte (einschließlich erhöhter Alanin-Aminotransferase, erhöhter Aspartat-Aminotransferase, erhöhter Gamma-Glutamyl-Transferase), Gelbsucht, geschwollene Zunge.
Haut
Alopezie, Juckreiz, Urtikaria.
Augen
verschwommenes Sehen, Diplopie, Sehstörungen.
Zentrales Nervensystem
Aggression, Krämpfe, Depersonalisation, Bewusstseinsdepression, Orientierungslosigkeit, Dysarthrie, Bewusstseinsverlust, Parästhesie, Sedierung, Stupor, Synkope (mit und ohne Hypotonie), transitorische ischämische Attacke, Suizidgedanken.
Während der Anfangstherapie haben einige Frauen eine Konstellation von vielen oder allen der folgenden Symptome erlebt: extremer Schwindel und/oder Benommenheit, verschwommenes Sehen, undeutliches Sprechen, Schwierigkeiten beim Gehen, Bewusstlosigkeit, Schwindel, Verwirrtheit, Orientierungslosigkeit, Trunkenheitsgefühl und Kurzatmigkeit.
Sonstig
anormaler Gang, anaphylaktische Reaktion, Arthralgie, erhöhter Blutzucker, Würgen, Lippen-Kiefer-Gaumenspalte, Schwierigkeiten beim Gehen, Dyspnoe, Gesichtsödem, anormales Gefühl, Trunkenheitsgefühl, Überempfindlichkeit, Asthma, Muskelkrämpfe, Engegefühl im Hals, Tinnitus, Schwindel, Gewichtsabnahme , Gewicht zugenommen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Arzneimittel-Labortest-Wechselwirkungen
Die folgenden Laborergebnisse können durch die Anwendung von Östrogen plus Progestin-Therapie verändert werden:
WARNUNGEN
Sehen KASTENWARNUNG .
Herz-Kreislauf-Erkrankungen
Es wurde über ein erhöhtes Risiko für Lungenembolie, tiefe Venenthrombose (TVT), Schlaganfall und Myokardinfarkt unter Östrogen plus Progestin-Therapie berichtet. Sollte einer dieser Fälle auftreten oder vermutet werden, sollte die Östrogen-Gestagen-Therapie sofort abgesetzt werden.
Risikofaktoren für arterielle Gefäßerkrankungen (z. B. Bluthochdruck, Diabetes mellitus, Tabakkonsum, Hypercholesterinämie und Fettleibigkeit) und/oder venöse Thromboembolien (z. B. persönliche oder familiäre Vorgeschichte von venösen Thromboembolien [VTE], Fettleibigkeit und systemischem Lupus erythematodes). ) sollten angemessen verwaltet werden.
Streicheln
In der Substudie Östrogen plus Progestin der Women's Health Initiative (WHI) wurde bei Frauen im Alter von 50 bis 79 Jahren, die täglich CE (0,625 mg) plus MPA (2,5 mg) erhielten, ein statistisch signifikant erhöhtes Schlaganfallrisiko im Vergleich zu Frauen im gleichen Alter berichtet Gruppe, die Placebo erhielt (33 versus 25 pro 10.000 Frauenjahre). Der Anstieg des Risikos wurde nach dem ersten Jahr nachgewiesen und hielt an. (Sehen Klinische Studien .) Sollte ein Schlaganfall auftreten oder vermutet werden, sollte die Östrogen- plus Gestagentherapie sofort abgesetzt werden.
Koronare Herzerkrankung
In der WHI-Substudie Östrogen plus Progestin wurde bei Frauen, die täglich CE erhielten, ein statistisch nicht signifikant erhöhtes Risiko für Ereignisse der koronaren Herzkrankheit (KHK) (definiert als nicht tödlicher Myokardinfarkt [MI], stiller MI oder KHK-Tod) berichtet (0,625 mg) plus MPA (2,5 mg) im Vergleich zu Frauen, die Placebo erhielten (41 versus 34 pro 10.000 Frauenjahre). Ein Anstieg des relativen Risikos wurde in Jahr 1 nachgewiesen und ein Trend zu einem abnehmenden relativen Risiko wurde in den Jahren 2 bis 5 gemeldet. (Siehe Klinische Studien .)
Bei postmenopausalen Frauen mit nachgewiesener Herzerkrankung (n = 2.763, Durchschnittsalter 66,7 Jahre) in einer kontrollierten klinischen Studie zur Sekundärprävention kardiovaskulärer Erkrankungen (Heart and Estrogen/Progestin Replacement Study [HERS]), Behandlung mit täglich CE (0,625 mg) plus MPA (2,5 mg) zeigte keinen kardiovaskulären Nutzen. Während einer durchschnittlichen Nachbeobachtungszeit von 4,1 Jahren reduzierte die Behandlung mit CE plus MPA die Gesamtrate von CHD-Ereignissen bei postmenopausalen Frauen mit bestehender koronarer Herzkrankheit nicht. In der mit CE plus MPA behandelten Gruppe traten in Jahr 1 mehr KHK-Ereignisse auf als in der Placebogruppe, aber nicht in den darauffolgenden Jahren. Zweitausenddreihunderteinundzwanzig (2.321) Frauen aus der ursprünglichen HERS-Studie erklärten sich bereit, an einer Open-Label-Verlängerung von HERS, HERS II, teilzunehmen. Die durchschnittliche Nachbeobachtungszeit bei HERS II betrug weitere 2,7 Jahre, insgesamt also 6,8 Jahre. Die Raten von CHD-Ereignissen waren bei Frauen in der CE plus MPA-Gruppe und der Placebo-Gruppe bei HERS, HERS II und insgesamt vergleichbar.
Venöse Thromboembolie
In der WHI-Substudie Östrogen plus Gestagen wurde eine statistisch signifikante 2-fach höhere Rate von VTE (TVT und Lungenembolie [LE]) bei Frauen berichtet, die täglich CE (0,625 mg) plus MPA (2,5 mg) erhielten, im Vergleich zu Frauen, die Placebo erhielten ( 35 gegenüber 17 pro 10.000 Frauenjahre). Statistisch signifikante Risikoerhöhungen sowohl für TVT (26 gegenüber 13 pro 10.000 Frauenjahre) als auch LE (18 gegenüber 8 pro 10.000 Frauenjahre) wurden ebenfalls nachgewiesen. Der Anstieg des VTE-Risikos wurde im ersten Jahr nachgewiesen und hielt an. (Sehen Klinische Studien .) Sollte eine VTE auftreten oder vermutet werden, sollte die Östrogen- plus Gestagentherapie sofort abgesetzt werden.
Wenn möglich, sollten Östrogene mit Gestagenen mindestens 4 bis 6 Wochen vor Operationen, die mit einem erhöhten Thromboembolierisiko verbunden sind, oder während längerer Immobilisationsperioden abgesetzt werden.
Bösartige Neubildungen
Brustkrebs
Die wichtigste randomisierte klinische Studie, die Informationen über Brustkrebs bei Anwenderinnen von Östrogen plus Gestagen liefert, ist die Teilstudie der Women's Health Initiative (WHI) mit täglichem CE (0,625 mg) plus MPA (2,5 mg). Nach einer durchschnittlichen Nachbeobachtungszeit von 5,6 Jahren berichtete die Östrogen-plus-Progestin-Substudie über ein erhöhtes Risiko für invasiven Brustkrebs bei Frauen, die täglich CE plus MPA einnahmen. In dieser Teilstudie berichteten 26 Prozent der Frauen über eine vorherige Anwendung einer Östrogen-Monotherapie oder einer Östrogen-plus-Gestagen-Therapie. Das relative Risiko für invasiven Brustkrebs betrug 1,24 (95 Prozent nCI, 1,01–1,54) und das absolute Risiko betrug 41 versus 33 Fälle pro 10.000 Frauenjahre für CE plus MPA im Vergleich zu Placebo. Bei Frauen, die über eine vorherige Anwendung einer Hormontherapie berichteten, betrug das relative Risiko für invasiven Brustkrebs 1,86 und das absolute Risiko 46 versus 25 Fälle pro 10.000 Frauenjahre für Östrogen plus Progestin im Vergleich zu Placebo. Bei Frauen, die keine vorherige Anwendung einer Hormontherapie angaben, betrug das relative Risiko für invasiven Brustkrebs 1,09 und das absolute Risiko 40 gegenüber 36 Fällen pro 10.000 Frauenjahre für CE plus MPA im Vergleich zu Placebo. In derselben Teilstudie waren invasiver Brustkrebs in der Gruppe mit CE (0,625 mg) plus MPA (2,5 mg) größer, häufiger knotenpositiv und in einem fortgeschritteneren Stadium diagnostiziert als in der Placebogruppe. Metastasen traten selten auf, ohne erkennbaren Unterschied zwischen den beiden Gruppen. Andere prognostische Faktoren wie histologischer Subtyp, Grad und Hormonrezeptorstatus unterschieden sich nicht zwischen den Gruppen. (Sehen Klinische Studien .)
In Übereinstimmung mit den klinischen WHI-Studien haben Beobachtungsstudien auch ein erhöhtes Risiko für Brustkrebs bei einer Östrogen-plus-Gestagen-Therapie und ein geringeres erhöhtes Risiko bei einer Östrogen-Monotherapie nach mehrjähriger Anwendung berichtet. Das Risiko nahm mit der Dauer der Anwendung zu und schien über etwa 5 Jahre nach Beendigung der Behandlung auf den Ausgangswert zurückzukehren (nur die Beobachtungsstudien verfügen über aussagekräftige Daten zum Risiko nach Beendigung der Behandlung). Beobachtungsstudien deuten auch darauf hin, dass das Brustkrebsrisiko bei einer Östrogen-plus-Gestagen-Therapie größer war und früher auftrat als bei einer Östrogen-Monotherapie. Diese Studien haben jedoch im Allgemeinen keine signifikanten Unterschiede im Brustkrebsrisiko zwischen verschiedenen Östrogen- und Gestagenkombinationen, Dosierungen oder Verabreichungswegen festgestellt.
Es wurde berichtet, dass die Anwendung von Östrogen plus Progestin zu einer Zunahme von abnormalen Mammogrammen führt, die einer weiteren Bewertung bedürfen. Alle Frauen sollten jährliche Brustuntersuchungen durch einen Gesundheitsdienstleister erhalten und monatliche Brustselbstuntersuchungen durchführen. Darüber hinaus sollten Mammographieuntersuchungen basierend auf dem Alter der Patientin, Risikofaktoren und früheren Mammographieergebnissen geplant werden.
Endometriumkarzinom
Es wurde über ein erhöhtes Risiko für Endometriumkarzinom bei der Anwendung einer ungehinderten Östrogentherapie bei einer Frau mit Uterus berichtet. Das gemeldete Endometriumkarzinomrisiko bei Östrogenkonsumenten ohne Gegenmaßnahmen ist etwa 2- bis 12-mal höher als bei Nicht-Konsumenten und scheint von der Behandlungsdauer und der Östrogendosis abhängig zu sein. Die meisten Studien zeigen kein signifikant erhöhtes Risiko im Zusammenhang mit der Anwendung von Östrogenen für weniger als 1 Jahr. Das größte Risiko scheint mit längerer Anwendung verbunden zu sein, mit erhöhten Risiken um das 15- bis 24-fache für 5 bis 10 Jahre oder länger, und dieses Risiko besteht nachweislich mindestens 8 bis 15 Jahre nach Absetzen der Östrogentherapie.
Eine klinische Überwachung aller Frauen, die eine Östrogen-plus-Gestagen-Therapie anwenden, ist wichtig. Angemessene diagnostische Maßnahmen, einschließlich gerichteter oder zufälliger endometrialer Entnahmen, falls angezeigt, sollten durchgeführt werden, um Malignität in allen Fällen von nicht diagnostizierten persistierenden oder wiederkehrenden abnormalen genitalen Blutungen auszuschließen. Es gibt keine Hinweise darauf, dass die Anwendung natürlicher Östrogene zu einem anderen endometrialen Risikoprofil führt als synthetische Östrogene mit äquivalenter Östrogendosis. Es hat sich gezeigt, dass die Zugabe eines Gestagens zur Östrogentherapie bei postmenopausalen Frauen das Risiko einer Endometriumhyperplasie verringert, die eine Vorstufe von Endometriumkrebs sein kann.
Eierstockkrebs
Die WHI-Substudie Östrogen plus Progestin berichtete über ein statistisch nicht signifikant erhöhtes Risiko für Eierstockkrebs. Nach einer durchschnittlichen Nachbeobachtungszeit von 5,6 Jahren betrug das relative Risiko für Eierstockkrebs für CE plus MPA im Vergleich zu Placebo 1,58 (95 Prozent nCI, 0,77 – 3,24). Das absolute Risiko für CE plus MPA gegenüber Placebo betrug 4 gegenüber 3 Fällen pro 10.000 Frauenjahre. In einigen epidemiologischen Studien wurde die Anwendung von Östrogen plus Progestin und Östrogen-Monopräparaten, insbesondere über einen Zeitraum von 5 oder mehr Jahren, mit einem erhöhten Risiko für Eierstockkrebs in Verbindung gebracht. Die mit einem erhöhten Risiko verbundene Expositionsdauer ist jedoch nicht in allen epidemiologischen Studien konsistent, und einige berichten über keinen Zusammenhang.
Wahrscheinlich Demenz
In der Östrogen-Gestagen-Women's Health Initiative Memory Study (WHIMS), einer ergänzenden Studie zu WHI, wurde eine Population von 4.532 postmenopausalen Frauen im Alter von 65 bis 79 Jahren randomisiert täglich CE (0,625 mg) plus MPA (2,5 mg) oder Placebo zugeteilt.
In der WHIMS-Estrogen-plus-Progestin-Zusatzstudie wurde nach einer durchschnittlichen Nachbeobachtungszeit von 4 Jahren bei 40 Frauen in der CE-plus-MPA-Gruppe und 21 Frauen in der Placebo-Gruppe eine wahrscheinliche Demenz diagnostiziert. Das relative Risiko einer wahrscheinlichen Demenz für Östrogen plus Progestin im Vergleich zu Placebo betrug 2,05 (95 Prozent CI, 1,21–3,48). Das absolute Risiko einer wahrscheinlichen Demenz für CE plus MPA im Vergleich zu Placebo betrug 45 gegenüber 22 Fällen pro 10.000 Frauenjahre. Es ist nicht bekannt, ob diese Ergebnisse für jüngere postmenopausale Frauen gelten. (Sehen Klinische Studien und VORSICHTSMASSNAHMEN , Geriatrische Verwendung .)
Anomalien des Sehvermögens
Bei Patienten, die Östrogen erhielten, wurde über retinale Gefäßthrombosen berichtet. Beenden Sie die Östrogen- plus Gestagentherapie bis zur Untersuchung, wenn ein plötzlicher teilweiser oder vollständiger Verlust des Sehvermögens auftritt oder wenn plötzlich eine Proptosis, Diplopie oder Migräne auftritt. Wenn die Untersuchung ein Papillenödem oder retinale Gefäßläsionen zeigt, sollte die Östrogen-Gestagen-Therapie dauerhaft abgesetzt werden.
VORSICHTSMASSNAHMEN
Allgemein
Zugabe eines Gestagens, wenn eine Frau keine Hysterektomie hatte
Studien über die Zugabe eines Gestagens über 10 oder mehr Tage eines Östrogenverabreichungszyklus oder täglich mit Östrogen in einem kontinuierlichen Regime haben über eine geringere Inzidenz von Endometriumhyperplasie berichtet, als sie durch eine Östrogenbehandlung allein induziert würde. Endometriumhyperplasie kann ein Vorläufer von Endometriumkrebs sein.
Es gibt jedoch mögliche Risiken, die mit der Anwendung von Gestagenen mit Östrogenen im Vergleich zu Östrogen-Monotherapien verbunden sein können. Dazu gehört ein erhöhtes Brustkrebsrisiko.
Flüssigkeitsretention
Progesteron kann zu einem gewissen Grad an Flüssigkeitsretention führen. Frauen mit Erkrankungen, die von diesem Faktor beeinflusst werden könnten, wie z. B. Herz- oder Nierenfunktionsstörungen, erfordern eine sorgfältige Beobachtung.
Schwindel und Benommenheit
PROMETRIUM-Kapseln können vorübergehend Schwindel und Schläfrigkeit verursachen und sollten beim Führen eines Kraftfahrzeugs oder beim Bedienen von Maschinen mit Vorsicht angewendet werden. PROMETRIUM-Kapseln sollten als tägliche Einzeldosis vor dem Schlafengehen eingenommen werden.
Informationen zum Patienten
Allgemein
Dieses Produkt enthält Erdnussöl und sollte nicht verwendet werden, wenn Sie allergisch gegen Erdnüsse sind.
Ärzten wird empfohlen, den Inhalt der Packungsbeilage mit Patienten zu besprechen, denen sie PROMETRIUM 100 mg Kapseln verschreiben.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Progesteron wurde bei oraler Verabreichung an Tieren nicht auf Karzinogenität getestet. Bei Implantation in weibliche Mäuse erzeugte Progesteron Mammakarzinome, Granulosazelltumoren der Eierstöcke und Stromasarkome des Endometriums. Bei Hunden führten langfristige intramuskuläre Injektionen zu knotiger Hyperplasie und gutartigen und bösartigen Brusttumoren. Subkutane oder intramuskuläre Injektionen von Progesteron verkürzten die Latenzzeit und erhöhten die Inzidenz von Brusttumoren bei Ratten, die zuvor mit einem chemischen Karzinogen behandelt wurden.
Progesteron zeigte in In-vitro-Studien keine Hinweise auf Genotoxizität für Punktmutationen oder Chromosomenschäden. In-vivo-Studien zur Chromosomenschädigung haben bei oralen Dosen von 1000 mg/kg und 2000 mg/kg positive Ergebnisse bei Mäusen ergeben. Es wurde gezeigt, dass exogen verabreichtes Progesteron bei einer Reihe von Arten die Ovulation hemmt, und es ist zu erwarten, dass hohe Dosen, die über einen längeren Zeitraum verabreicht werden, die Fertilität bis zum Absetzen der Behandlung beeinträchtigen würden.
Schwangerschaft
PROMETRIUM-Kapseln sollten nicht während der Schwangerschaft angewendet werden. (Sehen KONTRAINDIKATIONEN ).
Schwangerschaftskategorie B
Reproduktionsstudien wurden an Mäusen mit Dosen bis zum 9-fachen der oralen Dosis beim Menschen, an Ratten mit Dosen bis zum 44-fachen der oralen Dosis beim Menschen und an Kaninchen mit einer Dosis von 10 µg/Tag durchgeführt, die lokal durch ein implantiertes Gerät in die Gebärmutter abgegeben wurde , bei Meerschweinchen in Dosen von etwa der Hälfte der oralen Humandosis und bei Rhesusaffen in Dosen, die etwa der Humandosis entsprechen, alle basierend auf der Körperoberfläche, und haben wenig oder keine Hinweise auf eine Beeinträchtigung der Fruchtbarkeit oder eine Schädigung des Fötus aufgrund von ergeben Progesteron.
Stillende Frauen
In der Milch stillender Frauen, die Gestagene erhalten, wurden nachweisbare Mengen an Gestagen festgestellt. Vorsicht ist geboten, wenn PROMETRIUM 100 mg Kapseln einer stillenden Frau verabreicht werden.
Pädiatrische Verwendung
PROMETRIUM-Kapseln sind bei Kindern nicht angezeigt. Es wurden keine klinischen Studien in der pädiatrischen Population durchgeführt.
Geriatrische Verwendung
Es gab keine ausreichende Anzahl geriatrischer Frauen, die an klinischen Studien mit PROMETRIUM-Kapseln teilgenommen haben, um festzustellen, ob sich Personen über 65 Jahren in ihrer Reaktion auf PROMETRIUM 200 mg-Kapseln von jüngeren Probanden unterscheiden.
Die Studie der Frauengesundheitsinitiative
In der Substudie Östrogen plus Gestagen der Women's Health Initiative (WHI) (täglich CE [0,625 mg] plus MPA [2,5 mg] versus Placebo) bestand bei Frauen über 65 Jahren ein höheres relatives Risiko für nicht tödlichen Schlaganfall und invasiven Brustkrebs . (Sehen Klinische Studien und WARNUNGEN , Herz-Kreislauf-Erkrankungen und Bösartige Neubildungen. )
Die Gedächtnisstudie der Frauengesundheitsinitiative
In der Women's Health Initiative Memory Study (WHIMS) mit postmenopausalen Frauen im Alter von 65 bis 79 Jahren bestand in der Östrogen-plus-Progestin-Zusatzstudie im Vergleich zu Placebo ein erhöhtes Risiko, wahrscheinlich eine Demenz zu entwickeln. (Sehen Klinische Studien und WARNUNGEN , Wahrscheinlich Demenz. )
ÜBERDOSIS
Beim Menschen wurden keine Studien zur Überdosierung durchgeführt. Im Falle einer Überdosierung sollten PROMETRIUM-Kapseln abgesetzt und der Patient symptomatisch behandelt werden.
KONTRAINDIKATIONEN
PROMETRIUM-Kapseln sollten nicht bei Frauen mit einer der folgenden Erkrankungen angewendet werden:
KLINISCHE PHARMAKOLOGIE
PROMETRIUM 200 mg Kapseln sind eine orale Darreichungsform von mikronisiertem Progesteron, das chemisch identisch mit Progesteron aus den Eierstöcken ist. Die orale Bioverfügbarkeit von Progesteron wird durch Mikronisierung erhöht.
Pharmakokinetik
Absorption
Nach oraler Gabe von Progesteron als mikronisierte Weichgelatinekapselformulierung wurden maximale Serumkonzentrationen innerhalb von 3 Stunden erreicht. Die absolute Bioverfügbarkeit von mikronisiertem Progesteron ist nicht bekannt. Tabelle 1 fasst die mittleren pharmakokinetischen Parameter bei postmenopausalen Frauen nach fünf oralen Tagesdosen von PROMETRIUM Kapseln 100 mg als mikronisierte Weichgelatinekapselformulierung zusammen.
TABELLE 1. Pharmakokinetische Parameter von PROMETRIUM 200 mg Kapseln
Die Progesteronkonzentrationen im Serum erschienen nach Mehrfachgabe von PROMETRIUM 200 mg Kapseln 100 mg über den Dosisbereich von 100 mg pro Tag bis 300 mg pro Tag bei postmenopausalen Frauen linear und dosisproportional. Obwohl Dosen von mehr als 300 mg pro Tag bei Frauen nicht untersucht wurden, schienen die Serumkonzentrationen aus einer Studie mit männlichen Probanden zwischen 100 mg pro Tag und 400 mg pro Tag linear und dosisproportional zu sein. Die pharmakokinetischen Parameter bei männlichen Probanden stimmten im Allgemeinen mit denen überein, die bei postmenopausalen Frauen beobachtet wurden.
Verteilung
Progesteron ist zu etwa 96 bis 99 Prozent an Serumproteine gebunden, hauptsächlich an Serumalbumin (50 bis 54 Prozent) und Transcortin (43 bis 48 Prozent).
Stoffwechsel
Progesteron wird hauptsächlich von der Leber größtenteils zu Pregnandiolen und Pregnanolonen metabolisiert. Pregnanediole und Pregnanolone werden in der Leber zu Glucuronid- und Sulfatmetaboliten konjugiert. Progesteron-Metabolite, die in die Galle ausgeschieden werden, können dekonjugiert und im Darm durch Reduktion, Dehydroxylierung und Epimerisierung weiter metabolisiert werden.
Ausscheidung
Die Glucuronid- und Sulfatkonjugate von Pregnandiol und Pregnanolon werden über die Galle und den Urin ausgeschieden. Progesteron-Metaboliten werden hauptsächlich über die Nieren ausgeschieden. Progesteron-Metabolite, die in die Galle ausgeschieden werden, können einem enterohepatischen Recycling unterliegen oder mit dem Stuhl ausgeschieden werden.
Besondere Populationen
Die Pharmakokinetik von PROMETRIUM-Kapseln wurde bei Patienten mit niedrigem Körpergewicht oder Adipositas nicht untersucht.
Leberinsuffizienz
Die Auswirkung einer Leberfunktionsstörung auf die Pharmakokinetik von PROMETRIUM 100 mg Kapseln wurde nicht untersucht.
Niereninsuffizienz
Die Auswirkung einer Nierenfunktionsstörung auf die Pharmakokinetik von PROMETRIUM-Kapseln wurde nicht untersucht.
Lebensmittel-Arzneimittel-Wechselwirkung
Die gleichzeitige Einnahme von Nahrung erhöhte die Bioverfügbarkeit von PROMETRIUM 100 mg Kapseln im Vergleich zu einem nüchternen Zustand, wenn es postmenopausalen Frauen in einer Dosis von 200 mg verabreicht wurde.
Wechselwirkungen mit anderen Medikamenten
Der Metabolismus von Progesteron durch menschliche Lebermikrosomen wurde durch Ketoconazol gehemmt (IC50
Die gleichzeitige Verabreichung von konjugierten Östrogenen und PROMETRIUM 200-mg-Kapseln an 29 Frauen nach der Menopause über einen Zeitraum von 12 Tagen führte zu einem Anstieg der Gesamt-Östron-Konzentration (Cmax 3,68 ng/ml bis 4,93 ng/ml) und der Gesamt-Equilin-Konzentration (Cmax 2,27 ng/ml bis 3,22 ng/ml) und eine Abnahme der zirkulierenden 17β-Östradiolkonzentrationen (Cmax 0,037 ng/ml bis 0,030 ng/ml). Die Halbwertszeit der konjugierten Östrogene war bei gleichzeitiger Verabreichung von PROMETRIUM-Kapseln ähnlich. Tabelle 2 fasst die pharmakokinetischen Parameter zusammen.
TABELLE 2. Mittlere (±SD) pharmakokinetische Parameter für Estradiol, Estron und Equilin nach gleichzeitiger Verabreichung von konjugierten Östrogenen 0,625 mg und PROMETRIUM-Kapseln 200 mg für 12 Tage an postmenopausale Frauen
Klinische Studien
Auswirkungen auf das Endometrium
In einer randomisierten, doppelblinden klinischen Studie wurden 358 postmenopausale Frauen mit jeweils intaktem Uterus bis zu 36 Monate lang behandelt. Die Behandlungsgruppen waren: PROMETRIUM-Kapseln in einer Dosis von 200 mg pro Tag für 12 Tage pro 28-Tage-Zyklus in Kombination mit konjugierten Östrogenen 0,625 mg pro Tag (n = 120); konjugierte Östrogene nur 0,625 mg pro Tag (n = 119); oder Placebo (n=119). Die Probanden in allen drei Behandlungsgruppen waren hauptsächlich kaukasische Frauen (mindestens 87 Prozent in jeder Gruppe). Die Ergebnisse zur Inzidenz von Endometriumhyperplasie bei Frauen, die bis zu 3 Jahre lang behandelt wurden, sind in Tabelle 3 dargestellt Kombinationsprodukt gegenüber 64 Prozent Östrogen allein) in der Behandlungsgruppe mit PROMETRIUM-Kapseln plus konjugierten Östrogenen während der 36-monatigen Behandlung.
TABELLE 3. Inzidenz von Endometriumhyperplasie bei Frauen, die eine 3-jährige Behandlung erhalten
Die Zeiten bis zur Diagnose einer Endometriumhyperplasie über 36 Behandlungsmonate sind in Abbildung 1 dargestellt. Diese Abbildung veranschaulicht grafisch, dass der Anteil der Patientinnen mit Hyperplasie in der Gruppe mit konjugierten Östrogenen signifikant größer war (64 Prozent) als in der Gruppe mit konjugierten Östrogenen plus PROMETRIUM-Kapseln (6 Prozent).
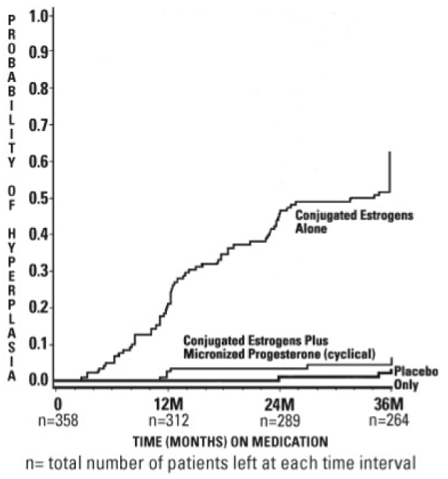
Abbildung 1. Zeit bis zur Hyperplasie bei Frauen, die eine Behandlung von bis zu 36 Monaten erhalten
Die Abbruchraten aufgrund von Hyperplasie über die 36 Behandlungsmonate sind in Tabelle 4 aufgeführt. Bei jedem Grad der Hyperplasie war die Abbruchrate bei Patienten, die konjugierte Östrogene plus PROMETRIUM 100 mg Kapseln erhielten, ähnlich wie in der Placebogruppe, während die die Abbruchrate bei Patienten, die nur konjugierte Östrogene erhielten, war signifikant höher. Frauen, die die Behandlung aufgrund von Hyperplasie dauerhaft abbrachen, waren hinsichtlich der demografischen Daten ähnlich wie die gesamte Studienpopulation.
TABELLE 4. Abbruchrate aufgrund von Hyperplasie über 36 Behandlungsmonate
Auswirkungen auf die sekundäre Amenorrhoe
In einer monozentrischen, randomisierten, doppelblinden klinischen Studie, an der prämenopausale Frauen mit sekundärer Amenorrhoe für mindestens 90 Tage teilnahmen, führte die 10-tägige Verabreichung von PROMETRIUM 200 mg Kapseln dazu, dass 80 Prozent der Frauen innerhalb von 7 Tagen nach der letzten eine Abbruchblutung erlitten Dosis von PROMETRIUM 100 mg Kapseln, 300 mg pro Tag (n = 20), im Vergleich zu 10 Prozent der Frauen, die in der Placebogruppe (n = 21) eine Abbruchblutung erlitten.
In einer multizentrischen, offenen Postmarketing-Dosierungsstudie mit parallelen Gruppen, an der prämenopausale Frauen mit sekundärer Amenorrhoe für mindestens 90 Tage teilnahmen, wurde die 10-tägige Verabreichung von PROMETRIUM 100-mg-Kapseln während zwei 28-tägigen Behandlungszyklen mit 300 mg pro Tag (n= 107) oder 400 mg pro Tag (n=99) führten bei 73,8 Prozent bzw. 76,8 Prozent der Frauen zu Abbruchblutungen.
Die Rate der sekretorischen Transformation wurde in einer multizentrischen, randomisierten, doppelblinden klinischen Studie mit Östrogen-geprimten postmenopausalen Frauen bewertet. PROMETRIUM 100 mg Kapseln, die 10 Tage lang oral mit 400 mg pro Tag (n = 22) verabreicht wurden, induzierten bei 45 Prozent der Frauen vollständige sekretorische Veränderungen im Endometrium, verglichen mit 0 Prozent in der Placebogruppe (n = 23).
In einer zweiten multizentrischen, unverblindeten Postmarketing-Dosierungsstudie mit parallelen Gruppen bei prämenopausalen Frauen mit sekundärer Amenorrhoe über mindestens 90 Tage wurde auch die Rate der sekretorischen Transformation bewertet. Alle Probanden erhielten täglich orale konjugierte Östrogene über 3 aufeinanderfolgende 28-tägige Behandlungszyklen und PROMETRIUM-Kapseln, 300 mg pro Tag (n = 107) oder 400 mg pro Tag (n = 99) für 10 Tage jedes Behandlungszyklus. Die Rate der vollständigen sekretorischen Transformation betrug 21,5 Prozent bzw. 28,3 Prozent.
Studien der Frauengesundheitsinitiative
Die Women's Health Initiative (WHI) hat etwa 27.000 überwiegend gesunde postmenopausale Frauen in zwei Teilstudien aufgenommen, um die Risiken und Vorteile der täglichen oralen Gabe von konjugierten Östrogenen (CE) [0,625 mg] allein oder in Kombination mit Medroxyprogesteronacetat (MPA) [2,5 mg] zu bewerten. im Vergleich zu Placebo bei der Vorbeugung bestimmter chronischer Krankheiten. Der primäre Endpunkt war die Inzidenz von koronarer Herzkrankheit [(CHD) definiert als nicht-tödlicher Myokardinfarkt (MI), stiller Myokardinfarkt und CHD-Tod] mit invasivem Brustkrebs als primärem unerwünschtem Ergebnis. Ein „globaler Index“ umfasste das früheste Auftreten von KHK, invasivem Brustkrebs, Schlaganfall, Lungenembolie (LE), Endometriumkarzinom (nur in der CE plus MPA-Substudie), Darmkrebs, Hüftfraktur oder Tod aus anderen Gründen. In diesen Teilstudien wurden die Wirkungen von CE allein oder CE plus MPA auf die Symptome der Menopause nicht bewertet.
WHI Östrogen plus Gestagen-Substudie
Die Substudie WHI Östrogen plus Progestin wurde vorzeitig abgebrochen. Gemäß der vordefinierten Abbruchregel überstieg nach einer durchschnittlichen Nachbeobachtungszeit von 5,6 Behandlungsjahren das erhöhte Risiko für Brustkrebs und kardiovaskuläre Ereignisse die im „globalen Index“ enthaltenen spezifischen Vorteile. Das absolute Exzessrisiko von Ereignissen im „globalen Index“ betrug 19 pro 10.000 Frauenjahre.
Für die im WHI „Global Index“ enthaltenen Ergebnisse, die nach 5,6 Jahren Nachbeobachtung statistische Signifikanz erreichten, betrugen die absoluten Exzessrisiken pro 10.000 Frauenjahre in der mit CE plus MPA behandelten Gruppe 7 weitere KHK-Ereignisse, 8 weitere Schlaganfälle, 10 weitere PEs und 8 weitere invasive Brustkrebserkrankungen, während die absolute Risikoreduktion pro 10.000 Frauenjahre 6 weniger Darmkrebs und 5 weniger Hüftfrakturen betrug.
Die Ergebnisse der Östrogen-plus-Gestagen-Substudie, an der 16.608 Frauen teilnahmen (Durchschnittsalter 63 Jahre, Bereich 50 bis 79; 83,9 Prozent Weiße, 6,8 Prozent Schwarze, 5,4 Prozent Hispanoamerikaner, 3,9 Prozent andere) sind in Tabelle 5 dargestellt. Diese Ergebnisse spiegeln zentral wider Beurteilte Daten nach einer durchschnittlichen Nachbeobachtungszeit von 5,6 Jahren.
TABELLE 5. Relatives und absolutes Risiko, das in der Östrogen-Plus-Progestin-Substudie von WHI bei durchschnittlich 5,6 Jahren beobachtet wurde a, b
Der Zeitpunkt des Beginns einer Östrogen- plus Gestagentherapie relativ zum Beginn der Menopause kann das Gesamtrisiko-Nutzen-Profil beeinflussen. Die nach Alter stratifizierte Substudie WHI Östrogen plus Progestin zeigte bei Frauen im Alter von 50 bis 59 Jahren einen nicht signifikanten Trend zur Verringerung des Gesamtsterblichkeitsrisikos [Hazard Ratio (HR) 0,69 (95 Prozent KI, 0,44–1,07)].
Gedächtnisstudie der Frauengesundheitsinitiative
In die Östrogen plus Progestin Women's Health Initiative Memory Study (WHIMS), eine ergänzende Studie von WHI, wurden 4.532 überwiegend gesunde postmenopausale Frauen im Alter von 65 Jahren und älter aufgenommen (47 Prozent waren 65 bis 69 Jahre alt; 35 Prozent waren 70 bis 74 Jahre alt). Alter und 18 Prozent waren 75 Jahre und älter), um die Auswirkungen von täglichem CE (0,625 mg) plus MPA (2,5 mg) auf das Auftreten einer wahrscheinlichen Demenz (primäres Ergebnis) im Vergleich zu Placebo zu bewerten.
Nach einer durchschnittlichen Nachbeobachtungszeit von 4 Jahren betrug das relative Risiko einer wahrscheinlichen Demenz für CE plus MPA im Vergleich zu Placebo 2,05 (95-Prozent-KI, 1,21 – 3,48). Das absolute Risiko einer wahrscheinlichen Demenz für CE plus MPA im Vergleich zu Placebo betrug 45 gegenüber 22 pro 10.000 Frauenjahre. Wahrscheinliche Demenz, wie in dieser Studie definiert, umfasste die Alzheimer-Krankheit (AD), vaskuläre Demenz (VaD) und gemischten Typ (mit Merkmalen sowohl von AD als auch von VaD). Die häufigste Klassifizierung einer wahrscheinlichen Demenz in der Behandlungsgruppe und der Placebogruppe war AD. Da die Zusatzstudie an Frauen im Alter von 65 bis 79 Jahren durchgeführt wurde, ist nicht bekannt, ob diese Ergebnisse auf jüngere postmenopausale Frauen zutreffen. (Sehen WARNUNGEN , Wahrscheinlich Demenz und VORSICHTSMASSNAHMEN , Geriatrische Verwendung .)
INFORMATIONEN ZUM PATIENTEN
PROMETRIUM® (Progesteron, USP) Kapseln 100 mg & 200 mg
Lesen Sie diese PATIENTENINFORMATION, bevor Sie mit der Einnahme von PROMETRIUM 200 mg Kapseln beginnen, und lesen Sie, was Sie jedes Mal erhalten, wenn Sie Ihr Rezept für PROMETRIUM 100 mg Kapseln nachfüllen. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung.
WAS SIND DIE WICHTIGSTEN INFORMATIONEN, DIE ICH ÜBER PROMETRIUM 100 mg KAPSELN (ein Progesteronhormon) WISSEN SOLLTE?
DIESES PRODUKT ENTHÄLT ERDNUSSÖL UND SOLLTE NICHT VERWENDET WERDEN, WENN SIE ALLERGISCH GEGEN ERDNÜSSE SIND.
Was sind PROMETRIUM 200 mg Kapseln?
PROMETRIUM 100 mg Kapseln enthalten das weibliche Hormon Progesteron.
Wofür werden PROMETRIUM 100 mg Kapseln verwendet?
Behandlung von Menstruationsstörungen
PROMETRIUM 200 mg Kapseln werden zur Behandlung von sekundärer Amenorrhoe (Ausbleiben der Menstruation bei Frauen, die zuvor eine Menstruation hatten) aufgrund eines Progesteronabfalls angewendet. Wenn Sie nicht genug Progesteron produzieren, können Menstruationsunregelmäßigkeiten auftreten. Wenn Ihr Arzt festgestellt hat, dass Ihr Körper selbst nicht genug Progesteron produziert, können PROMETRIUM 200 mg Kapseln verschrieben werden, um das benötigte Progesteron bereitzustellen.
Schutz des Endometriums (Gebärmutterschleimhaut)
PROMETRIUM 200 mg Kapseln werden in Kombination mit östrogenhaltigen Medikamenten bei Frauen nach der Menopause mit Uterus (Gebärmutter) angewendet. Die alleinige Einnahme von Östrogen erhöht die Wahrscheinlichkeit, eine Erkrankung namens Endometriumhyperplasie zu entwickeln, die zu Krebs der Gebärmutterschleimhaut führen kann. Die Zugabe eines Gestagens wird im Allgemeinen für eine Frau mit Gebärmutter empfohlen, um die Wahrscheinlichkeit zu verringern, an Gebärmutterkrebs zu erkranken.
Wer sollte PROMETRIUM-Kapseln nicht einnehmen?
Beginnen Sie nicht mit der Einnahme von PROMETRIUM Kapseln, wenn Sie:
Informieren Sie Ihren Arzt:
Wie sollte ich PROMETRIUM 200 mg Kapseln einnehmen?
Welche Nebenwirkungen können PROMETRIUM-Kapseln haben?
Nebenwirkungen werden danach gruppiert, wie schwerwiegend sie sind und wie oft sie auftreten, wenn Sie behandelt werden:
Schwerwiegende, aber weniger häufige Nebenwirkungen sind:
Einige der Warnzeichen für schwerwiegende Nebenwirkungen sind:
Rufen Sie sofort Ihren Arzt an, wenn Sie eines dieser Warnzeichen oder andere ungewöhnliche Symptome bemerken, die Sie beunruhigen.
Weniger schwerwiegende, aber häufige Nebenwirkungen sind:
Dies sind nicht alle möglichen Nebenwirkungen von PROMETRIUM 200 mg Kapseln. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker um Rat zu Nebenwirkungen. Sie können Nebenwirkungen an AbbVie Inc. unter 1-800-633-9110 oder an die FDA unter 1-800-FDA-1088 melden.
Was kann ich tun, um das Risiko einer schwerwiegenden Nebenwirkung von PROMETRIUM 100 mg Kapseln zu verringern?
Allgemeine Informationen zur sicheren und wirksamen Anwendung von PROMETRIUM-Kapseln
Bewahren Sie PROMETRIUM-Kapseln außerhalb der Reichweite von Kindern auf.
Diese Packungsbeilage enthält eine Zusammenfassung der wichtigsten Informationen zu PROMETRIUM 100 mg Kapseln. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt oder Apotheker. Sie können Informationen zu PROMETRIUM 100 mg Kapseln anfordern, die für Angehörige der Gesundheitsberufe bestimmt sind. Weitere Informationen erhalten Sie unter der gebührenfreien Nummer 1-800-633-9110.
Was sind die Inhaltsstoffe in PROMETRIUM-Kapseln?
Wirkstoff: 100 mg oder 200 mg mikronisiertes Progesteron
Zu den inaktiven Inhaltsstoffen von PROMETRIUM-Kapseln 100 mg gehören: Erdnussöl NF, Gelatine NF, Glycerin USP, Lezithin NF, Titandioxid USP, FD&C Red Nr. 40 und D&C Yellow Nr. 10.
Zu den inaktiven Inhaltsstoffen von PROMETRIUM Kapseln 200 mg gehören: Erdnussöl NF, Gelatine NF, Glycerin USP, Lezithin NF, Titandioxid USP, D&C Yellow Nr. 10 und FD&C Yellow Nr. 6.
WIE GELIEFERT
PROMETRIUM 200 mg Kapseln 100 mg sind runde, pfirsichfarbene Kapseln mit dem schwarzen Aufdruck „SV“.
PROMETRIUM 100 mg Kapseln 200 mg sind ovale, blassgelbe Kapseln mit dem schwarzen Aufdruck „SV2“.
Bei 25 °C (77 °F) lagern; Abweichungen bis 15° bis 30°C (59° bis 86°F) zulässig [Siehe USP Controlled Room Temperature].