Celebrex 100mg, 200mg Celecoxib Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Celebrex 100 mg und wie wird es angewendet?
Celebrex 200 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome akuter Schmerzen oder Entzündungen. Celebrex kann allein oder mit anderen Medikamenten verwendet werden.
Celebrex 100 mg gehört zu einer Klasse von Arzneimitteln, die als nichtsteroidale Antirheumatika (NSAIDs) bezeichnet werden.
Es ist nicht bekannt, ob Celebrex bei Kindern unter 2 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Celebrex 100 mg haben?
Celebrex 200 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Celebrex sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Celebrex. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
RISIKO SCHWERER KARDIOVASKULÄRER UND GASTROINTESTINALER EREIGNISSE
Kardiovaskuläre thrombotische Ereignisse
Magen-Darm-Blutungen, Ulzerationen und Perforationen
BEZEICHNUNG
CELEBREX (Celecoxib) Kapsel ist ein nichtsteroidales entzündungshemmendes Arzneimittel, das als Kapseln mit 50 mg, 100 mg, 200 mg und 400 mg Celecoxib zur oralen Verabreichung erhältlich ist. Der chemische Name lautet 4-[5-(4-Methylphenyl)-3-(trifluormethyl)-1H-pyrazol-1-yl]benzolsulfonamid und ist ein Diaryl-substituiertes Pyrazol. Das Molekulargewicht beträgt 381,38. Seine Summenformel ist C17H14F3N3O2S und es hat die folgende chemische Struktur:
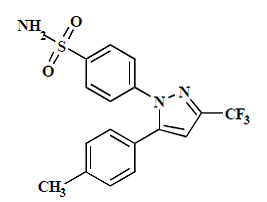
Celecoxib ist ein weißes bis cremefarbenes Pulver mit einem pKa-Wert von 11,1 (Sulfonamid-Einheit). Celecoxib ist hydrophob (log P ist 3,5) und in wässrigen Medien im physiologischen pH-Bereich praktisch unlöslich.
Zu den inaktiven Bestandteilen in CELEBREX 200 mg gehören: Croscarmellose-Natrium, essbare Tinten, Gelatine, Lactose-Monohydrat, Magnesiumstearat, Povidon und Natriumlaurylsulfat.
INDIKATIONEN
CELEBREX ist angezeigt
Arthrose (OA)
Zur Behandlung der Anzeichen und Symptome von OA [siehe Klinische Studien ].
Rheumatoide Arthritis (RA)
Zur Behandlung der Anzeichen und Symptome von RA [siehe Klinische Studien ].
Juvenile rheumatoide Arthritis (JRA)
Zur Behandlung der Anzeichen und Symptome von JRA bei Patienten ab 2 Jahren [siehe Klinische Studien ].
Ankylosierende Spondylitis (AS)
Zur Behandlung der Anzeichen und Symptome von AS [siehe Klinische Studien ].
Akuter Schmerz
Zur Behandlung akuter Schmerzen bei Erwachsenen [vgl Klinische Studien ].
Primäre Dysmenorrhoe
Zur Behandlung der primären Dysmenorrhoe [vgl Klinische Studien ].
DOSIERUNG UND ANWENDUNG
Allgemeine Dosierungsanleitung
Wägen Sie die potenziellen Vorteile und Risiken von CELEBREX und anderen Behandlungsoptionen sorgfältig ab, bevor Sie sich für die Anwendung von CELEBREX entscheiden. Verwenden Sie die niedrigste wirksame Dosis für die kürzeste Dauer im Einklang mit den individuellen Behandlungszielen des Patienten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Diese Dosen können unabhängig vom Zeitpunkt der Mahlzeiten verabreicht werden.
Arthrose
Für OA beträgt die Dosierung 200 mg pro Tag, verabreicht als Einzeldosis oder als 100 mg zweimal täglich.
Rheumatoide Arthritis
Bei RA beträgt die Dosierung 100 mg bis 200 mg zweimal täglich.
Juvenile rheumatoide Arthritis
Für JRA basiert die Dosierung für pädiatrische Patienten (ab 2 Jahren) auf dem Gewicht. Für Patienten ≥ 10 kg bis ≤ 25 kg beträgt die empfohlene Dosis 50 mg zweimal täglich. Für Patienten > 25 kg beträgt die empfohlene Dosis 100 mg zweimal täglich.
Für Patienten, die Schwierigkeiten beim Schlucken von Kapseln haben, kann Apfelmus mit dem Inhalt einer CELEBREX-Kapsel versetzt werden. Der gesamte Kapselinhalt wird vorsichtig auf einen gestrichenen Teelöffel kühles oder zimmerwarmes Apfelmus geleert und sofort mit Wasser eingenommen. Der auf Apfelmus gestreute Kapselinhalt ist unter gekühlten Bedingungen (2°C bis 8°C/35°F bis 45°F) bis zu 6 Stunden haltbar.
Spondylitis ankylosans
Bei AS beträgt die Dosierung von CELEBREX 200 mg täglich in Einzeldosen (einmal täglich) oder geteilten Dosen (zweimal täglich). Wenn nach 6 Wochen keine Wirkung zu beobachten ist, kann ein Versuch mit 400 mg täglich sinnvoll sein. Wenn nach 6 Wochen auf 400 mg täglich keine Wirkung beobachtet wird, ist ein Ansprechen unwahrscheinlich und es sollten alternative Behandlungsoptionen in Betracht gezogen werden.
Management von akuten Schmerzen und Behandlung von primärer Dysmenorrhoe
Zur Behandlung von akuten Schmerzen und zur Behandlung von primärer Dysmenorrhoe beträgt die Anfangsdosis 400 mg, gefolgt von einer zusätzlichen Dosis von 200 mg, falls am ersten Tag erforderlich. An den folgenden Tagen beträgt die empfohlene Dosis je nach Bedarf zweimal täglich 200 mg.
Besondere Populationen
Leberfunktionsstörung
Bei Patienten mit mäßig eingeschränkter Leberfunktion (Child-Pugh-Klasse B) die Dosis um 50 % reduzieren. Die Anwendung von CELEBREX 100 mg bei Patienten mit schwerer Leberfunktionsstörung wird nicht empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , Verwendung in bestimmten Bevölkerungsgruppen , und KLINISCHE PHARMAKOLOGIE ].
Schlechte Metabolisierer von CYP2C9-Substraten
Bei erwachsenen Patienten, von denen bekannt ist oder vermutet wird, dass sie schlechte CYP2C9-Metabolisierer sind, basierend auf dem Genotyp oder der Vorgeschichte/Erfahrung mit anderen CYP2C9-Substraten (wie Warfarin, Phenytoin), beginnen Sie die Behandlung mit der Hälfte der niedrigsten empfohlenen Dosis.
Bei Patienten mit JRA, von denen bekannt ist oder vermutet wird, dass sie schlechte CYP2C9-Metabolisierer sind, sollten alternative Behandlungen in Betracht gezogen werden [siehe Verwendung in bestimmten Bevölkerungsgruppen und KLINISCHE PHARMAKOLOGIE ].
WIE GELIEFERT
Darreichungsformen und Stärken
CELEBREX (Celecoxib) Kapseln:
50 mg weiß, mit rückseitig aufgedrucktem Weiß auf dem roten Band des Unterteils und des Oberteils mit Markierungen von 7767 auf dem Oberteil und 50 auf dem Unterteil.
100 mg weiß, mit rückseitig aufgedrucktem weißen Band auf Unterteil und Oberteil mit Aufdruck 7767 auf dem Oberteil und 100 auf dem Unterteil.
200 mg weiß, mit rückseitig bedrucktem Weiß auf goldenem Band mit Markierungen von 7767 auf dem Oberteil und 200 auf dem Unterteil.
400 mg weiß, mit rückseitig bedrucktem weißen Band auf grünem Band mit Markierungen von 7767 auf dem Oberteil und 400 auf dem Unterteil.
Lagerung und Handhabung
CELEBREX (Celecoxib) 50 mg Die Kapseln sind weiß, mit einem weißen Rückseitenaufdruck auf dem roten Band des Unterteils und des Oberteils mit Markierungen von 7767 auf dem Oberteil und 50 auf dem Unterteil, geliefert als:
CELEBREX (Celecoxib) 100 mg Die Kapseln sind weiß, mit einem weißen Rückseitenaufdruck auf dem blauen Band des Unterteils und des Oberteils mit Markierungen von 7767 auf dem Oberteil und 100 auf dem Unterteil, geliefert als:
CELEBREX (Celecoxib) 200 mg Die Kapseln sind weiß, mit einem weißen Rückseitenaufdruck auf einem goldenen Band mit Markierungen von 7767 auf dem Oberteil und 200 auf dem Unterteil, geliefert als:
CELEBREX (Celecoxib) 400 mg Kapseln sind weiß, mit Rückseite weiß auf grünem Band bedruckt, mit Markierungen von 7767 auf der Theka und 400 auf dem Körper, geliefert als:
Lagerung
Bei Raumtemperatur 20°C bis 25°C (68°F bis 77°F) lagern; Exkursionen zwischen 15°C und 30°C (59°F bis 86°F) erlaubt [siehe USP kontrollierte Raumtemperatur ].
Vertrieb durch: GD Searle LLC, Division of Pfizer Inc, NY, NY 10017. Überarbeitet: April 2021
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden in anderen Abschnitten der Kennzeichnung ausführlicher erörtert:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider. Die Informationen zu Nebenwirkungen aus klinischen Studien bieten jedoch eine Grundlage für die Identifizierung von Nebenwirkungen, die mit dem Arzneimittelkonsum in Zusammenhang zu stehen scheinen, und für ungefähre Raten.
Von den mit CELEBREX behandelten Patienten in den kontrollierten klinischen Studien vor der Markteinführung waren etwa 4.250 Patienten mit OA, etwa 2.100 Patienten mit RA und etwa 1.050 Patienten mit postoperativen Schmerzen. Mehr als 8.500 Patienten erhielten eine Tagesgesamtdosis von 200 mg CELEBREX 200 mg von 200 mg (100 mg zweimal täglich oder 200 mg einmal täglich) oder mehr, darunter mehr als 400, die mit 800 mg (400 mg zweimal täglich) behandelt wurden. Ungefähr 3.900 Patienten erhielten CELEBREX in diesen Dosierungen für 6 Monate oder länger; etwa 2.300 davon haben es für 1 Jahr oder länger erhalten und 124 von ihnen haben es für 2 Jahre oder mehr erhalten.
Kontrollierte Arthritis-Studien vor der Markteinführung
Tabelle 1 listet alle unerwünschten Ereignisse, unabhängig von der Kausalität, auf, die bei ≥ 2 % der Patienten auftraten, die CELEBREX 100 mg aus 12 kontrollierten Studien erhielten, die bei Patienten mit OA oder RA durchgeführt wurden, die eine Placebo- und/oder eine positive Kontrollgruppe umfassten. Da diese 12 Studien von unterschiedlicher Dauer waren und die Patienten in den Studien möglicherweise nicht für die gleiche Zeitdauer exponiert waren, erfassen diese Prozentsätze nicht die kumulativen Auftretensraten.
In placebo- oder aktivkontrollierten klinischen Studien betrug die Abbruchrate aufgrund von Nebenwirkungen 7,1 % bei Patienten, die CELEBREX erhielten, und 6,1 % bei Patienten, die Placebo erhielten. Zu den häufigsten Gründen für den Abbruch aufgrund von Nebenwirkungen in den CELEBREX-Behandlungsgruppen gehörten Dyspepsie und Bauchschmerzen (bei 0,8 % bzw. 0,7 % der CELEBREX-Patienten als Gründe für den Abbruch genannt). 0,6 % der Patienten, die Placebo erhielten, brachen die Behandlung wegen Dyspepsie und 0,6 % wegen Bauchschmerzen ab.
Die folgenden Nebenwirkungen traten bei 0,1 % bis 1,9 % der mit CELEBREX (100 mg bis 200 mg zweimal täglich oder 200 mg einmal täglich) behandelten Patienten auf:
Magen-Darm: Verstopfung, Divertikulitis, Dysphagie, Aufstoßen, Ösophagitis, Gastritis, Gastroenteritis, gastroösophagealer Reflux, Hämorrhoiden, Hiatushernie, Meläna, Mundtrockenheit, Stomatitis, Tenesmus, Erbrechen
Herz-Kreislauf: Verschlimmerter Bluthochdruck, Angina pectoris, koronare Herzkrankheit, Myokardinfarkt
Allgemein: Überempfindlichkeit, allergische Reaktion, Brustschmerzen, Zyste NOS, generalisiertes Ödem, Gesichtsödem, Müdigkeit, Fieber, Hitzewallungen, grippeähnliche Symptome, Schmerzen, periphere Schmerzen
Zentrales, peripheres Nervensystem: Beinkrämpfe, Hypertonie, Hypästhesie, Migräne, Parästhesien, Schwindel
Hören und vestibulär: Taubheit, Tinnitus
Herzfrequenz und Rhythmus: Herzklopfen, Tachykardie
Leber und Gallen: Erhöhte Leberenzyme (einschließlich erhöhter SGOT, erhöhter SGPT)
Stoffwechsel und Ernährung: Blut-Harnstoff-Stickstoff (BUN) erhöht, Kreatin-Phosphokinase (CPK) erhöht, Hypercholesterinämie, Hyperglykämie, Hypokaliämie, NPN erhöht, Kreatinin erhöht, alkalische Phosphatase erhöht, Gewichtszunahme
Bewegungsapparat: Arthralgie, Arthrose, Myalgie, Synovitis, Sehnenentzündung
Blutplättchen (Blutung oder Gerinnung): Ekchymose, Epistaxis, Thrombozythämie,
Psychiatrie: Anorexie, Angst, gesteigerter Appetit, Depression, Nervosität, Schläfrigkeit
Hämisch: Anämie
Atmung: Bronchitis, Bronchospasmus, Bronchospasmus verschlimmert, Husten, Dyspnoe, Laryngitis, Lungenentzündung
Haut und Anhängsel: Alopezie, Dermatitis, Lichtempfindlichkeitsreaktion, Pruritus, erythematöser Ausschlag, makulopapulöser Ausschlag, Hauterkrankung, Hauttrockenheit, vermehrtes Schwitzen, Urtikaria
Beschwerden am Applikationsort: Cellulitis, Kontaktdermatitis
Urin: Albuminurie, Zystitis, Dysurie, Hämaturie, Miktionshäufigkeit, Nierensteine
Die folgenden schwerwiegenden unerwünschten Ereignisse (Kausalität nicht bewertet) traten bei
Herz-Kreislauf: Synkope, dekompensierte Herzinsuffizienz, Kammerflimmern, Lungenembolie, Schlaganfall, periphere Gangrän, Thrombophlebitis
Magen-Darm: Darmverschluss, Darmperforation, Magen-Darm-Blutungen, Colitis mit Blutungen, Ösophagusperforation, Pankreatitis, Ileus
Allgemein: Sepsis, plötzlicher Tod
Leber und Gallen: Cholelithiasis
Hämisch und lymphatisch: Thrombozytopenie
Nervös: Ataxie, Selbstmord [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]
Nieren: Akute Niereninsuffizienz
Die Celecoxib-Langzeit-Arthritis-Sicherheitsstudie
[sehen Klinische Studien ]
Hämatologische Ereignisse: Die Inzidenz klinisch signifikanter Abnahmen des Hämoglobins (> 2 g/dl) war bei Patienten unter CELEBREX 400 mg zweimal täglich (0,5 %) geringer als bei Patienten unter entweder Diclofenac 75 mg zweimal täglich (1,3 %) oder Ibuprofen 800 mg dreimal täglich 1,9 %. Die geringere Inzidenz von Ereignissen unter CELEBREX wurde mit oder ohne Anwendung von Aspirin beibehalten [siehe KLINISCHE PHARMAKOLOGIE ].
Abhebungen/Schwerwiegende unerwünschte Ereignisse: Die kumulative Kaplan-Meier-Rate nach 9 Monaten für Studienabbrüche aufgrund unerwünschter Ereignisse für CELEBREX 100 mg, Diclofenac und Ibuprofen betrug 24 %, 29 % bzw. 26 %. Die Raten für schwerwiegende unerwünschte Ereignisse (dh Krankenhauseinweisungen verursachend oder als lebensbedrohlich oder anderweitig medizinisch bedeutsam empfunden) unterschieden sich unabhängig von der Kausalität nicht zwischen den Behandlungsgruppen (8 %, 7 % bzw. 8 %).
Juvenile rheumatoide Arthritis-Studie
In einer 12-wöchigen, doppelblinden, aktiv kontrollierten Studie wurden 242 JRA-Patienten im Alter von 2 bis 17 Jahren mit Celecoxib oder Naproxen behandelt; 77 JRA-Patienten wurden mit Celecoxib 3 mg/kg zweimal täglich behandelt, 82 Patienten wurden mit Celecoxib 6 mg/kg zweimal täglich behandelt und 83 Patienten wurden mit Naproxen 7,5 mg/kg zweimal täglich behandelt. Die am häufigsten auftretenden (≥5 %) Nebenwirkungen bei mit Celecoxib behandelten Patienten waren Kopfschmerzen, Fieber (Pyrexie), Oberbauchschmerzen, Husten, Nasopharyngitis, Bauchschmerzen, Übelkeit, Arthralgie, Durchfall und Erbrechen. Die am häufigsten auftretenden (≥ 5 %) Nebenwirkungen bei mit Naproxen behandelten Patienten waren Kopfschmerzen, Übelkeit, Erbrechen, Fieber, Oberbauchschmerzen, Durchfall, Husten, Bauchschmerzen und Schwindel (Tabelle 2). Im Vergleich zu Naproxen hatte Celecoxib in Dosierungen von 3 und 6 mg/kg zweimal täglich keine beobachtbare nachteilige Wirkung auf Wachstum und Entwicklung im Verlauf der 12-wöchigen Doppelblindstudie. Zwischen den Behandlungsgruppen gab es keinen wesentlichen Unterschied in der Anzahl der klinischen Exazerbationen der Uveitis oder der systemischen Merkmale der JRA.
In einer 12-wöchigen, unverblindeten Verlängerung der oben beschriebenen Doppelblindstudie wurden 202 JRA-Patienten zweimal täglich mit 6 mg/kg Celecoxib behandelt. Die Inzidenz unerwünschter Ereignisse war ähnlich der während der Doppelblindstudie beobachteten; es traten keine unerwarteten unerwünschten Ereignisse von klinischer Bedeutung auf.
Andere Studien vor der Zulassung
Unerwünschte Ereignisse aus Studien zur ankylosierenden Spondylitis
Insgesamt 378 Patienten wurden mit CELEBREX 200 mg in placebo- und aktivkontrollierten AS-Studien behandelt. Dosen bis zu 400 mg einmal täglich wurden untersucht. Die Arten von unerwünschten Ereignissen, die in den AS-Studien berichtet wurden, waren denen ähnlich, die in den OA/RA-Studien berichtet wurden.
Unerwünschte Ereignisse aus Analgesie- und Dysmenorrhoe-Studien
Etwa 1.700 Patienten wurden in Analgesie- und Dysmenorrhö-Studien mit CELEBREX 200 mg behandelt. Alle Patienten in postoralen Schmerzstudien erhielten eine Einzeldosis der Studienmedikation. Dosierungen von bis zu 600 mg CELEBREX 200 mg/Tag wurden in Studien zu primärer Dysmenorrhoe und Schmerzen nach orthopädischen Operationen untersucht. Die Arten von unerwünschten Ereignissen in den Analgesie- und Dysmenorrhö-Studien waren ähnlich denen, die in den Arthritis-Studien berichtet wurden. Die einzige zusätzlich berichtete Nebenwirkung war eine alveoläre Ostitis nach Zahnextraktion (trockene Alveole) in den Studien zu Schmerzen nach oraler Chirurgie.
Die APC- und PreSAP-Tests
Nebenwirkungen aus langfristigen, placebokontrollierten Polypenpräventionsstudien
Die CELEBREX-Exposition in den APC- und PreSAP-Studien betrug 400 mg bis 800 mg täglich für bis zu 3 Jahre [siehe Klinische Studien ].
Einige Nebenwirkungen traten bei einem höheren Prozentsatz von Patienten auf als in den vor der Markteinführung durchgeführten Arthritis-Studien (Behandlungsdauer bis zu 12 Wochen; siehe „Unerwünschte Ereignisse aus kontrollierten Arthritis-Studien vor der Markteinführung mit CELEBREX 200 mg“ weiter oben). Die Nebenwirkungen, bei denen diese Unterschiede bei mit CELEBREX behandelten Patienten im Vergleich zu den vor der Markteinführung durchgeführten Arthritis-Studien größer waren, waren wie folgt:
Die folgenden zusätzlichen Nebenwirkungen traten bei ≥ 0,1 % und
Erkrankungen des Nervensystems: Hirninfarkt
Augenerkrankungen: Glaskörpertrübungen, Bindehautblutung
Ohr und Labyrinth: Labyrinthitis
Herzerkrankungen: Instabile Angina pectoris, Aortenklappeninsuffizienz, Atherosklerose der Koronararterien, Sinusbradykardie, ventrikuläre Hypertrophie
Gefäßerkrankungen: Tiefe Venenthrombose
Störungen des Fortpflanzungssystems und der Brust: Eierstockzyste
Untersuchungen: Kalium im Blut erhöht, Natrium im Blut erhöht, Testosteron im Blut erniedrigt
Verletzungen, Vergiftungen und durch Eingriffe bedingte Komplikationen: Epicondylitis, Sehnenriss
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von CELEBREX nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen
Herz-Kreislauf: Vaskulitis, tiefe Venenthrombose
Allgemein: Anaphylaktoide Reaktion, Angioödem
Leber und Gallen: Lebernekrose, Hepatitis, Gelbsucht, Leberversagen
Hämisch und lymphatisch: Agranulozytose, aplastische Anämie, Panzytopenie, Leukopenie
Stoffwechsel: Hypoglykämie, Hyponatriämie
Nervös: Aseptische Meningitis, Ageusie, Anosmie, tödliche intrakranielle Blutung
Nieren: Interstitielle Nephritis
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Siehe Tabelle 3 für klinisch signifikante Arzneimittelwechselwirkungen mit Celecoxib.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Kardiovaskuläre thrombotische Ereignisse
Klinische Studien mit mehreren Cyclooxygenase-2 (COX-2)-selektiven und nicht-selektiven NSAIDs mit einer Dauer von bis zu drei Jahren haben ein erhöhtes Risiko für schwerwiegende kardiovaskuläre (CV) thrombotische Ereignisse, einschließlich Myokardinfarkt (MI) und Schlaganfall, die tödlich sein können, gezeigt. Basierend auf den verfügbaren Daten ist unklar, ob das Risiko für kardiovaskuläre thrombotische Ereignisse bei allen NSAIDs ähnlich ist. Der relative Anstieg schwerer kardiovaskulärer thrombotischer Ereignisse gegenüber dem Ausgangswert, der durch die Verwendung von NSAIDs hervorgerufen wird, scheint bei Patienten mit und ohne bekannte kardiovaskuläre Erkrankung oder Risikofaktoren für kardiovaskuläre Erkrankungen ähnlich zu sein. Allerdings hatten Patienten mit bekannter kardiovaskulärer Erkrankung oder Risikofaktoren aufgrund ihrer erhöhten Baseline-Rate eine höhere absolute Inzidenz von übermäßigen schwerwiegenden kardiovaskulären thrombotischen Ereignissen. Einige Beobachtungsstudien ergaben, dass dieses erhöhte Risiko für schwerwiegende kardiovaskuläre thrombotische Ereignisse bereits in den ersten Behandlungswochen einsetzte. Der Anstieg des kardiovaskulären Thromboserisikos wurde am konsistentesten bei höheren Dosen beobachtet.
In der APC-Studie (Adenoma Prevention with Celecoxib) bestand für die Behandlungsarme CELEBREX 400 mg zweimal täglich und CELEBREX 200 mg zweimal täglich ein etwa dreifach erhöhtes Risiko für den kombinierten Endpunkt kardiovaskulärer Tod, Herzinfarkt oder Schlaganfall im Vergleich zu Placebo. Die Erhöhungen in beiden Celecoxib-Dosisgruppen im Vergleich zu den mit Placebo behandelten Patienten waren hauptsächlich auf eine erhöhte Inzidenz von Myokardinfarkt zurückzuführen [siehe Klinische Studien ].
Eine randomisierte kontrollierte Studie mit dem Titel Prospective Randomized Evaluation of Celecoxib Integrated Safety vs. Ibuprofen Or Naproxen (PRECISION) wurde durchgeführt, um das relative kardiovaskuläre Thromboserisiko eines COX-2-Inhibitors, Celecoxib, im Vergleich zu den nicht-selektiven NSAIDs Naproxen und Ibuprofen zu bewerten. Celecoxib 100 mg zweimal täglich war Naproxen 375 bis 500 mg zweimal täglich und Ibuprofen 600 bis 800 mg dreimal täglich für den zusammengesetzten Endpunkt der Antithrombozyten-Studie nicht unterlegen. Collaboration (APTC), die aus kardiovaskulärem Tod (einschließlich hämorrhagischem Tod), nicht tödlichem Myokardinfarkt und nicht tödlichem Schlaganfall besteht [siehe Klinische Studien ].
Um das potenzielle Risiko eines unerwünschten kardiovaskulären Ereignisses bei NSAID-behandelten Patienten zu minimieren, verwenden Sie die niedrigste wirksame Dosis für die kürzestmögliche Dauer. Ärzte und Patienten sollten während des gesamten Behandlungsverlaufs auf die Entwicklung solcher Ereignisse achten, auch wenn zuvor keine kardiovaskulären Symptome aufgetreten sind. Die Patienten sollten über die Symptome schwerwiegender kardiovaskulärer Ereignisse und die zu ergreifenden Maßnahmen informiert werden, wenn sie auftreten.
Es gibt keine konsistenten Beweise dafür, dass die gleichzeitige Anwendung von Aspirin das erhöhte Risiko schwerer kardiovaskulärer thrombotischer Ereignisse im Zusammenhang mit der Anwendung von NSAR mindert. Die gleichzeitige Anwendung von Aspirin und einem NSAID wie Celecoxib erhöht das Risiko schwerwiegender gastrointestinaler (GI) Ereignisse [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Status nach Koronararterien-Bypass-Operation (CABG).
Zwei große, kontrollierte klinische Studien mit einem COX-2-selektiven NSAID zur Behandlung von Schmerzen in den ersten 10 bis 14 Tagen nach einer CABG-Operation ergaben eine erhöhte Inzidenz von Myokardinfarkt und Schlaganfall. NSAIDs sind bei CABG kontraindiziert [vgl KONTRAINDIKATIONEN ].
Post-MI-Patienten
Beobachtungsstudien, die im dänischen Nationalregister durchgeführt wurden, haben gezeigt, dass Patienten, die mit NSAIDs in der Zeit nach einem Myokardinfarkt behandelt wurden, ab der ersten Behandlungswoche ein erhöhtes Risiko für einen Reinfarkt, einen kardiovaskulären Tod und eine Gesamtmortalität hatten. In derselben Kohorte betrug die Inzidenz von Todesfällen im ersten Jahr nach MI 20 pro 100 Personenjahre bei NSAID-behandelten Patienten im Vergleich zu 12 pro 100 Personenjahre bei nicht-NSAID-exponierten Patienten. Obwohl die absolute Todesrate nach dem ersten Jahr nach dem Myokardinfarkt etwas zurückging, blieb das erhöhte relative Todesrisiko bei NSAID-Anwendern mindestens über die nächsten vier Jahre der Nachbeobachtung bestehen.
Vermeiden Sie die Anwendung von CELEBREX 100 mg bei Patienten mit kürzlich aufgetretenem MI, es sei denn, der Nutzen überwiegt voraussichtlich das Risiko wiederkehrender kardiovaskulärer thrombotischer Ereignisse. Wenn CELEBREX bei Patienten mit kürzlich aufgetretenem Herzinfarkt angewendet wird, sind die Patienten auf Anzeichen einer kardialen Ischämie zu überwachen.
Magen-Darm-Blutungen, Ulzerationen und Perforationen
NSAIDs, einschließlich Celecoxib, verursachen schwerwiegende gastrointestinale (GI) unerwünschte Ereignisse, einschließlich Entzündungen, Blutungen, Ulzerationen und Perforationen der Speiseröhre, des Magens, des Dünndarms oder des Dickdarms, die tödlich sein können. Diese schwerwiegenden unerwünschten Ereignisse können jederzeit mit oder ohne Warnsymptome bei mit CELEBREX behandelten Patienten auftreten. Nur jeder fünfte Patient, der unter NSAID-Therapie ein schwerwiegendes unerwünschtes Ereignis im oberen Gastrointestinaltrakt entwickelt, ist symptomatisch. Geschwüre im oberen Gastrointestinaltrakt, starke Blutungen oder Perforationen, die durch NSAIDs verursacht wurden, traten bei etwa 1 % der Patienten auf, die 3 bis 6 Monate behandelt wurden, und bei etwa 2 % bis 4 % der Patienten, die ein Jahr behandelt wurden. Allerdings ist auch eine kurzzeitige NSAID-Therapie nicht ohne Risiko.
Risikofaktoren für GI-Blutungen, Ulzerationen und Perforationen
Patienten mit Magengeschwüren und/oder gastrointestinalen Blutungen in der Vorgeschichte, die NSAR einnahmen, hatten ein mehr als 10-fach erhöhtes Risiko für die Entwicklung einer gastrointestinalen Blutung im Vergleich zu Patienten ohne diese Risikofaktoren. Andere Faktoren, die das Risiko von GI-Blutungen bei mit NSAIDs behandelten Patienten erhöhen, umfassen eine längere Dauer der NSAID-Therapie; gleichzeitige Anwendung von oralen Kortikosteroiden, Thrombozytenaggregationshemmern (wie Aspirin), Antikoagulantien; oder selektive Serotonin-Wiederaufnahmehemmer (SSRIs); Rauchen; Alkoholkonsum; älteres Alter; und schlechter allgemeiner Gesundheitszustand. Die meisten Post-Marketing-Berichte über tödliche gastrointestinale Ereignisse traten bei älteren oder geschwächten Patienten auf. Darüber hinaus besteht bei Patienten mit fortgeschrittener Lebererkrankung und/oder Koagulopathie ein erhöhtes Risiko für gastrointestinale Blutungen.
Die Rate an komplizierten und symptomatischen Geschwüren betrug nach neun Monaten 0,78 % für alle Patienten in der CLASS-Studie und 2,19 % für die Untergruppe mit niedrig dosiertem ASS. Patienten im Alter von 65 Jahren und älter hatten eine Inzidenz von 1,40 % nach neun Monaten, 3,06 % bei gleichzeitiger Einnahme von ASS [vgl Klinische Studien ].
Strategien zur Minimierung der GI-Risiken bei NSAID-behandelten Patienten
Hepatotoxizität
Erhöhungen von ALT oder AST (mindestens das Dreifache der oberen Normgrenze [ULN]) wurden in klinischen Studien bei etwa 1 % der mit NSAR behandelten Patienten berichtet. Darüber hinaus wurden seltene, manchmal tödliche Fälle von schwerer Leberschädigung, einschließlich fulminanter Hepatitis, Lebernekrose und Leberversagen, berichtet.
Erhöhungen von ALT oder AST (weniger als das Dreifache des ULN) können bei bis zu 15 % der Patienten auftreten, die mit NSAIDs, einschließlich Celecoxib, behandelt werden.
In kontrollierten klinischen Studien mit CELEBREX 200 mg betrug die Inzidenz von grenzwertigen Erhöhungen (größer oder gleich dem 1,2-fachen und weniger als dem 3-fachen der Obergrenze des Normalwerts) leberassoziierter Enzyme 6 % für CELEBREX und 5 % für Placebo und etwa 0,2 % der Patienten, die CELEBREX einnahmen, und 0,3 % der Patienten, die Placebo einnahmen, hatten bemerkenswerte Erhöhungen von ALT und AST.
Informieren Sie die Patienten über die Warnzeichen und Symptome einer Hepatotoxizität (z. B. Übelkeit, Müdigkeit, Lethargie, Durchfall, Juckreiz, Gelbsucht, Druckschmerz im rechten oberen Quadranten und „grippeähnliche“ Symptome). Wenn sich klinische Anzeichen und Symptome entwickeln, die einer Lebererkrankung entsprechen, oder wenn systemische Manifestationen auftreten (z. B. Eosinophilie, Hautausschlag), setzen Sie CELEBREX sofort ab und führen Sie eine klinische Untersuchung des Patienten durch.
Hypertonie
NSAIDs, einschließlich CELEBREX 200 mg, können zu einem erneuten Auftreten von Bluthochdruck oder einer Verschlechterung eines vorbestehenden Bluthochdrucks führen, die beide zu einer erhöhten Inzidenz von kardiovaskulären Ereignissen beitragen können. Patienten, die Angiotensin-Converting-Enzyme (ACE)-Hemmer, Thiaziddiuretika oder Schleifendiuretika einnehmen, können bei der Einnahme von NSAIDs ein beeinträchtigtes Ansprechen auf diese Therapien haben [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Sehen Klinische Studien für zusätzliche Blutdruckdaten für CELEBREX.
Überwachen Sie den Blutdruck (BP) zu Beginn der NSAID-Behandlung und während des gesamten Therapieverlaufs.
Herzinsuffizienz und Ödem
Die Coxib- und traditionelle NSAID-Studienteilnehmer' Eine kollaborative Metaanalyse randomisierter kontrollierter Studien zeigte eine ungefähr zweifache Zunahme der Krankenhauseinweisungen wegen Herzinsuffizienz bei COX-2-selektiv behandelten Patienten und nicht-selektiv NSAID-behandelten Patienten im Vergleich zu Placebo-behandelten Patienten. In einer Studie des Dänischen Nationalen Registers bei Patienten mit Herzinsuffizienz erhöhte die Verwendung von NSAID das Risiko für Herzinfarkt, Krankenhauseinweisung wegen Herzinsuffizienz und Tod.
Darüber hinaus wurden bei einigen Patienten, die mit NSAIDs behandelt wurden, Flüssigkeitsretention und Ödeme beobachtet. Die Anwendung von Celecoxib kann die kardiovaskulären Wirkungen mehrerer Therapeutika abschwächen, die zur Behandlung dieser Erkrankungen eingesetzt werden (z. B. Diuretika, ACE-Hemmer oder Angiotensin-Rezeptorblocker [ARBs]) [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
In der CLASS-Studie [vgl Klinische Studien ], die kumulativen Kaplan-Meier-Raten nach 9 Monaten von stationären Patienten mit peripheren Ödemen unter CELEBREX 400 mg zweimal täglich (das 4-Fache bzw. 2-Fache der empfohlenen OA- bzw. RA-Dosen), Ibuprofen 800 mg dreimal täglich und Diclofenac 75 mg zweimal täglich betrugen 4,5 %, 6,9 % bzw. 4,7 %.
Vermeiden Sie die Anwendung von CELEBREX 200 mg bei Patienten mit schwerer Herzinsuffizienz, es sei denn, der Nutzen überwiegt voraussichtlich das Risiko einer Verschlechterung der Herzinsuffizienz. Wenn CELEBREX 100 mg bei Patienten mit schwerer Herzinsuffizienz angewendet wird, sind die Patienten auf Anzeichen einer Verschlechterung der Herzinsuffizienz zu überwachen.
Nierentoxizität und Hyperkaliämie
Nierentoxizität
Die langfristige Verabreichung von NSAIDs hat zu Nierenpapillennekrose und anderen Nierenschäden geführt.
Nierentoxizität wurde auch bei Patienten beobachtet, bei denen renale Prostaglandine eine kompensatorische Rolle bei der Aufrechterhaltung der Nierendurchblutung spielen. Bei diesen Patienten kann die Verabreichung eines NSAID eine dosisabhängige Verringerung der Prostaglandinformationen und sekundär des renalen Blutflusses verursachen, was eine offenkundige Nierendekompensation auslösen kann. Patienten mit dem größten Risiko für diese Reaktion sind Patienten mit eingeschränkter Nierenfunktion, Dehydratation, Hypovolämie, Herzinsuffizienz, Leberfunktionsstörungen, Patienten, die Diuretika, ACE-Hemmer oder ARBs einnehmen, sowie ältere Menschen. Auf das Absetzen der NSAID-Therapie folgt normalerweise die Wiederherstellung des Zustands vor der Behandlung.
Aus kontrollierten klinischen Studien liegen keine Informationen zur Anwendung von CELEBREX 100 mg bei Patienten mit fortgeschrittener Nierenerkrankung vor. Die renale Wirkung von CELEBREX kann das Fortschreiten der Nierenfunktionsstörung bei Patienten mit vorbestehender Nierenerkrankung beschleunigen.
Korrigieren Sie den Volumenstatus bei dehydrierten oder hypovolämischen Patienten vor Beginn der Behandlung mit CELEBREX. Überwachen Sie die Nierenfunktion bei Patienten mit eingeschränkter Nieren- oder Leberfunktion, Herzinsuffizienz, Dehydratation oder Hypovolämie während der Anwendung von CELEBREX [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Vermeiden Sie die Anwendung von CELEBREX 200 mg bei Patienten mit fortgeschrittener Nierenerkrankung, es sei denn, der Nutzen überwiegt voraussichtlich das Risiko einer Verschlechterung der Nierenfunktion. Wenn CELEBREX 200 mg bei Patienten mit fortgeschrittener Nierenerkrankung angewendet wird, sind die Patienten auf Anzeichen einer Verschlechterung der Nierenfunktion zu überwachen.
Hyperkaliämie
Bei der Anwendung von NSAIDs wurde sogar bei einigen Patienten ohne Nierenfunktionsstörung über Anstiege der Serumkaliumkonzentration, einschließlich Hyperkaliämie, berichtet. Bei Patienten mit normaler Nierenfunktion wurden diese Wirkungen einem hyporeninämischen Zustand mit Hypoaldosteronismus zugeschrieben.
Anaphylaktische Reaktionen
Celecoxib wurde mit anaphylaktischen Reaktionen bei Patienten mit und ohne bekannte Überempfindlichkeit gegenüber Celecoxib und bei Patienten mit Aspirin-empfindlichem Asthma in Verbindung gebracht. Celebrex 200 mg ist ein Sulfonamid und sowohl NSAIDs als auch Sulfonamide können allergische Reaktionen hervorrufen, einschließlich anaphylaktischer Symptome und lebensbedrohlicher oder weniger schwerer asthmatischer Episoden bei bestimmten empfindlichen Personen [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Suchen Sie Notfallhilfe auf, wenn eine anaphylaktische Reaktion auftritt.
Verschlimmerung von Asthma im Zusammenhang mit Aspirin-Empfindlichkeit
Eine Subpopulation von Patienten mit Asthma kann Aspirin-empfindliches Asthma haben, das eine durch Nasenpolypen komplizierte chronische Rhinosinusitis umfassen kann; schwerer, möglicherweise tödlicher Bronchospasmus; und/oder Intoleranz gegenüber Aspirin und anderen NSAIDs. Da bei solchen Aspirin-empfindlichen Patienten über Kreuzreaktivität zwischen Aspirin und anderen NSAIDs berichtet wurde, ist CELEBREX bei Patienten mit dieser Form der Aspirin-Empfindlichkeit kontraindiziert [siehe KONTRAINDIKATIONEN ]. Wenn CELEBREX bei Patienten mit vorbestehendem Asthma (ohne bekannte Aspirin-Empfindlichkeit) angewendet wird, sind die Patienten auf Veränderungen der Anzeichen und Symptome von Asthma zu überwachen.
Schwerwiegende Hautreaktionen
Nach der Behandlung mit Celebrex 200 mg sind schwerwiegende Hautreaktionen aufgetreten, darunter Erythema multiforme, exfoliative Dermatitis, Stevens-Johnson-Syndrom (SJS), toxische epidermale Nekrolyse (TEN), Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS) und akute generalisierte exanthematische Pustulose ( AGEP). Diese schwerwiegenden Ereignisse können ohne Vorwarnung eintreten und tödlich sein.
Informieren Sie die Patienten über die Anzeichen und Symptome schwerwiegender Hautreaktionen und brechen Sie die Anwendung von CELEBREX 100 mg beim ersten Auftreten von Hautausschlag oder anderen Anzeichen einer Überempfindlichkeit ab. CELEBREX 200 mg ist kontraindiziert bei Patienten mit früheren schwerwiegenden Hautreaktionen auf NSAIDs [siehe KONTRAINDIKATIONEN ].
Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS)
Arzneimittelreaktionen mit Eosinophilie und systemischen Symptomen (DRESS) wurden bei Patienten berichtet, die NSAIDs wie CELEBREX einnahmen. Einige dieser Ereignisse waren tödlich oder lebensbedrohlich. DRESS zeigt sich typischerweise, wenn auch nicht ausschließlich, durch Fieber, Hautausschlag, Lymphadenopathie und/oder Gesichtsschwellungen. Andere klinische Manifestationen können Hepatitis, Nephritis, hämatologische Anomalien, Myokarditis oder Myositis umfassen. Manchmal ähneln die Symptome von DRESS einer akuten Virusinfektion. Eosinophilie ist oft vorhanden. Da diese Störung in ihrem Erscheinungsbild variabel ist, können andere Organsysteme, die hier nicht aufgeführt sind, beteiligt sein. Es ist wichtig zu beachten, dass frühe Manifestationen einer Überempfindlichkeit, wie Fieber oder Lymphadenopathie, vorhanden sein können, auch wenn kein Hautausschlag erkennbar ist. Wenn solche Anzeichen oder Symptome vorhanden sind, setzen Sie CELEBREX 200 mg ab und untersuchen Sie den Patienten sofort.
Fötale Toxizität
Vorzeitiger Verschluss des fötalen Ductus Arteriosus
Vermeiden Sie die Anwendung von NSAIDs, einschließlich CELEBREX 100 mg, bei schwangeren Frauen ab etwa der 30. Schwangerschaftswoche. NSAIDs, einschließlich CELEBREX, erhöhen das Risiko eines vorzeitigen Verschlusses des fetalen Ductus arteriosus etwa in diesem Gestationsalter.
Oligohydramnion/Niereninsuffizienz bei Neugeborenen
Die Anwendung von NSAIDs, einschließlich CELEBREX, etwa in der 20. Schwangerschaftswoche oder später in der Schwangerschaft kann zu einer fetalen Nierenfunktionsstörung führen, die zu Oligohydramnion und in einigen Fällen zu einer Nierenfunktionsstörung beim Neugeborenen führt. Diese Nebenwirkungen werden im Durchschnitt nach Tagen bis Wochen der Behandlung beobachtet, obwohl Oligohydramnion selten schon 48 Stunden nach Beginn der Behandlung mit NSAR berichtet wurde. Oligohydramnion ist oft, aber nicht immer, nach Absetzen der Behandlung reversibel. Zu den Komplikationen eines verlängerten Oligohydramnion können beispielsweise Extremitätenkontrakturen und eine verzögerte Lungenreifung gehören. In einigen Post-Marketing-Fällen mit eingeschränkter Nierenfunktion bei Neugeborenen waren invasive Verfahren wie Austauschtransfusionen oder Dialyse erforderlich.
Wenn eine NSAID-Behandlung zwischen etwa der 20. und 30. Schwangerschaftswoche erforderlich ist, beschränken Sie die Anwendung von CELEBREX auf die niedrigste wirksame Dosis und die kürzestmögliche Dauer. Erwägen Sie eine Ultraschallüberwachung des Fruchtwassers, wenn die Behandlung mit CELEBREX länger als 48 Stunden dauert. Setzen Sie CELEBREX ab, wenn Oligohydramnion auftritt, und folgen Sie der klinischen Praxis entsprechend [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Hämatologische Toxizität
Anämie ist bei NSAID-behandelten Patienten aufgetreten. Dies kann auf okkulten oder groben Blutverlust, Flüssigkeitsretention oder eine unvollständig beschriebene Wirkung auf die Erythropoese zurückzuführen sein. Wenn bei einem mit CELEBREX behandelten Patienten Anzeichen oder Symptome einer Anämie auftreten, sollten Hämoglobin oder Hämatokrit überwacht werden.
In kontrollierten klinischen Studien betrug die Inzidenz von Anämie 0,6 % unter CELEBREX und 0,4 % unter Placebo. Patienten unter Langzeitbehandlung mit CELEBREX 200 mg sollten ihren Hämoglobin- oder Hämatokritwert überprüfen lassen, wenn sie Anzeichen oder Symptome von Anämie oder Blutverlust aufweisen.
NSAIDs, einschließlich CELEBREX 100 mg, können das Risiko von Blutungsereignissen erhöhen. Begleiterkrankungen wie Gerinnungsstörungen oder die gleichzeitige Anwendung von Warfarin, anderen Antikoagulanzien, Thrombozytenaggregationshemmern (z. B. Aspirin), SSRIs und Serotonin-Noradrenalin-Wiederaufnahmehemmern (SNRIs) können dieses Risiko erhöhen. Überwachen Sie diese Patienten auf Anzeichen von Blutungen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Maskierung von Entzündungen und Fieber
Die pharmakologische Aktivität von CELEBREX 100 mg bei der Reduzierung von Entzündungen und möglicherweise Fieber kann die Nützlichkeit diagnostischer Zeichen beim Nachweis von Infektionen verringern.
Laborüberwachung
Da schwere Magen-Darm-Blutungen, Hepatotoxizität und Nierenschäden ohne Warnsymptome oder -zeichen auftreten können, erwägen Sie eine regelmäßige Überwachung von Patienten unter NSAID-Langzeitbehandlung mit einem Blutbild und einem chemischen Profil [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
In kontrollierten klinischen Studien traten bei Patienten, die CELEBREX erhielten, häufiger erhöhte BUN auf als bei Patienten, die Placebo erhielten. Diese Laboranomalie wurde auch bei Patienten beobachtet, die in diesen Studien Vergleichs-NSAIDs erhielten. Die klinische Bedeutung dieser Anomalie wurde nicht nachgewiesen.
Disseminierte intravasale Gerinnung (DIC)
Wegen des Risikos einer disseminierten intravaskulären Gerinnung bei der Anwendung von CELEBREX 200 mg bei pädiatrischen Patienten mit systemisch einsetzender JRA sollten die Patienten auf Anzeichen und Symptome einer anormalen Gerinnung oder Blutung überwacht werden und die Patienten und ihre Betreuer informiert werden, um die Symptome so bald wie möglich zu melden.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente ), die jeder ausgestellten Verschreibung beiliegt. Informieren Sie Patienten, Familien oder ihre Betreuer über die folgenden Informationen, bevor Sie mit der Therapie mit CELEBREX beginnen, und regelmäßig während der laufenden Therapie.
Kardiovaskuläre thrombotische Ereignisse
Weisen Sie die Patienten an, auf die Symptome kardiovaskulärer thrombotischer Ereignisse, einschließlich Brustschmerzen, Kurzatmigkeit, Schwäche oder undeutliche Sprache, zu achten und jedes dieser Symptome unverzüglich ihrem Arzt zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Magen-Darm-Blutungen, Ulzerationen und Perforationen
Weisen Sie die Patienten an, Symptome von Ulzerationen und Blutungen, einschließlich epigastrischer Schmerzen, Dyspepsie, Meläna und Hämatemesis, ihrem Arzt zu melden. Informieren Sie die Patienten bei gleichzeitiger Anwendung von niedrig dosiertem Aspirin zur Herzprophylaxe über das erhöhte Risiko für und die Anzeichen und Symptome von gastrointestinalen Blutungen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hepatotoxizität
Informieren Sie die Patienten über die Warnzeichen und Symptome einer Hepatotoxizität (z. B. Übelkeit, Müdigkeit, Lethargie, Juckreiz, Durchfall, Gelbsucht, Empfindlichkeit im rechten oberen Quadranten und „grippeähnliche“ Symptome). Wenn diese auftreten, weisen Sie die Patienten an, CELEBREX 200 mg abzusetzen und sich unverzüglich medizinisch behandeln zu lassen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , Verwendung in bestimmten Bevölkerungsgruppen ].
Herzinsuffizienz und Ödem
Weisen Sie die Patienten an, auf die Symptome einer dekompensierten Herzinsuffizienz, einschließlich Kurzatmigkeit, unerklärliche Gewichtszunahme oder Ödeme, aufmerksam zu sein und sich an ihren Arzt zu wenden, wenn solche Symptome auftreten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Anaphylaktische Reaktionen
Informieren Sie die Patienten über die Anzeichen einer anaphylaktischen Reaktion (z. B. Atembeschwerden, Schwellungen im Gesicht oder Rachen). Weisen Sie die Patienten an, sofort Nothilfe zu suchen, wenn diese auftreten [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schwerwiegende Hautreaktionen, einschließlich DRESS
Weisen Sie die Patienten an, die Einnahme von CELEBREX 100 mg sofort abzubrechen, wenn sie irgendeine Art von Hautausschlag oder Fieber entwickeln, und sich so schnell wie möglich an ihren Arzt zu wenden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Weibliche Fruchtbarkeit
Weisen Sie Frauen im gebärfähigen Alter, die eine Schwangerschaft wünschen, darauf hin, dass NSAIDs, einschließlich CELEBREX 200 mg, mit einer möglichen Verzögerung des Eisprungs in Verbindung gebracht werden können [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Fötale Toxizität
Informieren Sie schwangere Frauen, dass sie die Anwendung von CELEBREX und anderen NSAIDs ab der 30. Schwangerschaftswoche wegen des Risikos eines vorzeitigen Verschlusses des fetalen Ductus arteriosus vermeiden sollten. Wenn eine Behandlung mit CELEBREX 200 mg für eine schwangere Frau zwischen der 20. und 30. Schwangerschaftswoche erforderlich ist, weisen Sie sie darauf hin, dass sie möglicherweise auf Oligohydramnion überwacht werden muss, wenn die Behandlung länger als 48 Stunden andauert [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Vermeiden Sie die gleichzeitige Anwendung von NSAIDs
Informieren Sie die Patienten darüber, dass die gleichzeitige Anwendung von CELEBREX mit anderen NSAIDs oder Salicylaten (z. B. Diflunisal, Salsalat) aufgrund des erhöhten Risikos einer gastrointestinalen Toxizität und einer geringen oder keinen Steigerung der Wirksamkeit nicht empfohlen wird [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Weisen Sie die Patienten darauf hin, dass NSAIDs in „rezeptfreien“ Medikamenten zur Behandlung von Erkältungen, Fieber oder Schlaflosigkeit enthalten sein können.
Verwendung von NSAIDs und niedrig dosiertem Aspirin
Informieren Sie die Patienten darüber, dass sie kein niedrig dosiertes Aspirin gleichzeitig mit CELEBREX 200 mg anwenden sollen, bis sie mit ihrem Arzt gesprochen haben [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Die Kennzeichnung dieses Produkts wurde möglicherweise aktualisiert. Die neuesten Verschreibungsinformationen finden Sie unter www.pfizer.com.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Celecoxib war nicht karzinogen bei Sprague-Dawley-Ratten, denen orale Dosen von bis zu 200 mg/kg bei Männchen und 10 mg/kg bei Weibchen verabreicht wurden (ungefähr das 2- bis 4-fache der menschlichen Exposition, gemessen anhand der AUC0-24 bei 200 mg zweimal täglich ) oder bei Mäusen, denen zwei Jahre lang orale Dosen von bis zu 25 mg/kg bei Männchen und 50 mg/kg bei Weibchen (ungefähr gleich der menschlichen Exposition, gemessen anhand der AUC0-24 bei 200 mg zweimal täglich) verabreicht wurden.
Mutagenese
Celecoxib war in einem Ames-Test und einem Mutationsassay in Eierstockzellen des Chinesischen Hamsters (CHO) nicht mutagen, noch klastogen in einem Chromosomenaberrationsassay in CHO-Zellen und einem In-vivo-Mikrokerntest im Knochenmark von Ratten.
Beeinträchtigung der Fruchtbarkeit
Celecoxib hatte keine Wirkung auf die männliche oder weibliche Fertilität oder die männliche Fortpflanzungsfunktion bei Ratten in oralen Dosen von bis zu 600 mg/kg/Tag (etwa das 11-Fache der menschlichen Exposition bei 200 mg zweimal täglich, basierend auf der AUC0-24). Bei ≥50 mg/kg/Tag (ungefähr das 6-Fache der Humanexposition basierend auf der AUC0-24 bei 200 mg zweimal täglich) kam es zu einem erhöhten Präimplantationsverlust.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Die Anwendung von NSAIDs, einschließlich CELEBREX 200 mg, kann einen vorzeitigen Verschluss des fetalen Ductus arteriosus und eine fetale Nierenfunktionsstörung verursachen, die zu Oligohydramnion und in einigen Fällen zu einer Nierenfunktionsstörung bei Neugeborenen führt. Begrenzen Sie aufgrund dieser Risiken die Dosis und Dauer der Anwendung von CELEBREX 200 mg zwischen etwa der 20. und 30. Schwangerschaftswoche und vermeiden Sie die Anwendung von CELEBREX in der 30. Schwangerschaftswoche und später in der Schwangerschaft (siehe Klinische Überlegungen, Daten ).
Vorzeitiger Verschluss des fötalen Ductus Arteriosus
Die Anwendung von NSAIDs, einschließlich CELEBREX, etwa in der 30. Schwangerschaftswoche oder später in der Schwangerschaft erhöht das Risiko eines vorzeitigen Verschlusses des fetalen Ductus arteriosus.
Oligohydramnion/Niereninsuffizienz bei Neugeborenen
Die Anwendung von NSAIDs in der 20. Schwangerschaftswoche oder später in der Schwangerschaft wurde mit Fällen von fetaler Nierenfunktionsstörung in Verbindung gebracht, die zu Oligohydramnion und in einigen Fällen zu Nierenfunktionsstörungen bei Neugeborenen führte.
Daten aus Beobachtungsstudien zu anderen potenziellen embryofetalen Risiken der NSAID-Anwendung bei Frauen im ersten oder zweiten Trimenon der Schwangerschaft sind nicht schlüssig. In Reproduktionsstudien an Tieren wurden embryofötale Todesfälle und eine Zunahme von Zwerchfellhernien bei Ratten beobachtet, denen Celecoxib täglich während der Organogenese in oralen Dosen verabreicht wurde, die etwa dem 6-Fachen der maximal empfohlenen Humandosis (MRHD) von 200 mg zweimal täglich entsprachen. Darüber hinaus wurden strukturelle Anomalien (z. B. Septumdefekte, verwachsene Rippen, verwachsene Sternebrae und verformte Sternebrae) bei Kaninchen beobachtet, denen während der Organogenese tägliche orale Dosen von Celecoxib mit etwa dem 2-fachen der MRHD verabreicht wurden (siehe Daten ). Basierend auf Tierdaten wurde gezeigt, dass Prostaglandine eine wichtige Rolle bei der Gefäßpermeabilität des Endometriums, der Blastozystenimplantation und der Dezidualisierung spielen. In Tierversuchen führte die Verabreichung von Prostaglandinsynthesehemmern wie Celecoxib zu einem erhöhten Prä- und Postimplantationsverlust. Es wurde auch gezeigt, dass Prostaglandine eine wichtige Rolle bei der fötalen Nierenentwicklung spielen. In veröffentlichten Tierstudien wurde berichtet, dass Prostaglandinsynthesehemmer die Nierenentwicklung beeinträchtigen, wenn sie in klinisch relevanten Dosen verabreicht werden.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 % bis 4 % bzw. 15 % bis 20 %.
Klinische Überlegungen
Fetale/neonatale Nebenwirkungen
Vorzeitiger Verschluss des fötalen Ductus Arteriosus
Vermeiden Sie die Anwendung von NSAIDs bei Frauen in der 30. Schwangerschaftswoche und später in der Schwangerschaft, da NSAIDs, einschließlich CELEBREX 200 mg, einen vorzeitigen Verschluss des fetalen Ductus arteriosus verursachen können (siehe Daten ).
Oligohydramnion/neonatale Nierenfunktionsstörung:
Wenn ein NSAID etwa in der 20. Schwangerschaftswoche oder später in der Schwangerschaft erforderlich ist, beschränken Sie die Anwendung auf die niedrigste wirksame Dosis und die kürzestmögliche Dauer. Wenn die Behandlung mit CELEBREX länger als 48 Stunden dauert, ist eine Überwachung mit Ultraschall auf Oligohydramnion in Erwägung zu ziehen. Wenn Oligohydramnion auftritt, setzen Sie CELEBREX ab und folgen Sie der klinischen Praxis entsprechend (siehe Daten ).
Arbeit oder Lieferung
Es liegen keine Studien zu den Wirkungen von CELEBREX während der Wehen oder der Geburt vor. In Tierversuchen hemmen NSAIDs, einschließlich Celecoxib, die Prostaglandinsynthese, verursachen verzögerte Geburten und erhöhen die Häufigkeit von Totgeburten.
Daten
Menschliche Daten
Die verfügbaren Daten belegen nicht das Vorhandensein oder Nichtvorhandensein einer Entwicklungstoxizität im Zusammenhang mit der Anwendung von CELEBREX.
Vorzeitiger Verschluss des fötalen Ductus Arteriosus
In der veröffentlichten Literatur wird berichtet, dass die Anwendung von NSAIDs etwa in der 30. Schwangerschaftswoche und später in der Schwangerschaft zu einem vorzeitigen Verschluss des fetalen Ductus arteriosus führen kann.
Oligohydramnion/Niereninsuffizienz bei Neugeborenen
Veröffentlichte Studien und Post-Marketing-Berichte beschreiben die mütterliche Anwendung von NSAIDs etwa in der 20. Schwangerschaftswoche oder später in der Schwangerschaft im Zusammenhang mit fetaler Nierenfunktionsstörung, die zu Oligohydramnion und in einigen Fällen zu Nierenfunktionsstörungen bei Neugeborenen führt. Diese Nebenwirkungen werden im Durchschnitt nach Tagen bis Wochen der Behandlung beobachtet, obwohl Oligohydramnion selten schon 48 Stunden nach Beginn der Behandlung mit NSAR berichtet wurde. In vielen Fällen, aber nicht in allen Fällen, war die Abnahme des Fruchtwassers vorübergehend und nach Absetzen des Medikaments reversibel. Es gab eine begrenzte Anzahl von Fallberichten über die Anwendung von mütterlichen NSAIDs und neonatale Nierenfunktionsstörungen ohne Oligohydramnion, von denen einige irreversibel waren. Einige Fälle von Nierenfunktionsstörungen bei Neugeborenen erforderten eine Behandlung mit invasiven Verfahren wie Austauschtransfusionen oder Dialyse.
Zu den methodischen Einschränkungen dieser Post-Marketing-Studien und -Berichte gehört das Fehlen einer Kontrollgruppe; begrenzte Informationen zu Dosis, Dauer und Zeitpunkt der Arzneimittelexposition; und gleichzeitiger Einnahme anderer Medikamente. Diese Einschränkungen schließen eine verlässliche Schätzung des Risikos unerwünschter fetaler und neonataler Folgen bei mütterlicher NSAID-Nutzung aus. Da die veröffentlichten Sicherheitsdaten zu Folgen bei Neugeborenen hauptsächlich Frühgeborene betrafen, ist die Verallgemeinerbarkeit bestimmter berichteter Risiken für termingeborene Säuglinge, die NSAIDs durch mütterliche Anwendung ausgesetzt waren, ungewiss.
Tierdaten
Celecoxib in oralen Dosen von ≥ 150 mg/kg/Tag (ungefähr das 2-Fache der Humanexposition bei 200 mg zweimal täglich, gemessen anhand der AUC0–24), verursachte eine erhöhte Inzidenz von Ventrikelseptumdefekten, einem seltenen Ereignis, und fötalen Veränderungen, wie z fusionierte Rippen, fusionierte Sternebrae und missgestaltete Sternebrae, wenn Kaninchen während der gesamten Organogenese behandelt wurden. Eine dosisabhängige Zunahme von Zwerchfellhernien wurde beobachtet, wenn Ratten während der gesamten Organogenese Celecoxib in oralen Dosen von ≥ 30 mg/kg/Tag (etwa das 6-Fache der Exposition beim Menschen, basierend auf der AUC 0–24 bei 200 mg zweimal täglich für RA) verabreicht wurde. Bei Ratten führte die Exposition gegenüber Celecoxib während der frühen Embryonalentwicklung zu Prä- und Postimplantationsverlusten bei oralen Dosen von ≥ 50 mg/kg/Tag (ungefähr das 6-Fache der Exposition beim Menschen, basierend auf der AUC 0–24 bei 200 mg zweimal täglich für RA).
Celecoxib führte bei oralen Dosen von bis zu 100 mg/kg bei Ratten (ungefähr 7-fache Humanexposition, gemessen anhand der AUC 0–24 bei 200 mg zweimal täglich) zu keinen Hinweisen auf verzögerte Wehen oder Geburt. Die Auswirkungen von CELEBREX auf Wehen und Geburt bei Schwangeren sind nicht bekannt.
Stillzeit
Zusammenfassung der Risiken
Begrenzte Daten aus 3 veröffentlichten Berichten, die insgesamt 12 stillende Frauen umfassten, zeigten niedrige CELEBREX-Konzentrationen in der Muttermilch. Die berechnete durchschnittliche Tagesdosis für Säuglinge betrug 10 bis 40 mcg/kg/Tag, weniger als 1 % der gewichtsbasierten therapeutischen Dosis für ein zweijähriges Kind. Ein Bericht über zwei gestillte Säuglinge im Alter von 17 und 22 Monaten zeigte keine Nebenwirkungen. Vorsicht ist geboten, wenn CELEBREX 100 mg einer stillenden Frau verabreicht wird. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an CELEBREX und möglichen Nebenwirkungen von CELEBREX 200 mg auf den gestillten Säugling oder von der zugrunde liegenden Erkrankung der Mutter berücksichtigt werden.
Weibchen und Männchen mit reproduktivem Potenzial
Unfruchtbarkeit
Frauen
Basierend auf dem Wirkmechanismus kann die Anwendung von Prostaglandin-vermittelten NSAIDs, einschließlich CELEBREX, das Reißen von Ovarialfollikeln verzögern oder verhindern, was bei einigen Frauen mit reversibler Unfruchtbarkeit in Verbindung gebracht wurde. Veröffentlichte Tierstudien haben gezeigt, dass die Verabreichung von Prostaglandinsynthesehemmern das Potenzial hat, die für den Eisprung erforderliche Prostaglandin-vermittelte Follikelruptur zu stören. Kleine Studien an Frauen, die mit NSAR behandelt wurden, haben auch eine reversible Verzögerung des Eisprungs gezeigt. Erwägen Sie das Absetzen von NSAIDs, einschließlich CELEBREX 200 mg, bei Frauen, die Schwierigkeiten haben, schwanger zu werden, oder die sich einer Untersuchung auf Unfruchtbarkeit unterziehen.
Pädiatrische Verwendung
CELEBREX 200 mg ist zur Linderung der Anzeichen und Symptome der juvenilen rheumatoiden Arthritis bei Patienten ab 2 Jahren zugelassen. Sicherheit und Wirksamkeit wurden bei Kindern nicht über sechs Monate hinaus untersucht. Die kardiovaskuläre Langzeittoxizität bei Kindern, die CELEBREX 100 mg ausgesetzt waren, wurde nicht untersucht, und es ist nicht bekannt, ob die Langzeitrisiken denen ähneln, die bei Erwachsenen beobachtet werden, die CELEBREX oder anderen COX-2-selektiven und nicht-selektiven NSAIDs ausgesetzt wurden [siehe Eingerahmte Warnung , WARNUNGEN UND VORSICHTSMASSNAHMEN , und Klinische Studien ].
Die Anwendung von Celecoxib bei Patienten im Alter von 2 bis 17 Jahren mit pauziartikulärer JRA mit polyartikulärem Verlauf oder bei Patienten mit JRA mit systemischem Beginn wurde in einer 12-wöchigen, doppelblinden, aktiv kontrollierten, pharmakokinetischen, Sicherheits- und Wirksamkeitsstudie mit a 12-wöchige Open-Label-Verlängerung. Celecoxib wurde bei Patienten unter 2 Jahren, bei Patienten mit einem Körpergewicht von weniger als 10 kg (22 lbs) und bei Patienten mit aktiven systemischen Merkmalen nicht untersucht. Patienten mit JRA mit systemischem Beginn (ohne aktive systemische Merkmale) scheinen ein Risiko für die Entwicklung abnormaler Gerinnungslabortests zu haben. Bei einigen Patienten mit systemisch einsetzender JRA waren sowohl Celecoxib als auch Naproxen mit einer leichten Verlängerung der aktivierten partiellen Thromboplastinzeit (APTT), aber nicht der Prothrombinzeit (PT) verbunden. Wenn NSAIDs, einschließlich Celecoxib, bei Patienten mit systemisch einsetzender JRA angewendet werden, sind die Patienten aufgrund des Risikos einer disseminierten intravaskulären Gerinnung auf Anzeichen und Symptome einer anormalen Gerinnung oder Blutung zu überwachen. Patienten mit JRA mit systemischem Beginn sollten auf die Entwicklung abnormaler Gerinnungstests überwacht werden [siehe DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN , NEBENWIRKUNGEN , Tiertoxikologie , Klinische Studien ].
Alternative Therapien zur Behandlung von JRA sollten bei pädiatrischen Patienten in Erwägung gezogen werden, bei denen festgestellt wurde, dass sie langsame CYP2C9-Metabolisierer sind [siehe Schlechte Metabolisierer von CYP2C9-Substraten ].
Geriatrische Verwendung
Ältere Patienten haben im Vergleich zu jüngeren Patienten ein größeres Risiko für NSAID-assoziierte schwerwiegende kardiovaskuläre, gastrointestinale und/oder renale Nebenwirkungen. Wenn der erwartete Nutzen für den älteren Patienten diese potenziellen Risiken überwiegt, beginnen Sie mit der Dosierung am unteren Ende des Dosierungsbereichs und überwachen Sie die Patienten auf Nebenwirkungen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Von der Gesamtzahl der Patienten, die CELEBREX 100 mg in klinischen Studien vor der Zulassung erhielten, waren mehr als 3.300 65–74 Jahre alt, während etwa 1.300 weitere Patienten 75 Jahre und älter waren. Zwischen diesen Probanden und jüngeren Probanden wurden keine wesentlichen Unterschiede in der Wirksamkeit beobachtet. In klinischen Studien, in denen die anhand von GFR, BUN und Kreatinin gemessene Nierenfunktion und anhand der Blutungszeit und der Thrombozytenaggregation gemessene Thrombozytenfunktion verglichen wurden, unterschieden sich die Ergebnisse zwischen älteren und jungen Probanden nicht. Wie bei anderen NSAIDs, einschließlich denen, die COX-2 selektiv hemmen, gab es jedoch nach Markteinführung mehr spontane Berichte über tödliche gastrointestinale Ereignisse und akutes Nierenversagen bei älteren Patienten als bei jüngeren Patienten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Leberfunktionsstörung
Die empfohlene Tagesdosis von CELEBREX-Kapseln bei Patienten mit mäßig eingeschränkter Leberfunktion (Child-Pugh-Klasse B) sollte um 50 % reduziert werden. Die Anwendung von CELEBREX bei Patienten mit schwerer Leberfunktionsstörung wird nicht empfohlen [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
Nierenfunktionsstörung
CELEBREX wird bei Patienten mit schwerer Niereninsuffizienz nicht empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Schlechte Metabolisierer von CYP2C9-Substraten
Bei Patienten, von denen bekannt ist oder vermutet wird, dass sie langsame CYP2C9-Metabolisierer sind (dh CYP2C9*3/*3), verabreichen Sie CELEBREX 200 mg, beginnend mit der Hälfte des niedrigsten Werts, basierend auf dem Genotyp oder der Vorgeschichte/Erfahrung mit anderen CYP2C9-Substraten (wie Warfarin, Phenytoin). empfohlene Dosis. Bei JRA-Patienten, die als langsame CYP2C9-Metabolisierer identifiziert wurden, sollte eine alternative Behandlung in Betracht gezogen werden [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Die Symptome nach einer akuten NSAID-Überdosierung beschränkten sich typischerweise auf Lethargie, Benommenheit, Übelkeit, Erbrechen und epigastrische Schmerzen, die im Allgemeinen mit unterstützender Behandlung reversibel waren. Magen-Darm-Blutungen sind aufgetreten. Bluthochdruck, akutes Nierenversagen, Atemdepression und Koma sind aufgetreten, aber selten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Während klinischer Studien wurden keine Überdosierungen von CELEBREX 200 mg berichtet. Dosen bis zu 2400 mg/Tag für bis zu 10 Tage bei 12 Patienten führten nicht zu schwerwiegender Toxizität. Es liegen keine Informationen zur Entfernung von Celecoxib durch Hämodialyse vor, aber aufgrund seines hohen Grads an Plasmaproteinbindung (>97 %) ist es unwahrscheinlich, dass eine Dialyse bei einer Überdosierung sinnvoll ist.
Behandeln Sie Patienten mit symptomatischer und unterstützender Behandlung nach einer NSAID-Überdosierung. Es gibt keine spezifischen Gegenmittel. Erwägen Sie Erbrechen und/oder Aktivkohle (60 bis 100 Gramm bei Erwachsenen, 1 bis 2 Gramm pro kg Körpergewicht bei pädiatrischen Patienten) und/oder osmotische Abführmittel bei symptomatischen Patienten, die innerhalb von vier Stunden nach der Einnahme beobachtet wurden, oder bei Patienten mit einer starken Überdosierung ( 5- bis 10-fache der empfohlenen Dosierung). Forcierte Diurese, Alkalisierung des Urins, Hämodialyse oder Hämoperfusion sind aufgrund der hohen Proteinbindung möglicherweise nicht sinnvoll.
Wenden Sie sich für weitere Informationen zur Behandlung einer Überdosierung an eine Giftnotrufzentrale (1-800-222-1222).
KONTRAINDIKATIONEN
CELEBREX ist bei folgenden Patienten kontraindiziert:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Celecoxib hat analgetische, entzündungshemmende und fiebersenkende Eigenschaften.
Es wird angenommen, dass der Wirkungsmechanismus von CELEBREX 100 mg auf der Hemmung der Prostaglandinsynthese beruht, hauptsächlich über die Hemmung von COX-2.
Celecoxib ist ein potenter Inhibitor der Prostaglandinsynthese in vitro. Die während der Therapie erreichten Celecoxib-Konzentrationen haben in vivo Wirkungen hervorgerufen. Prostaglandine sensibilisieren afferente Nerven und potenzieren die Wirkung von Bradykinin bei der Schmerzauslösung in Tiermodellen. Prostaglandine sind Entzündungsmediatoren. Da Celecoxib ein Hemmer der Prostaglandinsynthese ist, kann seine Wirkungsweise auf einer Abnahme von Prostaglandinen in peripheren Geweben beruhen.
Pharmakodynamik
Blutplättchen
In klinischen Studien mit normalen Probanden hatte CELEBREX in Einzeldosen von bis zu 800 mg und Mehrfachdosen von 600 mg zweimal täglich für eine Dauer von bis zu 7 Tagen (höher als die empfohlenen therapeutischen Dosen) keine Wirkung auf die Verringerung der Thrombozytenaggregation oder die Verlängerung der Blutungszeit. Aufgrund seiner fehlenden Thrombozytenwirkung ist CELEBREX 100 mg kein Ersatz für Aspirin zur Herz-Kreislauf-Prophylaxe. Es ist nicht bekannt, ob CELEBREX Auswirkungen auf die Blutplättchen hat, die zu dem erhöhten Risiko schwerwiegender kardiovaskulärer thrombotischer Nebenwirkungen im Zusammenhang mit der Anwendung von CELEBREX beitragen könnten.
Flüssigkeitsretention
Die Hemmung der PGE2-Synthese kann durch erhöhte Reabsorption in der dicken aufsteigenden Henle-Schleife des Nierenmarks und möglicherweise in anderen Segmenten des distalen Nephrons zu einer Natrium- und Wasserretention führen. In den Sammelrohren scheint PGE2 die Wasserresorption zu hemmen, indem es der Wirkung des antidiuretischen Hormons entgegenwirkt.
Pharmakokinetik
Celecoxib zeigt nach oraler Gabe von bis zu 200 mg zweimal täglich einen dosisproportionalen Anstieg der Exposition und einen unterproportionalen Anstieg bei höheren Dosen. Es hat eine umfassende Verteilung und eine hohe Proteinbindung. Es wird hauptsächlich durch CYP2C9 mit einer Halbwertszeit von etwa 11 Stunden metabolisiert.
Absorption
Maximale Plasmaspiegel von Celecoxib treten etwa 3 Stunden nach einer oralen Dosis auf. Unter nüchternen Bedingungen sind sowohl die maximalen Plasmaspiegel (Cmax) als auch die Fläche unter der Kurve (AUC) bis zu 200 mg zweimal täglich ungefähr dosisproportional; bei höheren Dosen kommt es zu einem unterproportionalen Anstieg von Cmax und AUC (vgl Auswirkungen auf Lebensmittel ). Studien zur absoluten Bioverfügbarkeit wurden nicht durchgeführt. Bei Mehrfachdosierung werden Steady-State-Bedingungen an oder vor Tag 5 erreicht. Die pharmakokinetischen Parameter von Celecoxib bei einer Gruppe gesunder Probanden sind in Tabelle 4 dargestellt.
Auswirkungen auf Lebensmittel
Wenn CELEBREX 200 mg Kapseln zusammen mit einer fettreichen Mahlzeit eingenommen wurden, verzögerten sich die maximalen Plasmaspiegel um etwa 1 bis 2 Stunden mit einem Anstieg der Gesamtresorption (AUC) um 10 % bis 20 %. Unter nüchternen Bedingungen kommt es bei Dosen über 200 mg zu einem weniger als proportionalen Anstieg von Cmax und AUC, was vermutlich auf die geringe Löslichkeit des Arzneimittels in wässrigen Medien zurückzuführen ist.
Die gleichzeitige Anwendung von CELEBREX mit aluminium- und magnesiumhaltigen Antazida führte zu einer Verringerung der Celecoxib-Plasmakonzentrationen mit einer Verringerung der Cmax um 37 % und der AUC um 10 %. CELEBREX kann in Dosierungen von bis zu 200 mg zweimal täglich unabhängig vom Zeitpunkt der Mahlzeiten verabreicht werden. Höhere Dosen (400 mg zweimal täglich) sollten zusammen mit Nahrung verabreicht werden, um die Resorption zu verbessern.
Bei gesunden erwachsenen Probanden war die systemische Gesamtexposition (AUC) von Celecoxib äquivalent, wenn Celecoxib als intakte Kapsel oder auf Apfelmus gestreuter Kapselinhalt verabreicht wurde. Es gab keine signifikanten Veränderungen von Cmax, Tmax oder t½ nach Verabreichung von Kapselinhalten auf Apfelmus [siehe DOSIERUNG UND ANWENDUNG ].
Verteilung
Bei gesunden Probanden wird Celecoxib innerhalb des klinischen Dosisbereichs stark an Proteine gebunden (~97 %). In-vitro-Studien weisen darauf hin, dass Celecoxib hauptsächlich an Albumin und in geringerem Maße an α-saures Glykoprotein bindet. Das scheinbare Verteilungsvolumen im Steady State (V/F) beträgt etwa 400 l, was auf eine ausgedehnte Verteilung in die Gewebe hindeutet. Celecoxib wird nicht bevorzugt an rote Blutkörperchen gebunden.
Beseitigung
Stoffwechsel
Die Metabolisierung von Celecoxib wird hauptsächlich über CYP2C9 vermittelt. Drei Metaboliten, ein primärer Alkohol, die entsprechende Carbonsäure und ihr Glucuronid-Konjugat, wurden im menschlichen Plasma identifiziert. Diese Metaboliten sind als COX-1- oder COX-2-Hemmer inaktiv.
Ausscheidung
Celecoxib wird überwiegend über die Leber eliminiert, wobei wenig (
Spezifische Populationen
Geriatrie
Im Steady State hatten ältere Probanden (über 65 Jahre) im Vergleich zu jungen Probanden eine um 40 % höhere Cmax und eine um 50 % höhere AUC. Bei älteren Frauen sind die Cmax und AUC von Celecoxib höher als bei älteren Männern, aber diese Anstiege sind hauptsächlich auf das niedrigere Körpergewicht bei älteren Frauen zurückzuführen. Eine Dosisanpassung bei älteren Patienten ist im Allgemeinen nicht erforderlich. Bei Patienten mit einem Körpergewicht von weniger als 50 kg sollte die Therapie jedoch mit der niedrigsten empfohlenen Dosis eingeleitet werden [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Pädiatrie
Die Steady-State-Pharmakokinetik von Celecoxib, verabreicht als Prüfsuspension zum Einnehmen, wurde bei 152 JRA-Patienten im Alter von 2 bis 17 Jahren mit einem Körpergewicht von ≥ 10 kg mit pauziartikulärem oder polyartikulär verlaufendem JRA und bei Patienten mit JRA mit systemischem Ausbruch untersucht. Populationspharmakokinetische Analysen zeigten, dass die orale Clearance (nicht angepasst an das Körpergewicht) von Celecoxib weniger als proportional zur Gewichtszunahme ansteigt, wobei bei Patienten mit 10 kg und 25 kg eine um 40 % bzw Geduldig.
Die zweimal tägliche Verabreichung von 50-mg-Kapseln an JRA-Patienten mit einem Gewicht von ≥ 12 bis ≤ 25 kg und von 100-mg-Kapseln an JRA-Patienten mit einem Gewicht von > 25 kg sollte Plasmakonzentrationen ähnlich denen erreichen, die in einer klinischen Studie beobachtet wurden, die die Nicht-Unterlegenheit von Celecoxib demonstrierte Naproxen 7,5 mg/kg zweimal täglich [siehe DOSIERUNG UND ANWENDUNG ]. Celecoxib wurde bei JRA-Patienten unter 2 Jahren, bei Patienten mit einem Körpergewicht von weniger als 10 kg (22 lbs) oder über 24 Wochen nicht untersucht.
Wettrennen
Meta-Analysen pharmakokinetischer Studien deuten auf eine etwa 40 % höhere AUC von Celecoxib bei Schwarzen im Vergleich zu Kaukasiern hin. Die Ursache und klinische Bedeutung dieses Befundes ist unbekannt.
Leberfunktionsstörung
Eine pharmakokinetische Studie an Probanden mit leichter (Child-Pugh-Klasse A) und mittelschwerer (Child-Pugh-Klasse B) Leberfunktionsstörung hat gezeigt, dass die AUC von Celecoxib im Steady-State um etwa 40 % bzw. 180 % über derjenigen bei gesunden Kontrollpersonen erhöht ist Themen. Daher sollte die empfohlene Tagesdosis von CELEBREX-Kapseln bei Patienten mit mäßig eingeschränkter Leberfunktion (Child-Pugh-Klasse B) um etwa 50 % reduziert werden. Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klasse C) wurden nicht untersucht. Die Anwendung von CELEBREX bei Patienten mit schwerer Leberfunktionsstörung wird nicht empfohlen [siehe DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ].
Nierenfunktionsstörung
In einem studienübergreifenden Vergleich war die AUC von Celecoxib bei Patienten mit chronischer Niereninsuffizienz (GFR 35–60 ml/min) etwa 40 % niedriger als bei Patienten mit normaler Nierenfunktion. Es wurde kein signifikanter Zusammenhang zwischen der GFR und der Celecoxib-Clearance gefunden. Patienten mit schwerer Niereninsuffizienz wurden nicht untersucht. Ähnlich wie andere NSAIDs wird CELEBREX 200 mg bei Patienten mit schwerer Niereninsuffizienz nicht empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Arzneimittelwechselwirkungsstudien
In-vitro-Studien weisen darauf hin, dass Celecoxib kein Inhibitor von Cytochrom P450 2C9, 2C19 oder 3A4 ist.
In-vivo-Studien haben Folgendes gezeigt:
Aspirin
Wenn NSAIDs mit Aspirin verabreicht wurden, wurde die Proteinbindung von NSAIDs reduziert, obwohl die Clearance von freiem NSAID nicht verändert wurde. Die klinische Bedeutung dieser Wechselwirkung ist nicht bekannt. Siehe Tabelle 3 für klinisch signifikante Arzneimittelwechselwirkungen von NSAIDs mit Aspirin [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Lithium
In einer an gesunden Probanden durchgeführten Studie stiegen die mittleren Steady-State-Lithiumplasmaspiegel bei Probanden, die zweimal täglich 450 mg Lithium mit CELEBREX 200 mg zweimal täglich erhielten, im Vergleich zu Probanden, die Lithium allein erhielten, um etwa 17 % an [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Fluconazol
Die gleichzeitige Gabe von 200 mg Fluconazol einmal täglich führte zu einer zweifachen Erhöhung der Plasmakonzentration von Celecoxib. Dieser Anstieg ist auf die Hemmung des Celecoxib-Metabolismus über P450 2C9 durch Fluconazol zurückzuführen [ vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Andere Drogen
Die Wirkungen von Celecoxib auf die Pharmakokinetik und/oder Pharmakodynamik von Glyburid, Ketoconazol, [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ], Phenytoin und Tolbutamid wurden in vivo untersucht, und es wurden keine klinisch bedeutsamen Wechselwirkungen gefunden.
Pharmakogenomik
Die CYP2C9-Aktivität ist bei Personen mit genetischen Polymorphismen reduziert, die zu einer reduzierten Enzymaktivität führen, wie z. B. bei Personen, die homozygot für die CYP2C9*2- und CYP2C9*3-Polymorphismen sind. Begrenzte Daten aus 4 veröffentlichten Berichten, die insgesamt 8 Probanden mit dem homozygoten CYP2C9*3/*3-Genotyp umfassten, zeigten, dass die systemischen Celecoxib-Spiegel bei diesen Probanden 3- bis 7-fach höher waren als bei Probanden mit CYP2C9*1/*1 oder * I/*3 Genotypen. Die Pharmakokinetik von Celecoxib wurde bei Patienten mit anderen CYP2C9-Polymorphismen wie *2, *5, *6, *9 und *11 nicht untersucht. Es wird geschätzt, dass die Häufigkeit des homozygoten *3/*3-Genotyps in verschiedenen ethnischen Gruppen 0,3 % bis 1,0 % beträgt [vgl DOSIERUNG UND ANWENDUNG , Verwendung in bestimmten Bevölkerungsgruppen ].
Tiertoxikologie
Bei der juvenilen Ratte wurde eine erhöhte Inzidenz von Hintergrundbefunden von Spermatozelen mit oder ohne sekundäre Veränderungen wie Epididymalhy pospermia sowie eine minimale bis leichte Dilatation der Hodenkanälchen beobachtet. Obwohl diese reproduktiven Befunde offensichtlich mit der Behandlung in Zusammenhang standen, nahmen die Inzidenz oder der Schweregrad mit der Dosis nicht zu und können auf eine Exazerbation eines spontanen Zustands hinweisen. Ähnliche Reproduktionsbefunde wurden in Studien an juvenilen oder erwachsenen Hunden oder an mit Celecoxib behandelten erwachsenen Ratten nicht beobachtet. Die klinische Bedeutung dieser Beobachtung ist nicht bekannt.
Klinische Studien
Arthrose
CELEBREX 200 mg hat im Vergleich zu Placebo eine signifikante Verringerung der Gelenkschmerzen gezeigt. CELEBREX wurde zur Behandlung der Anzeichen und Symptome von Knie- und Hüftgelenksarthrose in placebo- und wirkstoffkontrollierten klinischen Studien mit einer Dauer von bis zu 12 Wochen untersucht. Bei Patienten mit OA führte die Behandlung mit CELEBREX 100 mg zweimal täglich oder 200 mg einmal täglich zu einer Verbesserung des WOMAC (Western Ontario und McMaster Universities) Osteoarthritis-Index, einer Zusammensetzung aus Schmerzen, Steifheit und funktionellen Messungen bei OA. In drei 12-wöchigen Studien zu Schmerzen, die mit OA-Schüben einhergingen, bewirkten CELEBREX 100-mg-Dosen von 100 mg zweimal täglich und 200 mg zweimal täglich eine signifikante Schmerzlinderung innerhalb von 24 bis 48 Stunden nach Behandlungsbeginn. Bei Dosen von 100 mg zweimal täglich oder 200 mg zweimal täglich wurde gezeigt, dass die Wirksamkeit von CELEBREX 200 mg der von Naproxen 500 mg zweimal täglich ähnlich ist. Dosen von 200 mg zweimal täglich brachten keinen zusätzlichen Nutzen über den hinaus, der bei 100 mg zweimal täglich beobachtet wurde. Es hat sich gezeigt, dass eine tägliche Gesamtdosis von 200 mg gleich wirksam ist, unabhängig davon, ob sie als 100 mg zweimal täglich oder 200 mg einmal täglich verabreicht wird.
Rheumatoide Arthritis
CELEBREX hat im Vergleich zu Placebo eine signifikante Verringerung von Gelenkempfindlichkeit/-schmerzen und Gelenkschwellungen gezeigt. CELEBREX 100 mg wurde zur Behandlung der Anzeichen und Symptome von RA in Placebo- und aktiv kontrollierten klinischen Studien mit einer Dauer von bis zu 24 Wochen untersucht. CELEBREX erwies sich in diesen Studien unter Verwendung des ACR20-Responder-Index, einer Zusammenstellung klinischer, Labor- und funktioneller Messungen bei RA, als überlegen gegenüber Placebo. CELEBREX-Dosen von 100 mg zweimal täglich und 200 mg zweimal täglich waren in der Wirksamkeit ähnlich und beide waren vergleichbar mit Naproxen 500 mg zweimal täglich.
Obwohl CELEBREX 100 mg zweimal täglich und 200 mg zweimal täglich eine ähnliche Gesamtwirksamkeit aufwiesen, zogen einige Patienten einen zusätzlichen Nutzen aus der Dosis von 200 mg zweimal täglich. Dosen von 400 mg zweimal täglich brachten keinen zusätzlichen Nutzen über den hinaus, der bei 100 mg bis 200 mg zweimal täglich beobachtet wurde.
Juvenile rheumatoide Arthritis (NCT00652925)
In einer 12-wöchigen, randomisierten, doppelblinden, aktiv kontrollierten, multizentrischen Parallelgruppen-Nichtunterlegenheitsstudie wurden Patienten im Alter von 2 bis 17 Jahren mit pauziartikulärer JRA mit polyartikulärem Verlauf oder JRA mit systemischem Beginn (mit derzeit inaktiven systemischen Merkmalen) untersucht ), erhielt eine der folgenden Behandlungen: Celecoxib 3 mg/kg (bis maximal 150 mg) zweimal täglich; Celecoxib 6 mg/kg (bis maximal 300 mg) zweimal täglich; oder Naproxen 7,5 mg/kg (bis maximal 500 mg) zweimal täglich. Die Ansprechraten basierten auf dem Kriterium der JRA-Definition einer Verbesserung größer oder gleich 30 % (JRA DOI 30), das sich aus klinischen, Labor- und funktionellen JRA-Maßnahmen zusammensetzt. Die JRA-DOI-30-Ansprechraten in Woche 12 betrugen 69 %, 80 % bzw. 67 % in den Behandlungsgruppen mit Celecoxib 3 mg/kg zweimal täglich, Celecoxib 6 mg/kg zweimal täglich bzw. Naproxen 7,5 mg/kg zweimal täglich.
Die Wirksamkeit und Sicherheit von CELEBREX 100 mg bei JRA wurde nicht länger als sechs Monate untersucht. Die kardiovaskuläre Langzeittoxizität bei Kindern, die CELEBREX 200 mg ausgesetzt waren, wurde nicht untersucht, und es ist nicht bekannt, ob das Langzeitrisiko ähnlich dem bei Erwachsenen ist, die CELEBREX 100 mg oder anderen COX-2-selektiven und nicht-selektiven NSAIDs ausgesetzt waren. sehen Eingerahmte Warnung , WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Spondylitis ankylosans
CELEBREX wurde bei AS-Patienten in zwei placebo- und aktivkontrollierten klinischen Studien mit einer Dauer von 6 und 12 Wochen untersucht. CELEBREX in Dosierungen von 100 mg zweimal täglich, 200 mg einmal täglich und 400 mg einmal täglich erwies sich in diesen Studien in allen drei co-primären Wirksamkeitsparametern, die die allgemeine Schmerzintensität (visuelle Analogskala) und die globale Krankheitsaktivität bewerteten, als statistisch überlegen gegenüber Placebo (visuelle Analogskala) und funktionelle Beeinträchtigung (Bath Ankylosing Spondylitis Functional Index). In der 12-wöchigen Studie gab es keinen Unterschied im Ausmaß der Verbesserung zwischen den 200-mg-Dosen von 200 mg und 400 mg CELEBREX im Vergleich der mittleren Veränderung gegenüber dem Ausgangswert, aber es gab einen größeren Prozentsatz von Patienten, die auf CELEBREX 400 mg ansprachen, 53 %, als CELEBREX 200 mg, 44 %, unter Verwendung der Bewertungskriterien für das Ansprechen auf ankylosierende Spondylitis (ASAS20). Der ASAS 20 definiert einen Responder als eine Verbesserung gegenüber dem Ausgangswert von mindestens 20 % und eine absolute Verbesserung von mindestens 10 mm auf einer Skala von 0 mm bis 100 mm in mindestens drei der vier folgenden Bereiche: globale Schmerzen des Patienten, Bath Spondylitis ankylosans Funktionsindex und Entzündung. Die Responderanalyse zeigte auch über 6 Wochen hinaus keine Veränderung der Responderraten.
Analgesie, einschließlich primärer Dysmenorrhoe
In akuten Analgetikamodellen für postorale chirurgische Schmerzen, postorthopädische chirurgische Schmerzen und primäre Dysmenorrhoe linderte CELEBREX 100 mg Schmerzen, die von Patienten als mäßig bis schwer eingestuft wurden. Einzeldosen [vgl DOSIERUNG UND ANWENDUNG ] von CELEBREX 200 mg bewirkte eine Schmerzlinderung innerhalb von 60 Minuten.
Studie zu kardiovaskulären Ergebnissen: Prospektive randomisierte Bewertung der integrierten Sicherheit von Celecoxib im Vergleich zu Ibuprofen oder Naproxen (PRECISION; NCT00346216)
Entwurf
Die PRECISION-Studie war eine doppelblinde, randomisierte, kontrollierte Studie zur kardiovaskulären Sicherheit bei OA- und RA-Patienten mit oder mit hohem Risiko für kardiovaskuläre Erkrankungen, in der Celecoxib mit Naproxen und Ibuprofen verglichen wurde. Die Patienten wurden randomisiert einer Anfangsdosis von 100 mg Celecoxib zweimal täglich, 600 mg Ibuprofen dreimal täglich oder 375 mg Naproxen zweimal täglich zugeteilt, mit der Möglichkeit, die Dosis je nach Bedarf zur Schmerzbehandlung zu steigern. Basierend auf den angegebenen Dosen konnte die Dosis von OA-Patienten, die randomisiert Celecoxib erhielten, nicht erhöht werden.
Der primäre Endpunkt, die Antiplatelet Trialists' Collaboration (APTC) Composite, war ein unabhängig beurteilter Composite aus kardiovaskulärem Tod (einschließlich hämorrhagischem Tod), nicht-tödlichem Myokardinfarkt und nicht-tödlichem Schlaganfall mit 80 % Aussagekraft zur Bewertung der Nicht-Unterlegenheit. Allen Patienten wurde unverblindet Esomeprazol (20–40 mg) zum Magenschutz verschrieben. Die Randomisierung der Behandlung wurde nach niedrig dosiertem Aspirin-Einsatz zu Studienbeginn stratifiziert.
Darüber hinaus gab es eine 4-monatige Unterstudie, in der die Wirkungen der drei Medikamente auf den Blutdruck, gemessen durch ambulantes Monitoring, bewertet wurden.
Ergebnisse
Unter den Patienten mit OA eskalierten nur 0,2 % (17/7259) Celecoxib auf die Dosis von 200 mg zweimal täglich, während 54,7 % (3946/7208) Ibuprofen auf 800 mg dreimal täglich eskalierten und 54,8 % (3937/7178) Naproxen eskalierten auf die Dosis von 500 mg zweimal täglich. Unter den Patienten mit RA eskalierten 55,7 % (453/813) Celecoxib auf die Dosis von 200 mg zweimal täglich, 56,5 % (470/832) eskalierten Ibuprofen auf 800 mg dreimal täglich und 54,6 % (432/791) eskalierten auf Naproxen 500 mg zweimal tägliche Dosis; die RA-Population machte jedoch nur 10 % der Studienpopulation aus.
Da insgesamt relativ wenige Celecoxib-Patienten (5,8 % [470/8072]) die Dosis auf 200 mg zweimal täglich eskalierten, sind die Ergebnisse der PRECISION-Studie nicht geeignet, um die relative kardiovaskuläre Sicherheit von Celecoxib bei 200 mg zweimal täglich im Vergleich zu Ibuprofen zu bestimmen Naproxen in den eingenommenen Dosen.
Primärer Endpunkt
Die Studie hatte zwei vordefinierte Analysepopulationen:
Celecoxib in der Dosis von 100 mg zweimal täglich erfüllte im Vergleich zu entweder Naproxen oder Ibuprofen in den eingenommenen Dosen alle vier vordefinierten Nicht-Unterlegenheitskriterien (p
Die primären Analyseergebnisse für ITT und mITT sind in Tabelle 5 beschrieben.
In der ITT-Analysepopulation über 30 Monate betrug die Gesamtmortalität 1,6 % in der Celecoxib-Gruppe, 1,8 % in der Ibuprofen-Gruppe und 2,0 % in der Naproxen-Gruppe.
Unterstudie zur ambulanten Blutdrucküberwachung (ABPM).
In der Unterstudie PRECISION-ABPM senkte bei den insgesamt 444 auswertbaren Patienten in Monat 4 Celecoxib in einer Dosis von 100 mg zweimal täglich den mittleren systolischen 24-Stunden-Blutdruck (SBP) um 0,3 mmHg, während Ibuprofen und Naproxen in den eingenommenen Dosen zunahmen mittlerer 24-Stunden-SBP um 3,7 bzw. 1,6 mmHg. Diese Veränderungen führten zu einem statistisch signifikanten und klinisch bedeutsamen Unterschied von 3,9 mmHg (p = 0,0009) zwischen Celecoxib und Ibuprofen und einem statistisch nicht signifikanten Unterschied von 1,8 (p = 0,119) mmHg zwischen Celecoxib und Naproxen.
Spezielle Studien
Studien zur Prävention adenomatöser Polypen (NCT00005094 und NCT00141193)
Die kardiovaskuläre Sicherheit wurde in zwei randomisierten, doppelblinden, placebokontrollierten Dreijahresstudien mit Patienten mit sporadischen adenomatösen Polypen, die mit CELEBREX behandelt wurden, bewertet: der APC-Studie (Adenoma Prevention with Celecoxib) und der PreSAP-Studie (Prevention of Spontaneous Adenomatous Polyps). . In der APC-Studie gab es einen dosisabhängigen Anstieg des kombinierten Endpunkts (adjudiziert) aus kardiovaskulärem Tod, Myokardinfarkt oder Schlaganfall unter Celecoxib im Vergleich zu Placebo über eine Behandlungsdauer von 3 Jahren. Die PreSAP-Studie zeigte kein statistisch signifikant erhöhtes Risiko für denselben zusammengesetzten Endpunkt (adjudiziert):
Klinische Studien mit anderen COX-2-selektiven und nicht-selektiven NSAIDs mit einer Dauer von bis zu drei Jahren haben ein erhöhtes Risiko für schwerwiegende kardiovaskuläre thrombotische Ereignisse, Myokardinfarkt und Schlaganfall gezeigt, die tödlich sein können. Daher gelten alle NSAIDs als potenziell mit diesem Risiko verbunden.
Celecoxib-Langzeit-Arthritis-Sicherheitsstudie (KLASSE)
Dies war eine prospektive, langfristige Sicherheitsstudie, die nach Markteinführung an etwa 5.800 OA-Patienten und 2.200 RA-Patienten durchgeführt wurde. Die Patienten erhielten CELEBREX 400 mg zweimal täglich (das 4-fache bzw. 2-fache der empfohlenen OA- bzw. RA-Dosen), Ibuprofen 800 mg dreimal täglich oder Diclofenac 75 mg zweimal täglich (übliche therapeutische Dosen). Die mediane Exposition für CELEBREX (n = 3.987) und Diclofenac (n = 1.996) betrug 9 Monate, während Ibuprofen (n = 1.985) 6 Monate betrug. Der primäre Endpunkt dieser Ergebnisstudie war die Inzidenz komplizierter Geschwüre (gastrointestinale Blutungen, Perforationen oder Obstruktionen). Die Patienten durften gleichzeitig niedrig dosiertes (≤ 325 mg/Tag) Aspirin (ASS) zur kardiovaskulären Prophylaxe einnehmen (ASS-Untergruppen: CELEBREX, n = 882; Diclofenac, n = 445; Ibuprofen, n = 412). Unterschiede in der Inzidenz komplizierter Geschwüre zwischen CELEBREX 200 mg und der kombinierten Gruppe aus Ibuprofen und Diclofenac waren statistisch nicht signifikant.
Bei Patienten, die CELEBREX und gleichzeitig niedrig dosiertes ASS (n = 882) erhielten, kam es im Vergleich zu Patienten ohne ASS (n = 3.105) zu einer 4-fach höheren Rate an komplizierten Geschwüren. Die Kaplan-Meier-Rate für komplizierte Geschwüre nach 9 Monaten betrug 1,12 % gegenüber 0,32 % für diejenigen, die niedrig dosiertes ASS erhielten bzw. diejenigen, die kein ASS erhielten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die geschätzten kumulativen Raten von komplizierten und symptomatischen Geschwüren nach 9 Monaten für Patienten, die mit CELEBREX 400 mg zweimal täglich behandelt wurden, sind in Tabelle 7 beschrieben. Tabelle 7 zeigt auch Ergebnisse für Patienten unter oder über 65 Jahren. Der Unterschied in den Raten zwischen CELEBREX 200 mg allein und CELEBREX 100 mg bei ASS-Gruppen kann auf das höhere Risiko für gastrointestinale Ereignisse bei ASS-Anwendern zurückzuführen sein.
Bei einer kleinen Anzahl von Patienten mit Ulkuserkrankungen in der Vorgeschichte betrug die Rate an komplizierten und symptomatischen Ulzera bei Patienten, die CELEBREX 100 mg allein oder CELEBREX 100 mg mit ASS einnahmen, 2,56 % (n = 243) bzw. 6,85 % (n = 91). 48 Wochen. Diese Ergebnisse sind bei Patienten mit Ulkuserkrankungen in der Vorgeschichte zu erwarten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ].
Die Ergebnisse der kardiovaskulären Sicherheit wurden in der CLASS-Studie ebenfalls bewertet. Die kumulativen Kaplan-Meier-Raten für vom Prüfarzt berichtete schwerwiegende kardiovaskuläre thromboembolische unerwünschte Ereignisse (einschließlich Herzinfarkt, Lungenembolie, tiefe Venenthrombose, instabile Angina pectoris, transitorische ischämische Attacken und ischämische Schlaganfälle) zeigten keine Unterschiede zwischen der Behandlung mit CELEBREX 200 mg, Diclofenac oder Ibuprofen Gruppen. Die kumulativen Raten bei allen Patienten nach neun Monaten für CELEBREX, Diclofenac und Ibuprofen betrugen 1,2 %, 1,4 % bzw. 1,1 %. Die kumulierten Raten bei Nicht-ASA-Anwendern betrugen nach neun Monaten in jeder der drei Behandlungsgruppen weniger als 1 %. Die kumulierten Myokardinfarktraten bei Nicht-ASA-Anwendern nach neun Monaten in jeder der drei Behandlungsgruppen betrugen weniger als 0,2 %. In der CLASS-Studie gab es keine Placebogruppe, was die Möglichkeit einschränkt festzustellen, ob die drei getesteten Medikamente kein erhöhtes Risiko für kardiovaskuläre Ereignisse hatten oder ob sie alle das Risiko in ähnlichem Maße erhöhten. In der CLASS-Studie wurden die kumulativen Kaplan-Meier-Raten von peripheren Ödemen nach 9 Monaten bei Patienten unter CELEBREX 400 mg zweimal täglich (das 4-fache bzw. 2-fache der empfohlenen OA- bzw. RA-Dosen), Ibuprofen 800 mg dreimal täglich und Diclofenac 75 mg zweimal täglich betrug 4,5 %, 6,9 % bzw. 4,7 %. Die Bluthochdruckraten aus der CLASS-Studie bei den mit CELEBREX, Ibuprofen und Diclofenac behandelten Patienten betrugen 2,4 %, 4,2 % bzw. 2,5 %.
Endoskopische Studien
Die Korrelation zwischen den Ergebnissen endoskopischer Kurzzeitstudien mit CELEBREX und der relativen Inzidenz klinisch signifikanter schwerwiegender Ereignisse im oberen Gastrointestinaltrakt bei Langzeitanwendung wurde nicht nachgewiesen. Schwerwiegende klinisch signifikante Blutungen im oberen Gastrointestinaltrakt wurden bei Patienten beobachtet, die CELEBREX 100 mg in kontrollierten und offenen Studien erhielten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Klinische Studien ].
Es wurde eine randomisierte, doppelblinde Studie mit 430 RA-Patienten durchgeführt, in der nach 6 Monaten eine endoskopische Untersuchung durchgeführt wurde. Die Inzidenz endoskopischer Ulzera bei Patienten, die CELEBREX 200 mg zweimal täglich einnahmen, betrug 4 % gegenüber 15 % bei Patienten, die Diclofenac SR 75 mg zweimal täglich einnahmen. Allerdings unterschied sich CELEBREX in der CLASS-Studie in Bezug auf klinisch relevante GI-Ergebnisse statistisch nicht von Diclofenac [siehe Klinische Studien ].
Die Inzidenz endoskopischer Ulzera wurde in zwei 12-wöchigen placebokontrollierten Studien an 2157 OA- und RA-Patienten untersucht, bei denen endoskopische Ausgangsuntersuchungen keine Ulzera zeigten. Es gab keine Dosisbeziehung zwischen der Inzidenz von Magen-Duodeni-Geschwüren und der CELEBREX-Dosis (50 mg bis 400 mg zweimal täglich). Die Inzidenz für Naproxen 500 mg zweimal täglich betrug in den beiden Studien 16,2 % und 17,6 %, für Placebo 2,0 % und 2,3 %, und für alle CELEBREX-Dosen lag die Inzidenz zwischen 2,7 % und 5,9 %. Es gab keine großen klinischen Ergebnisstudien zum Vergleich klinisch relevanter GI-Ergebnisse mit CELEBREX und Naproxen.
In den endoskopischen Studien nahmen ungefähr 11 % der Patienten Aspirin (≤ 325 mg/Tag) ein. In den CELEBREX-Gruppen schien die Rate endoskopischer Geschwüre bei Aspirin-Anwendern höher zu sein als bei Nicht-Anwendern. Allerdings war die erhöhte Ulkusrate bei diesen Aspirin-Anwendern geringer als die endoskopische Ulkusrate, die in den aktiven Vergleichsgruppen mit oder ohne Aspirin beobachtet wurde.
INFORMATIONEN ZUM PATIENTEN
Medikationsleitfaden für nichtsteroidale Antirheumatika (NSAIDs)
Was sind die wichtigsten Informationen, die ich über sogenannte nichtsteroidale Antirheumatika (NSAIDs) wissen sollte?
NSAIDs können schwerwiegende Nebenwirkungen haben, einschließlich:
Nehmen Sie NSAIDs nicht direkt vor oder nach einer Herzoperation ein, die als „Koronararterien-Bypass-Transplantation (CABG)“ bezeichnet wird. Vermeiden Sie die Einnahme von NSAIDs nach einem kürzlich erlittenen Herzinfarkt, es sei denn, Ihr medizinischer Betreuer sagt es Ihnen. Sie haben möglicherweise ein erhöhtes Risiko für einen weiteren Herzinfarkt, wenn Sie NSAIDs nach einem kürzlich erlittenen Herzinfarkt einnehmen.
Was sind NSAIDs?
NSAIDs werden zur Behandlung von Schmerzen und Rötungen, Schwellungen und Hitze (Entzündung) aufgrund von Erkrankungen wie verschiedenen Arten von Arthritis, Menstruationsbeschwerden und anderen Arten von kurzfristigen Schmerzen eingesetzt.
Wer sollte keine NSAIDs einnehmen?
Nehmen Sie keine NSAIDs ein:
Informieren Sie vor der Einnahme von NSAIDs Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger oder rezeptfreier Arzneimittel, Vitamine oder pflanzlicher Nahrungsergänzungsmittel. NSAIDs und einige andere Arzneimittel können miteinander interagieren und schwerwiegende Nebenwirkungen verursachen. Beginnen Sie nicht mit der Einnahme eines neuen Arzneimittels, ohne vorher mit Ihrem Arzt gesprochen zu haben.
Welche Nebenwirkungen können NSAIDs haben?
NSAIDs können schwerwiegende Nebenwirkungen haben, einschließlich:
Siehe „Was sind die wichtigsten Informationen, die ich über sogenannte nichtsteroidale Antirheumatika (NSAIDs) wissen sollte?
Andere Nebenwirkungen von NSAIDs sind: Magenschmerzen, Verstopfung, Durchfall, Blähungen, Sodbrennen, Übelkeit, Erbrechen und Schwindel.
Holen Sie sofort Hilfe, wenn Sie eines der folgenden Symptome bemerken:
Brechen Sie die Einnahme Ihres NSAID ab und rufen Sie sofort Ihren Arzt an, wenn Sie eines der folgenden Symptome bemerken:
Wenn Sie zu viel von Ihrem NSAID eingenommen haben, rufen Sie Ihren Arzt an oder holen Sie sich sofort medizinische Hilfe.
Dies sind nicht alle möglichen Nebenwirkungen von NSAIDs. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker nach NSAIDs.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Weitere Informationen zu NSAIDs
Allgemeine Informationen zur sicheren und wirksamen Anwendung von NSAIDs
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie NSAIDs nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie NSAIDs nicht an andere Personen, selbst wenn sie die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Wenn Sie weitere Informationen zu NSAIDs wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Apotheker oder Gesundheitsdienstleister um Informationen über NSAIDs bitten, die für medizinisches Fachpersonal geschrieben sind.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.