Maxalt 5mg, 10mg Rizatriptan Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Maxalt und wie wird es angewendet?
Maxalt ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Migränekopfschmerzen. Maxalt 10 mg kann allein oder mit anderen Medikamenten verwendet werden.
Maxalt gehört zu einer Klasse von Arzneimitteln, die Serotonin-5-HT-Rezeptor-Agonisten genannt werden; Antimigränemittel.
Es ist nicht bekannt, ob Maxalt 5 mg bei Kindern unter 6 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Maxalt haben?
Maxalt kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Maxalt sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Maxalt. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
MAXALT 10 mg enthält Rizatriptanbenzoat, einen selektiven 5-Hydroxytryptamin1B/1D (5-HT1B/1D)-Rezeptoragonisten.
Rizatriptanbenzoat wird chemisch beschrieben als: N,N-Dimethyl-5-(1H-1,2,4-triazol-1-ylmethyl)-1Hindole-3-ethanamine monobenzoate und seine Strukturformel ist:
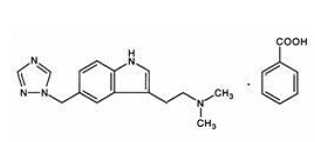
Seine empirische Formel ist C15H19N5·C7H6O2, was ein Molekulargewicht der freien Base von 269,4 darstellt. Rizatriptanbenzoat ist ein weißer bis cremefarbener, kristalliner Feststoff, der in Wasser mit etwa 42 mg pro ml (ausgedrückt als freie Base) bei 25 °C löslich ist.
MAXALT 5 mg Tabletten und MAXALT-MLT oral zerfallende Tabletten sind zur oralen Verabreichung in Stärken von 5 und 10 mg (entsprechend 7,265 mg bzw. 14,53 mg des Benzoatsalzes) erhältlich. Jede komprimierte Tablette enthält die folgenden inaktiven Bestandteile: Lactose-Monohydrat, mikrokristalline Cellulose, vorgelatinierte Stärke, Eisenoxid (rot) und Magnesiumstearat. Jede lyophilisierte, im Mund zerfallende Tablette enthält die folgenden inaktiven Bestandteile: Gelatine, Mannit, Glycin, Aspartam und Pfefferminzaroma.
INDIKATIONEN
MAXALT® und MAXALT-MLT® sind für die Akutbehandlung von Migräne mit oder ohne Aura bei Erwachsenen und pädiatrischen Patienten im Alter von 6 bis 17 Jahren indiziert.
Nutzungsbeschränkungen
DOSIERUNG UND ANWENDUNG
Dosierungsinformationen bei Erwachsenen
Die empfohlene Anfangsdosis von MAXALT beträgt entweder 5 mg oder 10 mg für die Akutbehandlung von Migräne bei Erwachsenen. Die 10-mg-Dosis kann eine stärkere Wirkung haben als die 5-mg-Dosis, kann aber ein größeres Risiko für Nebenwirkungen haben [siehe Klinische Studien ].
Redosing bei Erwachsenen
Obwohl die Wirksamkeit einer zweiten Dosis oder nachfolgender Dosen nicht in placebokontrollierten Studien nachgewiesen wurde, kann eine zweite Dosis 2 Stunden nach der ersten Dosis verabreicht werden, wenn die Migräne erneut auftritt. Die maximale Tagesdosis sollte 30 mg innerhalb von 24 Stunden nicht überschreiten. Die Sicherheit der Behandlung von durchschnittlich mehr als vier Kopfschmerzen in einem Zeitraum von 30 Tagen wurde nicht nachgewiesen.
Dosierungsinformationen bei pädiatrischen Patienten (Alter 6 bis 17 Jahre)
Die Dosierung bei pädiatrischen Patienten basiert auf dem Körpergewicht des Patienten. Die empfohlene Dosis von MAXALT 10 mg beträgt 5 mg bei Patienten, die weniger als 40 kg (88 lb) wiegen, und 10 mg bei Patienten, die 40 kg (88 lb) oder mehr wiegen.
Die Wirksamkeit und Sicherheit einer Behandlung mit mehr als einer Dosis MAXALT innerhalb von 24 Stunden bei pädiatrischen Patienten im Alter von 6 bis 17 Jahren ist nicht erwiesen.
Verabreichung von MAXALT-MLT oral zerfallenden Tabletten
Für MAXALT-MLT-Tabletten zum Einnehmen ist eine Verabreichung mit Flüssigkeit nicht erforderlich. Im Mund zerfallende Tabletten sind in einer Blisterpackung in einem äußeren Aluminiumbeutel verpackt, und die Patienten sollten die Blisterpackung erst kurz vor der Einnahme aus dem äußeren Beutel nehmen. Die Blisterpackung sollte dann mit trockenen Händen geöffnet und die im Mund zerfallende Tablette auf die Zunge gelegt werden, wo sie sich auflöst und mit dem Speichel geschluckt wird.
Dosisanpassung für Patienten unter Propranolol
Erwachsene Patienten
Bei erwachsenen Patienten, die Propranolol einnehmen, wird nur die 5-mg-Dosis von MAXALT 5 mg empfohlen, bis zu maximal 3 Dosen in einem Zeitraum von 24 Stunden (15 mg) [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
Pädiatrische Patienten
Für pädiatrische Patienten mit einem Gewicht von 40 kg (88 lb) oder mehr, die Propranolol einnehmen, wird nur eine Einzeldosis von 5 mg MAXALT empfohlen (maximale Dosis von 5 mg in einem Zeitraum von 24 Stunden). MAXALT sollte mit Propranolol behandelten pädiatrischen Patienten, die weniger als 40 kg (88 lb) wiegen, nicht verschrieben werden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
WIE GELIEFERT
Darreichungsformen und Stärken
MAXALT-Tabletten
MAXALT-MLT Oral zerfallende Tabletten
Lagerung und Handhabung
Nr. 3732 - MAXALT-Tabletten, 5 mg , sind blassrosa, kapselförmige, komprimierte Tabletten, die kodiert sind
MRK auf der einen Seite und 266 auf der anderen:
NDC 0006-0266-18, Karton mit 18 Tabletten.
Nr. 3733 - MAXALT 5 mg Tabletten, 10 mg , sind blassrosa, kapselförmige, komprimierte Tabletten mit der Kennzeichnung MAXALT 10 mg auf der einen Seite und MRK 267 auf der anderen Seite:
NDC 0006-0267-18, Karton mit 18 Tabletten.
Nr. 3800 – MAXALT-MLT im Mund zerfallende Tabletten, 5 mg sind weiße bis cremefarbene, runde, lyophilisierte, im Mund zerfallende Tabletten mit der Prägung eines modifizierten Dreiecks auf einer Seite und einer Größe von 10,0–11,5 mm (Seite an Seite) mit Pfefferminzaroma. Jede im Mund zerfallende Tablette ist einzeln in einer Blisterpackung in einem Aluminiumbeutel (Beutel) verpackt. Sie werden wie folgt geliefert:
NDC 0006-3800-18, 6 x Gebrauchseinheit Tragetasche mit 3 oral zerfallenden Tabletten (insgesamt 18 Tabletten).
Nr. 3801 – MAXALT-MLT im Mund zerfallende Tabletten, 10 mg , sind weiße bis cremefarbene, runde, lyophilisierte, im Mund zerfallende Tabletten mit der Prägung eines modifizierten Quadrats auf einer Seite und einer Größe von 12,0–13,8 mm (Seite an Seite) mit Pfefferminzaroma. Jede im Mund zerfallende Tablette ist einzeln in einer Blisterpackung in einem Aluminiumbeutel (Beutel) verpackt. Sie werden wie folgt geliefert:
NDC 0006-3801-18, 6 x Gebrauchseinheit Tragetasche mit 3 oral zerfallenden Tabletten (insgesamt 18 Tabletten).
Lagerung
Lagern Sie MAXALT 5 mg Tabletten bei Raumtemperatur, 15 °C bis 30 °C (59 °F bis 86 °F).
Lagern Sie MAXALT-MLT oral zerfallende Tabletten bei Raumtemperatur, 15 °C bis 30 °C (59 °F bis 86 °F).
Vertrieb durch: Merck Sharp & Dohme Corp., eine Tochtergesellschaft von MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Überarbeitet: Okt. 2019
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden in anderen Abschnitten der Kennzeichnung ausführlicher erörtert:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien eines Arzneimittels beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Erwachsene
Inzidenz in kontrollierten klinischen Studien
Die Nebenwirkungen von MAXALT wurden in kontrollierten klinischen Studien bewertet, an denen über 3700 erwachsene Patienten teilnahmen, die Einzel- oder Mehrfachdosen von MAXALT-Tabletten erhielten. Die häufigsten Nebenwirkungen während der Behandlung mit MAXALT (≥ 5 % in jeder Behandlungsgruppe und häufiger als Placebo) waren Asthenie/Müdigkeit, Somnolenz, Schmerzen/Druckgefühl und Schwindel. Diese Nebenwirkungen schienen dosisabhängig zu sein.
Tabelle 1 listet die Nebenwirkungen (Inzidenz ≥ 2 % und mehr als Placebo) nach einer Einzeldosis von MAXALT 5 mg bei Erwachsenen auf.
Die Häufigkeit von Nebenwirkungen in klinischen Studien nahm nicht zu, wenn bis zu drei Dosen innerhalb von 24 Stunden eingenommen wurden. Die Häufigkeit von Nebenwirkungen blieb auch bei gleichzeitiger Anwendung von Arzneimitteln, die üblicherweise zur Migräneprophylaxe eingenommen werden (einschließlich Propranolol), oralen Kontrazeptiva oder Analgetika, unverändert. Das Auftreten von Nebenwirkungen wurde nicht durch Alter oder Geschlecht beeinflusst. Es lagen keine ausreichenden Daten vor, um den Einfluss der ethnischen Zugehörigkeit auf die Häufigkeit von Nebenwirkungen zu beurteilen.
Andere Ereignisse, die im Zusammenhang mit der Anwendung von MAXALT bei Erwachsenen beobachtet wurden
Im folgenden Abschnitt werden die Häufigkeiten weniger häufig gemeldeter unerwünschter Ereignisse dargestellt, die in anderen Abschnitten der Kennzeichnung nicht berichtet wurden. Da die Berichte Ereignisse beinhalten, die in offenen Studien beobachtet wurden, kann die Rolle von MAXALT 5 mg bei ihrer Verursachung nicht zuverlässig bestimmt werden. Darüber hinaus schränken Schwankungen im Zusammenhang mit der Meldung unerwünschter Ereignisse, der Terminologie, die zur Beschreibung unerwünschter Ereignisse verwendet wird, den Wert der bereitgestellten quantitativen Häufigkeitsschätzungen ein. Ereignishäufigkeiten werden berechnet als die Anzahl der Patienten, die MAXALT angewendet und ein Ereignis gemeldet haben, dividiert durch die Gesamtzahl der Patienten, die MAXALT erhalten haben (N = 3716). Alle gemeldeten Ereignisse traten mit einer Inzidenz von ≥ 1 % auf oder es wird angenommen, dass sie in vernünftigem Zusammenhang mit der Anwendung des Arzneimittels stehen. Ereignisse werden weiter in Körpersystemkategorien eingeteilt und nach abnehmender Häufigkeit unter Verwendung der folgenden Definitionen aufgezählt: häufige unerwünschte Ereignisse sind solche, die als solche definiert sind, die bei mindestens (>) 1/100 Patienten auftreten; seltene Nebenwirkungen treten bei 1/100 bis 1/1000 Patienten auf; und seltene Nebenwirkungen sind solche, die bei weniger als 1/1000 Patienten auftreten.
Allgemein: Selten war ein Gesichtsödem. Selten waren Synkopen und Ödeme/Schwellungen.
Atypische Empfindungen: Häufig waren Wärmeempfindungen.
Herz-Kreislauf: Häufig war Herzklopfen. Selten traten Tachykardie, kalte Extremitäten und Bradykardie auf.
Verdauungs: Häufig waren Durchfall und Erbrechen. Selten traten Dyspepsie, Zungenödem und Bauchauftreibung auf.
Bewegungsapparat: Selten traten Muskelschwäche, Steifheit, Myalgie und Muskelkrämpfe/-spasmen auf.
Neurologische/Psychiatrische: Häufig waren Hypästhesie, Euphorie und Tremor. Selten traten Schwindel, Schlaflosigkeit, Verwirrtheit/Desorientierung, Gangstörungen, Gedächtnisstörungen und Agitiertheit auf.
Atmung: Häufig war Dyspnoe. Selten war ein Pharynxödem.
Besondere Sinne: Seltener waren verschwommenes Sehen und Tinnitus. Selten war Augenschwellung.
Haut und Hautanhang: Häufig war Spülung. Selten traten Schwitzen, Pruritus, Hautausschlag und Urtikaria auf. Selten war Erythem, Hitzewallungen.
Das Nebenwirkungsprofil, das bei MAXALT-MLT oral zerfallenden Tabletten beobachtet wurde, war ähnlich wie bei MAXALT 10 mg Tabletten.
Pädiatrische Patienten im Alter von 6 bis 17 Jahren
Inzidenz in kontrollierten klinischen Studien bei pädiatrischen Patienten
Die Nebenwirkungen von MAXALT-MLT wurden in einer kontrollierten klinischen Studie zur Akutbehandlung von Migräne (Studie 7) bewertet, an der insgesamt 1382 pädiatrische Patienten im Alter von 6 bis 17 Jahren teilnahmen, von denen 977 (72 %) mindestens eine Dosis erhielten der Studienbehandlung (MAXALT-MLT und/oder Placebo) [vgl Klinische Studien ]. Die Inzidenz von Nebenwirkungen, die bei pädiatrischen Patienten in der akuten klinischen Studie berichtet wurden, war bei Patienten, die MAXALT erhielten, ähnlich wie bei Patienten, die Placebo erhielten. Es wird erwartet, dass das Nebenwirkungsmuster bei pädiatrischen Patienten dem bei Erwachsenen ähnlich ist.
Andere Ereignisse, die im Zusammenhang mit der Verabreichung von MAXALT-MLT bei pädiatrischen Patienten beobachtet wurden
Im folgenden Abschnitt werden die Häufigkeiten seltener gemeldeter unerwünschter Ereignisse dargestellt. Da die Berichte Ereignisse beinhalten, die in offenen Studien beobachtet wurden, kann die Rolle von MAXALT-MLT bei ihrer Verursachung nicht zuverlässig bestimmt werden. Darüber hinaus schränken Schwankungen im Zusammenhang mit der Meldung unerwünschter Ereignisse, der Terminologie, die zur Beschreibung unerwünschter Ereignisse verwendet wird, den Wert der bereitgestellten quantitativen Häufigkeitsschätzungen ein.
Die Ereignishäufigkeiten werden berechnet als die Anzahl der pädiatrischen Patienten im Alter von 6 bis 17 Jahren, die MAXALT-MLT angewendet und ein Ereignis gemeldet haben, dividiert durch die Gesamtzahl der Patienten, die MAXALT-MLT erhielten (n = 1068). Alle gemeldeten Ereignisse traten mit einer Inzidenz von ≥ 1 % auf oder es wird angenommen, dass sie in vernünftigem Zusammenhang mit der Anwendung des Arzneimittels stehen. Ereignisse werden weiter innerhalb der Systemorganklasse klassifiziert und nach abnehmender Häufigkeit unter Verwendung der folgenden Definitionen aufgezählt: häufige unerwünschte Ereignisse treten bei (>)1/100 pädiatrischen Patienten auf; seltene Nebenwirkungen treten bei 1/100 bis 1/1000 pädiatrischen Patienten auf; und seltene Nebenwirkungen sind solche, die bei weniger als 1/1000 Patienten auftreten.
Allgemein: Häufig war Müdigkeit.
Erkrankungen des Ohrs und des Labyrinths: Selten war Hypoakusis.
Gastrointestinale Störungen: Häufig waren Bauchbeschwerden.
Erkrankungen des Nervensystems: Selten waren Koordinationsstörungen, Aufmerksamkeitsstörungen und Präsynkopen.
Psychische Störungen: Selten war Halluzination.
Postmarketing-Erfahrung
Der folgende Abschnitt führt potenziell wichtige unerwünschte Ereignisse auf, die in der klinischen Praxis aufgetreten sind und spontan an verschiedene Überwachungssysteme gemeldet wurden. Die aufgezählten Ereignisse umfassen alle außer denen, die bereits in anderen Abschnitten der Kennzeichnung aufgeführt sind oder die zu allgemein sind, um informativ zu sein. Da die Berichte spontan gemeldete Ereignisse aus der weltweiten Postmarketing-Erfahrung zitieren, kann die Häufigkeit von Ereignissen und die Rolle von MAXALT 5 mg bei ihrer Verursachung nicht zuverlässig bestimmt werden.
Neurologische/Psychiatrische: Krampfanfall.
Allgemein: Allergische Zustände einschließlich Anaphylaxie/anaphylaktoide Reaktion, Angioödem, Keuchen und toxische epidermale Nekrolyse [siehe KONTRAINDIKATIONEN ].
Besondere Sinne: Dysgeusie.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Propranolol
Die Dosis von MAXALT 5 mg sollte bei mit Propranolol behandelten Patienten angepasst werden, da gezeigt wurde, dass Propranolol die Plasma-AUC von Rizatriptan um 70 % erhöht [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
Ergot-haltige Drogen
Es wurde berichtet, dass Mutterkorn enthaltende Arzneimittel verlängerte vasospastische Reaktionen hervorrufen. Da diese Wirkungen additiv sein können, ist die Anwendung von ergotaminhaltigen oder ergotartigen Medikamenten (wie Dihydroergotamin oder Methysergid) und MAXALT 5 mg innerhalb von 24 Stunden kontraindiziert [siehe KONTRAINDIKATIONEN ].
Andere 5-HT1-Agonisten
Da sich ihre vasospastischen Wirkungen addieren können, ist die gleichzeitige Verabreichung von MAXALT 10 mg und anderen 5-HT1-Agonisten innerhalb von 24 Stunden kontraindiziert [siehe KONTRAINDIKATIONEN ].
SSRIs/SNRIs und Serotonin-Syndrom
Fälle von Serotonin-Syndrom wurden während der gleichzeitigen Anwendung von Triptanen und selektiven Serotonin-Wiederaufnahmehemmern (SSRIs) oder Serotonin-Noradrenalin-Wiederaufnahmehemmern (SNRIs) berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Monoaminoxidase-Inhibitoren
MAXALT ist kontraindiziert bei Patienten, die MAO-A-Hemmer und nicht-selektive MAO-Hemmer einnehmen. Ein spezifischer MAO-A-Hemmer erhöhte die systemische Exposition von Rizatriptan und seinem Metaboliten [siehe KONTRAINDIKATIONEN und KLINISCHE PHARMAKOLOGIE ].
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Myokardischämie, Myokardinfarkt und Prinzmetal-Angina
MAXALT sollte Patienten mit ischämischer oder vasospastischer Koronararterienerkrankung nicht verabreicht werden. Es gab seltene Berichte über schwerwiegende kardiale Nebenwirkungen, einschließlich akutem Myokardinfarkt, die innerhalb weniger Stunden nach der Verabreichung von MAXALT auftraten. Einige dieser Reaktionen traten bei Patienten ohne bekannte koronare Herzkrankheit (KHK) auf. 5-HT1-Agonisten, einschließlich MAXALT 5 mg, können Vasospasmen der Koronararterien (Prinzmetal-Angina) verursachen, selbst bei Patienten ohne KHK in der Vorgeschichte.
Triptan-naive Patienten mit mehreren kardiovaskulären Risikofaktoren (z. B. höheres Alter, Diabetes, Bluthochdruck, Rauchen, Fettleibigkeit, starke KHK in der Familienanamnese) sollten vor der Anwendung von MAXALT einer kardiovaskulären Untersuchung unterzogen werden. Bei Anzeichen einer KHK oder eines Vasospasmus der Koronararterien sollte MAXALT nicht verabreicht werden [siehe KONTRAINDIKATIONEN ]. Bei Patienten mit negativer kardiovaskulärer Beurteilung sollte die Verabreichung der ersten MAXALT-Dosis in einer medizinisch überwachten Umgebung und die Durchführung eines Elektrokardiogramms (EKG) unmittelbar nach der Verabreichung von MAXALT 10 mg in Betracht gezogen werden. Bei intermittierenden Langzeitanwendern von MAXALT mit kardiovaskulären Risikofaktoren sollte eine regelmäßige kardiovaskuläre Untersuchung in Erwägung gezogen werden.
Arrhythmien
Innerhalb weniger Stunden nach Verabreichung von 5-HT1-Agonisten wurde über lebensbedrohliche Herzrhythmusstörungen einschließlich ventrikulärer Tachykardie und Kammerflimmern mit Todesfolge berichtet. Setzen Sie MAXALT 10 mg ab, wenn diese Störungen auftreten.
Brust-, Hals-, Nacken- und/oder Kieferschmerzen/Enge/Druck
Wie bei anderen 5-HT1-Agonisten treten nach der Behandlung mit MAXALT 5 mg häufig Spannungs-, Schmerz-, Druck- und Schweregefühle in Präkordium, Rachen, Hals und Kiefer auf, die in der Regel nicht kardialen Ursprungs sind. Wenn jedoch ein kardialer Ursprung vermutet wird, sollten die Patienten untersucht werden. Patienten mit nachweislich koronarer Herzkrankheit und solche mit Prinzmetal-Angina-Variante sollten keine 5-HT1-Agonisten erhalten.
Zerebrovaskuläre Ereignisse
Bei Patienten, die mit 5-HT1-Agonisten behandelt wurden, sind Hirnblutungen, Subarachnoidalblutungen und Schlaganfälle aufgetreten, und einige führten zu Todesfällen. In einer Reihe von Fällen scheint es möglich, dass die zerebrovaskulären Ereignisse primär waren, da der 5-HT1-Agonist in der falschen Annahme verabreicht wurde, dass die aufgetretenen Symptome eine Folge von Migräne seien, obwohl dies nicht der Fall war. Außerdem können Patienten mit Migräne einem erhöhten Risiko für bestimmte zerebrovaskuläre Ereignisse (z. B. Schlaganfall, Blutung, transitorische ischämische Attacke) ausgesetzt sein. Setzen Sie MAXALT ab, wenn ein zerebrovaskuläres Ereignis auftritt.
Wie bei anderen akuten Migränetherapien sollte vor der Behandlung von Kopfschmerzen bei Patienten, bei denen zuvor keine Migräne diagnostiziert wurde, und bei Migränepatienten mit atypischen Symptomen darauf geachtet werden, andere potenziell schwerwiegende neurologische Erkrankungen auszuschließen. MAXALT sollte nicht an Patienten mit Schlaganfall oder transitorischer ischämischer Attacke in der Vorgeschichte verabreicht werden [siehe KONTRAINDIKATIONEN ].
Andere Vasospasmus-Reaktionen
5-HT1-Agonisten, einschließlich MAXALT, können nicht-koronare vasospastische Reaktionen wie periphere vaskuläre Ischämie, gastrointestinale vaskuläre Ischämie und Infarkt (mit Bauchschmerzen und blutigem Durchfall), Milzinfarkt und Raynaud-Syndrom verursachen. Bei Patienten, bei denen nach der Anwendung eines 5-HT1-Agonisten Symptome oder Anzeichen auftreten, die auf eine nicht koronare Vasospasmus-Reaktion hindeuten, sollte die vermutete Vasospasmus-Reaktion ausgeschlossen werden, bevor zusätzliche Dosen von MAXALT 10 mg verabreicht werden.
Bei der Anwendung von 5-HT1-Agonisten wurde über vorübergehende und dauerhafte Erblindung und erheblichen Verlust des Sehvermögens berichtet. Da Sehstörungen Teil einer Migräneattacke sein können, wurde ein kausaler Zusammenhang zwischen diesen Ereignissen und der Anwendung von 5-HT1-Agonisten nicht eindeutig nachgewiesen.
Kopfschmerzen bei Medikamentenübergebrauch
Der übermäßige Gebrauch von Medikamenten gegen akute Migräne (z. B. Ergotamin, Triptane, Opioide oder eine Kombination von Medikamenten an 10 oder mehr Tagen pro Monat) kann zu einer Verschlimmerung der Kopfschmerzen führen (Kopfschmerz bei Medikamentenübergebrauch). Kopfschmerzen bei Medikamentenübergebrauch können sich als migräneähnliche tägliche Kopfschmerzen oder als deutliche Zunahme der Häufigkeit von Migräneanfällen äußern. Eine Entgiftung der Patienten, einschließlich des Absetzens der übergebrauchten Medikamente, und die Behandlung von Entzugssymptomen (die häufig eine vorübergehende Verschlechterung der Kopfschmerzen beinhalten) können erforderlich sein.
Serotonin-Syndrom
Bei Triptanen, einschließlich MAXALT 10 mg, kann ein Serotonin-Syndrom auftreten, insbesondere bei gleichzeitiger Anwendung mit selektiven Serotonin-Wiederaufnahmehemmern (SSRIs), Serotonin-Noradrenalin-Wiederaufnahmehemmern (SNRIs), trizyklischen Antidepressiva (TCAs) und MAO-Hemmern [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Zu den Symptomen des Serotonin-Syndroms können Veränderungen des mentalen Status (z. B. Unruhe, Halluzinationen, Koma), autonome Instabilität (z. B. Tachykardie, labiler Blutdruck, Hyperthermie), neuromuskuläre Aberrationen (z. B. Hyperreflexie, Koordinationsstörungen) und/oder gastrointestinale Symptome (z. B. Übelkeit) gehören , Erbrechen, Durchfall). Die Symptome können innerhalb von Minuten bis Stunden nach Erhalt einer neuen oder höheren Dosis eines serotonergen Medikaments auftreten. Die Behandlung mit MAXALT sollte abgebrochen werden, wenn ein Verdacht auf ein Serotonin-Syndrom besteht [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und INFORMATIONEN ZUM PATIENTEN ].
Erhöhung des Blutdrucks
In seltenen Fällen wurde bei Patienten mit und ohne Hypertonie in der Anamnese, die 5-HT1-Agonisten, einschließlich MAXALT, erhielten, über einen signifikanten Anstieg des Blutdrucks, einschließlich einer hypertensiven Krise mit akuter Beeinträchtigung der Organsysteme, berichtet. Bei gesunden jungen erwachsenen männlichen und weiblichen Patienten, die Maximaldosen von MAXALT (10 mg alle 2 Stunden für 3 Dosen) erhielten, wurde ein leichter Anstieg des Blutdrucks (ca. 2-3 mmHg) beobachtet. MAXALT ist bei Patienten mit unkontrollierter Hypertonie kontraindiziert [siehe KONTRAINDIKATIONEN ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( INFORMATIONEN ZUM PATIENTEN ).
Risiko einer Myokardischämie und/oder eines Herzinfarkts, Prinzmetal-Angina, anderer mit Vasospasmus zusammenhängender Ereignisse und zerebrovaskulärer Ereignisse
Informieren Sie die Patienten darüber, dass MAXALT schwerwiegende kardiovaskuläre Nebenwirkungen wie Myokardinfarkt oder Schlaganfall verursachen kann. Obwohl schwerwiegende kardiovaskuläre Ereignisse ohne Warnsymptome auftreten können, sollten Patienten auf die Anzeichen und Symptome von Schmerzen in der Brust, Kurzatmigkeit, Schwäche, undeutliche Sprache achten und ärztlichen Rat einholen, wenn sie darauf hinweisende Anzeichen oder Symptome beobachten. Die Patienten sollten über die Bedeutung dieser Nachsorge informiert werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Serotonin-Syndrom
Patienten sollten vor dem Risiko eines Serotonin-Syndroms bei der Anwendung von MAXALT 10 mg oder anderen Triptanen gewarnt werden, insbesondere bei gleichzeitiger Anwendung mit selektiven Serotonin-Wiederaufnahmehemmern (SSRIs) oder Serotonin-Noradrenalin-Wiederaufnahmehemmern (SNRIs) [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , und KLINISCHE PHARMAKOLOGIE ].
Schwangerschaft
Informieren Sie die Patienten darüber, dass MAXALT während der Schwangerschaft nicht angewendet werden sollte, es sei denn, der potenzielle Nutzen rechtfertigt das potenzielle Risiko für den Fötus [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Stillzeit
Raten Sie den Patientinnen, ihren Arzt zu informieren, wenn sie stillen oder stillen möchten [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Fähigkeit, komplexe Aufgaben auszuführen
Da Migräne oder die Behandlung mit MAXALT 10 mg Schläfrigkeit und Schwindel verursachen können, weisen Sie die Patienten an, ihre Fähigkeit zur Ausführung komplexer Aufgaben während Migräneanfällen und nach der Verabreichung von MAXALT zu beurteilen.
Kopfschmerzen bei Medikamentenübergebrauch
Informieren Sie die Patienten darüber, dass die Einnahme von Medikamenten gegen akute Migräne an 10 oder mehr Tagen pro Monat zu einer Verschlimmerung der Kopfschmerzen führen kann, und ermutigen Sie die Patienten, die Kopfschmerzhäufigkeit und den Medikamentenkonsum zu dokumentieren (z. B. durch Führen eines Kopfschmerztagebuchs) [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Handhabung von Packungen mit im Mund zerfallenden Tabletten
Weisen Sie die Patienten an, die Blisterpackung nicht aus dem äußeren Aluminiumbeutel zu entfernen, bis sie bereit sind, die im Mund zerfallende Tablette darin zu verwenden [siehe DOSIERUNG UND ANWENDUNG ].
Patienten mit Phenylketonurie
Informieren Sie Patienten mit Phenylketonurie darüber, dass MAXALT-MLT oral zerfallende Tabletten Phenylalanin (ein Bestandteil von Aspartam) enthalten. Jede zerfallende 5-mg-Tablette enthält 1,1 mg Phenylalanin und jede zerfallende 10-mg-Tablette enthält 2,1 mg Phenylalanin [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Orale Kanzerogenitätsstudien mit Rizatriptan wurden an Mäusen (100 Wochen) und Ratten (106 Wochen) in Dosen von bis zu 125 mg/kg/Tag durchgeführt. Es gab bei keiner Spezies Hinweise auf eine Zunahme der Tumorinzidenz im Zusammenhang mit Rizatriptan. Die Plasmaexposition (AUC) bei der höchsten getesteten Dosis betrug etwa das 150- (Mäuse) bzw. 240-fache (Ratten) der beim Menschen bei der maximal empfohlenen Humandosis (MRHD) von 30 mg/Tag.
Mutagenese
Rizatriptan war in einer Reihe von In-vitro- und In-vivo-Studien zur genetischen Toxizität weder mutagen noch klastogen, darunter: der mikrobielle Mutagenese- (Ames-) Assay, der In-vitro-Säugerzell-Mutagenese- und Chromosomenaberrationsassay und der In-vivo-Chromosomenaberrationsassay bei Mäusen.
Beeinträchtigung der Fruchtbarkeit
Die orale Verabreichung von Rizatriptan (0, 2, 10 oder 100 mg/kg/Tag) an weibliche Ratten vor und während der Paarung und während der Trächtigkeit und Laktation hatte keine Auswirkungen auf die Fertilität; bei der höchsten getesteten Dosis wurden jedoch eine veränderte Östruszyklizität und Verzögerungen bei der Paarungszeit beobachtet. Die Plasmaexposition bei der No-Effect-Dosis (10 mg/kg/Tag) für Reproduktionstoxizität war etwa 15-mal höher als beim Menschen bei der MRHD.
Die orale Verabreichung von Rizatriptan (0, 5, 35 oder 250 mg/kg/Tag) an männliche Ratten vor und während der Paarung führte zu keiner Beeinträchtigung der Fertilität oder Fortpflanzungsfähigkeit. Die Plasmaexposition (AUC) bei der höchsten getesteten Dosis war etwa 550-mal höher als beim Menschen bei der MRHD.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Die verfügbaren Humandaten zur Anwendung von MAXALT bei Schwangeren reichen nicht aus, um Schlussfolgerungen über das arzneimittelbedingte Risiko schwerer Geburtsfehler und Fehlgeburten zu ziehen.
In Tierstudien wurde nach oraler Gabe von Rizatriptan während der Trächtigkeit (verringertes fötales Körpergewicht bei Ratten) oder während der gesamten Trächtigkeit und Laktation (erhöhte Sterblichkeit, verringertes Körpergewicht und Beeinträchtigung des neurologischen Verhaltens bei Rattennachkommen) bei höheren maternalen Plasmakonzentrationen Entwicklungstoxizität beobachtet in therapeutischen Dosen beim Menschen zu erwarten [vgl Tierdaten ].
In der US-Allgemeinbevölkerung beträgt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften 2 % bis 4 % bzw. 15 % bis 20 %. Die gemeldete Rate schwerer Geburtsfehler bei Geburten von Frauen mit Migräne reicht von 2,2 % bis 2,9 % und die gemeldete Rate von Fehlgeburten betrug 17 %, was ähnlich ist wie bei Frauen ohne Migräne.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryonale/fetales Risiko
Bei Frauen mit Migräne besteht ein erhöhtes Risiko für unerwünschte perinatale Folgen bei der Mutter, einschließlich Präeklampsie und Schwangerschaftsbluthochdruck.
Daten
Menschliche Daten
Das Schwangerschaftsregister für MAXALT hat im Zeitraum von 1998 bis 2018 kein Muster angeborener Anomalien oder anderer unerwünschter Geburtsergebnisse identifiziert. Das Fehlen der Identifizierung eines Musters sollte jedoch mit Vorsicht betrachtet werden, da die Anzahl der prospektiven Berichte mit Ergebnisinformationen war niedrig und lieferte keine ausreichende Aussagekraft, um ein erhöhtes Risiko individueller Geburtsfehler im Zusammenhang mit der Anwendung von MAXALT zu erkennen. Darüber hinaus gab es bei den prospektiven Schwangerschaftsberichten einen erheblichen Verlust an Nachbeobachtung, was diese Bewertung eines Zusammenhangs zwischen MAXALT und jeglichen Mustern angeborener Anomalien oder anderer unerwünschter Geburtsergebnisse weiter erschwert.
In einer Studie mit Daten aus dem schwedischen medizinischen Geburtsregister wurden Lebendgeburten von Frauen, die angaben, während der Schwangerschaft Triptane oder Mutterkorn eingenommen zu haben, mit denen von Frauen verglichen, die dies nicht taten. Von den 157 Geburten mit Rizatriptan-Exposition im ersten Trimester wurden 7 Säuglinge mit Missbildungen geboren (relatives Risiko 1,01 [95 %-KI: 0,40 bis 2,08]). Eine Studie, die verknüpfte Daten aus dem Medical Birth Registry of Norway mit der Norwegian Prescription Database verwendete, verglich die Schwangerschaftsergebnisse bei Frauen, die Triptane während der Schwangerschaft eingelöst hatten, sowie bei einer Vergleichsgruppe mit Migräneerkrankungen, die Triptane nur vor der Schwangerschaft einlöste, im Vergleich zu a Bevölkerungskontrollgruppe. Von den 310 Frauen, die Rezepte für Rizatriptan während des ersten Trimesters einlösten, hatten 10 Säuglinge mit schweren angeborenen Fehlbildungen (OR 1,03 [95 % KI: 0,55 bis 1,93]), während bei den 271 Frauen, die Rezepte für Rizatriptan vor, aber nicht währenddessen eingelöst hatten , Schwangerschaft, 12 hatten Säuglinge mit schweren angeborenen Fehlbildungen (OR 1,48 [95 % KI: 0,83 bis 2,64]), jeweils verglichen mit der Bevölkerungsvergleichsgruppe.
Tierdaten
Wenn Rizatriptan (0, 2, 10 oder 100 mg/kg/Tag) trächtigen Ratten während der gesamten Organogenese oral verabreicht wurde, wurde bei den höchsten getesteten Dosen eine Abnahme des fötalen Körpergewichts beobachtet. Bei der mittleren Dosis (10 mg/kg/Tag), bei der es sich um eine No-Effect-Dosis für Nebenwirkungen auf die embryofetale Entwicklung handelte, war die Plasmaexposition (AUC) etwa 15-mal höher als beim Menschen bei der maximal empfohlenen Humandosis (MRHD) von 30 Milligramm/Tag. Wenn Rizatriptan (0, 5, 10 oder 50 mg/kg/Tag) trächtigen Kaninchen während der gesamten Organogenese oral verabreicht wurde, wurden keine unerwünschten Wirkungen auf den Fötus beobachtet. Die Plasmaexposition (AUC) bei der höchsten getesteten Dosis war 115-mal höher als beim Menschen bei der MRHD. Bei beiden Spezies wurde eine plazentare Übertragung des Medikaments auf den Fötus nachgewiesen.
Die orale Verabreichung von Rizatriptan (0, 2, 10 oder 100 mg/kg/Tag) an weibliche Ratten vor und während der Paarung und während der gesamten Trächtigkeit und Laktation führte bei den Nachkommen von Geburt an und während der gesamten Laktation zu einem reduzierten Körpergewicht, bis auf den niedrigsten Wert getestete Dosis (2 mg/kg/Tag). Die Plasmaexposition (AUC) bei der Dosis ohne Wirkung (2 mg/kg/Tag) für Nebenwirkungen auf die postnatale Entwicklung war ähnlich wie beim Menschen bei der MRHD.
Die orale Verabreichung von Rizatriptan (0, 5, 100 oder 250 mg/kg/Tag) während der gesamten Organogenese und Laktation führte zu Neugeborenensterblichkeit, reduziertem Körpergewicht (das bis ins Erwachsenenalter anhielt) und beeinträchtigten neurologischen Verhaltensfunktionen bei den Nachkommen, außer bei der niedrigsten Dosis geprüft. Die Plasmaexposition (AUC) bei der No-Effect-Dosis für Nebenwirkungen auf die postnatale Entwicklung (5 mg/kg/Tag) war etwa 8-mal höher als beim Menschen bei der MRHD.
Stillzeit
Zusammenfassung der Risiken
Es liegen keine Daten zum Vorhandensein von Rizatriptan oder anderen aktiven Metaboliten in der Muttermilch oder zu den Auswirkungen von Rizatriptan auf den gestillten Säugling oder auf die Milchproduktion vor.
Rizatriptan wurde in die Rattenmilch ausgeschieden, wobei die Konzentrationen in der Milch ungefähr 6-mal höher waren als die im mütterlichen Plasma.
Die entwicklungsbezogenen und gesundheitlichen Vorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an MAXALT oder MAXALT-MLT und möglichen Nebenwirkungen von MAXALT oder MAXALT-MLT auf den gestillten Säugling oder von der zugrunde liegenden Erkrankung der Mutter berücksichtigt werden.
Daten
Nach oraler Gabe von Rizatriptan an laktierende Ratten in einer Dosis von 100 mg/kg/Tag überstiegen die Wirkstoffkonzentrationen von Rizatriptan in Milchproben die mütterlichen Plasmawirkstoffkonzentrationen um etwa das 6-Fache.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten unter 6 Jahren wurden nicht nachgewiesen. Die Wirksamkeit und Sicherheit von MAXALT 5 mg bei der Akutbehandlung von Migräne bei Patienten im Alter von 6 bis 17 Jahren wurde in einer angemessenen und gut kontrollierten Studie nachgewiesen [siehe Klinische Studien ].
Die Inzidenz von Nebenwirkungen, die bei pädiatrischen Patienten in der akuten klinischen Studie berichtet wurden, war bei Patienten, die MAXALT 5 mg erhielten, ähnlich wie bei Patienten, die Placebo erhielten. Es wird erwartet, dass das Nebenwirkungsmuster bei pädiatrischen Patienten dem bei Erwachsenen ähnlich ist.
Geriatrische Verwendung
Klinische Studien mit MAXALT 5 mg schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagieren als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt.
Obwohl die Pharmakokinetik von Rizatriptan bei älteren (im Alter von ≥ 65 Jahren) und jüngeren Erwachsenen (n = 17) ähnlich war, sollte die Dosisauswahl für einen älteren Patienten im Allgemeinen vorsichtig sein und am unteren Ende des Dosierungsbereichs beginnen. Dies spiegelt die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie wider.
Geriatrische Patienten mit anderen kardiovaskulären Risikofaktoren (z. B. Diabetes, Bluthochdruck, Rauchen, Fettleibigkeit, starke koronare Herzkrankheit in der Familie) sollten vor der Anwendung von MAXALT kardiovaskulär untersucht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Patienten mit Phenylketonurie
Oral Disintegrating Tablets enthalten Phenylalanin (ein Bestandteil von Aspartam). Die oral zerfallenden 5-mg- und 10-mg-Tabletten enthalten 1,1 bzw. 2,1 mg Phenylalanin.
ÜBERDOSIS
In klinischen Studien mit Erwachsenen wurden keine Überdosierungen von MAXALT berichtet.
Einige erwachsene Patienten, die 40 mg MAXALT 5 mg entweder als Einzeldosis oder als zwei Dosen im Abstand von 2 Stunden erhielten, litten unter Schwindel und Schläfrigkeit.
In einer klinisch-pharmakologischen Studie, in der 12 erwachsene Probanden MAXALT 5 mg in kumulativen Gesamtdosen von 80 mg (gegeben innerhalb von vier Stunden) erhielten, traten bei zwei der Probanden Synkopen, Schwindel, Bradykardie einschließlich AV-Block dritten Grades, Erbrechen und/oder Inkontinenz auf .
In der offenen Langzeitstudie mit 606 behandelten pädiatrischen Migränepatienten im Alter von 12 bis 17 Jahren (von denen 432 mindestens 12 Monate lang behandelt wurden) nahmen 151 Patienten (25 %) zwei 10-mg-Dosen MAXALT-MLT ein innerhalb von 24 Stunden. Zu den Nebenwirkungen bei 3 dieser Patienten gehörten Bauchbeschwerden, Müdigkeit und Dyspnoe.
Darüber hinaus könnten basierend auf der Pharmakologie von MAXALT 10 mg nach einer Überdosierung Hypertonie oder myokardiale Ischämie auftreten. Eine gastrointestinale Dekontamination (dh Magenspülung gefolgt von Aktivkohle) sollte bei Patienten mit Verdacht auf eine Überdosierung mit MAXALT in Betracht gezogen werden. Die klinische und elektrokardiographische Überwachung sollte für mindestens 12 Stunden fortgesetzt werden, auch wenn keine klinischen Symptome beobachtet werden.
Die Auswirkungen der Hämo- oder Peritonealdialyse auf die Serumkonzentrationen von Rizatriptan sind nicht bekannt.
KONTRAINDIKATIONEN
MAXALT 5 mg ist kontraindiziert bei Patienten mit:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Rizatriptan bindet mit hoher Affinität an humane geklonte 5-HT1B/1D-Rezeptoren. MAXALT 10 mg übt seine therapeutischen Wirkungen vermutlich bei der Behandlung von Migränekopfschmerzen aus, indem es an 5-HT1B/1D-Rezeptoren bindet, die sich auf intrakraniellen Blutgefäßen und sensorischen Nerven des Trigeminussystems befinden.
Pharmakokinetik
Absorption
Rizatriptan wird nach oraler Gabe vollständig resorbiert. Die mittlere orale absolute Bioverfügbarkeit der MAXALT 10 mg Tablette beträgt etwa 45 %, und mittlere maximale Plasmakonzentrationen (Cmax) werden in etwa 1-1,5 Stunden (Tmax) erreicht. Das Vorhandensein von Migränekopfschmerzen schien die Resorption oder Pharmakokinetik von Rizatriptan nicht zu beeinflussen. Nahrung hat keinen signifikanten Einfluss auf die Bioverfügbarkeit von Rizatriptan, verzögert jedoch die Zeit bis zum Erreichen der maximalen Konzentration um eine Stunde. In klinischen Studien wurde MAXALT 10 mg ohne Rücksicht auf Nahrung verabreicht.
Die Bioverfügbarkeit und Cmax von Rizatriptan waren nach Verabreichung von MAXALT-Tabletten und MAXALT-MLT-Tabletten zum Einnehmen ähnlich, aber die Resorptionsrate ist mit MAXALT-MLT etwas langsamer, wobei Tmax um bis zu 0,7 Stunden verzögert ist. Die AUC von Rizatriptan ist bei Frauen etwa 30 % höher als bei Männern. Bei Mehrfachgabe trat keine Akkumulation auf.
Verteilung
Das mittlere Verteilungsvolumen beträgt etwa 140 Liter bei männlichen Probanden und 110 Liter bei weiblichen Probanden. Rizatriptan wird minimal (14 %) an Plasmaproteine gebunden.
Stoffwechsel
Der primäre Stoffwechselweg von Rizatriptan verläuft über die oxidative Desaminierung durch Monoaminoxidase-A (MAO-A) zum Metaboliten von Indolessigsäure, der am 5-HT1B/1D-Rezeptor nicht aktiv ist. N-Monodesmethyl-Rizatriptan, ein Metabolit mit ähnlicher Aktivität wie die Ausgangssubstanz am 5-HT1B/1D-Rezeptor, wird in geringem Umfang gebildet. Die Plasmakonzentrationen von N-Monodesmethyl-Rizatriptan betragen ungefähr 14 % derjenigen der Muttersubstanz und es wird mit ähnlicher Geschwindigkeit ausgeschieden. Andere kleinere Metaboliten, das N-Oxid, die 6-Hydroxy-Verbindung und das Sulfat-Konjugat des 6-Hydroxy-Metaboliten sind am 5-HT1B/1D-Rezeptor nicht aktiv.
Beseitigung
Die Gesamtradioaktivität der verabreichten Dosis, die über 120 Stunden im Urin und Stuhl wiedergefunden wurde, betrug 82 % bzw. 12 % nach einer oralen Einzelgabe von 10 mg 14C-Rizatriptan. Nach oraler Gabe von 14C-Rizatriptan machte Rizatriptan etwa 17 % der zirkulierenden Plasmaradioaktivität aus. Ungefähr 14 % einer oralen Dosis werden als unverändertes Rizatriptan im Urin ausgeschieden, während 51 % als Metabolit von Indolessigsäure ausgeschieden werden, was auf einen erheblichen First-Pass-Metabolismus hinweist.
Die Plasmahalbwertszeit von Rizatriptan beträgt bei Männern und Frauen durchschnittlich 2-3 Stunden.
Cytochrom P450 Isoformen
Rizatriptan hemmt nicht die Aktivitäten der humanen Leber-Cytochrom-P450-Isoformen 3A4/5, 1A2, 2C9, 2C19 oder 2E1; Rizatriptan ist ein kompetitiver Inhibitor (Ki=1400 nM) von Cytochrom P450 2D6, jedoch nur in hohen, klinisch irrelevanten Konzentrationen.
Besondere Populationen
Geriatrie
Die Pharmakokinetik von Rizatriptan war bei gesunden älteren Probanden ohne Migräne (65-77 Jahre) ähnlich wie bei jüngeren Probanden ohne Migräne (18-45 Jahre).
Pädiatrie
Die Pharmakokinetik von Rizatriptan wurde bei pädiatrischen Migränepatienten im Alter von 6 bis 17 Jahren bestimmt. Die Expositionen nach Verabreichung einer Einzeldosis von 5 mg MAXALT-MLT an pädiatrische Patienten mit einem Gewicht von 20-39 kg (44-87 lb) oder 10 mg MAXALT-MLT an pädiatrische Patienten mit einem Gewicht von ≥ 40 kg (88 lb) waren ähnlich wie die nach einer Einzeldosis beobachteten Expositionen Verabreichung von 10 mg MAXALT-MLT an Erwachsene.
Geschlecht
Die mittlere AUC0-∞ und Cmax von Rizatriptan (10 mg oral) waren bei Frauen etwa 30 % bzw. 11 % höher als bei Männern, während Tmax etwa zur gleichen Zeit auftrat.
Leberfunktionsstörung
Nach oraler Verabreichung an Patienten mit eingeschränkter Leberfunktion aufgrund einer leichten bis mittelschweren alkoholischen Leberzirrhose waren die Plasmakonzentrationen von Rizatriptan bei Patienten mit leichter Leberinsuffizienz ähnlich wie bei einer Kontrollgruppe von Patienten mit normaler Leberfunktion; Die Plasmakonzentrationen von Rizatriptan waren bei Patienten mit mäßiger Leberinsuffizienz etwa 30 % höher.
Nierenfunktionsstörung
Bei Patienten mit eingeschränkter Nierenfunktion (Kreatinin-Clearance 10-60 ml/min/1,73 m2) unterschied sich die AUC0-∞ von Rizatriptan nicht signifikant von der bei Patienten mit normaler Nierenfunktion. Bei Hämodialysepatienten (Kreatinin-Clearance
Wettrennen
Pharmakokinetische Daten zeigten keine signifikanten Unterschiede zwischen afroamerikanischen und kaukasischen Probanden.
Wechselwirkungen mit anderen Medikamenten
[Siehe auch WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]
Monoaminoxidase-Inhibitoren
Rizatriptan wird hauptsächlich über Monoaminoxidase, Subtyp „A“ (MAO-A) metabolisiert. Plasmakonzentrationen von Rizatriptan können durch Arzneimittel erhöht werden, die selektive MAO-A-Hemmer (z. B. Moclobemid) oder nicht-selektive MAO-Hemmer [Typ A und B] (z. B. Isocarboxazid, Phenelzin, Tranylcypromin und Pargylin) sind. In einer Wechselwirkungsstudie kam es bei Verabreichung von MAXALT 10 mg an Probanden (n = 12), die eine Begleittherapie mit dem selektiven, reversiblen MAO-A-Hemmer Moclobemid 150 mg dreimal täglich erhielten, zu einem mittleren Anstieg der AUC und Cmax von Rizatriptan um 119 % und jeweils 41 %; und die AUC des aktiven N-Monodesmethyl-Metaboliten von Rizatriptan war um mehr als 400 % erhöht. Bei irreversiblen MAO-Hemmern wäre eine stärkere Wechselwirkung zu erwarten. Bei Patienten, die selektive MAO-B-Hemmer erhalten, ist keine pharmakokinetische Wechselwirkung zu erwarten [siehe KONTRAINDIKATIONEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Propranolol
In einer Studie zur gleichzeitigen Verabreichung von 240 mg Propranolol/Tag und einer Einzeldosis von 10 mg Rizatriptan bei gesunden erwachsenen Probanden (n = 11) stieg die mittlere Plasma-AUC von Rizatriptan während der Verabreichung von Propranolol um 70 % und um das Vierfache wurde in einem Fach beobachtet. Die AUC des aktiven N-Monodesmethyl-Metaboliten von Rizatriptan wurde durch Propranolol nicht beeinflusst [vgl DOSIERUNG UND ANWENDUNG und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Nadolol/Metoprolol
In einer Arzneimittelwechselwirkungsstudie wurden die Wirkungen mehrerer Dosen von 80 mg Nadolol oder 100 mg Metoprolol alle 12 Stunden auf die Pharmakokinetik einer Einzeldosis von 10 mg Rizatriptan bei gesunden Probanden (n = 12) untersucht. Es wurden keine pharmakokinetischen Wechselwirkungen beobachtet.
Paroxetin
In einer Studie zur Wechselwirkung zwischen dem selektiven Serotonin-Wiederaufnahmehemmer (SSRI) Paroxetin 20 mg/Tag für zwei Wochen und einer Einzeldosis von MAXALT 10 mg bei gesunden Probanden (n = 12) wurden weder die Plasmakonzentrationen von Rizatriptan noch sein Sicherheitsprofil untersucht von Paroxetin betroffen waren [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , und INFORMATIONEN ZUM PATIENTEN ].
Orale Kontrazeptiva
In einer Studie zur gleichzeitigen Verabreichung eines oralen Kontrazeptivums während der 6-tägigen Anwendung von MAXALT (10-30 mg/Tag) bei gesunden weiblichen Freiwilligen (n = 18) hatte Rizatriptan keinen Einfluss auf die Plasmakonzentrationen von Ethinylestradiol oder Norethindron.
Klinische Studien
Erwachsene
Die Wirksamkeit von MAXALT 5 mg Tabletten wurde in vier multizentrischen, randomisierten, placebokontrollierten Studien nachgewiesen. Die in diese Studien aufgenommenen Patienten waren überwiegend weiblich (84 %) und kaukasischer Herkunft (88 %) mit einem Durchschnittsalter von 40 Jahren (zwischen 18 und 71 Jahren). Die Patienten wurden angewiesen, mittelschwere bis starke Kopfschmerzen zu behandeln. Das Ansprechen auf Kopfschmerzen, definiert als Reduktion von mäßigen oder starken Kopfschmerzen auf keine oder leichte Kopfschmerzen, wurde bis zu 2 Stunden (Studie 1) oder bis zu 4 Stunden nach der Verabreichung (Studien 2, 3 und 4) bewertet. Begleitende Symptome von Übelkeit, Photophobie und Phonophobie und Aufrechterhaltung des Ansprechens bis zu 24 Stunden nach der Verabreichung wurden bewertet. Eine zweite Dosis von MAXALT 10 mg Tabletten wurde 2 bis 24 Stunden nach der Einnahme zur Behandlung von wiederkehrenden Kopfschmerzen in den Studien 1 und 2 erlaubt. Zusätzliche Analgetika und/oder Antiemetika wurden 2 Stunden nach der ersten Behandlung zur Notfallbehandlung in allen vier Studien erlaubt.
In allen Studien war der Prozentsatz der Patienten, die 2 Stunden nach der Behandlung ein Ansprechen der Kopfschmerzen erreichten, bei Patienten, die entweder MAXALT 5 oder 10 mg erhielten, signifikant größer als bei Patienten, die Placebo erhielten. In einer separaten Studie unterschieden sich Dosen von 2,5 mg nicht von Placebo. Dosen über 10 mg waren mit einem erhöhten Auftreten von Nebenwirkungen verbunden. Die Ergebnisse der vier kontrollierten Studien sind in Tabelle 2 zusammengefasst.
Vergleiche der Arzneimittelleistung auf der Grundlage von Ergebnissen aus verschiedenen klinischen Studien sind möglicherweise nicht zuverlässig. Da Studien zu unterschiedlichen Zeitpunkten, mit unterschiedlichen Patientenproben, von unterschiedlichen Prüfärzten, unter Verwendung unterschiedlicher Kriterien und/oder unterschiedlicher Interpretationen derselben Kriterien, unter unterschiedlichen Bedingungen (Dosis, Dosierungsschema usw.) durchgeführt werden, werden quantitative Schätzungen des Ansprechens auf die Behandlung und Es ist zu erwarten, dass der Zeitpunkt des Ansprechens von Studie zu Studie erheblich variiert.
Die geschätzte Wahrscheinlichkeit, innerhalb von 2 Stunden nach der Behandlung in den gepoolten Studien 1, 2, 3 und 4 eine erste Kopfschmerzreaktion zu erreichen, ist in Abbildung 1 dargestellt.
Abbildung 1: Geschätzte Wahrscheinlichkeit, innerhalb von 2 Stunden in den gepoolten Studien 1, 2, 3 und 4 ein erstes Ansprechen auf Kopfschmerzen zu erzielen* 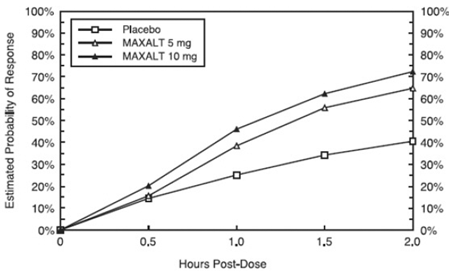
Bei Patienten mit Migräne-assoziierter Photophobie, Phonophobie und Übelkeit zu Studienbeginn traten diese Symptome nach Verabreichung von MAXALT im Vergleich zu Placebo weniger auf.
Zwei bis 24 Stunden nach der Anfangsdosis der Studienbehandlung durften die Patienten eine zusätzliche Behandlung zur Schmerzreaktion in Form einer zweiten Dosis der Studienbehandlung oder eines anderen Medikaments anwenden. Die geschätzte Wahrscheinlichkeit, dass Patienten innerhalb von 24 Stunden nach der Anfangsdosis der Studienbehandlung eine zweite Dosis oder ein anderes Medikament gegen Migräne einnehmen, ist in Abbildung 2 zusammengefasst.
Abbildung 2: Geschätzte Wahrscheinlichkeit, dass Patienten in den gepoolten Studien 1, 2, 3 und 4 in den gepoolten Studien 1, 2, 3 und 4 eine zweite Dosis von MAXALT 10 mg-Tabletten oder anderen Migränemedikamenten innerhalb von 24 Stunden nach der Anfangsdosis der Studienbehandlung einnehmen* 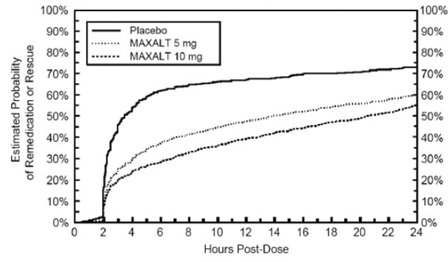
Die Wirksamkeit wurde durch das Vorhandensein von Aura nicht beeinträchtigt; nach Geschlecht oder Alter des Patienten; oder durch gleichzeitige Anwendung gängiger Migräneprophylaktika (z. B. Betablocker, Kalziumkanalblocker, trizyklische Antidepressiva) oder oraler Kontrazeptiva. In zwei weiteren ähnlichen Studien wurde die Wirksamkeit durch die Beziehung zur Menstruation nicht beeinflusst. Es lagen keine ausreichenden Daten vor, um den Einfluss der ethnischen Zugehörigkeit auf die Wirksamkeit zu beurteilen.
MAXALT-MLT Oral zerfallende Tabletten
Die Wirksamkeit von MAXALT-MLT wurde in zwei multizentrischen, randomisierten, placebokontrollierten Studien nachgewiesen, die im Design den Studien mit MAXALT-Tabletten ähnlich waren (Studien 5 und 6). Die Patienten wurden angewiesen, mittelschwere bis starke Kopfschmerzen zu behandeln. Die in diesen Studien behandelten Patienten waren überwiegend weiblich (88 %) und hellhäutig (95 %), mit einem Durchschnittsalter von 42 Jahren (Bereich 18-72).
In beiden Studien war der Prozentsatz der Patienten, die 2 Stunden nach der Behandlung ein Ansprechen der Kopfschmerzen erreichten, bei Patienten, die entweder MAXALT-MLT 5 oder 10 mg erhielten, signifikant höher als bei Patienten, die Placebo erhielten. Die Ergebnisse der Studien 5 und 6 sind in Tabelle 3 zusammengefasst.
Die geschätzte Wahrscheinlichkeit, innerhalb von 2 Stunden nach der Behandlung mit MAXALT-MLT in den gepoolten Studien 5 und 6 eine anfängliche Kopfschmerzreaktion zu erreichen, ist in Abbildung 3 dargestellt.
Abbildung 3: Geschätzte Wahrscheinlichkeit, mit MAXALT-MLT innerhalb von 2 Stunden in den gepoolten Studien 5 und 6 ein erstes Ansprechen auf Kopfschmerzen zu erzielen* 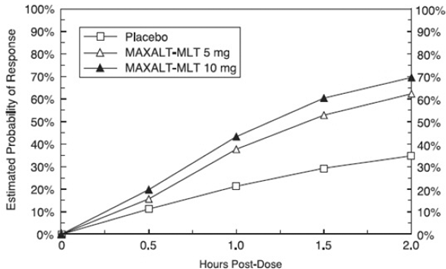
Bei Patienten mit Migräne-assoziierter Photophobie und Phonophobie zu Studienbeginn traten diese Symptome nach Verabreichung von MAXALT-MLT im Vergleich zu Placebo weniger auf.
Zwei bis 24 Stunden nach der Anfangsdosis der Studienbehandlung durften die Patienten eine zusätzliche Behandlung zur Schmerzreaktion in Form einer zweiten Dosis der Studienbehandlung oder eines anderen Medikaments anwenden. Die geschätzte Wahrscheinlichkeit, dass Patienten innerhalb von 24 Stunden nach der Anfangsdosis der Studienbehandlung eine zweite Dosis oder ein anderes Medikament gegen Migräne einnehmen, ist in Abbildung 4 zusammengefasst.
Abbildung 4: Geschätzte Wahrscheinlichkeit, dass Patienten in den gepoolten Studien 5 und 6 innerhalb von 24 Stunden nach der ersten Dosis der Studienbehandlung eine zweite Dosis von MAXALT-MLT oder einem anderen Medikament gegen Migräne einnehmen* 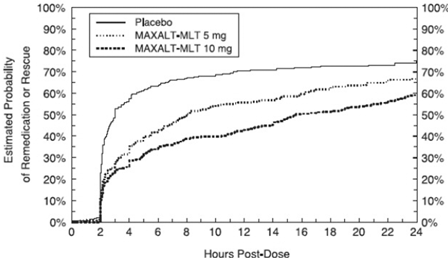
Pädiatrische Patienten im Alter von 6 bis 17 Jahren
Die Wirksamkeit von MAXALT-MLT bei pädiatrischen Patienten im Alter von 6 bis 17 Jahren wurde in einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten klinischen Parallelgruppenstudie (Studie 7) bewertet. Die Patienten mussten eine mindestens 6-monatige Vorgeschichte von Migräneanfällen (mit oder ohne Aura) haben, die normalerweise 3 Stunden oder länger anhielten (unbehandelt). Die Patientenpopulation sprach in der Vergangenheit nicht auf NSAIDs und Paracetamol-Therapie an.
Die Patienten wurden angewiesen, eine einzelne Migräneattacke mit Kopfschmerzen mittlerer bis schwerer Intensität zu behandeln. Die Behandlungsphase der Studie war zweistufig. Stufe 1 wurde verwendet, um Placebo-Non-Responder zu identifizieren, die dann in Stufe 2 eintraten, in der die Patienten randomisiert MAXALT-MLT oder Placebo zugeteilt wurden. Unter Verwendung einer gewichtsbasierten Dosierungsstrategie erhielten Patienten von 20 kg bis
Das Durchschnittsalter der untersuchten Patientenpopulation betrug 13 Jahre. Einundsechzig Prozent der Patienten waren Kaukasier und sechsundfünfzig Prozent der Patienten waren weiblich. Der Prozentsatz der Patienten, die 2 Stunden nach der Behandlung den primären Wirksamkeitsendpunkt „keine Kopfschmerzen“ erreichten, war bei Patienten, die MAXALT-MLT erhielten, signifikant höher als bei Patienten, die Placebo erhielten (33 % vs. 24 %). Die Ergebnisse von Studie 7 sind in Tabelle 4 zusammengefasst.
Der beobachtete Prozentsatz pädiatrischer Patienten, die innerhalb von 2 Stunden nach der Erstbehandlung mit MAXALT-MLT keine Kopfschmerzen mehr hatten, ist in Abbildung 5 dargestellt.
Abbildung 5: Beobachteter Prozentsatz der Patienten, die 2 Stunden nach der Einnahme in Studie 7 keine Kopfschmerzen mehr hatten 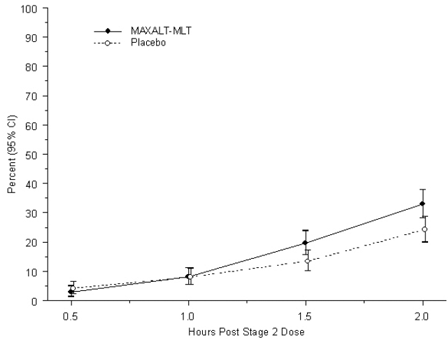
Die Prävalenz der explorativen Endpunkte des Fehlens von Migräne-assoziierten Symptomen (Übelkeit, Photophobie und Phonophobie) 2 Stunden nach Einnahme der Dosis unterschied sich nicht statistisch signifikant zwischen Patienten, die MAXALT-MLT erhielten, und denen, die Placebo erhielten.
INFORMATIONEN ZUM PATIENTEN
MAXALT® (max-awlt)
MAXALT-MLT® (Rizatriptanbenzoat) Tabletten und oral zerfallende Tabletten
Lesen Sie diese Patienteninformation, bevor Sie mit der Einnahme von MAXALT® beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Arzt über Ihren Gesundheitszustand oder Ihre Behandlung.
Sofern nicht anders angegeben, gelten die Informationen in dieser Packungsbeilage sowohl für MAXALT 10 mg Tabletten als auch für MAXALT-MLT® oral zerfallende Tabletten.
Was ist MAXALT?
MAXALT ist ein verschreibungspflichtiges Arzneimittel, das zu einer Arzneimittelklasse namens Triptane gehört. MAXALT ist als herkömmliche Tablette (MAXALT) und als im Mund zerfallende Tablette (MAXALT-MLT) erhältlich.
MAXALT 5 mg und MAXALT-MLT werden zur Behandlung von Migräneanfällen mit oder ohne Aura bei Erwachsenen und Kindern im Alter von 6 bis 17 Jahren angewendet.
MAXALT 5 mg darf nicht zur Vorbeugung von Migräneattacken verwendet werden.
MAXALT ist nicht zur Behandlung von hemiplegischer oder basilarer Migräne bestimmt.
Es ist nicht bekannt, ob MAXALT bei der Behandlung von Cluster-Kopfschmerz sicher und wirksam ist.
Es ist nicht bekannt, ob die Einnahme von mehr als 1 Dosis MAXALT in 24 Stunden bei Kindern im Alter von 6 bis 17 Jahren sicher und wirksam ist.
Es ist nicht bekannt, ob MAXALT bei Kindern unter 6 Jahren sicher und wirksam ist.
Wer sollte MAXALT nicht einnehmen?
Nehmen Sie MAXALT nicht ein, wenn Sie:
Sprechen Sie mit Ihrem Arzt, bevor Sie dieses Arzneimittel einnehmen, wenn Sie an einer der oben aufgeführten Erkrankungen leiden oder wenn Sie sich nicht sicher sind, ob Sie eines dieser Arzneimittel einnehmen.
Was sollte ich meinem Arzt vor der Einnahme von MAXALT sagen?
Bevor Sie MAXALT einnehmen, Informieren Sie Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen.
MAXALT 10 mg und andere Arzneimittel können sich gegenseitig beeinflussen und Nebenwirkungen verursachen. MAXALT kann die Wirkungsweise anderer Arzneimittel beeinflussen, und andere Arzneimittel können die Wirkungsweise von MAXALT 5 mg beeinflussen.
Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Fragen Sie Ihren Arzt oder Apotheker nach einer Liste dieser Arzneimittel, wenn Sie sich nicht sicher sind.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste davon, um sie Ihrem Arzt und Apotheker zu zeigen, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich MAXALT einnehmen?
Was sollte ich während der Einnahme von MAXALT vermeiden?
MAXALT 5 mg kann Schwindel, Schwäche oder Ohnmacht verursachen. Wenn Sie diese Symptome haben, fahren Sie kein Auto, bedienen Sie keine Maschinen und tun Sie nichts, bei dem Sie wachsam sein müssen.
Welche Nebenwirkungen kann MAXALT 5mg haben?
MAXALT 5 mg kann schwerwiegende Nebenwirkungen verursachen. Rufen Sie sofort Ihren Arzt an oder suchen Sie die Notaufnahme des nächstgelegenen Krankenhauses auf, wenn Sie glauben, dass bei Ihnen eine der schwerwiegenden Nebenwirkungen von MAXALT auftritt, einschließlich:
Zu den häufigsten Nebenwirkungen von MAXALT bei Erwachsenen gehören:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Wenn Sie MAXALT 10 mg zu oft einnehmen, kann dies zu chronischen Kopfschmerzen führen. In solchen Fällen sollten Sie sich an Ihren Arzt wenden, da Sie die Einnahme von MAXALT möglicherweise abbrechen müssen.
Dies sind nicht alle möglichen Nebenwirkungen von MAXALT. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA1088 melden.
Wie ist MAXALT aufzubewahren?
Bewahren Sie MAXALT 10 mg und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von MAXALT.
Arzneimittel werden manchmal zu anderen als den in der Packungsbeilage aufgeführten Zwecken verschrieben. Verwenden Sie MAXALT nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie MAXALT nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Diese Packungsbeilage fasst die wichtigsten Informationen über MAXALT zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt. Sie können Ihren Apotheker oder Arzt um Informationen über MAXALT bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Weitere Informationen finden Sie unter www.maxalt.com.
Welche Inhaltsstoffe enthält MAXALT?
Wirkstoff in MAXALT 10 mg und MAXALT-MLT-Tabletten zum Einnehmen:
Rizatriptanbenzoat.
Inaktive Inhaltsstoffe in MAXALT: Lactosemonohydrat, mikrokristalline Cellulose, vorgelatinierte Stärke, Eisenoxid (rot) und Magnesiumstearat.
Inaktive Bestandteile in MAXALT-MLT-Tabletten zum Einnehmen: Gelatine, Mannit, Glycin, Aspartam und Pfefferminzaroma.
MAXALT-MLT-Tabletten zum Einnehmen enthalten Aspartam, eine Quelle für Phenylalanin.
Phenylketonurika:
MAXALT-MLT-Tabletten zum Einnehmen 5 mg enthalten 1,1 mg Phenylalanin. MAXALT-MLT-Tabletten zum Einnehmen 10 mg enthalten 2,1 mg Phenylalanin.
Diese Patienteninformation wurde von der US Food and Drug Administration genehmigt.