Imuran 50mg, 25mg Azathioprine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Imuran und wie wird es angewendet?
Imuran 25 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome der rheumatoiden Arthritis und zur Vorbeugung einer Transplantatabstoßung. Imuran kann allein oder mit anderen Medikamenten verwendet werden.
Imuran 25 mg gehört zu einer Klasse von Medikamenten namens DMARDs, Immunmodulatoren; Immunsuppressiva.
Welche Nebenwirkungen kann Imuran haben?
Imuran 25 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Imuran 50 mg sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Imuran. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
MALIGNITÄT
Chronische Immunsuppression mit IMURAN, einem Purin-Antimetaboliten, erhöht das Malignitätsrisiko beim Menschen. Berichte über maligne Erkrankungen umfassen Posttransplantations-Lymphom und hepatosplenisches T-Zell-Lymphom (HSTCL) bei Patienten mit entzündlichen Darmerkrankungen. Ärzte, die dieses Medikament anwenden, sollten mit diesem Risiko sowie mit dem mutagenen Potenzial für Männer und Frauen und mit möglichen hämatologischen Toxizitäten vertraut sein. Ärzte sollten Patienten über das Malignitätsrisiko von IMURAN informieren. Sehen WARNUNGEN .
BEZEICHNUNG
IMURAN (Azathioprin), ein immunsuppressiver Antimetabolit, ist in Tablettenform zur oralen Verabreichung erhältlich. Jede Tablette mit Bruchkerbe enthält 50 mg Azathioprin und die sonstigen Bestandteile Lactose, Magnesiumstearat, Kartoffelstärke, Povidon und Stearinsäure.
Azathioprin ist chemisch 6-[(1-Methyl-4-nitro-1H-imidazol-5-yl)thio]-1H-purin. Die Strukturformel von Azathioprin lautet:
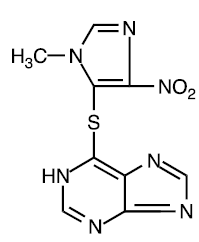
Es ist ein Imidazolyl-Derivat von 6-Mercaptopurin und viele seiner biologischen Wirkungen ähneln denen der Ausgangsverbindung.
Azathioprin ist in Wasser unlöslich, kann aber durch Zugabe von einem Moläquivalent Alkali gelöst werden. Azathioprin ist in Lösung bei neutralem oder saurem pH-Wert stabil, aber Hydrolyse zu Mercaptopurin tritt in überschüssigem Natriumhydroxid (0,1 N) auf, insbesondere beim Erwärmen. Die Umwandlung zu Mercaptopurin erfolgt auch in Gegenwart von Sulfhydrylverbindungen wie Cystein, Glutathion und Schwefelwasserstoff.
INDIKATIONEN
IMURAN ist als Zusatz zur Verhinderung von Abstoßungsreaktionen bei renaler Homotransplantation indiziert. Es ist auch zur Behandlung von aktiver rheumatoider Arthritis indiziert, um Anzeichen und Symptome zu reduzieren.
Renale Homotransplantation
IMURAN ist als Zusatz zur Verhinderung von Abstoßungsreaktionen bei renaler Homotransplantation indiziert. Die Erfahrung mit über 16.000 Transplantationen zeigt eine 5-Jahres-Patientenüberlebensrate von 35 % bis 55 %, aber dies hängt vom Spender, der Übereinstimmung mit HLA-Antigenen, Anti-Spender- oder Anti-B-Zell-Alloantigen-Antikörpern und anderen Variablen ab. Die Wirkung von IMURAN auf diese Variablen wurde nicht in kontrollierten Studien getestet.
Rheumatoide Arthritis
IMURAN ist angezeigt zur Behandlung der aktiven rheumatoiden Arthritis (RA), um Anzeichen und Symptome zu reduzieren. Aspirin, nichtsteroidale Antirheumatika und/oder niedrig dosierte Glukokortikoide können während der Behandlung mit IMURAN fortgesetzt werden. Die kombinierte Anwendung von IMURAN 25 mg mit krankheitsmodifizierenden Antirheumatika (DMARDs) wurde weder auf Zusatznutzen noch auf unerwartete Nebenwirkungen untersucht. Die Anwendung von IMURAN mit diesen Mitteln kann nicht empfohlen werden.
DOSIERUNG UND ANWENDUNG
TPMT-TESTS KÖNNEN DIE ÜBERWACHUNG DES VOLLSTÄNDIGEN BLUTZAHLS (CBC) BEI PATIENTEN, DIE IMURAN ERHALTEN, NICHT ERSETZEN. Die TPMT-Genotypisierung oder -Phänotypisierung kann verwendet werden, um Patienten mit fehlender oder reduzierter TPMT-Aktivität zu identifizieren. Patienten mit geringer oder fehlender TPMT-Aktivität haben ein erhöhtes Risiko, eine schwere, lebensbedrohliche Myelotoxizität durch IMURAN zu entwickeln, wenn herkömmliche Dosen verabreicht werden. Ärzte können alternative Therapien für Patienten mit geringer oder fehlender TPMT-Aktivität (homozygot für nicht-funktionelle Allele) in Betracht ziehen. IMURAN 25 mg sollte Patienten mit einem nicht funktionellen Allel (heterozygot) mit Vorsicht verabreicht werden, bei denen das Risiko einer verminderten TPMT-Aktivität besteht, die bei Verabreichung herkömmlicher Dosen zu Toxizität führen kann. Bei Patienten mit reduzierter TPMT-Aktivität wird eine Dosisreduktion empfohlen. Bei Patienten mit anormalen CBC-Ergebnissen, die nicht auf eine Dosisreduktion ansprechen, kann ein frühzeitiges Absetzen des Arzneimittels in Erwägung gezogen werden.
Renale Homotransplantation
Die Dosis von IMURAN 50 mg, die erforderlich ist, um eine Abstoßung zu verhindern und die Toxizität zu minimieren, wird von Patient zu Patient variieren; Dies erfordert eine sorgfältige Verwaltung. Die Anfangsdosis beträgt normalerweise 3 bis 5 mg/kg täglich, beginnend mit dem Zeitpunkt der Transplantation. IMURAN wird normalerweise als tägliche Einzeldosis am Tag der Transplantation und in einer Minderheit der Fälle 1 bis 3 Tage vor der Transplantation verabreicht. Eine Dosisreduktion auf Erhaltungsdosis von 1 bis 3 mg/kg täglich ist normalerweise möglich. Die Dosis von IMURAN 50 mg sollte wegen drohender Abstoßungsreaktionen nicht auf toxische Werte erhöht werden. Bei schwerer hämatologischer oder anderer Toxizität kann ein Absetzen erforderlich sein, selbst wenn die Abstoßung des Homotransplantats eine Folge des Arzneimittelentzugs sein kann.
Rheumatoide Arthritis
IMURAN 50 mg wird normalerweise täglich verabreicht. Die Anfangsdosis sollte etwa 1,0 mg/kg (50 bis 100 mg) betragen, verabreicht als Einzeldosis oder zweimal täglich. Die Dosis kann beginnend nach 6 bis 8 Wochen und danach schrittweise in 4-wöchigen Abständen erhöht werden, wenn keine schwerwiegenden Toxizitäten auftreten und das anfängliche Ansprechen unbefriedigend ist. Dosissteigerungen sollten 0,5 mg/kg täglich bis zu einer Höchstdosis von 2,5 mg/kg pro Tag betragen. Das therapeutische Ansprechen tritt nach mehreren Behandlungswochen auf, normalerweise nach 6 bis 8; eine angemessene Probezeit sollte mindestens 12 Wochen betragen. Patienten, die sich nach 12 Wochen nicht gebessert haben, können als refraktär angesehen werden. IMURAN 50 mg kann bei Patienten mit klinischem Ansprechen langfristig fortgesetzt werden, aber die Patienten sollten sorgfältig überwacht werden, und es sollte versucht werden, die Dosis schrittweise zu reduzieren, um das Risiko von Toxizitäten zu verringern.
Die Erhaltungstherapie sollte mit der niedrigsten wirksamen Dosis erfolgen, und die verabreichte Dosis kann alle 4 Wochen schrittweise um 0,5 mg/kg oder etwa 25 mg täglich verringert werden, während die andere Therapie konstant gehalten wird. Die optimale Erhaltungsdauer von IMURAN 50 mg wurde nicht bestimmt. IMURAN kann abrupt abgesetzt werden, verzögerte Wirkungen sind jedoch möglich.
Verwendung bei Nierenfunktionsstörung
Relativ oligurische Patienten, insbesondere Patienten mit tubulärer Nekrose in der unmittelbaren postkaveren Transplantationsphase, können eine verzögerte Clearance von IMURAN oder seinen Metaboliten aufweisen, können besonders empfindlich auf dieses Arzneimittel reagieren und erhalten normalerweise niedrigere Dosen.
Verfahren zur ordnungsgemäßen Handhabung und Entsorgung dieses immunsuppressiven Antimetaboliten sollten in Betracht gezogen werden. Mehrere Leitlinien zu diesem Thema wurden veröffentlicht.25-31 Es besteht keine allgemeine Übereinstimmung darüber, dass alle in den Leitlinien empfohlenen Verfahren notwendig oder angemessen sind.
WIE GELIEFERT
50mg sich überlappende, kreisförmige, gelbe bis cremefarbene Tabletten mit Bruchkerbe, die auf jeder Tablette mit „IMURAN“ und „50“ bedruckt sind; Flasche mit 100 ( NDC 65483-590-10).
Bei 15° bis 25°C (59° bis 77°F) an einem trockenen Ort lagern und vor Licht schützen.
VERWEISE
25. Empfehlungen für den sicheren Umgang mit parenteralen antineoplastischen Arzneimitteln. Washington, DC: Sicherheitsabteilung; Apothekenabteilung des klinischen Zentrums und Krebspflegedienste, National Institute of Health; 1992. US-Gesundheitsministerium. Veröffentlichung des öffentlichen Gesundheitsdienstes NIH 92-2621.
26. AMA-Rat für wissenschaftliche Angelegenheiten. Richtlinien für den Umgang mit parenteralen Antineoplastika. JAMA. 1985; 253:15901592.
27. Nationale Studienkommission für zytotoxische Exposition. Empfehlungen zum Umgang mit Zytostatika. 1987. Erhältlich bei Louis P. Jeffrey, Vorsitzender der National Study Commission on Cytotoxic Exposure. Massachusetts College of Pharmacy and Allied Health Sciences, 179 Longwood Avenue, Boston, MA 02115.
28. Clinical Oncological Society of Australia. Richtlinien und Empfehlungen für den sicheren Umgang mit antineoplastischen Mitteln. Med. J. Aust. 1983; 1:426-428.
29. Jones RB, Frank R, Mass T. Sicherer Umgang mit Chemotherapeutika: ein Bericht des Mount Sinai Medical Center. CA Cancer J für Kliniker. 1983; 33:258-263.
30. Amerikanische Gesellschaft der Krankenhausapotheker. ASHP Technical Assistance Bulletin zum Umgang mit zytotoxischen und gefährlichen Arzneimitteln. Am J. Hosp Pharm. 1990; 47:1033-1049.
31. Yodaiken RE, Bennett D. OSHA-Arbeitspraxisrichtlinien für Personal, das mit zytotoxischen (antineoplastischen) Arzneimitteln zu tun hat. Am. J. Hosp. Pharm., 1996; 43:1193-1204.
Hergestellt von Pharmaceutics International, Inc. Hunt Valley, MD 21031 für Prometheus Laboratories Inc. San Diego, CA 92121. Überarbeitet: Februar 2014
NEBENWIRKUNGEN
Die wichtigsten und möglicherweise schwerwiegenden toxischen Wirkungen von IMURAN sind hämatologischer und gastrointestinaler Natur. Die Risiken einer Sekundärinfektion und Malignität sind ebenfalls signifikant (vgl WARNUNGEN ). Häufigkeit und Schweregrad der Nebenwirkungen hängen von der Dosis und Dauer von IMURAN sowie von der Grunderkrankung des Patienten oder begleitenden Therapien ab. Die Inzidenz von hämatologischen Toxizitäten und Neoplasien, die in Gruppen von Empfängern von Nierenhomotransplantaten angetroffen wurden, ist signifikant höher als in Studien, in denen IMURAN 25 mg gegen rheumatoide Arthritis eingesetzt wurde. Die relativen Inzidenzen in klinischen Studien sind nachstehend zusammengefasst:
Hämatologisch
Leukopenie und/oder Thrombozytopenie sind dosisabhängig und können spät im Verlauf der Therapie mit IMURAN auftreten. Eine Dosisreduktion oder ein vorübergehendes Absetzen kann zu einer Umkehr dieser Toxizitäten führen. Eine Infektion kann als sekundäre Manifestation einer Knochenmarksuppression oder Leukopenie auftreten, aber die Inzidenz einer Infektion bei renaler Homotransplantation ist 30- bis 60-mal höher als bei rheumatoider Arthritis. Anämien, einschließlich makrozytärer Anämie, und/oder Blutungen wurden berichtet.
Die TPMT-Genotypisierung oder -Phänotypisierung kann dabei helfen, Patienten mit geringer oder fehlender TPMT-Aktivität (homozygot für nicht-funktionelle Allele) zu identifizieren, bei denen ein erhöhtes Risiko für eine schwere, lebensbedrohliche Myelosuppression durch IMURAN besteht. Sehen KLINISCHE PHARMAKOLOGIE , WARNUNGEN und VORSICHTSMASSNAHMEN : Labortests . Todesfälle im Zusammenhang mit Panzytopenie wurden bei Patienten ohne TPMT-Aktivität berichtet, die Azathioprin erhielten.6,20
Magen-Darm
Übelkeit und Erbrechen können in den ersten Monaten der Therapie mit IMURAN 50 mg auftreten und traten bei etwa 12 % von 676 Patienten mit rheumatoider Arthritis auf. Die Häufigkeit von Magenbeschwerden kann häufig durch Verabreichung des Arzneimittels in geteilten Dosen und/oder nach den Mahlzeiten verringert werden. Bei einigen Patienten können Übelkeit und Erbrechen jedoch schwerwiegend sein und von Symptomen wie Durchfall, Fieber, Unwohlsein und Myalgien begleitet sein (siehe VORSICHTSMASSNAHMEN ). Erbrechen mit Bauchschmerzen kann selten bei einer Überempfindlichkeits-Pankreatitis auftreten. Es ist bekannt, dass Hepatotoxizität, die sich durch Erhöhung der alkalischen Phosphatase, des Bilirubins und/oder der Serumtransaminasen im Serum manifestiert, nach der Anwendung von Azathioprin auftritt, hauptsächlich bei Empfängern von Allotransplantaten. Bei Patienten mit rheumatoider Arthritis trat gelegentlich (weniger als 1 %) eine Hepatotoxizität auf. Hepatotoxizität nach einer Transplantation tritt am häufigsten innerhalb von 6 Monaten nach der Transplantation auf und ist im Allgemeinen nach Unterbrechung der Behandlung mit IMURAN reversibel. Bei Transplantationspatienten und bei einem Patienten, der IMURAN wegen Panuveitis erhielt, wurde eine seltene, aber lebensbedrohliche venöse Verschlusskrankheit im Zusammenhang mit der chronischen Verabreichung von Azathioprin beschrieben Indiziert zur Früherkennung von Hepatotoxizität. Bei klinischem Verdacht auf eine hepatische Venenverschlusskrankheit sollte IMURAN dauerhaft abgesetzt werden.
Andere
Es wurden weitere Nebenwirkungen geringer Häufigkeit berichtet. Dazu gehören Hautausschläge, Alopezie, Fieber, Arthralgien, Durchfall, Steatorrhoe, negative Stickstoffbilanz, reversible interstitielle Pneumonitis, hepatosplenisches T-Zell-Lymphom (vgl WARNUNGEN – Malignität ) und Sweet-Syndrom (akute febrile neutrophile Dermatose).
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Verwenden Sie mit Allopurinol
Einer der Wege zur Inaktivierung von Azathioprin wird durch Allopurinol gehemmt. Bei Patienten, die gleichzeitig IMURAN 50 mg und Allopurinol erhalten, sollte die Dosis von IMURAN 50 mg auf etwa 1/3 bis 1/4 der üblichen Dosis reduziert werden. Es wird empfohlen, bei Patienten mit geringer oder fehlender TPMT-Aktivität, die IMURAN 50 mg und Allopurinol erhalten, eine weitere Dosisreduktion oder alternative Therapien in Erwägung zu ziehen, da sowohl die TPMT- als auch die XO-Inaktivierungswege betroffen sind. Sehen KLINISCHE PHARMAKOLOGIE , WARNUNGEN , VORSICHTSMASSNAHMEN : Labortests und NEBENWIRKUNGEN Abschnitte.
Verwendung mit Aminosalicylaten
Es gibt In-vitro-Beweise dafür, dass Aminosalicylat-Derivate (z. B. Sulfasalazin, Mesalazin oder Olsalazin) das TPMT-Enzym hemmen. Die gleichzeitige Anwendung dieser Wirkstoffe mit IMURAN 50 mg sollte mit Vorsicht erfolgen.
Verwendung mit anderen Mitteln, die die Myelopoese beeinflussen
Arzneimittel, die die Leukozytenproduktion beeinflussen können, einschließlich Cotrimoxazol, können zu einer überschießenden Leukopenie führen, insbesondere bei Empfängern von Nierentransplantaten.
Verwendung mit Angiotensin-Converting-Enzym-Hemmern
Es wurde berichtet, dass die Anwendung von Angiotensin-Converting-Enzym-Hemmern zur Kontrolle des Bluthochdrucks bei Patienten unter Azathioprin Anämie und schwere Leukopenie verursacht.
Verwenden Sie mit Warfarin
IMURAN kann die gerinnungshemmende Wirkung von Warfarin hemmen.
Verwenden Sie mit Ribavirin
Es wurde berichtet, dass die Anwendung von Ribavirin bei Hepatitis C bei Patienten, die Azathioprin erhalten, eine schwere Panzytopenie hervorruft und das Risiko einer Azathioprin-bedingten Myelotoxizität erhöhen kann. Inosinmonophosphatdehydrogenase (IMDH) wird für einen der Stoffwechselwege von Azathioprin benötigt. Es ist bekannt, dass Ribavirin IMDH hemmt, was zur Akkumulation eines Azathioprin-Metaboliten, 6-Methylthioionosinmonophosphat (6MTITP), führt, der mit Myelotoxizität (Neutropenie, Thrombozytopenie und Anämie) in Verbindung gebracht wird. Bei Patienten, die Azathioprin mit Ribavirin erhalten, sollte ein vollständiges Blutbild, einschließlich Thrombozytenzahl, im ersten Monat wöchentlich, im zweiten und dritten Behandlungsmonat zweimal monatlich und dann monatlich oder häufiger, wenn Dosis- oder andere Therapieänderungen erforderlich sind, kontrolliert werden.
VERWEISE
6. Archivierte Daten, Prometheus Laboratories Inc.
20. Schutz E, Gummert J, Mohr F, Oellerich M. Azathioprin-induzierte Myelosuppression bei Herztransplantationspatienten mit Thiopurin-Methyltransferase-Mangel. Lanzette. 1993; 341:436.
21. Read AE, Wiesner RH, LaBrecque DR, et al. Lebervenenverschlusskrankheit im Zusammenhang mit Nierentransplantation und Azathioprin-Therapie. Ann Intern Med. 1986; 104:651-655.
22. Katzka DA, Saul SH, Jorkasky D, et al. Azathioprin und hepatische Venenverschlusskrankheit bei Nierentransplantationspatienten. Gastroenterologie. 1986; 90:446-454.
23. H. Weitz, J. M. Gokel, K. Loeshke, et al. Venenverschlusskrankheit der Leber bei Patienten, die eine immunsuppressive Therapie erhalten. Virchows Arch A Pathol Anat Histol. 1982; 395:245-256.
WARNUNGEN
Malignität
Patienten, die Immunsuppressiva, einschließlich IMURAN 50 mg, erhalten, haben ein erhöhtes Risiko, ein Lymphom und andere maligne Erkrankungen, insbesondere der Haut, zu entwickeln. Ärzte sollten Patienten über das Malignitätsrisiko von IMURAN informieren. Wie bei Patienten mit erhöhtem Hautkrebsrisiko üblich, sollte die Exposition gegenüber Sonnenlicht und ultraviolettem Licht durch das Tragen von Schutzkleidung und die Verwendung eines Sonnenschutzmittels mit hohem Lichtschutzfaktor begrenzt werden.
Nach der Transplantation
Es ist bekannt, dass Nierentransplantationspatienten ein erhöhtes Risiko für maligne Erkrankungen haben, vor allem Hautkrebs und Retikulumzell- oder lymphomatöse Tumoren. Das Risiko für Lymphome nach der Transplantation kann bei Patienten erhöht sein, die eine aggressive Behandlung mit immunsuppressiven Arzneimitteln, einschließlich IMURAN, erhalten. Daher sollte die immunsuppressive medikamentöse Therapie auf den niedrigsten wirksamen Niveaus gehalten werden.
Rheumatoide Arthritis
Es liegen Informationen zum Malignomrisiko bei Anwendung von IMURAN 50 mg bei rheumatoider Arthritis vor (siehe NEBENWIRKUNGEN ). Es war nicht möglich, das genaue Malignitätsrisiko aufgrund von IMURAN zu definieren. Die Daten deuten darauf hin, dass das Risiko bei Patienten mit rheumatoider Arthritis erhöht sein könnte, wenn auch niedriger als bei Nierentransplantationspatienten. Bei Patienten mit rheumatoider Arthritis, die IMURAN erhalten haben, wurde jedoch über akute myeloische Leukämie sowie solide Tumore berichtet.
Entzündliche Darmerkrankung
Postmarketing-Fälle von hepatosplenischem T-Zell-Lymphom (HSTCL), einer seltenen Art von T-Zell-Lymphom, wurden bei mit IMURAN behandelten Patienten berichtet. Diese Fälle hatten einen sehr aggressiven Krankheitsverlauf und waren tödlich. Die Mehrzahl der gemeldeten Fälle trat bei Patienten mit Morbus Crohn oder Colitis ulcerosa auf, und die Mehrzahl betraf jugendliche und junge erwachsene Männer. Einige der Patienten wurden mit IMURAN als Monotherapie behandelt und einige hatten bei oder vor der Diagnose eine Begleitbehandlung mit einem TNFα-Blocker erhalten. Die Sicherheit und Wirksamkeit von IMURAN 25 mg zur Behandlung von Morbus Crohn und Colitis ulcerosa wurden nicht nachgewiesen.
Zytopenien
Schwere Leukopenie, Thrombozytopenie, Anämien einschließlich makrozytärer Anämie und/oder Panzytopenie können bei Patienten auftreten, die mit IMURAN behandelt werden. Es kann auch zu einer schweren Knochenmarksuppression kommen. Bei Patienten mit mittlerer Thiopurin-S-Methyltransferase (TPMT)-Aktivität besteht möglicherweise ein erhöhtes Myelotoxizitätsrisiko, wenn sie herkömmliche IMURAN-Dosen erhalten. Patienten mit geringer oder fehlender TPMT-Aktivität haben ein erhöhtes Risiko, eine schwere, lebensbedrohliche Myelotoxizität zu entwickeln, wenn sie herkömmliche IMURAN-Dosen erhalten. Die TPMT-Genotypisierung oder -Phänotypisierung kann helfen, Patienten zu identifizieren, die ein erhöhtes Risiko für die Entwicklung einer Toxizität von IMURAN 50 mg haben.2-9 (Siehe VORSICHTSMASSNAHMEN : Labortests ). Hämatologische Toxizitäten sind dosisabhängig und können bei Nierentransplantationspatienten, deren Homotransplantat abgestoßen wird, schwerwiegender sein. Es wird empfohlen, dass Patienten, die IMURAN erhalten, während des ersten Behandlungsmonats wöchentlich ein vollständiges Blutbild, einschließlich Blutplättchenzahl, erhalten, zweimal monatlich im zweiten und dritten Behandlungsmonat und dann monatlich oder häufiger, wenn Dosisänderungen oder andere Therapieänderungen erforderlich sind. Es kann zu einer verzögerten hämatologischen Suppression kommen. Eine sofortige Dosisreduktion oder ein vorübergehendes Absetzen des Arzneimittels kann erforderlich sein, wenn ein rascher Abfall oder anhaltend niedrige Leukozytenzahlen oder andere Anzeichen einer Knochenmarksdepression vorliegen. Leukopenie korreliert nicht mit therapeutischer Wirkung; Daher sollte die Dosis nicht absichtlich erhöht werden, um die Anzahl der weißen Blutkörperchen zu senken.
Schwere Infektionen
Patienten, die Immunsuppressiva, einschließlich Imuran 25 mg, erhalten, haben ein erhöhtes Risiko für bakterielle, virale, Pilz-, Protozoen- und opportunistische Infektionen, einschließlich der Reaktivierung latenter Infektionen. Diese Infektionen können schwerwiegende, einschließlich tödliche Folgen haben.
Progressive multifokale Leukenzephalopathie
Bei Patienten, die mit Immunsuppressiva, einschließlich Imuran, behandelt wurden, wurden Fälle von JC-Virus-assoziierten Infektionen berichtet, die zu progressiver multifokaler Leukoenzephalopathie (PML) führten, manchmal mit tödlichem Ausgang. Zu den Risikofaktoren für PML gehören die Behandlung mit immunsuppressiven Therapien und die Beeinträchtigung der Immunfunktion. Erwägen Sie die Diagnose einer PML bei jedem Patienten mit neu auftretenden neurologischen Manifestationen und erwägen Sie die Konsultation eines Neurologen, wenn dies klinisch angezeigt ist. Erwägen Sie, die Stärke der Immunsuppression bei Patienten zu reduzieren, die eine PML entwickeln. Berücksichtigen Sie bei Transplantationspatienten das Risiko, das die reduzierte Immunsuppression für das Transplantat darstellt.
Wirkung auf das Sperma bei Tieren
Es wurde berichtet, dass IMURAN eine vorübergehende Depression der Spermatogenese und eine Verringerung der Lebensfähigkeit der Spermien und der Spermienzahl bei Mäusen bei Dosen verursacht, die das 10-fache der therapeutischen Humandosis betragen;10 ein verringerter Prozentsatz fruchtbarer Paarungen trat auf, wenn Tiere 5 mg/kg erhielten.11
Schwangerschaft
Schwangerschaftskategorie D
IMURAN kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. IMURAN 50 mg sollte während der Schwangerschaft nicht ohne sorgfältige Nutzen-Risiko-Abwägung verabreicht werden. Wann immer möglich, sollte die Anwendung von IMURAN bei schwangeren Patientinnen vermieden werden. Dieses Medikament sollte nicht zur Behandlung von rheumatoider Arthritis bei schwangeren Frauen verwendet werden.12
IMURAN ist bei Kaninchen und Mäusen teratogen, wenn es in Dosen verabreicht wird, die der menschlichen Dosis entsprechen (5 mg/kg täglich). Zu den Anomalien gehörten Skelettmissbildungen und viszerale Anomalien.11
Begrenzte immunologische und andere Anomalien sind bei einigen Säuglingen aufgetreten, die von Empfängern von Nierentransplantaten unter IMURAN geboren wurden. In einem ausführlichen Fallbericht13 wurden dokumentierte Lymphopenie, verringerte IgG- und IgM-Spiegel, CMV-Infektion und ein verringerter Thymusschatten bei einem Säugling festgestellt, dessen Mutter während der gesamten Schwangerschaft täglich 150 mg Azathioprin und 30 mg Prednison erhielt. Nach 10 Wochen waren die meisten Merkmale normalisiert. DeWitte et al. berichteten über Panzytopenie und schwere Immunschwäche bei einem Frühgeborenen, dessen Mutter täglich 125 mg Azathioprin und 12,5 mg Prednison erhielt.14 Es wurden zwei Berichte über abnormale körperliche Befunde veröffentlicht. Williamson und Karp beschrieben einen Säugling, der mit präaxialer Polydaktylie geboren wurde und dessen Mutter während der Schwangerschaft täglich 200 mg Azathioprin und jeden zweiten Tag Prednison 20 mg erhielt.15 Tallent et al. beschrieben einen Säugling mit einer großen Myelomeningozele im oberen Lendenbereich, beidseitig ausgerenkten Hüften und beidseitig Spitzfuß equinovarus. Der Vater war auf Langzeittherapie mit Azathioprin.16
Vor der Anwendung von IMURAN bei Patientinnen im gebärfähigen Alter müssen Nutzen und Risiko sorgfältig abgewogen werden. Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. Wenn dieses Arzneimittel während der Schwangerschaft angewendet wird oder wenn die Patientin während der Einnahme dieses Arzneimittels schwanger wird, sollte die Patientin über die potenzielle Gefahr für den Fötus informiert werden. Frauen im gebärfähigen Alter sollte geraten werden, eine Schwangerschaft zu vermeiden.
VORSICHTSMASSNAHMEN
Allgemein
Es wurde über eine gastrointestinale Überempfindlichkeitsreaktion berichtet, die durch schwere Übelkeit und Erbrechen gekennzeichnet war. Diese Symptome können auch von Durchfall, Hautausschlag, Fieber, Unwohlsein, Muskelschmerzen, erhöhten Leberenzymen und gelegentlich Hypotonie begleitet sein. Symptome einer gastrointestinalen Toxizität entwickeln sich meistens innerhalb der ersten Wochen der Therapie mit IMURAN 25 mg und sind nach Absetzen des Arzneimittels reversibel. Die Reaktion kann innerhalb von Stunden nach einer erneuten Provokation mit einer Einzeldosis IMURAN erneut auftreten.
Labortests
Vollständige Überwachung des Blutbildes (CBC).
Bei Patienten, die IMURAN 25 mg erhalten, sollte ein vollständiges Blutbild, einschließlich Thrombozytenzahl, im ersten Monat wöchentlich, im zweiten und dritten Behandlungsmonat zweimal monatlich, dann monatlich oder häufiger, wenn Dosisänderungen oder andere Therapieänderungen erforderlich sind, erstellt werden.
TPMT-Test
Es wird empfohlen, Patienten mit Genotyp oder Phänotyp für TPMT in Betracht zu ziehen. Phänotypisierungs- und Genotypisierungsverfahren sind im Handel erhältlich. Die häufigsten nicht-funktionalen Allele, die mit verringerter TPMT-Aktivität assoziiert sind, sind TPMT*2, TPMT*3A und TPMT*3C. Patienten mit zwei nicht-funktionalen Allelen (homozygot) haben eine geringe oder keine TPMT-Aktivität und Patienten mit einem nicht-funktionalen Allel (heterozygot) haben eine mittlere Aktivität. Genaue Phänotypisierungsergebnisse (TPMT-Aktivität der roten Blutkörperchen) sind bei Patienten, die kürzlich Bluttransfusionen erhalten haben, nicht möglich. TPMT-Tests können auch bei Patienten mit anormalen CBC-Ergebnissen in Betracht gezogen werden, die nicht auf eine Dosisreduktion ansprechen. Bei diesen Patienten ist ein frühzeitiges Absetzen des Arzneimittels ratsam. TPMT-TESTS KÖNNEN DIE ÜBERWACHUNG DES VOLLSTÄNDIGEN BLUTZAHLS (CBC) BEI PATIENTEN, DIE IMURAN ERHALTEN, NICHT ERSETZEN. Sehen KLINISCHE PHARMAKOLOGIE , WARNUNGEN , NEBENWIRKUNGEN und DOSIERUNG UND ANWENDUNG Abschnitte.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Sehen WARNUNGEN Sektion.
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie D. Sehen WARNUNGEN Sektion.
Stillende Mutter
Die Anwendung von IMURAN 25 mg bei stillenden Müttern wird nicht empfohlen. Azathioprin oder seine Metaboliten werden in geringen Mengen sowohl transplazentar als auch in die Muttermilch übertragen.17,18,19 Aufgrund des für Azathioprin nachgewiesenen tumorerzeugenden Potenzials sollte eine Entscheidung getroffen werden, ob das Stillen beendet oder das Medikament abgesetzt werden soll Bedeutung des Medikaments für die Mutter.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit von Azathioprin bei pädiatrischen Patienten wurden nicht nachgewiesen.
VERWEISE
2. Weinshilboum R. Thiopurin-Pharmakogenetik: klinische und molekulare Studien der Thiopurin-Methyltransferase. Drug Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Der Thiopurin-S-Methyltransferase-Genlocus – Implikationen für die klinische Pharmakogenomik. Pharmakogenomik. 2002;3:89-98.
4. Anstey A., Lennard L., Mayou SC, et al. Panzytopenie im Zusammenhang mit Azathioprin – ein Enzymmangel, der durch einen gemeinsamen genetischen Polymorphismus verursacht wird: eine Übersicht. JR Soc Med. 1992; 85: 752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Reduzierte Thiopurin-Methyltransferase-Aktivität und Entwicklung von Nebenwirkungen einer Behandlung mit Azathioprin bei Patienten mit rheumatoider Arthritis. Arthritis-Rheuma. 1998; 41:18581866.
6. Archivierte Daten, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Molekulare Diagnose von Thiopurin-S-Methyltransferase-Mangel: genetische Grundlage für Azathioprin- und Mercaptopurin-Intoleranz. Ann Intern Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. Der Thiopurin-Methyltransferase-Genotyp sagt eine therapielimitierende schwere Toxizität von Azathioprin voraus. Ann Intern Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Relevanz des Thiopurin-Methyltransferase-Status bei Rheumatologiepatienten, die Azathioprin erhalten. Rheumatologie. 2004; 43:13-18.
10. Clark JM. Die Mutagenität von Azathioprin bei Mäusen, Drosophila melanogaster und Neurospora crassa. Mutat-Res. 1975; 28:87-99.
11. Archivierte Daten, Prometheus Laboratories Inc.
12. Tagatz GE, Simmons RL. Schwangerschaft nach Nierentransplantation. Ann Intern Med. 1975; 82:113-114. Redaktionelle Hinweise.
13. Cote' CJ, Meuwissen HJ, Pickering RJ. Wirkungen von Prednison und Azathioprin, die der Mutter während der Schwangerschaft verabreicht wurden, auf das Neugeborene. J Pediatr. 1974; 85:324-328.
14. DeWitte DB, Buick MK, Cyran SE, et al. Neonatale Panzytopenie und schwere kombinierte Immunschwäche im Zusammenhang mit der vorgeburtlichen Verabreichung von Azathioprin und Prednison. J Pediatr. 1984; 105:625-628.
15. Williamson RA, Karp LE. Azathioprin-Teratogenität: Überprüfung der Literatur und des Fallberichts. Geburtshilfe Gynäk. 1981; 58:247-250.
16. Tallent MB, Simmons RL, Najarian JS. Geburtsfehler beim Kind eines männlichen Empfängers einer Nierentransplantation. JAMA. 1970; 211: 1854-1855.
17. Archivierte Daten, Prometheus Laboratories Inc.
18. Saarikoski S, Seppälä M. Immunsuppression während der Schwangerschaft: Übertragung von Azathioprin und seinen Metaboliten von der Mutter auf den Fötus. Am J Obstet Gynecol. 1973; 115:1100-1106.
19. Coulam CB, Moyer TP, Jiang NS, et al. Stillen nach Nierentransplantation. Transplantationsverfahren 1982; 14: 605-609.
ÜBERDOSIS
Die oralen LD50-Werte für Einzeldosen von IMURAN 50 mg bei Mäusen und Ratten betragen 2500 mg/kg bzw. 400 mg/kg. Sehr hohe Dosen dieses Antimetaboliten können zu Knochenmarkshypoplasie, Blutungen, Infektionen und Tod führen. Etwa 30 % von IMURAN ist an Serumproteine gebunden, aber etwa 45 % werden während einer 8-stündigen Hämodialyse entfernt.24 Es wurde über einen einzelnen Fall eines Nierentransplantationspatienten berichtet, der eine Einzeldosis von 7500 mg IMURAN einnahm. Die unmittelbaren toxischen Reaktionen waren Übelkeit, Erbrechen und Durchfall, gefolgt von leichter Leukopenie und leichten Anomalien der Leberfunktion. Die Anzahl der weißen Blutkörperchen, SGOT und Bilirubin normalisierten sich 6 Tage nach der Überdosierung wieder.
KONTRAINDIKATIONEN
IMURAN 25 mg sollte nicht an Patienten verabreicht werden, die eine Überempfindlichkeit gegen das Arzneimittel gezeigt haben. IMURAN sollte nicht zur Behandlung von rheumatoider Arthritis bei schwangeren Frauen angewendet werden. Patienten mit rheumatoider Arthritis, die zuvor mit Alkylanzien (Cyclophosphamid, Chlorambucil, Melphalan oder anderen) behandelt wurden, können ein prohibitives Malignitätsrisiko haben, wenn sie mit IMURAN behandelt werden.
VERWEISE
24. Schusziarra V, Ziekursch V, Schlamp R, et al. Pharmakokinetik von Azathioprin unter Hämodialyse. Int. J. Clin. Pharmacol. Biopharm. 1976; 14:298-302.
KLINISCHE PHARMAKOLOGIE
Azathioprin wird nach oraler Gabe gut resorbiert. Die maximale Radioaktivität im Serum tritt 1 bis 2 Stunden nach oraler Gabe von 35S-Azathioprin auf und zerfällt mit einer Halbwertszeit von 5 Stunden. Dies ist keine Schätzung der Halbwertszeit von Azathioprin selbst, sondern die Zerfallsrate aller 35S-haltigen Metaboliten des Arzneimittels. Aufgrund des umfangreichen Metabolismus liegt nur ein Bruchteil der Radioaktivität als Azathioprin vor. Übliche Dosen führen zu niedrigen Blutspiegeln von Azathioprin und dem daraus gewonnenen Mercaptopurin ( ÜBERDOSIERUNG .
Azathioprin wird zu 6-Mercaptopurin (6-MP) metabolisiert. Beide Verbindungen werden schnell aus dem Blut eliminiert und in Erythrozyten und Leber oxidiert oder methyliert; nach 8 Stunden ist kein Azathioprin oder Mercaptopurin im Urin nachweisbar. Die Aktivierung von 6-Mercaptopurin erfolgt über Hypoxanthin-Guanin-Phosphoribosyltransferase (HGPRT) und eine Reihe von multienzymatischen Prozessen, an denen Kinasen beteiligt sind, um 6-Thioguanin-Nukleotide (6-TGNs) als Hauptmetaboliten zu bilden (siehe Stoffwechselschema in Abbildung 1 ). Die Zytotoxizität von Azathioprin ist teilweise auf den Einbau von 6-TGN in die DNA zurückzuführen.
6-MP unterliegt zwei Hauptinaktivierungswegen (Abbildung 1). Eine davon ist die Thiolmethylierung, die durch das Enzym Thiopurin-S-Methyltransferase (TPMT) katalysiert wird, um den inaktiven Metaboliten Methyl-6-MP (6-MeMP) zu bilden. Die TPMT-Aktivität wird durch einen genetischen Polymorphismus kontrolliert.1,2,3 Bei Kaukasiern und Afroamerikanern erben ungefähr 10 % der Bevölkerung ein nicht-funktionelles TPMT-Allel (heterozygot), das eine intermediäre TPMT-Aktivität verleiht, und 0,3 % erben zwei nicht-funktionelle TPMT Allele (homozygot) für geringe oder fehlende TPMT-Aktivität. Nicht-funktionelle Allele sind bei Asiaten weniger verbreitet. Die TPMT-Aktivität korreliert umgekehrt mit den 6-TGN-Spiegeln in Erythrozyten und vermutlich anderen hämatopoetischen Geweben, da diese Zellen vernachlässigbare Xanthinoxidase-Aktivitäten (beteiligt am anderen Inaktivierungsweg) aufweisen, wodurch die TPMT-Methylierung als einziger Inaktivierungsweg übrig bleibt. Bei Patienten mit mittlerer TPMT-Aktivität besteht möglicherweise ein erhöhtes Myelotoxizitätsrisiko, wenn sie herkömmliche IMURAN-Dosen erhalten. Patienten mit geringer oder fehlender TPMT-Aktivität haben ein erhöhtes Risiko, eine schwere, lebensbedrohliche Myelotoxizität zu entwickeln, wenn sie herkömmliche IMURAN-Dosen erhalten.4-9 Die TPMT-Genotypisierung oder -Phänotypisierung (rote Blutkörperchen-TPMT-Aktivität) kann helfen, Patienten mit erhöhter Aktivität zu identifizieren Risiko für die Entwicklung einer Toxizität von IMURAN 25 mg.2,3,7,8,9 Genaue Phänotypisierungsergebnisse (TPMT-Aktivität der roten Blutkörperchen) sind bei Patienten, die kürzlich Bluttransfusionen erhalten haben, nicht möglich. Sehen WARNUNGEN , VORSICHTSMASSNAHMEN : WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , VORSICHTSMASSNAHMEN : Labortests und NEBENWIRKUNGEN Abschnitte.
Abbildung 1 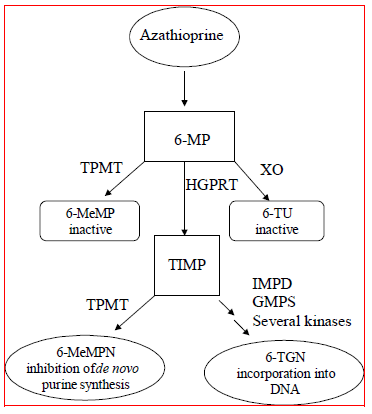 Abbildung 1. Stoffwechselweg von Azathioprin: Konkurrierende Wege führen zur Inaktivierung durch TPMT oder XO oder zum Einbau zytotoxischer Nukleotide in die DNA.
Abbildung 1. Stoffwechselweg von Azathioprin: Konkurrierende Wege führen zur Inaktivierung durch TPMT oder XO oder zum Einbau zytotoxischer Nukleotide in die DNA.
GMPS: Guanosinmonophosphat-Synthetase; HGPRT: Hypoxanthin-Guanin-Phosphoribosyl-Transferase; IMPD: Inosinmonophosphatdehydrogenase; MeMP: Methylmercaptopurin; MeMPN: Methylmercaptopurin-Nukleotid; TGN: Thioguanin-Nukleotide; TIMP: Thioinosinmonophosphat; TPMT: Thiopurin-S-Methyltransferase; TU Thioursäure; XO: Xanthinoxidase (Angepasst aus Pharmacogenomics 2002; 3:89–98; und Cancer Res 2001; 61:5810–5816.)
Ein weiterer Inaktivierungsweg ist die Oxidation, die durch Xanthinoxidase (XO) katalysiert wird, um 6-Thioursäure zu bilden. Die Hemmung der Xanthinoxidase bei Patienten, die Allopurinol (ZYLOPRIM®) erhalten, ist die Grundlage für die bei diesen Patienten erforderliche Dosisreduktion von Azathioprin (vgl VORSICHTSMASSNAHMEN : WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ). Die Anteile der Metaboliten sind bei einzelnen Patienten unterschiedlich, und dies erklärt vermutlich das unterschiedliche Ausmaß und die Dauer der Arzneimittelwirkungen. Die renale Clearance ist wahrscheinlich nicht wichtig für die Vorhersage der biologischen Wirksamkeit oder Toxizität, obwohl bei Patienten mit eingeschränkter Nierenfunktion eine Dosisreduktion praktiziert wird.
Homograft-Überleben
Die Verwendung von Azathioprin zur Hemmung der renalen Homotransplantat-Abstoßung ist gut etabliert, der/die Mechanismus(en) für diese Wirkung sind etwas unklar. Das Medikament unterdrückt Überempfindlichkeiten des zellvermittelten Typs und verursacht variable Veränderungen in der Antikörperproduktion. Die Unterdrückung von T-Zell-Effekten, einschließlich der Aufhebung der T-Zell-Unterdrückung, hängt von der zeitlichen Beziehung zum antigenen Stimulus oder Transplantat ab. Dieses Mittel hat wenig Wirkung auf etablierte Transplantatabstoßungen oder Sekundärreaktionen.
Veränderungen in spezifischen Immunantworten oder immunologischen Funktionen bei Transplantatempfängern lassen sich nur schwer spezifisch mit der Immunsuppression durch Azathioprin in Verbindung bringen. Diese Patienten haben eine subnormale Reaktion auf Impfstoffe, eine geringe Anzahl von T-Zellen und eine abnormale Phagozytose durch periphere Blutzellen, aber ihre mitogenen Reaktionen, Serum-Immunglobuline und sekundären Antikörperreaktionen sind normalerweise normal.
Immuninflammatorische Reaktion
Azathioprin unterdrückt Krankheitsmanifestationen sowie die zugrunde liegende Pathologie in Tiermodellen von Autoimmunerkrankungen. Beispielsweise wird die Schwere der adjuvanten Arthritis durch Azathioprin reduziert.
Die Mechanismen, durch die Azathioprin Autoimmunerkrankungen beeinflusst, sind nicht bekannt. Azathioprin ist immunsuppressiv, verzögerte Überempfindlichkeits- und zelluläre Zytotoxizitätstests werden stärker unterdrückt als Antikörperreaktionen. Im Rattenmodell der adjuvanten Arthritis wurde gezeigt, dass Azathioprin die Lymphknotenhyperplasie hemmt, die dem Einsetzen der Krankheitszeichen vorausgeht. Sowohl die immunsuppressiven als auch die therapeutischen Wirkungen in Tiermodellen sind dosisabhängig. Azathioprin gilt als langsam wirkendes Medikament und die Wirkungen können nach Absetzen des Medikaments anhalten.
VERWEISE
1. Lennard L. Die klinische Pharmakologie von 6-Mercaptopurin. Eur J Clin Pharmacol. 1992;43:329-339.
2. Weinshilboum R. Thiopurin-Pharmakogenetik: klinische und molekulare Studien der Thiopurin-Methyltransferase. Drug Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Der Thiopurin-S-Methyltransferase-Genlocus – Implikationen für die klinische Pharmakogenomik. Pharmakogenomik. 2002;3:89-98.
4. Anstey A., Lennard L., Mayou SC, et al. Panzytopenie im Zusammenhang mit Azathioprin – ein Enzymmangel, der durch einen gemeinsamen genetischen Polymorphismus verursacht wird: eine Übersicht. JR Soc Med. 1992; 85: 752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Reduzierte Thiopurin-Methyltransferase-Aktivität und Entwicklung von Nebenwirkungen einer Behandlung mit Azathioprin bei Patienten mit rheumatoider Arthritis. Arthritis-Rheuma. 1998; 41:18581866.
6. Archivierte Daten, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Molekulare Diagnose von Thiopurin-S-Methyltransferase-Mangel: genetische Grundlage für Azathioprin- und Mercaptopurin-Intoleranz. Ann Intern Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. Der Thiopurin-Methyltransferase-Genotyp sagt eine therapielimitierende schwere Toxizität von Azathioprin voraus. Ann Intern Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Relevanz des Thiopurin-Methyltransferase-Status bei Rheumatologiepatienten, die Azathioprin erhalten. Rheumatologie. 2004; 43:13-18.
INFORMATIONEN ZUM PATIENTEN
Patienten, die mit der Behandlung mit IMURAN beginnen, sollten über die Notwendigkeit regelmäßiger Blutuntersuchungen informiert werden, während sie das Medikament erhalten, und sollten ermutigt werden, ihrem Arzt alle ungewöhnlichen Blutungen oder Blutergüsse zu melden. Sie sollten über die Infektionsgefahr während der Behandlung mit IMURAN informiert und aufgefordert werden, ihrem Arzt Anzeichen und Symptome einer Infektion zu melden. Sorgfältige Dosierungsanweisungen sollten dem Patienten gegeben werden, insbesondere wenn IMURAN bei Vorliegen einer eingeschränkten Nierenfunktion oder gleichzeitig mit Allopurinol verabreicht wird (siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN Unterabschnitt u DOSIERUNG UND ANWENDUNG ). Die Patientinnen sollten auf die potenziellen Risiken der Anwendung von IMURAN 50 mg während der Schwangerschaft und während der Stillzeit hingewiesen werden. Das erhöhte Malignitätsrisiko nach einer Therapie mit IMURAN sollte dem Patienten erklärt werden.