Naprelan 250mg, 500mg Naproxen Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Naprelan und wie wird es angewendet?
Naprelan ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von rheumatoider Arthritis, Osteoarthritis, Ankylosin-Spondylitis, Dysmenorrhoe, akuter Gicht und Schmerzen. Naprelan kann allein oder mit anderen Medikamenten verwendet werden.
Naprelan gehört zu einer Klasse von Arzneimitteln, die als NSAIDs bezeichnet werden.
Es ist nicht bekannt, ob Naprelan 250 mg bei Kindern unter 2 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Naprelan 500mg haben?
Naprelan kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Naprelan sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Naprelan. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
RISIKO SCHWERER KARDIOVASKULÄRER UND GASTROINTESTINALER EREIGNISSE
Kardiovaskuläre thrombotische Ereignisse
Magen-Darm-Blutungen, Ulzerationen und Perforationen
BEZEICHNUNG
NAPRELAN (Naproxen-Natrium) Tabletten mit kontrollierter Freisetzung ist ein nichtsteroidales entzündungshemmendes Arzneimittel, das als Tabletten mit kontrollierter Freisetzung in den Stärken 375 mg, 500 mg und 750 mg zur oralen Verabreichung erhältlich ist. Der chemische Name ist 2-Naphthalinessigsäure, 6-Methoxy-α-methyl-natriumsalz, (S)-. Das Molekulargewicht beträgt 252,24. Seine Summenformel ist C14H13NaO3 und es hat die folgende chemische Struktur.
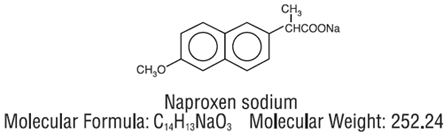
Naproxen-Natrium ist ein geruchloses kristallines Pulver von weißer bis cremiger Farbe. Es ist in Methanol und Wasser löslich. NAPRELAN 250 mg Tabletten enthalten 412,5 mg, 550 mg oder 825 mg Naproxen-Natrium, entsprechend 375 mg, 500 mg und 750 mg Naproxen bzw. 37,5 mg, 50 mg und 75 mg Natrium. Jede NAPRELAN 250 mg Tablette enthält außerdem die folgenden Hilfsstoffe: Ammoniummethacrylat-Copolymer Typ A, Ammoniummethacrylat-Copolymer Typ B, Zitronensäure, Crospovidon, Magnesiumstearat, Methacrylsäure-Copolymer Typ A, mikrokristalline Zellulose, Povidon und Talk. Der Tablettenüberzug enthält Hydroxypropylmethylcellulose, Polyethylenglykol und Titandioxid.
INDIKATIONEN
NAPRELAN 250 mg Tabletten sind angezeigt zur Behandlung von:
 [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
DOSIERUNG UND ANWENDUNG
Allgemeine Dosierungsanleitung
Wägen Sie die potenziellen Vorteile und Risiken von NAPRELAN und anderen Behandlungsoptionen sorgfältig ab, bevor Sie sich für die Anwendung von NAPRELAN entscheiden. Verwenden Sie die niedrigste wirksame Dosis für die kürzeste Dauer im Einklang mit den individuellen Behandlungszielen des Patienten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nachdem das Ansprechen auf die Initialtherapie mit NAPRELAN beobachtet wurde, sollten Dosis und Häufigkeit an die individuellen Bedürfnisse des Patienten angepasst werden.
Rheumatoide Arthritis, Osteoarthritis und Spondylitis ankylosans
Die empfohlene Anfangsdosis von NAPRELAN Tabletten bei Erwachsenen beträgt zwei NAPRELAN 375 mg Tabletten (750 mg) einmal täglich, eine NAPRELAN 750 mg (750 mg) einmal täglich oder zwei NAPRELAN 500 mg Tabletten (1.000 mg) einmal täglich. Bei Patienten, die bereits Naproxen 250 mg, 375 mg oder 500 mg zweimal täglich (morgens und abends) einnehmen, kann ihre tägliche Gesamtdosis durch NAPRELAN 500 mg Tabletten als einzelne Tagesdosis ersetzt werden.
Während der Langzeitanwendung kann die Dosis von NAPRELAN 250 mg Tabletten je nach klinischem Ansprechen des Patienten nach oben oder unten angepasst werden. Bei Patienten, die niedrigere Dosen von NAPRELAN-Tabletten gut vertragen, kann die Dosis auf zwei NAPRELAN-750-mg-Tabletten (1.500 mg) oder drei NAPRELAN-500-mg-Tabletten (1.500 mg) einmal täglich für begrenzte Zeiträume erhöht werden, wenn ein höherer entzündungshemmender Wert erreicht wird /analgetische Aktivität erforderlich ist. Bei der Behandlung von Patienten, insbesondere bei höheren Dosierungen, sollte der Arzt einen ausreichend erhöhten klinischen Nutzen beobachten, um das potenziell erhöhte Risiko auszugleichen [siehe KLINISCHE PHARMAKOLOGIE ]. Bei jedem Patienten sollte die niedrigste wirksame Dosis gesucht und angewendet werden. Die symptomatische Besserung der Arthritis beginnt normalerweise innerhalb einer Woche; jedoch kann eine zweiwöchige Behandlung erforderlich sein, um einen therapeutischen Nutzen zu erzielen.
Behandlung von Schmerzen, primärer Dysmenorrhoe und akuter Tendinitis und Bursitis
Die empfohlene Anfangsdosis beträgt einmal täglich zwei Tabletten NAPRELAN 500 mg (1.000 mg). Bei Patienten, die einen größeren analgetischen Nutzen benötigen, können zwei NAPRELAN 750 mg Tabletten (1.500 mg) oder drei NAPRELAN 500 mg Tabletten (1.500 mg) für einen begrenzten Zeitraum verwendet werden. Danach sollte die Tagesgesamtdosis zwei NAPRELAN 500 mg Tabletten (1.000 mg) nicht überschreiten.
Akute Gicht
Die empfohlene Dosis beträgt am ersten Tag zwei bis drei NAPRELAN 500 mg Tabletten (1.000 bis 1.500 mg) einmal täglich, gefolgt von zwei NAPRELAN 500 mg Tabletten (1.000 mg) einmal täglich, bis der Anfall abgeklungen ist.
Dosisanpassungen bei Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit eingeschränkter Nieren- oder Leberfunktion oder bei älteren Patienten sollte eine niedrigere Dosis in Betracht gezogen werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Studien zeigen, dass, obwohl die Gesamtplasmakonzentration von Naproxen unverändert ist, der ungebundene Plasmaanteil von Naproxen bei älteren Menschen erhöht ist. Vorsicht ist geboten, wenn hohe Dosen erforderlich sind, und bei älteren Patienten kann eine Dosisanpassung erforderlich sein. Wie bei anderen Arzneimitteln, die bei älteren Menschen angewendet werden, ist es ratsam, die niedrigste wirksame Dosis zu verwenden.
WIE GELIEFERT
Darreichungsformen und Stärken
NAPRELAN (Naproxen-Natrium) Tabletten mit kontrollierter Freisetzung sind wie folgt erhältlich:
Lagerung und Handhabung
NAPRELAN (Naproxen-Natrium) 375 mg, 500 mg und 750 mg sind Tabletten mit kontrollierter Freisetzung, erhältlich als:
NAPRELAN 375 : weiße, kapselförmige Tablette mit „N“ auf einer Seite und „375“ auf der Rückseite; in 100er Flaschen; NDC 52427-272-01. Jede Tablette enthält 412,5 mg Naproxen-Natrium, entsprechend 375 mg Naproxen.
NAPRELAN 500 : weiße, kapselförmige Tablette mit „N“ auf einer Seite und „500“ auf der Rückseite; in 75er Flaschen; NDC 52427-273-75. Jede Tablette enthält 550 mg Naproxen-Natrium, entsprechend 500 mg Naproxen.
NAPRELAN 750 : weiße, kapselförmige Tablette mit „N“ auf einer Seite und „750“ auf der Rückseite; in 30er Flaschen; NDC 52427-274-30. Jede Tablette enthält 825 mg Naproxen-Natrium, entsprechend 750 mg Naproxen.
Lagerung
Bei Raumtemperatur lagern, 20° bis 25°C (68° bis 77°F), Abweichungen zulässig 15° bis 30°C (59° bis 86°F) [siehe USP Controlled Room Temperature]. Apotheker: In einem gut verschlossenen Behälter abgeben.
Vertrieb durch: Almatica Pharma, Inc. Morristown, NJ 07960 USA. Überarbeitet: April 2021
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden in anderen Abschnitten der Kennzeichnung ausführlicher erörtert:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Wie bei allen Arzneimitteln dieser Klasse hängt die Häufigkeit und Schwere unerwünschter Ereignisse von mehreren Faktoren ab: der Dosis des Arzneimittels und der Behandlungsdauer; das Alter, das Geschlecht, die körperliche Verfassung des Patienten; etwaige gleichzeitige medizinische Diagnosen oder individuelle Risikofaktoren. Die folgenden Nebenwirkungen sind in drei Teile unterteilt, basierend auf der Häufigkeit und ob die Möglichkeit eines kausalen Zusammenhangs zwischen der Einnahme von Arzneimitteln und diesen Nebenwirkungen besteht oder nicht. Bei den als „Wahrscheinlicher kausaler Zusammenhang“ aufgeführten Reaktionen gibt es mindestens einen Fall für jede Nebenwirkung, bei dem Hinweise darauf hindeuten, dass ein kausaler Zusammenhang zwischen dem Arzneimittelkonsum und dem gemeldeten Ereignis besteht. Die berichteten Nebenwirkungen basierten auf den Ergebnissen von zwei doppelblinden kontrollierten klinischen Studien mit einer Dauer von drei Monaten mit einer zusätzlichen neunmonatigen unverblindeten Verlängerung. Insgesamt 542 Patienten erhielten NAPRELAN-Tabletten entweder in der doppelblinden Phase oder in der neunmonatigen Open-Label-Verlängerung. Von diesen 542 Patienten erhielten 232 NAPRELAN-Tabletten, 167 wurden initial mit Naprosyn® und 143 initial mit Placebo behandelt. Nebenwirkungen, die von Patienten berichtet wurden, die NAPRELAN 500 mg Tabletten erhielten, sind nach Körpersystem dargestellt. Jene Nebenwirkungen, die mit Naproxen beobachtet, aber nicht in kontrollierten Studien mit NAPRELAN-Tabletten berichtet wurden, sind kursiv gedruckt.
Die häufigsten unerwünschten Ereignisse in den doppelblinden und offenen klinischen Studien waren Kopfschmerzen (15 %), gefolgt von Dyspepsie (14 %) und Grippesyndrom (10 %). Die Häufigkeit anderer unerwünschter Ereignisse, die bei 3 % bis 9 % der Patienten auftraten, ist mit einem Sternchen gekennzeichnet.
Die Reaktionen, die bei weniger als 3 % der Patienten auftreten, sind unauffällig.
Inzidenz größer als 1 % (wahrscheinlicher kausaler Zusammenhang)
Körper als Ganzes - Schmerzen (Rücken)*, Schmerzen*, Infektion*, Fieber, Verletzung (Unfall), Asthenie, Brustschmerzen, Kopfschmerzen (15 %), Grippesyndrom (10 %).
Magen-Darm- Übelkeit*, Durchfall*, Verstopfung*, Bauchschmerzen*, Blähungen, Gastritis, Erbrechen, Dysphagie, Dyspepsie (14 %), Sodbrennen*, Stomatitis.
Hämatologie - Anämie, Ekchymose.
Atmung - Pharyngitis*, Rhinitis*, Sinusitis*, Bronchitis, verstärkter Husten.
Nieren - Harnwegsinfektion*, Zystitis.
Dermatologisch - Hautausschlag*, Hautausschläge*, Ekchymosen*, Purpura.
Stoffwechsel und Ernährung - Peripheres Ödem, Hyperglykämie.
Zentrales Nervensystem - Schwindel, Parästhesien, Schlaflosigkeit, Schläfrigkeit*, Benommenheit.
Herz-Kreislauf - Bluthochdruck, Ödem*, Dyspnoe*, Herzklopfen.
Bewegungsapparat - Krämpfe (Bein), Myalgie, Arthralgie, Gelenkerkrankung, Sehnenerkrankung.
Besondere Sinne - Tinnitus*, Hörstörungen, Sehstörungen.
Allgemein - Durst.
Inzidenz Weniger als 1 % (wahrscheinlicher kausaler Zusammenhang)
Körper als Ganzes - Abszess, Monilia, Nackenstarre, Nackenschmerzen, Bauchvergrößerung, Karzinom, Zellulitis, Ödem allgemein, LE-Syndrom, Unwohlsein, Schleimhauterkrankung, allergische Reaktion, Schmerzen im Beckenbereich.
Magen-Darm- Anorexie, Cholezystitis, Cholelithiasis, Aufstoßen, GI-Blutung, rektale Blutung, aphthöse Stomatitis, Stomatitis-Ulkus, Mundgeschwür, Magengeschwür, parodontaler Abszess, Kardiospasmus, Colitis, Ösophagitis, Gastroenteritis, GI-Erkrankung, rektale Erkrankung, Zahnerkrankung, Hepatosplenomegalie, Leberfunktion Anomalie, Meläna, Ösophagusgeschwür, Hämatemesis, Gelbsucht, Pankreatitis, Nekrose.
Nieren - Dysmenorrhoe, Dysurie, Nierenfunktionsstörung, Nykturie, Prostataerkrankung, Pyelonephritis, Brustkrebs, Harninkontinenz, Nierenstein, Nierenversagen, Menorrhagie, Metrorrhagie, Neoplasma Brust, Nephrosklerose, Hämaturie, Nierenschmerzen, Pyurie, abnormaler Urin, häufiges Wasserlassen, Harndrang Retention, Uterusspasmus, Vaginitis, glomeruläre Nephritis, Hyperkaliämie, interstitielle Nephritis, nephrotisches Syndrom, Nierenerkrankung, Nierenversagen, Nierenpapillennekrose.
Hämatologie - Leukopenie, erhöhte Blutungszeit, Eosinophilie, abnorme Erythrozyten, abnorme Leukozyten, Thrombozytopenie, Agranulozytose, Granulozytopenie.
Zentrales Nervensystem - Depression, Angst, Hypertonie, Nervosität, Neuralgie, Neuritis, Schwindel, Amnesie, Verwirrtheit, Koordination, abnorme Diplopie, emotionale Labilität, subdurales Hämatom, Lähmung, Traumanomalien, Konzentrationsschwäche, Muskelschwäche.
Dermatologisch: Angiodermatitis, Herpes simplex, trockene Haut, Schwitzen, Hautgeschwüre, Akne, Alopezie, Kontaktdermatitis, Ekzeme, Herpes zoster, Nagelerkrankungen, Hautnekrose, subkutane Knötchen, Juckreiz, Urtikaria, Neoplasmen der Haut, lichtempfindliche Dermatitis, Lichtempfindlichkeitsreaktionen, die Porphyrie kutane Tarda ähneln , Epidermolysis bullosa.
Besondere Sinne - Amblyopie, Skleritis, Katarakt, Konjunktivitis, Taubheit, Ohrerkrankung, Keratokonjunktivitis, Tränenflussstörung, Mittelohrentzündung, Augenschmerzen.
Herz-Kreislauf - Angina pectoris, koronare Herzkrankheit, Myokardinfarkt, tiefe Thrombophlebitis, Vasodilatation, Gefäßanomalie, Arrhythmie, Schenkelblock, abnormales EKG, Herzinsuffizienz rechts, Blutung, Migräne, Aortenstenose, Synkope, Tachykardie, dekompensierte Herzinsuffizienz.
Atmung - Asthma, Dyspnoe, Lungenödem, Laryngitis, Lungenerkrankung, Nasenbluten, Lungenentzündung, Atemnot, Atemstörung, eosinophile Pneumonitis.
Bewegungsapparat - Myasthenie, Knochenerkrankung, spontaner Knochenbruch, Fibrotendinitis, Knochenschmerzen, Ptosis, allgemeiner Krampf, Schleimbeutelentzündung.
Stoffwechsel und Ernährung - Kreatinin-Anstieg, Glukosurie, Hypercholesterinämie, Albuminurie, Alkalose, BUN-Anstieg, Dehydratation, Ödeme, Glukosetoleranzabfall, Hyperurikämie, Hypokaliämie, SGOT-Anstieg, SGPT-Anstieg, Gewichtsabnahme.
Allgemein - Anaphylaktoide Reaktionen, angioneurotisches Ödem, Menstruationsstörungen, Hypoglykämie, Pyrexie (Schüttelfrost und Fieber).
Inzidenz Weniger als 1 % (kausaler Zusammenhang unbekannt)
Andere Nebenwirkungen, die auf dem Packungsetikett von Naproxen aufgeführt sind, aber nicht von denjenigen gemeldet wurden, die NAPRELAN-Tabletten erhalten haben, sind kursiv dargestellt. Diese Beobachtungen werden als alarmierende Informationen für den Arzt aufgelistet.
Hämatologie - Aplastische Anämie, hämolytische Anämie.
Zentrales Nervensystem - Aseptische Meningitis, kognitive Dysfunktion.
Dermatologisch - Epidermale Nekrolyse, Erythema multiforme, Stevens-Johnson-Syndrom.
Magen-Darm- Nicht peptische GI-Ulzeration, ulzerative Stomatitis.
Herz-Kreislauf - Vaskulitis.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Siehe Tabelle 1 für klinisch signifikante Arzneimittelwechselwirkungen mit Naproxen.
Arzneimittel-/Labortest-Wechselwirkungen
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Kardiovaskuläre thrombotische Ereignisse
Klinische Studien mit mehreren COX-2-selektiven und nicht-selektiven NSAIDs mit einer Dauer von bis zu drei Jahren haben ein erhöhtes Risiko für schwerwiegende kardiovaskuläre (CV) thrombotische Ereignisse, einschließlich Myokardinfarkt (MI) und Schlaganfall, die tödlich sein können, gezeigt. Basierend auf den verfügbaren Daten ist unklar, ob das Risiko für kardiovaskuläre thrombotische Ereignisse bei allen NSAIDs ähnlich ist. Der relative Anstieg schwerer kardiovaskulärer thrombotischer Ereignisse gegenüber dem Ausgangswert, der durch die Verwendung von NSAIDs hervorgerufen wird, scheint bei Patienten mit und ohne bekannte kardiovaskuläre Erkrankung oder Risikofaktoren für kardiovaskuläre Erkrankungen ähnlich zu sein. Allerdings hatten Patienten mit bekannter kardiovaskulärer Erkrankung oder Risikofaktoren aufgrund ihrer erhöhten Baseline-Rate eine höhere absolute Inzidenz von übermäßigen schwerwiegenden kardiovaskulären thrombotischen Ereignissen. Einige Beobachtungsstudien ergaben, dass dieses erhöhte Risiko für schwerwiegende kardiovaskuläre thrombotische Ereignisse bereits in den ersten Behandlungswochen einsetzte. Der Anstieg des kardiovaskulären Thromboserisikos wurde am konsistentesten bei höheren Dosen beobachtet.
Um das potenzielle Risiko eines unerwünschten kardiovaskulären Ereignisses bei NSAID-behandelten Patienten zu minimieren, verwenden Sie die niedrigste wirksame Dosis für die kürzestmögliche Dauer. Ärzte und Patienten sollten während des gesamten Behandlungsverlaufs auf die Entwicklung solcher Ereignisse achten, auch wenn zuvor keine kardiovaskulären Symptome aufgetreten sind. Die Patienten sollten über die Symptome schwerwiegender kardiovaskulärer Ereignisse und die zu ergreifenden Maßnahmen informiert werden, wenn sie auftreten.
Es gibt keine konsistenten Beweise dafür, dass die gleichzeitige Anwendung von Aspirin das erhöhte Risiko schwerer kardiovaskulärer thrombotischer Ereignisse im Zusammenhang mit der Anwendung von NSAR mindert. Die gleichzeitige Anwendung von Aspirin und einem NSAID, wie Naproxen, erhöht das Risiko schwerwiegender gastrointestinaler (GI) Ereignisse [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Status nach Koronararterien-Bypass-Operation (CABG).
Zwei große, kontrollierte klinische Studien mit einem COX-2-selektiven NSAID zur Behandlung von Schmerzen in den ersten 10 bis 14 Tagen nach einer CABG-Operation ergaben eine erhöhte Inzidenz von Myokardinfarkt und Schlaganfall. NSAIDs sind bei CABG kontraindiziert [vgl KONTRAINDIKATIONEN ].
Post-MI-Patienten
Beobachtungsstudien, die im dänischen Nationalregister durchgeführt wurden, haben gezeigt, dass Patienten, die mit NSAIDs in der Zeit nach einem Myokardinfarkt behandelt wurden, ab der ersten Behandlungswoche ein erhöhtes Risiko für einen Reinfarkt, einen kardiovaskulären Tod und eine Gesamtmortalität hatten. In derselben Kohorte betrug die Inzidenz von Todesfällen im ersten Jahr nach MI 20 pro 100 Personenjahre bei NSAID-behandelten Patienten im Vergleich zu 12 pro 100 Personenjahre bei nicht-NSAID-exponierten Patienten. Obwohl die absolute Todesrate nach dem ersten Jahr nach dem Myokardinfarkt etwas zurückging, blieb das erhöhte relative Todesrisiko bei NSAID-Anwendern mindestens über die nächsten vier Jahre der Nachbeobachtung bestehen.
Vermeiden Sie die Anwendung von NAPRELAN 250 mg bei Patienten mit kürzlich aufgetretenem Herzinfarkt, es sei denn, der Nutzen überwiegt voraussichtlich das Risiko wiederkehrender kardiovaskulärer thrombotischer Ereignisse. Wenn NAPRELAN bei Patienten mit kürzlich aufgetretenem MI angewendet wird, sind die Patienten auf Anzeichen einer kardialen Ischämie zu überwachen.
Magen-Darm-Blutungen, Ulzerationen und Perforationen
NSAIDs, einschließlich Naproxen, verursachen schwerwiegende gastrointestinale (GI) unerwünschte Ereignisse, einschließlich Entzündungen, Blutungen, Ulzerationen und Perforationen der Speiseröhre, des Magens, des Dünndarms oder des Dickdarms, die tödlich sein können. Diese schwerwiegenden unerwünschten Ereignisse können jederzeit mit oder ohne Warnsymptome bei Patienten auftreten, die mit NSAIDs behandelt werden. Nur jeder fünfte Patient, der unter NSAID-Therapie ein schwerwiegendes unerwünschtes Ereignis im oberen Gastrointestinaltrakt entwickelt, ist symptomatisch. Geschwüre im oberen Gastrointestinaltrakt, starke Blutungen oder Perforationen, die durch NSAIDs verursacht wurden, traten bei etwa 1 % der Patienten auf, die 3 bis 6 Monate behandelt wurden, und bei etwa 2 % bis 4 % der Patienten, die ein Jahr behandelt wurden. Allerdings ist auch eine kurzzeitige NSAID-Therapie nicht ohne Risiko.
Risikofaktoren für GI-Blutungen, Ulzerationen und Perforationen
Patienten mit Magengeschwüren und/oder gastrointestinalen Blutungen in der Vorgeschichte, die NSAR einnahmen, hatten ein mehr als 10-fach erhöhtes Risiko für die Entwicklung einer gastrointestinalen Blutung im Vergleich zu Patienten ohne diese Risikofaktoren. Andere Faktoren, die das Risiko von GI-Blutungen bei mit NSAIDs behandelten Patienten erhöhen, umfassen eine längere Dauer der NSAID-Therapie; gleichzeitige Anwendung von oralen Kortikosteroiden, Aspirin, Antikoagulanzien oder selektiven Serotonin-Wiederaufnahmehemmern (SSRIs); Rauchen; Alkoholkonsum; älteres Alter; und schlechter allgemeiner Gesundheitszustand. Die meisten Postmarketing-Berichte über tödliche gastrointestinale Ereignisse traten bei älteren oder geschwächten Patienten auf. Darüber hinaus besteht bei Patienten mit fortgeschrittener Lebererkrankung und/oder Koagulopathie ein erhöhtes Risiko für gastrointestinale Blutungen.
Strategien zur Minimierung der GI-Risiken bei NSAID-behandelten Patienten
Hepatotoxizität
Erhöhungen von ALT oder AST (mindestens das Dreifache der oberen Normgrenze [ULN]) wurden in klinischen Studien bei etwa 1 % der mit NSAR behandelten Patienten berichtet. Darüber hinaus wurden seltene, manchmal tödliche Fälle von schwerer Leberschädigung, einschließlich fulminanter Hepatitis, Lebernekrose und Leberversagen, berichtet.
Erhöhungen von ALT oder AST (weniger als das Dreifache des ULN) können bei bis zu 15 % der mit NSAIDs einschließlich Naproxen behandelten Patienten auftreten.
Informieren Sie die Patienten über die Warnzeichen und Symptome einer Hepatotoxizität (z. B. Übelkeit, Müdigkeit, Lethargie, Durchfall, Juckreiz, Gelbsucht, Druckschmerz im rechten oberen Quadranten und „grippeähnliche“ Symptome). Wenn sich klinische Anzeichen und Symptome entwickeln, die einer Lebererkrankung entsprechen, oder wenn systemische Manifestationen auftreten (z. B. Eosinophilie, Hautausschlag usw.), setzen Sie NAPRELAN 500 mg sofort ab und führen Sie eine klinische Untersuchung des Patienten durch.
Hypertonie
NSAIDs, einschließlich NAPRELAN, können zu einem erneuten Auftreten oder einer Verschlechterung einer vorbestehenden Hypertonie führen, die beide zu einer erhöhten Inzidenz von kardiovaskulären Ereignissen beitragen können. Patienten, die Angiotensin-Converting-Enzyme (ACE)-Hemmer, Thiaziddiuretika oder Schleifendiuretika einnehmen, können bei der Einnahme von NSAIDs ein beeinträchtigtes Ansprechen auf diese Therapien haben [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Überwachen Sie den Blutdruck (BP) zu Beginn der NSAID-Behandlung und während des gesamten Therapieverlaufs.
Herzinsuffizienz und Ödem
Die Coxib and Traditional NSAID Trialists' Collaboration Meta-Analyse randomisierter kontrollierter Studien zeigte eine ungefähr zweifache Zunahme der Krankenhauseinweisungen wegen Herzinsuffizienz bei COX-2-selektiv behandelten Patienten und nicht-selektiv NSAID-behandelten Patienten im Vergleich zu Placebo-behandelten Patienten. In einer Studie des Dänischen Nationalen Registers bei Patienten mit Herzinsuffizienz erhöhte die Verwendung von NSAID das Risiko für Herzinfarkt, Krankenhauseinweisung wegen Herzinsuffizienz und Tod.
Darüber hinaus wurden bei einigen Patienten, die mit NSAIDs behandelt wurden, Flüssigkeitsretention und Ödeme beobachtet. Die Anwendung von Naproxen kann die kardiovaskulären Wirkungen mehrerer Therapeutika abschwächen, die zur Behandlung dieser Erkrankungen eingesetzt werden (z. B. Diuretika, ACE-Hemmer oder Angiotensin-Rezeptorblocker [ARBs]) [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Vermeiden Sie die Anwendung von NAPRELAN 250 mg bei Patienten mit schwerer Herzinsuffizienz, es sei denn, der Nutzen überwiegt voraussichtlich das Risiko einer Verschlechterung der Herzinsuffizienz. Wenn NAPRELAN bei Patienten mit schwerer Herzinsuffizienz angewendet wird, sind die Patienten auf Anzeichen einer Verschlechterung der Herzinsuffizienz zu überwachen.
Nierentoxizität und Hyperkaliämie
Nierentoxizität
Die langfristige Verabreichung von NSAIDs hat zu Nierenpapillennekrose und anderen Nierenschäden geführt.
Nierentoxizität wurde auch bei Patienten beobachtet, bei denen renale Prostaglandine eine kompensatorische Rolle bei der Aufrechterhaltung der Nierendurchblutung spielen. Bei diesen Patienten kann die Verabreichung eines NSAID eine dosisabhängige Verringerung der Prostaglandinbildung und sekundär des renalen Blutflusses verursachen, was eine offenkundige Nierendekompensation auslösen kann. Patienten mit dem größten Risiko für diese Reaktion sind Patienten mit eingeschränkter Nierenfunktion, Dehydratation, Hypovolämie, Herzinsuffizienz, Leberfunktionsstörungen, Patienten, die Diuretika und ACE-Hemmer oder ARBs einnehmen, sowie ältere Menschen. Auf das Absetzen der NSAID-Therapie folgt normalerweise die Wiederherstellung des Zustands vor der Behandlung.
Es liegen keine Informationen aus kontrollierten klinischen Studien zur Anwendung von NAPRELAN bei Patienten mit fortgeschrittener Nierenerkrankung vor. Die renale Wirkung von NAPRELAN 250 mg kann das Fortschreiten der Nierenfunktionsstörung bei Patienten mit vorbestehender Nierenerkrankung beschleunigen.
Korrigieren Sie den Volumenstatus bei dehydrierten oder hypovolämischen Patienten vor Beginn der Behandlung mit NAPRELAN. Überwachen Sie die Nierenfunktion bei Patienten mit eingeschränkter Nieren- oder Leberfunktion, Herzinsuffizienz, Dehydration oder Hypovolämie während der Anwendung von NAPRELAN [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Vermeiden Sie die Anwendung von NAPRELAN 500 mg bei Patienten mit fortgeschrittener Nierenerkrankung, es sei denn, der Nutzen überwiegt voraussichtlich das Risiko einer Verschlechterung der Nierenfunktion. Wenn NAPRELAN bei Patienten mit fortgeschrittener Nierenerkrankung angewendet wird, sind die Patienten auf Anzeichen einer Verschlechterung der Nierenfunktion zu überwachen.
Hyperkaliämie
Bei der Anwendung von NSAIDs wurde sogar bei einigen Patienten ohne Nierenfunktionsstörung über Anstiege der Serumkaliumkonzentration, einschließlich Hyperkaliämie, berichtet. Bei Patienten mit normaler Nierenfunktion wurden diese Wirkungen einem hyporeninämischen Hypoaldosteronismus-Zustand zugeschrieben.
Anaphylaktische Reaktionen
Naproxen wurde mit anaphylaktischen Reaktionen bei Patienten mit und ohne bekannte Überempfindlichkeit gegenüber Naproxen und bei Patienten mit Aspirin-sensitivem Asthma in Verbindung gebracht [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Suchen Sie Nothilfe auf, wenn eine anaphylaktische Reaktion auftritt.
Verschlimmerung von Asthma im Zusammenhang mit Aspirin-Empfindlichkeit
Eine Subpopulation von Patienten mit Asthma kann Aspirin-empfindliches Asthma haben, das eine durch Nasenpolypen komplizierte chronische Rhinosinusitis umfassen kann; schwerer, möglicherweise tödlicher Bronchospasmus; und/oder Intoleranz gegenüber Aspirin und anderen NSAIDs. Da bei solchen Aspirin-empfindlichen Patienten über Kreuzreaktivität zwischen Aspirin und anderen NSAIDs berichtet wurde, ist NAPRELAN 250 mg bei Patienten mit dieser Form der Aspirin-Empfindlichkeit kontraindiziert [siehe KONTRAINDIKATIONEN ]. Wenn NAPRELAN bei Patienten mit vorbestehendem Asthma (ohne bekannte Aspirin-Empfindlichkeit) angewendet wird, sind die Patienten auf Veränderungen der Anzeichen und Symptome von Asthma zu überwachen.
Schwerwiegende Hautreaktionen
NSAIDs, einschließlich Naproxen, können schwerwiegende Nebenwirkungen der Haut wie exfoliative Dermatitis, Stevens-Johnson-Syndrom (SJS) und toxische epidermale Nekrolyse (TEN) verursachen, die tödlich sein können. Diese schwerwiegenden Ereignisse können ohne Vorwarnung eintreten. Informieren Sie die Patienten über die Anzeichen und Symptome schwerwiegender Hautreaktionen und brechen Sie die Anwendung von NAPRELAN 500 mg beim ersten Auftreten von Hautausschlag oder anderen Anzeichen einer Überempfindlichkeit ab.
NAPRELAN ist kontraindiziert bei Patienten mit früheren schwerwiegenden Hautreaktionen auf NSAIDs [siehe KONTRAINDIKATIONEN ].
Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS)
Arzneimittelreaktionen mit Eosinophilie und systemischen Symptomen (DRESS) wurden bei Patienten berichtet, die NSAIDs wie NAPRELAN einnahmen. Einige dieser Ereignisse waren tödlich oder lebensbedrohlich. DRESS zeigt sich typischerweise, wenn auch nicht ausschließlich, durch Fieber, Hautausschlag, Lymphadenopathie und/oder Gesichtsschwellungen. Andere klinische Manifestationen können Hepatitis, Nephritis, hämatologische Anomalien, Myokarditis oder Myositis umfassen. Manchmal ähneln die Symptome von DRESS einer akuten Virusinfektion. Eosinophilie ist oft vorhanden. Da diese Störung in ihrem Erscheinungsbild variabel ist, können andere Organsysteme, die hier nicht aufgeführt sind, beteiligt sein. Es ist wichtig zu beachten, dass frühe Manifestationen einer Überempfindlichkeit, wie Fieber oder Lymphadenopathie, vorhanden sein können, auch wenn kein Hautausschlag erkennbar ist. Wenn solche Anzeichen oder Symptome vorhanden sind, brechen Sie NAPRELAN ab und untersuchen Sie den Patienten sofort.
Fötale Toxizität
Vorzeitiger Verschluss des fötalen Ductus Arteriosus
Vermeiden Sie die Anwendung von NSAIDs, einschließlich NAPRELAN, bei schwangeren Frauen ab der 30. Schwangerschaftswoche und später. NSAIDs, einschließlich NAPRELAN, erhöhen das Risiko eines vorzeitigen Verschlusses des fetalen Ductus arteriosus etwa in diesem Gestationsalter.
Oligohydramnion/Niereninsuffizienz bei Neugeborenen
Die Anwendung von NSAIDs, einschließlich NAPRELAN 500 mg, etwa in der 20. Schwangerschaftswoche oder später in der Schwangerschaft kann zu einer fetalen Nierenfunktionsstörung führen, die zu Oligohydramnion und in einigen Fällen zu einer Nierenfunktionsstörung beim Neugeborenen führt. Diese Nebenwirkungen werden im Durchschnitt nach Tagen bis Wochen der Behandlung beobachtet, obwohl Oligohydramnion selten schon 48 Stunden nach Beginn der Behandlung mit NSAR berichtet wurde. Oligohydramnion ist oft, aber nicht immer, nach Absetzen der Behandlung reversibel. Zu den Komplikationen eines verlängerten Oligohydramnion können beispielsweise Extremitätenkontrakturen und eine verzögerte Lungenreifung gehören. In einigen Postmarketing-Fällen mit eingeschränkter Nierenfunktion bei Neugeborenen waren invasive Verfahren wie Austauschtransfusionen oder Dialyse erforderlich.
Wenn eine NSAID-Behandlung zwischen etwa der 20. und 30. Schwangerschaftswoche erforderlich ist, beschränken Sie die Anwendung von NAPRELAN 500 mg auf die niedrigste wirksame Dosis und die kürzestmögliche Dauer. Erwägen Sie eine Ultraschallkontrolle des Fruchtwassers, wenn die NAPRELAN-Behandlung länger als 48 Stunden dauert. Setzen Sie NAPRELAN ab, wenn Oligohydramnion auftritt, und folgen Sie der klinischen Praxis entsprechend [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Hämatologische Toxizität
Anämie ist bei NSAID-behandelten Patienten aufgetreten. Dies kann auf okkulten oder groben Blutverlust, Flüssigkeitsretention oder eine unvollständig beschriebene Wirkung auf die Erythropoese zurückzuführen sein. Wenn bei einem mit NAPRELAN 500 mg behandelten Patienten Anzeichen oder Symptome einer Anämie auftreten, sind Hämoglobin oder Hämatokrit zu überwachen.
NSAIDs, einschließlich NAPRELAN, können das Risiko von Blutungsereignissen erhöhen. Begleiterkrankungen wie Gerinnungsstörungen, die gleichzeitige Anwendung von Warfarin, anderen Antikoagulanzien, Thrombozytenaggregationshemmern (z. B. Aspirin), Serotonin-Wiederaufnahmehemmern (SSRIs) und Serotonin-Noradrenalin-Wiederaufnahmehemmern (SNRIs) können dieses Risiko erhöhen. Überwachen Sie diese Patienten auf Anzeichen von Blutungen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Maskierung von Entzündungen und Fieber
Die pharmakologische Aktivität von NAPRELAN 250 mg bei der Reduzierung von Entzündungen und möglicherweise Fieber kann die Nützlichkeit diagnostischer Zeichen beim Nachweis von Infektionen verringern.
Laborüberwachung
Da schwere Magen-Darm-Blutungen, Hepatotoxizität und Nierenschäden ohne Warnsymptome oder -zeichen auftreten können, erwägen Sie eine regelmäßige Überwachung von Patienten unter NSAID-Langzeitbehandlung mit einem Blutbild und einem chemischen Profil [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente ), die jeder ausgestellten Verschreibung beiliegt. Informieren Sie Patienten, Familien oder ihre Betreuer über die folgenden Informationen, bevor Sie mit der Therapie mit NAPRELAN 500 mg beginnen, und regelmäßig während der laufenden Therapie.
Kardiovaskuläre thrombotische Ereignisse
Weisen Sie die Patienten an, auf die Symptome kardiovaskulärer thrombotischer Ereignisse, einschließlich Brustschmerzen, Kurzatmigkeit, Schwäche oder undeutliche Sprache, zu achten und jedes dieser Symptome unverzüglich ihrem Arzt zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Magen-Darm-Blutungen, Ulzerationen und Perforationen
NAPRELAN 500 mg kann wie andere NSAIDs gastrointestinale Beschwerden und selten schwerwiegende gastrointestinale Nebenwirkungen wie Geschwüre und Blutungen verursachen, die zu einem Krankenhausaufenthalt und sogar zum Tod führen können. Raten Sie den Patienten, Symptome von Ulzerationen und Blutungen, einschließlich Oberbauchschmerzen, Dyspepsie, Meläna und Hämatemesis, ihrem Arzt zu melden. Informieren Sie die Patienten bei gleichzeitiger Anwendung von niedrig dosiertem Aspirin zur Herzprophylaxe über das erhöhte Risiko für und die Anzeichen und Symptome von gastrointestinalen Blutungen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hepatotoxizität
Informieren Sie die Patienten über die Warnzeichen und Symptome einer Hepatotoxizität (z. B. Übelkeit, Müdigkeit, Lethargie, Juckreiz, Durchfall, Gelbsucht, Druckschmerz im rechten oberen Quadranten und „grippeähnliche“ Symptome). Wenn diese auftreten, weisen Sie die Patienten an, NAPRELAN abzusetzen und sich unverzüglich medizinisch behandeln zu lassen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Herzinsuffizienz und Ödem
Weisen Sie die Patienten an, auf die Symptome einer dekompensierten Herzinsuffizienz, einschließlich Kurzatmigkeit, unerklärliche Gewichtszunahme oder Ödeme, aufmerksam zu sein und sich an ihren Arzt zu wenden, wenn solche Symptome auftreten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Anaphylaktische Reaktionen
Informieren Sie die Patienten über die Anzeichen einer anaphylaktischen Reaktion (z. B. Atembeschwerden, Schwellungen im Gesicht oder Rachen). Weisen Sie die Patienten an, sofort Nothilfe zu suchen, wenn diese auftreten [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schwerwiegende Hautreaktionen, einschließlich DRESS
NAPRELAN 500 mg kann wie andere NSAIDs schwerwiegende Hautnebenwirkungen wie exfoliative Dermatitis, SJS und TEN verursachen, die zu Krankenhausaufenthalten und sogar zum Tod führen können. Weisen Sie die Patienten an, die Einnahme von NAPRELAN sofort abzubrechen, wenn sie irgendeine Art von Hautausschlag oder Fieber entwickeln, und sich so schnell wie möglich an ihren Arzt zu wenden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Weibliche Fruchtbarkeit
Weisen Sie Frauen im gebärfähigen Alter, die eine Schwangerschaft wünschen, darauf hin, dass NSAIDs, einschließlich NAPRELAN 250 mg, mit einer reversiblen Verzögerung des Eisprungs verbunden sein können [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Fötale Toxizität
Informieren Sie schwangere Frauen, dass sie die Anwendung von NAPRELAN 500 mg und anderen NSAIDs ab der 30. Schwangerschaftswoche wegen des Risikos eines vorzeitigen Verschlusses des fetalen Ductus arteriosus vermeiden sollten. Wenn eine Behandlung mit NAPRELAN 500 mg für eine schwangere Frau zwischen der 20. und 30. Schwangerschaftswoche erforderlich ist, weisen Sie sie darauf hin, dass sie möglicherweise auf Oligohydramnion überwacht werden muss, wenn die Behandlung länger als 48 Stunden andauert [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Vermeiden Sie die gleichzeitige Anwendung von NSAIDs
Informieren Sie die Patienten darüber, dass die gleichzeitige Anwendung von NAPRELAN mit anderen NSAIDs oder Salicylaten (z. B. Diflunisal, Salsalat) aufgrund des erhöhten Risikos einer gastrointestinalen Toxizität und einer geringen oder keinen Steigerung der Wirksamkeit nicht empfohlen wird [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Weisen Sie die Patienten darauf hin, dass NSAIDs in „rezeptfreien“ Medikamenten zur Behandlung von Erkältungen, Fieber oder Schlaflosigkeit enthalten sein können.
Verwendung von NSAIDs und niedrig dosiertem Aspirin
Weisen Sie die Patienten darauf hin, kein niedrig dosiertes Aspirin gleichzeitig mit NAPRELAN 250 mg anzuwenden, bis sie mit ihrem Arzt gesprochen haben [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Eine zweijährige Studie wurde an Ratten durchgeführt, um das karzinogene Potenzial von Naproxen in Dosen von 8 mg/kg/Tag, 16 mg/kg/Tag und 24 mg/kg/Tag (das 0,05-, 0,1- und 0,16-fache des empfohlenen Maximums) zu bewerten menschliche Tagesdosis von 1.500 mg/Tag basierend auf einem Vergleich der Körperoberfläche). Es wurden keine Hinweise auf Tumorigenität gefunden.
Mutagenese
Studien zur Bewertung des mutagenen Potenzials von Naprosyn Suspension wurden noch nicht abgeschlossen.
Beeinträchtigung der Fruchtbarkeit
Studien zur Bewertung der Auswirkungen von Naproxen auf die männliche oder weibliche Fruchtbarkeit wurden noch nicht abgeschlossen.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Die Anwendung von NSAIDs, einschließlich NAPRELAN 500 mg, kann einen vorzeitigen Verschluss des fetalen Ductus arteriosus und eine fetale Nierenfunktionsstörung verursachen, die zu Oligohydramnion und in einigen Fällen zu einer Nierenfunktionsstörung bei Neugeborenen führt. Wegen dieser Risiken sollten Sie die Dosis und Dauer der Anwendung von NAPRELAN 500 mg zwischen etwa der 20. und 30. Schwangerschaftswoche begrenzen und die Anwendung von NAPRELAN 500 mg etwa in der 30. Schwangerschaftswoche und später in der Schwangerschaft vermeiden (siehe Klinische Überlegungen , Daten ).
Vorzeitiger Verschluss des fötalen Ductus Arteriosus
Die Anwendung von NSAIDs, einschließlich NAPRELAN 500 mg, etwa in der 30. Schwangerschaftswoche oder später in der Schwangerschaft erhöht das Risiko eines vorzeitigen Verschlusses des fetalen Ductus arteriosus.
Oligohydramnion/Niereninsuffizienz bei Neugeborenen
Die Anwendung von NSAIDs in der 20. Schwangerschaftswoche oder später in der Schwangerschaft wurde mit Fällen von fetaler Nierenfunktionsstörung in Verbindung gebracht, die zu Oligohydramnion und in einigen Fällen zu Nierenfunktionsstörungen bei Neugeborenen führte.
Daten aus Beobachtungsstudien zu anderen potenziellen embryofetalen Risiken der Anwendung von NSAR bei Frauen im ersten oder zweiten Trimenon der Schwangerschaft sind nicht schlüssig. In Reproduktionsstudien an Ratten, Kaninchen und Mäusen ergaben sich keine Hinweise auf Teratogenität oder Schädigung des Fötus, wenn Naproxen während der Organogenese in Dosen verabreicht wurde, die dem 0,13-, 0,26- bzw. 0,6-Fachen der maximal empfohlenen Tagesdosis für Menschen von 1.500 mg/Tag entsprachen. Basierend auf Tierdaten wurde gezeigt, dass Prostaglandine eine wichtige Rolle bei der Gefäßpermeabilität des Endometriums, der Blastozystenimplantation und der Dezidualisierung spielen. In Tierversuchen führte die Verabreichung von Prostaglandinsynthesehemmern wie Naproxen zu einem erhöhten Prä- und Postimplantationsverlust. Es wurde auch gezeigt, dass Prostaglandine eine wichtige Rolle bei der fötalen Nierenentwicklung spielen. In veröffentlichten Tierstudien wurde berichtet, dass Prostaglandinsynthesehemmer die Nierenentwicklung beeinträchtigen, wenn sie in klinisch relevanten Dosen verabreicht werden.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene(n) Population(en) ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 % bis 4 % bzw. 15 % bis 20 %.
Klinische Überlegungen
Fetale/neonatale Nebenwirkungen
Vorzeitiger Verschluss des fetalen Ductus arteriosus: Vermeiden Sie die Anwendung von NSAIDs bei Frauen in der 30. Schwangerschaftswoche und später in der Schwangerschaft, da NSAIDs, einschließlich NAPRELAN, einen vorzeitigen Verschluss des fetalen Ductus arteriosus verursachen können (siehe Daten ).
Oligohydramnion/Niereninsuffizienz bei Neugeborenen: Wenn ein NSAID etwa in der 20. Schwangerschaftswoche oder später in der Schwangerschaft erforderlich ist, beschränken Sie die Anwendung auf die niedrigste wirksame Dosis und die kürzestmögliche Dauer. Wenn die Behandlung mit NAPRELAN 500 mg länger als 48 Stunden dauert, ist eine Überwachung mit Ultraschall auf Oligohydramnion in Betracht zu ziehen. Wenn Oligohydramnion auftritt, setzen Sie NAPRELAN 500 mg ab und folgen Sie der klinischen Praxis entsprechend (siehe Daten ).
Arbeit oder Lieferung
Es liegen keine Studien zu den Wirkungen von NAPRELAN 500 mg während der Wehen oder der Geburt vor. In Tierversuchen hemmen NSAIDs, einschließlich Naproxen-Natrium, die Prostaglandinsynthese, verursachen eine verzögerte Geburt, erhöhen das Auftreten von Dystokie und erhöhen das Auftreten von Totgeburten.
Daten
Menschliche Daten
Es gibt Hinweise darauf, dass bei Verwendung von Prostaglandinsynthesehemmern zur Verzögerung vorzeitiger Wehen ein erhöhtes Risiko für neonatale Komplikationen wie nekrotisierende Enterokolitis, offener Ductus arteriosus und intrakranielle Blutungen besteht. Die Behandlung mit Naproxen, die in der späten Schwangerschaft verabreicht wurde, um die Geburt zu verzögern, wurde mit anhaltender pulmonaler Hypertonie, Nierenfunktionsstörungen und abnormalen Prostaglandin-E-Spiegeln bei Frühgeborenen in Verbindung gebracht. Aufgrund der bekannten Wirkung von Arzneimitteln dieser Klasse auf das menschliche fetale Herz-Kreislauf-System (Verschluss des Ductus arteriosus) sollte die Anwendung während des dritten Trimesters vermieden werden.
Vorzeitiger Verschluss des fötalen Ductus Arteriosus
In der veröffentlichten Literatur wird berichtet, dass die Anwendung von NSAIDs etwa in der 30. Schwangerschaftswoche und später in der Schwangerschaft zu einem vorzeitigen Verschluss des fetalen Ductus arteriosus führen kann.
Oligohydramnion/Niereninsuffizienz bei Neugeborenen
Veröffentlichte Studien und Postmarketing-Berichte beschreiben die mütterliche NSAID-Nutzung etwa in der 20. Schwangerschaftswoche oder später in der Schwangerschaft im Zusammenhang mit fetaler Nierenfunktionsstörung, die zu Oligohydramnion und in einigen Fällen zu neonataler Nierenfunktionsstörung führt. Diese Nebenwirkungen werden im Durchschnitt nach Tagen bis Wochen der Behandlung beobachtet, obwohl Oligohydramnion selten schon 48 Stunden nach Beginn der Behandlung mit NSAR berichtet wurde. In vielen Fällen, aber nicht in allen Fällen, war die Abnahme des Fruchtwassers vorübergehend und nach Absetzen des Medikaments reversibel. Es gab eine begrenzte Anzahl von Fallberichten über die Anwendung von mütterlichen NSAIDs und neonatale Nierenfunktionsstörungen ohne Oligohydramnion, von denen einige irreversibel waren. Einige Fälle von Nierenfunktionsstörungen bei Neugeborenen erforderten eine Behandlung mit invasiven Verfahren wie Austauschtransfusionen oder Dialyse.
Zu den methodischen Einschränkungen dieser Postmarketing-Studien und -Berichte gehört das Fehlen einer Kontrollgruppe; begrenzte Informationen zu Dosis, Dauer und Zeitpunkt der Arzneimittelexposition; und gleichzeitiger Einnahme anderer Medikamente. Diese Einschränkungen schließen eine verlässliche Schätzung des Risikos unerwünschter fetaler und neonataler Folgen bei mütterlicher NSAID-Nutzung aus. Da die veröffentlichten Sicherheitsdaten zu Folgen bei Neugeborenen hauptsächlich Frühgeborene betrafen, ist die Verallgemeinerbarkeit bestimmter berichteter Risiken für termingeborene Säuglinge, die NSAIDs durch mütterliche Anwendung ausgesetzt waren, ungewiss.
Tierdaten
Reproduktionsstudien wurden an Ratten mit 20 mg/kg/Tag (dem 0,13-Fachen der empfohlenen Höchstdosis für den Menschen von 1.500 mg/Tag, basierend auf einem Vergleich der Körperoberfläche) und an Kaninchen mit 20 mg/kg/Tag (dem 0,26-Fachen der für Menschen empfohlenen Höchstdosis) durchgeführt Tagesdosis, basierend auf einem Vergleich der Körperoberfläche) und Mäusen mit 170 mg/kg/Tag (das 0,6-fache der maximal empfohlenen Tagesdosis beim Menschen, basierend auf einem Vergleich der Körperoberfläche) ohne Anzeichen einer beeinträchtigten Fruchtbarkeit oder Schädigung des Fötus aufgrund der Arzneimittel. Basierend auf Tierdaten wurde gezeigt, dass Prostaglandine eine wichtige Rolle bei der Gefäßpermeabilität des Endometriums, der Blastozystenimplantation und der Dezidualisierung spielen. In Tierversuchen führte die Verabreichung von Prostaglandinsynthesehemmern wie Naproxen-Natrium zu einem erhöhten Prä- und Postimplantationsverlust.
Stillzeit
Zusammenfassung der Risiken
Das Naproxen-Anion wurde in der Milch stillender Frauen in einer Konzentration von etwa 1 % der Plasmakonzentration gefunden. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an NAPRELAN und möglichen nachteiligen Auswirkungen von NAPRELAN oder der zugrunde liegenden Erkrankung der Mutter auf den gestillten Säugling berücksichtigt werden.
Weibchen und Männchen mit reproduktivem Potenzial
Unfruchtbarkeit
Frauen
Basierend auf dem Wirkmechanismus kann die Anwendung von Prostaglandin-vermittelten NSAIDs, einschließlich NAPRELAN, das Reißen der Ovarialfollikel verzögern oder verhindern, was bei einigen Frauen mit reversibler Unfruchtbarkeit in Verbindung gebracht wurde. Veröffentlichte Tierstudien haben gezeigt, dass die Verabreichung von Prostaglandinsynthesehemmern das Potenzial hat, die für den Eisprung erforderliche Prostaglandin-vermittelte Follikelruptur zu stören. Kleine Studien an Frauen, die mit NSAR behandelt wurden, haben auch eine reversible Verzögerung des Eisprungs gezeigt. Erwägen Sie das Absetzen von NSAIDs, einschließlich NAPRELAN 250 mg, bei Frauen, die Schwierigkeiten haben, schwanger zu werden, oder die sich einer Untersuchung auf Unfruchtbarkeit unterziehen.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von NAPRELAN 500 mg bei Kindern und Jugendlichen wurde nicht nachgewiesen.
Geriatrische Verwendung
Ältere Patienten haben im Vergleich zu jüngeren Patienten ein größeres Risiko für NSAID-assoziierte schwerwiegende kardiovaskuläre, gastrointestinale und/oder renale Nebenwirkungen. Wenn der erwartete Nutzen für den älteren Patienten diese potenziellen Risiken überwiegt, beginnen Sie mit der Dosierung am unteren Ende des Dosierungsbereichs und überwachen Sie die Patienten auf Nebenwirkungen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Es ist bekannt, dass Naproxen und seine Metaboliten im Wesentlichen über die Nieren ausgeschieden werden, und das Risiko von Nebenwirkungen dieses Arzneimittels kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da ältere Patienten eher eine eingeschränkte Nierenfunktion haben, ist bei dieser Patientengruppe Vorsicht geboten und es kann sinnvoll sein, die Nierenfunktion zu überwachen [siehe KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Die Symptome nach einer akuten NSAID-Überdosierung beschränkten sich typischerweise auf Lethargie, Benommenheit, Übelkeit, Erbrechen und epigastrische Schmerzen, die im Allgemeinen mit unterstützender Behandlung reversibel waren. Magen-Darm-Blutungen sind aufgetreten. Bluthochdruck, akutes Nierenversagen, Atemdepression und Koma sind aufgetreten, aber selten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Einige Patienten hatten Krampfanfälle, aber es ist nicht klar, ob diese mit dem Medikament in Zusammenhang standen oder nicht. Es ist nicht bekannt, welche Dosis des Medikaments lebensbedrohlich wäre.
Behandeln Sie Patienten mit symptomatischer und unterstützender Behandlung nach einer NSAID-Überdosierung. Es gibt keine spezifischen Gegenmittel. Die Hämodialyse verringert die Plasmakonzentration von Naproxen aufgrund des hohen Grades seiner Proteinbindung nicht. Erwägen Sie Erbrechen und/oder Aktivkohle (60 bis 100 Gramm bei Erwachsenen, 1 bis 2 Gramm pro kg Körpergewicht bei pädiatrischen Patienten) und/oder osmotische Abführmittel bei symptomatischen Patienten, die innerhalb von vier Stunden nach der Einnahme beobachtet wurden, oder bei Patienten mit einer starken Überdosierung ( 5- bis 10-fache der empfohlenen Dosierung). Forcierte Diurese, Alkalisierung des Urins, Hämodialyse oder Hämoperfusion sind aufgrund der hohen Proteinbindung möglicherweise nicht sinnvoll.
Wenden Sie sich für weitere Informationen zur Behandlung einer Überdosierung an eine Giftnotrufzentrale (1-800-222-1222).
KONTRAINDIKATIONEN
NAPRELAN 500 mg ist bei folgenden Patienten kontraindiziert:
Bekannte Überempfindlichkeit (z. B. anaphylaktische Reaktionen und schwerwiegende Hautreaktionen) gegen Naproxen oder andere Bestandteile des Arzneimittels [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Vorgeschichte von Asthma, Urtikaria oder anderen allergischen Reaktionen nach der Einnahme von Aspirin oder anderen NSAIDs. Bei solchen Patienten wurde über schwere, manchmal tödliche anaphylaktische Reaktionen auf NSAIDs berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Im Rahmen einer Koronararterien-Bypass-Operation (CABG) [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Naproxen hat analgetische, entzündungshemmende und fiebersenkende Eigenschaften.
Der Wirkungsmechanismus von NAPRELAN ist wie der anderer NSAIDs nicht vollständig geklärt, beinhaltet jedoch die Hemmung der Cyclooxygenase (COX-1 und COX-2).
Naproxen-Natrium ist ein potenter Inhibitor der Prostaglandinsynthese in vitro. Naproxen-Natrium-Konzentrationen, die während der Therapie erreicht wurden, haben in vivo Wirkungen hervorgerufen. Prostaglandine sensibilisieren afferente Nerven und potenzieren die Wirkung von Bradykinin bei der Schmerzauslösung in Tiermodellen.
Prostaglandine sind Entzündungsmediatoren. Da Naproxen-Natrium ein Hemmer der Prostaglandinsynthese ist, kann seine Wirkungsweise auf einer Abnahme von Prostaglandinen in peripheren Geweben beruhen.
Pharmakodynamik
In einer Studie mit gesunden Freiwilligen zeigte die 10-tägige gleichzeitige Verabreichung von Naproxen 220 mg einmal täglich mit niedrig dosiertem Aspirin mit sofortiger Wirkstofffreisetzung (81 mg) eine Wechselwirkung mit der gerinnungshemmenden Wirkung von Aspirin, gemessen anhand der prozentualen Hemmung von Thromboxan B2 im Serum nach 24 Stunden nach der Dosis von Tag 10 [98,7 % (Aspirin allein) gegenüber 93,1 % (Naproxen und Aspirin)]. Die Wechselwirkung wurde sogar nach Absetzen von Naproxen an Tag 11 beobachtet (während die Aspirin-Dosis fortgesetzt wurde), normalisierte sich jedoch bis Tag 13. In derselben Studie war die Wechselwirkung größer, wenn Naproxen 30 Minuten vor Aspirin verabreicht wurde [98,7 % vs. 87,7 %]. und minimal, wenn Aspirin 30 Minuten vor Naproxen verabreicht wurde [98,7 % vs. 95,4 %].
Nach Verabreichung von 220 mg Naproxen zweimal täglich mit niedrig dosiertem Aspirin mit sofortiger Freisetzung (erste Naproxen-Dosis 30 Minuten vor Aspirin) war die Wechselwirkung 24 Stunden nach der Dosis an Tag 10 minimal [98,7 % vs. 95,7 %]. Allerdings war die Wechselwirkung nach Absetzen von Naproxen (Washout) an Tag 11 deutlicher [98,7 % vs. 84,3 %] und normalisierte sich bis Tag 13 nicht vollständig [98,5 % vs. 90,7 %]. [sehen WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Pharmakokinetik
Obwohl Naproxen selbst gut resorbiert wird, wird die Natriumsalzform schneller resorbiert, was bei einer gegebenen Dosis zu höheren Spitzenplasmaspiegeln führt. Ungefähr 30 % der Naproxen-Natrium-Gesamtdosis in NAPRELAN 500-mg-Tabletten sind in der Dosierungsform als Komponente mit sofortiger Freisetzung vorhanden. Das verbleibende Naproxen-Natrium wird als Mikropartikel beschichtet, um Eigenschaften einer verzögerten Freisetzung bereitzustellen. Nach oraler Verabreichung werden die Plasmaspiegel von Naproxen innerhalb von 30 Minuten nach der Einnahme nachgewiesen, wobei die maximalen Plasmaspiegel etwa 5 Stunden nach der Einnahme erreicht werden. Die beobachtete terminale Eliminationshalbwertszeit von Naproxen sowohl aus Naproxen-Natrium mit sofortiger Freisetzung als auch aus NAPRELAN-Tabletten beträgt ungefähr 15 Stunden. Steady-State-Spiegel von Naproxen werden in 3 Tagen erreicht und der Grad der Naproxen-Akkumulation im Blut stimmt damit überein.
Naproxen-Plasmakonzentrationen Mittelwert von 24 Probanden (+/-2SD) (Steady State, Tag 5)
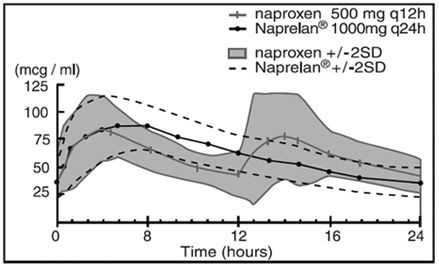
Pharmakokinetische Parameter am Steady-State-Tag 5 (Mittelwert von 24 Probanden)
Absorption
Naproxen selbst wird mit einer In-vivo-Bioverfügbarkeit von 95 % schnell und vollständig aus dem Gastrointestinaltrakt resorbiert. Basierend auf dem pharmakokinetischen Profil tritt die Resorptionsphase von NAPRELAN 250 mg Tabletten in den ersten 4 bis 6 Stunden nach der Verabreichung auf. Dies fällt zusammen mit dem Zerfall der Tablette im Magen, dem Durchgang der Mikropartikel mit verzögerter Freisetzung durch den Dünndarm und in den proximalen Dickdarm. An gesunden Freiwilligen wurde eine In-vivo-Bildgebungsstudie durchgeführt, die den schnellen Zerfall der Tablettenmatrix und die Dispersion der Mikropartikel bestätigt.
Die Absorptionsrate der Partikelkomponente mit verzögerter Freisetzung von NAPRELAN-Tabletten ist langsamer als die von herkömmlichen Naproxen-Natrium-Tabletten. Es ist diese Verlängerung der Arzneimittelabsorptionsprozesse, die die Plasmaspiegel aufrechterhält und eine einmal tägliche Dosierung ermöglicht.
Auswirkungen auf Lebensmittel
Es wurden keine signifikanten Nahrungsmitteleffekte beobachtet, als vierundzwanzig Probanden eine Einzeldosis von NAPRELAN 500 mg Tabletten 500 mg entweder nach nächtlichem Fasten oder 30 Minuten nach einer Mahlzeit erhielten. Wie bei herkömmlichen Naproxen- und Naproxen-Natrium-Formulierungen verursacht die Nahrung eine leichte Abnahme der Naproxen-Resorptionsrate nach der Verabreichung von NAPRELAN 250 mg Tabletten.
Verteilung
Naproxen hat ein Verteilungsvolumen von 0,16 l/kg. In therapeutischen Konzentrationen ist Naproxen zu mehr als 99 % an Albumin gebunden. Bei Naproxen-Dosen von mehr als 500 mg/Tag kommt es zu einem unterproportionalen Anstieg der Plasmaspiegel aufgrund einer Zunahme der Clearance, die durch Sättigung der Plasmaproteinbindung bei höheren Dosen verursacht wird. Die Konzentration von ungebundenem Naproxen steigt jedoch weiterhin proportional zur Dosis an. NAPRELAN-Tabletten weisen ähnliche dosisproportionale Eigenschaften auf.
Beseitigung
Stoffwechsel
Naproxen wird weitgehend zu 6-0-Desmethyl-Naproxen metabolisiert, und sowohl die Ausgangssubstanz als auch die Metaboliten induzieren keine metabolisierenden Enzyme.
Ausscheidung
Die Eliminationshalbwertszeit von NAPRELAN 500 mg Tabletten und herkömmlichem Naproxen beträgt etwa 15 Stunden. Steady-State-Bedingungen werden nach 2 bis 3 Dosen NAPRELAN-Tabletten erreicht. Der größte Teil des Arzneimittels wird im Urin ausgeschieden, hauptsächlich als unverändertes Naproxen (weniger als 1 %), 6-0-Desmethylnaproxen (weniger als 1 %) und deren Glucuronid oder andere Konjugate (66 bis 92 %). Eine kleine Menge (
Spezifische Populationen
Pädiatrie
Es wurden keine pädiatrischen Studien mit NAPRELAN 500 mg Tabletten durchgeführt, daher wurde die Sicherheit von NAPRELAN 500 mg Tabletten bei pädiatrischen Populationen nicht nachgewiesen.
Leberfunktionsstörung
Chronische alkoholische Lebererkrankungen und wahrscheinlich andere Erkrankungen mit verringerten oder abnormalen Plasmaproteinen (Albumin) verringern die Gesamtplasmakonzentration von Naproxen, aber die Plasmakonzentration von ungebundenem Naproxen ist erhöht. Vorsicht ist geboten, wenn hohe Dosen erforderlich sind, und bei diesen Patienten kann eine Dosisanpassung erforderlich sein. Es ist ratsam, die niedrigste wirksame Dosis zu verwenden.
Nierenfunktionsstörung
Die Pharmakokinetik von Naproxen wurde bei Patienten mit Niereninsuffizienz nicht bestimmt. Da Naproxen metabolisiert wird und Konjugate hauptsächlich über die Nieren ausgeschieden werden, besteht die Möglichkeit, dass Naproxen-Metaboliten bei Vorliegen einer Niereninsuffizienz akkumulieren. Die Elimination von Naproxen ist bei Patienten mit schwerer Nierenfunktionsstörung verringert. Naproxen-haltige Produkte werden nicht zur Anwendung bei Patienten mit mittelschwerer bis schwerer und schwerer Nierenfunktionsstörung (Kreatinin-Clearance WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Arzneimittelwechselwirkungsstudien
Aspirin
Wenn NSAIDs mit Aspirin verabreicht wurden, wurde die Proteinbindung von NSAIDs reduziert, obwohl die Clearance von freiem NSAID nicht verändert wurde. Die klinische Bedeutung dieser Wechselwirkung ist nicht bekannt. Siehe Tabelle 1 für klinisch signifikante Arzneimittelwechselwirkungen von NSAIDs mit Aspirin [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Klinische Studien
Rheumatoide Arthritis
Die Anwendung von NAPRELAN 500 mg Tabletten zur Behandlung der Anzeichen und Symptome von rheumatoider Arthritis wurde in einer 12-wöchigen, doppelblinden, randomisierten, placebo- und aktivkontrollierten Studie an 348 Patienten untersucht. Zwei NAPRELAN 500 mg Tabletten (1000 mg) einmal täglich und Naproxen 500 mg Tabletten zweimal täglich (1000 mg) waren wirksamer als Placebo. Die klinische Wirksamkeit wurde nach einer Woche nachgewiesen und hielt für die Dauer der Studie an.
Arthrose
Die Anwendung von NAPRELAN-Tabletten zur Behandlung der Anzeichen und Symptome von Osteoarthritis des Knies wurde in einer 12-wöchigen doppelblinden, placebo- und aktivkontrollierten Studie an 347 Patienten untersucht. Zwei NAPRELAN 500 mg Tabletten (1.000 mg) einmal täglich und Naproxen 500 mg Tabletten zweimal täglich (1.000 mg) waren wirksamer als Placebo. Die klinische Wirksamkeit wurde nach einer Woche nachgewiesen und hielt für die Dauer der Studie an.
Analgesie
Der Beginn der analgetischen Wirkung von NAPRELAN-Tabletten wurde innerhalb von 30 Minuten in einer pharmakokinetischen/pharmakodynamischen Studie an Patienten mit Schmerzen nach einer oralen Operation beobachtet. In kontrollierten klinischen Studien wurde Naproxen in Kombination mit Gold, D-Penicillamin, Methotrexat und Kortikosteroiden verwendet. Die Anwendung in Kombination mit Salicylat wird nicht empfohlen, da es Hinweise gibt, dass Aspirin die Ausscheidungsrate von Naproxen erhöht, und die Daten nicht ausreichen, um zu zeigen, dass Naproxen und Aspirin eine größere Verbesserung gegenüber der mit Aspirin allein erreichten bewirken. Darüber hinaus kann die Kombination wie bei anderen NSAIDs zu einer höheren Häufigkeit von unerwünschten Ereignissen führen, als dies für jedes Produkt allein gezeigt wurde.
Spezielle Studien
In einer doppelblinden, randomisierten Parallelgruppenstudie erhielten 19 Probanden 7 Tage lang entweder einmal täglich zwei NAPRELAN-500-mg-Tabletten (1.000 mg) oder zweimal täglich Naproxen-500-mg-Tabletten (1.000 mg). Schleimhautbiopsiewerte und endoskopische Werte waren bei den Probanden, die NAPRELAN-Tabletten erhielten, niedriger. In einer anderen doppelblinden, randomisierten Crossover-Studie erhielten 23 Probanden 7 Tage lang zwei NAPRELAN 500-mg-Tabletten (1.000 mg) einmal täglich, Naproxen 500-mg-Tabletten (1.000 mg) zweimal täglich und Aspirin 650 mg viermal täglich (2.600 mg). jeder. Unter NAPRELAN-Tabletten wurden signifikant weniger Zwölffingerdarmerosionen beobachtet als unter Naproxen oder Aspirin. Sowohl mit NAPRELAN-Tabletten als auch mit Naproxen traten signifikant weniger Magenerosionen auf als mit Aspirin. Die klinische Bedeutung dieser Befunde ist nicht bekannt.
INFORMATIONEN ZUM PATIENTEN
Medikationsleitfaden für nichtsteroidale Antirheumatika (NSAIDs)
Was sind die wichtigsten Informationen, die ich über sogenannte nichtsteroidale Antirheumatika (NSAIDs) wissen sollte?
NSAIDs können schwerwiegende Nebenwirkungen haben, einschließlich:
Nehmen Sie NSAIDs nicht direkt vor oder nach einer Herzoperation ein, die als „Koronararterien-Bypass-Transplantation (CABG)“ bezeichnet wird. Vermeiden Sie die Einnahme von NSAIDs nach einem kürzlichen Herzinfarkt, es sei denn, Ihr medizinischer Betreuer sagt es Ihnen. Sie haben möglicherweise ein erhöhtes Risiko für einen weiteren Herzinfarkt, wenn Sie NSAIDs nach einem kürzlich erlittenen Herzinfarkt einnehmen.
Das Risiko, ein Geschwür oder eine Blutung zu bekommen, steigt mit:
NSAIDs sollten nur verwendet werden:
Was sind NSAIDs?
NSAIDs werden zur Behandlung von Schmerzen und Rötungen, Schwellungen und Hitze (Entzündung) aufgrund von Erkrankungen wie verschiedenen Arten von Arthritis, Menstruationsbeschwerden und anderen Arten von kurzfristigen Schmerzen eingesetzt.
Wer sollte keine NSAIDs einnehmen?
Nehmen Sie keine NSAIDs ein:
Informieren Sie vor der Einnahme von NSAIDs Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger oder rezeptfreier Arzneimittel, Vitamine oder pflanzlicher Nahrungsergänzungsmittel. NSAIDs und einige andere Arzneimittel können miteinander interagieren und schwerwiegende Nebenwirkungen verursachen. Beginnen Sie nicht mit der Einnahme eines neuen Arzneimittels, ohne vorher mit Ihrem Arzt gesprochen zu haben.
Welche Nebenwirkungen können NSAIDs haben?
NSAIDs können schwerwiegende Nebenwirkungen haben, einschließlich:
Siehe „Was sind die wichtigsten Informationen, die ich über sogenannte nichtsteroidale Antirheumatika (NSAIDs) wissen sollte?
Andere Nebenwirkungen von NSAIDs sind: Magenschmerzen, Verstopfung, Durchfall, Blähungen, Sodbrennen, Übelkeit, Erbrechen und Schwindel.
Holen Sie sofort Hilfe, wenn Sie eines der folgenden Symptome bemerken:
Brechen Sie die Einnahme Ihres NSAID ab und rufen Sie sofort Ihren Arzt an, wenn Sie eines der folgenden Symptome bemerken:
Wenn Sie zu viel von Ihrem NSAID eingenommen haben, rufen Sie Ihren Arzt an oder holen Sie sich sofort medizinische Hilfe.
Dies sind nicht alle möglichen Nebenwirkungen von NSAIDs. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker nach NSAIDs.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Weitere Informationen zu NSAIDs
Allgemeine Informationen zur sicheren und wirksamen Anwendung von NSAIDs
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie NSAIDs nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie NSAIDs nicht an andere Personen, selbst wenn sie die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Wenn Sie weitere Informationen zu NSAIDs wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Apotheker oder Gesundheitsdienstleister um Informationen über NSAIDs bitten, die für medizinisches Fachpersonal geschrieben sind.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.