Neurontin 100mg, 300mg, 400mg, 600mg Gabapentin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Neurontin und wie wird es angewendet?
Neurontin 400 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Nervenschmerzen und Krampfanfällen. Neurontin kann allein oder mit anderen Medikamenten verwendet werden.
Neurontin ist ein GABA-Analogon, ein Antiepileptikum.
Es ist nicht bekannt, ob Neurontin bei Kindern unter 3 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Neurontin 400mg haben?
Neurontin kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Neurontin gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Neurontin. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Der Wirkstoff in NEURONTIN Kapseln, Tabletten und Lösung zum Einnehmen ist Gabapentin, das den chemischen Namen 1-(Aminomethyl)cyclohexanessigsäure hat.
Die Molekularformel von Gabapentin ist C9H17NO2 und das Molekulargewicht beträgt 171,24. Die Strukturformel von Gabapentin lautet:
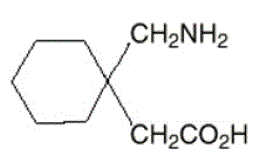
Gabapentin ist ein weißer bis cremefarbener kristalliner Feststoff mit einem pKa1-Wert von 3,7 und einem pKa2-Wert von 10,7. Es ist in Wasser und sowohl in basischen als auch in sauren wässrigen Lösungen frei löslich. Der log des Verteilungskoeffizienten (Noctanol/0,05 M Phosphatpuffer) bei pH 7,4 beträgt –1,25.
Jede Neurontin 100 mg Kapsel enthält 100 mg, 300 mg oder 400 mg Gabapentin und die folgenden inaktiven Bestandteile: Lactose, Maisstärke, Talk, Gelatine, Titandioxid, FD&C Blue No. 2, gelbes Eisenoxid (nur 300 mg und 400 mg) und rotes Eisenoxid (nur 400 mg).
Jede Neurontin-Tablette enthält 600 mg oder 800 mg Gabapentin und die folgenden Hilfsstoffe: Poloxamer 407, Copovidon, Maisstärke, Magnesiumstearat, Hydroxypropylcellulose, Talk und Candelillawachs
Neurontin Lösung zum Einnehmen enthält 250 mg Gabapentin pro 5 ml (50 mg pro ml) und die folgenden inaktiven Bestandteile: Glycerin, Xylit, gereinigtes Wasser und künstliches kühles Erdbeer-Anis-Aroma.
INDIKATIONEN
NEURONTIN® ist indiziert bei:
DOSIERUNG UND ANWENDUNG
Dosierung für postherpetische Neuralgie
Bei Erwachsenen mit postzosterischer Neuralgie kann mit NEURONTIN an Tag 1 als Einzeldosis von 300 mg, an Tag 2 mit 600 mg/Tag (300 mg zweimal täglich) und an Tag 3 mit 900 mg/Tag (300 mg dreimal täglich) begonnen werden Mal am Tag). Die Dosis kann anschließend nach Bedarf zur Schmerzlinderung auf eine Dosis von 1800 mg/Tag (600 mg dreimal täglich) erhöht werden. In klinischen Studien wurde die Wirksamkeit über einen Dosisbereich von 1800 mg/Tag bis 3600 mg/Tag mit vergleichbaren Wirkungen über den gesamten Dosisbereich nachgewiesen; In diesen klinischen Studien wurde jedoch der zusätzliche Nutzen der Anwendung von Dosen über 1800 mg/Tag nicht nachgewiesen.
Dosierung für Epilepsie mit partiellen Anfällen
Patienten ab 12 Jahren
Die Anfangsdosis beträgt 300 mg dreimal täglich. Die empfohlene Erhaltungsdosis von NEURONTIN beträgt 300 mg bis 600 mg dreimal täglich. Dosierungen bis zu 2400 mg/Tag wurden in klinischen Langzeitstudien gut vertragen. Dosen von 3600 mg/Tag wurden ebenfalls einer kleinen Anzahl von Patienten über einen relativ kurzen Zeitraum verabreicht und wurden gut vertragen. Verabreichen Sie NEURONTIN dreimal täglich mit 300-mg- oder 400-mg-Kapseln oder 600-mg- oder 800-mg-Tabletten. Die maximale Zeit zwischen den Dosen sollte 12 Stunden nicht überschreiten.
Pädiatrische Patienten im Alter von 3 bis 11 Jahren
Die Anfangsdosis beträgt 10 mg/kg/Tag bis 15 mg/kg/Tag, gegeben in drei aufgeteilten Dosen, und die empfohlene Erhaltungsdosis wird durch Auftitrieren über einen Zeitraum von etwa 3 Tagen erreicht. Die empfohlene Erhaltungsdosis von NEURONTIN bei Patienten im Alter von 3 bis 4 Jahren beträgt 40 mg/kg/Tag, verabreicht in drei Einzeldosen. Die empfohlene Erhaltungsdosis von NEURONTIN 100 mg bei Patienten im Alter von 5 bis 11 Jahren beträgt 25 mg/kg/Tag bis 35 mg/kg/Tag, verabreicht in drei getrennten Dosen. NEURONTIN 300 mg kann als orale Lösung, Kapsel oder Tablette oder unter Verwendung von Kombinationen dieser Formulierungen verabreicht werden. Dosierungen bis zu 50 mg/kg/Tag wurden in einer klinischen Langzeitstudie gut vertragen. Das maximale Zeitintervall zwischen den Dosen sollte 12 Stunden nicht überschreiten.
Dosisanpassung bei Patienten mit eingeschränkter Nierenfunktion
Bei Patienten ab 12 Jahren mit Nierenfunktionsstörung oder Hämodialyse wird eine Dosisanpassung wie folgt empfohlen (siehe Dosierungsempfehlungen oben für wirksame Dosen in jeder Indikation):
TABELLE 1: NEURONTIN-Dosierung basierend auf der Nierenfunktion
Die Kreatinin-Clearance (CLCr) ist bei ambulanten Patienten schwer zu messen. Bei Patienten mit stabiler Nierenfunktion lässt sich die Kreatinin-Clearance mit der Gleichung von Cockcroft und Gault recht gut abschätzen:
Die Anwendung von NEURONTIN bei Patienten unter 12 Jahren mit eingeschränkter Nierenfunktion wurde nicht untersucht.
Dosierung bei älteren Menschen
Da bei älteren Patienten mit größerer Wahrscheinlichkeit eine eingeschränkte Nierenfunktion vorliegt, sollte die Dosis sorgfältig ausgewählt und die Dosis bei diesen Patienten auf der Grundlage der Kreatinin-Clearance-Werte angepasst werden.
Verwaltungsinformationen
NEURONTIN oral mit oder ohne Nahrung verabreichen.
NEURONTIN 100 mg Kapseln sollten unzerkaut mit Wasser geschluckt werden.
Informieren Sie die Patienten darüber, dass sie, wenn sie die Bruchrille von 600 mg oder 800 mg NEURONTIN teilen, um eine halbe Tablette zu verabreichen, die unbenutzte halbe Tablette als nächste Dosis einnehmen sollten. Halbe Tabletten, die nicht innerhalb von 28 Tagen nach dem Teilen der Bruchkerbe verwendet wurden, sollten verworfen werden.
Wenn die NEURONTIN-Dosis reduziert, abgesetzt oder durch ein alternatives Medikament ersetzt wird, sollte dies schrittweise über mindestens 1 Woche erfolgen (nach Ermessen des verschreibenden Arztes kann ein längerer Zeitraum erforderlich sein).
WIE GELIEFERT
Darreichungsformen und Stärken
Kapseln
Tablets
Mündliche Lösung
Lagerung und Handhabung
NEURONTIN (Gabapentin) Kapseln, Tabletten und Lösung zum Einnehmen werden wie folgt geliefert:
100-mg-Kapseln
Weiße Hartgelatinekapseln mit dem Aufdruck „PD“ auf dem Unterteil und „Neurontin/100 mg“ auf dem Oberteil; verfügbar in:
100er Flaschen: NDC 0071-0803-24
300-mg-Kapseln
Gelbe Hartgelatinekapseln mit dem Aufdruck „PD“ auf dem Unterteil und „Neurontin/300 mg“ auf dem Oberteil; verfügbar in:
100er Flaschen: NDC 0071-0805-24 Einheitsdosis 50’s: NDC 0071-0805-40
400-mg-Kapseln
Orangefarbene Hartgelatinekapseln mit dem Aufdruck „PD“ auf dem Unterteil und „Neurontin/400 mg“ auf dem Oberteil; verfügbar in:
100er Flaschen: NDC 0071-0806-24 Einheitsdosis 50’s: NDC 0071-0806-40
600-mg-Tabletten
Weiße, elliptische Filmtabletten mit Bruchkerbe mit der Prägung „NT“ und „16“ auf einer Seite; verfügbar in:
100er Flaschen: NDC 0071-0513-24
800-mg-Tabletten
Weiße, elliptische Filmtabletten mit Bruchkerbe mit der Prägung „NT“ und „26“ auf einer Seite; verfügbar in:
100er Flaschen: NDC 0071-0401-24
250 mg pro 5 ml Lösung zum Einnehmen
Klare farblose bis leicht gelbe Lösung; jede 5 ml Lösung zum Einnehmen enthält 250 mg Gabapentin; verfügbar in:
Glasflaschen mit 470 ml Inhalt: NDC 0071-2012-23 Flaschen mit 470 ml: NDC 0071-2012-44
NEURONTIN 400 mg Tabletten und Kapseln bei 25 °C (77 °F) lagern; Exkursionen zwischen 15°C und 30°C (59°F bis 86°F) erlaubt [siehe USP kontrollierte Raumtemperatur ].
NEURONTIN Lösung zum Einnehmen gekühlt bei 2 °C bis 8 °C (36 °F bis 46 °F) lagern.
Vertrieb durch: Parke-Davis, Division of Pfizer Inc., NY, NY 10017. Überarbeitet: Dez 2020
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden in anderen Abschnitten ausführlicher besprochen:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Postherpetische Neuralgie
Die häufigsten Nebenwirkungen im Zusammenhang mit der Anwendung von NEURONTIN bei Erwachsenen, die bei mit Placebo behandelten Patienten nicht mit der gleichen Häufigkeit beobachtet wurden, waren Schwindel, Somnolenz und periphere Ödeme.
In den 2 kontrollierten Studien zu postzosterischer Neuralgie brachen 16 % der 336 Patienten, die NEURONTIN erhielten, und 9 % der 227 Patienten, die Placebo erhielten, die Behandlung wegen einer Nebenwirkung ab. Die Nebenwirkungen, die bei mit NEURONTIN behandelten Patienten am häufigsten zum Absetzen führten, waren Schwindel, Somnolenz und Übelkeit.
Tabelle 3 listet Nebenwirkungen auf, die bei mindestens 1 % der mit NEURONTIN behandelten Patienten mit postzosterischer Neuralgie auftraten, die an placebokontrollierten Studien teilnahmen, und die zahlenmäßig häufiger in der NEURONTIN-Gruppe als in der Placebo-Gruppe auftraten.
TABELLE 3: Nebenwirkungen in gepoolten Placebo-kontrollierten Studien bei postzosterischer Neuralgie
Andere Reaktionen bei mehr als 1 % der Patienten, aber gleich oder häufiger in der Placebogruppe, waren Schmerzen, Tremor, Neuralgie, Rückenschmerzen, Dyspepsie, Dyspnoe und Grippesyndrom.
Es gab keine klinisch bedeutsamen Unterschiede zwischen Männern und Frauen in Art und Häufigkeit von Nebenwirkungen. Da es wenige Patienten gab, deren ethnische Zugehörigkeit nicht als weiß angegeben wurde, liegen keine ausreichenden Daten vor, um eine Aussage über die Verteilung der Nebenwirkungen nach ethnischer Zugehörigkeit zu stützen.
Epilepsie mit fokalen Anfällen (Zusatztherapie)
Die häufigsten Nebenwirkungen von NEURONTIN 300 mg in Kombination mit anderen Antiepileptika bei Patienten über 12 Jahren, die bei mit Placebo behandelten Patienten nicht mit der gleichen Häufigkeit beobachtet wurden, waren Somnolenz, Schwindel, Ataxie, Müdigkeit und Nystagmus.
Die häufigsten Nebenwirkungen von NEURONTIN in Kombination mit anderen Antiepileptika bei pädiatrischen Patienten im Alter von 3 bis 12 Jahren, die bei mit Placebo behandelten Patienten nicht mit der gleichen Häufigkeit beobachtet wurden, waren Virusinfektion, Fieber, Übelkeit und/oder Erbrechen, Somnolenz und Feindseligkeit [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Etwa 7 % der 2074 Patienten > 12 Jahre und etwa 7 % der 449 pädiatrischen Patienten im Alter von 3 bis 12 Jahren, die NEURONTIN in klinischen Studien vor der Markteinführung erhielten, brachen die Behandlung wegen einer Nebenwirkung ab. Die am häufigsten mit dem Absetzen verbundenen Nebenwirkungen bei Patienten über 12 Jahren waren Somnolenz (1,2 %), Ataxie (0,8 %), Müdigkeit (0,6 %), Übelkeit und/oder Erbrechen (0,6 %) und Schwindel (0,6 %). . Die Nebenwirkungen, die am häufigsten mit dem Entzug bei pädiatrischen Patienten in Verbindung gebracht wurden, waren emotionale Labilität (1,6 %), Feindseligkeit (1,3 %) und Hyperkinesie (1,1 %).
Tabelle 4 listet Nebenwirkungen auf, die bei mindestens 1 % der mit NEURONTIN behandelten Patienten > 12 Jahre mit Epilepsie auftraten, die an placebokontrollierten Studien teilnahmen, und in der NEURONTIN-Gruppe zahlenmäßig häufiger auftraten. In diesen Studien wurde entweder NEURONTIN 300 mg oder ein Placebo zur aktuellen antiepileptischen Arzneimitteltherapie des Patienten hinzugefügt.
TABELLE 4: Nebenwirkungen in gepoolten placebokontrollierten Add-on-Studien bei Epilepsiepatienten > 12 Jahre
Unter den Nebenwirkungen, die bei mit NEURONTIN behandelten Patienten mit einer Inzidenz von mindestens 10 % auftraten, schienen Somnolenz und Ataxie eine positive Dosis-Wirkungs-Beziehung aufzuweisen.
Die Gesamthäufigkeit von Nebenwirkungen und die Arten der beobachteten Nebenwirkungen waren bei Männern und Frauen, die mit NEURONTIN behandelt wurden, ähnlich. Die Inzidenz von Nebenwirkungen nahm mit zunehmendem Alter bei Patienten, die entweder mit NEURONTIN oder Placebo behandelt wurden, leicht zu. Da nur 3 % der Patienten (28/921) in Placebo-kontrollierten Studien als nicht-weiß (schwarz oder anders) identifiziert wurden, liegen keine ausreichenden Daten vor, um eine Aussage über die Verteilung von Nebenwirkungen nach ethnischer Zugehörigkeit zu stützen.
Tabelle 5 listet Nebenwirkungen auf, die bei mindestens 2 % der mit NEURONTIN behandelten Patienten im Alter von 3 bis 12 Jahren mit Epilepsie auftraten, die an placebokontrollierten Studien teilnahmen, und die zahlenmäßig häufiger in der NEURONTIN-Gruppe auftraten.
TABELLE 5: Nebenwirkungen in einer placebokontrollierten Add-on-Studie bei pädiatrischen Epilepsiepatienten im Alter von 3 bis 12 Jahren
Andere Reaktionen bei mehr als 2 % der pädiatrischen Patienten im Alter von 3 bis 12 Jahren, aber gleich häufig oder häufiger in der Placebogruppe, waren: Pharyngitis, Infektion der oberen Atemwege, Kopfschmerzen, Rhinitis, Krämpfe, Durchfall, Anorexie, Husten und Mittelohrentzündung.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden nach der Markteinführung von NEURONTIN festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Leber- und Gallenerkrankungen: Gelbsucht
Untersuchungen: erhöhte Kreatinkinase, erhöhte Leberfunktionswerte
Stoffwechsel- und Ernährungsstörungen: Hyponatriämie
Erkrankungen des Bewegungsapparates und des Bindegewebes: Rhabdomyolyse
Erkrankungen des Nervensystems: Bewegungsstörung
Psychische Störungen: Agitation
Störungen des Fortpflanzungssystems und der Brust: Brustvergrößerung, Veränderungen der Libido, Ejakulationsstörungen und Anorgasmie
Erkrankungen der Haut und des Unterhautzellgewebes: Angioödem [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ], bullöses Pemphigoid, Erythema multiforme, Stevens-Johnson-Syndrom.
Es gibt Postmarketing-Berichte über lebensbedrohliche oder tödliche Atemdepression bei Patienten, die NEURONTIN zusammen mit Opioiden oder anderen ZNS-Depressiva einnehmen, oder im Zusammenhang mit einer zugrunde liegenden Atemstörung [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Es wurden auch Nebenwirkungen nach abruptem Absetzen von Gabapentin berichtet. Die am häufigsten berichteten Reaktionen waren Angstzustände, Schlaflosigkeit, Übelkeit, Schmerzen und Schwitzen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Opioide
Atemdepression und Sedierung, manchmal mit Todesfolge, wurden nach gleichzeitiger Gabe von Gabapentin mit Opioiden (z. B. Morphin, Hydrocodon, Oxycodon, Buprenorphin) berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hydrocodon
Die gleichzeitige Verabreichung von NEURONTIN 300 mg mit Hydrocodon verringert die Hydrocodon-Exposition [siehe KLINISCHE PHARMAKOLOGIE ]. Die Möglichkeit einer Veränderung der Hydrocodon-Exposition und -Wirkung sollte berücksichtigt werden, wenn NEURONTIN 100 mg bei einem Patienten, der Hydrocodon einnimmt, begonnen oder abgesetzt wird.
Morphium
Wenn Gabapentin zusammen mit Morphin verabreicht wird, sollten die Patienten auf Anzeichen einer ZNS-Depression wie Somnolenz, Sedierung und Atemdepression beobachtet werden [siehe KLINISCHE PHARMAKOLOGIE ].
Andere Antiepileptika
Gabapentin wird nicht nennenswert metabolisiert, noch stört es den Metabolismus von üblicherweise gleichzeitig verabreichten Antiepileptika [siehe KLINISCHE PHARMAKOLOGIE ].
Maalox® (Aluminiumhydroxid, Magnesiumhydroxid)
Die mittlere Bioverfügbarkeit von Gabapentin war bei gleichzeitiger Anwendung eines Antazidums (Maalox), das Magnesium- und Aluminiumhydroxide enthielt, um etwa 20 % reduziert. Es wird empfohlen, Gabapentin mindestens 2 Stunden nach der Verabreichung von Maalox einzunehmen [siehe KLINISCHE PHARMAKOLOGIE ].
Arzneimittel-/Labortest-Wechselwirkungen
Da beim Ames N-Multistix SG Dipstick-Test für Protein im Urin falsch positive Ergebnisse gemeldet wurden, wenn Gabapentin anderen Antiepileptika zugesetzt wurde, wird das spezifischere Sulfosalicylsäure-Präzipitationsverfahren empfohlen, um das Vorhandensein von Protein im Urin zu bestimmen.
Drogenmissbrauch und -abhängigkeit
Kontrollierte Substanz
Gabapentin ist kein geplantes Medikament.
Missbrauch
Missbrauch ist die absichtliche, nicht therapeutische Anwendung eines Arzneimittels, auch nur für einmalige Zwecke, wegen seiner wünschenswerten psychologischen oder physiologischen Wirkungen. Missbrauch ist die absichtliche Verwendung eines Arzneimittels zu therapeutischen Zwecken durch eine Person auf eine andere Weise als von einem Gesundheitsdienstleister verschrieben oder für die es nicht verschrieben wurde.
Gabapentin zeigt keine Affinität zu Benzodiazepin-, Opioid- (mu, delta oder kappa) oder Cannabinoid-1-Rezeptorstellen. Gabapentin-Missbrauch und -Missbrauch wurden nach der Markteinführung und in der veröffentlichten Literatur berichtet. Die meisten der in diesen Berichten beschriebenen Personen hatten eine Vorgeschichte von Mehrfachsubstanzmissbrauch. Einige dieser Personen nahmen Gabapentin in höheren als den empfohlenen Dosen für nicht genehmigte Anwendungen ein. Wenn Sie NEURONTIN verschreiben, werten Sie die Patienten sorgfältig auf Drogenmissbrauch in der Vorgeschichte aus und beobachten Sie sie auf Anzeichen und Symptome von Gabapentin-Missbrauch oder -Missbrauch (z. B. Selbstdosissteigerung und Suchtverhalten). Das Missbrauchspotential von Gabapentin wurde nicht in Studien am Menschen untersucht.
Abhängigkeit
Körperliche Abhängigkeit ist ein Zustand, der sich als Ergebnis der physiologischen Anpassung an wiederholten Drogenkonsum entwickelt und sich durch Entzugserscheinungen und -symptome nach abruptem Absetzen oder einer signifikanten Dosisreduktion eines Arzneimittels äußert. Es gibt seltene Postmarketing-Berichte von Personen, bei denen kurz nach dem Absetzen von Gabapentin, das zur Behandlung von Krankheiten verwendet wird, für die das Medikament nicht zugelassen ist, Entzugserscheinungen auftraten. Zu diesen Symptomen gehörten Unruhe, Orientierungslosigkeit und Verwirrtheit nach plötzlichem Absetzen von Gabapentin, die nach Wiederaufnahme der Behandlung mit Gabapentin verschwanden. Das Abhängigkeitspotential von Gabapentin wurde nicht in Studien am Menschen untersucht.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS)/Multiorgan-Überempfindlichkeit
Bei NEURONTIN ist ein Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS), auch bekannt als Multiorgan-Überempfindlichkeit, aufgetreten. Einige dieser Reaktionen waren tödlich oder lebensbedrohlich. DRESS zeigt sich typischerweise, wenn auch nicht ausschließlich, mit Fieber, Hautausschlag und/oder Lymphadenopathie in Verbindung mit einer Beteiligung anderer Organsysteme wie Hepatitis, Nephritis, hämatologischen Anomalien, Myokarditis oder Myositis, die manchmal einer akuten Virusinfektion ähnelt. Eosinophilie ist oft vorhanden. Diese Störung ist in ihrer Ausprägung variabel, und andere hier nicht erwähnte Organsysteme können beteiligt sein.
Es ist wichtig zu beachten, dass frühe Manifestationen einer Überempfindlichkeit, wie Fieber oder Lymphadenopathie, vorhanden sein können, auch wenn kein Hautausschlag erkennbar ist. Wenn solche Anzeichen oder Symptome vorhanden sind, sollte der Patient sofort untersucht werden. NEURONTIN sollte abgesetzt werden, wenn keine alternative Ätiologie für die Anzeichen oder Symptome festgestellt werden kann.
Anaphylaxie und Angioödem
NEURONTIN kann nach der ersten Dosis oder zu jedem Zeitpunkt während der Behandlung Anaphylaxie und Angioödem verursachen. Zu den Anzeichen und Symptomen in gemeldeten Fällen gehörten Atembeschwerden, Schwellungen der Lippen, des Rachens und der Zunge sowie Hypotonie, die eine Notfallbehandlung erforderte. Die Patienten sollten angewiesen werden, NEURONTIN 300 mg abzusetzen und unverzüglich einen Arzt aufzusuchen, wenn sie Anzeichen oder Symptome einer Anaphylaxie oder eines Angioödems bemerken.
Auswirkungen auf das Fahren und Bedienen schwerer Maschinen
Patienten, die NEURONTIN einnehmen, sollten kein Fahrzeug führen, bis sie ausreichende Erfahrungen gesammelt haben, um beurteilen zu können, ob NEURONTIN 100 mg ihre Fahrtüchtigkeit beeinträchtigt. Studien zur Fahrtüchtigkeit, die mit einem Prodrug von Gabapentin (Gabapentin-Enacarbil-Tablette, Retardtablette) durchgeführt wurden, weisen darauf hin, dass Gabapentin eine erhebliche Beeinträchtigung der Fahrtüchtigkeit verursachen kann. Verschreibende Ärzte und Patienten sollten sich darüber im Klaren sein, dass Patienten' Fähigkeit zur Beurteilung der eigenen Fahrtüchtigkeit sowie zur Beurteilung des Grades der durch NEURONTIN verursachten Somnolenz können unvollkommen sein. Die Dauer der Fahrtüchtigkeit nach Beginn der Therapie mit NEURONTIN 300 mg ist nicht bekannt. Ob die Beeinträchtigung mit Somnolenz zusammenhängt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ] oder andere Wirkungen von NEURONTIN sind nicht bekannt.
Da NEURONTIN 300 mg außerdem Schläfrigkeit und Schwindel verursacht [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN sollten Patienten angewiesen werden, keine komplexen Maschinen zu bedienen, bis sie ausreichende Erfahrungen mit NEURONTIN gesammelt haben, um beurteilen zu können, ob NEURONTIN 300 mg ihre Fähigkeit zur Durchführung solcher Aufgaben beeinträchtigt.
Schläfrigkeit/Sedierung und Schwindel
Während der kontrollierten Epilepsiestudien bei Patienten über 12 Jahren, die Dosen von NEURONTIN 100 mg bis zu 1800 mg täglich erhielten, wurden Schläfrigkeit, Schwindel und Ataxie bei Patienten, die NEURONTIN erhielten, im Vergleich zu Placebo häufiger berichtet, dh 19 % des Medikaments gegenüber 9 % bei Placebo bei Somnolenz, 17 % bei Medikament gegenüber 7 % bei Placebo bei Schwindel und 13 % bei Medikament gegenüber 6 % bei Placebo bei Ataxie. In diesen Studien waren Schläfrigkeit, Ataxie und Müdigkeit häufige Nebenwirkungen, die zum Absetzen von NEURONTIN bei Patienten über 12 Jahren führten, wobei 1,2 %, 0,8 % bzw. 0,6 % die Behandlung aufgrund dieser Ereignisse abbrachen.
Während der kontrollierten Studien bei Patienten mit postzosterischer Neuralgie wurden Schläfrigkeit und Schwindel im Vergleich zu Placebo bei Patienten, die NEURONTIN in Dosierungen von bis zu 3600 mg pro Tag erhielten, häufiger berichtet: dh 21 % bei mit NEURONTIN behandelten Patienten gegenüber 5 % bei mit Placebo behandelten Patienten wegen Somnolenz und 28 % bei mit NEURONTIN behandelten Patienten gegenüber 8 % bei mit Placebo behandelten Patienten wegen Schwindel. Schwindel und Schläfrigkeit gehörten zu den häufigsten Nebenwirkungen, die zum Absetzen von NEURONTIN führten.
Patienten sollten wegen möglicher Synergien sorgfältig auf Anzeichen einer Depression des zentralen Nervensystems (ZNS) wie Schläfrigkeit und Sedierung überwacht werden, wenn NEURONTIN 400 mg zusammen mit anderen Arzneimitteln mit sedierenden Eigenschaften angewendet wird. Darüber hinaus können bei Patienten, die eine gleichzeitige Behandlung mit Morphin benötigen, Anstiege der Gabapentin-Konzentration auftreten und eine Dosisanpassung erforderlich sein [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Entzugskrampf, Status Epilepticus
Antiepileptika sollten wegen der möglichen Erhöhung der Anfallshäufigkeit nicht abrupt abgesetzt werden.
In den Placebo-kontrollierten Epilepsiestudien bei Patienten über 12 Jahren betrug die Inzidenz des Status epilepticus bei Patienten, die NEURONTIN erhielten, 0,6 % (3 von 543) gegenüber 0,5 % bei Patienten, die Placebo erhielten (2 von 378). Von den 2074 Patienten im Alter von > 12 Jahren, die in allen Epilepsiestudien (kontrolliert und unkontrolliert) mit NEURONTIN 300 mg behandelt wurden, hatten 31 (1,5 %) einen Status epilepticus. Von diesen hatten 14 Patienten weder vor der Behandlung noch während der Einnahme anderer Medikamente einen Status epilepticus in der Vorgeschichte. Da keine ausreichenden historischen Daten verfügbar sind, ist es unmöglich zu sagen, ob die Behandlung mit NEURONTIN mit einer höheren oder niedrigeren Rate an Status epilepticus verbunden ist, als dies bei einer ähnlichen Population ohne Behandlung mit NEURONTIN zu erwarten wäre.
Suizidverhalten und Ideenfindung
Antiepileptika (AEDs), einschließlich NEURONTIN 100 mg, erhöhen das Risiko von Suizidgedanken oder -verhalten bei Patienten, die diese Arzneimittel für jede Indikation einnehmen. Patienten, die mit einem beliebigen AED für jegliche Indikation behandelt werden, sollten auf das Auftreten oder die Verschlechterung von Depressionen, Suizidgedanken oder -verhalten und/oder ungewöhnliche Stimmungs- oder Verhaltensänderungen überwacht werden.
Gepoolte Analysen von 199 placebokontrollierten klinischen Studien (Mono- und Zusatztherapie) mit 11 verschiedenen AEDs zeigten, dass Patienten, die einem der AEDs randomisiert wurden, ein etwa doppelt so hohes Suizidrisiko hatten (angepasstes relatives Risiko 1,8, 95 %-KI: 1,2, 2,7). Denken oder Verhalten im Vergleich zu Patienten, die randomisiert Placebo erhielten. In diesen Studien, die eine mediane Behandlungsdauer von 12 Wochen hatten, betrug die geschätzte Inzidenzrate von Suizidverhalten oder Suizidgedanken bei 27.863 mit AED behandelten Patienten 0,43 %, verglichen mit 0,24 % bei 16.029 mit Placebo behandelten Patienten, was einem Anstieg von ungefähr 1 entspricht Fall von Selbstmordgedanken oder -verhalten für je 530 behandelte Patienten. In den Studien gab es vier Suizide bei mit Arzneimitteln behandelten Patienten und keinen bei mit Placebo behandelten Patienten, aber die Zahl ist zu gering, um eine Schlussfolgerung über die Wirkung des Arzneimittels auf den Suizid zuzulassen.
Das erhöhte Risiko von Suizidgedanken oder -verhalten mit AEDs wurde bereits eine Woche nach Beginn der medikamentösen Behandlung mit AEDs beobachtet und blieb für die Dauer der untersuchten Behandlung bestehen. Da die meisten in die Analyse eingeschlossenen Studien nicht über 24 Wochen hinausgingen, konnte das Risiko von Suizidgedanken oder -verhalten über 24 Wochen hinaus nicht bewertet werden.
Das Risiko für Suizidgedanken oder -verhalten war in den analysierten Daten unter den Drogen im Allgemeinen konsistent. Die Feststellung eines erhöhten Risikos bei AEDs mit unterschiedlichen Wirkungsmechanismen und über eine Reihe von Indikationen hinweg legt nahe, dass das Risiko für alle AEDs gilt, die für alle Indikationen verwendet werden. Das Risiko variierte in den analysierten klinischen Studien nicht wesentlich mit dem Alter (5–100 Jahre). Tabelle 2 zeigt das absolute und relative Risiko nach Indikation für alle bewerteten AEDs.
TABELLE 2: Risiko nach Indikation für Antiepileptika in der gepoolten Analyse
Das relative Risiko für Suizidgedanken oder -verhalten war in klinischen Studien zu Epilepsie höher als in klinischen Studien zu psychiatrischen oder anderen Erkrankungen, aber die absoluten Risikounterschiede waren für die Indikationen Epilepsie und Psychiatrie ähnlich.
Jeder, der erwägt, NEURONTIN 100 mg oder ein anderes AED zu verschreiben, muss das Risiko von Suizidgedanken oder -verhalten mit dem Risiko einer unbehandelten Erkrankung abwägen. Epilepsie und viele andere Krankheiten, für die Antiepileptika verschrieben werden, sind selbst mit Morbidität und Mortalität und einem erhöhten Risiko für Selbstmordgedanken und -verhalten verbunden. Sollten während der Behandlung Suizidgedanken und -verhalten auftreten, muss der verschreibende Arzt prüfen, ob das Auftreten dieser Symptome bei einem bestimmten Patienten mit der zu behandelnden Krankheit in Zusammenhang stehen könnte.
Patienten, ihre Betreuer und Familien sollten darüber informiert werden, dass AEDs das Risiko von Suizidgedanken und -verhalten erhöhen, und sollten darauf hingewiesen werden, dass sie auf das Auftreten oder die Verschlechterung von Anzeichen und Symptomen einer Depression, ungewöhnliche Stimmungs- oder Verhaltensänderungen achten müssen , oder das Auftreten von Selbstmordgedanken, Verhalten oder Gedanken über Selbstverletzung. Besorgniserregendes Verhalten sollte unverzüglich den Gesundheitsdienstleistern gemeldet werden.
Atemwegs beschwerden
Es gibt Hinweise aus Fallberichten, Studien am Menschen und Tierstudien, die Gabapentin mit einer schweren, lebensbedrohlichen oder tödlichen Atemdepression in Verbindung bringen, wenn es gleichzeitig mit ZNS-dämpfenden Mitteln, einschließlich Opioiden, oder im Rahmen einer zugrunde liegenden Atemstörung verabreicht wird. Wenn die Entscheidung getroffen wird, NEURONTIN 100 mg zusammen mit einem anderen ZNS-dämpfenden Mittel, insbesondere einem Opioid, zu verschreiben oder NEURONTIN 100 mg Patienten mit zugrunde liegender Atemfunktionsstörung zu verschreiben, überwachen Sie die Patienten auf Symptome einer Atemdepression und Sedierung und erwägen Sie die Einleitung einer Behandlung mit NEURONTIN in einer niedrigen Dosis . Die Behandlung einer Atemdepression kann eine engmaschige Überwachung, unterstützende Maßnahmen und die Reduzierung oder das Absetzen von ZNS-dämpfenden Mitteln (einschließlich NEURONTIN) umfassen.
Neuropsychiatrische Nebenwirkungen (Kinder im Alter von 3 bis 12 Jahren)
Die Anwendung von Gabapentin bei pädiatrischen Patienten mit Epilepsie im Alter von 3 bis 12 Jahren ist mit dem Auftreten von ZNS-bedingten Nebenwirkungen verbunden. Die wichtigsten davon können in die folgenden Kategorien eingeteilt werden: 1) emotionale Labilität (hauptsächlich Verhaltensprobleme), 2) Feindseligkeit, einschließlich aggressives Verhalten, 3) Denkstörungen, einschließlich Konzentrationsprobleme und Leistungsveränderungen in der Schule, und 4) Hyperkinesie ( hauptsächlich Ruhelosigkeit und Hyperaktivität). Bei den mit Gabapentin behandelten Patienten waren die meisten Reaktionen von leichter bis mäßiger Intensität.
In kontrollierten klinischen Studien zur Epilepsie bei pädiatrischen Patienten im Alter von 3 bis 12 Jahren betrug die Inzidenz dieser Nebenwirkungen: emotionale Labilität 6 % (mit Gabapentin behandelte Patienten) gegenüber 1,3 % (mit Placebo behandelte Patienten); Feindseligkeit 5,2 % gegenüber 1,3 %; Hyperkinesie 4,7 % gegenüber 2,9 %; und Denkstörung 1,7 % versus 0 %. Eine dieser Reaktionen, ein Bericht über Feindseligkeit, wurde als schwerwiegend eingestuft. Bei 1,3 % der Patienten, die über emotionale Labilität und Hyperkinesie berichteten, und bei 0,9 % der mit Gabapentin behandelten Patienten, die über Feindseligkeit und Denkstörungen berichteten, wurde die Behandlung mit Gabapentin abgebrochen. Ein mit Placebo behandelter Patient (0,4 %) brach die Studie aufgrund emotionaler Labilität ab.
Tumorerzeugendes Potential
In einer oralen Karzinogenitätsstudie erhöhte Gabapentin die Inzidenz von Azinuszelltumoren der Bauchspeicheldrüse bei Ratten [vgl Nichtklinische Toxikologie ]. Die klinische Bedeutung dieses Befundes ist nicht bekannt. Klinische Erfahrungen während der Entwicklung vor der Markteinführung von Gabapentin bieten keine direkte Möglichkeit, sein Potenzial zur Induktion von Tumoren beim Menschen zu beurteilen.
In klinischen Studien zur Zusatztherapie bei Epilepsie, die 2.085 Patientenjahre Exposition bei Patienten im Alter von > 12 Jahren umfassten, wurden bei 10 Patienten (2 Brust-, 3 Gehirn-, 2 Lungen-, 1 Nebennieren-, 1 Non-Hodgkin' S-Lymphom, 1 Endometriumkarzinom in situ) und vorbestehende Tumore verschlechterten sich bei 11 Patientinnen (9 Gehirn, 1 Brust, 1 Prostata) während oder bis zu 2 Jahre nach Absetzen von NEURONTIN. Ohne Kenntnis der Hintergrundinzidenz und des Rezidivs in einer ähnlichen Population, die nicht mit NEURONTIN 100 mg behandelt wurde, ist es unmöglich zu wissen, ob die in dieser Kohorte beobachtete Inzidenz durch die Behandlung beeinflusst wird oder nicht.
Plötzlicher und unerklärlicher Tod bei Patienten mit Epilepsie
Während der Entwicklung von NEURONTIN 400 mg vor der Markteinführung wurden 8 plötzliche und ungeklärte Todesfälle in einer Kohorte von 2203 mit NEURONTIN behandelten Epilepsiepatienten (2103 Patientenjahre der Exposition) verzeichnet.
Einige davon könnten anfallsbedingte Todesfälle darstellen, bei denen der Anfall nicht beobachtet wurde, z. B. nachts. Dies entspricht einer Inzidenz von 0,0038 Todesfällen pro Patientenjahr. Obwohl diese Rate höher ist als bei einer gesunden Bevölkerung gleichen Alters und Geschlechts zu erwarten, liegt sie innerhalb des Schätzbereichs für die Inzidenz plötzlicher ungeklärter Todesfälle bei Patienten mit Epilepsie, die kein NEURONTIN erhalten (von 0,0005 für die allgemeine Population von Epileptikern bis 0,003 für Epileptiker). einer klinischen Studienpopulation ähnlich der im NEURONTIN-Programm auf 0,005 für Patienten mit refraktärer Epilepsie). Ob diese Zahlen beruhigend sind oder Anlass zu weiterer Besorgnis geben, hängt folglich von der Vergleichbarkeit der gemeldeten Populationen mit der NEURONTIN-Kohorte und der Genauigkeit der bereitgestellten Schätzungen ab.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente ).
Verwaltungsinformationen
Informieren Sie die Patienten darüber, dass NEURONTIN oral mit oder ohne Nahrung eingenommen wird. Informieren Sie die Patienten darüber, dass sie, wenn sie die 600-mg- oder 800-mg-Tablette mit Bruchrille teilen, um eine halbe Tablette zu verabreichen, die unbenutzte halbe Tablette als nächste Dosis einnehmen sollten. Weisen Sie die Patienten an, halbe Tabletten, die nicht innerhalb von 28 Tagen nach dem Teilen der Bruchrille verwendet wurden, zu verwerfen.
Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS)/Multiorgan-Überempfindlichkeit
Weisen Sie die Patienten vor Beginn der Behandlung mit NEURONTIN darauf hin, dass ein Hautausschlag oder andere Anzeichen oder Symptome einer Überempfindlichkeit (wie Fieber oder Lymphadenopathie) ein schwerwiegendes medizinisches Ereignis ankündigen können und dass der Patient ein solches Vorkommnis unverzüglich einem Arzt melden sollte [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Anaphylaxie und Angioödem
Raten Sie den Patienten, NEURONTIN 300 mg abzusetzen und einen Arzt aufzusuchen, wenn sie Anzeichen oder Symptome einer Anaphylaxie oder eines Angioödems entwickeln [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schwindel und Somnolenz und Auswirkungen auf das Fahren und Bedienen schwerer Maschinen
Weisen Sie die Patienten darauf hin, dass NEURONTIN 100 mg Schwindel, Schläfrigkeit und andere Symptome und Anzeichen einer ZNS-Depression verursachen kann. Andere Medikamente mit sedierenden Eigenschaften können diese Symptome verstärken. Obwohl Patienten' Fähigkeit, den Grad ihrer Beeinträchtigung zu bestimmen, unzuverlässig sein kann, raten Sie ihnen, kein Auto zu fahren oder andere komplexe Maschinen zu bedienen, bis sie ausreichende Erfahrung mit NEURONTIN gesammelt haben, um beurteilen zu können, ob es ihre geistige und/oder motorische Leistungsfähigkeit beeinträchtigt oder nicht. Informieren Sie die Patienten darüber, dass nicht bekannt ist, wie lange diese Wirkung anhält [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Selbstmordgedanken und -verhalten
Informieren Sie den Patienten, seine Betreuer und seine Familien darüber, dass AEDs, einschließlich NEURONTIN, das Risiko von Suizidgedanken und -verhalten erhöhen können. Weisen Sie die Patienten darauf hin, dass sie auf das Auftreten oder die Verschlechterung von Depressionssymptomen, ungewöhnliche Stimmungs- oder Verhaltensänderungen oder das Auftreten von Suizidgedanken, -verhalten oder Gedanken über Selbstverletzung achten müssen. Weisen Sie die Patienten an, besorgniserregendes Verhalten unverzüglich dem Gesundheitsdienstleister zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Atemwegs beschwerden
Informieren Sie die Patienten über das Risiko einer Atemdepression. Schließen Sie Informationen ein, dass das Risiko für diejenigen am größten ist, die gleichzeitig ZNS-dämpfende Mittel (wie z. Bringen Sie den Patienten bei, wie sie eine Atemdepression erkennen können, und raten Sie ihnen, sofort einen Arzt aufzusuchen, wenn sie auftritt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Verwendung in der Schwangerschaft
Weisen Sie die Patientinnen an, ihren Arzt zu benachrichtigen, wenn sie schwanger werden oder beabsichtigen, während der Therapie schwanger zu werden, und ihren Arzt zu benachrichtigen, wenn sie stillen oder beabsichtigen, während der Therapie zu stillen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Ermutigen Sie Patientinnen, sich im Schwangerschaftsregister der NAAED anzumelden, wenn sie schwanger werden. Dieses Register sammelt Informationen über die Sicherheit von Antiepileptika während der Schwangerschaft. Um sich anzumelden, können Patienten die gebührenfreie Nummer 1-888-233-2334 anrufen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Die Kennzeichnung dieses Produkts wurde möglicherweise aktualisiert. Die neuesten Verschreibungsinformationen finden Sie unter www.pfizer.com.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Gabapentin wurde Mäusen und Ratten in 2-Jahres-Karzinogenitätsstudien oral verabreicht. Bei Mäusen, die mit Dosen von bis zu 2000 mg/kg/Tag behandelt wurden, wurden keine Hinweise auf eine arzneimittelbedingte Karzinogenität beobachtet. Bei 2000 mg/kg war die Plasma-Gabapentin-Exposition (AUC) bei Mäusen etwa doppelt so hoch wie beim Menschen bei einer MRHD von 3600 mg/Tag. Bei Ratten wurde bei männlichen Ratten, die die höchste Dosis (2000 mg/kg) erhielten, jedoch nicht bei Dosen von 250 oder 1000 mg/kg/Tag, eine erhöhte Inzidenz von Azinuszelladenomen und -karzinomen der Bauchspeicheldrüse festgestellt. Bei 1000 mg/kg war die Gabapentin-Plasmaexposition (AUC) bei Ratten ungefähr fünfmal so hoch wie beim Menschen bei der MRHD.
Studien zur Untersuchung des Mechanismus der Gabapentin-induzierten Pankreas-Karzinogenese bei Ratten weisen darauf hin, dass Gabapentin die DNA-Synthese in Pankreas-Azinuszellen von Ratten in vitro stimuliert und somit möglicherweise als Tumorpromotor wirkt, indem es die mitogene Aktivität verstärkt. Es ist nicht bekannt, ob Gabapentin die Fähigkeit hat, die Zellproliferation in anderen Zelltypen oder in anderen Spezies, einschließlich Menschen, zu erhöhen.
Mutagenese
Gabapentin zeigte weder in vitro (Ames-Test, HGPRT-Vorwärtsmutationsassay in Lungenzellen des chinesischen Hamsters) noch in vivo (Chromosomenaberrations- und Mikrokerntest im Knochenmark des chinesischen Hamsters, Mikronukleus der Maus, außerplanmäßige DNA-Synthese in Hepatozyten der Ratte) ein mutagenes oder genotoxisches Potenzial. Tests.
Beeinträchtigung der Fruchtbarkeit
Bei Ratten wurden bei Dosen bis zu 2000 mg/kg keine nachteiligen Wirkungen auf die Fertilität oder Reproduktion beobachtet. Bei 2000 mg/kg ist die Gabapentin-Plasmaexposition (AUC) bei Ratten etwa 8-mal höher als beim Menschen bei der MRHD.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschafts-Expositionsregister
Es gibt ein Schwangerschaftsexpositionsregister, das die Schwangerschaftsausgänge bei Frauen überwacht, die während der Schwangerschaft Antiepileptika (AEDs) wie NEURONTIN 300 mg ausgesetzt waren. Ermutigen Sie Frauen, die NEURONTIN während der Schwangerschaft einnehmen, sich im Schwangerschaftsregister für nordamerikanische Antiepileptika (NAAED) anzumelden, indem Sie die gebührenfreie Nummer 1-888-233-2334 anrufen oder http://www.aedpregnancyregistry.org/ besuchen.
Zusammenfassung der Risiken
Es liegen keine ausreichenden Daten zu den Entwicklungsrisiken im Zusammenhang mit der Anwendung von NEURONTIN bei Schwangeren vor. In präklinischen Studien an Mäusen, Ratten und Kaninchen war Gabapentin entwicklungstoxisch (erhöhte Anomalien des fötalen Skeletts und der Eingeweide und erhöhte embryofötale Sterblichkeit), wenn es trächtigen Tieren in ähnlichen oder niedrigeren Dosen als den klinisch verwendeten verabreicht wurde [siehe Daten ].
In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 bis 4 % bzw. 15 bis 20 %. Das Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt.
Daten
Tierdaten
Wenn trächtige Mäuse während der Organogenese orale Gabapentin-Dosen (500, 1000 oder 3000 mg/kg/Tag) erhielten, wurde bei den beiden höchsten Dosen eine embryofetale Toxizität (erhöhtes Auftreten von Skelettvariationen) beobachtet. Die No-Effect-Dosis für embryofetale Entwicklungstoxizität bei Mäusen (500 mg/kg/Tag) ist geringer als die maximal empfohlene Humandosis (MRHD) von 3600 mg auf Basis der Körperoberfläche (mg/m²).
In Studien, in denen Ratten während der Trächtigkeit orale Gabapentin-Dosen (500 bis 2000 mg/kg/Tag) erhielten, wurden bei allen Dosen negative Auswirkungen auf die Entwicklung der Nachkommen (erhöhtes Auftreten von Hydroureter und/oder Hydronephrose) beobachtet. Die niedrigste getestete Dosis entspricht der MRHD auf mg/m²-Basis.
Wenn trächtige Kaninchen während der Organogenese mit Gabapentin behandelt wurden, wurde bei allen getesteten Dosen (60, 300 oder 1500 mg/kg) ein Anstieg der embryofetalen Mortalität beobachtet. Die niedrigste getestete Dosis liegt unter der MRHD auf mg/m²-Basis.
In einer veröffentlichten Studie wurde Gabapentin (400 mg/kg/Tag) durch intraperitoneale Injektion an neugeborene Mäuse während der ersten postnatalen Woche verabreicht, einer Periode der Synaptogenese bei Nagetieren (entsprechend dem letzten Schwangerschaftstrimester beim Menschen). Gabapentin verursachte eine deutliche Abnahme der neuronalen Synapsenbildung im Gehirn von intakten Mäusen und eine abnormale neuronale Synapsenbildung in einem Mausmodell der Synapsenreparatur. Es wurde in vitro gezeigt, dass Gabapentin die Aktivität der α2δ-Untereinheit von spannungsaktivierten Calciumkanälen beeinflusst, einem Rezeptor, der an der neuronalen Synaptogenese beteiligt ist. Die klinische Bedeutung dieser Befunde ist nicht bekannt.
Stillzeit
Zusammenfassung der Risiken
Gabapentin wird nach oraler Verabreichung in die Muttermilch ausgeschieden. Die Auswirkungen auf den gestillten Säugling und die Milchproduktion sind nicht bekannt. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an NEURONTIN und möglichen Nebenwirkungen von NEURONTIN oder der zugrunde liegenden Erkrankung der Mutter auf den gestillten Säugling berücksichtigt werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von NEURONTIN 600 mg bei der Behandlung von postzosterischer Neuralgie bei pädiatrischen Patienten wurde nicht nachgewiesen.
Die Sicherheit und Wirksamkeit als Zusatztherapie bei der Behandlung partieller Anfälle bei pädiatrischen Patienten unter 3 Jahren wurde nicht nachgewiesen [siehe Klinische Studien ].
Geriatrische Verwendung
Die Gesamtzahl der mit NEURONTIN in kontrollierten klinischen Studien bei Patienten mit postzosterischer Neuralgie behandelten Patienten betrug 336, von denen 102 (30 %) 65 bis 74 Jahre alt waren und 168 (50 %) 75 Jahre und älter waren. Es gab einen größeren Behandlungseffekt bei Patienten im Alter von 75 Jahren und älter im Vergleich zu jüngeren Patienten, die die gleiche Dosis erhielten. Da Gabapentin fast ausschließlich über die Nieren ausgeschieden wird, kann der größere Behandlungseffekt, der bei Patienten ≥ 75 Jahren beobachtet wurde, eine Folge einer erhöhten Gabapentin-Exposition bei einer gegebenen Dosis sein, die aus einer altersbedingten Abnahme der Nierenfunktion resultiert. Andere Faktoren können jedoch nicht ausgeschlossen werden. Art und Häufigkeit der Nebenwirkungen waren in allen Altersgruppen ähnlich, mit Ausnahme von peripheren Ödemen und Ataxie, deren Häufigkeit mit zunehmendem Alter tendenziell zunahm.
Klinische Studien mit NEURONTIN bei Epilepsie schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagierten als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
Es ist bekannt, dass dieses Medikament im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko toxischer Reaktionen auf dieses Medikament kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da ältere Patienten eher eine eingeschränkte Nierenfunktion haben, sollte die Dosis sorgfältig ausgewählt und die Dosis bei diesen Patienten auf der Grundlage der Kreatinin-Clearance-Werte angepasst werden [siehe DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN , und KLINISCHE PHARMAKOLOGIE ].
Nierenfunktionsstörung
Bei erwachsenen Patienten mit eingeschränkter Nierenfunktion ist eine Dosisanpassung erforderlich [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ]. Pädiatrische Patienten mit Niereninsuffizienz wurden nicht untersucht.
Eine Dosisanpassung bei Patienten, die sich einer Hämodialyse unterziehen, ist erforderlich [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Anzeichen einer akuten Toxizität bei Tieren waren Ataxie, Atemnot, Ptosis, Sedierung, Hypoaktivität oder Erregung.
Akute orale Überdosierungen von NEURONTIN 300 mg wurden berichtet. Zu den Symptomen gehörten Doppeltsehen, Zittern, undeutliche Sprache, Schläfrigkeit, veränderter Geisteszustand, Schwindel, Lethargie und Durchfall. Bei einer Überdosierung von NEURONTIN 400 mg, allein oder in Kombination mit anderen ZNS-dämpfenden Mitteln, wurde über tödliche Atemdepression berichtet.
Gabapentin kann durch Hämodialyse entfernt werden.
Wenn es zu einer Überexposition kommt, rufen Sie Ihre Giftnotrufzentrale unter 1-800-222-1222 an.
KONTRAINDIKATIONEN
NEURONTIN ist kontraindiziert bei Patienten, die eine Überempfindlichkeit gegen das Medikament oder seine Inhaltsstoffe gezeigt haben.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Die genauen Mechanismen, durch die Gabapentin seine analgetischen und antiepileptischen Wirkungen entfaltet, sind unbekannt. Gabapentin ist strukturell mit dem Neurotransmitter Gamma-Aminobuttersäure (GABA) verwandt, hat aber keinen Einfluss auf die Bindung, Aufnahme oder den Abbau von GABA. In-vitro-Studien haben gezeigt, dass Gabapentin mit hoher Affinität an die α2δ-Untereinheit von spannungsaktivierten Calciumkanälen bindet; die Beziehung dieser Bindung zu den therapeutischen Wirkungen von Gabapentin ist jedoch unbekannt.
Pharmakokinetik
Alle pharmakologischen Wirkungen nach Verabreichung von Gabapentin sind auf die Aktivität der Muttersubstanz zurückzuführen; Gabapentin wird beim Menschen nicht nennenswert metabolisiert.
Orale Bioverfügbarkeit
Die Bioverfügbarkeit von Gabapentin ist nicht dosisproportional; dh wenn die Dosis erhöht wird, nimmt die Bioverfügbarkeit ab. Die Bioverfügbarkeit von Gabapentin beträgt ungefähr 60 %, 47 %, 34 %, 33 % und 27 % nach Gabe von 900, 1200, 2400, 3600 bzw. 4800 mg/Tag in 3 aufgeteilten Dosen. Nahrung hat nur einen geringen Einfluss auf die Geschwindigkeit und das Ausmaß der Resorption von Gabapentin (14 % Anstieg von AUC und Cmax).
Verteilung
Weniger als 3 % des Gabapentins zirkulieren an Plasmaprotein gebunden. Das scheinbare Verteilungsvolumen von Gabapentin nach intravenöser Gabe von 150 mg beträgt 58 ± 6 l (Mittelwert ± Standardabweichung). Bei Patienten mit Epilepsie betrugen die Steady-State-Prädosis-(Cmin)-Konzentrationen von Gabapentin in der Zerebrospinalflüssigkeit etwa 20 % der entsprechenden Plasmakonzentrationen.
Beseitigung
Gabapentin wird als unveränderter Wirkstoff über die Nieren ausgeschieden. Gabapentin wird beim Menschen nicht nennenswert metabolisiert.
Die Eliminationshalbwertszeit von Gabapentin beträgt 5 bis 7 Stunden und wird durch die Dosis oder nach Mehrfachgabe nicht verändert. Die Eliminationskonstante von Gabapentin, die Plasmaclearance und die renale Clearance sind direkt proportional zur Kreatininclearance. Bei älteren Patienten und bei Patienten mit eingeschränkter Nierenfunktion ist die Plasmaclearance von Gabapentin verringert. Gabapentin kann durch Hämodialyse aus dem Plasma entfernt werden.
Spezifische Populationen
Das Alter
Die Wirkung des Alters wurde bei Probanden im Alter von 20 bis 80 Jahren untersucht. Die scheinbare orale Clearance (CL/F) von Gabapentin nahm mit zunehmendem Alter von etwa 225 ml/min bei den unter 30-Jährigen auf etwa 125 ml/min bei den über 70-jährigen ab. Auch die renale Clearance (CLr) und die an die Körperoberfläche angepasste CLr nahmen mit zunehmendem Alter ab; Die Abnahme der renalen Clearance von Gabapentin mit zunehmendem Alter kann jedoch weitgehend durch die Abnahme der Nierenfunktion erklärt werden. [sehen DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ].
Geschlecht
Obwohl keine formale Studie zum Vergleich der Pharmakokinetik von Gabapentin bei Männern und Frauen durchgeführt wurde, scheint es, dass die pharmakokinetischen Parameter für Männer und Frauen ähnlich sind und es keine signifikanten geschlechtsspezifischen Unterschiede gibt.
Wettrennen
Unterschiede in der Pharmakokinetik aufgrund der Rasse wurden nicht untersucht. Da Gabapentin hauptsächlich renal ausgeschieden wird und es keine bedeutenden Rassenunterschiede in der Kreatinin-Clearance gibt, sind pharmakokinetische Unterschiede aufgrund der Rasse nicht zu erwarten.
Pädiatrie
Die Pharmakokinetik von Gabapentin wurde bei 48 pädiatrischen Probanden im Alter zwischen 1 Monat und 12 Jahren nach einer Dosis von etwa 10 mg/kg bestimmt. Die maximalen Plasmakonzentrationen waren in der gesamten Altersgruppe ähnlich und traten 2 bis 3 Stunden nach der Einnahme auf. Im Allgemeinen erreichten pädiatrische Probanden im Alter von 1 Monat bis
Bei 253 pädiatrischen Probanden im Alter zwischen 1 Monat und 13 Jahren wurde eine populationspharmakokinetische Analyse durchgeführt. Die Patienten erhielten dreimal täglich 10 bis 65 mg/kg/Tag. Die scheinbare orale Clearance (CL/F) war direkt proportional zur Kreatinin-Clearance und diese Beziehung war nach einer Einzeldosis und im Steady-State ähnlich. Bei Kindern unter 5 Jahren wurden höhere orale Clearance-Werte beobachtet als bei Kindern ab 5 Jahren, normalisiert auf das Körpergewicht. Die Clearance war bei Säuglingen
Diese pharmakokinetischen Daten weisen darauf hin, dass die wirksame Tagesdosis bei pädiatrischen Patienten mit Epilepsie im Alter von 3 und 4 Jahren 40 mg/kg/Tag betragen sollte, um durchschnittliche Plasmakonzentrationen zu erreichen, die denen ähnlich sind, die bei Patienten ab 5 Jahren erreicht werden, die 30 mg/l Gabapentin erhalten. kg/Tag [vgl DOSIERUNG UND ANWENDUNG ].
Erwachsene Patienten mit eingeschränkter Nierenfunktion
Probanden (N=60) mit eingeschränkter Nierenfunktion (mittlere Kreatinin-Clearance im Bereich von 13–114 ml/min) erhielten orale Gabapentin-Einzeldosen von 400 mg. Die mittlere Gabapentin-Halbwertszeit reichte von etwa 6,5 Stunden (Patienten mit einer Kreatinin-Clearance > 60 ml/min) bis 52 Stunden (Kreatinin-Clearance 60 ml/min). Gruppe) auf etwa 10 ml/min ( DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ]. Pädiatrische Patienten mit Niereninsuffizienz wurden nicht untersucht.
Hämodialyse
In einer Studie mit erwachsenen Probanden mit Anurie (N = 11) betrug die scheinbare Eliminationshalbwertszeit von Gabapentin an dialysefreien Tagen etwa 132 Stunden; während der Dialyse war die scheinbare Halbwertszeit von Gabapentin auf 3,8 Stunden reduziert. Die Hämodialyse hat somit eine signifikante Wirkung auf die Elimination von Gabapentin bei anurischen Personen [siehe DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ].
Lebererkrankung
Da Gabapentin nicht metabolisiert wird, wurde keine Studie bei Patienten mit eingeschränkter Leberfunktion durchgeführt.
Wechselwirkungen mit anderen Medikamenten
In-vitro-Studien
In-vitro-Studien wurden durchgeführt, um das Potenzial von Gabapentin zur Hemmung der wichtigsten Cytochrom-P450-Enzyme (CYP1A2, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1 und CYP3A4) zu untersuchen, die den Arzneimittel- und Fremdstoffstoffwechsel vermitteln, wobei isoformselektive Markersubstrate und mikrosomale Präparate der menschlichen Leber verwendet wurden . Nur bei der höchsten getesteten Konzentration (171 mcg/ml; 1 mM) wurde eine leichte Hemmung (14 % bis 30 %) der Isoform CYP2A6 beobachtet. Bei Gabapentin-Konzentrationen von bis zu 171 µg/ml (ungefähr das 15-fache der Cmax bei 3600 mg/Tag) der beobachteten Isoform CYP2A6 wurde keine Hemmung einer der anderen getesteten Isoformen beobachtet. Bei Gabapentin-Konzentrationen bis zu 171 µg/ml (ungefähr das 15-fache der Cmax bei 3600 mg/Tag) wurde keine Hemmung einer der anderen getesteten Isoformen beobachtet.
In-vivo-Studien
Die in diesem Abschnitt beschriebenen Daten zu Arzneimittelwechselwirkungen stammen aus Studien mit gesunden Erwachsenen und erwachsenen Patienten mit Epilepsie.
Phenytoin
In einer Studie mit Einzel- (400 mg) und Mehrfachdosis (400 mg dreimal täglich) von NEURONTIN 400 mg bei epileptischen Patienten (N = 8), die mindestens 2 Monate lang eine Phenytoin-Monotherapie erhielten, hatte Gabapentin keine Auswirkung auf den Talspiegel im Steady-State Plasmakonzentrationen von Phenytoin und Phenytoin hatten keinen Einfluss auf die Pharmakokinetik von Gabapentin.
Carbamazepin
Steady-State-Talspiegel von Carbamazepin und Carbamazepin 10, 11-Epoxid wurden durch die gleichzeitige Verabreichung von Gabapentin (400 mg dreimal täglich; N = 12) nicht beeinflusst. Ebenso blieb die Pharmakokinetik von Gabapentin durch die Verabreichung von Carbamazepin unverändert.
Valproinsäure
Die mittleren Valproinsäure-Talkonzentrationen im Steady State im Serum vor und während der gleichzeitigen Verabreichung von Gabapentin (400 mg dreimal täglich; N = 17) waren nicht unterschiedlich und auch die pharmakokinetischen Parameter von Gabapentin wurden durch Valproinsäure nicht beeinflusst.
Phenobarbital
Die Schätzungen der pharmakokinetischen Steady-State-Parameter für Phenobarbital oder Gabapentin (300 mg dreimal täglich; N = 12) sind identisch, unabhängig davon, ob die Arzneimittel allein oder zusammen verabreicht werden.
Naproxen
Die gleichzeitige Verabreichung (N = 18) von Naproxen-Natrium-Kapseln (250 mg) mit NEURONTIN (125 mg) scheint die Menge an resorbiertem Gabapentin um 12 % bis 15 % zu erhöhen. Gabapentin hatte keine Wirkung auf die pharmakokinetischen Parameter von Naproxen. Diese Dosen sind niedriger als die therapeutischen Dosen für beide Medikamente. Das Ausmaß der Wechselwirkung innerhalb der empfohlenen Dosisbereiche beider Arzneimittel ist nicht bekannt.
Hydrocodon
Die gleichzeitige Verabreichung von NEURONTIN (125 bis 500 mg; N = 48) verringert die Cmax- und AUC-Werte von Hydrocodon (10 mg; N = 50) dosisabhängig im Vergleich zur alleinigen Verabreichung von Hydrocodon; Cmax- und AUC-Werte sind nach Gabe von 125 mg NEURONTIN um 3 % bis 4 % bzw. nach Gabe von 500 mg NEURONTIN um 21 % bis 22 % niedriger. Der Mechanismus für diese Wechselwirkung ist unbekannt. Hydrocodon erhöht die AUC-Werte von Gabapentin um 14 %. Das Ausmaß der Wechselwirkung bei anderen Dosierungen ist nicht bekannt.
Morphium
In einem Literaturartikel wurde berichtet, dass bei Verabreichung einer 60-mg-Morphinkapsel mit kontrollierter Freisetzung 2 Stunden vor einer 600-mg-Neurontin-Kapsel (n = 12) die mittlere Gabapentin-AUC um 44 % im Vergleich zu ohne Morphin verabreichtem Gabapentin anstieg. Die pharmakokinetischen Parameterwerte von Morphin wurden durch die Verabreichung von NEURONTIN 2 Stunden nach Morphin nicht beeinflusst. Das Ausmaß der Wechselwirkung bei anderen Dosierungen ist nicht bekannt.
Cimetidin
In Gegenwart von 300 mg Cimetidin viermal täglich (N = 12) fiel die mittlere scheinbare orale Clearance von Gabapentin um 14 % und die Kreatinin-Clearance um 10 %. Somit schien Cimetidin die renale Ausscheidung sowohl von Gabapentin als auch von Kreatinin, einem endogenen Marker der Nierenfunktion, zu verändern. Es wird nicht erwartet, dass diese geringfügige Verringerung der Ausscheidung von Gabapentin durch Cimetidin von klinischer Bedeutung ist. Die Wirkung von Gabapentin auf Cimetidin wurde nicht bewertet.
Orales Kontrazeptivum
Basierend auf AUC und Halbwertszeit waren die pharmakokinetischen Profile von Norethindron und Ethinylestradiol nach Verabreichung von Tabletten mit 2,5 mg Norethindronacetat und 50 µg Ethinylestradiol mit und ohne gleichzeitige Gabe von Gabapentin (400 mg dreimal täglich; N = 13). Die Cmax von Norethindron war um 13 % höher, wenn es zusammen mit Gabapentin verabreicht wurde; Es wird nicht erwartet, dass diese Wechselwirkung von klinischer Bedeutung ist.
Antazida (Maalox®) (Aluminiumhydroxid, Magnesiumhydroxid)
Antazidum (Maalox®), das Magnesium- und Aluminiumhydroxide enthält, verringerte die mittlere Bioverfügbarkeit von Gabapentin (N = 16) um etwa 20 %. Diese Abnahme der Bioverfügbarkeit betrug etwa 10 %, wenn Gabapentin 2 Stunden nach Maalox verabreicht wurde.
Probenecid
Probenecid ist ein Blocker der renalen tubulären Sekretion. Die pharmakokinetischen Parameter von Gabapentin ohne und mit Probenecid waren vergleichbar. Dies deutet darauf hin, dass Gabapentin nicht über den durch Probenecid blockierten Weg in die Nierentubuli sezerniert wird.
Klinische Studien
Postherpetische Neuralgie
NEURONTIN wurde in zwei randomisierten, doppelblinden, placebokontrollierten, multizentrischen Studien für die Behandlung von postzosterischer Neuralgie (PHN) untersucht. Die Intent-to-treat (ITT)-Population bestand aus insgesamt 563 Patienten mit Schmerzen für mehr als 3 Monate nach Abheilen des Herpes-Zoster-Hautausschlags (Tabelle 6).
TABELLE 6. Kontrollierte PHN-Studien: Dauer, Dosierungen und Anzahl der Patienten
Jede Studie umfasste eine 7- oder 8-wöchige Doppelblindphase (3 oder 4 Wochen Titration und 4 Wochen Fixdosis). Die Patienten begannen die Behandlung mit einer Titration auf maximal 900 mg/Tag Gabapentin über 3 Tage. Die Dosierungen sollten dann in Schritten von 600 bis 1200 mg/Tag in 3- bis 7-Tages-Intervallen auf die Zieldosis über 3 bis 4 Wochen titriert werden. Die Patienten notierten ihre Schmerzen in einem täglichen Tagebuch unter Verwendung einer 11-Punkte-Schmerzbewertungsskala, die von 0 (kein Schmerz) bis 10 (stärkster möglicher Schmerz) reichte. Für die Randomisierung war ein mittlerer Schmerzwert von mindestens 4 zu Studienbeginn erforderlich. Die Analysen wurden unter Verwendung der ITT-Population durchgeführt (alle randomisierten Patienten, die mindestens eine Dosis der Studienmedikation erhalten haben).
Beide Studien zeigten bei allen getesteten Dosierungen eine Wirksamkeit im Vergleich zu Placebo.
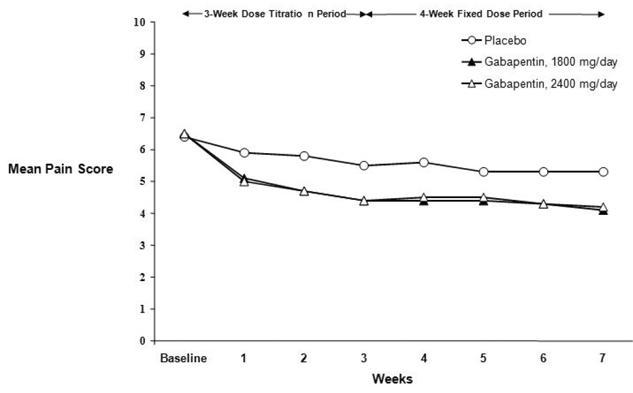
Die Verringerung der wöchentlichen mittleren Schmerzwerte wurde in beiden Studien in Woche 1 beobachtet und hielt bis zum Ende der Behandlung an. Vergleichbare Behandlungseffekte wurden in allen aktiven Behandlungsarmen beobachtet. Die pharmakokinetische/pharmakodynamische Modellierung lieferte einen bestätigenden Nachweis der Wirksamkeit über alle Dosierungen hinweg. Die Abbildungen 1 und 2 zeigen die Schmerzintensitätswerte im Laufe der Zeit für die Studien 1 und 2.
Abbildung 1. Wöchentliche mittlere Schmerzwerte (beobachtete Fälle in der ITT-Population): Studie 1
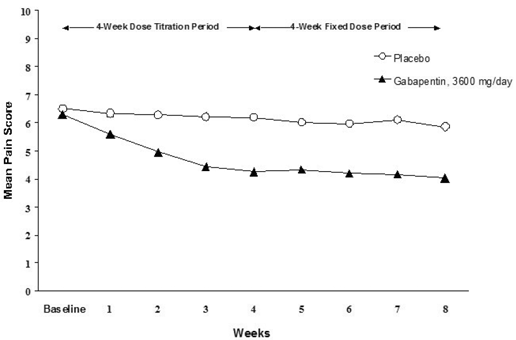
Abbildung 2. Wöchentliche mittlere Schmerzwerte (beobachtete Fälle in der ITT-Population): Studie 2
Der Anteil der Responder (die Patienten, die eine mindestens 50-prozentige Verbesserung des Endpunkt-Schmerzwertes im Vergleich zum Ausgangswert meldeten) wurde für jede Studie berechnet (Abbildung 3).
Abbildung 3. Anteil der Responder (Patienten mit ≥50 % weniger Schmerzscore) am Endpunkt: Kontrollierte PHN-Studien
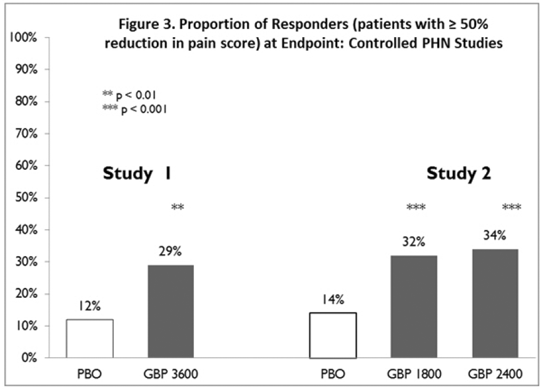
Epilepsie bei fokalen Anfällen (Zusatztherapie)
Die Wirksamkeit von NEURONTIN 400 mg als Zusatztherapie (zusätzlich zu anderen Antiepileptika) wurde in multizentrischen, placebokontrollierten, doppelblinden klinischen Parallelgruppenstudien bei erwachsenen und pädiatrischen Patienten (3 Jahre und älter) mit refraktären partiellen Anfällen nachgewiesen.
Wirksamkeitsnachweise wurden in drei Studien mit 705 Patienten (im Alter von 12 Jahren und älter) und in einer Studie mit 247 pädiatrischen Patienten (im Alter von 3 bis 12 Jahren) erbracht. Die eingeschlossenen Patienten hatten eine Vorgeschichte von mindestens 4 partiellen Anfällen pro Monat, obwohl sie ein oder mehrere Antiepileptika in therapeutischer Dosierung erhalten hatten, und wurden während einer 12-wöchigen Baseline-Periode (6 Wochen in der Studie zu pädiatrischen Patienten). Bei Patienten, die weiterhin mindestens 2 (oder in einigen Studien 4) Anfälle pro Monat hatten, wurde NEURONTIN 300 mg oder Placebo dann während einer 12-wöchigen Behandlungszeit zu der bestehenden Therapie hinzugefügt. Die Wirksamkeit wurde hauptsächlich auf der Grundlage des Prozentsatzes der Patienten mit einer mindestens 50 %igen Verringerung der Anfallshäufigkeit vom Ausgangswert bis zur Behandlung (die „Ansprechrate“) und einer abgeleiteten Messgröße, die als Ansprechverhältnis bezeichnet wird, einem Maß für die Veränderung, definiert als (T – B)/(T + B), wobei B die Grundlinien-Anfallshäufigkeit des Patienten und T die Anfallshäufigkeit des Patienten während der Behandlung ist. Das Antwortverhältnis ist im Bereich von -1 bis +1 verteilt. Ein Nullwert zeigt keine Änderung an, während eine vollständige Eliminierung von Anfällen einen Wert von –1 ergeben würde; erhöhte Anfallsraten würden positive Werte ergeben. Ein Ansprechverhältnis von -0,33 entspricht einer 50 %igen Verringerung der Anfallshäufigkeit. Die unten angegebenen Ergebnisse gelten für alle partiellen Anfälle in der Intent-to-Treat-Population (alle Patienten, die eine beliebige Behandlungsdosis erhalten haben) in jeder Studie, sofern nicht anders angegeben.
In einer Studie wurde NEURONTIN 1200 mg/Tag in drei aufgeteilten Dosen mit Placebo verglichen. Die Ansprechrate betrug 23 % (14/61) in der NEURONTIN-600-mg-Gruppe und 9 % (6/66) in der Placebo-Gruppe; der Unterschied zwischen den Gruppen war statistisch signifikant. Auch das Ansprechverhältnis war in der NEURONTIN-Gruppe (-0,199) besser als in der Placebo-Gruppe (-0,044), ein Unterschied, der ebenfalls statistisch signifikant war.
In einer zweiten Studie wurde hauptsächlich NEURONTIN 1200 mg/Tag in drei aufgeteilten Dosen (N = 101) mit Placebo (N = 98) verglichen. Zusätzliche kleinere NEURONTIN 300 mg-Dosierungsgruppen (600 mg/Tag, N = 53; 1800 mg/Tag, N = 54) wurden ebenfalls auf Informationen zur Dosiswirkung hin untersucht. Die Ansprechrate war in der Gruppe mit NEURONTIN 1200 mg/Tag höher (16 %) als in der Placebogruppe (8 %), aber der Unterschied war statistisch nicht signifikant. Die Ansprechrate bei 600 mg (17 %) war ebenfalls nicht signifikant höher als bei Placebo, aber die Ansprechrate in der 1800-mg-Gruppe (26 %) war der Placeborate statistisch signifikant überlegen. Das Ansprechverhältnis war in der Gruppe mit NEURONTIN 1200 mg/Tag besser (-0,103) als in der Placebo-Gruppe (-0,022); aber auch dieser Unterschied war statistisch nicht signifikant (p = 0,224). In der Gruppe mit 600 mg/Tag NEURONTIN (-0,105) und der Gruppe mit 1800 mg/Tag (-0,222) wurde ein besseres Ansprechen beobachtet als in der Gruppe mit 1200 mg/Tag, wobei die Gruppe mit 1800 mg/Tag eine statistische Signifikanz im Vergleich zu Placebo erreichte Gruppe.
Eine dritte Studie verglich NEURONTIN 900 mg/Tag in drei aufgeteilten Dosen (N = 111) und Placebo (N = 109). Eine zusätzliche NEURONTIN 1200 mg/Tag Dosierungsgruppe (N=52) lieferte Dosis-Wirkungs-Daten. Ein statistisch signifikanter Unterschied in der Ansprechrate wurde in der Gruppe mit NEURONTIN 900 mg/Tag (22 %) im Vergleich zu der Placebogruppe (10 %) beobachtet. Das Ansprechverhältnis war in der NEURONTIN 900 mg/Tag-Gruppe (-0,119) im Vergleich zu dem in der Placebogruppe (-0,027) ebenfalls statistisch signifikant überlegen, ebenso wie das Ansprechverhältnis in 1200 mg/Tag NEURONTIN (-0,184) im Vergleich zu Placebo.
In jeder Studie wurden auch Analysen durchgeführt, um die Wirkung von NEURONTIN 300 mg auf die Prävention sekundär generalisierter tonisch-klonischer Anfälle zu untersuchen. In diese Analysen wurden Patienten eingeschlossen, bei denen entweder zu Beginn oder während der Behandlungsphase in allen drei placebokontrollierten Studien ein sekundär generalisierter tonisch-klonischer Anfall auftrat. Es gab mehrere Vergleiche des Ansprechverhältnisses, die einen statistisch signifikanten Vorteil für NEURONTIN im Vergleich zu Placebo und günstige Trends für fast alle Vergleiche zeigten.
Die Analyse der Ansprechrate unter Verwendung kombinierter Daten aus allen drei Studien und allen Dosierungen (N = 162, NEURONTIN; N = 89, Placebo) zeigte ebenfalls einen signifikanten Vorteil für NEURONTIN gegenüber Placebo bei der Verringerung der Häufigkeit von sekundär generalisierten tonisch-klonischen Anfällen.
In zwei der drei kontrollierten Studien wurde mehr als eine Dosis NEURONTIN verwendet. Innerhalb jeder Studie zeigten die Ergebnisse keine durchgängig erhöhte Reaktion auf die Dosis. Betrachtet man jedoch die Studien, so ist ein Trend zu einer zunehmenden Wirksamkeit mit zunehmender Dosis erkennbar (siehe Abbildung 4).
Abbildung 4. Ansprechrate bei Patienten, die NEURONTIN 600 mg erhielten, ausgedrückt als Unterschied zu Placebo, nach Dosis und Studie: Begleittherapiestudien bei Patienten im Alter von ≥ 12 Jahren mit partiellen Anfällen
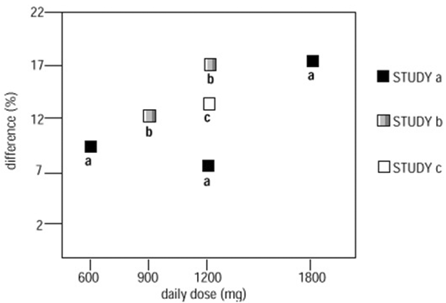
In der Figur ist die Größe des Behandlungseffekts, gemessen auf der Y-Achse als Unterschied im Anteil von Gabapentin- und Placebo-behandelten Patienten, die eine 50%ige oder größere Reduktion der Anfallshäufigkeit gegenüber dem Ausgangswert erreichten, gegen die täglich verabreichte Gabapentin-Dosis aufgetragen (X-Achse).
Obwohl keine formale Analyse nach Geschlecht durchgeführt wurde, deuten Schätzungen des Ansprechens (Ansprechverhältnis) aus klinischen Studien (398 Männer, 307 Frauen) darauf hin, dass keine wesentlichen geschlechtsspezifischen Unterschiede bestehen. Es gab kein konsistentes Muster, das darauf hinweist, dass das Alter einen Einfluss auf die Reaktion auf NEURONTIN hat. Es gab nicht genügend Patienten anderer Rassen als Kaukasier, um einen Vergleich der Wirksamkeit zwischen Rassengruppen zu ermöglichen.
Eine vierte Studie mit pädiatrischen Patienten im Alter von 3 bis 12 Jahren verglich 25 – 35 mg/kg/Tag NEURONTIN (N = 118) mit Placebo (N = 127). Bei allen partiellen Anfällen in der Intent-to-treat-Population war das Ansprechverhältnis statistisch signifikant besser für die NEURONTIN-Gruppe (-0,146) als für die Placebo-Gruppe (-0,079). Bei derselben Population unterschied sich die Ansprechrate für NEURONTIN (21 %) nicht signifikant von Placebo (18 %).
Eine Studie mit pädiatrischen Patienten im Alter von 1 Monat bis 3 Jahren verglich 40 mg/kg/Tag NEURONTIN (N = 38) mit Placebo (N = 38) bei Patienten, die mindestens ein vermarktetes Antiepileptikum erhielten und währenddessen mindestens einen partiellen Anfall hatten Screening-Zeitraum (innerhalb von 2 Wochen vor Studienbeginn). Die Patienten hatten bis zu 48 Stunden Ausgangszeit und bis zu 72 Stunden doppelblinde Video-EEG-Überwachung, um das Auftreten von Anfällen aufzuzeichnen und zu zählen. Es gab keine statistisch signifikanten Unterschiede zwischen den Behandlungen, weder beim Ansprechverhältnis noch bei der Ansprechrate.
INFORMATIONEN ZUM PATIENTEN
NEURONTIN (Neuron-Zinn) (Gabapentin) Kapseln, Tabletten und Lösung zum Einnehmen
Was sind die wichtigsten Informationen, die ich über NEURONTIN wissen sollte?
Brechen Sie die Einnahme von NEURONTIN 300 mg nicht ab, ohne vorher mit Ihrem Arzt gesprochen zu haben.
Das plötzliche Absetzen von NEURONTIN kann schwerwiegende Probleme verursachen.
NEURONTIN 400 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
1. Selbstmordgedanken. Wie andere Antiepileptika kann NEURONTIN 100 mg bei einer sehr kleinen Anzahl von Menschen, etwa 1 von 500, Selbstmordgedanken oder -handlungen hervorrufen.
Rufen Sie sofort einen Arzt an, wenn Sie eines dieser Symptome haben, insbesondere wenn sie neu oder schlimmer sind oder Sie beunruhigen:
Wie kann ich auf frühe Symptome von Selbstmordgedanken und -handlungen achten?
Rufen Sie bei Bedarf Ihren Arzt zwischen den Besuchen an, insbesondere wenn Sie sich Sorgen wegen der Symptome machen.
Brechen Sie die Einnahme von NEURONTIN nicht ab, ohne vorher mit einem Arzt gesprochen zu haben.
2. Verhaltens- und Denkänderungen - Die Anwendung von NEURONTIN 100 mg bei Kindern im Alter von 3 bis 12 Jahren kann zu emotionalen Veränderungen, aggressivem Verhalten, Konzentrationsstörungen, Unruhe, Leistungsstörungen in der Schule und Hyperaktivität führen.
3. NEURONTIN kann schwere oder lebensbedrohliche allergische Reaktionen hervorrufen die Ihre Haut oder andere Teile Ihres Körpers wie Ihre Leber oder Ihre Blutzellen beeinträchtigen können. Dies kann dazu führen, dass Sie ins Krankenhaus eingeliefert werden oder NEURONTIN absetzen. Möglicherweise haben Sie einen Ausschlag mit einer allergischen Reaktion, die durch NEURONTIN verursacht wird. Rufen Sie sofort einen Arzt an, wenn Sie eines der folgenden Symptome haben:
Diese Symptome können die ersten Anzeichen einer schwerwiegenden Reaktion sein. Ein Arzt sollte Sie untersuchen, um zu entscheiden, ob Sie NEURONTIN weiterhin einnehmen sollten.
4. Ernste Atemprobleme. Schwerwiegende Atemprobleme können auftreten, wenn NEURONTIN zusammen mit anderen Arzneimitteln eingenommen wird, die starke Schläfrigkeit oder vermindertes Bewusstsein verursachen können, oder wenn es von jemandem eingenommen wird, der bereits Atemprobleme hat. Achten Sie auf erhöhte Schläfrigkeit oder verminderte Atmung, wenn Sie mit NEURONTIN 300 mg beginnen oder die Dosis erhöhen. Holen Sie sich sofort Hilfe, wenn Atemprobleme auftreten.
Was ist NEURONTIN 400 mg?
NEURONTIN 400 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von:
Wer sollte NEURONTIN nicht einnehmen?
Nehmen Sie NEURONTIN nicht ein, wenn Sie allergisch gegen Gabapentin oder einen der sonstigen Bestandteile von NEURONTIN sind. Eine vollständige Liste der Inhaltsstoffe von NEURONTIN finden Sie am Ende dieses Arzneimittelleitfadens.
Was sollte ich meinem Arzt vor der Einnahme von NEURONTIN 300 mg mitteilen?
Informieren Sie vor der Einnahme von NEURONTIN 400 mg Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen. Informieren Sie Ihren Arzt insbesondere, wenn Sie Opioid-Schmerzmittel (z. B. Oxycodon), Arzneimittel gegen Angstzustände (z. B. Lorazepam) oder Schlaflosigkeit (z. B. Zolpidem) oder Arzneimittel, die Sie schläfrig machen, einnehmen.
Sie haben möglicherweise ein erhöhtes Risiko für Schwindel, Schläfrigkeit oder Atemprobleme, wenn diese Arzneimittel zusammen mit NEURONTIN eingenommen werden.
Die Einnahme von NEURONTIN 100 mg zusammen mit bestimmten anderen Arzneimitteln kann Nebenwirkungen verursachen oder deren Wirkung beeinträchtigen. Beginnen oder beenden Sie andere Arzneimittel nicht, ohne vorher mit Ihrem Arzt gesprochen zu haben.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste darüber und zeigen Sie diese Ihrem Arzt und Apotheker, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich NEURONTIN 400 mg einnehmen?
Was sollte ich während der Einnahme von NEURONTIN vermeiden?
Welche Nebenwirkungen kann NEURONTIN 300mg haben?
NEURONTIN 100 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Sehen „Was sind die wichtigsten Informationen, die ich über NEURONTIN wissen sollte?“
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von NEURONTIN. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist NEURONTIN aufzubewahren?
Bewahren Sie NEURONTIN 600 mg und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von NEURONTIN
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie NEURONTIN 300 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie NEURONTIN nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Dieser Medikationsratgeber fasst die wichtigsten Informationen zu NEURONTIN zusammen. Wenn Sie weitere Informationen wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Arzt oder Apotheker um Informationen zu NEURONTIN 100 mg bitten, die für medizinisches Fachpersonal geschrieben wurden.
Weitere Informationen erhalten Sie unter http://www.pfizer.com oder telefonisch unter 1-800-438-1985.
Welche Inhaltsstoffe enthält NEURONTIN 400mg?
Wirkstoff: Gabapentin
Hilfsstoffe in den Kapseln: Lactose, Maisstärke, Talkum, Gelatine, Titandioxid und FD&C Blue No. 2.
Die 300-mg-Kapselhülle enthält außerdem: gelbes Eisenoxid.
Die 400-mg-Kapselhülle enthält außerdem: rotes Eisenoxid und gelbes Eisenoxid.
Hilfsstoffe in den Tabletten: Poloxamer 407, Copovidon, Maisstärke, Magnesiumstearat, Hydroxypropylcellulose, Talk und Candelillawachs
Inaktive Inhaltsstoffe in der Lösung zum Einnehmen: Glycerin, Xylit, gereinigtes Wasser und künstliches Aroma.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.