Imitrex 100mg, 25mg, 50mg Sumatriptan Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Imitrex 25 mg und wie wird es angewendet?
Imitrex 100 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Migräne und Cluster-Kopfschmerz. Imitrex kann allein oder mit anderen Medikamenten verwendet werden.
Imitrex 50 mg ist ein Antimigränemittel, Seratonin 5-HT-Rezeptoragonist.
Es ist nicht bekannt, ob Imitrex 50 mg bei Kindern unter 18 Jahren sicher und wirksam ist, und die Anwendung bei geriatrischen Patienten wird nicht empfohlen.
Welche Nebenwirkungen kann Imitrex 50 mg haben?
Imitrex 25 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Imitrex gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Imitrex. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
IMITREX 50 mg zur Injektion enthält Sumatriptansuccinat, einen selektiven 5-HT1B/1D-Rezeptoragonisten. Sumatriptansuccinat wird chemisch als 3-[2-(Dimethylamino)ethyl]-N-methyl-indol-5-methansulfonamidsuccinat (1:1) bezeichnet und hat die folgende Struktur:
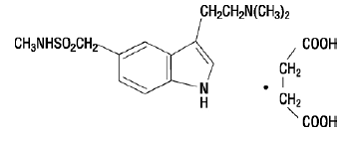
Die empirische Formel lautet C14H21N3O2S·C4H6O4 und repräsentiert ein Molekulargewicht von 413,5. Sumatriptansuccinat ist ein weißes bis cremefarbenes Pulver, das in Wasser und Kochsalzlösung leicht löslich ist.
IMITREX-Injektion ist eine klare, farblose bis blassgelbe, sterile, pyrogenfreie Lösung zur subkutanen Injektion. Jede 0,5 ml Injektionslösung von IMITREX 8 mg/ml enthält 4 mg Sumatriptan (Base) als Succinatsalz und 3,8 mg Natriumchlorid, USP in Wasser für Injektionszwecke, USP. Jede 0,5 ml Injektionslösung von IMITREX 12 mg/ml enthält 6 mg Sumatriptan (Base) als Succinatsalz und 3,5 mg Natriumchlorid, USP in Wasser für Injektionszwecke, USP. Der pH-Bereich beider Lösungen beträgt etwa 4,2 bis 5,3. Die Osmolalität beider Injektionen beträgt 291 mOsmol.
INDIKATIONEN
IMITREX® Injektion ist bei Erwachsenen indiziert zur (1) akuten Behandlung von Migräne, mit oder ohne Aura, und (2) zur akuten Behandlung von Cluster-Kopfschmerz.
Nutzungsbeschränkungen
DOSIERUNG UND ANWENDUNG
Dosierungsinformationen
Die empfohlene maximale Einzeldosis von IMITREX 25 mg zur Injektion für Erwachsene zur akuten Behandlung von Migräne oder Cluster-Kopfschmerz beträgt 6 mg subkutan injiziert. Zur Behandlung von Migräne können niedrigere Dosen (1 mg bis 5 mg) verwendet werden, wenn die Nebenwirkungen dosislimitierend sind [siehe Klinische Studien ]. Für die Behandlung von Cluster-Kopfschmerz wurde die Wirksamkeit niedrigerer Dosen nicht nachgewiesen.
Die maximale kumulative Dosis, die innerhalb von 24 Stunden verabreicht werden kann, beträgt 12 mg, zwei 6-mg-Injektionen im Abstand von mindestens 1 Stunde. Eine zweite 6-mg-Dosis sollte nur in Betracht gezogen werden, wenn eine gewisse Reaktion auf eine erste Injektion beobachtet wurde.
Verabreichung mit dem IMITREX STATdose Pen®
Ein Autoinjektor (IMITREX 25 mg STATdose Pen) ist zur Verwendung mit 4-mg- und 6-mg-Fertigspritzenkartuschen erhältlich. Bei diesem Gerät dringt die Nadel etwa 1/4 Zoll (5 bis 6 mm) ein. Die Injektion soll subkutan verabreicht werden, und eine intramuskuläre oder intravaskuläre Verabreichung muss vermieden werden. Weisen Sie die Patienten in die richtige Anwendung des IMITREX 100 mg STATdose Pens ein und weisen Sie sie an, Injektionsstellen mit einer ausreichenden Haut- und Subkutandicke zu verwenden, um die Länge der Nadel aufzunehmen.
Verabreichung anderer IMITREX-Dosen als 4 oder 6 mg
Verwenden Sie bei Patienten, die andere Dosen als 4 mg oder 6 mg erhalten, die 6-mg-Einzeldosis-Durchstechflasche; Verwenden Sie nicht den IMITREX 50 mg STATdose Pen. Untersuchen Sie die Durchstechflasche vor der Verabreichung visuell auf Partikel und Verfärbungen. Nicht verwenden, wenn Partikel und Verfärbungen festgestellt werden.
WIE GELIEFERT
Darreichungsformen und Stärken
Lagerung und Handhabung
IMITREX 100 mg Injektion enthält Sumatriptan (Base) als Succinatsalz und wird als klare, farblose bis blassgelbe, sterile, pyrogenfreie Lösung wie folgt geliefert:
Fertigspritze und/oder Autoinjektor-Pen
Jede Packung enthält eine Patienteninformation und eine Gebrauchsanweisung für Patienten.
IMITREX 100 mg STATdose System®, 4 mg , enthält 1 IMITREX 25 mg STATdose Pen, 2 vorgefüllte Einzeldosis-Spritzenkartuschen und 1 Tragetasche ( NDC 0173-0739-00).
IMITREX 100 mg STATdose-System, 6 mg enthält 1 IMITREX STATdose Pen, 2 vorgefüllte Einzeldosis-Spritzenkartuschen und 1 Tragetasche ( NDC 0173-0479-00).
Zwei 4-mg-Einzeldosis-Fertigspritzen Patronen zur Verwendung mit dem IMITREX STATdose System ( NDC 0173-0739-02).
Zwei 6-mg-Einzeldosis-Fertigspritzen Patronen zur Verwendung mit dem IMITREX 25 mg STATdose System ( NDC 0173-0478-00).
Einzeldosis-Durchstechflasche
IMITREX 25 mg Injektions-Einzeldosis-Durchstechflasche (6 mg/0,5 ml) in Faltschachteln mit 5 Durchstechflaschen ( NDC 01730449-02).
Zwischen 2° und 30°C (36° und 86°F) lagern. Vor Licht schützen.
GlaxoSmithKline, Research Triangle Park, NC 27709
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden unten und an anderer Stelle in der Kennzeichnung beschrieben:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Migräne
Tabelle 1 listet Nebenwirkungen auf, die in 2 placebokontrollierten klinischen Studien in den USA bei Migränepatienten (Studien 2 und 3) entweder nach einer Einzeldosis von 6 mg IMITREX 100 mg zur Injektion oder nach Placebo auftraten. In Tabelle 1 sind nur Reaktionen aufgeführt, die in den mit IMITREX Injection 6 mg behandelten Gruppen mit einer Häufigkeit von 2 % oder mehr und mit einer höheren Häufigkeit als in der Placebogruppe auftraten.
Die Inzidenz von Nebenwirkungen in kontrollierten klinischen Studien wurde nicht durch Geschlecht oder Alter der Patienten beeinflusst. Es lagen keine ausreichenden Daten vor, um den Einfluss der ethnischen Zugehörigkeit auf die Häufigkeit von Nebenwirkungen zu beurteilen.
Cluster-Kopfschmerz
In den kontrollierten klinischen Studien zur Bewertung der Wirksamkeit von IMITREX 50 mg zur Injektion bei der Behandlung von Cluster-Kopfschmerz (Studien 4 und 5) wurden keine neuen signifikanten Nebenwirkungen festgestellt, die nicht bereits in Studien mit IMITREX 100 mg bei Patienten mit Migräne festgestellt worden waren.
Insgesamt war die Häufigkeit von Nebenwirkungen, die in den Studien zu Cluster-Kopfschmerz berichtet wurden, im Allgemeinen geringer als in den Migräne-Studien. Ausnahmen sind Berichte über Parästhesien (5 % IMITREX, 0 % Placebo), Übelkeit und Erbrechen (4 % IMITREX, 0 % Placebo) und Bronchospasmus (1 % IMITREX 50 mg, 0 % Placebo).
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von IMITREX 50 mg Tabletten, IMITREX Nasenspray und IMITREX 50 mg Injektionslösung nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Herz-Kreislauf
Hypotonie, Herzklopfen.
Neurologisch
Dystonie, Zittern.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Mutterkornhaltige Drogen
Es wurde berichtet, dass Mutterkorn enthaltende Arzneimittel verlängerte vasospastische Reaktionen hervorrufen. Da diese Wirkungen additiv sein können, ist die Anwendung von ergotaminhaltigen oder ergotartigen Medikamenten (wie Dihydroergotamin oder Methysergid) und IMITREX 25 mg zur Injektion innerhalb von 24 Stunden kontraindiziert.
Monoaminoxidase-A-Inhibitoren
MAO-A-Hemmer erhöhen die systemische Exposition um das Zweifache. Daher ist die Anwendung von IMITREX zur Injektion bei Patienten, die MAO-A-Hemmer erhalten, kontraindiziert [siehe KLINISCHE PHARMAKOLOGIE ].
Andere 5-HT1-Agonisten
Da sich ihre vasospastischen Wirkungen addieren können, ist die gleichzeitige Verabreichung von IMITREX Injection und anderen 5-HT1-Agonisten (z. B. Triptanen) innerhalb von 24 Stunden kontraindiziert.
Selektive Serotonin-Wiederaufnahmehemmer/Serotonin-Noradrenalin-Wiederaufnahmehemmer und Serotonin-Syndrom
Fälle von Serotonin-Syndrom wurden während der gleichzeitigen Anwendung von Triptanen und SSRIs, SNRIs, TCAs und MAO-Hemmern berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Myokardischämie, Myokardinfarkt und Prinzmetal-Angina
Die Anwendung von IMITREX Injection ist bei Patienten mit ischämischer oder vasospastischer KHK kontraindiziert. Es gab seltene Berichte über schwerwiegende kardiale Nebenwirkungen, einschließlich akutem Myokardinfarkt, die innerhalb weniger Stunden nach der Verabreichung von IMITREX zur Injektion auftraten. Einige dieser Reaktionen traten bei Patienten ohne bekannte KHK auf. IMITREX 100 mg zur Injektion kann einen Vasospasmus der Koronararterien (Prinzmetal-Angina) verursachen, selbst bei Patienten ohne KHK in der Vorgeschichte.
Führen Sie bei Triptan-naiven Patienten mit mehreren kardiovaskulären Risikofaktoren (z. B. erhöhtes Alter, Diabetes, Bluthochdruck, Rauchen, Fettleibigkeit, starke KHK in der Familienanamnese) eine kardiovaskuläre Untersuchung durch, bevor Sie IMITREX-Injektion erhalten. Bei Anzeichen von KHK oder Vasospasmus der Koronararterien ist IMITREX 100 mg zur Injektion kontraindiziert. Erwägen Sie bei Patienten mit mehreren kardiovaskulären Risikofaktoren, die eine negative kardiovaskuläre Bewertung haben, die Verabreichung der ersten Dosis von IMITREX Injection in einer medizinisch überwachten Umgebung und die Durchführung eines Elektrokardiogramms (EKG) unmittelbar nach der Verabreichung von IMITREX Injection. Erwägen Sie für solche Patienten eine regelmäßige kardiovaskuläre Untersuchung bei intermittierenden Langzeitanwendern von IMITREX 100 mg zur Injektion.
Arrhythmien
Innerhalb weniger Stunden nach Verabreichung von 5-HT1-Agonisten wurde über lebensbedrohliche Herzrhythmusstörungen einschließlich ventrikulärer Tachykardie und Kammerflimmern mit Todesfolge berichtet. Setzen Sie IMITREX Injection ab, wenn diese Störungen auftreten. IMITREX-Injektion ist kontraindiziert bei Patienten mit Wolff-Parkinson-White-Syndrom oder Arrhythmien, die mit anderen Störungen der kardialen akzessorischen Leitungsbahn einhergehen.
Brust-, Hals-, Nacken- und/oder Kieferschmerzen/Enge/Druck
Spannungs-, Schmerz-, Druck- und Schweregefühle in Präkordium, Rachen, Nacken und Kiefer treten häufig nach der Behandlung mit IMITREX Injection auf und sind in der Regel nicht kardialen Ursprungs. Führen Sie jedoch eine kardiale Untersuchung durch, wenn diese Patienten ein hohes kardiales Risiko haben. Die Anwendung von IMITREX Injection ist bei Patienten mit KHK und bei Patienten mit Prinzmetal-Angina-Variante kontraindiziert.
Zerebrovaskuläre Ereignisse
Bei Patienten, die mit 5-HT1-Agonisten behandelt wurden, sind Hirnblutungen, Subarachnoidalblutungen und Schlaganfälle aufgetreten, und einige führten zu Todesfällen. In einer Reihe von Fällen scheint es möglich, dass die zerebrovaskulären Ereignisse primär waren, da der 5-HT1-Agonist in der falschen Annahme verabreicht wurde, dass die aufgetretenen Symptome eine Folge von Migräne seien, obwohl dies nicht der Fall war. Außerdem können Patienten mit Migräne einem erhöhten Risiko für bestimmte zerebrovaskuläre Ereignisse (z. B. Schlaganfall, Blutung, TIA) ausgesetzt sein. Unterbrechen Sie die IMITREX-Injektion, wenn ein zerebrovaskuläres Ereignis auftritt.
Vor der Behandlung von Kopfschmerzen bei Patienten, bei denen zuvor keine Migräne oder Cluster-Kopfschmerz diagnostiziert wurde, oder bei Patienten mit atypischen Symptomen, schließen Sie andere potenziell schwerwiegende neurologische Erkrankungen aus. IMITREX-Injektion ist bei Patienten mit Schlaganfall oder TIA in der Vorgeschichte kontraindiziert.
Andere Vasospasmus-Reaktionen
IMITREX 25 mg zur Injektion kann nicht-koronare vasospastische Reaktionen hervorrufen, wie z. B. periphere vaskuläre Ischämie, gastrointestinale vaskuläre Ischämie und Infarkt (mit Bauchschmerzen und blutigem Durchfall), Milzinfarkt und Raynaud-Syndrom. Bei Patienten, bei denen nach der Anwendung eines 5-HT1-Agonisten Symptome oder Anzeichen auftreten, die auf eine nicht koronare vasospastische Reaktion hindeuten, schließen Sie eine vasospastische Reaktion aus, bevor Sie zusätzliche IMITREX-Injektionen erhalten.
Bei der Anwendung von 5-HT1-Agonisten wurde über vorübergehende und dauerhafte Erblindung und erheblichen Verlust des Sehvermögens berichtet. Da Sehstörungen Teil einer Migräneattacke sein können, wurde ein kausaler Zusammenhang zwischen diesen Ereignissen und der Anwendung von 5-HT1-Agonisten nicht eindeutig nachgewiesen.
Kopfschmerzen bei Medikamentenübergebrauch
Der übermäßige Gebrauch von Medikamenten gegen akute Migräne (z. B. Ergotamin, Triptane, Opioide oder eine Kombination dieser Medikamente an 10 oder mehr Tagen pro Monat) kann zu einer Verschlimmerung der Kopfschmerzen führen (Kopfschmerz bei Medikamentenübergebrauch). Kopfschmerzen bei Medikamentenübergebrauch können sich als migräneähnliche tägliche Kopfschmerzen oder als deutliche Zunahme der Häufigkeit von Migräneanfällen äußern. Eine Entgiftung der Patienten, einschließlich des Absetzens der übergebrauchten Medikamente, und die Behandlung von Entzugssymptomen (die häufig eine vorübergehende Verschlechterung der Kopfschmerzen beinhalten) können erforderlich sein.
Serotonin-Syndrom
Unter IMITREX-Injektion kann ein Serotonin-Syndrom auftreten, insbesondere bei gleichzeitiger Anwendung mit selektiven Serotonin-Wiederaufnahmehemmern (SSRIs), Serotonin-Noradrenalin-Wiederaufnahmehemmern (SNRIs), trizyklischen Antidepressiva (TCAs) und MAO-Hemmern [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Zu den Symptomen des Serotonin-Syndroms können Veränderungen des mentalen Status (z. B. Unruhe, Halluzinationen, Koma), autonome Instabilität (z. B. Tachykardie, labiler Blutdruck, Hyperthermie), neuromuskuläre Aberrationen (z. B. Hyperreflexie, Koordinationsstörungen) und/oder gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Durchfall). Die Symptome treten normalerweise innerhalb von Minuten bis Stunden nach Erhalt einer neuen oder höheren Dosis eines serotonergen Medikaments auf. IMITREX-Injektion absetzen, wenn Verdacht auf ein Serotonin-Syndrom besteht.
Erhöhung des Blutdrucks
In seltenen Fällen wurde bei mit 5-HT1-Agonisten behandelten Patienten, einschließlich Patienten ohne Hypertonie in der Anamnese, über einen signifikanten Anstieg des Blutdrucks, einschließlich einer hypertensiven Krise mit akuter Beeinträchtigung der Organsysteme, berichtet. Überwachen Sie den Blutdruck bei Patienten, die mit IMITREX behandelt werden. IMITREX-Injektion ist bei Patienten mit unkontrolliertem Bluthochdruck kontraindiziert.
Anaphylaktische/anaphylaktoide Reaktionen
Bei Patienten, die IMITREX erhielten, sind anaphylaktische/anaphylaktoide Reaktionen aufgetreten. Solche Reaktionen können lebensbedrohlich oder tödlich sein. Im Allgemeinen treten anaphylaktische Reaktionen auf Arzneimittel eher bei Personen auf, die in der Vergangenheit auf mehrere Allergene empfindlich reagiert haben. IMITREX 50 mg zur Injektion ist kontraindiziert bei Patienten mit einer Vorgeschichte von Überempfindlichkeitsreaktionen auf IMITREX.
Krampfanfälle
Nach der Verabreichung von IMITREX wurden Krampfanfälle berichtet. Einige traten bei Patienten mit Krampfanfällen in der Vorgeschichte oder gleichzeitigen Erkrankungen auf, die für Krampfanfälle prädisponieren. Es gibt auch Berichte von Patienten, bei denen keine solchen prädisponierenden Faktoren offensichtlich sind. IMITREX zur Injektion sollte bei Patienten mit Epilepsie in der Anamnese oder Erkrankungen, die mit einer erniedrigten Anfallsschwelle einhergehen, mit Vorsicht angewendet werden.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( PATIENTENINFORMATION und Gebrauchsanweisung ).
Risiko von Myokardischämie und/oder -infarkt, Prinzmetal-Angina, anderen mit Vasospasmus in Verbindung stehenden Ereignissen, Arrhythmien und zerebrovaskulären Ereignissen
Informieren Sie die Patienten darüber, dass IMITREX 50 mg zur Injektion schwerwiegende kardiovaskuläre Nebenwirkungen wie Myokardinfarkt oder Schlaganfall verursachen kann. Obwohl schwerwiegende kardiovaskuläre Ereignisse ohne Warnsymptome auftreten können, sollten Patienten auf die Anzeichen und Symptome von Brustschmerzen, Kurzatmigkeit, unregelmäßigem Herzschlag, deutlichem Blutdruckanstieg, Schwäche und undeutlicher Sprache achten und sich gegebenenfalls ärztlich beraten lassen irgendwelche Anzeichen oder Symptome beobachtet werden. Weisen Sie die Patienten auf die Bedeutung dieser Nachsorge hin [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Anaphylaktische/anaphylaktoide Reaktionen
Informieren Sie die Patienten darüber, dass bei Patienten, die IMITREX 100 mg zur Injektion erhielten, anaphylaktische/anaphylaktoide Reaktionen aufgetreten sind. Solche Reaktionen können lebensbedrohlich oder tödlich sein. Im Allgemeinen treten anaphylaktische Reaktionen auf Arzneimittel eher bei Personen auf, die in der Vorgeschichte gegenüber mehreren Allergenen empfindlich waren [siehe KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Gleichzeitige Anwendung mit anderen Triptanen oder Ergot-Medikamenten
Informieren Sie die Patienten darüber, dass die Anwendung von IMITREX 50 mg zur Injektion innerhalb von 24 Stunden nach einem anderen Triptan oder einem Medikament vom Mutterkorntyp (einschließlich Dihydroergotamin oder Methysergid) kontraindiziert ist [siehe KONTRAINDIKATIONEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Serotonin-Syndrom
Warnen Sie die Patienten vor dem Risiko eines Serotonin-Syndroms bei der Anwendung von IMITREX zur Injektion oder anderen Triptanen, insbesondere während der kombinierten Anwendung mit SSRIs, SNRIs, TCAs und MAO-Hemmern [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Kopfschmerzen bei Medikamentenübergebrauch
Informieren Sie die Patienten darüber, dass die Anwendung von Medikamenten gegen akute Migräne an 10 oder mehr Tagen pro Monat zu einer Verschlimmerung der Kopfschmerzen führen kann, und ermutigen Sie die Patienten, die Kopfschmerzhäufigkeit und den Medikamentenkonsum zu dokumentieren (z. B. durch Führen eines Kopfschmerztagebuchs) [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schwangerschaft
Informieren Sie die Patienten darüber, dass IMITREX 25 mg zur Injektion während der Schwangerschaft nicht angewendet werden sollte, es sei denn, der potenzielle Nutzen rechtfertigt das potenzielle Risiko für den Fötus [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Stillende Mutter
Raten Sie den Patientinnen, ihren Arzt zu informieren, wenn sie stillen oder stillen möchten [siehe Verwendung in bestimmten Populationen ].
Fähigkeit, komplexe Aufgaben auszuführen
Die Behandlung mit IMITREX 25 mg zur Injektion kann Schläfrigkeit und Schwindel verursachen; Weisen Sie die Patienten an, ihre Fähigkeit zur Durchführung komplexer Aufgaben nach der Verabreichung von IMITREX 25 mg zur Injektion zu beurteilen.
So verwenden Sie IMITREX 100 mg Injektion
Geben Sie den Patienten Anweisungen zur richtigen Anwendung von IMITREX 100 mg zur Injektion, wenn sie in der Lage sind, sich IMITREX 50 mg zur Injektion in medizinisch unbeaufsichtigten Situationen selbst zu verabreichen.
Informieren Sie die Patienten darüber, dass die Nadel im IMITREX STATdose Pen ungefähr 5 bis 6 mm (1/4 Zoll) einsticht. Informieren Sie die Patienten darüber, dass die Injektion subkutan verabreicht werden soll und eine intramuskuläre oder intravaskuläre Verabreichung vermieden werden sollte. Weisen Sie die Patienten an, Injektionsstellen mit ausreichender Haut- und Unterhautdicke zu verwenden, um die Länge der Nadel aufzunehmen.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
In Kanzerogenitätsstudien an Mäusen und Ratten, in denen Sumatriptan oral über 78 Wochen bzw. 104 Wochen in Dosen von bis zu 160 mg/kg/Tag verabreicht wurde (die höchste Dosis bei Ratten wurde von 360 mg/kg/Tag in Woche 21 reduziert). ). Die höchste Dosis bei Mäusen und Ratten betrug etwa das 130- bis 260-fache der subkutan verabreichten Einzel-MRHD von 6 mg auf mg/m²-Basis. Bei beiden Spezies gab es keine Hinweise auf eine Zunahme von Tumoren im Zusammenhang mit der Verabreichung von Sumatriptan.
Mutagenese
Sumatriptan war in In-vitro- (bakterielle Rückmutation [Ames], Genzellmutation im chinesischen Hamster V79/HGPRT, Chromosomenaberration in menschlichen Lymphozyten) und In-vivo-Tests (Ratten-Mikronukleus) negativ.
Beeinträchtigung der Fruchtbarkeit
Wenn Sumatriptan männlichen und weiblichen Ratten vor und während der Paarungszeit subkutan injiziert wurde, gab es keinen Hinweis auf eine Beeinträchtigung der Fertilität bei Dosen bis zu 60 mg/kg/Tag oder etwa dem 100-fachen der humanen Einzeldosis von 6 mg bei a mg/m²-Basis. Wenn Sumatriptan (5, 50, 500 mg/kg/Tag) männlichen und weiblichen Ratten vor und während der Paarungszeit oral verabreicht wurde, kam es bei den mit Dosen behandelten Tieren zu einer behandlungsbedingten Abnahme der Fertilität infolge einer Abnahme der Paarungszeit mehr als 5 mg/kg/Tag. Es ist nicht klar, ob dieser Befund auf eine Wirkung auf Männer oder Frauen oder auf beide zurückzuführen war.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie C
Es gibt keine angemessenen und gut kontrollierten Studien mit IMITREX 50 mg zur Injektion bei schwangeren Frauen. In Entwicklungstoxizitätsstudien an Ratten und Kaninchen wurde die orale Verabreichung von Sumatriptan an trächtige Tiere mit Embryoletalität, fötalen Anomalien und Jungtiersterblichkeit in Verbindung gebracht. Bei intravenöser Verabreichung an trächtige Kaninchen war Sumatriptan embryoletal. IMITREX 100 mg Injektionslösung sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Die orale Verabreichung von Sumatriptan an trächtige Ratten während der Organogenese führte zu einer erhöhten Inzidenz von Anomalien der fötalen Blutgefäße (zervikothorakal und umbilikal). Die höchste Nicht-Effekt-Dosis für embryofetale Entwicklungstoxizität in Raten betrug 60 mg/kg/Tag oder etwa das 100-fache der beim Menschen empfohlenen maximalen Einzeldosis (MRHD) von 6 mg, die subkutan auf mg/m²-Basis verabreicht wurde. Die orale Verabreichung von Sumatriptan an trächtige Kaninchen während der Organogenese führte zu einer erhöhten Inzidenz von Embryoletalität und fötalen zervikothorakalen Gefäß- und Skelettanomalien. Die intravenöse Verabreichung von Sumatriptan an trächtige Kaninchen während der Organogenese führte zu einer erhöhten Inzidenz von Embryoletalität. Die höchsten oralen und intravenösen Dosen ohne Wirkung für Entwicklungstoxizität bei Kaninchen betrugen 15 und 0,75 mg/kg/Tag oder etwa das 50- bzw. 2-fache der subkutan verabreichten Einzel-MRHD von 6 mg auf mg/m²-Basis.
Die orale Verabreichung von Sumatriptan an Ratten vor und während der Trächtigkeit führte zu embryofetaler Toxizität (verringertes Körpergewicht, verringerte Ossifikation, erhöhte Inzidenz von Skelettanomalien). Die höchste Dosis ohne Wirkung betrug 50 mg/kg/Tag oder etwa das 80-fache der subkutan verabreichten Einzel-MRHD von 6 mg auf mg/m²-Basis. Bei den Nachkommen trächtiger Ratten, die während der Organogenese oral mit Sumatriptan behandelt wurden, kam es zu einer Abnahme der Überlebensrate der Jungtiere. Die höchste Dosis ohne Wirkung für diese Wirkung betrug 60 mg/kg/Tag oder etwa das 100-fache der subkutan verabreichten einzelnen MRHD von 6 mg auf mg/m²-Basis. Die orale Behandlung trächtiger Ratten mit Sumatriptan während der letzten Phase der Trächtigkeit und während der gesamten Laktation führte zu einer verringerten Überlebensrate der Jungtiere. Die höchste Dosis ohne Wirkung für diesen Befund betrug 100 mg/kg/Tag oder etwa das 160-fache der subkutan verabreichten einzelnen MRHD von 6 mg auf mg/m²-Basis.
Stillende Mutter
Sumatriptan wird nach subkutaner Verabreichung in die Muttermilch ausgeschieden. Die Exposition von Säuglingen gegenüber Sumatriptan kann minimiert werden, indem das Stillen für 12 Stunden nach der Behandlung mit IMITREX 50 mg zur Injektion vermieden wird.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen. IMITREX 100 mg Injektion wird nicht für die Anwendung bei Patienten unter 18 Jahren empfohlen.
In zwei kontrollierten klinischen Studien wurde IMITREX Nasenspray (5 bis 20 mg) bei 1.248 pädiatrischen Migränepatienten im Alter von 12 bis 17 Jahren untersucht, die eine einzelne Attacke behandelten. Die Studien ergaben keine Wirksamkeit von IMITREX Nasenspray im Vergleich zu Placebo bei der Behandlung von Migräne bei pädiatrischen Patienten. Die in diesen klinischen Studien beobachteten Nebenwirkungen ähnelten denen, die in klinischen Studien bei Erwachsenen berichtet wurden.
In fünf kontrollierte klinische Studien (2 Einzelattacken-Studien, 3 Mehrfachattacken-Studien) zur Bewertung von oralem IMITREX (25 bis 100 mg) bei pädiatrischen Patienten im Alter von 12 bis 17 Jahren wurden insgesamt 701 pädiatrische Migränepatienten aufgenommen. Diese Studien belegten nicht die Wirksamkeit von oralem IMITREX 25 mg im Vergleich zu Placebo bei der Behandlung von Migräne bei pädiatrischen Patienten. Die in diesen klinischen Studien beobachteten Nebenwirkungen ähnelten denen, die in klinischen Studien bei Erwachsenen berichtet wurden. Die Häufigkeit aller Nebenwirkungen bei diesen Patienten schien sowohl dosis- als auch altersabhängig zu sein, wobei jüngere Patienten häufiger über Nebenwirkungen berichteten als ältere pädiatrische Patienten.
Erfahrungen nach der Markteinführung dokumentieren, dass bei Kindern und Jugendlichen nach subkutaner, oraler und/oder intranasaler Anwendung von IMITREX schwerwiegende Nebenwirkungen aufgetreten sind. Diese Berichte umfassen Reaktionen ähnlich denen, die selten bei Erwachsenen berichtet wurden, einschließlich Schlaganfall, Sehverlust und Tod. Bei einem 14-jährigen Mann wurde nach oraler Anwendung von IMITREX über einen Myokardinfarkt berichtet; klinische Anzeichen traten innerhalb von 1 Tag nach der Verabreichung des Arzneimittels auf. Klinische Daten zur Bestimmung der Häufigkeit schwerwiegender Nebenwirkungen bei pädiatrischen Patienten, die möglicherweise subkutanes, orales oder intranasales IMITREX erhalten, sind derzeit nicht verfügbar.
Geriatrische Verwendung
Klinische Studien mit IMITREX 100 mg zur Injektion schlossen keine ausreichende Anzahl von Patienten im Alter von 65 Jahren und älter ein, um festzustellen, ob sie anders ansprechen als jüngere Patienten. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
Bei geriatrischen Patienten mit anderen kardiovaskulären Risikofaktoren (z. B. Diabetes, Bluthochdruck, Rauchen, Fettleibigkeit, starke KHK in der Familienanamnese) wird vor der IMITREX-Injektion eine kardiovaskuläre Untersuchung empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
ÜBERDOSIS
Koronare Vasospasmen wurden nach intravenöser Verabreichung von IMITREX 50 mg zur Injektion beobachtet [siehe KONTRAINDIKATIONEN ]. Aus Tierversuchsdaten (Hunde bei 0,1 g/kg, Ratten bei 2 g/kg) ist zu erwarten, dass Überdosierungen möglicherweise Krämpfe, Tremor, Inaktivität, Erythem der Extremitäten, verringerte Atemfrequenz, Zyanose, Ataxie, Mydriasis, Reaktionen an der Injektionsstelle verursachen ( Abschuppung, Haarausfall und Schorfbildung) und Lähmungen.
Die Eliminationshalbwertszeit von Sumatriptan beträgt etwa 2 Stunden [vgl KLINISCHE PHARMAKOLOGIE ]; Daher sollte die Überwachung von Patienten nach einer Überdosierung mit IMITREX zur Injektion für mindestens 10 Stunden fortgesetzt werden oder solange die Symptome oder Anzeichen anhalten.
Es ist nicht bekannt, welche Wirkung eine Hämodialyse oder Peritonealdialyse auf die Serumkonzentrationen von Sumatriptan hat.
KONTRAINDIKATIONEN
IMITREX-Injektion ist kontraindiziert bei Patienten mit:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Sumatriptan bindet mit hoher Affinität an humane geklonte 5-HT1B/1D-Rezeptoren. Sumatriptan übt seine therapeutischen Wirkungen bei der Behandlung von Migräne und Cluster-Kopfschmerzen vermutlich durch agonistische Wirkungen an den 5-HT1B/1D-Rezeptoren auf intrakraniale Blutgefäße und sensorische Nerven des Trigeminussystems aus, die zu einer Verengung der Schädelgefäße und einer Hemmung proinflammatorischer Neuropeptide führen Veröffentlichung.
Pharmakodynamik
Blutdruck
Bei Patienten mit und ohne Hypertonie in der Vorgeschichte wurde über eine signifikante Erhöhung des Blutdrucks, einschließlich einer hypertensiven Krise, berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Periphere (kleine) Arterien
Bei gesunden Probanden (N = 18) konnte in einer Studie zur Bewertung der Wirkungen von Sumatriptan auf die periphere (kleine Gefäße) arterielle Reaktivität kein klinisch signifikanter Anstieg des peripheren Widerstands festgestellt werden.
Pulsschlag
Vorübergehende Blutdruckanstiege, die bei einigen Patienten in klinischen Studien beobachtet wurden, die während der Entwicklung von Sumatriptan zur Behandlung von Migräne durchgeführt wurden, gingen nicht mit klinisch signifikanten Veränderungen der Herzfrequenz einher.
Pharmakokinetik
Resorption und Bioverfügbarkeit
Die Bioverfügbarkeit von Sumatriptan nach subkutaner Injektion an 18 gesunden männlichen Probanden betrug 97 % ± 16 % der Bioverfügbarkeit nach intravenöser Injektion.
Nach einer subkutanen manuellen Einzelinjektion von 6 mg in den Deltamuskelbereich bei 18 gesunden Männern (Alter: 24 ± 6 Jahre, Gewicht: 70 kg) betrug die maximale Serumkonzentration (Cmax) von Sumatriptan (Mittelwert ± Standardabweichung) 74 ± 15 ng/ml und die Zeit bis zur Spitzenkonzentration (Tmax) betrug 12 Minuten nach der Injektion (Bereich: 5 bis 20 Minuten). In dieser Studie ergab dieselbe subkutan in den Oberschenkel injizierte Dosis eine Cmax von 61 ± 15 ng/ml bei manueller Injektion gegenüber 52 ± 15 ng/ml bei Autoinjektortechniken. Die Tmax oder die absorbierte Menge wurde weder durch die Injektionsstelle noch durch die Injektionstechnik signifikant verändert.
Verteilung
Die Proteinbindung, bestimmt durch Gleichgewichtsdialyse über den Konzentrationsbereich von 10 bis 1.000 ng/ml, ist gering, etwa 14 % bis 21 %. Die Wirkung von Sumatriptan auf die Proteinbindung anderer Arzneimittel wurde nicht untersucht.
Nach einer subkutanen Injektion von 6 mg in den Deltoideusbereich des Arms bei 9 Männern (Durchschnittsalter: 33 Jahre, Durchschnittsgewicht: 77 kg) betrug das Verteilungsvolumen von Sumatriptan im zentralen Kompartiment 50 ± 8 Liter und die Verteilungshalbwertszeit war 15 ± 2 Minuten.
Stoffwechsel
In-vitro-Studien mit menschlichen Mikrosomen deuten darauf hin, dass Sumatriptan durch MAO, hauptsächlich das A-Isoenzym, metabolisiert wird. Der größte Teil einer radioaktiv markierten Sumatriptan-Dosis, die im Urin ausgeschieden wird, ist der Hauptmetabolit Indolessigsäure (IAA) oder das IAA-Glucuronid, die beide inaktiv sind.
Beseitigung
Nach einer subkutanen Einzeldosis von 6 mg wurden 22 % ± 4 % als unverändertes Sumatriptan und 38 % ± 7 % als IAA-Metabolit im Urin ausgeschieden.
Nach subkutaner Injektion von 6 mg in den Deltamuskel des Arms betrug die systemische Clearance von Sumatriptan 1.194 ± 149 ml/min und die terminale Halbwertszeit 115 ± 19 Minuten.
Spezifische Populationen
Das Alter
Die Pharmakokinetik von Sumatriptan bei älteren (Durchschnittsalter: 72 Jahre, 2 Männer und 4 Frauen) und bei Probanden mit Migräne (Durchschnittsalter: 38 Jahre, 25 Männer und 155 Frauen) war ähnlich wie bei gesunden männlichen Probanden (Durchschnittsalter: 30 Jahre).
Leberfunktionsstörung
Die Wirkung einer leichten bis mittelschweren Lebererkrankung auf die Pharmakokinetik von subkutan verabreichtem Sumatriptan wurde untersucht. Es gab keine signifikanten Unterschiede in der Pharmakokinetik von subkutan verabreichtem Sumatriptan bei mäßig eingeschränkter Leberfunktion im Vergleich zu gesunden Kontrollpersonen. Die Pharmakokinetik von subkutan verabreichtem Sumatriptan bei Patienten mit schwerer Leberfunktionsstörung wurde nicht untersucht. Die Anwendung von IMITREX zur Injektion in dieser Population ist kontraindiziert [siehe KONTRAINDIKATIONEN ].
Wettrennen
Die systemische Clearance und Cmax von subkutan verabreichtem Sumatriptan waren bei schwarzen (n = 34) und kaukasischen (n = 38) gesunden männlichen Probanden ähnlich.
Arzneimittelwechselwirkungsstudien
Monoaminoxidase-A-Inhibitoren
In einer Studie mit 14 gesunden Frauen verringerte die Vorbehandlung mit einem MAO-A-Hemmer die Clearance von subkutanem Sumatriptan, was zu einer 2-fachen Zunahme der Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC) von Sumatriptan führte, was einer Zunahme von 40 % entspricht in der Eliminationshalbwertszeit.
Tiertoxikologie und/oder Pharmakologie
Hornhauttrübungen
Hunde, die Sumatriptan oral erhielten, entwickelten Hornhauttrübungen und Defekte im Hornhautepithel. Hornhauttrübungen wurden bei der niedrigsten getesteten Dosis, 2 mg/kg/Tag, beobachtet und waren nach 1-monatiger Behandlung vorhanden. In einer 60-wöchigen Studie wurden Defekte im Hornhautepithel festgestellt. Frühere Untersuchungen auf diese Toxizitäten wurden nicht durchgeführt und No-Effect-Dosen wurden nicht ermittelt; Die relative Plasmaexposition bei der niedrigsten getesteten Dosis war jedoch etwa dreimal so hoch wie die Humanexposition nach einer subkutanen Dosis von 6 mg.
Klinische Studien
Migräne
In kontrollierten klinischen Studien, an denen mehr als 1.000 Patienten teilnahmen, die während Migräneattacken mäßige oder starke Schmerzen und 1 oder mehr der in Tabelle 3 aufgeführten Symptome hatten, setzte die Linderung bereits 10 Minuten nach einer 6-mg-IMITREX-50-mg-Injektion ein. Niedrigere Dosen von IMITREX 100 mg zur Injektion können sich ebenfalls als wirksam erweisen, obwohl der Anteil der Patienten, die eine angemessene Linderung erreichten, verringert war und die Latenzzeit bis zu dieser Linderung bei niedrigeren Dosen größer ist.
In Studie 1 wurden 6 verschiedene Dosen von IMITREX 100 mg zur Injektion (n = 30 in jeder Gruppe) mit Placebo (n = 62) in einem Design mit einer einzigen Attacke und parallelen Gruppen verglichen. Die Dosis-Wirkungs-Beziehung war wie gezeigt in Tabelle 2.
In 2 randomisierten, placebokontrollierten klinischen Studien mit IMITREX 25 mg Injektion 6 mg bei 1.104 Patienten mit mäßigen oder schweren Migräneschmerzen (Studien 2 und 3) trat die Linderung nach weniger als 10 Minuten ein. Bei 70 % der Patienten wurde innerhalb von 1 Stunde nach einer subkutanen Einzeldosis von 6 mg IMITREX Injection eine Linderung des Kopfschmerzes, definiert durch eine Verringerung der Schmerzen von schweren oder mittelschweren zu leichten oder keinen Kopfschmerzen, erreicht. Etwa 82 % bzw. 65 % der mit IMITREX 6 mg behandelten Patienten hatten eine Linderung der Kopfschmerzen bzw. waren innerhalb von 2 Stunden schmerzfrei.
Tabelle 3 zeigt die 1- und 2-Stunden-Wirksamkeitsergebnisse für IMITREX Injection 6 mg in den Studien 2 und 3.
IMITREX 100 mg Injektion linderte auch Photophobie, Phonophobie (Geräuschempfindlichkeit), Übelkeit und Erbrechen im Zusammenhang mit Migräneanfällen. Eine ähnliche Wirksamkeit wurde beobachtet, als Patienten sich IMITREX 50 mg zur Injektion mit dem IMITREX 100 mg STATdose Pen selbst verabreichten.
Die Wirksamkeit von IMITREX-Injektion wurde nicht davon beeinflusst, ob die Migräne mit der Aura, der Attackendauer, dem Geschlecht oder Alter des Patienten oder der gleichzeitigen Anwendung gängiger prophylaktischer Medikamente gegen Migräne (z. B. Betablocker) assoziiert war oder nicht.
Cluster-Kopfschmerz
Die Wirksamkeit von IMITREX Injection bei der akuten Behandlung von Cluster-Kopfschmerz wurde in 2 randomisierten, doppelblinden, placebokontrollierten Crossover-Studien über 2 Perioden (Studien 4 und 5) nachgewiesen. Patienten im Alter von 21 bis 65 Jahren wurden aufgenommen und angewiesen, mittelschwere bis sehr starke Kopfschmerzen innerhalb von 10 Minuten nach Beginn zu behandeln. Die Linderung von Kopfschmerzen wurde als Verringerung der Kopfschmerzschwere auf leichte oder keine Schmerzen definiert. In beiden Studien war der Anteil der Patienten, die nach 10 oder 15 Minuten eine Linderung verspürten, bei Patienten, die 6 mg IMITREX-Injektion erhielten, signifikant größer als bei Patienten, die Placebo erhielten (siehe Tabelle 4).
Eine Schätzung der kumulativen Wahrscheinlichkeit, dass ein Patient mit Cluster-Kopfschmerz nach einer Behandlung mit IMITREX 25 mg zur Injektion oder Placebo Linderung erfährt, ist in Abbildung 1 dargestellt.
Abbildung 1: Zeit bis zur Linderung des Cluster-Kopfschmerzes ab dem Zeitpunkt der Injektiona 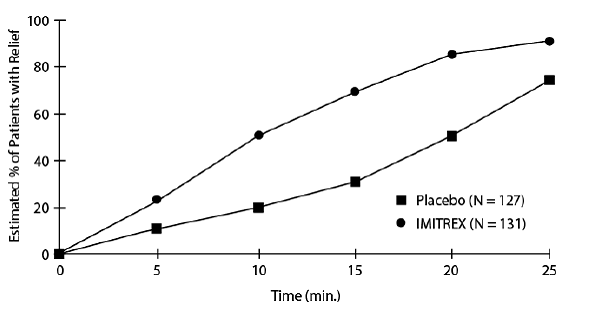
aDie Abbildung verwendet Kaplan-Meier (Produktgrenze) Survivorship Plot. Patienten, die Notfallmedikamente einnahmen, wurden nach 15 Minuten zensiert.
Das Diagramm wurde mit Daten von Patienten erstellt, die innerhalb eines Zeitraums von 2 Stunden nach der Behandlung entweder Linderung verspürten oder keine Notfallmedikation benötigten (anforderten). Folglich stammen die Daten im Diagramm nur von einer Untergruppe der 258 behandelten Kopfschmerzen (bei 52 der 127 mit Placebo behandelten Kopfschmerzen und bei 18 der 131 mit IMITREX 50 mg zur Injektion behandelten Kopfschmerzen war eine Notfallmedikation erforderlich).
Andere Daten deuten darauf hin, dass die Behandlung mit IMITREX 25 mg zur Injektion nicht mit einer Zunahme des frühen Wiederauftretens von Kopfschmerzen verbunden ist und wenig Einfluss auf das Auftreten später auftretender Kopfschmerzen hat (dh solche, die nach 2, aber vor 18 oder 24 Stunden auftreten).
INFORMATIONEN ZUM PATIENTEN
IMITREX® (IM-i-trex) (Sumatriptansuccinat) Injektion
Lesen Sie diese Patienteninformation, bevor Sie mit der Einnahme von IMITREX beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung.
Was sind die wichtigsten Informationen, die ich über IMITREX wissen sollte?
IMITREX kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Herzinfarkt und andere Herzprobleme. Herzprobleme können zum Tod führen.
Brechen Sie die Einnahme von IMITREX 25 mg ab und suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der folgenden Symptome eines Herzinfarkts haben:
IMITREX ist nicht für Menschen mit Risikofaktoren für Herzerkrankungen geeignet, es sei denn, eine Herzuntersuchung wird durchgeführt und zeigt kein Problem. Sie haben ein höheres Risiko für Herzerkrankungen, wenn Sie:
Was ist IMITREX?
IMITREX Injection ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von akuten Migränekopfschmerzen mit oder ohne Aura und akuten Cluster-Kopfschmerzen bei Erwachsenen, bei denen Migräne oder Cluster-Kopfschmerzen diagnostiziert wurden.
IMITREX 50 mg wird nicht zur Behandlung anderer Arten von Kopfschmerzen wie Hemiplegie (bei der Sie sich nicht auf einer Körperseite bewegen können) oder basilarer Migräne (seltene Form von Migräne mit Aura) angewendet.
IMITREX 100 mg wird nicht zur Vorbeugung oder Verringerung der Anzahl Ihrer Migräne- oder Cluster-Kopfschmerzen angewendet.
Es ist nicht bekannt, ob IMITREX 100 mg bei Kindern unter 18 Jahren sicher und wirksam ist.
Wer sollte IMITREX 100 mg nicht einnehmen?
Nehmen Sie IMITREX 50 mg nicht ein, wenn Sie:
Was sollte ich meinem Arzt vor der Einnahme von IMITREX mitteilen?
Bevor Sie IMITREX einnehmen, informieren Sie Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen.
IMITREX und bestimmte andere Arzneimittel können sich gegenseitig beeinflussen und schwerwiegende Nebenwirkungen verursachen.
Informieren Sie Ihren Arzt besonders, wenn Sie nehmen Antidepressiva mit den Bezeichnungen:
Fragen Sie Ihren Arzt oder Apotheker nach einer Liste dieser Arzneimittel, wenn Sie sich nicht sicher sind.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste davon, um sie Ihrem Arzt oder Apotheker zu zeigen, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich IMITREX 100 mg einnehmen?
Was sollte ich während der Einnahme von IMITREX vermeiden?
IMITREX kann Schwindel, Schwäche oder Benommenheit verursachen. Wenn Sie diese Symptome haben, fahren Sie kein Auto, bedienen Sie keine Maschinen und tun Sie nichts, bei dem Sie wachsam sein müssen.
Welche Nebenwirkungen kann IMITREX 25 mg haben?
IMITREX kann schwerwiegende Nebenwirkungen verursachen. Siehe „Was sind die wichtigsten Informationen, die ich über IMITREX wissen sollte?“
Zu diesen schwerwiegenden Nebenwirkungen gehören:
Die häufigsten Nebenwirkungen von IMITREX 50 mg Injektion sind:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von IMITREX. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist IMITREX-Injektion aufzubewahren?
Bewahren Sie IMITREX und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von IMITREX
Arzneimittel werden manchmal für andere als die in den Packungsbeilagen aufgeführten Zwecke verschrieben. Verwenden Sie IMITREX nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie IMITREX 25 mg nicht an andere Personen, selbst wenn sie die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Diese Packungsbeilage fasst die wichtigsten Informationen zu IMITREX zusammen. Wenn Sie weitere Informationen wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Arzt oder Apotheker um Informationen über IMITREX bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Weitere Informationen erhalten Sie unter www.gsk.com oder telefonisch unter 1-888-825-5249.
Was sind die Inhaltsstoffe von IMITREX Injection?
Wirkstoff: Sumatriptansuccinat
Inaktive Bestandteile: Natriumchlorid, Wasser für Injektionszwecke
Diese Patienteninformation und Gebrauchsanweisung wurde von der US Food and Drug Administration genehmigt.
Gebrauchsanweisung für Patienten
IMITREX STAT-Dosiersystem
Lesen Sie diese Gebrauchsanweisung für Patienten, bevor Sie das IMITREX STATdose System verwenden. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung. Sprechen Sie mit Ihrem Arzt oder Ihrer Ärztin über IMITREX 25 mg zur Injektion, wenn Sie mit der Einnahme beginnen und bei regelmäßigen Kontrolluntersuchungen.
Bewahren Sie das IMITREX STATdose System außerhalb der Reichweite von Kindern auf.
Bevor Sie das IMITREX STATdose System verwenden
Wenn Sie die Schachtel des IMITREX 25 mg STATdose-Systems zum ersten Mal öffnen, befinden sich die Patronenpackung und der IMITREX STATdose Pen® bereits in der Tragetasche, damit Sie es bequem haben.
Das Grau und Blau Tragetasche dient zur Aufbewahrung des entladenen Pens und der Patronenpackung, wenn sie nicht verwendet werden.
Das Patronenpaket hält 2 einzeln versiegelt Spritzenkartuschen Jede Spritzenkartusche enthält 1 Dosis IMITREX® (Sumatriptansuccinat) zur Injektion. Die Patronenpackung für die 4-mg-Stärke dieses Arzneimittels ist gelb, und die Patronenpackung für die 6-mg-Stärke ist blau (wie abgebildet). Nachfüllkartuschenpackungen sind erhältlich.
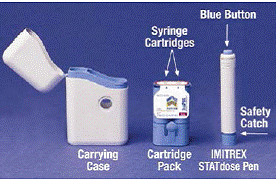
Das Grau und Blau Stift wird verwendet, um automatisch 1 Dosis des Arzneimittels aus einer Spritzenkartusche zu injizieren. Berühren Sie nicht die Blauer Knopf bis Sie den Pen gegen Ihre Haut gedrückt haben, um eine Dosis zu verabreichen. Wenn Sie zu einem anderen Zeitpunkt darauf drücken, können Sie eine Dosis verlieren. Das Sicherheitssperre verhindert, dass der Stift versehentlich ausgelöst wird, bis Sie bereit sind. Der Stift funktioniert nur, wenn Sie den grauen Teil des Schafts auf den blauen Teil schieben. Stellen Sie immer sicher, dass der weiße Füllstab nicht aus dem Ende des Pens herausragt (wie in Abbildung B gezeigt), bevor Sie eine neue Spritzenkartusche einsetzen. Wenn es herausragt, verlieren Sie diese Dosis.
So laden Sie den IMITREX STATdose Pen
Laden Sie den Pen erst, wenn Sie bereit sind, sich selbst eine Injektion zu geben. Berühren Sie nicht den blauen Knopf oben auf dem Stift (siehe Abbildung A), während Sie den Stift laden.
Abbildung A 
Abbildung B 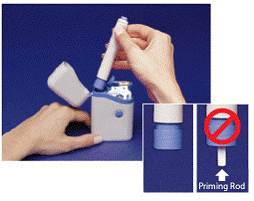
1. Öffnen Sie den Deckel der Tragetasche. Die manipulationssicheren Siegel über den 2 Spritzenkartuschen sind mit „A“ und „B“ gekennzeichnet (siehe Abbildung A Einschub ).
Verwenden Sie immer die mit „A“ gekennzeichnete Spritzenkartusche vor der mit „B“ gekennzeichneten, um Ihnen zu helfen, den Überblick über Ihre Dosen zu behalten. Nicht verwenden, wenn eines der Siegel beschädigt ist oder fehlt, wenn Sie die Tragetasche zum ersten Mal öffnen.
2. Reißen Sie eines der Originalitätssiegel ab (siehe Abbildung A ). Wirf das Siegel weg. Öffnen Sie den Deckel über der Spritzenkartusche.
3. Halten Sie den Stift an den Rippen oben. Nehmen Sie den Stift aus der Tragetasche (siehe Abbildung B ).
Stellen Sie sicher, dass der weiße Zündstab nicht aus dem unteren Ende des Stifts herausragt (siehe Abbildung B Einschub ). Wenn er herausragt, legen Sie den Stift wieder in die Tragetasche und drücken Sie ihn fest nach unten, bis Sie ein Klicken spüren. Nehmen Sie den Stift aus der Tragetasche.
Abbildung C 
4. Legen Sie den Pen in die Patronenpackung. Drehen Sie ihn nach rechts (im Uhrzeigersinn), bis er sich nicht mehr dreht (etwa eine halbe Umdrehung) (siehe Abbildung C ).
5. Halten Sie den geladenen Stift an den Rippen und ziehen Sie ihn gerade heraus (siehe Abbildung D ). Möglicherweise müssen Sie kräftig am Stift ziehen, aber das ist normal. Drücken Sie noch nicht die blaue Taste.
Abbildung D 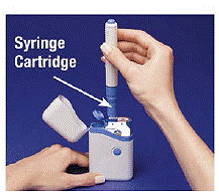
Der Stift ist jetzt einsatzbereit. Unterlassen Sie Legen Sie den geladenen Pen wieder in die Tragetasche, da dies die Nadel beschädigen würde.
So verwenden Sie den IMITREX STAT-Dosispen zur Einnahme Ihres Arzneimittels
Wählen Sie vor der Injektion Ihres Arzneimittels einen Bereich mit einer Fettgewebeschicht aus (siehe Abbildung E oder Abbildung F). Wenden Sie sich an Ihren Arzt, wenn Sie Fragen dazu haben, wo Sie Ihr Arzneimittel injizieren sollen.
Um den Hautbereich vorzubereiten, in den IMITREX injiziert werden soll, wischen Sie die Injektionsstelle mit einem Alkoholtupfer ab. Berühren Sie diesen Bereich vor der Injektion nicht mehr.
Abbildung E oder Abbildung F Abbildung G 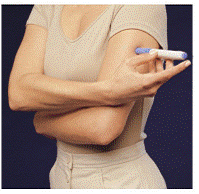
6. Drücken Sie, ohne den blauen Knopf zu drücken, den geladenen Pen fest gegen die Haut, sodass der graue Schaft nach unten in Richtung des blauen Abschnitts gleitet, der die Spritzenkartusche hält (siehe Abbildung D ). (Dadurch wird die Sicherheitsverriegelung gelöst, die verhindert, dass der Stift versehentlich ausgelöst wird, bis Sie bereit sind.)
7. Drücken Sie die blaue Taste. Halten Sie den Stift ruhig für mindestens 5 Sekunden . Wenn der Pen zu früh von der Haut entfernt wird, tritt nicht das gesamte Arzneimittel aus.
8 Nach 5 Sekunden , entfernen Sie den Pen vorsichtig von Ihrer Haut. Die Nadel wird angezeigt (siehe Abbildung G ). Berühren Sie nicht die Nadel.
So entladen Sie den IMITREX STAT-Dosispen nach der Einnahme Ihres Arzneimittels
Unmittelbar nachdem Sie eine Dosis mit dem Pen genommen haben, müssen Sie die gebrauchte Spritzenpatrone wieder in die Patronenpackung zurücklegen.
Abbildung H Abbildung I und Abbildung J 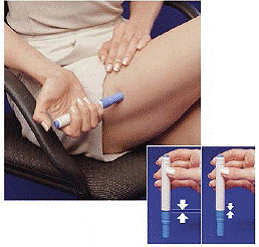
9. Drücken Sie den Pen so weit wie möglich in die leere Seite der Patronenpackung (siehe Abbildung H ).
10. Drehen Sie den Pen etwa eine halbe Umdrehung nach links (gegen den Uhrzeigersinn), bis er sich von der Spritzenkartusche löst (siehe Abbildung I ).
11. Ziehen Sie den leeren Pen aus der Patronenpackung (siehe Abbildung J ).
Da der Pen jetzt verwendet wurde, ragt der weiße Priming Rod aus dem unteren Ende des Pens heraus (siehe Abbildung J ).
12. Schließen Sie den Deckel der Kartuschenpackung über der gebrauchten Spritzenkartusche. Wenn die gebrauchten Spritzenkartuschen korrekt eingesetzt sind, ist das Kartuschenpaket eine Einweg-Schutzhülle, die Ihnen hilft, Nadelstiche zu vermeiden und die Spritzen korrekt zu verwenden.
13. Legen Sie den Stift wieder in die Tragetasche und drücken Sie ihn fest nach unten, bis Sie ein Klicken spüren. Schließen Sie den Deckel der Tragetasche. Dadurch wird der Stift für die nächste Verwendung vorbereitet.
Wenn sich der Deckel nicht schließen lässt, drücken Sie den Stift nach unten, bis Sie ein Klicken spüren. Schließen Sie dann den Deckel.
So nehmen Sie ein gebrauchtes Patronenpaket heraus
Nachdem beide Spritzenpatronen verwendet wurden, nehmen Sie die Patronenpackung aus der Tragetasche. Niemals eine Spritzenkartusche wiederverwenden oder recyceln.
Abbildung K Abbildung L 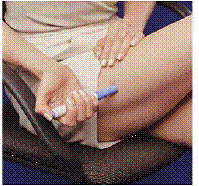
14. Öffnen Sie den Deckel der Tragetasche.
15. Halten Sie die Tragetasche mit einer Hand und drücken Sie die 2 Knöpfe auf beiden Seiten der Tragetasche (siehe Abbildung K ).
16. Ziehen Sie das Patronenpaket vorsichtig mit der anderen Hand heraus (siehe Abbildung L ).
17. Werfen Sie die Patronenpackung weg oder entsorgen Sie sie gemäß den Anweisungen Ihres medizinischen Betreuers. Für die Entsorgung gebrauchter Nadeln und Spritzen können besondere bundesstaatliche und lokale Gesetze gelten. Immer außerhalb der Reichweite von Kindern aufbewahren.
So legen Sie ein neues Patronenpaket ein
Abbildung M Abbildung N und Abbildung O 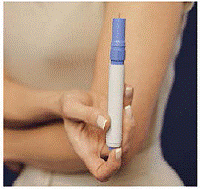
18. Nehmen Sie das neue Patronenpaket aus seiner Verpackung. Entfernen Sie nicht die Originalitätssiegel (siehe Abbildung M).
19. Legen Sie das Patronenpaket in die Tragetasche. Schieben Sie es sanft nach unten (siehe Abbildung N ).
20. Das Patronenpaket rastet ein, wenn die beiden Knöpfe durch die Löcher in der Tragetasche ragen (siehe Abbildung O ). Mach den Deckel zu.
Diese Patienteninformation und Gebrauchsanweisung wurde von der US Food and Drug Administration genehmigt.