Ditropan 2.5mg, 5mg Oxybutynin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Ditropan und wie wird es angewendet?
Ditropan ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome einer überaktiven Blase. Ditropan 5 mg kann allein oder mit anderen Medikamenten verwendet werden.
Ditropan gehört zu einer Klasse von Arzneimitteln, die als krampflösende Mittel für die Harnwege bezeichnet werden.
Es ist nicht bekannt, ob Ditropan bei Kindern unter 5 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Ditropan haben?
Ditropan kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Ditropan gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Ditropan. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Jede bikonvexe, blau gravierte DITROPAN® (Oxybutyninchlorid) Tablette mit Bruchrille enthält 5 mg Oxybutyninchlorid. Chemisch gesehen ist Oxybutyninchlorid d,l (racemisches) 4-Diethylamino-2-butinylphenylcyclohexylglycolat-Hydrochlorid. Das
Die empirische Formel von Oxybutyninchlorid ist C22H31NO3·HCl. Die Strukturformel erscheint unten:
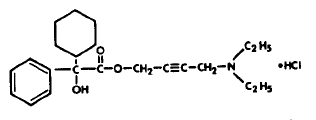
Oxybutyninchlorid ist ein weißer kristalliner Feststoff mit einem Molekulargewicht von 393,9. Es ist gut löslich in Wasser und Säuren, aber relativ unlöslich in Alkalien.
DITROPAN Tabletten enthalten außerdem Calciumstearat, FD&C Blue #1 Lake, Laktose und mikrokristalline Zellulose.
DITROPAN Tabletten sind zur oralen Verabreichung bestimmt.
Therapeutische Kategorie: Spasmolytisch, Anticholinergikum.
INDIKATIONEN
DITROPAN 2,5 mg XL® (Oxybutyninchlorid) ist ein muskarinischer Antagonist, der zur Behandlung der überaktiven Blase mit Symptomen von Dranginkontinenz, Harndrang und Häufigkeit indiziert ist.
DITROPAN XL® ist auch angezeigt für die Behandlung von pädiatrischen Patienten ab 6 Jahren mit Symptomen einer Detrusor-Überaktivität im Zusammenhang mit einer neurologischen Erkrankung (z. B. Spina bifida).
DOSIERUNG UND ANWENDUNG
DITROPAN 2,5 mg XL® muss unzerkaut mit Flüssigkeit geschluckt werden und darf nicht gekaut, geteilt oder zerkleinert werden.
DITROPAN XL® kann mit oder ohne Nahrung verabreicht werden.
Erwachsene
Die empfohlene Anfangsdosis von DITROPAN 5 mg XL® beträgt 5 oder 10 mg einmal täglich etwa zur gleichen Tageszeit. Die Dosierung kann in 5-mg-Schritten angepasst werden, um ein Gleichgewicht zwischen Wirksamkeit und Verträglichkeit zu erreichen (bis zu einer Höchstdosis von 30 mg/Tag). Im Allgemeinen kann eine Dosisanpassung in ungefähr wöchentlichen Intervallen erfolgen.
Pädiatrische Patienten im Alter von 6 Jahren und älter
Die empfohlene Anfangsdosis von DITROPAN 5 mg XL® beträgt 5 mg einmal täglich, jeden Tag ungefähr zur gleichen Zeit. Die Dosierung kann in 5-mg-Schritten angepasst werden, um ein Gleichgewicht zwischen Wirksamkeit und Verträglichkeit zu erreichen (bis zu einer Höchstdosis von 20 mg/Tag).
WIE GELIEFERT
Darreichungsformen und Stärken
DITROPAN 5 mg XL® Retardtabletten sind als 5- und 10-mg-Tabletten zum Einnehmen erhältlich:
5mg : Blassgelbe, runde Tablette mit dem Aufdruck „5 XL“ auf einer Seite mit schwarzer Tinte.
10mg Rosafarbene, runde Tablette mit dem Aufdruck „10 XL“ auf einer Seite mit schwarzer Tinte.
Lagerung und Handhabung
DITROPAN XL® Retardtabletten sind in zwei Dosierungsstärken erhältlich, 5 mg (blassgelb) und 10 mg (rosa) und sind auf einer Seite mit schwarzer Tinte mit „5 XL“ oder „10 XL“ bedruckt. DITROPAN XL® Retardtabletten werden in Flaschen mit 100 Tabletten geliefert.
Lagerung
Bei 25 °C (77 °F) lagern; Exkursionen erlaubt bis 15–30 °C (59–86 °F) [siehe USP kontrollierte Raumtemperatur ]. Vor Nässe und Nässe schützen.
Außerhalb der Reichweite von Kindern aufbewahren.
Hergestellt von: ALZA Corporation, Vacaville, CA 95688, Ein Produkt der ALZA OROS Technologie. Hergestellt für: Janssen Pharmaceuticals, Inc., Titusville, NJ 08560. Überarbeitet: September 2019
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Die Sicherheit und Wirksamkeit von DITROPAN 2,5 mg XL® (5 bis 30 mg/Tag) wurde bei 774 erwachsenen Probanden untersucht, die an fünf doppelblinden, kontrollierten klinischen Studien teilgenommen haben. In vier der fünf Studien war Ditropan 5 mg IR (5 bis 20 mg/Tag bei 199 Probanden) ein aktives Vergleichspräparat. Nebenwirkungen, die von ≥ 1 % der Patienten berichtet wurden, sind in Tabelle 1 aufgeführt.
Die Abbruchrate aufgrund von Nebenwirkungen betrug 4,4 % bei DITROPAN XL® im Vergleich zu 0 % bei Ditropan IR. Die häufigste Nebenwirkung, die zum Absetzen der Studienmedikation führte, war Mundtrockenheit (0,7 %).
Die folgenden Nebenwirkungen wurden von Stoffwechsel- und Ernährungsstörungen: Anorexie, Flüssigkeitsretention; Gefäßerkrankungen: Hitzewallungen; Erkrankungen der Atemwege, des Brustraums und Mediastinums: Dysphonie; Gastrointestinale Störungen: Dysphagie, häufiger Stuhlgang; Allgemeine Erkrankungen und Beschwerden am Verabreichungsort: Brustbeschwerden, Durst.
Postmarketing-Erfahrung
Die folgenden zusätzlichen Nebenwirkungen wurden aus der weltweiten Postmarketing-Erfahrung mit DITROPAN 5 mg XL® berichtet. Da Postmarketing-Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Infektionen und Schädlinge: Infektion der Harnwege; Psychische Störungen: psychotische Störung, Erregung, Verwirrtheitszustand, Halluzinationen, Gedächtnisstörungen, anormales Verhalten; Erkrankungen des Nervensystems: Krämpfe; Augenerkrankungen: Glaukom; Erkrankungen der Atemwege, des Brustraums und des Mediastinums: verstopfte Nase; Herzerkrankungen: Arrhythmie, Tachykardie, Herzklopfen, Verlängerung des QT-Intervalls; Gefäßerkrankungen: Hitzewallungen, Bluthochdruck; Erkrankungen der Haut und des Unterhautgewebes: Ausschlag; Nieren- und Harnwegserkrankungen: Impotenz; Allgemeine Erkrankungen und Bedingungen am Verabreichungsort: Überempfindlichkeitsreaktionen, einschließlich Angioödem mit Atemwegsobstruktion, Urtikaria und Gesichtsödem; anaphylaktische Reaktionen, die einen Krankenhausaufenthalt zur Notfallbehandlung erfordern; Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen: Sturz.
Weitere Nebenwirkungen, die bei einigen anderen Oxybutyninchlorid-Formulierungen berichtet wurden, umfassen: Zykloplegie, Mydriasis und Unterdrückung der Laktation. In einem gemeldeten Fall war die gleichzeitige Anwendung von Oxybutynin mit Carbamazepin und Dantrolen mit Nebenwirkungen wie Erbrechen, Schläfrigkeit, Verwirrtheit, Unsicherheit, verwaschener Sprache und Nystagmus verbunden, was auf eine Carbamazepin-Toxizität hindeutet.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Die gleichzeitige Anwendung von Oxybutynin mit anderen Anticholinergika oder mit anderen Mitteln, die Mundtrockenheit, Verstopfung, Somnolenz (Schläfrigkeit) und/oder andere Anticholinergika-ähnliche Wirkungen hervorrufen, kann die Häufigkeit und/oder Schwere solcher Wirkungen erhöhen.
Anticholinergika können aufgrund ihrer anticholinergen Wirkung auf die gastrointestinale Motilität möglicherweise die Resorption einiger gleichzeitig verabreichter Arzneimittel verändern. Dies kann bei Arzneimitteln mit einer engen therapeutischen Breite von Bedeutung sein. Anticholinergika können auch die Wirkungen von Prokinetika wie Metoclopramid antagonisieren.
Die mittleren Oxybutynin-Plasmakonzentrationen waren etwa 2-mal höher, wenn DITROPAN 5 mg XL® zusammen mit Ketoconazol, einem starken CYP3A4-Hemmer, verabreicht wurde. Andere Inhibitoren des Cytochrom-P450-3A4-Enzymsystems, wie Antimykotika (z. B. Itraconazol und Miconazol) oder Makrolid-Antibiotika (z. B. Erythromycin und Clarithromycin), können die mittleren pharmakokinetischen Parameter von Oxybutynin (dh Cmax und AUC) verändern. Die klinische Relevanz solcher potenzieller Wechselwirkungen ist nicht bekannt. Bei gleichzeitiger Anwendung solcher Arzneimittel ist Vorsicht geboten.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Angioödem
Unter Oxybutynin wurde über Angioödeme des Gesichts, der Lippen, der Zunge und/oder des Kehlkopfes berichtet. In einigen Fällen trat nach der ersten Dosis ein Angioödem auf. Angioödeme in Verbindung mit einer Schwellung der oberen Atemwege können lebensbedrohlich sein. Wenn eine Beteiligung der Zunge, des Hypopharynx oder des Larynx auftritt, sollte Oxybutynin sofort abgesetzt und eine geeignete Therapie und/oder Maßnahmen, die erforderlich sind, um einen freien Atemweg zu gewährleisten, unverzüglich bereitgestellt werden.
Auswirkungen auf das zentrale Nervensystem
Oxybutynin wird mit anticholinergen Wirkungen auf das Zentralnervensystem (ZNS) in Verbindung gebracht [vgl NEBENWIRKUNGEN ]. Es wurde über eine Vielzahl von anticholinergen Wirkungen auf das ZNS berichtet, darunter Halluzinationen, Erregung, Verwirrtheit und Somnolenz. Die Patienten sollten insbesondere in den ersten Monaten nach Behandlungsbeginn oder Dosiserhöhung auf Anzeichen anticholinerger ZNS-Wirkungen überwacht werden. Weisen Sie die Patienten darauf hin, kein Fahrzeug zu führen oder schwere Maschinen zu bedienen, bis sie wissen, wie sich DITROPAN XL® auf sie auswirkt. Wenn bei einem Patienten anticholinerge ZNS-Wirkungen auftreten, sollte eine Dosisreduktion oder ein Absetzen des Arzneimittels in Betracht gezogen werden.
DITROPAN XL® sollte bei Patienten mit vorbestehender Demenz, die mit Cholinesterasehemmern behandelt werden, wegen des Risikos einer Verschlimmerung der Symptome mit Vorsicht angewendet werden.
DITROPAN XL® sollte bei Patienten mit Parkinson-Krankheit wegen des Risikos einer Verschlimmerung der Symptome mit Vorsicht angewendet werden.
Verschlechterung der Symptome von Myasthenia gravis
DITROPAN XL® sollte bei Patienten mit Myasthenia gravis wegen des Risikos einer Verschlimmerung der Symptome mit Vorsicht angewendet werden.
Verschlechterung der Symptome einer verminderten gastrointestinalen Motilität bei Patienten mit autonomer Neuropathie
DITROPAN 2,5 mg XL® sollte bei Patienten mit autonomer Neuropathie aufgrund des Risikos einer Verschlimmerung der Symptome einer verminderten gastrointestinalen Motilität mit Vorsicht angewendet werden.
Harnverhalt
DITROPAN 5 mg XL® sollte Patienten mit klinisch signifikanter Blasenabflussobstruktion wegen des Risikos einer Harnverhaltung mit Vorsicht verabreicht werden [siehe KONTRAINDIKATIONEN ].
Magen-Darm-Nebenwirkungen
DITROPAN 2,5 mg XL® sollte Patienten mit gastrointestinalen obstruktiven Erkrankungen wegen des Risikos einer Magenretention mit Vorsicht verabreicht werden [siehe KONTRAINDIKATIONEN ].
DITROPAN XL® kann wie andere Anticholinergika die gastrointestinale Motilität verringern und sollte bei Patienten mit Erkrankungen wie Colitis ulcerosa und Darmatonie mit Vorsicht angewendet werden.
DITROPAN 2,5 mg XL® sollte bei Patienten mit gastroösophagealem Reflux und/oder gleichzeitiger Einnahme von Arzneimitteln (z. B. Bisphosphonaten), die eine Ösophagitis verursachen oder verschlimmern können, mit Vorsicht angewendet werden.
Wie bei jedem anderen nicht verformbaren Material ist bei der Verabreichung von DITROPAN XL® an Patienten mit vorbestehender schwerer Magen-Darm-Verengung (pathologisch oder iatrogen) Vorsicht geboten. Es gab seltene Berichte über obstruktive Symptome bei Patienten mit bekannten Strikturen im Zusammenhang mit der Einnahme anderer Arzneimittel in nicht verformbaren Formulierungen mit kontrollierter Freisetzung.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Eine 24-monatige Studie an Ratten mit Oxybutyninchlorid-Dosierungen von 20, 80 und 160 mg/kg/Tag ergab keine Hinweise auf Karzinogenität. Diese Dosen betragen etwa das 6-, 25- und 50-fache der maximalen menschlichen Exposition, basierend auf einer menschlichen Äquivalentdosis unter Berücksichtigung der Normalisierung der Körperoberfläche.
Oxybutyninchlorid zeigte keine Zunahme der mutagenen Aktivität, wenn es in Schizosaccharomyces pompholiciformis-, Saccharomyces cerevisiae- und Salmonella typhimurium-Testsystemen getestet wurde.
Reproduktionsstudien mit Oxybutyninchlorid bei Maus, Ratte, Hamster und Kaninchen ergaben keine Hinweise auf eine Beeinträchtigung der Fertilität.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie B
Es gibt keine ausreichenden und gut kontrollierten Studien mit DITROPAN 5mg XL® bei Schwangeren. DITROPAN XL® sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen für die Patientin das Risiko für Patientin und Fötus überwiegt. Frauen, die während der Behandlung mit DITROPAN XL® schwanger werden, sollten sich an ihren Arzt wenden.
Zusammenfassung der Risiken
Basierend auf Tierdaten wird für Oxybutynin eine geringe Wahrscheinlichkeit vorhergesagt, dass es das Risiko für unerwünschte Entwicklungseffekte über das Hintergrundrisiko hinaus erhöht.
Tierdaten
Reproduktionsstudien mit Oxybutyninchlorid bei Maus, Ratte, Hamster und Kaninchen zeigten keine Hinweise auf eine Beeinträchtigung der Fertilität oder eine Schädigung des Fötus des Tieres.
Stillende Mutter
Es ist nicht bekannt, ob Oxybutynin in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch ausgeschieden werden, ist Vorsicht geboten, wenn DITROPAN 5 mg XL® einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von DITROPAN XL® wurden bei 60 Kindern in einer 24-wöchigen, unverblindeten, nicht randomisierten Studie untersucht. Die Patienten waren zwischen 6 und 15 Jahre alt, alle hatten Symptome einer Detrusorüberaktivität in Verbindung mit einer neurologischen Erkrankung (z. B. Spina bifida), alle verwendeten eine saubere intermittierende Katheterisierung und alle waren aktuelle Anwender von Oxybutyninchlorid. Die Studienergebnisse zeigten, dass die Verabreichung von DITROPAN 2,5 mg XL® 5 bis 20 mg/Tag mit einem Anstieg des mittleren Urinvolumens pro Katheterisierung gegenüber dem Ausgangswert von 108 ml auf 136 ml verbunden war, einem Anstieg des mittleren Urinvolumens gegenüber dem Ausgangswert nach dem morgendlichen Aufwachen von 148 ml auf 189 ml und eine Zunahme des mittleren Prozentsatzes der Katheterisierungen ohne Leckage-Episode gegenüber dem Ausgangswert von 34 % auf 51 %.
Die urodynamischen Ergebnisse stimmten mit den klinischen Ergebnissen überein. Die Verabreichung von DITROPAN XL® führte zu einer Erhöhung der mittleren maximalen zystometrischen Kapazität gegenüber dem Ausgangswert von 185 ml auf 254 ml, zu einer Abnahme des mittleren Detrusordrucks bei maximaler zystometrischer Kapazität gegenüber dem Ausgangswert von 44 cm H2O auf 33 cm H2O und zu einer Verringerung des Prozentsatzes der Patienten mit ungehemmten Detrusorkontraktionen (mindestens 15 cm HO) von 60 % auf 28 %.
Die Pharmakokinetik von DITROPAN 5 mg XL® bei diesen Patienten stimmte mit der für Erwachsene berichteten überein [siehe KLINISCHE PHARMAKOLOGIE ].
DITROPAN 5 mg XL® wird nicht empfohlen für pädiatrische Patienten, die die Tablette nicht im Ganzen schlucken können, ohne sie zu zerkauen, zu teilen oder zu zerdrücken, oder für Kinder unter 6 Jahren.
Geriatrische Verwendung
Häufigkeit und Schweregrad anticholinerger Wirkungen, die von Patienten unter 65 Jahren und über 65 Jahren berichtet wurden, waren ähnlich. Die Pharmakokinetik von DITROPAN XL® war bei allen untersuchten Patienten (bis 78 Jahre) ähnlich.
Nierenfunktionsstörung
Es wurden keine Studien mit DITROPAN XL® bei Patienten mit eingeschränkter Nierenfunktion durchgeführt.
Leberfunktionsstörung
Es wurden keine Studien mit DITROPAN 2,5 mg XL® bei Patienten mit eingeschränkter Leberfunktion durchgeführt.
ÜBERDOSIS
Die kontinuierliche Freisetzung von Oxybutynin aus DITROPAN 5 mg XL® sollte bei der Behandlung einer Überdosierung berücksichtigt werden. Die Patienten sollten mindestens 24 Stunden lang überwacht werden. Die Behandlung sollte symptomatisch und unterstützend sein. Ein Abführmittel kann verabreicht werden.
Eine Überdosierung mit Oxybutyninchlorid wurde mit anticholinergen Wirkungen in Verbindung gebracht, einschließlich Erregung des Zentralnervensystems, Hautrötung, Fieber, Dehydration, Herzrhythmusstörungen, Erbrechen und Harnverhalt.
Die Einnahme von 100 mg Oxybutyninchlorid in Verbindung mit Alkohol wurde bei einem 13-jährigen Jungen berichtet, der unter Gedächtnisverlust litt, und bei einer 34-jährigen Frau, die Stupor entwickelte, gefolgt von Orientierungslosigkeit und Unruhe beim Erwachen, erweiterten Pupillen, trocken Haut, Herzrhythmusstörungen und Harnverhalt. Beide Patienten erholten sich vollständig unter symptomatischer Behandlung.
KONTRAINDIKATIONEN
DITROPAN 2,5 mg XL® ist kontraindiziert bei Patienten mit Harnverhalt, Magenverhalt und anderen schweren Erkrankungen mit verminderter gastrointestinaler Motilität, unkontrolliertem Engwinkelglaukom.
DITROPAN 2,5 mg XL® ist auch bei Patienten kontraindiziert, die eine Überempfindlichkeit gegen den Wirkstoff oder andere Bestandteile des Produkts gezeigt haben. Es gibt Berichte über Überempfindlichkeitsreaktionen, einschließlich Anaphylaxie und Angioödem.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Oxybutynin entspannt die glatte Muskulatur der Blase. Oxybutyninchlorid übt eine direkte krampflösende Wirkung auf die glatte Muskulatur aus und hemmt die muskarinische Wirkung von Acetylcholin auf die glatte Muskulatur. Es treten keine blockierenden Wirkungen an skelettalen neuromuskulären Verbindungen oder autonomen Ganglien auf (antinikotinische Wirkungen).
Die antimuskarinische Aktivität liegt überwiegend im R-Isomer. Ein Metabolit, Desethyloxybutynin, hat in In-vitro-Studien eine ähnliche pharmakologische Aktivität wie Oxybutynin.
Pharmakodynamik
Bei Patienten mit Zuständen, die durch unwillkürliche Blasenkontraktionen gekennzeichnet sind, haben zystometrische Studien gezeigt, dass Oxybutynin die (Blasen-)Kapazität der Blase erhöht, die Häufigkeit ungehemmter Kontraktionen des Detrusormuskels verringert und den anfänglichen Wunsch zu entleeren verzögert.
Pharmakokinetik
Absorption
Nach der ersten Dosis von DITROPAN XL® steigen die Oxybutynin-Plasmakonzentrationen für 4 bis 6 Stunden an; danach werden konstante Konzentrationen für bis zu 24 Stunden aufrechterhalten, wodurch Schwankungen zwischen den mit Oxybutynin verbundenen Spitzen- und Talkonzentrationen minimiert werden.
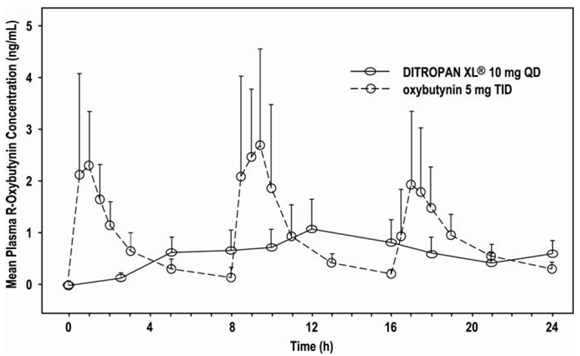
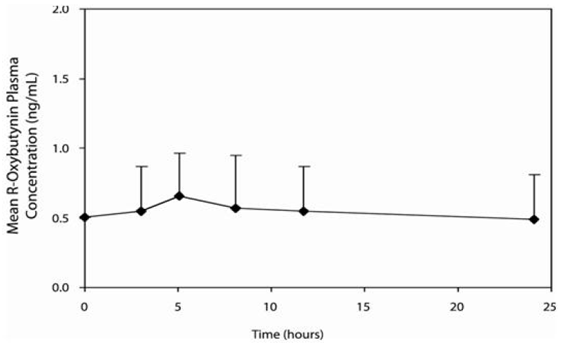
Die relative Bioverfügbarkeit von R- und S-Oxybutynin aus DITROPAN XL® beträgt 156 % bzw. 187 % im Vergleich zu Oxybutynin. Die mittleren pharmakokinetischen Parameter für R- und S-Oxybutynin sind in Tabelle 2 zusammengefasst. Die Plasmakonzentrations-Zeit-Profile für R- und S-Oxybutynin haben eine ähnliche Form; Abbildung 1 zeigt das Profil für R-Oxybutynin.
Abbildung 1: Mittlere R-Oxybutynin-Plasmakonzentrationen nach einer Einzeldosis von DITROPAN XL® 10 mg und Oxybutynin 5 mg, verabreicht alle 8 Stunden (n = 23 für jede Behandlung).
Steady-State-Oxybutynin-Plasmakonzentrationen werden an Tag 3 der wiederholten Gabe von DITROPAN XL® erreicht, ohne dass eine Arzneimittelakkumulation oder Veränderung der pharmakokinetischen Parameter von Oxybutynin und Desethyloxybutynin beobachtet wird.
Die Steady-State-Pharmakokinetik von DITROPAN 5 mg XL® wurde bei 19 Kindern im Alter von 5–15 Jahren mit Detrusorüberaktivität in Verbindung mit einer neurologischen Erkrankung (z. B. Spina bifida) untersucht. Die Kinder erhielten DITROPAN 2,5 mg XL® mit einer täglichen Gesamtdosis von 5 bis 20 mg (0,10 bis 0,77 mg/kg). Zur Gewinnung von Serumproben wurde eine Sparse-Sampling-Technik verwendet. Wenn alle verfügbaren Daten auf ein Äquivalent von 5 mg DITROPAN XL® pro Tag normalisiert werden, sind die mittleren pharmakokinetischen Parameter, die für R- und S-Oxybutynin und R- und S-Desethyloxybutynin abgeleitet wurden, in Tabelle 3 zusammengefasst. Die Plasma-Zeit-Konzentrationsprofile denn R- und S-Oxybutynin haben eine ähnliche Form; Abbildung 2 zeigt das Profil für R-Oxybutynin, wenn alle verfügbaren Daten auf ein Äquivalent von 5 mg pro Tag normalisiert werden.
Abbildung 2: Mittlere Plasmakonzentrationen von R-Oxybutynin im Steady State (± SD) nach Verabreichung von 5 bis 20 mg DITROPAN 5 mg XL® einmal täglich bei Kindern im Alter von 5–15 Jahren. Das Diagramm stellt alle verfügbaren Daten dar, normalisiert auf ein Äquivalent von DITROPAN XL® 5 mg einmal täglich.
Auswirkungen auf Lebensmittel
Die Geschwindigkeit und das Ausmaß der Resorption und des Metabolismus von Oxybutynin sind nach Nahrungsaufnahme und nüchternem Zustand ähnlich.
Verteilung
Oxybutynin wird nach systemischer Resorption weit im Körpergewebe verteilt. Das Verteilungsvolumen beträgt 193 l nach intravenöser Verabreichung von 5 mg Oxybutyninchlorid. Beide Enantiomere von Oxybutynin werden stark (> 99 %) an Plasmaproteine gebunden. Beide Enantiomere von N-Desethyloxybutynin werden auch stark (>97 %) an Plasmaproteine gebunden. Das wichtigste Bindungsprotein ist Alpha-1-Säure-Glykoprotein.
Stoffwechsel
Oxybutynin wird hauptsächlich durch die Cytochrom-P450-Enzymsysteme metabolisiert, insbesondere durch CYP3A4, das hauptsächlich in der Leber und der Darmwand vorkommt. Zu seinen Stoffwechselprodukten gehören die pharmakologisch inaktive Phenylcyclohexylglycolsäure und das pharmakologisch aktive Desethyloxybutynin. Nach der Verabreichung von DITROPAN 2,5 mg XL® betragen die Plasmakonzentrationen von R- und S-Desethyloxybutynin 73 % bzw. 92 % der mit Oxybutynin beobachteten Konzentrationen.
Ausscheidung
Oxybutynin wird weitgehend von der Leber metabolisiert, wobei weniger als 0,1 % der verabreichten Dosis unverändert mit dem Urin ausgeschieden werden. Außerdem werden weniger als 0,1 % der verabreichten Dosis als Metabolit Desethyloxybutynin ausgeschieden.
Dosisproportionalität
Die pharmakokinetischen Parameter von Oxybutynin und Desethyloxybutynin (Cmax und AUC) nach Verabreichung von 5–20 mg DITROPAN 5 mg XL® sind dosisproportional.
Verwendung in bestimmten Bevölkerungsgruppen
Pädiatrie
Die Pharmakokinetik von DITROPAN 2,5 mg XL® wurde bei 19 Kindern im Alter von 5–15 Jahren mit Detrusorüberaktivität in Verbindung mit einer neurologischen Erkrankung (z. B. Spina bifida) untersucht. Die Pharmakokinetik von DITROPAN 2,5 mg XL® bei diesen pädiatrischen Patienten stimmte mit der für Erwachsene berichteten überein (siehe Tabellen 2 und 3 sowie Abbildungen 1 und 2 oben).
Geschlecht
Es gibt keine signifikanten Unterschiede in der Pharmakokinetik von Oxybutynin bei gesunden männlichen und weiblichen Probanden nach Verabreichung von DITROPAN 2,5 mg XL®.
Wettrennen
Die verfügbaren Daten deuten darauf hin, dass es bei gesunden Probanden nach Verabreichung von DITROPAN 2,5 mg XL® keine signifikanten Unterschiede in der Pharmakokinetik von Oxybutynin aufgrund der Rasse gibt.
Klinische Studien
DITROPAN 5 mg XL® wurde für die Behandlung von Patienten mit überaktiver Blase mit Symptomen von Dranginkontinenz, Drang und Häufigkeit in drei kontrollierten Wirksamkeitsstudien untersucht. Die Mehrheit der Patienten war Kaukasier (89,0 %) und weiblich (91,9 %) mit einem Durchschnittsalter von 59 Jahren (Bereich 18 bis 98 Jahre). Die Aufnahmekriterien erforderten, dass die Patienten Drang- oder Mischinkontinenz (mit vorherrschendem Drang) haben, nachgewiesen durch ≥ 6 Dranginkontinenz-Episoden pro Woche und ≥ 10 Miktionen pro Tag. Studie 1 war ein Design mit fester Dosiseskalation, während die anderen beiden Studien ein Dosisanpassungsdesign verwendeten, bei dem die Enddosis jedes Patienten angepasst wurde, um ein Gleichgewicht zwischen der Verbesserung der Inkontinenzsymptome und der Verträglichkeit von Nebenwirkungen herzustellen. Alle drei Studien umfassten Patienten, von denen bekannt ist, dass sie auf Oxybutynin oder andere Anticholinergika ansprechen, und diese Patienten wurden bis zu 2 Wochen lang auf einer Enddosis gehalten.
Die Wirksamkeitsergebnisse für die drei kontrollierten Studien sind in den folgenden Tabellen 4, 5 und 6 und den Abbildungen 3, 4 und 5 dargestellt.
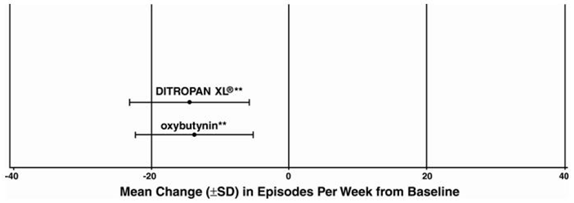
Abbildung 3: Mittlere Veränderung (±SD) der Dranginkontinenz-Episoden pro Woche gegenüber dem Ausgangswert (Studie 1)
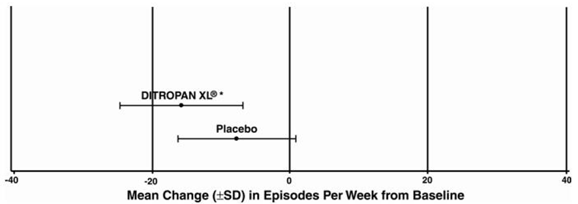
Abbildung 4: Mittlere Veränderung (±SD) der Dranginkontinenz-Episoden pro Woche gegenüber dem Ausgangswert (Studie 2)
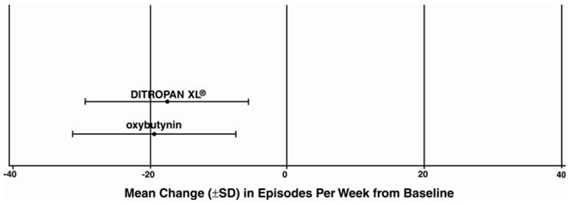
Abbildung 5: Mittlere Veränderung (±SD) der Dranginkontinenz-Episoden pro Woche gegenüber dem Ausgangswert (Studie 3)