Imdur 40mg, 20mg, 30mg, 60mg Isosorbide Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Imdur 30 mg und wie wird es angewendet?
Imdur 30 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Brustschmerzen (Angina pectoris). Imdur 30 mg kann allein oder mit anderen Medikamenten verwendet werden.
Imdur 20 mg gehört zu einer Klasse von Medikamenten namens Nitrate, Angina.
Es ist nicht bekannt, ob Imdur 60 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Imdur haben?
Zu den Nebenwirkungen von Imdur gehören:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Imdur 30 mg sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Imdur. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Isosorbidmononitrat (ISMN), ein organisches Nitrat und der wichtigste biologisch aktive Metabolit von Isosorbiddinitrat (ISDN), ist ein Vasodilatator mit Wirkungen auf Arterien und Venen.
IMDUR® Tabletten zur oralen Verabreichung enthalten entweder 30 mg, 60 mg oder 120 mg Isosorbidmononitrat in einer Formulierung mit verlängerter Freisetzung. Darüber hinaus enthält jede Tablette die folgenden Hilfsstoffe: kolloidales Siliciumdioxid, gehärtetes Rizinusöl, Hypromellose, Lactose-Monohydrat, Magnesiumstearat, mikrokristalline Cellulose und Talkum.
Die Summenformel von ISMN ist C6H9NO6 und das Molekulargewicht ist 191,14. Der chemische Name für ISMN ist 1,4:3,6-Dianhydro-,D-glucitol-5-nitrat; die Verbindung hat die folgende Strukturformel:
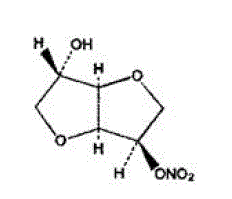
ISMN ist eine weiße, kristalline, geruchlose Verbindung, die an Luft und in Lösung stabil ist, einen Schmelzpunkt von etwa 90 °C und eine optische Drehung von +144 ° (2 % in Wasser, 20 °C) hat.
Isosorbidmononitrat ist in Wasser, Ethanol, Methanol, Chloroform, Ethylacetat und Dichlormethan frei löslich.
INDIKATIONEN
IMDUR-Tabletten sind angezeigt zur Vorbeugung von Angina pectoris aufgrund einer koronaren Herzkrankheit. Der Wirkungseintritt von oralem Isosorbidmononitrat ist nicht schnell genug, um dieses Produkt zum Abbruch einer akuten Angina pectoris-Episode zu verwenden.
DOSIERUNG UND ANWENDUNG
Die empfohlene Anfangsdosis von IMDUR-Tabletten beträgt 30 mg (gegeben als einzelne 30-mg-Tablette oder als 1/2 einer 60-mg-Tablette) oder 60 mg (gegeben als einzelne Tablette) einmal täglich. Nach einigen Tagen kann die Dosis auf 120 mg (als einzelne 120-mg-Tablette oder als zwei 60-mg-Tabletten) einmal täglich erhöht werden. Selten können 240 mg erforderlich sein. Die Tagesdosis von IMDUR Tabletten sollte morgens nach dem Aufstehen eingenommen werden. IMDUR Retardtabletten sollten nicht gekaut oder zerkleinert werden und zusammen mit einem halben Glas Flüssigkeit geschluckt werden. Zerbrechen Sie die 30-mg-Tablette nicht.
WIE GELIEFERT
IMDUR Retardtabletten 30 mg sind weiße, kapselförmige Tabletten mit Bruchkerbe auf einer Seite und der Prägung „IMDUR“ auf der Seite ohne Bruchkerbe. Sie werden wie folgt geliefert:
Flaschen zu 100 NDC 0085-1374-01
IMDUR Retardtabletten 60 mg sind weiße, kapselförmige Tabletten mit der Bruchkerbe „60-60“ auf einer Seite und der Prägung „IMDUR“ auf der Seite ohne Bruchkerbe. Sie werden wie folgt geliefert:
Flaschen zu 100 NDC 0085-2028-01
IMDUR 30 mg Retardtabletten 120 mg sind weiße, kapselförmige Tabletten mit der Prägung „IMDUR“ auf der einen Seite und „120“ auf der anderen Seite. Sie werden wie folgt geliefert:
Flaschen zu 100 NDC 0085-0091-01
Bei kontrollierter Raumtemperatur von 20°-25°C (68°-77°F) lagern [siehe USP].
Hergestellt von: Kremers Urban Pharmaceuticals Inc., Seymour,IN47274,USA. Überarbeitet: Dezember 2010
NEBENWIRKUNGEN
Die folgende Tabelle zeigt die Häufigkeiten der unerwünschten Ereignisse, die bei > 5 % der Patienten in drei placebokontrollierten nordamerikanischen Studien auftraten, in denen Patienten im aktiven Behandlungsarm 30 mg, 60 mg, 120 mg oder 240 mg Isosorbid erhielten Mononitrat als IMDUR 60 mg Tabletten einmal täglich. In Klammern zeigt dieselbe Tabelle die Häufigkeiten, mit denen diese unerwünschten Ereignisse mit dem Absetzen der Behandlung in Verbindung gebracht wurden. Insgesamt brachen 8 % der Patienten, die in den drei placebokontrollierten nordamerikanischen Studien 30 mg, 60 mg, 120 mg oder 240 mg Isosorbidmononitrat erhielten, die Behandlung wegen Nebenwirkungen ab. Die meisten davon brachen wegen Kopfschmerzen ab. Schwindel wurde selten mit dem Abbruch dieser Studien in Verbindung gebracht. Da Kopfschmerzen eine dosisabhängige Nebenwirkung zu sein scheinen und bei fortgesetzter Behandlung tendenziell verschwinden, wird empfohlen, die Behandlung mit IMDUR einige Tage lang in niedrigen Dosen zu beginnen, bevor sie auf das gewünschte Niveau gesteigert wird.
HÄUFIGKEIT UND NEBENWIRKUNGEN (EINGESTELLT) *
Darüber hinaus wurden die drei nordamerikanischen Studien mit 11 in Europa durchgeführten kontrollierten Studien gepoolt. In den 14 kontrollierten Studien wurden insgesamt 711 Patienten zu IMDUR-Tabletten randomisiert. Als die gepoolten Daten überprüft wurden, waren Kopfschmerzen und Schwindel die einzigen unerwünschten Ereignisse, die von > 5 % der Patienten berichtet wurden. Andere unerwünschte Ereignisse, die jeweils von ≤5 % der exponierten Patienten berichtet wurden und in vielen Fällen einen unsicheren Zusammenhang mit der Arzneimittelbehandlung hatten, waren:
Störungen des autonomen Nervensystems : Mundtrockenheit, Hitzewallungen.
Körper als Ganzes : Asthenie, Rückenschmerzen, Brustschmerzen, Ödeme, Müdigkeit, Fieber, grippeähnliche Symptome, Unwohlsein, Schüttelfrost.
Herz-Kreislauf-Erkrankungen, Allgemein : Herzinsuffizienz, Bluthochdruck, Hypotonie.
Erkrankungen des zentralen und peripheren Nervensystems : Schwindel, Kopfschmerzen, Hypästhesie, Migräne, Neuritis, Parese, Parästhesie, Ptosis, Tremor, Schwindel.
Störungen des Magen-Darm-Systems Bauchschmerzen, Verstopfung, Durchfall, Dyspepsie, Flatulenz, Magengeschwür, Gastritis, Glossitis, hämorrhagisches Magengeschwür, Hämorrhoiden, weicher Stuhl, Meläna, Übelkeit, Erbrechen.
Hör- und Gleichgewichtsstörungen : Ohrenschmerzen, Tinnitus, Perforation des Trommelfells.
Herzfrequenz- und Rhythmusstörungen : Arrhythmie, atriale Arrhythmie, Vorhofflimmern, Bradykardie, Schenkelblock, Extrasystole, Herzklopfen, Tachykardie, ventrikuläre Tachykardie.
Erkrankungen der Leber und des Gallensystems : SGOT-Erhöhung, SGPT-Erhöhung.
Stoffwechsel- und Ernährungsstörungen : Hyperurikämie, Hypokaliämie.
Erkrankungen des Bewegungsapparates : Arthralgie, Schultersteife, Muskelschwäche, Muskel-Skelett-Schmerzen, Myalgie, Myositis, Sehnenerkrankung, Torticollis.
Myo-, Endo-, Perikard- und Klappenerkrankungen : Verschlimmerung der Angina pectoris, Herzgeräusch, anormaler Herzton, Myokardinfarkt, anormale Q-Zacke.
Thrombozyten-, Blutungs- und Gerinnungsstörungen : Purpura, Thrombozytopenie.
Psychische Störungen Angst, Konzentrationsstörungen, Verwirrtheit, verminderte Libido, Depression, Impotenz, Schlaflosigkeit, Nervosität, Paronirie, Somnolenz.
Störung der roten Blutkörperchen : Hypochrome Anämie.
Fortpflanzungsstörungen, weiblich : Atrophische Vaginitis, Brustschmerzen.
Störungen des Widerstandsmechanismus : Bakterielle Infektion, Moniliasis, virale Infektion.
Erkrankungen der Atemwege : Bronchitis, Bronchospasmus, Husten, Dyspnoe, vermehrter Auswurf, verstopfte Nase, Pharyngitis, Lungenentzündung, Lungeninfiltration, Rasseln, Rhinitis, Sinusitis.
Erkrankungen der Haut und Anhängsel : Akne, anormale Haarstruktur, vermehrtes Schwitzen, Juckreiz, Hautausschlag, Hautknötchen.
Erkrankungen des Harnsystems : Polyurie, Nierenstein, Harnwegsinfektion.
Vaskuläre (extrakardiale) Erkrankungen : Flush, Claudicatio intermittens, Ulcus cruris, Krampfadern.
Sehstörungen : Konjunktivitis, Photophobie, Sehstörungen.
Darüber hinaus wurde während der Vermarktung von Isosorbidmononitrat über das folgende spontane unerwünschte Ereignis berichtet: Synkope.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Die gefäßerweiternden Wirkungen von Isosorbidmononitrat können sich mit denen anderer Vasodilatatoren addieren. Es wurde festgestellt, dass insbesondere Alkohol additive Wirkungen dieser Art aufweist.
Bei gleichzeitiger Anwendung von Calciumkanalblockern und organischen Nitraten wurde über ausgeprägte symptomatische orthostatische Hypotonie berichtet. Dosisanpassungen beider Wirkstoffklassen können erforderlich sein.
Arzneimittel-/Labortest-Wechselwirkungen
Nitrate und Nitrite können die Zlatkis-Zak-Farbreaktion stören und zu falsch niedrigen Messwerten bei Serumcholesterinbestimmungen führen.
WARNUNGEN
Eine Verstärkung der gefäßerweiternden Wirkung von IMDUR durch Sildenafil kann zu schwerer Hypotonie führen. Der zeitliche Verlauf und die Dosisabhängigkeit dieser Wechselwirkung wurden nicht untersucht. Eine angemessene unterstützende Behandlung wurde nicht untersucht, aber es erscheint vernünftig, dies als Nitrat-Überdosierung mit Anheben der Extremitäten und mit zentraler Volumenerweiterung zu behandeln.
Der Nutzen von ISMN bei Patienten mit akutem Myokardinfarkt oder dekompensierter Herzinsuffizienz wurde nicht nachgewiesen; Da die Wirkung von Isosorbidmononitrat schwer schnell zu beenden ist, wird dieses Medikament in diesen Situationen nicht empfohlen.
Wenn Isosorbidmononitrat unter diesen Bedingungen angewendet wird, muss eine sorgfältige klinische oder hämodynamische Überwachung erfolgen, um die Gefahren einer Hypotonie und Tachykardie zu vermeiden.
VORSICHTSMASSNAHMEN
Allgemein
Schwere Hypotonie, insbesondere bei aufrechter Körperhaltung, kann selbst bei geringen Dosen von Isosorbidmononitrat auftreten. Dieses Medikament sollte daher bei Patienten, die möglicherweise an Volumenmangel leiden oder die aus irgendeinem Grund bereits hypotensiv sind, mit Vorsicht angewendet werden. Eine durch Isosorbidmononitrat induzierte Hypotonie kann von paradoxer Bradykardie und verstärkter Angina pectoris begleitet sein.
Eine Nitrattherapie kann die durch hypertrophe Kardiomyopathie verursachte Angina verschlimmern.
Bei Industriearbeitern, die über längere Zeit unbekannten (vermutlich hohen) Dosen organischer Nitrate ausgesetzt waren, tritt eindeutig eine Toleranz auf. Schmerzen in der Brust, akuter Myokardinfarkt und sogar plötzlicher Tod sind während des vorübergehenden Entzugs von Nitraten bei diesen Arbeitern aufgetreten, was die Existenz einer echten körperlichen Abhängigkeit demonstriert. Die Bedeutung dieser Beobachtungen für die routinemäßige, klinische Anwendung von oralem Isosorbidmononitrat ist nicht bekannt.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Bei Ratten, die Isosorbidmononitrat in Dosen von bis zu 900 mg/kg/Tag in den ersten 6 Monaten und 500 mg/kg/Tag für die restliche Dauer einer Studie, in der männliche Tiere behandelt wurden, in ihrer Nahrung erhielten, wurden keine Hinweise auf Karzinogenität beobachtet für bis zu 121 Wochen und Frauen wurden für bis zu 137 Wochen dosiert. Bei Mäusen, die bis zu 104 Wochen lang Isosorbidmononitrat in Dosen von bis zu 900 mg/kg/Tag in ihrer Ernährung ausgesetzt waren, wurden keine Hinweise auf Karzinogenität beobachtet.
Isosorbidmononitrat verursachte in biologisch relevanten Konzentrationen keine Genmutationen (Ames-Test, Maus-Lymphom-Test) oder Chromosomenaberrationen (Human-Lymphozyten- und Maus-Mikronukleus-Test).
In einer Studie, in der männlichen und weiblichen Ratten Dosen von bis zu 750 mg/kg/Tag verabreicht wurden, wurden bei männlichen Ratten 9 Wochen vor der Paarung und bei weiblichen Ratten 2 Wochen vor der Paarung keine Auswirkungen auf die Fertilität beobachtet.
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie B
In Studien zum Nachweis von Wirkungen von Isosorbidmononitrat auf die embryofetale Entwicklung waren Dosen von bis zu 240 oder 248 mg/kg/Tag, die trächtigen Ratten und Kaninchen verabreicht wurden, nicht mit Hinweisen auf solche Wirkungen verbunden. Diese Tierdosen sind etwa das 100-fache der empfohlenen Höchstdosis beim Menschen (120 mg bei einer 50 kg schweren Frau), wenn der Vergleich auf dem Körpergewicht basiert; Wenn der Vergleich auf der Körperoberfläche basiert, beträgt die Rattendosis etwa das 17-fache der menschlichen Dosis und die Kaninchendosis etwa das 38-fache der menschlichen Dosis. Es gibt jedoch keine adäquaten und gut kontrollierten Studien bei Schwangeren. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollten IMDUR-Tabletten während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Nicht teratogene Wirkungen
Das Überleben und die Entwicklung von Neugeborenen sowie die Inzidenz von Totgeburten wurden negativ beeinflusst, wenn trächtigen Ratten während der späten Trächtigkeit und Laktation orale Dosen von 750 (aber nicht 300) mg Isosorbidmononitrat/kg/Tag verabreicht wurden. Diese Dosis (etwa das 312-fache der menschlichen Dosis beim Vergleich basierend auf dem Körpergewicht und das 54-fache der menschlichen Dosis beim Vergleich basierend auf der Körperoberfläche) war mit einer Abnahme der mütterlichen Gewichtszunahme und der motorischen Aktivität sowie Hinweisen auf eine beeinträchtigte Laktation verbunden.
Stillende Mutter
Es ist nicht bekannt, ob dieses Arzneimittel in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch ausgeschieden werden, ist Vorsicht geboten, wenn ISMN einer stillenden Mutter verabreicht wird.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von ISMN bei pädiatrischen Patienten wurde nicht nachgewiesen.
Geriatrische Verwendung
Klinische Studien mit IMDUR 60 mg Tabletten enthielten keine ausreichenden Informationen zu Patienten ab 65 Jahren, um festzustellen, ob sie anders ansprechen als jüngere Patienten. Andere berichtete klinische Erfahrungen mit IMDUR 20 mg haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Klinische Erfahrungen mit organischen Nitraten, die in der Literatur berichtet wurden, identifizierten ein Potenzial für schwere Hypotonie und erhöhte Empfindlichkeit gegenüber Nitraten bei älteren Menschen. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
Ältere Patienten können eine reduzierte Barorezeptorfunktion haben und eine schwere orthostatische Hypotonie entwickeln, wenn Vasodilatatoren verwendet werden. IMDUR 60 mg sollte daher bei älteren Patienten, die möglicherweise an Volumenmangel leiden, mehrere Medikamente einnehmen oder aus anderen Gründen bereits hypotensiv sind, mit Vorsicht angewendet werden. Eine durch Isosorbidmononitrat induzierte Hypotonie kann von paradoxer Bradykardie und verstärkter Angina pectoris begleitet sein.
Ältere Patienten können bei therapeutischen Dosen von Nitroglycerin anfälliger für Hypotonie sein und einem höheren Sturzrisiko ausgesetzt sein.
Eine Nitrattherapie kann die durch hypertrophe Kardiomyopathie verursachte Angina verschlimmern, insbesondere bei älteren Menschen.
ÜBERDOSIS
Hämodynamische Effekte
Die negativen Auswirkungen einer Überdosierung von Isosorbidmononitrat sind im Allgemeinen das Ergebnis der Fähigkeit von Isosorbidmononitrat, Vasodilatation, venöse Ansammlung, reduziertes Herzzeitvolumen und Hypotonie zu induzieren. Diese hämodynamischen Veränderungen können proteische Manifestationen haben, einschließlich erhöhtem Hirndruck, mit einigen oder allen anhaltenden pochenden Kopfschmerzen, Verwirrtheit und mäßigem Fieber; Schwindel, Herzklopfen; Sehstörungen; Übelkeit und Erbrechen (möglicherweise mit Koliken und sogar blutigem Durchfall); Synkope (insbesondere in aufrechter Haltung); Lufthunger und Dyspnoe, später gefolgt von reduzierter Atemanstrengung; Schwitzen, wobei die Haut entweder gerötet oder kalt und klamm ist; Herzblock und Bradykardie; Lähmung; Koma; Anfälle und Tod.
Laborbestimmungen der Serumspiegel von Isosorbidmononitrat und seinen Metaboliten sind nicht allgemein verfügbar, und solche Bestimmungen spielen jedenfalls keine etablierte Rolle bei der Behandlung einer Überdosierung von Isosorbidmononitrat.
Es liegen keine Daten vor, die darauf hindeuten, welche Dosis von Isosorbidmononitrat beim Menschen wahrscheinlich lebensbedrohlich ist. Bei Ratten und Mäusen besteht bei Dosen von 2000 mg/kg bzw. 3000 mg/kg eine signifikante Letalität.
Es liegen keine Daten vor, die auf physiologische Manöver hinweisen (z. B. Manöver zur Veränderung des pH-Werts des Urins), die die Elimination von Isosorbidmononitrat beschleunigen könnten. Insbesondere ist bekannt, dass die Dialyse bei der Entfernung von Isosorbidmononitrat aus dem Körper unwirksam ist.
Kein spezifischer Antagonist der gefäßerweiternden Wirkung von Isosorbidmononitrat bekannt und keine Intervention Es ist kein spezifischer Antagonist der vasodilatatorischen Wirkung von Isosorbidmononitrat bekannt und keine Intervention wurde Gegenstand einer kontrollierten Studie als Therapie einer Isosorbidmononitrat-Überdosierung. Da die mit einer Überdosierung von Isosorbidmononitrat verbundene Hypotonie das Ergebnis einer Venenerweiterung und einer arteriellen Hypovolämie ist, sollte eine umsichtige Therapie in dieser Situation auf eine Erhöhung des zentralen Flüssigkeitsvolumens ausgerichtet sein. Das passive Anheben der Beine des Patienten kann ausreichend sein, aber auch eine intravenöse Infusion von normaler Kochsalzlösung oder einer ähnlichen Flüssigkeit kann erforderlich sein.
Die Verwendung von Epinephrin oder anderen arteriellen Vasokonstriktoren in dieser Situation wird wahrscheinlich mehr schaden als nützen.
Bei Patienten mit Nierenerkrankungen oder dekompensierter Herzinsuffizienz ist eine Therapie, die zu einer zentralen Volumenexpansion führt, nicht ungefährlich. Die Behandlung einer Isosorbidmononitrat-Überdosis bei diesen Patienten kann subtil und schwierig sein, und es kann eine invasive Überwachung erforderlich sein.
Methämoglobinämie
Methämoglobinämie wurde bei Patienten berichtet, die andere organische Nitrate erhielten, und sie könnte wahrscheinlich auch als Nebenwirkung von Isosorbidmononitrat auftreten. Sicherlich können Nitrationen, die während des Metabolismus von Isosorbidmononitrat freigesetzt werden, Hämoglobin zu Methämoglobin oxidieren. Aber selbst bei Patienten ohne Cytochrom-b-Reduktase-Aktivität und selbst unter der Annahme, dass die Nitrateinheit von Isosorbidmononitrat quantitativ zur Oxidation von Hämoglobin eingesetzt wird, sollten etwa 2 mg/kg Isosorbidmononitrat erforderlich sein, bevor sich bei einem dieser Patienten klinisch signifikante Symptome zeigen ( ≥10 %) Methämoglobinämie. Bei Patienten mit normaler Reduktasefunktion sollte eine signifikante Produktion von Methämoglobin sogar noch höhere Dosen von Isosorbidmononitrat erfordern. In einer Studie, in der 36 Patienten 2-4 Wochen lang eine kontinuierliche Nitroglycerin-Therapie mit 3,1 bis 4,4 mg/h (entspricht in der verabreichten Gesamtdosis an Nitrationen 7,8-11,1 mg Isosorbidmononitrat pro Stunde) erhielten, lag der durchschnittliche Methämoglobinspiegel gemessen war 0,2 %; dies war vergleichbar mit dem, das bei Patienten beobachtet wurde, die gleichzeitig Placebo erhielten.
Ungeachtet dieser Beobachtungen gibt es Fallberichte über signifikante Methämoglobinämie in Verbindung mit mäßigen Überdosierungen von organischen Nitraten. Keiner der betroffenen Patienten wurde als ungewöhnlich anfällig angesehen.
Methämoglobinwerte sind in den meisten klinischen Labors erhältlich. Die Diagnose sollte bei Patienten vermutet werden, die trotz ausreichender Herzleistung und ausreichendem arteriellem pO2 Anzeichen einer beeinträchtigten Sauerstoffversorgung aufweisen. Klassischerweise wird methämoglobinämisches Blut als schokoladenbraun ohne Farbveränderung an der Luft beschrieben. Wenn eine Methämoglobinämie diagnostiziert wird, ist die Behandlung der Wahl Methylenblau, 1–2 mg/kg intravenös.
KONTRAINDIKATIONEN
IMDUR 20 mg Tabletten sind kontraindiziert bei Patienten, die Überempfindlichkeit oder idiosynkratische Reaktionen auf andere Nitrate oder Nitrite gezeigt haben.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Das IMDUR-Produkt ist eine orale Formulierung mit verlängerter Freisetzung von ISMN, dem wichtigsten aktiven Metaboliten von Isosorbiddinitrat; der größte Teil der klinischen Aktivität des Dinitrats ist dem Mononitrat zuzuschreiben.
Die hauptsächliche pharmakologische Wirkung von ISMN und allen organischen Nitraten im Allgemeinen ist die Entspannung der vaskulären glatten Muskulatur, wodurch eine Erweiterung der peripheren Arterien und Venen, insbesondere der letzteren, bewirkt wird. Die Dilatation der Venen fördert die periphere Ansammlung von Blut, verringert den venösen Rückfluss zum Herzen und verringert dadurch den linksventrikulären enddiastolischen Druck und den pulmonalen Kapillarkeildruck (Vorlast). Die arterioläre Entspannung reduziert den systemischen Gefäßwiderstand, den systolischen arteriellen Druck und den mittleren arteriellen Druck (Nachlast). Es kommt auch zu einer Dilatation der Koronararterien. Die relative Bedeutung von Vorlastreduktion, Nachlastreduktion und Koronardilatation bleibt undefiniert.
Pharmakodynamik
Die Dosierungsschemata für die meisten chronisch verwendeten Medikamente sind darauf ausgelegt, Plasmakonzentrationen bereitzustellen, die kontinuierlich größer als eine minimal wirksame Konzentration sind. Diese Strategie ist für organische Nitrate ungeeignet. Mehrere gut kontrollierte klinische Studien haben Belastungstests verwendet, um die antianginöse Wirksamkeit von kontinuierlich zugeführten Nitraten zu bewerten. In der großen Mehrheit dieser Studien waren die Wirkstoffe nach 24 Stunden (oder weniger) kontinuierlicher Therapie nicht von Placebo zu unterscheiden. Versuche, die Toleranz durch Dosiseskalation zu überwinden, sogar auf Dosen, die weit über den akut verwendeten Dosen liegen, sind durchweg gescheitert. Erst nach mehrstündiger Abwesenheit von Nitraten aus dem Körper ist ihre antianginöse Wirksamkeit wiederhergestellt. IMDUR-Tabletten verbesserten während der Langzeitanwendung über 42 Tage in einer Dosis von 120 mg einmal täglich die Trainingsleistung 4 Stunden und 12 Stunden nach der Einnahme, aber ihre Wirkungen (obwohl besser als Placebo) sind geringer oder bestenfalls gleich Wirkungen der ersten Dosis von 60 mg.
Pharmakokinetik und Stoffwechsel
Nach oraler Verabreichung von ISMN als Lösung oder Tabletten mit sofortiger Freisetzung werden maximale Plasmakonzentrationen von ISMN in 30 bis 60 Minuten erreicht, mit einer absoluten Bioverfügbarkeit von ungefähr 100 %. Nach intravenöser Verabreichung wird ISMN in etwa 9 Minuten mit einem Verteilungsvolumen von etwa 0,6–0,7 l/kg im gesamten Körperwasser verteilt. Isosorbidmononitrat ist zu etwa 5 % an menschliche Plasmaproteine gebunden und wird in Blutzellen und Speichel verteilt. Isosorbidmononitrat wird hauptsächlich von der Leber metabolisiert, unterliegt jedoch im Gegensatz zu oralem Isosorbiddinitrat keinem First-Pass-Metabolismus. Isosorbidmononitrat wird durch Denitrierung zu Isosorbid und Glucuronidierung als Mononitrat ausgeschieden, wobei 96 % der verabreichten Dosis innerhalb von 5 Tagen mit dem Urin ausgeschieden und nur etwa 1 % mit den Fäzes ausgeschieden werden. Mindestens sechs verschiedene Verbindungen wurden im Urin nachgewiesen, wobei etwa 2 % der Dosis als unveränderter Wirkstoff und mindestens fünf Metaboliten ausgeschieden werden. Die Metaboliten sind pharmakologisch nicht aktiv. Die renale Clearance macht nur etwa 4 % der Gesamtkörperclearance aus. Die mittlere Eliminationshalbwertszeit von ISMN aus dem Plasma beträgt etwa 5 Stunden.
Die ISMN-Disposition bei Patienten mit Niereninsuffizienz unterschiedlichen Grades, Leberzirrhose oder kardialer Dysfunktion wurde bewertet und als ähnlich zu der bei gesunden Probanden beobachteten befunden. Die Eliminationshalbwertszeit von ISMN war nicht verlängert und es kam zu keiner Arzneimittelakkumulation bei Patienten mit chronischer Niereninsuffizienz nach mehrfacher oraler Gabe.
Die Pharmakokinetik und/oder Bioverfügbarkeit von IMDUR 40 mg Tabletten wurde sowohl an gesunden Probanden als auch an Patienten nach Einzel- und Mehrfachgabe untersucht. Daten aus diesen Studien deuten darauf hin, dass die Pharmakokinetik von ISMN, das als IMDUR-Tabletten verabreicht wird, bei gesunden Probanden und Patienten mit Angina pectoris ähnlich ist. In Einzel- und Mehrfachdosisstudien war die Pharmakokinetik von ISMN zwischen 30 mg und 240 mg dosisproportional.
In einer Mehrfachdosisstudie wurde die Wirkung des Alters auf das pharmakokinetische Profil von IMDUR 60 mg und 120 mg (2 × 60 mg) bei Probanden ≥ 45 Jahre untersucht. Die Ergebnisse dieser Studie weisen darauf hin, dass es bei keiner der pharmakokinetischen Variablen von ISMN zwischen älteren (≥ 65 Jahre) und jüngeren Personen (45–64 Jahre) für die IMDUR-Dosis von 60 mg signifikante Unterschiede gibt. Die Verabreichung von IMDUR-Tabletten 120 mg (2 × 60-mg-Tabletten alle 24 Stunden über 7 Tage) führte zu einem dosisproportionalen Anstieg von Cmax und AUC, ohne Änderungen von Tmax oder der terminalen Halbwertszeit. Die ältere Gruppe (65–74 Jahre) zeigte nach der höheren Dosis, dh 120 mg, im Vergleich zur jüngeren Gruppe (45–64 Jahre) eine um 30 % niedrigere scheinbare orale Clearance (Cl/F); Cl/F war zwischen den beiden Gruppen nach dem 60-mg-Regime nicht unterschiedlich. Während Cl/F in der jüngeren Gruppe dosisunabhängig war, zeigte die ältere Gruppe nach dem 120-mg-Regime im Vergleich zum 60-mg-Regime ein etwas niedrigeres Cl/F. Unterschiede zwischen den beiden Altersgruppen waren jedoch statistisch nicht signifikant. In derselben Studie zeigten Frauen eine leichte (15 %) Verringerung der Clearance, wenn die Dosis erhöht wurde. Frauen zeigten höhere AUCs und Cmax im Vergleich zu Männern, aber diese Unterschiede wurden durch Unterschiede im Körpergewicht zwischen den beiden Gruppen erklärt. Als die Daten unter Verwendung des Alters als Variable analysiert wurden, zeigten die Ergebnisse, dass es bei keiner der pharmakokinetischen Variablen von ISMN signifikante Unterschiede zwischen älteren (≥65 Jahre) und jüngeren Personen (45-64 Jahre) gab. Die Ergebnisse dieser Studie sind jedoch aufgrund der geringen Probandenzahl in jeder Altersuntergruppe und damit der fehlenden statistischen Aussagekraft mit Vorsicht zu genießen.
Die folgende Tabelle fasst die wichtigsten pharmakokinetischen Parameter von ISMN nach Einzel- und Mehrfachgabe von ISMN als Lösung zum Einnehmen oder IMDUR-Tabletten zusammen:
Auswirkungen auf Lebensmittel
Der Einfluss von Nahrungsmitteln auf die Bioverfügbarkeit von ISMN nach Verabreichung einer Einzeldosis von IMDUR Tabletten 60 mg wurde in drei verschiedenen Studien mit entweder einem „leichten“ Frühstück oder einem kalorienreichen, fettreichen Frühstück untersucht. Die Ergebnisse dieser Studien weisen darauf hin, dass die gleichzeitige Nahrungsaufnahme die Geschwindigkeit (Erhöhung von Tmax), aber nicht das Ausmaß (AUC) der Resorption von ISMN verringern kann.
Klinische Versuche
Kontrollierte Studien mit IMDUR-Tabletten haben eine antianginöse Aktivität nach akuter und chronischer Dosierung gezeigt. Die Einnahme von IMDUR 40 mg Tabletten einmal täglich, eingenommen früh morgens nach dem Aufstehen, führte zu mindestens 12 Stunden antianginöser Aktivität.
In einer placebokontrollierten Parallelstudie wurden 30, 60, 120 und 240 mg IMDUR 60 mg Tabletten einmal täglich für bis zu 6 Wochen verabreicht. Vor der Randomisierung absolvierten alle Patienten eine 1- bis 3-wöchige einfach verblindete Placebo-Phase, um die Reaktion auf Nitrat und die Reproduzierbarkeit der Laufbandzeit insgesamt zu demonstrieren. An den Tagen 1, 7, 14, 28 und 42 der Doppelblindperiode wurden Belastungstoleranztests unter Verwendung des Bruce-Protokolls vor und 4 und 12 Stunden nach der morgendlichen Dosis durchgeführt. IMDUR 60 mg Tabletten mit 30 und 60 mg (nur Dosen, die akut bewertet wurden) zeigten 4 und 12 Stunden nach der Verabreichung der ersten Dosis eine signifikante Verlängerung der gesamten Laufbandzeit im Vergleich zu Placebo gegenüber dem Ausgangswert. An Tag 42 zeigte die 120- und 240-mg-Dosis von IMDUR 40-mg-Tabletten 4 und 12 Stunden nach der Einnahme eine signifikante Verlängerung der gesamten Laufbandzeit, aber an Tag 42 waren die 30- und 60-mg-Dosen nicht mehr von Placebo zu unterscheiden. Während der chronischen Dosierung wurde in keiner IMDUR-Behandlungsgruppe ein Rebound beobachtet.
Gepoolte Daten aus zwei anderen Studien, die IMDUR 40 mg Tabletten 60 mg einmal täglich, ISDN 30 mg QID und Placebo QID bei Patienten mit chronisch stabiler Angina pectoris unter Verwendung eines randomisierten, doppelblinden, dreifachen Crossover-Designs verglichen, ergaben statistisch signifikante Steigerungen der Belastungstoleranz Zeiten für IMDUR 20 mg Tabletten im Vergleich zu Placebo nach 4, 8 und 12 Stunden und zu ISDN nach 4 Stunden .
INFORMATIONEN ZUM PATIENTEN
Die Patienten sollten darüber aufgeklärt werden, dass die antianginöse Wirksamkeit von IMDUR 60 mg Tabletten aufrechterhalten werden kann, wenn das vorgeschriebene Dosierungsschema sorgfältig eingehalten wird. Bei den meisten Patienten kann dies erreicht werden, indem die Dosis beim Aufstehen eingenommen wird.
Wie bei anderen Nitraten wird die Behandlung mit Isosorbidmononitrat manchmal von täglichen Kopfschmerzen begleitet. Bei Patienten, die diese Kopfschmerzen bekommen, sind die Kopfschmerzen ein Marker für die Aktivität des Medikaments. Patienten sollten der Versuchung widerstehen, Kopfschmerzen zu vermeiden, indem sie das Behandlungsschema mit Isosorbidmononitrat ändern, da der Verlust der Kopfschmerzen mit einem gleichzeitigen Verlust der antianginösen Wirksamkeit einhergehen kann. Aspirin oder Paracetamol lindern oft erfolgreich Isosorbidmononitrat-induzierte Kopfschmerzen ohne nachteilige Wirkung auf die antianginöse Wirksamkeit von Isosorbidmononitrat.
Die Behandlung mit Isosorbidmononitrat kann mit Benommenheit beim Aufstehen verbunden sein, insbesondere direkt nach dem Aufstehen aus einer liegenden oder sitzenden Position. Dieser Effekt kann häufiger bei Patienten auftreten, die auch Alkohol konsumiert haben.