Behandlung von Schmerzen: Lioresal 10mg, 25mg Baclofen Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Lioresal 10 mg intrathekal und wie wird es angewendet?
Lioresal Intrathecal ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Spastik. Lioresal Intrathecal kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Lioresal Intrathecal gehört zu einer Klasse von Arzneimitteln, die Skelettmuskelrelaxanzien genannt werden.
Es ist nicht bekannt, ob Lioresal intrathekal bei Kindern unter 12 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Lioresal 25 mg intrathekal haben?
Lioresal 10 mg intrathekal kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Lioresal 25 mg intrathekal gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Lioresal Intrathecal. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Das abrupte Absetzen von intrathekalem Baclofen, unabhängig von der Ursache, hat zu Folgeerscheinungen geführt, die hohes Fieber, veränderten Geisteszustand, übertriebene Rebound-Spastik und Muskelrigidität umfassen, die in seltenen Fällen zu Rhabdomyolyse, multiplem Organsystemversagen und Tod führen können.
Um ein abruptes Absetzen von intrathekalem Baclofen zu verhindern, müssen Programmierung und Überwachung des Infusionssystems, Nachfüllplanung und -verfahren sowie Pumpenalarme sorgfältig beachtet werden. Patienten und Betreuer sollten auf die Wichtigkeit der Einhaltung geplanter Nachfülltermine hingewiesen und über die frühen Symptome eines Baclofen-Entzugs aufgeklärt werden. Patienten mit offensichtlichem Risiko (z. B. Rückenmarksverletzungen bei T-6 oder höher, Kommunikationsschwierigkeiten, Vorgeschichte von Entzugserscheinungen von oralem oder intrathekalem Baclofen) sollte besondere Aufmerksamkeit geschenkt werden. Weitere Informationen für Kliniker und Patienten nach der Implantation finden Sie im technischen Handbuch des implantierbaren Infusionssystems (siehe WARNUNGEN ).
BEZEICHNUNG
LIORESAL INTRATHECAL (Baclofen-Injektion) wirkt muskelentspannend und antispastisch. Sein chemischer Name ist 4-Amino-3-(4-chlorphenyl)butansäure und seine Strukturformel ist:
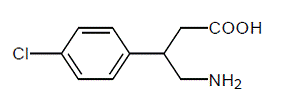
Baclofen ist ein weißes bis cremefarbenes, geruchloses oder praktisch geruchloses kristallines Pulver mit einem Molekulargewicht von 213,66. Es ist leicht löslich in Wasser, sehr leicht löslich in Methanol und unlöslich in Chloroform.
LIORESAL INTRATHECAL ist eine sterile, pyrogenfreie, isotonische Lösung ohne Antioxidantien, Konservierungsstoffe oder andere potenziell neurotoxische Zusätze, die nur zur intrathekalen Verabreichung angezeigt ist. Das Medikament ist in Lösung bei 37 °C stabil und mit CSF kompatibel. Jeder Milliliter LIORESAL INTRATHECAL enthält Baclofen USP 50 µg, 500 µg oder 2000 µg und Natriumchlorid 9 mg in Wasser für Injektionszwecke; Der pH-Bereich liegt zwischen 5,0 und 7,0. Jede Ampulle ist NUR ZUM EINMALIGEN GEBRAUCH bestimmt. Verwerfen Sie alle nicht verwendeten Teile. NICHT AUTOKLAVIEREN.
INDIKATIONEN
LIORESAL 10 mg INTRATHEKAL (Baclofen-Injektion) ist zur Anwendung bei der Behandlung schwerer Spastik indiziert. Patienten sollten zunächst auf eine Screening-Dosis von intrathekalem Baclofen ansprechen, bevor eine Langzeitinfusion über eine implantierbare Pumpe in Betracht gezogen wird. Bei Rückenmarksspastik sollte die chronische Infusion von LIORESAL INTRATHECAL über eine implantierbare Pumpe Patienten vorbehalten bleiben, die auf eine orale Baclofen-Therapie nicht ansprechen oder bei denen bei wirksamen Dosen nicht tolerierbare ZNS-Nebenwirkungen auftreten. Patienten mit Spastik aufgrund eines Schädel-Hirn-Traumas sollten mindestens ein Jahr nach der Verletzung warten, bevor sie eine langfristige intrathekale Baclofen-Therapie in Betracht ziehen. LIORESAL INTRATHECAL ist für die intrathekale Anwendung in einzelnen Bolus-Testdosen (über Spinalkatheter oder Lumbalpunktion) und für die chronische Anwendung nur in implantierbaren Pumpen vorgesehen, die von der FDA speziell für die Verabreichung von LIORESAL INTRATHECAL in den intrathekalen Raum zugelassen sind.
Spastizität des Rückenmarks
Belege für die Wirksamkeit von LIORESAL INTRATHECAL wurden in randomisierten, kontrollierten Untersuchungen erhalten, in denen die Wirkungen entweder einer intrathekalen Einzeldosis oder einer dreitägigen intrathekalen Infusion von LIORESAL INTRATHECAL mit Placebo bei Patienten mit schwerer Spastik und Spasmen aufgrund eines oder mehrerer Rückenmarkstraumata verglichen wurden Sklerose. LIORESAL 10 mg INTRATHECAL war dem Placebo bei beiden Hauptzielparametern überlegen: Veränderung gegenüber dem Ausgangswert in der Ashworth-Einstufung der Spastik und der Häufigkeit von Spasmen.
Spastik zerebralen Ursprungs
Die Wirksamkeit von LIORESAL INTRATHECAL wurde in drei kontrollierten klinischen Studien untersucht; zwei aufgenommene Patienten mit Zerebralparese und ein aufgenommener Patient mit Spastik aufgrund einer früheren Hirnverletzung. Die erste Studie, eine randomisierte, kontrollierte Crossover-Studie mit 51 Patienten mit Zerebralparese, lieferte starke, statistisch signifikante Ergebnisse; LIORESAL INTRATHECAL war dem Placebo bei der Verringerung der Spastik, gemessen anhand der Ashworth-Skala, überlegen. Eine zweite Crossover-Studie wurde bei 11 Patienten mit Spastik infolge einer Hirnverletzung durchgeführt. Trotz der kleinen Stichprobengröße ergab die Studie eine nahezu signifikante Teststatistik (p = 0,066) und lieferte richtungsweisende günstige Ergebnisse. Die letzte Studie lieferte jedoch keine verlässlich auswertbaren Daten.
Die Therapie mit LIORESAL 10 mg INTRATHEKAL kann als Alternative zu destruktiven neurochirurgischen Eingriffen angesehen werden. Vor der Implantation eines Geräts zur chronischen intrathekalen Infusion von LIORESAL 10 mg INTRATHEKAL müssen die Patienten in einer Screening-Studie auf LIORESAL 10 mg INTRATHEKAL ansprechen (siehe DOSIERUNG UND ANWENDUNG ).
DOSIERUNG UND ANWENDUNG
Spezifische Anweisungen und Vorsichtsmaßnahmen für die Programmierung der Pumpe und/oder das Nachfüllen des Reservoirs finden Sie im Handbuch des Herstellers der implantierbaren Pumpe, die für die intrathekale Infusion zugelassen ist. Es gibt verschiedene Pumpen mit unterschiedlichen Reservoirvolumina und verschiedene Nachfüllsets. Es ist wichtig, mit all diesen Produkten vertraut zu sein, um das geeignete Nachfüllset für die jeweils verwendete Pumpe auszuwählen.
Screening-Phase
Vor der Pumpenimplantation und dem Beginn einer chronischen Infusion von LIORESAL INTRATHECAL (Baclofen-Injektion) müssen die Patienten ein positives klinisches Ansprechen auf eine intrathekal verabreichte Bolusdosis von LIORESAL INTRATHECAL in einer Screening-Studie zeigen. Die Screening-Studie verwendet LIORESAL INTRATHECAL in einer Konzentration von 50 mcg/ml. Zur Verwendung in der Screening-Studie ist eine 1-ml-Ampulle (50 mcg/ml) erhältlich. Das Screening-Verfahren ist wie folgt. Ein anfänglicher Bolus mit 50 Mikrogramm in einem Volumen von 1 Milliliter wird durch Barbotage über einen Zeitraum von mindestens einer Minute in den intrathekalen Raum verabreicht. Der Patient wird während der folgenden 4 bis 8 Stunden beobachtet. Eine positive Reaktion besteht aus einer signifikanten Abnahme des Muskeltonus und/oder der Häufigkeit und/oder Schwere der Spasmen. Wenn die anfängliche Reaktion geringer als erwünscht ist, kann 24 Stunden nach der ersten eine zweite Bolusinjektion verabreicht werden. Die zweite Screening-Bolusdosis besteht aus 75 Mikrogramm in 1,5 Millilitern. Auch hier sollte der Patient für ein Intervall von 4 bis 8 Stunden beobachtet werden. Wenn das Ansprechen immer noch unzureichend ist, kann 24 Stunden später eine letzte Screening-Bolusdosis von 100 Mikrogramm in 2 Milliliter verabreicht werden.
Pädiatrische Patienten
Die anfängliche Screening-Dosis für pädiatrische Patienten ist die gleiche wie für erwachsene Patienten, dh 50 Mikrogramm. Bei sehr kleinen Patienten kann jedoch zunächst eine Screening-Dosis von 25 µg versucht werden. Patienten, die auf einen intrathekalen Bolus von 100 mcg nicht ansprechen, sollten nicht als Kandidaten für eine implantierte Pumpe zur chronischen Infusion angesehen werden.
Dosistitrationszeitraum nach der Implantation
Um die anfängliche Gesamttagesdosis von LIORESAL INTRATHECAL nach der Implantation zu bestimmen, sollte die Screening-Dosis, die eine positive Wirkung zeigte, verdoppelt und über einen Zeitraum von 24 Stunden verabreicht werden, es sei denn, die Wirksamkeit der Bolusdosis wurde länger als 8 Stunden aufrechterhalten In diesem Fall sollte die tägliche Anfangsdosis die Screening-Dosis sein, die über einen Zeitraum von 24 Stunden verabreicht wird. In den ersten 24 Stunden (dh bis zum Erreichen des Steady State) sollte keine Dosiserhöhung erfolgen.
Erwachsene Patienten mit Spastizität des Rückenmarks
Nach den ersten 24 Stunden sollte bei erwachsenen Patienten die Tagesdosis langsam in Schritten von 10-30 % und nur einmal alle 24 Stunden erhöht werden, bis die gewünschte klinische Wirkung erreicht ist.
Erwachsene Patienten mit Spastizität zerebralen Ursprungs
Nach den ersten 24 Stunden sollte die Tagesdosis nur einmal alle 24 Stunden langsam um 5-15 % erhöht werden, bis die gewünschte klinische Wirkung erreicht ist.
Pädiatrische Patienten
Nach den ersten 24 Stunden sollte die Tagesdosis nur einmal alle 24 Stunden langsam um 5-15 % erhöht werden, bis die gewünschte klinische Wirkung erreicht ist. Wenn keine deutliche klinische Reaktion auf Erhöhungen der Tagesdosis eintritt, überprüfen Sie die ordnungsgemäße Funktion der Pumpe und die Durchgängigkeit des Katheters. Die Patienten müssen während der Screening-Phase und der Phase der Dosistitration unmittelbar nach der Implantation in einer voll ausgestatteten und mit Personal ausgestatteten Umgebung engmaschig überwacht werden. Bei lebensbedrohlichen oder nicht tolerierbaren Nebenwirkungen sollte ein Wiederbelebungsgerät sofort einsatzbereit sein.
Erhaltungstherapie
Spastizität von Patienten mit Ursprung im Rückenmark
Das klinische Ziel ist es, den Muskeltonus so nah wie möglich am Normalzustand zu halten und die Häufigkeit und Schwere von Krämpfen so weit wie möglich zu minimieren, ohne unerträgliche Nebenwirkungen hervorzurufen. Sehr oft muss die Erhaltungsdosis in den ersten Monaten der Therapie angepasst werden, während sich die Patienten aufgrund der Linderung der Spastik an Veränderungen im Lebensstil gewöhnen. Bei regelmäßigen Nachfüllungen der Pumpe kann die Tagesdosis um 10-40 %, jedoch nicht um mehr als 40 % erhöht werden, um eine angemessene Symptomkontrolle aufrechtzuerhalten. Die Tagesdosis kann um 10-20 % reduziert werden, wenn bei Patienten Nebenwirkungen auftreten. Die meisten Patienten benötigen im Laufe der Zeit allmähliche Dosissteigerungen, um während einer Dauertherapie ein optimales Ansprechen aufrechtzuerhalten. Eine plötzliche große Notwendigkeit für eine Dosissteigerung deutet auf eine Katheterkomplikation hin (dh Katheterknick oder Dislokation).
Die Erhaltungsdosis für die kontinuierliche Langzeitinfusion von LIORESAL 10 mg INTRATHEKAL (Baclofen-Injektion) reicht von 12 Mikrogramm/Tag bis 2003 Mikrogramm/Tag, wobei die meisten Patienten mit 300 Mikrogramm bis 800 Mikrogramm pro Tag angemessen versorgt werden. Es liegen nur begrenzte Erfahrungen mit Tagesdosen von mehr als 1000 µg/Tag vor. Die Bestimmung der optimalen Dosis von LIORESAL INTRATHECAL erfordert eine individuelle Titration. Es sollte die niedrigste Dosis mit optimalem Ansprechen verwendet werden.
Patienten mit Spastizität zerebralen Ursprungs
Das klinische Ziel besteht darin, den Muskeltonus so nah wie möglich am Normalzustand zu halten und die Häufigkeit und Schwere von Krämpfen so weit wie möglich zu minimieren, ohne unerträgliche Nebenwirkungen hervorzurufen, oder die Dosis auf den gewünschten Grad an Muskeltonus für optimale Funktionen zu titrieren. Sehr oft muss die Erhaltungsdosis in den ersten Monaten der Therapie angepasst werden, während sich die Patienten aufgrund der Linderung der Spastik an Veränderungen im Lebensstil gewöhnen. Bei regelmäßigen Nachfüllungen der Pumpe kann die Tagesdosis um 5-20 %, jedoch nicht um mehr als 20 % erhöht werden, um eine angemessene Symptomkontrolle aufrechtzuerhalten. Die Tagesdosis kann um 10-20 % reduziert werden, wenn bei Patienten Nebenwirkungen auftreten. Viele Patienten benötigen im Laufe der Zeit allmähliche Dosissteigerungen, um während einer chronischen Therapie ein optimales Ansprechen aufrechtzuerhalten. Eine plötzliche große Notwendigkeit für eine Dosissteigerung deutet auf eine Katheterkomplikation hin (dh Katheterknick oder Dislokation).
Die Erhaltungsdosis für die kontinuierliche Langzeitinfusion von LIORESAL 25 mg INTRATHEKAL (Baclofen-Injektion) reicht von 22 Mikrogramm/Tag bis 1400 Mikrogramm/Tag, wobei die meisten Patienten mit 90 Mikrogramm bis 703 Mikrogramm pro Tag angemessen versorgt werden. In klinischen Studien benötigten nur 3 von 150 Patienten Tagesdosen von mehr als 1000 mcg/Tag.
Pädiatrische Patienten
Verwenden Sie dieselben Dosierungsempfehlungen für Patienten mit Spastik zerebralen Ursprungs. Pädiatrische Patienten unter 12 Jahren schienen in klinischen Studien eine niedrigere Tagesdosis zu benötigen. Die durchschnittliche Tagesdosis für Patienten unter 12 Jahren betrug 274 Mikrogramm/Tag, mit einem Bereich von 24 bis 1199 Mikrogramm/Tag. Die Dosierungsanforderungen für pädiatrische Patienten über 12 Jahre scheinen sich nicht von denen für erwachsene Patienten zu unterscheiden. Die Bestimmung der optimalen Dosis von LIORESAL INTRATHECAL erfordert eine individuelle Titration. Es sollte die niedrigste Dosis mit optimalem Ansprechen verwendet werden.
Mögliche Notwendigkeit von Dosisanpassungen bei chronischer Anwendung
Während der Langzeitbehandlung werden etwa 5 % (28/627) der Patienten gegenüber steigenden Dosen refraktär. Es gibt nicht genügend Erfahrung, um konkrete Empfehlungen für eine Toleranzbehandlung zu geben; Diese „Toleranz“ wurde jedoch gelegentlich im Krankenhaus durch eine „Arzneimittelpause“ behandelt, die aus der schrittweisen Reduzierung von LIORESAL 25 mg INTRATHEKAL über einen Zeitraum von 2 bis 4 Wochen und dem Wechsel zu alternativen Methoden zur Spastikbehandlung bestand. Nach der „Arzneimittelpause“ kann LIORESAL INTRATHECAL mit der anfänglichen kontinuierlichen Infusionsdosis wieder aufgenommen werden.
Stabilität
Parenterale Arzneimittel sollten vor der Verabreichung auf Partikel und Verfärbungen untersucht werden, sofern Lösung und Behältnis dies zulassen.
Lieferspezifikationen
Die spezifische Konzentration, die verwendet werden sollte, hängt von der erforderlichen Gesamttagesdosis sowie der Abgaberate der Pumpe ab. LIORESAL 10 mg INTRATHEKAL muss möglicherweise verdünnt werden, wenn es mit bestimmten implantierbaren Pumpen verwendet wird. Konsultieren Sie bitte das Handbuch des Herstellers für spezifische Empfehlungen.
Vorbereitungsanweisung
Screening
Verwenden Sie nur die 1-ml-Screening-Ampulle (50 mcg/ml) für die Bolusinjektion in den Subarachnoidalraum. Verwenden Sie für eine Bolusdosis von 50 µg 1 ml der Screening-Ampulle. Verwenden Sie 1,5 ml einer 50-mcg/ml-Baclofen-Injektion für eine 75-mcg-Bolusdosis. Verwenden Sie für die maximale Screening-Dosis von 100 µg 2 ml einer 50 µg/ml Baclofen-Injektion (2 Screening-Ampullen).
Wartung
Für Patienten, die andere Konzentrationen als 500 µg/ml oder 2000 µg/ml benötigen, LIORESAL INTRATHECAL muss verdünnt werden .
LIORESAL 10 mg INTRATHEKAL muss verdünnt werden mit sterilem, konservierungsmittelfreiem Natriumchlorid zur Injektion, USP
Lieferschema
LIORESAL 10 mg INTRATHEKAL wird am häufigsten unmittelbar nach der Implantation in Form einer kontinuierlichen Infusion verabreicht. Bei Patienten mit implantierten programmierbaren Pumpen, die eine relativ zufriedenstellende Kontrolle bei kontinuierlicher Infusion erreicht haben, kann ein weiterer Nutzen erzielt werden, wenn komplexere Schemata der intrathekalen Verabreichung von LIORESAL verwendet werden. Patienten mit vermehrten nächtlichen Krämpfen können beispielsweise eine Erhöhung ihrer stündlichen Infusionsrate um 20 % benötigen. Änderungen der Flussrate sollten so programmiert werden, dass sie zwei Stunden vor dem Zeitpunkt der gewünschten klinischen Wirkung beginnen.
WIE GELIEFERT
LIORESAL INTRATHECAL (Baclofen-Injektion) ist in Ampullen zum einmaligen Gebrauch mit 0,05 mg/1 ml (50 mcg/ml), 10 mg/20 ml (500 mcg/ml), 10 mg/5 ml (2000 mcg/ml) oder 40 mg/20 ml ( 2000 mcg/ml) wie folgt geliefert:
Screening-Dosis (Modell 8563s): fünf Ampullen mit jeweils 0,05 mg/1 ml (50 mcg/ml) ( NDC 70257-562-55).
LIORESAL INTRATHECAL (Baclofen-Injektion) Nachfüllsets Jedes Nachfüllset enthält die angegebene Menge LIORESAL INTRATHECAL, ein Arzneimittelzubereitungsset, ein Pumpennachfüllset mit Zubehör, das mit Medtronic SynchroMed® Infusionssystemen kompatibel ist, und zugehörige Anweisungen.
Modell 8561 : eine Ampulle mit 10 mg/20 ml (500 mcg/ml) ( NDC 70257-560-01).
Modell 8562 : zwei Ampullen, jede enthält 10 mg/5 ml (2000 mcg/ml) ( NDC 70257-561-02).
Modell 8564 : eine Ampulle mit 40 mg/20 ml (2000 mcg/ml) ( NDC 70257-563-01).
Modell 8565 : zwei Ampullen, jede enthält 10 mg/20 ml (500 mcg/ml) ( NDC 70257-560-02).
Modell 8566 : zwei Ampullen, jede enthält 40 mg/20 ml (2000 mcg/ml) ( NDC 70257-563-02).
Lagerung
Benötigt keine Kühlung.
Nicht über 30 °C (86 °F) lagern.
Nicht einfrieren.
Nicht hitzesterilisieren.
Vertrieb durch: Saol Therapeutics Inc. Saol Therapeutics Inc., Roswell, GA 30076. Überarbeitet: Januar 2019
NEBENWIRKUNGEN
Spastizität des Rückenmarks - Klinische Studien
Wird häufig bei Patienten mit Spastizität spinalen Ursprungs beobachtet
In klinischen Studien vor und nach der Markteinführung waren die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von LIORESAL 25 mg INTRATHEKAL (Baclofen-Injektion), die bei mit Placebo behandelten Patienten nicht in gleicher Häufigkeit beobachtet wurden: Somnolenz, Schwindel, Übelkeit, Hypotonie, Kopfschmerzen, Krämpfe und Hypotonie.
Im Zusammenhang mit dem Absetzen der Behandlung
8/474 Patienten mit Rückenmarksspastik, die in klinischen Studien vor und nach der Markteinführung in den USA eine Langzeitinfusion von 25 mg LIORESAL INTRATHEKAL erhielten, brachen die Behandlung aufgrund von Nebenwirkungen ab. Dazu gehören: Pumpentascheninfektionen (3), Meningitis (2), Wunddehiszenz (1), gynäkologische Myome (1) und Pumpenüberdruck (1) mit unbekannten, wenn überhaupt, Folgen. Bei elf Patienten, die infolge einer Überdosierung ein Koma entwickelten, wurde die Behandlung vorübergehend ausgesetzt, aber alle wurden anschließend wieder aufgenommen und wurden daher nicht als echte Unterbrechungen betrachtet.
Todesfälle
Sehen WARNUNGEN .
Inzidenz in kontrollierten Studien
Erfahrungen mit LIORESAL INTRATHECAL (Baclofen-Injektion) aus parallelen, placebokontrollierten, randomisierten Studien bieten nur eine begrenzte Grundlage für die Abschätzung der Häufigkeit von Nebenwirkungen, da die Studien von sehr kurzer Dauer waren (bis zu drei Tage Infusion) und nur a insgesamt 63 Patienten. Die folgenden Ereignisse traten bei den 31 Patienten auf, die LIORESAL INTRATHECAL (Baclofen-Injektion) in zwei randomisierten, placebokontrollierten Studien erhielten: Hypotonie (2), Schwindel (2), Kopfschmerzen (2), Dyspnoe (1). Bei den 32 Patienten, die in diesen Studien Placebo erhielten, wurden keine unerwünschten Ereignisse berichtet.
Ereignisse, die während der Bewertung vor und nach der Markteinführung von LIORESAL INTRATHECAL beobachtet wurden
Unerwünschte Ereignisse im Zusammenhang mit der Anwendung von LIORESAL 25 mg INTRATHEKAL spiegeln Erfahrungen wider, die bei 576 Patienten gesammelt wurden, die prospektiv in den Vereinigten Staaten nachbeobachtet wurden. Sie erhielten LIORESAL INTRATHECAL für Zeiträume von einem Tag (Screening) (N = 576) bis über acht Jahre (Erhaltungstherapie) (N = 10). Die übliche Screening-Bolusdosis, die in diesen Studien vor der Pumpenimplantation verabreicht wurde, betrug typischerweise 50 mcg. Die Erhaltungsdosis reichte von 12 µg bis 2003 µg pro Tag. Aufgrund der offenen, unkontrollierten Art der Erfahrung kann ein kausaler Zusammenhang zwischen den beobachteten Ereignissen und der Verabreichung von LIORESAL INTRATHECAL in vielen Fällen nicht zuverlässig beurteilt werden, und viele der berichteten unerwünschten Ereignisse treten bekanntermaßen im Zusammenhang mit den behandelten Grunderkrankungen auf. Dennoch scheinen viele der häufiger berichteten Reaktionen – Hypotonie, Schläfrigkeit, Schwindel, Parästhesien, Übelkeit/Erbrechen und Kopfschmerzen – eindeutig mit dem Arzneimittel in Zusammenhang zu stehen.
Unerwünschte Erfahrungen, die während aller US-Studien (sowohl kontrollierte als auch unkontrollierte) berichtet wurden, sind in der folgenden Tabelle aufgeführt. Acht von 474 Patienten, die eine chronische Infusion über implantierte Pumpen erhielten, hatten Nebenwirkungen, die in den Studien vor und nach der Markteinführung zu einem Abbruch der Langzeitbehandlung führten.
AUFFÄLLE DER HÄUFIGSTEN (≥1 %) NEBENWIRKUNGEN BEI PATIENTEN MIT SPASTIK URSACHENS DER WIRBELSÄULE IN PROSPEKTIV ÜBERWACHTEN KLINISCHEN STUDIEN
Zusätzlich zu den häufigeren (1 % oder mehr) unerwünschten Ereignissen, die bei den prospektiv nachverfolgten 576 inländischen Patienten in Studien vor und nach der Markteinführung berichtet wurden, liegen Erfahrungen von weiteren 194 Patienten, die mit LIORESAL 25 mg INTRATHEKAL (Baclofen-Injektion) behandelt wurden, aus ausländischen Studien vor gemeldet worden. Die folgenden unerwünschten Ereignisse, die nicht in der Tabelle beschrieben und nach absteigender Häufigkeit geordnet und nach Körpersystemen klassifiziert wurden, wurden berichtet:
Nervöses System: Abnormaler Gang, abnormes Denken, Tremor, Amnesie, Zuckungen, Vasodilatation, Schlaganfall, Nystagmus, Persönlichkeitsstörung, psychotische Depression, zerebrale Ischämie, emotionale Labilität, Euphorie, Hypertonie, Ileus, Drogenabhängigkeit, Koordinationsstörungen, paranoide Reaktion und Ptosis.
Verdauungstrakt: Blähungen, Dysphagie, Dyspepsie und Gastroenteritis.
Herz-Kreislauf: Orthostatische Hypotonie, Bradykardie, Herzklopfen, Synkope, ventrikuläre Arrhythmie, tiefe Thrombophlebitis, Blässe und Tachykardie.
Atmung: Atemstörung, Aspirationspneumonie, Hyperventilation, Lungenembolie und Rhinitis.
Urogenital: Hämaturie und Nierenversagen.
Haut und Anhängsel: Alopezie und Schwitzen.
Stoffwechsel- und Ernährungsstörungen: Gewichtsverlust, Albuminurie, Dehydratation und Hyperglykämie.
Besondere Sinne: Sehstörungen, Akkommodationsstörungen, Photophobie, Geschmacksverlust und Tinnitus.
Körper als Ganzes: Selbstmord, fehlende Arzneimittelwirkung, Bauchschmerzen, Unterkühlung, Nackensteifigkeit, Brustschmerzen, Schüttelfrost, Gesichtsödeme, Grippesyndrom und Überdosierung.
Hämisches und lymphatisches System: Anämie.
Spastik zerebralen Ursprungs – Klinische Studien
Häufig beobachtet
In klinischen Studien vor der Markteinführung waren die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von LIORESAL 25 mg INTRATHEKAL (Baclofen-Injektion), die bei mit Placebo behandelten Patienten nicht in gleicher Häufigkeit auftraten: Agitiertheit, Verstopfung, Somnolenz, Leukozytose, Schüttelfrost, Harndrang Retention und Hypotonie.
Im Zusammenhang mit dem Absetzen der Behandlung
Neun von 211 Patienten, die LIORESAL INTRATHECAL in klinischen Studien vor der Markteinführung in den USA erhielten, brachen die Langzeitinfusion aufgrund von Nebenwirkungen im Zusammenhang mit der intrathekalen Therapie ab.
Die neun unerwünschten Ereignisse, die zum Absetzen führten, waren: Infektion (3), Liquorlecks (2), Meningitis (2), Drainage (1) und unkontrollierbare Rumpfkontrolle (1).
Todesfälle
Drei Todesfälle, von denen keiner LIORESAL 10 mg INTRATHEKAL zugeschrieben wurde, wurden bei Patienten in klinischen Studien mit Patienten mit Spastik zerebralen Ursprungs berichtet. Sehen Warnungen zu anderen Todesfällen, die bei Patienten mit spinaler Spastik berichtet wurden .
Inzidenz in kontrollierten Studien
Erfahrungen mit LIORESAL INTRATHECAL (Baclofen-Injektion) aus parallelen, placebokontrollierten, randomisierten Studien bieten nur eine begrenzte Grundlage für die Abschätzung der Häufigkeit von Nebenwirkungen, da an den Studien insgesamt 62 Patienten teilnahmen, denen ein intrathekaler Einzelbolus von 50 µg verabreicht wurde. Die folgenden Ereignisse traten bei den 62 Patienten auf, die LIORESAL 10 mg INTRATHEKAL in zwei randomisierten, placebokontrollierten Studien mit Patienten mit Zerebralparese bzw. Kopfverletzung erhielten: Agitiertheit, Verstopfung, Somnolenz, Leukozytose, Übelkeit, Erbrechen, Nystagmus, Schüttelfrost, Harnverhalt und Hypotonie.
Ereignisse, die während der Pre-Marketing-Evaluierung von LIORESAL 25 mg INTRATHECAL beobachtet wurden
Unerwünschte Ereignisse im Zusammenhang mit der Anwendung von LIORESAL INTRATHECAL spiegeln Erfahrungen wider, die bei insgesamt 211 US-amerikanischen Patienten mit Spastik zerebralen Ursprungs gesammelt wurden, von denen 112 pädiatrische Patienten (unter 16 Jahren bei Aufnahme) waren. Sie erhielten LIORESAL INTRATHECAL für Zeiträume von einem Tag (Screening) (N = 211) bis 84 Monate (Erhaltungstherapie) (N = 1). Die übliche Screening-Bolusdosis, die in diesen Studien vor der Pumpenimplantation verabreicht wurde, betrug 50–75 mcg. Die Erhaltungsdosis lag zwischen 22 µg und 1400 µg pro Tag. Die Dosen, die bei dieser Patientenpopulation für Langzeitinfusionen verwendet werden, sind im Allgemeinen niedriger als die, die für Patienten mit Rückenmarksspastik erforderlich sind.
Aufgrund der offenen, unkontrollierten Art der Erfahrung kann ein kausaler Zusammenhang zwischen beobachteten Ereignissen und der Verabreichung von LIORESAL INTRATHECAL in vielen Fällen nicht zuverlässig beurteilt werden. Dennoch scheinen viele der häufiger berichteten Reaktionen – Schläfrigkeit, Schwindel, Kopfschmerzen, Übelkeit, Hypotonie, Hypotonie und Koma – eindeutig mit dem Arzneimittel in Zusammenhang zu stehen.
Die häufigsten (≥1 %) unerwünschten Ereignisse, die während aller klinischen Studien berichtet wurden, sind in der folgenden Tabelle aufgeführt. Neun Patienten brachen die Langzeitbehandlung aufgrund von Nebenwirkungen ab.
AUFTRETEN DER HÄUFIGSTEN (≥ 1 %) NEBENWIRKUNGEN BEI PATIENTEN MIT SPASTIK ZEREBRALEN URSPRUNGS IN PROSPEKTIV ÜBERWACHTEN KLINISCHEN STUDIEN
Die häufigeren (1 % oder mehr) Nebenwirkungen, die bei den prospektiv beobachteten 211 Patienten berichtet wurden, die LIORESAL 25 mg INTRATHEKAL (Baclofen-Injektion) erhielten, wurden berichtet. In der Gesamtkohorte wurden die folgenden unerwünschten Ereignisse, die nicht in der Tabelle beschrieben und nach absteigender Häufigkeit geordnet und nach Körpersystemen klassifiziert wurden, berichtet:
Nervöses System: Akathisie, Ataxie, Verwirrtheit, Depression, Opisthotonus, Amnesie, Angstzustände, Halluzinationen, Hysterie, Schlaflosigkeit, Nystagmus, Persönlichkeitsstörung, verminderte Reflexe und Vasodilatation.
Verdauungstrakt: Dysphagie, Stuhlinkontinenz, Magen-Darm-Blutungen und Zungenstörung.
Herz-Kreislauf: Bradykardie.
Atmung: Apnoe, Dyspnoe und Hyperventilation.
Urogenital: Anormale Ejakulation, Nierensteine, Oligurie und Vaginitis.
Haut und Anhängsel: Hautausschlag, Schwitzen, Alopezie, Kontaktdermatitis und Hautgeschwür.
Besondere Sinne: Anomalie der Unterkunft.
Körper als Ganzes: Tod, Fieber, Bauchschmerzen, Karzinom, Unwohlsein und Unterkühlung.
Hämisches und lymphatisches System: Leukozytose und petechialer Ausschlag.
Postmarketing-Erfahrung
Die folgenden unerwünschten Ereignisse wurden während der Anwendung von LIORESAL INTRATHECAL nach der Zulassung berichtet. Da diese Ereignisse freiwillig von einer Population ungewisser Größe gemeldet werden, ist es nicht möglich, ihre Häufigkeit zuverlässig abzuschätzen.
Bewegungsapparat
Es wurde über das Auftreten einer Skoliose oder die Verschlechterung einer vorbestehenden Skoliose berichtet.
Urogenital
Es wurde über sexuelle Funktionsstörungen bei Männern und Frauen, einschließlich verminderter Libido und Orgasmusstörungen, berichtet. Es wurde auch über erektile Dysfunktion bei Männern berichtet. Nach dem Absetzen von Baclofen wurde über Priapismus berichtet.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Es liegen keine ausreichenden systematischen Erfahrungen mit der Anwendung von LIORESAL INTRATHECAL in Kombination mit anderen Arzneimitteln vor, um spezifische Arzneimittelwechselwirkungen vorherzusagen. Zu den Wechselwirkungen, die der kombinierten Anwendung von LIORESAL INTRATHECAL und Epiduralmorphin zugeschrieben werden, gehören Hypotonie und Dyspnoe.
WARNUNGEN
LIORESAL INTRATHECAL ist für intrathekale Einzelbolusinjektionen (über einen in den lumbalen intrathekalen Raum platzierten Katheter oder Injektion durch Lumbalpunktion) und in implantierbaren Pumpen vorgesehen, die von der FDA speziell für die intrathekale Verabreichung von Baclofen zugelassen sind. Wegen der Möglichkeit einer potenziell lebensbedrohlichen ZNS-Depression, eines kardiovaskulären Kollapses und/oder Atemversagens müssen Ärzte in der chronischen intrathekalen Infusionstherapie angemessen geschult und ausgebildet sein.
Das Pumpensystem sollte nicht implantiert werden, bis das Ansprechen des Patienten auf die intrathekale Bolus-Injektion von LIORESAL 10 mg ausreichend beurteilt wurde. Evaluation (bestehend aus einem Screening-Verfahren: vgl DOSIERUNG UND ANWENDUNG erfordert, dass LIORESAL 25 mg INTRATHEKAL über einen Katheter oder eine Lumbalpunktion in den intrathekalen Raum verabreicht wird. Aufgrund der mit dem Screening-Verfahren und der Anpassung der Dosierung nach der Pumpenimplantation verbundenen Risiken müssen diese Phasen in einer medizinisch überwachten und angemessen ausgestatteten Umgebung gemäß den Anweisungen im Abschnitt „Dosierung und Verabreichung“ durchgeführt werden.
Reanimationsausrüstung sollte verfügbar sein.
Nach der chirurgischen Implantation der Pumpe, insbesondere während der ersten Phasen der Verwendung der Pumpe, sollte der Patient engmaschig überwacht werden, bis sicher ist, dass die Reaktion des Patienten auf die Infusion akzeptabel und einigermaßen stabil ist.
Bei jeder Anpassung der Dosierrate der Pumpe und/oder der Konzentration von LIORESAL INTRATHECAL (Baclofen-Injektion) im Reservoir ist eine engmaschige medizinische Überwachung erforderlich, bis sicher ist, dass die Reaktion des Patienten auf die Infusion akzeptabel und einigermaßen stabil ist.
Es ist zwingend erforderlich, dass der Patient, alle Patientenbetreuer und die für den Patienten verantwortlichen Ärzte angemessene Informationen über die Risiken dieser Behandlungsmethode erhalten. Alle medizinischen Mitarbeiter und Betreuer sollten über 1) die Anzeichen und Symptome einer Überdosierung, 2) die im Falle einer Überdosierung zu befolgenden Verfahren und 3) die ordnungsgemäße häusliche Pflege der Pumpe und der Einführungsstelle unterrichtet werden.
Überdosis
Anzeichen einer Überdosierung können plötzlich oder schleichend auftreten. Eine akute massive Überdosierung kann sich als Koma äußern. Weniger plötzliche und/oder weniger schwere Formen einer Überdosierung können sich mit Anzeichen von Benommenheit, Benommenheit, Schwindel, Somnolenz, Atemdepression, Krampfanfällen, rostralem Fortschreiten der Hypotonie und Bewusstlosigkeit bis hin zum Koma zeigen. Sollte eine Überdosierung wahrscheinlich erscheinen, sollte der Patient zur Beurteilung und Entleerung des Pumpenreservoirs sofort in ein Krankenhaus gebracht werden. In bisher gemeldeten Fällen war eine Überdosierung im Allgemeinen auf eine Fehlfunktion der Pumpe, eine versehentliche subkutane Injektion oder einen Dosierungsfehler zurückzuführen. (Sehen Symptome und Behandlung einer Arzneimittelüberdosierung .)
Beim Befüllen einer von der FDA zugelassenen implantierbaren Pumpe ist äußerste Vorsicht geboten. Solche Pumpen sollten nur durch das Nachfüllseptum des Behälters nachgefüllt werden. Es kann zu einer versehentlichen Injektion in das subkutane Gewebe kommen, wenn das Reservoir-Nachfüllseptum nicht richtig zugänglich ist. Einige Pumpen sind auch mit einem Katheterzugang ausgestattet, der einen direkten Zugang zum intrathekalen Katheter ermöglicht. Eine direkte Injektion in diesen Katheterzugangsport oder eine versehentliche Injektion in das subkutane Gewebe kann zu einer lebensbedrohlichen Überdosierung führen.
Rückzug
Das plötzliche Absetzen von intrathekalem Baclofen hat unabhängig von der Ursache zu Folgeerscheinungen geführt, die hohes Fieber, veränderten Geisteszustand, übertriebene Rebound-Spastik und Muskelrigidität umfassten, die in seltenen Fällen zu Rhabdomyolyse, multiplem Organsystemversagen und Tod führten. In den ersten 9 Jahren nach Markteinführung wurden 27 Fälle von Absetzen in zeitlichem Zusammenhang mit dem Absetzen der Baclofen-Therapie berichtet; sechs Patienten starben. In den meisten Fällen traten die Entzugserscheinungen innerhalb von Stunden bis zu einigen Tagen nach Unterbrechung der Baclofen-Therapie auf. Häufige Gründe für eine abrupte Unterbrechung der intrathekalen Baclofen-Therapie waren eine Fehlfunktion des Katheters (insbesondere Diskonnektion), geringes Volumen im Pumpenreservoir und das Ende der Batterielebensdauer der Pumpe; Menschliches Versagen mag in einigen Fällen eine ursächliche oder mitwirkende Rolle gespielt haben. Fälle von intrathekaler Raumforderung an der Spitze des implantierten Katheters, die zu Entzugserscheinungen führten, wurden ebenfalls berichtet, wobei die meisten von ihnen in der Apotheke hergestellte analgetische Beimischungen betrafen (siehe VORSICHTSMASSNAHMEN ).
Um ein abruptes Absetzen von intrathekalem Baclofen zu verhindern, müssen Programmierung und Überwachung des Infusionssystems, Nachfüllplanung und -verfahren sowie Pumpenalarme sorgfältig beachtet werden. Patienten und Betreuer sollten auf die Wichtigkeit der Einhaltung geplanter Nachfülltermine hingewiesen und über die frühen Symptome eines Baclofen-Entzugs aufgeklärt werden.
Bei allen Patienten, die eine intrathekale Baclofen-Therapie erhalten, besteht ein potenzielles Absetzrisiko. Frühe Symptome des Baclofen-Entzugs können die Rückkehr der Ausgangsspastik, Pruritus, Hypotonie und Parästhesien umfassen. Priapismus kann sich entwickeln oder erneut auftreten, wenn die Behandlung mit intrathekalem Baclofen unterbrochen wird. Einige klinische Merkmale des fortgeschrittenen intrathekalen Baclofen-Entzugssyndroms können einer autonomen Dysreflexie, einer Infektion (Sepsis), einer malignen Hyperthermie, einem neuroleptisch-malignen Syndrom oder anderen Zuständen ähneln, die mit einem hypermetabolischen Zustand oder einer ausgedehnten Rhabdomyolyse einhergehen.
Eine schnelle, genaue Diagnose und Behandlung in einer Notaufnahme oder Intensivstation sind wichtig, um die möglicherweise lebensbedrohlichen zentralnervösen und systemischen Auswirkungen eines intrathekalen Baclofenentzugs zu verhindern. Die vorgeschlagene Behandlung für den intrathekalen Baclofen-Entzug ist die Wiederherstellung der intrathekalen Baclofen-Dosis in oder nahe der gleichen Dosierung wie vor der Unterbrechung der Therapie. Wenn sich jedoch die Wiederherstellung der intrathekalen Freisetzung verzögert, kann die Behandlung mit GABA-ergen Agonisten wie oralem oder enteralem Baclofen oder oralen, enteralen oder intravenösen Benzodiazepinen möglicherweise tödliche Folgen verhindern. Orales oder enterales Baclofen allein sollte das Fortschreiten des intrathekalen Baclofenentzugs nicht aufhalten.
Krampfanfälle wurden während einer Überdosierung und nach dem Absetzen von LIORESAL 25 mg INTRATHEKAL sowie bei Patienten berichtet, die weiterhin therapeutische Dosen von LIORESAL INTRATHEKAL einnahmen.
Todesfälle
Spastizität des Rückenmarks
Es wurden 16 Todesfälle unter den 576 Patienten in den USA berichtet, die mit LIORESAL 10 mg INTRATHEKAL (Baclofen-Injektion) in Prä- und Post-Marketing-Studien behandelt wurden, die bis Dezember 1992 ausgewertet wurden. Da diese Patienten in unkontrollierten klinischen Umgebungen behandelt wurden, ist es unmöglich, definitiv zu bestimmen, welche Falls überhaupt, spielte LIORESAL INTRATHECAL bei ihrem Tod eine Rolle.
Als Gruppe waren die Patienten, die starben, relativ jung (Durchschnittsalter war 47 mit einem Bereich von 25 bis 63), aber die Mehrheit litt an schwerer Spastik über viele Jahre, war nicht gehfähig, hatte verschiedene medizinische Komplikationen wie Lungenentzündung, Harnwege Infektionen und Dekubiti und/oder hatten mehrere Begleitmedikationen erhalten. Eine fallweise Überprüfung des klinischen Verlaufs der 16 verstorbenen Patienten ergab keine eindeutigen Anzeichen, Symptome oder Laborergebnisse, die darauf hindeuten würden, dass die Behandlung mit LIORESAL INTRATHECAL ihren Tod verursachte. Zwei Patienten starben jedoch plötzlich und unerwartet innerhalb von 2 Wochen nach der Pumpenimplantation und ein Patient starb unerwartet nach dem Screening.
Ein Patient, ein 44-jähriger Mann mit MS, starb am zweiten Tag nach der Pumpenimplantation im Krankenhaus. Eine Autopsie zeigte eine schwere Fibrose des koronaren Erregungsleitungssystems. Eine zweite Patientin, eine 52-jährige Frau mit MS und einer Vorgeschichte eines Myokardinfarkts der unteren Wand, wurde 12 Tage nach der Pumpenimplantation tot im Bett aufgefunden, 2 Stunden nachdem sie normale Vitalfunktionen dokumentiert hatte. Eine Autopsie ergab eine Lungenstauung und bilaterale Pleuraergüsse. Es ist unmöglich festzustellen, ob LIORESAL INTRATHECAL zu diesen Todesfällen beigetragen hat. Der dritte Patient wurde drei Baclofen-Screening-Studien unterzogen. Seine Krankengeschichte umfasste SCI, Aspirationspneumonie, septischen Schock, disseminierte intravaskuläre Koagulopathie, schwere metabolische Azidose, hepatische Toxizität und Status epilepticus. Zwölf Tage nach dem Screening (er wurde nicht implantiert) erfuhr er erneut einen Status epilepticus mit anschließender signifikanter neurologischer Verschlechterung. Aufgrund vorheriger Anweisungen wurden keine außergewöhnlichen Wiederbelebungsmaßnahmen durchgeführt und der Patient starb.
Spastik zerebralen Ursprungs
Unter den 211 mit LIORESAL INTRATHECAL in Pre-Marketing-Studien bis März 1996 behandelten Patienten traten drei Todesfälle auf. Diese Todesfälle wurden nicht der Therapie zugeschrieben.
Überinfusion
Die Verabreichung von mehr Medikamentenvolumen als der programmierten Rate (Überinfusion) kann zu einer unerwarteten Überdosierung oder einem Entzug aufgrund einer vorzeitigen Entleerung des Pumpenreservoirs führen. Siehe Pumpenhandbuch und Anweisungen des Herstellers zum Nachfüllen des Reservoirs.
VORSICHTSMASSNAHMEN
Kinder sollten über eine ausreichende Körpermasse verfügen, um die implantierbare Pumpe für die chronische Infusion aufzunehmen. Bitte konsultieren Sie das Handbuch des Pumpenherstellers für spezifische Empfehlungen.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten unter 4 Jahren wurden nicht nachgewiesen.
Screening
Die Patienten sollten vor der Screening-Studie mit LIORESAL INTRATHECAL (Baclofen-Injektion) infektionsfrei sein, da das Vorhandensein einer systemischen Infektion die Beurteilung des Ansprechens des Patienten auf die Bolusgabe von LIORESAL 10 mg INTRATHECAL beeinträchtigen kann.
Pumpenimplantation
Die Patienten sollten vor der Pumpenimplantation infektionsfrei sein, da das Vorhandensein einer Infektion das Risiko chirurgischer Komplikationen erhöhen kann. Darüber hinaus kann eine systemische Infektion die Dosierung erschweren.
Anpassung der Pumpendosis und Titration
Bei den meisten Patienten wird es notwendig sein, die Dosis im Laufe der Zeit schrittweise zu erhöhen, um die Wirksamkeit aufrechtzuerhalten; eine plötzliche Notwendigkeit einer erheblichen Dosissteigerung weist typischerweise auf eine Katheterkomplikation hin (dh Katheterknick oder -dislokation).
Das Nachfüllen des Reservoirs muss von voll ausgebildetem und qualifiziertem Personal gemäß den Anweisungen des Pumpenherstellers durchgeführt werden. Es kann zu einer versehentlichen Injektion in das subkutane Gewebe kommen, wenn das Reservoir-Nachfüllseptum nicht richtig zugänglich ist. Die subkutane Injektion kann zu Symptomen einer systemischen Überdosierung oder einer vorzeitigen Erschöpfung des Reservoirs führen. Die Nachfüllintervalle sollten sorgfältig berechnet werden, um eine Erschöpfung des Reservoirs zu vermeiden, da dies zu einer Rückkehr schwerer Spastik und möglicherweise zu Entzugserscheinungen führen würde.
Beim Abfüllen ist eine streng aseptische Technik erforderlich, um eine bakterielle Kontamination und schwere Infektionen zu vermeiden. Nach jeder Neubefüllung oder Manipulation des Medikamentenreservoirs sollte eine der klinischen Situation angemessene Beobachtungsphase folgen.
Beim Befüllen einer von der FDA zugelassenen implantierbaren Pumpe, die mit einem Injektionsanschluss ausgestattet ist, der einen direkten Zugang zum intrathekalen Katheter ermöglicht, ist äußerste Vorsicht geboten. Die direkte Injektion in den Katheter durch den Zugangsport des Katheters kann zu einer lebensbedrohlichen Überdosierung führen.
Zusätzliche Überlegungen zur Dosisanpassung
Es kann wichtig sein, die Dosis zu titrieren, um einen gewissen Grad an Muskeltonus aufrechtzuerhalten und gelegentliche Krämpfe zuzulassen, um: 1) die Kreislauffunktion zu unterstützen, 2) möglicherweise die Bildung tiefer Venenthrombosen zu verhindern, 3) die Aktivitäten des täglichen Lebens und die Pflege zu optimieren .
Außer in Notfällen im Zusammenhang mit einer Überdosierung sollte die Dosis von LIORESAL 25 mg INTRATHEKAL normalerweise langsam reduziert werden, wenn das Arzneimittel aus irgendeinem Grund abgesetzt wird.
Es sollte versucht werden, die gleichzeitige orale antispastische Medikation abzusetzen, um eine mögliche Überdosierung oder unerwünschte Arzneimittelwechselwirkungen zu vermeiden, entweder vor dem Screening oder nach der Implantation und dem Beginn einer chronischen Infusion von LIORESAL INTRATHECAL. Die Reduktion und das Absetzen von oralen Antispasmotika sollten langsam und unter sorgfältiger Überwachung durch den Arzt erfolgen. Eine abrupte Reduktion oder das Absetzen von begleitenden Antispastika sollte vermieden werden.
Schläfrigkeit
Schläfrigkeit wurde bei Patienten unter LIORESAL INTRATHECAL berichtet. Patienten sollten vor dem Betrieb von Kraftfahrzeugen oder anderen gefährlichen Maschinen und Aktivitäten gewarnt werden, die durch verminderte Wachsamkeit gefährlich werden. Die Patienten sollten auch darauf hingewiesen werden, dass die das zentrale Nervensystem dämpfenden Wirkungen von LIORESAL INTRATHECAL (Baclofen-Injektion) zu denen von Alkohol und anderen ZNS-dämpfenden Mitteln hinzukommen können.
Intrathekale Masse
Fälle von intrathekaler Raumforderung an der Spitze des implantierten Katheters wurden berichtet, die meisten davon im Zusammenhang mit apothekenüblichen analgetischen Beimischungen. Die häufigsten Symptome im Zusammenhang mit intrathekalen Raumforderungen sind: 1) verringertes therapeutisches Ansprechen (sich verschlechternde Spastik, Rückkehr der Spastik bei zuvor gut kontrollierter Spastik, Entzugserscheinungen, schlechtes Ansprechen auf eskalierende Dosen oder häufige oder starke Dosissteigerungen), 2) Schmerzen, 3) neurologisches Defizit/Dysfunktion. Ärzte sollten Patienten unter intraspinaler Therapie sorgfältig auf neue neurologische Anzeichen oder Symptome überwachen. Ziehen Sie bei Patienten mit neuen neurologischen Anzeichen oder Symptomen, die auf eine intrathekale Raumforderung hindeuten, eine neurochirurgische Beratung in Betracht, da viele der Symptome einer entzündlichen Raumforderung den Symptomen nicht unähnlich sind, die bei Patienten mit schwerer Spastik aufgrund ihrer Krankheit auftreten. In einigen Fällen kann die Durchführung eines bildgebenden Verfahrens angebracht sein, um die Diagnose einer intrathekalen Raumforderung zu bestätigen oder auszuschließen.
Vorsichtsmaßnahmen bei speziellen Patientengruppen
Eine sorgfältige Dosistitration von LIORESAL 10 mg INTRATHEKAL ist erforderlich, wenn Spastik erforderlich ist, um eine aufrechte Körperhaltung und das Gleichgewicht bei der Fortbewegung aufrechtzuerhalten, oder wann immer Spastik verwendet wird, um eine optimale Funktion und Pflege zu erreichen.
Patienten, die an psychotischen Störungen, Schizophrenie oder Verwirrtheitszuständen leiden, sollten mit LIORESAL INTRATHECAL mit Vorsicht behandelt und sorgfältig überwacht werden, da bei oraler Verabreichung eine Verschlimmerung dieser Zustände beobachtet wurde.
LIORESAL INTRATHECAL sollte bei Patienten mit autonomer Dysreflexie in der Anamnese mit Vorsicht angewendet werden. Das Vorhandensein von nozizeptiven Reizen oder das plötzliche Absetzen von LIORESAL 10 mg INTRATHEKAL (Baclofen-Injektion) kann eine autonome dysreflexische Episode verursachen.
Da LIORESAL hauptsächlich unverändert über die Nieren ausgeschieden wird, sollte es bei Patienten mit eingeschränkter Nierenfunktion mit Vorsicht angewendet werden und es kann notwendig sein, die Dosierung zu reduzieren.
Labortests
Für die Behandlung von Patienten mit LIORESAL INTRATHECAL werden keine spezifischen Labortests als wesentlich erachtet.
Karzinogenese, Mutagenese und Beeinträchtigung der Fruchtbarkeit
Bei Ratten, die zwei Jahre lang oral Baclofen erhielten, wurde keine Zunahme von Tumoren beobachtet. Es wurden keine angemessenen Tests zur Genotoxizität von Baclofen durchgeführt.
Schwangerschaft
Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. In Tierversuchen hatte Baclofen bei oraler Verabreichung an trächtige Ratten nachteilige Auswirkungen auf die embryofetale Entwicklung. LIORESAL 25 mg INTRATHEKAL sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Oral verabreichtes Baclofen erhöhte die Inzidenz fötaler struktureller Anomalien (Omphalozelen) bei Ratten. Bei den Muttertieren wurde eine Verringerung der Futteraufnahme und der Körpergewichtszunahme beobachtet. Bei Mäusen oder Kaninchen wurden keine fötalen strukturellen Anomalien beobachtet
Stillende Mutter
Bei Müttern, die mit oralem LIORESAL (Baclofen USP) in therapeutischen Dosen behandelt werden, geht der Wirkstoff in die Muttermilch über. Es ist nicht bekannt, ob in der Milch von stillenden Müttern, die LIORESAL 25 mg INTRATHEKAL erhalten, nachweisbare Konzentrationen des Arzneimittels vorhanden sind. Als allgemeine Regel gilt, dass während der Behandlung mit LIORESAL 25 mg INTRATHEKAL nur gestillt werden sollte, wenn der potenzielle Nutzen die potenziellen Risiken für den Säugling rechtfertigt.
Pädiatrische Verwendung
Kinder sollten über eine ausreichende Körpermasse verfügen, um die implantierbare Pumpe für die chronische Infusion aufzunehmen. Bitte konsultieren Sie das Handbuch des Pumpenherstellers für spezifische Empfehlungen.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten unter 4 Jahren wurden nicht nachgewiesen.
Überlegungen basierend auf Erfahrungen mit oralem LIORESAL (Baclofen USP)
Bei weiblichen Ratten, die chronisch mit oralem LIORESAL behandelt wurden, wurde ein dosisabhängiger Anstieg der Inzidenz von Ovarialzysten beobachtet. Ovarialzysten wurden bei etwa 4 % der Patienten mit multipler Sklerose, die bis zu einem Jahr lang mit oralem LIORESAL 25 mg behandelt wurden, palpatorisch gefunden. In den meisten Fällen verschwanden diese Zysten spontan, während die Patienten das Medikament weiterhin erhielten. Es wird geschätzt, dass Ovarialzysten bei etwa 1 % bis 5 % der normalen weiblichen Bevölkerung spontan auftreten.
ÜBERDOSIS
Besondere Aufmerksamkeit muss dem Erkennen der Anzeichen und Symptome einer Überdosierung gewidmet werden, insbesondere während der anfänglichen Screening- und Dosistitrationsphase der Behandlung, aber auch während der Wiedereinführung von LIORESAL INTRATHECAL nach einer Unterbrechung der Therapie.
Symptome einer Überdosierung von LIORESAL INTRATHECAL
Schläfrigkeit, Benommenheit, Schwindel, Somnolenz, Atemdepression, Hypothermie, Krampfanfälle, rostrales Fortschreiten der Hypotonie und Bewusstlosigkeit bis zum Koma von bis zu 72 Stunden. Dauer. In den meisten berichteten Fällen war das Koma ohne Folgeerscheinungen reversibel, nachdem das Medikament abgesetzt wurde. Symptome einer Überdosierung von LIORESAL 25 mg INTRATHEKAL wurden bei einem empfindlichen erwachsenen Patienten nach intrathekaler Bolusgabe von 25 µg berichtet.
Behandlungsvorschläge bei Überdosierung
Es gibt kein spezifisches Antidot zur Behandlung einer Überdosierung von LIORESAL INTRATHECAL (Baclofen-Injektion); Normalerweise sollten jedoch die folgenden Schritte durchgeführt werden:
Wenn eine Lumbalpunktion nicht kontraindiziert ist, sollte erwogen werden, 30-40 ml Liquor zu entnehmen, um die Liquor-Baclofen-Konzentration zu reduzieren.
KONTRAINDIKATIONEN
Überempfindlichkeit gegen Baclofen. LIORESAL INTRATHECAL wird nicht zur intravenösen, intramuskulären, subkutanen oder epiduralen Verabreichung empfohlen.
KLINISCHE PHARMAKOLOGIE
Der genaue Wirkungsmechanismus von Baclofen als Muskelrelaxans und Antispastikum ist nicht vollständig geklärt. Baclofen hemmt sowohl monosynaptische als auch polysynaptische Reflexe auf spinaler Ebene, möglicherweise durch Verringerung der exzitatorischen Neurotransmitterfreisetzung aus primären afferenten Terminals, obwohl auch Wirkungen an supraspinalen Stellen auftreten und zu seiner klinischen Wirkung beitragen können. Baclofen ist ein strukturelles Analogon des inhibitorischen Neurotransmitters Gamma-Aminobuttersäure (GABA) und kann seine Wirkungen durch Stimulierung des GABAB-Rezeptor-Subtyps ausüben.
Wenn LIORESAL INTRATHECAL direkt in den intrathekalen Raum eingeführt wird, können wirksame CSF-Konzentrationen mit resultierenden Plasmakonzentrationen erreicht werden, die 100-mal geringer sind als bei oraler Verabreichung.
Sowohl bei Menschen als auch bei Tieren wurde gezeigt, dass Baclofen allgemeine ZNS-dämpfende Eigenschaften hat, wie durch die Erzeugung von Sedierung mit Toleranz, Somnolenz, Ataxie und Atmungs- und kardiovaskulärer Depression angezeigt wird.
Pharmakodynamik von LIORESAL INTRATHECAL
Intrathekaler Bolus
Erwachsene Patienten
Der Wirkungseintritt erfolgt im Allgemeinen eine halbe Stunde bis eine Stunde nach einem intrathekalen Bolus. Die maximale spasmolytische Wirkung wird etwa vier Stunden nach der Einnahme beobachtet und die Wirkung kann vier bis acht Stunden anhalten. Beginn, maximales Ansprechen und Wirkungsdauer können bei einzelnen Patienten je nach Dosis und Schweregrad der Symptome variieren.
Pädiatrische Patienten
Der Beginn, das maximale Ansprechen und die Wirkungsdauer sind ähnlich wie bei erwachsenen Patienten.
Kontinuierliche Infusion
Die antispastische Wirkung von LIORESAL 25 mg INTRATHECAL wird erstmals 6 bis 8 Stunden nach Beginn der Dauerinfusion sichtbar. Die maximale Aktivität wird in 24 bis 48 Stunden beobachtet.
Kontinuierliche Infusion
Für pädiatrische Patienten liegen keine zusätzlichen Informationen vor.
Pharmakokinetik von LIORESAL 25 mg INTRATHEKAL
Die aus intrathekalen Bolus- oder kontinuierlichen Infusionsstudien berechnete Pharmakokinetik der CSF-Clearance von LIORESAL 25 mg INTRATHEKAL entspricht in etwa dem CSF-Umsatz, was darauf hindeutet, dass die Elimination durch Bulk-Flow-Entfernung von CSF erfolgt.
Intrathekaler Bolus
Nach einer lumbalen Bolusinjektion von 50 oder 100 µg LIORESAL 10 mg INTRATHEKAL bei sieben Patienten betrug die durchschnittliche CSF-Eliminationshalbwertszeit 1,51 Stunden in den ersten vier Stunden und die durchschnittliche CSF-Clearance etwa 30 ml/Stunde.
Kontinuierliche Infusion
Die mittlere CSF-Clearance für LIORESAL 10 mg INTRATHEKAL (Baclofen-Injektion) betrug etwa 30 ml/Stunde in einer Studie mit zehn Patienten, die eine kontinuierliche intrathekale Infusion erhielten. Gleichzeitige Plasmakonzentrationen von Baclofen während der intrathekalen Verabreichung sind voraussichtlich niedrig (0-5 ng/ml).
Begrenzte pharmakokinetische Daten deuten darauf hin, dass sich während der Baclofen-Infusion entlang der Neuroachse ein lumbal-zisternaler Konzentrationsgradient von etwa 4:1 einstellt. Dies basiert auf der gleichzeitigen Liquorentnahme über Zisternen- und Lumbalpunktion bei 5 Patienten, die eine kontinuierliche Baclofen-Infusion auf lumbaler Ebene in Dosen erhielten, die mit der therapeutischen Wirksamkeit verbunden sind; die Variabilität zwischen den Patienten war groß. Der Gradient wurde nicht durch die Position verändert.
Sechs pädiatrische Patienten (Alter 8-18 Jahre), die eine kontinuierliche intrathekale Baclofen-Infusion in Dosen von 77-400 mcg/Tag erhielten, hatten Baclofen-Plasmaspiegel nahe oder unter 10 ng/ml.
INFORMATIONEN ZUM PATIENTEN
PrLIORESAL Intrathekal (Baclofen) Injektion 0,05 mg/ml, 0,5 mg/ml und 2 mg/ml
Nur zur intrathekalen Injektion und Infusion
Diese Broschüre ist Teil III einer dreiteiligen „Produktmonographie“, die veröffentlicht wurde, als LIORESAL IT zum Verkauf in Kanada zugelassen wurde, und ist speziell für Verbraucher bestimmt. Diese Packungsbeilage ist eine Zusammenfassung und wird Ihnen nicht alles über LIORESAL 10 mg IT erzählen. Wenden Sie sich an Ihren Arzt oder Apotheker, wenn Sie Fragen zu dem Arzneimittel haben.
ÜBER DIESES MEDIKAMENT
Wofür wird das Medikament verwendet:
LIORESAL 25 mg intrathekal gehört zu einer Gruppe von Arzneimitteln, die als Muskelrelaxantien bezeichnet werden. Es wird verwendet, um übermäßige Steifheit und/oder Krämpfe zu reduzieren und zu lindern, die bei verschiedenen Krankheiten wie beispielsweise Multipler Sklerose, Erkrankungen oder Verletzungen des Rückenmarks und bestimmten Gehirnstörungen auftreten.
Was es macht:
Die Lösung wird mithilfe einer speziellen Pumpe, die unter die Haut Ihres Bauches implantiert wird, in den Flüssigkeitsraum um das Rückenmark injiziert oder infundiert. Von der Pumpe wird eine konstante Menge der Lösung durch einen winzigen Schlauch in den Flüssigkeitsraum um das Rückenmark herum abgegeben.
Aufgrund der positiven Wirkung auf Muskelkontraktionen und der daraus resultierenden Schmerzlinderung verbessert LIORESAL Intrathecal Ihre Mobilität und Ihre Fähigkeit, Ihre täglichen Aktivitäten ohne Hilfe zu bewältigen. LIORESAL 25mg hilft Ihnen auch, mehr von der Physiotherapie zu profitieren.
Wann sollte es nicht verwendet werden:
Sie sollten nicht mit LIORESALIT behandelt werden, wenn Sie:
Was ist der medizinische Inhaltsstoff:
Baclofen.
Was die nichtmedizinischen Inhaltsstoffe sind:
LIORESAL 25 mg IT enthält: Natriumchlorid und Wasser für Injektionszwecke
In welchen Darreichungsformen kommt es vor:
LIORESAL 25 mg intrathekal (Baclofen-Injektion) 0,05 mg/ml: Jede 1-ml-Ampulle enthält 0,05 mg Baclofen zur intrathekalen Verabreichung.
LIORESAL Intrathekal (Baclofen-Injektion) 0,5 mg/ml: Jede 20-ml-Ampulle enthält 10 mg Baclofen zur intrathekalen Verabreichung.
LIORESAL 25 mg intrathekal (Baclofen-Injektion) 2 mg/ml: Jede 5-ml-Ampulle enthält 10 mg Baclofen zur intrathekalen Verabreichung.
WARNUNGEN UND VORSICHTSMASSNAHMEN
LIORESAL 10 mg intrathekal ist für viele, aber nicht alle Patienten mit Muskelkrämpfen geeignet.
Sprechen Sie VOR der Anwendung von LIORESAL 25mgIT mit Ihrem Arzt oder Apotheker, wenn Sie:
Wenn einer dieser Punkte auf Sie zutrifft, wird Ihr Arzt Ihnen dieses Arzneimittel möglicherweise nicht verabreichen oder besondere Vorsichtsmaßnahmen treffen. Wenn Sie Ihrem Arzt nichts davon gesagt haben, sagen Sie es ihm, bevor Sie mit der intrathekalen Behandlung mit LIORESAL 25 mg beginnen.
Wenn Sie glauben, allergisch zu sein, fragen Sie Ihren Arzt um Rat.
Verkehrstüchtigkeit und das Bedienen von Maschinen: LIORESAL intrathekal kann Sie schläfrig oder schwindelig machen. Seien Sie vorsichtig, wenn Sie Auto fahren oder eine Maschine bedienen oder Dinge tun, die besondere Aufmerksamkeit erfordern, bis Sie sich wieder normal fühlen.
WECHSELWIRKUNGEN MIT DIESEM MEDIKAMENT
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen bzw. vor kurzem eingenommen haben, einschließlich pflanzlicher und nicht verschreibungspflichtiger (rezeptfreier) Arzneimittel. Einige andere Arzneimittel können mit LIORESAL 10mgIT interagieren. Ihr Arzt kann die Dosierung ändern oder manchmal eines der Arzneimittel absetzen. Dies ist besonders wichtig für die folgenden Arzneimittel:
Informieren Sie Ihren Arzt oder das medizinische Fachpersonal immer über alle Arzneimittel, die Sie einnehmen. Das sind sowohl selbst gekaufte Arzneimittel als auch verschreibungspflichtige Arzneimittel von Ihrem Arzt.
Seien Sie vorsichtig, wenn Sie während der Behandlung mit LIORESAL 25 mg intrathekal alkoholische Getränke trinken, da Sie sich möglicherweise schläfriger oder schwindliger als gewöhnlich fühlen.
RICHTIGE VERWENDUNG DIESES MEDIKAMENTS
Übliche Dosis
LIORESAL Intrathecal darf nur von erfahrenen Ärzten unter Verwendung spezieller medizinischer Geräte verabreicht werden. Sie müssen zumindest zu Beginn der Behandlung im Krankenhaus bleiben.
Ihr Arzt wird eine kleine Menge LIORESAL Intrathecal in Ihr Rückenmark injizieren, um zu sehen, ob es Ihre Muskelkrämpfe verbessert. Ist dies der Fall, wird Ihnen eine spezielle Pumpe unter die Haut implantiert. Die Pumpe gibt Ihnen ständig eine kleine Menge des Arzneimittels.
Es kann mehrere Tage dauern, bis Sie die für Sie am besten geeignete Menge des Arzneimittels ermittelt haben. Ihr Arzt wird Sie während dieser Zeit genau beobachten.
Danach wird Ihr Arzt Sie weiterhin regelmäßig sehen wollen, um Ihren Fortschritt zu überprüfen und sicherzustellen, dass Ihre Pumpe gut funktioniert.
ES IST VON ÄUSSERSTER WICHTIGKEIT, DASS TERMINE ZUM NACHFÜLLEN DER PUMPE EINGEHALTEN WERDEN, ANDERNFALLS KÖNNEN WIEDER KRÄMPFE AUFTRETEN, WEIL SIE NICHT EINE HOCH GENUG DOSIS VON LIORESAL INTRATHEKAL BEKOMMEN. MUSKELSPASTIZITÄT KANN SICH DADURCH NICHT VERBESSERN ODER VERSCHLECHTERN.
Wenn sich die Muskelspastik nicht bessert oder wenn Sie allmählich oder plötzlich wieder Krämpfe bekommen, wenden Sie sich sofort an Ihren Arzt.
Informationen zur richtigen häuslichen Pflege der Pumpe und der Einführstelle finden Sie in der Literatur des Pumpenherstellers.
Überwachung während der Behandlung mit LIORESAL 10 mg intrathekal
Sie werden während der Screening-Phase und der Dosistitrationsperiode unmittelbar nach der Pumpenimplantation in einer voll ausgestatteten und personell ausgestatteten Umgebung engmaschig überwacht. Sie werden regelmäßig auf Ihre Dosierungsanforderungen, mögliche Nebenwirkungen oder Anzeichen einer Infektion untersucht. Auch die Funktionsfähigkeit des Liefersystems wird überprüft.
Schwangerschaft und Stillzeit
Sie sollten Ihren Arzt informieren, wenn Sie schwanger sind oder eine Schwangerschaft planen, da LIORESAL 25 mg intrathekal während der Schwangerschaft oder Stillzeit nicht angewendet werden sollte. Fragen Sie vor der Einnahme von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat.
Ihr Arzt wird mit Ihnen das potenzielle Risiko einer intrathekalen Einnahme von LIORESAL 25 mg während der Schwangerschaft besprechen.
Der Arzt wird entscheiden, ob Sie in diesen besonderen Situationen LIORESAL 10 mg intrathekal erhalten dürfen. LIORESAL 10 mg geht nur in sehr geringen Mengen in die Muttermilch über. Fragen Sie Ihren Arzt, wenn Sie stillen möchten.
Überdosis
Wenden Sie sich im Falle einer Überdosierung sofort an einen Arzt, die Notaufnahme eines Krankenhauses oder ein regionales Giftinformationszentrum, auch wenn keine Symptome vorliegen.
Anzeichen einer Überdosierung können plötzlich oder schleichend auftreten, zB durch eine Fehlfunktion der Pumpe. Es ist sehr wichtig, dass Sie und Ihre Betreuer Anzeichen einer Überdosierung erkennen. Wenn bei Ihnen eines oder eine Kombination der folgenden Symptome auftritt, informieren Sie unverzüglich Ihren Arzt, da die Menge des Arzneimittels, das Sie erhalten, zu hoch sein kann:
Verpasste Dosis
Das abrupte Absetzen von LIORESAL 10 mg intrathekal kann zu schwerwiegenden medizinischen Problemen führen und war in seltenen Fällen tödlich.
Anzeichen dafür, dass Ihre Pumpe nicht richtig funktioniert oder dass sie nicht die richtige Medikamentenmenge abgibt, sind eine Zunahme oder Rückkehr von Spastik, Juckreiz, niedriger Blutdruck, Benommenheit, Kribbeln, hohes Fieber, veränderter Geisteszustand und Muskelsteifheit oder neu aufgetreten Muskelschwäche oder Lähmung. Es ist wichtig, dass Sie sofort Ihren Arzt informieren, wenn bei Ihnen eines der oben genannten Symptome auftritt.
NEBENWIRKUNGEN UND WAS MAN GEGEN SIE TUN KANN
Wie bei allen Arzneimitteln können bei Patienten, die mit LIORESAL 25 mg intrathekal behandelt werden, einige Nebenwirkungen auftreten, die aber nicht bei jedem auftreten müssen. Diese treten häufiger zu Beginn der Behandlung während Ihres Krankenhausaufenthalts auf, können aber auch später auftreten und sollten mit Ihrem Arzt abgeklärt werden.
Sehr gewöhnlich: Schläfrigkeit, Muskelschwäche
Verbreitet: Angstgefühl, Sedierung und Müdigkeit (Erschöpfung), Schwäche in den Beinen, Steifheit in den Muskeln, Schwindel/Benommenheit, Kopfschmerzen, Schläfrigkeit, Übelkeit und/oder Erbrechen, Kribbeln in Händen und Füßen, Schlaflosigkeit, undeutliche Sprache, Lungenentzündung , Schwäche, Schüttelfrost, Müdigkeit, Schmerzen, Mundtrockenheit, Hautausschlag und/oder Juckreiz, Schwellung der Knöchel, Füße oder Unterschenkel, geschwollenes Gesicht, ungewöhnliche Nervosität oder Unruhe, Verwirrtheit/Orientierungslosigkeit, Verstopfung, Durchfall, verminderter Appetit, übermäßig Speichelfluss, Fieber/Schüttelfrost, Harnprobleme, sexuelle Schwierigkeiten.
Ungewöhnlich: Stimmungs- oder geistige Veränderungen, Paranoia, extremes Glücksgefühl (Euphorie), Verlust der Muskelkoordination (Ataxie), ungewöhnlich niedrige Körpertemperatur, Gedächtnisverlust, anhaltende unkontrollierbare Augenbewegungen, verminderter Geschmackssinn, Schluckbeschwerden, Bauchschmerzen, Haarausfall, starkes Schwitzen.
Selten: Ruhelosigkeit, ungewöhnlich langsame Atemfrequenz.
Informieren Sie Ihren Arzt, wenn Sie andere Wirkungen bemerken. Einige Nebenwirkungen können mit dem Abgabesystem in Verbindung gebracht werden.
SCHWERE NEBENWIRKUNGEN, WIE HÄUFIG SIE AUFTRETEN UND WAS MAN GEGEN SIE TUN KANN
Dies ist keine vollständige Liste der Nebenwirkungen. Bei unerwarteten Wirkungen während der Einnahme von LIORESAL IT wenden Sie sich an Ihren Arzt oder Apotheker.
WIE IST ES AUFZUBEWAHREN?
LIORESAL 10mg IT Ampullen zwischen 15-30°C lagern (vor Hitze schützen). Nicht einfrieren. Nicht hitzesterilisieren.
Bewahren Sie alle Arzneimittel für Kinder unzugänglich auf.
Dieses Arzneimittel wird für Ihr spezifisches medizinisches Problem und nur für Ihren eigenen Gebrauch verschrieben. Nicht an andere Personen weitergeben.
Verwenden Sie keine abgelaufenen Arzneimittel. Entsorgen Sie sie sicher außerhalb der Reichweite von Kindern oder bringen Sie sie zu Ihrem Apotheker, der sie für Sie entsorgen wird.
MELDEN MÖGLICHER NEBENWIRKUNGEN
Sie können alle vermuteten Nebenwirkungen im Zusammenhang mit der Verwendung von Gesundheitsprodukten dem Canada Vigilance Program auf eine der folgenden 3 Arten melden:
Portofreie Etiketten, das Canada Vigilance Reporting Form und die Richtlinien zur Meldung von Nebenwirkungen sind auf der Website von MedEffect™ Canada unter www.healthcanada.gc.ca/medeffect verfügbar.
HINWEIS: Wenn Sie Informationen zum Umgang mit Nebenwirkungen benötigen, wenden Sie sich an Ihren Arzt. Das Canada Vigilance Program bietet keine medizinische Beratung.
MEHR INFORMATIONEN
Dieses Dokument sowie die vollständige Produktmonographie für Angehörige der Gesundheitsberufe finden Sie unter: http://www.novartis.ca oder wenden Sie sich an den Sponsor, Novartis Pharmaceuticals Canada Inc, unter: 1-800-363-8883