Abilify 10mg, 15mg, 20mg Aripiprazole Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.

Was ist Abilify 20 mg und wie wird es angewendet?
Abilify ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Schizophrenie, Bipolar-I-Störung (manische Depression) und Major Depression. Abilify 10 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden. Abilify ist ein antipsychotisches, antimanisches Mittel.
Welche Nebenwirkungen kann Abilify 15 mg haben?
Abilify 15 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Abilify 20 mg gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Abilify. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
ERHÖHTE STERBLICHKEIT BEI ÄLTEREN PATIENTEN MIT PSYCHOSE IM ZUSAMMENHANG MIT DEMENZ UND SUIZIDALEN GEDANKEN UND VERHALTEN MIT ANTIDEPRESSIONSMITTELN
Ältere Patienten mit demenzbedingter Psychose, die mit Antipsychotika behandelt werden, haben ein erhöhtes Sterberisiko. ABILIFY 20 mg ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
Antidepressiva erhöhten in Kurzzeitstudien das Risiko für Suizidgedanken und -verhalten bei Kindern, Jugendlichen und jungen Erwachsenen. Diese Studien zeigten keine Erhöhung des Risikos für Suizidgedanken und -verhalten bei Anwendung von Antidepressiva bei Patienten über 24 Jahren; bei Patienten im Alter von 65 Jahren und älter wurde das Risiko bei der Anwendung von Antidepressiva verringert [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
Bei Patienten jeden Alters, die mit einer antidepressiven Therapie begonnen werden, ist eine genaue Überwachung auf eine Verschlechterung und das Auftreten von Suizidgedanken und -verhalten vorzunehmen. Informieren Sie Familien und Pflegekräfte über die Notwendigkeit einer genauen Beobachtung und Kommunikation mit dem verschreibenden Arzt [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
BEZEICHNUNG
Aripiprazol ist ein Psychopharmakon, das als ABILIFY® (Aripiprazol) Tabletten, ABILIFY DISCMELT® (Aripiprazol) Oral Disintegrating Tablets, ABILIFY® (Aripiprazol) Oral Solution und ABILIFY® (Aripiprazol) Injection, eine Lösung zur intramuskulären Injektion, erhältlich ist. Aripiprazol ist 7-[4-[4-(2,3-Dichlorphenyl)-1-piperazinyl]butoxy]-3,4-dihydrocarbostyril. Die Summenformel lautet C23H27Cl2N3O2 und sein Molekulargewicht beträgt 448,38. Die chemische Struktur ist:
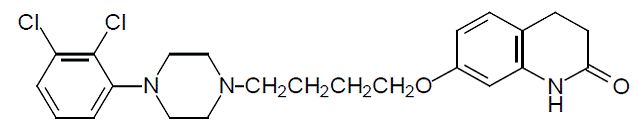
ABILIFY Tabletten sind in Stärken von 2 mg, 5 mg, 10 mg, 15 mg, 20 mg und 30 mg erhältlich. Zu den inaktiven Inhaltsstoffen gehören Maisstärke, Hydroxypropylcellulose, Lactosemonohydrat, Magnesiumstearat und mikrokristalline Cellulose. Farbstoffe umfassen Eisenoxid (gelb oder rot) und FD&C Blue No. 2 Aluminium Lake.
ABILIFY 20 mg DISCMELT oral zerfallende Tabletten sind in Stärken von 10 mg und 15 mg erhältlich. Zu den inaktiven Inhaltsstoffen gehören Acesulfam-Kalium, Aspartam, Calciumsilikat, Croscarmellose-Natrium, Crospovidon, Crème de Vanilla (natürliche und künstliche Aromen), Magnesiumstearat, mikrokristalline Cellulose, Siliciumdioxid, Weinsäure und Xylit. Farbstoffe umfassen Eisenoxid (gelb oder rot) und FD&C Blue No. 2 Aluminium Lake.
ABILIFY Lösung zum Einnehmen ist eine klare, farblose bis hellgelbe Lösung, die in einer Konzentration von 1 mg/ml erhältlich ist. Zu den inaktiven Inhaltsstoffen dieser Lösung gehören Dinatriumedetat, Fructose, Glycerin, DL-Milchsäure, Methylparaben, Propylenglykol, Propylparaben, Natriumhydroxid, Saccharose und gereinigtes Wasser. Die Lösung zum Einnehmen ist mit natürlicher Orangencreme und anderen natürlichen Aromen aromatisiert.
ABILIFY Injection ist in Einzeldosis-Durchstechflaschen als gebrauchsfertige, 9,75 mg/1,3 ml (7,5 mg/ml) klare, farblose, sterile, wässrige Lösung nur zur intramuskulären Anwendung erhältlich. Zu den inaktiven Bestandteilen dieser Lösung gehören 199,5 mg Sulfobutylether-β-Cyclodextrin (SBECD), 10,4 mg Weinsäure, qs bis pH 4,3 Natriumhydroxid und qs bis 1,33 ml Wasser für Injektionszwecke.
INDIKATIONEN
ABILIFY Tabletten zum Einnehmen, im Mund zerfallende Tabletten und Lösung zum Einnehmen sind indiziert zur Behandlung von:
ABILIFY Injektion ist indiziert zur Behandlung von:
DOSIERUNG UND ANWENDUNG
Schizophrenie
Erwachsene
Die empfohlene Anfangs- und Zieldosis für ABILIFY beträgt 10 oder 15 mg/Tag einmal täglich, unabhängig von den Mahlzeiten. ABILIFY wurde systematisch evaluiert und hat sich bei Verabreichung als Tablettenformulierung in einem Dosisbereich von 10 bis 30 mg/Tag als wirksam erwiesen; Dosen von mehr als 10 oder 15 mg/Tag waren jedoch nicht wirksamer als 10 oder 15 mg/Tag. Dosiserhöhungen sollten im Allgemeinen nicht vor Ablauf von 2 Wochen vorgenommen werden, der Zeit, die benötigt wird, um einen Steady-State zu erreichen [siehe Klinische Studien ].
Erhaltungstherapie: Die Aufrechterhaltung der Wirksamkeit bei Schizophrenie wurde in einer Studie mit Patienten mit Schizophrenie nachgewiesen, die unter anderen Antipsychotika über einen Zeitraum von 3 Monaten oder länger symptomatisch stabil waren. Diese Patienten wurden von diesen Medikamenten abgesetzt und randomisiert entweder ABILIFY 15 mg/Tag oder Placebo zugeteilt und auf Rückfälle beobachtet [siehe Klinische Studien ]. Die Patienten sollten regelmäßig neu untersucht werden, um festzustellen, ob eine Erhaltungstherapie weiterhin erforderlich ist.
Jugendliche
Die empfohlene Zieldosis von ABILIFY beträgt 10 mg/Tag. Aripiprazol wurde bei jugendlichen Patienten im Alter von 13 bis 17 Jahren mit Schizophrenie in Tagesdosen von 10 mg und 30 mg untersucht. Die tägliche Anfangsdosis der Tablettenformulierung bei diesen Patienten betrug 2 mg, die nach 2 Tagen auf 5 mg und nach 2 weiteren Tagen auf die Zieldosis von 10 mg titriert wurde. Nachfolgende Dosiserhöhungen sollten in 5-mg-Schritten verabreicht werden. Die Dosis von 30 mg/Tag erwies sich nicht als wirksamer als die Dosis von 10 mg/Tag. ABILIFY kann unabhängig von den Mahlzeiten verabreicht werden [siehe Klinische Studien ]. Die Patienten sollten regelmäßig neu untersucht werden, um die Notwendigkeit einer Erhaltungstherapie zu bestimmen.
Umstellung von anderen Antipsychotika
Es liegen keine systematisch gesammelten Daten vor, die sich speziell mit der Umstellung von Patienten mit Schizophrenie von anderen Antipsychotika auf ABILIFY 20 mg oder mit der gleichzeitigen Anwendung mit anderen Antipsychotika befassen. Während für einige Patienten mit Schizophrenie ein sofortiges Absetzen der vorherigen antipsychotischen Behandlung akzeptabel sein kann, ist für andere ein langsameres Absetzen am besten geeignet. In allen Fällen sollte der Zeitraum der überlappenden Verabreichung von Antipsychotika minimiert werden.
Bipolare I-Störung
Akute Behandlung manischer und gemischter Episoden
Erwachsene
Die empfohlene Anfangsdosis bei Erwachsenen beträgt 15 mg einmal täglich als Monotherapie und 10 mg bis 15 mg einmal täglich als Zusatztherapie mit Lithium oder Valproat. ABILIFY 10 mg kann unabhängig von den Mahlzeiten verabreicht werden. Die empfohlene Zieldosis von ABILIFY beträgt 15 mg/Tag als Monotherapie oder als Zusatztherapie mit Lithium oder Valproat. Je nach klinischem Ansprechen kann die Dosis auf 30 mg/Tag erhöht werden. Die Sicherheit von Dosen über 30 mg/Tag wurde nicht in klinischen Studien untersucht.
Pädiatrie
Die empfohlene Anfangsdosis bei pädiatrischen Patienten (10 bis 17 Jahre) als Monotherapie beträgt 2 mg/Tag, mit Titration auf 5 mg/Tag nach 2 Tagen und einer Zieldosis von 10 mg/Tag nach 2 weiteren Tagen. Die empfohlene Dosierung als Zusatztherapie zu Lithium oder Valproat ist dieselbe. Nachfolgende Dosiserhöhungen sollten, falls erforderlich, in Schritten von 5 mg/Tag verabreicht werden. ABILIFY kann unabhängig von den Mahlzeiten gegeben werden [siehe Klinische Studien ].
Begleitende Behandlung von schweren depressiven Störungen
Erwachsene
Die empfohlene Anfangsdosis für ABILIFY als Zusatzbehandlung für Patienten, die bereits ein Antidepressivum einnehmen, beträgt 2 bis 5 mg/Tag. Der empfohlene Dosierungsbereich beträgt 2 bis 15 mg/Tag. Dosisanpassungen von bis zu 5 mg/Tag sollten schrittweise in Abständen von mindestens 1 Woche erfolgen [siehe Klinische Studien ]. Die Patienten sollten regelmäßig neu untersucht werden, um festzustellen, ob eine Erhaltungstherapie weiterhin erforderlich ist.
Reizbarkeit im Zusammenhang mit autistischer Störung
Pädiatrische Patienten (6 bis 17 Jahre)
Der empfohlene Dosierungsbereich für die Behandlung von pädiatrischen Patienten mit Reizbarkeit im Zusammenhang mit einer autistischen Störung beträgt 5 bis 15 mg/Tag.
Die Dosierung sollte mit 2 mg/Tag begonnen werden. Die Dosis sollte auf 5 mg/Tag erhöht werden, mit nachfolgenden Erhöhungen auf 10 oder 15 mg/Tag, falls erforderlich. Dosisanpassungen von bis zu 5 mg/Tag sollten schrittweise in Abständen von mindestens 1 Woche erfolgen [siehe Klinische Studien ]. Die Patienten sollten regelmäßig neu untersucht werden, um festzustellen, ob eine Erhaltungstherapie weiterhin erforderlich ist.
Tourette-Krankheit
Pädiatrische Patienten (6 bis 18 Jahre)
Der empfohlene Dosierungsbereich für die Tourette-Krankheit beträgt 5 bis 20 mg/Tag.
Bei Patienten mit einem Körpergewicht unter 50 kg sollte die Dosierung mit 2 mg/Tag mit einer Zieldosis von 5 mg/Tag nach 2 Tagen begonnen werden. Bei Patienten, die keine optimale Tic-Kontrolle erreichen, kann die Dosis auf 10 mg/Tag erhöht werden. Dosisanpassungen sollten schrittweise in Abständen von mindestens 1 Woche erfolgen.
Bei Patienten, die 50 kg oder mehr wiegen, sollte die Dosierung mit 2 mg/Tag für 2 Tage begonnen und dann auf 5 mg/Tag für 5 Tage erhöht werden, mit einer Zieldosis von 10 mg/Tag am 8. Tag bei Patienten, die keine optimale Tic-Kontrolle erreichen, auf bis zu 20 mg/Tag erhöht werden. Dosisanpassungen sollten schrittweise in Schritten von 5 mg/Tag in Abständen von mindestens 1 Woche erfolgen. [Sehen Klinische Studien ].
Die Patienten sollten regelmäßig neu untersucht werden, um festzustellen, ob eine Erhaltungstherapie weiterhin erforderlich ist.
Unruhe im Zusammenhang mit Schizophrenie oder bipolarer Manie (intramuskuläre Injektion)
Erwachsene
Die empfohlene Dosis bei diesen Patienten beträgt 9,75 mg. Der empfohlene Dosierungsbereich beträgt 5,25 bis 15 mg. Für 15 mg im Vergleich zu 9,75 mg wurde kein zusätzlicher Nutzen nachgewiesen. Eine niedrigere Dosis von 5,25 mg kann in Betracht gezogen werden, wenn klinische Faktoren dies rechtfertigen. Wenn die Erregung nach der Anfangsdosis anhält, die eine zweite Dosis rechtfertigt, können kumulative Dosen bis zu einer Gesamtdosis von 30 mg/Tag gegeben werden. Die Wirksamkeit wiederholter Injektionen von ABILIFY 10 mg bei unruhigen Patienten wurde jedoch nicht systematisch in kontrollierten klinischen Studien untersucht. Die Sicherheit von Tagesgesamtdosen von mehr als 30 mg oder Injektionen, die häufiger als alle 2 Stunden verabreicht wurden, wurde in klinischen Studien nicht ausreichend untersucht [siehe Klinische Studien ].
Wenn eine laufende ABILIFY-Therapie klinisch indiziert ist, sollte das orale ABILIFY in einem Bereich von 10 bis 30 mg/Tag die ABILIFY-Injektion so bald wie möglich ersetzen [siehe DOSIERUNG UND ANWENDUNG ].
Verabreichung der ABILIFY-Injektion
Um ABILIFY 10 mg zur Injektion zu verabreichen, ziehen Sie das erforderliche Volumen der Lösung in die Spritze auf, wie in Tabelle 1 gezeigt. Verwerfen Sie alle nicht verwendeten Portionen.
ABILIFY Injection ist nur zur intramuskulären Anwendung bestimmt. Nicht intravenös oder subkutan verabreichen. Injizieren Sie langsam und tief in die Muskelmasse.
Parenterale Arzneimittel sollten vor der Verabreichung visuell auf Partikel und Verfärbungen untersucht werden, sofern Lösung und Behältnis dies zulassen.
Dosisanpassungen für Überlegungen zu Cytochrom P450
Dosisanpassungen werden bei Patienten empfohlen, die bekanntermaßen langsame CYP2D6-Metabolisierer sind, und bei Patienten, die gleichzeitig CYP3A4-Hemmer oder CYP2D6-Hemmer oder starke CYP3A4-Induktoren einnehmen (siehe Tabelle 2). Wenn das gleichzeitig verabreichte Arzneimittel aus der Kombinationstherapie abgesetzt wird, sollte die Dosierung von ABILIFY 10 mg auf die ursprüngliche Dosis angepasst werden. Wenn der gleichzeitig verabreichte CYP3A4-Induktor abgesetzt wird, sollte die ABILIFY-Dosis über 1 bis 2 Wochen auf das ursprüngliche Niveau reduziert werden. Bei Patienten, die möglicherweise eine Kombination aus starken, mäßigen und schwachen Inhibitoren von CYP3A4 und CYP2D6 erhalten (z. B. einen starken CYP3A4-Inhibitor und einen mäßigen CYP2D6-Inhibitor oder einen mäßigen CYP3A4-Inhibitor mit einem mäßigen CYP2D6-Inhibitor), kann die Dosis auf eine reduziert werden -Viertel (25 %) der üblichen Dosis und dann angepasst, um ein günstiges klinisches Ansprechen zu erzielen.
Wenn Patienten mit schweren depressiven Störungen zusätzlich ABILIFY verabreicht wird, sollte ABILIFY 10 mg ohne Dosisanpassung verabreicht werden, wie in Dosierung und Verabreichung (2.3) angegeben.
Dosierung der Lösung zum Einnehmen
Die Lösung zum Einnehmen kann Tabletten auf einer mg-pro-mg-Basis bis zu einer Dosis von 25 mg ersetzen. Patienten, die 30-mg-Tabletten erhalten, sollten 25 mg der Lösung erhalten [siehe KLINISCHE PHARMAKOLOGIE ].
Dosierung oral zerfallender Tabletten
Die Dosierung für ABILIFY 10 mg oral zerfallende Tabletten ist die gleiche wie für die oralen Tabletten [siehe oben Abschnitte ].
WIE GELIEFERT
Darreichungsformen und Stärken
ABILIFY® (Aripiprazol) Tabletten sind wie in Tabelle 3 beschrieben erhältlich.
ABILIFY DISCMELT® (Aripiprazol) im Mund auflösende Tabletten sind wie in Tabelle 4 beschrieben erhältlich.
ABILIFY® (Aripiprazol) Lösung zum Einnehmen (1 mg/ml) ist eine klare, farblose bis hellgelbe Lösung, die in kindersicheren Flaschen zusammen mit einem kalibrierten oralen Dosierbecher geliefert wird.
ABILIFY® (Aripiprazol) Injektion zur intramuskulären Anwendung ist eine klare, farblose Lösung, die als gebrauchsfertige Lösung mit 9,75 mg/1,3 ml (7,5 mg/ml) in durchsichtigen Durchstechflaschen aus Typ-1-Glas erhältlich ist.
Lagerung und Handhabung
ABILIFY® (Aripiprazol) Tabletten haben einseitige Markierungen und sind in den in Tabelle 32 aufgeführten Stärken und Verpackungen erhältlich.
ABILIFY 15 mg DISCMELT® (Aripiprazol) im Mund zerfallende Tabletten sind runde Tabletten mit Markierungen auf beiden Seiten. ABILIFY 15 mg DISCMELT ist in den in Tabelle 33 aufgeführten Stärken und Packungen erhältlich.
ABILIFY® (Aripiprazol) Lösung zum Einnehmen (1 mg/ml) wird in kindersicheren Flaschen zusammen mit einem kalibrierten oralen Dosierbecher geliefert. ABILIFY 20 mg Lösung zum Einnehmen ist wie folgt erhältlich:
150-ml-Flasche NDC 59148-013-15
ABILIFY® (Aripiprazol) Injektion zur intramuskulären Anwendung ist als gebrauchsfertige Lösung mit 9,75 mg/1,3 ml (7,5 mg/ml) in durchsichtigen Durchstechflaschen aus Typ-1-Glas wie folgt erhältlich:
9,75 mg/1,3 ml Einzeldosis-Durchstechflasche NDC 59148-016-65
Lagerung
Tablets
Bei 25 °C (77 °F) lagern; Exkursionen zwischen 15°C und 30°C (59°F bis 86°F) erlaubt [siehe USP kontrollierte Raumtemperatur ].
Mündliche Lösung
Bei 25 °C (77 °F) lagern; Exkursionen zwischen 15°C und 30°C (59°F bis 86°F) erlaubt [siehe USP kontrollierte Raumtemperatur ]. Geöffnete Flaschen mit ABILIFY Lösung zum Einnehmen können bis zu 6 Monate nach dem Öffnen verwendet werden, jedoch nicht über das auf der Flasche angegebene Verfallsdatum hinaus. Die Flasche und ihr Inhalt sollten nach Ablauf des Verfallsdatums entsorgt werden.
Injektion
Bei 25 °C (77 °F) lagern; Exkursionen zwischen 15°C und 30°C (59°F bis 86°F) erlaubt [siehe USP kontrollierte Raumtemperatur ]. Im Originalbehälter vor Licht schützen. Bis zur Verwendung im Karton aufbewahren.
Vertrieb und Vertrieb durch Otsuka America Pharmaceutical, Inc., Rockville, MD 20850 USA. Otsuka America Pharmaceutical, Inc.,. Rev. August 2019
NEBENWIRKUNGEN
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die folgenden Nebenwirkungen werden in anderen Abschnitten der Kennzeichnung ausführlicher erörtert:
Die häufigsten Nebenwirkungen bei erwachsenen Patienten in klinischen Studien (≥ 10 %) waren Übelkeit, Erbrechen, Verstopfung, Kopfschmerzen, Schwindel, Akathisie, Angst, Schlaflosigkeit und Unruhe.
Die häufigsten Nebenwirkungen in den pädiatrischen klinischen Studien (≥ 10 %) waren Somnolenz, Kopfschmerzen, Erbrechen, extrapyramidale Störungen, Müdigkeit, gesteigerter Appetit, Schlaflosigkeit, Übelkeit, Nasopharyngitis und Gewichtszunahme.
Die Sicherheit von ABILIFY wurde bei 13.543 erwachsenen Patienten untersucht, die an klinischen Mehrfachdosis-Studien zu Schizophrenie, bipolarer Störung, schwerer depressiver Störung, Demenz vom Alzheimer-Typ, Parkinson-Krankheit und Alkoholismus teilnahmen und etwa 7619 Patientenjahre davon hatten Exposition gegenüber oralem ABILIFY 10 mg und 749 Patienten mit Exposition gegenüber ABILIFY-Injektion. Insgesamt 3.390 Patienten wurden mindestens 180 Tage lang mit oralem ABILIFY behandelt, und 1.933 Patienten, die mit oralem ABILIFY behandelt wurden, hatten eine Exposition von mindestens 1 Jahr.
Die Sicherheit von ABILIFY 15 mg wurde bei 1.686 Patienten (6 bis 18 Jahre) untersucht, die an klinischen Mehrfachdosis-Studien zu Schizophrenie, bipolarer Manie, autistischer Störung oder Tourette-Syndrom teilnahmen und etwa 1.342 Patientenjahre mit oralem ABILIFY behandelt wurden . Insgesamt 959 pädiatrische Patienten wurden mindestens 180 Tage lang mit oralem ABILIFY behandelt, und 556 pädiatrische Patienten, die mit oralem ABILIFY 10 mg behandelt wurden, hatten eine Exposition von mindestens 1 Jahr.
Die Bedingungen und Dauer der Behandlung mit ABILIFY (Monotherapie und Zusatztherapie mit Antidepressiva oder Stimmungsstabilisatoren) umfassten (in sich überschneidenden Kategorien) doppelblinde, vergleichende und nicht vergleichende offene Studien, stationäre und ambulante Studien, Studien mit fester und flexibler Dosis, und kurz- und längerfristige Exposition.
Erfahrung mit klinischen Studien
Erwachsene Patienten mit Schizophrenie
Die folgenden Ergebnisse basieren auf einem Pool von fünf placebokontrollierten Studien (vier 4-wöchige und eine 6-wöchige), in denen ABILIFY 15 mg oral in Dosen von 2 bis 30 mg/Tag verabreicht wurde.
Häufig beobachtete Nebenwirkungen
Die einzige häufig beobachtete Nebenwirkung im Zusammenhang mit der Anwendung von ABILIFY 20 mg bei Patienten mit Schizophrenie (Inzidenz von 5 % oder mehr und ABILIFY-Inzidenz mindestens doppelt so hoch wie bei Placebo) war Akathisie (ABILIFY 8 %; Placebo 4 %).
Erwachsene Patienten mit bipolarer Manie
Monotherapie
Die folgenden Ergebnisse basieren auf einem Pool von 3-wöchigen, placebokontrollierten Studien mit bipolarer Manie, in denen ABILIFY 15 mg oral in Dosen von 15 oder 30 mg/Tag verabreicht wurde.
Häufig beobachtete Nebenwirkungen
Häufig beobachtete Nebenwirkungen im Zusammenhang mit der Anwendung von ABILIFY bei Patienten mit bipolarer Manie (Inzidenz von 5 % oder mehr und ABILIFY 15 mg Inzidenz mindestens doppelt so hoch wie unter Placebo) sind in Tabelle 16 aufgeführt.
Weniger häufige Nebenwirkungen bei Erwachsenen
Tabelle 17 listet die gepoolte, auf den nächsten Prozentwert gerundete Inzidenz von Nebenwirkungen auf, die während der Akuttherapie (bis zu 6 Wochen bei Schizophrenie und bis zu 3 Wochen bei bipolarer Manie) auftraten, einschließlich nur jener Reaktionen, die bei 2 % oder mehr auftraten Patienten, die mit ABILIFY (Dosen ≥ 2 mg/Tag) behandelt wurden und bei denen die Inzidenz bei Patienten, die mit ABILIFY 20 mg behandelt wurden, größer war als die Inzidenz bei Patienten, die im kombinierten Datensatz mit Placebo behandelt wurden.
Eine Untersuchung der Untergruppen der Bevölkerung ergab keine eindeutigen Hinweise auf eine unterschiedliche Inzidenz von Nebenwirkungen auf der Grundlage von Alter, Geschlecht oder ethnischer Zugehörigkeit.
Erwachsene Patienten mit Zusatztherapie bei bipolarer Manie
Die folgenden Ergebnisse basieren auf einer placebokontrollierten Studie mit erwachsenen Patienten mit bipolarer Störung, in der ABILIFY 15 mg in Dosen von 15 oder 30 mg/Tag als Begleittherapie mit Lithium oder Valproat verabreicht wurde.
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung
In einer Studie mit Patienten, die bereits entweder Lithium oder Valproat als Monotherapie vertragen, betrug die Abbruchrate aufgrund von Nebenwirkungen 12 % bei Patienten, die zusätzlich mit ABILIFY behandelt wurden, verglichen mit 6 % bei Patienten, die zusätzlich Placebo erhielten. Die häufigsten unerwünschten Arzneimittelwirkungen im Zusammenhang mit dem Absetzen bei den mit ABILIFY zusätzlich behandelten Patienten im Vergleich zu den mit Placebo behandelten Patienten waren Akathisie (5 % bzw. 1 %) und Tremor (2 % bzw. 1 %).
Häufig beobachtete Nebenwirkungen
Die häufig beobachteten Nebenwirkungen im Zusammenhang mit der zusätzlichen Gabe von ABILIFY und Lithium oder Valproat bei Patienten mit bipolarer Manie (Inzidenz von 5 % oder mehr und mindestens doppelt so hoch wie bei der zusätzlichen Gabe von Placebo) waren: Akathisie, Schlaflosigkeit und extrapyramidale Störung.
Weniger häufige Nebenwirkungen bei erwachsenen Patienten mit Zusatztherapie bei bipolarer Manie
Tabelle 18 listet die Häufigkeit, gerundet auf den nächsten Prozentsatz, von Nebenwirkungen auf, die während der Akutbehandlung (bis zu 6 Wochen) auftraten, einschließlich nur jener Reaktionen, die bei 2 % oder mehr der Patienten auftraten, die mit ABILIFY (Dosen von 15 oder 30 mg/Tag) und Lithium oder Valproat und bei denen die Inzidenz bei Patienten, die mit dieser Kombination behandelt wurden, größer war als die Inzidenz bei Patienten, die mit Placebo plus Lithium oder Valproat behandelt wurden.
Pädiatrische Patienten (13 bis 17 Jahre) mit Schizophrenie
Die folgenden Ergebnisse basieren auf einer 6-wöchigen placebokontrollierten Studie, in der ABILIFY oral in Dosen von 2 bis 30 mg/Tag verabreicht wurde.
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung
Die Inzidenz von Behandlungsabbrüchen aufgrund von Nebenwirkungen bei mit ABILIFY behandelten und mit Placebo behandelten pädiatrischen Patienten (13 bis 17 Jahre) betrug 5 % bzw. 2 %.
Häufig beobachtete Nebenwirkungen
Häufig beobachtete Nebenwirkungen im Zusammenhang mit der Anwendung von ABILIFY 10 mg bei jugendlichen Patienten mit Schizophrenie (Inzidenz von 5 % oder mehr und ABILIFY-Inzidenz mindestens doppelt so hoch wie bei Placebo) waren extrapyramidale Störungen, Somnolenz und Tremor.
Pädiatrische Patienten (10 bis 17 Jahre) mit bipolarer Manie
Die folgenden Ergebnisse basieren auf einer 4-wöchigen placebokontrollierten Studie, in der ABILIFY oral in Dosen von 10 oder 30 mg/Tag verabreicht wurde.
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung
Die Inzidenz von Behandlungsabbrüchen aufgrund von Nebenwirkungen bei mit ABILIFY behandelten und mit Placebo behandelten pädiatrischen Patienten (10 bis 17 Jahre) betrug 7 % bzw. 2 %.
Häufig beobachtete Nebenwirkungen
Häufig beobachtete Nebenwirkungen im Zusammenhang mit der Anwendung von ABILIFY 20 mg bei pädiatrischen Patienten mit bipolarer Manie (Inzidenz von 5 % oder mehr und ABILIFY-Inzidenz mindestens doppelt so hoch wie bei Placebo) sind in Tabelle 19 aufgeführt.
Pädiatrische Patienten (6 bis 17 Jahre) mit autistischer Störung
Die folgenden Ergebnisse basieren auf zwei 8-wöchigen placebokontrollierten Studien, in denen ABILIFY 20 mg oral in Dosen von 2 bis 15 mg/Tag verabreicht wurde.
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung
Die Inzidenz von Behandlungsabbrüchen aufgrund von Nebenwirkungen bei mit ABILIFY behandelten und mit Placebo behandelten pädiatrischen Patienten (6 bis 17 Jahre) betrug 10 % bzw. 8 %.
Häufig beobachtete Nebenwirkungen
Häufig beobachtete Nebenwirkungen im Zusammenhang mit der Anwendung von ABILIFY bei pädiatrischen Patienten mit autistischer Störung (Inzidenz von 5 % oder mehr und ABILIFY 10 mg Inzidenz mindestens doppelt so hoch wie bei Placebo) sind in Tabelle 20 aufgeführt.
Pädiatrische Patienten (6 bis 18 Jahre) mit Tourette-Krankheit
Die folgenden Ergebnisse basieren auf einer 8-wöchigen und einer 10-wöchigen placebokontrollierten Studie, in denen ABILIFY 15 mg oral in Dosen von 2 bis 20 mg/Tag verabreicht wurde.
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung
Die Inzidenz von Behandlungsabbrüchen aufgrund von Nebenwirkungen bei mit ABILIFY behandelten und mit Placebo behandelten pädiatrischen Patienten (6 bis 18 Jahre) betrug 7 % bzw. 1 %.
Häufig beobachtete Nebenwirkungen
Häufig beobachtete Nebenwirkungen im Zusammenhang mit der Anwendung von ABILIFY bei pädiatrischen Patienten mit Tourette-Krankheit (Inzidenz von 5 % oder mehr und Inzidenz von ABILIFY 10 mg mindestens doppelt so hoch wie bei Placebo) sind in Tabelle 21 aufgeführt.
Weniger häufige Nebenwirkungen bei pädiatrischen Patienten (6 bis 18 Jahre) mit Schizophrenie, bipolarer Manie, autistischer Störung oder Tourette-Störung
Tabelle 22 führt die gepoolte, auf den nächsten Prozentsatz gerundete Inzidenz von Nebenwirkungen auf, die während der Akuttherapie auftraten (bis zu 6 Wochen bei Schizophrenie, bis zu 4 Wochen bei bipolarer Manie, bis zu 8 Wochen bei autistischer Störung und bis zu 10 Wochen bei Morbus Tourette), einschließlich der Reaktionen, die bei 2 % oder mehr der mit ABILIFY (Dosen ≥ 2 mg/Tag) behandelten pädiatrischen Patienten auftraten und deren Inzidenz bei mit ABILIFY 10 mg behandelten Patienten größer war als die Inzidenz bei mit ABILIFY behandelten Patienten Placebo.
Erwachsene Patienten, die ABILIFY als Zusatzbehandlung einer Major Depression erhalten
Die folgenden Ergebnisse basieren auf einem Pool von zwei placebokontrollierten Studien an Patienten mit schweren depressiven Störungen, in denen ABILIFY 20 mg in Dosen von 2 mg bis 20 mg als Zusatzbehandlung zu einer fortgesetzten antidepressiven Therapie verabreicht wurde.
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung
Die Inzidenz von Behandlungsabbrüchen aufgrund von Nebenwirkungen betrug 6 % bei Patienten, die zusätzlich mit ABILIFY behandelt wurden, und 2 % bei Patienten, die zusätzlich mit Placebo behandelt wurden.
Häufig beobachtete Nebenwirkungen
Die häufig beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von ABILIFY 15 mg zusätzlich bei Patienten mit schweren depressiven Störungen (Inzidenz von 5 % oder mehr und ABILIFY 15 mg Inzidenz mindestens doppelt so hoch wie bei Placebo) waren: Akathisie, Unruhe, Schlaflosigkeit, Verstopfung, Müdigkeit und verschwommene Sicht.
Weniger häufige Nebenwirkungen bei erwachsenen Patienten mit Major Depression
Tabelle 23 listet die gepoolte, auf den nächsten Prozentsatz gerundete Inzidenz von Nebenwirkungen auf, die während der Akuttherapie (bis zu 6 Wochen) auftraten, einschließlich nur der Nebenwirkungen, die bei 2 % oder mehr der Patienten auftraten, die mit ABILIFY (Dosen ≥ 2,0) als Zusatztherapie behandelt wurden mg/Tag) und bei denen die Inzidenz bei Patienten, die zusätzlich mit ABILIFY 10 mg behandelt wurden, größer war als die Inzidenz bei Patienten, die im kombinierten Datensatz zusätzlich mit Placebo behandelt wurden.
Patienten mit Unruhe im Zusammenhang mit Schizophrenie oder bipolarer Manie (intramuskuläre Injektion)
Die folgenden Ergebnisse basieren auf einem Pool von drei placebokontrollierten Studien an Patienten mit Agitiertheit im Zusammenhang mit Schizophrenie oder bipolarer Manie, in denen ABILIFY 20 mg als Injektion in Dosen von 5,25 mg bis 15 mg verabreicht wurde.
Häufig beobachtete Nebenwirkungen
Es gab eine häufig beobachtete Nebenwirkung (Übelkeit) im Zusammenhang mit der Anwendung von ABILIFY 10 mg zur Injektion bei Patienten mit Agitiertheit in Verbindung mit Schizophrenie und bipolarer Manie (Inzidenz von 5 % oder mehr und ABILIFY 20 mg Inzidenz mindestens doppelt so hoch wie bei Placebo).
Weniger häufige Nebenwirkungen bei Patienten mit Unruhe im Zusammenhang mit Schizophrenie oder bipolarer Manie
Tabelle 24 listet die gepoolte, auf den nächsten Prozentsatz gerundete Inzidenz von Nebenwirkungen auf, die während der Akuttherapie (24 Stunden) auftraten, einschließlich nur der Nebenwirkungen, die bei 2 % oder mehr der mit ABILIFY-Injektion behandelten Patienten (Dosen ≥ 5,25 mg) auftraten /Tag) und bei denen die Inzidenz bei Patienten, die mit ABILIFY 15 mg Injektion behandelt wurden, größer war als die Inzidenz bei Patienten, die im kombinierten Datensatz mit Placebo behandelt wurden.
Dosisabhängige Nebenwirkungen
Schizophrenie
Die Dosis-Wirkungs-Beziehungen für das Auftreten behandlungsbedingter unerwünschter Ereignisse wurden in vier Studien mit erwachsenen Patienten mit Schizophrenie bewertet, in denen verschiedene Fixdosen (2, 5, 10, 15, 20 und 30 mg/Tag) von oralem ABILIFY mit Placebo verglichen wurden. Diese nach Studien stratifizierte Analyse zeigte, dass die einzige Nebenwirkung, die eine mögliche Dosis-Wirkungs-Beziehung aufwies und dann nur bei 30 mg am deutlichsten war, Somnolenz [einschließlich Sedierung] war; (Inzidenzen waren Placebo, 7,1 %; 10 mg, 8,5 %; 15 mg, 8,7 %; 20 mg, 7,5 %; 30 mg, 12,6 %).
In der Studie an pädiatrischen Patienten (im Alter von 13 bis 17 Jahren) mit Schizophrenie schienen drei häufige Nebenwirkungen eine mögliche Dosis-Wirkungs-Beziehung zu haben: Extrapyramidale Störung (Inzidenzen waren Placebo, 5,0 %; 10 mg, 13,0 %; 30 mg, 21,6 %); Schläfrigkeit (Inzidenzen waren Placebo, 6,0 %; 10 mg, 11,0 %; 30 mg, 21,6 %); und Tremor (Inzidenzen waren Placebo, 2,0 %; 10 mg, 2,0 %; 30 mg, 11,8 %).
Bipolare Manie
In der Studie an pädiatrischen Patienten (10 bis 17 Jahre) mit bipolarer Manie hatten vier häufige Nebenwirkungen nach 4 Wochen eine mögliche Dosis-Wirkungs-Beziehung; extrapyramidale Störung (Inzidenz war Placebo, 3,1 %; 10 mg, 12,2 %; 30 mg, 27,3 %); Schläfrigkeit (Inzidenzen waren Placebo, 3,1 %; 10 mg, 19,4 %; 30 mg, 26,3 %); Akathisie (Inzidenzen waren Placebo, 2,1 %; 10 mg, 8,2 %; 30 mg, 11,1 %); und Speichelüberschuss (Inzidenzen waren Placebo, 0 %; 10 mg, 3,1 %; 30 mg, 8,1 %).
Autistische Störung
In einer Studie an pädiatrischen Patienten (im Alter von 6 bis 17 Jahren) mit autistischer Störung hatte eine häufige Nebenwirkung eine mögliche Dosis-Wirkungs-Beziehung: Müdigkeit (Inzidenzen waren Placebo, 0 %; 5 mg, 3,8 %; 10 mg, 22,0 %; 15 mg, 18,5 %).
Tourette-Krankheit
In einer Studie mit pädiatrischen Patienten (im Alter von 7 bis 17 Jahren) mit Tourette-Krankheit gab es bei keiner der häufigen Nebenwirkungen eine Dosis-Wirkungs-Beziehung.
Extrapyramidale Symptome
Schizophrenie
In placebokontrollierten Kurzzeitstudien zu Schizophrenie bei Erwachsenen betrug die Inzidenz der berichteten EPS-bezogenen Ereignisse, ausgenommen Ereignisse im Zusammenhang mit Akathisie, bei mit ABILIFY behandelten Patienten 13 % vs. 12 % bei Placebo; und die Inzidenz von Akathisie-bedingten Ereignissen bei mit ABILIFY behandelten Patienten betrug 8 % gegenüber 4 % bei Placebo. In der placebokontrollierten Kurzzeitstudie zu Schizophrenie bei pädiatrischen Patienten (13 bis 17 Jahre) betrug die Inzidenz der gemeldeten EPS-bezogenen Ereignisse, ausgenommen Ereignisse im Zusammenhang mit Akathisie, bei den mit ABILIFY behandelten Patienten 25 % gegenüber 7 % Placebo; und die Inzidenz von Akathisie-bedingten Ereignissen bei mit ABILIFY behandelten Patienten betrug 9 % gegenüber 6 % bei Placebo.
Objektiv gesammelte Daten aus diesen Studien wurden auf der Simpson Angus Rating Scale (für EPS), der Barnes Akathisia Scale (für Akathisie) und den Assessments of Involuntary Movement Scales (für Dyskinesien) gesammelt. In den Schizophrenie-Studien bei Erwachsenen zeigten die objektiv gesammelten Daten keinen Unterschied zwischen ABILIFY 10 mg und Placebo, mit Ausnahme der Barnes-Akathisie-Skala (ABILIFY 20 mg, 0,08; Placebo, -0,05). In der Schizophrenie-Studie bei Kindern (13 bis 17 Jahre) zeigten die objektiv gesammelten Daten keinen Unterschied zwischen ABILIFY 20 mg und Placebo, mit Ausnahme der Simpson-Angus-Bewertungsskala (ABILIFY 20 mg, 0,24; Placebo, -0,29).
In ähnlicher Weise wurden in einer placebokontrollierten Langzeitstudie (26 Wochen) zu Schizophrenie bei Erwachsenen objektiv Daten zur Simpson-Angus-Rating-Skala (für EPS), zur Barnes-Akathisie-Skala (für Akathisie) und zu den Assessments of Involuntary erhoben Bewegungsskalen (für Dyskinesien) zeigten keinen Unterschied zwischen ABILIFY und Placebo.
Bipolare Manie
In den placebokontrollierten Kurzzeitstudien zur bipolaren Manie bei Erwachsenen betrug die Inzidenz der gemeldeten EPS-bezogenen Ereignisse, ausgenommen Ereignisse im Zusammenhang mit Akathisie, bei mit ABILIFY behandelten Patienten mit Monotherapie 16 % gegenüber 8 % bei Placebo und der Inzidenz von Akathisie-bedingte Ereignisse bei mit Monotherapie ABILIFY behandelten Patienten betrug 13 % gegenüber 4 % bei Placebo. In der 6-wöchigen placebokontrollierten Studie bei bipolarer Manie zur Zusatztherapie mit Lithium oder Valproat betrug die Inzidenz der berichteten EPS-bezogenen Ereignisse, ausgenommen Ereignisse im Zusammenhang mit Akathisie, bei mit ABILIFY zusätzlich behandelten Patienten 15 % gegenüber 8 % bei Zusatztherapie Placebo und die Inzidenz von Akathisie-bedingten Ereignissen bei Patienten, die zusätzlich mit ABILIFY behandelt wurden, betrug 19 % gegenüber 5 % für adjunktives Placebo. In der placebokontrollierten Kurzzeitstudie zu bipolarer Manie bei pädiatrischen Patienten (10 bis 17 Jahre) betrug die Inzidenz der gemeldeten EPS-bezogenen Ereignisse, ausgenommen Ereignisse im Zusammenhang mit Akathisie, bei den mit ABILIFY behandelten Patienten 26 % gegenüber 5 %. für Placebo und die Inzidenz von Akathisie-bedingten Ereignissen bei mit ABILIFY behandelten Patienten betrug 10 % gegenüber 2 % für Placebo.
In den Studien zur bipolaren Manie mit ABILIFY als Monotherapie zeigten die Simpson Angus Rating Scale und die Barnes Akathisia Scale einen signifikanten Unterschied zwischen ABILIFY 15 mg und Placebo (ABILIFY, 0,50; Placebo, -0,01 und ABILIFY 10 mg, 0,21; Placebo, -0,05). Die Veränderungen in der Bewertung der Skalen zur unwillkürlichen Bewegung waren für die ABILIFY 15 mg- und die Placebo-Gruppe ähnlich. In den Studien zur bipolaren Manie mit ABILIFY 20 mg als Begleittherapie mit entweder Lithium oder Valproat zeigten die Simpson Angus Rating Scale und die Barnes Akathisia Scale einen signifikanten Unterschied zwischen der Begleittherapie mit ABILIFY und der Begleittherapie mit Placebo (ABILIFY 20 mg, 0,73; Placebo, 0,07 und ABILIFY 10 mg, 0,30; Placebo 0,11). Die Veränderungen in den Skalen zur Beurteilung der unwillkürlichen Bewegung waren bei der Zusatztherapie mit ABILIFY 20 mg und der Zusatztherapie mit Placebo ähnlich. In der pädiatrischen (10 bis 17 Jahre) Kurzzeitstudie zu bipolarer Manie zeigte die Simpson-Angus-Bewertungsskala einen signifikanten Unterschied zwischen ABILIFY 10 mg und Placebo (ABILIFY 15 mg, 0,90; Placebo, -0,05). Die Veränderungen der Barnes Akathisia Scale und der Assessments of Involuntary Movement Scales waren für die ABILIFY 20 mg und Placebo-Gruppen ähnlich.
Depression
In den placebokontrollierten Kurzzeitstudien zu Major Depression betrug die Inzidenz der gemeldeten EPS-bezogenen Ereignisse, ausgenommen Ereignisse im Zusammenhang mit Akathisie, bei zusätzlich mit ABILIFY behandelten Patienten 8 % gegenüber 5 % bei zusätzlich mit Placebo behandelten Patienten; und die Inzidenz von Akathisie-bedingten Ereignissen bei zusätzlich mit ABILIFY behandelten Patienten betrug 25 % gegenüber 4 % bei zusätzlich mit Placebo behandelten Patienten.
In den Studien zu schweren Depressionen zeigten die Simpson Angus Rating Scale und die Barnes Akathisia Scale einen signifikanten Unterschied zwischen der Zusatztherapie mit ABILIFY und der Zusatztherapie mit Placebo (ABILIFY 10 mg, 0,31; Placebo, 0,03 und ABILIFY, 0,22; Placebo, 0,02). Die Änderungen in den Beurteilungen der Skalen zur unwillkürlichen Bewegung waren für die ergänzende ABILIFY- und die ergänzende Placebo-Gruppe ähnlich.
Autistische Störung
In den placebokontrollierten Kurzzeitstudien zu autistischen Störungen bei pädiatrischen Patienten (6 bis 17 Jahre) betrug die Inzidenz der gemeldeten EPS-bezogenen Ereignisse, ausgenommen Ereignisse im Zusammenhang mit Akathisie, bei mit ABILIFY behandelten Patienten 18 % gegenüber 2 %. für Placebo und die Inzidenz von Akathisie-bedingten Ereignissen bei mit ABILIFY behandelten Patienten betrug 3 % gegenüber 9 % für Placebo.
In den pädiatrischen (6 bis 17 Jahre) Kurzzeitstudien zu autistischen Störungen zeigte die Simpson-Angus-Bewertungsskala einen signifikanten Unterschied zwischen ABILIFY und Placebo (ABILIFY 20 mg, 0,1; Placebo, -0,4). Die Veränderungen der Barnes Akathisia Scale und der Assessments of Involuntary Movement Scales waren für die ABILIFY 10 mg und Placebo-Gruppen ähnlich.
Tourette-Krankheit
In den placebokontrollierten Kurzzeitstudien zum Tourette-Syndrom bei pädiatrischen Patienten (6 bis 18 Jahre) betrug die Inzidenz der gemeldeten EPS-bezogenen Ereignisse, ausgenommen Ereignisse im Zusammenhang mit Akathisie, bei den mit ABILIFY behandelten Patienten 7 % gegenüber 6 %. für Placebo und die Inzidenz von Akathisie-bedingten Ereignissen bei mit ABILIFY behandelten Patienten betrug 4 % gegenüber 6 % für Placebo.
In den pädiatrischen (6 bis 18 Jahre) Kurzzeit-Studien zur Tourette-Erkrankung waren die Änderungen in der Simpson-Angus-Bewertungsskala, der Barnes-Akathisie-Skala und der Bewertung der unwillkürlichen Bewegungsskala für ABILIFY 15 mg und Placebo nicht klinisch bedeutsam.
Unruhe im Zusammenhang mit Schizophrenie oder bipolarer Manie
In den placebokontrollierten Studien bei Patienten mit Agitiertheit im Zusammenhang mit Schizophrenie oder bipolarer Manie betrug die Inzidenz der berichteten EPS-bezogenen Ereignisse, ausgenommen Ereignisse im Zusammenhang mit Akathisie, bei den mit ABILIFY behandelten Patienten 2 % vs. 2 % bei Placebo und die Inzidenz von Akathisie- verbundene Ereignisse bei mit ABILIFY behandelten Patienten 2 % gegenüber 0 % bei Placebo. Objektiv gesammelte Daten auf der Simpson Angus Rating Scale (für EPS) und der Barnes Akathisia Scale (für Akathisie) für alle Behandlungsgruppen zeigten keinen Unterschied zwischen ABILIFY 10 mg und Placebo.
Dystonie
Bei empfindlichen Personen können in den ersten Tagen der Behandlung Symptome einer Dystonie, verlängerte abnorme Kontraktionen von Muskelgruppen, auftreten. Zu den dystonischen Symptomen gehören: Krämpfe der Nackenmuskulatur, die sich manchmal zu einem Engegefühl im Hals entwickeln, Schluckbeschwerden, Atembeschwerden und/oder Heraustreten der Zunge. Während diese Symptome bei niedrigen Dosen auftreten können, treten sie häufiger und mit größerer Schwere bei hochpotenten und höheren Dosen von Antipsychotika der ersten Generation auf. Ein erhöhtes Risiko einer akuten Dystonie wird bei Männern und jüngeren Altersgruppen beobachtet.
Zusätzliche in klinischen Studien beobachtete Ergebnisse
Nebenwirkungen in doppelblinden, Placebo-kontrollierten Langzeitstudien
Die Nebenwirkungen, die in einer 26-wöchigen, doppelblinden Studie zum Vergleich von oralem ABILIFY 10 mg und Placebo bei Patienten mit Schizophrenie berichtet wurden, stimmten im Allgemeinen mit denen überein, die in placebokontrollierten Kurzzeitstudien berichtet wurden, mit Ausnahme einer höheren Inzidenz von Tremor [8 % (12/153) für ABILIFY 20 mg vs. 2 % (3/153) für Placebo]. In dieser Studie war die Mehrzahl der Fälle von Tremor von leichter Intensität (8/12 leicht und 4/12 mäßig), trat früh in der Therapie auf (9/12 ≤ 49 Tage) und von begrenzter Dauer (7/12 ≤ 10 Tage). Tremor führte selten zum Absetzen (
Andere Nebenwirkungen, die während der Premarketing-Evaluierung von ABILIFY beobachtet wurden
Die folgende Auflistung enthält keine Reaktionen: 1) bereits in vorherigen Tabellen oder an anderer Stelle in der Kennzeichnung aufgeführt, 2) für die eine medikamentöse Ursache entfernt war, 3) die so allgemein waren, dass sie nicht aussagekräftig waren, 4) die als nicht signifikant angesehen wurden klinische Auswirkungen, oder 5) die mit einer gleichen oder geringeren Häufigkeit als Placebo auftraten.
Reaktionen werden nach Körpersystem gemäß den folgenden Definitionen kategorisiert: häufige Nebenwirkungen sind solche, die bei mindestens 1/100 Patienten auftreten; seltene Nebenwirkungen treten bei 1/100 bis 1/1000 Patienten auf; Seltene Reaktionen treten bei weniger als 1/1000 Patienten auf:
Erwachsene - Orale Verabreichung
Erkrankungen des Blut- und Lymphsystems: selten - Thrombozytopenie
Herzerkrankungen: selten - Bradykardie, Herzklopfen, selten - Vorhofflattern, Herzstillstand, AV-Block, Vorhofflimmern, Angina pectoris, Myokardischämie, Myokardinfarkt, Herz-Lungen-Versagen
Augenerkrankungen: selten - Photophobie; selten - Doppelbilder
Gastrointestinale Störungen: selten - gastroösophageale Refluxkrankheit
Allgemeine Erkrankungen und Bedingungen am Verabreichungsort: häufig - Asthenie; selten - peripheres Ödem, Brustschmerzen; selten - Gesichtsödem
Leber- und Gallenerkrankungen: selten - Hepatitis, Gelbsucht
Erkrankungen des Immunsystems : selten - Überempfindlichkeit
Verletzungen, Vergiftungen und durch Eingriffe bedingte Komplikationen: selten - fallen; selten - Hitzschlag
Untersuchungen: häufig – Gewichtsabnahme, selten – Leberenzyme erhöht, Blutzucker erhöht, Blutlaktatdehydrogenase erhöht, Gamma-Glutamyltransferase erhöht; selten - Prolaktin im Blut erhöht, Harnstoff im Blut erhöht, Kreatinin im Blut erhöht, Bilirubin im Blut erhöht, QT im Elektrokardiogramm verlängert, glykosyliertes Hämoglobin erhöht
Stoffwechsel- und Ernährungsstörungen: häufig - Anorexie; selten - Hypokaliämie, Hyponatriämie, Hypoglykämie
Erkrankungen des Bewegungsapparates und des Bindegewebes: selten - Muskelschwäche, Muskelverspannungen; selten - Rhabdomyolyse, eingeschränkte Mobilität
Erkrankungen des Nervensystems: selten - Parkinsonismus, Gedächtnisstörungen, Zahnradstarrheit, Hypokinesie, Bradykinesie; selten - Akinese, Myoklonus, Koordinationsstörung, Sprachstörung, Grand-Mal-Anfall;
Psychische Störungen: selten - Aggression, Libidoverlust, Delirium; selten - gesteigerte Libido, Anorgasmie, Tic, Mordgedanken, Katatonie, Schlafwandeln
Nieren- und Harnwegserkrankungen: selten - Harnverhalt, Nykturie
Störungen des Fortpflanzungssystems und der Brust: selten - erektile Dysfunktion; selten - Gynäkomastie, unregelmäßige Menstruation, Amenorrhoe, Brustschmerzen, Priapismus
Erkrankungen der Atemwege, des Brustraums und des Mediastinums: selten - verstopfte Nase, Dyspnoe
Erkrankungen der Haut und des Unterhautgewebes: selten - Hautausschlag, Hyperhidrose, Juckreiz, Lichtempfindlichkeitsreaktion, Alopezie; selten - Urtikaria
Gefäßerkrankungen: selten - Hypotonie, Bluthochdruck
Pädiatrische Patienten – Orale Verabreichung
Die meisten Nebenwirkungen, die in der gepoolten Datenbank von 1.686 pädiatrischen Patienten im Alter von 6 bis 18 Jahren beobachtet wurden, wurden auch bei Erwachsenen beobachtet. Weitere Nebenwirkungen, die bei Kindern und Jugendlichen beobachtet wurden, sind unten aufgeführt.
Augenerkrankungen selten - Augenkrise
Gastrointestinale Störungen: selten - Zunge trocken, Zungenkrämpfe
Untersuchungen: häufig - Insulin im Blut erhöht
Erkrankungen des Nervensystems: selten - Sprechen im Schlaf
Nieren- und Harnwegserkrankungen häufig - Enuresis
Erkrankungen der Haut und des Unterhautgewebes: selten - Hirsutismus
Erwachsene - Intramuskuläre Injektion
Die meisten Nebenwirkungen, die in der gepoolten Datenbank von 749 mit ABILIFY-Injektion behandelten erwachsenen Patienten beobachtet wurden, wurden auch in der erwachsenen Population beobachtet, die mit oralem ABILIFY behandelt wurde. Weitere Nebenwirkungen, die bei der ABILIFY-Injektionspopulation beobachtet wurden, sind unten aufgeführt.
Allgemeine Erkrankungen und Bedingungen am Verabreichungsort: ≥1/100 Patienten - Reaktion an der Injektionsstelle; ≥1/1000 Patienten und
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von ABILIFY nach der Zulassung festgestellt. Da diese Reaktionen freiwillig von einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen: Auftreten von allergischen Reaktionen (anaphylaktische Reaktion, Angioödem, Laryngospasmus, Pruritus/Urtikaria oder oropharyngealer Spasmus), pathologisches Spielen , Schluckauf und Blutzuckerschwankungen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Arzneimittel mit klinisch bedeutsamen Wechselwirkungen mit ABILIFY
Arzneimittel ohne klinisch bedeutsame Wechselwirkungen mit ABILIFY
Basierend auf pharmakokinetischen Studien ist keine Dosisanpassung von ABILIFY erforderlich, wenn es gleichzeitig mit Famotidin, Valproat, Lithium oder Lorazepam verabreicht wird.
Darüber hinaus ist keine Dosisanpassung für Substrate von CYP2D6 (z. B. Dextromethorphan, Fluoxetin, Paroxetin oder Venlafaxin), CYP2C9 (z. B. Warfarin), CYP2C19 (z. B. Omeprazol, Warfarin, Escitalopram) oder CYP3A4 (z. B. Dextromethorphan) erforderlich. bei gleichzeitiger Verabreichung mit ABILIFY. Darüber hinaus ist keine Dosisanpassung für Valproat, Lithium, Lamotrigin, Lorazepam oder Sertralin erforderlich, wenn sie zusammen mit ABILIFY verabreicht werden [siehe KLINISCHE PHARMAKOLOGIE ].
Drogenmissbrauch und -abhängigkeit
Kontrollierte Substanz
ABILIFY ist keine kontrollierte Substanz.
Missbrauch
ABILIFY wurde beim Menschen nicht systematisch auf sein Potenzial für Missbrauch, Toleranz oder körperliche Abhängigkeit untersucht. Folglich sollten Patienten sorgfältig auf Drogenmissbrauch in der Vorgeschichte untersucht werden, und solche Patienten sollten engmaschig auf Anzeichen von Missbrauch oder Missbrauch von ABILIFY 20 mg beobachtet werden (z. B. Toleranzentwicklung, Dosissteigerungen, Suchtverhalten).
Abhängigkeit
In Studien zur körperlichen Abhängigkeit bei Affen wurden Entzugserscheinungen nach plötzlichem Absetzen der Einnahme beobachtet. Während die klinischen Studien keine Tendenz zu Drogensuchtverhalten aufzeigten, waren diese Beobachtungen nicht systematisch und es ist nicht möglich, auf der Grundlage dieser begrenzten Erfahrung vorherzusagen, in welchem Ausmaß ein ZNS-aktives Medikament missbraucht, abgezweigt, und/oder nach der Vermarktung missbraucht werden.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Erhöhte Sterblichkeit bei älteren Patienten mit demenzbedingter Psychose
Erhöhte Sterblichkeit
Ältere Patienten mit demenzbedingter Psychose, die mit Antipsychotika behandelt werden, haben ein erhöhtes Sterberisiko. ABILIFY (Aripiprazol) ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen [siehe UMKÄSTENER WARNHINWEIS].
Sicherheitserfahrung bei älteren Patienten mit Psychose im Zusammenhang mit der Alzheimer-Krankheit
In drei 10-wöchigen, placebokontrollierten Studien mit ABILIFY 10 mg bei älteren Patienten mit Psychosen im Zusammenhang mit der Alzheimer-Krankheit (n = 938; mittleres Alter: 82,4 Jahre; Bereich: 56–99 Jahre) wurden die Nebenwirkungen festgestellt Bei einer Inzidenz von ≥ 3 % und einer mindestens doppelt so hohen Inzidenz von ABILIFY 15 mg gegenüber Placebo wurden Lethargie [Placebo 2 %, ABILIFY 5 %], Somnolenz (einschließlich Sedierung) [Placebo 3 %, ABILIFY 8 %] und Inkontinenz (hauptsächlich) berichtet , Harninkontinenz) [Placebo 1 %, ABILIFY 5 %], übermäßiger Speichelfluss [Placebo 0 %, ABILIFY 4 %] und Benommenheit [Placebo 1 %, ABILIFY 4 %].
Die Sicherheit und Wirksamkeit von ABILIFY 15 mg bei der Behandlung von Patienten mit Psychosen im Zusammenhang mit Demenz wurden nicht nachgewiesen. Wenn der verschreibende Arzt solche Patienten mit ABILIFY 15 mg behandelt, prüfen Sie das Auftreten von Schluckbeschwerden oder übermäßiger Schläfrigkeit, die zu einer versehentlichen Verletzung oder Aspiration prädisponieren könnten [siehe Eingerahmte Warnung ].
Zerebrovaskuläre unerwünschte Ereignisse, einschließlich Schlaganfall
In placebokontrollierten klinischen Studien (zwei Studien mit flexibler Dosierung und eine Studie mit fester Dosierung) zu Demenz-assoziierter Psychose kam es bei mit ABILIFY behandelten Patienten zu einer erhöhten Inzidenz von zerebrovaskulären Nebenwirkungen (z. B. Schlaganfall, transitorische ischämische Attacke), einschließlich Todesfällen ( Durchschnittsalter: 84 Jahre; Bereich: 78-88 Jahre). In der Fixdosis-Studie gab es eine statistisch signifikante Dosis-Wirkungs-Beziehung für zerebrovaskuläre unerwünschte Ereignisse bei Patienten, die mit ABILIFY behandelt wurden. ABILIFY ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen [siehe Eingerahmte Warnung ].
Selbstmordgedanken und -verhalten bei Kindern, Jugendlichen und jungen Erwachsenen
Bei Patienten mit schwerer depressiver Störung (MDD), sowohl bei Erwachsenen als auch bei Kindern, kann es zu einer Verschlechterung ihrer Depression und/oder zum Auftreten von Suizidgedanken und -verhalten (Suizidalität) oder zu ungewöhnlichen Verhaltensänderungen kommen, unabhängig davon, ob sie Antidepressiva einnehmen oder nicht Das Risiko kann bestehen bleiben, bis eine signifikante Remission eintritt. Selbstmord ist ein bekanntes Risiko für Depressionen und bestimmte andere psychiatrische Störungen, und diese Störungen selbst sind die stärksten Prädiktoren für Selbstmord. Es besteht jedoch seit langem die Sorge, dass Antidepressiva bei bestimmten Patienten in den frühen Phasen der Behandlung eine Rolle bei der Induktion einer Verschlechterung der Depression und dem Auftreten von Suizidalität spielen könnten. Gepoolte Analysen von Placebo-kontrollierten Kurzzeitstudien mit Antidepressiva (SSRIs und andere) zeigten, dass diese Medikamente das Risiko von Suizidgedanken und -verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen (Alter 18-24) mit MDD erhöhen und andere psychiatrische Störungen. Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; bei Erwachsenen ab 65 Jahren kam es unter Antidepressiva im Vergleich zu Placebo zu einer Reduktion.
Die gepoolten Analysen placebokontrollierter Studien bei Kindern und Jugendlichen mit MDD, Zwangsstörung (OCD) oder anderen psychiatrischen Erkrankungen umfassten insgesamt 24 Kurzzeitstudien mit 9 Antidepressiva bei über 4400 Patienten. Die gepoolten Analysen placebokontrollierter Studien bei Erwachsenen mit MDD oder anderen psychiatrischen Erkrankungen umfassten insgesamt 295 Kurzzeitstudien (mediane Dauer von 2 Monaten) mit 11 Antidepressiva bei über 77.000 Patienten. Es gab beträchtliche Schwankungen des Suizidalitätsrisikos zwischen den Medikamenten, aber bei fast allen untersuchten Medikamenten eine Tendenz zu einem Anstieg bei den jüngeren Patienten. Es gab Unterschiede im absoluten Suizidalitätsrisiko zwischen den verschiedenen Indikationen, mit der höchsten Inzidenz bei MDD. Die Risikounterschiede (Medikament vs. Placebo) waren jedoch relativ stabil innerhalb der Altersschichten und über Indikationen hinweg. Diese Risikounterschiede (Arzneimittel-Placebo-Unterschied in der Anzahl der Fälle von Suizidalität pro 1000 behandelten Patienten) sind in Tabelle 5 aufgeführt.
In keiner der pädiatrischen Studien kam es zu Suiziden. In den Studien mit Erwachsenen gab es Suizide, aber die Anzahl reichte nicht aus, um zu einer Schlussfolgerung über die Wirkung des Medikaments auf Suizide zu gelangen.
Es ist nicht bekannt, ob sich das Suizidrisiko auf eine längerfristige Anwendung erstreckt, dh über mehrere Monate hinaus. Es gibt jedoch erhebliche Hinweise aus placebokontrollierten Erhaltungsstudien bei Erwachsenen mit Depressionen, dass die Anwendung von Antidepressiva das Wiederauftreten von Depressionen verzögern kann.
Alle Patienten, die mit Antidepressiva aus beliebigen Indikationen behandelt werden, sollten angemessen überwacht und engmaschig auf eine klinische Verschlechterung, Suizidalität und ungewöhnliche Verhaltensänderungen beobachtet werden, insbesondere während der ersten Monate einer medikamentösen Therapie oder bei Dosisänderungen oder -steigerungen oder abnimmt.
Die folgenden Symptome, Angst, Agitiertheit, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Unruhe), Hypomanie und Manie, wurden bei erwachsenen und pädiatrischen Patienten berichtet, die mit Antidepressiva sowohl gegen MDD als auch gegen MDD behandelt wurden andere Indikationen, sowohl psychiatrische als auch nichtpsychiatrische. Obwohl ein kausaler Zusammenhang zwischen dem Auftreten solcher Symptome und entweder der Verschlechterung einer Depression und/oder dem Auftreten suizidaler Impulse nicht hergestellt werden konnte, besteht die Sorge, dass solche Symptome Vorboten einer aufkommenden Suizidalität sein könnten.
Bei Patienten, deren Depression sich anhaltend verschlimmert oder die an Suizidalität oder Symptomen leiden, die Vorboten einer Verschlechterung der Depression oder Suizidalität sein könnten, sollte eine Änderung des therapeutischen Schemas, einschließlich eines möglichen Absetzens der Medikation, in Betracht gezogen werden, insbesondere wenn diese Symptome schwerwiegend und abrupt sind zu Beginn oder waren nicht Teil der Symptome des Patienten.
Familien und Betreuer von Patienten, die wegen einer schweren depressiven Störung oder anderen Indikationen, sowohl psychiatrischen als auch nichtpsychiatrischen, mit Antidepressiva behandelt werden, sollten auf die Notwendigkeit aufmerksam gemacht werden, Patienten auf das Auftreten von Unruhe, Reizbarkeit, ungewöhnlichen Verhaltensänderungen und den anderen oben beschriebenen Symptomen zu überwachen , sowie das Auftreten von Suizidalität, und solche Symptome unverzüglich dem Gesundheitsdienstleister zu melden. Eine solche Überwachung sollte die tägliche Beobachtung durch Familien und Betreuer umfassen. Verschreibungen für ABILIFY sollten für die kleinste Tablettenmenge im Einklang mit einem guten Patientenmanagement ausgestellt werden, um das Risiko einer Überdosierung zu verringern.
Screening von Patienten auf bipolare Störungen
Eine schwere depressive Episode kann die anfängliche Präsentation einer bipolaren Störung sein. Es wird allgemein angenommen (obwohl dies nicht in kontrollierten Studien nachgewiesen wurde), dass die Behandlung einer solchen Episode mit einem Antidepressivum allein die Wahrscheinlichkeit des Auftretens einer gemischten/manischen Episode bei Patienten mit einem Risiko für eine bipolare Störung erhöhen kann. Ob eines der oben beschriebenen Symptome eine solche Konversion darstellt, ist unbekannt. Vor Beginn der Behandlung mit einem Antidepressivum sollten Patienten mit depressiven Symptomen jedoch angemessen untersucht werden, um festzustellen, ob bei ihnen ein Risiko für eine bipolare Störung besteht; Ein solches Screening sollte eine detaillierte psychiatrische Vorgeschichte umfassen, einschließlich einer Familienanamnese von Selbstmord, bipolarer Störung und Depression.
Es ist zu beachten, dass ABILIFY 20 mg nicht zur Behandlung von Depressionen bei Kindern und Jugendlichen zugelassen ist.
Malignes neuroleptisches Syndrom (NMS)
Bei der Verabreichung von Antipsychotika, einschließlich ABILIFY, kann ein potenziell tödlicher Symptomkomplex auftreten, der manchmal als malignes neuroleptisches Syndrom (NMS) bezeichnet wird. In der weltweiten klinischen Datenbank traten während der Behandlung mit ABILIFY 15 mg seltene Fälle von NMS auf. Klinische Manifestationen von NMS sind Hyperpyrexie, Muskelrigidität, veränderter Geisteszustand und Anzeichen einer autonomen Instabilität (unregelmäßiger Puls oder Blutdruck, Tachykardie, Diaphorese und Herzrhythmusstörungen). Zusätzliche Anzeichen können erhöhte Kreatinphosphokinase, Myoglobinurie (Rhabdomyolyse) und akutes Nierenversagen sein.
Die diagnostische Beurteilung von Patienten mit diesem Syndrom ist kompliziert. Um zu einer Diagnose zu gelangen, ist es wichtig, Fälle auszuschließen, in denen das klinische Erscheinungsbild sowohl eine schwere medizinische Erkrankung (z. B. Pneumonie, systemische Infektion) als auch unbehandelte oder unzureichend behandelte extrapyramidale Zeichen und Symptome (EPS) umfasst. Andere wichtige Erwägungen bei der Differentialdiagnose umfassen die zentrale anticholinerge Toxizität, Hitzschlag, Drogenfieber und primäre Pathologie des Zentralnervensystems.
Das Management von NMS sollte umfassen: 1) sofortiges Absetzen von Antipsychotika und anderen Arzneimitteln, die für eine gleichzeitige Therapie nicht unbedingt erforderlich sind; 2) intensive symptomatische Behandlung und medizinische Überwachung; und 3) Behandlung aller begleitenden schwerwiegenden medizinischen Probleme, für die spezifische Behandlungen verfügbar sind. Es gibt keine allgemeine Übereinstimmung über spezifische pharmakologische Behandlungsschemata für unkompliziertes NMS.
Wenn ein Patient nach Genesung von NMS eine antipsychotische medikamentöse Behandlung benötigt, sollte die mögliche Wiederaufnahme der medikamentösen Therapie sorgfältig erwogen werden. Der Patient sollte sorgfältig überwacht werden, da Rezidive von NMS berichtet wurden.
Tardive Dyskinesie
Bei Patienten, die mit Antipsychotika behandelt werden, kann sich ein Syndrom potenziell irreversibler, unwillkürlicher, dyskinetischer Bewegungen entwickeln. Obwohl die Prävalenz des Syndroms bei älteren Menschen, insbesondere bei älteren Frauen, am höchsten zu sein scheint, ist es unmöglich, sich auf Prävalenzschätzungen zu verlassen, um zu Beginn einer antipsychotischen Behandlung vorherzusagen, welche Patienten wahrscheinlich das Syndrom entwickeln werden. Ob Antipsychotika sich in ihrem Potenzial unterscheiden, tardive Dyskinesie zu verursachen, ist nicht bekannt.
Es wird angenommen, dass das Risiko der Entwicklung einer tardiven Dyskinesie und die Wahrscheinlichkeit, dass sie irreversibel wird, mit der Dauer der Behandlung und der kumulativen Gesamtdosis der dem Patienten verabreichten Antipsychotika zunimmt. Das Syndrom kann sich jedoch, wenn auch viel seltener, nach relativ kurzen Behandlungszeiten bei niedrigen Dosen entwickeln.
Spätdyskinesie kann teilweise oder vollständig zurückgehen, wenn die antipsychotische Behandlung abgesetzt wird. Die antipsychotische Behandlung selbst kann jedoch die Anzeichen und Symptome des Syndroms unterdrücken (oder teilweise unterdrücken) und dadurch möglicherweise den zugrunde liegenden Prozess maskieren. Die Auswirkung der symptomatischen Unterdrückung auf den Langzeitverlauf des Syndroms ist unbekannt.
Angesichts dieser Erwägungen sollte ABILIFY so verschrieben werden, dass das Auftreten von Spätdyskinesien am wahrscheinlichsten minimiert wird. Eine chronische antipsychotische Behandlung sollte im Allgemeinen Patienten vorbehalten bleiben, die an einer chronischen Krankheit leiden, die (1) bekanntermaßen auf Antipsychotika anspricht und (2) für die alternative, ebenso wirksame, aber möglicherweise weniger schädliche Behandlungen nicht verfügbar oder angemessen sind. Bei Patienten, die eine chronische Behandlung benötigen, sollte die niedrigste Dosis und die kürzeste Behandlungsdauer angestrebt werden, die ein zufriedenstellendes klinisches Ansprechen bewirken. Die Notwendigkeit einer Fortsetzung der Behandlung sollte regelmäßig überprüft werden.
Wenn bei einem Patienten unter ABILIFY Anzeichen und Symptome einer tardiven Dyskinesie auftreten, sollte ein Absetzen des Arzneimittels in Betracht gezogen werden. Einige Patienten können jedoch trotz des Vorliegens des Syndroms eine Behandlung mit ABILIFY 15 mg benötigen.
Stoffwechselveränderungen
Atypische Antipsychotika wurden mit metabolischen Veränderungen wie Hyperglykämie/Diabetes mellitus, Dyslipidämie und Körpergewichtszunahme in Verbindung gebracht. Obwohl gezeigt wurde, dass alle Medikamente dieser Klasse einige metabolische Veränderungen hervorrufen, hat jedes Medikament sein eigenes spezifisches Risikoprofil.
Hyperglykämie/Diabetes mellitus
Hyperglykämie, in einigen Fällen extrem und verbunden mit Ketoazidose oder hyperosmolarem Koma oder Tod, wurde bei Patienten berichtet, die mit atypischen Antipsychotika behandelt wurden. Es liegen Berichte über Hyperglykämie bei Patienten vor, die mit ABILIFY behandelt wurden [siehe NEBENWIRKUNGEN ]. Die Beurteilung des Zusammenhangs zwischen der atypischen Anwendung von Antipsychotika und Glukoseanomalien wird durch die Möglichkeit eines erhöhten Hintergrundrisikos für Diabetes mellitus bei Patienten mit Schizophrenie und die zunehmende Inzidenz von Diabetes mellitus in der Allgemeinbevölkerung erschwert. Angesichts dieser Confounder ist die Beziehung zwischen der atypischen Anwendung von Antipsychotika und Hyperglykämie-bedingten unerwünschten Ereignissen nicht vollständig geklärt. Epidemiologische Studien deuten jedoch auf ein erhöhtes Risiko für Hyperglykämie-bedingte Nebenwirkungen bei Patienten hin, die mit atypischen Antipsychotika behandelt werden. Da ABILIFY zum Zeitpunkt der Durchführung dieser Studien nicht vermarktet wurde, ist nicht bekannt, ob ABILIFY mit diesem erhöhten Risiko verbunden ist. Präzise Risikoabschätzungen für Hyperglykämie-bedingte Nebenwirkungen bei Patienten, die mit atypischen Antipsychotika behandelt werden, sind nicht verfügbar.
Patienten mit einer gesicherten Diagnose von Diabetes mellitus, die mit atypischen Antipsychotika begonnen werden, sollten regelmäßig auf eine Verschlechterung der Glukosekontrolle überwacht werden. Patienten mit Risikofaktoren für Diabetes mellitus (z. B. Fettleibigkeit, Diabetes in der Familienanamnese), die eine Behandlung mit atypischen Antipsychotika beginnen, sollten zu Beginn der Behandlung und in regelmäßigen Abständen während der Behandlung einer Nüchtern-Blutzuckermessung unterzogen werden. Jeder Patient, der mit atypischen Antipsychotika behandelt wird, sollte auf Symptome einer Hyperglykämie einschließlich Polydipsie, Polyurie, Polyphagie und Schwäche überwacht werden. Patienten, die während der Behandlung mit atypischen Antipsychotika Symptome einer Hyperglykämie entwickeln, sollten sich einer Nüchtern-Blutzuckermessung unterziehen. In einigen Fällen klang die Hyperglykämie ab, wenn das atypische Antipsychotikum abgesetzt wurde; Einige Patienten benötigten jedoch trotz Absetzens des verdächtigen Medikaments eine Fortsetzung der antidiabetischen Behandlung.
Erwachsene
In einer Analyse von 13 placebokontrollierten Monotherapiestudien bei Erwachsenen, hauptsächlich mit Schizophrenie oder bipolarer Störung, war die mittlere Veränderung des Nüchternglukosespiegels bei mit ABILIFY behandelten Patienten (+4,4 mg/dl; mediane Exposition 25 Tage; N = 1057) nicht signifikant anders als bei mit Placebo behandelten Patienten (+2,5 mg/dl; mediane Exposition 22 Tage; N = 799). Tabelle 6 zeigt den Anteil der mit ABILIFY behandelten Patienten mit normalem und grenzwertigem Nüchternglukosewert zu Studienbeginn (mediane Exposition 25 Tage), die behandlungsbedingt hohe Nüchternglukosewerte aufwiesen, im Vergleich zu den mit Placebo behandelten Patienten (mediane Exposition 22 Tage).
Nach 24 Wochen war die mittlere Veränderung des Nüchternglukosespiegels bei den mit ABILIFY behandelten Patienten nicht signifikant anders als bei den mit Placebo behandelten Patienten [jeweils +2,2 mg/dl (n=42) und +9,6 mg/dl (n=28)]. .
Die mittlere Veränderung des Nüchternglukosespiegels bei zusätzlich mit ABILIFY behandelten Patienten mit Major Depression (+0,7 mg/dl; mediane Exposition 42 Tage; N=241) unterschied sich nicht signifikant von den mit Placebo behandelten Patienten (+0,8 mg/dl; Median). Exposition 42 Tage; N=246). Tabelle 7 zeigt den Anteil erwachsener Patienten mit Veränderungen des Nüchternglukosespiegels aus zwei Placebo-kontrollierten Begleitstudien (mediane Exposition 42 Tage) bei Patienten mit Major Depression.
Pädiatrische Patienten und Jugendliche
In einer Analyse von zwei placebokontrollierten Studien bei Jugendlichen mit Schizophrenie (13 bis 17 Jahre) und pädiatrischen Patienten mit bipolarer Störung (10 bis 17 Jahre) war die mittlere Veränderung des Nüchternglukosespiegels bei mit ABILIFY behandelten Patienten (+4,8 mg/dl; mit einer medianen Exposition von 43 Tagen; N=259) unterschied sich nicht signifikant von den mit Placebo behandelten Patienten (+1,7 mg/dl; mit einer medianen Exposition von 42 Tagen; N=123).
In einer Analyse von zwei placebokontrollierten Studien bei pädiatrischen und jugendlichen Patienten mit Reizbarkeit in Verbindung mit autistischer Störung (6 bis 17 Jahre) mit einer medianen Exposition von 56 Tagen war die mittlere Veränderung des Nüchternglukosespiegels bei mit ABILIFY behandelten Patienten (–0,2 mg /dL; N=83) unterschied sich nicht signifikant von den mit Placebo behandelten Patienten (–0,6 mg/dL; N=33).
In einer Analyse von zwei placebokontrollierten Studien bei pädiatrischen und jugendlichen Patienten mit Tourette-Syndrom (6 bis 18 Jahre) mit einer medianen Exposition von 57 Tagen war die mittlere Veränderung des Nüchternglukosespiegels bei mit ABILIFY behandelten Patienten (0,79 mg/dl; N = 90) unterschied sich nicht signifikant von den mit Placebo behandelten Patienten (–1,66 mg/dl; N = 58).
Tabelle 8 zeigt den Anteil der Patienten mit Veränderungen des Nüchternglukosespiegels aus den gepoolten jugendlichen Schizophrenie- und pädiatrischen bipolaren Patienten (mediane Exposition von 42–43 Tagen) aus zwei placebokontrollierten Studien bei pädiatrischen Patienten (6 bis 17 Jahre) mit Reizbarkeit mit autistischer Störung (mediane Exposition von 56 Tagen) und aus den beiden placebokontrollierten Studien bei pädiatrischen Patienten (6 bis 18 Jahre) mit Tourette-Syndrom (mediane Exposition von 57 Tagen).
Nach 12 Wochen war in den gepoolten Studien zu jugendlicher Schizophrenie und pädiatrischen bipolaren Störungen die mittlere Veränderung des Nüchternblutzuckers bei den mit ABILIFY behandelten Patienten nicht signifikant anders als bei den mit Placebo behandelten Patienten [+2,4 mg/dl (n=81) und +0,1 mg /dL (n=15).
Dyslipidämie
Bei Patienten, die mit atypischen Antipsychotika behandelt wurden, wurden unerwünschte Veränderungen der Lipide beobachtet.
Es gab keine signifikanten Unterschiede zwischen den mit ABILIFY und Placebo behandelten Patienten in Bezug auf den Anteil mit Änderungen von normalen zu klinisch signifikanten Werten für das Nüchtern-/Nicht-Nüchtern-Gesamtcholesterin, die Nüchtern-Triglyceride, die Nüchtern-LDLs und die Nüchtern-/Nicht-Nüchtern-HDLs. Analysen von Patienten mit einer mindestens 12- oder 24-wöchigen Exposition waren durch eine kleine Anzahl von Patienten begrenzt.
Erwachsene
Tabelle 9 zeigt den Anteil erwachsener Patienten, hauptsächlich aus gepoolten placebokontrollierten Monotherapie-Studien zu Schizophrenie und bipolaren Störungen, mit Veränderungen des Gesamtcholesterins (gepoolt aus 17 Studien; mediane Exposition 21 bis 25 Tage), Nüchtern-Triglyzeride (gepoolt aus acht Studien; mediane Exposition 42 Tage), Nüchtern-LDL-Cholesterin (gepoolt aus acht Studien; mediane Exposition 39 bis 45 Tage, außer bei mit Placebo behandelten Patienten mit normalen Nüchtern-LDL-Messwerten zu Studienbeginn, die eine mediane Behandlungsexposition von 24 Tagen hatten) und HDL-Cholesterin (gepoolt aus neun Studien). Studien; mediane Exposition 40 bis 42 Tage).
In Monotherapie-Studien mit Erwachsenen war der Anteil der Patienten nach 12 Wochen und 24 Wochen mit Änderungen von Normal zu Hoch beim Gesamtcholesterin (Nüchtern/Nicht-Nüchtern), Nüchtern-Triglyzeriden und Nüchtern-LDL-Cholesterin bei den mit ABILIFY und Placebo behandelten Patienten ähnlich: bei 12 Wochen, Gesamtcholesterin (fasten/nicht nüchtern), 1/71 (1,4 %) vs. 3/74 (4,1 %); Nüchtern-Triglyceride, 8/62 (12,9 %) vs. 5/37 (13,5 %); Nüchtern-LDL-Cholesterin, 0/34 (0 %) vs. 1/25 (4,0 %); und nach 24 Wochen, Gesamtcholesterin (fasten/nicht nüchtern), 1/42 (2,4 %) vs. 3/37 (8,1 %); Nüchtern-Triglyceride, 5/34 (14,7 %) vs. 5/20 (25 %); Nüchtern-LDL-Cholesterin, 0/22 (0 %) vs. 1/18 (5,6 %).
Tabelle 10 zeigt den Anteil der Patienten mit Veränderungen des Gesamtcholesterins (Nüchtern/Nichtfasten), Nüchterntriglyceride, Nüchtern-LDL-Cholesterin und HDL-Cholesterin aus zwei Placebo-kontrollierten Zusatzstudien bei erwachsenen Patienten mit Major Depression (mediane Exposition 42 Tage).
Pädiatrische Patienten und Jugendliche
Tabelle 11 zeigt den Anteil von Jugendlichen mit Schizophrenie (13 bis 17 Jahre) und pädiatrischen Patienten mit bipolarer Störung (10 bis 17 Jahre) mit Veränderungen des Gesamtcholesterins und des HDL-Cholesterins (gepoolt aus zwei placebokontrollierten Studien; mediane Exposition 42 bis 43 Tage ) und Nüchtern-Triglyceride (gepoolt aus zwei Placebo-kontrollierten Studien; mediane Exposition 42 bis 44 Tage).
In Monotherapie-Studien mit Jugendlichen mit Schizophrenie und pädiatrischen Patienten mit bipolarer Störung war der Anteil der Patienten nach 12 Wochen und 24 Wochen mit Änderungen von normal zu hoch beim Gesamtcholesterin (Nüchtern/Nicht-Nüchtern), Nüchtern-Triglyceriden und Nüchtern-LDL-Cholesterin zwischen ABILIFY ähnlich - und mit Placebo behandelte Patienten: nach 12 Wochen, Gesamtcholesterin (fasten/nicht nüchtern), 0/57 Â (0 %) vs. 0/15 (0 %); Nüchtern-Triglyceride, 2/72 (2,8 %) vs. 1/14 (7,1 %); und nach 24 Wochen, Gesamtcholesterin (fasten/nicht nüchtern), 0/36 (0 %) vs. 0/12 (0 %); Nüchtern-Triglyceride, 1/47 (2,1 %) bzw. 1/10 (10,0 %).
Tabelle 12 zeigt den Anteil der Patienten mit Veränderungen des Gesamtcholesterins (nüchtern/nicht nüchtern) und der Nüchterntriglyceride (mediane Exposition 56 Tage) und des HDL-Cholesterins (mediane Exposition 55 bis 56 Tage) aus zwei placebokontrollierten Studien mit pädiatrischen Patienten (6 bis 17 Jahre) mit Reizbarkeit im Zusammenhang mit autistischer Störung.
Tabelle 13 zeigt den Anteil der Patienten mit Veränderungen des Gesamtcholesterins (nüchtern/nicht nüchtern) und der Nüchterntriglyceride (mediane Exposition 57 Tage) und des HDL-Cholesterins (mediane Exposition 57 Tage) aus zwei placebokontrollierten Studien bei pädiatrischen Patienten (6 bis 18 Jahre). mit Tourette-Krankheit.
Gewichtszunahme
Bei atypischer Anwendung von Antipsychotika wurde eine Gewichtszunahme beobachtet. Eine klinische Überwachung des Gewichts wird empfohlen.
Erwachsene
In einer Analyse von 13 Placebo-kontrollierten Monotherapie-Studien, hauptsächlich bei gepoolter Schizophrenie und bipolarer Störung, mit einer medianen Exposition von 21 bis 25 Tagen, betrug die mittlere Veränderung des Körpergewichts bei den mit ABILIFY behandelten Patienten +0,3 kg (N = 1673) im Vergleich bis –0,1 kg (N=1100) bei Placebo-kontrollierten Patienten. Nach 24 Wochen betrug die mittlere Veränderung des Körpergewichts gegenüber dem Ausgangswert bei den mit ABILIFY behandelten Patienten –1,5 kg (n=73) im Vergleich zu –0,2 kg (n=46) bei den mit Placebo behandelten Patienten.
In den Studien, in denen ABILIFY zu Antidepressiva hinzugefügt wurde, erhielten die Patienten zunächst eine 8-wöchige Behandlung mit Antidepressiva, gefolgt von einer 6-wöchigen Behandlung mit ABILIFY 10 mg oder Placebo zusätzlich zu ihrer laufenden Behandlung mit Antidepressiva. Die mittlere Veränderung des Körpergewichts bei Patienten, die zusätzlich ABILIFY erhielten, betrug +1,7 kg (N = 347) im Vergleich zu +0,4 kg (N = 330) bei Patienten, die zusätzlich Placebo erhielten.
Tabelle 14 zeigt den Prozentsatz erwachsener Patienten mit einer Gewichtszunahme von ≥ 7 % des Körpergewichts nach Indikation.
Pädiatrische Patienten und Jugendliche
In einer Analyse von zwei placebokontrollierten Studien bei Jugendlichen mit Schizophrenie (13 bis 17 Jahre) und pädiatrischen Patienten mit bipolarer Störung (10 bis 17 Jahre) mit einer medianen Exposition von 42 bis 43 Tagen zeigte sich die mittlere Veränderung des Körpergewichts bei der Behandlung mit ABILIFY Patienten betrug +1,6 kg (N=381) im Vergleich zu +0,3 kg (N=187) bei den mit Placebo behandelten Patienten. Nach 24 Wochen ist die mittlere Veränderung des Körpergewichts gegenüber dem Ausgangswert in
ABILIFY-behandelte Patienten betrug +5,8 kg (n=62) im Vergleich zu +1,4 kg (n=13) bei Placebo-behandelten Patienten.
In zwei placebokontrollierten Kurzzeitstudien an Patienten (6 bis 17 Jahre) mit Reizbarkeit in Verbindung mit autistischer Störung mit einer medianen Exposition von 56 Tagen betrug die mittlere Veränderung des Körpergewichts bei mit ABILIFY behandelten Patienten +1,6 kg (n=209 ) im Vergleich zu +0,4 kg (n=98) bei mit Placebo behandelten Patienten.
In zwei placebokontrollierten Kurzzeitstudien an Patienten (6 bis 18 Jahre) mit Tourette-Syndrom mit einer medianen Exposition von 57 Tagen betrug die mittlere Veränderung des Körpergewichts bei mit ABILIFY behandelten Patienten +1,5 kg (n=105 ) im Vergleich zu +0,4 kg (n=66) bei mit Placebo behandelten Patienten.
Tabelle 15 zeigt den Prozentsatz der pädiatrischen und jugendlichen Patienten mit einer Gewichtszunahme von ≥ 7 % des Körpergewichts nach Indikation.
In einer offenen Studie, in die Patienten aus den beiden placebokontrollierten Studien mit Jugendlichen mit Schizophrenie (13 bis 17 Jahre) und pädiatrischen Patienten mit bipolarer Störung (10 bis 17 Jahre) aufgenommen wurden, schlossen 73,2 % der Patienten (238/325) 26 ab Wochen Therapie mit ABILIFY. Nach 26 Wochen nahmen 32,8 % der Patienten ≥ 7 % ihres Körpergewichts zu, nicht angepasst an normales Wachstum. Zur Anpassung an normales Wachstum wurden z-Scores abgeleitet (gemessen in Standardabweichungen [SD]), die das natürliche Wachstum von pädiatrischen Patienten und Jugendlichen durch Vergleiche mit alters- und geschlechtsangepassten Bevölkerungsstandards normalisieren. Eine Z-Score-Änderung
In einer offenen Studie, in die Patienten aus zwei placebokontrollierten Kurzzeitstudien, Patienten (6 bis 17 Jahre) mit Reizbarkeit im Zusammenhang mit autistischer Störung sowie De-novo-Patienten, eingeschlossen wurden, schlossen 60,3 % (199/330) eine ab Therapiejahr mit ABILIFY. Die mittlere Veränderung des Gewichts-z-Scores betrug 0,26 SDs bei Patienten, die > 9 Monate behandelt wurden.
Bei der Behandlung von pädiatrischen Patienten für alle Indikationen sollte die Gewichtszunahme überwacht und im Vergleich zu der erwarteten Gewichtszunahme bei normalem Wachstum bewertet werden.
Pathologisches Glücksspiel und andere zwanghafte Verhaltensweisen
Post-Marketing-Fallberichte deuten darauf hin, dass Patienten während der Einnahme von Aripiprazol einen intensiven Drang verspüren können, insbesondere zum Spielen, und die Unfähigkeit, diesen Drang zu kontrollieren. Andere zwanghafte Triebe, die seltener berichtet werden, umfassen: sexuelle Triebe, Einkaufen, Essen oder Essattacken und andere impulsive oder zwanghafte Verhaltensweisen. Da Patienten diese Verhaltensweisen möglicherweise nicht als abnormal erkennen, ist es wichtig, dass verschreibende Ärzte Patienten oder ihre Betreuer speziell über die Entwicklung neuer oder intensiver Spieltriebe, zwanghafter sexueller Triebe, zwanghaftes Einkaufen, Essanfälle oder zwanghaftes Essen oder andere Triebe während der Behandlung befragen mit Aripiprazol. Es sollte beachtet werden, dass Impulskontrollsymptome mit der zugrunde liegenden Störung in Verbindung gebracht werden können. In einigen Fällen, wenn auch nicht in allen Fällen, wurde berichtet, dass der Drang aufhörte, wenn die Dosis reduziert oder das Medikament abgesetzt wurde. Zwangshandlungen können dem Patienten und anderen schaden, wenn sie nicht erkannt werden. Erwägen Sie eine Dosisreduktion oder das Absetzen des Medikaments, wenn ein Patient einen solchen Drang entwickelt.
Orthostatische Hypotonie
ABILIFY 20 mg kann orthostatische Hypotonie verursachen, möglicherweise aufgrund seines α1-adrenergen Rezeptorantagonismus. Die Inzidenz orthostatischer Hypotonie-assoziierter Ereignisse aus Placebo-kontrollierten Kurzzeitstudien mit erwachsenen Patienten mit oralem ABILIFY (n = 2467) umfasste (ABILIFY 20 mg Inzidenz, Placebo-Inzidenz) orthostatische Hypotonie (1 %, 0,3 %), posturaler Schwindel ( 0,5 %, 0,3 %) und Synkope (0,5 %, 0,4 %); bei pädiatrischen Patienten im Alter von 6 bis 18 Jahren (n = 732) unter oraler ABILIFY-Behandlung traten orthostatische Hypotonie (0,5 %, 0 %), posturaler Schwindel (0,4 %, 0 %) und Synkope (0,2 %, 0 %) auf; und bei Patienten unter ABILIFY-Injektion (n = 501) schlossen orthostatische Hypotonie (0,6 %, 0 %), posturaler Schwindel (0,2 %, 0,5 %) und Synkope (0,4 %, 0 %) ein [siehe NEBENWIRKUNGEN ].
Die Inzidenz einer signifikanten orthostatischen Blutdruckänderung (definiert als eine Abnahme des systolischen Blutdrucks um ≥ 20 mmHg, begleitet von einem Anstieg der Herzfrequenz um ≥ 25 bpm im Vergleich zu Werten im Stehen und im Liegen) unter ABILIFY unterschied sich nicht signifikant von Placebo (ABILIFY-Inzidenz , Placebo-Inzidenz): bei oral mit ABILIFY behandelten erwachsenen Patienten (4 %, 2 %), bei pädiatrischen oral
Mit ABILIFY behandelte Patienten im Alter von 6 bis 18 Jahren (0,4 %, 1 %) oder mit ABILIFY 15 mg Injektion behandelte Patienten (3 %, 2 %).
ABILIFY 20 mg sollte bei Patienten mit bekannter kardiovaskulärer Erkrankung (Myokardinfarkt oder ischämische Herzerkrankung in der Vorgeschichte, Herzinsuffizienz oder Reizleitungsstörungen), zerebrovaskulärer Erkrankung oder Zuständen, die Patienten für Hypotonie prädisponieren würden (Dehydratation, Hypovolämie und Behandlung mit Antihypertensiva), mit Vorsicht angewendet werden Medikamente) [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Wenn zusätzlich zur ABILIFY-Injektionsbehandlung eine parenterale Benzodiazepin-Therapie als notwendig erachtet wird, sollten die Patienten auf übermäßige Sedierung und orthostatische Hypotonie überwacht werden [siehe Abschnitt 4.4]. WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Stürze
Antipsychotika, einschließlich ABILIFY 10 mg, können Somnolenz, posturale Hypotonie, motorische und sensorische Instabilität verursachen, was zu Stürzen und folglich zu Knochenbrüchen oder anderen Verletzungen führen kann. Führen Sie bei Patienten mit Krankheiten, Zuständen oder Medikamenten, die diese Wirkungen verschlimmern könnten, zu Beginn einer antipsychotischen Behandlung und wiederholt bei Patienten unter antipsychotischer Langzeittherapie eine Sturzrisikobewertung durch.
Leukopenie, Neutropenie und Agranulozytose
In klinischen Studien und/oder Erfahrungen nach der Markteinführung wurden Fälle von Leukopenie und Neutropenie in zeitlichem Zusammenhang mit Antipsychotika, einschließlich ABILIFY, berichtet. Agranulozytose wurde ebenfalls berichtet.
Zu den möglichen Risikofaktoren für Leukopenie/Neutropenie gehören eine vorbestehende niedrige Anzahl weißer Blutkörperchen (WBC)/absolute Neutrophilenzahl (ANC) und eine arzneimittelinduzierte Leukopenie/Neutropenie in der Vorgeschichte. Führen Sie bei Patienten mit klinisch signifikant niedrigem WBC/ANC oder arzneimittelinduzierter Leukopenie/Neutropenie in der Vorgeschichte in den ersten Behandlungsmonaten häufig ein großes Blutbild (CBC) durch. Erwägen Sie bei solchen Patienten das Absetzen von ABILIFY beim ersten Anzeichen eines klinisch signifikanten Rückgangs der WBC, wenn keine anderen ursächlichen Faktoren vorliegen.
Patienten mit klinisch signifikanter Neutropenie auf Fieber oder andere Symptome oder Anzeichen einer Infektion überwachen und unverzüglich behandeln, wenn solche Symptome oder Anzeichen auftreten. Setzen Sie ABILIFY 20 mg bei Patienten mit schwerer Neutropenie (absolute Neutrophilenzahl
Krampfanfälle/Krämpfe
In placebokontrollierten Kurzzeitstudien traten bei 0,1 % (3/2467) der nicht diagnostizierten erwachsenen Patienten, die mit oralem ABILIFY 20 mg behandelt wurden, bei Patienten mit Krampfanfällen in der Vorgeschichte und bei 0,1 % (1/732) der pädiatrischen Patienten auf (6 bis 18 Jahre) und bei 0,2 % (1/501) der mit ABILIFY 15 mg Injektion behandelten erwachsenen Patienten.
Wie andere Antipsychotika sollte ABILIFY 15 mg bei Patienten mit Krampfanfällen in der Vorgeschichte oder mit Erkrankungen, die die Krampfschwelle senken, mit Vorsicht angewendet werden. Zustände, die die Anfallsschwelle senken, können in einer Bevölkerung von 65 Jahren oder älter häufiger auftreten.
Potenzial für kognitive und motorische Beeinträchtigungen
ABILIFY kann, wie andere Antipsychotika, möglicherweise das Urteilsvermögen, das Denkvermögen oder die motorischen Fähigkeiten beeinträchtigen. Beispielsweise wurde in placebokontrollierten Kurzzeitstudien Schläfrigkeit (einschließlich Sedierung) wie folgt berichtet (ABILIFY-Inzidenz, Placebo-Inzidenz): bei erwachsenen Patienten (n = 2467), die mit oralem ABILIFY behandelt wurden (11 %, 6 %), bei pädiatrischen Patienten im Alter von 6 bis 17 Jahren (n = 611) (24 %, 6 %) und bei erwachsenen Patienten (n = 501) unter ABILIFY-Injektion (9 %, 6 %). Somnolenz (einschließlich Sedierung) führte in placebokontrollierten Kurzzeitstudien bei 0,3 % (8/2467) der erwachsenen Patienten und 3 % (20/732) der pädiatrischen Patienten (6 bis 18 Jahre) zum Abbruch der oralen Behandlung mit ABILIFY 10 mg. führte jedoch nicht zum Abbruch der ABILIFY-Injektion bei erwachsenen Patienten.
Trotz der relativ geringfügig erhöhten Inzidenz dieser Ereignisse im Vergleich zu Placebo sollten Patienten davor gewarnt werden, gefährliche Maschinen, einschließlich Kraftfahrzeuge, zu bedienen, bis sie hinreichend sicher sind, dass die Therapie mit ABILIFY 15 mg keine nachteiligen Auswirkungen auf sie hat.
Regulierung der Körpertemperatur
Eine Störung der Fähigkeit des Körpers, die Körperkerntemperatur zu senken, wurde Antipsychotika zugeschrieben. Bei der Verschreibung von ABILIFY 10 mg für Patienten, die an Zuständen leiden, die zu einer Erhöhung der Körperkerntemperatur beitragen können, ist bei der Verschreibung von ABILIFY 10 mg angemessene Vorsicht geboten (z. [sehen NEBENWIRKUNGEN ].
Selbstmord
Die Möglichkeit eines Suizidversuchs ist bei psychotischen Erkrankungen, bipolaren Störungen und schweren depressiven Störungen inhärent, und eine engmaschige Überwachung von Hochrisikopatienten sollte eine medikamentöse Therapie begleiten. Verschreibungen für ABILIFY sollten für die kleinste Menge ausgestellt werden, die mit einem guten Patientenmanagement vereinbar ist, um das Risiko einer Überdosierung zu verringern [siehe NEBENWIRKUNGEN ].
Dysphagie
Ösophagus-Motilitätsstörungen und Aspiration wurden mit der Anwendung von Antipsychotika, einschließlich ABILIFY, in Verbindung gebracht. Aspirationspneumonie ist eine häufige Ursache für Morbidität und Mortalität bei älteren Patienten, insbesondere bei Patienten mit fortgeschrittener Alzheimer-Demenz. ABILIFY und andere Antipsychotika sollten bei Patienten mit einem Risiko für eine Aspirationspneumonie mit Vorsicht angewendet werden [siehe Erhöhte Sterblichkeit bei älteren Patienten mit demenzbedingter Psychose  und NEBENWIRKUNGEN ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente ).
Besprechen Sie die folgenden Probleme mit Patienten, denen ABILIFY verschrieben wurde:
Klinische Verschlechterung von Depression und Suizidrisiko
Patienten, ihre Familien und ihre Betreuer sollten ermutigt werden, auf das Auftreten von Angstzuständen, Unruhe, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Unruhe), Hypomanie, Manie und anderen ungewöhnlichen Verhaltensänderungen zu achten , Verschlechterung von Depressionen und Suizidgedanken, besonders früh während der Behandlung mit Antidepressiva und wenn die Dosis nach oben oder unten angepasst wird. Familien und Betreuer von Patienten sollten angewiesen werden, täglich auf das Auftreten solcher Symptome zu achten, da Änderungen abrupt sein können. Solche Symptome sollten dem verschreibenden Arzt oder medizinischen Fachpersonal des Patienten gemeldet werden, insbesondere wenn sie schwerwiegend sind, abrupt einsetzen oder nicht zu den Symptomen des Patienten gehörten. Symptome wie diese können mit einem erhöhten Risiko für Suizidgedanken und -verhalten verbunden sein und weisen auf die Notwendigkeit einer sehr engmaschigen Überwachung und möglicherweise einer Änderung der Medikation hin [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Verschreibende Ärzte oder andere Angehörige der Gesundheitsberufe sollten Patienten, ihre Familien und ihre Betreuer über die Vorteile und Risiken im Zusammenhang mit der Behandlung mit ABILIFY informieren und sie bezüglich der angemessenen Anwendung beraten. Für ABILIFY ist ein Medikationsleitfaden für Patienten mit Informationen zu „Antidepressiva, Depressionen und anderen schweren psychischen Erkrankungen sowie Selbstmordgedanken oder -handlungen“ verfügbar. Der verschreibende Arzt oder medizinisches Fachpersonal sollte Patienten, ihre Familien und ihre Betreuer anweisen, den Medikationsleitfaden zu lesen, und ihnen helfen, seinen Inhalt zu verstehen. Den Patienten sollte Gelegenheit gegeben werden, den Inhalt des Medikationsleitfadens zu diskutieren und Antworten auf eventuelle Fragen zu erhalten. Es ist zu beachten, dass ABILIFY nicht als Einzelwirkstoff zur Behandlung von Depressionen zugelassen ist und bei pädiatrischen schweren depressiven Störungen nicht untersucht wurde.
Pathologisches Glücksspiel und andere zwanghafte Verhaltensweisen
Weisen Sie die Patienten und ihre Betreuer auf die Möglichkeit hin, dass sie während der Einnahme von Aripiprazol unter zwanghaftem Drang zum Einkaufen, starkem Spieldrang, zwanghaftem sexuellem Drang, Essattacken und/oder anderen zwanghaften Drang leiden und die Unfähigkeit, diesen Drang zu kontrollieren. In einigen Fällen, aber nicht in allen, wurde berichtet, dass der Drang aufhörte, wenn die Dosis reduziert oder gestoppt wurde [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Verwendung einer im Mund zerfallenden Tablette
Öffnen Sie die Blisterpackung erst, wenn Sie zur Verabreichung bereit sind. Öffnen Sie zur Entnahme einer einzelnen Tablette die Verpackung und ziehen Sie die Folie von der Blisterpackung ab, um die Tablette freizulegen. Drücken Sie die Tablette nicht durch die Folie, da dies die Tablette beschädigen könnte. Entnehmen Sie die Tablette sofort nach dem Öffnen der Blisterpackung mit trockenen Händen und legen Sie die gesamte oral zerfallende ABILIFY DISCMELT-Tablette auf die Zunge. Die Tablette zerfällt schnell im Speichel. Es wird empfohlen, ABILIFY DISCMELT ohne Flüssigkeit einzunehmen. Bei Bedarf kann es jedoch mit Flüssigkeit eingenommen werden. Versuchen Sie nicht, die Tablette zu teilen.
Beeinträchtigung der kognitiven und motorischen Leistung
Da ABILIFY das Urteilsvermögen, Denkvermögen oder motorische Fähigkeiten beeinträchtigen kann, sollten Patienten davor gewarnt werden, gefährliche Maschinen, einschließlich Autos, zu bedienen, bis sie hinreichend sicher sind, dass die ABILIFY-Therapie sie nicht nachteilig beeinflusst [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Begleitmedikation
Patienten sollten angewiesen werden, ihren Arzt zu informieren, wenn sie verschreibungspflichtige oder rezeptfreie Arzneimittel einnehmen oder deren Einnahme planen, da die Möglichkeit von Wechselwirkungen besteht [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Hitzeeinwirkung und Austrocknung
Die Patienten sollten über angemessene Vorsichtsmaßnahmen zur Vermeidung von Überhitzung und Dehydration aufgeklärt werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Zuckergehalt
Die Patienten sollten darauf hingewiesen werden, dass jeder ml ABILIFY 10 mg Lösung zum Einnehmen 400 mg Saccharose und 200 mg Fructose enthält.
Schwangerschaft
Empfehlen Sie Patientinnen, ihren Arzt zu informieren, wenn sie während der Behandlung mit ABILIFY schwanger werden oder eine Schwangerschaft beabsichtigen. Weisen Sie die Patienten darauf hin, dass ABILIFY 20 mg bei einem Neugeborenen extrapyramidale Symptome und/oder Entzugssymptome (Agitiertheit, Hypertonie, Hypotonie, Tremor, Somnolenz, Atemnot und Fütterstörung) hervorrufen kann. Weisen Sie die Patientinnen darauf hin, dass es ein Schwangerschaftsregister gibt, das den Ausgang der Schwangerschaft bei Frauen überwacht, die während der Schwangerschaft ABILIFY 15 mg ausgesetzt waren [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Phenylketonurika
Phenylalanin ist ein Bestandteil von Aspartam. Jede oral zerfallende ABILIFY DISCMELT-Tablette enthält die folgenden Mengen: 10 mg, 1,12 mg Phenylalanin und 15 mg, 1,68 mg Phenylalanin.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Karzinogenitätsstudien über die gesamte Lebensdauer wurden an ICR-Mäusen, F344-Ratten und Sprague-Dawley (SD)-Ratten durchgeführt. Aripiprazol wurde über 2 Jahre mit der Nahrung in Dosen von 1, 3, 10 und 30 mg/kg/Tag an ICR-Mäuse und 1, 3 und 10 mg/kg/Tag an F344-Ratten (0,2, 0,5, 2 bzw 5-mal und 0,3-, 1- und 3-mal die MRHD von 30 mg/Tag, bezogen auf mg/m² Körperoberfläche). Darüber hinaus wurden SD-Ratten 2 Jahre lang oral mit 10, 20, 40 und 60 mg/kg/Tag dosiert, was dem 3-, 6-, 13- und 19-fachen der MRHD, basierend auf mg/m² Körperoberfläche, entspricht. Aripiprazol induzierte keine Tumore bei männlichen Mäusen oder männlichen Ratten. Bei weiblichen Mäusen war die Inzidenz von Adenomen der Hypophyse und Adenokarzinomen der Brustdrüse sowie von Adenoakanthomen bei Futterdosen von 3 bis 30 mg/kg/Tag (das 0,5- bis 5-fache der MRHD) erhöht. Bei weiblichen Ratten war die Inzidenz von Brustdrüsenfibroadenomen bei einer diätetischen Dosis von 10 mg/kg/Tag (das Dreifache der MRHD) erhöht; und die Inzidenzen von Nebennierenrindenkarzinomen und kombinierten Adenomen/Karzinomen der Nebennierenrinde waren bei einer oralen Dosis von 60 mg/kg/Tag (das 19-fache der MRHD) erhöht.
Bei Nagetieren wurde nach chronischer Verabreichung anderer Antipsychotika eine Zunahme von Neoplasien der Brustdrüse, der Hypophyse und des endokrinen Pankreas festgestellt, und es wird angenommen, dass dies durch einen verlängerten Dopamin-D2-Rezeptor-Antagonismus und Hyperprolaktinämie vermittelt wird. Serumprolaktin wurde in den Studien zur Karzinogenität von Aripiprazol nicht gemessen. Allerdings wurden bei weiblichen Mäusen in einer 13-wöchigen Ernährungsstudie bei Dosen, die mit Brustdrüsen- und Hypophysentumoren in Verbindung gebracht wurden, Erhöhungen der Prolaktinspiegel im Serum beobachtet. Serumprolaktin war bei weiblichen Ratten in 4-wöchigen und 13-wöchigen Ernährungsstudien bei der mit Brustdrüsentumoren assoziierten Dosis nicht erhöht. Die Relevanz der Befunde von Prolaktin-vermittelten endokrinen Tumoren bei Nagern für das Humanrisiko ist unklar.
Mutagenese
Das mutagene Potenzial von Aripiprazol wurde im bakteriellen In-vitro-Rückmutationstest, im bakteriellen In-vitro-DNA-Reparaturtest, im In-vitro-Vorwärtsgenmutationstest in Maus-Lymphomzellen und im In-vitro-Chromosomenaberrationstest in der Lunge des Chinesischen Hamsters (CHL) getestet. Zellen, der In-vivo-Mikronukleus-Assay bei Mäusen und der ungeplante DNA-Synthese-Assay bei Ratten. Aripiprazol und ein Metabolit (2,3-DCPP) waren im In-vitro-Chromosomenaberrationstest in CHL-Zellen mit und ohne metabolische Aktivierung klastogen. Der Metabolit 2,3DCPP erhöhte die numerischen Aberrationen im In-vitro-Assay in CHL-Zellen ohne metabolische Aktivierung. Eine positive Antwort wurde im In-vivo-Mikronukleus-Assay bei Mäusen erhalten; Die Reaktion war jedoch auf einen Mechanismus zurückzuführen, der als für den Menschen nicht relevant erachtet wurde.
Beeinträchtigung der Fruchtbarkeit
Weibliche Ratten wurden ab 2 Wochen vor der Paarung bis zum 7. Trächtigkeitstag oral mit Aripiprazol in Dosen von 2, 6 und 20 mg/kg/Tag behandelt, was dem 0,6-, 2- und 6-fachen der MRHD von 30 mg/Tag entspricht mg/m² Körperoberfläche. Unregelmäßigkeiten im Östruszyklus und vermehrte Gelbkörper wurden bei allen Dosierungen beobachtet, aber es wurde keine Beeinträchtigung der Fertilität beobachtet. Beim 2- und 6-fachen der MRHD wurde ein erhöhter Präimplantationsverlust beobachtet, und beim 6-fachen der MRHD wurde ein verringertes fötales Gewicht beobachtet.
Männliche Ratten wurden 9 Wochen vor der Paarung bis zur Paarung oral mit Aripiprazol in Dosen von 20, 40 und 60 mg/kg/Tag behandelt, was dem 6-, 13- und 19-fachen der MRHD von 30 mg/Tag entspricht, basierend auf mg/ m² Körperoberfläche. Störungen der Spermatogenese wurden beim 19-fachen der MRHD und Prostataatrophie beim 13- und 19-fachen der MRHD ohne Beeinträchtigung der Fertilität beobachtet.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschafts-Expositionsregister
Es gibt ein Schwangerschafts-Expositionsregister, das die Schwangerschaftsausgänge bei Frauen überwacht, die während der Schwangerschaft atypischen Antipsychotika, einschließlich ABILIFY, ausgesetzt waren. Gesundheitsdienstleister werden ermutigt, Patienten zu registrieren, indem sie sich unter 1-866-961-2388 an das National Pregnancy Registry for Atypical Antipsychotics wenden oder http://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/ besuchen.
Zusammenfassung der Risiken
Neugeborene, die während des dritten Trimenons der Schwangerschaft Antipsychotika, einschließlich ABILIFY 20 mg, ausgesetzt waren, haben ein erhöhtes Risiko für extrapyramidale Symptome und/oder Entzugserscheinungen nach der Entbindung (siehe Klinische Überlegungen ). Insgesamt verfügbare Daten aus veröffentlichten epidemiologischen Studien an schwangeren Frauen, die Aripiprazol ausgesetzt waren, haben kein arzneimittelbedingtes Risiko für schwerwiegende Geburtsfehler, Fehlgeburten oder unerwünschte Folgen für Mutter oder Fötus ergeben (siehe Daten ). Es bestehen Risiken für die Mutter im Zusammenhang mit einer unbehandelten Schizophrenie, einer Bipolar-I-Störung oder einer schweren depressiven Störung und einer Exposition gegenüber Antipsychotika, einschließlich ABILIFY, während der Schwangerschaft (siehe Klinische Überlegungen ).
In Reproduktionsstudien an Tieren führte die orale und intravenöse Verabreichung von Aripiprazol während der Organogenese bei Ratten und/oder Kaninchen in Dosierungen, die dem 10- bzw. 19-Fachen der maximal empfohlenen Humandosis (MRHD) von 30 mg/Tag, basierend auf mg/m² Körperoberfläche, entsprachen fetaler Tod, vermindertes fetales Gewicht, Hodenhochstand, verzögerte Skelettverknöcherung, Skelettanomalien und Zwerchfellhernie. Die orale und intravenöse Verabreichung von Aripiprazol während der prä- und postnatalen Phase bei Ratten in Dosen, die dem 10-fachen der MRHD, basierend auf mg/m² Körperoberfläche, entsprachen, führte zu einer verlängerten Trächtigkeit, Totgeburten, einem verringerten Gewicht der Jungtiere und einer verringerten Überlebensrate der Jungtiere (siehe Daten ).
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2–4 % bzw. 15–20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryonale/fetales Risiko
Es besteht ein Risiko für die Mutter durch unbehandelte Schizophrenie oder Bipolar-I-Störung, einschließlich eines erhöhten Rückfallrisikos, Krankenhausaufenthalts und Suizids. Schizophrenie und Bipolar-I-Störung sind mit erhöhten unerwünschten perinatalen Folgen, einschließlich Frühgeburten, verbunden. Es ist nicht bekannt, ob dies eine direkte Folge der Krankheit oder anderer komorbider Faktoren ist.
Eine prospektive Längsschnittstudie folgte 201 schwangeren Frauen mit einer Vorgeschichte von schweren depressiven Störungen, die euthymisch waren und zu Beginn der Schwangerschaft Antidepressiva einnahmen. Frauen, die Antidepressiva während der Schwangerschaft absetzten, erlitten mit größerer Wahrscheinlichkeit einen Rückfall einer schweren Depression als Frauen, die Antidepressiva weiter einnahmen. Berücksichtigen Sie das Risiko einer unbehandelten Depression, wenn Sie die Behandlung mit Antidepressiva während der Schwangerschaft und nach der Geburt abbrechen oder ändern.
Fetale/neonatale Nebenwirkungen
Extrapyramidale und/oder Entzugserscheinungen, einschließlich Agitiertheit, Hypertonie, Hypotonie, Tremor, Somnolenz, Atemnot und Fütterstörungen, wurden bei Neugeborenen berichtet, die während des dritten Trimenons der Schwangerschaft Antipsychotika (einschließlich ABILIFY) ausgesetzt waren. Diese Symptome haben unterschiedliche Schweregrade. Überwachen Sie Neugeborene auf extrapyramidale und/oder Entzugserscheinungen und behandeln Sie die Symptome entsprechend. Einige Neugeborene erholten sich ohne spezifische Behandlung innerhalb von Stunden oder Tagen; andere erforderten einen längeren Krankenhausaufenthalt.
Daten
Menschliche Daten
Veröffentlichte Daten aus Beobachtungsstudien, Geburtsregistern und Fallberichten über die Anwendung atypischer Antipsychotika während der Schwangerschaft zeigen keinen eindeutigen Zusammenhang mit Antipsychotika und schweren Geburtsfehlern. Eine retrospektive Studie aus einer Medicaid-Datenbank mit 9258 Frauen, die während der Schwangerschaft Antipsychotika ausgesetzt waren, zeigte kein insgesamt erhöhtes Risiko für schwere Geburtsfehler.
Tierdaten
In Tierversuchen zeigte Aripiprazol Entwicklungstoxizität, einschließlich möglicher teratogener Wirkungen bei Ratten und Kaninchen.
Bei trächtigen Ratten, die während der Organogenese oral mit Aripiprazol in Dosen von 3, 10 und 30 mg/kg/Tag behandelt wurden, was etwa dem 1-, 3- und 10-fachen der MRHD von 30 mg/Tag, bezogen auf mg/m² Körperoberfläche, entspricht, a Beim 10-fachen der MRHD wurden eine leichte Verlängerung der Schwangerschaft und eine Verzögerung der fötalen Entwicklung beobachtet, die durch ein verringertes fötales Gewicht und einen Hodenhochstand erkennbar waren. Eine verzögerte Skelettossifikation wurde beim 3- und 10-fachen der MRHD beobachtet. Bei entbundenen Nachkommen wurden vermehrt hepatodiaphragmatische Knoten und Zwerchfellhernien beim 10-fachen der MRHD beobachtet (die anderen Dosisgruppen wurden nicht auf diese Befunde untersucht). Postnatal wurde eine verzögerte Vaginalöffnung beim 3- und 10-fachen der MRHD beobachtet. Eine Beeinträchtigung der Reproduktionsleistung (verringerte Fertilitätsrate, Gelbkörper, Implantate, lebende Föten und erhöhter Verlust nach der Implantation, wahrscheinlich vermittelt durch Auswirkungen auf weibliche Nachkommen) wurde beim 10-fachen der MRHD beobachtet; es gab jedoch keine Hinweise darauf, dass diese Auswirkungen auf die Entwicklung sekundär zur maternalen Toxizität waren.
Bei trächtigen Ratten, denen Aripiprazol während der Organogenese intravenös in Dosen von 3, 9 und 27 mg/kg/Tag injiziert wurde, was dem 1-, 3- und 9-fachen der MRHD von 30 mg/Tag, bezogen auf mg/m² Körperoberfläche, entspricht, nahm die Dosis ab fötales Gewicht und verzögerte Skelettossifikation wurden beim 9-fachen der MRHD beobachtet; diese Dosis verursachte auch maternale Toxizität.
Bei trächtigen Kaninchen, die während der Organogenese oral mit Aripiprazol in Dosen von 10, 30 und 100 mg/kg/Tag behandelt wurden, was dem 6-, 19- und 65-fachen der MRHD von 30 mg/Tag, bezogen auf mg/m² Körperoberfläche, entspricht, verringerte sich die maternale Dosis Nahrungsaufnahme und vermehrte Abtreibungen sowie erhöhte fötale Sterblichkeit wurden beim 65-fachen der MHRD beobachtet. Beim 19- und 65-fachen der MRHD wurden ein verringertes fötales Gewicht und eine erhöhte Inzidenz von fusionierten Sternebrae beobachtet.
Bei trächtigen Kaninchen, denen Aripiprazol während der Organogenese in Dosen von 3, 10 und 30 mg/kg/Tag intravenös injiziert wurde, was dem 2-, 6- und 19-fachen der MRHD von 30 mg/Tag, bezogen auf mg/m² Körperoberfläche, entspricht, nahm die Dosis ab fötales Gewicht, erhöhte fötale Anomalien (hauptsächlich Skelett) und verminderte fötale Skelettossifikation wurden beim 19-fachen der MRHD beobachtet; diese Dosis verursachte auch maternale Toxizität. Die fötale Dosis ohne Wirkung betrug 10 mg/kg/Tag, was dem 6-fachen der MRHD entspricht.
Bei Ratten, die vom 17. bis zum 21. Tag der Trächtigkeit peri- und postnatal mit Aripiprazol in Dosen von 3, 10 und 30 mg/kg/Tag behandelt wurden, was dem 1-, 3- und 10-fachen der MRHD von 30 mg/Tag entspricht basierend auf mg/m² Körperoberfläche wurden beim 10-fachen der MHRD eine leichte maternale Toxizität und eine leicht verlängerte Trächtigkeit beobachtet. Bei dieser Dosis wurde auch eine Zunahme von Totgeburten und eine Abnahme des Welpengewichts (das bis ins Erwachsenenalter anhält) und der Überlebensrate beobachtet.
Bei Ratten, denen vom 6. Trächtigkeitstag bis zum 20. Laktationstag Aripiprazol in Dosen von 3, 8 und 20 mg/kg/Tag intravenös injiziert wurde, was dem 1-, 3- und 6-fachen der MRHD von 30 mg/Tag, bezogen auf mg/m², entspricht Körperoberfläche wurden beim 3- und 6-fachen der MRHD vermehrt Totgeburten beobachtet; und Abnahmen des frühen postnatalen Gewichts und Überlebens der Jungtiere wurden beim 6-fachen der MRHD beobachtet; diese Dosen verursachten auch eine gewisse maternale Toxizität. Es gab keine Auswirkungen auf das postnatale Verhalten und die reproduktive Entwicklung.
Stillzeit
Zusammenfassung der Risiken
Begrenzte Daten aus der veröffentlichten Literatur berichten über das Vorhandensein von Aripiprazol in der menschlichen Muttermilch in relativen Säuglingsdosen zwischen 0,7 % und 8,3 % der gewichtsangepassten Dosis der Mutter. Es gibt Berichte über eine geringe Gewichtszunahme bei gestillten Säuglingen, die Aripiprazol ausgesetzt waren, und Berichte über eine unzureichende Milchproduktion bei stillenden Frauen, die Aripiprazol einnahmen.
Die Entwicklung und der gesundheitliche Nutzen des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an ABILIFY und möglichen Nebenwirkungen von ABILIFY oder der zugrunde liegenden Erkrankung der Mutter auf den gestillten Säugling berücksichtigt werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit bei pädiatrischen Patienten mit schwerer depressiver Störung oder Agitiertheit in Verbindung mit Schizophrenie oder bipolarer Manie wurde nicht nachgewiesen.
Die Pharmakokinetik von Aripiprazol und Dehydro-Aripiprazol bei pädiatrischen Patienten im Alter von 10 bis 17 Jahren war ähnlich wie bei Erwachsenen, nachdem die Unterschiede im Körpergewicht korrigiert wurden [siehe KLINISCHE PHARMAKOLOGIE ].
Schizophrenie
Sicherheit und Wirksamkeit bei pädiatrischen Patienten mit Schizophrenie wurden in einer 6-wöchigen placebokontrollierten klinischen Studie mit 202 pädiatrischen Patienten im Alter von 13 bis 17 Jahren nachgewiesen [siehe DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN , und Klinische Studien ]. Obwohl die Erhaltungswirksamkeit bei pädiatrischen Patienten nicht systematisch evaluiert wurde, kann die Erhaltungswirksamkeit aus Daten von Erwachsenen zusammen mit Vergleichen der pharmakokinetischen Parameter von Aripiprazol bei erwachsenen und pädiatrischen Patienten extrapoliert werden.
Bipolare I-Störung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten mit bipolarer Manie wurden in einer 4-wöchigen placebokontrollierten klinischen Studie mit 197 pädiatrischen Patienten im Alter von 10 bis 17 Jahren nachgewiesen [siehe DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN , und Klinische Studien ]. Obwohl die Erhaltungswirksamkeit bei pädiatrischen Patienten nicht systematisch evaluiert wurde, kann die Erhaltungswirksamkeit aus Daten von Erwachsenen zusammen mit Vergleichen der pharmakokinetischen Parameter von Aripiprazol bei erwachsenen und pädiatrischen Patienten extrapoliert werden.
Die Wirksamkeit von ABILIFY 10 mg als Zusatztherapie mit gleichzeitiger Gabe von Lithium oder Valproat bei der Behandlung von manischen oder gemischten Episoden bei pädiatrischen Patienten wurde nicht systematisch untersucht. Diese Wirksamkeit und das Fehlen einer pharmakokinetischen Wechselwirkung zwischen Aripiprazol und Lithium oder Valproat können jedoch aus Daten von Erwachsenen extrapoliert werden, zusammen mit Vergleichen der pharmakokinetischen Parameter von Aripiprazol bei erwachsenen und pädiatrischen Patienten.
Reizbarkeit im Zusammenhang mit autistischer Störung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten, die Reizbarkeit im Zusammenhang mit autistischen Störungen zeigten, wurden in zwei 8-wöchigen, placebokontrollierten klinischen Studien mit 212 pädiatrischen Patienten im Alter von 6 bis 17 Jahren nachgewiesen [siehe INDIKATIONEN UND VERWENDUNG , DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN , und Klinische Studien ]. Bei pädiatrischen Patienten (im Alter von 6 bis 17 Jahren) mit Reizbarkeit im Zusammenhang mit einer autistischen Störung wurde eine Erhaltungsstudie durchgeführt. Die erste Phase dieser Studie war eine offene Phase mit flexibler Dosierung (Aripiprazol 2 bis 15 mg/Tag), in der die Patienten stabilisiert wurden (definiert als > 25 % Verbesserung auf der ABC-I-Subskala und einer CGI-I-Bewertung von „stark verbessert“ oder „sehr stark verbessert“) auf ABILIFY für 12 aufeinanderfolgende Wochen. Insgesamt wurden 85 Patienten stabilisiert und traten in die zweite, 16-wöchige, doppelblinde Phase ein, in der sie randomisiert wurden, entweder die ABILIFY-Behandlung fortzusetzen oder auf Placebo umzustellen. In dieser Studie wurde die Wirksamkeit von ABILIFY zur Dauerbehandlung von Reizbarkeit im Zusammenhang mit autistischen Störungen nicht nachgewiesen.
Tourette-Krankheit
Sicherheit und Wirksamkeit von Aripiprazol bei pädiatrischen Patienten mit Tourette-Syndrom wurden in einer 8-wöchigen (im Alter von 7 bis 17 Jahren) und einer 10-wöchigen Studie (im Alter von 6 bis 18) mit 194 pädiatrischen Patienten untersucht [siehe DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN , und Klinische Studien ]. Die Erhaltungswirksamkeit bei pädiatrischen Patienten wurde nicht systematisch untersucht.
Jugendtierstudien
Aripiprazol verursachte bei juvenilen Ratten Mortalität, klinische ZNS-Symptome, Gedächtnis- und Lernstörungen und verzögerte Geschlechtsreife, wenn es in oralen Dosen von 10, 20, 40 mg/kg/Tag von der Entwöhnung (21 Tage alt) bis zur Geschlechtsreife (80 Tage alt) verabreicht wurde. . Bei 40 mg/kg/Tag wurden bei beiden Geschlechtern Mortalität, verminderte Aktivität, gespreizte Hinterbeine, gekrümmte Körperhaltung, Ataxie, Zittern und andere ZNS-Symptome beobachtet. Außerdem wurde bei Männchen eine verzögerte Geschlechtsreife beobachtet. Bei allen Dosen und in dosisabhängiger Weise Beeinträchtigung des Gedächtnisses und Lernens, erhöhte motorische Aktivität und histopathologische Veränderungen in der Hypophyse (Atrophie), Nebennieren (Nebennierenrindenhypertrophie), Brustdrüsen (Hyperplasie und erhöhte Sekretion) und weiblichen Fortpflanzungsorganen ( Vaginalverschleimung, Endometriumatrophie, Abnahme der Gelbkörper der Eierstöcke) wurden beobachtet. Die Veränderungen der weiblichen Fortpflanzungsorgane wurden als sekundär zum Anstieg der Prolaktin-Serumspiegel angesehen. Ein No Observed Adverse Effect Level (NOAEL) konnte nicht bestimmt werden, und bei der niedrigsten getesteten Dosis von 10 mg/kg/Tag gibt es keine Sicherheitsspanne in Bezug auf die systemische Exposition (AUC0-24) für Aripiprazol oder seinen aktiven Hauptmetaboliten bei Jugendlichen mit der maximal empfohlenen pädiatrischen Dosis von 15 mg/Tag. Alle arzneimittelbedingten Wirkungen waren nach einer 2-monatigen Erholungsphase reversibel, und die meisten Arzneimittelwirkungen bei juvenilen Ratten wurden auch bei erwachsenen Ratten aus zuvor durchgeführten Studien beobachtet.
Aripiprazol verursachte bei juvenilen Hunden (2 Monate alt) bei oraler Gabe von 3, 10, 30 mg/kg/Tag über 6 Monate klinische ZNS-Symptome wie Zittern, Hypoaktivität, Ataxie, Liegenbleiben und eingeschränkte Beweglichkeit der Hinterbeine. Das mittlere Körpergewicht und die Gewichtszunahme waren bei Frauen in allen Arzneimittelgruppen im Vergleich zu den Kontrollwerten um bis zu 18 % verringert. Ein NOAEL konnte nicht bestimmt werden, und bei der niedrigsten getesteten Dosis von 3 mg/kg/Tag gibt es keine Sicherheitsspanne in Bezug auf die systemische Exposition (AUC0-24) für Aripiprazol oder seinen aktiven Hauptmetaboliten bei Jugendlichen bei der maximal empfohlenen pädiatrischen Dosis Dosis von 15 mg/Tag. Alle arzneimittelbedingten Wirkungen waren nach einer 2-monatigen Erholungsphase reversibel.
Geriatrische Verwendung
Für ältere Patienten wird keine Dosisanpassung empfohlen [siehe Eingerahmte Warnung , WARNUNGEN UND VORSICHTSMASSNAHMEN , und KLINISCHE PHARMAKOLOGIE ].
Von den 13.543 Patienten, die in klinischen Studien mit oralem ABILIFY 15 mg behandelt wurden, waren 1073 (8 %) ≥ 65 Jahre und 799 (6 %) ≥ 75 Jahre alt. Placebokontrollierte Studien mit oral verabreichtem ABILIFY 10 mg bei Schizophrenie, bipolarer Manie oder schweren depressiven Störungen schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders als jüngere Probanden reagieren.
Von den 749 Patienten, die in klinischen Studien mit ABILIFY-Injektion behandelt wurden, waren 99 (13 %) ≥ 65 Jahre und 78 (10 %) ≥ 75 Jahre alt. Placebokontrollierte Studien zur ABILIFY-Injektion bei Patienten mit Agitiertheit im Zusammenhang mit Schizophrenie oder bipolarer Manie schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders als jüngere Probanden reagieren.
ABILIFY 15 mg ist nicht für die Behandlung von Patienten mit Psychosen im Zusammenhang mit der Alzheimer-Krankheit zugelassen [siehe Eingerahmte Warnung und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
CYP2D6 Schlechte Metabolisierer
Bei bekanntermaßen langsamen CYP2D6-Metabolisierern wird aufgrund hoher Aripiprazol-Konzentrationen eine Dosisanpassung empfohlen. Ungefähr 8 % der Kaukasier und 3–8 % der Schwarzen/Afroamerikaner können CYP2D6-Substrate nicht metabolisieren und werden als langsame Metabolisierer (PM) eingestuft [vgl DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
Leber- und Nierenfunktionsstörung
Es ist keine Dosisanpassung von ABILIFY aufgrund der Leberfunktion (leichte bis schwere Leberfunktionsstörung, Child-Pugh-Score zwischen 5 und 15) oder der Nierenfunktion (leichte bis schwere Nierenfunktionsstörung, glomeruläre Filtrationsrate zwischen 15) eines Patienten erforderlich und 90 ml/Minute) [vgl KLINISCHE PHARMAKOLOGIE ].
Andere spezifische Populationen
Es ist keine Dosisanpassung für ABILIFY aufgrund des Geschlechts, der Rasse oder des Raucherstatus eines Patienten erforderlich [siehe KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Zur Klassifizierung der Nebenwirkungen wurde die MedDRA-Terminologie verwendet.
Menschliche Erfahrung
In klinischen Studien und Erfahrungen nach der Markteinführung wurden weltweit Nebenwirkungen einer absichtlichen oder versehentlichen Überdosierung mit oralem ABILIFY berichtet. Dazu gehören Überdosierungen mit oralem ABILIFY 20 mg allein und in Kombination mit anderen Substanzen. Unter ABILIFY allein wurde kein Todesfall gemeldet. Die größte bekannte Dosis mit bekanntem Ausgang umfasste die akute Einnahme von 1260 mg oralem ABILIFY (das 42-fache der maximal empfohlenen Tagesdosis) durch einen Patienten, der sich vollständig erholte. Bei Kindern (12 Jahre und jünger) wurde auch über absichtliche oder versehentliche Überdosierung im Zusammenhang mit oraler Einnahme von ABILIFY 10 mg bis zu 195 mg ohne Todesfälle berichtet.
Häufige Nebenwirkungen (berichtet in mindestens 5 % aller Fälle von Überdosierung), die bei einer oralen Überdosierung von ABILIFY (allein oder in Kombination mit anderen Substanzen) berichtet wurden, sind Erbrechen, Somnolenz und Tremor. Andere klinisch wichtige Anzeichen und Symptome, die bei einem oder mehreren Patienten mit Überdosierung von ABILIFY (allein oder zusammen mit anderen Substanzen) beobachtet wurden, sind Azidose, Aggression, Anstieg der Aspartataminotransferase, Vorhofflimmern, Bradykardie, Koma, Verwirrtheitszustand, Krämpfe, Anstieg der Kreatinphosphokinase im Blut, erniedrigter Spiegel Bewusstseinsstörungen, Bluthochdruck, Hypokaliämie, Hypotonie, Lethargie, Bewusstlosigkeit, verlängerter QRS-Komplex, verlängertes QT, Aspirationspneumonie, Atemstillstand, Status epilepticus und Tachykardie.
Management einer Überdosierung
Zur Behandlung einer Überdosierung mit ABILIFY liegen keine spezifischen Informationen vor. Im Falle einer Überdosierung sollte ein Elektrokardiogramm erstellt werden, und wenn eine Verlängerung des QT-Intervalls vorliegt, sollte eine Herzüberwachung eingeleitet werden. Andernfalls sollte sich die Behandlung einer Überdosierung auf eine unterstützende Therapie, die Aufrechterhaltung eines angemessenen Atemwegs, Sauerstoffversorgung und Beatmung sowie die Behandlung von Symptomen konzentrieren. Eine engmaschige medizinische Überwachung und Überwachung sollte fortgesetzt werden, bis sich der Patient erholt hat.
Holzkohle
Im Falle einer Überdosierung von ABILIFY 10 mg kann eine frühzeitige Gabe von Aktivkohle nützlich sein, um die Resorption von Aripiprazol teilweise zu verhindern. Die Verabreichung von 50 g Aktivkohle eine Stunde nach einer oralen Einzeldosis von 15 mg ABILIFY verringerte die mittlere AUC und Cmax von Aripiprazol um 50 %.
Hämodialyse
Obwohl keine Informationen über die Wirkung der Hämodialyse bei der Behandlung einer Überdosierung mit ABILIFY vorliegen, ist eine Hämodialyse bei der Behandlung einer Überdosierung unwahrscheinlich, da Aripiprazol stark an Plasmaproteine gebunden wird.
KONTRAINDIKATIONEN
ABILIFY 15 mg ist kontraindiziert bei Patienten mit einer Vorgeschichte einer Überempfindlichkeitsreaktion auf Aripiprazol. Die Reaktionen reichten von Juckreiz/Urtikaria bis hin zu Anaphylaxie [siehe NEBENWIRKUNGEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Der Wirkungsmechanismus von Aripiprazol bei Schizophrenie oder bipolarer Manie ist unklar. Die Wirksamkeit von Aripiprazol in den aufgeführten Indikationen könnte jedoch durch eine Kombination aus partieller agonistischer Aktivität an D2- und 5-HT1A-Rezeptoren und antagonistischer Aktivität an 5-HT2A-Rezeptoren vermittelt werden.
Pharmakodynamik
Aripiprazol zeigt eine hohe Affinität für Dopamin D2 und D3, Serotonin 5-HT1A- und 5-HT2A-Rezeptoren (Ki-Werte von 0,34 nM, 0,8 nM, 1,7 nM bzw. 3,4 nM), eine mäßige Affinität für Dopamin D4, Serotonin 5-HT2C und 5-HT7, alpha1-adrenerge und Histamin-H1-Rezeptoren (Ki-Werte von 44 nM, 15 nM, 39 nM, 57 nM bzw. 61 nM) und mäßige Affinität zur Serotonin-Wiederaufnahmestelle (Ki=98 nM). Aripiprazol hat keine nennenswerte Affinität zu cholinergen Muskarinrezeptoren (IC50 > 1000 nM).
Pharmakokinetik
Die Aktivität von ABILIFY ist vermutlich in erster Linie auf das Ausgangsarzneimittel Aripiprazol und in geringerem Maße auf seinen Hauptmetaboliten Dehydro-Aripiprazol zurückzuführen, von dem gezeigt wurde, dass es ähnliche Affinitäten zu D2-Rezeptoren wie das Ausgangsarzneimittel aufweist und 40 % des Ausgangsarzneimittels ausmacht Drogenexposition im Plasma. Die mittlere Eliminationshalbwertszeit beträgt etwa 75 Stunden für Aripiprazol und 94 Stunden für Dehydro-Aripiprazol. Steady-State-Konzentrationen werden für beide Wirkstoffe innerhalb von 14 Tagen nach Verabreichung erreicht. Die Akkumulation von Aripiprazol ist anhand der Pharmakokinetik einer Einzeldosis vorhersagbar. Im Steady State ist die Pharmakokinetik von Aripiprazol dosisproportional. Die Elimination von Aripiprazol erfolgt hauptsächlich über den hepatischen Metabolismus, an dem zwei P450-Isoenzyme, CYP2D6 und CYP3A4, beteiligt sind. Bei langsamen CYP2D6-Metabolisierern beträgt die mittlere Eliminationshalbwertszeit von Aripiprazol etwa 146 Stunden.
Pharmakokinetische Studien haben gezeigt, dass ABILIFY 10 mg DISCMELT oral zerfallende Tabletten bioäquivalent zu ABILIFY 15 mg Tabletten sind.
Mündliche Verabreichung
Absorption
Tablette: Aripiprazol wird nach Einnahme der Tablette gut resorbiert, wobei maximale Plasmakonzentrationen innerhalb von 3 bis 5 Stunden erreicht werden; die absolute orale Bioverfügbarkeit der Tablettenformulierung beträgt 87 %. ABILIFY 10 mg kann mit oder ohne Nahrung verabreicht werden. Die Einnahme einer 15 mg ABILIFY Tablette zusammen mit einer fettreichen Standardmahlzeit hatte keinen signifikanten Einfluss auf Cmax oder AUC von Aripiprazol oder seines aktiven Metaboliten Dehydro-Aripiprazol, verzögerte jedoch Tmax um 3 Stunden bei Aripiprazol und um 12 Stunden bei Dehydro-Aripiprazol.
Lösung zum Einnehmen: Aripiprazol wird gut resorbiert, wenn es als Lösung oral verabreicht wird. Bei äquivalenten Dosen waren die Plasmakonzentrationen von Aripiprazol aus der Lösung höher als die aus der Tablettenformulierung. In einer Studie zur relativen Bioverfügbarkeit, in der die Pharmakokinetik von 30 mg Aripiprazol als Lösung zum Einnehmen mit 30 mg Aripiprazol-Tabletten bei gesunden Probanden verglichen wurde, betrug das Verhältnis von Lösung zu Tablette der geometrischen mittleren Cmax- und AUC-Werte 122 % bzw. 114 % [siehe DOSIERUNG UND ANWENDUNG ]. Die Pharmakokinetik einer Einzeldosis von Aripiprazol war zwischen den Dosen von 5 mg bis 30 mg linear und dosisproportional.
Verteilung
Das Verteilungsvolumen von Aripiprazol im Steady State nach intravenöser Verabreichung ist hoch (404 l oder 4,9 l/kg), was auf eine ausgedehnte extravaskuläre Verteilung hinweist. Bei therapeutischen Konzentrationen sind Aripiprazol und sein Hauptmetabolit zu mehr als 99 % an Serumproteine gebunden, hauptsächlich an Albumin. Bei gesunden menschlichen Freiwilligen, denen 0,5 bis 30 mg/Tag Aripiprazol über 14 Tage verabreicht wurden, gab es eine dosisabhängige Besetzung des D2-Rezeptors, was auf eine Penetration von Aripiprazol in das Gehirn beim Menschen hinweist.
Stoffwechsel und Ausscheidung
Aripiprazol wird hauptsächlich über drei Biotransformationswege metabolisiert: Dehydrierung, Hydroxylierung und N-Dealkylierung. Basierend auf In-vitro-Studien sind die Enzyme CYP3A4 und CYP2D6 für die Dehydrierung und Hydroxylierung von Aripiprazol verantwortlich, und die N-Dealkylierung wird durch CYP3A4 katalysiert. Aripiprazol ist der vorherrschende Wirkstoffanteil im systemischen Kreislauf. Im Steady State macht Dehydro-Aripiprazol, der aktive Metabolit, etwa 40 % der AUC von Aripiprazol im Plasma aus.
Nach einer oralen Einzeldosis von [14C]-markiertem Aripiprazol wurden etwa 25 % bzw. 55 % der verabreichten Radioaktivität im Urin bzw. im Stuhl wiedergefunden. Weniger als 1 % des unveränderten Aripiprazols wurde mit dem Urin ausgeschieden und etwa 18 % der oralen Dosis wurden unverändert im Stuhl wiedergefunden.
Arzneimittelwechselwirkungsstudien
Die Auswirkungen anderer Medikamente auf die Exposition gegenüber Aripiprazol und Dehydro-Aripiprazol sind in Abbildung 1 bzw. Abbildung 2 zusammengefasst. Basierend auf Simulationen wird ein 4,5-facher Anstieg der mittleren Cmax- und AUC-Werte im Steady State erwartet, wenn schnelle Metabolisierer von CYP2D6 mit starken CYP2D6- und CYP3A4-Inhibitoren verabreicht werden. Bei langsamen Metabolisierern von CYP2D6, die zusammen mit starken CYP3A4-Inhibitoren verabreicht werden, wird ein 3-facher Anstieg der mittleren Cmax- und AUC-Werte im Steady State erwartet.
Abbildung 1: Die Auswirkungen anderer Arzneimittel auf die Pharmakokinetik von Aripiprazol 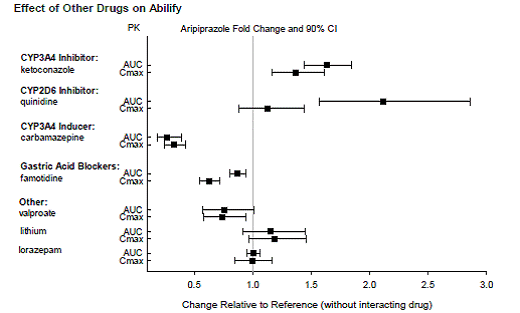
Abbildung 2: Die Auswirkungen anderer Arzneimittel auf die Pharmakokinetik von Dehydro-Aripiprazol 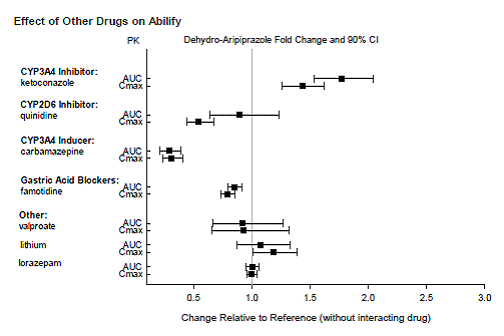
Die Auswirkungen von ABILIFY 15 mg auf die Exposition gegenüber anderen Arzneimitteln sind in Abbildung 3 zusammengefasst. Eine populationspharmakokinetische Analyse bei Patienten mit Major Depression zeigte keine wesentliche Veränderung der Plasmakonzentrationen von Fluoxetin (20 oder 40 mg/Tag), Paroxetin CR (37,5 oder 50 mg/Tag) oder Sertralin (100 oder 150 mg/Tag) bis zum Steady-State. Die Steady-State-Plasmakonzentrationen von Fluoxetin und Norfluoxetin stiegen um etwa 18 % bzw. 36 %, und die Konzentrationen von Paroxetin nahmen um etwa 27 % ab. Die Steady-State-Plasmakonzentrationen von Sertralin und Desmethylsertralin veränderten sich nicht wesentlich, wenn diese Antidepressiva zusammen mit Aripiprazol verabreicht wurden.
Abbildung 3: Die Auswirkungen von ABILIFY 15 mg auf die Pharmakokinetik anderer Arzneimittel 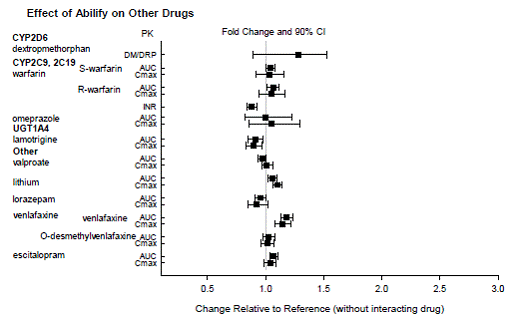
Studien in bestimmten Bevölkerungsgruppen
Expositionen gegenüber Aripiprazol und Dehydro-Aripiprazol in bestimmten Populationen sind in Abbildung 4 bzw. Abbildung 5 zusammengefasst. Darüber hinaus war bei pädiatrischen Patienten (10 bis 17 Jahre), denen ABILIFY (20 mg bis 30 mg) verabreicht wurde, die körpergewichtskorrigierte Aripiprazol-Clearance ähnlich wie bei Erwachsenen.
Abbildung 4: Auswirkungen intrinsischer Faktoren auf die Pharmakokinetik von Aripiprazol 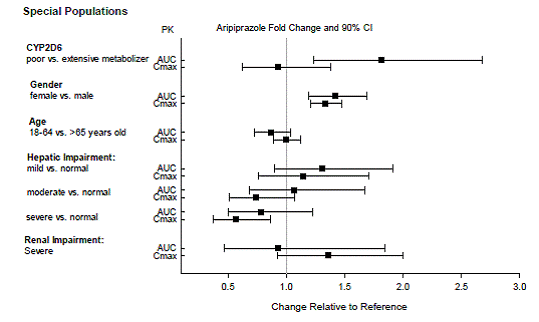
Abbildung 5: Auswirkungen intrinsischer Faktoren auf die Pharmakokinetik von Dehydro-Aripiprazol 
Intramuskuläre Verabreichung
In zwei pharmakokinetischen Studien mit Aripiprazol-Injektion, die gesunden Probanden intramuskulär verabreicht wurde, lagen die medianen Zeiten bis zu den maximalen Plasmakonzentrationen bei 1 Stunde und 3 Stunden. Eine intramuskuläre Injektion von 5 mg Aripiprazol hatte eine absolute Bioverfügbarkeit von 100 %. Die nach einer intramuskulären Dosis erreichte geometrische mittlere maximale Konzentration war im Durchschnitt 19 % höher als die Cmax der Tablette zum Einnehmen. Während die systemische Exposition über 24 Stunden zwischen intramuskulärer Aripiprazol-Injektion und nach oraler Tablettenverabreichung im Allgemeinen ähnlich war, war die Aripiprazol-AUC in den ersten 2 Stunden nach einer intramuskulären Injektion um 90 % größer als die AUC nach der gleichen Dosis als Tablette. Bei stabilen Patienten mit Schizophrenie oder schizoaffektiven Störungen war die Pharmakokinetik von Aripiprazol nach intramuskulärer Verabreichung über einen Dosisbereich von 1 mg bis 45 mg linear. Obwohl der Metabolismus von Aripiprazol-Injektion nicht systematisch untersucht wurde, ist nicht zu erwarten, dass der intramuskuläre Verabreichungsweg die Stoffwechselwege verändert.
Tiertoxikologie und/oder Pharmakologie
Aripiprazol führte bei Albino-Ratten in einer 26-wöchigen Studie zur chronischen Toxizität bei einer Dosis von 60 mg/kg/Tag und in einer 2-Jahres-Karzinogenitätsstudie bei Dosen von 40 und 60 mg/kg/Tag, was dem 13- und 19-fachen entspricht, zu Netzhautdegeneration die MRHD von 30 mg/Tag basierend auf mg/m² Körperoberfläche. Die Untersuchung der Netzhäute von Albino-Mäusen und Affen ergab keinen Hinweis auf eine Netzhautdegeneration. Zusätzliche Studien zur weiteren Bewertung des Mechanismus wurden nicht durchgeführt. Die Relevanz dieses Ergebnisses für das menschliche Risiko ist nicht bekannt.
Klinische Studien
Die Wirksamkeit der oralen Formulierungen von ABILIFY (Aripiprazol) wurde in den folgenden angemessenen und gut kontrollierten Studien nachgewiesen:
Die Wirksamkeit der injizierbaren Formulierung von ABILIFY (Aripiprazol) wurde in den folgenden angemessenen und gut kontrollierten Studien nachgewiesen:
Schizophrenie
Erwachsene
Die Wirksamkeit von ABILIFY 15 mg bei der Behandlung von Schizophrenie wurde in fünf placebokontrollierten Kurzzeitstudien (4 Wochen und 6 Wochen) mit akut rezidivierten stationären Patienten untersucht, die überwiegend die DSM-III/IV-Kriterien für Schizophrenie erfüllten. Vier der fünf Studien konnten ABILIFY von Placebo unterscheiden, aber eine Studie, die kleinste, konnte dies nicht. Drei dieser Studien umfassten auch eine aktive Kontrollgruppe, die entweder aus Risperidon (eine Studie) oder Haloperidol (zwei Studien) bestand, aber sie waren nicht darauf ausgelegt, einen Vergleich von ABILIFY 20 mg und den aktiven Vergleichspräparaten zu ermöglichen.
In den vier positiven Studien zu ABILIFY 10 mg wurden vier primäre Maßnahmen zur Beurteilung psychiatrischer Anzeichen und Symptome verwendet. Die Wirksamkeit wurde anhand der Gesamtpunktzahl auf der Positive and Negative Syndrome Scale (PANSS) bewertet. Die PANSS ist eine 30-Punkte-Skala, die positive Symptome von Schizophrenie (7 Punkte), negative Symptome von Schizophrenie (7 Punkte) und allgemeine Psychopathologie (16 Punkte) misst, die jeweils auf einer Skala von 1 (nicht vorhanden) bis 7 (extrem) bewertet werden. ; die PANSS-Gesamtwerte reichen von 30 bis 210. Die Bewertung des klinischen Gesamteindrucks (CGI) spiegelt den Eindruck eines erfahrenen Beobachters, der mit den Manifestationen der Schizophrenie vollständig vertraut ist, über den klinischen Gesamtzustand des Patienten wider.
In einer 4-wöchigen Studie (n = 414), in der zwei Fixdosen von ABILIFY (15 oder 30 mg/Tag) mit Placebo verglichen wurden, waren beide Dosen von ABILIFY 10 mg dem Placebo im PANSS-Gesamtscore überlegen (Studie 1 in Tabelle 26). Positive PANSS-Subskala und CGI-Severity-Score. Darüber hinaus war die 15-mg-Dosis dem Placebo in der negativen PANSS-Subskala überlegen.
In einer 4-wöchigen Studie (n = 404), in der zwei Fixdosen von ABILIFY (20 oder 30 mg/Tag) mit Placebo verglichen wurden, waren beide Dosen von ABILIFY dem Placebo im PANSS-Gesamtscore (Studie 2 in Tabelle 26), PANSS, überlegen positive Subskala, negative PANSS-Subskala und CGI-Severity-Score.
In einer 6-wöchigen Studie (n = 420), in der drei Fixdosen von ABILIFY (10, 15 oder 20 mg/Tag) mit Placebo verglichen wurden, waren alle drei Dosen von ABILIFY dem Placebo im PANSS-Gesamtscore überlegen (Studie 3 in Tabelle 26), die positive PANSS-Subskala und die negative PANSS-Subskala.
In einer 6-wöchigen Studie (n=367), in der drei Fixdosen von ABILIFY (2, 5 oder 10 mg/Tag) mit Placebo verglichen wurden, war die 10-mg-Dosis ABILIFY dem Placebo im PANSS-Gesamtscore überlegen (Studie 4 in Tabelle 26), dem primären Ergebnismaß der Studie. Die 2- und 5-mg-Dosen zeigten beim primären Endpunkt keine Überlegenheit gegenüber Placebo.
So wurde die Wirksamkeit von Tagesdosen von 10, 15, 20 und 30 mg in zwei Studien für jede Dosis nachgewiesen. Bei diesen Dosierungen gab es keine Hinweise darauf, dass die höheren Dosisgruppen einen Vorteil gegenüber der niedrigsten Dosisgruppe dieser Studien boten.
Eine Untersuchung der Untergruppen der Bevölkerung ergab keine eindeutigen Hinweise auf eine unterschiedliche Reaktionsfähigkeit auf der Grundlage von Alter, Geschlecht oder Rasse.
In eine längerfristige Studie wurden 310 stationäre oder ambulante Patienten aufgenommen, die die DSM-IV-Kriterien für Schizophrenie erfüllten und die bei anderen Antipsychotika in der Anamnese über einen Zeitraum von 3 Monaten oder länger symptomatisch stabil waren. Diese Patienten wurden von ihren Antipsychotika abgesetzt und randomisiert ABILIFY 15 mg/Tag oder Placebo für eine Beobachtungszeit von bis zu 26 Wochen auf Rückfälle zugewiesen. Ein Rückfall während der doppelblinden Phase wurde definiert als CGI-Verbesserungs-Score von ≥5 (minimal schlechter), Scores ≥5 (mäßig schwerwiegend) bei den Items „Feindseligkeit“ oder „Unkooperativität“ des PANSS oder ≥20 % Anstieg des PANSS-Gesamtscores. Patienten, die ABILIFY 15 mg/Tag erhielten, erlebten in den folgenden 26 Wochen eine signifikant längere Zeit bis zum Rückfall im Vergleich zu Patienten, die Placebo erhielten (Studie 5 in Abbildung 6).
Pädiatrische Patienten
Die Wirksamkeit von ABILIFY (Aripiprazol) bei der Behandlung von Schizophrenie bei pädiatrischen Patienten (im Alter von 13 bis 17 Jahren) wurde in einer 6-wöchigen, placebokontrollierten Studie mit ambulanten Patienten untersucht, die die DSM-IV-Kriterien für Schizophrenie erfüllten und einen PANSS-Score aufwiesen ≥70 zu Studienbeginn. In dieser Studie (n=302), in der zwei Fixdosen von ABILIFY (10 oder 30 mg/Tag) mit Placebo verglichen wurden, wurde ABILIFY 15 mg ausgehend von 2 mg/Tag bis zur Zieldosis innerhalb von 5 Tagen im Behandlungsarm mit 10 mg/Tag titriert und in 11 Tagen im Behandlungsarm mit 30 mg/Tag. Beide Dosierungen von ABILIFY waren Placebo im PANSS-Gesamtscore (Studie 6 in Tabelle 26), dem primären Endpunkt der Studie, überlegen. Die Dosis von 30 mg/Tag erwies sich nicht als wirksamer als die Dosis von 10 mg/Tag. Obwohl die Erhaltungswirksamkeit bei pädiatrischen Patienten nicht systematisch evaluiert wurde, kann die Erhaltungswirksamkeit aus Daten von Erwachsenen zusammen mit Vergleichen der pharmakokinetischen Parameter von Aripiprazol bei erwachsenen und pädiatrischen Patienten extrapoliert werden.
Abbildung 6: Kaplan-Meier-Schätzung des kumulativen Anteils von Patienten mit Rückfall (Schizophrenie-Studie 5) 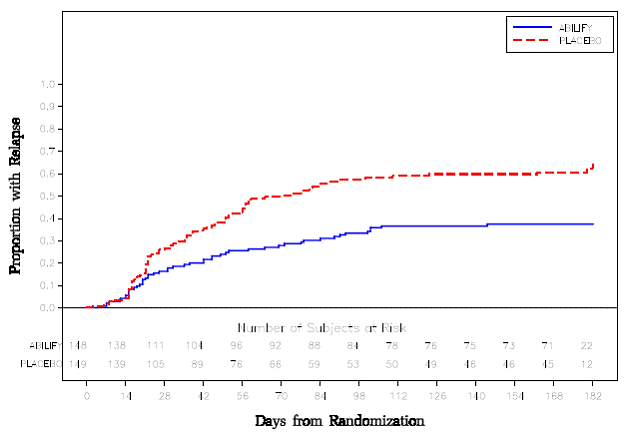
Bipolare Störung
Akute Behandlung manischer und gemischter Episoden
Erwachsene
Monotherapie
Die Wirksamkeit von ABILIFY 10 mg als Monotherapie bei der akuten Behandlung von manischen Episoden wurde in vier 3-wöchigen, placebokontrollierten Studien mit Krankenhauspatienten nachgewiesen, die die DSM-IV-Kriterien für eine Bipolar-I-Störung mit manischen oder gemischten Episoden erfüllten. Diese Studien schlossen Patienten mit oder ohne psychotische Merkmale ein und zwei der Studien schlossen auch Patienten mit oder ohne Rapid-Cycling-Verlauf ein.
Das primäre Instrument zur Bewertung manischer Symptome war die Young Mania Rating Scale (Y-MRS), eine 11-Punkte-Skala, die von Klinikern bewertet wurde und traditionell verwendet wird, um den Grad der manischen Symptomatik in einem Bereich von 0 (keine manischen Merkmale) bis 60 ( höchste Punktzahl). Ein wichtiges sekundäres Instrument war die Clinical Global Impression-Bipolar (CGI-BP) Scale.
In den vier positiven, 3-wöchigen, placebokontrollierten Studien (n = 268; n = 248; n = 480; n = 485), die ABILIFY in einem Bereich von 15 mg bis 30 mg einmal täglich (mit einer Anfangsdosis) bewerteten von 30 mg/Tag in zwei Studien und 15 mg/Tag in zwei Studien) war ABILIFY 20 mg Placebo bei der Reduzierung des Y-MRS-Gesamtscores (Studien 1-4 in Tabelle 27) und des CGI-BP-Scores für den Schweregrad der Erkrankung überlegen (Manie). In den beiden Studien mit einer Anfangsdosis von 15 mg/Tag erhielten 48 % bzw. 44 % der Patienten am Endpunkt 15 mg/Tag. In den beiden Studien mit einer Anfangsdosis von 30 mg/Tag nahmen 86 % bzw. 85 % der Patienten am Endpunkt 30 mg/Tag ein.
Begleitende Therapie
Die Wirksamkeit von ABILIFY als Zusatztherapie mit Lithium oder Valproat bei der Behandlung von manischen oder gemischten Episoden wurde in einer 6-wöchigen, placebokontrollierten Studie (n = 384) mit einer 2-wöchigen Einleitungsphase mit einem Stimmungsstabilisator als Monotherapie bei erwachsenen Patienten nachgewiesen die die DSM-IV-Kriterien für eine Bipolar-I-Störung erfüllten. Diese Studie umfasste Patienten mit manischen oder gemischten Episoden und mit oder ohne psychotische Merkmale.
Die Patienten wurden mit unverblindetem Lithium (0,6 bis 1,0 mÄq/l) oder Valproat (50 bis 125 μg/ml) in therapeutischen Serumspiegeln begonnen und blieben 2 Wochen lang auf stabilen Dosen. Am Ende von 2 Wochen wurden Patienten, die ein unzureichendes Ansprechen (YMRS-Gesamtscore ≥16 und ≤25 % Verbesserung des Y-MRS-Gesamtscores) auf Lithium oder Valproat zeigten, randomisiert, um entweder ABILIFY (15 mg/Tag oder eine Erhöhung auf 30 mg/Tag) zu erhalten mg/Tag bereits ab Tag 7) oder Placebo als Zusatztherapie mit unverblindetem Lithium oder Valproat. In der 6-wöchigen placebokontrollierten Phase war die zusätzliche Gabe von ABILIFY ab 15 mg/Tag mit begleitendem Lithium oder Valproat (in einem therapeutischen Bereich von 0,6 bis 1,0 mÄq/l bzw. 50 bis 125 μg/ml) Lithium überlegen oder Valproat mit zusätzlichem Placebo zur Verringerung des YMRS-Gesamtscores (Studie 5 in Tabelle 27) und des CGI-BP-Scores für den Schweregrad der Erkrankung (Manie). Einundsiebzig Prozent der Patienten, denen gleichzeitig Valproat verabreicht wurde, und 62 % der Patienten, denen gleichzeitig Lithium verabreicht wurde, nahmen am 6-Wochen-Endpunkt 15 mg/Tag ein.
Pädiatrische Patienten
Die Wirksamkeit von ABILIFY 15 mg bei der Behandlung von Bipolar-I-Störungen bei pädiatrischen Patienten (im Alter von 10 bis 17 Jahren) wurde in einer 4-wöchigen, placebokontrollierten Studie (n = 296) mit ambulanten Patienten untersucht, die die DSM-IV-Kriterien für bipolare Störungen erfüllten Ich habe manische oder gemischte Episoden mit oder ohne psychotische Merkmale und hatte zu Studienbeginn einen Y-MRS-Score von ≥ 20. Diese doppelblinde, placebokontrollierte Studie verglich zwei Fixdosen von ABILIFY (10 oder 30 mg/Tag) mit Placebo. Die ABILIFY 20-mg-Dosis wurde mit 2 mg/Tag begonnen, die nach 2 Tagen auf 5 mg/Tag titriert wurde, und in 5 Tagen im 10-mg/Tag-Behandlungsarm auf die Zieldosis und in 13 Tagen im 30-mg/Tag-Behandlungsarm. Tagesbehandlungsarm. Beide Dosen von ABILIFY 10 mg waren Placebo in Bezug auf die Veränderung vom Ausgangswert bis Woche 4 beim Y-MRS-Gesamtscore überlegen (Studie 6 in Tabelle 27).
Erhaltungsbehandlung der Bipolar-I-Störung
Monotherapie Erhaltungstherapie
Es wurde eine Erhaltungsstudie mit erwachsenen Patienten durchgeführt, die die DSM-IV-Kriterien für eine Bipolar-I-Störung mit einer kürzlich aufgetretenen manischen oder gemischten Episode erfüllten, die mit unverblindetem ABILIFY 20 mg stabilisiert worden waren und für mindestens 6 Wochen ein klinisches Ansprechen aufrechterhalten hatten. Die erste Phase dieser Studie war eine unverblindete Stabilisierungsphase, in der stationäre und ambulante Patienten klinisch stabilisiert und dann mindestens für mindestens eine unverblindete Behandlung mit ABILIFY (15 oder 30 mg/Tag, mit einer Anfangsdosis von 30 mg/Tag) aufrechterhalten wurden 6 aufeinanderfolgende Wochen. Einhunderteinundsechzig ambulante Patienten wurden dann doppelblind randomisiert und erhielten entweder die gleiche ABILIFY-Dosis, die sie am Ende der Stabilisierungs- und Erhaltungsphase erhielten, oder Placebo, und wurden dann auf einen manischen oder depressiven Rückfall überwacht. Während der Randomisierungsphase war ABILIFY dem Placebo bei der Anzahl der kombinierten affektiven Schübe (manisch plus depressiv), dem primären Endpunkt dieser Studie, zeitlich überlegen (Studie 7 in Abbildung 7). Während der doppelblinden Behandlungsphase wurden insgesamt 55 Stimmungsereignisse beobachtet. Neunzehn waren aus der ABILIFY-Gruppe und 36 aus der Placebo-Gruppe. Die Anzahl der beobachteten manischen Episoden in der ABILIFY-15-mg-Gruppe (6) war geringer als in der Placebo-Gruppe (19), während die Anzahl depressiver Episoden in der ABILIFY-Gruppe (9) ähnlich war wie in der Placebo-Gruppe (11). .
Eine Untersuchung von Untergruppen der Bevölkerung ergab keine eindeutigen Hinweise auf eine unterschiedliche Reaktionsfähigkeit auf der Grundlage von Alter und Geschlecht; Allerdings gab es in jeder der ethnischen Gruppen nicht genügend Patienten, um die Unterschiede zwischen den Gruppen angemessen beurteilen zu können.
Abbildung 7: Kaplan-Meier-Schätzung des kumulativen Anteils von Patienten mit Rückfall (bipolare Studie 7) 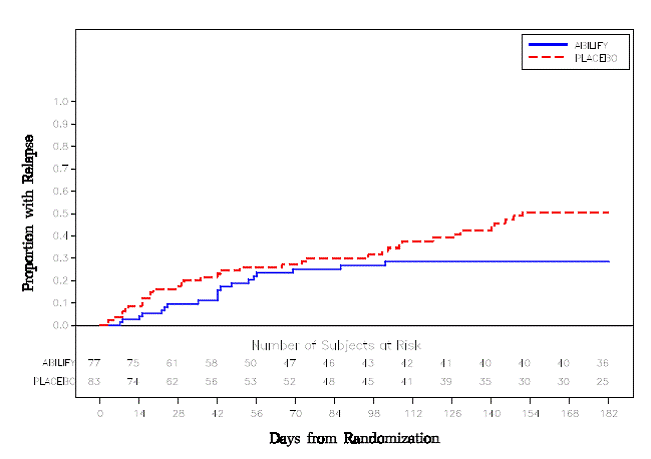
Begleitende Erhaltungstherapie
Bei erwachsenen Patienten, die die DSMIV-Kriterien für eine Bipolar-I-Störung erfüllten und kürzlich eine manische oder gemischte Episode hatten, wurde eine begleitende Erhaltungsstudie durchgeführt. Die Patienten wurden mit unverblindetem Lithium (0,6 bis 1,0 mÄq/l) oder Valproat (50 bis 125 μg/ml) in therapeutischen Serumspiegeln begonnen und blieben 2 Wochen lang auf stabilen Dosen. Am Ende von 2 Wochen erhielten Patienten, die ein unzureichendes Ansprechen (Y-MRS-Gesamtscore ≥ 16 und ≤ 35 % Verbesserung des Y-MRS-Gesamtscores) auf Lithium oder Valproat zeigten, ABILIFY mit einer Anfangsdosis von 15 mg/Tag mit der Option Erhöhung auf 30 mg oder Reduzierung auf 10 mg bereits am 4. Tag als Begleittherapie mit unverblindetem Lithium oder Valproat. Vor der Randomisierung mussten Patienten, die die Kombination aus einfach verblindetem ABILIFY und Lithium oder Valproat erhielten, die Stabilität (Y-MRS- und MADRS-Gesamtscores ≤ 12) über 12 aufeinanderfolgende Wochen aufrechterhalten. Dreihundertsiebenunddreißig Patienten wurden dann doppelblind randomisiert und erhielten entweder dieselbe Dosis ABILIFY 20 mg, die sie am Ende der Stabilisierungsphase erhielten, oder Placebo plus Lithium oder Valproat, und wurden dann auf manisch, gemischt oder überwacht depressiver Rückfall für maximal 52 Wochen. ABILIFY 15 mg war dem Placebo beim primären Endpunkt, der Zeit von der Randomisierung bis zum Rückfall bis zu einem Stimmungsereignis, überlegen (Studie 8 in Abbildung 8). Ein Stimmungsereignis wurde definiert als Krankenhausaufenthalt wegen einer manischen, gemischten oder depressiven Episode, Studienabbruch wegen mangelnder Wirksamkeit, begleitet von einem Y-MRS-Score > 16 und/oder einem MADRS > 16, oder ein SUE einer Verschlechterung der Erkrankung, begleitet von Y- MRS-Score >16 und/oder MADRS >16. Während der doppelblinden Behandlungsphase wurden insgesamt 68 Stimmungsereignisse beobachtet. 25 stammten aus der ABILIFY 20 mg-Gruppe und 43 aus der Placebo-Gruppe. Die Anzahl der beobachteten manischen Episoden in der ABILIFY-15-mg-Gruppe (7) war geringer als in der Placebo-Gruppe (19), während die Anzahl depressiver Episoden in der ABILIFY-Gruppe (14) ähnlich war wie in der Placebo-Gruppe (18). . Die Kaplan-Meier-Kurven der Zeit von der Randomisierung bis zum Rückfall in irgendein Stimmungsereignis während der 52-wöchigen, doppelblinden Behandlungsphase für die ABILIFY 10 mg- und Placebo-Gruppen sind in Abbildung 8 dargestellt.
Abbildung 8: Kaplan-Meier-Schätzung des kumulativen Anteils von Patienten mit einem Rückfall bei einem Stimmungsereignis (bipolare Studie 8) 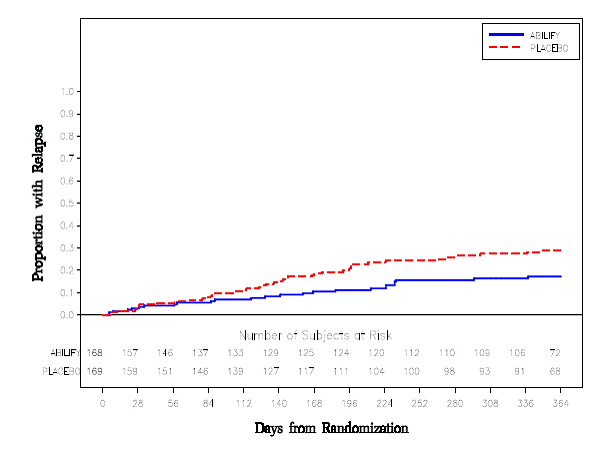
Eine Untersuchung von Untergruppen der Bevölkerung ergab keine eindeutigen Hinweise auf eine unterschiedliche Reaktionsfähigkeit auf der Grundlage von Alter und Geschlecht; Allerdings gab es in jeder der ethnischen Gruppen nicht genügend Patienten, um die Unterschiede zwischen den Gruppen angemessen beurteilen zu können.
Begleitende Behandlung von schweren depressiven Störungen
Erwachsene
Die Wirksamkeit von ABILIFY 15 mg bei der Zusatzbehandlung einer Major Depression (MDD) wurde in zwei placebokontrollierten Kurzzeitstudien (6 Wochen) mit erwachsenen Patienten nachgewiesen, die die DSM-IV-Kriterien für MDD erfüllten und auf die sie unzureichend angesprochen hatten vorherige antidepressive Therapie (1 bis 3 Zyklen) in der aktuellen Episode und die auch ein unzureichendes Ansprechen auf eine 8-wöchige prospektive antidepressive Therapie (Paroxetin mit kontrollierter Freisetzung, Venlafaxin mit verlängerter Freisetzung, Fluoxetin, Escitalopram oder Sertralin) gezeigt hatten. Unzureichendes Ansprechen auf eine prospektive Behandlung wurde definiert als eine Verbesserung von weniger als 50 % auf der 17-Punkte-Version der Hamilton Depression Rating Scale (HAMD17), ein minimaler HAMD17-Score von 14 und eine Verbesserungsbewertung der Clinical Global Impressions von nicht besser als einer minimalen Verbesserung. Unzureichendes Ansprechen auf eine vorherige Behandlung wurde definiert als weniger als 50 % Verbesserung, wie sie vom Patienten nach mindestens 6-wöchiger Antidepressiva-Therapie mit oder über der minimal wirksamen Dosis wahrgenommen wurde.
Das primäre Instrument zur Bewertung depressiver Symptome war die Montgomery-Asberg-Depressionsbewertungsskala (MADRS), eine 10-Punkte-Skala, die von Ärzten bewertet wurde, um den Grad der depressiven Symptomatologie zu bewerten. Das wichtigste sekundäre Instrument war die Sheehan Disability Scale (SDS), ein 3-Punkte-Selbstbeurteilungsinstrument, das verwendet wird, um die Auswirkungen von Depressionen auf drei Funktionsbereiche zu bewerten, wobei jeder Punkt von 0 (überhaupt nicht) bis 10 (extrem) bewertet wird.
In den beiden Studien (n = 381, n = 362) war ABILIFY 15 mg Placebo bei der Reduzierung der mittleren MADRS-Gesamtscores überlegen (Studien 1, 2 in Tabelle 28). In einer Studie war ABILIFY Placebo auch bei der Senkung des mittleren SDS-Scores überlegen.
In beiden Studien erhielten die Patienten ABILIFY 15 mg zusätzlich zu Antidepressiva in einer Dosis von 5 mg/Tag. Je nach Verträglichkeit und Wirksamkeit konnten die Dosen im Abstand von einer Woche in 5-mg-Schritten angepasst werden. Zulässige Dosen waren: 2, 5, 10, 15 mg/Tag und für Patienten, die nicht mit starken CYP2D6-Hemmern Fluoxetin und Paroxetin behandelt wurden, 20 mg/Tag. Die mittlere Enddosis am Endpunkt der beiden Studien betrug 10,7 und 11,4 mg/Tag.
Eine Untersuchung der Untergruppen der Bevölkerung ergab keine Hinweise auf ein unterschiedliches Ansprechen auf der Grundlage des Alters, der Wahl des potenziellen Antidepressivums oder der ethnischen Zugehörigkeit. Bezüglich des Geschlechts zeigte sich bei Männern eine geringere mittlere Reduktion des MADRS-Gesamtscores als bei Frauen.
Reizbarkeit im Zusammenhang mit autistischer Störung
Pädiatrische Patienten
Die Wirksamkeit von ABILIFY (Aripiprazol) bei der Behandlung von Reizbarkeit im Zusammenhang mit autistischen Störungen wurde in zwei 8-wöchigen, placebokontrollierten Studien mit pädiatrischen Patienten (im Alter von 6 bis 17 Jahren), die die DSM-IV-Kriterien für autistische Störungen erfüllten, nachgewiesen gezeigte Verhaltensweisen wie Wutanfälle, Aggression, selbstverletzendes Verhalten oder eine Kombination dieser Probleme. Über 75 % dieser Probanden waren unter 13 Jahre alt.
Die Wirksamkeit wurde anhand von zwei Bewertungsskalen bewertet: der Aberrant Behavior Checklist (ABC) und der Clinical Global Impression-Improvement (CGI-I)-Skala. Der primäre Endpunkt in beiden Studien war die Veränderung von der Baseline zum Endpunkt in der Subskala Reizbarkeit des ABC (ABC-I). Die ABC-I-Subskala maß Symptome der Reizbarkeit bei autistischer Störung.
Die Ergebnisse dieser Versuche sind wie folgt:
In einer der 8-wöchigen placebokontrollierten Studien erhielten Kinder und Jugendliche mit autistischer Störung (n = 98) im Alter von 6 bis 17 Jahren täglich Placebo oder ABILIFY 2 bis 15 mg/Tag. ABILIFY, beginnend mit 2 mg/Tag, wobei je nach klinischem Ansprechen Steigerungen auf bis zu 15 mg/Tag zulässig sind, verbesserte die Werte auf der ABC-I-Subskala und auf der CGI-I-Skala im Vergleich zu Placebo signifikant. Die mittlere Tagesdosis von ABILIFY 10 mg am Ende der 8-wöchigen Behandlung betrug 8,6 mg/Tag (Studie 1 in Tabelle 29).
In der anderen 8-wöchigen, placebokontrollierten Studie mit Kindern und Jugendlichen mit autistischer Störung (n=218) im Alter von 6 bis 17 Jahren wurden drei Fixdosen ABILIFY (5 mg/Tag, 10 mg/Tag oder 15 mg/Tag) Tag) wurden mit Placebo verglichen. Die Dosierung von ABILIFY begann mit 2 mg/Tag und wurde nach einer Woche auf 5 mg/Tag erhöht. Nach einer zweiten Woche wurde sie auf 10 mg/Tag für Patienten in den Behandlungsarmen mit 10 und 15 mg Dosis erhöht, und nach einer dritten Woche wurde sie auf 15 mg/Tag in der Behandlungsgruppe mit 15 mg/Tag erhöht (Studie 2 in Tabelle 29). Alle drei ABILIFY-Dosen verbesserten die Werte auf der ABC-I-Subskala im Vergleich zu Placebo signifikant.
Tourette-Krankheit
Pädiatrische Patienten
Die Wirksamkeit von ABILIFY (Aripiprazol) bei der Behandlung des Tourette-Syndroms wurde in einer 8-wöchigen (7 bis 17 Jahre) und einer 10-wöchigen (6 bis 18 Jahre), placebokontrollierten Studie nachgewiesen pädiatrische Patienten (6 bis 18 Jahre), die die DSM-IV-Kriterien für die Tourette-Erkrankung erfüllten und einen Gesamt-Tic-Score (TTS) ≥ 20 - 22 auf der Yale Global Tic Severity Scale (YGTSS) aufwiesen. Die YGTSS ist eine vollständig validierte Skala zur Messung der aktuellen Tic-Schwere. Die Wirksamkeit wurde anhand von zwei Bewertungsskalen bewertet: 1) dem Gesamt-Tic-Score (TTS) des YGTSS und 2) der Clinical Global Impressions Scale for Tourette's Syndrome (CGI-TS), einem vom Arzt festgelegten zusammenfassenden Maß, das berücksichtigt alle verfügbaren Patienteninformationen. Über 65 % dieser Patienten waren jünger als 13 Jahre.
Der primäre Endpunkt in beiden Studien war die Änderung der TTS des YGTSS vom Ausgangswert zum Endpunkt. Bewertungen für den TTS werden entlang 5 verschiedener Dimensionen auf einer Skala von 0 bis 5 für motorische und vokale Tics vorgenommen. Die Summierung dieser 10 Bewertungen ergibt eine TTS (dh 0–50).
Die Ergebnisse dieser Versuche sind wie folgt:
In der 8-wöchigen, placebokontrollierten Studie mit fester Dosierung wurden Kinder und Jugendliche mit Tourette-Syndrom (n = 133) im Alter von 7 bis 17 Jahren im Verhältnis 1:1:1 zu ABILIFY in niedriger Dosis und hoher Dosis randomisiert ABILIFY 15 mg oder Placebo. Die Zieldosen für die Gruppen mit niedriger und hoher Dosis ABILIFY 10 mg basierten auf dem Gewicht. Patienten
Abbildung 9: Least-Square-Means der Änderung vom Ausgangswert in YGTSS TTS nach Woche (Tourette-Störungsstudie 1) 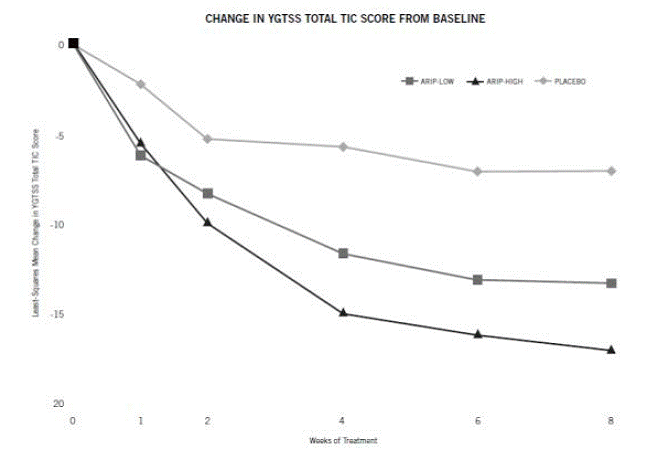
In der 10-wöchigen placebokontrollierten Studie mit flexibler Dosierung bei Kindern und Jugendlichen mit Tourette-Krankheit (n=61) im Alter von 6 bis 18 Jahren erhielten die Patienten tägliche Dosen von Placebo oder ABILIFY, beginnend mit 2 mg/l. täglich, wobei je nach klinischem Ansprechen Erhöhungen um bis zu 20 mg/Tag zulässig sind. ABILIFY zeigte statistisch signifikant verbesserte Werte auf der YGTSS-TTS-Skala im Vergleich zu Placebo (Studie 2 in Tabelle 30). Die mittlere Tagesdosis von ABILIFY am Ende der 10-wöchigen Behandlung betrug 6,54 mg/Tag.
Unruhe im Zusammenhang mit Schizophrenie oder bipolarer Manie
Die Wirksamkeit von intramuskulärem ABILIFY zur Injektion zur Behandlung von Unruhe wurde in drei placebokontrollierten Kurzzeitstudien (24 Stunden) mit unruhigen stationären Patienten aus zwei Diagnosegruppen nachgewiesen: Schizophrenie und Bipolar-I-Störung (manische oder gemischte Episoden mit oder ohne psychotische Merkmale). Jede der Studien umfasste einen einzigen aktiven Vergleichsbehandlungsarm mit entweder einer Haloperidol-Injektion (Schizophrenie-Studien) oder einer Lorazepam-Injektion (bipolare Manie-Studie). Die Patienten konnten während der 24-stündigen Behandlungsperioden bis zu drei Injektionen erhalten; Die Patienten konnten die zweite Injektion jedoch erst nach dem anfänglichen 2-Stunden-Zeitraum erhalten, in dem der primäre Wirksamkeitsmaßstab bewertet wurde. Patienten, die in die Studien aufgenommen wurden, mussten: (1) von den klinischen Prüfärzten als klinisch agitiert und klinisch geeignete Kandidaten für die Behandlung mit intramuskulärer Medikation beurteilt werden und (2) ein Agitationsniveau aufweisen, das einen Schwellenwert von ≥ 15 erreicht oder überschreitet die fünf Items, die die positive und negative Syndromskala (PANSS) Excited Component umfassen (d. h. schlechte Impulskontrolle, Anspannung, Feindseligkeit, Unkooperativität und Erregung) mit mindestens zwei individuellen Itemwerten ≥ 4 unter Verwendung eines 1-7-Bewertungssystems (1 = nicht vorhanden, 4 = mäßig, 7 = extrem). In den Studien betrug der durchschnittliche PANSS Excited Component-Score zu Studienbeginn 19, mit Scores im Bereich von 15 bis 34 (von einem maximalen Score von 35), was auf überwiegend mäßige Agitiertheit hindeutet, wobei einige Patienten leichte oder schwere Agitiertheit zeigten. Der primäre Wirksamkeitsmaßstab, der in diesen Studien zur Beurteilung von Agitationszeichen und -symptomen verwendet wurde, war die Veränderung der PANSS Excited Component gegenüber dem Ausgangswert 2 Stunden nach der Injektion. Ein wichtiges sekundäres Maß war die Clinical Global Impression of Improvement (CGI-I)-Skala. Die Ergebnisse der Versuche folgen:
In einer placebokontrollierten Studie mit unruhigen stationären Patienten, die überwiegend die DSM-IV-Kriterien für Schizophrenie erfüllten (n=350), wurden vier fixe ABILIFY 20 mg-Injektionsdosen von 1 mg, 5,25 mg, 9,75 mg und 15 mg untersucht. 2 Stunden nach der Injektion waren die 5,25-mg-, 9,75-mg- und 15-mg-Dosen dem Placebo in der PANSS-Excited-Komponente (Studie 1 in Tabelle 31) und auf der CGII-Skala statistisch überlegen.
In einer zweiten placebokontrollierten Studie mit unruhigen stationären Patienten, die überwiegend die DSM-IV-Kriterien für Schizophrenie erfüllten (n = 445), wurde eine fixe Injektionsdosis von 9,75 mg ABILIFY 15 mg untersucht. 2 Stunden nach der Injektion war ABILIFY zur Injektion dem Placebo in der PANSS-Excited-Komponente (Studie 2 in Tabelle 31) und auf der CGI-I-Skala statistisch überlegen.
In einer placebokontrollierten Studie mit agitierten stationären Patienten, die die DSMIV-Kriterien für eine Bipolar-I-Störung (manisch oder gemischt) erfüllten (n=291), wurden zwei fixe ABILIFY 10 mg-Injektionsdosen von 9,75 mg und 15 mg untersucht. 2 Stunden nach der Injektion waren beide Dosen Placebo in der PANSS Excited-Komponente statistisch überlegen (Studie 3 in Tabelle 31).
Die Untersuchung von Bevölkerungsuntergruppen (Alter, Rasse und Geschlecht) ergab keine unterschiedliche Reaktionsfähigkeit auf der Grundlage dieser Untergruppen.
INFORMATIONEN ZUM PATIENTEN
ABILIFY® (Aripiprazol) Tabletten
ABILIFY DISCMELT® (Aripiprazol) Im Mund zerfallende Tabletten
ABILIFY® (Aripiprazol) Lösung zum Einnehmen
ABILIFY® (Aripiprazol) Injektion Nur zur intramuskulären Anwendung
Was sind die wichtigsten Informationen, die ich über ABILIFY 20 mg wissen sollte?
(Für andere Nebenwirkungen siehe auch „Welche Nebenwirkungen kann ABILIFY haben?“)
Schwerwiegende Nebenwirkungen können auftreten, wenn Sie ABILIFY einnehmen, einschließlich:
1. Antidepressiva können bei manchen Kindern, Teenagern und jungen Erwachsenen in den ersten Behandlungsmonaten Suizidgedanken oder -handlungen verstärken.
2. Depressionen und andere schwere psychische Erkrankungen sind die wichtigsten Ursachen für Selbstmordgedanken und -handlungen. Bei manchen Menschen besteht ein besonders hohes Risiko für Suizidgedanken oder -handlungen. Dazu gehören Menschen, die eine bipolare Erkrankung (auch manisch-depressive Erkrankung genannt) oder Suizidgedanken oder -handlungen haben (oder in deren Familienanamnese aufgetreten sind).
3. Wie kann ich Suizidgedanken und -handlungen bei mir oder einem Familienmitglied beobachten und versuchen zu verhindern?
Rufen Sie sofort einen Arzt an, wenn Sie oder Ihr Familienmitglied eines der folgenden Symptome haben, insbesondere wenn sie neu oder schlimmer sind oder Sie beunruhigen:
Was muss ich sonst noch über Antidepressiva wissen?
Was ist ABILIFY?
Es ist nicht bekannt, ob ABILIFY 10 mg bei Kindern sicher oder wirksam ist:
Nehmen Sie ABILIFY 20 mg nicht ein, wenn Sie allergisch gegen Aripiprazol oder einen der Bestandteile von ABILIFY sind. Eine vollständige Liste der Inhaltsstoffe von ABILIFY finden Sie am Ende dieses Arzneimittelleitfadens.
Informieren Sie vor der Einnahme von ABILIFY 15 mg Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie Folgendes haben oder hatten:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen.
ABILIFY und andere Arzneimittel können sich gegenseitig beeinflussen und möglicherweise schwerwiegende Nebenwirkungen verursachen. ABILIFY kann die Wirkungsweise anderer Arzneimittel beeinflussen, und andere Arzneimittel können die Wirkungsweise von ABILIFY beeinflussen.
Ihr Arzt kann Ihnen sagen, ob es sicher ist, ABILIFY zusammen mit Ihren anderen Arzneimitteln einzunehmen. Beginnen oder beenden Sie keine Arzneimittel, während Sie ABILIFY einnehmen, ohne vorher mit Ihrem Arzt gesprochen zu haben. Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste Ihrer Arzneimittel, die Sie Ihrem Arzt und Apotheker zeigen können, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich ABILIFY 20 mg einnehmen?
Was sollte ich während der Einnahme von ABILIFY 10 mg vermeiden?
Welche Nebenwirkungen kann ABILIFY haben?
ABILIFY 10 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Wenden Sie sich an Ihren Arzt, wenn Sie während der Behandlung mit ABILIFY eines dieser Symptome von hohem Blutzucker haben:
Zu den häufigsten Nebenwirkungen von ABILIFY 10 mg bei Erwachsenen gehören:
Zu den häufigsten Nebenwirkungen von ABILIFY bei Kindern gehören:
Dies sind nicht alle möglichen Nebenwirkungen von ABILIFY.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist ABILIFY aufzubewahren?
Bewahren Sie ABILIFY und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von ABILIFY
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie ABILIFY 20 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie ABILIFY 20 mg nicht an andere Personen, selbst wenn sie die gleichen Symptome wie Sie haben. Es kann ihnen schaden. Sie können Ihren Arzt oder Apotheker um Informationen zu ABILIFY 10 mg bitten, die für medizinisches Fachpersonal geschrieben wurden.
Was sind die Inhaltsstoffe von ABILIFY?
Wirkstoff: Aripiprazol
Inaktive Zutaten:
Maisstärke, Hydroxypropylcellulose, Lactosemonohydrat, Magnesiumstearat und mikrokristalline Cellulose. Farbstoffe umfassen Eisenoxid (gelb oder rot) und FD&C Blue No. 2 Aluminium Lake
ABILIFY 10 mg DISCMELT Oral zerfallende Tabletten: Acesulfam-Kalium, Aspartam (das Phenylalanin enthält), Calciumsilicat, Croscarmellose-Natrium, Crospovidon, Crème de Vanilla (natürliche und künstliche Aromen), Magnesiumstearat, mikrokristalline Cellulose, Siliciumdioxid, Weinsäure und Xylit. Farbstoffe umfassen Eisenoxid (gelb oder rot) und FD&C Blue No. 2 Aluminium Lake
ABILIFY Lösung zum Einnehmen: Dinatriumedetat, Fruktose (200 mg pro ml), Glycerin, dl-Milchsäure, Methylparaben, Propylenglycol, Propylparaben, Natriumhydroxid, Saccharose (400 mg pro ml) und gereinigtes Wasser. Die Lösung zum Einnehmen ist mit natürlicher Orangencreme und anderen natürlichen Aromen aromatisiert
Weitere Informationen zu ABILIFY finden Sie unter www.abilify.com oder telefonisch unter 1-800-438-6055.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt