Cymbalta 20mg, 30mg, 40mg, 60mg Duloxetine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Cymbalta und wie wird es angewendet?
Cymbalta ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von Symptomen einer schweren depressiven Störung, diabetischen peripheren neuropathischen Schmerzen, generalisierter Angststörung, Fibromyalgie und chronischen Muskelschmerzen. Cymbalta kann allein oder mit anderen Medikamenten verwendet werden.
Welche Nebenwirkungen kann Cymbalta 20mg haben?
Cymbalta kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Cymbalta sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Cymbalta. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
Selbstmordgedanken und Verhaltensweisen
Antidepressiva erhöhten in Kurzzeitstudien das Risiko für Suizidgedanken und -verhalten bei Kindern, Jugendlichen und jungen Erwachsenen. Diese Studien zeigten keine Erhöhung des Risikos für Suizidgedanken und -verhalten bei Anwendung von Antidepressiva bei Patienten über 24 Jahren; bei Patienten im Alter von 65 Jahren und älter wurde das Risiko bei der Anwendung von Antidepressiva verringert [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Bei Patienten jeden Alters, die mit einer antidepressiven Therapie begonnen werden, ist eine genaue Überwachung auf eine Verschlechterung und das Auftreten von Suizidgedanken und -verhalten vorzunehmen. Informieren Sie Familien und Pflegekräfte über die Notwendigkeit einer genauen Beobachtung und Kommunikation mit dem verschreibenden Arzt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
BEZEICHNUNG
CYMBALTA® (Duloxetin-Retardkapseln) ist ein selektiver Serotonin- und Noradrenalin-Wiederaufnahmehemmer (SSNRI) zur oralen Verabreichung. Seine chemische Bezeichnung lautet (+)-(S)-N-Methyl-γ-(1-Naphthyloxy)-2-Thiophenpropylamin-Hydrochlorid. Die Summenformel lautet C18H19NOS·HCl, was einem Molekulargewicht von 333,88 entspricht. Die Strukturformel lautet:
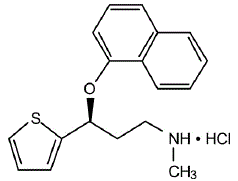
Duloxetinhydrochlorid ist ein weißer bis leicht bräunlich-weißer Feststoff, der in Wasser leicht löslich ist.
Jede Kapsel enthält magensaftresistente Pellets mit 22,4, 33,7 oder 67,3 mg Duloxetinhydrochlorid, entsprechend 20, 30 bzw. 60 mg Duloxetin. Diese magensaftresistenten Pellets sollen den Abbau des Medikaments in der sauren Umgebung des Magens verhindern. Zu den inaktiven Inhaltsstoffen gehören FD&C Blue Nr. 2, Gelatine, Hypromellose, Hydroxypropylmethylcelluloseacetatsuccinat, Natriumlaurylsulfat, Saccharose, Zuckerkügelchen, Talk, Titandioxid und Triethylcitrat. Die 20- und 60-mg-Kapseln enthalten außerdem gelbes Eisenoxid.
INDIKATIONEN
CYMBALTA® ist angezeigt zur Behandlung von:
DOSIERUNG UND ANWENDUNG
Wichtige Verwaltungsanweisungen
CYMBALTA oral verabreichen (mit oder ohne Mahlzeiten) und unzerkaut schlucken. Nicht kauen oder zerdrücken und die Kapsel mit verzögerter Wirkstofffreisetzung nicht öffnen und ihren Inhalt nicht über Lebensmittel streuen oder mit Flüssigkeiten mischen, da dies die magensaftresistente Beschichtung beeinträchtigen könnte. Wenn eine Dosis von CYMBALTA 20 mg vergessen wurde, nehmen Sie die vergessene Dosis ein, sobald Sie sich daran erinnern. Wenn es fast Zeit für die nächste Dosis ist, lassen Sie die vergessene Dosis aus und nehmen Sie die nächste Dosis zur gewohnten Zeit ein. Nehmen Sie nicht zwei Dosen CYMBALTA 60 mg gleichzeitig ein.
Dosierung zur Behandlung von schweren depressiven Störungen bei Erwachsenen
Die empfohlene Anfangsdosis bei Erwachsenen mit MDD beträgt 40 mg/Tag (gegeben als 20 mg zweimal täglich) bis 60 mg/Tag (gegeben entweder einmal täglich oder als 30 mg zweimal täglich). Bei einigen Patienten kann es wünschenswert sein, mit 30 mg einmal täglich für 1 Woche zu beginnen, damit sich die Patienten an CYMBALTA 30 mg gewöhnen können, bevor sie auf 60 mg einmal täglich erhöhen. Während sich eine Dosis von 120 mg/Tag als wirksam erwiesen hat, gibt es keine Hinweise darauf, dass Dosen von mehr als 60 mg/Tag einen zusätzlichen Nutzen bringen. Regelmäßige Neubewertung, um die Notwendigkeit einer Erhaltungsbehandlung und die geeignete Dosierung für eine solche Behandlung zu bestimmen.
Dosierung zur Behandlung von generalisierter Angststörung
Empfohlene Dosierung bei Erwachsenen unter 65 Jahren
Bei den meisten Erwachsenen unter 65 Jahren mit GAD sollte mit CYMBALTA 60 mg einmal täglich begonnen werden. Bei einigen Patienten kann es wünschenswert sein, mit 30 mg einmal täglich für 1 Woche zu beginnen, damit sich die Patienten auf CYMBALTA 40 mg einstellen können, bevor sie auf 60 mg einmal täglich erhöhen. Während sich eine Dosis von 120 mg einmal täglich als wirksam erwiesen hat, gibt es keine Hinweise darauf, dass Dosen von mehr als 60 mg/Tag einen zusätzlichen Nutzen bringen. Wenn dennoch die Entscheidung getroffen wird, die Dosis über 60 mg einmal täglich zu erhöhen, erhöhen Sie die Dosis in Schritten von 30 mg einmal täglich. Regelmäßige Neubewertung, um festzustellen, ob eine Erhaltungstherapie weiterhin erforderlich ist und welche Dosierung für eine solche Behandlung angemessen ist.
Empfohlene Dosierung bei geriatrischen Patienten
Beginnen Sie bei geriatrischen Patienten mit GAD mit CYMBALTA in einer Dosierung von 30 mg einmal täglich für 2 Wochen, bevor Sie eine Erhöhung auf die Zieldosis von 60 mg/Tag in Betracht ziehen. Danach können die Patienten von Dosen über 60 mg einmal täglich profitieren. Wenn entschieden wird, die Dosis über 60 mg einmal täglich zu erhöhen, erhöhen Sie die Dosis in Schritten von 30 mg einmal täglich. Die untersuchte Höchstdosis betrug 120 mg pro Tag.
Empfohlene Dosierung bei pädiatrischen Patienten im Alter von 7 bis 17 Jahren
Beginnen Sie mit CYMBALTA 30 mg bei pädiatrischen Patienten im Alter von 7 bis 17 Jahren mit GAD in einer Dosierung von 30 mg einmal täglich für 2 Wochen, bevor Sie eine Erhöhung auf 60 mg einmal täglich in Betracht ziehen. Der empfohlene Dosierungsbereich beträgt 30 bis 60 mg einmal täglich. Einige Patienten können von Dosierungen über 60 mg einmal täglich profitieren. Wenn entschieden wird, die Dosis über 60 mg einmal täglich zu erhöhen, erhöhen Sie die Dosis in Schritten von 30 mg einmal täglich. Die untersuchte Höchstdosis betrug 120 mg pro Tag.
Dosierung zur Behandlung von diabetischen peripheren neuropathischen Schmerzen bei Erwachsenen
60 mg einmal täglich bei Erwachsenen mit diabetischen peripheren neuropathischen Schmerzen verabreichen. Es gibt keine Hinweise darauf, dass Dosen von mehr als 60 mg einmal täglich einen zusätzlichen signifikanten Nutzen bringen, und die höhere Dosierung wird eindeutig weniger gut vertragen. Bei Patienten, bei denen die Verträglichkeit von Bedeutung ist, kann eine niedrigere Anfangsdosis in Betracht gezogen werden.
Da Diabetes häufig durch eine Nierenerkrankung kompliziert wird, sollten Sie bei Patienten mit eingeschränkter Nierenfunktion eine niedrigere Anfangsdosis und eine allmähliche Dosissteigerung in Betracht ziehen [siehe Dosierung bei Patienten mit eingeschränkter Leberfunktion oder schwerer Nierenfunktionsstörung und Verwendung in bestimmten Bevölkerungsgruppen ].
Dosierung zur Behandlung von Fibromyalgie
Empfohlene Dosierung bei Erwachsenen
Die empfohlene Dosierung von CYMBALTA beträgt 60 mg einmal täglich bei Erwachsenen mit Fibromyalgie. Beginnen Sie die Behandlung mit 30 mg einmal täglich für 1 Woche, damit sich die Patienten auf CYMBALTA 20 mg einstellen können, bevor sie auf 60 mg einmal täglich erhöhen. Einige Patienten können auf die Anfangsdosis ansprechen. Es gibt keine Hinweise darauf, dass Dosierungen von mehr als 60 mg/Tag einen zusätzlichen Nutzen bringen, selbst bei Patienten, die auf eine Dosierung von 60 mg/Tag nicht ansprechen, und höhere Dosierungen waren mit einer höheren Nebenwirkungsrate verbunden.
Empfohlene Dosierung bei pädiatrischen Patienten im Alter von 13 bis 17 Jahren
Die empfohlene Anfangsdosis von CYMBALTA 60 mg bei pädiatrischen Patienten im Alter von 13 bis 17 Jahren mit Fibromyalgie beträgt 30 mg einmal täglich. Die Dosierung kann je nach Ansprechen und Verträglichkeit auf 60 mg einmal täglich erhöht werden.
Dosierung zur Behandlung von chronischen Schmerzen des Bewegungsapparates bei Erwachsenen
Die empfohlene Dosierung von CYMBALTA beträgt 60 mg einmal täglich bei Erwachsenen mit chronischen Schmerzen des Bewegungsapparates. Beginnen Sie die Behandlung mit 30 mg einmal täglich für eine Woche, damit sich die Patienten an CYMBALTA gewöhnen können, bevor Sie die Dosis auf 60 mg einmal täglich erhöhen. Es gibt keine Hinweise darauf, dass höhere Dosierungen einen zusätzlichen Nutzen bringen, selbst bei Patienten, die auf eine Dosis von 60 mg einmal täglich nicht ansprechen, und höhere Dosierungen sind mit einer höheren Rate von Nebenwirkungen verbunden [siehe Klinische Studien ].
Dosierung bei Patienten mit eingeschränkter Leberfunktion oder schwerer Nierenfunktionsstörung
Vermeiden Sie die Anwendung bei Patienten mit chronischer Lebererkrankung oder Zirrhose [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Vermeiden Sie die Anwendung bei Patienten mit schwerer Nierenfunktionsstörung, GFR WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Einstellung von CYMBALTA
Zu den Nebenwirkungen nach Absetzen von CYMBALTA, nach abruptem oder schrittweisem Absetzen gehören: Schwindel, Kopfschmerzen, Übelkeit, Durchfall, Parästhesien, Reizbarkeit, Erbrechen, Schlaflosigkeit, Angstzustände, Hyperhidrose und Müdigkeit. Wann immer möglich, wird eine allmähliche Reduzierung der Dosierung anstelle eines abrupten Absetzens empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Umstellung eines Patienten auf oder von einem Monoaminoxidase-Hemmer (MAOI) zur Behandlung von psychiatrischen Erkrankungen
Zwischen dem Absetzen eines MAO-Hemmers zur Behandlung psychiatrischer Erkrankungen und dem Beginn einer Therapie mit CYMBALTA sollten mindestens 14 Tage vergehen. Umgekehrt sollten nach dem Absetzen von CYMBALTA 60 mg mindestens 5 Tage vergehen, bevor mit einem MAOI zur Behandlung psychiatrischer Erkrankungen begonnen wird [siehe KONTRAINDIKATIONEN ].
Anwendung von CYMBALTA mit anderen MAO-Hemmern wie Linezolid oder Methylenblau
Beginnen Sie nicht mit CYMBALTA bei einem Patienten, der mit Linezolid oder intravenösem Methylenblau behandelt wird, da ein erhöhtes Risiko für ein Serotonin-Syndrom besteht. Bei einem Patienten, der eine dringendere Behandlung einer psychiatrischen Erkrankung benötigt, sollten andere Interventionen, einschließlich eines Krankenhausaufenthalts, in Betracht gezogen werden [siehe KONTRAINDIKATIONEN ].
In einigen Fällen kann ein Patient, der bereits eine CYMBALTA-Therapie erhält, eine dringende Behandlung mit Linezolid oder intravenösem Methylenblau benötigen. Wenn keine akzeptablen Alternativen zur Behandlung mit Linezolid oder intravenösem Methylenblau verfügbar sind und der potenzielle Nutzen einer Behandlung mit Linezolid oder intravenösem Methylenblau die Risiken eines Serotonin-Syndroms bei einem bestimmten Patienten überwiegen, sollte CYMBALTA sofort abgesetzt und Linezolid oder Methylenblau intravenös verabreicht werden verwaltet werden können. Der Patient sollte für 5 Tage oder bis 24 Stunden nach der letzten Dosis von Linezolid oder intravenösem Methylenblau, je nachdem, was zuerst eintritt, auf Symptome des Serotonin-Syndroms überwacht werden. Die Therapie mit CYMBALTA kann 24 Stunden nach der letzten Dosis von Linezolid oder intravenösem Methylenblau wieder aufgenommen werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Das Risiko der Verabreichung von Methylenblau auf nicht-intravenösem Weg (z. B. als Tabletten zum Einnehmen oder durch lokale Injektion) oder in intravenösen Dosen von viel weniger als 1 mg/kg zusammen mit CYMBALTA ist unklar. Der Arzt sollte sich jedoch der Möglichkeit bewusst sein, dass bei einer solchen Anwendung Symptome des Serotonin-Syndroms auftreten können [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
WIE GELIEFERT
Darreichungsformen und Stärken
CYMBALTA ist als Kapseln mit verzögerter Freisetzung erhältlich:
CYMBALTA (Duloxetin-Kapseln mit verzögerter Freisetzung) ist in folgenden Stärken, Farben, Aufdrucken und Aufmachungen erhältlich:
Lagerung und Handhabung
Bei 25 °C (77 °F) lagern; Abweichungen bis 15-30°C (59-86°F) zulässig [siehe USP Controlled Room Temperature].
Vertrieben durch: Lilly USA, LLC Indianapolis, IN 46285, USA. Überarbeitet: Juli 2021
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden unten und an anderer Stelle in der Kennzeichnung beschrieben:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die angegebenen Häufigkeiten von Nebenwirkungen stellen den Anteil der Patienten dar, bei denen mindestens einmal eine behandlungsbedingte Nebenwirkung der aufgeführten Art auftrat. Eine Reaktion wurde als behandlungsbedingt angesehen, wenn sie zum ersten Mal auftrat oder sich während der Therapie nach der Ausgangsbewertung verschlechterte.
Nebenwirkungen bei Erwachsenen
Datenbank für klinische Studien für Erwachsene
Die unten beschriebenen Daten spiegeln die Exposition gegenüber CYMBALTA in placebokontrollierten Studien mit Erwachsenen für MDD (N = 3779), GAD (N = 1018), OA (N = 503), CLBP (N = 600), DPNP (N = 906), und FM (N = 1294). Die Altersspanne in dieser gepoolten Population lag zwischen 17 und 89 Jahren. In dieser gepoolten Population waren 66 %, 61 %, 61 %, 43 % und 94 % der erwachsenen Patienten weiblich; und 82 %, 73 %, 85 %, 74 % und 86 % der erwachsenen Patienten in den MDD-, GAD-, OA- bzw. CLBP-, DPNP- und FM-Populationen waren Kaukasier. Die meisten Patienten erhielten CYMBALTA-Dosierungen von insgesamt 60 bis 120 mg pro Tag [vgl Klinische Studien ]. Die nachstehenden Daten beinhalten nicht die Ergebnisse der Studie, die die Wirksamkeit von CYMBALTA 30 mg zur Behandlung von GAD bei Patienten ≥ 65 Jahre bewertete (Studie GAD-5) [siehe Klinische Studien ]; Die in dieser geriatrischen Population beobachteten Nebenwirkungen waren jedoch im Allgemeinen ähnlich wie die Nebenwirkungen in der gesamten erwachsenen Population.
Nebenwirkungen, die zu einem Behandlungsabbruch in Placebo-kontrollierten Studien mit Erwachsenen führten
Depression
Etwa 8,4 % (319/3779) der mit CYMBALTA behandelten Patienten in Placebo-kontrollierten Erwachsenenstudien zu MDD brachen die Behandlung aufgrund einer Nebenwirkung ab, verglichen mit 4,6 % (117/2536) der mit Placebo behandelten Patienten. Übelkeit (CYMBALTA 1,1 %, Placebo 0,4 %) war die einzige Nebenwirkung, die als Grund für das Absetzen berichtet wurde und als arzneimittelbedingt angesehen wurde (d. h. Absetzen trat bei mindestens 1 % der mit CYMBALTA behandelten Patienten und mit einer Häufigkeit von 0,4 % auf). mindestens doppelt so hoch wie bei mit Placebo behandelten Patienten).
Generalisierte Angststörung
Ungefähr 13,7 % (139/1018) der mit CYMBALTA behandelten Patienten in placebokontrollierten GAD-Studien mit Erwachsenen brachen die Behandlung aufgrund einer Nebenwirkung ab, verglichen mit 5 % (38/767) der mit Placebo behandelten Patienten. Häufige Nebenwirkungen, die als Grund für das Absetzen berichtet wurden und als arzneimittelbedingt (wie oben definiert) angesehen wurden, waren Übelkeit (CYMBALTA 3,3 %, Placebo 0,4 %) und Schwindel (CYMBALTA 1,3 %, Placebo 0,4 %).
Diabetischer peripherer neuropathischer Schmerz
Etwa 12,9 % (117/906) der mit CYMBALTA behandelten Patienten in placebokontrollierten Studien mit Erwachsenen zu DPNP brachen die Behandlung aufgrund einer Nebenwirkung ab, verglichen mit 5,1 % (23/448) der mit Placebo behandelten Patienten. Häufige Nebenwirkungen, die als Grund für das Absetzen berichtet wurden und als arzneimittelbedingt (wie oben definiert) angesehen wurden, waren Übelkeit (CYMBALTA 3,5 %, Placebo 0,7 %), Schwindel (CYMBALTA 1,2 %, Placebo 0,4 %) und Somnolenz (CYMBALTA 1,1 % , Placebo 0 %).
Fibromyalgie
Etwa 17,5 % (227/1294) der mit CYMBALTA behandelten Patienten in 3- bis 6-monatigen placebokontrollierten FM-Studien mit Erwachsenen brachen die Behandlung aufgrund einer Nebenwirkung ab, verglichen mit 10,1 % (96/955) der mit Placebo behandelten Patienten . Nebenwirkungen, die als Grund für das Absetzen berichtet wurden und als arzneimittelbedingt (wie oben definiert) angesehen wurden, waren Übelkeit (CYMBALTA 2,0 %, Placebo 0,5 %), Kopfschmerzen (CYMBALTA 1,2 %, Placebo 0,3 %), Schläfrigkeit (CYMBALTA 1,1 %, Placebo). 0 %) und Müdigkeit (CYMBALTA 1,1 %, Placebo 0,1 %).
Chronische Schmerzen aufgrund von Arthrose
Etwa 15,7 % (79/503) der mit CYMBALTA behandelten Patienten in 13-wöchigen, placebokontrollierten Erwachsenenstudien zu chronischen Schmerzen aufgrund von Arthrose brachen die Behandlung aufgrund einer Nebenwirkung ab, verglichen mit 7,3 % (37/508) bei Placebo- behandelte Patienten. Nebenwirkungen, die als Grund für das Absetzen berichtet wurden und als arzneimittelbedingt (wie oben definiert) angesehen wurden, waren Übelkeit (CYMBALTA 2,2 %, Placebo 1 %).
Chronische Rückenschmerzen
Etwa 16,5 % (99/600) der mit CYMBALTA behandelten Patienten in 13-wöchigen, placebokontrollierten Studien mit Erwachsenen zu CLBP brachen die Behandlung aufgrund einer Nebenwirkung ab, verglichen mit 6,3 % (28/441) der mit Placebo behandelten Patienten. Nebenwirkungen, die als Grund für das Absetzen berichtet wurden und als arzneimittelbedingt (wie oben definiert) angesehen wurden, waren Übelkeit (CYMBALTA 3 %, Placebo 0,7 %) und Somnolenz (CYMBALTA 1 %, Placebo 0 %).
Die häufigsten Nebenwirkungen in Studien mit Erwachsenen
Die am häufigsten beobachteten Nebenwirkungen bei mit CYMBALTA behandelten Patienten (wie oben definiert) waren:
Die am häufigsten beobachteten Nebenwirkungen bei mit CYMBALTA behandelten Patienten in allen gepoolten Erwachsenenpopulationen (d. h. MDD, GAD, DPNP, FM, OA und CLBP) (Inzidenz von mindestens 5 % und mindestens doppelt so häufig wie bei Placebo-behandelten Patienten). Patienten) waren Übelkeit, Mundtrockenheit, Somnolenz, Verstopfung, verminderter Appetit und Hyperhidrose.
Tabelle 2 zeigt die Inzidenz von Nebenwirkungen in placebokontrollierten Studien für zugelassene erwachsene Populationen (dh MDD, GAD, DPNP, FM, OA und CLBP), die bei 5 % oder mehr der mit CYMBALTA behandelten Patienten und mit einer höheren Inzidenz auftraten als mit Placebo behandelte Patienten.
Nebenwirkungen in gepoolten MDD- und GAD-Studien bei Erwachsenen
Tabelle 3 zeigt die Inzidenz von Nebenwirkungen in Placebo-kontrollierten Studien mit MDD und GAD, die bei 2 % oder mehr der mit CYMBALTA behandelten Patienten auftraten und mit einer höheren Inzidenz als bei Placebo-behandelten Patienten.
Nebenwirkungen in den DPNP-, FM-, OA- und CLBP-Erwachsenenstudien
Tabelle 4 zeigt die Inzidenz von Nebenwirkungen, die bei 2 % oder mehr der mit CYMBALTA behandelten Patienten (bestimmt vor Rundung) in der akuten Phase vor der Markteinführung von placebokontrollierten Studien mit DPNP, FM, OA und CLBP und mit einer höheren Inzidenz auftraten als mit Placebo behandelte Patienten.
Auswirkungen auf die männliche und weibliche Sexualfunktion bei Erwachsenen mit MDD
Veränderungen des sexuellen Verlangens, der sexuellen Leistungsfähigkeit und der sexuellen Befriedigung treten häufig als Manifestation psychiatrischer Störungen oder Diabetes auf, können aber auch eine Folge einer pharmakologischen Behandlung sein. Da angenommen wird, dass unerwünschte sexuelle Reaktionen freiwillig zu wenig gemeldet werden, wurde die Arizona Sexual Experience Scale (ASEX), ein validiertes Maß zur Identifizierung sexueller Nebenwirkungen, prospektiv in 4 Placebo-kontrollierten MDD-Erwachsenenstudien verwendet (Studien MDD-1, MDD-2 , MDD-3 und MDD-4) [siehe Klinische Studien ]. Die ASEX-Skala umfasst fünf Fragen, die sich auf die folgenden Aspekte der Sexualfunktion beziehen: 1) Sexualtrieb, 2) Leichtigkeit der Erregung, 3) Fähigkeit, eine Erektion (Männer) oder Gleitfähigkeit (Frauen) zu erreichen, 4) Leichtigkeit, einen Orgasmus zu erreichen, und 5) Orgasmusbefriedigung. Positive Zahlen bedeuten eine Verschlechterung der sexuellen Funktion gegenüber dem Ausgangswert. Negative Zahlen bedeuten eine Verbesserung gegenüber einem Ausgangswert der Dysfunktion, die häufig bei depressiven Patienten beobachtet wird.
In diesen Studien erlebten mit CYMBALTA behandelte männliche Patienten signifikant mehr sexuelle Dysfunktion, gemessen anhand der Gesamtpunktzahl auf dem ASEX und der Fähigkeit, einen Orgasmus zu erreichen, als mit Placebo behandelte männliche Patienten (siehe ). Mit CYMBALTA behandelte Patientinnen erfuhren nicht mehr sexuelle Funktionsstörungen als mit Placebo behandelte Patientinnen, gemessen anhand des ASEX-Gesamtscores. Gesundheitsdienstleister sollten sich routinemäßig nach möglichen sexuellen Nebenwirkungen bei mit CYMBALTA behandelten Patienten erkundigen.
Vitalzeichenveränderungen bei Erwachsenen
In placebokontrollierten klinischen Studien in zugelassenen erwachsenen Populationen zur Veränderung vom Ausgangswert zum Endpunkt kam es bei mit CYMBALTA behandelten Patienten zu einem mittleren Anstieg des systolischen Blutdrucks (SBP) um 0,23 mm Hg und des diastolischen Blutdrucks (DBP) um 0,73 mm Hg im Vergleich zu einem mittleren Abfall von 1,09 mm Hg bei SBP und 0,55 mm Hg bei DBP bei mit Placebo behandelten Patienten. Es gab keinen signifikanten Unterschied in der Häufigkeit von anhaltendem (3 aufeinanderfolgenden Besuchen) erhöhtem Blutdruck [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die bis zu 26-wöchige Behandlung mit CYMBALTA 20 mg in placebokontrollierten Studien mit zugelassenen erwachsenen Populationen verursachte im Vergleich zu Placebo typischerweise einen leichten Anstieg der Herzfrequenz für die Änderung vom Ausgangswert zum Endpunkt um bis zu 1,37 Schläge pro Minute (Anstieg von 1,20 Schlägen pro Minute). bei mit CYMBALTA behandelten Patienten Abnahme von 0,17 Schlägen pro Minute bei mit Placebo behandelten Patienten).
Laborveränderungen bei Erwachsenen
Die Behandlung mit CYMBALTA war in placebokontrollierten klinischen Studien in zugelassenen erwachsenen Populationen mit kleinen mittleren Anstiegen von ALT, AST, CPK und alkalischer Phosphatase vom Ausgangswert bis zum Endpunkt verbunden; für diese Analyten wurden bei mit CYMBALTA behandelten Patienten im Vergleich zu mit Placebo behandelten Patienten seltene, bescheidene, vorübergehende, abnormale Werte beobachtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Hohe Bikarbonat-, Cholesterin- und abnorme (hohe oder niedrige) Kaliumwerte wurden bei mit CYMBALTA behandelten Patienten häufiger beobachtet als bei mit Placebo behandelten Patienten.
Andere Nebenwirkungen, die während der klinischen Studienbewertung von CYMBALTA bei Erwachsenen beobachtet wurden
Nachfolgend finden Sie eine Liste von Nebenwirkungen, die von Patienten berichtet wurden, die mit CYMBALTA 40 mg in klinischen Studien mit Erwachsenen behandelt wurden. In klinischen Studien aller zugelassenen Erwachsenenpopulationen wurden 34.756 Patienten mit CYMBALTA behandelt. Von diesen nahmen 27 % (9337) CYMBALTA 60 mg für mindestens 6 Monate und 12 % (4317) nahmen CYMBALTA für mindestens ein Jahr ein. Die folgende Auflistung soll keine Reaktionen enthalten, (1) die bereits in den vorherigen Tabellen oder an anderer Stelle in der Kennzeichnung aufgeführt sind, (2) für die eine medikamentöse Ursache entfernt war, (3) die so allgemein waren, dass sie nicht aussagekräftig waren, (4) die waren nicht als signifikante klinische Auswirkungen angesehen werden, oder (5) die mit einer gleichen oder geringeren Häufigkeit als Placebo auftraten.
Reaktionen werden nach Körpersystem gemäß den folgenden Definitionen kategorisiert: häufige Nebenwirkungen sind solche, die bei mindestens 1/100 Patienten auftreten; seltene Nebenwirkungen treten bei 1/100 bis 1/1000 Patienten auf; seltene Reaktionen treten bei weniger als 1/1000 Patienten auf.
Nebenwirkungen, die in Placebo-kontrollierten klinischen Studien bei pädiatrischen Patienten beobachtet wurden
Datenbank für pädiatrische klinische Studien
Die unten beschriebenen Daten spiegeln die Exposition gegenüber CYMBALTA (N=567) bei pädiatrischen Patienten im Alter von 7 bis 18 Jahren aus zwei 10-wöchigen, placebokontrollierten Studien bei Patienten mit MDD (N=341) wider (Studien MDD-6 und MDD- 7), eine 10-wöchige placebokontrollierte Studie bei GAD (N=135) (Studie GAD-6) und eine 13-wöchige Studie bei Fibromyalgie (N=91). CYMBALTA 60 mg ist nicht für die Behandlung von MDD bei pädiatrischen Patienten zugelassen [siehe Verwendung in bestimmten Bevölkerungsgruppen ]. Von den mit CYMBALTA behandelten Patienten in diesen Studien waren 36 % 7 bis 11 Jahre alt (64 % waren zwischen 12 und 18 Jahre alt), 55 % waren Frauen und 69 % Kaukasier. Während placebokontrollierter Akutbehandlungsstudien erhielten die Patienten 30 bis 120 mg CYMBALTA pro Tag. In den pädiatrischen MDD-, GAD- und Fibromyalgie-Studien mit einer Dauer von bis zu 40 Wochen wurden 988 pädiatrische Patienten im Alter von 7 bis 17 Jahren mit CYMBALTA behandelt (die meisten Patienten erhielten 30-120 mg pro Tag) – 35 % waren 7 bis 11 Jahre alt (65 % waren 12 bis 17 Jahre alt) und 56 % waren weiblich.
Die häufigsten Nebenwirkungen in pädiatrischen Studien
Die häufigsten Nebenwirkungen (≥ 5 % bei den mit CYMBALTA behandelten Patienten und mindestens doppelt so häufig wie bei den mit Placebo behandelten Patienten) in allen gepoolten pädiatrischen Populationen (MDD, GAD und Fibromyalgie) waren Gewichtsverlust, verminderter Appetit, Übelkeit, Erbrechen, Müdigkeit und Durchfall.
Nebenwirkungen bei pädiatrischen Patienten im Alter von 7 bis 17 Jahren mit MDD und GAD
Das Nebenwirkungsprofil, das in klinischen Studien bei pädiatrischen Patienten im Alter von 7 bis 18 Jahren mit MDD und GAD beobachtet wurde, stimmte mit dem Nebenwirkungsprofil überein, das in klinischen Studien mit Erwachsenen beobachtet wurde. Die häufigsten (≥5 % und zweimal Placebo) Nebenwirkungen, die in diesen pädiatrischen klinischen Studien beobachtet wurden, waren: Übelkeit, Durchfall, Gewichtsabnahme und Schwindel.
Tabelle 6 zeigt die Inzidenz von Nebenwirkungen in placebokontrollierten pädiatrischen MDD- und GAD-Studien, die bei mehr als 2 % der mit CYMBALTA behandelten Patienten und mit einer höheren Inzidenz als bei mit Placebo behandelten Patienten auftraten. CYMBALTA ist nicht für die Behandlung von MDD bei pädiatrischen Patienten zugelassen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Andere Nebenwirkungen, die mit einer Inzidenz von weniger als 2 % auftraten und von mehr mit CYMBALTA behandelten Patienten als von mit Placebo behandelten Patienten in pädiatrischen klinischen Studien zu MDD und GAD berichtet wurden, waren: anormale Träume (einschließlich Albträume), Angstzustände, Hitzewallungen (einschließlich Hitzewallungen). ), Hyperhidrose, Herzklopfen, erhöhter Puls und Tremor (CYMBALTA 20 mg ist nicht zur Behandlung von pädiatrischen Patienten mit MDD zugelassen).
Die am häufigsten berichteten Symptome nach Absetzen von CYMBALTA 30 mg in pädiatrischen klinischen Studien zu MDD und GAD waren Kopfschmerzen, Schwindel, Schlaflosigkeit und Bauchschmerzen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Wachstum (Größe und Gewicht) bei pädiatrischen Patienten im Alter von 7 bis 17 Jahren mit GAD und MDD
Verminderter Appetit und Gewichtsverlust wurden im Zusammenhang mit der Anwendung von SSRIs und SNRIs beobachtet. Bei mit CYMBALTA behandelten pädiatrischen Patienten in klinischen Studien kam es nach 10 Wochen zu einer mittleren Gewichtsabnahme von 0,1 kg, verglichen mit einer mittleren Gewichtszunahme von etwa 0,9 kg bei mit Placebo behandelten pädiatrischen Patienten. Der Anteil der Patienten, bei denen eine klinisch signifikante Gewichtsabnahme (≥ 3,5 %) auftrat, war in der CYMBALTA-Gruppe größer als in der Placebo-Gruppe (16 % bzw. 6 %). Anschließend tendierten die mit CYMBALTA behandelten Patienten während der 4- bis 6-monatigen unkontrollierten Verlängerungsperioden im Durchschnitt zu einer Erholung auf ihr erwartetes Baseline-Gewichtsperzentil, basierend auf Populationsdaten von Alters- und Geschlechtsgleichen.
In Studien über bis zu 9 Monate kam es bei mit CYMBALTA behandelten pädiatrischen Patienten zu einer Zunahme der Körpergröße von durchschnittlich 1,7 cm (2,2 cm Zunahme bei Patienten im Alter von 7 bis 11 Jahren und 1,3 cm Zunahme bei Patienten im Alter von 12 bis 17 Jahren). Während während dieser Studien eine Zunahme der Körpergröße beobachtet wurde, wurde eine mittlere Abnahme des Perzentils der Körpergröße um 1 % beobachtet (Abnahme um 2 % bei Patienten im Alter von 7 bis 11 Jahren und Zunahme um 0,3 % bei Patienten im Alter von 12 bis 17 Jahren). Gewicht und Größe sollten bei pädiatrischen Patienten, die mit CYMBALTA behandelt werden, regelmäßig überwacht werden [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Nebenwirkungen bei pädiatrischen Patienten im Alter von 13 bis 17 Jahren mit Fibromyalgie
Tabelle 7 zeigt die Inzidenz von Nebenwirkungen in einer placebokontrollierten Fibromyalgie-Studie bei Kindern (Studie FM-4), die bei mehr als 5 % der mit CYMBALTA 30 mg behandelten Patienten und mit einer höheren Inzidenz als bei mit Placebo behandelten Patienten auftraten [siehe Klinische Studien ].
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von CYMBALTA nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Seit der Markteinführung berichtete Nebenwirkungen, die in zeitlichem Zusammenhang mit der Therapie mit CYMBALTA 40 mg standen und an anderer Stelle in der Kennzeichnung nicht erwähnt wurden, umfassen: akute Pankreatitis, anaphylaktische Reaktion, Aggression und Wut (insbesondere zu Beginn der Behandlung oder nach Absetzen der Behandlung), angioneurotisches Ödem, Engwinkelglaukom, Kolitis (mikroskopisch oder nicht näher bezeichnet), kutane Vaskulitis (manchmal verbunden mit systemischer Beteiligung), extrapyramidale Störung, Galaktorrhoe, gynäkologische Blutungen, Halluzinationen, Hyperglykämie, Hyperprolaktinämie, Überempfindlichkeit, hypertensive Krise, Muskelkrämpfe, Hautausschlag, Restless-Legs-Syndrom, Krampfanfälle nach Absetzen der Behandlung, supraventrikuläre Arrhythmie, Tinnitus (nach Absetzen der Behandlung), Trismus und Urtikaria.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Sowohl CYP1A2 als auch CYP2D6 sind für den Metabolismus von Duloxetin verantwortlich.
Inhibitoren von CYP1A2
Bei gleichzeitiger Verabreichung von 60 mg CYMBALTA mit 100 mg Fluvoxamin, einem starken CYP1A2-Hemmer, bei männlichen Probanden (n = 14) stieg die AUC von Duloxetin um das etwa 6-Fache, die Cmax um das etwa 2,5-Fache und die t1/2 von Duloxetin an etwa um das 3-fache erhöht. Andere Arzneimittel, die den CYP1A2-Metabolismus hemmen, umfassen antimikrobielle Cimetidin- und Chinolon-Antibiotika wie Ciprofloxacin und Enoxacin [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Inhibitoren von CYP2D6
Die gleichzeitige Anwendung von CYMBALTA (40 mg einmal täglich) mit Paroxetin (20 mg einmal täglich) erhöhte die AUC-Konzentration von Duloxetin um etwa 60 %, und bei höheren Paroxetin-Dosen ist eine stärkere Hemmung zu erwarten. Ähnliche Wirkungen wären mit anderen potenten CYP2D6-Inhibitoren (z. B. Fluoxetin, Chinidin) zu erwarten [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Doppelte Hemmung von CYP1A2 und CYP2D6
Die gleichzeitige Verabreichung von zweimal täglich 40 mg CYMBALTA mit 100 mg Fluvoxamin, einem potenten CYP1A2-Hemmer, an CYP2D6-Low-Metabolizer-Patienten (n = 14) führte zu einem 6-fachen Anstieg der AUC und Cmax von Duloxetin.
Medikamente, die die Hämostase beeinträchtigen (z. B. NSAIDs, Aspirin und Warfarin)
Die Serotoninfreisetzung durch Blutplättchen spielt eine wichtige Rolle bei der Hämostase. Epidemiologische Studien des Fall-Kontroll- und Kohorten-Designs, die einen Zusammenhang zwischen der Einnahme von Psychopharmaka, die die Serotonin-Wiederaufnahme beeinträchtigen, und dem Auftreten von Blutungen im oberen Gastrointestinaltrakt gezeigt haben, haben auch gezeigt, dass die gleichzeitige Einnahme von NSAR oder Aspirin dieses Blutungsrisiko potenzieren kann. Bei gleichzeitiger Anwendung von SSRIs oder SNRIs mit Warfarin wurde über veränderte gerinnungshemmende Wirkungen, einschließlich verstärkter Blutungen, berichtet. Die gleichzeitige Gabe von Warfarin (2-9 mg einmal täglich) unter Steady-State-Bedingungen mit CYMBALTA 60 oder 120 mg einmal täglich für bis zu 14 Tage bei gesunden Probanden (n = 15) veränderte die INR gegenüber dem Ausgangswert nicht signifikant (mittlere INR-Veränderungen lagen zwischen 0,05 bis +0,07). Die Gesamtpharmakokinetik von Warfarin (proteingebunden plus freier Wirkstoff) (AUCτ,ss, Cmax,ss oder tmax,ss) für R- und S-Warfarin wurde durch Duloxetin nicht verändert. Wegen der möglichen Wirkung von Duloxetin auf die Blutplättchen sollten Patienten, die eine Warfarin-Therapie erhalten, sorgfältig überwacht werden, wenn mit CYMBALTA begonnen oder die Behandlung beendet wird [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Lorazepam
Unter Steady-State-Bedingungen für CYMBALTA (60 mg alle 12 Stunden) und Lorazepam (2 mg alle 12 Stunden) wurde die Pharmakokinetik von Duloxetin durch die gleichzeitige Verabreichung nicht beeinflusst.
Temazepam
Unter Steady-State-Bedingungen für CYMBALTA (20 mg qh) und Temazepam (30 mg qh) wurde die Pharmakokinetik von Duloxetin durch die gleichzeitige Verabreichung nicht beeinflusst.
Medikamente, die die Magensäure beeinflussen
CYMBALTA hat eine magensaftresistente Beschichtung, die der Auflösung widersteht, bis ein Segment des Gastrointestinaltrakts erreicht wird, in dem der pH-Wert 5,5 übersteigt. Unter extrem sauren Bedingungen kann CYMBALTA 20 mg, das nicht durch die magensaftresistente Beschichtung geschützt ist, hydrolysiert werden, um Naphthol zu bilden. Vorsicht ist geboten bei der Anwendung von CYMBALTA 30 mg bei Patienten mit Erkrankungen, die die Magenentleerung verlangsamen können (z. B. einige Diabetiker). Arzneimittel, die den gastrointestinalen pH-Wert erhöhen, können zu einer früheren Freisetzung von Duloxetin führen. Die gleichzeitige Gabe von 60 mg CYMBALTA mit aluminium- und magnesiumhaltigen Antazida (51 mEq) oder CYMBALTA mit Famotidin hatte jedoch keine signifikante Wirkung auf die Geschwindigkeit oder das Ausmaß der Duloxetin-Resorption nach oraler Gabe von 40 mg
Medikamente, die von CYP1A2 metabolisiert werden
In-vitro-Interaktionsstudien zeigen, dass Duloxetin keine CYP1A2-Aktivität induziert. Daher ist eine Erhöhung des Metabolismus von CYP1A2-Substraten (z. B. Theophyllin, Koffein) infolge der Induktion nicht zu erwarten, obwohl keine klinischen Studien zur Induktion durchgeführt wurden. In In-vitro-Studien ist Duloxetin ein Inhibitor der CYP1A2-Isoform, und in zwei klinischen Studien betrug der durchschnittliche (90 % Konfidenzintervall) Anstieg der AUC von Theophyllin 7 % (1 % – 15 %) und 20 % (13 % – 27 %). bei gleichzeitiger Anwendung mit CYMBALTA (60 mg zweimal täglich).
Medikamente, die von CYP2D6 metabolisiert werden
Duloxetin ist ein mäßiger Inhibitor von CYP2D6. Wenn CYMBALTA (in einer Dosis von 60 mg zweimal täglich) in Verbindung mit einer Einzeldosis von 50 mg Desipramin, einem CYP2D6-Substrat, verabreicht wurde, erhöhte sich die AUC von Desipramin um das 3-Fache [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Medikamente, die von CYP2C9 metabolisiert werden
Ergebnisse von In-vitro-Studien zeigen, dass Duloxetin die Aktivität nicht hemmt. In einer klinischen Studie wurde die Pharmakokinetik von S-Warfarin, einem CYP2C9-Substrat, durch Duloxetin nicht signifikant beeinflusst [siehe Medikamente, die die Hämostase beeinträchtigen (z. B. NSAIDs, Aspirin und Warfarin) ].
Medikamente, die durch CYP3A metabolisiert werden
Ergebnisse von In-vitro-Studien zeigen, dass Duloxetin die CYP3A-Aktivität weder hemmt noch induziert. Daher ist eine Erhöhung oder Verringerung des Metabolismus von CYP3A-Substraten (z. B. orale Kontrazeptiva und andere Steroide) aufgrund einer Induktion oder Hemmung nicht zu erwarten, obwohl keine klinischen Studien durchgeführt wurden.
Medikamente, die von CYP2C19 metabolisiert werden
Ergebnisse von In-vitro-Studien zeigen, dass Duloxetin die CYP2C19-Aktivität in therapeutischen Konzentrationen nicht hemmt. Eine Hemmung des Metabolismus von CYP2C19-Substraten ist daher nicht zu erwarten, obwohl keine klinischen Studien durchgeführt wurden.
Monoaminoxidase-Hemmer (MAO-Hemmer)
[Sehen DOSIERUNG UND ANWENDUNG , KONTRAINDIKATIONEN , und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Serotonerge Medikamente
[Sehen DOSIERUNG UND ANWENDUNG , KONTRAINDIKATIONEN , und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Alkohol
Wenn CYMBALTA 40 mg und Ethanol im Abstand von mehreren Stunden verabreicht wurden, so dass die Spitzenkonzentrationen von beiden zusammenfielen, verstärkte CYMBALTA die durch Alkohol verursachte Beeinträchtigung der geistigen und motorischen Fähigkeiten nicht.
In der Datenbank für klinische Studien mit CYMBALTA hatten drei mit CYMBALTA behandelte Patienten eine Leberschädigung, die sich durch Erhöhungen von ALT und Gesamtbilirubin manifestierte, mit Anzeichen einer Obstruktion. In jedem dieser Fälle lag ein erheblicher interkurrenter Ethanolkonsum vor, der möglicherweise zu den beobachteten Anomalien beigetragen hat [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
ZNS-Medikamente
[Sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Arzneimittel, die stark an Plasmaproteine gebunden sind
Da Duloxetin stark an Plasmaproteine gebunden wird, kann die Verabreichung von CYMBALTA 30 mg an einen Patienten, der ein anderes Arzneimittel mit hoher Proteinbindung einnimmt, zu erhöhten freien Konzentrationen des anderen Arzneimittels führen, was möglicherweise zu Nebenwirkungen führen kann. Die gleichzeitige Verabreichung von CYMBALTA (60 oder 120 mg) mit Warfarin (2-9 mg), einem stark proteingebundenen Arzneimittel, führte jedoch nicht zu signifikanten Veränderungen der INR und der Pharmakokinetik von Gesamt-S- oder Gesamt-R-. Warfarin (proteingebundenes plus freies Medikament) [vgl Medikamente, die die Hämostase beeinträchtigen (z. B. NSAIDs, Aspirin und Warfarin) ].
Drogenmissbrauch und -abhängigkeit
Missbrauch
In Tierversuchen zeigte Duloxetin kein Barbiturat-ähnliches (Beruhigungsmittel) Missbrauchspotenzial.
Während CYMBALTA beim Menschen nicht systematisch auf sein Missbrauchspotenzial untersucht wurde, gab es in den klinischen Studien keinen Hinweis auf Drogensuchtverhalten. Es ist jedoch nicht möglich, auf der Grundlage von Erfahrungen vor der Markteinführung vorherzusagen, inwieweit ein ZNS-aktives Arzneimittel nach seiner Markteinführung missbraucht, abgezweigt und/oder missbraucht wird. Folglich sollten Ärzte Patienten sorgfältig auf Drogenmissbrauch in der Vorgeschichte untersuchen und solche Patienten engmaschig überwachen und sie auf Anzeichen von Missbrauch oder Missbrauch von CYMBALTA (z. B. Entwicklung einer Toleranz, Erhöhung der Dosis, Suchtverhalten) beobachten.
Abhängigkeit
In Drogenabhängigkeitsstudien zeigte Duloxetin bei Ratten kein abhängigkeitserzeugendes Potenzial.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Selbstmordgedanken und -verhalten bei Kindern, Jugendlichen und jungen Erwachsenen
Bei Patienten mit schwerer depressiver Störung (MDD), sowohl bei Erwachsenen als auch bei Kindern, kann es zu einer Verschlechterung ihrer Depression und/oder zum Auftreten von Suizidgedanken und -verhalten (Suizidalität) oder zu ungewöhnlichen Verhaltensänderungen kommen, unabhängig davon, ob sie Antidepressiva einnehmen oder nicht Das Risiko kann bestehen bleiben, bis eine signifikante Remission eintritt. Selbstmord ist ein bekanntes Risiko für Depressionen und bestimmte andere psychiatrische Störungen, und diese Störungen selbst sind die stärksten Prädiktoren für Selbstmord. Es besteht jedoch seit langem die Sorge, dass Antidepressiva bei bestimmten Patienten in den frühen Phasen der Behandlung eine Rolle bei der Induktion einer Verschlechterung der Depression und dem Auftreten von Suizidalität spielen könnten.
Gepoolte Analysen von Placebo-kontrollierten Kurzzeitstudien mit Antidepressiva (SSRIs und andere) zeigten, dass diese Medikamente das Risiko von suizidalem Denken und Verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen (Alter 1824) mit Major Depression erhöhen ( MDD) und andere psychiatrische Erkrankungen. Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; bei Erwachsenen ab 65 Jahren kam es unter Antidepressiva im Vergleich zu Placebo zu einer Reduktion.
Die gepoolten Analysen placebokontrollierter Studien bei Kindern und Jugendlichen mit MDD, Zwangsstörungen (OCD) oder anderen psychiatrischen Erkrankungen umfassten insgesamt 24 Kurzzeitstudien mit 9 Antidepressiva bei über 4400 Patienten. Die gepoolten Analysen placebokontrollierter Studien bei Erwachsenen mit MDD oder anderen psychiatrischen Erkrankungen umfassten insgesamt 295 Kurzzeitstudien (mediane Dauer von 2 Monaten) mit 11 Antidepressiva bei über 77.000 Patienten. Es gab beträchtliche Schwankungen des Suizidalitätsrisikos zwischen den Medikamenten, aber bei fast allen untersuchten Medikamenten eine Tendenz zu einem Anstieg bei den jüngeren Patienten. Es gab Unterschiede im absoluten Suizidalitätsrisiko zwischen den verschiedenen Indikationen, mit der höchsten Inzidenz bei MDD. Das Risiko von Unterschieden (Arzneimittel vs. Placebo) war jedoch innerhalb der Altersschichten und über Indikationen hinweg relativ stabil. Diese Risikounterschiede (Arzneimittel-Placebo-Unterschied in der Anzahl der Fälle von Suizidalität pro 1000 behandelten Patienten) sind in Tabelle 1 aufgeführt.
In keiner der pädiatrischen CYMBALTA-Studien traten Suizide auf. In den Studien mit CYMBALTA 20 mg bei Erwachsenen gab es Suizide, aber die Zahl reichte nicht aus, um zu einer Schlussfolgerung über die Wirkung von CYMBALTA auf Suizide zu gelangen.
Es ist nicht bekannt, ob sich das Suizidrisiko auf eine längerfristige Anwendung erstreckt, dh über mehrere Monate hinaus. Es gibt jedoch erhebliche Hinweise aus placebokontrollierten Erhaltungsstudien bei Erwachsenen mit Depressionen, dass die Anwendung von Antidepressiva das Wiederauftreten von Depressionen verzögern kann.
Alle Patienten, die mit Antidepressiva aus beliebigen Indikationen behandelt werden, sollten angemessen überwacht und engmaschig auf eine klinische Verschlechterung, Suizidalität und ungewöhnliche Verhaltensänderungen beobachtet werden, insbesondere während der ersten Monate einer medikamentösen Therapie oder bei Dosisänderungen oder -steigerungen oder abnimmt.
Die folgenden Symptome, Angst, Agitiertheit, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Ruhelosigkeit), Hypomanie und Manie, wurden bei erwachsenen und pädiatrischen Patienten berichtet, die ebenfalls mit Antidepressiva wegen schwerer depressiver Störung behandelt wurden wie für andere Indikationen, sowohl psychiatrische als auch nichtpsychiatrische. Obwohl ein kausaler Zusammenhang zwischen dem Auftreten solcher Symptome und entweder der Verschlechterung einer Depression und/oder dem Auftreten suizidaler Impulse nicht hergestellt werden konnte, besteht die Sorge, dass solche Symptome Vorboten einer aufkommenden Suizidalität sein könnten.
Bei Patienten, deren Depression sich anhaltend verschlimmert oder die an Suizidalität oder Symptomen leiden, die Vorboten einer Verschlechterung der Depression oder Suizidalität sein könnten, sollte eine Änderung des therapeutischen Schemas, einschließlich eines möglichen Absetzens der Medikation, in Betracht gezogen werden, insbesondere wenn diese Symptome schwerwiegend und abrupt sind zu Beginn oder waren nicht Teil der Symptome des Patienten.
Wenn die Entscheidung getroffen wurde, die Behandlung abzubrechen, sollte die Medikation so schnell wie möglich ausgeschlichen werden, jedoch unter Berücksichtigung, dass das Absetzen mit bestimmten Symptomen verbunden sein kann [siehe DOSIERUNG UND ANWENDUNG und Abbruchsyndrom ] für Beschreibungen der Risiken beim Absetzen von CYMBALTA.
Familien und Betreuer von Patienten, die wegen einer schweren depressiven Störung oder anderen Indikationen, sowohl psychiatrischen als auch nichtpsychiatrischen, mit Antidepressiva behandelt werden, sollten auf die Notwendigkeit aufmerksam gemacht werden, Patienten auf das Auftreten von Unruhe, Reizbarkeit, ungewöhnlichen Verhaltensänderungen und den anderen oben beschriebenen Symptomen zu überwachen , sowie das Auftreten von Suizidalität, und solche Symptome unverzüglich dem Gesundheitsdienstleister zu melden. Eine solche Überwachung sollte die tägliche Beobachtung durch Familien und Betreuer umfassen. Rezepte für CYMBALTA sollten für die kleinste Menge an Kapseln im Einklang mit einem guten Patientenmanagement ausgestellt werden, um das Risiko einer Überdosierung zu verringern.
Screening von Patienten auf bipolare Störungen
Eine schwere depressive Episode kann die anfängliche Präsentation einer bipolaren Störung sein. Es wird allgemein angenommen (obwohl dies nicht in kontrollierten Studien nachgewiesen wurde), dass die Behandlung einer solchen Episode mit einem Antidepressivum allein die Wahrscheinlichkeit des Auftretens einer gemischten/manischen Episode bei Patienten mit einem Risiko für eine bipolare Störung erhöhen kann. Ob eines der oben beschriebenen Symptome eine solche Konversion darstellt, ist unbekannt. Vor Beginn der Behandlung mit einem Antidepressivum sollten Patienten mit depressiven Symptomen jedoch angemessen untersucht werden, um festzustellen, ob bei ihnen ein Risiko für eine bipolare Störung besteht; Ein solches Screening sollte eine detaillierte psychiatrische Vorgeschichte umfassen, einschließlich einer Familienanamnese von Selbstmord, bipolarer Störung und Depression. Es ist zu beachten, dass CYMBALTA nicht zur Behandlung von bipolarer Depression zugelassen ist.
Hepatotoxizität
Es gab Berichte über Leberversagen, manchmal mit tödlichem Ausgang, bei Patienten, die mit CYMBALTA behandelt wurden. Diese Fälle zeigten sich als Hepatitis mit Bauchschmerzen, Hepatomegalie und Erhöhung der Transaminasenwerte auf mehr als das Zwanzigfache der oberen Normgrenze (ULN) mit oder ohne Gelbsucht, was ein gemischtes oder hepatozelluläres Muster einer Leberschädigung widerspiegelt. CYMBALTA 30 mg sollte bei Patienten, die Gelbsucht oder andere Anzeichen einer klinisch signifikanten Leberfunktionsstörung entwickeln, abgesetzt und nicht wieder aufgenommen werden, es sei denn, eine andere Ursache kann festgestellt werden.
Fälle von cholestatischem Ikterus mit minimaler Erhöhung der Transaminasespiegel wurden ebenfalls berichtet. Andere Postmarketing-Berichte weisen darauf hin, dass bei Patienten mit chronischer Lebererkrankung oder Zirrhose erhöhte Transaminasen, Bilirubin und alkalische Phosphatase aufgetreten sind.
CYMBALTA erhöhte das Risiko einer Erhöhung der Serum-Transaminase-Spiegel in klinischen Studien des Entwicklungsprogramms. Erhöhte Lebertransaminasen führten bei 0,3 % (92/34.756) der mit CYMBALTA behandelten Patienten zum Abbruch. Bei den meisten Patienten betrug die mediane Zeit bis zum Nachweis der Transaminaseerhöhung etwa zwei Monate. In Placebo-kontrollierten Studien mit Erwachsenen trat bei Patienten mit normalen und anormalen ALT-Werten zu Studienbeginn bei 1,25 % (144/11.496) der mit CYMBALTA behandelten Patienten eine Erhöhung der ALT auf das >3-fache des ULN auf, verglichen mit 0,45 % (39/8716) der Placebo-Patienten -behandelte Patienten. In Placebo-kontrollierten Studien mit Erwachsenen, die ein Design mit fester Dosierung verwendeten, gab es Hinweise auf eine CYMBALTA-Dosis-Wirkungs-Beziehung für eine ALT- und AST-Erhöhung von > dem 3-Fachen des ULN bzw. > dem 5-Fachen des ULN.
Da es möglich ist, dass CYMBALTA und Alkohol in Wechselwirkung treten und eine Leberschädigung verursachen oder dass CYMBALTA 20 mg eine vorbestehende Lebererkrankung verschlimmern kann, sollte CYMBALTA Patienten mit erheblichem Alkoholkonsum oder Anzeichen einer chronischen Lebererkrankung nicht verschrieben werden.
Orthostatische Hypotonie, Stürze und Synkopen
Orthostatische Hypotonie, Stürze und Synkopen wurden bei Patienten berichtet, die mit den empfohlenen Dosierungen von CYMBALTA behandelt wurden. Synkopen und orthostatische Hypotonie treten in der Regel innerhalb der ersten Therapiewoche auf, können aber jederzeit während der Behandlung mit CYMBALTA auftreten, insbesondere nach Dosiserhöhungen. Das Sturzrisiko scheint mit dem Grad der orthostatischen Blutdrucksenkung (BP) sowie mit anderen Faktoren zusammenzuhängen, die das zugrunde liegende Sturzrisiko erhöhen können.
In einer Analyse von Patienten aus allen placebokontrollierten Studien berichteten Patienten, die mit CYMBALTA 20 mg behandelt wurden, eine höhere Sturzrate im Vergleich zu Patienten, die mit Placebo behandelt wurden. Das Risiko scheint mit dem Vorhandensein einer orthostatischen Blutdrucksenkung zusammenzuhängen. Das Risiko einer Blutdrucksenkung kann bei Patienten größer sein, die gleichzeitig Medikamente einnehmen, die eine orthostatische Hypotonie induzieren (z. B. Antihypertensiva) oder starke CYP1A2-Hemmer sind [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Klinisch wichtige Arzneimittelwechselwirkungen ] und bei Patienten, die CYMBALTA 20 mg in Dosen über 60 mg täglich einnehmen. Bei Patienten, bei denen während der Therapie mit CYMBALTA 40 mg CYMBALTA eine symptomatische orthostatische Hypotonie, Stürze und/oder Synkopen auftreten, sollte eine Dosisreduktion oder das Absetzen von CYMBALTA in Erwägung gezogen werden.
Das Sturzrisiko schien auch proportional zum zugrunde liegenden Sturzrisiko eines Patienten zu sein und schien mit dem Alter stetig zuzunehmen. Da geriatrische Patienten aufgrund einer höheren Prävalenz von Risikofaktoren wie der Einnahme mehrerer Medikamente, medizinischen Komorbiditäten und Gangstörungen tendenziell ein höheres Grundrisiko für Stürze haben, ist der Einfluss des zunehmenden Alters an sich unklar. Bei der Anwendung von CYMBALTA 30 mg wurde über Stürze mit schwerwiegenden Folgen einschließlich Frakturen und Krankenhauseinweisungen berichtet [siehe NEBENWIRKUNGEN ].
Serotonin-Syndrom
Die Entwicklung eines potenziell lebensbedrohlichen Serotoninsyndroms wurde mit SNRIs und SSRIs, einschließlich CYMBALTA 60 mg, allein, aber insbesondere bei gleichzeitiger Anwendung mit anderen serotonergen Arzneimitteln (einschließlich Triptanen, trizyklischen Antidepressiva, Fentanyl, Lithium, Tramadol, Tryptophan, Buspiron, Amphetaminen) berichtet und Johanniskraut) und mit Arzneimitteln, die den Serotoninstoffwechsel beeinträchtigen (insbesondere MAO-Hemmer, sowohl solche, die zur Behandlung psychiatrischer Störungen bestimmt sind, als auch andere, wie Linezolid und intravenöses Methylenblau).
Zu den Symptomen des Serotonin-Syndroms können Veränderungen des mentalen Status (z. B. Unruhe, Halluzinationen, Delirium und Koma), autonome Instabilität (z. B. Tachykardie, labiler Blutdruck, Schwindel, Diaphorese, Hitzewallungen, Hyperthermie), neuromuskuläre Symptome (z. B. Tremor, Steifheit, Myoklonus, Hyperreflexie, Koordinationsstörungen), Krampfanfälle und/oder gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Durchfall). Die Patienten sollten auf das Auftreten eines Serotonin-Syndroms überwacht werden.
Die gleichzeitige Anwendung von CYMBALTA 30 mg mit MAOI-Antidepressiva ist kontraindiziert. CYMBALTA 60 mg sollte auch nicht bei einem Patienten begonnen werden, der mit MAO-Hemmern wie Linezolid oder intravenösem Methylenblau behandelt wird. Alle Berichte mit Methylenblau, die Informationen zum Verabreichungsweg enthielten, betrafen die intravenöse Verabreichung im Dosisbereich von 1 mg/kg bis 8 mg/kg. Es gab keine Berichte über die Verabreichung von Methylenblau auf anderem Wege (wie z. B. Tabletten zum Einnehmen oder lokale Gewebeinjektion) oder in niedrigeren Dosen. Es kann Umstände geben, unter denen es notwendig ist, bei einem Patienten, der CYMBALTA einnimmt, eine Behandlung mit einem MAO-Hemmer wie Linezolid oder intravenösem Methylenblau einzuleiten. CYMBALTA sollte abgesetzt werden, bevor eine Behandlung mit dem MAO-Hemmer begonnen wird [siehe DOSIERUNG UND ANWENDUNG und KONTRAINDIKATIONEN ].
Wenn die gleichzeitige Anwendung von CYMBALTA 20 mg mit anderen serotonergen Arzneimitteln einschließlich Triptanen, trizyklischen Antidepressiva, Fentanyl, Lithium, Tramadol, Buspiron, Tryptophan, Amphetaminen und Johanniskraut klinisch gerechtfertigt ist, sollten die Patienten auf ein potenziell erhöhtes Risiko für ein Serotonin-Syndrom aufmerksam gemacht werden , insbesondere zu Beginn der Behandlung und bei Dosiserhöhungen. Die Behandlung mit CYMBALTA 60 mg und allen begleitenden serotonergen Arzneimitteln sollte sofort abgebrochen werden, wenn die oben genannten Ereignisse auftreten, und eine unterstützende symptomatische Behandlung eingeleitet werden.
Erhöhtes Blutungsrisiko
Arzneimittel, die die Serotonin-Wiederaufnahmehemmung beeinflussen, einschließlich CYMBALTA, können das Risiko von Blutungsereignissen erhöhen. Fallberichte und epidemiologische Studien (Fall-Kontroll- und Kohortendesign) haben einen Zusammenhang zwischen der Einnahme von Arzneimitteln, die die Serotonin-Wiederaufnahme beeinträchtigen, und dem Auftreten von gastrointestinalen Blutungen gezeigt. Eine Post-Marketing-Studie zeigte eine höhere Inzidenz postpartaler Blutungen bei Müttern, die CYMBALTA einnahmen. Andere Blutungsereignisse im Zusammenhang mit der Anwendung von SSRI und SNRI reichten von Ekchymosen, Hämatomen, Epistaxis und Petechien bis hin zu lebensbedrohlichen Blutungen. Die gleichzeitige Anwendung von Aspirin, nichtsteroidalen Antirheumatika (NSAIDs), Warfarin und anderen Antikoagulanzien kann dieses Risiko erhöhen.
Informieren Sie die Patienten über das Blutungsrisiko im Zusammenhang mit der gleichzeitigen Anwendung von CYMBALTA und NSAIDs, Aspirin oder anderen Arzneimitteln, die die Blutgerinnung beeinflussen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Schwere Hautreaktionen
Schwere Hautreaktionen, einschließlich Erythema multiforme und Stevens-Johnson-Syndrom (SJS), können unter CYMBALTA auftreten. Die Melderate von SJS im Zusammenhang mit der Anwendung von CYMBALTA übersteigt die Hintergrundinzidenzrate für diese schwerwiegende Hautreaktion in der Allgemeinbevölkerung (1 bis 2 Fälle pro Million Personenjahre). Es wird allgemein angenommen, dass die Melderate aufgrund von Underreporting zu niedrig angesetzt ist.
CYMBALTA sollte beim ersten Auftreten von Blasen, schuppendem Hautausschlag, Schleimhauterosionen oder anderen Anzeichen einer Überempfindlichkeit abgesetzt werden, wenn keine andere Ätiologie festgestellt werden kann.
Abbruchsyndrom
Absetzsymptome wurden bei Patienten, die CYMBALTA einnahmen, systematisch untersucht. Nach abruptem oder ausschleichendem Absetzen in placebokontrollierten klinischen Studien mit Erwachsenen traten die folgenden Symptome bei 1 % oder mehr und mit einer signifikant höheren Häufigkeit bei mit CYMBALTA behandelten Patienten im Vergleich zu Patienten auf, die Placebo absetzten: Schwindel, Kopfschmerzen, Übelkeit, Durchfall, Parästhesien, Reizbarkeit, Erbrechen, Schlaflosigkeit, Angst, Hyperhidrose und Müdigkeit.
Während der Vermarktung anderer SSRIs und SNRIs (Serotonin- und Noradrenalin-Wiederaufnahmehemmer) gab es spontane Berichte über Nebenwirkungen, die nach Absetzen dieser Arzneimittel auftraten, insbesondere bei abruptem Absetzen, einschließlich der folgenden: dysphorische Stimmung, Reizbarkeit, Agitiertheit, Schwindel, Sensibilitätsstörungen ( B. Parästhesien wie Elektroschocks), Angstzustände, Verwirrtheit, Kopfschmerzen, Lethargie, emotionale Labilität, Schlaflosigkeit, Hypomanie, Tinnitus und Krampfanfälle. Obwohl diese Ereignisse im Allgemeinen selbstlimitierend sind, wurde von einigen berichtet, dass sie schwerwiegend sind.
Patienten sollten auf diese Symptome hin überwacht werden, wenn sie die Behandlung mit CYMBALTA abbrechen. Wann immer möglich, wird eine allmähliche Reduzierung der Dosis anstelle eines abrupten Absetzens empfohlen. Wenn nach einer Verringerung der Dosis oder beim Absetzen der Behandlung unerträgliche Symptome auftreten, kann eine Wiederaufnahme der zuvor verschriebenen Dosis in Betracht gezogen werden. Anschließend kann der Gesundheitsdienstleister die Dosis weiter verringern, jedoch in einem langsameren Tempo [siehe DOSIERUNG UND ANWENDUNG ].
Aktivierung von Manie/Hypomanie
In Placebo-kontrollierten Studien mit Erwachsenen bei Patienten mit MDD wurde bei 0,1 % (4/3779) der mit CYMBALTA behandelten Patienten und 0,04 % (1/2536) der mit Placebo behandelten Patienten die Aktivierung einer Manie oder Hypomanie berichtet. In Placebo-kontrollierten Studien zu DPNP, GAD, Fibromyalgie oder chronischen muskuloskelettalen Schmerzen wurde keine Aktivierung von Manie oder Hypomanie berichtet. Die Aktivierung einer Manie oder Hypomanie wurde bei einem kleinen Teil der Patienten mit affektiven Störungen berichtet, die mit anderen vermarkteten Arzneimitteln behandelt wurden, die bei der Behandlung einer Major Depression wirksam sind. Wie diese anderen Wirkstoffe sollte CYMBALTA 60 mg bei Patienten mit manischer Vorgeschichte mit Vorsicht angewendet werden.
Engwinkelglaukom
Die Pupillenerweiterung, die nach der Anwendung vieler Antidepressiva, einschließlich CYMBALTA, auftritt, kann bei einem Patienten mit anatomisch engen Winkeln, der keine offene Iridektomie hat, eine Engwinkelattacke auslösen.
Krampfanfälle
CYMBALTA wurde bei Patienten mit Anfallsleiden nicht systematisch untersucht, und solche Patienten wurden von klinischen Studien ausgeschlossen. In placebokontrollierten klinischen Studien mit Erwachsenen traten Krampfanfälle/Krämpfe bei 0,02 % (3/12.722) der mit CYMBALTA 60 mg behandelten Patienten und bei 0,01 % (1/9513) der mit Placebo behandelten Patienten auf. CYMBALTA sollte bei Patienten mit Anfallsleiden in der Anamnese mit Vorsicht verschrieben werden.
Erhöhungen des Blutdrucks
In placebokontrollierten klinischen Studien mit Erwachsenen in den zugelassenen erwachsenen Populationen vom Ausgangswert bis zum Endpunkt war die Behandlung mit CYMBALTA mit einem mittleren Anstieg des systolischen Blutdrucks um 0,5 mm Hg und des diastolischen Blutdrucks um 0,8 mm Hg im Vergleich zu einem mittleren Abfall des systolischen Blutdrucks um 0,6 mm Hg verbunden 0,3 mm Hg diastolisch bei mit Placebo behandelten Patienten. Es gab keinen signifikanten Unterschied in der Häufigkeit von anhaltendem (3 aufeinanderfolgenden Besuchen) erhöhtem Blutdruck. In einer klinisch-pharmakologischen Studie zur Untersuchung der Wirkungen von CYMBALTA 60 mg auf verschiedene Parameter, einschließlich des Blutdrucks bei supratherapeutischen Dosen mit beschleunigter Dosistitration, gab es Hinweise auf einen Anstieg des Blutdrucks im Liegen bei Dosen von bis zu 200 mg zweimal täglich (ca die maximal empfohlene Dosierung). Bei der höchsten Dosis von 200 mg zweimal täglich betrug der Anstieg der mittleren Pulsfrequenz 5,0 bis 6,8 Schläge und der Anstieg des mittleren Blutdrucks 4,7 bis 6,8 mm Hg (systolisch) und 4,5 bis 7 mm Hg (diastolisch) bis zu 12 Stunden nach der Einnahme .
Der Blutdruck sollte vor Beginn der Behandlung und während der gesamten Behandlung regelmäßig gemessen werden [siehe NEBENWIRKUNGEN ].
Klinisch wichtige Arzneimittelwechselwirkungen
Sowohl CYP1A2 als auch CYP2D6 sind für den Metabolismus von CYMBALTA verantwortlich.
Mögliche Beeinflussung von CYMBALTA durch andere Arzneimittel
CYP1A2-Inhibitoren
Die gleichzeitige Anwendung von CYMBALTA 40 mg mit starken CYP1A2-Inhibitoren sollte vermieden werden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
CYP2D6-Inhibitoren
Da CYP2D6 am Metabolismus von CYMBALTA beteiligt ist, ist zu erwarten, dass die gleichzeitige Anwendung von CYMBALTA mit starken Inhibitoren von CYP2D6 zu höheren Konzentrationen (durchschnittlich 60 %) von CYMBALTA führt [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Mögliche Auswirkungen von CYMBALTA 30 mg auf andere Arzneimittel
Medikamente, die von CYP2D6 metabolisiert werden
Gleichzeitige Anwendung von CYMBALTA 20 mg mit Arzneimitteln, die extensiv durch CYP2D6 metabolisiert werden und eine geringe therapeutische Breite haben, einschließlich bestimmter Antidepressiva (trizyklische Antidepressiva [TCAs] wie Nortriptylin, Amitriptylin und Imipramin), Phenothiazine und Typ-1C-Antiarrhythmika (z. Propafenon, Flecainid) sollte mit Vorsicht angegangen werden. Bei gleichzeitiger Gabe von TCA und CYMBALTA müssen die Plasma-TCA-Konzentrationen möglicherweise überwacht und die TCA-Dosis reduziert werden. Aufgrund des Risikos schwerwiegender ventrikulärer Arrhythmien und plötzlichen Todes, die möglicherweise mit erhöhten Plasmaspiegeln von Thioridazin einhergehen, sollten CYMBALTA 30 mg und Thioridazin nicht gleichzeitig verabreicht werden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Andere klinisch wichtige Arzneimittelwechselwirkungen
Alkohol
Die gleichzeitige Anwendung von CYMBALTA 40 mg und starkem Alkoholkonsum kann mit schweren Leberschäden einhergehen. Aus diesem Grund sollte CYMBALTA 60 mg Patienten mit erheblichem Alkoholkonsum nicht verschrieben werden [siehe Hepatotoxizität und Wechselwirkungen mit Arzneimitteln ].
Auf das ZNS wirkende Arzneimittel
Angesichts der primären ZNS-Wirkungen von CYMBALTA sollte es mit Vorsicht angewendet werden, wenn es in Kombination mit oder als Ersatz für andere zentral wirkende Arzneimittel eingenommen wird, einschließlich solcher mit einem ähnlichen Wirkmechanismus [siehe Klinisch wichtige Arzneimittelwechselwirkungen und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Hyponatriämie
Hyponatriämie kann als Folge einer Behandlung mit SSRIs und SNRIs, einschließlich CYMBALTA, auftreten. In vielen Fällen scheint diese Hyponatriämie das Ergebnis des Syndroms der inadäquaten Sekretion des antidiuretischen Hormons (SIADH) zu sein. Fälle mit Serum-Natriumwerten unter 110 mmol/l wurden bei der Anwendung von CYMBALTA 40 mg berichtet und schienen reversibel zu sein, wenn CYMBALTA abgesetzt wurde. Geriatrische Patienten können unter SSRIs und SNRIs einem höheren Risiko ausgesetzt sein, eine Hyponatriämie zu entwickeln. Auch Patienten, die Diuretika einnehmen oder anderweitig an Volumenmangel leiden, können einem größeren Risiko ausgesetzt sein [siehe Verwendung in bestimmten Bevölkerungsgruppen ]. Bei Patienten mit symptomatischer Hyponatriämie sollte ein Absetzen von CYMBALTA in Betracht gezogen und eine angemessene medizinische Intervention eingeleitet werden.
Anzeichen und Symptome einer Hyponatriämie sind Kopfschmerzen, Konzentrationsschwierigkeiten, Gedächtnisstörungen, Verwirrtheit, Schwäche und Unsicherheit, die zu Stürzen führen können. Schwerere und/oder akute Fälle wurden mit Halluzinationen, Synkopen, Krampfanfällen, Koma, Atemstillstand und Tod in Verbindung gebracht.
Anwendung bei Patienten mit Begleiterkrankungen
Die klinische Erfahrung mit CYMBALTA bei Patienten mit begleitenden systemischen Erkrankungen ist begrenzt. Es liegen keine Informationen über die Auswirkungen vor, die Veränderungen der Magenmotilität auf die Stabilität des magensaftresistenten Überzugs von CYMBALTA haben könnten. Unter extrem sauren Bedingungen kann CYMBALTA, das nicht durch die magensaftresistente Beschichtung geschützt ist, hydrolysiert werden, um Naphthol zu bilden. Vorsicht ist geboten bei der Anwendung von CYMBALTA bei Patienten mit Erkrankungen, die die Magenentleerung verlangsamen können (z. B. einige Diabetiker).
CYMBALTA 30 mg wurde bei Patienten mit kürzlich aufgetretenem Myokardinfarkt oder instabiler koronarer Herzkrankheit nicht systematisch untersucht. Patienten mit diesen Diagnosen wurden während der Premarketing-Tests des Produkts im Allgemeinen von klinischen Studien ausgeschlossen.
Leberfunktionsstörung
Vermeiden Sie die Anwendung bei Patienten mit chronischer Lebererkrankung oder Zirrhose [siehe DOSIERUNG UND ANWENDUNG , Hepatotoxizität , und Verwendung in bestimmten Bevölkerungsgruppen ].
Schwere Nierenfunktionsstörung
Vermeiden Sie die Anwendung bei Patienten mit schwerer Nierenfunktionsstörung, GFR DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ].
Glykämische Kontrolle bei Patienten mit Diabetes
Wie in DPNP-Studien beobachtet, verschlechterte die Behandlung mit CYMBALTA 30 mg die glykämische Kontrolle bei einigen Patienten mit Diabetes. In drei klinischen Studien mit CYMBALTA zur Behandlung von neuropathischen Schmerzen im Zusammenhang mit diabetischer peripherer Neuropathie [vgl Klinische Studien betrug die mittlere Dauer des Diabetes etwa 12 Jahre, der mittlere Nüchtern-Blutzuckerwert zu Studienbeginn 176 mg/dl und der mittlere Hämoglobin-A1c (HbA1c)-Wert zu Studienbeginn 7,8 %. In der 12-wöchigen akuten Behandlungsphase dieser Studien war CYMBALTA im Vergleich zu Placebo mit einem geringen Anstieg des mittleren Nüchternblutzuckers verbunden. In der Verlängerungsphase dieser Studien, die bis zu 52 Wochen dauerte, stieg der mittlere Nüchtern-Blutzucker in der CYMBALTA-40-mg-Gruppe um 12 mg/dl und sank in der Routinebehandlungsgruppe um 11,5 mg/dl. HbA1c stieg um 0,5 % in der Gruppe mit CYMBALTA 40 mg und um 0,2 % in der Gruppe mit routinemäßiger Behandlung.
Zögern beim Wasserlassen und Retention
CYMBALTA 60 mg gehört zu einer Klasse von Arzneimitteln, von denen bekannt ist, dass sie den Harnröhrenwiderstand beeinflussen. Wenn während der Behandlung mit CYMBALTA 20 mg Symptome eines Harnverhalts auftreten, sollte die Möglichkeit in Betracht gezogen werden, dass sie mit dem Arzneimittel in Zusammenhang stehen könnten.
Nach der Markteinführung wurden Fälle von Harnverhalt beobachtet. In einigen Fällen von Harnverhalt im Zusammenhang mit der Anwendung von CYMBALTA 60 mg war eine Krankenhauseinweisung und/oder Katheterisierung erforderlich.
Sexuelle Funktionsstörung
Die Anwendung von SNRIs, einschließlich CYMBALTA 60 mg, kann Symptome einer sexuellen Dysfunktion hervorrufen [siehe NEBENWIRKUNGEN ]. Bei männlichen Patienten kann die Anwendung von SNRI zu Ejakulationsverzögerung oder -versagen, verminderter Libido und erektiler Dysfunktion führen. Bei weiblichen Patienten kann die Anwendung von SNRI zu einer verminderten Libido und einem verzögerten oder ausbleibenden Orgasmus führen.
Es ist wichtig, dass sich der verschreibende Arzt vor Beginn der Behandlung mit CYMBALTA 40 mg nach der Sexualfunktion erkundigt und sich während der Behandlung speziell nach Veränderungen der Sexualfunktion erkundigt, da die Sexualfunktion möglicherweise nicht spontan gemeldet wird. Bei der Beurteilung von Veränderungen der Sexualfunktion ist es wichtig, eine detaillierte Anamnese (einschließlich des Zeitpunkts des Auftretens der Symptome) zu erheben, da sexuelle Symptome andere Ursachen haben können, einschließlich der zugrunde liegenden psychiatrischen Störung. Besprechen Sie mögliche Behandlungsstrategien, um Patienten dabei zu unterstützen, fundierte Entscheidungen über die Behandlung zu treffen.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente ).
Selbstmordgedanken und Verhaltensweisen
Weisen Sie die Patienten, ihre Familien und ihre Betreuer an, auf das Auftreten von Suizidgedanken und -verhalten zu achten, insbesondere während der Behandlung und wenn die Dosis nach oben oder unten angepasst wird, und weisen Sie sie an, solche Symptome ihrem medizinischen Betreuer zu melden [siehe KASTENWARNUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Verwaltung
Weisen Sie die Patienten an, CYMBALTA 20 mg unzerkaut zu schlucken und die Kapsel nicht zu kauen, zu zerdrücken oder zu öffnen (den Inhalt nicht über das Essen zu streuen oder mit Flüssigkeiten zu vermischen), da dies die magensaftresistente Beschichtung beeinträchtigen könnte.
Hepatotoxizität
Informieren Sie die Patienten darüber, dass bei Patienten, die mit CYMBALTA behandelt wurden, über schwere Leberprobleme, manchmal mit tödlichem Ausgang, berichtet wurde. Weisen Sie die Patienten an, mit ihrem Arzt zu sprechen, wenn sie während der Einnahme von CYMBALTA Juckreiz, Schmerzen im rechten Oberbauch, dunklen Urin oder gelbe Haut/Augen bekommen, was Anzeichen von Leberproblemen sein können. Weisen Sie die Patienten an, mit ihrem Arzt über ihren Alkoholkonsum zu sprechen. Die Anwendung von CYMBALTA zusammen mit starkem Alkoholkonsum kann mit einer schweren Leberschädigung einhergehen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Alkohol
Obwohl CYMBALTA die durch Alkohol verursachte Beeinträchtigung der geistigen und motorischen Fähigkeiten nicht verstärkt, kann die gleichzeitige Anwendung von CYMBALTA mit starkem Alkoholkonsum mit schweren Leberschäden einhergehen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Orthostatische Hypotonie, Stürze und Synkopen
Weisen Sie die Patienten auf das Risiko von orthostatischer Hypotonie, Stürzen und Synkopen hin, insbesondere während der ersten Anwendung und der anschließenden Dosiseskalation sowie in Verbindung mit der gleichzeitigen Anwendung von Arzneimitteln, die die orthostatische Wirkung von CYMBALTA verstärken könnten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Serotonin-Syndrom
Warnen Sie Patienten vor dem Risiko eines Serotonin-Syndroms bei gleichzeitiger Anwendung von CYMBALTA 30 mg und anderen serotonergen Mitteln, einschließlich Triptanen, trizyklischen Antidepressiva, Fentanyl, Lithium, Tramadol, Buspiron, Tryptophan, Amphetaminen und Johanniskraut [siehe KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN , und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Informieren Sie die Patienten über die Anzeichen und Symptome im Zusammenhang mit dem Serotonin-Syndrom, zu denen Veränderungen des mentalen Status (z. B. Unruhe, Halluzinationen, Delirium und Koma), autonome Instabilität (z. B. Tachykardie, labiler Blutdruck, Schwindel, Schwitzen, Hitzegefühl, Hyperthermie) gehören können. neuromuskuläre Veränderungen (z. B. Tremor, Steifigkeit, Myoklonus, Hyperreflexie, Koordinationsstörungen), Krampfanfälle und/oder gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Durchfall). Weisen Sie die Patienten darauf hin, sofort einen Arzt aufzusuchen, wenn diese Symptome auftreten.
Erhöhtes Blutungsrisiko
Warnen Sie Patienten vor der gleichzeitigen Anwendung von CYMBALTA 30 mg und NSAIDs, Aspirin, Warfarin oder anderen Arzneimitteln, die die Blutgerinnung beeinflussen, da die kombinierte Anwendung von Psychopharmaka, die die Serotonin-Wiederaufnahme beeinträchtigen, mit einem erhöhten Blutungsrisiko in Verbindung gebracht wurde [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Schwere Hautreaktionen
Warnen Sie die Patienten, dass CYMBALTA schwerwiegende Hautreaktionen hervorrufen kann. Dies muss möglicherweise in einem Krankenhaus behandelt werden und kann lebensbedrohlich sein. Raten Sie den Patienten, sofort ihren Arzt anzurufen oder Notfallhilfe zu holen, wenn sie Hautblasen, Hautausschlag, wunde Stellen im Mund, Nesselsucht oder andere allergische Reaktionen haben [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Abbruch der Behandlung
Weisen Sie die Patienten darauf hin, dass das Absetzen von CYMBALTA 30 mg mit Symptomen wie Schwindel, Kopfschmerzen, Übelkeit, Durchfall, Parästhesien, Reizbarkeit, Erbrechen, Schlaflosigkeit, Angstzuständen, Hyperhidrose und Müdigkeit verbunden sein kann, und ihnen sollte geraten werden, ihr Dosierungsschema nicht zu ändern oder die Behandlung zu beenden Einnahme von CYMBALTA ohne Rücksprache mit Ihrem Arzt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Aktivierung von Manie oder Hypomanie
Patienten mit depressiven Symptomen sollten vor Beginn der Behandlung mit CYMBALTA angemessen auf das Risiko einer bipolaren Störung (z. B. Suizid in der Familienanamnese, bipolare Störung und Depression) untersucht werden. Raten Sie den Patienten, alle Anzeichen oder Symptome einer manischen Reaktion zu melden, wie z. B. stark erhöhte Energie, schwere Schlafstörungen, rasende Gedanken, rücksichtsloses Verhalten, mehr oder schnelleres Sprechen als gewöhnlich, ungewöhnlich großartige Ideen und übermäßige Freude oder Reizbarkeit [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Engwinkelglaukom
Weisen Sie die Patienten darauf hin, dass die Einnahme von CYMBALTA 40 mg eine leichte Pupillenerweiterung verursachen kann, die bei empfindlichen Personen zu einem Engwinkelglaukom führen kann. Ein vorbestehendes Glaukom ist fast immer ein Offenwinkelglaukom, da ein Engwinkelglaukom, wenn es diagnostiziert wird, definitiv mit einer Iridektomie behandelt werden kann. Das Offenwinkelglaukom ist kein Risikofaktor für das Engwinkelglaukom. Patienten möchten möglicherweise untersucht werden, um festzustellen, ob sie für einen Winkelverschluss anfällig sind, und sich einem prophylaktischen Verfahren (z. B. Iridektomie) unterziehen, wenn sie anfällig sind [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Krampfanfälle
Raten Sie den Patienten, ihren Arzt zu informieren, wenn sie in der Vorgeschichte Anfallsleiden hatten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Auswirkungen auf den Blutdruck
Patienten sollten darauf hingewiesen werden, dass CYMBALTA 60 mg einen Anstieg des Blutdrucks verursachen kann [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Begleitmedikation
Raten Sie den Patienten, ihren Arzt zu informieren, wenn sie verschreibungspflichtige oder rezeptfreie Medikamente einnehmen oder einnehmen möchten, da die Möglichkeit von Wechselwirkungen besteht [siehe DOSIERUNG UND ANWENDUNG , KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN , und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Hyponatriämie
Weisen Sie die Patienten darauf hin, dass Hyponatriämie als Folge einer Behandlung mit SNRIs und SSRIs, einschließlich CYMBALTA, berichtet wurde. Informieren Sie die Patienten über die Anzeichen und Symptome einer Hyponatriämie [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].

Begleiterkrankungen
Raten Sie den Patienten, ihren Arzt über alle ihre Erkrankungen zu informieren [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Zögern beim Wasserlassen und Retention
CYMBALTA gehört zu einer Klasse von Arzneimitteln, die das Wasserlassen beeinflussen können. Weisen Sie die Patienten an, sich an ihren Arzt zu wenden, wenn sie Probleme mit dem Urinfluss entwickeln [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Sexuelle Funktionsstörung
Weisen Sie die Patienten darauf hin, dass die Anwendung von CYMBALTA 40 mg sowohl bei männlichen als auch bei weiblichen Patienten Symptome einer sexuellen Dysfunktion hervorrufen kann. Informieren Sie die Patienten darüber, dass sie alle Veränderungen der Sexualfunktion und potenzielle Behandlungsstrategien mit ihrem Arzt besprechen sollten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schwangerschaft
Stillzeit
Raten Sie stillenden Frauen, die CYMBALTA 30 mg anwenden, Säuglinge auf Sedierung, schlechte Ernährung und schlechte Gewichtszunahme zu überwachen und einen Arzt aufzusuchen, wenn sie diese Anzeichen bemerken [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Beeinträchtigung der psychomotorischen Leistung
CYMBALTA 30 mg kann mit Sedierung und Schwindel verbunden sein. Patienten sollten daher vor dem Bedienen gefährlicher Maschinen, einschließlich Autos, gewarnt werden, bis sie sich hinreichend sicher sind, dass die CYMBALTA-Therapie ihre Fähigkeit zur Teilnahme an solchen Aktivitäten nicht beeinträchtigt.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Duloxetin wurde Mäusen und Ratten über 2 Jahre mit der Nahrung verabreicht.
Bei weiblichen Mäusen, die Duloxetin in einer Dosierung von 140 mg/kg/Tag (das Dreifache der empfohlenen Höchstdosis für den Menschen (MRHD) von 120 mg/Tag für Kinder auf mg/m2-Basis) erhielten, kam es zu einer erhöhten Inzidenz von hepatozellulären Adenomen und Karzinomen. Die Dosis ohne Wirkung betrug 50 mg/kg/Tag (das 1-Fache der MRHD, die Kindern verabreicht wird). Die Tumorinzidenz war bei männlichen Mäusen, die Duloxetin in Dosen von bis zu 100 mg/kg/Tag (das Doppelte der MRHD bei Kindern) erhielten, nicht erhöht.
Bei Ratten erhöhten diätetische Dosen von Duloxetin bis zu 27 mg/kg/Tag bei weiblichen Tieren (das 1-Fache der MRHD bei Kindern) und bis zu 36 mg/kg/Tag bei männlichen Tieren (das 1,4-fache der MRHD bei Kindern) nicht Auftreten von Tumoren.
Mutagenese
Duloxetin war im In-vitro-Test auf bakterielle Rückmutation (Ames-Test) nicht mutagen und in einem In-vivo-Chromosomenaberrationstest an Knochenmarkszellen der Maus nicht klastogen. Darüber hinaus war Duloxetin in einem In-vitro-Säugetier-Vorwärts-Genmutationstest in Maus-Lymphomzellen oder in einem In-vitro-Test zur außerplanmäßigen DNA-Synthese (UDS) in primären Rattenhepatozyten nicht genotoxisch und induzierte in vivo keinen Schwesterchromatidaustausch im Knochenmark des chinesischen Hamsters .
Beeinträchtigung der Fruchtbarkeit
Die orale Verabreichung von Duloxetin an männliche oder weibliche Ratten vor und während der Verpaarung in Dosen von bis zu 45 mg/kg/Tag (das Dreifache der MRHD, die Heranwachsenden auf mg/m2-Basis verabreicht wird) veränderte weder die Verpaarung noch die Fertilität.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschafts-Expositionsregister
Es gibt ein Schwangerschafts-Expositionsregister, das die Schwangerschaftsausgänge bei Frauen überwacht, die während der Schwangerschaft CYMBALTA ausgesetzt waren. Um sich anzumelden, kontaktieren Sie das CYMBALTA Schwangerschaftsregister unter 1-866-814-6975 oder www.cymbalta 20mgpregnancyregistry.com.
Zusammenfassung der Risiken
Daten aus einer retrospektiven Kohortenstudie nach Markteinführung weisen darauf hin, dass die Anwendung von Duloxetin im Monat vor der Geburt mit einem erhöhten Risiko für postpartale Blutungen verbunden sein kann. Daten aus der veröffentlichten Literatur und aus einer retrospektiven Kohortenstudie nach Markteinführung haben kein klares arzneimittelbedingtes Risiko für schwerwiegende Geburtsfehler oder andere nachteilige Entwicklungsergebnisse identifiziert (siehe Daten ). Es gibt Risiken im Zusammenhang mit unbehandelter Depression und Fibromyalgie in der Schwangerschaft und mit der Exposition gegenüber SNRIs und SSRIs, einschließlich CYMBALTA, während der Schwangerschaft (siehe Klinische Überlegungen ).
Bei Ratten und Kaninchen, die während der Organogenese mit Duloxetin behandelt wurden, war das fötale Gewicht verringert, aber es gab keine Hinweise auf Auswirkungen auf die Entwicklung bei Dosen, die das 3- bzw. 6-Fache der maximal empfohlenen Humandosis (MRHD) von 120 mg/Tag betrugen an Jugendliche auf mg/m2-Basis. Bei oraler Verabreichung von Duloxetin an trächtige Ratten während der Trächtigkeit und Laktation verringerte sich das Gewicht der Jungtiere bei der Geburt und die Überlebensrate der Jungtiere bis 1 Tag nach der Geburt bei einer Dosis, die das Zweifache der MRHD betrug, die Jugendlichen auf mg/m2-Basis verabreicht wurde. Bei dieser Dosis wurden Verhaltensweisen der Welpen beobachtet, die mit einer erhöhten Reaktivität einhergingen, wie z. B. eine erhöhte Schreckreaktion auf Geräusche und eine verringerte Gewöhnung an die Bewegungsaktivität. Das Wachstum nach dem Absetzen wurde nicht beeinträchtigt.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 bis 4 % bzw. 15 bis 20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryonale/fetales Risiko
Frauen, die Antidepressiva während der Schwangerschaft absetzen, erleiden mit größerer Wahrscheinlichkeit einen Rückfall einer schweren Depression als Frauen, die Antidepressiva weiter einnehmen. Dieses Ergebnis stammt aus einer prospektiven Längsschnittstudie, die 201 schwangere Frauen mit einer Vorgeschichte einer schweren depressiven Störung, die euthymisch waren und zu Beginn der Schwangerschaft Antidepressiva einnahmen, beobachtete. Berücksichtigen Sie das Risiko einer unbehandelten Depression, wenn Sie die Behandlung mit Antidepressiva während der Schwangerschaft und nach der Geburt abbrechen oder ändern.
Schwangere Frauen mit Fibromyalgie haben ein erhöhtes Risiko für unerwünschte Folgen für Mutter und Kind, einschließlich vorzeitiger vorzeitiger Membranruptur, Frühgeburt, zu klein für das Gestationsalter, intrauterine Wachstumsbeschränkung, Plazentastörung und Venenthrombose. Es ist nicht bekannt, ob diese unerwünschten Folgen für Mutter und Fötus eine direkte Folge von Fibromyalgie oder anderen komorbiden Faktoren sind.
Mütterliche Nebenwirkungen
Die Anwendung von Duloxetin im Monat vor der Entbindung kann mit einem erhöhten Risiko für postpartale Blutungen verbunden sein [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Fetale/neonatale Nebenwirkung
Neugeborene, die spät im dritten Trimenon CYMBALTA und anderen SNRIs oder SSRIs ausgesetzt waren, entwickelten Komplikationen, die einen verlängerten Krankenhausaufenthalt, Atemunterstützung und Sondenernährung erforderten. Solche Komplikationen können unmittelbar nach der Geburt auftreten. Zu den berichteten klinischen Befunden gehörten Atemnot, Zyanose, Apnoe, Krampfanfälle, Temperaturinstabilität, Schwierigkeiten beim Füttern, Erbrechen, Hypoglykämie, Hypotonie, Hypertonie, Hyperreflexie, Zittern, Nervosität, Reizbarkeit und ständiges Weinen. Diese Befunde stimmen entweder mit einer direkten toxischen Wirkung der SNRIs oder SSRIs oder möglicherweise mit einem Arzneimittelabsetzsyndrom überein. Es sollte beachtet werden, dass das klinische Bild in einigen Fällen mit dem Serotonin-Syndrom übereinstimmt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Daten
Menschliche Daten
Daten aus einer retrospektiven Claims-basierten Kohortenstudie nach Markteinführung ergaben ein erhöhtes Risiko für postpartale Blutungen bei 955 schwangeren Frauen, die im letzten Schwangerschaftsmonat Duloxetin ausgesetzt waren, im Vergleich zu 4.128.460 nicht exponierten schwangeren Frauen (angepasstes relatives Risiko: 1,53; 95 %-KI: 1,08-2,18). ). Dieselbe Studie fand keinen klinisch bedeutsamen Anstieg des Risikos für schwerwiegende Geburtsfehler im Vergleich von 2532 Frauen, die im ersten Trimenon der Schwangerschaft Duloxetin erhielten, mit 1.284.827 nicht exponierten Frauen, nachdem mehrere Confounder bereinigt wurden. Zu den methodischen Einschränkungen gehören mögliche Restverzerrungen, falsche Einstufung der Exposition und der Ergebnisse, das Fehlen direkter Messwerte für die Schwere der Erkrankung und das Fehlen von Informationen über Alkoholkonsum, Ernährung und Exposition gegenüber rezeptfreien Medikamenten.
Tierdaten
In Reproduktionsstudien an Tieren hat sich gezeigt, dass Duloxetin nachteilige Auswirkungen auf die embryonale/fötale und postnatale Entwicklung hat.
Bei oraler Verabreichung von Duloxetin an trächtige Ratten und Kaninchen während der Organogenese gab es keine Hinweise auf Missbildungen oder Entwicklungsschwankungen bei Dosen bis zu 45 mg/kg/Tag [das 3- bzw. 6-fache der MRHD von 120 mg/Tag]. verabreicht an Jugendliche auf einer mg/m2-Basis]. Das fötale Gewicht war jedoch bei dieser Dosis verringert, mit einer Dosis ohne Wirkung von 10 mg/kg/Tag (entspricht ungefähr der MRHD bei Ratten und der 2-fachen MRHD bei Kaninchen).
Bei oraler Verabreichung von Duloxetin an trächtige Ratten während der Trächtigkeit und Laktation waren das Überleben der Jungtiere bis 1 Tag nach der Geburt und das Körpergewicht der Jungtiere bei der Geburt und während der Laktationsperiode bei einer Dosis von 30 mg/kg/Tag (dem 2-fachen der gegebenen MRHD) verringert an Jugendliche auf mg/m2-Basis); die Dosis ohne Wirkung betrug 10 mg/kg/Tag. Darüber hinaus wurden Verhaltensweisen, die mit einer erhöhten Reaktivität einhergehen, wie z. B. eine erhöhte Schreckreaktion auf Lärm und eine verringerte Gewöhnung an die Bewegungsaktivität, bei Welpen beobachtet, nachdem das Muttertier 30 mg/kg/Tag ausgesetzt war. Das Wachstum nach dem Absetzen und die Fortpflanzungsleistung der Nachkommen wurden durch die mütterliche Duloxetin-Behandlung nicht beeinträchtigt.
Stillzeit
Zusammenfassung der Risiken
Daten aus der veröffentlichten Literatur berichten über das Vorhandensein von Duloxetin in der Muttermilch (vgl Daten ). Es gibt Berichte über Sedierung, schlechte Ernährung und schlechte Gewichtszunahme bei Säuglingen, die Duloxetin über die Muttermilch ausgesetzt waren (siehe Klinische Überlegungen ). Es liegen keine Daten zur Wirkung von Duloxetin auf die Milchproduktion vor.
Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an CYMBALTA und möglichen Nebenwirkungen von CYMBALTA oder der zugrunde liegenden Erkrankung der Mutter auf das gestillte Kind berücksichtigt werden.
Klinische Überlegungen
Säuglinge, die CYMBALTA ausgesetzt waren, sollten auf Sedierung, schlechte Ernährung und schlechte Gewichtszunahme überwacht werden.
Daten
Die Disposition von CYMBALTA 60 mg wurde bei 6 stillenden Frauen untersucht, die mindestens 12 Wochen nach der Geburt waren und sich entschieden hatten, ihre Säuglinge zu entwöhnen. Die Frauen erhielten 3,5 Tage lang zweimal täglich 40 mg CYMBALTA 60 mg. Die in der Muttermilch gemessene Spitzenkonzentration trat im Median 3 Stunden nach der Dosis auf. Die Menge an CYMBALTA in der Muttermilch betrug unter dieser Dosis etwa 7 µg/Tag; die geschätzte tägliche Säuglingsdosis betrug etwa 2 mcg/kg/Tag, was weniger als 1 % der mütterlichen Dosis ist. Das Vorhandensein von Metaboliten von CYMBALTA 40 mg in der Muttermilch wurde nicht untersucht.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von CYMBALTA 60 mg wurde für die Behandlung der generalisierten Angststörung (GAD) bei Patienten im Alter von 7 bis 17 Jahren und für die Behandlung des juvenilen Fibromyalgie-Syndroms bei Patienten im Alter von 13 bis 17 Jahren nachgewiesen. Die Sicherheit und Wirksamkeit von CYMBALTA 20 mg wurde bei pädiatrischen Patienten mit Major Depression (MDD), diabetischen peripheren neuropathischen Schmerzen oder chronischen muskuloskelettalen Schmerzen nicht nachgewiesen.
Antidepressiva erhöhten das Risiko von Suizidgedanken und -verhalten bei pädiatrischen Patienten. Überwachen Sie alle pädiatrischen Patienten, die mit Antidepressiva behandelt werden, auf eine klinische Verschlechterung und das Auftreten von Suizidgedanken und -verhalten, insbesondere während der ersten Behandlungsmonate oder bei Dosisänderungen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Führen Sie bei pädiatrischen Patienten, die mit CYMBALTA behandelt werden, eine regelmäßige Überwachung von Gewicht und Wachstum durch [siehe NEBENWIRKUNGEN ].
Generalisierte Angststörung
Die Anwendung von CYMBALTA zur Behandlung von GAD bei Patienten im Alter von 7 bis 17 Jahren wird durch eine 10-wöchige placebokontrollierte Studie (GAD-6) gestützt. Die Studie umfasste 272 pädiatrische Patienten mit GAD, von denen 47 % 7 bis 11 Jahre alt waren (53 % waren 12 bis 17 Jahre alt). CYMBALTA zeigte eine Überlegenheit gegenüber Placebo, gemessen an einer stärkeren Verbesserung auf der Pediatric Anxiety Rating Scale (PARS) für den GAD-Schweregrad [siehe Klinische Studien ].
Die Sicherheit und Wirksamkeit von CYMBALTA 20 mg zur Behandlung von GAD bei pädiatrischen Patienten unter 7 Jahren wurde nicht nachgewiesen.
Fibromyalgie
Die Anwendung von CYMBALTA zur Behandlung von Fibromyalgie bei Patienten im Alter von 13 bis 17 Jahren wird durch eine 13-wöchige placebokontrollierte Studie an 184 Patienten mit juvenilem Fibromyalgie-Syndrom (Studie FM-4) gestützt. CYMBALTA zeigte eine Verbesserung gegenüber Placebo beim primären Endpunkt, Veränderung vom Ausgangswert bis zum Ende der Behandlung im Brief Pain Inventory (BPI) – Modifizierte Kurzform: Jugendversion 24-Stunden-Durchschnitt der Schmerzstärke [siehe Klinische Studien ].
Die Sicherheit und Wirksamkeit von CYMBALTA zur Behandlung von Fibromyalgie bei Patienten unter 13 Jahren wurde nicht nachgewiesen.
Depression
Die Sicherheit und Wirksamkeit von CYMBALTA wurde bei pädiatrischen Patienten zur Behandlung von MDD nicht nachgewiesen.
Die Wirksamkeit von CYMBALTA wurde in zwei 10-wöchigen placebokontrollierten Studien mit 800 pädiatrischen Patienten im Alter von 7 bis 17 Jahren mit MDD (MDD-6 und MDD-7) nicht nachgewiesen. Weder CYMBALTA noch eine aktive Kontrolle (zur Behandlung von pädiatrischer MDD zugelassen) war Placebo überlegen.
Die am häufigsten beobachteten Nebenwirkungen in den pädiatrischen MDD-Studien waren Übelkeit, Kopfschmerzen, Gewichtsabnahme und Bauchschmerzen. Verminderter Appetit und Gewichtsverlust wurden im Zusammenhang mit der Anwendung von SSRIs und SNRIs beobachtet.
Daten zur Toxikologie von Jungtieren
Die Verabreichung von Duloxetin an junge Ratten vom 21. Tag nach der Geburt (Entwöhnung) bis zum 90. Tag nach der Geburt (Erwachsener) führte zu einer Abnahme des Körpergewichts, die bis ins Erwachsenenalter anhielt, sich aber erholte, wenn die medikamentöse Behandlung abgesetzt wurde; leicht verzögerte (~1,5 Tage) sexuelle Reifung bei Frauen, ohne Auswirkungen auf die Fruchtbarkeit; und eine Verzögerung beim Erlernen einer komplexen Aufgabe im Erwachsenenalter, die nach Absetzen der medikamentösen Behandlung nicht beobachtet wurde. Diese Wirkungen wurden bei der hohen Dosis von 45 mg/kg/Tag (das Zweifache der MRHD für ein Kind) beobachtet; der No-Effect-Level betrug 20 mg/kg/Tag (ca. das 1-fache der MRHD für ein Kind).
Geriatrische Verwendung
Geriatrische Exposition in klinischen Studien vor der Markteinführung von CYMBALTA
In den MDD-, GAD-, DPNP-, FM-, OA- und CLBP-Studien wurden im Allgemeinen keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Patienten und jüngeren erwachsenen Patienten beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen diesen geriatrischen und jüngeren Patienten festgestellt erwachsene Patienten, eine größere Empfindlichkeit einiger älterer Patienten kann jedoch nicht ausgeschlossen werden.
SSRIs und SNRIs, einschließlich CYMBALTA, wurden mit einer klinisch signifikanten Hyponatriämie bei geriatrischen Patienten in Verbindung gebracht, die möglicherweise einem höheren Risiko für diese Nebenwirkung ausgesetzt sind [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
In einer Analyse der Daten aus allen placebokontrollierten Studien berichteten die mit CYMBALTA behandelten Patienten eine höhere Sturzrate im Vergleich zu den mit Placebo behandelten Patienten. Das erhöhte Risiko scheint proportional zum zugrunde liegenden Sturzrisiko eines Patienten zu sein. Das zugrunde liegende Risiko scheint mit dem Alter stetig zuzunehmen. Da Risikofaktoren für Stürze wie Medikamente, medizinische Komorbiditäten und Gangstörungen bei geriatrischen Patienten tendenziell häufiger auftreten, ist die Auswirkung des zunehmenden Alters allein auf Stürze während der Behandlung mit CYMBALTA 30 mg unklar. Bei der Anwendung von CYMBALTA wurde über Stürze mit schwerwiegenden Folgen einschließlich Knochenbrüchen und Krankenhauseinweisungen berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ].
Die Pharmakokinetik von Duloxetin nach einer Einzeldosis von 40 mg wurde bei gesunden älteren Frauen (65 bis 77 Jahre) und gesunden Frauen mittleren Alters (32 bis 50 Jahre) verglichen. Es gab keinen Unterschied in der Cmax, aber die AUC von Duloxetin war etwas (etwa 25 %) höher und die Halbwertszeit etwa 4 Stunden länger bei älteren Frauen. Populationspharmakokinetische Analysen deuten darauf hin, dass die typischen Werte für die Clearance mit jedem Lebensjahr zwischen 25 und 75 Jahren um etwa 1 % abnehmen; aber das Alter als prädiktiver Faktor macht nur einen kleinen Prozentsatz der Variabilität zwischen den Patienten aus. Eine Dosisanpassung aufgrund des Alters des erwachsenen Patienten ist nicht erforderlich.
Geschlecht
Die Halbwertszeit von Duloxetin ist bei Männern und Frauen ähnlich. Eine geschlechtsspezifische Dosisanpassung ist nicht erforderlich.
Rauchstatus
Die Bioverfügbarkeit von Duloxetin (AUC) scheint bei Rauchern um etwa ein Drittel reduziert zu sein. Dosisänderungen werden Rauchern nicht empfohlen.
Wettrennen
Es wurde keine spezifische pharmakokinetische Studie durchgeführt, um die Auswirkungen der Rasse zu untersuchen.
Leberfunktionsstörung
Bei Patienten mit klinisch erkennbarer Leberfunktionsstörung ist der Metabolismus und die Elimination von Duloxetin verringert. Nach einer Einzeldosis von 20 mg CYMBALTA 20 mg hatten 6 zirrhotische Patienten mit mittelgradiger Leberfunktionsstörung (Child-Pugh-Klasse B) eine mittlere Duloxetin-Plasmaclearance von etwa 15 % der von gesunden Probanden gleichen Alters und Geschlechts, mit einer 5-fachen Erhöhung in der mittleren Exposition (AUC). Obwohl Cmax bei Zirrhosepatienten ähnlich den Normalwerten war, war die Halbwertszeit etwa dreimal länger [siehe DOSIERUNG UND ANWENDUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schwere Nierenfunktionsstörung
Es liegen begrenzte Daten zu den Wirkungen von CYMBALTA 40 mg bei Patienten mit terminaler Niereninsuffizienz (ESRD) vor. Nach einer Einzeldosis von 60 mg CYMBALTA 20 mg waren die Cmax- und AUC-Werte bei Patienten mit ESRD, die eine chronische intermittierende Hämodialyse erhielten, etwa 100 % höher als bei Patienten mit normaler Nierenfunktion. Die Eliminationshalbwertszeit war jedoch in beiden Gruppen ähnlich. Die AUCs der wichtigsten zirkulierenden Metaboliten, 4-Hydroxy-Duloxetin-Glucuronid und 5-Hydroxy, 6-Methoxy-Duloxetin-Sulfat, die größtenteils im Urin ausgeschieden werden, waren etwa 7- bis 9-fach höher und es ist zu erwarten, dass sie bei Mehrfachdosierung weiter ansteigen. Populationspharmakokinetische Analysen deuten darauf hin, dass eine leichte bis mäßige Nierenfunktionsstörung (geschätzte CrCl 30–80 ml/min) keine signifikante Auswirkung auf die scheinbare Clearance von Duloxetin hat [siehe DOSIERUNG UND ANWENDUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
ÜBERDOSIS
Anzeichen und Symptome
Nach der Markteinführung wurden tödliche Folgen bei akuter Überdosierung von CYMBALTA 60 mg berichtet, hauptsächlich bei gemischten Überdosierungen, aber auch bei CYMBALTA 20 mg allein, einschließlich 1000 mg CYMBALTA (ungefähr das 8,3-fache der empfohlenen Höchstdosis). Anzeichen und Symptome einer Überdosierung (CYMBALTA allein oder mit gemischten Arzneimitteln) waren Schläfrigkeit, Koma, Serotoninsyndrom, Krampfanfälle, Synkope, Tachykardie, Hypotonie, Hypertonie und Erbrechen.
Management einer Überdosierung
Es gibt kein spezifisches Gegenmittel für eine Überdosierung von CYMBALTA 60 mg, aber wenn ein Serotonin-Syndrom auftritt, kann eine spezifische Behandlung (z. B. mit Cyproheptadin und/oder Temperaturkontrolle) in Betracht gezogen werden.
Im Falle einer akuten Überdosierung mit CYMBALTA 30 mg sollte die Behandlung aus den allgemeinen Maßnahmen bestehen, die bei der Behandlung einer Überdosierung mit jedem Arzneimittel angewendet werden, wie z. Eine Magenspülung mit einer großlumigen Magensonde mit angemessenem Atemwegsschutz kann bei Bedarf indiziert sein, wenn sie kurz nach der Einnahme oder bei symptomatischen Patienten durchgeführt wird. Die Induktion von Erbrechen wird nicht empfohlen.
Aktivkohle kann nützlich sein, um die Resorption von Duloxetin aus dem Gastrointestinaltrakt zu begrenzen. Es wurde gezeigt, dass die Verabreichung von Aktivkohle die AUC und Cmax von Duloxetin um durchschnittlich ein Drittel verringert, obwohl einige Patienten eine begrenzte Wirkung von Aktivkohle hatten. Aufgrund des großen Verteilungsvolumens von Duloxetin ist es unwahrscheinlich, dass forcierte Diurese, Dialyse, Hämoperfusion und Austauschtransfusion von Nutzen sind.
Bei der Behandlung einer Überdosierung sollte die Möglichkeit einer Beteiligung mehrerer Arzneimittel in Betracht gezogen werden. Besondere Vorsicht gilt Patienten, die CYMBALTA 60 mg und trizyklische Antidepressiva überdosieren. In einem solchen Fall kann eine verringerte Clearance des trizyklischen Ausgangsstoffs und/oder seines aktiven Metaboliten die Wahrscheinlichkeit klinisch signifikanter Folgeerscheinungen erhöhen und die Zeit verlängern, die für eine engmaschige medizinische Überwachung erforderlich ist [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Wenden Sie sich für weitere Informationen zur Behandlung einer Überdosierung an eine Giftnotrufzentrale (1-800-222-1222 oder www.poison.org).
KONTRAINDIKATIONEN
Die Anwendung von MAO-Hemmern zur Behandlung psychiatrischer Erkrankungen mit CYMBALTA 40 mg oder innerhalb von 5 Tagen nach Beendigung der Behandlung mit CYMBALTA ist aufgrund eines erhöhten Risikos für ein Serotonin-Syndrom kontraindiziert. Die Anwendung von CYMBALTA innerhalb von 14 Tagen nach Absetzen eines MAO-Hemmers zur Behandlung psychiatrischer Erkrankungen ist kontraindiziert [siehe DOSIERUNG UND ANWENDUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Der Beginn von CYMBALTA 30 mg bei einem Patienten, der mit MAO-Hemmern wie Linezolid oder intravenösem Methylenblau behandelt wird, ist aufgrund eines erhöhten Risikos für ein Serotonin-Syndrom ebenfalls kontraindiziert [siehe DOSIERUNG UND ANWENDUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Obwohl die genauen Mechanismen der antidepressiven, zentralen schmerzhemmenden und anxiolytischen Wirkung von Duloxetin beim Menschen unbekannt sind, wird angenommen, dass diese Wirkungen mit seiner Potenzierung der serotonergen und noradrenergen Aktivität im ZNS zusammenhängen.
Pharmakodynamik
Präklinische Studien haben gezeigt, dass Duloxetin ein potenter Inhibitor der neuronalen Serotonin- und Noradrenalin-Wiederaufnahme und ein weniger potenter Inhibitor der Dopamin-Wiederaufnahme ist. Duloxetin hat in vitro keine signifikante Affinität zu dopaminergen, adrenergen, cholinergen, histaminergen, Opioid-, Glutamat- und GABA-Rezeptoren. Duloxetin hemmt die Monoaminoxidase (MAO) nicht.
CYMBALTA gehört zu einer Klasse von Arzneimitteln, von denen bekannt ist, dass sie den Harnröhrenwiderstand beeinflussen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Herzelektrophysiologie
Die Wirkung von zweimal täglich 160 mg und 200 mg CYMBALTA (das 2,7- bzw. 3,3-fache der empfohlenen Höchstdosis) auf den Steady State wurde in einer randomisierten, doppelblinden, zweifachen Crossover-Studie an 117 gesunden erwachsenen Probandinnen untersucht. Es wurde keine Verlängerung des QT-Intervalls festgestellt. CYMBALTA 40 mg scheint mit einer konzentrationsabhängigen, aber nicht klinisch bedeutsamen QT-Verkürzung verbunden zu sein.
Pharmakokinetik
Duloxetin hat eine Eliminationshalbwertszeit von etwa 12 Stunden (Bereich 8 bis 17 Stunden) und seine Pharmakokinetik ist über den therapeutischen Bereich dosisproportional. Steady-State-Plasmakonzentrationen werden typischerweise nach 3-tägiger Einnahme erreicht. Die Elimination von Duloxetin erfolgt hauptsächlich über den hepatischen Metabolismus, an dem zwei P450-Isoenzyme, CYP1A2 und CYP2D6, beteiligt sind.
Absorption
Nach oraler Gabe von CYMBALTA 30 mg wird Duloxetinhydrochlorid gut resorbiert. Es gibt eine mediane Verzögerung von 2 Stunden bis zum Beginn der Resorption (Tlag), wobei die maximalen Plasmakonzentrationen (Cmax) von Duloxetin 6 Stunden nach der Einnahme erreicht werden. Es gibt eine 3-stündige Verzögerung der Resorption und eine Zunahme der scheinbaren Clearance von Duloxetin um ein Drittel nach einer abendlichen Dosis im Vergleich zu einer morgendlichen Dosis.
Wirkung von Lebensmitteln
Nahrung hat keinen Einfluss auf die Cmax von Duloxetin, verzögert jedoch die Zeit bis zum Erreichen der Spitzenkonzentration um 6 bis 10 Stunden und verringert das Ausmaß der Resorption (AUC) geringfügig um etwa 10 %.
Verteilung
Das scheinbare Verteilungsvolumen beträgt im Durchschnitt etwa 1640 l. Duloxetin wird stark (> 90 %) an Proteine im menschlichen Plasma gebunden, wobei es hauptsächlich an Albumin und α1-saures Glykoprotein bindet. Die Wechselwirkung zwischen Duloxetin und anderen Arzneimitteln mit hoher Proteinbindung wurde noch nicht vollständig untersucht. Die Plasmaproteinbindung von Duloxetin wird durch eine eingeschränkte Nieren- oder Leberfunktion nicht beeinflusst.
Beseitigung
Stoffwechsel
Biotransformation und Disposition von Duloxetin beim Menschen wurden nach oraler Verabreichung von 14C-markiertem Duloxetin bestimmt. Duloxetin macht etwa 3 % des gesamten radioaktiv markierten Materials im Plasma aus, was darauf hindeutet, dass es einem umfangreichen Metabolismus zu zahlreichen Metaboliten unterliegt. Die wichtigsten Biotransformationswege für Duloxetin umfassen die Oxidation des Naphthylrings, gefolgt von Konjugation und weiterer Oxidation. Sowohl CYP1A2 als auch CYP2D6 katalysieren die Oxidation des Naphthylrings in vitro. Zu den im Plasma gefundenen Metaboliten gehören 4-Hydroxy-Duloxetin-Glucuronid und 5-Hydroxy-6-Methoxy-Duloxetin-Sulfat.
Ausscheidung
Im Urin wurden viele weitere Metaboliten identifiziert, von denen einige nur geringfügige Eliminationswege darstellen. Im Urin sind nur Spuren (
Spezifische Populationen
Pädiatrische Patienten
Die Steady-State-Plasmakonzentration von Duloxetin war bei pädiatrischen Patienten im Alter von 7 bis 17 Jahren und bei erwachsenen Patienten vergleichbar. Die durchschnittliche Duloxetin-Konzentration im Steady State war in dieser pädiatrischen Population etwa 30 % niedriger als bei erwachsenen Patienten. Die vom Modell vorhergesagten Steady-State-Plasmakonzentrationen von Duloxetin bei pädiatrischen Patienten im Alter von 7 bis 17 Jahren lagen größtenteils innerhalb des Konzentrationsbereichs, der bei erwachsenen Patienten beobachtet wurde, und überschritten den Konzentrationsbereich bei Erwachsenen nicht.
Klinische Studien
Überblick über die klinischen Studien
Die Wirksamkeit von CYMBALTA 60 mg wurde in angemessenen und gut kontrollierten Studien in den folgenden Populationen nachgewiesen:
Major Depression (MDD)
4 Kurzzeit- (Studien MDD-1, MDD-2, MDD-3 und MDD-4) und 1 Erhaltungsstudie (Studie MDD-5) bei Erwachsenen [siehe Major Depression bei Erwachsenen ].
Generalisierte Angststörung (GAD)
3 Kurzzeitstudien bei Erwachsenen (Studien GAD-1, GAD-2 und GAD-3), 1 Erhaltungsstudie bei Erwachsenen (Studie GAD-4), 1 Kurzzeitstudie bei geriatrischen Patienten (Studie GAD-5), und 1 Kurzzeitstudie bei pädiatrischen Patienten im Alter von 7 bis 17 Jahren (Studie GAD-6) [siehe Generalisierte Angststörung ].
Diabetischer peripherer neuropathischer Schmerz (DPNP)
Zwei 12-wöchige Studien mit Erwachsenen (Studien DPNP-1 und DPNP-2) [siehe Diabetischer peripherer neuropathischer Schmerz bei Erwachsenen ].
Fibromyalgie (FM)
Zwei Studien mit Erwachsenen (eine mit 3 Monaten Dauer und eine mit 6 Monaten Dauer) (Studien FM-1 und FM-2) und eine 13-wöchige Studie mit pädiatrischen Patienten im Alter von 13 bis 17 Jahren (Studie FM-4) [siehe Fibromyalgie ].
Chronischer Muskel-Skelett-Schmerz
Zwei 12- bis 13-wöchige Studien mit erwachsenen Patienten mit chronischen Schmerzen im unteren Rücken (CLBP) (Studien CLBP-1 und CLBP-3) und eine 13-wöchige Studie mit erwachsenen Patienten mit chronischen Schmerzen aufgrund von Osteoarthritis (OA) (Studie OA -1) [siehe Chronischer Muskel-Skelett-Schmerz bei Erwachsenen ].
Zusätzlich wird unten eine Zusammenfassung der folgenden Studien präsentiert, die keine Wirksamkeit zeigten: Studie FM-3 (eine 16-wöchige Studie bei erwachsenen Patienten mit Fibromyalgie), Studie CLBP-2 (eine 13-wöchige Studie bei erwachsenen Patienten mit CLBP) und Studie OA-2 (eine 13-wöchige Studie bei erwachsenen Patienten mit chronischen Schmerzen aufgrund von OA).
Major Depression bei Erwachsenen
Die Wirksamkeit von CYMBALTA zur Behandlung von MDD bei Erwachsenen wurde in 4 randomisierten, doppelblinden, placebokontrollierten Fixdosis-Studien mit erwachsenen ambulanten Patienten (18 bis 83 Jahre), die die DSM-IV-Kriterien für MDD erfüllten, nachgewiesen:
In allen vier Studien zeigte CYMBALTA 40 mg eine Überlegenheit gegenüber Placebo, gemessen anhand der Verbesserung des 17-Punkte-Gesamtscores der Hamilton Depression Rating Scale (HAMD-17) (siehe ). Es gibt keine Hinweise darauf, dass Dosen von mehr als 60 mg/Tag einen zusätzlichen Nutzen bringen.
In all diesen klinischen Studien ergaben die Analysen des Zusammenhangs zwischen Behandlungsergebnis und Alter, Geschlecht und ethnischer Zugehörigkeit keinen Hinweis auf eine unterschiedliche Ansprechbarkeit auf der Grundlage dieser Patientenmerkmale.
Studie MDD-1 CYMBALTA (60 mg/Tag)b Placebo 21,5 (4,10) 21,1 (3,71) -10,9 (0,70) -6,1 (0,69) -4,9 (-6,8, -2,9) --
In der Studie MDD-5 erhielten 533 erwachsene Patienten, die die DSM-IV-Kriterien für MDD erfüllten, CYMBALTA 60 mg einmal täglich während einer anfänglichen 12-wöchigen offenen Behandlungsphase. 278 Patienten, die auf die Open-Label-Behandlung ansprachen [definiert als Erfüllung der folgenden Kriterien in Woche 10 und 12: ein HAMD-17-Gesamtscore ≤ 9, Clinical Global Impressions of Severity (CGI-S) ≤ 2 und nicht die die DSM-IV-Kriterien für MDD erfüllten] wurden nach dem Zufallsprinzip der 6-monatigen Fortsetzung der CYMBALTA-Behandlung mit der gleichen Dosierung (N = 136) oder Placebo (N = 142) zugeteilt.
In der Studie MDD-5 erlebten Patienten unter CYMBALTA eine statistisch signifikant längere Zeit bis zum Rückfall der Depression als Patienten unter Placebo (siehe Abbildung 1 ). Ein Rückfall wurde definiert als ein Anstieg des CGI-S-Scores um ≥ 2 Punkte im Vergleich zu dem in Woche 12 erzielten Wert sowie als Erfüllung der DSM-IV-Kriterien für MDD bei 2 aufeinanderfolgenden Besuchen im Abstand von mindestens 2 Wochen, wobei die 2-wöchige Zeitkriterium musste erst beim zweiten Besuch erfüllt werden.
Abbildung 1: Kumulative Anteilea erwachsener Patienten mit MDD-Rückfall (Studie MDD-5)
Generalisierte Angststörung
GAD-Studien bei Erwachsenen (einschließlich geriatrischer Patienten)
Die Wirksamkeit von CYMBALTA 20 mg bei der Behandlung von generalisierter Angststörung (GAD) wurde in 1 randomisierten, doppelblinden, placebokontrollierten Studie mit fester Dosis und 2 randomisierten, doppelblinden, placebokontrollierten Studien mit flexibler Dosis bei erwachsenen ambulanten Patienten nachgewiesen zwischen 18 und 83 Jahren, die die DSM-IV-Kriterien für GAD erfüllen (Studien GAD-1, GAD-2 bzw. GAD-3).
In den Studien GAD-1 und GAD-2 betrug die Anfangsdosis 60 mg einmal täglich (aus Gründen der Verträglichkeit war eine Heruntertitration auf 30 mg einmal täglich zulässig; die Dosis konnte auf 60 mg einmal täglich erhöht werden). Fünfzehn Prozent der Patienten wurden heruntertitriert. Studie GAD-3 hatte eine Anfangsdosis von 30 mg einmal täglich für 1 Woche, bevor sie auf 60 mg einmal täglich erhöht wurde.
Die Studien GAD-2 und GAD-3 umfassten eine Dosistitration mit CYMBALTA-Dosen im Bereich von 60 mg einmal täglich bis 120 mg einmal täglich (N = 168 und N = 162) im Vergleich zu Placebo (N = 159 und N = 161) über einen Zeitraum von 10 – Woche Behandlungsdauer. Die mittlere Dosis für die Absolvierenden am Endpunkt dieser Studien betrug 104,8 mg/Tag. In der Studie GAD-1 wurden CYMBALTA 60 mg-Dosierungen von 60 mg einmal täglich (n = 168) und 120 mg einmal täglich (n = 170) im Vergleich zu Placebo (n = 175) über einen Behandlungszeitraum von 9 Wochen bewertet. Während sich eine Dosis von 120 mg/Tag als wirksam erwiesen hat, gibt es keine Hinweise darauf, dass Dosen von mehr als 60 mg/Tag einen zusätzlichen Nutzen bringen.
In allen 3 Studien zeigte CYMBALTA eine Überlegenheit gegenüber Placebo, gemessen anhand einer stärkeren Verbesserung des Gesamtwertes der Hamilton Anxiety Scale (HAM-A) (siehe ) und des Wertes der globalen Funktionsbeeinträchtigung der Sheehan Disability Scale (SDS). Das SDS ist eine zusammengesetzte Messung des Ausmaßes, in dem emotionale Symptome die Funktionsfähigkeit des Patienten in drei Lebensbereichen beeinträchtigen: Arbeit/Schule, Sozialleben/Freizeitaktivitäten und Familienleben/Haushaltspflichten.
In der Studie GAD-4 erhielten 887 Patienten, die die DSM-IV-TR-Kriterien für GAD erfüllten, CYMBALTA 60 mg bis 120 mg einmal täglich während einer anfänglichen 26-wöchigen offenen Behandlungsphase. Vierhundertneunundzwanzig Patienten, die auf eine offene Behandlung ansprachen [definiert als Erfüllung der folgenden Kriterien in Woche 24 und 26: eine Verringerung des HAM-A-Gesamtscores zu Studienbeginn um mindestens 50 % auf einen Score von nicht mehr als 11, und a Clinical Global Impressions of Improvement (CGI-Improvement) Score von 1 oder 2] wurden randomisiert der Fortsetzung von CYMBALTA 30 mg in der gleichen Dosierung (N = 216) oder Placebo (N = 213) zugeordnet und es wurde auf einen Rückfall beobachtet. Von den randomisierten Patienten befanden sich 73 % seit mindestens 10 Wochen in einem Responder-Status. Rückfall wurde definiert als ein Anstieg des CGI-Severity-Scores um mindestens 2 Punkte auf einen Score ≥ 4 und eine MINI-Diagnose (Mini-International Neuropsychiatric Interview) von GAD (ohne Dauer) oder Absetzen aufgrund mangelnder Wirksamkeit. Bei Patienten, die CYMBALTA einnahmen, dauerte es statistisch signifikant länger bis zum Rückfall der GAD als bei Patienten, die Placebo einnahmen (vgl Figur 2 ).
Subgruppenanalysen zeigten keine Unterschiede in den Behandlungsergebnissen in Abhängigkeit von Alter oder Geschlecht.
GAD-Studie bei geriatrischen Patienten
Die Wirksamkeit von CYMBALTA bei der Behandlung von Patienten im Alter von ≥ 65 Jahren mit GAD wurde in einer 10-wöchigen, randomisierten, doppelblinden, placebokontrollierten Studie mit flexibler Dosierung bei Erwachsenen im Alter von ≥ 65 Jahren, die die DSM-IV-Kriterien erfüllten, nachgewiesen für GAD (Studie GAD-5). In der Studie GAD-5 betrug die Anfangsdosis 30 mg einmal täglich für 2 Wochen, bevor weitere Dosiserhöhungen in 30-mg-Schritten in den Behandlungswochen 2, 4 und 7 auf bis zu 120 mg einmal täglich erlaubt waren, basierend auf der Beurteilung des klinischen Ansprechens durch den Prüfarzt und Verträglichkeit. Die mittlere Dosis für Patienten, die die 10-wöchige akute Behandlungsphase abschlossen, betrug 51 mg. Mit CYMBALTA behandelte Patienten (N = 151) zeigten eine signifikant größere Verbesserung im Vergleich zu Placebo (N = 140) bei der mittleren Veränderung vom Ausgangswert zum Endpunkt, gemessen anhand des HAM-A-Gesamtscores (siehe ).
GAD-Studie bei pädiatrischen Patienten im Alter von 7 bis 17 Jahren
Die Wirksamkeit von CYMBALTA bei der Behandlung von pädiatrischen Patienten im Alter von 7 bis 17 Jahren mit GAD wurde in einer randomisierten, doppelblinden, placebokontrollierten Studie mit flexibler Dosis bei ambulanten pädiatrischen Patienten mit GAD (basierend auf den DSM-IV-Kriterien) nachgewiesen (Studie GAD-6).
In der Studie GAD-6 betrug die Anfangsdosis 30 mg einmal täglich für 2 Wochen. Weitere Dosissteigerungen in 30-mg-Schritten bis zu 120 mg einmal täglich waren nach Beurteilung des klinischen Ansprechens und der Verträglichkeit durch den Prüfarzt zulässig. Die mittlere Dosis für Patienten, die die 10-wöchige Behandlungsphase abschlossen, betrug 57,6 mg/Tag. In dieser Studie zeigte CYMBALTA (N = 135) eine Überlegenheit gegenüber Placebo (N = 137) von der Baseline bis zum Endpunkt, gemessen anhand einer stärkeren Verbesserung auf der Pediatric Anxiety Rating Scale (PARS) für den GAD-Schweregrad (siehe ).
Abbildung 2: Kumulative Anteilea erwachsener Patienten mit GAD-Rückfall (Studie GAD-4)
Diabetischer peripherer neuropathischer Schmerz bei Erwachsenen
Die Wirksamkeit von CYMBALTA 30 mg zur Behandlung von neuropathischen Schmerzen im Zusammenhang mit diabetischer peripherer Neuropathie bei Erwachsenen wurde in zwei randomisierten, 12-wöchigen, doppelblinden, placebokontrollierten Studien mit fester Dosis bei erwachsenen Patienten mit diabetischen peripheren neuropathischen Schmerzen (DPNP ) für mindestens 6 Monate (Studie DPNP-1 und Studie DPNP-2). In diese Studien wurden insgesamt 791 Patienten aufgenommen, von denen 592 (75 %) die Studien beendeten. Die eingeschlossenen Patienten litten seit mindestens 6 Monaten an Diabetes mellitus Typ I oder II mit der Diagnose einer schmerzhaften distalen symmetrischen sensomotorischen Polyneuropathie. Die Patienten hatten zu Studienbeginn einen Schmerzwert von ≥ 4 auf einer 11-Punkte-Skala von 0 (kein Schmerz) bis 10 (stärkster möglicher Schmerz). Zusätzlich zu CYMBALTA durften die Patienten je nach Bedarf bis zu 4 Gramm Paracetamol pro Tag gegen Schmerzen einnehmen. Die Patienten hielten ihre Schmerzen täglich in einem Tagebuch fest.
In beiden Studien wurde CYMBALTA 60 mg einmal täglich oder 60 mg zweimal täglich mit Placebo verglichen. Studie DPNP-1 verglich zusätzlich CYMBALTA 20 mg mit Placebo. Insgesamt 457 Patienten (342 CYMBALTA, 115 Placebo) wurden in die Studie DPNP-1 aufgenommen und insgesamt 334 Patienten (226 CYMBALTA, 108 Placebo) wurden in die Studie DPNP-2 aufgenommen.
Die Behandlung mit CYMBALTA 60 mg ein- oder zweimal täglich verbesserte die Endpunkt-Mittelwert-Schmerzwerte gegenüber dem Ausgangswert statistisch signifikant und erhöhte den Anteil der Patienten mit einer mindestens 50 %igen Verringerung der Schmerzwerte gegenüber dem Ausgangswert. Die Abbildungen 3 und 4 zeigen für verschiedene Grade der Schmerzverbesserung vom Ausgangswert bis zum Endpunkt der Studie den Anteil der Patienten, die diesen Grad der Verbesserung in den Studien DPNP-1 bzw. DPNP-2 erreichten. Die Zahlen sind kumulativ, so dass Patienten, deren Veränderung zum Ausgangswert beispielsweise 50 % beträgt, bei jedem Verbesserungsgrad unter 50 % ebenfalls eingeschlossen sind. Patienten, die die Studie nicht beendeten, wurde eine Verbesserung von 0 % zugeordnet. Bei einigen Patienten kam es bereits in Woche 1 zu einer Schmerzlinderung, die während der gesamten Studie anhielt.
Abbildung 3: Prozentsatz der erwachsenen DPNP-Patienten, die verschiedene Stufen der Schmerzlinderung erreichten, gemessen an der durchschnittlichen 24-Stunden-Schmerzstärke (Studie DPNP-1)
Abbildung 4: Prozentsatz der erwachsenen DPNP-Patienten, die verschiedene Stufen der Schmerzlinderung erreichten, gemessen anhand der durchschnittlichen Schmerzstärke über 24 Stunden (Studie DPNP-2)
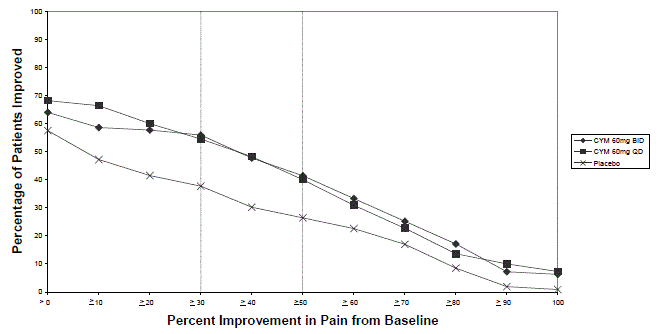
Fibromyalgie
Studien an Erwachsenen bei Fibromyalgie
Die Wirksamkeit von CYMBALTA zur Behandlung von Fibromyalgie bei Erwachsenen wurde in zwei randomisierten, doppelblinden, placebokontrollierten Studien mit fester Dosis bei erwachsenen Patienten nachgewiesen, die die Kriterien des American College of Rheumatology für Fibromyalgie erfüllten (eine Vorgeschichte von weit verbreiteten Schmerzen für 3 Monate und Schmerzen an 11 oder mehr der 18 spezifischen Tenderpoint-Stellen). Die Studie FM-1 dauerte drei Monate und schloss nur weibliche Patienten ein. Die Studie FM-2 dauerte sechs Monate und schloss männliche und weibliche Patienten ein. Etwa 25 % der Teilnehmer hatten eine komorbide Diagnose von MDD. In die Studien FM1 und FM-2 wurden insgesamt 874 Patienten aufgenommen, von denen 541 (62 %) die Studien abschlossen. Insgesamt 354 Patienten (234 CYMBALTA 40 mg, 120 Placebo) wurden in die Studie FM-1 aufgenommen und insgesamt 520 Patienten (376 CYMBALTA, 144 Placebo) wurden in die Studie FM-2 aufgenommen (5 % männlich, 95 % weiblich). Die Patienten hatten einen Ausgangsschmerzwert von 6,5 auf einer 11-Punkte-Skala von 0 (kein Schmerz) bis 10 (möglichst schlimmerer Schmerz).
In den Studien FM-1 und FM-2 wurde CYMBALTA 60 mg einmal täglich oder 120 mg täglich (verabreicht in aufgeteilten Dosen in Studie FM-1 und als tägliche Einzeldosis in Studie FM-2) mit Placebo verglichen. Studie FM-2 verglich zusätzlich CYMBALTA 20 mg mit Placebo während der ersten drei Monate einer sechsmonatigen Studie.
Die Behandlung mit CYMBALTA 60 mg oder 120 mg täglich verbesserte die Endpunkt-Mittelwert-Schmerzwerte gegenüber dem Ausgangswert statistisch signifikant und erhöhte den Anteil der Patienten mit einer mindestens 50 %igen Verringerung des Schmerzwertes gegenüber dem Ausgangswert. Eine Schmerzreduktion wurde sowohl bei Patienten mit als auch ohne komorbide MDD beobachtet. Der Grad der Schmerzreduktion kann jedoch bei Patienten mit komorbider MDD größer sein. Für verschiedene Grade der Schmerzlinderung vom Ausgangswert bis zum Endpunkt der Studie zeigen die Abbildungen 5 und 6 den Anteil der Patienten, die diesen Grad der Verbesserung in den Studien FM-1 bzw. FM-2 erreichten. Die Zahlen sind kumulativ, so dass Patienten, deren Veränderung zum Ausgangswert beispielsweise 50 % beträgt, bei jedem Verbesserungsgrad unter 50 % ebenfalls eingeschlossen sind. Patienten, die die Studie nicht beendeten, wurde eine Verbesserung von 0 % zugeordnet. Bei einigen Patienten kam es bereits in Woche 1 zu einer Schmerzlinderung, die während der gesamten Studie anhielt. Eine Verbesserung wurde auch bei Messungen der Funktion (Fibromyalgia Impact Questionnaires) und des globalen Eindrucks der Veränderung des Patienten (PGI) nachgewiesen. Keine der Studien zeigte einen Vorteil von 120 mg im Vergleich zu 60 mg, und eine höhere Dosierung war mit mehr Nebenwirkungen und vorzeitigen Behandlungsabbrüchen verbunden.
Abbildung 5: Prozentsatz der erwachsenen Fibromyalgie-Patienten, die am Studienende verschiedene Stufen der Schmerzlinderung erreichten, gemessen an der durchschnittlichen 24-Stunden-Schmerzstärke (Studie FM-1)
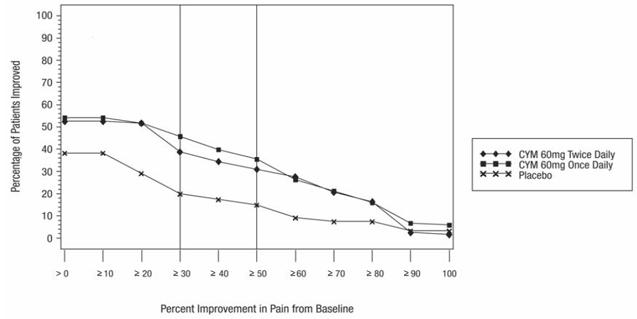
Abbildung 6: Prozentsatz der erwachsenen Fibromyalgie-Patienten, die am Studienende verschiedene Stufen der Schmerzlinderung erreichten, gemessen anhand der durchschnittlichen 24-Stunden-Schmerzstärke (Studie FM-2)
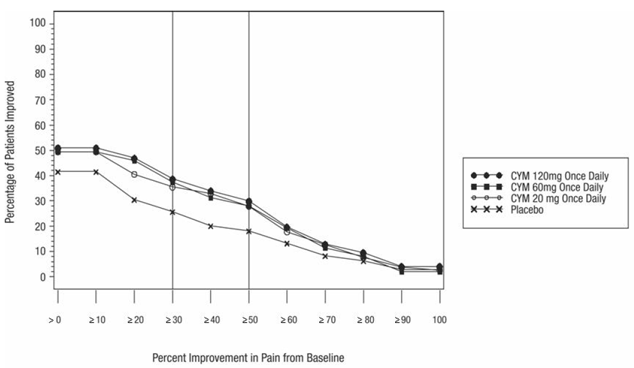
Darüber hinaus wurde der Nutzen einer Auftitration bei Patienten, die nicht auf 60 mg CYMBALTA/Tag ansprachen, in einer separaten Studie (Studie FM-3) untersucht. Erwachsene Patienten wurden anfänglich mit CYMBALTA 60 mg einmal täglich für acht Wochen offen behandelt. Anschließend wurden die Patienten, die diese Phase abgeschlossen hatten, randomisiert einer doppelblinden Behandlung mit CYMBALTA mit entweder 60 mg einmal täglich oder 120 mg einmal täglich zugeteilt. Responder wurden als Patienten definiert, die am Ende der 8-wöchigen Behandlung eine mindestens 30 %ige Reduktion des Schmerz-Scores gegenüber dem Ausgangswert aufwiesen. Bei Patienten, die nach 8 Wochen Non-Responder waren, war es nicht wahrscheinlicher, dass sie die Ansprechkriterien am Ende der 60-wöchigen Behandlung erfüllten, wenn sie blind auf CYMBALTA 120 mg titriert wurden, im Vergleich zu Patienten, die blind mit CYMBALTA 60 mg fortgeführt wurden.
Pädiatrische Studie bei Fibromyalgie
CYMBALTA wurde bei 184 pädiatrischen Patienten im Alter von 13 bis 17 Jahren mit juvenilem Fibromyalgie-Syndrom in einer 13-wöchigen, placebokontrollierten Studie (Studie FM-4) untersucht. In Studie FM-4 schlossen 149 (81 %) Patienten die Studie ab. CYMBALTA (N = 91) wurde mit einer Dosierung von 30 mg einmal täglich für eine Woche begonnen und je nach Verträglichkeit auf 60 mg einmal täglich für 12 Wochen titriert. Die mittlere Dosis für Patienten, die die 12-wöchige Behandlungsphase abschlossen, betrug 49 mg/Tag. CYMBALTA zeigte eine Verbesserung gegenüber Placebo in Bezug auf den primären Endpunkt [Veränderung vom Ausgangswert bis zum Ende der Behandlung im Brief Pain Inventory (BPI) – modifizierte Kurzform: durchschnittliche 24-Stunden-Schmerzschwerebewertung der Jugendversion] mit einem p-Wert von 0,052 aus die vorgegebene Primäranalyse und p-Werte im Bereich von 0,011 bis 0,020 aus Sensitivitätsanalysen, die fehlenden Bewertungen einiger Patienten, die die Studie aus verschiedenen Gründen nicht abgeschlossen hatten, Grundlinienwerte zuordneten. Die Patienten hatten einen Ausgangs-BPI von 5,7. Abbildung 7 zeigt für verschiedene Grade der Schmerzverbesserung vom Ausgangswert bis zum Endpunkt der Studie den Anteil der Patienten, die diesen Grad der Verbesserung in Studie FM-4 erreichten.
Abbildung 7: Prozentsatz der pädiatrischen Patienten im Alter von 13 bis 17 Jahren mit juvenilem Fibromyalgie-Syndrom, die in Woche 12 verschiedene Grade der Schmerzlinderung erreichten (Studie FM-4)a
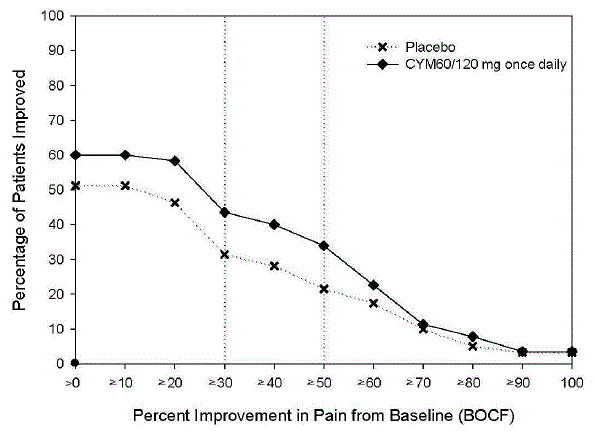
Chronischer Muskel-Skelett-Schmerz bei Erwachsenen
CYMBALTA ist angezeigt zur Behandlung von chronischen Schmerzen des Bewegungsapparates bei Erwachsenen. Dies wurde in Studien an erwachsenen Patienten mit chronischen Kreuzschmerzen und chronischen Schmerzen aufgrund von Osteoarthritis festgestellt.
Studien zu chronischen Rückenschmerzen bei Erwachsenen
Die Wirksamkeit von CYMBALTA 60 mg bei chronischen Rückenschmerzen (CLBP) bei Erwachsenen wurde in zwei doppelblinden, placebokontrollierten, randomisierten klinischen Studien mit einer Dauer von 13 Wochen (Studien CLBP-1 und CLBP-2) und einer von 12 untersucht -Wochen Dauer (CLBP-3). Die Studien CLBP-1 und CLBP-3 zeigten die Wirksamkeit von CYMBALTA bei der Behandlung von CLBP. Die Patienten in allen Studien hatten keine Anzeichen einer Radikulopathie oder Spinalkanalstenose.
Studieren Sie CLBP-1
Zweihundertsechsunddreißig erwachsene Patienten (N = 115 unter CYMBALTA 40 mg, N = 121 unter Placebo) wurden aufgenommen und 182 (77 %) beendeten die 13-wöchige Behandlungsphase. Nach 7-wöchiger Behandlung wurde bei mit CYMBALTA behandelten Patienten mit weniger als 30 % Reduktion der durchschnittlichen täglichen Schmerzen und die 60 mg einmal täglich vertragen, die CYMBALTA-Dosis doppelblind auf 120 mg einmal täglich für die erhöht Rest der Verhandlung. Die Patienten hatten eine durchschnittliche Ausgangsschmerzbewertung von 6 auf einer numerischen Bewertungsskala, die von 0 (keine Schmerzen) bis 10 (stärkste mögliche Schmerzen) reichte. Nach 13-wöchiger Behandlung zeigten Patienten, die CYMBALTA 60-120 mg täglich einnahmen, eine signifikant stärkere Schmerzlinderung im Vergleich zu Patienten, die Placebo einnahmen. Die Randomisierung wurde nach dem Ausgangsstatus der NSAR-Nutzung der Patienten stratifiziert. Subgruppenanalysen zeigten nicht, dass es Unterschiede bei den Behandlungsergebnissen in Abhängigkeit von der Anwendung von NSAIDs gab.
Studieren Sie CLBP-2
404 Patienten wurden randomisiert und erhielten feste Dosierungen von CYMBALTA 60 mg täglich oder ein passendes Placebo (N = 59 unter CYMBALTA 20 mg, N = 116 unter CYMBALTA 60 mg, N = 112 unter CYMBALTA 120 mg, N = 117 unter Placebo). und 267 (66 %) beendeten die gesamte 13-wöchige Studie. Nach 13 Behandlungswochen zeigte keine der drei Dosierungen von CYMBALTA 30 mg einen statistisch signifikanten Unterschied in der Schmerzlinderung im Vergleich zu Placebo.
Studieren Sie CLBP-3
401 Patienten wurden randomisiert und erhielten feste Dosen von CYMBALTA 60 mg täglich oder Placebo (N = 198 unter CYMBALTA 20 mg, N = 203 unter Placebo), und 303 (76 %) schlossen die Studie ab. Die Patienten hatten eine durchschnittliche Ausgangsschmerzbewertung von 6 auf einer numerischen Bewertungsskala, die von 0 (keine Schmerzen) bis 10 (stärkste mögliche Schmerzen) reichte. Nach 12-wöchiger Behandlung zeigten Patienten, die CYMBALTA 60 mg täglich einnahmen, eine signifikant stärkere Schmerzlinderung im Vergleich zu Patienten, die Placebo einnahmen.
Für verschiedene Grade der Schmerzlinderung vom Ausgangswert bis zum Studienendpunkt zeigen die Abbildungen 8 und 9 den Anteil der Patienten in den Studien CLBP-1 und CLBP-3, die jeweils diesen Grad der Verbesserung erreichten. Die Zahlen sind kumulativ, so dass Patienten, deren Veränderung zum Ausgangswert beispielsweise 50 % beträgt, bei jedem Verbesserungsgrad unter 50 % ebenfalls eingeschlossen sind. Patienten, die die Studie nicht beendeten, wurde der Wert von 0 % Verbesserung zugewiesen.
Abbildung 8: Prozentsatz der erwachsenen Patienten mit CLBP, die verschiedene Stufen der Schmerzlinderung erreichten, gemessen anhand der durchschnittlichen Schmerzstärke über 24 Stunden (Studie CLBP-1)
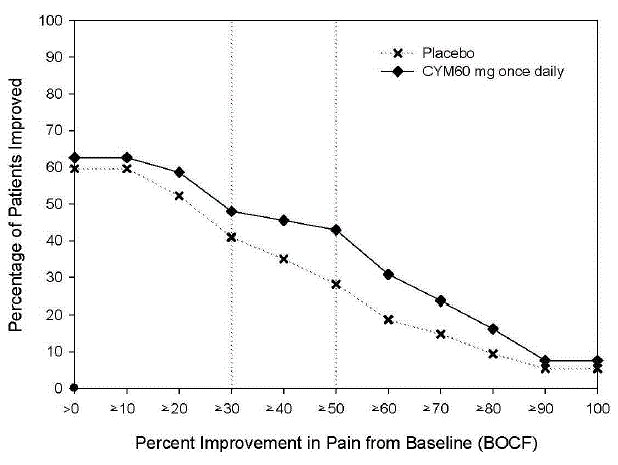
Abbildung 9: Prozentsatz der erwachsenen Patienten mit CLBP, die verschiedene Stufen der Schmerzlinderung erreichten, gemessen anhand der durchschnittlichen Schmerzstärke über 24 Stunden (Studie CLBP-3)
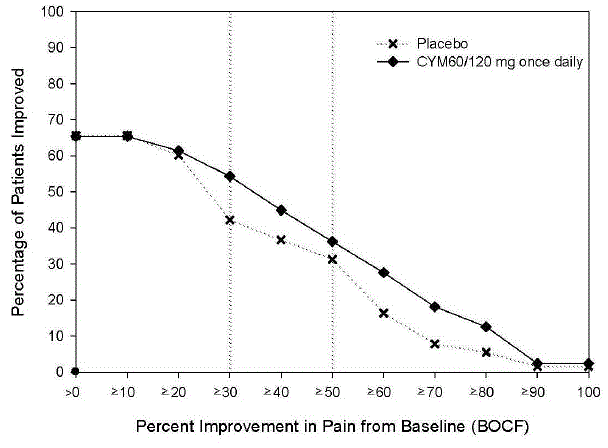
Studien zu chronischen Schmerzen aufgrund von Osteoarthritis bei Erwachsenen
Die Wirksamkeit von CYMBALTA bei chronischen Schmerzen aufgrund von Osteoarthritis (OA) bei Erwachsenen wurde in 2 doppelblinden, placebokontrollierten, randomisierten klinischen Studien mit einer Dauer von 13 Wochen (Studie OA-1 und Studie OA-2) untersucht. Alle Patienten in beiden Studien erfüllten die klinischen und röntgenologischen ACR-Kriterien für die Klassifizierung von idiopathischer Kniegelenksarthrose. Die Randomisierung wurde nach dem Ausgangsstatus der NSAIDs-Anwendung der Patienten stratifiziert.
Patienten, die CYMBALTA zugewiesen wurden, begannen die Behandlung in beiden Studien mit einer Dosis von 30 mg einmal täglich für eine Woche. Nach der ersten Woche wurde die Dosis von CYMBALTA auf 60 mg einmal täglich erhöht. Nach 7-wöchiger Behandlung mit CYMBALTA 60 mg einmal täglich wurde in Studie OA-1 bei Patienten mit suboptimalem Ansprechen auf die Behandlung (
Studieren Sie OA-1
Zweihundertsechsundfünfzig Patienten (N = 128 unter CYMBALTA 30 mg, N = 128 unter Placebo) nahmen an der Studie teil und 204 (80 %) schlossen die Studie ab. Die Patienten hatten eine durchschnittliche Ausgangsschmerzbewertung von 6 auf einer numerischen Bewertungsskala, die von 0 (keine Schmerzen) bis 10 (stärkste mögliche Schmerzen) reichte. Nach 13-wöchiger Behandlung zeigten Patienten, die CYMBALTA 20 mg einnahmen, eine signifikant stärkere Schmerzlinderung als Patienten, die Placebo einnahmen. Subgruppenanalysen zeigten nicht, dass es Unterschiede bei den Behandlungsergebnissen in Abhängigkeit von der Anwendung von NSAIDs gab.
Studieren Sie OA-2
231 Patienten (N = 111 unter CYMBALTA 30 mg, N = 120 unter Placebo) nahmen an der Studie teil und 173 (75 %) schlossen die Studie ab. Die Patienten hatten einen mittleren Ausgangsschmerz von 6 auf einer numerischen Bewertungsskala von 0 (kein Schmerz) bis 10 (stärkster möglicher Schmerz). Nach 13-wöchiger Behandlung zeigten Patienten, die CYMBALTA 20 mg einnahmen, keine signifikant stärkere Schmerzlinderung als Patienten, die Placebo einnahmen.
In Studie OA-1 zeigt Abbildung 10 für verschiedene Grade der Schmerzverbesserung vom Ausgangswert bis zum Endpunkt der Studie den Anteil der Patienten, die diesen Grad der Verbesserung erreichten. Die Zahl ist kumulativ, so dass Patienten, deren Veränderung zum Ausgangswert beispielsweise 50 % beträgt, bei jedem Verbesserungsgrad unter 50 % ebenfalls eingeschlossen sind. Patienten, die die Studie nicht beendeten, wurde der Wert von 0 % Verbesserung zugewiesen.
Abbildung 10: Prozentsatz der erwachsenen Patienten mit Arthrose, die verschiedene Stufen der Schmerzlinderung erreichten, gemessen an der durchschnittlichen 24-Stunden-Schmerzstärke (Studie OA-1)
INFORMATIONEN ZUM PATIENTEN
Cymbalta® [sim-BALL-tah] (Duloxetin-Kapseln mit verzögerter Freisetzung)
Lesen Sie diesen Medikationsleitfaden, bevor Sie mit der Einnahme von Cymbalta® beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung.
Sprechen Sie mit Ihrem Arzt über:
Was sind die wichtigsten Informationen, die ich über Antidepressiva, Depressionen, andere schwere psychische Erkrankungen und Selbstmordgedanken oder -handlungen wissen sollte?
Rufen Sie sofort Ihren Arzt an, wenn Sie eines der folgenden Symptome oder Gefühle haben, insbesondere wenn sie neu oder schlimmer sind oder Sie beunruhigen. Rufen Sie im Notfall 911 an.
Was muss ich sonst noch über Antidepressiva wissen?
Was ist Cymbalta 60 mg?
Cymbalta ist ein verschreibungspflichtiges Medikament zur Behandlung einer bestimmten Art von Depression, die Major Depression (MDD) genannt wird. Cymbalta 20 mg gehört zu einer Klasse von Arzneimitteln, die als SNRIs (Orserotonin-Noradrenalin-Wiederaufnahmehemmer) bekannt sind.
Cymbalta 60 mg wird auch verwendet zur Behandlung oder Verwaltung von:
Wer sollte Cymbalta nicht einnehmen?
Nehmen Sie Cymbalta 20 mg nicht ein, wenn Sie:
Personen, die Cymbalta 60 mg kurz vor einem MAO-Hemmer einnehmen, können ein ernstes Problem namens Serotonin-Syndrom haben (siehe „Welche Nebenwirkungen kann Cymbalta 60 mg haben?“).
Was sollte ich meinem Arzt vor der Einnahme von Cymbalta mitteilen?
Bevor Sie mit Cymbalta beginnen, informieren Sie Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen. Cymbalta und einige Arzneimittel können miteinander interagieren, möglicherweise nicht so gut wirken oder schwerwiegende Nebenwirkungen verursachen.
Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Fragen Sie Ihren Arzt nach einer Liste dieser Arzneimittel, wenn Sie sich nicht sicher sind.
Nehmen Sie Cymbalta nicht zusammen mit anderen Arzneimitteln ein, die Duloxetin enthalten.
Wie sollte ich Cymbalta 60 mg einnehmen?
Was sollte ich während der Einnahme von Cymbalta vermeiden?
Welche Nebenwirkungen kann Cymbalta haben?
Cymbalta 30 mg kann schwerwiegende Nebenwirkungen verursachen, darunter: Siehe „Was sind die wichtigsten Informationen, die ich über Cymbalta wissen sollte?“
Häufige mögliche Nebenwirkungen bei Personen, die Cymbalta 20 mg einnehmen, sind:
Symptome bei Männern können sein:
Zu den Symptomen bei Frauen können gehören:
Sprechen Sie mit Ihrem Arzt, wenn Sie während der Behandlung mit CYMBALTA irgendwelche Veränderungen Ihrer Sexualfunktion feststellen oder wenn Sie Fragen oder Bedenken zu sexuellen Problemen haben. Ihr Arzt kann Ihnen möglicherweise Behandlungen vorschlagen.
Nur einige Menschen sind für diese Probleme gefährdet. Möglicherweise möchten Sie sich einer Augenuntersuchung unterziehen, um festzustellen, ob Sie gefährdet sind, und gegebenenfalls eine vorbeugende Behandlung erhalten.
Die häufigsten Nebenwirkungen von Cymbalta 20 mg sind:
Häufige mögliche Nebenwirkungen bei Kindern und Jugendlichen, die Cymbalta 20 mg einnehmen, sind:
Nebenwirkungen bei Erwachsenen können auch bei Kindern und Jugendlichen auftreten, die Cymbalta einnehmen. Größe und Gewicht von Kindern und Jugendlichen sollten während der Behandlung überwacht werden.
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Cymbalta. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen an 1800-FDA-1088 melden.
Wie soll ich Cymbalta 40 mg aufbewahren?
Lagern Sie Cymbalta bei Raumtemperatur zwischen 20 °C und 25 °C (68 °F bis 77 °F).
Bewahren Sie Cymbalta und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von Cymbalta.
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie Cymbalta nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie Cymbalta 20 mg nicht an andere Personen weiter, selbst wenn sie die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Dieser Arzneimittelleitfaden fasst die wichtigsten Informationen zu Cymbalta zusammen. Wenn Sie weitere Informationen wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Gesundheitsdienstleister oder Apotheker um Informationen über Cymbalta bitten, die für medizinisches Fachpersonal geschrieben sind.
Weitere Informationen erhalten Sie telefonisch unter 1-800-545-5979.
Welche Inhaltsstoffe enthält Cymbalta 30 mg?
Wirkstoff: Duloxetinhydrochlorid
Inaktive Zutaten:
FD&C Blue No. 2, Gelatine, Hypromellose, Hydroxypropylmethylcelluloseacetatsuccinat, Natriumlaurylsulfat, Saccharose, Zuckerkügelchen, Talk, Titandioxid und Triethylcitrat. Die 20- und 60-mg-Kapseln enthalten außerdem gelbes Eisenoxid.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.