Zyprexa 2.5mg, 5mg, 7.5mg, 10mg, 15mg, 20mg Olanzapine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Zyprexa 10 mg und wie wird es angewendet?
Zyprexa ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Schizophrenie und bipolarer Störung (manische Depression). Zyprexa kann allein oder mit anderen Medikamenten verwendet werden.
Welche Nebenwirkungen kann Zyprexa 15mg haben?
Zyprexa kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Zyprexa gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Zyprexa. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
ERHÖHTE STERBLICHKEIT BEI ÄLTEREN PATIENTEN MIT PSYCHOSE IM ZUSAMMENHANG MIT DEMENZ
Ältere Patienten mit demenzbedingter Psychose, die mit Antipsychotika behandelt werden, haben ein erhöhtes Sterberisiko. Analysen von siebzehn placebokontrollierten Studien (modale Dauer von 10 Wochen), hauptsächlich bei Patienten, die atypische Antipsychotika einnahmen, ergaben ein Todesrisiko bei mit Arzneimitteln behandelten Patienten, das zwischen dem 1,6- und 1,7-fachen des Todesrisikos bei mit Placebo behandelten Patienten lag. Im Verlauf einer typischen 10-wöchigen kontrollierten Studie betrug die Todesrate bei mit Arzneimitteln behandelten Patienten etwa 4,5 %, verglichen mit einer Rate von etwa 2,6 % in der Placebogruppe. Obwohl die Todesursachen unterschiedlich waren, schienen die meisten Todesfälle entweder kardiovaskulärer (z. B. Herzinsuffizienz, plötzlicher Tod) oder infektiöser (z. B. Lungenentzündung) Natur zu sein. Beobachtungsstudien deuten darauf hin, dass die Behandlung mit konventionellen Antipsychotika, ähnlich wie bei atypischen Antipsychotika, die Sterblichkeit erhöhen kann. Inwieweit die Befunde einer erhöhten Sterblichkeit in Beobachtungsstudien auf das Antipsychotikum im Gegensatz zu einigen Merkmalen der Patienten zurückgeführt werden können, ist nicht klar. ZYPREXA (Olanzapin) ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und INFORMATIONEN ZUM PATIENTEN ].
Wenn Sie ZYPREXA 15 mg und Fluoxetin in Kombination verwenden, lesen Sie auch den Abschnitt Warnhinweise in der Packungsbeilage von Symbyax.
BEZEICHNUNG
ZYPREXA (Olanzapin) ist ein atypisches Antipsychotikum, das zur Klasse der Thienobenzodiazepine gehört. Die chemische Bezeichnung lautet 2-Methyl-4-(4-methyl-1-piperazinyl)-10H-thieno[2,3-b][1,5]benzodiazepin. Die Summenformel lautet C17H20N4S, was einem Molekulargewicht von 312,44 entspricht. Die chemische Struktur ist:
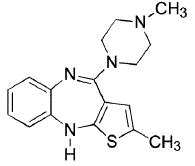
Olanzapin ist ein gelber kristalliner Feststoff, der in Wasser praktisch unlöslich ist.
ZYPREXA 7,5 mg Tabletten sind nur zur oralen Verabreichung bestimmt.
Jede Tablette enthält Olanzapin entsprechend 2,5 mg (8 μmol), 5 mg (16 μmol), 7,5 mg (24 μmol), 10 mg (32 μmol), 15 mg (48 μmol) oder 20 mg (64 μmol). Inaktive Inhaltsstoffe sind Carnaubawachs, Crospovidon, Hydroxypropylcellulose, Hypromellose, Lactose, Magnesiumstearat, mikrokristalline Cellulose und andere inaktive Inhaltsstoffe. Die Farbbeschichtung enthält Titandioxid (alle Stärken), FD&C Blue No. 2 Aluminium Lake (15 mg) oder Synthetic Red Iron Oxide (20 mg). Die 2,5-, 5-, 7,5- und 10-mg-Tabletten sind mit essbarer Tinte bedruckt, die FD&C Blue No. 2 Aluminium Lake enthält.
ZYPREXA 2,5 mg ZYDIS (Olanzapin-Tabletten zum Einnehmen) ist nur zur oralen Verabreichung bestimmt.
Jede im Mund zerfallende Tablette enthält Olanzapin entsprechend 5 mg (16 μmol), 10 mg (32 μmol), 15 mg (48 μmol) oder 20 mg (64 μmol). Es beginnt innerhalb von Sekunden im Mund zu zerfallen, sodass sein Inhalt anschließend mit oder ohne Flüssigkeit geschluckt werden kann. ZYPREXA 15 mg ZYDIS (Olanzapin-Tabletten zum Einnehmen) enthält außerdem die folgenden Hilfsstoffe: Gelatine, Mannit, Aspartam, Natriummethylparaben und Natriumpropylparaben.
ZYPREXA 2,5 mg intramuskulär (Olanzapin zur Injektion) ist nur zur intramuskulären Anwendung bestimmt.
Jede Durchstechflasche dient zur Verabreichung von 10 mg (32 μmol) Olanzapin mit den sonstigen Bestandteilen 50 mg Lactose-Monohydrat und 3,5 mg Weinsäure. Salzsäure und/oder Natriumhydroxid können während der Herstellung hinzugefügt worden sein, um den pH-Wert einzustellen.
INDIKATIONEN
Schizophrenie
Orales ZYPREXA ist angezeigt zur Behandlung von Schizophrenie. Die Wirksamkeit wurde in drei klinischen Studien bei erwachsenen Patienten mit Schizophrenie nachgewiesen: zwei 6-wöchige Studien und eine Erhaltungsstudie. Bei jugendlichen Patienten mit Schizophrenie (Alter 13-17) wurde die Wirksamkeit in einer 6-wöchigen Studie nachgewiesen [siehe Klinische Studien ].
Bei der Entscheidung zwischen den für Jugendliche verfügbaren alternativen Behandlungen sollten Ärzte das erhöhte Potenzial (bei Jugendlichen im Vergleich zu Erwachsenen) für Gewichtszunahme und Dyslipidämie berücksichtigen. Ärzte sollten bei der Verschreibung an Jugendliche die potenziellen Langzeitrisiken berücksichtigen, und in vielen Fällen kann dies dazu führen, dass sie erwägen, Jugendlichen zuerst andere Arzneimittel zu verschreiben [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Bipolar-I-Störung (manische oder gemischte Episoden)
Monotherapie
Oral verabreichtes ZYPREXA ist zur akuten Behandlung von manischen oder gemischten Episoden im Zusammenhang mit einer Bipolar-I-Störung und zur Erhaltungstherapie einer Bipolar-I-Störung indiziert. Die Wirksamkeit wurde in drei klinischen Studien bei erwachsenen Patienten mit manischen oder gemischten Episoden einer Bipolar-I-Störung nachgewiesen: zwei 3- bis 4-wöchige Studien und eine Monotherapie-Erhaltungsstudie. Bei jugendlichen Patienten mit manischen oder gemischten Episoden im Zusammenhang mit einer Bipolar-I-Störung (Alter 13–17) wurde die Wirksamkeit in einer 3-wöchigen Studie nachgewiesen [siehe Klinische Studien ].
Bei der Entscheidung zwischen den für Jugendliche verfügbaren alternativen Behandlungen sollten Ärzte das erhöhte Potenzial (bei Jugendlichen im Vergleich zu Erwachsenen) für Gewichtszunahme und Dyslipidämie berücksichtigen. Ärzte sollten bei der Verschreibung an Jugendliche die potenziellen Langzeitrisiken berücksichtigen, und in vielen Fällen kann dies dazu führen, dass sie erwägen, Jugendlichen zuerst andere Arzneimittel zu verschreiben [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Zusatztherapie zu Lithium oder Valproat
Orales ZYPREXA 5 mg ist zur Behandlung von manischen oder gemischten Episoden im Zusammenhang mit einer Bipolar-I-Störung als Ergänzung zu Lithium oder Valproat indiziert. Die Wirksamkeit wurde in zwei 6-wöchigen klinischen Studien mit Erwachsenen nachgewiesen. Die Wirksamkeit einer Begleittherapie zur längerfristigen Anwendung wurde nicht systematisch in kontrollierten Studien untersucht [vgl Klinische Studien ].
Besondere Überlegungen bei der Behandlung von pädiatrischer Schizophrenie und Bipolar-I-Störung
Pädiatrische Schizophrenie und Bipolar-I-Störung sind schwere psychische Störungen; Die Diagnose kann jedoch schwierig sein. Bei der pädiatrischen Schizophrenie können die Symptomprofile unterschiedlich sein, und bei der Bipolar-I-Störung können pädiatrische Patienten unterschiedliche Muster der Periodizität von manischen oder gemischten Symptomen aufweisen. Es wird empfohlen, eine medikamentöse Therapie bei pädiatrischer Schizophrenie und Bipolar-I-Störung erst nach gründlicher diagnostischer Abklärung und sorgfältiger Abwägung der mit der medikamentösen Behandlung verbundenen Risiken einzuleiten. Die medikamentöse Behandlung sowohl der pädiatrischen Schizophrenie als auch der Bipolar-I-Störung sollte Teil eines Gesamtbehandlungsprogramms sein, das häufig psychologische, pädagogische und soziale Interventionen umfasst.
ZYPREXA 15 mg intramuskulär: Unruhe im Zusammenhang mit Schizophrenie und bipolarer I-Manie
ZYPREXA 15 mg IntraMuscular ist angezeigt zur Behandlung von akuter Erregung im Zusammenhang mit Schizophrenie und Bipolar-I-Manie.
Die Wirksamkeit wurde in 3 placebokontrollierten Kurzzeitstudien (24 Stunden IM-Behandlung) bei unruhigen erwachsenen stationären Patienten mit Schizophrenie oder Bipolar-I-Störung (manische oder gemischte Episoden) nachgewiesen [siehe Klinische Studien ].
„Psychomotorische Erregung“ wird im DSM-IV als „übermäßige motorische Aktivität verbunden mit einem Gefühl innerer Anspannung“ definiert. Patienten, die unter Agitiertheit leiden, zeigen oft Verhaltensweisen, die ihre Diagnose und Versorgung beeinträchtigen, z. B. bedrohliches Verhalten, eskalierendes oder dringend belastendes Verhalten oder selbsterschöpfendes Verhalten, was Kliniker dazu veranlasst, intramuskuläre Antipsychotika zu verwenden, um eine sofortige Kontrolle der Agitiertheit zu erreichen.
ZYPREXA und Fluoxetin in Kombination: Depressive Episoden im Zusammenhang mit Bipolar-I-Störung
Basierend auf klinischen Studien ist die orale Kombination von ZYPREXA und Fluoxetin zur Behandlung von depressiven Episoden im Zusammenhang mit einer Bipolar-I-Störung indiziert. Wenn Sie ZYPREXA 10 mg und Fluoxetin in Kombination anwenden, lesen Sie den Abschnitt „Klinische Studien“ der Packungsbeilage für Symbyax.
ZYPREXA-Monotherapie ist nicht angezeigt zur Behandlung depressiver Episoden im Zusammenhang mit einer Bipolar-I-Störung.
ZYPREXA und Fluoxetin in Kombination: Behandlungsresistente Depression
Basierend auf klinischen Studien bei erwachsenen Patienten ist die orale Einnahme von ZYPREXA und Fluoxetin in Kombination zur Behandlung von behandlungsresistenter Depression (schwere depressive Störung bei Patienten, die in der aktuellen Episode nicht auf 2 separate Studien mit unterschiedlichen Antidepressiva in angemessener Dosis und Dauer ansprechen) indiziert . Wenn Sie ZYPREXA und Fluoxetin in Kombination anwenden, lesen Sie den Abschnitt „Klinische Studien“ der Packungsbeilage für Symbyax.
ZYPREXA 5 mg Monotherapie ist nicht angezeigt zur Behandlung von behandlungsresistenter Depression.
DOSIERUNG UND ANWENDUNG
Schizophrenie
Erwachsene
Dosisauswahl
Orales Olanzapin sollte einmal täglich unabhängig von den Mahlzeiten verabreicht werden, im Allgemeinen beginnend mit 5 bis 10 mg anfänglich, mit einer Zieldosis von 10 mg/Tag innerhalb einiger Tage. Weitere Dosisanpassungen sollten, falls angezeigt, im Allgemeinen in Abständen von mindestens 1 Woche erfolgen, da der Steady State für Olanzapin bei einem typischen Patienten erst nach etwa 1 Woche erreicht wird. Wenn Dosisanpassungen erforderlich sind, werden Dosiserhöhungen/-verringerungen von 5 mg QD empfohlen.
Die Wirksamkeit bei Schizophrenie wurde in klinischen Studien in einem Dosisbereich von 10 bis 15 mg/Tag nachgewiesen. Dosen über 10 mg/Tag erwiesen sich jedoch nicht als wirksamer als die 10-mg/Tag-Dosis. Eine Erhöhung auf eine Dosis über der Zieldosis von 10 mg/Tag (dh auf eine Dosis von 15 mg/Tag oder mehr) wird nur nach klinischer Beurteilung empfohlen. Olanzapin ist nicht zur Anwendung in Dosen über 20 mg/Tag angezeigt.
Dosierung bei speziellen Populationen
Die empfohlene Anfangsdosis beträgt 5 mg bei Patienten, die geschwächt sind, die eine Prädisposition für hypotensive Reaktionen haben, die ansonsten eine Kombination von Faktoren aufweisen, die zu einer verlangsamten Metabolisierung von Olanzapin führen können (z. B. nicht rauchende weibliche Patienten im Alter von ≥ 65 Jahren) oder die möglicherweise pharmakodynamisch empfindlicher auf Olanzapin reagieren [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , und KLINISCHE PHARMAKOLOGIE ]. Wenn angezeigt, sollte eine Dosissteigerung bei diesen Patienten mit Vorsicht durchgeführt werden.
Erhaltungsbehandlung
Die Wirksamkeit von oralem Olanzapin, 10 mg/Tag bis 20 mg/Tag, bei der Aufrechterhaltung des Ansprechens auf die Behandlung bei schizophrenen Patienten, die etwa 8 Wochen lang unter ZYPREXA stabil waren und dann auf einen Rückfall hin beobachtet wurden, wurde in einer Placebo-kontrollierten Studie nachgewiesen [siehe Klinische Studien ]. Der Gesundheitsdienstleister, der sich für die Anwendung von ZYPREXA über einen längeren Zeitraum entscheidet, sollte den langfristigen Nutzen des Arzneimittels für den einzelnen Patienten regelmäßig neu bewerten.
Jugendliche
Dosisauswahl
Orales Olanzapin sollte einmal täglich unabhängig von den Mahlzeiten mit einer empfohlenen Anfangsdosis von 2,5 oder 5 mg und einer Zieldosis von 10 mg/Tag verabreicht werden. Die Wirksamkeit bei Jugendlichen mit Schizophrenie wurde basierend auf einem flexiblen Dosisbereich von 2,5 bis 20 mg/Tag in klinischen Studien mit einer mittleren modalen Dosis von 12,5 mg/Tag (mittlere Dosis von 11,1 mg/Tag) nachgewiesen. Wenn Dosisanpassungen erforderlich sind, werden Dosiserhöhungen/-verringerungen von 2,5 oder 5 mg empfohlen.
Die Sicherheit und Wirksamkeit von Dosen über 20 mg/Tag wurden nicht in klinischen Studien untersucht [siehe Klinische Studien ].
Erhaltungsbehandlung
Die Wirksamkeit von ZYPREXA zur Erhaltungstherapie der Schizophrenie bei Jugendlichen wurde nicht systematisch untersucht; die Erhaltungswirksamkeit kann jedoch aus Daten von Erwachsenen zusammen mit Vergleichen der pharmakokinetischen Parameter von Olanzapin bei erwachsenen und jugendlichen Patienten extrapoliert werden. Daher wird im Allgemeinen empfohlen, dass Patienten, die auf das Ansprechen ansprechen, über das akute Ansprechen hinaus fortgesetzt werden, jedoch mit der niedrigsten Dosis, die erforderlich ist, um eine Remission aufrechtzuerhalten. Die Patienten sollten regelmäßig neu untersucht werden, um die Notwendigkeit einer Erhaltungstherapie zu bestimmen.
Bipolar-I-Störung (manische oder gemischte Episoden)
Erwachsene
Dosisauswahl für die Monotherapie
Orales Olanzapin sollte einmal täglich unabhängig von den Mahlzeiten verabreicht werden, im Allgemeinen beginnend mit 10 oder 15 mg. Dosisanpassungen sollten, falls angezeigt, im Allgemeinen in Abständen von nicht weniger als 24 Stunden erfolgen, entsprechend den Verfahren in den Placebo-kontrollierten Studien. Wenn Dosisanpassungen erforderlich sind, werden Dosiserhöhungen/-verringerungen von 5 mg QD empfohlen.
Kurzfristige (3-4 Wochen) antimanische Wirksamkeit wurde in klinischen Studien in einem Dosisbereich von 5 mg bis 20 mg/Tag gezeigt. Die Sicherheit von Dosen über 20 mg/Tag wurde nicht in klinischen Studien untersucht [siehe Klinische Studien ].
Erhaltungsmonotherapie
Der Vorteil der Aufrechterhaltung einer Monotherapie bei Bipolar-I-Patienten mit oralem ZYPREXA 10 mg in einer Dosis von 5 bis 20 mg/Tag nach Erreichen eines Responder-Status für eine durchschnittliche Dauer von 2 Wochen wurde in einer kontrollierten Studie nachgewiesen [siehe Klinische Studien ]. Der Gesundheitsdienstleister, der sich für die Anwendung von ZYPREXA über einen längeren Zeitraum entscheidet, sollte den langfristigen Nutzen des Arzneimittels für den einzelnen Patienten regelmäßig neu bewerten.
Dosisauswahl für die Zusatzbehandlung
Bei Verabreichung als Zusatzbehandlung zu Lithium oder Valproat sollte die orale Olanzapin-Dosierung im Allgemeinen mit 10 mg einmal täglich unabhängig von den Mahlzeiten beginnen.
Die antimanische Wirksamkeit wurde in klinischen Studien in einem Dosisbereich von 5 mg bis 20 mg/Tag nachgewiesen [vgl Klinische Studien ]. Die Sicherheit von Dosen über 20 mg/Tag wurde nicht in klinischen Studien untersucht.
Jugendliche
Dosisauswahl
Orales Olanzapin sollte einmal täglich unabhängig von den Mahlzeiten mit einer empfohlenen Anfangsdosis von 2,5 oder 5 mg und einer Zieldosis von 10 mg/Tag verabreicht werden. Die Wirksamkeit bei Jugendlichen mit Bipolar-I-Störung (manische oder gemischte Episoden) wurde basierend auf einem flexiblen Dosisbereich von 2,5 bis 20 mg/Tag in klinischen Studien mit einer mittleren modalen Dosis von 10,7 mg/Tag (mittlere Dosis von 8,9 mg/Tag) nachgewiesen ). Wenn Dosisanpassungen erforderlich sind, werden Dosiserhöhungen/-verringerungen von 2,5 oder 5 mg empfohlen.
Die Sicherheit und Wirksamkeit von Dosen über 20 mg/Tag wurden nicht in klinischen Studien untersucht [siehe Klinische Studien ].
Erhaltungsbehandlung
Die Wirksamkeit von ZYPREXA 7,5 mg zur Erhaltungstherapie der Bipolar-I-Störung bei Jugendlichen wurde nicht untersucht; die Erhaltungswirksamkeit kann jedoch aus Daten von Erwachsenen zusammen mit Vergleichen der pharmakokinetischen Parameter von Olanzapin bei erwachsenen und jugendlichen Patienten extrapoliert werden. Daher wird im Allgemeinen empfohlen, dass Patienten, die auf das Ansprechen ansprechen, über das akute Ansprechen hinaus fortgesetzt werden, jedoch mit der niedrigsten Dosis, die erforderlich ist, um eine Remission aufrechtzuerhalten. Die Patienten sollten regelmäßig neu untersucht werden, um die Notwendigkeit einer Erhaltungstherapie zu bestimmen.
Verabreichung von ZYPREXA ZYDIS (Olanzapin im Mund auflösende Tabletten)
Ziehen Sie nach dem Öffnen des Beutels die Rückseite der Blisterpackung ab. Drücken Sie die Tablette nicht durch die Folie. Unmittelbar nach dem Öffnen der Blisterpackung mit trockenen Händen die Tablette entnehmen und das gesamte ZYPREXA 15 mg ZYDIS in den Mund nehmen. Die Tablette zerfällt schnell im Speichel, sodass sie leicht mit oder ohne Flüssigkeit geschluckt werden kann.
ZYPREXA intramuskulär: Unruhe im Zusammenhang mit Schizophrenie und bipolarer Manie
Dosisauswahl für unruhige erwachsene Patienten mit Schizophrenie und Bipolar-I-Manie
Die Wirksamkeit von intramuskulärem Olanzapin zur Injektion bei der Kontrolle der Unruhe bei diesen Erkrankungen wurde in einem Dosisbereich von 2,5 mg bis 10 mg nachgewiesen. Die empfohlene Dosis bei diesen Patienten beträgt 10 mg. Eine niedrigere Dosis von 5 oder 7,5 mg kann in Betracht gezogen werden, wenn klinische Faktoren dies rechtfertigen [siehe Klinische Studien ]. Wenn die Erregung nach der Anfangsdosis anhält und zusätzliche intramuskuläre Dosen erfordert, können Folgedosen von bis zu 10 mg gegeben werden. Die Wirksamkeit wiederholter intramuskulärer Olanzapin-Injektionsdosen bei unruhigen Patienten wurde jedoch nicht systematisch in kontrollierten klinischen Studien untersucht. Auch die Sicherheit von Tagesgesamtdosen von mehr als 30 mg oder 10-mg-Injektionen, die häufiger als 2 Stunden nach der Anfangsdosis und 4 Stunden nach der zweiten Dosis verabreicht wurden, wurde nicht in klinischen Studien untersucht. Die maximale Dosierung von intramuskulärem Olanzapin (z. B. 3 Dosen von 10 mg, verabreicht im Abstand von 2–4 Stunden) kann mit einem erheblichen Auftreten einer signifikanten orthostatischen Hypotonie verbunden sein [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Daher wird empfohlen, dass Patienten, die nachfolgende intramuskuläre Injektionen benötigen, vor der Verabreichung jeglicher nachfolgender Dosen von intramuskulärem Olanzapin zur Injektion auf orthostatische Hypotonie untersucht werden. Die Verabreichung einer zusätzlichen Dosis an einen Patienten mit einer klinisch signifikanten posturalen Veränderung des systolischen Blutdrucks wird nicht empfohlen.
Wenn eine laufende Olanzapin-Therapie klinisch indiziert ist, kann eine orale Olanzapin-Gabe in einem Bereich von 5–20 mg/Tag eingeleitet werden, sobald dies klinisch angemessen ist [siehe Schizophrenie und Bipolar-I-Störung (manische oder gemischte Episoden) ].
Intramuskuläre Dosierung bei speziellen Populationen
Bei geriatrischen Patienten oder wenn andere klinische Faktoren dies rechtfertigen, sollte eine Dosis von 5 mg/Injektion in Betracht gezogen werden. Eine niedrigere Dosis von 2,5 mg/Injektion sollte für Patienten in Betracht gezogen werden, die andernfalls geschwächt sein könnten, für hypotensive Reaktionen prädisponiert sind oder pharmakodynamisch empfindlicher auf Olanzapin reagieren [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , und KLINISCHE PHARMAKOLOGIE ].
Verabreichung von ZYPREXA intramuskulär
ZYPREXA Intra Muscular ist nur zur intramuskulären Anwendung bestimmt. Nicht intravenös oder subkutan verabreichen. Injizieren Sie langsam und tief in die Muskelmasse. Parenterale Arzneimittel sollten vor der Verabreichung visuell auf Partikel und Verfärbungen untersucht werden, sofern Lösung und Behältnis dies zulassen.
Anleitung zur Zubereitung von ZYPREXA 2,5 mg intramuskulär mit sterilem Wasser zur Injektion
Lösen Sie den Inhalt der Durchstechflasche mit 2,1 ml sterilem Wasser für Injektionszwecke auf, um eine Lösung zu erhalten, die etwa 5 mg/ml Olanzapin enthält. Die resultierende Lösung sollte klar und gelb erscheinen. ZYPREXA 7,5 mg intramuskulär, rekonstituiert mit sterilem Wasser für Injektionszwecke, sollte sofort (innerhalb von 1 Stunde) nach der Rekonstitution verwendet werden. Verwerfen Sie alle nicht verwendeten Teile.
Die folgende Tabelle enthält Injektionsvolumina zur Verabreichung verschiedener Dosen von intramuskulärem Olanzapin zur Injektion, rekonstituiert mit sterilem Wasser für Injektionszwecke.
Informationen zur physikalischen Inkompatibilität
ZYPREXA 15 mg intramuskulär sollte nur mit sterilem Wasser für Injektionszwecke rekonstituiert werden. ZYPREXA 20 mg intramuskulär sollte nicht mit einer Diazepam-Injektion in einer Spritze kombiniert werden, da es beim Mischen dieser Produkte zu Ausfällungen kommt. Die Lorazepam-Injektion sollte nicht zur Rekonstitution von ZYPREXA IntraMuscular verwendet werden, da diese Kombination zu einer verzögerten Rekonstitutionszeit führt. ZYPREXA IntraMuscular sollte nicht mit einer Haloperidol-Injektion in einer Spritze kombiniert werden, da sich gezeigt hat, dass der resultierende niedrige pH-Wert Olanzapin im Laufe der Zeit abbaut.
ZYPREXA 20 mg und Fluoxetin in Kombination: Depressive Episoden im Zusammenhang mit Bipolar-I-Störung
Wenn Sie ZYPREXA 7,5 mg und Fluoxetin in Kombination anwenden, lesen Sie auch den Abschnitt „Klinische Studien“ der Packungsbeilage für Symbyax.
Erwachsene
Orales Olanzapin sollte in Kombination mit Fluoxetin einmal täglich abends unabhängig von den Mahlzeiten verabreicht werden, im Allgemeinen beginnend mit 5 mg oralem Olanzapin und 20 mg Fluoxetin. Dosisanpassungen können, falls angezeigt, je nach Wirksamkeit und Verträglichkeit innerhalb der Dosisbereiche von oralem Olanzapin 5 bis 12,5 mg und Fluoxetin 20 bis 50 mg vorgenommen werden. Die antidepressive Wirksamkeit wurde mit ZYPREXA 10 mg und Fluoxetin in Kombination bei erwachsenen Patienten mit einem Dosisbereich von 6 bis 12 mg Olanzapin und 25 bis 50 mg Fluoxetin nachgewiesen. Die Sicherheit der gleichzeitigen Anwendung von Dosen über 18 mg Olanzapin mit 75 mg Fluoxetin wurde nicht in klinischen Studien untersucht.
Kinder und Jugendliche (10-17 Jahre)
Orales Olanzapin sollte in Kombination mit Fluoxetin einmal täglich abends unabhängig von den Mahlzeiten verabreicht werden, im Allgemeinen beginnend mit 2,5 mg oralem Olanzapin und 20 mg Fluoxetin. Dosisanpassungen können, falls angezeigt, je nach Wirksamkeit und Verträglichkeit vorgenommen werden. Die Sicherheit der gleichzeitigen Anwendung von Dosen über 12 mg Olanzapin mit 50 mg Fluoxetin wurde in pädiatrischen klinischen Studien nicht untersucht.
Die Sicherheit und Wirksamkeit von ZYPREXA und Fluoxetin in Kombination wurde in klinischen Studien untersucht, die die Zulassung von Symbyax (fest dosierte Kombination von ZYPREXA und Fluoxetin) unterstützten. Symbyax wird zwischen 3 mg/25 mg (Olanzapin/Fluoxetin) pro Tag und 12 mg/50 mg (Olanzapin/Fluoxetin) pro Tag dosiert. Die folgende Tabelle zeigt die geeigneten Dosierungen der einzelnen Komponenten von ZYPREXA 10 mg und Fluoxetin im Vergleich zu Symbyax. Dosierungsanpassungen, falls angezeigt, sollten bei den einzelnen Komponenten je nach Wirksamkeit und Verträglichkeit vorgenommen werden.
Obwohl es keine Evidenz zur Beantwortung der Frage gibt, wie lange ein mit ZYPREXA und Fluoxetin in Kombination behandelter Patient darauf bleiben sollte, ist es allgemein anerkannt, dass die Bipolar-I-Störung, einschließlich der mit der Bipolar-I-Störung verbundenen depressiven Episoden, chronisch ist Krankheit, die einer chronischen Behandlung bedarf. Der Gesundheitsdienstleister sollte die Notwendigkeit einer Fortsetzung der Pharmakotherapie regelmäßig überprüfen.
ZYPREXA 5 mg als Monotherapie ist nicht angezeigt zur Behandlung von depressiven Episoden im Zusammenhang mit einer Bipolar-I-Störung.
ZYPREXA 7,5 mg und Fluoxetin in Kombination: Behandlungsresistente Depression
Wenn Sie ZYPREXA und Fluoxetin in Kombination anwenden, lesen Sie auch den Abschnitt „Klinische Studien“ der Packungsbeilage für Symbyax.
Orales Olanzapin sollte in Kombination mit Fluoxetin einmal täglich abends unabhängig von den Mahlzeiten verabreicht werden, im Allgemeinen beginnend mit 5 mg oralem Olanzapin und 20 mg Fluoxetin. Dosisanpassungen können, falls angezeigt, je nach Wirksamkeit und Verträglichkeit innerhalb von Dosisbereichen von oralem Olanzapin 5 bis 20 mg und Fluoxetin 20 bis 50 mg vorgenommen werden. Die antidepressive Wirksamkeit wurde mit Olanzapin und Fluoxetin in Kombination bei erwachsenen Patienten mit einem Dosisbereich von 6 bis 18 mg Olanzapin und 25 bis 50 mg Fluoxetin nachgewiesen.
Die Sicherheit und Wirksamkeit von Olanzapin in Kombination mit Fluoxetin wurde in klinischen Studien untersucht, die die Zulassung von Symbyax (fest dosierte Kombination von Olanzapin und Fluoxetin) unterstützten. Symbyax wird zwischen 3 mg/25 mg (Olanzapin/Fluoxetin) pro Tag und 12 mg/50 mg (Olanzapin/Fluoxetin) pro Tag dosiert. Die obige Tabelle 1 zeigt die geeigneten Dosierungen der einzelnen Komponenten von ZYPREXA und Fluoxetin im Vergleich zu Symbyax. Dosierungsanpassungen, falls angezeigt, sollten bei den einzelnen Komponenten je nach Wirksamkeit und Verträglichkeit vorgenommen werden.
Obwohl es keine Beweise gibt, um die Frage zu beantworten, wie lange ein mit ZYPREXA und Fluoxetin in Kombination behandelter Patient darauf bleiben sollte, ist es allgemein anerkannt, dass eine behandlungsresistente Depression (schwere depressive Störung bei erwachsenen Patienten, die nicht auf 2 separate Studien mit verschiedenen Antidepressiva in angemessener Dosis und Dauer in der aktuellen Episode) ist eine chronische Krankheit, die einer chronischen Behandlung bedarf. Der Gesundheitsdienstleister sollte die Notwendigkeit einer Fortsetzung der Pharmakotherapie regelmäßig überprüfen.
Die Sicherheit der gleichzeitigen Anwendung von Dosen über 18 mg Olanzapin mit 75 mg Fluoxetin wurde nicht in klinischen Studien untersucht.
ZYPREXA 7,5 mg Monotherapie ist nicht indiziert zur Behandlung von behandlungsresistenter Depression (schwere depressive Störung bei Patienten, die in der aktuellen Episode nicht auf 2 Antidepressiva in angemessener Dosis und Dauer ansprechen).
ZYPREXA 10 mg und Fluoxetin in Kombination: Dosierung bei speziellen Patientengruppen
Die Anfangsdosis von oralem Olanzapin 2,5-5 mg mit Fluoxetin 20 mg sollte bei Patienten mit einer Prädisposition für hypotensive Reaktionen, Patienten mit eingeschränkter Leberfunktion oder Patienten angewendet werden, die eine Kombination von Faktoren aufweisen, die den Metabolismus von Olanzapin oder Fluoxetin in Kombination verlangsamen können (weibliches Geschlecht, geriatrisches Alter, Nichtraucherstatus) oder Patienten, die möglicherweise pharmakodynamisch empfindlich auf Olanzapin reagieren. Bei Patienten mit einer Kombination von Faktoren, die den Stoffwechsel verlangsamen können, kann eine Dosisanpassung erforderlich sein. Wenn angezeigt, sollte eine Dosissteigerung bei diesen Patienten mit Vorsicht durchgeführt werden. ZYPREXA und Fluoxetin in Kombination wurden bei Patienten über 65 Jahren oder bei Patienten unter 10 Jahren nicht systematisch untersucht [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , und KLINISCHE PHARMAKOLOGIE ].
WIE GELIEFERT
Darreichungsformen und Stärken
Die ZYPREXA 2,5 mg, 5 mg, 7,5 mg und 10 mg Tabletten sind weiß, rund und mit blauer Tinte mit LILLY und der Tablettennummer bedruckt. Die 15-mg-Tabletten sind elliptisch, blau und mit der Prägung LILLY und der Tablettennummer versehen. Die 20-mg-Tabletten sind elliptisch, rosa und mit der Prägung LILLY und der Tablettennummer versehen. Tabletten werden nicht eingekerbt. Die Tabletten sind wie folgt erhältlich:
ZYPREXA 10mg ZYDIS (Olanzapin-Tabletten zum Einnehmen) sind gelb, rund und mit der Prägung der Tablettenstärke versehen. Tabletten werden nicht eingekerbt. Die Tabletten sind wie folgt erhältlich:
ZYPREXA 15 mg intramuskulär ist in 10-mg-Fläschchen (1s) erhältlich.
Die ZYPREXA 2,5 mg, 5 mg, 7,5 mg und 10 mg Tabletten sind weiß, rund und mit blauer Tinte mit LILLY und der Tablettennummer bedruckt. Die 15-mg-Tabletten sind elliptisch, blau und mit der Prägung LILLY und der Tablettennummer versehen. Die 20-mg-Tabletten sind elliptisch, rosa und mit der Prägung LILLY und der Tablettennummer versehen. Die Tabletten sind wie folgt erhältlich:
ZYPREXA 2,5 mg ZYDIS (Olanzapin-Tabletten zum Einnehmen) sind gelb, rund und mit der Prägung der Tablettenstärke versehen. Die Tabletten sind wie folgt erhältlich:
ZYPREXA intramuskulär ist erhältlich in:
NDC 0002-7597-01 (Nr. VL7597) – 10 mg Fläschchen (1s)
Lagerung und Handhabung
Lagern Sie ZYPREXA-Tabletten, ZYPREXA ZYDIS und ZYPREXA IntraMuscular-Durchstechflaschen (vor der Rekonstitution) bei kontrollierter Raumtemperatur, 20 °C bis 25 °C (68 °F bis 77 °F) [siehe USP ]. Rekonstituiertes ZYPREXA 20 mg IntraMuscular kann bei kontrollierter Raumtemperatur von 20 °C bis 25 °C (68 °F bis 77 °F) gelagert werden [siehe USP für bis zu 1 Stunde, falls erforderlich. Verwerfen Sie alle nicht verwendeten Portionen des rekonstituierten ZYPREXA IntraMuscular. Die USP definiert kontrollierte Raumtemperatur als eine thermostatisch aufrechterhaltene Temperatur, die die übliche und übliche Arbeitsumgebung von 20° bis 25°C (68° bis 77°F) umfasst; die zu einer berechneten mittleren kinetischen Temperatur von höchstens 25 °C führt; und das ermöglicht Abweichungen zwischen 15 ° und 30 ° C (59 ° und 86 ° F), die in Apotheken, Krankenhäusern und Lagern erlebt werden.
Schützen Sie ZYPREXA Tabletten und ZYPREXA ZYDIS vor Licht und Feuchtigkeit. ZYPREXA IntraMuscular vor Licht schützen, nicht einfrieren.
Vertrieben durch: Lilly USA, LLC, Indianapolis, IN 46285, USA. Überarbeitet: Okt. 2019
NEBENWIRKUNGEN
Wenn Sie ZYPREXA 2,5 mg und Fluoxetin in Kombination anwenden, lesen Sie auch den Abschnitt „Nebenwirkungen“ in der Packungsbeilage von Symbyax.
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln oder vorhersagen möglicherweise nicht die in der Praxis beobachteten Raten wider.
Klinische Studien bei Erwachsenen
Die nachstehenden Informationen zu Olanzapin stammen aus einer Datenbank für klinische Studien zu Olanzapin, bestehend aus 10.504 erwachsenen Patienten mit ungefähr 4765 Patientenjahren einer Exposition gegenüber Olanzapin plus 722 Patienten mit einer Exposition gegenüber intramuskulärem Olanzapin zur Injektion. Diese Datenbank enthält: (1) 2500 Patienten, die an Premarketing-Studien mit oraler Mehrfachdosis Olanzapin bei Schizophrenie und Alzheimer-Krankheit teilnahmen, was etwa 1122 Patientenjahren der Exposition zum 14. Februar 1995 entspricht; (2) 182 Patienten, die vor der Markteinführung an oralen Olanzapin-Studien zur Bipolar-I-Störung (manische oder gemischte Episoden) teilgenommen haben, was ungefähr 66 Patientenjahren der Exposition entspricht; (3) 191 Patienten, die an einer oralen Olanzapin-Studie mit Patienten mit verschiedenen psychiatrischen Symptomen in Verbindung mit der Alzheimer-Krankheit teilgenommen haben, was ungefähr 29 Patientenjahren der Exposition entspricht; (4) 5788 zusätzliche Patienten aus 88 klinischen Studien mit oralem Olanzapin zum 31. Dezember 2001; (5) 1843 zusätzliche Patienten aus 41 klinischen Olanzapin-Studien zum 31. Oktober 2011; und (6) 722 Patienten, die an Premarketing-Studien mit intramuskulärem Olanzapin zur Injektion bei unruhigen Patienten mit Schizophrenie, Bipolar-I-Störung (manische oder gemischte Episoden) oder Demenz teilgenommen haben. Unten sind auch Informationen aus der 6-wöchigen klinischen Studiendatenbank vor der Markteinführung für Olanzapin in Kombination mit Lithium oder Valproat enthalten, die aus 224 Patienten besteht, die an Studien zu Bipolar-I-Störungen (manische oder gemischte Episoden) mit ungefähr 22 Patientenjahren Exposition teilgenommen haben.
Die Bedingungen und Dauer der Behandlung mit Olanzapin waren sehr unterschiedlich und umfassten (in sich überschneidenden Kategorien) offene und doppelblinde Studienphasen, stationäre und ambulante Patienten, Fixdosis- und Dosistitrationsstudien sowie kurz- oder längerfristige Exposition . Nebenwirkungen wurden bewertet, indem Nebenwirkungen, Ergebnisse körperlicher Untersuchungen, Vitalzeichen, Gewichte, Laboranalyten, EKGs, Röntgenaufnahmen des Brustkorbs und Ergebnisse ophthalmologischer Untersuchungen gesammelt wurden.
Bestimmte Teile der nachstehenden Erörterung, die sich auf objektive oder numerische Sicherheitsparameter beziehen, nämlich dosisabhängige Nebenwirkungen, Veränderungen der Vitalfunktionen, Gewichtszunahme, Laborveränderungen und EKG-Veränderungen, stammen aus Studien an Patienten mit Schizophrenie und wurden für Bipolar-I-Störungen nicht dupliziert (manische oder gemischte Episoden) oder Unruhe. Diese Informationen gelten jedoch auch allgemein für Bipolar-I-Störungen (manische oder gemischte Episoden) und Agitation.
Nebenwirkungen während der Exposition wurden durch Spontanberichte erhalten und von klinischen Prüfern unter Verwendung einer Terminologie ihrer Wahl aufgezeichnet. Folglich ist es nicht möglich, eine aussagekräftige Schätzung des Anteils der Personen zu geben, bei denen Nebenwirkungen aufgetreten sind, ohne zunächst ähnliche Arten von Reaktionen in eine kleinere Anzahl standardisierter Reaktionskategorien einzuteilen. In den folgenden Tabellen und Tabellen wurde die Terminologie des MedDRA- und COSTART-Wörterbuchs verwendet, um gemeldete Nebenwirkungen zu klassifizieren.
Die angegebenen Häufigkeiten von Nebenwirkungen stellen den Anteil der Personen dar, bei denen mindestens einmal eine behandlungsbedingte Nebenwirkung der aufgeführten Art aufgetreten ist. Eine Reaktion wurde als behandlungsbedingt angesehen, wenn sie zum ersten Mal auftrat oder sich während der Therapie nach der Ausgangsbewertung verschlechterte. Die berichteten Reaktionen enthalten nicht jene Reaktionsbegriffe, die so allgemein waren, dass sie nicht aussagekräftig waren. Reaktionen, die an anderer Stelle in der Kennzeichnung aufgeführt sind, dürfen unten nicht wiederholt werden. Es ist wichtig zu betonen, dass die Reaktionen zwar während der Behandlung mit Olanzapin auftraten, aber nicht unbedingt dadurch verursacht wurden. Das gesamte Etikett sollte gelesen werden, um ein vollständiges Verständnis des Sicherheitsprofils von Olanzapin zu erlangen.
Der verschreibende Arzt sollte sich darüber im Klaren sein, dass die Zahlen in den Tabellen und Tabellen nicht dazu verwendet werden können, das Auftreten von Nebenwirkungen im Laufe der üblichen medizinischen Praxis vorherzusagen, wenn sich die Patientencharakteristika und andere Faktoren von denen unterscheiden, die in den klinischen Studien vorherrschten. Ebenso können die angegebenen Häufigkeiten nicht mit Zahlen verglichen werden, die aus anderen klinischen Studien mit unterschiedlichen Behandlungen, Anwendungen und Prüfärzten stammen. Die zitierten Zahlen bieten dem verschreibenden Gesundheitsdienstleister jedoch eine gewisse Grundlage für die Schätzung des relativen Beitrags von medikamentösen und nichtmedikamentösen Faktoren zur Inzidenz von Nebenwirkungen in der untersuchten Population.
Auftreten von Nebenwirkungen in Kurzzeit-, Placebo-kontrollierten und Kombinationsstudien
Die folgenden Ergebnisse basieren auf Premarketing-Studien mit (1) oralem Olanzapin bei Schizophrenie, Bipolar-I-Störung (manische oder gemischte Episoden), einer anschließenden Studie mit Patienten mit verschiedenen psychiatrischen Symptomen in Verbindung mit der Alzheimer-Krankheit und Premarketing-Kombinationsstudien und (2 ) intramuskuläres Olanzapin zur Injektion bei unruhigen Patienten mit Schizophrenie oder Bipolar-I-Manie.
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung in placebokontrollierten Kurzzeitstudien
Schizophrenie
Insgesamt gab es keinen Unterschied in der Häufigkeit von Abbrüchen aufgrund von Nebenwirkungen (5 % bei oralem Olanzapin vs. 6 % bei Placebo). Abbrüche aufgrund von ALT-Erhöhungen wurden jedoch als arzneimittelbedingt angesehen (2 % bei oralem Olanzapin gegenüber 0 % bei Placebo).
Bipolar-I-Störung (manische oder gemischte Episoden) Monotherapie
Insgesamt gab es keinen Unterschied in der Häufigkeit von Abbrüchen aufgrund von Nebenwirkungen (2 % bei oralem Olanzapin vs. 2 % bei Placebo).
Agitation
Insgesamt gab es keinen Unterschied in der Häufigkeit von Abbrüchen aufgrund von Nebenwirkungen (0,4 % für intramuskuläres Olanzapin zur Injektion vs. 0 % für Placebo).
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung in Kurzzeit-Kombinationsstudien
Bipolare I-Störung (manische oder gemischte Episoden), Olanzapin als Zusatz zu Lithium oder Valproat
In einer Studie mit Patienten, die bereits entweder Lithium oder Valproat als Monotherapie vertragen, betrug die Abbruchrate aufgrund von Nebenwirkungen 11 % bei der Kombination von oralem Olanzapin mit Lithium oder Valproat im Vergleich zu 2 % bei Patienten, die weiterhin eine Lithium- oder Valproat-Monotherapie erhielten. Abbrüche der Kombination von oralem Olanzapin und Lithium oder Valproat, die bei mehr als 1 Patient auftraten, waren: Schläfrigkeit (3 %), Gewichtszunahme (1 %) und periphere Ödeme (1 %).
Häufig beobachtete Nebenwirkungen in placebokontrollierten Kurzzeitstudien
Die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von oralem Olanzapin (Häufigkeit von 5 % oder mehr) und nicht in gleicher Häufigkeit bei mit Placebo behandelten Patienten (Olanzapin-Häufigkeit mindestens doppelt so hoch wie bei Placebo) waren:
Olanzapin intramuskulär
Es wurde 1 Nebenwirkung (Somnolenz) mit einer Inzidenz von 5 % oder mehr bei intramuskulär verabreichtem Olanzapin bei Patienten beobachtet, die mit Injektionen behandelt wurden, und nicht mit einer entsprechenden Inzidenz bei mit Placebo behandelten Patienten (Olanzapin-Inzidenz mindestens doppelt so hoch wie bei Placebo) während der Placebo-Behandlung -kontrollierte Premarketing-Studien. Die Inzidenz von Somnolenz während der 24-stündigen IM-Behandlungsdauer in klinischen Studien bei unruhigen Patienten mit Schizophrenie oder Bipolar-I-Manie betrug 6 % für intramuskuläres Olanzapin zur Injektion und 3 % für Placebo.
Nebenwirkungen, die bei mit oralem Olanzapin behandelten Patienten in Placebo-kontrollierten Kurzzeitstudien mit einer Inzidenz von 2 % oder mehr auftraten
Tabelle 11 listet die Inzidenz, gerundet auf den nächsten Prozentwert, von behandlungsbedingten Nebenwirkungen auf, die bei 2 % oder mehr der mit oralem Olanzapin (Dosen ≥ 2,5 mg/Tag) behandelten Patienten auftraten und mit einer höheren Inzidenz als Placebo, die an der akuten Behandlung teilnahmen Phase placebokontrollierter Studien.
Dosisabhängigkeit von Nebenwirkungen
Bei Müdigkeit, Schwindel, Gewichtszunahme und Prolaktinerhöhung wurde ein Dosisgruppenunterschied beobachtet. In einer einzigen 8-wöchigen randomisierten, doppelblinden Studie mit fester Dosis, in der 10 (N = 199), 20 (N = 200) und 40 (N = 200) mg/Tag orales Olanzapin bei erwachsenen Patienten mit Schizophrenie oder Schizoaffektiven verglichen wurden Inzidenz von Müdigkeit (10 mg/Tag: 1,5 %; 20 mg/Tag: 2,1 %; 40 mg/Tag: 6,6 %) wurde mit signifikanten Unterschieden zwischen 10 vs. 40 und 20 vs. 40 mg/Tag beobachtet. Das Auftreten von Schwindel (10 mg/Tag: 2,6 %; 20 mg/Tag: 1,6 %; 40 mg/Tag: 6,6 %) wurde mit signifikanten Unterschieden zwischen 20 mg und 40 mg beobachtet. Dosisgruppenunterschiede wurden auch für Gewichtszunahme und Prolaktinerhöhung festgestellt [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die folgende Tabelle befasst sich mit der Dosisabhängigkeit anderer Nebenwirkungen unter Verwendung von Daten aus einer Schizophrenie-Studie mit fixen Dosierungsbereichen von oralem Olanzapin. Es gibt den Prozentsatz der Patienten mit behandlungsbedingten Nebenwirkungen für die 3 Gruppen mit festem Dosisbereich und Placebo an. Die Daten wurden mit dem Cochran-Armitage-Test analysiert, wobei die Placebogruppe ausgeschlossen wurde, und die Tabelle enthält nur die Nebenwirkungen, für die ein Trend bestand.
Häufig beobachtete Nebenwirkungen in kurzfristigen Studien mit oralem Olanzapin als Zusatz zu Lithium oder Valproat
In den Placebo-kontrollierten Studien mit Bipolar-I-Störung (manische oder gemischte Episoden) waren die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Kombination von Olanzapin und Lithium oder Valproat (Inzidenz von ≥ 5 % und mindestens zweimal Placebo):
Nebenwirkungen, die in Kurzzeitstudien mit Olanzapin als Ergänzung zu Lithium oder Valproat bei mit Olanzapin oral behandelten Patienten mit einer Inzidenz von 2 % oder mehr auftraten
In Tabelle 14 ist die auf den nächsten Prozentsatz gerundete Inzidenz von behandlungsbedingten Nebenwirkungen aufgeführt, die bei 2 % oder mehr der mit der Kombination von Olanzapin (Dosen ≥ 5 mg/Tag) und Lithium oder Valproat behandelten Patienten und mit einer Inzidenz von mehr als auftraten Lithium oder Valproat allein, die an der Akutphase placebokontrollierter Kombinationsstudien teilnahmen.
Spezifische Informationen zu Nebenwirkungen, die mit Lithium oder Valproat beobachtet wurden, finden Sie im Abschnitt „Nebenwirkungen“ der Packungsbeilage dieser anderen Produkte.
Nebenwirkungen, die bei Patienten mit intramuskulärer Olanzapin-Injektion in Placebo-kontrollierten Kurzzeitstudien mit einer Inzidenz von 1 % oder mehr auftraten
Tabelle 15 führt die auf den nächsten Prozent gerundete Inzidenz von behandlungsbedingten Nebenwirkungen auf, die bei 1 % oder mehr der mit intramuskulärem Olanzapin zur Injektion (Dosisbereich von 2,5–10 mg/Injektion) behandelten Patienten auftraten und deren Inzidenz höher war als bei Placebo die an den placebokontrollierten Kurzzeitstudien bei agitierten Patienten mit Schizophrenie oder Bipolar-I-Manie teilnahmen.
Extrapyramidale Symptome
In der folgenden Tabelle ist der Prozentsatz der Patienten mit behandlungsbedingten extrapyramidalen Symptomen aufgeführt, wie er durch kategoriale Analysen formaler Bewertungsskalen während der Akuttherapie in einer kontrollierten klinischen Studie zum Vergleich von oralem Olanzapin in 3 Fixdosen mit Placebo bei der Behandlung von Schizophrenie über 6 Wochen ermittelt wurde Studie.
In der folgenden Tabelle ist der Prozentsatz der Patienten mit behandlungsbedingten extrapyramidalen Symptomen aufgeführt, wie anhand spontan gemeldeter Nebenwirkungen während der Akuttherapie in derselben kontrollierten klinischen Studie ermittelt, in der Olanzapin in 3 Fixdosen mit Placebo bei der Behandlung von Schizophrenie in einer 6-wöchigen Studie verglichen wurde.
Die folgende Tabelle listet den Prozentsatz jugendlicher Patienten mit behandlungsbedingten extrapyramidalen Symptomen auf, wie anhand spontan gemeldeter Nebenwirkungen während der Akuttherapie festgestellt (Dosisbereich: 2,5 bis 20 mg/Tag).
In der folgenden Tabelle ist der Prozentsatz der Patienten mit behandlungsbedingten extrapyramidalen Symptomen aufgeführt, wie er durch kategoriale Analysen formaler Bewertungsskalen während kontrollierter klinischer Studien ermittelt wurde, in denen fixe Dosen von intramuskulärem Olanzapin zur Injektion mit Placebo in Agitation verglichen wurden. Patienten in jeder Dosisgruppe konnten während der Studien bis zu 3 Injektionen erhalten [siehe Klinische Studien ]. Die Patientenbewertungen wurden während der 24 Stunden nach der Initialdosis von intramuskulärem Olanzapin zur Injektion durchgeführt.
In der folgenden Tabelle ist der Prozentsatz der Patienten mit behandlungsbedingten extrapyramidalen Symptomen aufgeführt, ermittelt anhand spontan gemeldeter Nebenwirkungen in derselben kontrollierten klinischen Studie, in der Fixdosen von intramuskulärem Olanzapin zur Injektion mit Placebo bei unruhigen Patienten mit Schizophrenie verglichen wurden.
Dystonie, Klasseneffekt
Bei empfindlichen Personen können in den ersten Tagen der Behandlung Symptome einer Dystonie, verlängerte abnorme Kontraktionen von Muskelgruppen, auftreten. Zu den dystonischen Symptomen gehören: Krämpfe der Nackenmuskulatur, die sich manchmal zu einem Engegefühl im Hals entwickeln, Schluckbeschwerden, Atembeschwerden und/oder Heraustreten der Zunge. Während diese Symptome bei niedrigen Dosen auftreten können, sind Häufigkeit und Schweregrad bei hochpotenten und höheren Dosen von Antipsychotika der ersten Generation größer. Im Allgemeinen kann bei Männern und jüngeren Altersgruppen, die Antipsychotika erhalten, ein erhöhtes Risiko für eine akute Dystonie beobachtet werden; jedoch wurden bei der Anwendung von Olanzapin selten (
Andere Nebenwirkungen
Andere Nebenwirkungen, die während der klinischen Studienbewertung von oralem Olanzapin beobachtet wurden
Nachfolgend finden Sie eine Liste von behandlungsbedingten Nebenwirkungen, die von Patienten berichtet wurden, die in klinischen Studien mit oralem Olanzapin (in Mehrfachdosen ≥ 1 mg/Tag) behandelt wurden. Diese Auflistung soll keine Reaktionen enthalten, (1) die bereits in vorherigen Tabellen oder an anderer Stelle in der Kennzeichnung aufgeführt sind, (2) für die eine medikamentöse Ursache entfernt war, (3) die so allgemein waren, dass sie nicht aussagekräftig waren, (4) die es nicht waren als signifikante klinische Auswirkungen angesehen werden, oder (5) die mit einer gleichen oder geringeren Häufigkeit als Placebo auftraten. Reaktionen werden nach Körpersystem unter Verwendung der folgenden Definitionen klassifiziert: häufige Nebenwirkungen sind solche, die bei mindestens 1/100 Patienten auftreten; seltene Nebenwirkungen treten bei 1/100 bis 1/1000 Patienten auf; seltene Reaktionen treten bei weniger als 1/1000 Patienten auf.
Körper als Ganzes - Selten: Schüttelfrost, Gesichtsödem, Lichtempfindlichkeitsreaktion, Suizidversuch1; Selten: Schüttelfrost und Fieber, Kater-Effekt, plötzlicher Tod1.
Herz-Kreislauf-System - Selten: Schlaganfall, Vasodilatation.
Verdauungstrakt - Selten: Blähungen, Übelkeit und Erbrechen, Zungenödem; Selten: Ileus, Darmverschluss, Leberfettablagerungen.
Hämisches und lymphatisches System - Selten: Thrombozytopenie.
Stoffwechsel- und Ernährungsstörungen - Häufig: alkalische Phosphatase erhöht; Selten: Bilirubinämie, Hypoproteinämie.
Bewegungsapparat - Selten: Osteoporose.
Nervöses System - Selten: Ataxie, Dysarthrie, verminderte Libido, Benommenheit; Selten: Koma.
Atmungssystem - Selten: Nasenbluten; Selten: Lungenödem.
Haut und Anhängsel - Selten: Alopezie.
Besondere Sinne - Selten: Anomalie der Akkommodation, trockene Augen; Selten: Mydriasis.
Urogenitalsystem - Selten: Amenorrhoe2, Brustschmerzen, verminderte Menstruation, Impotenz2, verstärkte Menstruation2, Menorrhagie2, Metrorrhagie2, Polyurie2, häufiges Wasserlassen, Harnverhalt, Harndrang, beeinträchtigtes Wasserlassen.
1 Diese Begriffe stellen schwerwiegende unerwünschte Ereignisse dar, entsprechen jedoch nicht der Definition für unerwünschte Arzneimittelwirkungen. Sie sind hier wegen ihrer Ernsthaftigkeit enthalten. 2 Geschlechtsbereinigt.
Andere Nebenwirkungen, die während der klinischen Studienbewertung von intramuskulärem Olanzapin zur Injektion beobachtet wurden
Im Folgenden finden Sie eine Liste der behandlungsbedingten Nebenwirkungen, die von Patienten berichtet wurden, die in klinischen Studien mit intramuskulärem Olanzapin zur Injektion (bei 1 oder mehr Dosen ≥ 2,5 mg/Injektion) behandelt wurden. Diese Auflistung soll keine Reaktionen enthalten, (1) die bereits in vorherigen Tabellen oder an anderer Stelle in der Kennzeichnung aufgeführt sind, (2) für die eine medikamentöse Ursache entfernt war, (3) die so allgemein waren, dass sie nicht aussagekräftig waren, (4) die es nicht waren als signifikante klinische Auswirkungen angesehen werden, oder (5) die mit einer Häufigkeit auftraten, die gleich oder geringer war als bei Placebo. Reaktionen werden nach Körpersystem unter Verwendung der folgenden Definitionen klassifiziert: häufige Nebenwirkungen sind solche, die bei mindestens 1/100 Patienten auftreten; seltene Nebenwirkungen treten bei 1/100 bis 1/1000 Patienten auf.
Körper als Ganzes - Häufig: Schmerzen an der Injektionsstelle.
Herz-Kreislauf-System - Selten: Synkope.
Verdauungstrakt - Selten: Übelkeit.
Stoffwechsel- und Ernährungsstörungen - Selten: Kreatinphosphokinase erhöht.
Klinische Studien bei jugendlichen Patienten (im Alter von 13 bis 17 Jahren)
Häufig beobachtete Nebenwirkungen in Placebo-kontrollierten Kurzzeitstudien mit oralem Olanzapin
Nebenwirkungen bei jugendlichen Patienten, die mit oralem Olanzapin (Dosen ≥ 2,5 mg) behandelt wurden und mit einer Inzidenz von 5 % oder mehr und mindestens doppelt so häufig berichtet wurden wie bei mit Placebo behandelten Patienten, sind in Tabelle 21 aufgeführt.
Nebenwirkungen, die bei mit oralem Olanzapin behandelten Patienten in Placebo-kontrollierten Kurzzeitstudien (3-6 Wochen) mit einer Inzidenz von 2 % oder mehr auftraten
Nebenwirkungen bei jugendlichen Patienten, die mit oralem Olanzapin (Dosen ≥ 2,5 mg) behandelt wurden und mit einer Inzidenz von 2 % oder mehr und mehr als unter Placebo berichtet wurden, sind in Tabelle 22 aufgeführt.
Vitalfunktionen und Laborstudien
Veränderungen der Vitalzeichen
Oral verabreichtes Olanzapin wurde in klinischen Studien mit orthostatischer Hypotonie und Tachykardie in Verbindung gebracht. In klinischen Studien wurde intramuskuläres Olanzapin zur Injektion mit Bradykardie, Hypotonie und Tachykardie in Verbindung gebracht [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Änderungen im Labor
Olanzapin-Monotherapie bei Erwachsenen
Eine Bewertung der Erfahrungen vor der Markteinführung von Olanzapin ergab einen Zusammenhang mit asymptomatischen Anstiegen von ALT, AST und GGT. In der ursprünglichen Premarketing-Datenbank mit etwa 2.400 erwachsenen Patienten mit ALT-Ausgangswerten von ≤ 90 IE/l betrug die Inzidenz von ALT-Erhöhungen auf > 200 IE/l 2 % (50/2.381). Bei keinem dieser Patienten kam es zu Gelbsucht oder anderen Symptomen, die auf eine Leberfunktionsstörung zurückzuführen waren, und die meisten zeigten vorübergehende Veränderungen, die sich tendenziell normalisierten, während die Behandlung mit Olanzapin fortgesetzt wurde.
In Placebo-kontrollierten Olanzapin-Monotherapie-Studien bei Erwachsenen wurden bei 5 % (77/1426) der behandelten Patienten klinisch signifikante ALT-Erhöhungen (Änderung vom
Aus einer Analyse der Labordaten in einer integrierten Datenbank von 41 abgeschlossenen klinischen Studien bei erwachsenen Patienten, die mit oralem Olanzapin behandelt wurden, wurden bei ≥ 1 % (88/5245) der Patienten hohe GGT-Spiegel festgestellt.
Vorsicht ist geboten bei Patienten mit Anzeichen und Symptomen einer Leberfunktionsstörung, bei Patienten mit vorbestehenden Erkrankungen, die mit einer eingeschränkten Leberfunktionsreserve einhergehen, und bei Patienten, die mit potenziell hepatotoxischen Arzneimitteln behandelt werden.
Die Verabreichung von Olanzapin war auch mit einem Anstieg des Serumprolaktins verbunden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ], mit einer asymptomatischen Erhöhung der Eosinophilenzahl bei 0,3 % der Patienten und mit einem Anstieg der CPK.
Aus einer Analyse der Labordaten in einer integrierten Datenbank von 41 abgeschlossenen klinischen Studien bei erwachsenen Patienten, die mit oralem Olanzapin behandelt wurden, wurde bei ≥ 3 % (171/4641) der Patienten eine erhöhte Harnsäure festgestellt.
Olanzapin-Monotherapie bei Jugendlichen
In placebokontrollierten klinischen Studien mit jugendlichen Patienten mit Schizophrenie oder Bipolar-I-Störung (manische oder gemischte Episoden) wurden im Vergleich zu Placebo zu jedem beliebigen Zeitpunkt bei Laboranalyten häufiger folgende behandlungsbedingte Befunde beobachtet: Erhöhte ALT (≥ 3x ULN bei Patienten mit ALT zu Studienbeginn
In Placebo-kontrollierten Olanzapin-Monotherapie-Studien bei Jugendlichen wurden klinisch signifikante ALT-Erhöhungen (Änderung vom
EKG-Veränderungen
In gepoolten Studien mit Erwachsenen sowie gepoolten Studien mit Jugendlichen gab es keine signifikanten Unterschiede zwischen Olanzapin und Placebo im Anteil der Patienten, bei denen potenziell wichtige Veränderungen der EKG-Parameter, einschließlich QT, QTc (Fridericia korrigiert) und PR-Intervalle, auftraten. Die Anwendung von Olanzapin war im Vergleich zu Placebo mit einem mittleren Anstieg der Herzfrequenz verbunden (Erwachsene: +2,4 Schläge pro Minute vs. keine Veränderung mit Placebo; Jugendliche: +6,3 Schläge pro Minute vs. -5,1 Schläge pro Minute mit Placebo). Diese Erhöhung der Herzfrequenz kann mit dem Potenzial von Olanzapin zur Induktion orthostatischer Veränderungen in Zusammenhang stehen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von ZYPREXA nach der Zulassung festgestellt. Da diese Reaktionen freiwillig von einer Population unbekannter Größe gemeldet werden, ist es schwierig, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition zu bewerten.
Seit der Markteinführung berichtete Nebenwirkungen, die zeitlich (aber nicht notwendigerweise kausal) mit der ZYPREXA-Therapie in Zusammenhang standen, umfassen die folgenden: allergische Reaktion (z. B. anaphylaktoide Reaktion, Angioödem, Pruritus oder Urtikaria), cholestatische oder gemischte Leberschädigung, diabetisches Koma, diabetische Ketoazidose, Absetzreaktion (Diaphorese, Übelkeit oder Erbrechen), Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS), Hepatitis, Gelbsucht, Neutropenie, Pankreatitis, Priapismus, Hautausschlag, Restless-Legs-Syndrom, Rhabdomyolyse, Stottern1 und venöse thromboembolische Ereignisse (einschließlich Lungenembolie und tiefe Venenthrombose). Es wurden zufällige Cholesterinspiegel von ≥240 mg/dl und zufällige Triglyceridspiegel von ≥1000 mg/dl berichtet.
1 Stottern wurde nur in oralen und lang wirkenden Injektionsformulierungen (LAI) untersucht.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Die Risiken der Anwendung von Olanzapin in Kombination mit anderen Arzneimitteln wurden nicht umfassend in systematischen Studien untersucht.
Potenzial für andere Medikamente, Olanzapin zu beeinflussen
Diazepam
Die gleichzeitige Verabreichung von Diazepam mit Olanzapin verstärkte die unter Olanzapin beobachtete orthostatische Hypotonie.
Cimetidin und Antazida
Einzeldosen von Cimetidin (800 mg) oder aluminium- und magnesiumhaltigen Antazida hatten keinen Einfluss auf die orale Bioverfügbarkeit von Olanzapin.
Induktoren von CYP1A2
Eine Carbamazepin-Therapie (200 mg 2-mal täglich) bewirkt eine etwa 50 %ige Erhöhung der Clearance von Olanzapin. Dieser Anstieg ist wahrscheinlich darauf zurückzuführen, dass Carbamazepin ein starker Induktor der CYP1A2-Aktivität ist. Höhere Tagesdosen von Carbamazepin können zu einem noch stärkeren Anstieg der Olanzapin-Clearance führen.
Alkohol
Ethanol (45 mg/70 kg Einzeldosis) hatte keine Wirkung auf die Pharmakokinetik von Olanzapin. Die gleichzeitige Verabreichung von Alkohol (dh Ethanol) mit Olanzapin verstärkte die bei Olanzapin beobachtete orthostatische Hypotonie [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Inhibitoren von CYP1A2
Fluvoxamin
Fluvoxamin, ein CYP1A2-Hemmer, verringert die Clearance von Olanzapin. Dies führt zu einem mittleren Anstieg der Cmax von Olanzapin nach Fluvoxamin von 54 % bei weiblichen Nichtrauchern und 77 % bei männlichen Rauchern. Der mittlere Anstieg der Olanzapin-AUC beträgt 52 % bzw. 108 %. Bei Patienten, die gleichzeitig mit Fluvoxamin behandelt werden, sollten niedrigere Olanzapin-Dosen in Betracht gezogen werden.
Inhibitoren von CYP2D6
Fluoxetin
Fluoxetin (60-mg-Einzeldosis oder 60-mg-Tagesdosis für 8 Tage) verursacht einen geringen (im Mittel 16 %) Anstieg der maximalen Konzentration von Olanzapin und eine geringe (im Mittel 16 %) Abnahme der Olanzapin-Clearance. Das Ausmaß des Einflusses dieses Faktors ist im Vergleich zur Gesamtvariabilität zwischen Individuen gering, und daher wird eine Dosisanpassung nicht routinemäßig empfohlen. Wenn Sie ZYPREXA und Fluoxetin in Kombination verwenden, lesen Sie auch den Abschnitt „Arzneimittelwechselwirkungen“ in der Packungsbeilage von Symbyax.
Warfarin
Warfarin (20 mg Einzeldosis) beeinflusste die Pharmakokinetik von Olanzapin nicht.
Induktoren von CYP1A2 oder Glucuronyltransferase
Omeprazol und Rifampin können die Olanzapin-Clearance erhöhen.
Holzkohle
Die Gabe von Aktivkohle (1 g) reduzierte die Cmax und AUC von oralem Olanzapin um etwa 60 %. Da Olanzapin-Spitzenspiegel typischerweise erst etwa 6 Stunden nach der Einnahme erreicht werden, kann Aktivkohle eine nützliche Behandlung einer Olanzapin-Überdosierung sein.
Potenzial für Olanzapin, andere Medikamente zu beeinflussen
Auf das ZNS wirkende Arzneimittel
Angesichts der primären ZNS-Wirkungen von Olanzapin ist Vorsicht geboten, wenn Olanzapin in Kombination mit anderen zentral wirkenden Arzneimitteln und Alkohol eingenommen wird.
Antihypertensive Mittel
Olanzapin kann aufgrund seines Potenzials zur Induktion von Hypotonie die Wirkung bestimmter Antihypertonika verstärken.
Levodopa und Dopamin-Agonisten
Olanzapin kann die Wirkung von Levodopa und Dopaminagonisten antagonisieren.
Lorazepam (IM)
Die Verabreichung von intramuskulärem Lorazepam (2 mg) 1 Stunde nach intramuskulärer Olanzapin-Injektion (5 mg) hatte keinen signifikanten Einfluss auf die Pharmakokinetik von Olanzapin, unkonjugiertem Lorazepam oder Gesamt-Lorazepam. Diese gleichzeitige Verabreichung von intramuskulärem Lorazepam und intramuskulärem Olanzapin zur Injektion trug jedoch zu der Schläfrigkeit bei, die mit beiden Arzneimitteln allein beobachtet wurde [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Lithium
Mehrfachdosen von Olanzapin (10 mg für 8 Tage) beeinflussten die Kinetik von Lithium nicht. Daher erfordert die gleichzeitige Gabe von Olanzapin keine Dosisanpassung von Lithium [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Valproat
Olanzapin (10 mg täglich über 2 Wochen) beeinflusste die Steady-State-Plasmakonzentrationen von Valproat nicht. Daher erfordert die gleichzeitige Gabe von Olanzapin keine Dosisanpassung von Valproat [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Wirkung von Olanzapin auf medikamentenmetabolisierende Enzyme
In-vitro-Studien mit menschlichen Lebermikrosomen deuten darauf hin, dass Olanzapin nur ein geringes Potenzial zur Hemmung von CYP1A2, CYP2C9, CYP2C19, CYP2D6 und CYP3A hat. Daher ist es unwahrscheinlich, dass Olanzapin klinisch bedeutsame Arzneimittelwechselwirkungen verursacht, die durch diese Enzyme vermittelt werden.
Imipramin
Einzeldosen von Olanzapin hatten keinen Einfluss auf die Pharmakokinetik von Imipramin oder seines aktiven Metaboliten Desipramin.
Warfarin
Einzeldosen von Olanzapin hatten keinen Einfluss auf die Pharmakokinetik von Warfarin.
Diazepam
Olanzapin hatte keinen Einfluss auf die Pharmakokinetik von Diazepam oder seines aktiven Metaboliten Ndesmethyldiazepam. Diazepam, das zusammen mit Olanzapin verabreicht wurde, erhöhte jedoch die orthostatische Hypotonie, die bei beiden allein verabreichten Arzneimitteln beobachtet wurde.
Alkohol
Mehrfachdosen von Olanzapin beeinflussten die Kinetik von Ethanol nicht.
Biperiden
Mehrfachdosen von Olanzapin beeinflussten die Kinetik von Biperiden nicht.
Theophyllin
Mehrfachdosen von Olanzapin hatten keinen Einfluss auf die Pharmakokinetik von Theophyllin oder seiner Metaboliten.
Drogenmissbrauch und -abhängigkeit
Abhängigkeit
In prospektiv angelegten Studien zur Bewertung des Missbrauchs- und Abhängigkeitspotenzials zeigte Olanzapin bei Ratten, denen orale Dosen bis zum 15-Fachen der täglichen oralen MRHD (20 mg) verabreicht wurden, und bei Rhesusaffen akute depressive ZNS-Wirkungen, aber wenig oder kein Potenzial für Missbrauch oder körperliche Abhängigkeit verabreichte orale Dosen bis zum 8-fachen der täglichen oralen MRHD, basierend auf mg/m² Körperoberfläche.
Olanzapin wurde beim Menschen nicht systematisch auf sein Potenzial für Missbrauch, Toleranz oder körperliche Abhängigkeit untersucht. Während die klinischen Studien keine Tendenz zu einem Suchtverhalten zeigten, waren diese Beobachtungen nicht systematisch, und es ist nicht möglich, auf der Grundlage dieser begrenzten Erfahrung vorherzusagen, in welchem Ausmaß ein ZNS-aktives Medikament missbraucht oder abgezweigt wird , und/oder missbraucht, sobald sie vermarktet wurden. Folglich sollten Patienten sorgfältig auf Drogenmissbrauch in der Vorgeschichte untersucht werden, und solche Patienten sollten engmaschig auf Anzeichen von Missbrauch oder Missbrauch von Olanzapin (z. B. Toleranzentwicklung, Dosissteigerungen, Suchtverhalten) beobachtet werden.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Wenn Sie ZYPREXA 7,5 mg und Fluoxetin in Kombination verwenden, lesen Sie auch den Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“ in der Packungsbeilage von Symbyax.
Ältere Patienten mit demenzbedingter Psychose
Erhöhte Sterblichkeit
Ältere Patienten mit demenzbedingter Psychose, die mit Antipsychotika behandelt werden, haben ein erhöhtes Sterberisiko. ZYPREXA 20 mg ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen [siehe UMKÄSTENER WARNHINWEIS, Anwendung bei Patienten mit Begleiterkrankungen und PATIENTENINFORMATIONEN].
In placebokontrollierten klinischen Studien mit älteren Patienten mit demenzbedingter Psychose war die Inzidenz von Todesfällen bei mit Olanzapin behandelten Patienten signifikant höher als bei mit Placebo behandelten Patienten (3,5 % vs. 1,5 %).
Zerebrovaskuläre unerwünschte Ereignisse (CVAE), einschließlich Schlaganfall
Zerebrovaskuläre unerwünschte Ereignisse (z. B. Schlaganfall, transitorische ischämische Attacke), einschließlich Todesfälle, wurden bei Patienten in Studien zu Olanzapin bei älteren Patienten mit demenzbedingter Psychose berichtet. In placebokontrollierten Studien kam es bei mit Olanzapin behandelten Patienten im Vergleich zu mit Placebo behandelten Patienten zu einer signifikant höheren Inzidenz zerebrovaskulärer Nebenwirkungen. Olanzapin ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen [siehe Eingerahmte Warnung und INFORMATIONEN ZUM PATIENTEN ].
Selbstmord
Die Möglichkeit eines Suizidversuchs ist bei Schizophrenie und Bipolar-I-Störung inhärent, und eine engmaschige Überwachung von Hochrisikopatienten sollte die medikamentöse Therapie begleiten. Verschreibungen für Olanzapin sollten für die kleinste Tablettenmenge im Einklang mit einem guten Patientenmanagement ausgestellt werden, um das Risiko einer Überdosierung zu verringern.
Malignes neuroleptisches Syndrom (NMS)
Im Zusammenhang mit der Verabreichung von Antipsychotika, einschließlich Olanzapin, wurde über einen potenziell tödlichen Symptomkomplex berichtet, der manchmal als malignes neuroleptisches Syndrom (NMS) bezeichnet wird. Klinische Manifestationen von NMS sind Hyperpyrexie, Muskelrigidität, veränderter Geisteszustand und Anzeichen einer autonomen Instabilität (unregelmäßiger Puls oder Blutdruck, Tachykardie, Schwitzen und Herzrhythmusstörungen). Zusätzliche Anzeichen können erhöhte Kreatininphosphokinase, Myoglobinurie (Rhabdomyolyse) und akutes Nierenversagen sein.
Die diagnostische Beurteilung von Patienten mit diesem Syndrom ist kompliziert. Um zu einer Diagnose zu gelangen, ist es wichtig, Fälle auszuschließen, in denen das klinische Erscheinungsbild sowohl eine schwere medizinische Erkrankung (z. B. Lungenentzündung, systemische Infektion usw.) als auch unbehandelte oder unzureichend behandelte extrapyramidale Zeichen und Symptome (EPS) umfasst. Andere wichtige Erwägungen bei der Differentialdiagnose umfassen die zentrale anticholinerge Toxizität, Hitzschlag, Drogenfieber und primäre Pathologie des Zentralnervensystems.
Das Management von NMS sollte umfassen: 1) sofortiges Absetzen von Antipsychotika und anderen Arzneimitteln, die für eine gleichzeitige Therapie nicht unbedingt erforderlich sind; 2) intensive symptomatische Behandlung und medizinische Überwachung; und 3) Behandlung aller begleitenden schwerwiegenden medizinischen Probleme, für die spezifische Behandlungen verfügbar sind. Es gibt keine allgemeine Einigung über spezifische pharmakologische Behandlungsschemata für NMS.
Wenn ein Patient nach Genesung von NMS eine antipsychotische medikamentöse Behandlung benötigt, sollte die mögliche Wiederaufnahme der medikamentösen Therapie sorgfältig erwogen werden. Der Patient sollte sorgfältig überwacht werden, da Rezidive von NMS berichtet wurden [siehe INFORMATIONEN ZUM PATIENTEN ].
Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS)
Arzneimittelreaktionen mit Eosinophilie und systemischen Symptomen (DRESS) wurden bei Olanzapin-Exposition berichtet. DRESS kann mit Hautreaktionen (wie Hautausschlag oder exfoliativer Dermatitis), Eosinophilie, Fieber und/oder Lymphadenopathie mit systemischen Komplikationen wie Hepatitis, Nephritis, Pneumonitis, Myokarditis und/oder Perikarditis einhergehen. DRESS ist manchmal tödlich. Bei Verdacht auf DRESS Olanzapin absetzen [siehe INFORMATIONEN ZUM PATIENTEN ].
Stoffwechselveränderungen
Atypische Antipsychotika wurden mit Stoffwechselveränderungen wie Hyperglykämie, Dyslipidämie und Gewichtszunahme in Verbindung gebracht. Stoffwechselveränderungen können mit einem erhöhten kardiovaskulären/zerebrovaskulären Risiko verbunden sein. Das spezifische Stoffwechselprofil von Olanzapin ist unten dargestellt.
Hyperglykämie und Diabetes mellitus
Gesundheitsdienstleister sollten bei der Verschreibung von Olanzapin an Patienten mit einer gesicherten Diagnose von Diabetes mellitus oder einem grenzwertig erhöhten Blutzuckerspiegel (Nüchtern 100-126 mg/dl, Nicht-Nüchtern 140-200 mg/dl) Risiken und Nutzen abwägen. Patienten, die Olanzapin einnehmen, sollten regelmäßig auf eine Verschlechterung der Glukosekontrolle überwacht werden. Patienten, die eine Behandlung mit Olanzapin beginnen, sollten sich zu Beginn der Behandlung und in regelmäßigen Abständen während der Behandlung einer Nüchtern-Blutzuckermessung unterziehen. Jeder Patient, der mit atypischen Antipsychotika behandelt wird, sollte auf Symptome einer Hyperglykämie einschließlich Polydipsie, Polyurie, Polyphagie und Schwäche überwacht werden. Patienten, die während der Behandlung mit atypischen Antipsychotika Symptome einer Hyperglykämie entwickeln, sollten sich einer Nüchtern-Blutzuckermessung unterziehen. In einigen Fällen klang die Hyperglykämie ab, wenn das atypische Antipsychotikum abgesetzt wurde; Einige Patienten benötigten jedoch trotz Absetzens des verdächtigen Medikaments eine Fortsetzung der antidiabetischen Behandlung [siehe INFORMATIONEN ZUM PATIENTEN ].
Hyperglykämie, in einigen Fällen extrem und mit Ketoazidose oder hyperosmolarem Koma oder Tod verbunden, wurde bei Patienten berichtet, die mit atypischen Antipsychotika, einschließlich Olanzapin, behandelt wurden. Die Beurteilung des Zusammenhangs zwischen der atypischen Anwendung von Antipsychotika und Glukoseanomalien wird durch die Möglichkeit eines erhöhten Hintergrundrisikos für Diabetes mellitus bei Patienten mit Schizophrenie und die zunehmende Inzidenz von Diabetes mellitus in der Allgemeinbevölkerung erschwert. Epidemiologische Studien deuten auf ein erhöhtes Risiko behandlungsbedingter Hyperglykämie-bedingter Nebenwirkungen bei Patienten hin, die mit atypischen Antipsychotika behandelt werden. Während die Schätzungen des relativen Risikos widersprüchlich sind, scheint der Zusammenhang zwischen atypischen Antipsychotika und einem Anstieg des Glukosespiegels auf einem Kontinuum zu liegen, und Olanzapin scheint einen größeren Zusammenhang zu haben als einige andere atypische Antipsychotika.
Bei Patienten, die in Phase 1 der Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE) mit Olanzapin behandelt wurden (mittlere Exposition 9,2 Monate), wurde ein mittlerer Anstieg des Blutzuckerspiegels beobachtet. Der mittlere Anstieg der Serumglukose (Nüchtern- und Nicht-Nüchtern-Proben) vom Ausgangswert bis zum Durchschnitt der beiden höchsten Serumkonzentrationen betrug 15,0 mg/dl.
In einer Studie mit gesunden Probanden hatten Probanden, die Olanzapin (N = 22) für 3 Wochen erhielten, einen mittleren Anstieg des Nüchtern-Blutzuckers um 2,3 mg/dl im Vergleich zum Ausgangswert. Mit Placebo behandelte Probanden (N = 19) hatten einen mittleren Anstieg des Nüchtern-Blutzuckers im Vergleich zum Ausgangswert von 0,34 mg/dL.
Olanzapin-Monotherapie bei Erwachsenen
In einer Analyse von 5 placebokontrollierten Monotherapiestudien mit Olanzapin bei Erwachsenen mit einer medianen Behandlungsdauer von etwa 3 Wochen war Olanzapin im Vergleich zu Placebo mit einer größeren mittleren Veränderung des Nüchternblutzuckerspiegels verbunden (2,76 mg/dl gegenüber 0,17 mg/dl). Der Unterschied in den mittleren Veränderungen zwischen Olanzapin und Placebo war größer bei Patienten mit Anzeichen einer Glukose-Dysregulation zu Studienbeginn (Patienten, bei denen Diabetes mellitus oder verwandte Nebenwirkungen diagnostiziert wurden, Patienten, die mit Antidiabetika behandelt wurden, Patienten mit einem zufälligen Glukosespiegel zu Studienbeginn von ≥ 200 mg/ dL und/oder ein Nüchtern-Glukose-Ausgangswert von ≥126 mg/dL). Mit Olanzapin behandelte Patienten hatten einen größeren mittleren HbA1c-Anstieg von 0,04 % gegenüber dem Ausgangswert (mediane Exposition 21 Tage) im Vergleich zu einer mittleren HbA1c-Abnahme von 0,06 % bei mit Placebo behandelten Patienten (mediane Exposition 17 Tage).
In einer Analyse von 8 placebokontrollierten Studien (mittlere Behandlungsdauer 4–5 Wochen) hatten 6,1 % der mit Olanzapin behandelten Patienten (N = 855) eine behandlungsbedingte Glykosurie, verglichen mit 2,8 % der mit Placebo behandelten Patienten (N = 599). . Tabelle 2 zeigt kurzfristige und langfristige Veränderungen des Nüchternblutzuckerspiegels aus Studien mit Olanzapin-Monotherapie bei Erwachsenen.
Die mittlere Veränderung des Nüchternglukosespiegels bei Patienten, die mindestens 48 Wochen exponiert waren, betrug 4,2 mg/dl (N = 487). In Analysen von Patienten, die eine 9- bis 12-monatige Olanzapin-Therapie abgeschlossen hatten, stieg die mittlere Veränderung der Nüchtern- und Nicht-Nüchtern-Glukosespiegel im Laufe der Zeit weiter an.
Olanzapin-Monotherapie bei Jugendlichen
Die Sicherheit und Wirksamkeit von Olanzapin wurde bei Patienten unter 13 Jahren nicht nachgewiesen. In einer Analyse von 3 placebokontrollierten Olanzapin-Monotherapie-Studien mit jugendlichen Patienten, einschließlich Patienten mit Schizophrenie (6 Wochen) oder Bipolar-I-Störung (manische oder gemischte Episoden) (3 Wochen), war Olanzapin mit einer größeren mittleren Veränderung gegenüber dem Ausgangswert im Nüchternzustand verbunden Glukosespiegel im Vergleich zu Placebo (2,68 mg/dl gegenüber -2,59 mg/dl). Die mittlere Veränderung des Nüchternglukosespiegels bei Jugendlichen, die mindestens 24 Wochen exponiert waren, betrug 3,1 mg/dl (N = 121). Tabelle 3 zeigt kurzfristige und langfristige Veränderungen des Nüchtern-Blutzuckerspiegels aus Olanzapin-Monotherapie-Studien bei Jugendlichen.
Dyslipidämie
Bei der Anwendung von Olanzapin wurden unerwünschte Veränderungen der Lipide beobachtet. Bei Patienten, die Olanzapin anwenden, wird eine klinische Überwachung, einschließlich Baseline- und regelmäßiger Follow-up-Lipidbewertungen, empfohlen [siehe INFORMATIONEN ZUM PATIENTEN ].
Bei der Anwendung von Olanzapin wurden klinisch signifikante und manchmal sehr hohe (> 500 mg/dl) Erhöhungen der Triglyceridspiegel beobachtet. Auch bei der Anwendung von Olanzapin wurde ein mäßiger mittlerer Anstieg des Gesamtcholesterins beobachtet.
Olanzapin-Monotherapie bei Erwachsenen
In einer Analyse von 5 placebokontrollierten Olanzapin-Monotherapie-Studien mit einer Behandlungsdauer von bis zu 12 Wochen zeigten mit Olanzapin behandelte Patienten gegenüber dem Ausgangswert einen Anstieg des mittleren Nüchtern-Gesamtcholesterins, des LDL-Cholesterins und der Triglyceride um 5,3 mg/dl, 3,0 mg/dl und 20,8 mg/dl verglichen mit Abnahmen gegenüber dem Ausgangswert des mittleren Nüchtern-Gesamtcholesterins, LDL-Cholesterins und Triglyzeride um 6,1 mg/dl, 4,3 mg/dl und 10,7 mg/dl bei mit Placebo behandelten Patienten. Beim Nüchtern-HDL-Cholesterin wurden keine klinisch bedeutsamen Unterschiede zwischen den mit Olanzapin behandelten Patienten und den mit Placebo behandelten Patienten beobachtet. Die mittleren Anstiege der Nüchtern-Lipidwerte (Gesamtcholesterin, LDL-Cholesterin und Triglyceride) waren größer bei Patienten ohne Anzeichen einer Lipid-Dysregulation zu Studienbeginn, wobei eine Lipid-Dysregulation definiert war als Patienten, bei denen eine Dyslipidämie oder damit verbundene Nebenwirkungen diagnostiziert wurden, Patienten, die mit lipidsenkenden Mitteln behandelt wurden, oder Patienten mit hohen Grundlinien-Lipidspiegeln.
In Langzeitstudien (mindestens 48 Wochen) wiesen die Patienten gegenüber dem Ausgangswert Anstiege des mittleren Nüchtern-Gesamtcholesterins, des LDL-Cholesterins und der Triglyceride um 5,6 mg/dl, 2,5 mg/dl bzw. 18,7 mg/dl und einen Mittelwert auf Abnahme des Nüchtern-HDL-Cholesterins um 0,16 mg/dL. In einer Analyse von Patienten, die eine 12-monatige Therapie abgeschlossen hatten, stieg das mittlere Gesamtcholesterin nicht nüchtern nach etwa 4–6 Monaten nicht weiter an.
Der Anteil der Patienten, die (mindestens einmal) Veränderungen des Gesamtcholesterins, des LDL-Cholesterins oder der Triglyceride von normal oder grenzwertig zu hoch oder Veränderungen des HDL-Cholesterins von normal oder grenzwertig zu niedrig aufwiesen, war in Langzeitstudien (mindestens 48 Wochen) größer. im Vergleich zu Kurzzeitstudien. Tabelle 4 zeigt kategoriale Änderungen der Nüchtern-Lipidwerte.
In Phase 1 der Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE) über eine mediane Exposition von 9,2 Monaten betrug der mittlere Anstieg der Triglyceride bei Patienten, die Olanzapin einnahmen, 40,5 mg/dl. In Phase 1 von CATIE betrug der mittlere Anstieg des Gesamtcholesterins 9,4 mg/dL.
Olanzapin-Monotherapie bei Jugendlichen
Die Sicherheit und Wirksamkeit von Olanzapin wurde bei Patienten unter 13 Jahren nicht nachgewiesen. In einer Analyse von 3 Placebo-kontrollierten Olanzapin-Monotherapie-Studien mit Jugendlichen, einschließlich solcher mit Schizophrenie (6 Wochen) oder Bipolar-I-Störung (manische oder gemischte Episoden) (3 Wochen), zeigten mit Olanzapin behandelte Jugendliche gegenüber dem Ausgangswert einen Anstieg des mittleren Nüchtern-Gesamtcholesterins, LDL Cholesterin und Triglyceride von 12,9 mg/dl, 6,5 mg/dl bzw. 28,4 mg/dl, verglichen mit einem Anstieg des mittleren Nüchtern-Gesamtcholesterins und LDL-Cholesterin um 1,3 mg/dl und 1,0 mg/dl gegenüber dem Ausgangswert und einer Abnahme in Triglyceriden von 1,1 mg/dl für mit Placebo behandelte Jugendliche. Beim Nüchtern-HDL-Cholesterin wurden keine klinisch bedeutsamen Unterschiede zwischen mit Olanzapin behandelten Jugendlichen und mit Placebo behandelten Jugendlichen beobachtet.
In Langzeitstudien (mindestens 24 Wochen) wiesen Jugendliche gegenüber dem Ausgangswert Anstiege des mittleren Nüchtern-Gesamtcholesterins, des LDL-Cholesterins und der Triglyzeride um 5,5 mg/dl, 5,4 mg/dl bzw. 20,5 mg/dl und einen Mittelwert auf Senkung des Nüchtern-HDL-Cholesterins um 4,5 mg/dL. Tabelle 5 zeigt kategoriale Veränderungen der Nüchtern-Lipidwerte bei Jugendlichen.
Gewichtszunahme
Mögliche Folgen einer Gewichtszunahme sollten vor Beginn der Behandlung mit Olanzapin berücksichtigt werden. Patienten, die Olanzapin erhalten, sollten regelmäßig ihr Gewicht kontrollieren [siehe Informationen zur Patientenberatung ].
Olanzapin-Monotherapie bei Erwachsenen
In einer Analyse von 13 placebokontrollierten Olanzapin-Monotherapiestudien nahmen die mit Olanzapin behandelten Patienten durchschnittlich 2,6 kg (5,7 lb) zu, verglichen mit einem durchschnittlichen Gewichtsverlust von 0,3 kg (0,6 lb) bei den mit Placebo behandelten Patienten bei einer medianen Exposition von 6 Wochen ; 22,2 % der mit Olanzapin behandelten Patienten nahmen mindestens 7 % ihres Ausgangsgewichts zu, verglichen mit 3 % der mit Placebo behandelten Patienten, mit einer medianen Exposition gegenüber dem Ereignis von 8 Wochen; 4,2 % der mit Olanzapin behandelten Patienten nahmen mindestens 15 % ihres Ausgangsgewichts zu, verglichen mit 0,3 % der mit Placebo behandelten Patienten, bei einer medianen Exposition gegenüber dem Ereignis von 12 Wochen. Eine klinisch signifikante Gewichtszunahme wurde in allen Baseline-Kategorien des Body-Mass-Index (BMI) beobachtet. Bei 0,2 % der mit Olanzapin behandelten Patienten und bei 0 % der mit Placebo behandelten Patienten kam es zu einem Abbruch aufgrund einer Gewichtszunahme.
In Langzeitstudien (mindestens 48 Wochen) betrug die mittlere Gewichtszunahme 5,6 kg (12,3 lb) (mediane Exposition von 573 Tagen, N=2021). Die Prozentsätze der Patienten, die bei Langzeitexposition mindestens 7 %, 15 % oder 25 % ihres Körpergewichts zu Beginn der Studie zunahmen, betrugen 64 %, 32 % bzw. 12 %. Bei 0,4 % der mit Olanzapin behandelten Patienten kam es nach mindestens 48-wöchiger Exposition zu einem Abbruch aufgrund einer Gewichtszunahme.
Tabelle 6 enthält gepoolte Daten zur Gewichtszunahme von Erwachsenen mit Olanzapin aus 86 klinischen Studien. Die Daten in jeder Spalte stellen Daten für diejenigen Patienten dar, die Behandlungsperioden der angegebenen Dauer abgeschlossen haben.
Dosisgruppenunterschiede in Bezug auf die Gewichtszunahme wurden beobachtet. In einer einzelnen 8-wöchigen randomisierten, doppelblinden Studie mit fester Dosis, die 10 (N = 199), 20 (N = 200) und 40 (N = 200) mg/Tag orales Olanzapin bei erwachsenen Patienten mit Schizophrenie oder schizoaffektiven Störungen verglich, mittlere Gewichtszunahme vom Ausgangswert bis zum Endpunkt (10 mg/Tag: 1,9 kg; 20 mg/Tag: 2,3 kg; 40 mg/Tag: 3 kg) wurde mit signifikanten Unterschieden zwischen 10 mg/Tag und 40 mg/Tag beobachtet.
Olanzapin-Monotherapie bei Jugendlichen
Die Sicherheit und Wirksamkeit von Olanzapin wurde bei Patienten unter 13 Jahren nicht nachgewiesen. Die mittlere Gewichtszunahme war bei Jugendlichen größer als bei Erwachsenen. In 4 placebokontrollierten Studien wurde die Behandlung aufgrund von Gewichtszunahme bei 1 % der mit Olanzapin behandelten Patienten abgebrochen, verglichen mit 0 % der mit Placebo behandelten Patienten.
In Langzeitstudien (mindestens 24 Wochen) betrug die mittlere Gewichtszunahme 11,2 kg (24,6 lb); (mediane Exposition von 201 Tagen, N=179). Der Prozentsatz der Jugendlichen, die bei Langzeitexposition mindestens 7 %, 15 % oder 25 % ihres Ausgangskörpergewichts zunahmen, betrug 89 %, 55 % bzw. 29 %. Bei den jugendlichen Patienten betrug die durchschnittliche Gewichtszunahme nach Ausgangs-BMI-Kategorie 11,5 kg (25,3 lb), 12,1 kg (26,6 lb) bzw. 12,7 kg (27,9 lb) für Normalgewicht (N = 106) bzw. Übergewicht (N = 26). und fettleibig (N=17). Bei 2,2 % der mit Olanzapin behandelten Patienten kam es nach mindestens 24-wöchiger Exposition zu einem Abbruch aufgrund einer Gewichtszunahme.
Tabelle 8 zeigt gepoolte Daten zur Gewichtszunahme bei Jugendlichen mit Olanzapin aus 6 klinischen Studien. Die Daten in jeder Spalte stellen Daten für diejenigen Patienten dar, die Behandlungsperioden der angegebenen Dauer abgeschlossen haben. Zur Gewichtszunahme bei Jugendlichen mit Olanzapin über eine Behandlungsdauer von 6 Monaten hinaus liegen nur wenige Daten aus klinischen Studien vor.
Tardive Dyskinesie
Bei Patienten, die mit Antipsychotika behandelt werden, kann sich ein Syndrom potenziell irreversibler, unwillkürlicher, dyskinetischer Bewegungen entwickeln. Obwohl die Prävalenz des Syndroms bei älteren Menschen, insbesondere bei älteren Frauen, am höchsten zu sein scheint, ist es unmöglich, sich auf Prävalenzschätzungen zu verlassen, um zu Beginn einer antipsychotischen Behandlung vorherzusagen, welche Patienten wahrscheinlich das Syndrom entwickeln werden. Ob Antipsychotika sich in ihrem Potenzial unterscheiden, tardive Dyskinesie zu verursachen, ist nicht bekannt.
Es wird angenommen, dass das Risiko der Entwicklung einer tardiven Dyskinesie und die Wahrscheinlichkeit, dass sie irreversibel wird, mit der Dauer der Behandlung und der kumulativen Gesamtdosis der dem Patienten verabreichten Antipsychotika zunimmt. Das Syndrom kann sich jedoch, wenn auch viel seltener, nach relativ kurzen Behandlungszeiten bei niedrigen Dosen entwickeln oder sogar nach Absetzen der Behandlung auftreten.
Spätdyskinesie kann teilweise oder vollständig zurückgehen, wenn die antipsychotische Behandlung abgesetzt wird. Die antipsychotische Behandlung selbst kann jedoch die Anzeichen und Symptome des Syndroms unterdrücken (oder teilweise unterdrücken) und dadurch möglicherweise den zugrunde liegenden Prozess maskieren. Die Auswirkung der symptomatischen Unterdrückung auf den Langzeitverlauf des Syndroms ist unbekannt.
Angesichts dieser Überlegungen sollte Olanzapin so verschrieben werden, dass das Auftreten von tardiven Dyskinesien am wahrscheinlichsten minimiert wird. Eine chronische Behandlung mit Antipsychotika sollte im Allgemeinen Patienten vorbehalten bleiben, (1) die an einer chronischen Krankheit leiden, von der bekannt ist, dass sie auf Antipsychotika anspricht, und (2) für die alternative, ebenso wirksame, aber möglicherweise weniger schädliche Behandlungen nicht verfügbar oder angemessen sind. Bei Patienten, die eine chronische Behandlung benötigen, sollte die niedrigste Dosis und die kürzeste Behandlungsdauer angestrebt werden, die ein zufriedenstellendes klinisches Ansprechen bewirken. Die Notwendigkeit einer Fortsetzung der Behandlung sollte regelmäßig überprüft werden.
Wenn bei einem mit Olanzapin behandelten Patienten Anzeichen und Symptome einer tardiven Dyskinesie auftreten, sollte ein Absetzen des Arzneimittels in Betracht gezogen werden. Einige Patienten können jedoch trotz des Syndroms eine Behandlung mit Olanzapin benötigen.
Spezifische Informationen zu den Warnhinweisen zu Lithium oder Valproat finden Sie im Abschnitt „Warnhinweise“ der Packungsbeilagen dieser anderen Produkte.
Orthostatische Hypotonie
Olanzapin kann eine orthostatische Hypotonie hervorrufen, die mit Schwindel, Tachykardie, Bradykardie und bei manchen Patienten mit Synkopen einhergeht, insbesondere während der anfänglichen Dosistitrationsphase, was wahrscheinlich seine α1-adrenergen antagonistischen Eigenschaften widerspiegelt [siehe Informationen zur Patientenberatung ].
Aus einer Analyse der Vitalfunktionsdaten in einer integrierten Datenbank von 41 abgeschlossenen klinischen Studien bei erwachsenen Patienten, die mit oralem Olanzapin behandelt wurden, wurde bei ≥ 20 % (1277/6030) der Patienten eine orthostatische Hypotonie festgestellt.
Bei einer oralen Olanzapin-Therapie kann das Risiko einer orthostatischen Hypotonie und Synkope minimiert werden, indem die Therapie mit 5 mg QD begonnen wird [siehe DOSIERUNG UND ANWENDUNG ]. Bei Auftreten einer Hypotonie sollte eine langsamere Titration auf die Zieldosis in Betracht gezogen werden.
Hypotonie, Bradykardie mit oder ohne Hypotonie, Tachykardie und Synkope wurden auch während der klinischen Studien mit intramuskulärem Olanzapin zur Injektion berichtet. In einer offenen klinisch-pharmakologischen Studie an nicht aufgeregten Patienten mit Schizophrenie, in der die Sicherheit und Verträglichkeit von intramuskulärem Olanzapin unter einem maximalen Dosierungsschema (drei 10-mg-Dosen im Abstand von 4 Stunden verabreicht) untersucht wurden, trat bei etwa einem Drittel dieser Patienten eine signifikante Wirkung auf orthostatischer Abfall des systolischen Blutdrucks (dh Abfall ≥ 30 mmHg) [vgl DOSIERUNG UND ANWENDUNG ]. Synkopen wurden bei 0,6 % (15/2500) der mit Olanzapin behandelten Patienten in Phase-2-3-Studien mit oralem Olanzapin und bei 0,3 % (2/722) der mit Olanzapin behandelten Patienten mit Agitiertheit in den intramuskulären Olanzapin-Injektionsstudien berichtet. Bei drei gesunden Freiwilligen in Phase-1-Studien mit intramuskulärem Olanzapin traten Hypotonie, Bradykardie und Sinuspausen von bis zu 6 Sekunden auf, die sich spontan zurückbildeten (in 2 Fällen traten die Reaktionen unter intramuskulärem Olanzapin und in 1 Fall unter oralem Olanzapin auf). Das Risiko für diese Abfolge von Hypotonie, Bradykardie und Sinuspause kann bei nichtpsychiatrischen Patienten größer sein als bei psychiatrischen Patienten, die möglicherweise besser an bestimmte Wirkungen von Psychopharmaka angepasst sind. Bei intramuskulärer Olanzapin-Injektionstherapie sollten Patienten liegen bleiben, wenn sie nach der Injektion schläfrig oder schwindelig werden, bis die Untersuchung zeigt, dass sie keine orthostatische Hypotonie, Bradykardie und/oder Hypoventilation haben.
Olanzapin sollte mit besonderer Vorsicht bei Patienten mit bekannter kardiovaskulärer Erkrankung (Myokardinfarkt oder Ischämie in der Vorgeschichte, Herzinsuffizienz oder Leitungsstörungen), zerebrovaskulärer Erkrankung und Zuständen angewendet werden, die Patienten für Hypotonie prädisponieren würden (Dehydratation, Hypovolämie und Behandlung mit blutdrucksenkenden Medikamenten). ), wenn das Auftreten von Synkopen oder Hypotonie und/oder Bradykardie den Patienten einem erhöhten medizinischen Risiko aussetzen könnte.
Vorsicht ist geboten bei Patienten, die mit anderen Arzneimitteln behandelt werden, deren Wirkung Hypotonie, Bradykardie, Depression der Atemwege oder des Zentralnervensystems hervorrufen kann [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Die gleichzeitige Verabreichung von intramuskulärem Olanzapin und parenteralem Benzodiazepin wird aufgrund der Möglichkeit einer übermäßigen Sedierung und kardiorespiratorischen Depression nicht empfohlen.
Stürze
ZYPREXA kann Somnolenz, orthostatische Hypotonie, motorische und sensorische Instabilität verursachen, was zu Stürzen und folglich zu Knochenbrüchen oder anderen Verletzungen führen kann. Führen Sie bei Patienten mit Krankheiten, Zuständen oder Medikamenten, die diese Wirkungen verschlimmern könnten, zu Beginn einer antipsychotischen Behandlung und wiederholt bei Patienten unter einer langfristigen antipsychotischen Therapie eine Sturzrisikobewertung durch.
Leukopenie, Neutropenie und Agranulozytose
Klasseneffekt
In klinischen Studien und/oder Erfahrungen nach Markteinführung wurden Fälle von Leukopenie/Neutropenie in zeitlichem Zusammenhang mit Antipsychotika, einschließlich ZYPREXA, berichtet. Agranulozytose wurde ebenfalls berichtet.
Mögliche Risikofaktoren für Leukopenie/Neutropenie sind eine vorbestehende niedrige Anzahl weißer Blutkörperchen (WBC) und eine arzneimittelinduzierte Leukopenie/Neutropenie in der Vorgeschichte. Bei Patienten mit klinisch signifikant niedrigen WBC oder arzneimittelinduzierter Leukopenie/Neutropenie in der Anamnese sollte ihr komplettes Blutbild (CBC) während der ersten Monate der Therapie häufig überwacht werden, und ein Absetzen von ZYPREXA sollte bei den ersten Anzeichen einer klinisch signifikanten Verschlechterung in Betracht gezogen werden in WBC in Abwesenheit anderer ursächlicher Faktoren.
Patienten mit klinisch signifikanter Neutropenie sollten sorgfältig auf Fieber oder andere Symptome oder Anzeichen einer Infektion überwacht und unverzüglich behandelt werden, wenn solche Symptome oder Anzeichen auftreten. Patienten mit schwerer Neutropenie (absolute Neutrophilenzahl
Dysphagie
Dysmotilität und Aspiration des Ösophagus wurden mit dem Gebrauch von Antipsychotika in Verbindung gebracht. Aspirationspneumonie ist eine häufige Ursache für Morbidität und Mortalität bei Patienten mit fortgeschrittener Alzheimer-Krankheit. Olanzapin ist nicht für die Behandlung von Patienten mit Alzheimer-Krankheit zugelassen.
Krampfanfälle
Während der Tests vor Markteinführung traten bei 0,9 % (22/2500) der mit Olanzapin behandelten Patienten Krampfanfälle auf. Es gab verwirrende Faktoren, die in vielen dieser Fälle zum Auftreten von Anfällen beigetragen haben könnten. Olanzapin sollte bei Patienten mit Krampfanfällen in der Vorgeschichte oder mit Erkrankungen, die möglicherweise die Krampfschwelle senken, z. B. Alzheimer-Demenz, mit Vorsicht angewendet werden. Olanzapin ist nicht für die Behandlung von Patienten mit Alzheimer-Krankheit zugelassen. Zustände, die die Anfallsschwelle senken, können in einer Bevölkerung von 65 Jahren oder älter häufiger auftreten.
Potenzial für kognitive und motorische Beeinträchtigungen
Somnolenz war eine häufig berichtete Nebenwirkung im Zusammenhang mit der Behandlung mit Olanzapin, die bei Olanzapin-Patienten mit einer Inzidenz von 26 % im Vergleich zu 15 % bei Placebo-Patienten auftrat. Diese Nebenwirkung war ebenfalls dosisabhängig. Schläfrigkeit führte bei 0,4 % (9/2500) der Patienten in der Premarketing-Datenbank zum Absetzen.
Da Olanzapin das Urteilsvermögen, das Denkvermögen oder die motorischen Fähigkeiten beeinträchtigen kann, sollten Patienten davor gewarnt werden, gefährliche Maschinen, einschließlich Kraftfahrzeuge, zu bedienen, bis sie hinreichend sicher sind, dass die Olanzapin-Therapie sie nicht nachteilig beeinflusst [siehe Informationen zur Patientenberatung ].
Regulierung der Körpertemperatur
Eine Störung der Fähigkeit des Körpers, die Körperkerntemperatur zu senken, wurde Antipsychotika zugeschrieben. Bei der Verschreibung von Olanzapin für Patienten mit Erkrankungen, die zu einer Erhöhung der Körperkerntemperatur beitragen können, z. B. anstrengende körperliche Betätigung, extreme Hitzeeinwirkung, gleichzeitige Einnahme von Arzneimitteln mit anticholinerger Wirkung oder Dehydrierung, ist bei der Verschreibung von Olanzapin angemessene Vorsicht geboten [siehe INFORMATIONEN ZUM PATIENTEN ].
Anwendung bei Patienten mit Begleiterkrankungen
Die klinische Erfahrung mit Olanzapin bei Patienten mit bestimmten systemischen Begleiterkrankungen ist begrenzt [siehe KLINISCHE PHARMAKOLOGIE ].
Olanzapin weist in vitro eine Affinität zu Muskarinrezeptoren auf. In klinischen Studien vor der Markteinführung mit Olanzapin wurde Olanzapin mit Verstopfung, Mundtrockenheit und Tachykardie in Verbindung gebracht, wobei alle Nebenwirkungen möglicherweise mit einem cholinergen Antagonismus zusammenhängen. Solche Nebenwirkungen waren nicht oft die Grundlage für das Absetzen von Olanzapin, aber Olanzapin sollte bei Patienten mit klinisch signifikanter Prostatahypertrophie, Engwinkelglaukom oder paralytischem Ileus oder verwandten Erkrankungen in der Vorgeschichte mit Vorsicht angewendet werden.
In 5 placebokontrollierten Studien zu Olanzapin bei älteren Patienten mit demenzbedingter Psychose (n = 1184) wurden die folgenden behandlungsbedingten Nebenwirkungen bei mit Olanzapin behandelten Patienten mit einer Inzidenz von mindestens 2 % und signifikant häufiger als bei Placebo berichtet: behandelte Patienten: Stürze, Somnolenz, periphere Ödeme, anomaler Gang, Harninkontinenz, Lethargie, Gewichtszunahme, Asthenie, Pyrexie, Lungenentzündung, Mundtrockenheit und visuelle Halluzinationen. Die Abbruchrate aufgrund von Nebenwirkungen war unter Olanzapin höher als unter Placebo (13 % vs. 7 %). Ältere Patienten mit demenzbedingter Psychose, die mit Olanzapin behandelt werden, haben im Vergleich zu Placebo ein erhöhtes Sterberisiko. Olanzapin ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen [siehe Eingerahmte Warnung , Ältere Patienten mit demenzbedingter Psychose , und INFORMATIONEN ZUM PATIENTEN ].
Olanzapin wurde bei Patienten mit kürzlich aufgetretenem Myokardinfarkt oder instabiler Herzerkrankung nicht untersucht oder in nennenswertem Umfang angewendet. Patienten mit diesen Diagnosen wurden von klinischen Premarketing-Studien ausgeschlossen. Aufgrund des Risikos einer orthostatischen Hypotonie unter Olanzapin ist bei Herzpatienten Vorsicht geboten [siehe Orthostatische Hypotonie ].
Hyperprolaktinämie
Wie bei anderen Arzneimitteln, die Dopamin-D2-Rezeptoren antagonisieren, erhöht Olanzapin die Prolaktinspiegel, und die Erhöhung bleibt während der chronischen Verabreichung bestehen. Hyperprolaktinämie kann das hypothalamische GnRH unterdrücken, was zu einer verringerten Gonadotropin-Sekretion der Hypophyse führt. Dies wiederum kann die Fortpflanzungsfunktion hemmen, indem es die gonadale Steroidogenese sowohl bei weiblichen als auch bei männlichen Patienten beeinträchtigt. Galaktorrhoe, Amenorrhoe, Gynäkomastie und Impotenz wurden bei Patienten berichtet, die Prolaktin-erhöhende Präparate erhielten. Langanhaltende Hyperprolaktinämie in Verbindung mit Hypogonadismus kann sowohl bei weiblichen als auch bei männlichen Probanden zu einer verminderten Knochendichte führen.
Gewebekulturexperimente weisen darauf hin, dass ungefähr ein Drittel der menschlichen Brustkrebserkrankungen in vitro Prolaktin-abhängig sind, ein Faktor von potenzieller Bedeutung, wenn die Verschreibung dieser Arzneimittel bei einem Patienten mit zuvor festgestelltem Brustkrebs in Erwägung gezogen wird. Wie es bei Verbindungen üblich ist, die die Prolaktinfreisetzung erhöhen, wurde in den Karzinogenitätsstudien von Olanzapin, die an Mäusen und Ratten durchgeführt wurden, eine Zunahme der Brustdrüsenneoplasie beobachtet [siehe Nichtklinische Toxikologie ]. Weder bisher durchgeführte klinische Studien noch epidemiologische Studien haben einen Zusammenhang zwischen der chronischen Verabreichung dieser Arzneimittelklasse und der Tumorentstehung beim Menschen gezeigt; Die verfügbaren Beweise gelten als zu begrenzt, um zum jetzigen Zeitpunkt schlüssig zu sein.
In placebokontrollierten klinischen Olanzapin-Studien (bis zu 12 Wochen) wurden bei 30 % der mit Olanzapin behandelten Erwachsenen im Vergleich zu 10,5 % der mit Placebo behandelten Erwachsenen Veränderungen von normalen zu hohen Prolaktinkonzentrationen beobachtet. In einer gepoolten Analyse aus klinischen Studien mit 8136 Erwachsenen, die mit Olanzapin behandelt wurden, umfassten möglicherweise damit verbundene klinische Manifestationen menstruationsbedingte Ereignisse1 (2 % [49/3240] der Frauen), sexuelle funktionsbedingte Ereignisse2 (2 % [150/8136] der Frauen). und Männer) und brustbezogene Ereignisse3 (0,7 % [23/3240] der Frauen, 0,2 % [9/4896] der Männer).
In placebokontrollierten Olanzapin-Monotherapie-Studien bei jugendlichen Patienten (bis zu 6 Wochen) mit Schizophrenie oder Bipolar-I-Störung (manische oder gemischte Episoden) wurden bei 47 % der mit Olanzapin behandelten Patienten im Vergleich zu 7 % Veränderungen von normalen zu hohen Prolaktinkonzentrationen beobachtet % der mit Placebo behandelten Patienten. In einer gepoolten Analyse aus klinischen Studien mit 454 Jugendlichen, die mit Olanzapin behandelt wurden, umfassten potenziell assoziierte klinische Manifestationen menstruationsbedingte Ereignisse1 (1 % [2/168] der Frauen) und Ereignisse im Zusammenhang mit der Sexualfunktion2 (0,7 % [3/454] der Frauen und Männer ) und brustbezogene Ereignisse3 (2 % [3/168] der Frauen, 2 % [7/286] der Männer) [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
1 Basierend auf einer Suche nach den folgenden Begriffen: Amenorrhoe, Hypomenorrhoe, verzögerte Menstruation und Oligomenorrhoe.
2 Basierend auf einer Suche nach den folgenden Begriffen: Anorgasmie, verzögerte Ejakulation, erektile Dysfunktion, verminderte Libido, Verlust der Libido, abnormaler Orgasmus und sexuelle Dysfunktion.
Basierend auf einer Suche nach den folgenden Begriffen: Brustentladung, Vergrößerung oder Schwellung, Galaktorrhoe, Gynäkomastie und Laktationsstörung.
Dosisgruppenunterschiede in Bezug auf die Prolaktinerhöhung wurden beobachtet. In einer einzigen 8-wöchigen randomisierten, doppelblinden Studie mit fester Dosis, in der 10 (N = 199), 20 (N = 200) und 40 (N = 200) mg/Tag orales Olanzapin bei erwachsenen Patienten mit Schizophrenie oder Schizoaffektiven verglichen wurden Störung, Inzidenz von Prolaktinerhöhung > 24,2 ng/ml (Frauen) oder > 18,77 ng/ml (Männer) zu irgendeinem Zeitpunkt während der Studie (10 mg/Tag: 31,2 %; 20 mg/Tag: 42,7 %; 40 mg/Tag : 61,1 %) zeigten signifikante Unterschiede zwischen 10 vs. 40 mg/Tag und 20 vs. 40 mg/Tag.
Verwendung in Kombination mit Fluoxetin, Lithium oder Valproat
Bei der Kombination von ZYPREXA und Fluoxetin sollte der verschreibende Arzt auch den Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“ in der Packungsbeilage von Symbyax beachten. Bei der Anwendung von ZYPREXA in Kombination mit Lithium oder Valproat sollte der verschreibende Arzt die Abschnitte „Warnhinweise und Vorsichtsmaßnahmen“ der Packungsbeilagen für Lithium oder Valproat lesen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Labortests
Es wird empfohlen, zu Beginn und in regelmäßigen Abständen während der Behandlung Blutzuckerwerte und Lipidprofile auf nüchternen Magen zu testen [siehe Stoffwechselveränderungen und INFORMATIONEN ZUM PATIENTEN ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente ) für die oralen Formulierungen.
Die Patienten sollten auf die folgenden Probleme hingewiesen und gebeten werden, ihren verschreibenden Arzt zu informieren, wenn diese während der Einnahme von ZYPREXA 15 mg als Monotherapie oder in Kombination mit Fluoxetin auftreten. Wenn Sie glauben, dass es Ihnen während der Einnahme von ZYPREXA 2,5 mg nicht besser geht oder Sie Bedenken hinsichtlich Ihres Zustands haben, wenden Sie sich an Ihren Arzt. Wenn Sie ZYPREXA und Fluoxetin in Kombination anwenden, lesen Sie auch den Abschnitt Informationen zur Patientenberatung in der Packungsbeilage von Symbyax.
Ältere Patienten mit demenzbedingter Psychose: Erhöhte Mortalität und zerebrovaskuläre unerwünschte Ereignisse (CVAE), einschließlich Schlaganfall
Patienten und Betreuer sollten darauf hingewiesen werden, dass ältere Patienten mit demenzbedingter Psychose, die mit Antipsychotika behandelt werden, einem erhöhten Sterberisiko ausgesetzt sind. Patienten und Betreuer sollten darauf hingewiesen werden, dass ältere Patienten mit demenzbedingter Psychose, die mit ZYPREXA behandelt wurden, im Vergleich zu Placebo eine signifikant höhere Inzidenz von zerebrovaskulären unerwünschten Ereignissen (z. B. Schlaganfall, transitorische ischämische Attacke) hatten.
ZYPREXA ist nicht für ältere Patienten mit demenzbedingter Psychose zugelassen [siehe Eingerahmte Warnung und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Malignes neuroleptisches Syndrom (NMS)
Patienten und Betreuer sollten darauf hingewiesen werden, dass im Zusammenhang mit der Verabreichung von Antipsychotika, einschließlich ZYPREXA, über einen potenziell tödlichen Symptomkomplex berichtet wurde, der manchmal als NMS bezeichnet wird. Zu den Anzeichen und Symptomen von NMS gehören Hyperpyrexie, Muskelstarrheit, veränderter Geisteszustand und Anzeichen einer autonomen Instabilität (unregelmäßiger Puls oder Blutdruck, Tachykardie, Diaphorese und Herzrhythmusstörungen) [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS)
Patienten sollten darauf hingewiesen werden, dass sie sich so bald wie möglich bei ihrem Arzt melden, wenn Anzeichen und Symptome auftreten, die mit einem Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS) in Zusammenhang stehen können [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hyperglykämie und Diabetes mellitus
Die Patienten sollten auf das potenzielle Risiko von Hyperglykämie-bedingten Nebenwirkungen hingewiesen werden. Die Patienten sollten regelmäßig auf eine Verschlechterung der Glukosekontrolle überwacht werden. Patienten mit Diabetes sollten die Anweisungen ihres Arztes befolgen, wie oft sie ihren Blutzucker während der Einnahme von ZYPREXA kontrollieren müssen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Dyslipidämie
Die Patienten sollten darauf hingewiesen werden, dass während der Behandlung mit ZYPREXA eine Dyslipidämie aufgetreten ist. Patienten sollten ihr Lipidprofil regelmäßig überwachen lassen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Gewichtszunahme
Die Patienten sollten darauf hingewiesen werden, dass es während der Behandlung mit ZYPREXA zu einer Gewichtszunahme gekommen ist. Das Gewicht der Patienten sollte regelmäßig überwacht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Orthostatische Hypotonie
Die Patienten sollten auf das Risiko einer orthostatischen Hypotonie hingewiesen werden, insbesondere während der anfänglichen Dosistitration und in Verbindung mit der gleichzeitigen Anwendung von Arzneimitteln, die die orthostatische Wirkung von ZYPREXA verstärken können, z WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Den Patienten sollte geraten werden, ihre Position vorsichtig zu wechseln, um eine orthostatische Hypotonie zu vermeiden, und sich hinzulegen, wenn ihnen schwindelig oder ohnmächtig wird, bis sie sich besser fühlen. Patienten sollten angewiesen werden, ihren Arzt anzurufen, wenn bei ihnen eines der folgenden Anzeichen und Symptome im Zusammenhang mit orthostatischer Hypotonie auftritt: Schwindel, schneller oder langsamer Herzschlag oder Ohnmacht.
Potenzial für kognitive und motorische Beeinträchtigungen
Da ZYPREXA das Urteilsvermögen, Denkvermögen oder motorische Fähigkeiten beeinträchtigen kann, sollten Patienten davor gewarnt werden, gefährliche Maschinen, einschließlich Autos, zu bedienen, bis sie hinreichend sicher sind, dass die ZYPREXA-Therapie sie nicht beeinträchtigt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Regulierung der Körpertemperatur
Die Patienten sollten über angemessene Vorsichtsmaßnahmen zur Vermeidung von Überhitzung und Austrocknung aufgeklärt werden. Patienten sollten darauf hingewiesen werden, sofort ihren Arzt anzurufen, wenn sie ernsthaft krank werden und einige oder alle der folgenden Symptome einer Dehydratation aufweisen: übermäßiges oder gar kein Schwitzen, Mundtrockenheit, starkes Hitzegefühl, Durstgefühl, kein Urin produzieren [ sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Begleitmedikation
Patienten sollten angewiesen werden, ihren Arzt zu informieren, wenn sie Symbyax einnehmen oder einnehmen möchten. Patienten sollten auch angewiesen werden, ihren Arzt zu informieren, wenn sie verschreibungspflichtige oder rezeptfreie Arzneimittel, einschließlich pflanzlicher Nahrungsergänzungsmittel, einnehmen, einnehmen oder abgesetzt haben, da die Möglichkeit von Wechselwirkungen besteht [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Alkohol
Den Patienten sollte geraten werden, Alkohol während der Einnahme von ZYPREXA zu vermeiden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Phenylketonurika
ZYPREXA 10 mg ZYDIS (Olanzapin-Tabletten zum Einnehmen) enthält Phenylalanin (0,34, 0,45, 0,67 oder 0,90 mg pro 5-, 10-, 15- oder 20-mg-Tablette) [siehe BEZEICHNUNG ].
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Raten Sie Frauen, ihren Arzt zu informieren, wenn sie während der Behandlung mit ZYPREXA schwanger werden oder eine Schwangerschaft planen. Weisen Sie die Patienten darauf hin, dass ZYPREXA bei Neugeborenen extrapyramidale Symptome und/oder Entzugssymptome (Agitiertheit, Hypertonie, Hypotonie, Tremor, Somnolenz, Atemnot und Fütterstörungen) hervorrufen kann. Weisen Sie die Patientinnen darauf hin, dass es ein Schwangerschafts-Expositionsregister gibt, das den Ausgang der Schwangerschaft bei Frauen überwacht, die während der Schwangerschaft ZYPREXA 7,5 mg ausgesetzt waren [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Stillzeit
Raten Sie stillenden Frauen, die ZYPREXA 20 mg anwenden, Säuglinge auf übermäßige Sedierung, Reizbarkeit, schlechte Ernährung und extrapyramidale Symptome (Zittern und anormale Muskelbewegungen) zu überwachen und einen Arzt aufzusuchen, wenn sie diese Anzeichen bemerken. [sehen Verwendung in bestimmten Bevölkerungsgruppen ].
Unfruchtbarkeit
Weisen Sie gebärfähige Frauen darauf hin, dass ZYPREXA die Fruchtbarkeit aufgrund eines Anstiegs der Prolaktinspiegel im Serum beeinträchtigen kann. Die Auswirkungen auf die Fertilität sind reversibel [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Pädiatrische Verwendung
ZYPREXA 15 mg ist indiziert zur Behandlung von Schizophrenie und manischen oder gemischten Episoden im Zusammenhang mit einer Bipolar-I-Störung bei Jugendlichen im Alter von 13 bis 17 Jahren. Im Vergleich zu Patienten aus klinischen Studien mit Erwachsenen nahmen Jugendliche wahrscheinlich mehr zu, erlebten eine stärkere Sedierung und zeigten einen stärkeren Anstieg des Gesamtcholesterins, der Triglyceride, des LDL-Cholesterins, des Prolaktins und der hepatischen Aminotransferase. Die Patienten sollten über die potenziellen Langzeitrisiken im Zusammenhang mit ZYPREXA aufgeklärt und darauf hingewiesen werden, dass diese Risiken sie dazu veranlassen können, zuerst andere Arzneimittel in Betracht zu ziehen [siehe INDIKATIONEN UND VERWENDUNG ]. Sicherheit und Wirksamkeit von ZYPREXA 5 mg bei Patienten unter 13 Jahren sind nicht erwiesen. Sicherheit und Wirksamkeit von ZYPREXA 15 mg und Fluoxetin in Kombination bei Patienten im Alter von 10 bis 17 Jahren wurden für die akute Behandlung von depressiven Episoden im Zusammenhang mit einer Bipolar-I-Störung nachgewiesen. Sicherheit und Wirksamkeit von ZYPREXA und Fluoxetin in Kombination bei Patienten unter 10 Jahren sind nicht erwiesen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Notwendigkeit eines umfassenden Behandlungsprogramms bei pädiatrischen Patienten
ZYPREXA 20 mg ist als integraler Bestandteil eines Gesamtbehandlungsprogramms für pädiatrische Patienten mit Schizophrenie und bipolarer Störung indiziert, das andere (psychologische, erzieherische, soziale) Maßnahmen für Patienten mit dieser Störung umfassen kann. Wirksamkeit und Sicherheit von ZYPREXA 7,5 mg wurden bei pädiatrischen Patienten unter 13 Jahren nicht nachgewiesen. Atypische Antipsychotika sind nicht für die Anwendung bei pädiatrischen Patienten bestimmt, die Symptome aufweisen, die auf Umweltfaktoren und/oder andere primäre psychiatrische Störungen zurückzuführen sind. Eine angemessene schulische Unterbringung ist unerlässlich, und psychosoziale Interventionen sind oft hilfreich. Die Entscheidung, atypische antipsychotische Medikamente zu verschreiben, hängt von der Beurteilung der Chronizität und Schwere der Symptome des Patienten durch den Gesundheitsdienstleister ab [siehe INDIKATIONEN UND VERWENDUNG ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Orale Karzinogenitätsstudien wurden an Mäusen und Ratten durchgeführt. Olanzapin wurde Mäusen in zwei 78-wöchigen Studien in Dosen von 3, 10, 30/20 mg/kg/Tag (entspricht dem 0,8- bis 5-fachen der täglichen oralen MRHD, basierend auf mg/m² Körperoberfläche) und 0,25, 2 verabreicht , 8 mg/kg/Tag (entsprechend dem 0,06- bis 2-fachen der täglichen oralen MRHD, basierend auf mg/m² Körperoberfläche). Ratten wurden 2 Jahre lang mit Dosen von 0,25, 1, 2,5, 4 mg/kg/Tag (Männchen) und 0,25, 1, 4, 8 mg/kg/Tag (Weibchen) (entsprechend 0,13-2 und 0,13-4) behandelt multipliziert mit der täglichen oralen MRHD, bezogen auf mg/m² Körperoberfläche). Die Inzidenz von Leberhämangiomen und Hämangiosarkomen war in 1 Mausstudie an weiblichen Mäusen bei 2-facher täglicher oraler MRHD, bezogen auf mg/m² Körperoberfläche, signifikant erhöht. Diese Tumore wurden in einer anderen Mausstudie an weiblichen Tieren, denen das 2- bis 5-fache der täglichen oralen MRHD, basierend auf mg/m² Körperoberfläche, verabreicht wurde, nicht vermehrt; In dieser Studie gab es eine hohe Inzidenz früher Todesfälle bei Männern der Gruppe mit 30/20 mg/kg/Tag. Die Inzidenz von Adenomen und Adenokarzinomen der Brustdrüse war bei weiblichen Mäusen mit einer Dosis von ≥ 2 mg/kg/Tag und bei weiblichen Ratten mit einer Dosis von ≥ 4 mg/kg/Tag (das 0,5- und 2-fache der täglichen oralen MRHD, basierend auf mg/m²) signifikant erhöht Körperoberfläche). Es wurde gezeigt, dass Antipsychotika den Prolaktinspiegel bei Nagetieren chronisch erhöhen. Die Prolaktinspiegel im Serum wurden während der Studien zur Karzinogenität von Olanzapin nicht gemessen; Messungen während der Studien zur subchronischen Toxizität zeigten jedoch, dass Olanzapin bei Ratten bei denselben Dosen, die in der Karzinogenitätsstudie verwendet wurden, die Serumprolaktinspiegel um das bis zu 4-Fache erhöhte. Bei Nagetieren wurde nach chronischer Verabreichung anderer Antipsychotika eine Zunahme von Brustdrüsenneoplasmen festgestellt, die als Prolaktin-vermittelt angesehen werden. Die Relevanz des Nachweises von Prolaktin-vermittelten endokrinen Tumoren bei Nagern für das menschliche Risiko ist nicht bekannt [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Mutagenese
Keine Hinweise auf ein genotoxisches Potenzial von Olanzapin wurden im Ames-Rückmutationstest, im In-vivo-Mikronukleustest bei Mäusen, im Chromosomenaberrationstest in Eierstockzellen des chinesischen Hamsters, im außerplanmäßigen DNA-Synthesetest in Rattenhepatozyten und im Induktions-Vorwärtsmutationstest in Maus-Lymphomzellen gefunden , oder in vivo-Schwesterchromatid-Austauschtest im Knochenmark chinesischer Hamster.
Beeinträchtigung der Fruchtbarkeit
In einer oralen Fertilitäts- und Reproduktionsleistungsstudie an Ratten wurde die männliche Paarungsleistung, aber nicht die Fertilität bei einer Dosis von 22,4 mg/kg/Tag beeinträchtigt und die weibliche Fertilität wurde bei einer Dosis von 3 mg/kg/Tag verringert (11 und 1.5 multipliziert mit der täglichen oralen MRHD, bezogen auf mg/m² Körperoberfläche). Das Absetzen der Olanzapin-Behandlung kehrte die Auswirkungen auf die männliche Paarungsleistung um. Bei weiblichen Ratten war bei 5 mg/kg/Tag (das 2,5-fache der täglichen oralen MRHD, basierend auf mg/m² Körperoberfläche) die Präkoitalperiode verlängert und der Paarungsindex verringert. Bei 1,1 mg/kg/Tag (das 0,6-fache der täglichen oralen MRHD, basierend auf mg/m² Körperoberfläche) war die Distrosis verlängert und die Brunst verzögert; Daher kann Olanzapin zu einer Verzögerung des Eisprungs führen.
Verwendung in bestimmten Bevölkerungsgruppen
Wenn Sie ZYPREXA und Fluoxetin in Kombination anwenden, lesen Sie auch den Abschnitt „Anwendung in bestimmten Populationen“ der Packungsbeilage für Symbyax.
Schwangerschaft
Schwangerschafts-Expositionsregister
Es gibt ein Schwangerschafts-Expositionsregister, das die Schwangerschaftsausgänge bei Frauen überwacht, die während der Schwangerschaft atypischen Antipsychotika, einschließlich ZYPREXA, ausgesetzt waren. Gesundheitsdienstleister werden ermutigt, Patienten zu registrieren, indem sie sich unter 1-866-961-2388 an das National Pregnancy Registry for Atypical Antipsychotics wenden oder http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/ besuchen.
Zusammenfassung der Risiken
Neugeborene, die während des dritten Trimesters Antipsychotika, einschließlich ZYPREXA, ausgesetzt waren, haben ein erhöhtes Risiko für extrapyramidale Symptome und/oder Entzugssymptome nach der Entbindung (siehe Klinische Überlegungen ). Insgesamt verfügbare Daten aus veröffentlichten epidemiologischen Studien an schwangeren Frauen, die Olanzapin ausgesetzt waren, haben kein arzneimittelbedingtes Risiko für schwerwiegende Geburtsfehler, Fehlgeburten oder unerwünschte Folgen für Mutter oder Fötus ergeben (siehe Daten ). Es bestehen Risiken für die Mutter im Zusammenhang mit unbehandelter Schizophrenie oder Bipolar-I-Störung und mit der Exposition gegenüber Antipsychotika, einschließlich ZYPREXA 7,5 mg, während der Schwangerschaft (siehe Klinische Überlegungen ).
Olanzapin war nicht teratogen, wenn es oral an trächtige Ratten und Kaninchen in Dosen verabreicht wurde, die dem 9- und 30-Fachen der täglichen oralen maximalen empfohlenen Dosis beim Menschen (MRHD) entsprachen, basierend auf mg/m² Körperoberfläche; bei diesen Dosen wurden einige fötale Toxizitäten beobachtet (vgl Daten ).
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebenen Populationen ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere unerwünschte Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 % bis 4 % bzw. 15 % bis 20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und embryo-/fetales Risiko
Es besteht ein Risiko für die Mutter durch unbehandelte Schizophrenie oder Bipolar-I-Störung, einschließlich eines erhöhten Rückfallrisikos, Krankenhausaufenthalts und Suizids. Schizophrenie und Bipolar-I-Störung sind mit erhöhten unerwünschten perinatalen Folgen, einschließlich Frühgeburten, verbunden. Es ist nicht bekannt, ob dies eine direkte Folge der Krankheit oder anderer komorbider Faktoren ist.
Fetale/neonatale Nebenwirkungen
Extrapyramidale und/oder Entzugserscheinungen, einschließlich Agitiertheit, Hypertonie, Hypotonie, Tremor, Somnolenz, Atemnot und Fütterstörungen, wurden bei Neugeborenen berichtet, die während des dritten Trimenons der Schwangerschaft Antipsychotika, einschließlich ZYPREXA 2,5 mg, ausgesetzt waren. Diese Symptome haben unterschiedliche Schweregrade. Überwachen Sie Neugeborene auf extrapyramidale und/oder Entzugserscheinungen und behandeln Sie die Symptome entsprechend. Einige Neugeborene erholten sich ohne spezifische Behandlung innerhalb von Stunden oder Tagen; andere erforderten einen längeren Krankenhausaufenthalt.
Daten
Menschliche Daten
In veröffentlichten Studienberichten wurde über eine Plazentapassage berichtet; Das Plazentapassageverhältnis war jedoch sehr unterschiedlich und lag bei der Geburt nach Exposition während der Schwangerschaft zwischen 7 % und 167 %. Die klinische Relevanz dieses Befundes ist nicht bekannt.
Veröffentlichte Daten aus Beobachtungsstudien, Geburtsregistern und Fallberichten, die die Anwendung atypischer Antipsychotika während der Schwangerschaft bewertet haben, belegen kein erhöhtes Risiko für schwere Geburtsfehler. Eine retrospektive Kohortenstudie aus einer Medicaid-Datenbank mit 9258 Frauen, die während der Schwangerschaft Antipsychotika ausgesetzt waren, zeigte kein insgesamt erhöhtes Risiko für schwere Geburtsfehler.
Tierdaten
In oralen Reproduktionsstudien an Ratten in Dosen von bis zu 18 mg/kg/Tag und an Kaninchen in Dosen von bis zu 30 mg/kg/Tag (das 9- bzw. 30-fache der täglichen oralen MRHD, basierend auf mg/m² Körperoberfläche), es wurden keine Hinweise auf Teratogenität beobachtet. In einer oralen Teratologiestudie an Ratten wurden bei einer Dosis von 18 mg/kg/Tag (das Neunfache der täglichen oralen MRHD, basierend auf mg/m² Körperoberfläche) frühe Resorptionen und eine erhöhte Anzahl nicht lebensfähiger Föten beobachtet, und die Trächtigkeit verlängerte sich bei 10 mg/kg/Tag (das Fünffache der täglichen oralen MRHD, basierend auf mg/m² Körperoberfläche). In einer oralen Teratologiestudie an Kaninchen trat bei einer für das Muttertier toxischen Dosis von 30 mg/kg/Tag (das 30-fache der täglichen oralen MRHD, basierend auf mg/m² Körperoberfläche) eine fötale Toxizität auf, die sich in erhöhten Resorptionen und vermindertem fötalen Gewicht manifestierte.
Stillzeit
Zusammenfassung der Risiken
Olanzapin ist in der Muttermilch enthalten. Es gibt Berichte über übermäßige Sedierung, Reizbarkeit, schlechte Nahrungsaufnahme und extrapyramidale Symptome (Zittern und anormale Muskelbewegungen) bei Säuglingen, die Olanzapin über die Muttermilch erhalten haben (siehe Klinische Überlegungen ). Es liegen keine Informationen über die Auswirkungen von Olanzapin auf die Milchproduktion vor.
Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an ZYPREXA und möglichen Nebenwirkungen von ZYPREXA oder der Grunderkrankung der Mutter auf das gestillte Kind berücksichtigt werden.
Klinische Überlegungen
Säuglinge, die ZYPREXA 7,5 mg ausgesetzt waren, sollten auf übermäßige Sedierung, Reizbarkeit, unzureichende Nahrungsaufnahme und extrapyramidale Symptome (Zittern und anormale Muskelbewegungen) überwacht werden.
Weibchen und Männchen mit reproduktivem Potenzial
Unfruchtbarkeit
Frauen
Basierend auf der pharmakologischen Wirkung von Olanzapin (D2-Rezeptor-Antagonismus) kann die Behandlung mit ZYPREXA zu einem Anstieg der Serum-Prolaktinspiegel führen, was zu einer reversiblen Verringerung der Fertilität bei gebärfähigen Frauen führen kann [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von oralem ZYPREXA bei der Behandlung von Schizophrenie und manischen oder gemischten Episoden im Zusammenhang mit einer Bipolar-I-Störung wurden in Kurzzeitstudien bei Jugendlichen (im Alter von 13 bis 17 Jahren) nachgewiesen. Die Anwendung von ZYPREXA bei Jugendlichen wird durch Belege aus angemessenen und gut kontrollierten Studien mit ZYPREXA 5 mg gestützt, in denen 268 Jugendliche ZYPREXA 20 mg in einem Bereich von 2,5 bis 20 mg/Tag erhielten [siehe Klinische Studien ]. Die empfohlene Anfangsdosis für Jugendliche ist niedriger als die für Erwachsene [siehe DOSIERUNG UND ANWENDUNG ]. Im Vergleich zu Patienten aus klinischen Studien mit Erwachsenen nahmen Jugendliche wahrscheinlich mehr an Gewicht zu, erlebten eine stärkere Sedierung und zeigten einen stärkeren Anstieg der Gesamtcholesterin-, Triglyzerid-, LDL-Cholesterin-, Prolaktin- und hepatischen Aminotransferasespiegel [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ]. Bei der Entscheidung zwischen den für Jugendliche verfügbaren alternativen Behandlungen sollten Ärzte das erhöhte Potenzial (bei Jugendlichen im Vergleich zu Erwachsenen) für Gewichtszunahme und Dyslipidämie berücksichtigen. Ärzte sollten bei der Verschreibung an Jugendliche die potenziellen Langzeitrisiken berücksichtigen, und in vielen Fällen kann dies dazu führen, dass sie erwägen, Jugendlichen zuerst andere Arzneimittel zu verschreiben [siehe INDIKATIONEN UND VERWENDUNG ].
Sicherheit und Wirksamkeit von Olanzapin bei Kindern unter 13 Jahren sind nicht erwiesen [siehe INFORMATIONEN ZUM PATIENTEN ].
Sicherheit und Wirksamkeit von ZYPREXA 7,5 mg und Fluoxetin in Kombination bei Kindern und Jugendlichen (im Alter von 10 bis 17 Jahren) wurden für die akute Behandlung von depressiven Episoden im Zusammenhang mit einer Bipolar-I-Störung nachgewiesen.
Die Sicherheit und Wirksamkeit von ZYPREXA und Fluoxetin in Kombination bei Kindern unter 10 Jahren ist nicht erwiesen.
Geriatrische Verwendung
Von den 2500 Patienten in klinischen Premarketing-Studien mit oralem Olanzapin waren 11 % (263) 65 Jahre oder älter. Bei Patienten mit Schizophrenie gab es keinen Hinweis auf eine unterschiedliche Verträglichkeit von Olanzapin bei älteren Patienten im Vergleich zu jüngeren Patienten. Studien an älteren Patienten mit demenzbedingter Psychose haben nahegelegt, dass bei dieser Patientengruppe möglicherweise ein anderes Verträglichkeitsprofil besteht als bei jüngeren Patienten mit Schizophrenie. Ältere Patienten mit demenzbedingter Psychose, die mit Olanzapin behandelt werden, haben im Vergleich zu Placebo ein erhöhtes Sterberisiko. In placebokontrollierten Studien mit Olanzapin bei älteren Patienten mit demenzbedingter Psychose traten bei mit Olanzapin behandelten Patienten im Vergleich zu mit Placebo behandelten Patienten häufiger zerebrovaskuläre Nebenwirkungen (z. B. Schlaganfall, transitorische ischämische Attacke) auf. Olanzapin ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen. Auch das Vorhandensein von Faktoren, die die pharmakokinetische Clearance verringern oder die pharmakodynamische Reaktion auf Olanzapin verstärken könnten, sollte dazu führen, dass eine niedrigere Anfangsdosis für jeden geriatrischen Patienten in Betracht gezogen wird [siehe Eingerahmte Warnung , DOSIERUNG UND ANWENDUNG , und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Klinische Studien mit ZYPREXA und Fluoxetin in Kombination schlossen keine ausreichende Anzahl von Patienten im Alter von ≥ 65 Jahren ein, um festzustellen, ob sie anders ansprechen als jüngere Patienten.
ÜBERDOSIS
Menschliche Erfahrung
In Premarketing-Studien mit mehr als 3100 Patienten und/oder gesunden Probanden wurde bei 67 Patienten eine versehentliche oder absichtliche akute Überdosierung von Olanzapin festgestellt. Bei dem Patienten, der die größte identifizierte Menge, 300 mg, einnahm, waren die einzigen berichteten Symptome Schläfrigkeit und undeutliche Sprache. Bei der begrenzten Anzahl von Patienten, die in Krankenhäusern untersucht wurden, einschließlich des Patienten, der 300 mg einnahm, gab es keine Beobachtungen, die auf eine nachteilige Veränderung der Laborwerte oder des EKG hindeuteten. Die Vitalfunktionen lagen nach Überdosierungen normalerweise innerhalb der normalen Grenzen.
In Postmarketing-Berichten über eine Überdosierung mit Olanzapin allein wurden in den meisten Fällen Symptome berichtet. Bei symptomatischen Patienten umfassten die Symptome mit einer Inzidenz von ≥ 10 % Agitiertheit/Aggressivität, Dysarthrie, Tachykardie, verschiedene extrapyramidale Symptome und einen reduzierten Bewusstseinsgrad, der von Sedierung bis zum Koma reichte. Zu den weniger häufig berichteten Symptomen gehörten die folgenden potenziell medizinisch schwerwiegenden Reaktionen: Aspiration, Herz-Lungen-Stillstand, Herzrhythmusstörungen (wie supraventrikuläre Tachykardie und 1 Patient mit Sinuspause mit spontaner Wiederaufnahme des normalen Rhythmus), Delirium, mögliches malignes neuroleptisches Syndrom, Atemdepression/Atemstillstand , Krämpfe, Bluthochdruck und Hypotonie. Eli Lilly and Company hat Berichte über Todesfälle im Zusammenhang mit einer Überdosierung von Olanzapin allein erhalten. In 1 Todesfall wurde berichtet, dass die Menge an akut eingenommenem Olanzapin möglicherweise nur 450 mg orales Olanzapin betrug; In einem anderen Fall wurde jedoch berichtet, dass ein Patient eine akute Olanzapin-Einnahme von etwa 2 g oralem Olanzapin überlebte.
Management einer Überdosierung
Wenden Sie sich für aktuelle Informationen zum Umgang mit einer Überdosierung von ZYPREXA (Olanzapin) an eine zertifizierte Giftnotrufzentrale (1-800-222-1222 oder www.poison.org). Die Möglichkeit einer multiplen Drogenbeteiligung sollte in Betracht gezogen werden. Im Falle einer akuten Überdosierung Atemwege herstellen und freihalten und für ausreichende Oxygenierung und Belüftung sorgen, was eine Intubation einschließen kann. Eine Magenspülung (nach Intubation, wenn der Patient bewusstlos ist) und die Gabe von Aktivkohle zusammen mit einem Abführmittel sollten in Betracht gezogen werden. Die Gabe von Aktivkohle (1 g) reduzierte die Cmax und AUC von oralem Olanzapin um etwa 60 %. Da Olanzapin-Spitzenspiegel typischerweise erst etwa 6 Stunden nach der Einnahme erreicht werden, kann Aktivkohle eine nützliche Behandlung einer Olanzapin-Überdosierung sein.
Die Möglichkeit von Benommenheit, Krampfanfällen oder dystonischen Reaktionen des Kopfes und Halses nach einer Überdosierung kann zu einem Aspirationsrisiko mit induzierter Erbrechen führen. Die kardiovaskuläre Überwachung sollte sofort beginnen und eine kontinuierliche elektrokardiographische Überwachung umfassen, um mögliche Arrhythmien zu erkennen.
Es gibt kein spezifisches Gegenmittel für Olanzapin. Daher sollten entsprechende unterstützende Maßnahmen eingeleitet werden. Hypotonie und Kreislaufkollaps sollten mit geeigneten Maßnahmen wie intravenöser Flüssigkeitsgabe und/oder Sympathomimetika behandelt werden. (Verwenden Sie kein Epinephrin, Dopamin oder andere Sympathomimetika mit Beta-Agonisten-Aktivität, da eine Beta-Stimulation die Hypotonie im Rahmen einer Olanzapin-induzierten Alpha-Blockade verschlimmern kann.) Eine engmaschige medizinische Überwachung und Überwachung sollte fortgesetzt werden, bis sich der Patient erholt hat.
Spezifische Informationen zur Überdosierung mit Lithium oder Valproat finden Sie im Abschnitt „Überdosierung“ der Packungsbeilage dieser Produkte. Spezifische Informationen zur Überdosierung mit Olanzapin und Fluoxetin in Kombination finden Sie im Abschnitt „Überdosierung“ der Packungsbeilage von Symbyax.
KONTRAINDIKATIONEN
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Der Wirkungsmechanismus von Olanzapin in den aufgeführten Indikationen ist unklar. Die Wirksamkeit von Olanzapin bei Schizophrenie könnte jedoch durch eine Kombination aus Dopamin- und Serotonin-Typ-2 (5HT2)-Antagonismus vermittelt werden.
Pharmakodynamik
Olanzapin bindet mit hoher Affinität an die folgenden Rezeptoren: Serotonin 5HT2A/2C, 5HT6 (Ki=4, 11 bzw. 5 nM), Dopamin D1-4 (Ki=11-31 nM), Histamin H1 (Ki=7 nM). ) und adrenerge α1-Rezeptoren (Ki=19 nM). Olanzapin ist ein Antagonist mit mäßiger Affinitätsbindung für Serotonin 5HT3 (Ki = 57 nM) und Muscarin M1-5 (Ki = 73, 96, 132, 32 bzw. 48 nM). Olanzapin bindet mit geringer Affinität an GABAA-, BZD- und β-adrenerge Rezeptoren (Ki>10 μM).
Pharmakokinetik
Orale Verabreichung, Monotherapie
Olanzapin wird gut resorbiert und erreicht Spitzenkonzentrationen etwa 6 Stunden nach einer oralen Dosis. Es wird weitgehend durch First-Pass-Metabolisierung eliminiert, wobei etwa 40 % der Dosis metabolisiert werden, bevor sie den systemischen Kreislauf erreichen. Nahrung hat keinen Einfluss auf die Geschwindigkeit oder das Ausmaß der Resorption von Olanzapin. Pharmakokinetische Studien haben gezeigt, dass ZYPREXA 5 mg Tabletten und ZYPREXA ZYDIS (Olanzapin im Mund auflösende Tabletten) Darreichungsformen von Olanzapin bioäquivalent sind.
Olanzapin zeigt über den klinischen Dosierungsbereich eine lineare Kinetik. Seine Halbwertszeit liegt im Bereich von 21 bis 54 Stunden (5. bis 95. Perzentil; Mittelwert 30 Stunden), und die scheinbare Plasmaclearance liegt im Bereich von 12 bis 47 l/h (5. bis 95. Perzentil; Mittelwert 25 l/h).
Die einmal tägliche Gabe von Olanzapin führt nach etwa 1 Woche zu Steady-State-Konzentrationen, die etwa doppelt so hoch sind wie die Konzentrationen nach Einzeldosen. Plasmakonzentrationen, Halbwertszeit und Clearance von Olanzapin können je nach Raucherstatus, Geschlecht und Alter von Person zu Person variieren.
Olanzapin wird mit einem Verteilungsvolumen von ca. 1000 l extensiv im Körper verteilt. Im Konzentrationsbereich von 7 bis 1100 ng/ml wird es zu 93 % an Plasmaproteine gebunden, wobei es hauptsächlich an Albumin und α1-saures Glykoprotein bindet.
Stoffwechsel und Ausscheidung
Nach einer oralen Einzeldosis von 14C-markiertem Olanzapin wurden 7 % der Olanzapin-Dosis als unveränderter Wirkstoff im Urin wiedergefunden, was darauf hindeutet, dass Olanzapin stark metabolisiert wird. Ungefähr 57 % bzw. 30 % der Dosis wurden im Urin bzw. im Stuhl wiedergefunden. Im Plasma machte Olanzapin nur 12 % der AUC für die Gesamtradioaktivität aus, was auf eine signifikante Exposition gegenüber Metaboliten hinweist. Nach Mehrfachdosierung waren die wichtigsten zirkulierenden Metaboliten 10-N-Glucuronid, das im Steady State in 44 % der Olanzapin-Konzentration vorhanden war, und 4´-N-Desmethyl-Olanzapin, das im Steady State in 31 % der Olanzapin-Konzentration vorhanden war . Beiden Metaboliten fehlt es an pharmakologischer Aktivität bei den beobachteten Konzentrationen.
Die direkte Glucuronidierung und die durch Cytochrom P450 (CYP) vermittelte Oxidation sind die primären Stoffwechselwege für Olanzapin. In-vitro-Studien deuten darauf hin, dass die CYPs 1A2 und 2D6 sowie das Flavin-haltige Monooxygenase-System an der Olanzapin-Oxidation beteiligt sind. Die CYP2D6-vermittelte Oxidation scheint in vivo ein untergeordneter Stoffwechselweg zu sein, da die Clearance von Olanzapin bei Patienten mit einem Mangel an diesem Enzym nicht verringert ist.
Intramuskuläre Verabreichung
ZYPREXA IntraMuscular führt zu einer schnellen Resorption, wobei maximale Plasmakonzentrationen innerhalb von 15 bis 45 Minuten erreicht werden. Basierend auf einer pharmakokinetischen Studie an gesunden Freiwilligen erzeugt eine 5-mg-Dosis von intramuskulärem Olanzapin zur Injektion im Durchschnitt eine maximale Plasmakonzentration, die etwa 5-mal höher ist als die maximale Plasmakonzentration, die von einer 5-mg-Dosis von oralem Olanzapin erzeugt wird. Die Fläche unter der Kurve, die nach einer intramuskulären Dosis erreicht wird, ist ähnlich der, die nach oraler Verabreichung derselben Dosis erreicht wird. Die nach intramuskulärer Verabreichung beobachtete Halbwertszeit ist ähnlich der nach oraler Gabe beobachteten. Die Pharmakokinetik ist über den klinischen Dosierungsbereich hinweg linear. Die Stoffwechselprofile nach intramuskulärer Verabreichung sind den Stoffwechselprofilen nach oraler Verabreichung qualitativ ähnlich.
Spezifische Populationen
Nierenfunktionsstörung
Da Olanzapin vor der Ausscheidung stark metabolisiert wird und nur 7 % des Arzneimittels unverändert ausgeschieden werden, ist es unwahrscheinlich, dass eine Nierenfunktionsstörung allein einen wesentlichen Einfluss auf die Pharmakokinetik von Olanzapin hat. Die pharmakokinetischen Eigenschaften von Olanzapin waren bei Patienten mit schwerer Nierenfunktionsstörung und gesunden Probanden ähnlich, was darauf hindeutet, dass eine Dosisanpassung basierend auf dem Grad der Nierenfunktionsstörung nicht erforderlich ist. Außerdem wird Olanzapin nicht durch Dialyse entfernt. Die Auswirkung einer Nierenfunktionsstörung auf die Elimination von Metaboliten wurde nicht untersucht.
Leberfunktionsstörung
Obwohl zu erwarten ist, dass das Vorliegen einer Leberfunktionsstörung die Clearance von Olanzapin verringert, zeigte eine Studie zur Auswirkung einer eingeschränkten Leberfunktion bei Patienten (n = 6) mit klinisch signifikanter Zirrhose (Childs-Pugh-Klassifikation A und B) nur geringe Auswirkungen auf die Pharmakokinetik von Olanzapin.
Geriatrie
In einer Studie mit 24 gesunden Probanden war die mittlere Eliminationshalbwertszeit von Olanzapin bei älteren (≥ 65 Jahre) etwa 1,5-mal länger als bei nicht älteren Probanden ( DOSIERUNG UND ANWENDUNG ].
Geschlecht
Die Clearance von Olanzapin ist bei Frauen etwa 30 % niedriger als bei Männern. Es gab jedoch keine offensichtlichen Unterschiede zwischen Männern und Frauen in Bezug auf Wirksamkeit oder Nebenwirkungen. Dosisanpassungen aufgrund des Geschlechts sollten nicht erforderlich sein.
Rauchstatus
Die Clearance von Olanzapin ist bei Rauchern etwa 40 % höher als bei Nichtrauchern, obwohl Dosierungsänderungen nicht routinemäßig empfohlen werden.
Wettrennen
In-vivo-Studien haben gezeigt, dass die Expositionen bei Japanern, Chinesen und Kaukasiern ähnlich sind, insbesondere nach Normalisierung auf Körpergewichtsunterschiede. Dosierungsänderungen für Rennen werden daher nicht empfohlen.
Kombinierte Effekte
Die kombinierten Auswirkungen von Alter, Rauchen und Geschlecht könnten zu erheblichen pharmakokinetischen Unterschieden in Populationen führen. Beispielsweise kann die Clearance bei jungen, rauchenden Männern dreimal höher sein als bei älteren, nicht rauchenden Frauen. Eine Dosisanpassung kann bei Patienten erforderlich sein, die eine Kombination von Faktoren aufweisen, die zu einer langsameren Metabolisierung von Olanzapin führen können [siehe DOSIERUNG UND ANWENDUNG ].
Jugendliche (13 bis 17 Jahre)
In klinischen Studien waren die meisten Jugendlichen Nichtraucher und diese Population hatte ein niedrigeres durchschnittliches Körpergewicht, was im Vergleich zu Erwachsenen zu einer höheren durchschnittlichen Olanzapin-Exposition führte.
Tiertoxikologie und/oder Pharmakologie
In tierexperimentellen Studien mit Olanzapin waren die hauptsächlichen hämatologischen Befunde reversible periphere Zytopenien bei einzelnen Hunden, die mit 10 mg/kg (das 17-fache der täglichen oralen MRHD, basierend auf mg/m² Körperoberfläche) dosiert wurden, sowie eine dosisabhängige Abnahme der Lymphozyten und Neutrophilen bei Mäusen und Lymphopenie bei Ratten. Einige mit 10 mg/kg behandelte Hunde entwickelten zwischen 1 und 10 Behandlungsmonaten eine reversible Neutropenie und/oder eine reversible hämolytische Anämie. Bei Mäusen, die Dosen von 10 mg/kg (entspricht dem 2-fachen der täglichen oralen MRHD, bezogen auf mg/m² Körperoberfläche) erhielten, wurde in Studien über 3 Monate eine dosisabhängige Abnahme der Lymphozyten und Neutrophilen beobachtet. Unspezifische Lymphopenie, die mit einer verminderten Körpergewichtszunahme einhergeht, trat bei Ratten auf, die 3 Monate lang 22,5 mg/kg (das 11-fache der täglichen oralen MRHD, basierend auf mg/m² Körperoberfläche) oder 16 mg/kg (das 8-fache der täglichen oralen MRHD, basierend auf mg/m² Körperoberfläche) für 6 oder 12 Monate. Bei keiner der untersuchten Arten wurden Hinweise auf eine Knochenmark-Zytotoxizität gefunden. Knochenmark war normozellulär oder hyperzellulär, was darauf hindeutet, dass die Verringerung der zirkulierenden Blutzellen wahrscheinlich auf periphere (nicht-marksbedingte) Faktoren zurückzuführen war.
Klinische Studien
Wenn Sie ZYPREXA 7,5 mg und Fluoxetin in Kombination anwenden, lesen Sie auch den Abschnitt „Klinische Studien“ der Packungsbeilage für Symbyax.
Schizophrenie
Erwachsene
Die Wirksamkeit von oralem Olanzapin bei der Behandlung von Schizophrenie wurde in 2 kontrollierten Kurzzeitstudien (6 Wochen) mit erwachsenen stationären Patienten nachgewiesen, die die DSM III-R-Kriterien für Schizophrenie erfüllten. In 1 der 2 Studien wurde ein einziger Haloperidol-Arm als Vergleichsbehandlung eingeschlossen, aber in dieser Studie wurden diese 2 Medikamente nicht im gesamten Spektrum klinisch relevanter Dosierungen für beide verglichen.
In diesen Studien wurden mehrere Instrumente zur Bewertung psychiatrischer Anzeichen und Symptome verwendet, darunter die Brief Psychiatric Rating Scale (BPRS), eine aus mehreren Elementen bestehende Bestandsaufnahme der allgemeinen Psychopathologie, die traditionell zur Bewertung der Auswirkungen einer medikamentösen Behandlung bei Schizophrenie verwendet wird. Das BPRS-Psychose-Cluster (konzeptionelle Desorganisation, halluzinatorisches Verhalten, Misstrauen und ungewöhnliche Gedankeninhalte) gilt als besonders nützliche Untergruppe zur Beurteilung aktiv psychotischer schizophrener Patienten. Eine zweite traditionelle Bewertung, der Clinical Global Impression (CGI), spiegelt den Eindruck eines erfahrenen Beobachters, der mit den Manifestationen der Schizophrenie vollständig vertraut ist, über den klinischen Gesamtzustand des Patienten wider. Zusätzlich wurden 2 neuere Skalen verwendet; Dazu gehörten die 30-Punkte-Skala für positive und negative Symptome (PANSS), in der die 18 Punkte des BPRS eingebettet sind, und die Skala zur Bewertung negativer Symptome (SANS). Die nachstehenden Studienzusammenfassungen konzentrieren sich auf die folgenden Ergebnisse: PANSS gesamt und/oder BPRS gesamt; BPRS-Psychose-Cluster; PANSS negative Subskala oder SANS; und CGI-Schweregrad. Die Ergebnisse der Versuche folgen:
(1) In einer 6-wöchigen, placebokontrollierten Studie (n=149) mit 2 fixen Olanzapin-Dosen von 1 und 10 mg/Tag (einmal tägliches Schema), Olanzapin mit 10 mg/Tag (aber nicht mit 1 mg/Tag). Tag) war Placebo im PANSS-Gesamtwert (auch im extrahierten BPRS-Gesamtwert), im BPRS-Psychose-Cluster, in der PANSS-Negativ-Subskala und im CGI-Schweregrad überlegen.
(2) In einer 6-wöchigen placebokontrollierten Studie (n=253) mit 3 festen Dosisbereichen von Olanzapin (5 ± 2,5 mg/Tag, 10 ± 2,5 mg/Tag und 15 ± 2,5 mg/Tag) an a einmal täglich waren die 2 Gruppen mit der höchsten Olanzapin-Dosis (tatsächliche mittlere Dosen von 12 bzw. 16 mg/Tag) Placebo im BPRS-Gesamtscore, BPRS-Psychose-Cluster und CGI-Schwere-Score überlegen; die Gruppe mit der höchsten Olanzapin-Dosis war Placebo in der SANS überlegen. Es zeigte sich kein eindeutiger Vorteil der Hochdosisgruppe gegenüber der Mitteldosisgruppe.
(3) In einer längerfristigen Studie wurden erwachsene ambulante Patienten (n=326), die überwiegend die DSM-IV-Kriterien für Schizophrenie erfüllten und die unter Olanzapin während einer unverblindeten Behandlung für mindestens 8 Wochen stabil blieben, zur Fortsetzung ihrer derzeitigen Olanzapin-Behandlung randomisiert Dosen (im Bereich von 10 bis 20 mg/Tag) oder Placebo. Der Nachbeobachtungszeitraum zur Beobachtung von Patienten auf Rückfälle, definiert als Zunahme positiver BPRS-Symptome oder Krankenhausaufenthalte, war für 12 Monate geplant, jedoch wurden die Kriterien für einen vorzeitigen Abbruch der Studie aufgrund eines Übermaßes an Placebo-Schüben im Vergleich zu Olanzapin-Schüben erfüllt und Olanzapin war dem Placebo in Bezug auf die Zeit bis zum Rückfall, dem primären Endpunkt dieser Studie, überlegen. Somit war Olanzapin bei der Aufrechterhaltung der Wirksamkeit bei Patienten, die für etwa 8 Wochen stabilisiert und über einen Beobachtungszeitraum von bis zu 8 Monaten nachbeobachtet wurden, wirksamer als Placebo.
Die Untersuchung von Bevölkerungsuntergruppen (Rasse und Geschlecht) ergab keine unterschiedliche Reaktionsfähigkeit auf der Grundlage dieser Untergruppen.
Jugendliche
Die Wirksamkeit von oralem Olanzapin bei der akuten Behandlung von Schizophrenie bei Jugendlichen (im Alter von 13 bis 17 Jahren) wurde in einer 6-wöchigen, doppelblinden, placebokontrollierten, randomisierten Studie mit stationären und ambulanten Patienten mit Schizophrenie (n = 107) nachgewiesen, die sich trafen Diagnosekriterien nach DSM-IV-TR und bestätigt durch den Kiddie Schedule for Affective Disorders and Schizophrenia for School Aged Children-Present and Lifetime Version (K-SADS-PL).
Das primäre Bewertungsinstrument, das zur Beurteilung psychiatrischer Anzeichen und Symptome in dieser Studie verwendet wurde, war die verankerte Version der Gesamtpunktzahl der Brief Psychiatric Rating Scale for Children (BPRS-C).
In dieser Studie mit flexibler Dosierung war Olanzapin 2,5 bis 20 mg/Tag (mittlere modale Dosis 12,5 mg/Tag, mittlere Dosis 11,1 mg/Tag) bei der Behandlung von Jugendlichen, bei denen Schizophrenie diagnostiziert wurde, wirksamer als Placebo, wie durch die Statistik belegt eine signifikant stärkere mittlere Verringerung des BPRS-C-Gesamtscores bei Patienten in der Olanzapin-Behandlungsgruppe als in der Placebo-Gruppe.
Obwohl keine Evidenz vorliegt, um die Frage zu beantworten, wie lange ein jugendlicher Patient mit ZYPREXA behandelt werden sollte, kann die Erhaltungswirksamkeit aus Daten von Erwachsenen zusammen mit Vergleichen der pharmakokinetischen Parameter von Olanzapin bei erwachsenen und jugendlichen Patienten extrapoliert werden. Es wird allgemein empfohlen, dass Patienten, die auf das Ansprechen ansprechen, über das akute Ansprechen hinaus fortgesetzt werden, jedoch mit der niedrigsten Dosis, die erforderlich ist, um eine Remission aufrechtzuerhalten. Die Patienten sollten regelmäßig neu untersucht werden, um die Notwendigkeit einer Erhaltungstherapie zu bestimmen.
Bipolare I-Störung (manische oder gemischte Episoden)
Erwachsene
Monotherapie
Die Wirksamkeit von oralem Olanzapin bei der Behandlung von manischen oder gemischten Episoden wurde in 2 placebokontrollierten Kurzzeitstudien (eine 3-wöchige und eine 4-wöchige) bei erwachsenen Patienten nachgewiesen, die die DSM-IV-Kriterien für eine Bipolar-I-Störung erfüllten manische oder gemischte Episoden. Diese Studien umfassten Patienten mit oder ohne psychotische Merkmale und mit oder ohne Rapid-Cycling-Verlauf.
Das primäre Bewertungsinstrument, das in diesen Studien zur Bewertung manischer Symptome verwendet wurde, war die Young Mania Rating Scale (Y-MRS), eine 11-Punkte-Skala, die von Klinikern bewertet wird und traditionell zur Bewertung des Ausmaßes manischer Symptome (Reizbarkeit, störendes/aggressives Verhalten, Schlaf) verwendet wird , gehobene Stimmung, Sprache, gesteigerte Aktivität, sexuelles Interesse, Sprach-/Denkstörung, Gedankeninhalt, Aussehen und Einsicht) in einem Bereich von 0 (keine manischen Züge) bis 60 Â (Maximalwert). Der primäre Endpunkt in diesen Studien war die Veränderung des Y-MRS-Gesamtscores gegenüber dem Ausgangswert. Die Ergebnisse der Versuche folgen:
(1) In einer 3-wöchigen placebokontrollierten Studie (n = 67), die einen Dosisbereich von Olanzapin (5–20 mg/Tag, einmal täglich, beginnend mit 10 mg/Tag) umfasste, war Olanzapin dem Placebo in den folgenden Punkten überlegen Reduktion des Y-MRS-Gesamtscores. In einer Studie mit identischem Design, die gleichzeitig mit der ersten Studie durchgeführt wurde, zeigte Olanzapin einen ähnlichen Behandlungsunterschied, aber möglicherweise aufgrund der Stichprobengröße und der Variabilität der Lokalisation war es Placebo in Bezug auf dieses Ergebnis nicht überlegen.
(2) In einer 4-wöchigen placebokontrollierten Studie (n=115), die einen Dosisbereich von Olanzapin (5-20 mg/Tag, einmal täglich, beginnend mit 15 mg/Tag) umfasste, war Olanzapin dem Placebo in den folgenden Punkten überlegen Reduktion des Y-MRS-Gesamtscores.
(3) In einer anderen Studie wurden 361 Patienten, die die DSM-IV-Kriterien für eine manische oder gemischte Episode einer Bipolar-I-Störung erfüllten und während einer anfänglichen offenen Behandlungsphase von durchschnittlich etwa 2 Wochen auf Olanzapin 5 bis 20 mg/ Tag wurden zur Beobachtung eines Rückfalls randomisiert entweder auf die Fortsetzung der Olanzapin-Dosis in derselben Dosis (n = 225) oder auf Placebo (n = 136) randomisiert. Etwa 50 % der Patienten hatten die Olanzapin-Gruppe bis Tag 59 und 50 % der Placebo-Gruppe bis Tag 23 der doppelblinden Behandlung abgebrochen. Das Ansprechen während der offenen Phase wurde durch eine Abnahme des Y-MRS-Gesamtscores auf ≤ 12 und des HAM-D 21 auf ≤ 8 definiert. Ein Rückfall während der doppelblinden Phase wurde definiert als ein Anstieg des Y-MRS- oder HAM-D 21-Gesamtscores auf ≥ 15 oder ein Krankenhausaufenthalt wegen Manie oder Depression. In der randomisierten Phase erlebten Patienten, die weiterhin Olanzapin erhielten, eine signifikant längere Zeit bis zum Rückfall.
Ergänzung zu Lithium oder Valproat
Die Wirksamkeit von oralem Olanzapin zusammen mit Lithium oder Valproat bei der Behandlung von manischen oder gemischten Episoden wurde in 2 kontrollierten Studien bei Patienten nachgewiesen, die die DSM-IV-Kriterien für eine Bipolar-I-Störung mit manischen oder gemischten Episoden erfüllten. Diese Studien umfassten Patienten mit oder ohne psychotische Merkmale und mit oder ohne Rapid-Cycling-Verlauf. Die Ergebnisse der Versuche folgen:
(1) In einer 6-wöchigen placebokontrollierten Kombinationsstudie wurden 175 ambulante Patienten unter Lithium- oder Valproattherapie mit unzureichend kontrollierten manischen oder gemischten Symptomen (Y-MRS ≥ 16) randomisiert, um entweder Olanzapin oder Placebo in Kombination mit ihrer ursprünglichen Therapie zu erhalten . Olanzapin (in einem Dosisbereich von 5–20 mg/Tag, einmal täglich, beginnend mit 10 mg/Tag) in Kombination mit Lithium oder Valproat (in einem therapeutischen Bereich von 0,6 mEq/l bis 1,2 mEq/l oder 50 μg/ml bis 125 μg/ml) war Lithium oder Valproat allein bei der Reduktion des Y-MRS-Gesamtscores überlegen.
(2) In einer zweiten 6-wöchigen Placebo-kontrollierten Kombinationsstudie wurden 169 ambulante Patienten unter Lithium- oder Valproattherapie mit unzureichend kontrollierten manischen oder gemischten Symptomen (Y-MRS ≥ 16) randomisiert, um entweder Olanzapin oder Placebo in Kombination mit ihrem Original zu erhalten Therapie. Olanzapin (in einem Dosisbereich von 5–20 mg/Tag, einmal täglich, beginnend mit 10 mg/Tag) in Kombination mit Lithium oder Valproat (in einem therapeutischen Bereich von 0,6 mEq/l bis 1,2 mEq/l oder 50 μg/ml bis 125 μg/ml) war Lithium oder Valproat allein bei der Reduktion des Y-MRS-Gesamtscores überlegen.
Jugendliche
Akute Monotherapie
Die Wirksamkeit von oralem Olanzapin bei der Behandlung von akuten manischen oder gemischten Episoden bei Jugendlichen (im Alter von 13 bis 17 Jahren) wurde in einer 3-wöchigen, doppelblinden, placebokontrollierten, randomisierten Studie mit jugendlichen stationären und ambulanten Patienten nachgewiesen, die die Diagnose erfüllten Kriterien für manische oder gemischte Episoden im Zusammenhang mit einer Bipolar-I-Störung (mit oder ohne psychotische Merkmale) gemäß DSM-IV-TR (n=161). Die Diagnose wurde von der K-SADS-PL bestätigt.
Das primäre Bewertungsinstrument, das in dieser Studie zur Bewertung manischer Symptome verwendet wurde, war die Adolescent Structured Young-Mania Rating Scale (Y-MRS) Gesamtpunktzahl.
In dieser Studie mit flexibler Dosierung war Olanzapin 2,5 bis 20 mg/Tag (mittlere modale Dosis 10,7 mg/Tag, mittlere Dosis 8,9 mg/Tag) wirksamer als Placebo bei der Behandlung von Jugendlichen mit manischen oder gemischten Episoden im Zusammenhang mit Bipolar-I wie durch die statistisch signifikant stärkere mittlere Verringerung des Y-MRS-Gesamtscores bei Patienten in der Olanzapin-Behandlungsgruppe als in der Placebo-Gruppe gestützt.
Obwohl keine Evidenz vorliegt, um die Frage zu beantworten, wie lange ein jugendlicher Patient mit ZYPREXA behandelt werden sollte, kann die Erhaltungswirksamkeit aus Daten von Erwachsenen zusammen mit Vergleichen der pharmakokinetischen Parameter von Olanzapin bei erwachsenen und jugendlichen Patienten extrapoliert werden. Es wird allgemein empfohlen, dass Patienten, die auf das Ansprechen ansprechen, über das akute Ansprechen hinaus fortgesetzt werden, jedoch mit der niedrigsten Dosis, die erforderlich ist, um eine Remission aufrechtzuerhalten. Die Patienten sollten regelmäßig neu untersucht werden, um die Notwendigkeit einer Erhaltungstherapie zu bestimmen.
Unruhe im Zusammenhang mit Schizophrenie und bipolarer Manie
Die Wirksamkeit von intramuskulärem Olanzapin zur Injektion zur Behandlung von Unruhe wurde in 3 placebokontrollierten Kurzzeitstudien (24 Stunden IM-Behandlung) mit unruhigen erwachsenen stationären Patienten aus 2 Diagnosegruppen nachgewiesen: Schizophrenie und Bipolar-I-Störung (manische oder gemischte Episoden) . Jede der Studien umfasste einen einzigen aktiven Vergleichsbehandlungsarm mit entweder einer Haloperidol-Injektion (Schizophrenie-Studien) oder einer Lorazepam-Injektion (Bipolar-I-Manie-Studie). Patienten, die in die Studien aufgenommen wurden, mussten: (1) von den klinischen Prüfärzten als klinisch agitiert und klinisch geeignete Kandidaten für die Behandlung mit intramuskulärer Medikation beurteilt werden und (2) ein Agitationsniveau aufweisen, das einen Schwellenwert von ≥ 14 erreicht oder überschreitet die 5 Items, die die positive und negative Syndromskala (PANSS) Excited Component umfassen (d. h. schlechte Impulskontrolle, Anspannung, Feindseligkeit, Unkooperativität und Aufregung) mit mindestens 1 Einzelitem-Score ≥4 unter Verwendung eines 1-7-Bewertungssystems (1= nicht vorhanden, 4=mäßig, 7=extrem). In den Studien betrug der durchschnittliche PANSS Excited Component Score zu Studienbeginn 18,4 mit Scores im Bereich von 13 bis 32 (von einem maximalen Score von 35), was auf überwiegend mäßige Erregung hindeutet, wobei einige Patienten unter leichter oder schwerer Erregung litten. Der primäre Wirksamkeitsmaßstab, der in diesen Studien zur Beurteilung von Agitationszeichen und -symptomen verwendet wurde, war die Veränderung der PANSS Excited Component gegenüber dem Ausgangswert 2 Stunden nach der Injektion. Die Patienten konnten während der 24-stündigen IM-Behandlungsperioden bis zu 3 Injektionen erhalten; Die Patienten konnten die zweite Injektion jedoch erst nach dem anfänglichen 2-Stunden-Zeitraum erhalten, in dem der primäre Wirksamkeitsmaßstab bewertet wurde. Die Ergebnisse der Versuche folgen:
(1) In einer placebokontrollierten Studie mit agitierten stationären Patienten, die die DSM-IV-Kriterien für Schizophrenie erfüllten (n=270), wurden 4 fixe intramuskuläre Olanzapin-Injektionsdosen von 2,5 mg, 5 mg, 7,5 mg und 10 mg bewertet. Alle Dosen waren 2 Stunden nach der Injektion in Bezug auf die PANSS Excited-Komponente dem Placebo statistisch überlegen. Allerdings war die Wirkung bei den 3 höchsten Dosen größer und konsistenter. Es gab keine signifikanten paarweisen Unterschiede für die 7,5- und 10-mg-Dosen gegenüber der 5-mg-Dosis.
(2) In einer zweiten placebokontrollierten Studie mit unruhigen stationären Patienten, die die DSM-IV-Kriterien für Schizophrenie erfüllten (n=311), wurde 1 fixe intramuskuläre Olanzapin-Injektionsdosis von 10 mg untersucht. Olanzapin zur Injektion war 2 Stunden nach der Injektion hinsichtlich der PANSS Excited-Komponente dem Placebo statistisch überlegen.
(3) In einer placebokontrollierten Studie mit agitierten stationären Patienten, die die DSM-IV-Kriterien für eine Bipolar-I-Störung erfüllten (und derzeit eine akute manische oder gemischte Episode mit oder ohne psychotische Merkmale aufweisen) (n = 201), 1 feste intramuskuläre Olanzapin-Injektionsdosis von 10 mg wurde bewertet. Olanzapin zur Injektion war 2 Stunden nach der Injektion hinsichtlich der PANSS Excited-Komponente dem Placebo statistisch überlegen.
Die Untersuchung von Bevölkerungsuntergruppen (Alter, Rasse und Geschlecht) ergab keine unterschiedliche Reaktionsfähigkeit auf der Grundlage dieser Untergruppen.
INFORMATIONEN ZUM PATIENTEN
ZYPREXA® (zy-PREX-a) (Olanzapin) Tablette
ZYPREXA® ZYDIS® (zy-PREX-a ZY-dis) (Olanzapin) Tablette, oral zerfallend
Lesen Sie den mit ZYPREXA gelieferten Medikationsleitfaden, bevor Sie mit der Einnahme beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Dieser Medikationsleitfaden ersetzt nicht das Gespräch mit Ihrem Arzt über Ihren Gesundheitszustand oder Ihre Behandlung. Sprechen Sie mit Ihrem Arzt oder Apotheker, wenn Sie etwas nicht verstehen oder mehr über ZYPREXA erfahren möchten.
Was sind die wichtigsten Informationen, die ich über ZYPREXA wissen sollte?
ZYPREXA 20 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Diese schwerwiegenden Nebenwirkungen werden im Folgenden beschrieben.
1. Erhöhtes Sterberisiko bei älteren Menschen, die verwirrt sind, Gedächtnisverlust haben und den Bezug zur Realität verloren haben (demenzbedingte Psychose). ZYPREXA ist nicht zur Behandlung von Psychosen bei älteren Menschen mit Demenz zugelassen.
2. Hoher Blutzucker (Hyperglykämie). Hoher Blutzucker kann auftreten, wenn Sie bereits Diabetes haben oder noch nie Diabetes hatten. Hoher Blutzucker kann zu Folgendem führen:
Ihr Arzt sollte Tests durchführen, um Ihren Blutzucker zu kontrollieren, bevor Sie mit der Einnahme von ZYPREXA 7,5 mg beginnen und während der Behandlung. Bei Menschen ohne Diabetes verschwindet der hohe Blutzucker manchmal, wenn ZYPREXA 7,5 mg abgesetzt wird. Menschen mit Diabetes und manche Menschen, die vor der Einnahme von ZYPREXA keinen Diabetes hatten, müssen auch nach Beendigung der Einnahme von ZYPREXA Arzneimittel gegen hohen Blutzucker einnehmen.
Wenn Sie Diabetes haben, befolgen Sie die Anweisungen Ihres Arztes, wie oft Sie Ihren Blutzucker während der Einnahme von ZYPREXA kontrollieren müssen.
Rufen Sie Ihren Arzt an wenn Sie während der Einnahme von ZYPREXA eines dieser Symptome eines hohen Blutzuckers (Hyperglykämie) haben:
3. Hohe Blutfettwerte (Cholesterin und Triglyceride). Bei Personen, die mit ZYPREXA 10 mg behandelt werden, können hohe Fettwerte auftreten, insbesondere bei Teenagern (13 bis 17 Jahre) oder bei Anwendung in Kombination mit Fluoxetin bei Kindern (10 bis 17 Jahre). Möglicherweise haben Sie keine Symptome, daher sollte Ihr Arzt vor Beginn der Einnahme von ZYPREXA und während der Behandlung Bluttests durchführen, um Ihre Cholesterin- und Triglyzeridspiegel zu überprüfen.
4. Gewichtszunahme. Gewichtszunahme ist bei Personen, die ZYPREXA einnehmen, sehr häufig. Teenager (13 bis 17 Jahre alt) nehmen eher zu und nehmen stärker zu als Erwachsene. Kinder (im Alter von 10 bis 17 Jahren) nehmen auch häufiger und stärker zu als Erwachsene, wenn ZYPREXA 7,5 mg in Kombination mit Fluoxetin angewendet wird. Einige Personen können während der Einnahme von ZYPREXA stark an Gewicht zunehmen, daher sollten Sie und Ihr Arzt Ihr Gewicht regelmäßig kontrollieren. Sprechen Sie mit Ihrem Arzt über Möglichkeiten, die Gewichtszunahme zu kontrollieren, wie z. B. eine gesunde, ausgewogene Ernährung und Bewegung.
Was ist ZYPREXA?
ZYPREXA ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von:
ZYPREXA 7,5 mg ist nicht für die Anwendung bei Kindern unter 13 Jahren zugelassen. ZYPREXA 10 mg in Kombination mit Fluoxetin ist nicht für die Anwendung bei Kindern unter 10 Jahren zugelassen.
Zu den Symptomen der Schizophrenie gehören das Hören von Stimmen, das Sehen von Dingen, die nicht da sind, Überzeugungen, die nicht der Wahrheit entsprechen, sowie Misstrauen oder Zurückgezogenheit.
Zu den Symptomen der Bipolar-I-Störung gehören abwechselnd Phasen von Depression und gehobener oder gereizter Stimmung, erhöhte Aktivität und Unruhe, rasende Gedanken, schnelles Sprechen, impulsives Verhalten und ein vermindertes Schlafbedürfnis.
Zu den Symptomen einer behandlungsresistenten Depression gehören verminderte Stimmung, vermindertes Interesse, erhöhte Schuldgefühle, verminderte Energie, verminderte Konzentration, Appetitveränderungen und Selbstmordgedanken oder -verhalten.
Einige Ihrer Symptome können sich mit der Behandlung verbessern. Wenn Sie glauben, dass es Ihnen nicht besser geht, wenden Sie sich an Ihren Arzt.
Was sollte ich meinem Arzt vor der Einnahme von ZYPREXA mitteilen?
ZYPREXA ist möglicherweise nicht das Richtige für Sie. Bevor Sie mit ZYPREXA beginnen, informieren Sie Ihren Arzt, wenn Sie Folgendes haben oder hatten:
Informieren Sie Ihren Arzt, wenn Sie viel Sport treiben oder sich oft an heißen Orten aufhalten.
Zu den Symptomen einer Bipolar-I-Störung, einer behandlungsresistenten Depression oder Schizophrenie können gehören: Selbstmordgedanken oder sich selbst oder andere zu verletzen. Wenn Sie diese Gedanken zu irgendeinem Zeitpunkt haben, informieren Sie sofort Ihren Arzt oder suchen Sie sofort eine Notaufnahme auf.
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen. ZYPREXA 20 mg und einige Arzneimittel können miteinander interagieren und möglicherweise nicht so gut wirken oder möglicherweise schwerwiegende Nebenwirkungen verursachen. Ihr Arzt kann Ihnen sagen, ob es sicher ist, ZYPREXA zusammen mit Ihren anderen Arzneimitteln einzunehmen. Beginnen oder beenden Sie keine Arzneimittel, während Sie ZYPREXA einnehmen, ohne vorher mit Ihrem Arzt gesprochen zu haben.
Wie sollte ich ZYPREXA 7,5 mg einnehmen?
Was sollte ich während der Einnahme von ZYPREXA vermeiden?
Welche Nebenwirkungen kann ZYPREXA 5mg haben?
Schwerwiegende Nebenwirkungen können auftreten, wenn Sie ZYPREXA 5 mg einnehmen, einschließlich:
Häufige Nebenwirkungen von ZYPREXA sind: Energiemangel, Mundtrockenheit, gesteigerter Appetit, Schläfrigkeit, Tremor (Zittern), harter oder seltener Stuhlgang, Schwindel, Verhaltensänderungen oder Unruhe.
Andere häufige Nebenwirkungen bei Teenagern (13-17 Jahre alt) sind: Kopfschmerzen, Bauchschmerzen, Schmerzen in Armen oder Beinen oder Müdigkeit. Jugendliche erlebten im Vergleich zu Erwachsenen einen stärkeren Anstieg von Prolaktin, Leberenzymen und Schläfrigkeit.
Informieren Sie Ihren Arzt über jede Nebenwirkung, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von ZYPREXA. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist ZYPREXA aufzubewahren?
Bewahren Sie ZYPREXA 5 mg und alle Arzneimittel für Kinder unzugänglich auf.
Allgemeine Informationen zu ZYPREXA
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie ZYPREXA nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie ZYPREXA 5 mg nicht an andere Personen weiter, selbst wenn sie die gleiche Erkrankung haben. Es kann ihnen schaden.
Dieser Arzneimittelleitfaden fasst die wichtigsten Informationen zu ZYPREXA zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt. Sie können Ihren Arzt oder Apotheker um Informationen zu ZYPREXA 20 mg bitten, die für medizinisches Fachpersonal geschrieben wurden. Weitere Informationen zu ZYPREXA erhalten Sie telefonisch unter 1-800-Lilly-Rx (1-800-545-5979).
Welche Inhaltsstoffe enthält ZYPREXA?
Wirkstoff: Olanzapin
Inaktive Zutaten:
Carnaubawachs, Crospovidon, Hydroxypropylcellulose, Hypromellose, Lactose, Magnesiumstearat, mikrokristalline Cellulose und andere inaktive Inhaltsstoffe. Die Farbbeschichtung enthält: Titandioxid, FD&C Blue No. 2 Aluminium Lake oder Synthetic Red Iron Oxide.
ZYDIS - Gelatine, Mannit, Aspartam, Natriummethylparaben und Natriumpropylparaben.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.