Geodon 40mg, 80mg, 20mg Ziprasidone Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Geodon und wie wird es angewendet?
Geodon ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Schizophrenie, akuter Unruhe bei Schizophrenie und Bipolar-I-Störung. Geodon kann allein oder mit anderen Medikamenten verwendet werden.
Geodon 20 mg gehört zu einer Klasse von Medikamenten, die als Antipsychotika bezeichnet werden.
Es ist nicht bekannt, ob Geodon bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Geodon haben?
Geodon 20 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Geodon 40 mg sind:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Prometrium. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
ERHÖHTE STERBLICHKEIT BEI ÄLTEREN PATIENTEN MIT PSYCHOSE IM ZUSAMMENHANG MIT DEMENZ
Ältere Patienten mit demenzbedingter Psychose, die mit Antipsychotika behandelt werden, haben ein erhöhtes Sterberisiko. GEODON ist nicht für die Behandlung von demenzbedingter Psychose zugelassen [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
BEZEICHNUNG
GEODON 40 mg ist als Kapseln (Ziprasidonhydrochlorid) zur oralen Verabreichung und als Injektion (Ziprasidonmesylat) ausschließlich zur intramuskulären Anwendung erhältlich. Ziprasidon ist ein psychotropes Mittel, das chemisch nicht mit Phenothiazin- oder Butyrophenon-Antipsychotika verwandt ist. Es hat ein Molekulargewicht von 412,94 (freie Base) und den folgenden chemischen Namen: 5-[2-[4-(1,2-Benzisothiazol-3-yl)-1-piperazinyl]ethyl]-6-chlor-1 ,3-Dihydro-2H-indol-2-on. Die empirische Formel von C21H21ClN4OS (freie Base von Ziprasidon) stellt die folgende Strukturformel dar:
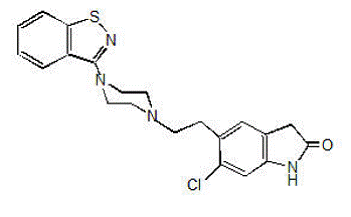
GEODON Kapseln enthalten ein Monohydrochlorid-Monohydratsalz von Ziprasidon. Chemisch gesehen ist Ziprasidon-Hydrochlorid-Monohydrat 5-[2-[4-(1,2-Benzisothiazol-3-yl)-1-piperazinyl]ethyl]-6-chlor-1,3-dihydro-2H-indol-2-on , Monohydrochlorid, Monohydrat. Die empirische Formel ist C21H21ClN4OS• HCl• H2O und sein Molekulargewicht ist 467,42. Ziprasidonhydrochlorid-Monohydrat ist ein weißes bis leicht rosafarbenes Pulver.
GEODON 20 mg Kapseln werden zur oralen Verabreichung in 20 mg (blau/weiß), 40 mg (blau/blau), 60 mg (weiß/weiß) und 80 mg (blau/weiß) Kapseln geliefert. GEODON 40 mg Kapseln enthalten Ziprasidonhydrochlorid-Monohydrat, Lactose, vorverkleisterte Stärke und Magnesiumstearat.
GEODON zur Injektion enthält eine lyophilisierte Form von Ziprasidonmesylat-Trihydrat. Chemisch gesehen ist Ziprasidonmesylat-Trihydrat 5-[2-[4-(1,2-Benzisothiazol-3-yl)-1-piperazinyl]ethyl]-6-chlor-1,3-dihydro-2H-indol-2-on , Methansulfonat, Trihydrat. Die empirische Formel lautet C21H21ClN4OS • CH3SO3H • 3H2O und sein Molekulargewicht beträgt 563,09.
GEODON 40 mg zur Injektion ist in einer Einzeldosis-Durchstechflasche als Ziprasidonmesylat (20 mg Ziprasidon/ml bei Rekonstitution gemäß den Anweisungen auf dem Etikett) erhältlich [siehe DOSIERUNG UND ANWENDUNG ]. Jeder ml Ziprasidonmesylat zur Injektion (nach Rekonstitution) enthält 20 mg Ziprasidon und 4,7 mg Methansulfonsäure, solubilisiert durch 294 mg Sulfobutylether-β-Cyclodextrin-Natrium (SBECD).
INDIKATIONEN
GEODON ist angezeigt zur Behandlung von Schizophrenie, als Monotherapie zur akuten Behandlung von bipolaren manischen oder gemischten Episoden und als Zusatz zu Lithium oder Valproat zur Erhaltungsbehandlung von bipolaren Störungen. GEODON intramuskulär ist angezeigt bei akuter Erregung bei schizophrenen Patienten. Bei der Entscheidung zwischen den verfügbaren alternativen Behandlungen für die zu behandelnde Erkrankung sollte der verschreibende Arzt die Erkenntnis berücksichtigen, dass Ziprasidon im Vergleich zu mehreren anderen Antipsychotika eine größere Fähigkeit zur Verlängerung des QT/QTc-Intervalls hat [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Die Verlängerung des QTc-Intervalls ist bei einigen anderen Arzneimitteln mit der Fähigkeit verbunden, eine Arrhythmie vom Torsade-de-Pointes-Typ, eine potenziell tödliche polymorphe ventrikuläre Tachykardie, und einen plötzlichen Tod zu verursachen. In vielen Fällen würde dies zu dem Schluss führen, dass zuerst andere Medikamente ausprobiert werden sollten. Ob Ziprasidon Torsade de Pointes verursacht oder die Rate des plötzlichen Todes erhöht, ist noch nicht bekannt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Schizophrenie
Bipolar-I-Störung (akute gemischte oder manische Episoden und Erhaltungsbehandlung als Ergänzung zu Lithium oder Valproat)
Akute Behandlung von Unruhe bei Schizophrenie
Da keine Erfahrungen bezüglich der Sicherheit der intramuskulären Verabreichung von Ziprasidon bei schizophrenen Patienten vorliegen, die bereits orales Ziprasidon einnehmen, wird die Praxis der gleichzeitigen Verabreichung nicht empfohlen.
DOSIERUNG UND ANWENDUNG
Schizophrenie
Dosisauswahl
GEODON 40 mg Kapseln sollten in einer anfänglichen Tagesdosis von 20 mg zweimal täglich mit einer Mahlzeit eingenommen werden. Bei einigen Patienten kann die Tagesdosis anschließend auf der Grundlage des individuellen klinischen Zustands auf bis zu 80 mg zweimal täglich angepasst werden. Dosisanpassungen sollten, falls angezeigt, im Allgemeinen in Abständen von mindestens 2 Tagen erfolgen, da der Steady State innerhalb von 1 bis 3 Tagen erreicht wird. Um sicherzustellen, dass die niedrigste wirksame Dosis angewendet wird, sollten die Patienten normalerweise mehrere Wochen lang auf Besserung beobachtet werden, bevor die Dosis nach oben angepasst wird.
Die Wirksamkeit bei Schizophrenie wurde in placebokontrollierten klinischen Kurzzeitstudien in einem Dosisbereich von 20 mg bis 100 mg zweimal täglich nachgewiesen. Es gab Tendenzen zur Dosiswirkung im Bereich von 20 mg bis 80 mg zweimal täglich, aber die Ergebnisse waren nicht konsistent. Eine Erhöhung auf eine Dosis von mehr als 80 mg zweimal täglich wird im Allgemeinen nicht empfohlen. Die Sicherheit von Dosen über 100 mg zweimal täglich wurde nicht systematisch in klinischen Studien untersucht [siehe Klinische Studien ].
Erhaltungsbehandlung
Während es keine Evidenz zur Beantwortung der Frage gibt, wie lange ein mit Ziprasidon behandelter Patient es einnehmen sollte, zeigte eine Erhaltungsstudie bei Patienten, die symptomatisch stabil waren und dann randomisiert wurden, um Ziprasidon fortzusetzen oder auf Placebo umzustellen, eine zeitliche Verzögerung Rückfall bei Patienten, die GEODON erhalten [siehe Klinische Studien ]. Für Dosen über 20 mg zweimal täglich wurde kein zusätzlicher Nutzen nachgewiesen. Die Patienten sollten regelmäßig neu untersucht werden, um die Notwendigkeit einer Erhaltungstherapie zu bestimmen.
Bipolar-I-Störung (akute gemischte oder manische Episoden und Erhaltungsbehandlung als Ergänzung zu Lithium oder Valproat)
Akute Behandlung manischer oder gemischter Episoden
Dosisauswahl – Orales Ziprasidon sollte in einer anfänglichen Tagesdosis von 40 mg zweimal täglich mit einer Mahlzeit eingenommen werden. Die Dosis kann dann am zweiten Behandlungstag auf 60 mg oder 80 mg zweimal täglich erhöht und anschließend auf der Grundlage von Verträglichkeit und Wirksamkeit innerhalb des Bereichs von 40 mg bis 80 mg zweimal täglich angepasst werden. In den klinischen Studien mit flexibler Dosierung betrug die verabreichte mittlere Tagesdosis ungefähr 120 mg [siehe Klinische Studien ].
Erhaltungstherapie (als Zusatz zu Lithium oder Valproat)
Setzen Sie die Behandlung mit der gleichen Dosis fort, auf die der Patient anfänglich eingestellt war, im Bereich von 40 mg bis 80 mg zweimal täglich mit Nahrung. Die Patienten sollten regelmäßig neu untersucht werden, um die Notwendigkeit einer Erhaltungstherapie zu bestimmen [siehe Klinische Studien ].
Akute Behandlung von Unruhe bei Schizophrenie
Intramuskuläre Dosierung
Die empfohlene Dosis beträgt 10 mg bis 20 mg, verabreicht nach Bedarf, bis zu einer Höchstdosis von 40 mg pro Tag. Dosen von 10 mg können alle zwei Stunden verabreicht werden; Dosen von 20 mg können alle vier Stunden bis zu einer Höchstdosis von 40 mg/Tag verabreicht werden. Die intramuskuläre Verabreichung von Ziprasidon an mehr als drei aufeinanderfolgenden Tagen wurde nicht untersucht.
Wenn eine Langzeittherapie angezeigt ist, sollten orale Ziprasidonhydrochlorid-Kapseln die intramuskuläre Verabreichung so schnell wie möglich ersetzen.
Da keine Erfahrungen bezüglich der Sicherheit der intramuskulären Verabreichung von Ziprasidon bei schizophrenen Patienten vorliegen, die bereits orales Ziprasidon einnehmen, wird die Praxis der gleichzeitigen Verabreichung nicht empfohlen.
Ziprasidon intramuskulär ist nur zur intramuskulären Anwendung bestimmt und sollte nicht intravenös verabreicht werden.
Intramuskuläre Zubereitung zur Verabreichung
GEODON zur Injektion (Ziprasidonmesylat) sollte nur durch intramuskuläre Injektion und nicht intravenös verabreicht werden. Einzeldosis-Durchstechflaschen müssen vor der Verabreichung rekonstituiert werden.
1,2 ml steriles Wasser für Injektionszwecke in die Durchstechflasche geben und kräftig schütteln, bis sich das gesamte Arzneimittel aufgelöst hat. Jeder ml der rekonstituierten Lösung enthält 20 mg Ziprasidon. Zur Verabreichung einer 10-mg-Dosis 0,5 ml der rekonstituierten Lösung aufziehen. Zur Verabreichung einer 20-mg-Dosis 1,0 ml der rekonstituierten Lösung aufziehen. Nicht verwendeter Teil sollte verworfen werden. Da dieses Produkt kein Konservierungsmittel oder bakteriostatisches Mittel enthält, muss bei der Herstellung der fertigen Lösung aseptisch vorgegangen werden. Dieses Arzneimittel darf nicht mit anderen Arzneimitteln oder Lösungsmitteln außer sterilem Wasser für Injektionszwecke gemischt werden. Parenterale Arzneimittel sollten vor der Verabreichung visuell auf Partikel und Verfärbungen untersucht werden, sofern Lösung und Behältnis dies zulassen.
WIE GELIEFERT
Darreichungsformen und Stärken
GEODON-Kapseln werden nach Kapselfarbe/-größe unterschieden und sind in schwarzer Tinte mit „Pfizer und ZDX [Dosierungsstärke]“ oder „Pfizer“ und einer eindeutigen Nummer bedruckt. GEODON 40 mg Kapseln werden zur oralen Verabreichung in 20 mg (blau/weiß), 40 mg (blau/blau), 60 mg (weiß/weiß) und 80 mg (blau/weiß) Kapseln geliefert. Sie werden in den folgenden Stärken und Verpackungskonfigurationen geliefert:
GEODON zur Injektion ist in einer Einzeldosis-Durchstechflasche als Ziprasidonmesylat (20 mg Ziprasidon/ml bei Rekonstitution gemäß den Anweisungen auf dem Etikett) erhältlich [siehe DOSIERUNG UND ANWENDUNG ]. Jeder ml Ziprasidonmesylat zur Injektion (nach Rekonstitution) ergibt eine farblose bis blassrosa Lösung, die 20 mg Ziprasidon und 4,7 mg Methansulfonsäure, solubilisiert durch 294 mg Sulfobutylether-β-Cyclodextrin-Natrium (SBECD), enthält.
Lagerung und Handhabung
GEODON-Kapseln werden nach Kapselfarbe/-größe unterschieden und sind in schwarzer Tinte mit „Pfizer und ZDX [Dosierungsstärke]“ oder mit „Pfizer“ und einer eindeutigen Nummer bedruckt. GEODON 20 mg Kapseln werden zur oralen Verabreichung in 20 mg (blau/weiß), 40 mg (blau/blau), 60 mg (weiß/weiß) und 80 mg (blau/weiß) Kapseln geliefert. Sie werden in den folgenden Stärken und Verpackungskonfigurationen geliefert:
Oder
GEODON-Kapseln sollten bei 25 °C (77 °F) gelagert werden; Exkursionen erlaubt bis 15°C bis 30°C (59°F bis 86°F) [siehe USP kontrollierte Raumtemperatur ].
GEODON 80 mg zur Injektion ist in einer Einzeldosis-Durchstechflasche als Ziprasidonmesylat (20 mg Ziprasidon/ml bei Rekonstitution gemäß den Anweisungen auf dem Etikett) erhältlich [siehe DOSIERUNG UND ANWENDUNG ]. Jeder ml Ziprasidonmesylat zur Injektion (nach Rekonstitution) ergibt eine farblose bis blassrosa Lösung, die 20 mg Ziprasidon und 4,7 mg Methansulfonsäure, solubilisiert durch 294 mg Sulfobutylether-β-Cyclodextrin-Natrium (SBECD), enthält.
GEODON 40 mg zur Injektion sollte bei 25 °C (77 °F) gelagert werden; Exkursionen erlaubt bis 15°C bis 30°C (59°F bis 86°F) [siehe USP kontrollierte Raumtemperatur in trockener Form. Vor Licht schützen. Nach der Rekonstitution kann GEODON 40 mg zur Injektion vor Licht geschützt bis zu 24 Stunden bei 15 °C bis 30 °C (59 °F bis 86 °F) oder bis zu 7 Tage gekühlt bei 2 °C bis 8 °C aufbewahrt werden °C (36 °F bis 46 °F).
Vertrieb durch: Roerig Division of Pfizer Inc, NY, NY 10017. Überarbeitet: Okt. 2020
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
An klinischen Studien zu oralem Ziprasidon nahmen etwa 5700 Patienten und/oder normale Probanden teil, die einer oder mehreren Dosen Ziprasidon ausgesetzt wurden. Von diesen 5700 waren über 4800 Patienten, die an Wirksamkeitsstudien mit Mehrfachdosierung teilnahmen, und ihre Erfahrung entsprach etwa 1831 Patientenjahren. Zu diesen Patienten gehören: (1) 4331 Patienten, die an Mehrfachdosis-Studien teilgenommen haben, hauptsächlich bei Schizophrenie, was ungefähr 1698 Patientenjahren der Exposition zum 5. Februar 2000 entspricht; und (2) 472 Patienten, die an Studien zur bipolaren Manie teilgenommen haben, die ungefähr 133 Patientenjahre der Exposition repräsentieren. Weitere 127 Patienten mit bipolarer Störung nahmen an einer Langzeit-Erhaltungsbehandlungsstudie teil, die ungefähr 74,7 Patientenjahre der Exposition gegenüber Ziprasidon repräsentierte. Die Bedingungen und Dauer der Behandlung mit Ziprasidon umfassten offene und doppelblinde Studien, stationäre und ambulante Studien sowie kurz- und längerfristige Exposition.
An klinischen Studien zu intramuskulärem Ziprasidon nahmen 570 Patienten und/oder gesunde Probanden teil, die eine oder mehrere Ziprasidon-Injektionen erhielten. Über 325 dieser Probanden nahmen an Studien teil, bei denen mehrere Dosen verabreicht wurden.
Nebenwirkungen während der Exposition wurden durch das Sammeln freiwillig gemeldeter unerwünschter Erfahrungen sowie von Ergebnissen körperlicher Untersuchungen, Vitalfunktionen, Gewichten, Laboranalysen, EKGs und Ergebnissen ophthalmologischer Untersuchungen ermittelt.
Die angegebenen Häufigkeiten von Nebenwirkungen stellen den Anteil der Personen dar, bei denen mindestens einmal eine behandlungsbedingte Nebenwirkung der aufgeführten Art aufgetreten ist. Eine Reaktion wurde als behandlungsbedingt angesehen, wenn sie zum ersten Mal auftrat oder sich während der Therapie nach der Ausgangsbewertung verschlechterte.
Unerwünschte Ergebnisse, die in Placebo-kontrollierten Kurzzeitstudien mit oralem Ziprasidon beobachtet wurden
Die folgenden Ergebnisse basieren auf den placebokontrollierten Kurzzeitstudien vor der Markteinführung für Schizophrenie (ein Pool von zwei 6-wöchigen und zwei 4-wöchigen Studien mit fester Dosierung) und bipolarer Manie (ein Pool von zwei 3-wöchigen flexiblen Dosierungsstudien). Studien), in denen Ziprasidon in Dosen von 10 bis 200 mg/Tag verabreicht wurde.
Häufig beobachtete Nebenwirkungen in placebokontrollierten Kurzzeitstudien
Die folgenden Nebenwirkungen waren die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von Ziprasidon (Häufigkeit von 5 % oder mehr) und wurden bei mit Placebo behandelten Patienten nicht mit gleicher Häufigkeit beobachtet (Ziprasidon-Häufigkeit mindestens doppelt so hoch wie bei Placebo):
Schizophrenie-Studien (siehe Tabelle 11)
Bipolare Studien (siehe Tabelle 12)
Schizophrenie
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung in Placebo-kontrollierten Kurzzeitstudien mit oralem Ziprasidon
Etwa 4,1 % (29/702) der mit Ziprasidon behandelten Patienten in placebokontrollierten Kurzzeitstudien brachen die Behandlung aufgrund einer Nebenwirkung ab, verglichen mit etwa 2,2 % (6/273) unter Placebo. Die häufigste mit dem Abbruch verbundene Reaktion war Hautausschlag, einschließlich 7 Abbrüche wegen Hautausschlag bei Ziprasidon-Patienten (1 %) im Vergleich zu keinem Placebo-Patienten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nebenwirkungen, die bei mit Ziprasidon behandelten Patienten in kurzzeitigen, oralen, placebokontrollierten Studien mit einer Inzidenz von 2 % oder mehr auftraten
Tabelle 11 führt die auf den nächsten Prozentsatz gerundete Inzidenz von behandlungsbedingten Nebenwirkungen auf, die während der Akuttherapie (bis zu 6 Wochen) bei überwiegend Patienten mit Schizophrenie auftraten, einschließlich nur jener Reaktionen, die bei 2 % oder mehr der mit Schizophrenie behandelten Patienten auftraten Ziprasidon, und bei denen die Inzidenz bei mit Ziprasidon behandelten Patienten höher war als die Inzidenz bei mit Placebo behandelten Patienten.
Dosisabhängigkeit von Nebenwirkungen in kurzfristigen, placebokontrollierten Studien mit fester Dosis
Eine Analyse der Dosis-Wirkungs-Beziehung im Pool der 4 Schizophrenie-Studien ergab eine offensichtliche Beziehung zwischen Nebenwirkung und Dosis für die folgenden Reaktionen: Asthenie, orthostatische Hypotonie, Anorexie, Mundtrockenheit, vermehrter Speichelfluss, Arthralgie, Angst, Schwindel, Dystonie, Hypertonie, Somnolenz , Tremor, Rhinitis, Hautausschlag und Sehstörungen.
Extrapyramidale Symptome (EPS)
Die Inzidenz von gemeldeter EPS (einschließlich der Nebenwirkungsbegriffe extrapyramidales Syndrom, Hypertonie, Dystonie, Dyskinesie, Hypokinesie, Tremor, Lähmung und Zuckungen) bei mit Ziprasidon behandelten Patienten in den placebokontrollierten Kurzzeitstudien zur Schizophrenie betrug 14 % vs. 8 % für Placebo. Objektiv gesammelte Daten aus diesen Studien auf der Simpson-Angus-Bewertungsskala (für EPS) und der Barnes-Akathisie-Skala (für Akathisie) zeigten im Allgemeinen keinen Unterschied zwischen Ziprasidon und Placebo.
Dystonie
Klasseneffekt: Bei empfindlichen Personen können in den ersten Tagen der Behandlung Symptome einer Dystonie, verlängerte abnorme Kontraktionen von Muskelgruppen, auftreten. Zu den dystonischen Symptomen gehören: Krämpfe der Nackenmuskulatur, die sich manchmal zu einem Engegefühl im Hals entwickeln, Schluckbeschwerden, Atembeschwerden und/oder Heraustreten der Zunge. Während diese Symptome bei niedrigen Dosen auftreten können, treten sie häufiger und mit größerer Schwere bei hochpotenten und höheren Dosen von Antipsychotika der ersten Generation auf. Ein erhöhtes Risiko einer akuten Dystonie wird bei Männern und jüngeren Altersgruppen beobachtet.
Veränderungen der Vitalzeichen
Ziprasidon ist mit orthostatischer Hypotonie verbunden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]
EKG-Veränderungen
Ziprasidon ist mit einer Verlängerung des QTc-Intervalls verbunden [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]. In den Schizophrenie-Studien war Ziprasidon mit einem mittleren Anstieg der Herzfrequenz von 1,4 Schlägen pro Minute im Vergleich zu einer Abnahme von 0,2 Schlägen pro Minute bei Placebo-Patienten verbunden.
Andere Nebenwirkungen, die während der Premarketing-Bewertung von oralem Ziprasidon beobachtet wurden
Es folgt eine Liste von COSTART-Begriffen, die behandlungsbedingte Nebenwirkungen widerspiegeln, wie in der Einleitung zum Abschnitt NEBENWIRKUNGEN definiert, die von Patienten berichtet wurden, die in Schizophrenie-Studien mit Ziprasidon in Mehrfachdosen von >4 mg/Tag in der Datenbank von 3834 Patienten behandelt wurden. Alle gemeldeten Reaktionen sind eingeschlossen, außer denen, die bereits in Tabelle 11 oder an anderer Stelle in der Kennzeichnung aufgeführt sind, solche Reaktionsbegriffe, die so allgemein waren, dass sie nicht aussagekräftig waren, nur einmal gemeldete Reaktionen, bei denen keine erhebliche Wahrscheinlichkeit besteht, dass sie akut lebensbedrohlich sind, Reaktionen, die die Teil der behandelten Krankheit sind oder anderweitig häufig auftreten, als Hintergrundreaktionen und Reaktionen, die als unwahrscheinlich mit dem Arzneimittel in Zusammenhang stehen. Es ist wichtig zu betonen, dass die berichteten Reaktionen zwar während der Behandlung mit Ziprasidon auftraten, aber nicht unbedingt dadurch verursacht wurden.
Die Nebenwirkungen werden weiter nach Körpersystem kategorisiert und nach abnehmender Häufigkeit gemäß den folgenden Definitionen aufgelistet:
Häufig – Nebenwirkungen, die bei mindestens 1/100 Patienten auftreten (≥1,0 % der Patienten) (in dieser Liste erscheinen nur diejenigen, die nicht bereits in den tabellarischen Ergebnissen aus placebokontrollierten Studien aufgeführt sind);
Selten - Nebenwirkungen, die bei 1/100 bis 1/1000 Patienten auftreten (bei 0,1-1,0 % der Patienten)
Selten – Nebenwirkungen, die bei weniger als 1/1000 Patienten (
Körper als Ganzes
Häufige Bauchschmerzen, Grippesyndrom, Fieber, Sturz, Gesichtsödem, Schüttelfrost, Lichtempfindlichkeitsreaktion, Flankenschmerzen, Unterkühlung, Autounfall
Herz-Kreislauf-System
Häufige Tachykardie, Bluthochdruck, orthostatische Hypotonie
Selten Bradykardie, Angina pectoris, Vorhofflimmern
Selten: AV-Block ersten Grades, Schenkelblock, Phlebitis, Lungenembolie, Kardiomegalie, Hirninfarkt, Schlaganfall, tiefe Thrombophlebitis, Myokarditis, Thrombophlebitis
Verdauungstrakt
Häufige Anorexie, Erbrechen
Selten rektale Blutungen, Dysphagie, Zungenödem
Selten Zahnfleischbluten, Gelbsucht, Kotstau, erhöhte Gamma-Glutamyl-Transpeptidase, Hämatemesis, cholestatischer Ikterus, Hepatitis, Hepatomegalie, Leukoplakie des Mundes, Fettleber, Meläna
Endokrine
Selten Hypothyreose, Hyperthyreose, Thyreoiditis
Hämisches und lymphatisches System
Selten Anämie, Ekchymose, Leukozytose, Leukopenie, Eosinophilie, Lymphadenopathie
Selten Thrombozytopenie, hypochrome Anämie, Lymphozytose, Monozytose, Basophilie, Lymphödem, Polyzythämie, Thrombozythämie
Stoffwechsel- und Ernährungsstörungen
Seltener Durst, erhöhte Transaminasen, periphere Ödeme, Hyperglykämie, erhöhte Kreatinphosphokinase, erhöhte alkalische Phosphatase, Hypercholesterinämie, Dehydratation, erhöhte Laktatdehydrogenase, Albuminurie, Hypokaliämie
Selten BUN erhöht, Kreatinin erhöht, Hyperlipämie, Hypocholesterämie, Hyperkaliämie, Hypochlorämie, Hypoglykämie, Hyponatriämie, Hypoproteinämie, verminderte Glukosetoleranz, Gicht, Hyperchlorämie, Hyperurikämie, Hypokalzämie, Hypoglykämie, Hypomagnesiämie, Ketose, respiratorische Alkalose
Bewegungsapparat
Häufige Myalgie
Selten Sehnenscheidenentzündung
Seltene Myopathie
Nervöses System
Frequentagitation, extrapyramidales Syndrom, Tremor, Dystonie, Hypertonie, Dyskinesie, Feindseligkeit, Zuckungen, Parästhesien, Verwirrtheit, Schwindel, Hypokinesie, Hyperkinesie, anormaler Gang, Augenkrise, Hypästhesie, Ataxie, Amnesie, Zahnradstarre, Delirium, Hypotonie, Akinesie, Dysarthrie, Entzugssyndrom, Buccoglossus-Syndrom, Choreoathetose, Diplopie, Koordinationsstörungen, Neuropathie
Seltene Lähmung
Selten Myoklonus, Nystagmus, Torticollis, zirkumorale Parästhesien, Opisthotonus, verstärkte Reflexe, Trismus
Atmungssystem
Häufige Dyspnoe
Selten Lungenentzündung, Epistaxis
Selten Bluthusten, Laryngismus
Haut und Anhängsel
Seltener makulopapulöser Ausschlag, Urtikaria, Alopezie, Ekzem, exfoliative Dermatitis, Kontaktdermatitis, vesikulobullöser Ausschlag
Besondere Sinne
Häufige Pilzdermatitis
Selten Konjunktivitis, trockene Augen, Tinnitus, Blepharitis, Katarakt, Photophobie
Selten Augenblutung, Gesichtsfelddefekt, Keratitis, Keratokonjunktivitis
Urogenitalsystem
Gelegentliche Impotenz, abnorme Ejakulation, Amenorrhoe, Hämaturie, Menorrhagie, weibliche Laktation, Polyurie, Harnverhalt, Metrorrhagie, männliche sexuelle Dysfunktion, Anorgasmie, Glykosurie
Selten Gynäkomastie, Vaginalblutung, Nykturie, Oligurie, weibliche sexuelle Dysfunktion, Uterusblutung
Bipolare Störung
Akute Behandlung manischer oder gemischter Episoden
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung in placebokontrollierten Kurzzeitstudien
Etwa 6,5 % (18/279) der mit Ziprasidon behandelten Patienten in placebokontrollierten Kurzzeitstudien brachen die Behandlung aufgrund einer Nebenwirkung ab, verglichen mit etwa 3,7 % (5/136) unter Placebo. Die häufigsten Reaktionen im Zusammenhang mit Abbruch bei den mit Ziprasidon behandelten Patienten waren Akathisie, Angst, Depression, Schwindel, Dystonie, Hautausschlag und Erbrechen, mit 2 Abbrüchen für jede dieser Reaktionen bei den Ziprasidon-Patienten (1 %) im Vergleich zu jeweils einem Placebo-Patienten Dystonie und Hautausschlag (1 %) und keine Placebo-Patienten für die verbleibenden Nebenwirkungen.
Nebenwirkungen, die bei mit Ziprasidon behandelten Patienten in kurzzeitigen, oralen, placebokontrollierten Studien mit einer Inzidenz von 2 % oder mehr auftraten
Tabelle 12 führt die auf den nächsten Prozentsatz gerundete Inzidenz von behandlungsbedingten Nebenwirkungen auf, die während der Akuttherapie (bis zu 3 Wochen) bei Patienten mit bipolarer Manie auftraten, einschließlich nur jener Reaktionen, die bei 2 % oder mehr der mit behandelten Patienten auftraten Ziprasidon, und bei denen die Inzidenz bei mit Ziprasidon behandelten Patienten höher war als die Inzidenz bei mit Placebo behandelten Patienten.
Untersuchungen zu Wechselwirkungen auf der Grundlage des Geschlechts ergaben keine klinisch bedeutsamen Unterschiede beim Auftreten von Nebenwirkungen auf der Grundlage dieses demografischen Faktors.
Intramuskuläres Ziprasidon
Nebenwirkungen, die bei mit Ziprasidon behandelten Patienten in Kurzzeitstudien mit intramuskulärem Ziprasidon mit einer Inzidenz von 1 % oder mehr auftraten
Tabelle 13 führt die auf den nächsten Prozentsatz gerundete Inzidenz von behandlungsbedingten Nebenwirkungen auf, die während der Akuttherapie mit intramuskulärem Ziprasidon bei 1 % oder mehr der Patienten auftraten.
In diesen Studien waren die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von intramuskulärem Ziprasidon (Inzidenz von 5 % oder mehr) und wurden mit einer Rate von intramuskulärem Ziprasidon (in den Gruppen mit höherer Dosis) beobachtet, die mindestens doppelt so hoch war wie die der Gruppe mit dem niedrigsten intramuskulären Ziprasidon waren Kopfschmerzen (13 %), Übelkeit (12 %) und Schläfrigkeit (20 %).
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von GEODON nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Berichte über Nebenwirkungen, die oben nicht aufgeführt sind und seit der Markteinführung eingegangen sind, umfassen seltene Vorkommen der folgenden: Herzerkrankungen: Tachykardie, Torsade de Pointes (bei Vorliegen mehrerer Störfaktoren), [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]; Erkrankungen des Verdauungssystems: Geschwollene Zunge; Störungen des Fortpflanzungssystems und der Brust: Galaktorrhoe, Priapismus; Erkrankungen des Nervensystems: Facial Droop, malignes neuroleptisches Syndrom, Serotonin-Syndrom (allein oder in Kombination mit serotonergen Arzneimitteln), tardive Dyskinesie; Psychiatrische Erkrankungen: Schlaflosigkeit, Manie/Hypomanie; Erkrankungen der Haut und des Unterhautzellgewebes: Allergische Reaktion (wie allergische Dermatitis, Angioödem, orofaziales Ödem, Urtikaria), Hautausschlag, Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS); Erkrankungen des Urogenitalsystems: Enuresis, Harninkontinenz; Gefäßerkrankungen: Orthostatische Hypotonie, Synkope.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Arzneimittelwechselwirkungen können pharmakodynamischer (kombinierte pharmakologische Wirkungen) oder pharmakokinetischer (Veränderung der Plasmaspiegel) sein. Die Risiken der Anwendung von Ziprasidon in Kombination mit anderen Arzneimitteln wurden wie unten beschrieben bewertet. Alle Wechselwirkungsstudien wurden mit oralem Ziprasidon durchgeführt. Basierend auf dem pharmakodynamischen und pharmakokinetischen Profil von Ziprasidon sind mögliche Wechselwirkungen zu erwarten:
Stoffwechselweg
Etwa zwei Drittel von Ziprasidon werden über eine Kombination aus chemischer Reduktion durch Glutathion und enzymatischer Reduktion durch Aldehydoxidase metabolisiert. Es sind keine klinisch relevanten Inhibitoren oder Induktoren der Aldehydoxidase bekannt. Weniger als ein Drittel der metabolischen Clearance von Ziprasidon wird durch Cytochrom-P450-katalysierte Oxidation vermittelt.
In-vitro-Studien
Eine In-vitro-Enzymhemmungsstudie mit menschlichen Lebermikrosomen zeigte, dass Ziprasidon eine geringe Hemmwirkung auf CYP1A2, CYP2C9, CYP2C19, CYP2D6 und CYP3A4 hat und daher wahrscheinlich nicht in den Metabolismus von Arzneimitteln eingreift, die hauptsächlich durch diese Enzyme metabolisiert werden. Es besteht nur ein geringes Potenzial für Arzneimittelwechselwirkungen mit Ziprasidon aufgrund von Verdrängung [siehe KLINISCHE PHARMAKOLOGIE ].
Pharmakodynamische Wechselwirkungen
Ziprasidon sollte nicht zusammen mit Arzneimitteln angewendet werden, die das QT-Intervall verlängern [siehe KONTRAINDIKATIONEN ].
Angesichts der primären ZNS-Wirkungen von Ziprasidon ist Vorsicht geboten, wenn es in Kombination mit anderen zentral wirkenden Arzneimitteln eingenommen wird.
Aufgrund seines Potenzials zur Induktion von Hypotonie kann Ziprasidon die Wirkung bestimmter Antihypertonika verstärken.
Ziprasidon kann die Wirkung von Levodopa und Dopaminagonisten antagonisieren.
Pharmakokinetische Wechselwirkungen
Carbamazepin
Carbamazepin ist ein Induktor von CYP3A4; Die Verabreichung von 200 mg zweimal täglich über 21 Tage führte zu einer Verringerung der AUC von Ziprasidon um etwa 35 %. Dieser Effekt kann stärker sein, wenn höhere Carbamazepin-Dosen verabreicht werden.
Ketoconazol
Ketoconazol, ein starker Inhibitor von CYP3A4, erhöhte in einer Dosis von 400 mg einmal täglich über 5 Tage die AUC und Cmax von Ziprasidon um etwa 35-40 %. Von anderen Inhibitoren von CYP3A4 sind ähnliche Wirkungen zu erwarten.
Cimetidin
Cimetidin in einer Dosis von 800 mg QD für 2 Tage hatte keinen Einfluss auf die Pharmakokinetik von Ziprasidon.
Antazida
Die gleichzeitige Verabreichung von 30 ml Maalox® mit Ziprasidon hatte keinen Einfluss auf die Pharmakokinetik von Ziprasidon.
Lithium
Ziprasidon in einer Dosis von 40 mg zweimal täglich, das gleichzeitig mit Lithium in einer Dosis von 450 mg zweimal täglich über 7 Tage verabreicht wurde, hatte keinen Einfluss auf den Steady-State-Spiegel oder die renale Clearance von Lithium. Ziprasidon, das in einer Erhaltungsstudie mit bipolaren Patienten zusätzlich zu Lithium dosiert wurde, beeinflusste die mittleren therapeutischen Lithiumspiegel nicht.
Orale Kontrazeptiva
In-vivo-Studien haben keine Wirkung von Ziprasidon auf die Pharmakokinetik von Östrogen- oder Progesteronkomponenten gezeigt. Ziprasidon in einer Dosis von 20 mg zweimal täglich hatte keinen Einfluss auf die Pharmakokinetik von gleichzeitig angewendeten oralen Kontrazeptiva, Ethinylestradiol (0,03 mg) und Levonorgestrel (0,15 mg).
Dextromethorphan
In Übereinstimmung mit den In-vitro-Ergebnissen zeigte eine Studie an gesunden Probanden, dass Ziprasidon den Metabolismus von Dextromethorphan, einem CYP2D6-Modellsubstrat, zu seinem Hauptmetaboliten Dextrorphan nicht veränderte. Es gab keine statistisch signifikante Veränderung des Dextromethorphan/Dextrorphan-Verhältnisses im Urin.
Valproat
Eine pharmakokinetische Wechselwirkung von Ziprasidon mit Valproat ist aufgrund des Fehlens gemeinsamer Stoffwechselwege für die beiden Arzneimittel unwahrscheinlich. Ziprasidon, das in einer Erhaltungsstudie mit bipolaren Patienten zusätzlich zu Valproat verabreicht wurde, beeinflusste die mittleren therapeutischen Valproatspiegel nicht.
Andere begleitende medikamentöse Therapie
Populationspharmakokinetische Analysen von schizophrenen Patienten, die in kontrollierte klinische Studien aufgenommen wurden, ergaben keine Hinweise auf klinisch signifikante pharmakokinetische Wechselwirkungen mit Benztropin, Propranolol oder Lorazepam.
Lebensmittelinteraktion
Die absolute Bioverfügbarkeit einer 20-mg-Dosis unter Nahrungsaufnahme beträgt etwa 60 %. Die Resorption von Ziprasidon wird in Gegenwart von Nahrung bis auf das Doppelte erhöht [vgl KLINISCHE PHARMAKOLOGIE ].
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Erhöhte Sterblichkeit bei älteren Patienten mit demenzbedingter Psychose
Ältere Patienten mit demenzbedingter Psychose, die mit Antipsychotika behandelt werden, haben ein erhöhtes Sterberisiko. Analysen von 17 placebokontrollierten Studien (modale Dauer von 10 Wochen), hauptsächlich bei Patienten, die atypische Antipsychotika einnahmen, ergaben ein Todesrisiko bei mit Arzneimitteln behandelten Patienten, das zwischen dem 1,6- und 1,7-fachen des Todesrisikos bei mit Placebo behandelten Patienten lag. Im Verlauf einer typischen 10-wöchigen kontrollierten Studie betrug die Todesrate bei mit Arzneimitteln behandelten Patienten etwa 4,5 %, verglichen mit einer Rate von etwa 2,6 % in der Placebogruppe.
Obwohl die Todesursachen unterschiedlich waren, schienen die meisten Todesfälle entweder kardiovaskulärer (z. B. Herzinsuffizienz, plötzlicher Tod) oder infektiöser (z. B. Lungenentzündung) Natur zu sein. GEODON ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen. [sehen KASTENWARNUNG , Zerebrovaskuläre Nebenwirkungen, einschließlich Schlaganfall, bei älteren Patienten mit demenzbedingter Psychose ].
Zerebrovaskuläre Nebenwirkungen, einschließlich Schlaganfall, bei älteren Patienten mit demenzbedingter Psychose
In placebokontrollierten Studien mit älteren Patienten mit Demenz hatten Patienten, die randomisiert Risperidon, Aripiprazol und Olanzapin erhielten, eine höhere Inzidenz von Schlaganfällen und transitorischen ischämischen Attacken, einschließlich tödlicher Schlaganfälle. GEODON ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen [vgl KASTENWARNUNG und Erhöhte Sterblichkeit bei älteren Patienten mit demenzbedingter Psychose ].
QT-Verlängerung und Risiko eines plötzlichen Todes
Die Anwendung von Ziprasidon in Kombination mit anderen Arzneimitteln, die bekanntermaßen das QTc-Intervall verlängern, sollte vermieden werden [siehe KONTRAINDIKATIONEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Darüber hinaus sollten Kliniker auf die Identifizierung anderer Arzneimittel achten, bei denen beständig eine Verlängerung des QTc-Intervalls beobachtet wurde. Solche Medikamente sollten nicht zusammen mit Ziprasidon verschrieben werden. Ziprasidon sollte auch bei Patienten mit angeborenem Long-QT-Syndrom und bei Patienten mit Herzrhythmusstörungen in der Anamnese vermieden werden [siehe KONTRAINDIKATIONEN ].
An freiwilligen Patienten wurde eine Studie durchgeführt, in der die QT/QTc-verlängernde Wirkung von oralem Ziprasidon direkt mit mehreren anderen Arzneimitteln verglichen wurde, die bei der Behandlung von Schizophrenie wirksam sind. In der ersten Phase der Studie wurden EKGs zum Zeitpunkt der maximalen Plasmakonzentration erhalten, wenn das Medikament allein verabreicht wurde. In der zweiten Phase der Studie wurden EKGs zum Zeitpunkt der maximalen Plasmakonzentration erhalten, während das Medikament zusammen mit einem Inhibitor des CYP4503A4-Metabolismus des Medikaments verabreicht wurde.
In der ersten Phase der Studie wurde die mittlere QTc-Änderung gegenüber dem Ausgangswert für jedes Medikament berechnet, wobei eine stichprobenbasierte Korrektur verwendet wurde, die die Auswirkung der Herzfrequenz auf das QT-Intervall entfernt. Der mittlere QTc-Anstieg gegenüber dem Ausgangswert war bei Ziprasidon etwa 9 bis 14 ms größer als bei vier der Vergleichspräparate (Risperidon, Olanzapin, Quetiapin und Haloperidol), war aber etwa 14 ms geringer als die bei Thioridazin beobachtete Verlängerung.
In der zweiten Phase der Studie wurde die Wirkung von Ziprasidon auf die QTc-Länge nicht durch das Vorhandensein eines metabolischen Inhibitors (Ketoconazol 200 mg zweimal täglich) verstärkt.
In placebokontrollierten Studien verlängerte orales Ziprasidon bei der höchsten empfohlenen Tagesdosis von 160 mg das QTc-Intervall im Vergleich zu Placebo um etwa 10 ms. In klinischen Studien mit oralem Ziprasidon zeigten die Elektrokardiogramme von 2/2988 (0,06 %) Patienten, die GEODON 80 mg erhielten, und 1/440 (0,23 %) Patienten, die Placebo erhielten, QTc-Intervalle, die den potenziell klinisch relevanten Schwellenwert von 500 ms überschritten. Bei den mit Ziprasidon behandelten Patienten deutete keiner der Fälle auf eine Rolle von Ziprasidon hin. Ein Patient hatte eine Vorgeschichte mit verlängertem QTc und einer Screening-Messung von 489 ms; QTc betrug während der Behandlung mit Ziprasidon 503 ms. Der andere Patient hatte eine QTc von 391 ms am Ende der Behandlung mit Ziprasidon und nach Umstellung auf Thioridazin erfuhren QTc-Messungen von 518 und 593 ms.
Einige Medikamente, die das QT/QTc-Intervall verlängern, wurden mit dem Auftreten von Torsade de Pointes und mit plötzlichem ungeklärtem Tod in Verbindung gebracht. Die Beziehung zwischen QT-Verlängerung und Torsade de Pointes ist am deutlichsten bei stärkeren Anstiegen (20 ms und mehr), aber es ist möglich, dass auch kleinere QT/QTc-Verlängerungen das Risiko erhöhen oder es bei anfälligen Personen erhöhen. Obwohl Torsade de Pointes im Zusammenhang mit der Anwendung von Ziprasidon in Studien vor der Markteinführung nicht beobachtet wurde und die Erfahrung zu begrenzt ist, um ein erhöhtes Risiko auszuschließen, gab es seltene Berichte nach der Markteinführung (beim Vorliegen mehrerer Störfaktoren) [siehe NEBENWIRKUNGEN ].
An freiwilligen Patienten wurde eine Studie zur Bewertung der QT/QTc-verlängernden Wirkung von intramuskulärem Ziprasidon mit intramuskulärem Haloperidol als Kontrolle durchgeführt. In der Studie wurden EKGs zum Zeitpunkt der maximalen Plasmakonzentration nach zwei Injektionen von Ziprasidon (20 mg, dann 30 mg) oder Haloperidol (7,5 mg, dann 10 mg) im Abstand von vier Stunden aufgenommen. Beachten Sie, dass eine Dosis von 30 mg intramuskulärem Ziprasidon 50 % höher ist als die empfohlene therapeutische Dosis. Die mittlere QTc-Änderung gegenüber dem Ausgangswert wurde für jedes Medikament berechnet, wobei eine stichprobenbasierte Korrektur verwendet wurde, die die Auswirkung der Herzfrequenz auf das QT-Intervall beseitigt. Die mittlere QTc-Zunahme gegenüber dem Ausgangswert für Ziprasidon betrug 4,6 ms nach der ersten Injektion und 12,8 ms nach der zweiten Injektion. Der mittlere QTc-Anstieg gegenüber dem Ausgangswert für Haloperidol betrug 6,0 ms nach der ersten Injektion und 14,7 ms nach der zweiten Injektion. In dieser Studie hatte kein Patient ein QTc-Intervall von mehr als 500 ms.
Wie bei anderen Antipsychotika und Placebo wurden plötzliche Todesfälle aus ungeklärter Ursache bei Patienten berichtet, die Ziprasidon in den empfohlenen Dosen einnahmen. Die Erfahrungen vor der Markteinführung von Ziprasidon zeigten kein erhöhtes Mortalitätsrisiko für Ziprasidon im Vergleich zu anderen Antipsychotika oder Placebo, aber das Ausmaß der Exposition war begrenzt, insbesondere für die als aktive Kontrollen verwendeten Arzneimittel und Placebo. Dennoch erhöht die größere Verlängerung der QTc-Länge von Ziprasidon im Vergleich zu mehreren anderen Antipsychotika die Möglichkeit, dass das Risiko eines plötzlichen Todes bei Ziprasidon größer sein könnte als bei anderen verfügbaren Arzneimitteln zur Behandlung von Schizophrenie. Diese Möglichkeit muss bei der Entscheidung zwischen alternativen Arzneimitteln berücksichtigt werden [vgl INDIKATIONEN ].
Bestimmte Umstände können das Risiko des Auftretens von Torsade de Pointes und/oder plötzlichem Herztod in Verbindung mit der Einnahme von Arzneimitteln erhöhen, die das QTc-Intervall verlängern, einschließlich (1) Bradykardie; (2) Hypokaliämie oder Hypomagnesiämie; (3) gleichzeitige Anwendung anderer Arzneimittel, die das QTc-Intervall verlängern; und (4) Vorhandensein einer angeborenen Verlängerung des QT-Intervalls.
Es wird empfohlen, dass bei Patienten, die für eine Behandlung mit Ziprasidon in Betracht gezogen werden und bei denen ein Risiko für signifikante Elektrolytstörungen, insbesondere Hypokaliämie, besteht, Serumkalium- und -magnesium-Basiswerte bestimmt werden. Hypokaliämie (und/oder Hypomagnesiämie) kann das Risiko einer QT-Verlängerung und Arrhythmie erhöhen. Eine Hypokaliämie kann aus einer diuretischen Therapie, Durchfall und anderen Ursachen resultieren. Patienten mit niedrigem Kalium- und/oder Magnesiumspiegel im Serum sollten mit diesen Elektrolyten aufgefüllt werden, bevor sie mit der Behandlung fortfahren. Bei Patienten, bei denen während der Behandlung mit Ziprasidon eine diuretische Therapie eingeleitet wird, müssen die Serumelektrolyte regelmäßig überwacht werden. Anhaltend verlängerte QTc-Intervalle können auch das Risiko einer weiteren Verlängerung und Arrhythmie erhöhen, aber es ist nicht klar, ob routinemäßige EKG-Screening-Maßnahmen bei der Erkennung solcher Patienten wirksam sind. Vielmehr sollte Ziprasidon bei Patienten mit signifikanten kardiovaskulären Erkrankungen in der Vorgeschichte, z. B. QT-Verlängerung, kürzlich aufgetretenem akuten Myokardinfarkt, unkompensierter Herzinsuffizienz oder Herzrhythmusstörungen, vermieden werden. Ziprasidon sollte bei Patienten abgesetzt werden, bei denen anhaltende QTc-Messungen > 500 ms festgestellt werden.
Bei Patienten, die Ziprasidon einnehmen und bei denen Symptome auftreten, die auf das Auftreten einer Torsade de Pointes hindeuten könnten, z. B. Schwindel, Herzklopfen oder Synkope, sollte der verschreibende Arzt eine weitere Untersuchung einleiten, z. B. kann eine Holter-Überwachung hilfreich sein.
Malignes neuroleptisches Syndrom (NMS)
Im Zusammenhang mit der Verabreichung von Antipsychotika wurde über einen potenziell tödlichen Symptomkomplex berichtet, der manchmal als malignes neuroleptisches Syndrom (NMS) bezeichnet wird. Klinische Manifestationen von NMS sind Hyperpyrexie, Muskelrigidität, veränderter Geisteszustand und Anzeichen einer autonomen Instabilität (unregelmäßiger Puls oder Blutdruck, Tachykardie, Diaphorese und Herzrhythmusstörungen). Zusätzliche Anzeichen können erhöhte Kreatininphosphokinase, Myoglobinurie (Rhabdomyolyse) und akutes Nierenversagen sein.
Die diagnostische Beurteilung von Patienten mit diesem Syndrom ist kompliziert. Um zu einer Diagnose zu gelangen, ist es wichtig, Fälle auszuschließen, in denen das klinische Erscheinungsbild sowohl eine schwere medizinische Erkrankung (z. B. Lungenentzündung, systemische Infektion usw.) als auch unbehandelte oder unzureichend behandelte extrapyramidale Zeichen und Symptome (EPS) umfasst. Weitere wichtige Erwägungen bei der Differentialdiagnose sind zentrale anticholinerge Toxizität, Hitzschlag, Drogenfieber und primäre Pathologie des Zentralnervensystems (ZNS).
Das Management von NMS sollte umfassen: (1) sofortiges Absetzen von Antipsychotika und anderen Arzneimitteln, die für eine gleichzeitige Therapie nicht unbedingt erforderlich sind; (2) intensive symptomatische Behandlung und medizinische Überwachung; und (3) Behandlung aller begleitenden schwerwiegenden medizinischen Probleme, für die spezifische Behandlungen verfügbar sind. Es gibt keine allgemeine Einigung über spezifische pharmakologische Behandlungsschemata für NMS.
Wenn ein Patient nach Genesung von NMS eine antipsychotische medikamentöse Behandlung benötigt, sollte die mögliche Wiederaufnahme der medikamentösen Therapie sorgfältig erwogen werden. Der Patient sollte sorgfältig überwacht werden, da Rezidive von NMS berichtet wurden.
Schwere kutane Nebenwirkungen
Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS)
Arzneimittelreaktionen mit Eosinophilie und systemischen Symptomen (DRESS) wurden bei Exposition gegenüber Ziprasidon berichtet. DRESS besteht aus einer Kombination von drei oder mehr der folgenden: Hautreaktion (wie Hautausschlag oder exfoliative Dermatitis), Eosinophilie, Fieber, Lymphadenopathie und eine oder mehrere systemische Komplikationen wie Hepatitis, Nephritis, Pneumonitis, Myokarditis und Perikarditis. DRESS ist manchmal tödlich. Bei Verdacht auf DRESS Ziprasidon absetzen.
Andere schwere kutane Nebenwirkungen
Andere schwere kutane Nebenwirkungen, wie Stevens-Johnson-Syndrom, wurden bei Ziprasidon-Exposition berichtet. Schwere kutane Nebenwirkungen sind manchmal tödlich. Setzen Sie Ziprasidon ab, wenn der Verdacht auf schwere kutane Nebenwirkungen besteht.
Tardive Dyskinesie
Bei Patienten, die mit Antipsychotika behandelt werden, kann sich ein Syndrom potenziell irreversibler, unwillkürlicher, dyskinetischer Bewegungen entwickeln. Obwohl die Prävalenz des Syndroms bei älteren Menschen, insbesondere bei älteren Frauen, am höchsten zu sein scheint, ist es unmöglich, sich auf Prävalenzschätzungen zu verlassen, um zu Beginn einer antipsychotischen Behandlung vorherzusagen, welche Patienten wahrscheinlich das Syndrom entwickeln werden. Ob Antipsychotika sich in ihrem Potenzial unterscheiden, tardive Dyskinesie zu verursachen, ist nicht bekannt.
Es wird angenommen, dass das Risiko der Entwicklung einer tardiven Dyskinesie und die Wahrscheinlichkeit, dass sie irreversibel wird, mit der Dauer der Behandlung und der kumulativen Gesamtdosis der dem Patienten verabreichten Antipsychotika zunimmt. Das Syndrom kann sich jedoch, wenn auch viel seltener, nach relativ kurzen Behandlungszeiten bei niedrigen Dosen entwickeln.
Es gibt keine bekannte Behandlung für etablierte Fälle von tardiver Dyskinesie, obwohl das Syndrom teilweise oder vollständig zurückgehen kann, wenn die antipsychotische Behandlung abgesetzt wird. Die antipsychotische Behandlung selbst kann jedoch die Anzeichen und Symptome des Syndroms unterdrücken (oder teilweise unterdrücken) und dadurch möglicherweise den zugrunde liegenden Prozess maskieren. Die Auswirkung der symptomatischen Unterdrückung auf den Langzeitverlauf des Syndroms ist unbekannt.
Angesichts dieser Überlegungen sollte Ziprasidon so verschrieben werden, dass das Auftreten von tardiven Dyskinesien am wahrscheinlichsten minimiert wird. Eine chronische Behandlung mit Antipsychotika sollte im Allgemeinen Patienten vorbehalten bleiben, die an einer chronischen Krankheit leiden, die (1) bekanntermaßen auf Antipsychotika anspricht, und (2) für die alternative, ebenso wirksame, aber möglicherweise weniger schädliche Behandlungen nicht verfügbar oder angemessen sind. Bei Patienten, die eine chronische Behandlung benötigen, sollte die niedrigste Dosis und die kürzeste Behandlungsdauer angestrebt werden, die ein zufriedenstellendes klinisches Ansprechen bewirken. Die Notwendigkeit einer Fortsetzung der Behandlung sollte regelmäßig überprüft werden.
Wenn bei einem Patienten unter Ziprasidon Anzeichen und Symptome einer tardiven Dyskinesie auftreten, sollte ein Absetzen des Arzneimittels in Betracht gezogen werden. Einige Patienten können jedoch trotz des Vorliegens des Syndroms eine Behandlung mit Ziprasidon benötigen.
Stoffwechselveränderungen
Atypische Antipsychotika wurden mit Stoffwechselveränderungen in Verbindung gebracht, die das kardiovaskuläre/zerebrovaskuläre Risiko erhöhen können. Diese metabolischen Veränderungen umfassen Hyperglykämie, Dyslipidämie und Körpergewichtszunahme. Obwohl gezeigt wurde, dass alle Medikamente dieser Klasse einige metabolische Veränderungen hervorrufen, hat jedes Medikament sein eigenes spezifisches Risikoprofil.
Hyperglykämie und Diabetes mellitus
Hyperglykämie und Diabetes mellitus, in einigen Fällen extrem und verbunden mit Ketoazidose oder hyperosmolarem Koma oder Tod, wurden bei Patienten berichtet, die mit atypischen Antipsychotika behandelt wurden. Es liegen wenige Berichte über Hyperglykämie oder Diabetes bei mit GEODON behandelten Patienten vor. Obwohl weniger Patienten mit GEODON behandelt wurden, ist nicht bekannt, ob diese begrenztere Erfahrung der einzige Grund für die geringe Anzahl solcher Berichte ist. Die Beurteilung des Zusammenhangs zwischen der atypischen Anwendung von Antipsychotika und Glukoseanomalien wird durch die Möglichkeit eines erhöhten Hintergrundrisikos für Diabetes mellitus bei Patienten mit Schizophrenie und die zunehmende Inzidenz von Diabetes mellitus in der Allgemeinbevölkerung erschwert. Angesichts dieser Confounder ist die Beziehung zwischen der atypischen Anwendung von Antipsychotika und Hyperglykämie-bedingten Nebenwirkungen nicht vollständig geklärt. Präzise Risikoabschätzungen für Hyperglykämie-bedingte Nebenwirkungen bei Patienten, die mit atypischen Antipsychotika behandelt werden, sind nicht verfügbar.
Patienten mit einer gesicherten Diagnose von Diabetes mellitus, die mit atypischen Antipsychotika begonnen werden, sollten regelmäßig auf eine Verschlechterung der Glukosekontrolle überwacht werden. Patienten mit Risikofaktoren für Diabetes mellitus (z. B. Fettleibigkeit, Diabetes in der Familienanamnese), die eine Behandlung mit atypischen Antipsychotika beginnen, sollten zu Beginn der Behandlung und in regelmäßigen Abständen während der Behandlung einer Nüchtern-Blutzuckermessung unterzogen werden. Jeder Patient, der mit atypischen Antipsychotika behandelt wird, sollte auf Symptome einer Hyperglykämie einschließlich Polydipsie, Polyurie, Polyphagie und Schwäche überwacht werden. Patienten, die während der Behandlung mit atypischen Antipsychotika Symptome einer Hyperglykämie entwickeln, sollten sich einer Nüchtern-Blutzuckermessung unterziehen. In einigen Fällen klang die Hyperglykämie ab, wenn das atypische Antipsychotikum abgesetzt wurde; Einige Patienten benötigten jedoch trotz Absetzens des verdächtigen Medikaments eine Fortsetzung der antidiabetischen Behandlung.
Gepoolte Daten aus placebokontrollierten Kurzzeitstudien bei Schizophrenie und bipolarer Störung sind in den Tabellen 1-4 dargestellt. Beachten Sie, dass für die Studien mit flexibler Dosierung sowohl bei Schizophrenie als auch bei bipolaren Störungen jeder Proband kategorisiert wird, basierend auf der modalen Tagesdosis des Probanden entweder eine niedrige (20-40 mg BID) oder eine hohe (60-80 mg BID) Dosis erhalten zu haben. In den Tabellen mit kategorialen Änderungen werden die Prozentsätze (%-Spalte) als 100x(n/N) berechnet.

In langfristigen (mindestens 1 Jahr), placebokontrollierten Studien mit flexibler Dosierung bei Schizophrenie betrug die mittlere Veränderung der zufälligen Glukosewerte für Ziprasidon 20-40 mg BID gegenüber dem Ausgangswert -3,4 mg/dl (N = 122); für Ziprasidon 60-80 mg BID war +1,3 mg/dl (N=10); und für Placebo +0,3 mg/dL (N=71).
Dyslipidämie
Bei Patienten, die mit atypischen Antipsychotika behandelt wurden, wurden unerwünschte Veränderungen der Lipide beobachtet. Gepoolte Daten aus Placebo-kontrollierten Kurzzeitstudien bei Schizophrenie und bipolarer Störung sind in den Tabellen 5-8 dargestellt.
In langfristigen (mindestens 1 Jahr), placebokontrollierten Studien mit flexibler Dosierung bei Schizophrenie betrug die mittlere Veränderung der zufälligen Triglyceride gegenüber dem Ausgangswert für Ziprasidon 20–40 mg BID +26,3 mg/dl (N = 15); für Ziprasidon 60-80 mg BID war -39,3 mg/dl (N=10); und für Placebo +12,9 mg/dl (N=9). In placebokontrollierten Langzeitstudien (mindestens 1 Jahr) mit flexibler Dosierung bei Schizophrenie betrug die mittlere Veränderung des zufälligen Gesamtcholesterins gegenüber dem Ausgangswert für Ziprasidon 20–40 mg zweimal täglich +2,5 mg/dl (N = 14); für Ziprasidon 60-80 mg BID war -19,7 mg/dl (N=10); und für Placebo -28,0 mg/dL (N=9).
Gewichtszunahme
Bei atypischer Anwendung von Antipsychotika wurde eine Gewichtszunahme beobachtet. Eine Überwachung des Gewichts wird empfohlen. Gepoolte Daten aus Placebo-kontrollierten Kurzzeitstudien bei Schizophrenie und bipolarer Störung sind in den Tabellen 9-10 dargestellt.
In placebokontrollierten Langzeitstudien (mindestens 1 Jahr) mit flexibler Dosierung bei Schizophrenie betrug die mittlere Veränderung des Ausgangsgewichts für Ziprasidon 20–40 mg zweimal täglich –2,3 kg (N = 124); für Ziprasidon 60-80 mg BID war +2,5 kg (N = 10); und für Placebo -2,9 kg (N=72). In den gleichen Langzeitstudien betrug der Anteil der Patienten mit einer Gewichtszunahme von ≥ 7 % gegenüber dem Ausgangswert für Ziprasidon 20–40 mg BID 5,6 % (N = 124); für Ziprasidon 60–80 mg zweimal täglich 20,0 % (n = 10) und für Placebo 5,6 % (n = 72). In einer placebokontrollierten Langzeitstudie (mindestens 1 Jahr) mit fester Dosis bei Schizophrenie betrug die mittlere Veränderung des Ausgangsgewichts für Ziprasidon 20 mg BID -2,6 kg (N = 72); für Ziprasidon 40 mg BID war -3,3 kg (N = 69); für Ziprasidon 80 mg BID betrug -2,8 kg (N = 70) und für Placebo -3,8 kg (N = 70). In derselben langfristigen Schizophrenie-Studie mit fester Dosis betrug der Anteil der Patienten mit ≥ 7 % Gewichtszunahme gegenüber dem Ausgangswert für Ziprasidon 20 mg BID 5,6 % (N = 72); für Ziprasidon 40 mg BID war 2,9 % (N = 69); für Ziprasidon 80 mg zweimal täglich 5,7 % (n = 70) und für Placebo 2,9 % (n = 70).
Schizophrenie
Die Anteile der Patienten, die ein Gewichtszunahmekriterium von ≥ 7 % des Körpergewichts erfüllten, wurden in einem Pool von vier 4- und 6-wöchigen placebokontrollierten klinischen Schizophrenie-Studien verglichen, die eine statistisch signifikant höhere Inzidenz von Gewichtszunahme bei Ziprasidon (10 % ) im Vergleich zu Placebo (4 %). Bei Ziprasidon-Patienten wurde eine mediane Gewichtszunahme von 0,5 kg beobachtet, verglichen mit keiner medianen Gewichtsveränderung bei Placebo-Patienten. In dieser Reihe klinischer Studien wurde Gewichtszunahme als Nebenwirkung bei 0,4 % bzw. 0,4 % der Ziprasidon- bzw. Placebo-Patienten berichtet. Während der Langzeittherapie mit Ziprasidon zeigte eine Kategorisierung der Patienten zu Studienbeginn auf der Grundlage des Body-Mass-Index (BMI) die größte mittlere Gewichtszunahme und die höchste Inzidenz einer klinisch signifikanten Gewichtszunahme (> 7 % des Körpergewichts) bei Patienten mit niedriger BMI (27). Es gab eine durchschnittliche Gewichtszunahme von 1,4 kg bei Patienten mit einem „niedrigen“ Ausgangs-BMI, keine mittlere Veränderung bei Patienten mit einem „normalen“ BMI und einen durchschnittlichen Gewichtsverlust von 1,3 kg bei Patienten, die mit einem „hohen“ BMI in das Programm aufgenommen wurden. BMI.
Bipolare Störung
Während einer 6-monatigen placebokontrollierten bipolaren Erhaltungsstudie bei Erwachsenen mit Ziprasidon als Zusatz zu Lithium oder Valproat betrug die Inzidenz einer klinisch signifikanten Gewichtszunahme (≥ 7 % des Körpergewichts) während der doppelblinden Phase 5,6 % für beide Ziprasidon und Placebo-Behandlungsgruppen, die die 6-monatige Beobachtung auf einen Rückfall abgeschlossen hatten. Bei der Interpretation dieser Ergebnisse sollte berücksichtigt werden, dass nur Patienten, die Ziprasidon angemessen vertragen, in die doppelblinde Phase der Studie aufgenommen wurden und es während der unverblindeten Phase erhebliche Studienabbrüche gab.
Ausschlag
In Premarketing-Studien mit Ziprasidon entwickelten etwa 5 % der Patienten Hautausschlag und/oder Urtikaria, wobei in etwa einem Sechstel dieser Fälle die Behandlung abgebrochen wurde. Das Auftreten von Hautausschlag hing mit der Ziprasidon-Dosis zusammen, obwohl der Befund auch durch die längere Expositionszeit bei Patienten mit höherer Dosis erklärt werden könnte. Mehrere Patienten mit Hautausschlag hatten Anzeichen und Symptome einer assoziierten systemischen Erkrankung, z. B. erhöhte WBCs. Bei den meisten Patienten besserte sich der Zustand sofort nach einer Zusatzbehandlung mit Antihistaminika oder Steroiden und/oder nach Absetzen von Ziprasidon, und alle Patienten, bei denen diese Reaktionen auftraten, erholten sich Berichten zufolge vollständig. Beim Auftreten eines Hautausschlags, für den keine alternative Ätiologie identifiziert werden kann, sollte Ziprasidon abgesetzt werden.
Orthostatische Hypotonie
Ziprasidon kann eine orthostatische Hypotonie hervorrufen, die mit Schwindel, Tachykardie und bei einigen Patienten verbunden ist, insbesondere während der anfänglichen Dosistitrationsphase, was wahrscheinlich seine α1-adrenergen antagonistischen Eigenschaften widerspiegelt. Synkopen wurden bei 0,6 % der mit Ziprasidon behandelten Patienten berichtet.
Ziprasidon sollte mit besonderer Vorsicht bei Patienten mit bekannter kardiovaskulärer Erkrankung (Myokardinfarkt oder ischämische Herzerkrankung in der Vorgeschichte, Herzinsuffizienz oder Reizleitungsstörungen), zerebrovaskulärer Erkrankung oder Zuständen angewendet werden, die Patienten für Hypotonie prädisponieren würden (Dehydratation, Hypovolämie und Behandlung mit Antihypertensiva). Medikamente).
Stürze
Antipsychotika (einschließlich GEODON) können Somnolenz, orthostatische Hypotonie und motorische und sensorische Instabilität verursachen, was zu Stürzen und folglich zu Knochenbrüchen oder anderen Verletzungen führen kann. Führen Sie bei Patienten mit Krankheiten, Zuständen oder Medikamenten, die diese Wirkungen verschlimmern könnten, zu Beginn einer antipsychotischen Behandlung und wiederholt bei Patienten unter antipsychotischer Langzeittherapie eine Sturzrisikobewertung durch.
Leukopenie, Neutropenie und Agranulozytose
In klinischen Studien und nach Markteinführung wurden Fälle von Leukopenie/Neutropenie in zeitlichem Zusammenhang mit Antipsychotika berichtet. Agranulozytose (einschließlich tödlicher Fälle) wurde ebenfalls berichtet.
Mögliche Risikofaktoren für Leukopenie/Neutropenie sind eine vorbestehende niedrige Anzahl weißer Blutkörperchen (WBC) und eine arzneimittelinduzierte Leukopenie/Neutropenie in der Vorgeschichte. Bei Patienten mit vorbestehender niedriger Leukozytenzahl oder arzneimittelinduzierter Leukopenie/Neutropenie in der Anamnese sollte ihr großes Blutbild (CBC) während der ersten Monate der Therapie häufig überwacht werden und GEODON sollte bei den ersten Anzeichen einer Abnahme der Leukozytenzahl in Abwesenheit abgesetzt werden von anderen ursächlichen Faktoren.
Patienten mit Neutropenie sollten sorgfältig auf Fieber oder andere Symptome oder Anzeichen einer Infektion überwacht und unverzüglich behandelt werden, wenn solche Symptome oder Anzeichen auftreten. Patienten mit schwerer Neutropenie (absolute Neutrophilenzahl
Krampfanfälle
Während klinischer Studien traten bei 0,4 % der mit Ziprasidon behandelten Patienten Krampfanfälle auf. Es gab verwirrende Faktoren, die in vielen dieser Fälle zum Auftreten von Anfällen beigetragen haben könnten. Wie andere Antipsychotika sollte Ziprasidon bei Patienten mit Krampfanfällen in der Vorgeschichte oder mit Erkrankungen, die möglicherweise die Krampfschwelle senken, z. B. Alzheimer-Demenz, mit Vorsicht angewendet werden. Zustände, die die Anfallsschwelle senken, können in einer Bevölkerung von 65 Jahren oder älter häufiger auftreten.
Dysphagie
Dysmotilität und Aspiration des Ösophagus wurden mit dem Gebrauch von Antipsychotika in Verbindung gebracht. Aspirationspneumonie ist eine häufige Ursache für Morbidität und Mortalität bei älteren Patienten, insbesondere solchen mit fortgeschrittener Alzheimer-Demenz. Ziprasidon und andere Antipsychotika sollten bei Patienten mit einem Risiko für eine Aspirationspneumonie mit Vorsicht angewendet werden [siehe KASTENWARNUNG ].
Hyperprolaktinämie
Wie bei anderen Arzneimitteln, die Dopamin-D2-Rezeptoren antagonisieren, erhöht Ziprasidon die Prolaktinspiegel beim Menschen. Erhöhte Prolaktinspiegel wurden auch in Tierversuchen mit dieser Verbindung beobachtet und waren mit einer Zunahme von Brustdrüsenneoplasien bei Mäusen verbunden; ein ähnlicher Effekt wurde bei Ratten nicht beobachtet [vgl Nichtklinische Toxikologie ]. Gewebekulturexperimente weisen darauf hin, dass ungefähr ein Drittel der menschlichen Brustkrebserkrankungen in vitro Prolaktin-abhängig sind, ein Faktor von potenzieller Bedeutung, wenn die Verschreibung dieser Medikamente bei einem Patienten mit zuvor festgestelltem Brustkrebs in Erwägung gezogen wird. Weder bisher durchgeführte klinische Studien noch epidemiologische Studien haben einen Zusammenhang zwischen der chronischen Verabreichung dieser Arzneimittelklasse und der Tumorentstehung beim Menschen gezeigt; Die verfügbaren Beweise gelten als zu begrenzt, um zum jetzigen Zeitpunkt schlüssig zu sein.
Obwohl über Störungen wie Galaktorrhoe, Amenorrhoe, Gynäkomastie und Impotenz im Zusammenhang mit Prolaktin-erhöhenden Verbindungen berichtet wurde, ist die klinische Bedeutung erhöhter Prolaktinspiegel im Serum für die meisten Patienten unbekannt. Langanhaltende Hyperprolaktinämie in Verbindung mit Hypogonadismus kann zu einer verminderten Knochendichte führen.
Potenzial für kognitive und motorische Beeinträchtigungen
Schläfrigkeit war eine häufig berichtete Nebenwirkung bei mit Ziprasidon behandelten Patienten. In den 4- und 6-wöchigen placebokontrollierten Studien wurde Schläfrigkeit bei 14 % der Patienten unter Ziprasidon im Vergleich zu 7 % der Placebo-Patienten berichtet. Schläfrigkeit führte bei 0,3 % der Patienten in klinischen Kurzzeitstudien zum Absetzen. Da Ziprasidon das Urteilsvermögen, das Denkvermögen oder die motorischen Fähigkeiten beeinträchtigen kann, sollten Patienten davor gewarnt werden, Aktivitäten durchzuführen, die geistige Wachsamkeit erfordern, wie z sie negativ beeinflussen.
Priapismus
Ein Fall von Priapismus wurde in der Premarketing-Datenbank gemeldet. Während der Zusammenhang zwischen der Reaktion und der Anwendung von Ziprasidon nicht nachgewiesen wurde, wurde von anderen Arzneimitteln mit alpha-adrenergen blockierenden Wirkungen berichtet, dass sie Priapismus induzieren, und es ist möglich, dass Ziprasidon diese Fähigkeit teilt. Ein schwerer Priapismus kann einen chirurgischen Eingriff erfordern.
Regulierung der Körpertemperatur
Obwohl in Premarketing-Studien nicht über Ziprasidon berichtet wurde, wurde eine Störung der Fähigkeit des Körpers, die Körperkerntemperatur zu senken, auf Antipsychotika zurückgeführt. Bei der Verschreibung von Ziprasidon für Patienten, bei denen Erkrankungen auftreten, die zu einer Erhöhung der Körperkerntemperatur beitragen können, z. B. anstrengende körperliche Betätigung, extreme Hitzeeinwirkung, gleichzeitige Einnahme von Medikamenten mit anticholinerger Wirkung oder Dehydrierung, ist bei der Verschreibung von Ziprasidon angemessene Vorsicht geboten.
Selbstmord
Die Möglichkeit eines Suizidversuchs ist bei psychotischen Erkrankungen oder bipolaren Störungen inhärent, und eine engmaschige Überwachung von Hochrisikopatienten sollte die medikamentöse Therapie begleiten. Verschreibungen für Ziprasidon sollten für die kleinste Menge an Kapseln im Einklang mit einem guten Patientenmanagement ausgestellt werden, um das Risiko einer Überdosierung zu verringern.
Patienten mit Begleiterkrankungen
Die klinische Erfahrung mit Ziprasidon bei Patienten mit bestimmten systemischen Begleiterkrankungen ist begrenzt [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Ziprasidon wurde bei Patienten mit kürzlich aufgetretenem Myokardinfarkt oder instabiler Herzerkrankung nicht untersucht oder in nennenswertem Umfang angewendet. Patienten mit diesen Diagnosen wurden von klinischen Premarketing-Studien ausgeschlossen. Aufgrund des Risikos einer QTc-Verlängerung und einer orthostatischen Hypotonie unter Ziprasidon ist bei Herzpatienten Vorsicht geboten. [sehen QT-Verlängerung und Risiko eines plötzlichen Todes, orthostatische Hypotonie ].
Labortests
Bei Patienten, die für eine Behandlung mit Ziprasidon in Betracht gezogen werden und bei denen ein Risiko für signifikante Elektrolytstörungen besteht, sollten Serum-Kalium- und -Magnesium-Basiswerte gemessen werden. Niedrige Kalium- und Magnesiumspiegel im Serum sollten ersetzt werden, bevor mit der Behandlung fortgefahren wird. Bei Patienten, die während einer Ziprasidon-Therapie mit Diuretika begonnen werden, ist eine regelmäßige Überwachung des Kalium- und Magnesiumspiegels im Serum erforderlich. Ziprasidon sollte bei Patienten abgesetzt werden, bei denen anhaltende QTc-Messungen > 500 ms festgestellt werden [siehe QT-Verlängerung und Risiko eines plötzlichen Todes ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( INFORMATIONEN ZUM PATIENTEN ).
Verabreichungsinformationen für Kapseln
Empfehlen Sie den Patienten, GEODON-Kapseln unzerkaut einzunehmen. Die Kapseln nicht öffnen, zerdrücken oder kauen. Weisen Sie die Patienten an, GEODON-Kapseln mit Nahrung einzunehmen, um eine optimale Absorption zu erreichen. Die Resorption von Ziprasidon wird in Gegenwart von Nahrung bis auf das Doppelte erhöht [vgl DOSIERUNG UND ANWENDUNG , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , und KLINISCHE PHARMAKOLOGIE ].
QTc-Verlängerung
Raten Sie den Patienten, ihren Arzt über Folgendes zu informieren: QT-Verlängerung in der Anamnese; frischer akuter Myokardinfarkt; unkompensierte Herzinsuffizienz; Verschreibung anderer Medikamente, die eine QT-Verlängerung gezeigt haben; Risiko für signifikante Elektrolytanomalien; und Vorgeschichte von Herzrhythmusstörungen [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Weisen Sie die Patienten an, das Auftreten von Erkrankungen zu melden, die sie einem Risiko für signifikante Elektrolytstörungen aussetzen, insbesondere Hypokaliämie, einschließlich, aber nicht beschränkt auf die Einleitung einer diuretischen Therapie oder anhaltenden Durchfall. Weisen Sie die Patienten außerdem an, dem verschreibenden Arzt Symptome wie Schwindel, Herzklopfen oder Synkopen zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schwere kutane Nebenwirkungen
Weisen Sie die Patienten an, ihrem Arzt so bald wie möglich alle Anzeichen oder Symptome zu melden, die mit einer Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS) oder mit schweren kutanen Nebenwirkungen wie dem Stevens-Johnson-Syndrom in Verbindung stehen können [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schwangerschaft
Raten Sie schwangeren Frauen, ihren Arzt zu informieren, wenn sie während der Behandlung mit GEODON schwanger werden oder eine Schwangerschaft planen. Weisen Sie die Patienten darauf hin, dass GEODON bei einem Neugeborenen extrapyramidale Symptome und/oder Entzugssymptome (Agitiertheit, Hypertonie, Hypotonie, Tremor, Somnolenz, Atemnot und Fütterstörungen) verursachen kann. Weisen Sie die Patientinnen darauf hin, dass es ein Schwangerschaftsexpositionsregister gibt, das die Schwangerschaftsausgänge bei Frauen überwacht, die GEODON während der Schwangerschaft ausgesetzt waren [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Stillzeit
Raten Sie stillenden Frauen, die GEODON 20 mg anwenden, Säuglinge auf übermäßige Sedierung, Reizbarkeit, schlechte Ernährung und extrapyramidale Symptome (Zittern und anormale Muskelbewegungen) zu überwachen und einen Arzt aufzusuchen, wenn sie diese Anzeichen bemerken [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Unfruchtbarkeit
Weisen Sie gebärfähige Frauen darauf hin, dass GEODON 80 mg die Fruchtbarkeit aufgrund eines Anstiegs der Prolaktinspiegel im Serum beeinträchtigen kann. Die Auswirkungen auf die Fertilität sind reversibel [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Karzinogenitätsstudien über die Lebenszeit wurden mit Ziprasidon an Long-Evans-Ratten und CD-1-Mäusen durchgeführt. Ziprasidon wurde 24 Monate lang mit der Nahrung in Dosen von 2, 6 oder 12 mg/kg/Tag an Ratten und 50, 100 oder 200 mg/kg/Tag an Mäuse (das 0,1- bis 0,6- und 1- bis 5-Fache der Dosis) verabreicht maximal empfohlene Dosis für den Menschen (MRHD) von 200 mg/Tag basierend auf mg/m2 Körperoberfläche). In der Rattenstudie gab es keine Hinweise auf eine erhöhte Inzidenz von Tumoren im Vergleich zu den Kontrollen. Bei männlichen Mäusen gab es keine erhöhte Inzidenz von Tumoren im Vergleich zu den Kontrollen. Bei weiblichen Mäusen gab es bei allen getesteten Dosierungen (50 bis 200 mg/kg/Tag oder 1- bis 5-fache MRHD, basierend auf mg/m2 Körper) dosisabhängige Erhöhungen der Inzidenz von Hypophysenadenomen und -karzinomen sowie von Brustdrüsenadenokarzinomen Oberfläche). Proliferative Veränderungen in der Hypophyse und den Brustdrüsen von Nagetieren wurden nach chronischer Verabreichung anderer Antipsychotika beobachtet und gelten als Prolaktin-vermittelt. Anstiege des Serumprolaktins wurden in einer 1-monatigen Ernährungsstudie bei weiblichen, aber nicht bei männlichen Mäusen bei 100 und 200 mg/kg/Tag (oder dem 2,5- und 5-fachen der MRHD, basierend auf mg/m2 Körperoberfläche) beobachtet. Ziprasidon hatte in einer 5-wöchigen Ernährungsstudie bei Ratten in den Dosen, die in der Karzinogenitätsstudie verwendet wurden, keine Wirkung auf das Serumprolaktin. Die Relevanz der Befunde von Prolaktin-vermittelten endokrinen Tumoren bei Nagern für das Humanrisiko ist nicht bekannt [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Mutagenese
Ziprasidon wurde im Ames-Bakterienmutationsassay, im In-vitro-Säugerzell-Genmutations-Maus-Lymphom-Assay, im In-vitro-Chromosomenaberrationsassay an menschlichen Lymphozyten und im In-vivo-Chromosomenaberrationsassay im Knochenmark der Maus getestet. Bei einem Stamm von S. typhimurium kam es ohne metabolische Aktivierung zu einer reproduzierbaren mutagenen Reaktion im Ames-Assay. Positive Ergebnisse wurden sowohl im In-vitro-Genmutationstest an Säugetierzellen als auch im In-vitro-Chromosomenaberrationstest in menschlichen Lymphozyten erzielt.
Beeinträchtigung der Fruchtbarkeit
In zwei Studien zur Fertilität und frühen embryonalen Entwicklung bei Sprague-Dawley-Ratten mit Dosen von 10 bis 160 mg/kg/Tag (das 0,5- bis 8-fache der MRHD von 200 mg/Tag, basierend auf mg/m2 Körper) wurde gezeigt, dass Ziprasidon die Zeit bis zur Kopulation verlängert Oberfläche). Die Fertilitätsrate war bei 160 mg/kg/Tag (dem 8-fachen der MRHD, basierend auf mg/m2 Körperoberfläche) reduziert. Es gab keine Auswirkung auf die Fertilität bei 40 mg/kg/Tag (das 2-fache der MRHD, basierend auf mg/m2 Körperoberfläche). Die Wirkung auf die Fertilität schien bei den Weibchen aufzutreten, da die Fertilität nicht beeinträchtigt wurde, wenn Männchen, denen 160 mg/kg/Tag (das 8-fache der MRHD, basierend auf mg/m2 Körperoberfläche) verabreicht wurden, mit unbehandelten Weibchen gepaart wurden.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschafts-Expositionsregister
Es gibt ein Schwangerschafts-Expositionsregister, das die Schwangerschaftsausgänge bei Frauen überwacht, die während der Schwangerschaft atypischen Antipsychotika, einschließlich GEODON 40 mg, ausgesetzt waren. Gesundheitsdienstleister werden ermutigt, Patienten zu registrieren, indem sie sich unter 1-866-961-2388 oder online an das National Pregnancy Registry for Atypical Antipsychotics wenden http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Zusammenfassung der Risiken
Neugeborene, die während des dritten Trimesters Antipsychotika, einschließlich GEODON, ausgesetzt waren, haben ein erhöhtes Risiko für extrapyramidale und/oder Entzugssymptome nach der Entbindung (siehe Klinische Überlegungen ). Insgesamt verfügbare Daten aus veröffentlichten epidemiologischen Studien an schwangeren Frauen, die Ziprasidon ausgesetzt waren, haben kein arzneimittelbedingtes Risiko für schwerwiegende Geburtsfehler, Fehlgeburten oder unerwünschte Folgen für Mutter oder Fötus ergeben (siehe Daten ). Es bestehen Risiken für die Mutter im Zusammenhang mit einer unbehandelten Schizophrenie oder einer Bipolar-I-Störung und einer Exposition gegenüber Antipsychotika, einschließlich GEODON, während der Schwangerschaft (siehe Klinische Überlegungen ).
In Tierversuchen verursachte die Verabreichung von Ziprasidon an trächtige Ratten und Kaninchen während der Organogenese Entwicklungstoxizität bei Dosen, die den empfohlenen Dosen beim Menschen ähnelten, und war bei Kaninchen teratogen, wenn das Dreifache der maximal empfohlenen Dosis beim Menschen (MRHD) eingenommen wurde. Ratten, die Ziprasidon während der Trächtigkeit und Laktation ausgesetzt waren, zeigten eine erhöhte perinatale Jungtiersterblichkeit und eine verzögerte Entwicklung des neurologischen Verhaltens und der funktionellen Entwicklung der Nachkommen bei Dosen, die geringer oder ähnlich der therapeutischen Dosis beim Menschen waren (siehe Daten ).
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebenen Populationen ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 bis 4 % bzw. 15 bis 20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryo/fetales Risiko
Es besteht ein Risiko für die Mutter durch eine unbehandelte Schizophrenie oder Bipolar-I-Störung, einschließlich eines erhöhten Rückfallrisikos, Krankenhausaufenthalts und Suizids. Schizophrenie und Bipolar-I-Störung sind mit erhöhten unerwünschten perinatalen Folgen, einschließlich Frühgeburten, verbunden. Es ist nicht bekannt, ob dies eine direkte Folge der Krankheit oder anderer komorbider Faktoren ist.
Fetale/neonatale Nebenwirkungen
Extrapyramidale und/oder Entzugserscheinungen, einschließlich Agitiertheit, Hypertonie, Hypotonie, Tremor, Somnolenz, Atemnot und Fütterstörungen, wurden bei Neugeborenen berichtet, die während des dritten Trimenons der Schwangerschaft Antipsychotika, einschließlich GEODON, ausgesetzt waren. Diese Symptome haben unterschiedliche Schweregrade. Überwachen Sie Neugeborene auf extrapyramidale und/oder Entzugserscheinungen und behandeln Sie die Symptome entsprechend. Einige Neugeborene erholten sich ohne spezifische Behandlung innerhalb von Stunden oder Tagen; andere erforderten einen längeren Krankenhausaufenthalt.
Daten
Menschliche Daten
Veröffentlichte Daten aus Beobachtungsstudien, Geburtsregistern und Fallberichten über die Anwendung atypischer Antipsychotika während der Schwangerschaft zeigen keinen eindeutigen Zusammenhang mit Antipsychotika und schweren Geburtsfehlern. Eine retrospektive Kohortenstudie aus einer Medicaid-Datenbank mit 9258 Frauen, die während der Schwangerschaft Antipsychotika ausgesetzt waren, zeigte kein insgesamt erhöhtes Risiko für schwere Geburtsfehler.
Tierdaten
Wenn Ziprasidon während der Organogenese trächtigen Kaninchen verabreicht wurde, wurde bei einer Dosis von 30 mg/kg/Tag (3-fache MRHD) eine erhöhte Inzidenz fötaler struktureller Anomalien (Ventrikelseptumdefekte und andere kardiovaskuläre Fehlbildungen und Nierenveränderungen) beobachtet von 200 mg/Tag bezogen auf mg/m2 Körperoberfläche). Es gab keine Hinweise darauf, dass diese Auswirkungen auf die Entwicklung sekundär zur maternalen Toxizität waren. Die entwicklungsbedingte Dosis ohne Wirkung betrug 10 mg/kg/Tag (entspricht der MRHD basierend auf einer Körperoberfläche in mg/m2). Bei Ratten wurde nach Verabreichung von 10 bis 160 mg/kg/Tag (das 0,5- bis 8-fache der MRHD, bezogen auf mg/m2 Körperoberfläche) während der Organogenese oder während der Trächtigkeit embryofetale Toxizität (verringertes Gewicht der Föten, verzögerte Skelettossifikation) beobachtet es gab keine Hinweise auf Teratogenität. Dosen von 40 und 160 mg/kg/Tag (das 2- und 8-fache der MRHD, basierend auf mg/m2 Körperoberfläche) waren mit maternaler Toxizität verbunden. Die Entwicklungsdosis ohne Wirkung beträgt 5 mg/kg/Tag (das 0,2-fache der MRHD, basierend auf mg/m2 Körperoberfläche).
Bei den Nachkommen weiblicher Ratten, die während der Trächtigkeit und Laktation mit Dosen von 10 mg/kg/Tag (das 0,5-fache der MRHD basierend auf auf mg/m2 Körperoberfläche) oder größer. Bei Dosen von 5 mg/kg/Tag (das 0,2-fache der MRHD basierend auf mg/m2 Körperoberfläche) oder mehr wurden Entwicklungsverzögerungen der Nachkommen (verringertes Gewicht der Jungtiere) und neurologische Verhaltensstörungen (Aufrichtung der Augenöffnung) beobachtet. Für diese Effekte wurde kein No-Effect-Level festgelegt.
Stillzeit
Zusammenfassung der Risiken
Begrenzte Daten aus einem veröffentlichten Fallbericht weisen auf das Vorhandensein von Ziprasidon in der Muttermilch hin. Obwohl es keine Berichte über Nebenwirkungen bei gestillten Säuglingen gibt, die Ziprasidon über die Muttermilch ausgesetzt waren, gibt es Berichte über übermäßige Sedierung, Reizbarkeit, schlechte Nahrungsaufnahme und extrapyramidale Symptome (Zittern und abnormale Muskelbewegungen) bei Säuglingen, die anderen atypischen Antipsychotika über die Brust ausgesetzt wurden Milch (vgl Klinische Überlegungen ). Es liegen keine Informationen über die Auswirkungen von Ziprasidon auf die Milchproduktion vor. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an GEODON und möglichen Nebenwirkungen von GEODON 20 mg auf das gestillte Kind oder von der Grunderkrankung der Mutter berücksichtigt werden.
Klinische Überlegungen
Säuglinge, die GEODON ausgesetzt waren, sollten auf übermäßige Sedierung, Reizbarkeit, schlechte Nahrungsaufnahme und extrapyramidale Symptome (Zittern und anormale Muskelbewegungen) überwacht werden.
Weibchen und Männchen mit reproduktivem Potenzial
Unfruchtbarkeit
Frauen
Basierend auf der pharmakologischen Wirkung von Ziprasidon (D2-Antagonismus) kann die Behandlung mit GEODON 40 mg zu einem Anstieg des Serum-Prolaktinspiegels führen, was zu einer reversiblen Verringerung der Fertilität bei gebärfähigen Frauen führen kann [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Nichtklinische Toxikologie ].
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von Ziprasidon bei pädiatrischen Patienten wurde nicht nachgewiesen.
Geriatrische Verwendung
Von der Gesamtzahl der Probanden in klinischen Studien zu Ziprasidon waren 2,4 Prozent 65 Jahre und älter. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden. Dennoch sollte das Vorhandensein mehrerer Faktoren, die die pharmakodynamische Reaktion auf Ziprasidon verstärken oder eine schlechtere Verträglichkeit oder Orthostase verursachen könnten, bei einigen älteren Patienten dazu führen, dass eine niedrigere Anfangsdosis, eine langsamere Titration und eine sorgfältige Überwachung während der anfänglichen Dosierungsphase in Betracht gezogen werden.
Ziprasidon intramuskulär wurde bei älteren Patienten (65 Jahre und älter) nicht systematisch untersucht.
Nierenfunktionsstörung
Da Ziprasidon stark metabolisiert wird, wobei weniger als 1 % des Arzneimittels unverändert ausgeschieden wird, ist es unwahrscheinlich, dass eine Nierenfunktionsstörung allein einen wesentlichen Einfluss auf die Pharmakokinetik von Ziprasidon hat. Die Pharmakokinetik von Ziprasidon nach einer 8-tägigen Einnahme von 20 mg zweimal täglich war bei Probanden mit unterschiedlich stark eingeschränkter Nierenfunktion (n = 27) und Probanden mit normaler Nierenfunktion ähnlich, was darauf hindeutet, dass eine Dosisanpassung basierend auf dem Grad der Nierenfunktionsstörung nicht erforderlich ist . Ziprasidon wird nicht durch Hämodialyse entfernt.
Intramuskuläres Ziprasidon wurde bei älteren Patienten oder bei Patienten mit eingeschränkter Leber- oder Nierenfunktion nicht systematisch untersucht. Da der Cyclodextrin-Hilfsstoff durch die Nierenfiltration ausgeschieden wird, sollte Ziprasidon intramuskulär bei Patienten mit eingeschränkter Nierenfunktion mit Vorsicht verabreicht werden [siehe KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Da Ziprasidon im Wesentlichen über die Leber ausgeschieden wird, ist zu erwarten, dass das Vorliegen einer Leberfunktionsstörung die AUC von Ziprasidon erhöht; eine Mehrfachdosisstudie mit 20 mg zweimal täglich für 5 Tage bei Probanden (n=13) mit klinisch signifikanter Zirrhose (Childs-Pugh-Klasse A und B) zeigte einen Anstieg der AUC 0-12 von 13 % und 34 % bei Kinder- Pugh-Klasse A bzw. B im Vergleich zu einer passenden Kontrollgruppe (n=14). Bei Patienten mit Zirrhose wurde eine Halbwertszeit von 7,1 Stunden beobachtet, verglichen mit 4,8 Stunden in der Kontrollgruppe.
Alters- und Geschlechtseffekte
In einer Mehrfachdosis-Studie (8 Tage Behandlung) mit 32 Probanden gab es keinen Unterschied in der Pharmakokinetik von Ziprasidon zwischen Männern und Frauen oder zwischen älteren (> 65 Jahre) und jungen (18 bis 45 Jahre) Probanden. Darüber hinaus hat die populationspharmakokinetische Bewertung von Patienten in kontrollierten Studien keine Hinweise auf klinisch signifikante alters- oder geschlechtsspezifische Unterschiede in der Pharmakokinetik von Ziprasidon ergeben. Dosisanpassungen aufgrund von Alter oder Geschlecht werden daher nicht empfohlen.
Rauchen
Basierend auf In-vitro-Studien mit menschlichen Leberenzymen ist Ziprasidon kein Substrat für CYP1A2; Rauchen sollte daher keinen Einfluss auf die Pharmakokinetik von Ziprasidon haben. In Übereinstimmung mit diesen In-vitro-Ergebnissen hat die populationspharmakokinetische Bewertung keine signifikanten pharmakokinetischen Unterschiede zwischen Rauchern und Nichtrauchern ergeben.
ÜBERDOSIS
Menschliche Erfahrung
In Premarketing-Studien mit mehr als 5400 Patienten und/oder gesunden Probanden wurde bei 10 Patienten eine versehentliche oder absichtliche Überdosierung von oralem Ziprasidon dokumentiert. Alle diese Patienten überlebten ohne Folgen. Bei dem Patienten, der die größte bestätigte Menge, 3.240 mg, einnahm, waren die einzigen berichteten Symptome minimale Sedierung, undeutliche Sprache und vorübergehender Bluthochdruck (200/95).
Zu den Nebenwirkungen, die bei einer Ziprasidon-Überdosierung berichtet wurden, gehörten extrapyramidale Symptome, Somnolenz, Tremor und Angstzustände. [sehen NEBENWIRKUNGEN ]
Management einer Überdosierung
Im Falle einer akuten Überdosierung Atemwege herstellen und freihalten und für ausreichende Oxygenierung und Belüftung sorgen. Ein intravenöser Zugang sollte eingerichtet werden, und eine Magenspülung (nach Intubation, wenn der Patient bewusstlos ist) und die Verabreichung von Aktivkohle zusammen mit einem Abführmittel sollten in Betracht gezogen werden. Die Möglichkeit von Benommenheit, Krampfanfällen oder dystonischen Reaktionen des Kopfes und Halses nach einer Überdosierung kann zu einem Aspirationsrisiko mit induzierter Erbrechen führen.
Die kardiovaskuläre Überwachung sollte sofort beginnen und eine kontinuierliche elektrokardiographische Überwachung umfassen, um mögliche Arrhythmien zu erkennen. Wenn eine antiarrhythmische Therapie verabreicht wird, bergen Disopyramid, Procainamid und Chinidin ein theoretisches Risiko zusätzlicher QT-verlängernder Wirkungen, die zu denen von Ziprasidon additiv sein könnten.
Hypotonie und Kreislaufkollaps sollten mit geeigneten Maßnahmen wie intravenöser Flüssigkeitsgabe behandelt werden. Wenn Sympathomimetika zur Gefäßunterstützung verwendet werden, sollten Epinephrin und Dopamin nicht verwendet werden, da eine Beta-Stimulation in Kombination mit einem mit Ziprasidon assoziierten α1-Antagonismus die Hypotonie verschlimmern kann. In ähnlicher Weise ist zu erwarten, dass die alpha-adrenergen Blockereigenschaften von Bretylium zu denen von Ziprasidon addiert werden könnten, was zu einer problematischen Hypotonie führt.
Bei schweren extrapyramidalen Symptomen sollten Anticholinergika verabreicht werden. Es gibt kein spezifisches Antidot für Ziprasidon und es ist nicht dialysierbar. Die Möglichkeit einer multiplen Drogenbeteiligung sollte in Betracht gezogen werden. Eine engmaschige medizinische Überwachung und Überwachung sollte fortgesetzt werden, bis sich der Patient erholt hat.
KONTRAINDIKATIONEN
QT-Verlängerung
Aufgrund der dosisabhängigen Verlängerung des QT-Intervalls durch Ziprasidon und der bekannten Assoziation tödlicher Arrhythmien mit QT-Verlängerung durch einige andere Arzneimittel ist Ziprasidon kontraindiziert:
Pharmakokinetische/pharmakodynamische Studien zwischen Ziprasidon und anderen Arzneimitteln, die das QT-Intervall verlängern, wurden nicht durchgeführt. Eine additive Wirkung von Ziprasidon und anderen Arzneimitteln, die das QT-Intervall verlängern, kann nicht ausgeschlossen werden. Daher sollte Ziprasidon nicht gegeben werden mit:
Überempfindlichkeit
Ziprasidon ist bei Personen mit bekannter Überempfindlichkeit gegen das Produkt kontraindiziert.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Der Wirkmechanismus von Ziprasidon bei der Behandlung der aufgeführten Indikationen könnte durch eine Kombination aus Dopamin-Typ-2-(D2)- und Serotonin-Typ-2-(5HT2)-Antagonismus vermittelt werden.
Pharmakodynamik
Ziprasidon bindet mit relativ hoher Affinität an die Dopamin-D2- und -D3-, Serotonin-5HT2A-, 5HT2C-, 5HT1A-, 5HT1D- und α1-adrenergen Rezeptoren (Ki s von 4,8, 7,2, 0,4, 1,3, 3,4, 2 bzw. 10 nM), und mit mäßiger Affinität zum Histamin-H1-Rezeptor (Ki = 47 nM). Ziprasidon ist ein Antagonist am D2-, 5HT2A- und 5HT1D-Rezeptor und ein Agonist am 5HT1A-Rezeptor. Ziprasidon hemmte die synaptische Wiederaufnahme von Serotonin und Norepinephrin. Für andere getestete Rezeptoren/Bindungsstellen, einschließlich des cholinergen Muscarinrezeptors (IC50 > 1 μM), wurde keine nennenswerte Affinität gezeigt.
Pharmakokinetik
Orale Pharmakokinetik
Die Aktivität von Ziprasidon ist hauptsächlich auf das Ausgangsarzneimittel zurückzuführen. Die Pharmakokinetik von Ziprasidon nach Mehrfachgabe ist innerhalb des vorgeschlagenen klinischen Dosisbereichs dosisproportional, und die Akkumulation von Ziprasidon ist bei Mehrfachgabe vorhersehbar. Die Elimination von Ziprasidon erfolgt hauptsächlich über die Leber mit einer mittleren terminalen Halbwertszeit von etwa 7 Stunden innerhalb des vorgeschlagenen klinischen Dosisbereichs. Steady-State-Konzentrationen werden innerhalb von ein bis drei Tagen nach der Einnahme erreicht. Die mittlere scheinbare systemische Clearance beträgt 7,5 ml/min/kg. Es ist unwahrscheinlich, dass Ziprasidon den Metabolismus von Arzneimitteln beeinflusst, die durch Cytochrom-P450-Enzyme metabolisiert werden.
Absorption
Ziprasidon wird nach oraler Verabreichung gut resorbiert und erreicht maximale Plasmakonzentrationen nach 6 bis 8 Stunden. Die absolute Bioverfügbarkeit einer 20-mg-Dosis unter Nahrungsaufnahme beträgt etwa 60 %. Die Resorption von Ziprasidon wird in Gegenwart von Nahrung bis auf das Zweifache erhöht.
Verteilung
Ziprasidon hat ein mittleres scheinbares Verteilungsvolumen von 1,5 l/kg. Es ist zu mehr als 99 % an Plasmaproteine gebunden, wobei es hauptsächlich an Albumin und α1-saures Glykoprotein bindet. Die In-vitro-Plasmaproteinbindung von Ziprasidon wurde durch Warfarin oder Propranolol, zwei stark proteingebundene Arzneimittel, nicht verändert, noch veränderte Ziprasidon die Bindung dieser Arzneimittel im menschlichen Plasma. Daher ist das Potenzial für Arzneimittelwechselwirkungen mit Ziprasidon aufgrund einer Verdrängung minimal.
Stoffwechsel und Ausscheidung
Ziprasidon wird nach oraler Gabe weitgehend metabolisiert, wobei nur eine geringe Menge als unverändertes Arzneimittel mit dem Urin (
Intramuskuläre Pharmakokinetik
Systemische Bioverfügbarkeit
Die Bioverfügbarkeit von intramuskulär verabreichtem Ziprasidon beträgt 100 %. Nach intramuskulärer Verabreichung von Einzeldosen treten die maximalen Serumkonzentrationen typischerweise etwa 60 Minuten nach der Verabreichung oder früher auf, und die mittlere Halbwertszeit (T½) liegt im Bereich von zwei bis fünf Stunden. Die Exposition nimmt dosisabhängig zu und nach dreitägiger intramuskulärer Gabe wird eine geringe Akkumulation beobachtet.
Stoffwechsel und Ausscheidung
Obwohl der Metabolismus und die Elimination von i.m. Ziprasidon nicht systematisch untersucht wurden, ist nicht zu erwarten, dass der intramuskuläre Verabreichungsweg die Stoffwechselwege verändert.
Klinische Studien
Schizophrenie
Die Wirksamkeit von oralem Ziprasidon bei der Behandlung von Schizophrenie wurde in 5 placebokontrollierten Studien, 4 Kurzzeitstudien (4 und 6 Wochen) und einer Erhaltungsstudie untersucht. Alle Studien wurden mit erwachsenen stationären Patienten durchgeführt, von denen die meisten die DSM-III-R-Kriterien für Schizophrenie erfüllten. Jede Studie umfasste 2 bis 3 Fixdosen von Ziprasidon sowie Placebo. Vier der fünf Studien konnten Ziprasidon von Placebo unterscheiden; eine Kurzzeitstudie nicht. Obwohl in einer der drei Kurzzeitstudien ein einzelner Haloperidol-Arm mit fester Dosis als Vergleichsbehandlung eingeschlossen wurde, war diese einzelne Studie nicht geeignet, um einen zuverlässigen und validen Vergleich zwischen Ziprasidon und Haloperidol zu liefern.
In diesen Studien wurden mehrere Instrumente zur Beurteilung psychiatrischer Anzeichen und Symptome verwendet. Die Brief Psychiatric Rating Scale (BPRS) und die Positive and Negative Syndrome Scale (PANSS) sind beides Multi-Item-Inventare der allgemeinen Psychopathologie, die normalerweise verwendet werden, um die Auswirkungen der medikamentösen Behandlung bei Schizophrenie zu bewerten. Das BPRS-Psychose-Cluster (konzeptionelle Desorganisation, halluzinatorisches Verhalten, Misstrauen und ungewöhnliche Gedankeninhalte) gilt als besonders nützliche Untergruppe zur Beurteilung aktiv psychotischer schizophrener Patienten. Eine zweite weit verbreitete Bewertung, der Clinical Global Impression (CGI), spiegelt den Eindruck eines erfahrenen Beobachters, der mit den Manifestationen der Schizophrenie vollständig vertraut ist, über den klinischen Gesamtzustand des Patienten wider. Darüber hinaus wurde in einer Studie die Skala zur Bewertung negativer Symptome (SANS) zur Bewertung negativer Symptome verwendet.
Die Ergebnisse der oralen Ziprasidon-Studien bei Schizophrenie folgen
Bipolar-I-Störung (akute gemischte oder manische Episoden und Erhaltungsbehandlung als Ergänzung zu Lithium oder Valproat)
Akute manische und gemischte Episoden im Zusammenhang mit Bipolar-I-Störung
Die Wirksamkeit von Ziprasidon wurde in 2 placebokontrollierten, doppelblinden, 3-wöchigen Monotherapiestudien bei Patienten nachgewiesen, die die DSM-IV-Kriterien für Bipolar-I-Störung, manische oder gemischte Episoden mit oder ohne psychotische Merkmale erfüllten. Primäre Bewertungsinstrumente, die in diesen Studien zur Bewertung manischer Symptome verwendet wurden, waren: (1) die Mania Rating Scale (MRS), die aus dem Schedule for Affective Disorders and Schizophrenia-Change Version (SADS-CB) abgeleitet ist, wobei Elemente als Manisches Syndrom gruppiert sind Subskala (gehobene Stimmung, weniger Schlafbedürfnis, übermäßige Energie, übermäßige Aktivität, Grandiosität), die Subskala Verhalten und Vorstellungskraft (Reizbarkeit, motorische Hyperaktivität, beschleunigte Sprache, rasende Gedanken, schlechtes Urteilsvermögen) und beeinträchtigte Einsicht; und (2) die Clinical Global Impression-Severity of Illness Scale (CGI-S), die zur Beurteilung der klinischen Signifikanz des Ansprechens auf die Behandlung verwendet wurde.
Die Ergebnisse der oralen Ziprasidon-Studien bei erwachsenen Bipolar-I-Störungen, manischen/gemischten Episoden folgen: In einer 3-wöchigen placebokontrollierten Studie (n = 210) betrug die Ziprasidon-Dosis 40 mg zweimal täglich an Tag 1 und 80 mg zweimal täglich täglich an Tag 2. Titration im Bereich von 40-80 mg zweimal täglich (in 20-mg-Schritten zweimal täglich) war für die Dauer der Studie erlaubt. Ziprasidon war bei der Reduktion des MRS-Gesamtscores und des CGI-S-Scores signifikant wirksamer als Placebo. Die mittlere Tagesdosis von Ziprasidon in dieser Studie betrug 132 mg. In einer zweiten 3-wöchigen placebokontrollierten Studie (n = 205) betrug die Ziprasidon-Dosis an Tag 1 zweimal täglich 40 mg. Eine Titration im Bereich von zweimal täglich 40-80 mg (in Schritten von zweimal täglich 20 mg) war zulässig für die Dauer des Studiums (beginnend am 2. Tag). Ziprasidon war bei der Reduktion des MRS-Gesamtscores und des CGI-S-Scores signifikant wirksamer als Placebo. Die mittlere Tagesdosis von Ziprasidon in dieser Studie betrug 112 mg.
Erhaltungstherapie
Die Wirksamkeit von Ziprasidon als Zusatztherapie zu Lithium oder Valproat in der Erhaltungstherapie der Bipolar-I-Störung wurde in einer placebokontrollierten Studie bei Patienten nachgewiesen, die die DSM-IV-Kriterien für eine Bipolar-I-Störung erfüllten. Die Studie umfasste Patienten, deren letzte Episode manisch oder gemischt war, mit oder ohne psychotische Merkmale. In der Open-Label-Phase mussten die Patienten für mindestens 8 Wochen auf Ziprasidon plus Lithium oder Valproinsäure stabilisiert werden, um randomisiert zu werden. In der doppelblinden, randomisierten Phase setzten die Patienten die Behandlung mit Lithium oder Valproinsäure fort und erhielten randomisiert entweder Ziprasidon (verabreicht zweimal täglich mit insgesamt 80 mg bis 160 mg pro Tag) oder Placebo. Im Allgemeinen setzten die Patienten in der Erhaltungsphase die gleiche Dosis fort, mit der sie während der Stabilisierungsphase stabilisiert wurden. Der primäre Endpunkt in dieser Studie war die Zeit bis zum Wiederauftreten einer Stimmungsepisode (manische, gemischte oder depressive Episode), die eine Intervention erforderte, die wie folgt definiert war: Absetzen aufgrund einer Stimmungsepisode, klinische Intervention wegen einer Stimmungsepisode (z. Einleitung von Medikamenten oder Krankenhausaufenthalt) oder Mania Rating Scale-Score ≥ 18 oder MADRS-Score ≥ 18 (bei 2 aufeinanderfolgenden Bewertungen im Abstand von höchstens 10 Tagen). Insgesamt wurden 584 Probanden in der offenen Stabilisierungsphase behandelt. In der doppelblinden Randomisierungsphase wurden 127 Patienten mit Ziprasidon und 112 Patienten mit Placebo behandelt. Ziprasidon war dem Placebo bei der Verlängerung der Zeit bis zum Wiederauftreten einer Stimmungsepisode überlegen. Zu den beobachteten Arten von Rückfällen gehörten depressive, manische und gemischte Episoden. Depressive, manische und gemischte Episoden machten 53 %, 34 % bzw. 13 % der Gesamtzahl der Rückfallereignisse in der Studie aus.
Akute Behandlung von Unruhe bei Schizophrenie
Die Wirksamkeit von intramuskulärem Ziprasidon bei der Behandlung agitierter schizophrener Patienten wurde in zwei doppelblinden Kurzzeitstudien mit schizophrenen Probanden nachgewiesen, die von den Prüfärzten als „akut agitiert“ eingestuft wurden und antipsychotische IM-Medikamente benötigten. Darüber hinaus mussten die Patienten bei mindestens 3 der folgenden Punkte des PANSS einen Wert von 3 oder mehr aufweisen: Angst, Anspannung, Feindseligkeit und Erregung. Die Wirksamkeit wurde durch Analyse der Fläche unter der Kurve (AUC) der Behavioral Activity Rating Scale (BARS) und der Schweregradbewertung des Clinical Global Impression (CGI) bewertet. Die BARS-Skala ist eine Sieben-Punkte-Skala mit Werten von 1 (schwierig oder nicht in der Lage aufzuwachen) bis 7 (gewalttätig, erfordert Zurückhaltung). Patienten' Die BARS-Scores zu Studienbeginn betrugen meistens 5 (Anzeichen offenkundiger Aktivität [körperlich oder verbal], beruhigt sich mit Anweisungen) und zeigten, wie von den Prüfärzten festgestellt, einen Grad an Erregung, der eine intramuskuläre Therapie rechtfertigte. Es gab nur wenige Patienten mit einer BARS-Bewertung von mehr als 5, da die am stärksten erregten Patienten im Allgemeinen nicht in der Lage waren, ihre informierte Einwilligung zur Teilnahme an klinischen Studien vor der Markteinführung zu erteilen.
In beiden Studien wurden höhere intramuskuläre Dosen von Ziprasidon mit einer Kontrolldosis von 2 mg verglichen. In einer Studie betrug die höhere Dosis 20 mg, die in den 24 Stunden der Studie bis zu 4-mal in Abständen von mindestens 4 Stunden zwischen den Dosen verabreicht werden konnte. In der anderen Studie betrug die höhere Dosis 10 mg, die in den 24 Stunden der Studie bis zu 4-mal in Abständen von mindestens 2 Stunden zwischen den Dosen verabreicht werden konnte.
Die Ergebnisse der intramuskulären Ziprasidon-Studien folgen
INFORMATIONEN ZUM PATIENTEN
GEODON® Kapseln (Ziprasidon)
Informationen für Patienten, die GEODON einnehmen, oder ihre Betreuer
Diese Zusammenfassung enthält wichtige Informationen über GEODON. Es soll die Anweisungen Ihres Arztes nicht ersetzen. Lesen Sie diese Informationen sorgfältig durch, bevor Sie GEODON einnehmen. Fragen Sie Ihren Arzt oder Apotheker, wenn Sie eine dieser Informationen nicht verstehen oder wenn Sie mehr über GEODON wissen möchten.
Was ist GEODON 80 mg?
GEODON ist eine Art verschreibungspflichtiges Medikament, das als Psychopharmakon bezeichnet wird und auch als atypisches Antipsychotikum bekannt ist. GEODON kann zur Behandlung von Symptomen von Schizophrenie und akuten manischen oder gemischten Episoden im Zusammenhang mit einer bipolaren Störung angewendet werden. GEODON 80 mg kann auch als Erhaltungstherapie bei bipolarer Störung verwendet werden, wenn es zu Lithium oder Valproat hinzugefügt wird.
Wer sollte GEODON 20 mg einnehmen?
Nur Ihr Arzt kann wissen, ob GEODON für Sie geeignet ist. GEODON 20 mg kann Ihnen verschrieben werden, wenn Sie an Schizophrenie oder einer bipolaren Störung leiden.
Symptome einer Schizophrenie können sein:
Zu den Symptomen manischer oder gemischter Episoden einer bipolaren Störung können gehören:
Wenn Sie auf GEODON 40 mg ansprechen, können sich Ihre Symptome bessern. Wenn Sie GEODON 40 mg weiterhin einnehmen, ist die Wahrscheinlichkeit eines Wiederauftretens Ihrer Symptome geringer. Brechen Sie die Einnahme der Kapseln nicht ab, auch wenn Sie sich besser fühlen, ohne dies vorher mit Ihrem Arzt zu besprechen.
Es ist auch wichtig, daran zu denken, dass GEODON 40 mg Kapseln mit einer Mahlzeit eingenommen werden sollten.
Was sind die wichtigsten Sicherheitsinformationen, die ich über GEODON 20 mg wissen sollte?
GEODON ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen. Ältere Patienten mit der Diagnose einer Psychose im Zusammenhang mit Demenz, die mit Antipsychotika behandelt werden, haben ein erhöhtes Sterberisiko im Vergleich zu Patienten, die mit Placebo (einer Zuckerpille) behandelt werden.
GEODON ist ein wirksames Medikament zur Behandlung der Symptome von Schizophrenie und manischen oder gemischten Episoden einer bipolaren Störung. Eine mögliche Nebenwirkung ist jedoch, dass es die Funktionsweise des elektrischen Stroms in Ihrem Herzen stärker verändern kann als einige andere Medikamente. Die Veränderung ist gering und es ist nicht bekannt, ob dies schädlich sein wird, aber einige andere Medikamente, die diese Art von Veränderung verursachen, haben in seltenen Fällen gefährliche Herzrhythmusstörungen verursacht. Aus diesem Grund sollte GEODON nur angewendet werden, nachdem Ihr Arzt dieses Risiko für GEODON gegen die Risiken und den Nutzen anderer Medikamente abgewogen hat, die zur Behandlung von Schizophrenie oder bipolaren manischen und gemischten Episoden erhältlich sind.
Ihr Risiko für gefährliche Veränderungen des Herzrhythmus kann erhöht sein, wenn Sie bestimmte andere Arzneimittel einnehmen und wenn Sie bereits bestimmte anormale Herzerkrankungen haben. Daher ist es wichtig, dass Sie Ihren Arzt über alle anderen Arzneimittel informieren, die Sie einnehmen, einschließlich nicht verschreibungspflichtiger Arzneimittel, Nahrungsergänzungsmittel und pflanzlicher Arzneimittel. Sie müssen Ihren Arzt auch über alle Herzprobleme informieren, die Sie haben oder hatten.
Wer sollte GEODON 40mg NICHT einnehmen?
Ältere Patienten mit der Diagnose einer Psychose im Zusammenhang mit Demenz. GEODON ist für die Behandlung dieser Patienten nicht zugelassen.
Alles, was die Wahrscheinlichkeit einer Herzrhythmusstörung erhöhen kann, sollte vermieden werden. Nehmen Sie daher GEODON 80 mg nicht ein, wenn:
Was Sie Ihrem Arzt mitteilen sollten, bevor Sie mit GEODON beginnen
Nur Ihr Arzt kann entscheiden, ob GEODON für Sie geeignet ist. Bevor Sie mit GEODON beginnen, informieren Sie unbedingt Ihren Arzt, wenn Sie:
Ihr Arzt möchte möglicherweise, dass Sie zusätzliche Labortests durchführen lassen, um festzustellen, ob GEODON 40 mg eine geeignete Behandlung für Sie ist.
GEODON und andere Arzneimittel
Es gibt einige Medikamente, deren Anwendung bei der Einnahme von GEODON unsicher sein kann, und es gibt einige Medikamente, die die Wirkung von GEODON 40 mg beeinflussen können. Wenden Sie sich während der Behandlung mit GEODON an Ihren Arzt, bevor Sie mit der Einnahme neuer verschreibungspflichtiger oder rezeptfreier Medikamente, einschließlich natürlicher/pflanzlicher Heilmittel, beginnen.
Wie ist GEODON einzunehmen?
Mögliche Nebenwirkungen
Da diese Probleme bedeuten könnten, dass Sie eine Herzrhythmusstörung haben, wenden Sie sich an Ihren Arzt SOFORT wenn du:
Häufige Nebenwirkungen von GEODON sind die folgenden und sollten ebenfalls mit Ihrem Arzt besprochen werden, wenn sie auftreten:
Wenn Sie Nebenwirkungen bemerken, die Sie beunruhigen, sprechen Sie mit Ihrem Arzt. Es ist besonders wichtig, dass Sie Ihren Arzt informieren, wenn Sie Durchfall, Erbrechen oder eine andere Krankheit haben, die zu Flüssigkeitsverlust führen kann. Ihr Arzt möchte möglicherweise Ihr Blut untersuchen, um sicherzustellen, dass Sie nach solchen Erkrankungen die richtige Menge an wichtigen Salzen haben.
Für eine Auflistung aller berichteten Nebenwirkungen fragen Sie Ihren Arzt oder Apotheker nach der GEODON Professional Packungsbeilage.
Was tun bei einer Überdosis
Rufen Sie im Falle einer Überdosierung sofort Ihren Arzt oder die Giftnotrufzentrale an oder suchen Sie die nächste Notaufnahme auf.
Weitere wichtige Sicherheitsinformationen
Bei allen Antipsychotika, einschließlich GEODON, kann eine schwerwiegende Erkrankung namens malignes neuroleptisches Syndrom (NMS) auftreten. Anzeichen von NMS sind sehr hohes Fieber, steife Muskeln, Zittern, Verwirrtheit, Schwitzen oder erhöhte Herzfrequenz und erhöhter Blutdruck. NMS ist eine seltene, aber schwerwiegende Nebenwirkung, die tödlich sein kann. Informieren Sie daher Ihren Arzt, wenn Sie eines dieser Anzeichen bemerken.
Unter Ziprasidon kann eine Arzneimittelreaktion mit verzögertem Beginn auftreten, die Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS) genannt wird. Anzeichen von DRESS können Hautausschlag, Fieber und geschwollene Lymphknoten sein. Andere schwere kutane Nebenwirkungen (SCAR) wie das Stevens-Johnson-Syndrom können unter Ziprasidon auftreten. Anzeichen des Stevens-Johnson-Syndroms können Hautausschlag mit Blasen sein, die Geschwüre im Mund, Hautablösung, Fieber und zielscheibenähnliche Flecken auf der Haut umfassen können. DRESS und andere SCAR sind manchmal tödlich; Informieren Sie daher sofort Ihren Arzt, wenn Sie eines dieser Anzeichen bemerken.
Nebenwirkungen im Zusammenhang mit hohem Blutzucker (Hyperglykämie), manchmal schwerwiegend, wurden bei Patienten berichtet, die mit atypischen Antipsychotika behandelt wurden. Es liegen wenige Berichte über Hyperglykämie oder Diabetes bei Patienten vor, die mit GEODON behandelt wurden, und es ist nicht bekannt, ob GEODON mit diesen Reaktionen in Verbindung gebracht wird. Patienten, die mit einem atypischen Antipsychotikum behandelt werden, sollten auf Symptome einer Hyperglykämie überwacht werden.
Durch einen Blutdruckabfall verursachter Schwindel kann unter GEODON auftreten, insbesondere wenn Sie mit der Einnahme dieses Arzneimittels beginnen oder wenn die Dosis erhöht wird. Achten Sie in diesem Fall darauf, nicht zu schnell aufzustehen, und sprechen Sie mit Ihrem Arzt über das Problem.
Informieren Sie vor der Einnahme von GEODON Ihren Arzt, wenn Sie
Da GEODON 80 mg Schläfrigkeit verursachen kann, seien Sie beim Bedienen von Maschinen oder beim Führen eines Kraftfahrzeugs vorsichtig.
Da Medikamente derselben Wirkstoffklasse wie GEODON die Fähigkeit des Körpers beeinträchtigen können, sich an Wärme anzupassen, ist es am besten, Situationen mit hoher Temperatur oder Feuchtigkeit zu vermeiden.
Es ist am besten, während der Einnahme von GEODON auf den Konsum alkoholischer Getränke zu verzichten.
Rufen Sie Ihren Arzt an sofort wenn Sie mehr als die von Ihrem Arzt verschriebene Menge GEODON eingenommen haben.
GEODON hat sich bei der Behandlung von Kindern und Jugendlichen unter 18 Jahren nicht als sicher oder wirksam erwiesen.
Bewahren Sie GEODON 80 mg und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Wie ist GEODON aufzubewahren?
Lagern Sie GEODON 20 mg Kapseln bei Raumtemperatur (59 °F bis 86 °F oder 15 °C bis 30 °C).
Weitere Informationen zu GEODON
Dieses Blatt ist nur eine Zusammenfassung. GEODON 20 mg ist ein verschreibungspflichtiges Arzneimittel und nur Ihr Arzt kann entscheiden, ob es für Sie geeignet ist. Wenn Sie Fragen haben oder weitere Informationen zu GEODON wünschen, sprechen Sie mit Ihrem Arzt oder Apotheker. Sie können auch www.geodon.com besuchen.
Die Kennzeichnung dieses Produkts wurde möglicherweise aktualisiert. Die neuesten Verschreibungsinformationen finden Sie unter www.pfizer.com