Pamelor 25mg Nortriptyline Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Pamelor 25 mg und wie wird es angewendet?
Pamelor 25 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Depressionen. Pamelor 25 mg kann allein oder mit anderen Medikamenten verwendet werden.
Pamelor gehört zu einer Klasse von Medikamenten namens Antidepressiva, TCAs.
Es ist nicht bekannt, ob Pamelor bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Pamelor 25mg haben?
Pamelor kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Pamelor sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Pamelor. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
Suizidalität und Antidepressiva
Antidepressiva erhöhten im Vergleich zu Placebo das Risiko für suizidales Denken und Verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen in Kurzzeitstudien zu Major Depression (MDD) und anderen psychiatrischen Erkrankungen. Jeder, der die Anwendung von Nortriptylinhydrochlorid oder anderen Antidepressiva bei einem Kind, Jugendlichen oder jungen Erwachsenen in Betracht zieht, muss dieses Risiko mit der klinischen Notwendigkeit abwägen. Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; Bei Erwachsenen ab 65 Jahren war das Risiko unter Antidepressiva im Vergleich zu Placebo geringer. Depressionen und bestimmte andere psychiatrische Störungen sind selbst mit einem erhöhten Suizidrisiko verbunden. Patienten jeden Alters, die mit einer antidepressiven Therapie begonnen werden, sollten angemessen überwacht und engmaschig auf klinische Verschlechterung, Suizidalität oder ungewöhnliche Verhaltensänderungen beobachtet werden. Familien und Betreuer sollten auf die Notwendigkeit einer genauen Beobachtung und Kommunikation mit dem verschreibenden Arzt hingewiesen werden. Nortriptylinhydrochlorid ist nicht für die Anwendung bei pädiatrischen Patienten zugelassen (siehe WARNUNGEN klinische Verschlechterung und Suizidrisiko; INFORMATIONEN ZUM PATIENTEN ; und VORSICHTSMASSNAHMEN , Verwendung in der Pädiatrie).
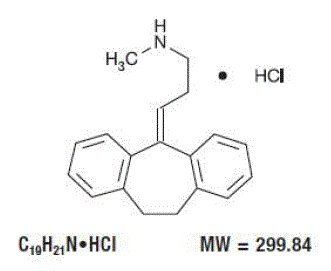
BEZEICHNUNG
Pamelor™ (Nortriptylin HCl) ist 1-Propanamin, 3-(10,11-Dihydro-5H-dibenzo[a,d]cyclohepten-5-yliden)-N-methyl-, Hydrochlorid.
Die Strukturformel lautet wie folgt:
10 mg, 25 mg, 50 mg und 75 mg Kapseln
Wirkstoff
Nortriptylinhydrochlorid USP.
10 mg, 25 mg und 75 mg Kapseln
Inaktive Zutaten
D&C Yellow Nr. 10, FD&C Yellow Nr. 6, Gelatine, Silikonflüssigkeit, Stärke und Titandioxid.
50-mg-Kapseln
Inaktive Zutaten
Gelatine, Silikonflüssigkeit, Stärke und Titandioxid.
INDIKATIONEN
Pamelor™ (Nortriptylin-HCl) ist zur Linderung von Depressionssymptomen indiziert. Endogene Depressionen werden eher gelindert als andere depressive Zustände.
DOSIERUNG UND ANWENDUNG
Pamelor 25 mg wird für Kinder nicht empfohlen.
Pamelor wird oral in Form von Kapseln verabreicht. Für ältere Patienten und Jugendliche werden niedrigere Dosierungen als üblich empfohlen. Auch für ambulante Patienten werden niedrigere Dosierungen empfohlen als für stationäre Patienten, die engmaschig überwacht werden. Der Arzt sollte die Dosierung auf einem niedrigen Niveau beginnen und allmählich erhöhen, wobei er das klinische Ansprechen und alle Anzeichen einer Unverträglichkeit sorgfältig beobachtet. Nach der Remission kann eine Erhaltungsmedikation für einen längeren Zeitraum in der niedrigsten Dosis erforderlich sein, die die Remission aufrechterhält.
Wenn ein Patient geringfügige Nebenwirkungen entwickelt, sollte die Dosierung reduziert werden. Das Medikament sollte sofort abgesetzt werden, wenn schwerwiegende Nebenwirkungen oder allergische Manifestationen auftreten.
Übliche Dosis für Erwachsene
25 mg drei- oder viermal täglich; Die Dosierung sollte auf einem niedrigen Niveau beginnen und bei Bedarf gesteigert werden. Als alternatives Regime kann die gesamte Tagesdosis einmal täglich verabreicht werden. Wenn Dosen über 100 mg täglich verabreicht werden, sollten die Plasmaspiegel von Nortriptylin überwacht und im optimalen Bereich von 50 bis 150 ng/ml gehalten werden. Dosen über 150 mg/Tag werden nicht empfohlen.
Ältere und jugendliche Patienten
30 bis 50 mg/Tag, in aufgeteilten Dosen, oder die gesamte Tagesdosis können einmal täglich verabreicht werden.
Umstellung eines Patienten auf oder von einem Monoaminoxidase-Hemmer (MAOI) zur Behandlung psychiatrischer Störungen
Zwischen dem Absetzen eines MAO-Hemmers zur Behandlung psychiatrischer Erkrankungen und dem Beginn einer Therapie mit Pamelor sollten mindestens 14 Tage vergehen. Umgekehrt sollten nach dem Absetzen von Pamelor mindestens 14 Tage vergehen, bevor mit einem MAOI zur Behandlung psychiatrischer Erkrankungen begonnen wird ( KONTRAINDIKATIONEN ).
Verwendung von Pamelor 25 mg mit anderen MAO-Hemmern wie Linezolid oder Methylenblau
Beginnen Sie die Behandlung mit Pamelor nicht bei einem Patienten, der mit Linezolid oder intravenösem Methylenblau behandelt wird, da ein erhöhtes Risiko für ein Serotonin-Syndrom besteht. Bei einem Patienten, der eine dringendere Behandlung einer psychiatrischen Erkrankung benötigt, sollten andere Interventionen, einschließlich eines Krankenhausaufenthalts, in Betracht gezogen werden (siehe KONTRAINDIKATIONEN ).
In einigen Fällen kann ein Patient, der bereits eine Pamelor-Therapie erhält, eine dringende Behandlung mit Linezolid oder intravenösem Methylenblau benötigen. Wenn keine akzeptablen Alternativen zur Behandlung mit Linezolid oder intravenösem Methylenblau verfügbar sind und der potenzielle Nutzen einer Behandlung mit Linezolid oder intravenösem Methylenblau die Risiken eines Serotonin-Syndroms bei einem bestimmten Patienten überwiegen, sollte Pamelor 25 mg sofort abgesetzt und Linezolid oder Methylenblau intravenös verabreicht werden blau verabreicht werden kann. Der Patient sollte zwei Wochen lang oder bis 24 Stunden nach der letzten Dosis von Linezolid oder intravenösem Methylenblau, je nachdem, was zuerst eintritt, auf Symptome des Serotonin-Syndroms überwacht werden. Die Therapie mit Pamelor kann 24 Stunden nach der letzten Dosis von Linezolid oder intravenösem Methylenblau wieder aufgenommen werden (siehe WARNUNGEN ).
Das Risiko der Verabreichung von Methylenblau auf nicht-intravenösem Wege (z. B. als Tabletten zum Einnehmen oder durch lokale Injektion) oder in intravenösen Dosen von viel weniger als 1 mg/kg mit Pamelor 25 mg ist unklar. Der Arzt sollte sich jedoch der Möglichkeit bewusst sein, dass bei einer solchen Anwendung Symptome des Serotonin-Syndroms auftreten können (siehe WARNUNGEN ).
WIE GELIEFERT
Pamelor™ (Nortriptylin HCl) Kapseln USP
Pamelor™ (Nortriptylin-HCl) Kapseln USP, entsprechend 10 mg, 25 mg, 50 mg und 75 mg Base, sind wie folgt erhältlich:
10mg : Hellorangefarbenes, undurchsichtiges Oberteil mit schwarzem Aufdruck „PAMELOR 10 mg“ und weißes, undurchsichtiges Unterteil mit schwarzem Aufdruck „M“.
30 Flaschen: NDC 0406-9910-03
25mg : Hellorangefarbenes, undurchsichtiges Oberteil mit schwarzem Aufdruck „PAMELOR 25 mg“ und weißes, undurchsichtiges Unterteil mit schwarzem Aufdruck „M“.
30 Flaschen: NDC 0406-9911-03
50mg : Weißes, undurchsichtiges Oberteil mit schwarzem Aufdruck „PAMELOR 50 mg“ und weißes, undurchsichtiges Unterteil mit schwarzem Aufdruck „M“.
30 Flaschen: NDC 0406-9912-03
75mg Hellorangefarbenes, undurchsichtiges Oberteil mit dem schwarzen Aufdruck „PAMELOR 75 mg“ und ein hellorangefarbenes, undurchsichtiges Unterteil mit dem schwarzen Aufdruck „M“.
30 Flaschen: NDC 0406-9913-03
Speichern und abgeben
Bei 20° bis 25°C (68° bis 77°F) lagern [siehe USP Kontrollierte Raumtemperatur].
Abgabe in dichtem Behälter (USP) mit kindergesichertem Verschluss.
Mallinckrodt, das Markenzeichen „M“, das Logo von Mallinckrodt Pharmaceuticals und andere Marken sind Warenzeichen eines Unternehmens von Mallinckrodt.
Hergestellt von: Patheon Inc. Whitby, Ontario, Kanada. L1N5Z5. Überarbeitet: Okt. 2016
NEBENWIRKUNGEN
Notiz
In der folgenden Liste sind einige Nebenwirkungen aufgeführt, die mit diesem spezifischen Medikament nicht berichtet wurden. Die pharmakologischen Ähnlichkeiten zwischen den trizyklischen Antidepressiva erfordern jedoch, dass bei der Verabreichung von Nortriptylin jede der Reaktionen berücksichtigt wird.
Herz-Kreislauf
Hypotonie, Bluthochdruck, Tachykardie, Herzklopfen, Myokardinfarkt, Arrhythmien, Herzblock, Schlaganfall.
Psychiatrisch
Verwirrtheitszustände (insbesondere bei älteren Menschen) mit Halluzinationen, Orientierungslosigkeit, Wahnvorstellungen; Angst, Unruhe, Erregung; Schlaflosigkeit, Panik, Alpträume; Hypomanie; Verschlimmerung der Psychose.
Neurologische
Taubheit, Kribbeln, Parästhesien der Extremitäten; Koordinationsstörungen, Ataxie, Zittern; periphere Neuropathie; extrapyramidale Symptome; Krampfanfälle, Veränderung der EEG-Muster; Ohrgeräusche.
Anticholinergikum
Mundtrockenheit und selten damit verbundene sublinguale Adenitis; verschwommenes Sehen, Akkommodationsstörung, Mydriasis; Verstopfung, paralytischer Ileus; Harnverhalt, verzögerte Miktion, Dilatation der Harnwege.
Allergisch
Hautausschlag, Petechien, Urtikaria, Juckreiz, Photosensibilisierung (übermäßige Sonneneinstrahlung vermeiden); Ödeme (allgemein oder von Gesicht und Zunge), Arzneimittelfieber, Kreuzempfindlichkeit mit anderen trizyklischen Arzneimitteln.
Hämatologisch
Knochenmarkdepression, einschließlich Agranulozytose; Eosinophilie; Purpura; Thrombozytopenie.
Magen-Darm
Übelkeit und Erbrechen, Anorexie, epigastrische Beschwerden, Durchfall, eigenartiger Geschmack, Stomatitis, Bauchkrämpfe, Zungenentzündung.
Endokrine
Gynäkomastie beim Mann, Brustvergrößerung und Galaktorrhoe bei der Frau; gesteigerte oder verminderte Libido, Impotenz; Hodenschwellung; Erhöhung oder Senkung des Blutzuckerspiegels; Syndrom der unangemessenen Sekretion von ADH (antidiuretisches Hormon).
Sonstiges
Gelbsucht (vortäuschend obstruktiv), veränderte Leberfunktion; Gewichtszunahme oder -verlust; Schweiß; Spülung; häufiges Wasserlassen, Nykturie; Schläfrigkeit, Schwindel, Schwäche, Müdigkeit; Kopfschmerzen; Parotisschwellung; Alopezie.
Entzugserscheinungen
Obwohl dies kein Hinweis auf eine Sucht ist, kann ein abruptes Absetzen der Behandlung nach längerer Therapie Übelkeit, Kopfschmerzen und Unwohlsein hervorrufen.
Postmarketing-Erfahrung
Die folgende Nebenwirkung wurde während der Anwendung von Pamelor nach der Zulassung berichtet. Da diese Reaktion freiwillig von einer Population unbekannter Größe gemeldet wird, ist es nicht immer möglich, die Häufigkeit zuverlässig abzuschätzen.
Herzerkrankungen - Brugada-Syndrom
Augenerkrankungen - Engwinkelglaukom
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Es hat sich gezeigt, dass die Verabreichung von Reserpin während der Therapie mit einem trizyklischen Antidepressivum bei einigen depressiven Patienten eine „stimulierende“ Wirkung hervorruft.
Eine engmaschige Überwachung und sorgfältige Anpassung der Dosierung sind erforderlich, wenn Pamelor 25 mg zusammen mit anderen Anticholinergika und Sympathomimetika angewendet wird.
Die gleichzeitige Verabreichung von Cimetidin und trizyklischen Antidepressiva kann zu klinisch signifikanten Erhöhungen der Plasmakonzentrationen des trizyklischen Antidepressivums führen. Der Patient sollte darüber informiert werden, dass die Reaktion auf Alkohol übertrieben sein kann.
Ein Fall von signifikanter Hypoglykämie wurde bei einem Patienten mit Typ-II-Diabetes berichtet, der nach der Zugabe von Nortriptylin (125 mg/Tag) mit Chlorpropamid (250 mg/Tag) behandelt wurde.
Medikamente, die von P450 2D6 metabolisiert werden
Die biochemische Aktivität des Arzneimittel metabolisierenden Isozyms Cytochrom P450 2D6 (Debrisoquin-Hydroxylase) ist in einer Untergruppe der kaukasischen Bevölkerung reduziert (etwa 7 % bis 10 % der Kaukasier sind sogenannte „poor metabolizers“); Zuverlässige Schätzungen der Prävalenz von reduzierter P450-2D6-Isozym-Aktivität bei asiatischen, afrikanischen und anderen Bevölkerungsgruppen sind noch nicht verfügbar. Langsame Metabolisierer haben höhere als erwartete Plasmakonzentrationen von trizyklischen Antidepressiva (TCAs), wenn sie übliche Dosen erhalten. Abhängig von der durch P450 2D6 metabolisierten Fraktion des Arzneimittels kann der Anstieg der Plasmakonzentration gering oder ziemlich groß sein (8-facher Anstieg der Plasma-AUC des TCA).
Darüber hinaus hemmen bestimmte Arzneimittel die Aktivität dieses Isozyms und lassen normale Metabolisierer langsamen Metabolisierern ähneln. Eine Person, die mit einer gegebenen TCA-Dosis stabil ist, kann abrupt toxisch werden, wenn sie eines dieser hemmenden Arzneimittel als Begleittherapie erhält. Zu den Arzneimitteln, die Cytochrom P450 2D6 hemmen, gehören einige, die nicht durch das Enzym verstoffwechselt werden (Chinidin; Cimetidin), und viele, die Substrate für P450 2D6 sind (viele andere Antidepressiva, Phenothiazine und die Typ-1C-Antiarrhythmika Propafenon und Flecainid). Während alle selektiven Serotonin-Wiederaufnahmehemmer (SSRIs), z. B. Fluoxetin, Sertralin und Paroxetin, P450 2D6 hemmen, können sie im Ausmaß der Hemmung variieren. Das Ausmaß, in dem SSRI-TCA-Wechselwirkungen klinische Probleme aufwerfen können, hängt vom Grad der Hemmung und der Pharmakokinetik der beteiligten SSRI ab. Dennoch ist bei der gleichzeitigen Verabreichung von TCAs mit einem der SSRIs und auch beim Wechsel von einer Klasse zur anderen Vorsicht geboten. Besonders wichtig ist, dass bei einem Patienten, der Fluoxetin abgesetzt wird, angesichts der langen Halbwertszeit des Ausgangsstoffs und des aktiven Metaboliten ausreichend Zeit verstreichen muss, bevor mit der Behandlung mit TCA begonnen wird (mindestens 5 Wochen können erforderlich sein).
Die gleichzeitige Anwendung von trizyklischen Antidepressiva mit Arzneimitteln, die Cytochrom P450 2D6 hemmen können, kann niedrigere Dosen als die üblicherweise verschriebenen entweder für das trizyklische Antidepressivum oder das andere Arzneimittel erfordern. Darüber hinaus kann immer dann, wenn eines dieser anderen Arzneimittel aus der Co-Therapie abgesetzt wird, eine erhöhte Dosis des trizyklischen Antidepressivums erforderlich sein. Es ist wünschenswert, die TCA-Plasmaspiegel zu überwachen, wann immer ein TCA zusammen mit einem anderen Medikament verabreicht wird, von dem bekannt ist, dass es ein Inhibitor von P450 2D6 ist.
WARNUNGEN
Klinische Verschlechterung und Suizidrisiko
Bei Patienten mit schwerer depressiver Störung (MDD), sowohl bei Erwachsenen als auch bei Kindern, kann es zu einer Verschlechterung ihrer Depression und/oder zum Auftreten von Suizidgedanken und -verhalten (Suizidalität) oder zu ungewöhnlichen Verhaltensänderungen kommen, unabhängig davon, ob sie Antidepressiva einnehmen oder nicht Das Risiko kann bestehen bleiben, bis eine signifikante Remission eintritt. Selbstmord ist ein bekanntes Risiko für Depressionen und bestimmte andere psychiatrische Störungen, und diese Störungen selbst sind die stärksten Prädiktoren für Selbstmord. Es besteht jedoch seit langem die Sorge, dass Antidepressiva bei bestimmten Patienten in den frühen Phasen der Behandlung eine Rolle bei der Induktion einer Verschlechterung der Depression und dem Auftreten von Suizidalität spielen könnten. Gepoolte Analysen von Placebo-kontrollierten Kurzzeitstudien mit Antidepressiva (SSRIs und andere) zeigten, dass diese Medikamente das Risiko für suizidales Denken und Verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen (im Alter von 18 bis 24) mit Major Depression erhöhen Störung (MDD) und andere psychiatrische Störungen. Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; bei Erwachsenen ab 65 Jahren kam es unter Antidepressiva im Vergleich zu Placebo zu einer Reduktion.
Die gepoolten Analysen placebokontrollierter Studien bei Kindern und Jugendlichen mit MDD, Zwangsstörungen (OCD) oder anderen psychiatrischen Erkrankungen umfassten insgesamt 24 Kurzzeitstudien mit 9 Antidepressiva bei über 4400 Patienten. Die gepoolten Analysen placebokontrollierter Studien bei Erwachsenen mit MDD oder anderen psychiatrischen Erkrankungen umfassten insgesamt 295 Kurzzeitstudien (mediane Dauer von 2 Monaten) mit 11 Antidepressiva bei über 77.000 Patienten. Es gab beträchtliche Schwankungen des Suizidalitätsrisikos zwischen den Medikamenten, aber bei fast allen untersuchten Medikamenten eine Tendenz zu einem Anstieg bei den jüngeren Patienten. Es gab Unterschiede im absoluten Suizidalitätsrisiko zwischen den verschiedenen Indikationen, mit der höchsten Inzidenz bei MDD. Die Risikounterschiede (Medikament vs. Placebo) waren jedoch relativ stabil innerhalb der Altersschichten und über Indikationen hinweg. Diese Risikounterschiede (Arzneimittel-Placebo-Unterschied in der Anzahl der Fälle von Suizidalität pro 1000 behandelten Patienten) sind in angegeben.
In keiner der pädiatrischen Studien kam es zu Suiziden. In den Studien mit Erwachsenen gab es Suizide, aber die Anzahl reichte nicht aus, um zu einer Schlussfolgerung über die Wirkung des Medikaments auf Suizide zu gelangen.
Es ist nicht bekannt, ob sich das Suizidrisiko auf eine längerfristige Anwendung erstreckt, dh über mehrere Monate hinaus. Es gibt jedoch erhebliche Hinweise aus placebokontrollierten Erhaltungsstudien bei Erwachsenen mit Depressionen, dass die Anwendung von Antidepressiva das Wiederauftreten von Depressionen verzögern kann.
Alle Patienten, die mit Antidepressiva aus beliebigen Indikationen behandelt werden, sollten angemessen überwacht und engmaschig auf eine klinische Verschlechterung, Suizidalität und ungewöhnliche Verhaltensänderungen beobachtet werden, insbesondere während der ersten Monate einer medikamentösen Therapie oder bei Dosisänderungen oder -steigerungen oder abnimmt.
Die folgenden Symptome, Angst, Agitiertheit, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Ruhelosigkeit), Hypomanie und Manie, wurden bei erwachsenen und pädiatrischen Patienten berichtet, die ebenfalls mit Antidepressiva wegen schwerer depressiver Störung behandelt wurden wie für andere Indikationen, sowohl psychiatrische als auch nichtpsychiatrische. Obwohl ein kausaler Zusammenhang zwischen dem Auftreten solcher Symptome und entweder der Verschlechterung einer Depression und/oder dem Auftreten suizidaler Impulse nicht hergestellt werden konnte, besteht die Sorge, dass solche Symptome Vorboten einer aufkommenden Suizidalität sein könnten.
Bei Patienten, deren Depression sich anhaltend verschlimmert oder die an Suizidalität oder Symptomen leiden, die Vorboten einer Verschlechterung der Depression oder Suizidalität sein könnten, sollte eine Änderung des therapeutischen Schemas, einschließlich eines möglichen Absetzens der Medikation, in Betracht gezogen werden, insbesondere wenn diese Symptome schwerwiegend und abrupt sind zu Beginn oder waren nicht Teil der Symptome des Patienten.
Familien und Betreuer von Patienten, die wegen einer schweren depressiven Störung oder anderen Indikationen, sowohl psychiatrischen als auch nichtpsychiatrischen, mit Antidepressiva behandelt werden, sollten auf die Notwendigkeit aufmerksam gemacht werden, Patienten auf das Auftreten von Unruhe, Reizbarkeit, ungewöhnlichen Verhaltensänderungen und den anderen oben beschriebenen Symptomen zu überwachen , sowie das Auftreten von Suizidalität, und solche Symptome unverzüglich dem Gesundheitsdienstleister zu melden. Eine solche Überwachung sollte die tägliche Beobachtung durch Familien und Betreuer umfassen. Rezepte für Nortriptylinhydrochlorid sollten für die kleinste Menge an Kapseln im Einklang mit einem guten Patientenmanagement ausgestellt werden, um das Risiko einer Überdosierung zu verringern.
Screening von Patienten auf bipolare Störungen
Eine schwere depressive Episode kann die anfängliche Präsentation einer bipolaren Störung sein. Es wird allgemein angenommen (obwohl dies nicht in kontrollierten Studien nachgewiesen wurde), dass die Behandlung einer solchen Episode mit einem Antidepressivum allein die Wahrscheinlichkeit des Auftretens einer gemischten/manischen Episode bei Patienten mit einem Risiko für eine bipolare Störung erhöhen kann. Ob eines der oben beschriebenen Symptome eine solche Konversion darstellt, ist unbekannt. Vor Beginn der Behandlung mit einem Antidepressivum sollten Patienten mit depressiven Symptomen jedoch angemessen untersucht werden, um festzustellen, ob bei ihnen ein Risiko für eine bipolare Störung besteht; Ein solches Screening sollte eine detaillierte psychiatrische Vorgeschichte umfassen, einschließlich einer Familienanamnese von Selbstmord, bipolarer Störung und Depression. Es sollte beachtet werden, dass Nortriptylinhydrochlorid nicht zur Behandlung von bipolarer Depression zugelassen ist.
Patienten mit Herz-Kreislauf-Erkrankungen sollten Pamelor 25 mg nur unter strenger Überwachung verabreicht werden, da das Arzneimittel dazu neigt, eine Sinustachykardie hervorzurufen und die Überleitungszeit zu verlängern. Myokardinfarkt, Arrhythmie und Schlaganfälle sind aufgetreten. Die blutdrucksenkende Wirkung von Guanethidin und ähnlichen Wirkstoffen kann blockiert werden. Wegen seiner anticholinergen Wirkung sollte Pamelor bei Patienten mit Harnverhalt in der Vorgeschichte mit großer Vorsicht angewendet werden. Patienten mit Krampfanfällen in der Anamnese sollten engmaschig überwacht werden, wenn Pamelor 25 mg verabreicht wird, da bekannt ist, dass dieses Arzneimittel die Krampfschwelle senkt. Große Vorsicht ist geboten, wenn Pamelor hyperthyreoten Patienten oder Patienten verabreicht wird, die Schilddrüsenmedikamente erhalten, da sich Herzrhythmusstörungen entwickeln können.
Pamelor kann die geistigen und/oder körperlichen Fähigkeiten beeinträchtigen, die für die Ausführung gefährlicher Aufgaben wie das Bedienen von Maschinen oder das Führen eines Autos erforderlich sind; daher sollte der Patient entsprechend gewarnt werden.
Übermäßiger Alkoholkonsum in Kombination mit einer Nortriptylin-Therapie kann eine potenzierende Wirkung haben, die zu der Gefahr vermehrter Suizidversuche oder einer Überdosierung führen kann, insbesondere bei Patienten mit emotionalen Störungen oder Suizidgedanken in der Vorgeschichte.
Die gleichzeitige Verabreichung von Chinidin und Nortriptylin kann zu einer signifikant längeren Plasmahalbwertszeit, einer höheren AUC und einer geringeren Clearance von Nortriptylin führen.
Serotonin-Syndrom
Die Entwicklung eines potenziell lebensbedrohlichen Serotoninsyndroms wurde mit SNRIs und SSRIs, einschließlich Pamelor 25 mg, allein, aber insbesondere bei gleichzeitiger Anwendung anderer serotonerger Arzneimittel (einschließlich Triptane, trizyklische Antidepressiva, Fentanyl, Lithium, Tramadol, Tryptophan, Buspiron und Johanniskraut) und mit Arzneimitteln, die den Serotoninstoffwechsel beeinträchtigen (insbesondere MAO-Hemmer, sowohl solche, die zur Behandlung psychiatrischer Erkrankungen bestimmt sind, als auch andere, wie Linezolid und intravenöses Methylenblau).
Zu den Symptomen des Serotonin-Syndroms können Veränderungen des mentalen Status (z. B. Unruhe, Halluzinationen, Delirium und Koma), autonome Instabilität (z. B. Tachykardie, labiler Blutdruck, Schwindel, Diaphorese, Hitzewallungen, Hyperthermie), neuromuskuläre Veränderungen (z. B. Tremor, Steifheit, Myoklonus, Hyperreflexie, Koordinationsstörungen), Krampfanfälle und/oder gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Durchfall). Die Patienten sollten auf das Auftreten eines Serotonin-Syndroms überwacht werden.
Die gleichzeitige Anwendung von Pamelor 25 mg mit MAO-Hemmern zur Behandlung psychiatrischer Erkrankungen ist kontraindiziert. Pamelor sollte auch nicht bei einem Patienten begonnen werden, der mit MAO-Hemmern wie Linezolid oder intravenösem Methylenblau behandelt wird. Alle Berichte mit Methylenblau, die Informationen zum Verabreichungsweg enthielten, betrafen die intravenöse Verabreichung im Dosisbereich von 1 mg/kg bis 8 mg/kg. Es gab keine Berichte über die Verabreichung von Methylenblau auf anderem Wege (wie z. B. Tabletten zum Einnehmen oder lokale Gewebeinjektion) oder in niedrigeren Dosen. Es kann Umstände geben, unter denen es notwendig ist, bei einem Patienten, der Pamelor einnimmt, eine Behandlung mit einem MAO-Hemmer wie Linezolid oder intravenösem Methylenblau zu beginnen. Pamelor 25 mg sollte abgesetzt werden, bevor eine Behandlung mit dem MAO-Hemmer begonnen wird (siehe KONTRAINDIKATIONEN und DOSIERUNG UND ANWENDUNG ).
Wenn die gleichzeitige Anwendung von Pamelor 25 mg mit anderen serotonergen Arzneimitteln, einschließlich Triptanen, trizyklischen Antidepressiva, Fentanyl, Lithium, Tramadol, Buspiron, Tryptophan und Johanniskraut, klinisch gerechtfertigt ist, sollten die Patienten auf ein potenziell erhöhtes Risiko für ein Serotonin-Syndrom aufmerksam gemacht werden. insbesondere zu Beginn der Behandlung und bei Dosiserhöhungen.
Die Behandlung mit Pamelor 25 mg und allen begleitenden serotonergen Arzneimitteln sollte sofort abgebrochen werden, wenn die oben genannten Ereignisse auftreten, und eine unterstützende symptomatische Behandlung eingeleitet werden.
Demaskierung des Brugada-Syndroms
Nach der Markteinführung gab es Berichte über einen möglichen Zusammenhang zwischen der Behandlung mit Pamelor und der Demaskierung des Brugada-Syndroms. Das Brugada-Syndrom ist eine Erkrankung, die durch Synkopen, abnormale elektrokardiographische (EKG) Befunde und das Risiko eines plötzlichen Todes gekennzeichnet ist. Pamelor sollte im Allgemeinen bei Patienten mit Brugada-Syndrom oder solchen mit Verdacht auf Brugada-Syndrom vermieden werden.
Engwinkelglaukom
Die Pupillenerweiterung, die nach der Anwendung vieler Antidepressiva, einschließlich Pamelor 25 mg, auftritt, kann bei einem Patienten mit anatomisch engen Winkeln, der keine offene Iridektomie hat, eine Engwinkelattacke auslösen.
Verwendung in der Schwangerschaft
Die sichere Anwendung von Pamelor während der Schwangerschaft und Stillzeit wurde nicht nachgewiesen; Wenn das Medikament schwangeren Patienten, stillenden Müttern oder Frauen im gebärfähigen Alter verabreicht wird, muss daher der potenzielle Nutzen gegen die möglichen Gefahren abgewogen werden. Reproduktionsstudien an Tieren haben zu nicht schlüssigen Ergebnissen geführt.
VORSICHTSMASSNAHMEN
Informationen für Patienten
Verschreibende Ärzte oder andere Angehörige der Gesundheitsberufe sollten Patienten, ihre Familien und ihre Betreuer über die Vorteile und Risiken einer Behandlung mit Nortriptylinhydrochlorid informieren und sie bezüglich der angemessenen Anwendung beraten. Ein Patient Leitfaden für Medikamente über „Antidepressiva, Depressionen und andere schwere psychische Erkrankungen und Selbstmordgedanken oder -handlungen“ ist für Nortriptylinhydrochlorid verfügbar. Der verschreibende Arzt oder medizinisches Fachpersonal sollte Patienten, ihre Familien und ihre Betreuer anweisen, den Medikationsleitfaden zu lesen, und ihnen helfen, seinen Inhalt zu verstehen. Den Patienten sollte die Möglichkeit gegeben werden, den Inhalt des zu diskutieren Leitfaden für Medikamente und um Antworten auf eventuelle Fragen zu erhalten. Der vollständige Text des Medikationsleitfadens ist am Ende dieses Dokuments abgedruckt.
Die Patienten sollten auf die folgenden Probleme hingewiesen und gebeten werden, ihren verschreibenden Arzt zu informieren, wenn diese während der Einnahme von Nortriptylinhydrochlorid auftreten.
Klinische Verschlechterung und Suizidrisiko
Patienten, ihre Familien und ihre Betreuer sollten ermutigt werden, auf das Auftreten von Angstzuständen, Unruhe, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Unruhe), Hypomanie, Manie und anderen ungewöhnlichen Verhaltensänderungen zu achten , Verschlechterung von Depressionen und Suizidgedanken, besonders früh während der Behandlung mit Antidepressiva und wenn die Dosis nach oben oder unten angepasst wird. Familien und Betreuer von Patienten sollten angewiesen werden, täglich auf das Auftreten solcher Symptome zu achten, da Änderungen abrupt sein können. Solche Symptome sollten dem verschreibenden Arzt oder medizinischen Fachpersonal des Patienten gemeldet werden, insbesondere wenn sie schwerwiegend sind, abrupt einsetzen oder nicht zu den Symptomen des Patienten gehörten. Symptome wie diese können mit einem erhöhten Risiko für Suizidgedanken und -verhalten verbunden sein und weisen auf die Notwendigkeit einer sehr engmaschigen Überwachung und möglicherweise einer Änderung der Medikation hin.
Die Anwendung von Pamelor bei schizophrenen Patienten kann zu einer Verschlimmerung der Psychose führen oder latente schizophrene Symptome aktivieren. Wenn das Arzneimittel überaktiven oder unruhigen Patienten verabreicht wird, können erhöhte Angst und Unruhe auftreten. Bei manisch-depressiven Patienten kann Pamelor Symptome der manischen Phase hervorrufen.
Durch die Anwendung von Pamelor kann eine lästige Patientenfeindlichkeit hervorgerufen werden. Epileptiforme Anfälle können seine Verabreichung begleiten, wie es bei anderen Arzneimitteln seiner Klasse der Fall ist.
Wenn es unbedingt erforderlich ist, kann das Medikament zusammen mit einer Elektrokrampftherapie verabreicht werden, obwohl die Risiken erhöht sein können. Setzen Sie das Medikament, wenn möglich, für einige Tage vor einer elektiven Operation ab.
Die Möglichkeit eines Suizidversuchs eines depressiven Patienten bleibt nach Beginn der Behandlung bestehen; in dieser hinsicht ist es wichtig, dass zu jedem gegebenen zeitpunkt die geringstmögliche menge an medikament abgegeben wird.
Es wurde sowohl über eine Erhöhung als auch über eine Senkung des Blutzuckerspiegels berichtet.
Die Patienten sollten darauf hingewiesen werden, dass die Einnahme von Pamelor 25 mg eine leichte Pupillenerweiterung verursachen kann, die bei empfindlichen Personen zu einem Engwinkelglaukom führen kann. Ein vorbestehendes Glaukom ist fast immer ein Offenwinkelglaukom, da ein Engwinkelglaukom, wenn es diagnostiziert wird, definitiv mit einer Iridektomie behandelt werden kann. Das Offenwinkelglaukom ist kein Risikofaktor für das Engwinkelglaukom. Patienten möchten möglicherweise untersucht werden, um festzustellen, ob sie für Winkelverschluss anfällig sind, und sich einem prophylaktischen Verfahren (z. B. Iridektomie) unterziehen, wenn sie anfällig sind.
Monoaminoxidase-Hemmer (MAO-Hemmer)
(Sehen KONTRAINDIKATIONEN , WARNUNGEN , und DOSIERUNG UND ANWENDUNG .)
Serotonerge Medikamente
(Sehen KONTRAINDIKATIONEN , WARNUNGEN , und DOSIERUNG UND ANWENDUNG .)
Pädiatrische Verwendung
Sicherheit und Wirksamkeit in der pädiatrischen Population wurden nicht nachgewiesen (siehe KASTENWARNUNG und WARNUNGEN , klinische Verschlechterung und Suizidrisiko). Jeder, der die Anwendung von Nortriptylinhydrochlorid bei einem Kind oder Jugendlichen in Betracht zieht, muss die potenziellen Risiken mit der klinischen Notwendigkeit abwägen.
Geriatrische Verwendung
Klinische Studien mit Pamelor schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagieren als jüngere Probanden. Andere berichtete klinische Erfahrungen weisen darauf hin, dass, wie bei anderen trizyklischen Antidepressiva, hepatische Nebenwirkungen (hauptsächlich gekennzeichnet durch Gelbsucht und erhöhte Leberenzymwerte) bei geriatrischen Patienten sehr selten beobachtet werden und Todesfälle im Zusammenhang mit cholestatischen Leberschäden in Einzelfällen berichtet wurden. Die Herz-Kreislauf-Funktion, insbesondere Arrhythmien und Blutdruckschwankungen, sollten überwacht werden. Es gibt auch Berichte über Verwirrtheitszustände nach der Verabreichung trizyklischer Antidepressiva bei älteren Patienten. Bei älteren Patienten wurde auch über höhere Plasmakonzentrationen des aktiven Nortriptylin-Metaboliten 10-Hydroxynortriptylin berichtet. Wie bei anderen trizyklischen Antidepressiva sollte die Dosisauswahl für einen älteren Patienten normalerweise auf die kleinste wirksame Gesamttagesdosis beschränkt werden (siehe DOSIERUNG UND ANWENDUNG ).
ÜBERDOSIS
Todesfälle können durch Überdosierung mit dieser Klasse von Medikamenten auftreten. Die Einnahme mehrerer Arzneimittel (einschließlich Alkohol) ist bei einer absichtlichen Überdosierung trizyklischer Antidepressiva üblich. Da die Behandlung komplex ist und sich ändert, wird empfohlen, dass sich der Arzt an eine Giftinformationszentrale wendet, um aktuelle Informationen zur Behandlung zu erhalten. Anzeichen und Symptome einer Toxizität entwickeln sich nach einer Überdosierung mit trizyklischen Antidepressiva schnell, daher ist eine schnellstmögliche Überwachung im Krankenhaus erforderlich.
Manifestationen
Zu den kritischen Manifestationen einer Überdosierung gehören: Herzrhythmusstörungen, schwere Hypotonie, Schock, dekompensierte Herzinsuffizienz, Lungenödem, Krämpfe und ZNS-Depression, einschließlich Koma. Veränderungen im Elektrokardiogramm, insbesondere in der QRS-Achse oder -Breite, sind klinisch signifikante Indikatoren für die Toxizität trizyklischer Antidepressiva.
Andere Anzeichen einer Überdosierung können sein: Verwirrtheit, Unruhe, Konzentrationsstörungen, vorübergehende visuelle Halluzinationen, erweiterte Pupillen, Erregung, hyperaktive Reflexe, Benommenheit, Schläfrigkeit, Muskelstarre, Erbrechen, Hypothermie, Hyperpyrexie oder eines der unten aufgeführten akuten Symptome NEBENWIRKUNGEN . Es liegen Berichte über Patienten vor, die sich von Nortriptylin-Überdosierungen von bis zu 525 mg erholten.
Management
Allgemein
Erhalten Sie ein EKG und leiten Sie sofort eine Herzüberwachung ein. Schützen Sie die Atemwege des Patienten, legen Sie einen intravenösen Zugang an und leiten Sie eine Magendekontamination ein. Eine mindestens sechsstündige Beobachtung mit Herzüberwachung und Beobachtung auf Anzeichen von ZNS- oder Atemdepression, Hypotonie, Herzrhythmusstörungen und/oder Reizleitungsblockaden und Krampfanfällen ist erforderlich. Wenn zu irgendeinem Zeitpunkt während dieses Zeitraums Anzeichen einer Toxizität auftreten, ist eine erweiterte Überwachung erforderlich. Es gibt Fallberichte von Patienten, die spät nach einer Überdosierung tödlichen Rhythmusstörungen erlagen; Diese Patienten hatten klinische Anzeichen einer signifikanten Vergiftung vor dem Tod und die meisten erhielten eine unzureichende Magen-Darm-Dekontamination. Die Überwachung der Arzneimittelspiegel im Plasma sollte nicht das Management des Patienten leiten.
Magen-Darm-Dekontamination
Alle Patienten mit Verdacht auf eine Überdosierung trizyklischer Antidepressiva sollten eine gastrointestinale Dekontamination erhalten. Dies sollte eine großvolumige Magenspülung gefolgt von Aktivkohle umfassen. Bei Bewusstseinsstörungen sollten die Atemwege vor der Spülung gesichert werden. EMESIS IST KONTRAINDIZIERT.
Herz-Kreislauf
Eine maximale Extremitäten-Ableitungs-QRS-Dauer von ≥ 0,10 Sekunden kann der beste Hinweis auf die Schwere der Überdosierung sein. Natriumbicarbonat sollte intravenös verabreicht werden, um den Serum-pH-Wert im Bereich von 7,45 bis 7,55 zu halten. Wenn die pH-Reaktion unzureichend ist, kann auch Hyperventilation verwendet werden. Die gleichzeitige Anwendung von Hyperventilation und Natriumbikarbonat sollte mit äußerster Vorsicht und häufiger pH-Überwachung erfolgen. Ein pH > 7,60 oder ein pCO
ZNS
Bei Patienten mit ZNS-Depression wird wegen der Möglichkeit einer abrupten Verschlechterung eine frühzeitige Intubation empfohlen. Krampfanfälle sollten mit Benzodiazepinen oder, falls diese unwirksam sind, anderen Antikonvulsiva (z. B. Phenobarbital, Phenytoin) kontrolliert werden. Physostigmin wird nicht empfohlen, außer zur Behandlung von lebensbedrohlichen Symptomen, die auf andere Therapien nicht angesprochen haben, und dann nur in Absprache mit einem Giftinformationszentrum.
Psychiatrische Nachsorge
Da eine Überdosierung oft vorsätzlich erfolgt, können Patienten während der Genesungsphase einen Suizidversuch auf andere Weise unternehmen. Eine psychiatrische Überweisung kann angebracht sein.
Pädiatrisches Management
Die Grundsätze der Behandlung von Überdosierungen bei Kindern und Erwachsenen sind ähnlich. Es wird dringend empfohlen, dass sich der Arzt für eine spezifische pädiatrische Behandlung an das örtliche Giftinformationszentrum wendet.
KONTRAINDIKATIONEN
Monoaminoxidase-Hemmer (MAO-Hemmer)
Die Anwendung von MAO-Hemmern zur Behandlung psychiatrischer Erkrankungen mit Pamelor 25 mg oder innerhalb von 14 Tagen nach Beendigung der Behandlung mit Pamelor 25 mg ist aufgrund eines erhöhten Risikos für ein Serotonin-Syndrom kontraindiziert. Die Anwendung von Pamelor 25 mg innerhalb von 14 Tagen nach Absetzen eines MAO-Hemmers zur Behandlung psychiatrischer Erkrankungen ist ebenfalls kontraindiziert (vgl WARNUNGEN und DOSIERUNG UND ANWENDUNG ).
Der Beginn von Pamelor 25 mg bei einem Patienten, der mit MAO-Hemmern wie Linezolid oder intravenösem Methylenblau behandelt wird, ist ebenfalls kontraindiziert, da ein erhöhtes Risiko für ein Serotonin-Syndrom besteht (siehe WARNUNGEN und DOSIERUNG UND ANWENDUNG ).
Überempfindlichkeit gegen trizyklische Antidepressiva
Eine Kreuzempfindlichkeit zwischen Pamelor und anderen Dibenzazepinen ist möglich.
Herzinfarkt
Pamelor 25 mg ist während der akuten Erholungsphase nach einem Myokardinfarkt kontraindiziert.
KLINISCHE PHARMAKOLOGIE
Der Mechanismus der Stimmungsaufhellung durch trizyklische Antidepressiva ist derzeit unbekannt. Pamelor 25 mg ist kein Monoaminooxidase-Hemmer. Es hemmt die Aktivität so unterschiedlicher Wirkstoffe wie Histamin, 5-Hydroxytryptamin und Acetylcholin. Es erhöht die pressorische Wirkung von Norepinephrin, blockiert aber die pressorische Reaktion von Phenethylamin. Studien deuten darauf hin, dass Pamelor 25 mg den Transport, die Freisetzung und die Speicherung von Katecholaminen stört. Operante Konditionierungstechniken bei Ratten und Tauben deuten darauf hin, dass Pamelor eine Kombination aus stimulierenden und dämpfenden Eigenschaften hat.
INFORMATIONEN ZUM PATIENTEN
Pamelor™ (Nortriptylin HCl) Kapseln USP
Antidepressiva, Depressionen und andere schwere psychische Erkrankungen sowie Selbstmordgedanken oder -handlungen
Lesen Sie den Medikationsleitfaden, der mit dem Antidepressivum von Ihnen oder Ihrem Familienmitglied geliefert wird. In diesem Medikationsleitfaden geht es nur um das Risiko von Selbstmordgedanken und -handlungen mit Antidepressiva.
Sprechen Sie mit Ihrem Gesundheitsdienstleister oder dem Ihres Familienmitglieds über:
Was sind die wichtigsten Informationen, die ich über Antidepressiva, Depressionen und andere schwere psychische Erkrankungen sowie Selbstmordgedanken oder -handlungen wissen sollte?
Rufen Sie sofort einen Arzt an, wenn Sie oder Ihr Familienmitglied eines der folgenden Symptome haben, insbesondere wenn sie neu oder schlimmer sind oder Sie beunruhigen:
Visuelle Probleme
Nur einige Menschen sind für diese Probleme gefährdet. Möglicherweise möchten Sie sich einer Augenuntersuchung unterziehen, um festzustellen, ob Sie gefährdet sind, und eine vorbeugende Behandlung erhalten, wenn dies der Fall ist.
Wer sollte Pamelor nicht einnehmen?
Nehmen Sie Pamelor nicht ein, wenn Sie:
Was muss ich sonst noch über Antidepressiva wissen?
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.