Lexapro 10mg, 20mg, 5mg Escitalopram Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Lexapro und wie wird es angewendet?
Lexapro ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome einer schweren depressiven Störung und einer generalisierten Angststörung. Lexapro kann allein oder mit anderen Medikamenten verwendet werden.
Welche Nebenwirkungen kann Lexapro haben?
Lexapro kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Lexapro gehören:
WARNUNG
SUIZIDALITÄT UND ANTIDEPRESSIONSMITTEL
Antidepressiva erhöhten im Vergleich zu Placebo das Risiko für suizidales Denken und Verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen in Kurzzeitstudien zu Major Depression (MDD) und anderen psychiatrischen Erkrankungen. Jeder, der die Anwendung von Lexapro oder einem anderen Antidepressivum bei einem Kind, Jugendlichen oder jungen Erwachsenen in Betracht zieht, muss dieses Risiko mit der klinischen Notwendigkeit abwägen. Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; Bei Erwachsenen ab 65 Jahren war das Risiko unter Antidepressiva im Vergleich zu Placebo geringer. Depressionen und bestimmte andere psychiatrische Störungen sind selbst mit einem erhöhten Suizidrisiko verbunden. Patienten jeden Alters, die mit einer antidepressiven Therapie begonnen werden, sollten angemessen überwacht und engmaschig auf klinische Verschlechterung, Suizidalität oder ungewöhnliche Verhaltensänderungen beobachtet werden. Familien und Betreuer sollten auf die Notwendigkeit einer genauen Beobachtung und Kommunikation mit dem verschreibenden Arzt hingewiesen werden. Lexapro 5 mg ist nicht für die Anwendung bei pädiatrischen Patienten unter 12 Jahren zugelassen. [Sehen WARNUNGEN UND VORSICHTSMASSNAHMEN Klinische Verschlechterung und Suizidrisiko, INFORMATIONEN ZUM PATIENTEN , und Verwendung in bestimmten Bevölkerungsgruppen : Verwendung in der Pädiatrie].
BEZEICHNUNG
Lexapro® (Escitalopramoxalat) ist ein oral verabreichter selektiver Serotonin-Wiederaufnahmehemmer (SSRI). Escitalopram ist das reine Senantiomer (einziges Isomer) des racemischen bicyclischen Phthalanderivats Citalopram. Escitalopramoxalat wird als S-(+)-1-[3(Dimethylamino)propyl]-1-(p-fluorphenyl)-5-phthalancarbonitriloxalat mit der folgenden Strukturformel bezeichnet:
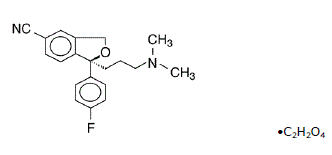
Die Summenformel ist C20H21FN2O • C2H2O4 und das Molekulargewicht ist 414,40.
Escitalopramoxalat liegt als feines, weißes bis leicht gelbes Pulver vor und ist in Methanol und Dimethylsulfoxid (DMSO) gut löslich, in isotonischer Kochsalzlösung löslich, in Wasser und Ethanol schwer löslich, in Ethylacetat schwer löslich und in Heptan unlöslich.
Lexapro (Escitalopramoxalat) ist als Tabletten oder als Lösung zum Einnehmen erhältlich.
Lexapro-Tabletten sind runde Filmtabletten, die Escitalopramoxalat in Stärken enthalten, die 5 mg, 10 mg und 20 mg Escitalopram-Base entsprechen. Die 10- und 20-mg-Tabletten sind mit Bruchkerben versehen. Die Tabletten enthalten außerdem die folgenden Hilfsstoffe: Talkum, Croscarmellose-Natrium, mikrokristalline Cellulose/kolloidales Siliciumdioxid und Magnesiumstearat. Der Filmüberzug enthält Hypromellose, Titandioxid und Polyethylenglycol.
Lexapro 5 mg Lösung zum Einnehmen enthält Escitalopramoxalat entsprechend 1 mg/ml Escitalopram-Base. Es enthält auch die folgenden inaktiven Inhaltsstoffe: Sorbit, gereinigtes Wasser, Zitronensäure, Natriumcitrat, Äpfelsäure, Glycerin, Propylenglycol, Methylparaben, Propylparaben und natürliches Pfefferminzaroma.
INDIKATIONEN
Depression
Lexapro (Escitalopram) ist indiziert zur Akut- und Erhaltungsbehandlung von schweren depressiven Störungen bei Erwachsenen und Jugendlichen im Alter von 12 bis 17 Jahren [siehe Klinische Studien ].
Eine schwere depressive Episode (DSM-IV) impliziert eine auffällige und relativ anhaltende (fast jeden Tag für mindestens 2 Wochen) depressive oder dysphorische Stimmung, die normalerweise das tägliche Funktionieren beeinträchtigt und mindestens fünf der folgenden neun Symptome umfasst: depressive Stimmung, Verlust des Interesses an gewöhnlichen Aktivitäten, erhebliche Gewichts- und/oder Appetitveränderungen, Schlaflosigkeit oder Hypersomnie, psychomotorische Erregung oder Retardierung, erhöhte Müdigkeit, Schuld- oder Wertlosigkeitsgefühle, verlangsamtes Denken oder Konzentrationsstörungen, Selbstmordversuch oder Selbstmordgedanken.
Generalisierte Angststörung
Lexapro 20 mg ist für die Akutbehandlung der generalisierten Angststörung (GAD) bei Erwachsenen indiziert [siehe Klinische Studien ].
Die generalisierte Angststörung (DSM-IV) ist gekennzeichnet durch übermäßige Angst und Sorge (ängstliche Erwartung), die mindestens 6 Monate anhält und die die Person nur schwer kontrollieren kann. Es muss mit mindestens 3 der folgenden Symptome einhergehen: Ruhelosigkeit oder Gefühl der Angespanntheit oder Nervosität, leichte Ermüdbarkeit, Konzentrationsschwierigkeiten oder Leere im Kopf, Reizbarkeit, Muskelverspannungen und Schlafstörungen.
DOSIERUNG UND ANWENDUNG
Lexapro 5 mg sollte einmal täglich morgens oder abends mit oder ohne Nahrung eingenommen werden.
Depression
Erstbehandlung
Jugendliche
Die empfohlene Dosis von Lexapro beträgt 10 mg einmal täglich. Eine Studie mit flexibler Dosierung von Lexapro (10 bis 20 mg/Tag) zeigte die Wirksamkeit von Lexapro [siehe Klinische Studien ]. Wenn die Dosis auf 20 mg erhöht wird, sollte dies nach mindestens drei Wochen erfolgen.
Erwachsene
Die empfohlene Dosis von Lexapro 10 mg beträgt 10 mg einmal täglich. Eine Studie mit fester Dosierung von Lexapro zeigte die Wirksamkeit sowohl von 10 mg als auch von 20 mg Lexapro 5 mg, konnte jedoch keinen größeren Nutzen von 20 mg gegenüber 10 mg nachweisen [siehe Klinische Studien ]. Wenn die Dosis auf 20 mg erhöht wird, sollte dies nach mindestens einer Woche erfolgen.
Erhaltungsbehandlung
Es besteht allgemein Einigkeit darüber, dass akute Episoden einer Major Depression mehrere Monate oder länger einer anhaltenden pharmakologischen Therapie über das Ansprechen auf die akute Episode hinaus erfordern. Eine systematische Bewertung der fortgesetzten Einnahme von Lexapro 10 oder 20 mg/Tag bei erwachsenen Patienten mit Major Depression, die während einer 8-wöchigen Akutbehandlungsphase während der Einnahme von Lexapro darauf ansprachen, zeigte einen Nutzen einer solchen Erhaltungstherapie [siehe Klinische Studien ]. Dennoch sollte der Arzt, der sich für die Anwendung von Lexapro 5 mg über einen längeren Zeitraum entscheidet, den langfristigen Nutzen des Medikaments für den einzelnen Patienten regelmäßig neu bewerten. Die Patienten sollten regelmäßig neu untersucht werden, um die Notwendigkeit einer Erhaltungstherapie zu bestimmen.
Generalisierte Angststörung
Erstbehandlung
Erwachsene
Die empfohlene Anfangsdosis von Lexapro beträgt 10 mg einmal täglich. Wenn die Dosis auf 20 mg erhöht wird, sollte dies nach mindestens einer Woche erfolgen.
Erhaltungsbehandlung
Die generalisierte Angststörung wird als chronische Erkrankung anerkannt. Die Wirksamkeit von Lexapro bei der Behandlung von GAD über 8 Wochen hinaus wurde nicht systematisch untersucht. Der Arzt, der sich für die Anwendung von Lexapro über einen längeren Zeitraum entscheidet, sollte den langfristigen Nutzen des Medikaments für den einzelnen Patienten regelmäßig neu bewerten.
Vor dem Start von Lexapro auf Bipolare Störung untersuchen
Vor Beginn der Behandlung mit Lexapro oder einem anderen Antidepressivum sollten Patienten auf eine persönliche Familienanamnese mit bipolarer Störung, Manie oder Hypomanie untersucht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Besondere Populationen
10 mg/Tag ist die empfohlene Dosis für die meisten älteren Patienten und Patienten mit eingeschränkter Leberfunktion.
Bei Patienten mit leichter oder mittelschwerer Nierenfunktionsstörung ist keine Dosisanpassung erforderlich. Lexapro sollte bei Patienten mit schwerer Nierenfunktionsstörung mit Vorsicht angewendet werden.
Absetzen der Behandlung mit Lexapro
Es wurden Symptome im Zusammenhang mit dem Absetzen von Lexapro 5 mg und anderen SSRIs und SNRIs berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Patienten sollten auf diese Symptome hin überwacht werden, wenn sie die Behandlung abbrechen. Wann immer möglich, wird eine allmähliche Reduzierung der Dosis anstelle eines abrupten Absetzens empfohlen. Wenn nach einer Verringerung der Dosis oder beim Absetzen der Behandlung unerträgliche Symptome auftreten, kann eine Wiederaufnahme der zuvor verschriebenen Dosis in Betracht gezogen werden. Anschließend kann der Arzt die Dosis weiter verringern, jedoch mit einer allmählicheren Rate.
Umstellung eines Patienten auf oder von einem Monoaminoxidase-Hemmer (MAOI) zur Behandlung psychiatrischer Störungen
Zwischen dem Absetzen eines MAO-Hemmers zur Behandlung psychiatrischer Erkrankungen und dem Beginn einer Therapie mit Lexapro sollten mindestens 14 Tage vergehen. Umgekehrt sollten nach dem Absetzen von Lexapro 20 mg mindestens 14 Tage vergehen, bevor mit einem MAOI zur Behandlung psychiatrischer Erkrankungen begonnen wird [siehe KONTRAINDIKATIONEN ].
Verwendung von Lexapro mit anderen MAO-Hemmern wie Linezolid oder Methylenblau
Beginnen Sie die Behandlung mit Lexapro 5 mg nicht bei einem Patienten, der mit Linezolid oder Methylenblau intravenös behandelt wird, da ein erhöhtes Risiko für ein Serotonin-Syndrom besteht. Bei einem Patienten, der eine dringendere Behandlung einer psychiatrischen Erkrankung benötigt, sollten andere Interventionen, einschließlich eines Krankenhausaufenthalts, in Betracht gezogen werden [siehe KONTRAINDIKATIONEN ].
In einigen Fällen kann ein Patient, der bereits mit Lexapro 10 mg behandelt wird, eine dringende Behandlung mit Linezolid oder intravenösem Methylenblau benötigen. Wenn keine akzeptablen Alternativen zur Behandlung mit Linezolid oder intravenösem Methylenblau verfügbar sind und der potenzielle Nutzen einer Behandlung mit Linezolid oder intravenösem Methylenblau die Risiken eines Serotonin-Syndroms bei einem bestimmten Patienten überwiegen, sollte Lexapro unverzüglich abgesetzt und Linezolid oder Methylenblau intravenös verabreicht werden verwaltet werden können. Der Patient sollte 2 Wochen lang oder bis 24 Stunden nach der letzten Dosis von Linezolid oder intravenösem Methylenblau, je nachdem, was zuerst eintritt, auf Symptome des Serotonin-Syndroms überwacht werden. Die Therapie mit Lexapro kann 24 Stunden nach der letzten Dosis von Linezolid oder intravenösem Methylenblau wieder aufgenommen werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Das Risiko der Verabreichung von Methylenblau auf nicht-intravenösem Weg (z. B. als Tabletten zum Einnehmen oder durch lokale Injektion) oder in intravenösen Dosen von viel weniger als 1 mg/kg mit Lexapro 10 mg ist unklar. Der Arzt sollte sich jedoch der Möglichkeit bewusst sein, dass bei einer solchen Anwendung Symptome des Serotonin-Syndroms auftreten können [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
WIE GELIEFERT
Darreichungsformen und Stärken
Tablets
Lexapro 10 mg Tabletten sind runde Filmtabletten, die Escitalopramoxalat in Stärken enthalten, die 5 mg, 10 mg und 20 mg Escitalopram-Base entsprechen. Die 10- und 20-mg-Tabletten sind mit Bruchkerben versehen. Auf der einen Seite mit „FL“ und auf der anderen Seite je nach Stärke mit „5“, „10“ oder „20“ bedruckt.
Mündliche Lösung
Lexapro Lösung zum Einnehmen enthält Escitalopramoxalat entsprechend 1 mg/ml Escitalopram-Base (wird derzeit nicht vermarktet).
Lagerung und Handhabung
Tablets
5 mg Tabletten
Flasche 100 - NDC # 0456-2005-01
Weiß bis cremefarben, rund, nicht gekerbt, filmbeschichtet. Prägen Sie „FL“ auf einer Seite der Tablette und „5“ auf der anderen Seite ein.
10-mg-Tabletten
Flasche 100 - NDC 0456-2010-01 10 x 10 Einzeldosis - NDC # 0456-2010-63
Weiß bis cremefarben, rund, geritzt, filmbeschichtet. Aufdruck auf der gerillten Seite mit „F“ auf der linken Seite und „L“ auf der rechten Seite. Aufdruck auf der nicht geritzten Seite mit „10“.
20 mg Tabletten
Flasche 100 - NDC # 0456-2020-01 10 x 10 Einzeldosis - NDC # 0456-2020-63
Weiß bis cremefarben, rund, geritzt, filmbeschichtet. Aufdruck auf der gerillten Seite mit „F“ auf der linken Seite und „L“ auf der rechten Seite. Aufdruck auf der nicht geritzten Seite mit „20“.
Mündliche Lösung
5 mg/5 ml, Pfefferminzaroma (240 ml) - NDC # 0456-2101-08. Die Lösung zum Einnehmen wird derzeit nicht vermarktet.
Lagerung und Handhabung
Bei 20 °C bis 25 °C (68 °F bis 77 °F) lagern; Exkursionen bis 15 bis 30°C (59° bis 86°F) erlaubt.
Vertrieb durch: Allergan USA, Inc. Madison, NJ 07940. Überarbeitet: September 2021
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien eines Arzneimittels beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Datenquellen für klinische Studien
Pädiatrie (6 -17 Jahre)
Nebenwirkungen wurden bei 576 pädiatrischen Patienten (286 Lexapro 5 mg, 290 Placebo) mit schwerer depressiver Störung in doppelblinden placebokontrollierten Studien erfasst. Die Sicherheit und Wirksamkeit von Lexapro 5 mg bei pädiatrischen Patienten unter 12 Jahren wurde nicht nachgewiesen.
Erwachsene
Informationen zu Nebenwirkungen von Lexapro 5 mg wurden von 715 Patienten mit schwerer depressiver Störung, die Escitalopram erhielten, und von 592 Patienten, die Placebo in doppelblinden, placebokontrollierten Studien erhielten, gesammelt. Weitere 284 Patienten mit Major Depression wurden in offenen Studien neu mit Escitalopram behandelt. Die Informationen zu Nebenwirkungen von Lexapro bei Patienten mit GAD wurden von 429 Patienten, die Escitalopram und 427 Patienten, die Placebo erhielten, in doppelblinden, placebokontrollierten Studien erhalten.
Unerwünschte Ereignisse während der Exposition wurden in erster Linie durch allgemeine Anfragen ermittelt und von klinischen Prüfern unter Verwendung einer Terminologie ihrer eigenen Wahl aufgezeichnet. Folglich ist es nicht möglich, eine aussagekräftige Schätzung des Anteils der Personen anzugeben, bei denen unerwünschte Ereignisse auftreten, ohne zuerst ähnliche Arten von Ereignissen in eine kleinere Anzahl standardisierter Ereigniskategorien einzuteilen. In den folgenden Tabellen und Tabellen wurde die Standardterminologie der Weltgesundheitsorganisation (WHO) verwendet, um gemeldete unerwünschte Ereignisse zu klassifizieren.
Die angegebenen Häufigkeiten von Nebenwirkungen stellen den Anteil der Personen dar, bei denen mindestens einmal ein behandlungsbedingtes unerwünschtes Ereignis der aufgeführten Art aufgetreten ist. Ein Ereignis wurde als behandlungsbedingt angesehen, wenn es zum ersten Mal auftrat oder sich während der Therapie nach der Ausgangsbewertung verschlechterte.
Unerwünschte Ereignisse im Zusammenhang mit dem Abbruch der Behandlung
Depression
Pädiatrie (6 -17 Jahre)
Bei 3,5 % von 286 Patienten, die Lexapro erhielten, und bei 1 % von 290 Patienten, die Placebo erhielten, waren Nebenwirkungen mit dem Absetzen verbunden. Die häufigste Nebenwirkung (Inzidenz mindestens 1 % für Lexapro 10 mg und mehr als Placebo) im Zusammenhang mit dem Absetzen war Schlaflosigkeit (1 % Lexapro, 0 % Placebo).
Erwachsene
Von den 715 depressiven Patienten, die Lexapro in Placebo-kontrollierten Studien erhielten, brachen 6 % die Behandlung aufgrund eines unerwünschten Ereignisses ab, im Vergleich zu 2 % von 592 Patienten, die Placebo erhielten. In zwei Studien mit fester Dosierung unterschied sich die Abbruchrate wegen unerwünschter Ereignisse bei Patienten, die 10 mg/Tag Lexapro 20 mg erhielten, nicht signifikant von der Abbruchrate wegen unerwünschter Ereignisse bei Patienten, die Placebo erhielten. Die Abbruchrate wegen unerwünschter Ereignisse bei Patienten, denen eine Fixdosis von 20 mg/Tag Lexapro zugewiesen wurde, betrug 10 %, was signifikant anders war als die Abbruchrate wegen unerwünschter Ereignisse bei Patienten, die 10 mg/Tag Lexapro (4 %) und Placebo erhielten (3%). Unerwünschte Ereignisse, die mit dem Absetzen von mindestens 1 % der mit Lexapro 5 mg behandelten Patienten einhergingen und bei denen die Häufigkeit mindestens doppelt so hoch war wie bei Placebo, waren Übelkeit (2 %) und Ejakulationsstörungen (2 % der männlichen Patienten).
Generalisierte Angststörung
Erwachsene
Von den 429 GAD-Patienten, die Lexapro 10–20 mg/Tag in placebokontrollierten Studien erhielten, brachen 8 % die Behandlung aufgrund eines unerwünschten Ereignisses ab, im Vergleich zu 4 % der 427 Patienten, die Placebo erhielten. Nebenwirkungen, die mit dem Absetzen von mindestens 1 % der mit Lexapro 20 mg behandelten Patienten einhergingen und bei denen die Rate mindestens doppelt so hoch war wie die Placeborate, waren Übelkeit (2 %), Schlaflosigkeit (1 %) und Müdigkeit (1 %).
Häufigkeit von Nebenwirkungen in Placebo-kontrollierten klinischen Studien
Depression
Pädiatrie (6 -17 Jahre)
Das Gesamtprofil der Nebenwirkungen bei pädiatrischen Patienten war im Allgemeinen ähnlich wie in Studien mit Erwachsenen, wie in Tabelle 2 gezeigt. Die folgenden Nebenwirkungen (mit Ausnahme der in Tabelle 2 aufgeführten und derjenigen, für die die kodierten Begriffe nicht informativ oder irreführend waren, traten jedoch auf ) wurden mit einer Inzidenz von mindestens 2 % unter Lexapro und häufiger als unter Placebo berichtet: Rückenschmerzen, Harnwegsinfektionen, Erbrechen und verstopfte Nase.
Erwachsene
Die am häufigsten beobachteten Nebenwirkungen bei Patienten mit Lexapro 10 mg (Inzidenz von etwa 5 % oder mehr und etwa doppelt so häufig wie bei Placebo-Patienten) waren Schlaflosigkeit, Ejakulationsstörung (hauptsächlich Ejakulationsverzögerung), Übelkeit, vermehrtes Schwitzen, Müdigkeit und Somnolenz.
Tabelle 2 führt die auf den nächsten Prozentsatz gerundete Inzidenz von behandlungsbedingten unerwünschten Ereignissen auf, die bei 715 depressiven Patienten auftraten, die Lexapro 20 mg in Dosen von 10 bis 20 mg/Tag in Placebo-kontrollierten Studien erhielten. Eingeschlossen sind Ereignisse, die bei 2 % oder mehr der mit Lexapro 20 mg behandelten Patienten auftraten und deren Inzidenz bei mit Lexapro 10 mg behandelten Patienten größer war als die Inzidenz bei mit Placebo behandelten Patienten.
TABELLE 2 Behandlungsbedingte Nebenwirkungen, die bei Major Depression mit einer Häufigkeit von ≥ 2 % und häufiger als unter Placebo beobachtet wurden
Generalisierte Angststörung
Erwachsene
Die am häufigsten beobachteten Nebenwirkungen bei Lexapro-Patienten (Inzidenz von etwa 5 % oder mehr und etwa doppelt so häufig wie bei Placebo-Patienten) waren Übelkeit, Ejakulationsstörung (hauptsächlich Ejakulationsverzögerung), Schlaflosigkeit, Müdigkeit, verminderte Libido und Anorgasmie.
listet die auf den nächsten Prozentsatz gerundete Inzidenz der behandlungsbedingten unerwünschten Ereignisse auf, die bei 429 GAD-Patienten auftraten, die Lexapro 10 bis 20 mg/Tag in Placebo-kontrollierten Studien erhielten. Eingeschlossen sind Ereignisse, die bei 2 % oder mehr der mit Lexapro behandelten Patienten auftraten und deren Inzidenz bei mit Lexapro behandelten Patienten größer war als die Inzidenz bei mit Placebo behandelten Patienten.
TABELLE 3 Behandlungsbedingte Nebenwirkungen, die bei generalisierten Angststörungen mit einer Häufigkeit von ≥ 2 % und häufiger als unter Placebo beobachtet wurden
Dosisabhängigkeit von Nebenwirkungen
Die potenzielle Dosisabhängigkeit häufiger Nebenwirkungen (definiert als eine Inzidenzrate von ≥ 5 % in der 10-mg- oder 20-mg-Gruppe von Lexapro) wurde auf der Grundlage der kombinierten Inzidenz von Nebenwirkungen in zwei Studien mit fester Dosierung untersucht. Die Gesamtinzidenzrate von unerwünschten Ereignissen bei mit 10 mg Lexapro behandelten Patienten (66 %) war ähnlich wie bei den mit Placebo behandelten Patienten (61 %), während die Inzidenzrate bei mit 20 mg/Tag Lexapro behandelten Patienten höher war (86 %). Tabelle 4 zeigt häufige Nebenwirkungen, die in der Gruppe mit 20 mg/Tag Lexapro mit einer Inzidenz auftraten, die etwa doppelt so hoch war wie in der Gruppe mit 10 mg/Tag Lexapro 10 mg und etwa doppelt so hoch wie in der Placebo-Gruppe.
TABELLE 4 Häufigkeit häufiger Nebenwirkungen bei Patienten mit Major Depression
Männliche und weibliche sexuelle Dysfunktion mit SSRIs
Obwohl Veränderungen des sexuellen Verlangens, der sexuellen Leistung und der sexuellen Befriedigung häufig als Manifestationen einer psychiatrischen Störung auftreten, können sie auch eine Folge einer pharmakologischen Behandlung sein. Insbesondere deuten einige Hinweise darauf hin, dass SSRIs solche unerwünschten sexuellen Erfahrungen verursachen können.
Zuverlässige Schätzungen der Häufigkeit und des Schweregrades unerwünschter Erfahrungen im Zusammenhang mit sexuellem Verlangen, sexueller Leistung und Befriedigung sind jedoch schwierig zu erhalten, zum Teil, weil Patienten und Ärzte möglicherweise zögern, darüber zu sprechen. Dementsprechend ist es wahrscheinlich, dass Schätzungen der Häufigkeit von unerwünschten sexuellen Erfahrungen und Verhaltensweisen, die in der Produktkennzeichnung angegeben werden, ihre tatsächliche Häufigkeit unterschätzen.
TABELLE 5 Häufigkeit sexueller Nebenwirkungen in Placebo-kontrollierten klinischen Studien
Es gibt keine angemessen konzipierten Studien, die sexuelle Funktionsstörungen bei einer Behandlung mit Escitalopram untersuchen.
Priapismus wurde bei allen SSRIs berichtet.
Obwohl es schwierig ist, das genaue Risiko einer sexuellen Dysfunktion im Zusammenhang mit der Anwendung von SSRIs zu kennen, sollten sich Ärzte routinemäßig nach solchen möglichen Nebenwirkungen erkundigen.
Veränderungen der Vitalzeichen
Lexapro 5 mg und Placebo-Gruppen wurden im Hinblick auf (1) die mittlere Veränderung der Vitalzeichen (Puls, systolischer Blutdruck und diastolischer Blutdruck) gegenüber dem Ausgangswert und (2) die Inzidenz von Patienten, die die Kriterien für potenziell klinisch signifikante Veränderungen gegenüber dem Ausgangswert erfüllten, verglichen diese Variablen. Diese Analysen ergaben keine klinisch bedeutsamen Veränderungen der Vitalfunktionen im Zusammenhang mit der Behandlung mit Lexapro 20 mg. Darüber hinaus zeigte ein Vergleich der Vitalfunktionen im Liegen und im Stehen bei Probanden, die Lexapro 20 mg erhielten, dass die Lexapro-Behandlung nicht mit orthostatischen Veränderungen verbunden ist.
Gewichtsänderungen
Patienten, die in kontrollierten Studien mit Lexapro behandelt wurden, unterschieden sich hinsichtlich klinisch bedeutsamer Veränderungen des Körpergewichts nicht von Patienten, die mit Placebo behandelt wurden.
Änderungen im Labor
Lexapro-5-mg- und Placebo-Gruppen wurden in Bezug auf (1) die mittlere Veränderung gegenüber dem Ausgangswert bei verschiedenen Serumchemie-, Hämatologie- und Urinanalyse-Variablen und (2) die Inzidenz von Patienten, die die Kriterien für potenziell klinisch signifikante Veränderungen gegenüber dem Ausgangswert bei diesen Variablen erfüllten, verglichen. Diese Analysen ergaben keine klinisch bedeutsamen Veränderungen der Labortestparameter im Zusammenhang mit der Behandlung mit Lexapro.
EKG-Veränderungen
Elektrokardiogramme der Lexapro- (N=625) und der Placebo-Gruppe (N=527) wurden in Bezug auf Ausreißer verglichen, die als Patienten mit QTc-Änderungen über 60 ms vom Ausgangswert oder absoluten Werten über 500 ms nach der Einnahme und Patienten mit Herzfrequenzanstieg auf definiert wurden über 100 bpm oder sinkt auf weniger als 50 bpm mit einer Änderung von 25 % gegenüber dem Ausgangswert (jeweils tachykarde oder bradykarde Ausreißer). Keiner der Patienten in der Gruppe mit 20 mg Lexapro hatte ein QTcF-Intervall von > 500 ms oder eine Verlängerung von > 60 ms im Vergleich zu 0,2 % der Patienten in der Placebogruppe. Die Inzidenz tachykarder Ausreißer betrug 0,2 % in der Lexapro 5 mg- und der Placebo-Gruppe. Die Inzidenz bradykarder Ausreißer betrug 0,5 % in der Lexapro 10 mg-Gruppe und 0,2 % in der Placebo-Gruppe.
Das QTcF-Intervall wurde in einer randomisierten, Placebo- und aktiv (Moxifloxacin 400 mg) kontrollierten Crossover-Studie mit eskalierender Mehrfachdosis bei 113 gesunden Probanden bewertet. Der maximale mittlere (95 % obere Konfidenzgrenze) Unterschied zum Placebo-Arm betrug 4,5 (6,4) bzw. 10,7 (12,7) ms für 10 mg bzw. 30 mg supratherapeutisches Escitalopram einmal täglich. Basierend auf der etablierten Expositions-Wirkungs-Beziehung beträgt die vorhergesagte QTcF-Änderung gegenüber dem Placebo-Arm (95 % Konfidenzintervall) unter der Cmax für die Dosis von 20 mg 6,6 (7,9) ms. Escitalopram 30 mg einmal täglich führte zu einer mittleren Cmax, die 1,7-fach höher war als die mittlere Cmax für die maximal empfohlene therapeutische Dosis im Steady State (20 mg). Die Exposition unter einer supratherapeutischen 30-mg-Dosis ist ähnlich den Steady-State-Konzentrationen, die bei langsamen CYP2C19-Metabolisierern nach einer therapeutischen Dosis von 20 mg erwartet werden.
Andere Reaktionen, die während der Premarketing-Evaluierung von Lexapro beobachtet wurden
Im Folgenden finden Sie eine Liste der behandlungsbedingten unerwünschten Ereignisse, wie in der Einleitung zum beschrieben NEBENWIRKUNGEN Abschnitt, berichtet von den 1428 Patienten, die mit Lexapro für Zeiträume von bis zu einem Jahr in doppelblinden oder offenen klinischen Studien während der Premarketing-Bewertung behandelt wurden. Die Liste umfasst nicht jene Ereignisse, die bereits in den Ereignissen aufgeführt sind, für die eine medikamentöse Ursache gering war und mit einer Rate von weniger als 1 % oder niedriger als bei Placebo, solche Ereignisse, die so allgemein waren, dass sie nicht aussagekräftig waren, und solche Ereignisse, die nur einmal berichtet wurden keine erhebliche Wahrscheinlichkeit, akut lebensbedrohlich zu sein. Ereignisse werden nach Körpersystem kategorisiert. Ereignisse von großer klinischer Bedeutung sind im beschrieben WARNUNGEN UND VORSICHTSMASSNAHMEN Sektion.
Herz-Kreislauf -Bluthochdruck, Herzklopfen.
Erkrankungen des zentralen und peripheren Nervensystems - Benommenheit, Migräne.
Gastrointestinale Störungen - Bauchkrämpfe, Sodbrennen, Gastroenteritis.
Allgemein - Allergie, Brustschmerzen, Fieber, Hitzewallungen, Gliederschmerzen.
Stoffwechsel- und Ernährungsstörungen - erhöhtes Gewicht.
Erkrankungen des Bewegungsapparates - Arthralgie, Myalgie Kiefersteifheit.
Psychische Störungen Appetit gesteigert, Konzentrationsstörungen, Reizbarkeit.
Fortpflanzungsstörungen/Frauen - Menstruationsbeschwerden, Menstruationsstörung.
Erkrankungen der Atemwege - Bronchitis, Husten, verstopfte Nase, verstopfte Nebenhöhlen, Kopfschmerzen in den Nebenhöhlen.
Erkrankungen der Haut und Anhängsel - Ausschlag.
Besondere Sinne - verschwommenes Sehen, Tinnitus.
Erkrankungen des Harnsystems - häufiges Wasserlassen, Harnwegsinfektion.
Post-Marketing-Erfahrung
Nebenwirkungen, die nach der Vermarktung von Escitalopram berichtet wurden
Die folgenden Nebenwirkungen wurden während der Anwendung von Lexapro nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Erkrankungen des Blut- und Lymphsystems: Anämie, Agranulozytis, aplastische Anämie, hämolytische Anämie, idiopathische Thrombozytopenie purpura, Leukopenie, Thrombozytopenie.
Herzerkrankungen: Vorhofflimmern, Bradykardie, Herzinsuffizienz, Myokardinfarkt, Tachykardie, Torsade de Pointes, ventrikuläre Arrhythmie, ventrikuläre Tachykardie.
Erkrankungen des Ohrs und des Labyrinths: Schwindel
Endokrine Störungen: Diabetes mellitus, Hyperprolaktinämie, SIADH.
Augenerkrankungen: Engwinkelglaukom, Diplopie, Mydriasis, Sehstörung.
Magen-Darm-Störung: Dysphagie, gastrointestinale Blutung, gastroösophagealer Reflux, Pankreatitis, rektale Blutung.
Allgemeine Erkrankungen und Bedingungen am Verabreichungsort: anormaler Gang, Asthenie, Ödeme, Stürze, anormales Gefühl, Unwohlsein.
Leber- und Gallenerkrankungen: fulminante Hepatitis, Leberversagen, Lebernekrose, Hepatitis.
Erkrankungen des Immunsystems: allergische Reaktion, Anaphylaxie.
Untersuchungen: Bilirubin erhöht, Gewichtsabnahme, EKG-QT-Verlängerung, Leberenzyme erhöht, Hypercholesterinämie, INR erhöht, Prothrombin erniedrigt.
Stoffwechsel- und Ernährungsstörungen: Hyperglykämie, Hypoglykämie, Hypokaliämie, Hyponatriämie.
Erkrankungen des Bewegungsapparates und des Bindegewebes: Muskelkrämpfe, Muskelsteifheit, Muskelschwäche, Rhabdomyolyse.
Erkrankungen des Nervensystems: Akathisie, Amnesie, Ataxie, Choreoathetose, Schlaganfall, Dysarthrie, Dyskinesie, Dystonie, extrapyramidale Störungen, Grand-Mal-Anfälle (oder Krämpfe), Hypästhesie, Myoklonus, Nystagmus, Parkinsonismus, Restless Legs, Krampfanfälle, Synkope, tardive Dyskinesie, Tremor.
Schwangerschaft, Wochenbett und perinatale Erkrankungen: spontane Abtreibung.
Psychische Störungen: akute Psychose, Aggression, Erregung, Wut, Angst, Apathie, vollendeter Selbstmord, Verwirrtheit, Depersonalisation, verschlimmerte Depression, Delirium, Wahnvorstellungen, Orientierungslosigkeit, Unwirklichkeitsgefühl, Halluzinationen (visuell und auditiv), Stimmungsschwankungen, Nervosität, Alptraum, Panikreaktion, Paranoia , Ruhelosigkeit, Selbstverletzung oder Gedanken an Selbstverletzung, Suizidversuch, Suizidgedanken, suizidale Tendenz.
Nieren- und Harnwegserkrankungen: akutes Nierenversagen, Dysurie, Harnverhalt.
Störungen des Fortpflanzungssystems und der Brust: Menorrhagie, Priapismus.
Erkrankungen der Atemwege, des Brustraums und des Mediastinums: Dyspnoe, Epistaxis, Lungenembolie, pulmonale Hypertonie des Neugeborenen. Erkrankungen der Haut und des Unterhautzellgewebes: Alopezie, Angioödem, Dermatitis, Ekchymose, Erythema multiforme, Lichtempfindlichkeitsreaktion, Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, Urtikaria.
Gefäßerkrankungen: tiefe Venenthrombose, Hautrötung, hypertensive Krise, Hypotonie, orthostatische Hypotonie, Phlebitis, Thrombose.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Monoaminoxidase-Hemmer (MAO-Hemmer)
[Sehen DOSIERUNG UND ANWENDUNG und , KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Serotonerge Medikamente
[Sehen DOSIERUNG UND ANWENDUNG und , KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Triptane
Es gab seltene Postmarketing-Berichte über ein Serotonin-Syndrom bei der Anwendung eines SSRI und eines Triptans. Wenn die gleichzeitige Behandlung von Lexapro 10 mg mit einem Triptan klinisch gerechtfertigt ist, wird eine sorgfältige Überwachung des Patienten empfohlen, insbesondere zu Beginn der Behandlung und bei Dosiserhöhungen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
ZNS-Medikamente
Angesichts der primären ZNS-Wirkungen von Escitalopram ist Vorsicht geboten, wenn es in Kombination mit anderen zentral wirkenden Arzneimitteln eingenommen wird.
Alkohol
Obwohl Lexapro die kognitiven und motorischen Wirkungen von Alkohol in einer klinischen Studie nicht potenziert hat, wird wie bei anderen Psychopharmaka der Konsum von Alkohol durch Patienten, die Lexapro einnehmen, nicht empfohlen.
Medikamente, die die Hämostase beeinträchtigen (NSAIDs, Aspirin, Warfarin usw.)
Die Serotoninfreisetzung durch Blutplättchen spielt eine wichtige Rolle bei der Hämostase. Epidemiologische Studien des Fall-Kontroll- und Kohorten-Designs, die einen Zusammenhang zwischen der Einnahme von Psychopharmaka, die die Serotonin-Wiederaufnahme beeinträchtigen, und dem Auftreten von Blutungen im oberen Gastrointestinaltrakt gezeigt haben, haben auch gezeigt, dass die gleichzeitige Einnahme von NSAR oder Aspirin das Blutungsrisiko potenzieren kann. Bei gleichzeitiger Gabe von SSRIs und SNRIs mit Warfarin wurde über veränderte gerinnungshemmende Wirkungen, einschließlich verstärkter Blutungen, berichtet. Patienten, die eine Warfarin-Therapie erhalten, sollten sorgfältig überwacht werden, wenn Lexapro begonnen oder abgesetzt wird.
Cimetidin
Bei Probanden, die 21 Tage lang 40 mg/Tag racemisches Citalopram erhalten hatten, führte die kombinierte Gabe von 400 mg Cimetidin zweimal täglich über 8 Tage zu einem Anstieg der AUC und Cmax von Citalopram um 43 % bzw. 39 %. Die klinische Bedeutung dieser Befunde ist nicht bekannt.
Digoxin
Bei Patienten, die 21 Tage lang 40 mg/Tag racemisches Citalopram erhalten hatten, hatte die kombinierte Gabe von Citalopram und Digoxin (Einzeldosis von 1 mg) keinen signifikanten Einfluss auf die Pharmakokinetik von Citalopram oder Digoxin.
Lithium
Die gleichzeitige Verabreichung von racemischem Citalopram (40 mg/Tag für 10 Tage) und Lithium (30 mmol/Tag für 5 Tage) hatte keine signifikante Wirkung auf die Pharmakokinetik von Citalopram oder Lithium. Dennoch sollten die Plasma-Lithiumspiegel mit entsprechender Anpassung der Lithiumdosis gemäß der klinischen Standardpraxis überwacht werden. Da Lithium die serotonergen Wirkungen von Escitalopram verstärken kann, ist bei gleichzeitiger Anwendung von Lexapro 5 mg und Lithium Vorsicht geboten.
Pimozid und Celexa
In einer kontrollierten Studie war eine Einzeldosis von 2 mg Pimozid zusammen mit racemischem Citalopram 40 mg einmal täglich über 11 Tage mit einem mittleren Anstieg der QTc-Werte von etwa 10 ms im Vergleich zur alleinigen Gabe von Pimozid verbunden. Racemisches Citalopram veränderte die mittlere AUC oder Cmax von Pimozid nicht. Der Mechanismus dieser pharmakodynamischen Wechselwirkung ist nicht bekannt.
Sumatriptan
Es gab seltene Postmarketing-Berichte, in denen Patienten mit Schwäche, Hyperreflexie und Koordinationsstörungen nach der Anwendung eines SSRI und Sumatriptan beschrieben wurden. Wenn eine gleichzeitige Behandlung mit Sumatriptan und einem SSRI (z. B. Fluoxetin, Fluvoxamin, Paroxetin, Sertralin, Citalopram, Escitalopram) klinisch gerechtfertigt ist, wird eine angemessene Überwachung des Patienten empfohlen.
Theophyllin
Die kombinierte Gabe von racemischem Citalopram (40 mg/Tag über 21 Tage) und dem CYP1A2-Substrat Theophyllin (Einzeldosis von 300 mg) hatte keinen Einfluss auf die Pharmakokinetik von Theophyllin. Die Wirkung von Theophyllin auf die Pharmakokinetik von Citalopram wurde nicht untersucht.
Warfarin
Die Verabreichung von 40 mg/Tag racemischem Citalopram über 21 Tage hatte keinen Einfluss auf die Pharmakokinetik von Warfarin, einem CYP3A4-Substrat. Die Prothrombinzeit war um 5 % erhöht, deren klinische Bedeutung unbekannt ist.
Carbamazepin
Die kombinierte Gabe von racemischem Citalopram (40 mg/Tag über 14 Tage) und Carbamazepin (titriert auf 400 mg/Tag über 35 Tage) hatte keinen signifikanten Einfluss auf die Pharmakokinetik von Carbamazepin, einem CYP3A4-Substrat. Obwohl die Citalopram-Talspiegel im Plasma nicht beeinflusst wurden, sollte angesichts der enzyminduzierenden Eigenschaften von Carbamazepin die Möglichkeit in Betracht gezogen werden, dass Carbamazepin die Clearance von Escitalopram erhöht, wenn die beiden Arzneimittel gleichzeitig verabreicht werden.
Triazolam
Die kombinierte Gabe von racemischem Citalopram (titriert auf 40 mg/Tag für 28 Tage) und dem CYP3A4-Substrat Triazolam (Einzeldosis von 0,25 mg) hatte keinen signifikanten Einfluss auf die Pharmakokinetik von Citalopram oder Triazolam.
Ketoconazol
Die kombinierte Gabe von racemischem Citalopram (40 mg) und Ketoconazol (200 mg), einem starken CYP3A4-Hemmer, senkte die Cmax und AUC von Ketoconazol um 21 % bzw. 10 % und beeinflusste die Pharmakokinetik von Citalopram nicht signifikant.
Ritonavir
Die kombinierte Gabe einer Einzeldosis Ritonavir (600 mg), sowohl ein CYP3A4-Substrat als auch ein starker Inhibitor von CYP3A4, und Escitalopram (20 mg) hatte keinen Einfluss auf die Pharmakokinetik von Ritonavir oder Escitalopram.
CYP3A4- und -2C19-Inhibitoren
In-vitro-Studien zeigten, dass CYP3A4 und -2C19 die primären Enzyme sind, die am Metabolismus von Escitalopram beteiligt sind. Die gleichzeitige Verabreichung von Escitalopram (20 mg) und Ritonavir (600 mg), einem potenten CYP3A4-Inhibitor, hatte jedoch keinen signifikanten Einfluss auf die Pharmakokinetik von Escitalopram. Da Escitalopram von mehreren Enzymsystemen metabolisiert wird, kann die Hemmung eines einzelnen Enzyms die Clearance von Escitalopram nicht nennenswert verringern.
Medikamente, die durch Cytochrom P4502D6 metabolisiert werden
In-vitro-Studien zeigten keine inhibitorische Wirkung von Escitalopram auf CYP2D6. Darüber hinaus waren die Steady-State-Spiegel von racemischem Citalopram bei langsamen Metabolisierern und schnellen CYP2D6-Metabolisierern nach mehrfacher Gabe von Citalopram nicht signifikant unterschiedlich, was darauf hindeutet, dass die gleichzeitige Verabreichung eines Arzneimittels, das CYP2D6 hemmt, mit Escitalopram wahrscheinlich keine klinisch signifikanten Auswirkungen auf hat Metabolismus von Escitalopram. Es liegen jedoch begrenzte In-vivo-Daten vor, die auf eine mäßige CYP2D6-Hemmwirkung von Escitalopram hindeuten, dh die gleichzeitige Verabreichung von Escitalopram (20 mg/Tag über 21 Tage) mit dem trizyklischen Antidepressivum Desipramin (Einzeldosis von 50 mg), einem Substrat für CYP2D6, resultierte in einer 40 %igen Erhöhung der Cmax und einer 100 %igen Erhöhung der AUC von Desipramin. Die klinische Bedeutung dieses Befundes ist nicht bekannt. Dennoch ist bei der gleichzeitigen Anwendung von Escitalopram und Arzneimitteln, die durch CYP2D6 metabolisiert werden, Vorsicht geboten.
Metoprolol
Die Verabreichung von 20 mg/Tag Lexapro 20 mg über 21 Tage bei gesunden Probanden führte zu einer 50 %igen Erhöhung der Cmax und einer 82 %igen Erhöhung der AUC des beta-adrenergen Blockers Metoprolol (gegeben in einer Einzeldosis von 100 mg). Erhöhte Metoprolol-Plasmaspiegel wurden mit einer verminderten Kardioselektivität in Verbindung gebracht. Die gleichzeitige Verabreichung von Lexapro 5 mg und Metoprolol hatte keine klinisch signifikanten Auswirkungen auf den Blutdruck oder die Herzfrequenz.
Elektrokrampftherapie (ECT)
Es liegen keine klinischen Studien zur kombinierten Anwendung von ECT und Escitalopram vor.
Drogenmissbrauch und -abhängigkeit
Missbrauch und Abhängigkeit
Physische und psychische Abhängigkeit
Tierstudien deuten darauf hin, dass die Missbrauchsneigung von racemischem Citalopram gering ist. Lexapro 10 mg wurde beim Menschen nicht systematisch auf sein Potenzial für Missbrauch, Toleranz oder körperliche Abhängigkeit untersucht. Die klinischen Erfahrungen vor der Markteinführung mit Lexapro zeigten kein Suchtverhalten. Diese Beobachtungen waren jedoch nicht systematisch, und es ist auf der Grundlage dieser begrenzten Erfahrung nicht möglich, das Ausmaß vorherzusagen, in dem ein ZNS-aktives Medikament nach seiner Markteinführung missbraucht, abgezweigt und/oder missbraucht wird. Folglich sollten Ärzte Lexapro-Patienten sorgfältig auf Drogenmissbrauch in der Vorgeschichte untersuchen und solche Patienten engmaschig überwachen und sie auf Anzeichen von Missbrauch oder Missbrauch (z. B. Entwicklung einer Toleranz, Erhöhung der Dosis, Suchtverhalten) beobachten.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Suizidgedanken und -verhalten bei Jugendlichen und jungen Erwachsenen
In gepoolten Analysen placebokontrollierter Studien mit Antidepressiva (SSRIs und andere Antidepressiva-Klassen), an denen etwa 77.000 erwachsene Patienten und 4.500 pädiatrische Patienten teilnahmen, war die Häufigkeit von Suizidgedanken und -verhalten bei den mit Antidepressiva behandelten Patienten im Alter von 24 Jahren und jünger größer als bei mit Placebo behandelten Patienten. Es gab beträchtliche Unterschiede im Risiko für Selbstmordgedanken und -verhalten unter den Medikamenten, aber bei jungen Patienten wurde für die meisten untersuchten Medikamente ein erhöhtes Risiko festgestellt. Es gab Unterschiede im absoluten Risiko für Suizidgedanken und -verhalten bei den verschiedenen Indikationen, mit der höchsten Inzidenz bei Patienten mit MDD. Die Arzneimittel-Placebo-Unterschiede in der Anzahl der Fälle von Suizidgedanken und -verhalten pro 1000 behandelten Patienten sind angegeben
Es ist nicht bekannt, ob das Risiko von Suizidgedanken und -verhalten bei Kindern, Jugendlichen und jungen Erwachsenen auch bei längerfristiger Anwendung, dh über vier Monate hinaus, besteht. Aus Placebo-kontrollierten Erhaltungsstudien bei Erwachsenen mit MDD gibt es jedoch erhebliche Hinweise darauf, dass Antidepressiva das Wiederauftreten von Depressionen verzögern und dass Depressionen selbst ein Risikofaktor für Selbstmordgedanken und -verhalten sind.
Überwachen Sie alle mit Antidepressiva behandelten Patienten auf Anzeichen einer klinischen Verschlechterung und des Auftretens von Suizidgedanken und -verhalten, insbesondere während der ersten paar Monate der Arzneimitteltherapie und zu Zeiten von Dosisänderungen. Beraten Sie Familienmitglieder oder Betreuer von Patienten, um auf Verhaltensänderungen zu achten und den Gesundheitsdienstleister zu warnen. Erwägen Sie eine Änderung des therapeutischen Schemas, einschließlich eines möglichen Absetzens von Lexapro, bei Patienten, deren Depression sich anhaltend verschlimmert oder die aufkommende Suizidgedanken oder -verhalten zeigen.
Serotonin-Syndrom
Die Entwicklung eines potenziell lebensbedrohlichen Serotoninsyndroms wurde mit SNRIs und SSRIs, einschließlich Lexapro, allein, aber insbesondere bei gleichzeitiger Anwendung anderer serotonerger Arzneimittel (einschließlich Triptane, trizyklische Antidepressiva, Fentanyl, Lithium, Tramadol, Tryptophan, Buspiron, Amphetamine, und Johanniskraut) und mit Arzneimitteln, die den Serotoninstoffwechsel beeinträchtigen (insbesondere MAO-Hemmer, sowohl solche, die zur Behandlung psychiatrischer Erkrankungen bestimmt sind, als auch andere, wie Linezolid und intravenöses Methylenblau).
Zu den Symptomen des Serotonin-Syndroms können Veränderungen des mentalen Status (z. B. Unruhe, Halluzinationen, Delirium und Koma), autonome Instabilität (z. B. Tachykardie, labiler Blutdruck, Schwindel, Diaphorese, Hitzewallungen, Hyperthermie), neuromuskuläre Symptome (z. B. Tremor, Steifheit, Myoklonus, Hyperreflexie, Koordinationsstörungen) Krampfanfälle und/oder gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Durchfall). Die Patienten sollten auf das Auftreten eines Serotonin-Syndroms überwacht werden.
Die gleichzeitige Anwendung von Lexapro 10 mg mit MAO-Hemmern zur Behandlung psychiatrischer Erkrankungen ist kontraindiziert. Lexapro 5 mg sollte auch nicht bei einem Patienten begonnen werden, der mit MAO-Hemmern wie Linezolid oder intravenösem Methylenblau behandelt wird. Alle Berichte mit Methylenblau, die Informationen zum Verabreichungsweg enthielten, betrafen die intravenöse Verabreichung im Dosisbereich von 1 mg/kg bis 8 mg/kg. Es gab keine Berichte über die Verabreichung von Methylenblau auf anderem Wege (wie z. B. Tabletten zum Einnehmen oder lokale Gewebeinjektion) oder in niedrigeren Dosen. Es kann Umstände geben, unter denen es notwendig ist, bei einem Patienten, der Lexapro einnimmt, eine Behandlung mit einem MAO-Hemmer wie Linezolid oder intravenösem Methylenblau einzuleiten. Lexapro sollte abgesetzt werden, bevor eine Behandlung mit dem MAO-Hemmer begonnen wird [siehe KONTRAINDIKATIONEN und DOSIERUNG UND ANWENDUNG ].
Wenn die gleichzeitige Anwendung von Lexapro 5 mg mit anderen serotonergen Arzneimitteln einschließlich Triptanen, trizyklischen Antidepressiva, Fentanyl, Lithium, Tramadol, Buspiron, Tryptophan, Amphetamin und Johanniskraut klinisch gerechtfertigt ist, sollten die Patienten auf ein potenziell erhöhtes Risiko für ein Serotonin-Syndrom aufmerksam gemacht werden , insbesondere zu Beginn der Behandlung und bei Dosiserhöhungen.
Die Behandlung mit Lexapro und allen begleitenden serotonergen Arzneimitteln sollte sofort abgebrochen werden, wenn die oben genannten Ereignisse auftreten, und eine unterstützende symptomatische Behandlung sollte eingeleitet werden.
Absetzen der Behandlung mit Lexapro
Während der Vermarktung von Lexapro und anderen SSRIs und SNRIs (Serotonin- und Noradrenalin-Wiederaufnahmehemmer) gab es spontane Berichte über Nebenwirkungen, die nach dem Absetzen dieser Arzneimittel auftraten, insbesondere bei abruptem Absetzen, einschließlich der folgenden: dysphorische Stimmung, Reizbarkeit, Unruhe, Schwindel, Sensibilität Störungen (z. B. Parästhesien wie Elektroschocks), Angst, Verwirrtheit, Kopfschmerzen, Lethargie, emotionale Labilität, Schlaflosigkeit und Hypomanie. Obwohl diese Ereignisse im Allgemeinen selbstlimitierend sind, gab es Berichte über schwerwiegende Absetzsymptome.
Patienten sollten auf diese Symptome überwacht werden, wenn sie die Behandlung mit Lexapro abbrechen. Wann immer möglich, wird eine allmähliche Reduzierung der Dosis anstelle eines abrupten Absetzens empfohlen. Wenn nach einer Verringerung der Dosis oder beim Absetzen der Behandlung unerträgliche Symptome auftreten, kann eine Wiederaufnahme der zuvor verschriebenen Dosis in Betracht gezogen werden. Anschließend kann der Arzt die Dosis weiter verringern, jedoch langsamer [siehe DOSIERUNG UND ANWENDUNG ].
Krampfanfälle
Obwohl in Tierversuchen krampflösende Wirkungen von racemischem Citalopram beobachtet wurden, wurde Lexapro bei Patienten mit Anfallsleiden nicht systematisch untersucht. Diese Patienten wurden während der Premarketing-Tests des Produkts von klinischen Studien ausgeschlossen. In klinischen Studien mit Lexapro 5 mg wurden Fälle von Krämpfen im Zusammenhang mit der Lexapro-Behandlung berichtet. Wie andere Arzneimittel, die bei der Behandlung einer Major Depression wirksam sind, sollte Lexapro 20 mg bei Patienten mit Anfallsleiden in der Anamnese mit Vorsicht eingeführt werden.
Aktivierung von Manie oder Hypomanie
Bei Patienten mit bipolarer Störung kann die Behandlung einer depressiven Episode mit Lexapro oder einem anderen Antidepressivum eine gemischte/manische Episode auslösen. In placebokontrollierten Studien mit Lexapro 20 mg bei schweren depressiven Störungen wurde bei einem (0,1 %) von 715 mit Lexapro 20 mg behandelten Patienten und bei keinem der 592 mit Placebo behandelten Patienten die Aktivierung einer Manie/Hypomanie berichtet. Ein weiterer Fall von Hypomanie wurde im Zusammenhang mit der Behandlung mit Lexapro 10 mg berichtet. Die Aktivierung von Manie/Hypomanie wurde auch bei einem kleinen Teil der Patienten mit schweren affektiven Störungen berichtet, die mit racemischem Citalopram und anderen auf dem Markt befindlichen Arzneimitteln behandelt wurden, die bei der Behandlung von schweren depressiven Störungen wirksam sind. Vor Beginn der Behandlung mit Lexapro sollten Patienten auf persönliche oder familiäre Vorgeschichte von bipolaren Störungen, Manie oder Hypomanie untersucht werden [siehe DOSIERUNG UND ANWENDUNG ].
Hyponatriämie
Hyponatriämie kann als Folge einer Behandlung mit SSRIs und SNRIs, einschließlich Lexapro, auftreten. In vielen Fällen scheint diese Hyponatriämie das Ergebnis des Syndroms der inadäquaten Sekretion des antidiuretischen Hormons (SIADH) zu sein und war nach Absetzen von Lexapro 20 mg reversibel. Es wurden Fälle mit Serumnatriumwerten unter 110 mmol/l berichtet. Ältere Patienten können unter SSRIs und SNRIs einem höheren Risiko ausgesetzt sein, eine Hyponatriämie zu entwickeln. Auch Patienten, die Diuretika einnehmen oder anderweitig an Volumenmangel leiden, können einem größeren Risiko ausgesetzt sein [siehe Geriatrische Verwendung ]. Bei Patienten mit symptomatischer Hyponatriämie sollte ein Absetzen von Lexapro in Betracht gezogen und eine geeignete medizinische Intervention eingeleitet werden.
Anzeichen und Symptome einer Hyponatriämie sind Kopfschmerzen, Konzentrationsschwierigkeiten, Gedächtnisstörungen, Verwirrtheit, Schwäche und Unsicherheit, die zu Stürzen führen können. Anzeichen und Symptome im Zusammenhang mit schwereren und/oder akuten Fällen waren Halluzinationen, Synkopen, Krampfanfälle, Koma, Atemstillstand und Tod.
Abnorme Blutung
SSRIs und SNRIs, einschließlich Lexapro 20 mg, können das Risiko von Blutungsereignissen erhöhen. Die gleichzeitige Anwendung von Aspirin, nichtsteroidalen Antirheumatika, Warfarin und anderen Antikoagulanzien kann das Risiko erhöhen. Fallberichte und epidemiologische Studien (Fall-Kontroll- und Kohortendesign) haben einen Zusammenhang zwischen der Einnahme von Arzneimitteln, die die Serotonin-Wiederaufnahme beeinträchtigen, und dem Auftreten von gastrointestinalen Blutungen gezeigt. Blutungsereignisse im Zusammenhang mit der Anwendung von SSRIs und SNRIs reichten von Ekchymosen, Hämatomen, Epistaxis und Petechien bis hin zu lebensbedrohlichen Blutungen.
Patienten sollten vor dem Blutungsrisiko gewarnt werden, das mit der gleichzeitigen Anwendung von Lexapro 20 mg und NSAIDs, Aspirin oder anderen Arzneimitteln, die die Blutgerinnung beeinflussen, verbunden ist.
Beeinträchtigung der kognitiven und motorischen Leistung
In einer Studie mit gesunden Freiwilligen verursachte Lexapro 10 mg/Tag keine Beeinträchtigung der intellektuellen Funktion oder der psychomotorischen Leistungsfähigkeit. Da jedes psychoaktive Medikament das Urteilsvermögen, das Denkvermögen oder die motorischen Fähigkeiten beeinträchtigen kann, sollten die Patienten jedoch davor gewarnt werden, gefährliche Maschinen, einschließlich Autos, zu bedienen, bis sie hinreichend sicher sind, dass die Lexapro-Therapie ihre Fähigkeit zur Teilnahme an solchen Aktivitäten nicht beeinträchtigt.
Engwinkelglaukom
Winkelverschlussglaukom: Die Pupillenerweiterung, die nach der Anwendung vieler Antidepressiva, einschließlich Lexapro 20 mg, auftritt, kann bei einem Patienten mit anatomisch engen Winkeln, der keine offene Iridektomie hat, einen Winkelverschlussanfall auslösen.
Anwendung bei Patienten mit Begleiterkrankungen
Die klinische Erfahrung mit Lexapro bei Patienten mit bestimmten systemischen Begleiterkrankungen ist begrenzt. Vorsicht ist geboten bei der Anwendung von Lexapro 5 mg bei Patienten mit Krankheiten oder Zuständen, die einen veränderten Stoffwechsel oder hämodynamische Reaktionen hervorrufen.
Lexapro wurde bei Patienten mit kürzlich aufgetretenem Myokardinfarkt oder instabiler Herzerkrankung nicht systematisch untersucht. Patienten mit diesen Diagnosen wurden während der Premarketing-Tests des Produkts im Allgemeinen von klinischen Studien ausgeschlossen.
Bei Patienten mit eingeschränkter Leberfunktion war die Clearance von racemischem Citalopram verringert und die Plasmakonzentrationen erhöht. Die empfohlene Dosis von Lexapro bei Patienten mit eingeschränkter Leberfunktion beträgt 10 mg/Tag [siehe DOSIERUNG UND ANWENDUNG ].
Da Escitalopram extensiv metabolisiert wird, ist die Ausscheidung des unveränderten Arzneimittels im Urin ein untergeordneter Eliminationsweg. Bis eine ausreichende Anzahl von Patienten mit schwerer Nierenfunktionsstörung während der chronischen Behandlung mit Lexapro 20 mg untersucht wurde, sollte es jedoch bei solchen Patienten mit Vorsicht angewendet werden [siehe DOSIERUNG UND ANWENDUNG ].
Sexuelle Funktionsstörung
Die Anwendung von SSRIs, einschließlich Lexapro, kann Symptome einer sexuellen Funktionsstörung verursachen [siehe NEBENWIRKUNGEN ]. Bei männlichen Patienten kann die Anwendung von SSRI zu Ejakulationsverzögerung oder -versagen, verminderter Libido und erektiler Dysfunktion führen. Bei weiblichen Patienten kann die Anwendung von SSRI zu einer verminderten Libido und einem verzögerten oder ausbleibenden Orgasmus führen.
Es ist wichtig, dass sich die verschreibenden Ärzte vor Beginn der Behandlung mit Lexapro nach der sexuellen Funktion erkundigen und sich während der Behandlung speziell nach Veränderungen der sexuellen Funktion erkundigen, da die sexuelle Funktion möglicherweise nicht spontan gemeldet wird. Bei der Beurteilung von Veränderungen der Sexualfunktion ist es wichtig, eine detaillierte Anamnese (einschließlich des Zeitpunkts des Auftretens der Symptome) zu erheben, da sexuelle Symptome andere Ursachen haben können, einschließlich der zugrunde liegenden psychiatrischen Störung. Besprechen Sie mögliche Behandlungsstrategien, um Patienten dabei zu unterstützen, fundierte Entscheidungen über die Behandlung zu treffen.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente ).
Selbstmordgedanken und Verhaltensweisen
Weisen Sie Patienten, ihre Familien und Betreuer an, auf das Auftreten von Suizidgedanken und -verhalten zu achten, insbesondere während der Behandlung und wenn die Dosis nach oben oder unten angepasst wird, und weisen Sie sie an, solche Symptome ihrem medizinischen Betreuer zu melden [siehe KASTENWARNUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Serotonin-Syndrom
Patienten sollten vor dem Risiko eines Serotoninsyndroms bei gleichzeitiger Anwendung von Lexapro mit anderen serotonergen Arzneimitteln einschließlich Triptanen, trizyklischen Antidepressiva, Fentanyl, Lithium, Tramadol, Tryptophan, Buspiron, Amphetaminen und Johanniskraut sowie mit Arzneimitteln, die den Stoffwechsel beeinträchtigen, gewarnt werden Serotonin (insbesondere MAO-Hemmer, sowohl solche, die zur Behandlung psychiatrischer Störungen bestimmt sind, als auch andere, wie Linezolid) [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Aktivierung von Manie oder Hypomanie
Weisen Sie die Patienten und ihre Betreuer an, auf Anzeichen einer Aktivierung von Manie/Hypomanie zu achten, und weisen Sie sie an, solche Symptome dem medizinischen Fachpersonal zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Abnorme Blutung
Patienten sollten vor der gleichzeitigen Anwendung von Lexapro 5 mg und NSAIDs, Aspirin, Warfarin oder anderen Arzneimitteln, die die Blutgerinnung beeinflussen, gewarnt werden, da die kombinierte Anwendung von Psychopharmaka, die die Wiederaufnahme von Serotonin beeinträchtigen, mit einem erhöhten Blutungsrisiko in Verbindung gebracht wurde [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Engwinkelglaukom
Die Patienten sollten darauf hingewiesen werden, dass die Einnahme von Lexapro 5 mg eine leichte Pupillenerweiterung verursachen kann, die bei empfindlichen Personen zu einer Episode eines Engwinkelglaukoms führen kann. Ein vorbestehendes Glaukom ist fast immer ein Offenwinkelglaukom, da ein Winkelblockglaukom, wenn es diagnostiziert wird, definitiv mit einer Iridektomie behandelt werden kann. Das Offenwinkelglaukom ist kein Risikofaktor für das Engwinkelglaukom. Patienten möchten möglicherweise untersucht werden, um festzustellen, ob sie für Winkelverschluss anfällig sind, und sich einem prophylaktischen Verfahren (z. B. Iridektomie) unterziehen, wenn sie anfällig sind [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Sexuelle Funktionsstörung
Weisen Sie die Patienten darauf hin, dass die Anwendung von Lexapro sowohl bei männlichen als auch bei weiblichen Patienten Symptome einer sexuellen Dysfunktion hervorrufen kann. Informieren Sie die Patienten darüber, dass sie alle Veränderungen der Sexualfunktion und potenzielle Behandlungsstrategien mit ihrem Arzt besprechen sollten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Begleitmedikation
Da Escitalopram das aktive Isomer von racemischem Citalopram (Celexa) ist, sollten die beiden Wirkstoffe nicht gleichzeitig verabreicht werden. Patienten sollten angewiesen werden, ihren Arzt zu informieren, wenn sie verschreibungspflichtige oder rezeptfreie Arzneimittel einnehmen oder deren Einnahme planen, da die Möglichkeit von Wechselwirkungen besteht.
Fortsetzung der verordneten Therapie
Während die Patienten unter einer Therapie mit Lexapro 10 mg innerhalb von 1 bis 4 Wochen eine Besserung feststellen können, sollte ihnen geraten werden, die Therapie wie verordnet fortzusetzen.
Beeinträchtigung der psychomotorischen Leistung
Da Psychopharmaka das Urteilsvermögen, das Denkvermögen oder die motorischen Fähigkeiten beeinträchtigen können, sollten Patienten vor dem Bedienen gefährlicher Maschinen, einschließlich Autos, gewarnt werden, bis sie hinreichend sicher sind, dass die Lexapro-Therapie ihre Fähigkeit zur Teilnahme an solchen Aktivitäten nicht beeinträchtigt.
Alkohol
Die Patienten sollten darüber aufgeklärt werden, dass Lexapro 5 mg zwar in Experimenten mit gesunden Probanden nicht gezeigt hat, dass es die durch Alkohol verursachten geistigen und motorischen Beeinträchtigungen verstärkt, die gleichzeitige Anwendung von Lexapro 20 mg und Alkohol bei depressiven Patienten jedoch nicht empfohlen wird.
Schwangerschaft
Raten Sie schwangeren Frauen, ihren Arzt zu informieren, wenn sie während der Behandlung mit LEXAPRO schwanger werden oder eine Schwangerschaft planen. Weisen Sie die Patientinnen darauf hin, dass die Anwendung von LEXAPRO 10 mg später in der Schwangerschaft zu einem erhöhten Risiko für neonatale Komplikationen führen kann, die einen längeren Krankenhausaufenthalt, Atemunterstützung, Sondenernährung und/oder anhaltende pulmonale Hypertonie (PPHN) des Neugeborenen erfordern [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Weisen Sie Frauen darauf hin, dass es ein Schwangerschaftsexpositionsregister gibt, das die Schwangerschaftsausgänge bei Frauen überwacht, die während der Schwangerschaft LEXAPRO ausgesetzt waren [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Stillzeit
Raten Sie stillenden Frauen, die LEXAPRO anwenden, Säuglinge auf übermäßige Sedierung, Unruhe, Unruhe, schlechte Nahrungsaufnahme und schlechte Gewichtszunahme zu überwachen und einen Arzt aufzusuchen, wenn sie diese Anzeichen bemerken [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Notwendigkeit eines umfassenden Behandlungsprogramms
Lexapro 20 mg ist als integraler Bestandteil eines Gesamtbehandlungsprogramms für MDD indiziert, das andere (psychologische, erzieherische, soziale) Maßnahmen für Patienten mit diesem Syndrom umfassen kann. Eine medikamentöse Behandlung ist möglicherweise nicht für alle Jugendlichen mit diesem Syndrom indiziert. Die Sicherheit und Wirksamkeit von Lexapro 10 mg bei MDD wurde bei pädiatrischen Patienten unter 12 Jahren nicht nachgewiesen. Antidepressiva sind nicht für die Anwendung bei Jugendlichen bestimmt, die Symptome zeigen, die auf Umweltfaktoren und/oder andere primäre psychiatrische Störungen zurückzuführen sind. Eine angemessene schulische Unterbringung ist unerlässlich, und psychosoziale Interventionen sind oft hilfreich. Wenn Abhilfemaßnahmen allein nicht ausreichen, hängt die Entscheidung, ein Antidepressivum zu verschreiben, von der Einschätzung des Arztes über die Chronizität und Schwere der Symptome des Patienten ab.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Racemisches Citalopram wurde Mäusen vom Stamm NMRI/BOM und Ratten vom Stamm COBS WI über 18 bzw. 24 Monate mit der Nahrung verabreicht. Es gab keine Hinweise auf Karzinogenität von racemischem Citalopram bei Mäusen, die bis zu 240 mg/kg/Tag erhielten. Bei Ratten, die 8 oder 24 mg/kg/Tag racemisches Citalopram erhielten, traten vermehrt Dünndarmkarzinome auf. Eine No-Effect-Dosierung für diesen Befund wurde nicht festgelegt. Die Relevanz dieser Befunde für den Menschen ist nicht bekannt.
Mutagenese
Racemisches Citalopram war in 2 von 5 Bakterienstämmen (Salmonella TA98 und TA1537) ohne metabolische Aktivierung im bakteriellen Rückmutationstest (Ames-Test) in vitro mutagen. Es war klastogen im In-vitro-Test mit Lungenzellen chinesischer Hamster auf Chromosomenaberrationen in Anwesenheit und Abwesenheit einer metabolischen Aktivierung. Racemisches Citalopram war im In-vitro-Säugetier-Forward-Gen-Mutation-Assay (HPRT) in Maus-Lymphomzellen oder in einem gekoppelten In-vitro/In-vivo-Test zur außerplanmäßigen DNA-Synthese (UDS) in Rattenleber nicht mutagen. Es war im In-vitro-Chromosomenaberrationsassay an menschlichen Lymphozyten oder in zwei In-vivo-Maus-Mikronukleus-Assays nicht klastogen.
Beeinträchtigung der Fruchtbarkeit
Wenn racemisches Citalopram 16 männlichen und 24 weiblichen Ratten vor und während der Paarung und Trächtigkeit in Dosen von 32, 48 und 72 mg/kg/Tag oral verabreicht wurde, war die Paarung bei allen Dosen verringert und die Fertilität war bei Dosen ≥ 32 verringert mg/kg/Tag. Die Trächtigkeitsdauer war bei 48 mg/kg/Tag verlängert.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschafts-Expositionsregister
Es gibt ein Schwangerschafts-Expositionsregister, das die Schwangerschaftsausgänge bei Frauen überwacht, die während der Schwangerschaft Antidepressiva ausgesetzt waren. Gesundheitsdienstleister werden ermutigt, Patienten anzumelden, indem sie das National Pregnancy Registry for Antidepressants unter 1-844-405-6185 anrufen oder online unter besuchen https://womensmentalhealth.org/clnical-and-research-programs/pregnancyregistry/antidepressants/
Zusammenfassung der Risiken
Verfügbare Daten aus veröffentlichten epidemiologischen Studien und Postmarketing-Berichten haben kein erhöhtes Risiko für schwere Geburtsfehler oder Fehlgeburten ergeben. Es besteht das Risiko einer persistierenden pulmonalen Hypertonie des Neugeborenen (PPHN) (vgl Daten ) und schlechte neonatale Anpassung (vgl Klinische Überlegungen ) mit Exposition gegenüber selektiven Serotonin-Wiederaufnahmehemmern (SSRIs), einschließlich LEXAPRO 5 mg, während der Schwangerschaft. Es gibt Risiken im Zusammenhang mit einer unbehandelten Depression in der Schwangerschaft (siehe Klinische Überlegungen ).
In Reproduktionsstudien an Tieren wurde gezeigt, dass sowohl Escitalopram als auch racemisches Citalopram nachteilige Auswirkungen auf die embryonale/fötale und postnatale Entwicklung haben, einschließlich fötaler struktureller Anomalien, wenn sie in Dosen verabreicht werden, die höher sind als die therapeutischen Dosen für den Menschen (siehe Daten ).
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 bis 4 % bzw. 15 bis 20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches Risiko und/oder embryonale/fötales Risiko
Frauen, die Antidepressiva absetzen, erleiden mit größerer Wahrscheinlichkeit einen Rückfall einer schweren Depression als Frauen, die Antidepressiva weiter einnehmen. Dieses Ergebnis stammt aus einer prospektiven Längsschnittstudie mit 201 schwangeren Frauen mit einer Vorgeschichte von schweren Depressionen, die zu Beginn der Schwangerschaft euthymisch waren und Antidepressiva einnahmen. Berücksichtigen Sie das Risiko einer unbehandelten Depression, wenn Sie die Behandlung mit Antidepressiva während der Schwangerschaft und nach der Geburt abbrechen oder ändern.
Fötale/neonatale Nebenwirkungen
Neugeborene, die gegen Ende des dritten Trimesters SSRIs oder SNRIs, einschließlich Lexapro 5 mg, ausgesetzt waren, entwickelten Komplikationen, die einen verlängerten Krankenhausaufenthalt, Atemunterstützung und Sondenernährung erforderten. Solche Komplikationen können unmittelbar nach der Geburt auftreten. Zu den berichteten klinischen Befunden gehörten Atemnot, Zyanose, Apnoe, Krampfanfälle, Temperaturinstabilität, Schwierigkeiten beim Füttern, Erbrechen, Hypoglykämie, Hypotonie, Hypertonie, Hyperreflexie, Zittern, Nervosität, Reizbarkeit und ständiges Weinen. Diese Merkmale stimmen entweder mit einer direkten toxischen Wirkung von SSRIs und SNRIs oder möglicherweise mit einem Arzneimittelabsetzsyndrom überein. Es sollte beachtet werden, dass das klinische Bild in einigen Fällen mit dem Serotonin-Syndrom übereinstimmt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Daten
Menschliche Daten
Die Exposition gegenüber SSRIs, insbesondere später in der Schwangerschaft, kann das PPHN-Risiko erhöhen. PPHN tritt bei 1–2 von 1000 Lebendgeburten in der Allgemeinbevölkerung auf und ist mit einer erheblichen neonatalen Morbidität und Mortalität verbunden.
Tierdaten
In einer Studie zur embryonalen/fötalen Entwicklung bei Ratten führte die orale Verabreichung von Escitalopram (56, 112 oder 150 mg/kg/Tag) an trächtige Tiere während der Organogenese bei den beiden höheren Dosen zu einem verringerten fötalen Körpergewicht und damit verbundenen Verzögerungen der Ossifikation [ungefähr ≥ 55-mal die maximal empfohlene Dosis für den Menschen (MRHD) von 20 mg/Tag auf einer mg/m2-Basis]. Maternale Toxizität (klinische Anzeichen und verringerte Körpergewichtszunahme und Nahrungsaufnahme), mild bei 56 mg/kg/Tag, war bei allen Dosierungen vorhanden. Die Entwicklungsdosis ohne Wirkung von 56 mg/kg/Tag entspricht etwa dem 27-fachen der MRHD von 20 mg auf mg/m2-Basis. Bei keiner der getesteten Dosen (bis zum 73-fachen der MRHD auf mg/m2-Basis) wurden Missbildungen beobachtet.
Wenn weibliche Ratten während der Trächtigkeit und während der Entwöhnung mit Escitalopram (6, 12, 24 oder 48 mg/kg/Tag) behandelt wurden, wurden bei 48 mg/kg/Tag, was ungefähr dem 23-fachen entspricht, eine leicht erhöhte Nachkommenssterblichkeit und Wachstumsverzögerung festgestellt MRHD von 20 mg auf mg/m2-Basis. Bei dieser Dosis wurde eine leichte maternale Toxizität (klinische Anzeichen und verminderte Körpergewichtszunahme und Nahrungsaufnahme) beobachtet. Eine leicht erhöhte Sterblichkeit der Nachkommen wurde auch bei 24 mg/kg/Tag beobachtet. Die Dosis ohne Wirkung betrug 12 mg/kg/Tag, was etwa dem 6-fachen der MRHD von 20 mg auf mg/m2-Basis entspricht.
In zwei Studien zur embryonalen/fötalen Entwicklung bei Ratten führte die orale Verabreichung von racemischem Citalopram (32, 56 oder 112 mg/kg/Tag) an trächtige Tiere während der Organogenese zu einem verringerten Wachstum und Überleben von Embryonen/Föten und einer erhöhten Inzidenz von Föten Anomalien (einschließlich kardiovaskulärer und Skelettdefekte) bei der hohen Dosis, die ungefähr dem 18-fachen der MRHD von 60 mg/Tag auf mg/m2-Basis entspricht. Diese Dosis war auch mit maternaler Toxizität verbunden (klinische Symptome, verringerte Körpergewichtszunahme). Die Entwicklungsdosis ohne Wirkung betrug 56 mg/kg/Tag, was etwa dem 9-fachen der MRHD auf mg/m2-Basis entspricht. In einer Kaninchenstudie wurden bei Dosen von racemischem Citalopram von bis zu 16 mg/kg/Tag oder etwa dem 5-fachen der MRHD auf mg/m2-Basis keine Nebenwirkungen auf die embryonale/fötale Entwicklung beobachtet. Daher wurden Entwicklungseffekte von racemischem Citalopram bei einer für das Muttertier toxischen Dosis bei der Ratte und nicht beim Kaninchen beobachtet.
Wenn weibliche Ratten mit racemischem Citalopram (4,8, 12,8 oder 32 mg/kg/Tag) von der späten Trächtigkeit bis zum Absetzen behandelt wurden, wurde bei der höchsten Dosis eine erhöhte Sterblichkeit der Nachkommen während der ersten 4 Tage nach der Geburt und eine anhaltende Wachstumsverzögerung der Nachkommen beobachtet ist etwa das 5-fache der MRHD von 60 mg auf mg/m2-Basis. Die Dosis ohne Wirkung betrug 12,8 mg/kg/Tag, was ungefähr dem 2-fachen der MRHD auf mg/m2-Basis entspricht. Ähnliche Wirkungen auf die Sterblichkeit und das Wachstum der Nachkommen wurden beobachtet, wenn Muttertiere während der Trächtigkeit und frühen Laktation mit Dosen ≥ 24 mg/kg/Tag behandelt wurden, was etwa dem 4-fachen der MRHD auf mg/m2-Basis entspricht. Eine Dosis ohne Wirkung wurde in dieser Studie nicht bestimmt.
Stillzeit
Zusammenfassung der Risiken
Daten aus der veröffentlichten Literatur berichten über das Vorhandensein von Escitalopram und Desmethylescitalopram in der Muttermilch (vgl Daten ). Es gibt Berichte über übermäßige Sedierung, Unruhe, Agitiertheit, schlechte Nahrungsaufnahme und geringe Gewichtszunahme bei Säuglingen, die Escitalopram über die Muttermilch ausgesetzt waren (vgl Klinische Überlegungen ),. Es liegen keine Daten zu den Wirkungen von Escitalopram oder seinen Metaboliten auf die Milchproduktion vor. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an LEXAPRO 5 mg und möglichen Nebenwirkungen von LEXAPRO oder der zugrunde liegenden Erkrankung der Mutter auf das gestillte Kind berücksichtigt werden.
Klinische Überlegungen
Säuglinge, die LEXAPRO 20 mg ausgesetzt waren, sollten auf übermäßige Sedierung, Unruhe, Unruhe, schlechte Nahrungsaufnahme und geringe Gewichtszunahme überwacht werden.
Daten
Eine Studie mit 8 stillenden Müttern unter Escitalopram mit Tagesdosen von 10-20 mg/Tag zeigte, dass ausschließlich gestillte Säuglinge etwa 3,9 % der mütterlichen gewichtsangepassten Escitalopram-Dosis und 1,7 % der mütterlichen gewichtsangepassten Desmethylcitalopram-Dosis erhielten .
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von Lexapro 10 mg wurde bei Jugendlichen (im Alter von 12 bis 17 Jahren) zur Behandlung von schweren depressiven Störungen nachgewiesen [siehe Klinische Studien ]. Obwohl die Erhaltungswirksamkeit bei jugendlichen Patienten mit Major Depression nicht systematisch evaluiert wurde, kann die Erhaltungswirksamkeit aus Daten von Erwachsenen zusammen mit Vergleichen der pharmakokinetischen Parameter von Escitalopram bei Erwachsenen und jugendlichen Patienten extrapoliert werden.
Die Sicherheit und Wirksamkeit von Lexapro wurde bei pädiatrischen Patienten (jünger als 12 Jahre) mit Major Depression nicht nachgewiesen. In einer 24-wöchigen offenen Sicherheitsstudie mit 118 Kindern (im Alter von 7 bis 11 Jahren) mit schwerer depressiver Störung stimmten die Sicherheitsergebnisse mit dem bekannten Sicherheits- und Verträglichkeitsprofil von Lexapro überein.
Die Sicherheit und Wirksamkeit von Lexapro wurde bei pädiatrischen Patienten unter 18 Jahren mit generalisierter Angststörung nicht nachgewiesen.
Verminderter Appetit und Gewichtsverlust wurden im Zusammenhang mit der Anwendung von SSRIs beobachtet. Daher sollten bei Kindern und Jugendlichen, die mit einem SSRI wie Lexapro behandelt werden, regelmäßige Gewichts- und Wachstumskontrollen durchgeführt werden.
Geriatrische Verwendung
Ungefähr 6 % der 1144 Patienten, die Escitalopram in kontrollierten Studien mit Lexapro 10 mg bei Major Depression und GAD erhielten, waren 60 Jahre oder älter; ältere Patienten erhielten in diesen Studien tägliche Dosen von Lexapro zwischen 10 und 20 mg. Die Anzahl älterer Patienten in diesen Studien reichte nicht aus, um eine adäquate Bewertung möglicher differentieller Wirksamkeits- und Sicherheitsmaßnahmen auf der Grundlage des Alters vorzunehmen. Dennoch kann eine größere Empfindlichkeit einiger älterer Personen gegenüber den Wirkungen von Lexapro nicht ausgeschlossen werden.
SSRIs und SNRIs, einschließlich Lexapro 5 mg, wurden mit Fällen von klinisch signifikanter Hyponatriämie bei älteren Patienten in Verbindung gebracht, die möglicherweise ein höheres Risiko für dieses unerwünschte Ereignis haben [siehe Hyponatriämie ].
In zwei pharmakokinetischen Studien war die Halbwertszeit von Escitalopram bei älteren Probanden im Vergleich zu jungen Probanden um etwa 50 % verlängert und die Cmax blieb unverändert [siehe KLINISCHE PHARMAKOLOGIE ]. 10 mg/Tag ist die empfohlene Dosis für ältere Patienten [siehe DOSIERUNG UND ANWENDUNG ].
Von 4422 Patienten in klinischen Studien mit racemischem Citalopram waren 1357 60 Jahre und älter, 1034 65 Jahre und älter und 457 75 Jahre und älter. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber auch hier kann eine größere Empfindlichkeit einiger älterer Personen nicht ausgeschlossen werden.
ÜBERDOSIS
Folgendes wurde im Zusammenhang mit einer Überdosierung von Lexapro-Tabletten berichtet:
Aufgrund des Arrhythmierisikos wird bei einer Überdosierung von Lexapro eine längere Herzüberwachung empfohlen.
Eine Magen-Darm-Dekontamination mit Aktivkohle sollte bei Patienten in Betracht gezogen werden, die sich früh nach einer Lexapro-Überdosis vorstellen.
Erwägen Sie, sich an ein Giftzentrum (1-800-221-2222) oder einen medizinischen Toxikologen zu wenden, um Empfehlungen zum Umgang mit einer Überdosierung zu erhalten.
KONTRAINDIKATIONEN
Monoaminoxidase-Hemmer (MAO-Hemmer)
Die Anwendung von MAO-Hemmern zur Behandlung psychiatrischer Erkrankungen mit Lexapro oder innerhalb von 14 Tagen nach Beendigung der Behandlung mit Lexapro 5 mg ist aufgrund eines erhöhten Risikos für ein Serotonin-Syndrom kontraindiziert. Die Anwendung von Lexapro 20 mg innerhalb von 14 Tagen nach Absetzen eines MAO-Hemmers zur Behandlung psychiatrischer Erkrankungen ist ebenfalls kontraindiziert [siehe DOSIERUNG UND ANWENDUNG , und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die Einnahme von Lexapro 20 mg bei einem Patienten, der mit MAO-Hemmern wie Linezolid oder intravenösem Methylenblau behandelt wird, ist ebenfalls kontraindiziert, da ein erhöhtes Risiko für ein Serotonin-Syndrom besteht [siehe DOSIERUNG UND ANWENDUNG , und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Pimozid
Die gleichzeitige Anwendung bei Patienten, die Pimozid einnehmen, ist kontraindiziert [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Überempfindlichkeit gegen Escitalopram oder Citalopram
Lexapro 20 mg ist bei Patienten mit einer Überempfindlichkeit gegen Escitalopram oder Citalopram oder einen der sonstigen Bestandteile von Lexapro kontraindiziert.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Es wird angenommen, dass der Mechanismus der antidepressiven Wirkung von Escitalopram, dem S-Enantiomer von racemischem Citalopram, mit einer Potenzierung der serotonergen Aktivität im Zentralnervensystem (ZNS) zusammenhängt, die aus seiner Hemmung der ZNS-neuronalen Wiederaufnahme von Serotonin (5-HT) resultiert.
Pharmakodynamik
In-vitro- und in-vivo-Studien an Tieren deuten darauf hin, dass Escitalopram ein hochselektiver Serotonin-Wiederaufnahmehemmer (SSRI) mit minimalen Auswirkungen auf die neuronale Wiederaufnahme von Noradrenalin und Dopamin ist. Escitalopram ist hinsichtlich der Hemmung der 5-HT-Wiederaufnahme und der Hemmung der neuronalen Feuerungsrate von 5-HT mindestens 100-mal wirksamer als das R-Enantiomer. Toleranz gegenüber einem Modell der antidepressiven Wirkung bei Ratten wurde durch eine Langzeitbehandlung (bis zu 5 Wochen) mit Escitalopram nicht induziert. Escitalopram hat keine oder eine sehr geringe Affinität zu serotonergen (5-HT1-7) oder anderen Rezeptoren, einschließlich alpha- und beta-adrenergen, Dopamin (D1-5), Histamin (H1-3), Muskarin (M1-5) und Benzodiazepin Rezeptoren. Escitalopram bindet auch nicht oder hat eine geringe Affinität zu verschiedenen Ionenkanälen, einschließlich Na+-, K+-, Cl- und Ca++-Kanälen. Es wurde die Hypothese aufgestellt, dass Antagonismus von muskarinischen, histaminergen und adrenergen Rezeptoren mit verschiedenen anticholinergen, sedierenden und kardiovaskulären Nebenwirkungen anderer Psychopharmaka verbunden ist.
Pharmakokinetik
Die Pharmakokinetik von Escitalopram nach Einzel- und Mehrfachdosis ist in einem Dosisbereich von 10 bis 30 mg/Tag linear und dosisproportional. Die Biotransformation von Escitalopram erfolgt hauptsächlich hepatisch mit einer mittleren terminalen Halbwertszeit von etwa 27-32 Stunden. Bei einmal täglicher Gabe werden Steady-State-Plasmakonzentrationen innerhalb von etwa einer Woche erreicht. Im Steady-State betrug das Ausmaß der Kumulation von Escitalopram im Plasma bei jungen gesunden Probanden das 2,2- bis 2,5-Fache der Plasmakonzentrationen, die nach einer Einzeldosis beobachtet wurden. Die Darreichungsformen von Escitalopramoxalat in Tabletten- und Lösungsform zum Einnehmen sind bioäquivalent.
Absorption und Verteilung
Nach einer oralen Einzeldosis (20 mg Tablette oder Lösung) von Escitalopram treten nach etwa 5 Stunden maximale Blutspiegel auf. Die Resorption von Escitalopram wird durch Nahrung nicht beeinflusst.
Die absolute Bioverfügbarkeit von Citalopram beträgt etwa 80 % relativ zu einer intravenösen Dosis, und das Verteilungsvolumen von Citalopram beträgt etwa 12 l/kg. Spezifische Daten zu Escitalopram sind nicht verfügbar.
Die Bindung von Escitalopram an menschliche Plasmaproteine beträgt etwa 56 %.
Stoffwechsel und Ausscheidung
Nach oraler Verabreichung von Escitalopram beträgt der Anteil des Arzneimittels, der als Escitalopram und S-Demethylcitalopram (S-DCT) im Urin wiedergefunden wird, etwa 8 % bzw. 10 %. Die orale Clearance von Escitalopram beträgt 600 ml/min, wobei etwa 7 % davon auf die renale Clearance zurückzuführen sind.
Escitalopram wird zu S-DCT und S-Didemethylcitalopram (S-DDCT) metabolisiert. Beim Menschen ist unverändertes Escitalopram die vorherrschende Verbindung im Plasma. Im Steady State beträgt die Konzentration des Escitalopram-Metaboliten S-DCT im Plasma etwa ein Drittel der von Escitalopram. Der S-DDCT-Spiegel war bei den meisten Probanden nicht nachweisbar. In-vitro-Studien zeigen, dass Escitalopram bei der Hemmung der Serotonin-Wiederaufnahme mindestens 7- bzw. 27-mal stärker ist als S-DCT bzw. S-DDCT, was darauf hindeutet, dass die Metaboliten von Escitalopram nicht wesentlich zu den antidepressiven Wirkungen von Escitalopram beitragen. S-DCT und SDDCT haben auch keine oder sehr geringe Affinität zu serotonergen (5-HT1-7) oder anderen Rezeptoren, einschließlich alpha- und beta-adrenergen, Dopamin (D1-5), Histamin (H1-3), muskarinischen (M1- 5) und Benzodiazepin-Rezeptoren. S-DCT und S-DDCT binden auch nicht an verschiedene Ionenkanäle, einschließlich Na+-, K+-, Cl- und Ca++-Kanäle.
In-vitro-Studien mit menschlichen Lebermikrosomen zeigten, dass CYP3A4 und CYP2C19 die primären Isozyme sind, die an der N-Demethylierung von Escitalopram beteiligt sind.
Bevölkerungsuntergruppen
Das Alter
Jugendliche
In einer Einzeldosisstudie mit 10 mg Escitalopram verringerte sich die AUC von Escitalopram um 19 % und die Cmax stieg um 26 % bei gesunden jugendlichen Probanden (im Alter von 12 bis 17 Jahren) im Vergleich zu Erwachsenen. Nach mehrfacher Gabe von 40 mg/Tag Citalopram waren die Eliminationshalbwertszeit von Escitalopram, Cmax und AUC im Steady State bei Patienten mit MDD (im Alter von 12 bis 17 Jahren) ähnlich wie bei erwachsenen Patienten. Bei jugendlichen Patienten ist keine Dosisanpassung erforderlich.
Alten
Die Pharmakokinetik von Escitalopram bei Personen im Alter von ≥ 65 Jahren wurde mit jüngeren Personen in einer Einzeldosis- und einer Mehrfachdosisstudie verglichen. Die AUC und Halbwertszeit von Escitalopram waren bei älteren Patienten um etwa 50 % erhöht, und die Cmax blieb unverändert. 10 mg ist die empfohlene Dosis für ältere Patienten [siehe DOSIERUNG UND ANWENDUNG ].
Geschlecht
Basierend auf Daten aus Einzel- und Mehrfachdosisstudien, in denen Escitalopram bei älteren Menschen, jungen Erwachsenen und Jugendlichen gemessen wurde, ist keine Dosisanpassung aufgrund des Geschlechts erforderlich.
Reduzierte Leberfunktion
Die orale Clearance von Citalopram war bei Patienten mit eingeschränkter Leberfunktion im Vergleich zu gesunden Probanden um 37 % reduziert und die Halbwertszeit verdoppelt. 10 mg ist die empfohlene Escitalopram-Dosis für die meisten Patienten mit eingeschränkter Leberfunktion [siehe DOSIERUNG UND ANWENDUNG ].
Reduzierte Nierenfunktion
Bei Patienten mit leichter bis mittelschwerer Nierenfunktionsstörung war die orale Clearance von Citalopram im Vergleich zu gesunden Probanden um 17 % verringert. Für solche Patienten wird keine Dosisanpassung empfohlen. Zur Pharmakokinetik von Escitalopram bei Patienten mit stark eingeschränkter Nierenfunktion (Kreatinin-Clearance
Arzneimittelwechselwirkungen
In-vitro-Daten zur Enzymhemmung zeigten keine hemmende Wirkung von Escitalopram auf CYP3A4, -1A2, -2C9, -2C19 und -2E1. Basierend auf In-vitro-Daten ist zu erwarten, dass Escitalopram nur eine geringe hemmende Wirkung auf den durch diese Cytochrome vermittelten In-vivo-Metabolismus hat. Während die In-vivo-Daten zur Beantwortung dieser Frage begrenzt sind, deuten Ergebnisse aus Wechselwirkungsstudien darauf hin, dass Escitalopram in einer Dosis von 20 mg keine 3A4-Hemmwirkung und eine mäßige 2D6-Hemmwirkung hat. Sehen WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN für detailliertere Informationen zu verfügbaren Daten zu Wechselwirkungen mit Arzneimitteln.
Tiertoxikologie und/oder Pharmakologie
Netzhautveränderungen bei Ratten
In der 2-Jahres-Karzinogenitätsstudie mit racemischem Citalopram wurden pathologische Veränderungen (Degeneration/Atrophie) an der Netzhaut von Albino-Ratten beobachtet. Es gab sowohl bei männlichen als auch bei weiblichen Ratten, die 80 mg/kg/Tag erhielten, eine Zunahme sowohl der Inzidenz als auch der Schwere der Netzhautpathologie. Ähnliche Befunde wurden bei Ratten, die zwei Jahre lang 24 mg/kg/Tag racemisches Citalopram erhielten, bei Mäusen, die 18 Monate lang bis zu 240 mg/kg/Tag racemisches Citalopram erhielten, oder bei Hunden, die bis zu 20 mg/kg/Tag erhielten, nicht gefunden. Tag racemisches Citalopram für ein Jahr.
Zusätzliche Studien zur Untersuchung des Mechanismus für diese Pathologie wurden nicht durchgeführt, und die potenzielle Bedeutung dieser Wirkung beim Menschen wurde nicht nachgewiesen.
Herz-Kreislauf-Veränderungen bei Hunden
In einer einjährigen toxikologischen Studie starben 5 von 10 Beagle-Hunden, die orale racemische Citalopram-Dosen von 8 mg/kg/Tag erhielten, zwischen der 17. und 31. Woche nach Behandlungsbeginn plötzlich. Plötzliche Todesfälle wurden bei Ratten bei Dosen von racemischem Citalopram von bis zu 120 mg/kg/Tag nicht beobachtet, was zu Plasmaspiegeln von Citalopram und seinen Metaboliten Demethylcitalopram und Didemethylcitalopram (DDCT) führte, die denen ähnelten, die bei Hunden bei 8 mg/kg/Tag beobachtet wurden. Eine anschließende Studie mit intravenöser Verabreichung zeigte, dass razemisches DDCT bei Beagle-Hunden eine QT-Verlängerung verursachte, ein bekannter Risikofaktor für das bei Hunden beobachtete Ergebnis.
Klinische Studien
Depression
Jugendliche
Die Wirksamkeit von Lexapro zur akuten Behandlung von schweren depressiven Störungen bei jugendlichen Patienten wurde in einer 8-wöchigen placebokontrollierten Studie mit flexibler Dosierung nachgewiesen, in der Lexapro 10-20 mg/Tag mit Placebo bei ambulanten Patienten im Alter von 12 bis 17 Jahren verglichen wurde einschließlich, die die DSM-IV-Kriterien für eine schwere depressive Störung erfüllten. Das primäre Ergebnis war die Veränderung vom Ausgangswert zum Endpunkt der Children's Depression Rating Scale – Revised (CDRS-R). In dieser Studie zeigte Lexapro 5 mg im CDRS-R eine statistisch signifikant größere mittlere Verbesserung im Vergleich zu Placebo.
Die Wirksamkeit von Lexapro bei der akuten Behandlung von schweren depressiven Störungen bei Jugendlichen wurde teilweise auf Grundlage der Extrapolation aus der 8-wöchigen placebokontrollierten Studie mit flexibler Dosierung und razemischem Citalopram 20–40 mg/Tag nachgewiesen. In dieser ambulanten Studie mit Kindern und Jugendlichen im Alter von 7 bis 17 Jahren, die die DSM-IV-Kriterien für eine schwere depressive Störung erfüllten, zeigte die Citalopram-Behandlung im CDRS-R eine statistisch signifikant größere mittlere Verbesserung gegenüber dem Ausgangswert im Vergleich zu Placebo; Die positiven Ergebnisse dieser Studie kamen größtenteils aus der Untergruppe der Jugendlichen.
Zwei weitere placebokontrollierte MDD-Studien mit flexibler Dosierung (eine Lexapro-Studie bei Patienten im Alter von 7 bis 17 Jahren und eine Citalopram-Studie bei Jugendlichen) zeigten keine Wirksamkeit.
Obwohl die Erhaltungswirksamkeit bei jugendlichen Patienten nicht systematisch untersucht wurde, kann die Erhaltungswirksamkeit aus Daten von Erwachsenen zusammen mit Vergleichen der pharmakokinetischen Parameter von Escitalopram bei Erwachsenen und jugendlichen Patienten extrapoliert werden.
Erwachsene
Die Wirksamkeit von Lexapro 5 mg zur Behandlung einer schweren depressiven Störung wurde in drei 8-wöchigen placebokontrollierten Studien nachgewiesen, die an ambulanten Patienten im Alter zwischen 18 und 65 Jahren durchgeführt wurden, die die DSM-IV-Kriterien für eine schwere depressive Störung erfüllten. Der primäre Endpunkt in allen drei Studien war die Veränderung vom Ausgangswert zum Endpunkt der Montgomery Asberg Depression Rating Scale (MADRS).
In einer Fixdosisstudie wurden 10 mg/Tag Lexapro und 20 mg/Tag Lexapro mit Placebo und 40 mg/Tag Citalopram verglichen. Die Behandlungsgruppen mit 10 mg/Tag und 20 mg/Tag Lexapro 5 mg zeigten im MADRS eine statistisch signifikant größere mittlere Verbesserung im Vergleich zu Placebo. Die Gruppen mit 10 mg und 20 mg Lexapro waren bei dieser Ergebnismessung ähnlich.
In einer zweiten Studie mit fester Dosierung von 10 mg/Tag Lexapro und Placebo zeigte die Behandlungsgruppe mit 10 mg/Tag Lexapro eine statistisch signifikant größere mittlere Verbesserung im Vergleich zu Placebo bei der MADRS.
In einer Studie mit flexibler Dosierung, in der Lexapro 20 mg, titriert zwischen 10 und 20 mg/Tag, mit Placebo und Citalopram, titriert zwischen 20 und 40 mg/Tag, verglichen wurde, zeigte die Lexapro 5 mg-Behandlungsgruppe eine statistisch signifikant größere mittlere Verbesserung im Vergleich zu Placebo MADRS.
Analysen des Zusammenhangs zwischen Behandlungsergebnis und Alter, Geschlecht und ethnischer Zugehörigkeit ließen auf der Grundlage dieser Patientenmerkmale keine unterschiedliche Ansprechbarkeit vermuten.
In einer längerfristigen Studie wurden 274 Patienten, die die (DSM-IV)-Kriterien für eine schwere depressive Störung erfüllten und während einer anfänglichen 8-wöchigen, offenen Behandlungsphase mit Lexapro 10 oder 20 mg/Tag angesprochen hatten, zur Fortsetzung der Behandlung mit Lexapro randomisiert bei gleicher Dosis oder Placebo für bis zu 36 Wochen Beobachtung auf Rückfall. Das Ansprechen während der Open-Label-Phase wurde durch eine Abnahme des MADRS-Gesamtscores auf ≤ 12 definiert. Ein Rückfall während der doppelblinden Phase wurde definiert als ein Anstieg des MADRS-Gesamtscores auf ≥ 22 oder ein Abbruch aufgrund unzureichenden klinischen Ansprechens . Patienten, die Lexapro weiterhin erhielten, erlebten eine statistisch signifikant längere Zeit bis zum Rückfall im Vergleich zu Patienten, die Placebo erhielten.
Generalisierte Angststörung
Die Wirksamkeit von Lexapro 5 mg bei der akuten Behandlung von generalisierter Angststörung (GAD) wurde in drei 8-wöchigen, multizentrischen, placebokontrollierten Studien mit flexibler Dosierung nachgewiesen, in denen Lexapro 10-20 mg/Tag mit Placebo bei erwachsenen ambulanten Patienten verglichen wurde 18 und 80 Jahre alt, die die DSM-IV-Kriterien für GAD erfüllten. In allen drei Studien zeigte Lexapro eine statistisch signifikant größere mittlere Verbesserung auf der Hamilton-Angstskala (HAM-A) im Vergleich zu Placebo.
Es gab zu wenige Patienten in unterschiedlichen ethnischen und Altersgruppen, um angemessen beurteilen zu können, ob Lexapro in diesen Gruppen unterschiedliche Wirkungen hat oder nicht. Es gab keinen Unterschied in der Reaktion auf Lexapro zwischen Männern und Frauen.
INFORMATIONEN ZUM PATIENTEN
Lexapro® (leks-a-pro) (Escitalopram) Tabletten/Lösung zum Einnehmen
Lesen Sie den mit Lexapro gelieferten Medikationsleitfaden, bevor Sie mit der Einnahme beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Dieser Medikationsleitfaden ersetzt nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung. Sprechen Sie mit Ihrem Arzt, wenn Sie etwas nicht verstehen oder mehr darüber erfahren möchten.
Was sind die wichtigsten Informationen, die ich über Lexapro 20 mg wissen sollte?
Lexapro 10 mg und andere Antidepressiva können schwerwiegende Nebenwirkungen haben, einschließlich:
Halten Sie alle Nachsorgetermine bei Ihrem Arzt und rufen Sie zwischen den Terminen an, wenn Sie sich wegen der Symptome Sorgen machen.
Rufen Sie sofort Ihren Arzt an, wenn Sie eines der folgenden Symptome haben, oder rufen Sie 911 an, wenn ein Notfall auftritt, insbesondere wenn sie neu oder schlimmer sind oder Sie sich Sorgen machen:
Rufen Sie sofort Ihren Arzt an, wenn Sie eines der folgenden Symptome haben, oder rufen Sie im Notfall 911 an. Lexapro kann mit diesen schwerwiegenden Nebenwirkungen in Verbindung gebracht werden:
Symptome bei Männern können sein:
Zu den Symptomen bei Frauen können gehören:
Sprechen Sie mit Ihrem medizinischen Betreuer, wenn Sie irgendwelche Veränderungen Ihrer Sexualfunktion bemerken oder wenn Sie Fragen oder Bedenken zu sexuellen Problemen während der Behandlung mit Lexapro haben. Möglicherweise gibt es Behandlungen, die Ihr Arzt vorschlagen kann.
Nur einige Menschen sind für diese Probleme gefährdet. Möglicherweise möchten Sie sich einer Augenuntersuchung unterziehen, um festzustellen, ob Sie gefährdet sind, und eine vorbeugende Behandlung erhalten, wenn dies der Fall ist.
Setzen Sie Lexapro nicht ab, ohne vorher mit Ihrem Arzt gesprochen zu haben. Ein zu schnelles Absetzen von Lexapro 5 mg kann zu schwerwiegenden Symptomen führen, einschließlich:
Was ist Lexapro?
Lexapro 20 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von Depressionen. Es ist wichtig, mit Ihrem Arzt über die Risiken der Behandlung von Depressionen und auch über die Risiken einer Nichtbehandlung zu sprechen. Sie sollten alle Behandlungsoptionen mit Ihrem Arzt besprechen. Lexapro wird auch verwendet zur Behandlung von:
Sprechen Sie mit Ihrem Arzt, wenn Sie glauben, dass sich Ihr Zustand durch die Lexapro-Behandlung nicht bessert.
Wer sollte Lexapro 5mg nicht einnehmen?
Nehmen Sie Lexapro 10 mg nicht ein, wenn Sie:
Personen, die Lexapro 20 mg zeitnah zu einem MAO-Hemmer einnehmen, können schwerwiegende oder sogar lebensbedrohliche Nebenwirkungen haben. Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines dieser Symptome haben:
Was sollte ich meinem Arzt vor der Einnahme von Lexapro 20 mg mitteilen? Fragen Sie nach, wenn Sie sich nicht sicher sind.
Bevor Sie mit Lexapro 20 mg beginnen, informieren Sie Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen. Lexapro 10 mg und einige Arzneimittel können miteinander interagieren, möglicherweise nicht so gut wirken oder schwerwiegende Nebenwirkungen verursachen.
Ihr Arzt oder Apotheker kann Ihnen sagen, ob die Einnahme von Lexapro 20 mg zusammen mit Ihren anderen Arzneimitteln unbedenklich ist. Beginnen oder beenden Sie keine Arzneimittel, während Sie Lexapro 10 mg einnehmen, ohne vorher mit Ihrem Arzt gesprochen zu haben.
Wenn Sie Lexapro einnehmen, sollten Sie keine anderen Arzneimittel einnehmen, die Escitalopram oder Citalopram enthalten, einschließlich: Celexa.
Wie sollte ich Lexapro einnehmen?
Was sollte ich während der Einnahme von Lexapro vermeiden?
Lexapro 5 mg kann Schläfrigkeit verursachen oder Ihre Fähigkeit beeinträchtigen, Entscheidungen zu treffen, klar zu denken oder schnell zu reagieren. Sie sollten kein Fahrzeug führen, schwere Maschinen bedienen oder andere gefährliche Tätigkeiten ausüben, bis Sie wissen, wie Lexapro Sie beeinflusst. Trinken Sie während der Anwendung von Lexapro keinen Alkohol.
Welche Nebenwirkungen kann Lexapro 20mg haben?
Lexapro 10 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich aller derjenigen, die im Abschnitt „Was sind die wichtigsten Informationen, die ich über Lexapro wissen sollte?“ beschrieben sind.
Häufige mögliche Nebenwirkungen bei Personen, die Lexapro 5 mg einnehmen, sind:
Andere Nebenwirkungen bei Kindern und Jugendlichen sind:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt. Dies sind nicht alle möglichen Nebenwirkungen von Lexapro. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
RUFEN SIE IHREN ARZT FÜR ÄRZTLICHE RATSCHLÄGE ÜBER NEBENWIRKUNGEN AN. SIE KÖNNEN NEBENWIRKUNGEN DER FDA UNTER 1-800-FDA-1088 MELDEN.
Wie ist Lexapro 20 mg aufzubewahren?
Bewahren Sie Lexapro 10 mg und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zu Lexapro
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie Lexapro nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie Lexapro 10 mg nicht an andere Personen, selbst wenn sie die gleiche Erkrankung haben. Es kann ihnen schaden.
Dieser Arzneimittelleitfaden fasst die wichtigsten Informationen zu Lexapro zusammen. Wenn Sie weitere Informationen wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Arzt oder Apotheker um Informationen über Lexapro bitten, die für medizinisches Fachpersonal geschrieben sind.
Weitere Informationen zu Lexapro 20 mg erhalten Sie telefonisch 1-800-678-1605 oder besuchen Sie www.Lexapro.com.
Welche Inhaltsstoffe enthält Lexapro 20 mg?
Wirkstoff: Escitalopramoxalat Hilfsstoffe:
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.