Remeron 15mg, 30mg Mirtazapine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was sind Remeron und wie wird es angewendet?
Remeron ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von Depressionssymptomen. Remeron 30 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Remeron gehört zu einer Klasse von Arzneimitteln namens Antidepressiva, Alpha-2-Antagonisten; Antidepressiva, Sonstiges.
Es ist nicht bekannt, ob Remeron 30 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Remeron 30 mg haben?
Remeron kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Remeron gehören:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Remeron. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Suizidalität und Antidepressiva
Antidepressiva erhöhten im Vergleich zu Placebo das Risiko für suizidales Denken und Verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen in Kurzzeitstudien zu Major Depression (MDD) und anderen psychiatrischen Erkrankungen. Jeder, der die Anwendung von REMERON® (Mirtazapin) Tabletten oder anderen Antidepressiva bei einem Kind, Jugendlichen oder jungen Erwachsenen in Erwägung zieht, muss dieses Risiko mit der klinischen Notwendigkeit abwägen. Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; Bei Erwachsenen ab 65 Jahren war das Risiko unter Antidepressiva im Vergleich zu Placebo geringer. Depressionen und bestimmte andere psychiatrische Störungen sind selbst mit einem erhöhten Suizidrisiko verbunden. Patienten jeden Alters, die mit einer antidepressiven Therapie begonnen werden, sollten angemessen überwacht und engmaschig auf klinische Verschlechterung, Suizidalität oder ungewöhnliche Verhaltensänderungen beobachtet werden. Familien und Betreuer sollten auf die Notwendigkeit einer genauen Beobachtung und Kommunikation mit dem verschreibenden Arzt hingewiesen werden. REMERON ist nicht für die Anwendung bei pädiatrischen Patienten zugelassen. (Siehe WARNHINWEISE: Klinische Verschlechterung und Suizidrisiko, PATIENTENINFORMATIONEN und VORSICHTSMASSNAHMEN: Anwendung bei Kindern)
BEZEICHNUNG
REMERON® (Mirtazapin) Tabletten sind ein oral verabreichtes Medikament. Mirtazapin hat eine tetrazyklische chemische Struktur und gehört zur Gruppe der Piperazino-Azepine-Verbindungen. Es wird als 1,2,3,4,10,14b-Hexahydro-2-methylpyrazino[2,1-a]pyrido[2,3-c]benzazepin bezeichnet und hat die empirische Formel C17H19N3. Sein Molekulargewicht beträgt 265,36. Die Strukturformel ist die folgende und es handelt sich um die racemische Mischung:
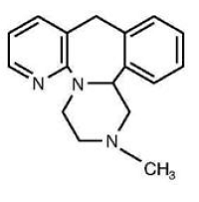
Mirtazapin ist ein weißes bis cremeweißes kristallines Pulver, das in Wasser leicht löslich ist.
REMERON wird zur oralen Verabreichung als Filmtabletten mit Bruchrille mit 15 oder 30 mg Mirtazapin und als Filmtabletten ohne Bruchkerbe mit 45 mg Mirtazapin geliefert. Jede Tablette enthält außerdem Maisstärke, Hydroxypropylcellulose, Magnesiumstearat, kolloidales Siliciumdioxid, Lactose und andere inaktive Inhaltsstoffe.
INDIKATIONEN
REMERON (Mirtazapin) Tabletten sind angezeigt zur Behandlung von schweren depressiven Störungen.
Die Wirksamkeit von REMERON bei der Behandlung von schweren depressiven Störungen wurde in kontrollierten 6-wöchigen Studien mit ambulanten Patienten nachgewiesen, deren Diagnosen am ehesten der Kategorie der schweren depressiven Störung im Diagnostic and Statistical Manual of Mental Disorders – 3rd edition (DSM-III) entsprachen (vgl KLINISCHE PHARMAKOLOGIE ).
Eine schwere depressive Episode (DSM-IV) impliziert eine auffällige und relativ anhaltende (fast jeden Tag für mindestens 2 Wochen) depressive oder dysphorische Stimmung, die normalerweise das tägliche Funktionieren beeinträchtigt und mindestens 5 der folgenden 9 Symptome umfasst: depressive Stimmung, Verlust des Interesses an üblichen Aktivitäten, erhebliche Gewichts- und/oder Appetitveränderungen, Schlaflosigkeit oder Hypersomnie, psychomotorische Erregung oder Retardierung, erhöhte Müdigkeit, Schuld- oder Wertlosigkeitsgefühle, verlangsamtes Denken oder Konzentrationsstörungen, Selbstmordversuch oder Selbstmordgedanken.
Die Wirksamkeit von REMERON 15 mg bei depressiven Patienten im Krankenhaus wurde nicht ausreichend untersucht.
Die Wirksamkeit von REMERON 15 mg bei der Aufrechterhaltung des Ansprechens bei Patienten mit schweren depressiven Störungen für bis zu 40 Wochen nach 8 bis 12 Wochen offener Erstbehandlung wurde in einer placebokontrollierten Studie nachgewiesen. Dennoch sollte der Arzt, der REMERON 15 mg über einen längeren Zeitraum einnimmt, regelmäßig den langfristigen Nutzen des Arzneimittels für den einzelnen Patienten neu bewerten (siehe KLINISCHE PHARMAKOLOGIE ).
DOSIERUNG UND ANWENDUNG
Erstbehandlung
Die empfohlene Anfangsdosis für REMERON (Mirtazapin) Tabletten beträgt 15 mg/Tag, verabreicht als Einzeldosis, vorzugsweise abends vor dem Schlafengehen. In den kontrollierten klinischen Studien, in denen die Wirksamkeit von REMERON bei der Behandlung von Major Depression nachgewiesen wurde, lag der wirksame Dosisbereich im Allgemeinen zwischen 15 und 45 mg/Tag. Obwohl die Beziehung zwischen Dosis und zufriedenstellendem Ansprechen bei der Behandlung von Major Depression auf REMERON 15 mg nicht ausreichend untersucht wurde, können Patienten, die nicht auf die Anfangsdosis von 15 mg ansprechen, von einer Dosiserhöhung bis zu einem Maximum von 45 mg/Tag profitieren. REMERON hat eine Eliminationshalbwertszeit von etwa 20 bis 40 Stunden; Daher sollten Dosisänderungen nicht in Abständen von weniger als 1 bis 2 Wochen vorgenommen werden, um ausreichend Zeit für die Beurteilung des therapeutischen Ansprechens auf eine gegebene Dosis zu haben.
Ältere Menschen und Patienten mit eingeschränkter Nieren- oder Leberfunktion
Die Clearance von Mirtazapin ist bei älteren Patienten und bei Patienten mit mäßiger bis schwerer Nieren- oder Leberfunktionsstörung verringert. Folglich sollte sich der verschreibende Arzt bewusst sein, dass die Plasmaspiegel von Mirtazapin bei diesen Patientengruppen im Vergleich zu den bei jüngeren Erwachsenen ohne Nieren- oder Leberfunktionsstörung beobachteten Spiegeln erhöht sein können (siehe VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ).
Wartung/Erweiterte Behandlung
Es besteht allgemein Einigkeit darüber, dass akute depressive Episoden mehrere Monate oder länger einer anhaltenden pharmakologischen Therapie bedürfen, die über das Ansprechen auf die akute Episode hinausgeht. Eine systematische Bewertung von REMERON (Mirtazapin) Tabletten hat gezeigt, dass seine Wirksamkeit bei schweren depressiven Störungen nach einer 8- bis 12-wöchigen Erstbehandlung mit einer Dosis von 15 bis 45 mg/Tag über einen Zeitraum von bis zu 40 Wochen anhält (vgl KLINISCHE PHARMAKOLOGIE ). Auf der Grundlage dieser begrenzten Daten ist nicht bekannt, ob die für die Erhaltungstherapie erforderliche Dosis von REMERON 30 mg mit der Dosis identisch ist, die zum Erreichen eines anfänglichen Ansprechens erforderlich ist. Die Patienten sollten regelmäßig neu untersucht werden, um die Notwendigkeit einer Erhaltungstherapie und die geeignete Dosis für eine solche Behandlung zu bestimmen.
Umstellung eines Patienten auf oder von einem Monoaminoxidase-Hemmer (MAOI) zur Behandlung psychiatrischer Störungen
Zwischen dem Absetzen eines MAO-Hemmers zur Behandlung psychiatrischer Erkrankungen und dem Beginn einer Therapie mit REMERON (Mirtazapin) Tabletten sollten mindestens 14 Tage vergehen. Umgekehrt sollten nach dem Absetzen von REMERON 30 mg mindestens 14 Tage vergehen, bevor mit einem MAO-Hemmer zur Behandlung psychiatrischer Erkrankungen begonnen wird (vgl KONTRAINDIKATIONEN ).
Verwendung von REMERON 15 mg mit anderen MAO-Hemmern wie Linezolid oder Methylenblau
Beginnen Sie nicht mit REMERON 15 mg bei einem Patienten, der mit Linezolid oder intravenösem Methylenblau behandelt wird, da ein erhöhtes Risiko für ein Serotonin-Syndrom besteht. Bei einem Patienten, der eine dringendere Behandlung einer psychiatrischen Erkrankung benötigt, sollten andere Interventionen, einschließlich eines Krankenhausaufenthalts, in Betracht gezogen werden (siehe KONTRAINDIKATIONEN ).
In einigen Fällen kann ein Patient, der bereits mit REMERON 30 mg behandelt wird, eine dringende Behandlung mit Linezolid oder intravenösem Methylenblau benötigen. Wenn keine akzeptablen Alternativen zur Behandlung mit Linezolid oder intravenösem Methylenblau verfügbar sind und der potenzielle Nutzen einer Behandlung mit Linezolid oder intravenösem Methylenblau die Risiken eines Serotonin-Syndroms bei einem bestimmten Patienten überwiegen, sollte REMERON 30 mg sofort abgesetzt und Linezolid oder Methylenblau intravenös verabreicht werden blau verabreicht werden kann. Der Patient sollte 2 Wochen lang oder bis 24 Stunden nach der letzten Dosis von Linezolid oder intravenösem Methylenblau, je nachdem, was zuerst eintritt, auf Symptome des Serotonin-Syndroms überwacht werden. Die Therapie mit REMERON 30 mg kann 24 Stunden nach der letzten Dosis von Linezolid oder Methylenblau intravenös wieder aufgenommen werden (siehe WARNUNGEN ).
Das Risiko der Verabreichung von Methylenblau auf nicht-intravenösem Weg (z. B. als orale Tabletten oder durch lokale Injektion) oder in intravenösen Dosen von viel weniger als 1 mg/kg mit REMERON ist unklar. Der Arzt sollte sich jedoch der Möglichkeit bewusst sein, dass bei einer solchen Anwendung Symptome des Serotonin-Syndroms auftreten können (siehe WARNUNGEN ).
Absetzen der REMERON-Behandlung
Es wurden Symptome im Zusammenhang mit dem Absetzen oder der Dosisreduktion von REMERON 15 mg Tabletten berichtet. Patienten sollten auf diese und andere Symptome hin überwacht werden, wenn sie die Behandlung abbrechen oder die Dosis reduzieren. Wenn immer möglich, wird eine allmähliche Reduzierung der Dosis über mehrere Wochen anstelle eines abrupten Absetzens empfohlen. Wenn nach einer Verringerung der Dosis oder beim Absetzen der Behandlung unerträgliche Symptome auftreten, sollte die Dosistitration auf der Grundlage des klinischen Ansprechens des Patienten vorgenommen werden (siehe VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ).
Informationen für Patienten
Die Patienten sollten darauf hingewiesen werden, dass die Einnahme von REMERON eine leichte Pupillenerweiterung verursachen kann, die bei empfindlichen Personen zu einem Engwinkelglaukom führen kann. Ein vorbestehendes Glaukom ist fast immer ein Offenwinkelglaukom, da ein Engwinkelglaukom, wenn es diagnostiziert wird, definitiv mit einer Iridektomie behandelt werden kann. Das Offenwinkelglaukom ist kein Risikofaktor für das Engwinkelglaukom. Patienten möchten möglicherweise untersucht werden, um festzustellen, ob sie für einen Winkelverschluss anfällig sind, und sich einem prophylaktischen Verfahren (z. B. Iridektomie) unterziehen, wenn sie anfällig sind.
WIE GELIEFERT
REMERON (Mirtazapin) Tabletten werden geliefert als:
15-mg-Tabletten — oval, gerillt, gelb, beschichtet, mit Prägung „Organon“ auf einer Seite und „T3Z “ auf der anderen Seite.
Flaschen zu 30 NDC 0052-0105-30
30-mg-Tabletten — oval, geritzt, rotbraun, beschichtet, mit Prägung „Organon“ auf einer Seite und „T5Z“ auf der anderen Seite.
Flaschen zu 30 NDC 0052-0107-30
45-mg-Tabletten — oval, weiß, beschichtet, mit Prägung „Organon“ auf einer Seite und „T7Z“ auf der anderen Seite.
Flaschen zu 30 NDC 0052-0109-30
Lagerung
Bei 20 °C bis 25 °C (68 °F bis 77 °F) lagern; Exkursionen erlaubt bis 15°C bis 30°C (59°F bis 86°F) [siehe USP kontrollierte Raumtemperatur ]. Vor Licht und Feuchtigkeit schützen.
Hergestellt für: Merck Sharp & Dohme Corp., eine Tochtergesellschaft von Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Hergestellt von: NV Organon, Oss, Niederlande, einer Tochtergesellschaft von Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Überarbeitet: Juli 2016
NEBENWIRKUNGEN
Im Zusammenhang mit dem Absetzen der Behandlung
Ungefähr 16 % der 453 Patienten, die REMERON (Mirtazapin) Tabletten in kontrollierten klinischen Studien in den USA über 6 Wochen erhielten, brachen die Behandlung aufgrund einer unerwünschten Erfahrung ab, verglichen mit 7 % der 361 mit Placebo behandelten Patienten in diesen Studien. Die häufigsten Ereignisse (≥ 1 %), die mit dem Absetzen in Zusammenhang stehen und als arzneimittelbedingt angesehen werden (d. h. die Ereignisse, die mit mindestens doppelt so hoher Abbruchrate wie bei Placebo einhergehen), sind in Tabelle 2 aufgeführt.
Häufig beobachtete Nebenwirkungen in kontrollierten klinischen Studien in den USA
Die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von REMERON (Mirtazapin)-Tabletten (Inzidenz von 5 % oder mehr) und nicht in gleicher Häufigkeit bei mit Placebo behandelten Patienten (REMERON-Inzidenz mindestens doppelt so hoch wie bei Placebo) sind in der Tabelle aufgeführt 3.
Nebenwirkungen, die bei mit REMERON behandelten Patienten mit einer Inzidenz von 1 % oder mehr auftraten
Tabelle 4 listet Nebenwirkungen auf, die bei mit REMERON (Mirtazapin) Tabletten behandelten Patienten, die an placebokontrollierten Kurzzeitstudien in den USA teilnahmen, mit einer Inzidenz von 1 % oder mehr auftraten und häufiger auftraten als in der Placebogruppe in einem Bereich von 5 bis 60 mg/Tag dosiert. Diese Tabelle zeigt den Prozentsatz der Patienten in jeder Gruppe, die zu irgendeinem Zeitpunkt während ihrer Behandlung mindestens 1 Episode eines Ereignisses hatten. Gemeldete unerwünschte Ereignisse wurden unter Verwendung einer auf COSTART basierenden Wörterbuchterminologie klassifiziert.
Der verschreibende Arzt sollte sich darüber im Klaren sein, dass diese Zahlen nicht verwendet werden können, um das Auftreten von Nebenwirkungen im Laufe der üblichen medizinischen Praxis vorherzusagen, wenn sich Patientencharakteristika und andere Faktoren von denen unterscheiden, die in den klinischen Studien vorherrschten. Ebenso können die angegebenen Häufigkeiten nicht mit Zahlen verglichen werden, die aus anderen Untersuchungen mit unterschiedlichen Behandlungen, Anwendungen und Untersuchern stammen. Die zitierten Zahlen bieten dem verschreibenden Arzt jedoch eine gewisse Grundlage für die Schätzung des relativen Beitrags von medikamentösen und nichtmedikamentösen Faktoren zur Inzidenzrate von Nebenwirkungen in der untersuchten Population.
EKG-Veränderungen
Die Elektrokardiogramme von 338 Patienten, die REMERON (Mirtazapin) Tabletten erhielten, und von 261 Patienten, die Placebo in 6-wöchigen placebokontrollierten Studien erhielten, wurden analysiert. Bei den mit Mirtazapin behandelten Patienten wurde keine QTc-Verlängerung von ≥ 500 ms beobachtet; die mittlere QTc-Änderung betrug +1,6 ms für Mirtazapin und -3,1 ms für Placebo. Mirtazapin war mit einem mittleren Anstieg der Herzfrequenz von 3,4 Schlägen pro Minute verbunden, verglichen mit 0,8 Schlägen pro Minute unter Placebo. Die klinische Bedeutung dieser Veränderungen ist nicht bekannt.
Die Wirkung von REMERON (Mirtazapin) auf das QTc-Intervall wurde in einer klinischen randomisierten Studie mit Placebo und positiven (Moxifloxacin) Kontrollen mit 54 gesunden Freiwilligen unter Verwendung einer Expositions-Wirkungs-Analyse untersucht. Diese Studie zeigte eine positive Beziehung zwischen Mirtazapin-Konzentrationen und Verlängerung des QTc-Intervalls. Der Grad der QT-Verlängerung, der sowohl mit 45 mg (therapeutischer) als auch mit 75 mg (supratherapeutischer) Dosis von Mirtazapin beobachtet wurde, war jedoch nicht auf einem Niveau, das allgemein als klinisch bedeutsam angesehen wird.
Andere unerwünschte Ereignisse, die während der Premarketing-Evaluierung von REMERON beobachtet wurden
Während der Beurteilung vor Markteinführung wurden 2796 Patienten in klinischen Studien Mehrfachdosen von REMERON (Mirtazapin)-Tabletten verabreicht. Die Bedingungen und die Dauer der Mirtazapin-Exposition waren sehr unterschiedlich und umfassten (in sich überschneidenden Kategorien) offene und doppelblinde Studien, unkontrollierte und kontrollierte Studien, stationäre und ambulante Studien, Fixdosis- und Titrationsstudien. Unerwünschte Ereignisse im Zusammenhang mit dieser Exposition wurden von klinischen Prüfern unter Verwendung einer Terminologie ihrer eigenen Wahl aufgezeichnet. Folglich ist es nicht möglich, eine aussagekräftige Schätzung des Anteils der Personen anzugeben, bei denen unerwünschte Ereignisse auftreten, ohne zunächst ähnliche Arten von unerwünschten Ereignissen in eine kleinere Anzahl standardisierter Ereigniskategorien einzuteilen.
In den folgenden Tabellen wurden die gemeldeten unerwünschten Ereignisse unter Verwendung einer Standard-COSTART-basierten Wörterbuchterminologie klassifiziert. Die dargestellten Häufigkeiten stellen daher den Anteil der 2796 Patienten dar, die Mehrfachdosen von REMERON ausgesetzt waren und bei denen während der Behandlung mit REMERON mindestens einmal ein Ereignis der genannten Art auftrat. Alle gemeldeten Ereignisse sind enthalten, mit Ausnahme der bereits in Tabelle 4 aufgelisteten Nebenwirkungen, die unter den COSTART-Begriffen subsumiert werden und entweder zu allgemein oder zu spezifisch sind, um nicht aussagekräftig zu sein, und die Ereignisse, für die eine medikamentöse Ursache sehr gering war.
Es ist wichtig zu betonen, dass, obwohl die berichteten Ereignisse während der Behandlung mit REMERON 30 mg auftraten, sie nicht unbedingt dadurch verursacht wurden.
Ereignisse werden weiter nach Körpersystem kategorisiert und in der Reihenfolge abnehmender Häufigkeit gemäß den folgenden Definitionen aufgelistet: häufige unerwünschte Ereignisse sind solche, die bei mindestens 1/100 Patienten ein- oder mehrmals auftreten; seltene unerwünschte Ereignisse treten bei 1/100 bis 1/1000 Patienten auf; seltene Ereignisse sind solche, die bei weniger als 1/1000 Patienten auftreten. In dieser Auflistung erscheinen nur die Ereignisse, die nicht bereits in Tabelle 4 aufgeführt sind. Ereignisse von großer klinischer Bedeutung werden auch in den Abschnitten WARNHINWEISE und VORSICHTSMASSNAHMEN beschrieben.
Körper als Ganzes: häufig: Unwohlsein, Bauchschmerzen, akutes Abdominalsyndrom; selten: Schüttelfrost, Fieber, Gesichtsödem, Geschwür, Lichtempfindlichkeitsreaktion, Nackensteifigkeit, Nackenschmerzen, vergrößerter Bauch; selten: Phlegmone, substernaler Brustschmerz.
Herz-Kreislauf-System: häufig: Hypertonie, Vasodilatation; selten: Angina pectoris, Myokardinfarkt, Bradykardie, ventrikuläre Extrasystolen, Synkope, Migräne, Hypotonie; selten: atriale Arrhythmie, Bigeminie, vaskulärer Kopfschmerz, Lungenembolie, zerebrale Ischämie, Kardiomegalie, Phlebitis, Linksherzinsuffizienz.
Verdauungstrakt: häufig: Erbrechen, Anorexie; selten: Aufstoßen, Glossitis, Cholezystitis, Übelkeit und Erbrechen, Zahnfleischbluten, Stomatitis, Colitis, abnorme Leberfunktionstests; Selten: Zungenverfärbung, ulzerative Stomatitis, Speicheldrüsenvergrößerung, erhöhter Speichelfluss, Darmverschluss, Pankreatitis, aphthöse Stomatitis, Leberzirrhose, Gastritis, Gastroenteritis, orale Moniliasis, Zungenödem.
Hormonsystem: selten: Kropf, Hypothyreose.
Hämisches und lymphatisches System: selten: Lymphadenopathie, Leukopenie, Petechie, Anämie, Thrombozytopenie, Lymphozytose, Panzytopenie.
Stoffwechsel- und Ernährungsstörungen: häufig: Durst; selten: Dehydration, Gewichtsverlust; selten: Gicht, SGOT erhöht, Heilungsstörungen, saure Phosphatase erhöht, SGPT erhöht, Diabetes mellitus, Hyponatriämie.
Bewegungsapparat: häufig: Myasthenie, Arthralgie; selten: Arthritis, Tenosynovitis; selten: pathologische Fraktur, Osteoporose-Fraktur, Knochenschmerzen, Myositis, Sehnenriss, Arthrose, Schleimbeutelentzündung.
Nervöses System: häufig: Hypästhesie, Apathie, Depression, Hypokinesie, Schwindel, Zuckungen, Erregung, Angst, Amnesie, Hyperkinesie, Parästhesien; selten: Ataxie, Delirium, Wahnvorstellungen, Depersonalisation, Dyskinesie, extrapyramidales Syndrom, erhöhte Libido, Koordinationsstörungen, Dysarthrie, Halluzinationen, manische Reaktion, Neurose, Dystonie, Feindseligkeit, verstärkte Reflexe, emotionale Labilität, Euphorie, paranoide Reaktion; Selten: Aphasie, Nystagmus, Akathisie (psychomotorische Unruhe), Stupor, Demenz, Diplopie, Drogenabhängigkeit, Lähmung, Grand-mal-Anfall, Muskelhypotonie, Myoklonus, psychotische Depression, Entzugssyndrom, Serotonin-Syndrom.
Atmungssystem: häufig: vermehrter Husten, Sinusitis; selten: Nasenbluten, Bronchitis, Asthma, Lungenentzündung; selten: Asphyxie, Laryngitis, Pneumothorax, Schluckauf.
Haut und Anhängsel: häufig: Pruritus, Hautausschlag; selten: Akne, exfoliative Dermatitis, trockene Haut, Herpes simplex, Alopezie; selten: Urtikaria, Herpes zoster, Hauthypertrophie, Seborrhoe, Hautgeschwür.
Besondere Sinne: selten: Augenschmerzen, Akkommodationsstörung, Konjunktivitis, Taubheit, Keratokonjunktivitis, Tränenflussstörung, Engwinkelglaukom, Hyperakusis, Ohrenschmerzen; selten: Blepharitis, teilweise vorübergehende Taubheit, Mittelohrentzündung, Geschmacksverlust, Parosmie.
Urogenitalsystem: häufig: Harnwegsinfektion; selten: Nierensteine, Zystitis, Dysurie, Harninkontinenz, Harnverhalt, Vaginitis, Hämaturie, Brustschmerzen, Amenorrhoe, Dysmenorrhoe, Leukorrhoe, Impotenz; selten: Polyurie, Urethritis, Metrorrhagie, Menorrhagie, abnorme Ejakulation, Milchstau, Brustvergrößerung, Harndrang.
Andere unerwünschte Ereignisse, die während der Bewertung von REMERON nach Markteinführung beobachtet wurden
Zu den seit Markteinführung gemeldeten unerwünschten Ereignissen, die zeitlich (aber nicht notwendigerweise kausal) mit der Mirtazapin-Therapie in Zusammenhang standen, gehören Fälle der ventrikulären Arrhythmie Torsades de Pointes. In der Mehrzahl dieser Fälle waren jedoch Begleitmedikamente impliziert. Fälle von schweren Hautreaktionen, einschließlich Stevens-Johnson-Syndrom, bullöser Dermatitis, Erythema multiforme und toxischer epidermaler Nekrolyse, wurden ebenfalls berichtet. Erhöhte Kreatinkinase-Blutspiegel und Rhabdomyolyse wurden ebenfalls berichtet.
Drogenmissbrauch und -abhängigkeit
Klasse der kontrollierten Substanz
REMERON (Mirtazapin) Tabletten sind keine kontrollierte Substanz.
Physische und psychische Abhängigkeit
REMERON (Mirtazapin) Tabletten wurden nicht systematisch an Tieren oder Menschen auf ihr Potenzial für Missbrauch, Toleranz oder körperliche Abhängigkeit untersucht. Während die klinischen Studien keine Tendenz zu Drogensuchtverhalten aufzeigten, waren diese Beobachtungen nicht systematisch und es ist nicht möglich, auf der Grundlage dieser begrenzten Erfahrung vorherzusagen, in welchem Ausmaß ein ZNS-aktives Medikament missbraucht, abgezweigt und missbraucht wird /oder einmal vermarktet missbraucht. Folglich sollten Patienten sorgfältig auf Drogenmissbrauch in der Vorgeschichte untersucht werden, und solche Patienten sollten engmaschig auf Anzeichen von REMERON-Missbrauch oder -Missbrauch (z. B. Entwicklung einer Toleranz, Dosiserhöhungen, Suchtverhalten) beobachtet werden.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Wie bei anderen Arzneimitteln ist das Potenzial für Wechselwirkungen durch eine Vielzahl von Mechanismen (z. B. pharmakodynamische, pharmakokinetische Hemmung oder Verstärkung usw.) möglich (siehe KLINISCHE PHARMAKOLOGIE ).
Monoaminoxidase-Inhibitoren
(Sehen KONTRAINDIKATIONEN , WARNUNGEN , und DOSIERUNG UND ANWENDUNG .)
Serotonerge Medikamente
(Sehen KONTRAINDIKATIONEN und WARNUNGEN .)
Medikamente, die den Leberstoffwechsel beeinflussen
Der Metabolismus und die Pharmakokinetik von REMERON (Mirtazapin) Tabletten können durch die Induktion oder Hemmung von arzneimittelmetabolisierenden Enzymen beeinflusst werden.
Arzneimittel, die durch Cytochrom P450-Enzyme metabolisiert werden und/oder diese hemmen
CYP-Enzyminduktoren
(in diesen Studien wurden beide Medikamente im Steady State verwendet)
Phenytoin
Bei gesunden männlichen Patienten (n = 18) erhöhte Phenytoin (200 mg täglich) die Clearance von Mirtazapin (30 mg täglich) um etwa das Zweifache, was zu einer Abnahme der durchschnittlichen Mirtazapin-Plasmakonzentrationen um 45 % führte. Mirtazapin beeinflusste die Pharmakokinetik von Phenytoin nicht signifikant.
Carbamazepin
Bei gesunden männlichen Patienten (n = 24) erhöhte Carbamazepin (400 mg 2-mal täglich) die Clearance von Mirtazapin (15 mg 2-mal täglich) um etwa das Zweifache, was zu einer Abnahme der durchschnittlichen Mirtazapin-Plasmakonzentrationen um 60 % führte.
Wenn Phenytoin, Carbamazepin oder ein anderer Induktor des Leberstoffwechsels (z. B. Rifampicin) zur Mirtazapin-Therapie hinzugefügt wird, muss die Mirtazapin-Dosis möglicherweise erhöht werden. Wenn die Behandlung mit einem solchen Arzneimittel abgebrochen wird, kann es erforderlich sein, die Mirtazapin-Dosis zu reduzieren.
CYP-Enzym-Inhibitoren
Cimetidin
Bei gesunden männlichen Patienten (n = 12), wenn Cimetidin, ein schwacher Inhibitor von CYP1A2, CYP2D6 und CYP3A4, gegeben mit 800 mg zweimal täglich im Steady State, gleichzeitig mit Mirtazapin (30 mg täglich) im Steady State verabreicht wurde, die Fläche unter der Kurve (AUC) von Mirtazapin stieg um mehr als 50 %. Mirtazapin verursachte keine relevanten Veränderungen der Pharmakokinetik von Cimetidin. Die Mirtazapin-Dosis muss möglicherweise verringert werden, wenn eine gleichzeitige Behandlung mit Cimetidin begonnen wird, oder erhöht werden, wenn die Behandlung mit Cimetidin beendet wird.
Ketoconazol
Bei gesunden, männlichen, kaukasischen Patienten (n = 24) erhöhte die gleichzeitige Verabreichung des starken CYP3A4-Hemmers Ketoconazol (200 mg zweimal täglich über 6,5 Tage) die Spitzenplasmaspiegel und die AUC einer Einzeldosis von 30 mg Mirtazapin um etwa 40 % und 50 % bzw.
Bei gleichzeitiger Anwendung von Mirtazapin mit starken CYP3A4-Inhibitoren, HIV-Protease-Inhibitoren, Azol-Antimykotika, Erythromycin oder Nefazodon ist Vorsicht geboten.
Paroxetin
In einer In-vivo-Interaktionsstudie bei gesunden Patienten mit schnellen CYP2D6-Metabolisierern (n = 24) verursachte Mirtazapin (30 mg/Tag) im Steady State keine relevanten Veränderungen der Pharmakokinetik von Paroxetin (40 mg/Tag) im Steady State. ein CYP2D6-Hemmer.
Andere Arzneimittelwechselwirkungen
Amitriptylin
Bei gesunden Patienten mit schnellen CYP2D6-Metabolisierern (n = 32) verursachte Amitriptylin (75 mg täglich) im Steady State keine relevanten Veränderungen der Pharmakokinetik von Mirtazapin (30 mg täglich) im Steady State; Auch Mirtazapin verursachte keine relevanten Veränderungen der Pharmakokinetik von Amitriptylin.
Warfarin
Bei gesunden männlichen Probanden (n = 16) verursachte Mirtazapin (30 mg täglich) im Steady State einen kleinen (0,2), aber statistisch signifikanten Anstieg der International Normalized Ratio (INR) bei mit Warfarin behandelten Probanden. Da bei einer höheren Mirtazapin-Dosis eine stärkere Wirkung nicht ausgeschlossen werden kann, ist es ratsam, bei gleichzeitiger Behandlung mit Warfarin und Mirtazapin die INR zu überwachen.
Lithium
Bei gesunden männlichen Probanden wurden bei gleichzeitiger Behandlung mit subtherapeutischen Lithiumspiegeln (600 mg/Tag für 10 Tage) im Steady State und einer Einzeldosis von 30 mg Mirtazapin keine relevanten klinischen Wirkungen oder signifikanten Veränderungen der Pharmakokinetik beobachtet. Die Auswirkungen höherer Lithiumdosen auf die Pharmakokinetik von Mirtazapin sind nicht bekannt.
Risperidon
In einer nicht randomisierten In-vivo-Interaktionsstudie mit Probanden (n=6), die eine Behandlung mit einem Antipsychotikum und Antidepressivum benötigten, zeigte sich, dass Mirtazapin (30 mg täglich) im Steady State die Pharmakokinetik von Risperidon (bis zu 3 mg Gebot).
Alkohol
Die gleichzeitige Gabe von Alkohol (entsprechend 60 g) hatte bei 6 gesunden männlichen Probanden eine minimale Wirkung auf die Plasmaspiegel von Mirtazapin (15 mg). Es wurde jedoch gezeigt, dass die durch REMERON verursachte Beeinträchtigung der kognitiven und motorischen Fähigkeiten zu den durch Alkohol verursachten Beeinträchtigungen addiert wird. Dementsprechend sollten die Patienten angewiesen werden, Alkohol während der Einnahme von REMERON zu vermeiden.
Diazepam
Die gleichzeitige Gabe von Diazepam (15 mg) hatte bei 12 gesunden Probanden eine minimale Wirkung auf die Plasmaspiegel von Mirtazapin (15 mg). Es hat sich jedoch gezeigt, dass die durch REMERON 30 mg verursachte Beeinträchtigung der motorischen Fähigkeiten zu der durch Diazepam verursachten Beeinträchtigung addiert wird. Dementsprechend sollten Patienten angewiesen werden, Diazepam und andere ähnliche Arzneimittel während der Einnahme von REMERON zu vermeiden.
QTc-verlängernde Medikamente
Das Risiko einer QT-Verlängerung und/oder ventrikulärer Arrhythmien (z. B. Torsades de Pointes) kann bei gleichzeitiger Anwendung von Arzneimitteln, die das QTc-Intervall verlängern (z. B. einige Antipsychotika und Antibiotika) und im Falle einer Überdosierung von Mirtazapin erhöht sein (siehe NEBENWIRKUNGEN und ÜBERDOSIS Abschnitte).
WARNUNGEN
Klinische Verschlechterung und Suizidrisiko
Bei Patienten mit schwerer depressiver Störung (MDD), sowohl bei Erwachsenen als auch bei Kindern, kann es zu einer Verschlechterung ihrer Depression und/oder zum Auftreten von Suizidgedanken und -verhalten (Suizidalität) oder zu ungewöhnlichen Verhaltensänderungen kommen, unabhängig davon, ob sie Antidepressiva einnehmen oder nicht Das Risiko kann bestehen bleiben, bis eine signifikante Remission eintritt. Selbstmord ist ein bekanntes Risiko für Depressionen und bestimmte andere psychiatrische Störungen, und diese Störungen selbst sind die stärksten Prädiktoren für Selbstmord. Es besteht jedoch seit langem die Sorge, dass Antidepressiva bei bestimmten Patienten in den frühen Phasen der Behandlung eine Rolle bei der Induktion einer Verschlechterung der Depression und dem Auftreten von Suizidalität spielen könnten. Gepoolte Analysen von placebokontrollierten Kurzzeitstudien mit Antidepressiva (SSRIs und andere) zeigten, dass diese Medikamente das Risiko für suizidales Denken und Verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen (im Alter von 18 bis 24 Jahren) mit Major Depression erhöhen Störung (MDD) und andere psychiatrische Störungen. Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; Bei Erwachsenen ab 65 Jahren war das Risiko unter Antidepressiva im Vergleich zu Placebo geringer.
Die gepoolten Analysen placebokontrollierter Studien bei Kindern und Jugendlichen mit MDD, Zwangsstörungen (OCD) oder anderen psychiatrischen Erkrankungen umfassten insgesamt 24 Kurzzeitstudien mit 9 Antidepressiva bei über 4400 Patienten. Die gepoolten Analysen placebokontrollierter Studien bei Erwachsenen mit MDD oder anderen psychiatrischen Erkrankungen umfassten insgesamt 295 Kurzzeitstudien (mediane Dauer von 2 Monaten) mit 11 Antidepressiva bei über 77.000 Patienten. Es gab beträchtliche Schwankungen des Suizidalitätsrisikos zwischen den Medikamenten, aber bei fast allen untersuchten Medikamenten eine Tendenz zu einem Anstieg bei den jüngeren Patienten. Es gab Unterschiede im absoluten Suizidrisiko bei verschiedenen Indikationen, mit der höchsten Inzidenz bei MDD. Die Risikounterschiede (Medikament vs. Placebo) waren jedoch relativ stabil innerhalb der Altersschichten und über Indikationen hinweg. Diese Risikounterschiede (Arzneimittel-Placebo-Unterschied in der Anzahl der Fälle von Suizidalität pro 1000 behandelten Patienten) sind in Tabelle 1 aufgeführt.
In keiner der pädiatrischen Studien kam es zu Suiziden. In den Studien mit Erwachsenen gab es Suizide, aber die Anzahl reichte nicht aus, um zu einer Schlussfolgerung über die Wirkung des Medikaments auf Suizide zu gelangen.
Es ist nicht bekannt, ob sich das Suizidrisiko auf eine längerfristige Anwendung erstreckt, dh über mehrere Monate hinaus. Es gibt jedoch erhebliche Hinweise aus placebokontrollierten Erhaltungsstudien bei Erwachsenen mit Depressionen, dass die Anwendung von Antidepressiva das Wiederauftreten von Depressionen verzögern kann.
Alle Patienten, die mit Antidepressiva aus beliebigen Indikationen behandelt werden, sollten angemessen überwacht und engmaschig auf eine klinische Verschlechterung, Suizidalität und ungewöhnliche Verhaltensänderungen beobachtet werden, insbesondere während der ersten Monate einer medikamentösen Therapie oder bei Dosisänderungen oder -steigerungen oder abnimmt.
Die folgenden Symptome, Angst, Agitiertheit, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Ruhelosigkeit), Hypomanie und Manie, wurden bei erwachsenen und pädiatrischen Patienten berichtet, die ebenfalls mit Antidepressiva wegen schwerer depressiver Störung behandelt wurden wie für andere Indikationen, sowohl psychiatrische als auch nichtpsychiatrische. Obwohl ein kausaler Zusammenhang zwischen dem Auftreten solcher Symptome und entweder der Verschlechterung einer Depression und/oder dem Auftreten suizidaler Impulse nicht hergestellt werden konnte, besteht die Sorge, dass solche Symptome Vorboten einer aufkommenden Suizidalität sein könnten.
Bei Patienten, deren Depression sich anhaltend verschlimmert oder die an Suizidalität oder Symptomen leiden, die Vorboten einer Verschlechterung der Depression oder Suizidalität sein könnten, sollte eine Änderung des therapeutischen Schemas, einschließlich eines möglichen Absetzens der Medikation, in Betracht gezogen werden, insbesondere wenn diese Symptome schwerwiegend und abrupt sind zu Beginn oder waren nicht Teil der Symptome des Patienten.
Familien und Betreuer von Patienten, die wegen einer schweren depressiven Störung oder anderen Indikationen, sowohl psychiatrischen als auch nichtpsychiatrischen, mit Antidepressiva behandelt werden, sollten auf die Notwendigkeit aufmerksam gemacht werden, Patienten auf das Auftreten von Unruhe, Reizbarkeit, ungewöhnlichen Verhaltensänderungen und den anderen oben beschriebenen Symptomen zu überwachen , sowie das Auftreten von Suizidalität, und solche Symptome unverzüglich dem Gesundheitsdienstleister zu melden . Eine solche Überwachung sollte die tägliche Beobachtung durch Familien und Betreuer umfassen. Rezepte für REMERON (Mirtazapin)-Tabletten sollten für die kleinste Tablettenmenge im Einklang mit einem guten Patientenmanagement ausgestellt werden, um das Risiko einer Überdosierung zu verringern.
Screening von Patienten auf bipolare Störungen
Eine schwere depressive Episode kann die anfängliche Präsentation einer bipolaren Störung sein. Es wird allgemein angenommen (obwohl dies nicht in kontrollierten Studien nachgewiesen wurde), dass die Behandlung einer solchen Episode mit einem Antidepressivum allein die Wahrscheinlichkeit des Auftretens einer gemischten/manischen Episode bei Patienten mit einem Risiko für eine bipolare Störung erhöhen kann. Ob eines der oben beschriebenen Symptome eine solche Konversion darstellt, ist unbekannt. Vor Beginn der Behandlung mit einem Antidepressivum sollten Patienten mit depressiven Symptomen jedoch angemessen untersucht werden, um festzustellen, ob bei ihnen ein Risiko für eine bipolare Störung besteht; Ein solches Screening sollte eine detaillierte psychiatrische Vorgeschichte umfassen, einschließlich einer Familienanamnese von Selbstmord, bipolarer Störung und Depression. Es sollte beachtet werden, dass REMERON (Mirtazapin) Tabletten nicht zur Behandlung von bipolarer Depression zugelassen sind.
Agranulozytose
In klinischen Studien vor der Markteinführung entwickelten 2 (1 mit Sjögren-Syndrom) von 2796 mit REMERON (Mirtazapin) Tabletten behandelten Patienten eine Agranulozytose [absolute Neutrophilenzahl (ANC)
Serotonin-Syndrom
Die Entwicklung eines potenziell lebensbedrohlichen Serotoninsyndroms wurde mit SNRIs und SSRIs, einschließlich REMERON 30 mg, allein, aber insbesondere bei gleichzeitiger Anwendung anderer serotonerger Arzneimittel (einschließlich Triptane, trizyklische Antidepressiva, Fentanyl, Lithium, Tramadol, Tryptophan, Buspiron und Johanniskraut) und mit Arzneimitteln, die den Serotoninstoffwechsel beeinträchtigen (insbesondere MAO-Hemmer, sowohl solche, die zur Behandlung psychiatrischer Erkrankungen bestimmt sind, als auch andere, wie Linezolid und intravenöses Methylenblau).
Zu den Symptomen des Serotonin-Syndroms können Veränderungen des mentalen Status (z. B. Unruhe, Halluzinationen, Delirium und Koma), autonome Instabilität (z. B. Tachykardie, labiler Blutdruck, Schwindel, Diaphorese, Hitzewallungen, Hyperthermie), neuromuskuläre Symptome (z. B. Tremor, Steifheit, Myoklonus, Hyperreflexie, Koordinationsstörungen), Krampfanfälle und/oder gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Durchfall). Die Patienten sollten auf das Auftreten eines Serotonin-Syndroms überwacht werden.
Die gleichzeitige Anwendung von REMERON 15 mg mit MAO-Hemmern zur Behandlung psychiatrischer Erkrankungen ist kontraindiziert. REMERON sollte auch nicht bei einem Patienten begonnen werden, der mit MAO-Hemmern wie Linezolid oder intravenösem Methylenblau behandelt wird. Alle Berichte mit Methylenblau, die Informationen zum Verabreichungsweg enthielten, betrafen die intravenöse Verabreichung im Dosisbereich von 1 mg/kg bis 8 mg/kg. Es gab keine Berichte über die Verabreichung von Methylenblau auf anderem Wege (wie z. B. Tabletten zum Einnehmen oder lokale Gewebeinjektion) oder in niedrigeren Dosen. Es kann Umstände geben, unter denen es erforderlich ist, bei einem Patienten, der REMERON einnimmt, eine Behandlung mit einem MAO-Hemmer wie Linezolid oder intravenösem Methylenblau einzuleiten. REMERON 15 mg sollte abgesetzt werden, bevor eine Behandlung mit dem MAO-Hemmer begonnen wird (siehe KONTRAINDIKATIONEN und DOSIERUNG UND ANWENDUNG ).
Wenn die gleichzeitige Anwendung von REMERON 30 mg mit anderen serotonergen Arzneimitteln, einschließlich Triptanen, trizyklischen Antidepressiva, Fentanyl, Lithium, Tramadol, Buspiron, Tryptophan und Johanniskraut, klinisch gerechtfertigt ist, sollten Sie sich eines potenziell erhöhten Risikos für ein Serotonin-Syndrom bewusst sein, insbesondere während Behandlungsbeginn und Dosiserhöhungen.
Die Behandlung mit REMERON 30 mg und allen begleitenden serotonergen Arzneimitteln sollte sofort abgebrochen werden, wenn die oben genannten Ereignisse auftreten, und eine unterstützende symptomatische Behandlung eingeleitet werden.
Engwinkelglaukom
Die Pupillenerweiterung, die nach der Anwendung vieler Antidepressiva, einschließlich REMERON 15 mg, auftritt, kann bei einem Patienten mit anatomisch engen Winkeln, der keine offene Iridektomie hat, eine Engwinkelattacke auslösen.
QT-Verlängerung und Torsade de Pointes
Die Wirkung von REMERON (Mirtazapin) auf das QTc-Intervall wurde in einer klinischen randomisierten Studie mit Placebo und positiven (Moxifloxacin) Kontrollen mit 54 gesunden Freiwilligen unter Verwendung einer Expositions-Wirkungs-Analyse untersucht. Diese Studie zeigte eine positive Beziehung zwischen Mirtazapin-Konzentrationen und Verlängerung des QTc-Intervalls. Der Grad der QT-Verlängerung, der sowohl mit 45 mg (therapeutischer) als auch mit 75 mg (supratherapeutischer) Dosis von Mirtazapin beobachtet wurde, war jedoch nicht auf einem Niveau, das allgemein als klinisch bedeutsam angesehen wird. Während der Postmarketing-Anwendung von Mirtazapin wurden Fälle von QT-Verlängerung, Torsades de Pointes, ventrikulärer Tachykardie und plötzlichem Herztod berichtet (siehe NEBENWIRKUNGEN ). Die Mehrzahl der Berichte trat im Zusammenhang mit einer Überdosierung oder bei Patienten mit anderen Risikofaktoren für eine QT-Verlängerung auf, einschließlich der gleichzeitigen Anwendung von QTc-verlängernden Arzneimitteln (siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und ÜBERDOSIS Abschnitte). Vorsicht ist geboten, wenn REMERON Patienten mit bekannter kardiovaskulärer Erkrankung oder QT-Verlängerung in der Familienanamnese und bei gleichzeitiger Anwendung mit anderen Arzneimitteln, von denen angenommen wird, dass sie das QTc-Intervall verlängern, verschrieben wird.
VORSICHTSMASSNAHMEN
Allgemein
Absetzsymptome
Es gab Berichte über Nebenwirkungen nach dem Absetzen von REMERON (Mirtazapin) Tabletten (insbesondere wenn abrupt), einschließlich, aber nicht beschränkt auf die folgenden: Schwindel, anormale Träume, sensorische Störungen (einschließlich Parästhesien und Elektroschocks), Unruhe, Angst, Müdigkeit, Verwirrtheit, Kopfschmerzen, Zittern, Übelkeit, Erbrechen und Schwitzen oder andere Symptome, die von klinischer Bedeutung sein können. Die Mehrzahl der gemeldeten Fälle verläuft mild und selbstlimitierend. Auch wenn diese als Nebenwirkungen berichtet wurden, sollte beachtet werden, dass diese Symptome mit der Grunderkrankung zusammenhängen können.
Patienten, die derzeit REMERON einnehmen, sollten die Behandlung NICHT abrupt abbrechen, da die Gefahr von Absetzsymptomen besteht. Zu dem Zeitpunkt, an dem eine ärztliche Entscheidung getroffen wird, die Behandlung mit REMERON abzubrechen, wird eher eine allmähliche Reduzierung der Dosis als ein abruptes Absetzen empfohlen.
Akathisie/psychomotorische Unruhe
Die Einnahme von Antidepressiva wurde mit der Entwicklung einer Akathisie in Verbindung gebracht, die durch eine subjektiv unangenehme oder belastende Unruhe und Bewegungsdrang gekennzeichnet ist, die oft von der Unfähigkeit, still zu sitzen oder zu stehen, begleitet wird. Dies tritt am ehesten in den ersten Behandlungswochen auf. Bei Patienten, die diese Symptome entwickeln, kann eine Erhöhung der Dosis schädlich sein.
Hyponatriämie
Bei der Anwendung von Mirtazapin wurde sehr selten über Hyponatriämie berichtet. Vorsicht ist geboten bei Risikopatienten, wie z. B. älteren Patienten oder Patienten, die gleichzeitig mit Arzneimitteln behandelt werden, von denen bekannt ist, dass sie eine Hyponatriämie verursachen.
Schläfrigkeit
In kontrollierten US-Studien wurde bei 54 % der mit REMERON (Mirtazapin)-Tabletten behandelten Patienten über Somnolenz berichtet, verglichen mit 18 % unter Placebo und 60 % unter Amitriptylin. In diesen Studien führte Schläfrigkeit bei 10,4 % der mit REMERON behandelten Patienten zum Abbruch, verglichen mit 2,2 % bei Placebo. Es ist unklar, ob sich eine Toleranz gegenüber den schläfrigen Wirkungen von REMERON entwickelt oder nicht. Aufgrund der möglicherweise erheblichen Auswirkungen von REMERON 30 mg auf die Leistungseinschränkung sollten Patienten davor gewarnt werden, Aktivitäten nachzugehen, die Aufmerksamkeit erfordern, bis sie in der Lage sind, die Wirkung des Arzneimittels auf ihre eigene psychomotorische Leistungsfähigkeit einzuschätzen (siehe Abschnitt 4.4). INFORMATIONEN ZUM PATIENTEN ).
Schwindel
In kontrollierten US-Studien wurde Schwindel bei 7 % der mit REMERON behandelten Patienten berichtet, verglichen mit 3 % unter Placebo und 14 % unter Amitriptylin. Es ist unklar, ob sich eine Toleranz gegenüber dem im Zusammenhang mit der Anwendung von REMERON beobachteten Schwindel entwickelt.
Erhöhter Appetit/Gewichtszunahme
In kontrollierten US-Studien wurde bei 17 % der mit REMERON 30 mg behandelten Patienten über eine Zunahme des Appetits berichtet, verglichen mit 2 % unter Placebo und 6 % unter Amitriptylin. In denselben Studien wurde bei 7,5 % der mit Mirtazapin behandelten Patienten eine Gewichtszunahme von ≥ 7 % des Körpergewichts berichtet, verglichen mit 0 % unter Placebo und 5,9 % unter Amitriptylin. In einem Pool von Premarketing-Studien in den USA, an denen viele Patienten für eine offene Langzeitbehandlung teilnahmen, brachen 8 % der Patienten, die REMERON 30 mg erhielten, die Behandlung wegen Gewichtszunahme ab. In einer 8-wöchigen pädiatrischen klinischen Studie mit Dosen zwischen 15 und 45 mg/Tag kam es bei 49 % der mit REMERON behandelten Patienten zu einer Gewichtszunahme von mindestens 7 %, verglichen mit 5,7 % der mit Placebo behandelten Patienten (vgl VORSICHTSMASSNAHMEN : Pädiatrische Verwendung ).
Cholesterin/Triglyceride
In kontrollierten US-Studien wurde bei 15 % der mit REMERON 30 mg behandelten Patienten ein Anstieg des Cholesterinspiegels außerhalb des Nüchternzustands auf ≥ 20 % über der oberen Normgrenze beobachtet, verglichen mit 7 % unter Placebo und 8 % unter Amitriptylin. In denselben Studien wurden bei 6 % der mit Mirtazapin behandelten Patienten nicht nüchtern Triglyceride auf ≥ 500 mg/dl erhöht, verglichen mit 3 % unter Placebo und 3 % unter Amitriptylin.
Transaminasenerhöhungen
Klinisch signifikante ALT (SGPT)-Erhöhungen (≥ 3-fache Obergrenze des Normalbereichs) wurden bei 2,0 % (8/424) der Patienten beobachtet, die REMERON 30 mg in einem Pool kontrollierter Kurzzeitstudien in den USA erhielten, verglichen mit 0,3 % (1/328) der Placebo-Patienten und 2,0 % (3/181) der Amitriptylin-Patienten. Die meisten dieser Patienten mit ALT-Erhöhungen entwickelten keine Anzeichen oder Symptome im Zusammenhang mit einer eingeschränkten Leberfunktion. Während einige Patienten wegen der ALT-Erhöhungen abgesetzt wurden, normalisierten sich die Enzymspiegel in anderen Fällen trotz fortgesetzter Behandlung mit REMERON. REMERON sollte bei Patienten mit eingeschränkter Leberfunktion mit Vorsicht angewendet werden (siehe KLINISCHE PHARMAKOLOGIE und DOSIERUNG UND ANWENDUNG ).
Aktivierung von Manie/Hypomanie
Manie/Hypomanie trat in Studien in den USA bei etwa 0,2 % (3/1299 Patienten) der mit REMERON behandelten Patienten auf. Obwohl die Inzidenz von Manie/Hypomanie während der Behandlung mit Mirtazapin sehr gering war, sollte es bei Patienten mit Manie/Hypomanie in der Anamnese mit Vorsicht angewendet werden.
Krampfanfall
In klinischen Studien vor der Markteinführung wurde nur 1 Anfall unter den 2796 mit REMERON behandelten Patienten in den USA und außerhalb der USA berichtet. Es wurden jedoch keine kontrollierten Studien bei Patienten mit Krampfanfällen in der Anamnese durchgeführt. Daher ist bei der Anwendung von Mirtazapin bei diesen Patienten Vorsicht geboten.
Anwendung bei Patienten mit Begleiterkrankungen
Die klinische Erfahrung mit REMERON bei Patienten mit gleichzeitiger systemischer Erkrankung ist begrenzt. Dementsprechend ist bei der Verschreibung von Mirtazapin für Patienten mit Krankheiten oder Zuständen, die den Stoffwechsel oder die hämodynamischen Reaktionen beeinflussen, Vorsicht geboten.
REMERON wurde bei Patienten mit kürzlich aufgetretenem Myokardinfarkt oder einer anderen signifikanten Herzerkrankung nicht systematisch untersucht oder in nennenswertem Umfang angewendet. REMERON wurde in frühen klinischen Pharmakologiestudien mit normalen Probanden mit signifikanter orthostatischer Hypotonie in Verbindung gebracht. In klinischen Studien mit depressiven Patienten wurde selten eine orthostatische Hypotonie beobachtet. REMERON 15 mg sollte bei Patienten mit bekannter kardiovaskulärer oder zerebrovaskulärer Erkrankung, die durch Hypotonie verschlimmert werden könnte (Myokardinfarkt, Angina pectoris oder ischämischer Schlaganfall in der Vorgeschichte) und Erkrankungen, die Patienten für Hypotonie prädisponieren würden (Dehydratation, Hypovolämie und Behandlung mit Antihypertonika), mit Vorsicht angewendet werden Medikation).
Die Mirtazapin-Clearance ist bei Patienten mit mittelschwerer [glomerulärer Filtrationsrate (GFR) = 11 - 39 ml/min/1,73 m²] und schwerer [GFR KLINISCHE PHARMAKOLOGIE und DOSIERUNG UND ANWENDUNG ).
Informationen für Patienten
Verschreibende Ärzte oder andere Angehörige der Gesundheitsberufe sollten Patienten, ihre Familien und ihre Betreuer über die Vorteile und Risiken im Zusammenhang mit der Behandlung mit REMERON (Mirtazapin)-Tabletten informieren und sie bezüglich der angemessenen Anwendung beraten. Ein Patient Leitfaden für Medikamente über „Antidepressiva, Depressionen und andere schwere psychische Erkrankungen und Selbstmordgedanken oder -handlungen“ ist für REMERON verfügbar. Der verschreibende Arzt oder medizinisches Fachpersonal sollte Patienten, ihre Familien und ihre Betreuer anweisen, die zu lesen Leitfaden für Medikamente und soll ihnen helfen, den Inhalt zu verstehen. Den Patienten sollte die Möglichkeit gegeben werden, den Inhalt des zu diskutieren Leitfaden für Medikamente und um Antworten auf eventuelle Fragen zu erhalten. Der vollständige Text der Leitfaden für Medikamente ist am Ende dieses Dokuments abgedruckt.
Die Patienten sollten auf die folgenden Probleme hingewiesen und gebeten werden, ihren verschreibenden Arzt zu informieren, wenn diese während der Einnahme von REMERON auftreten.
Klinische Verschlechterung und Suizidrisiko
Patienten, ihre Familien und ihre Betreuer sollten ermutigt werden, auf das Auftreten von Angstzuständen, Unruhe, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Unruhe), Hypomanie, Manie und anderen ungewöhnlichen Verhaltensänderungen zu achten , Verschlechterung von Depressionen und Suizidgedanken, besonders früh während der Behandlung mit Antidepressiva und wenn die Dosis nach oben oder unten angepasst wird. Familien und Betreuer von Patienten sollten angewiesen werden, täglich auf das Auftreten solcher Symptome zu achten, da Änderungen abrupt sein können. Solche Symptome sollten dem verschreibenden Arzt oder medizinischen Fachpersonal des Patienten gemeldet werden, insbesondere wenn sie schwerwiegend sind, abrupt einsetzen oder nicht zu den Symptomen des Patienten gehörten. Symptome wie diese können mit einem erhöhten Risiko für Suizidgedanken und -verhalten verbunden sein und weisen auf die Notwendigkeit einer sehr engmaschigen Überwachung und möglicherweise einer Änderung der Medikation hin.
Agranulozytose
Patienten, die REMERON erhalten sollen, sollten vor dem Risiko gewarnt werden, eine Agranulozytose zu entwickeln. Den Patienten sollte geraten werden, sich an ihren Arzt zu wenden, wenn sie Anzeichen einer Infektion wie Fieber, Schüttelfrost, Halsschmerzen, Schleimhautgeschwüre oder andere mögliche Anzeichen einer Infektion bemerken. Besonderes Augenmerk sollte auf grippeähnliche Beschwerden oder andere Symptome gelegt werden, die auf eine Infektion hindeuten könnten.
Beeinträchtigung der kognitiven und motorischen Leistung
REMERON 15 mg kann aufgrund seiner ausgeprägten sedierenden Wirkung das Urteilsvermögen, das Denkvermögen und insbesondere die motorischen Fähigkeiten beeinträchtigen. Die mit der Anwendung von Mirtazapin verbundene Schläfrigkeit kann die Verkehrstüchtigkeit, die Fähigkeit zum Bedienen von Maschinen oder die Ausführung von Aufgaben, die Wachsamkeit erfordern, beeinträchtigen. Daher sollten Patienten davor gewarnt werden, sich an gefährlichen Aktivitäten zu beteiligen, bis sie hinreichend sicher sind, dass die REMERON-Therapie ihre Fähigkeit, sich an solchen Aktivitäten zu beteiligen, nicht beeinträchtigt.
Abschluss der Therapie
Während die Patienten unter REMERON 15 mg-Therapie innerhalb von 1 bis 4 Wochen eine Besserung feststellen können, sollte ihnen geraten werden, die Therapie wie verordnet fortzusetzen.
Begleitmedikation
Patienten sollten angewiesen werden, ihren Arzt zu informieren, wenn sie verschreibungspflichtige oder rezeptfreie Arzneimittel einnehmen oder beabsichtigen, diese einzunehmen, da die Möglichkeit besteht, dass REMERON mit anderen Arzneimitteln interagiert.
Patienten sollten auf ein potenziell erhöhtes Risiko für ein Serotonin-Syndrom aufmerksam gemacht werden, wenn die gleichzeitige Anwendung von REMERON 15 mg mit anderen serotonergen Arzneimitteln, einschließlich Triptanen, trizyklischen Antidepressiva, Fentanyl, Lithium, Tramadol, Buspiron, Tryptophan und Johanniskraut, klinisch gerechtfertigt ist. insbesondere zu Beginn der Behandlung und bei Dosiserhöhungen.
Alkohol
Es hat sich gezeigt, dass die durch REMERON verursachte Beeinträchtigung der kognitiven und motorischen Fähigkeiten zu der durch Alkohol verursachten Beeinträchtigung addiert wird. Dementsprechend sollten Patienten darauf hingewiesen werden, Alkohol während der Einnahme von Mirtazapin zu vermeiden.
Schwangerschaft
Patientinnen sollte geraten werden, ihren Arzt zu informieren, wenn sie schwanger werden oder beabsichtigen, während der Therapie mit REMERON schwanger zu werden.
Pflege
Patientinnen sollten angewiesen werden, ihren Arzt zu informieren, wenn sie ein Kind stillen.
Labortests
Es werden keine routinemäßigen Labortests empfohlen.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Karzinogenitätsstudien wurden mit Mirtazapin durchgeführt, das mit der Nahrung in Dosen von 2, 20 und 200 mg/kg/Tag an Mäuse und 2, 20 und 60 mg/kg/Tag an Ratten verabreicht wurde. Die höchsten verwendeten Dosen betragen etwa das 20- bzw. 12-fache der maximal empfohlenen Humandosis (MRHD) von 45 mg/Tag auf mg/m²-Basis bei Mäusen bzw. Ratten. Bei männlichen Mäusen trat bei der hohen Dosis eine erhöhte Inzidenz von hepatozellulären Adenomen und Karzinomen auf. Bei Ratten kam es bei mittleren und hohen Dosen zu einer Zunahme von hepatozellulären Adenomen bei weiblichen Tieren und bei männlichen Tieren zu einer Zunahme von hepatozellulären Tumoren und follikulären Adenomen/Cystadenomen und Karzinomen der Schilddrüse bei hohen Dosen. Die Daten deuten darauf hin, dass die oben genannten Wirkungen möglicherweise durch nichtgenotoxische Mechanismen vermittelt werden, deren Relevanz für den Menschen nicht bekannt ist.
Die in der Mausstudie verwendeten Dosen waren möglicherweise nicht hoch genug, um das karzinogene Potenzial von REMERON (Mirtazapin) Tabletten vollständig zu charakterisieren.
Mutagenese
Mirtazapin war nicht mutagen oder klastogen und verursachte keine allgemeinen DNA-Schäden, wie in mehreren Genotoxizitätstests festgestellt wurde: Ames-Test, In-vitro-Genmutationstest in V 79-Zellen des chinesischen Hamsters, In-vitro-Schwesterchromatid-Austauschtest in kultivierten Kaninchenlymphozyten, In-vivo-Knochenmark Mikrokerntest bei Ratten und außerplanmäßiger DNA-Synthesetest in HeLa-Zellen.
Beeinträchtigung der Fruchtbarkeit
In einer Fertilitätsstudie an Ratten wurde Mirtazapin in Dosen von bis zu 100 mg/kg verabreicht [das 20-Fache der maximal empfohlenen Humandosis (MRHD) auf mg/m-Basis]. Paarung und Empfängnis wurden durch das Medikament nicht beeinflusst, aber der Östruszyklus wurde bei Dosen unterbrochen, die das 3-fache oder mehr der MRHD betrugen, und Präimplantationsverluste traten bei der 20-fachen MRHD auf.
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie C
Reproduktionsstudien an trächtigen Ratten und Kaninchen mit Dosen von bis zu 100 mg/kg bzw. 40 mg/kg [das 20- bzw. 17-fache der maximal empfohlenen Humandosis (MRHD) auf mg/m²-Basis] ergaben keine Hinweise auf teratogene Wirkungen. Bei Ratten, die mit Mirtazapin behandelt wurden, kam es jedoch zu einem Anstieg der Postimplantationsverluste. Während der ersten 3 Tage der Laktation kam es zu einem Anstieg der Todesfälle bei den Jungtieren und zu einem Rückgang des Geburtsgewichts der Jungtiere. Die Ursache dieser Todesfälle ist nicht bekannt. Die Wirkungen traten bei Dosen auf, die dem 20-fachen der MRHD entsprachen, aber nicht dem 3-fachen der MRHD, auf mg/m²-Basis. Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Stillende Mutter
Da ein Teil von REMERON in die Muttermilch übergehen kann, ist Vorsicht geboten, wenn REMERON (Mirtazapin) Tabletten an stillende Frauen verabreicht werden.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit in der pädiatrischen Population wurden nicht nachgewiesen (siehe Eingerahmte Warnung und WARNUNGEN : Klinische Verschlechterung und Suizidrisiko ). Zwei placebokontrollierte Studien an 258 pädiatrischen Patienten mit MDD wurden mit REMERON (Mirtazapin) Tabletten durchgeführt, und die Daten reichten nicht aus, um eine Behauptung zur Anwendung bei pädiatrischen Patienten zu stützen. Jeder, der die Anwendung von REMERON 30 mg bei einem Kind oder Jugendlichen in Betracht zieht, muss die potenziellen Risiken mit der klinischen Notwendigkeit abwägen.
In einer 8-wöchigen pädiatrischen klinischen Studie mit Dosen zwischen 15 und 45 mg/Tag kam es bei 49 % der mit REMERON behandelten Patienten zu einer Gewichtszunahme von mindestens 7 %, verglichen mit 5,7 % der mit Placebo behandelten Patienten. Die mittlere Gewichtszunahme betrug 4 kg (2 kg SD) bei den mit REMERON behandelten Patienten gegenüber 1 kg (2 kg SD) bei den mit Placebo behandelten Patienten (vgl VORSICHTSMASSNAHMEN : Erhöhter Appetit/Gewichtszunahme ).
Geriatrische Verwendung
Etwa 190 ältere Personen (≥ 65 Jahre) nahmen an klinischen Studien mit REMERON (Mirtazapin) Tabletten teil. Es ist bekannt, dass dieses Medikament im Wesentlichen über die Nieren ausgeschieden wird (75 %), und das Risiko einer verringerten Clearance dieses Medikaments ist bei Patienten mit eingeschränkter Nierenfunktion größer. Da bei älteren Patienten mit größerer Wahrscheinlichkeit eine eingeschränkte Nierenfunktion vorliegt, sollte die Dosis sorgfältig ausgewählt werden. Beruhigungsmittel können bei älteren Menschen zu Verwirrung und Übersedierung führen. In dieser Gruppe wurden keine ungewöhnlichen nachteiligen altersbedingten Phänomene festgestellt. Pharmakokinetische Studien zeigten eine verringerte Clearance bei älteren Patienten. Bei der Verabreichung von REMERON an ältere Patienten ist Vorsicht geboten (siehe KLINISCHE PHARMAKOLOGIE und DOSIERUNG UND ANWENDUNG ).
ÜBERDOSIS
Menschliche Erfahrung
Es liegen nur sehr begrenzte Erfahrungen mit einer Überdosierung von REMERON (Mirtazapin) Tabletten vor. In klinischen Studien vor der Markteinführung gab es 8 Berichte über eine Überdosierung von REMERON allein oder in Kombination mit anderen pharmakologischen Wirkstoffen. Der einzige Todesfall durch Überdosierung, der während der Einnahme von REMERON berichtet wurde, trat in einer klinischen Studie außerhalb der USA in Kombination mit Amitriptylin und Chlorprothixen auf. Basierend auf den Plasmaspiegeln betrug die eingenommene Dosis von REMERON 15 mg 30 bis 45 mg, während die Plasmaspiegel von Amitriptylin und Chlorprothixen toxische Werte aufwiesen. Alle anderen Fälle von Überdosierung vor der Markteinführung führten zu einer vollständigen Genesung. Zu den im Zusammenhang mit einer Überdosierung berichteten Anzeichen und Symptomen gehörten Orientierungslosigkeit, Schläfrigkeit, Gedächtnisstörungen und Tachykardie. Es gab keine Berichte über EKG-Anomalien, Koma oder Krämpfe nach einer Überdosierung mit REMERON allein.
Basierend auf Postmarketing-Berichten besteht jedoch die Möglichkeit schwerwiegenderer Folgen (einschließlich Todesfälle) bei Dosierungen, die viel höher als die therapeutische Dosis sind, insbesondere bei gemischten Überdosierungen. In diesen Fällen wurde auch über QT-Verlängerung und Torsades de Pointes berichtet (siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und NEBENWIRKUNGEN Abschnitte).
Überdosierungsmanagement
Die Behandlung sollte aus den allgemeinen Maßnahmen bestehen, die bei der Behandlung einer Überdosierung mit jedem Arzneimittel angewendet werden, das bei der Behandlung einer Major Depression wirksam ist. Sorgen Sie für ausreichende Atemwege, Sauerstoffversorgung und Belüftung. Überwachen Sie EKG-Parameter (einschließlich Herzrhythmus) und Vitalfunktionen. Allgemeine unterstützende und symptomatische Maßnahmen werden ebenfalls empfohlen. Die Induktion von Erbrechen wird nicht empfohlen. Eine Magenspülung mit einer großlumigen Magensonde mit angemessenem Atemwegsschutz kann, falls erforderlich, indiziert sein, wenn sie kurz nach der Einnahme oder bei symptomatischen Patienten durchgeführt wird. Aktivkohle sollte verabreicht werden. Es liegen keine Erfahrungen mit der Anwendung von forcierter Diurese, Dialyse, Hämoperfusion oder Austauschtransfusion bei der Behandlung einer Überdosierung von Mirtazapin vor. Es sind keine spezifischen Gegenmittel für Mirtazapin bekannt.
Berücksichtigen Sie bei der Behandlung einer Überdosierung die Möglichkeit einer Beteiligung mehrerer Arzneimittel. Der Arzt sollte erwägen, sich an ein Giftinformationszentrum zu wenden, um weitere Informationen zur Behandlung einer Überdosierung zu erhalten. Telefonnummern für zertifizierte Giftnotrufzentralen sind in der Physicians' Desk Reference (PDR) aufgeführt.
KONTRAINDIKATIONEN
Überempfindlichkeit
REMERON (Mirtazapin) Tabletten sind bei Patienten mit bekannter Überempfindlichkeit gegen Mirtazapin oder einen der sonstigen Bestandteile kontraindiziert.
Monoaminoxidase-Inhibitoren
Die Anwendung von Monoaminoxidase-Hemmern (MAO-Hemmern) zur Behandlung psychiatrischer Erkrankungen mit REMERON 15 mg Tabletten oder innerhalb von 14 Tagen nach Beendigung der Behandlung mit REMERON 15 mg ist aufgrund eines erhöhten Risikos für ein Serotonin-Syndrom kontraindiziert. Die Anwendung von REMERON 15 mg innerhalb von 14 Tagen nach Absetzen eines MAO-Hemmers zur Behandlung psychiatrischer Erkrankungen ist ebenfalls kontraindiziert (vgl WARNUNGEN und DOSIERUNG UND ANWENDUNG ).
Der Beginn von REMERON bei einem Patienten, der mit MAO-Hemmern wie Linezolid oder intravenösem Methylenblau behandelt wird, ist aufgrund eines erhöhten Risikos für ein Serotonin-Syndrom ebenfalls kontraindiziert (siehe WARNUNGEN und DOSIERUNG UND ANWENDUNG ).
KLINISCHE PHARMAKOLOGIE
Pharmakodynamik
Der Wirkungsmechanismus von REMERON (Mirtazapin) Tabletten ist wie bei anderen Arzneimitteln, die bei der Behandlung einer Major Depression wirksam sind, nicht bekannt.
In vorklinischen Studien gesammelte Beweise deuten darauf hin, dass Mirtazapin die zentrale noradrenerge und serotonerge Aktivität verstärkt. Diese Studien haben gezeigt, dass Mirtazapin als Antagonist an zentralen präsynaptischen α2-adrenergen inhibitorischen Autorezeptoren und Heterorezeptoren wirkt, eine Wirkung, von der postuliert wird, dass sie zu einer Erhöhung der zentralen noradrenergen und serotonergen Aktivität führt.
Mirtazapin ist ein starker Antagonist der 5-HT2- und 5-HT3-Rezeptoren. Mirtazapin hat keine signifikante Affinität zu den 5-HT1A- und 5-HT1B-Rezeptoren.
Mirtazapin ist ein starker Antagonist von Histamin (H1)-Rezeptoren, eine Eigenschaft, die seine herausragende sedierende Wirkung erklären könnte.
Mirtazapin ist ein moderater peripherer α-adrenerger Antagonist, eine Eigenschaft, die die gelegentliche orthostatische Hypotonie erklären könnte, über die im Zusammenhang mit seiner Anwendung berichtet wurde.
Mirtazapin ist ein mäßiger Antagonist an muskarinischen Rezeptoren, eine Eigenschaft, die die relativ geringe Häufigkeit von anticholinergen Nebenwirkungen im Zusammenhang mit seiner Anwendung erklären könnte.
Pharmakokinetik
REMERON (Mirtazapin) Tabletten werden nach oraler Verabreichung schnell und vollständig resorbiert und haben eine Halbwertszeit von etwa 20 bis 40 Stunden. Maximale Plasmakonzentrationen werden innerhalb von etwa 2 Stunden nach einer oralen Dosis erreicht. Das Vorhandensein von Nahrung im Magen hat einen minimalen Einfluss sowohl auf die Geschwindigkeit als auch auf das Ausmaß der Resorption und erfordert keine Dosisanpassung.
Mirtazapin wird nach oraler Gabe weitgehend metabolisiert. Hauptwege der Biotransformation sind Demethylierung und Hydroxylierung, gefolgt von Glucuronid-Konjugation. In-vitro-Daten aus menschlichen Lebermikrosomen weisen darauf hin, dass Cytochrom 2D6 und 1A2 an der Bildung des 8-Hydroxy-Metaboliten von Mirtazapin beteiligt sind, während Cytochrom 3A als verantwortlich für die Bildung des N-Desmethyl- und N-Oxid-Metaboliten angesehen wird. Mirtazapin hat eine absolute Bioverfügbarkeit von etwa 50 %. Es wird überwiegend über den Urin (75 %) und zu 15 % über den Kot ausgeschieden. Mehrere unkonjugierte Metaboliten besitzen pharmakologische Aktivität, sind jedoch in sehr geringen Konzentrationen im Plasma vorhanden. Das (-)-Enantiomer hat eine etwa doppelt so lange Eliminationshalbwertszeit wie das (+)-Enantiomer und erreicht daher etwa 3-mal so hohe Plasmaspiegel wie das (+)-Enantiomer.
Die Plasmaspiegel stehen in einem Dosisbereich von 15 bis 80 mg in linearem Zusammenhang mit der Dosis. Die mittlere Eliminationshalbwertszeit von Mirtazapin nach oraler Verabreichung reicht von etwa 20 bis 40 Stunden über Alters- und Geschlechtsuntergruppen hinweg, wobei Frauen jeden Alters signifikant längere Eliminationshalbwertszeiten aufweisen als Männer (mittlere Halbwertszeit von 37 Stunden für Frauen vs. 26 Stunden). Für Männer). Steady-State-Plasmaspiegel von Mirtazapin werden innerhalb von 5 Tagen mit einer Akkumulation von etwa 50 % erreicht (Akkumulationsverhältnis = 1,5).
Mirtazapin wird in einem Konzentrationsbereich von 0,01 bis 10 µg/ml zu etwa 85 % an Plasmaproteine gebunden.
Besondere Populationen
Geriatrie
Nach oraler Gabe von REMERON (Mirtazapin) Tabletten 20 mg/Tag über 7 Tage an Personen unterschiedlichen Alters (Bereich 25 – 74) war die orale Clearance von Mirtazapin bei älteren Personen im Vergleich zu jüngeren Personen verringert. Die Unterschiede waren bei Männern am auffälligsten, mit einer um 40 % niedrigeren Clearance bei älteren Männern im Vergleich zu jüngeren Männern, während die Clearance bei älteren Frauen im Vergleich zu jüngeren Frauen nur um 10 % niedriger war. Bei der Verabreichung von REMERON 30 mg an ältere Patienten ist Vorsicht geboten (siehe VORSICHTSMASSNAHMEN und DOSIERUNG UND ANWENDUNG ).
Pädiatrie
Sicherheit und Wirksamkeit von Mirtazapin bei Kindern und Jugendlichen sind nicht erwiesen (siehe VORSICHTSMASSNAHMEN ).
Geschlecht
Die mittlere Eliminationshalbwertszeit von Mirtazapin nach oraler Verabreichung reicht von etwa 20 bis 40 Stunden über Alters- und Geschlechtsuntergruppen hinweg, wobei Frauen jeden Alters signifikant längere Eliminationshalbwertszeiten aufweisen als Männer (mittlere Halbwertszeit von 37 Stunden für Frauen vs. 26 Stunden für Männer) (vgl Pharmakokinetik ).
Wettrennen
Es wurden keine klinischen Studien durchgeführt, um den Einfluss der ethnischen Zugehörigkeit auf die Pharmakokinetik von REMERON zu untersuchen.
Niereninsuffizienz
Die Disposition von Mirtazapin wurde bei Patienten mit unterschiedlich ausgeprägter Nierenfunktion untersucht. Die Elimination von Mirtazapin korreliert mit der Kreatinin-Clearance. Die Gesamtkörper-Clearance von Mirtazapin war bei Patienten mit mäßiger (Clcr = 11 – 39 ml/min/1,73 m²) und etwa 50 % bei Patienten mit schwerer (Clcr = VORSICHTSMASSNAHMEN und DOSIERUNG UND ANWENDUNG ).
Leberinsuffizienz
Nach einer oralen Einzeldosis von 15 mg REMERON war die orale Clearance von Mirtazapin bei Patienten mit eingeschränkter Leberfunktion im Vergleich zu Patienten mit normaler Leberfunktion um etwa 30 % verringert. Bei der Verabreichung von REMERON an Patienten mit eingeschränkter Leberfunktion ist Vorsicht geboten (siehe VORSICHTSMASSNAHMEN und DOSIERUNG UND ANWENDUNG ).
Klinische Studien zeigen Wirksamkeit
Die Wirksamkeit von REMERON (Mirtazapin) Tabletten zur Behandlung einer schweren depressiven Störung wurde in 4 placebokontrollierten, 6-wöchigen Studien mit erwachsenen ambulanten Patienten nachgewiesen, die die DSM-III-Kriterien für eine schwere depressive Störung erfüllten. Die Patienten wurden mit Mirtazapin in einem Dosisbereich von 5 mg bis zu 35 mg/Tag titriert. Insgesamt zeigten diese Studien, dass Mirtazapin Placebo bei mindestens 3 der folgenden 4 Messungen überlegen ist: 21-Punkte Hamilton Depression Rating Scale (HDRS) Gesamtpunktzahl; HDRS-Element „Depressive Stimmung“; CGI-Schweregrad-Score; und Montgomery and Asberg Depression Rating Scale (MADRS). Eine Überlegenheit von Mirtazapin gegenüber Placebo wurde auch für bestimmte Faktoren des HDRS festgestellt, einschließlich des Angst-/Somatisierungsfaktors und des Schlafstörungsfaktors. Die mittlere Mirtazapin-Dosis für Patienten, die diese 4 Studien abgeschlossen hatten, lag zwischen 21 und 32 mg/Tag. Eine fünfte Studie mit ähnlichem Design verwendete eine höhere Dosis (bis zu 50 mg) pro Tag und zeigte ebenfalls Wirksamkeit.
Die Untersuchung von alters- und geschlechtsspezifischen Untergruppen der Bevölkerung ergab keine unterschiedliche Reaktionsfähigkeit auf der Grundlage dieser Untergruppen.
In einer längerfristigen Studie wurden Patienten, die die (DSM-IV)-Kriterien für eine schwere depressive Störung erfüllten und während einer anfänglichen 8- bis 12-wöchigen Akutbehandlung auf REMERON 30 mg angesprochen hatten, randomisiert einer Fortsetzung von REMERON 15 mg oder Placebo für bis zu 40 Wochen unterzogen Beobachtung auf Rückfall. Das Ansprechen während der offenen Phase wurde definiert als Erreichen eines HAM-D 17-Gesamtscores von ≤ 8 und eines CGI-Verbesserungs-Scores von 1 oder 2 bei zwei aufeinanderfolgenden Besuchen, beginnend mit Woche 6 der 8 bis 12 Wochen in der offenen Phase des Studiums. Rückfälle während der doppelblinden Phase wurden von den einzelnen Untersuchern festgestellt. Bei Patienten, die die Behandlung mit REMERON 30 mg fortsetzten, kam es in den folgenden 40 Wochen zu signifikant geringeren Rückfallraten im Vergleich zu Patienten, die Placebo erhielten. Dieses Muster zeigte sich sowohl bei männlichen als auch bei weiblichen Patienten.
INFORMATIONEN ZUM PATIENTEN
REMERON® (rem' - e - ron) (Mirtazapin) Tabletten
Was sind die wichtigsten Informationen, die ich über REMERON® wissen sollte?
REMERON 15 mg und andere Antidepressiva können schwerwiegende Nebenwirkungen haben, einschließlich:
1. Selbstmordgedanken oder -handlungen:
Halten Sie alle Nachsorgetermine bei Ihrem Arzt und rufen Sie zwischen den Terminen an, wenn Sie sich wegen der Symptome Sorgen machen.
Rufen Sie sofort Ihren Arzt an, wenn Sie eines der folgenden Symptome haben, oder rufen Sie 911 an, wenn ein Notfall auftritt, insbesondere wenn sie neu oder schlimmer sind oder Sie sich Sorgen machen:
Rufen Sie sofort Ihren Arzt an, wenn Sie eines der folgenden Symptome haben, oder rufen Sie im Notfall 911 an. REMERON kann mit diesen schwerwiegenden Nebenwirkungen in Verbindung gebracht werden:
2. Manische Episoden:
3. Verminderte weiße Blutkörperchen sogenannte Neutrophile, die zur Bekämpfung von Infektionen benötigt werden. Informieren Sie Ihren Arzt, wenn Sie Anzeichen einer Infektion wie Fieber, Schüttelfrost, Halsschmerzen oder wunde Stellen im Mund oder in der Nase haben, insbesondere bei grippeähnlichen Symptomen.
4. Serotonin-Syndrom. Dieser Zustand kann lebensbedrohlich sein und Folgendes umfassen:
5. Visuelle Probleme
Nur einige Menschen sind für diese Probleme gefährdet. Möglicherweise möchten Sie sich einer Augenuntersuchung unterziehen, um festzustellen, ob Sie gefährdet sind, und eine vorbeugende Behandlung erhalten, wenn dies der Fall ist.
6. Krampfanfälle
7. Niedriger Salz- (Natrium-)Spiegel im Blut.
Ältere Menschen sind möglicherweise einem höheren Risiko ausgesetzt. Zu den Symptomen können gehören:
8. Schläfrigkeit. Am besten nehmen REMERON kurz vor dem Schlafengehen.
9. Schwere Hautreaktionen: Rufen Sie sofort Ihren Arzt an, wenn Sie eines oder alle der folgenden Symptome haben:
10. Schwere allergische Reaktionen: Atembeschwerden, Schwellung von Gesicht, Zunge, Augen oder Mund
11. Anstieg des Appetits oder des Gewichts. Größe und Gewicht von Kindern und Jugendlichen sollten während der Behandlung überwacht werden.
12. Erhöhte Cholesterin- und Triglyceridspiegel in Ihrem Blut
Setzen Sie REMERON 15 mg nicht ab, ohne vorher mit Ihrem Arzt gesprochen zu haben. Ein zu schnelles Absetzen von REMERON 15 mg kann möglicherweise schwerwiegende Symptome hervorrufen, einschließlich:
Was ist REMERON 15 mg?
REMERON 15 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von Depressionen. Es ist wichtig, mit Ihrem Arzt über die Risiken der Behandlung von Depressionen und auch über die Risiken einer Nichtbehandlung zu sprechen. Sie sollten alle Behandlungsoptionen mit Ihrem Arzt besprechen.
Sprechen Sie mit Ihrem Arzt, wenn Sie glauben, dass sich Ihr Zustand durch die Behandlung mit REMERON nicht bessert.
Wer sollte REMERON 15 mg nicht einnehmen?
REMERON darf nicht eingenommen werden:
Personen, die REMERON 15 mg kurz vor einem MAO-Hemmer einnehmen, können schwerwiegende oder sogar lebensbedrohliche Nebenwirkungen haben. Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines dieser Symptome haben:
Was sollte ich meinem Arzt vor der Einnahme von REMERON mitteilen?
Bevor Sie REMERON einnehmen, informieren Sie Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen. REMERON und einige Arzneimittel können miteinander interagieren, möglicherweise nicht so gut wirken oder schwerwiegende Nebenwirkungen verursachen.
Ihr Arzt oder Apotheker kann Ihnen sagen, ob es sicher ist, REMERON 15 mg zusammen mit Ihren anderen Arzneimitteln einzunehmen. Beginnen oder beenden Sie keine Arzneimittel, während Sie REMERON einnehmen, ohne vorher mit Ihrem Arzt gesprochen zu haben. Wenn Sie REMERON 30 mg einnehmen, sollten Sie keine anderen Arzneimittel einnehmen, die Mirtazapin enthalten, einschließlich REMERON 30 mgSolTab®.
Wie soll ich REMERON einnehmen?
Zu den Symptomen einer möglichen Überdosierung können Veränderungen Ihres Herzrhythmus (schneller, unregelmäßiger Herzschlag) oder Ohnmacht gehören, die Symptome eines lebensbedrohlichen Zustands sein können, der als Torsade de Pointes bekannt ist.
Was sollte ich während der Einnahme von REMERON 15 mg vermeiden?
Welche Nebenwirkungen kann REMERON haben?
REMERON kann schwerwiegende Nebenwirkungen verursachen:
Zu den häufigsten Nebenwirkungen von REMERON gehören:
Dies sind nicht alle möglichen Nebenwirkungen von REMERON.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist REMERON aufzubewahren?
Bewahren Sie REMERON 30 mg und alle Arzneimittel für Kinder unzugänglich auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von REMERON.
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie REMERON 15 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie REMERON nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden. Sie können Ihren Apotheker oder Gesundheitsdienstleister nach Informationen über REMERON 30 mg fragen, die für medizinisches Fachpersonal bestimmt sind.
Welche Inhaltsstoffe enthält REMERON 15 mg?
Wirkstoff: Mirtazapin
Inaktive Zutaten :