Wellbutrin 150mg, 300mg Bupropion Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Wellbutrin 150 mg und wie wird es angewendet?
Wellbutrin 150 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome einer schweren Depression und saisonaler Depression. Wellbutrin 150 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Wellbutrin 150mg gehört zu einer Klasse von Medikamenten namens Antidepressiva, Dopamin-Wiederaufnahmehemmer, Antidepressiva, andere, Raucherentwöhnungshilfen.
Welche Nebenwirkungen kann Wellbutrin 150 mg haben?
Wellbutrin kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Wellbutrin gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Wellbutrin. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden
WARNUNG
Selbstmordgedanken und Verhaltensweisen
SUIZIDALITÄT UND ANTIDEPRESSIONSMITTEL
Antidepressiva erhöhten in Kurzzeitstudien das Risiko von Suizidgedanken und -verhalten bei Kindern, Jugendlichen und jungen Erwachsenen. Diese Studien zeigten keine Erhöhung des Risikos für Suizidgedanken und -verhalten bei Anwendung von Antidepressiva bei Personen über 24 Jahren; bei Patienten ab 65 Jahren war das Risiko bei Anwendung von Antidepressiva geringer [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
Bei Patienten jeden Alters, die mit einer antidepressiven Therapie begonnen werden, ist eine genaue Überwachung auf eine Verschlechterung und das Auftreten von Suizidgedanken und -verhalten vorzunehmen. Informieren Sie Familien und Pflegekräfte über die Notwendigkeit einer genauen Beobachtung und Kommunikation mit dem verschreibenden Arzt [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
BEZEICHNUNG
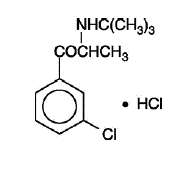
WELLBUTRIN (Bupropionhydrochlorid), ein Antidepressivum aus der Klasse der Aminoketone, ist chemisch nicht mit trizyklischen, tetrazyklischen, selektiven Serotonin-Wiederaufnahmehemmern oder anderen bekannten Antidepressiva verwandt. Seine Struktur ähnelt stark der von Diethylpropion; es ist verwandt mit Phenylethylaminen. Es wird als (±)-1-(3-Chlorphenyl)-2-[(1,1-dimethylethyl)amino]-1-propanonhydrochlorid bezeichnet. Das Molekulargewicht beträgt 276,2. Die Summenformel ist C13H18ClNO·HCl. Bupropion-Hydrochlorid-Pulver ist weiß, kristallin und in Wasser gut löslich. Es hat einen bitteren Geschmack und erzeugt auf der Mundschleimhaut das Gefühl einer Lokalanästhesie. Die Strukturformel lautet:
WELLBUTRIN wird zur oralen Verabreichung als 75-mg- (gelbgoldene) und 100-mg- (rote) Filmtabletten geliefert. Jede Tablette enthält die auf dem Etikett angegebene Menge Bupropionhydrochlorid und die inaktiven Bestandteile: 75-mg-Tablette – D&C Yellow Nr. 10 Lake, FD&C Yellow No. 6 Lake, Hydroxypropylcellulose, Hypromellose, mikrokristalline Cellulose, Polyethylenglycol, Talk und Titandioxid; 100-mg-Tablette – FD&C Red No. 40 Lake, FD&C Yellow No. 6 Lake, Hydroxypropylcellulose, Hypromellose, mikrokristalline Cellulose, Polyethylenglycol, Talk und Titandioxid.
INDIKATIONEN
WELLBUTRIN (Bupropionhydrochlorid) ist für die Behandlung der Major Depression (MDD) gemäß Definition im Diagnostic and Statistical Manual (DSM) indiziert.
Die Wirksamkeit von WELLBUTRIN 300 mg bei der Behandlung einer Episode einer Major Depression wurde in zwei 4-wöchigen kontrollierten stationären Studien und einer 6-wöchigen kontrollierten ambulanten Studie mit erwachsenen Probanden mit MDD nachgewiesen [siehe Klinische Studien ].
DOSIERUNG UND ANWENDUNG
Allgemeine Gebrauchsanweisung
Um das Krampfrisiko zu minimieren, erhöhen Sie die Dosis schrittweise [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Dosiserhöhungen sollten 100 mg/Tag über einen Zeitraum von 3 Tagen nicht überschreiten. WELLBUTRIN-Tabletten sollten im Ganzen geschluckt und nicht zerkleinert, geteilt oder gekaut werden. WELLBUTRIN 300 mg kann mit oder ohne Nahrung eingenommen werden.
Die empfohlene Anfangsdosis beträgt 200 mg/Tag, gegeben als 100 mg zweimal täglich. Nach 3-tägiger Einnahme kann die Dosis auf 300 mg/Tag erhöht werden, verabreicht als 100 mg 3-mal täglich, mit mindestens 6 Stunden zwischen aufeinanderfolgenden Dosen. Dosierungen über 300 mg/Tag können mit den 75- oder 100-mg-Tabletten erreicht werden.
Bei Patienten, die nach mehrwöchiger Behandlung mit 300 mg/Tag keine klinische Besserung zeigen, kann eine Höchstdosis von 450 mg/Tag, aufgeteilt in Einzeldosen von jeweils nicht mehr als 150 mg, in Betracht gezogen werden. Verabreichen Sie die 100-mg-Tablette 4-mal täglich, um die Grenze von 150 mg in einer Einzeldosis nicht zu überschreiten.
Es besteht allgemein Einigkeit darüber, dass akute Depressionsepisoden eine mehrmonatige oder längere Behandlung mit Antidepressiva über das Ansprechen in der akuten Episode hinaus erfordern. Es ist nicht bekannt, ob die für die Erhaltungstherapie benötigte WELLBUTRIN-Dosis mit der Dosis identisch ist, die zu einem anfänglichen Ansprechen geführt hat. Überprüfen Sie regelmäßig die Notwendigkeit einer Erhaltungstherapie und die angemessene Dosis für eine solche Behandlung.
Dosisanpassung bei Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit mittelschwerer bis schwerer Leberfunktionsstörung (Child-Pugh-Score: 7 bis 15) beträgt die Höchstdosis von WELLBUTRIN 150 mg 75 mg/Tag. Bei Patienten mit leichter Leberfunktionsstörung (Child-Pugh-Score: 5 bis 6) sollte eine Reduzierung der Dosis und/oder der Häufigkeit der Anwendung in Betracht gezogen werden [siehe Verwendung in bestimmten Bevölkerungsgruppen , KLINISCHE PHARMAKOLOGIE ].
Dosisanpassung bei Patienten mit eingeschränkter Nierenfunktion
Erwägen Sie, die Dosis und/oder Häufigkeit von WELLBUTRIN 150 mg bei Patienten mit eingeschränkter Nierenfunktion (glomeruläre Filtrationsrate unter 90 ml/min) zu reduzieren [siehe Verwendung in bestimmten Bevölkerungsgruppen , KLINISCHE PHARMAKOLOGIE ].
Umstellung eines Patienten auf oder von einem Monoaminoxidase-Hemmer (MAOI) Antidepressivum
Zwischen dem Absetzen eines MAO-Hemmers zur Behandlung von Depressionen und dem Beginn einer Therapie mit WELLBUTRIN sollten mindestens 14 Tage vergehen. Umgekehrt sollten nach dem Absetzen von WELLBUTRIN mindestens 14 Tage gewartet werden, bevor mit einem MAOI-Antidepressivum begonnen wird [siehe KONTRAINDIKATIONEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Verwendung von WELLBUTRIN mit reversiblen MAOIs wie Linezolid oder Methylenblau
Beginnen Sie nicht mit WELLBUTRIN 300 mg bei einem Patienten, der mit einem reversiblen MAO-Hemmer wie Linezolid oder Methylenblau intravenös behandelt wird. Arzneimittelwechselwirkungen können das Risiko von hypertensiven Reaktionen erhöhen. Bei einem Patienten, der eine dringendere Behandlung einer psychiatrischen Erkrankung benötigt, sollten nicht-pharmakologische Interventionen, einschließlich Krankenhausaufenthalt, in Betracht gezogen werden [siehe KONTRAINDIKATIONEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
In einigen Fällen kann ein Patient, der bereits eine Therapie mit WELLBUTRIN erhält, eine dringende Behandlung mit Linezolid oder intravenösem Methylenblau benötigen. Wenn keine akzeptablen Alternativen zur Behandlung mit Linezolid oder intravenösem Methylenblau verfügbar sind und der potenzielle Nutzen einer Behandlung mit Linezolid oder intravenösem Methylenblau die Risiken einer hypertensiven Reaktion bei einem bestimmten Patienten überwiegt, sollte WELLBUTRIN 300 mg sofort abgesetzt und Linezolid oder intravenöses Methylenblau verabreicht werden blau verabreicht werden kann. Der Patient sollte 2 Wochen lang oder bis 24 Stunden nach der letzten Dosis von Linezolid oder intravenösem Methylenblau überwacht werden, je nachdem, was zuerst eintritt. Die Therapie mit WELLBUTRIN 300 mg kann 24 Stunden nach der letzten Gabe von Linezolid oder intravenösem Methylenblau wieder aufgenommen werden.
Das Risiko der Verabreichung von Methylenblau auf nicht-intravenösem Wege (z. B. als Tabletten zum Einnehmen oder durch lokale Injektion) oder in intravenösen Dosen von viel weniger als 1 mg/kg mit WELLBUTRIN 300 mg ist unklar. Der Kliniker sollte sich jedoch der Möglichkeit einer Arzneimittelwechselwirkung bei einer solchen Anwendung bewusst sein [siehe KONTRAINDIKATIONEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
WIE GELIEFERT
Darreichungsformen und Stärken
Lagerung und Handhabung
WELLBUTRIN 150 mg Tabletten, 75 mg Bupropionhydrochlorid, sind gelbgoldene, runde, bikonvexe Tabletten mit dem Aufdruck „WELLBUTRIN 75“ in Flaschen mit 100 ( NDC 0173-0177-55).
WELLBUTRIN Tabletten, 100 mg Bupropionhydrochlorid, sind rote, runde, bikonvexe Tabletten mit dem Aufdruck „WELLBUTRIN 100“ in Flaschen mit 100 ( NDC 0173-0178-55).
Bei Raumtemperatur lagern, 20° bis 25°C (68° bis 77°F); Exkursionen zwischen 15°C und 30°C (59°F und 86°F) erlaubt [Siehe USP kontrollierte Raumtemperatur ]. Vor Licht und Feuchtigkeit schützen.
Hergestellt für: GlaxoSmithKline, Research Triangle Park,. Überarbeitet: November 2019
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden in anderen Abschnitten der Kennzeichnung ausführlicher erörtert:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Nebenwirkungen, die zum Abbruch der Behandlung führen
Bei ungefähr 10 % der 2.400 Probanden und gesunden Probanden, die während der anfänglichen Entwicklung des Produkts an klinischen Studien teilnahmen, waren die Nebenwirkungen so belastend, dass sie zum Abbruch der Behandlung mit WELLBUTRIN führten. Zu den häufigeren Ereignissen, die zu einem Abbruch führten, gehören neuropsychiatrische Störungen (3,0 %), hauptsächlich Agitiertheit und Anomalien des Geisteszustands; Magen-Darm-Störungen (2,1 %), hauptsächlich Übelkeit und Erbrechen; neurologische Störungen (1,7 %), hauptsächlich Krampfanfälle, Kopfschmerzen und Schlafstörungen; und dermatologische Probleme (1,4 %), hauptsächlich Hautausschläge. Es ist jedoch wichtig zu beachten, dass viele dieser Ereignisse bei Dosen auftraten, die die empfohlene Tagesdosis überschritten.
Häufig beobachtete Nebenwirkungen
Nebenwirkungen, die häufig bei mit WELLBUTRIN behandelten Personen auftreten, sind Unruhe, Mundtrockenheit, Schlaflosigkeit, Kopfschmerzen/Migräne, Übelkeit/Erbrechen, Verstopfung, Zittern, Schwindel, übermäßiges Schwitzen, verschwommenes Sehen, Tachykardie, Verwirrtheit, Hautausschlag, Feindseligkeit, Herzrhythmusstörungen und Hörstörungen Störung.
Tabelle 2 fasst die Nebenwirkungen zusammen, die in placebokontrollierten Studien mit einer Inzidenz von mindestens 1 % der Probanden, die WELLBUTRIN 150 mg erhielten, und häufiger bei diesen Probanden als in der Placebogruppe auftraten.
Andere Nebenwirkungen, die während der klinischen Entwicklung von WELLBUTRIN beobachtet wurden
Die Bedingungen und die Dauer der Exposition gegenüber WELLBUTRIN waren sehr unterschiedlich, und ein wesentlicher Teil der Erfahrungen wurde in offenen und unkontrollierten klinischen Umgebungen gesammelt. Während dieser Erfahrung wurden zahlreiche unerwünschte Ereignisse gemeldet; Ohne angemessene Kontrollen ist es jedoch unmöglich, mit Sicherheit festzustellen, welche Ereignisse von WELLBUTRIN verursacht wurden oder nicht. Die folgende Aufzählung ist nach Organsystemen organisiert und beschreibt Ereignisse in Bezug auf ihre relative Häufigkeit der Meldung in der Datenbank.
Die folgenden Häufigkeitsdefinitionen werden verwendet: Häufige Nebenwirkungen sind definiert als Nebenwirkungen, die bei mindestens 1/100 Probanden auftreten. Seltene Nebenwirkungen sind solche, die bei 1/100 bis 1/1.000 Patienten auftreten, während seltene Ereignisse solche sind, die bei weniger als 1/1.000 Patienten auftreten.
Herz-Kreislauf Häufig war Ödem; selten traten Brustschmerzen, Anomalien des Elektrokardiogramms (EKG) (vorzeitige Herzschläge und unspezifische ST-T-Veränderungen) und Kurzatmigkeit/Dyspnoe auf; selten waren Flush und Myokardinfarkt.
Dermatologisch: Alopezie war selten.
Endokrin: Selten war Gynäkomastie; selten war Glykosurie.
Magen-Darm: Selten traten Dysphagie, Durststörungen und Leberschäden/Gelbsucht auf; selten war eine Darmperforation.
Urogenital: Häufig war Nykturie; selten waren vaginale Reizung, Hodenschwellung, Harnwegsinfektion, schmerzhafte Erektion und verzögerte Ejakulation; selten waren Enuresis und Harninkontinenz.
Neurologisch: Häufig waren Ataxie/Koordinationsstörungen, Krampfanfälle, Myoklonus, Dyskinesie und Dystonie; selten waren Mydriasis, Schwindel und Dysarthrie; selten waren Anomalien des Elektroenzephalogramms (EEG) und Aufmerksamkeitsstörungen.
Neuropsychiatrisch: Häufig waren Manie/Hypomanie, gesteigerte Libido, Halluzinationen, verminderte Sexualfunktion und Depression; selten waren Gedächtnisstörungen, Depersonalisation, Psychose, Dysphorie, Stimmungsschwankungen, Paranoia und formale Denkstörungen; selten war Selbstmordgedanken.
Mündliche Beschwerden: Häufig war Stomatitis; selten waren Zahnschmerzen, Bruxismus, Zahnfleischreizungen und orale Ödeme.
Atmung: Selten traten Bronchitis und Atemnot/Dyspnoe auf; selten war Lungenembolie.
Besondere Sinne: Selten trat eine Sehstörung auf; selten war Doppeltsehen.
Unspezifisch: Häufig waren grippeähnliche Symptome; selten war unspezifischer Schmerz; selten war eine Überdosierung.
Veränderter Appetit und Gewicht
Ein Gewichtsverlust von mehr als 5 lbs. trat bei 28 % der Patienten auf, die WELLBUTRIN erhielten. Diese Inzidenz ist etwa doppelt so hoch wie bei vergleichbaren Probanden, die mit Trizyklika oder Placebo behandelt wurden. Während 35 % der Probanden, die trizyklische Antidepressiva erhielten, zunahmen, nahmen darüber hinaus nur 9,4 % der mit WELLBUTRIN behandelten Probanden zu. Wenn daher Gewichtsverlust ein wichtiges Anzeichen für eine depressive Erkrankung eines Patienten ist, sollte das anorektische und/oder gewichtsreduzierende Potenzial von WELLBUTRIN in Betracht gezogen werden.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von WELLBUTRIN nach der Zulassung festgestellt und sind an keiner anderen Stelle auf dem Etikett beschrieben. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Körper (Allgemein)
Arthralgie, Myalgie und Fieber mit Hautausschlag und anderen Symptomen, die auf eine verzögerte Überempfindlichkeit hindeuten. Diese Symptome können der Serumkrankheit ähneln [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Herz-Kreislauf
Hypertonie (in einigen Fällen schwer), orthostatische Hypotonie, Herzblock dritten Grades.
Endokrine
Hyponatriämie, Syndrom der unangemessenen ADH-Sekretion, Hyperglykämie, Hypoglykämie.
Magen-Darm
Ösophagitis, Hepatitis.
Hämisch und lymphatisch
Ekchymose, Leukozytose, Leukopenie, Thrombozytopenie. Veränderte PT und/oder INR, selten in Verbindung mit hämorrhagischen oder thrombotischen Komplikationen, wurden beobachtet, wenn Bupropion zusammen mit Warfarin verabreicht wurde.
Bewegungsapparat
Muskelsteifheit/Fieber/Rhabdomyolyse, Muskelschwäche.
Nervöses System
Aggression, Koma, vollendeter Suizid, Delirium, Traumanomalien, paranoide Vorstellungen, Parästhesien, Parkinsonismus, Ruhelosigkeit, Suizidversuch, Demaskierung von Spätdyskinesien.
Haut und Anhänge
Stevens-Johnson-Syndrom, Angioödem, exfoliative Dermatitis, Urtikaria.
Besondere Sinne
Tinnitus, erhöhter Augeninnendruck.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Potenzial für andere Medikamente, WELLBUTRIN zu beeinflussen
Bupropion wird hauptsächlich durch CYP2B6 zu Hydroxybupropion metabolisiert. Daher besteht die Möglichkeit von Arzneimittelwechselwirkungen zwischen WELLBUTRIN und Arzneimitteln, die Inhibitoren oder Induktoren von CYP2B6 sind.
Inhibitoren von CYP2B6
Ticlopidin und Clopidogrel
Die gleichzeitige Behandlung mit diesen Arzneimitteln kann die Bupropion-Exposition erhöhen, aber die Hydroxybupropion-Exposition verringern. Basierend auf dem klinischen Ansprechen kann eine Dosisanpassung von WELLBUTRIN erforderlich sein, wenn es zusammen mit CYP2B6-Inhibitoren (z. B. Ticlopidin oder Clopidogrel) verabreicht wird [siehe KLINISCHE PHARMAKOLOGIE ].
Induktoren von CYP2B6
Ritonavir, Lopinavir und Efavirenz
Die gleichzeitige Behandlung mit diesen Arzneimitteln kann die Bupropion- und Hydroxybupropion-Exposition verringern. Bei gleichzeitiger Anwendung mit Ritonavir, Lopinavir oder Efavirenz kann eine Dosiserhöhung von WELLBUTRIN erforderlich sein [siehe KLINISCHE PHARMAKOLOGIE ], sollte aber die maximal empfohlene Dosis nicht überschreiten.
Carbamazepin, Phenobarbital, Phenytoin
Obwohl nicht systematisch untersucht, können diese Medikamente den Bupropion-Metabolismus induzieren und die Bupropion-Exposition verringern [siehe KLINISCHE PHARMAKOLOGIE ]. Wenn Bupropion gleichzeitig mit einem CYP-Induktor angewendet wird, kann es erforderlich sein, die Dosis von Bupropion zu erhöhen, aber die maximal empfohlene Dosis sollte nicht überschritten werden.
Potenzial für WELLBUTRIN 300 mg, andere Medikamente zu beeinflussen
Medikamente, die von CYP2D6 metabolisiert werden
Bupropion und seine Metaboliten (Erythrohydrobupropion, Threohydrobupropion, Hydroxybupropion) sind CYP2D6-Inhibitoren. Daher kann die gleichzeitige Verabreichung von WELLBUTRIN mit Arzneimitteln, die durch CYP2D6 metabolisiert werden, die Exposition gegenüber Arzneimitteln erhöhen, die Substrate von CYP2D6 sind. Zu diesen Arzneimitteln gehören bestimmte Antidepressiva (z. B. Venlafaxin, Nortriptylin, Imipramin, Desipramin, Paroxetin, Fluoxetin und Sertralin), Antipsychotika (z. B. Haloperidol, Risperidon, Thioridazin), Betablocker (z. B. Metoprolol) und Typ-1C-Antiarrhythmika (z , Propafenon und Flecainid). Bei gleichzeitiger Anwendung mit WELLBUTRIN kann es erforderlich sein, die Dosis dieser CYP2D6-Substrate zu verringern, insbesondere bei Arzneimitteln mit geringer therapeutischer Breite.
Arzneimittel, die eine metabolische Aktivierung durch CYP2D6 erfordern, um wirksam zu sein (z. B. Tamoxifen), könnten theoretisch eine verringerte Wirksamkeit aufweisen, wenn sie gleichzeitig mit Inhibitoren von CYP2D6 wie Bupropion verabreicht werden. Patienten, die gleichzeitig mit WELLBUTRIN und solchen Arzneimitteln behandelt werden, benötigen möglicherweise erhöhte Dosen des Arzneimittels [siehe KLINISCHE PHARMAKOLOGIE ].
Digoxin
Die gleichzeitige Verabreichung von WELLBUTRIN mit Digoxin kann die Digoxinspiegel im Plasma verringern. Überwachen Sie die Digoxinspiegel im Plasma bei Patienten, die gleichzeitig mit WELLBUTRIN und Digoxin behandelt werden [siehe KLINISCHE PHARMAKOLOGIE ].
Medikamente, die die Krampfschwelle senken
Seien Sie äußerst vorsichtig, wenn Sie WELLBUTRIN zusammen mit anderen Arzneimitteln verabreichen, die die Krampfschwelle senken (z. B. andere Bupropion-Produkte, Antipsychotika, Antidepressiva, Theophyllin oder systemische Kortikosteroide). Verwenden Sie niedrige Anfangsdosen und erhöhen Sie die Dosis schrittweise [siehe KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Dopaminerge Medikamente (Levodopa und Amantadin)
Bupropion, Levodopa und Amantadin haben dopaminagonistische Wirkungen. Bei gleichzeitiger Anwendung von Bupropion mit Levodopa oder Amantadin wurde über ZNS-Toxizität berichtet. Zu den Nebenwirkungen gehörten Unruhe, Erregung, Zittern, Ataxie, Gangstörungen, Schwindel und Schwindel. Es wird vermutet, dass die Toxizität aus kumulativen dopaminagonistischen Wirkungen resultiert. Seien Sie vorsichtig, wenn Sie WELLBUTRIN 150 mg gleichzeitig mit diesen Arzneimitteln verabreichen.
Verwendung mit Alkohol
Nach Markteinführung gab es seltene Berichte über unerwünschte neuropsychiatrische Ereignisse oder verminderte Alkoholtoleranz bei Patienten, die während der Behandlung mit WELLBUTRIN Alkohol tranken. Der Konsum von Alkohol während der Behandlung mit WELLBUTRIN sollte minimiert oder vermieden werden.
MAO-Hemmer
Bupropion hemmt die Wiederaufnahme von Dopamin und Noradrenalin. Die gleichzeitige Anwendung von MAO-Hemmern und Bupropion ist kontraindiziert, da bei gleichzeitiger Anwendung von Bupropion und MAO-Hemmern ein erhöhtes Risiko für hypertensive Reaktionen besteht. Tierstudien zeigen, dass die akute Toxizität von Bupropion durch den MAO-Hemmer Phenelzin verstärkt wird. Zwischen dem Absetzen eines MAO-Hemmers zur Behandlung von Depressionen und dem Beginn der Behandlung mit WELLBUTRIN sollten mindestens 14 Tage vergehen. Umgekehrt sollten nach dem Absetzen von WELLBUTRIN 150 mg mindestens 14 Tage vergehen, bevor mit einem MAOI-Antidepressivum begonnen wird [siehe DOSIERUNG UND ANWENDUNG , KONTRAINDIKATIONEN ].
Arzneimittel-Labortest-Wechselwirkungen
Bei Patienten, die Bupropion einnahmen, wurde über falsch-positive Urin-Immunoassay-Screening-Tests für Amphetamine berichtet. Dies liegt an der mangelnden Spezifität einiger Screening-Tests. Auch nach Absetzen der Bupropion-Therapie können falsch-positive Testergebnisse auftreten. Bestätigungstests wie Gaschromatographie/Massenspektrometrie unterscheiden Bupropion von Amphetaminen.
Drogenmissbrauch und -abhängigkeit
Kontrollierte Substanz
Bupropion ist keine kontrollierte Substanz.
Missbrauch
Menschen
Kontrollierte klinische Studien, die an normalen Freiwilligen, an Probanden mit mehrfachem Drogenmissbrauch in der Vorgeschichte und an depressiven Probanden durchgeführt wurden, zeigten eine gewisse Zunahme der motorischen Aktivität und Unruhe/Erregung, die oft typisch für eine zentrale stimulierende Aktivität sind.
In einer Population von Personen mit Erfahrung im Umgang mit Drogen führte eine orale Einzeldosis von 400 mg Bupropion zu einer milden amphetaminähnlichen Aktivität im Vergleich zu Placebo auf der Morphin-Benzedrin-Unterskala des Addiction Research Center Inventories (ARCI) und einer Punktzahl von mehr als Placebo, aber weniger als 15 mg des Schedule-II-Stimulans Dextroamphetamin auf der Zuneigungsskala des ARCI. Diese Skalen messen allgemeine Gefühle der Euphorie und der Vorliebe für Drogen, die oft mit Missbrauchspotenzial in Verbindung gebracht werden.
Es ist jedoch nicht bekannt, dass Ergebnisse in klinischen Studien das Missbrauchspotenzial von Arzneimitteln zuverlässig vorhersagen. Nichtsdestotrotz deuten Beweise aus Einzeldosisstudien darauf hin, dass die empfohlene Tagesdosis von Bupropion bei oraler Verabreichung in geteilten Dosen wahrscheinlich keine signifikante Verstärkung für Amphetamin- oder ZNS-Stimulanzien-Missbraucher darstellt. Höhere Dosen (die wegen des Krampfrisikos nicht getestet werden konnten) könnten jedoch für diejenigen, die ZNS-stimulierende Medikamente missbrauchen, mäßig attraktiv sein.
WELLBUTRIN ist nur zur oralen Anwendung bestimmt. Es wurde über die Inhalation zerkleinerter Tabletten oder die Injektion von gelöstem Bupropion berichtet. Krampfanfälle und/oder Todesfälle wurden berichtet, wenn Bupropion intranasal oder durch parenterale Injektion verabreicht wurde.
Tiere
Studien an Nagetieren und Primaten zeigten, dass Bupropion einige pharmakologische Wirkungen aufweist, die Psychostimulanzien gemeinsam sind. Bei Nagetieren wurde gezeigt, dass es die lokomotorische Aktivität erhöht, eine milde stereotype Verhaltensreaktion hervorruft und die Reaktionsraten in mehreren zeitplangesteuerten Verhaltensparadigmata erhöht. In Primatenmodellen zur Bewertung der positiv verstärkenden Wirkungen von Psychopharmaka wurde Bupropion selbst intravenös verabreicht. Bei Ratten erzeugte Bupropion amphetaminähnliche und kokainähnliche diskriminierende Stimuluseffekte in Drogendiskriminierungsparadigmen, die zur Charakterisierung der subjektiven Wirkungen psychoaktiver Drogen verwendet wurden.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Selbstmordgedanken und -verhalten bei Kindern, Jugendlichen und jungen Erwachsenen
Patienten mit MDD, sowohl Erwachsene als auch Kinder, können eine Verschlechterung ihrer Depression und/oder das Auftreten von Suizidgedanken und -verhalten (Suizidalität) oder ungewöhnliche Verhaltensänderungen erfahren, unabhängig davon, ob sie Antidepressiva einnehmen oder nicht, und dieses Risiko kann bestehen bleiben, bis es signifikant ist Remission eintritt. Selbstmord ist ein bekanntes Risiko für Depressionen und bestimmte andere psychiatrische Störungen, und diese Störungen selbst sind die stärksten Prädiktoren für Selbstmord. Es besteht seit langem die Sorge, dass Antidepressiva bei bestimmten Patienten in den frühen Phasen der Behandlung eine Rolle bei der Auslösung von Depressionen und dem Auftreten von Suizidalität spielen könnten.
Gepoolte Analysen von Placebo-kontrollierten Kurzzeitstudien mit Antidepressiva (selektive Serotonin-Wiederaufnahmehemmer [SSRIs] und andere) zeigen, dass diese Medikamente das Risiko für suizidales Denken und Verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen (im Alter von 18 Jahren) erhöhen bis 24) mit MDD und anderen psychiatrischen Störungen. Klinische Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; bei Erwachsenen ab 65 Jahren kam es unter Antidepressiva im Vergleich zu Placebo zu einer Reduktion.
Die gepoolten Analysen placebokontrollierter Studien bei Kindern und Jugendlichen mit MDD, Zwangsstörungen (OCD) oder anderen psychiatrischen Erkrankungen umfassten insgesamt 24 Kurzzeitstudien mit 9 Antidepressiva bei über 4.400 Probanden. Die gepoolten Analysen placebokontrollierter Studien bei Erwachsenen mit MDD oder anderen psychiatrischen Erkrankungen umfassten insgesamt 295 Kurzzeitstudien (mediane Dauer von 2 Monaten) mit 11 Antidepressiva bei über 77.000 Probanden. Es gab beträchtliche Schwankungen im Suizidalitätsrisiko zwischen den Drogen, aber bei fast allen untersuchten Drogen eine Tendenz zu einem Anstieg bei den jüngeren Probanden. Es gab Unterschiede im absoluten Suizidalitätsrisiko zwischen den verschiedenen Indikationen, mit der höchsten Inzidenz bei MDD. Die Risikounterschiede (Medikament vs. Placebo) waren jedoch relativ stabil innerhalb der Altersschichten und über Indikationen hinweg. Diese Risikounterschiede (Arzneimittel-Placebo-Unterschied in der Anzahl der Fälle von Suizidalität pro 1.000 behandelten Probanden) sind in Tabelle 1 aufgeführt.
In keiner der pädiatrischen Studien kam es zu Suiziden. In den Studien mit Erwachsenen gab es Suizide, aber die Anzahl reichte nicht aus, um zu einer Schlussfolgerung über die Wirkung des Medikaments auf Suizide zu gelangen.
Es ist nicht bekannt, ob sich das Suizidrisiko auf eine längerfristige Anwendung erstreckt, dh über mehrere Monate hinaus. Es gibt jedoch erhebliche Hinweise aus placebokontrollierten Erhaltungsstudien bei Erwachsenen mit Depressionen, dass die Anwendung von Antidepressiva das Wiederauftreten von Depressionen verzögern kann.
Alle Patienten, die mit Antidepressiva aus beliebigen Indikationen behandelt werden, sollten angemessen überwacht und engmaschig auf eine klinische Verschlechterung, Suizidalität und ungewöhnliche Verhaltensänderungen beobachtet werden, insbesondere während der ersten Monate einer medikamentösen Therapie oder bei Dosisänderungen oder -steigerungen oder abnimmt [siehe BOXED WARNING].
Die folgenden Symptome, Angst, Agitiertheit, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Ruhelosigkeit), Hypomanie und Manie, wurden bei erwachsenen und pädiatrischen Patienten berichtet, die ebenfalls mit Antidepressiva wegen schwerer depressiver Störung behandelt wurden wie für andere Indikationen, sowohl psychiatrische als auch nichtpsychiatrische. Obwohl ein kausaler Zusammenhang zwischen dem Auftreten solcher Symptome und entweder der Verschlechterung einer Depression und/oder dem Auftreten suizidaler Impulse nicht hergestellt werden konnte, besteht die Sorge, dass solche Symptome Vorboten einer aufkommenden Suizidalität sein könnten.
Bei Patienten, deren Depression sich anhaltend verschlimmert oder die an Suizidalität oder Symptomen leiden, die Vorboten einer Verschlechterung der Depression oder Suizidalität sein könnten, sollte eine Änderung des therapeutischen Schemas, einschließlich eines möglichen Absetzens der Medikation, in Betracht gezogen werden, insbesondere wenn diese Symptome schwerwiegend und abrupt sind zu Beginn oder waren nicht Teil der Symptome des Patienten.
Familien und Betreuer von Patienten, die wegen MDD oder anderen Indikationen, sowohl psychiatrischen als auch nichtpsychiatrischen, mit Antidepressiva behandelt werden, sollten auf die Notwendigkeit aufmerksam gemacht werden, Patienten auf das Auftreten von Unruhe, Reizbarkeit, ungewöhnlichen Verhaltensänderungen und den anderen oben beschriebenen Symptomen zu überwachen, wie z sowie das Auftreten von Suizidalität zu melden und solche Symptome unverzüglich dem Gesundheitsdienstleister zu melden. Eine solche Überwachung sollte die tägliche Beobachtung durch Familien und Betreuer umfassen. Rezepte für WELLBUTRIN 150 mg sollten für die kleinste Tablettenmenge im Einklang mit einem guten Patientenmanagement ausgestellt werden, um das Risiko einer Überdosierung zu verringern.
Neuropsychiatrische Nebenwirkungen und Suizidrisiko bei der Raucherentwöhnungsbehandlung
WELLBUTRIN ist nicht zur Raucherentwöhnungsbehandlung zugelassen; es enthält jedoch den gleichen Wirkstoff wie das Raucherentwöhnungsmittel ZYBAN. Bei Patienten, die Bupropion zur Raucherentwöhnung einnahmen, wurde über schwerwiegende neuropsychiatrische Nebenwirkungen berichtet. Diese Postmarketing-Berichte beinhalten Stimmungsschwankungen (einschließlich Depression und Manie), Psychosen, Halluzinationen, Paranoia, Wahnvorstellungen, Mordgedanken, Aggression, Feindseligkeit, Erregung, Angst und Panik sowie Suizidgedanken, Suizidversuche und vollendete Suizide [ sehen NEBENWIRKUNGEN ]. Einige Patienten, die mit dem Rauchen aufgehört haben, haben möglicherweise Symptome eines Nikotinentzugs, einschließlich depressiver Stimmung, erfahren. Bei Rauchern, die versuchten, das Rauchen ohne Medikamente aufzugeben, wurde über Depressionen, selten einschließlich Suizidgedanken, berichtet. Einige dieser unerwünschten Ereignisse traten jedoch bei Patienten auf, die Bupropion einnahmen und weiterhin rauchten.
Neuropsychiatrische unerwünschte Ereignisse traten bei Patienten ohne und mit vorbestehender psychiatrischer Erkrankung auf; Bei einigen Patienten verschlimmerten sich ihre psychiatrischen Erkrankungen. Beobachten Sie die Patienten auf das Auftreten von neuropsychiatrischen unerwünschten Ereignissen. Weisen Sie Patienten und Pflegepersonal darauf hin, dass der Patient die Einnahme von WELLBUTRIN 300 mg abbrechen und sofort einen Arzt aufsuchen sollte, wenn Unruhe, depressive Stimmung oder Verhaltens- oder Denkänderungen beobachtet werden, die nicht typisch für den Patienten sind, oder wenn der Patient Suizidgedanken oder suizidales Verhalten entwickelt . In vielen Postmarketing-Fällen wurde über ein Verschwinden der Symptome nach Absetzen von Bupropion berichtet. In einigen Fällen blieben die Symptome jedoch bestehen; Daher sollte eine kontinuierliche Überwachung und unterstützende Behandlung erfolgen, bis die Symptome abgeklungen sind.
Krampfanfall
WELLBUTRIN 300 mg kann Krampfanfälle verursachen. Das Krampfrisiko ist dosisabhängig. Die Dosis sollte 450 mg/Tag nicht überschreiten. Erhöhen Sie die Dosis schrittweise. Beenden Sie WELLBUTRIN 150 mg und setzen Sie die Behandlung nicht fort, wenn der Patient einen Krampfanfall erleidet.
Das Risiko von Krampfanfällen hängt auch mit Patientenfaktoren, klinischen Situationen und begleitenden Medikamenten zusammen, die die Krampfschwelle senken. Berücksichtigen Sie diese Risiken, bevor Sie mit der Behandlung mit WELLBUTRIN beginnen. WELLBUTRIN 300 mg ist kontraindiziert bei Patienten mit Anfallsleiden, aktueller oder früherer Diagnose von Anorexia nervosa oder Bulimie oder bei plötzlichem Absetzen von Alkohol, Benzodiazepinen, Barbituraten und Antiepileptika [siehe KONTRAINDIKATIONEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Die folgenden Bedingungen können das Anfallsrisiko ebenfalls erhöhen: schwere Kopfverletzung; arteriovenöse Missbildung; ZNS-Tumor oder ZNS-Infektion; schwerer Schlaganfall; gleichzeitige Anwendung anderer Medikamente, die die Krampfschwelle senken (z. B. andere Bupropion-Produkte, Antipsychotika, trizyklische Antidepressiva, Theophyllin und systemische Kortikosteroide); Stoffwechselstörungen (z. B. Hypoglykämie, Hyponatriämie, schwere Leberfunktionsstörung und Hypoxie); Konsum illegaler Drogen (z. B. Kokain); oder Missbrauch oder Missbrauch von verschreibungspflichtigen Medikamenten wie ZNS-Stimulanzien. Zusätzliche prädisponierende Zustände umfassen Diabetes mellitus, der mit oralen hypoglykämischen Arzneimitteln oder Insulin behandelt wird; Verwendung von Appetitzüglern; und übermäßiger Konsum von Alkohol, Benzodiazepinen, Beruhigungsmitteln/Hypnotika oder Opiaten.
Häufigkeit von Krampfanfällen bei Verwendung von Bupropion
Bupropion wird bei etwa 0,4 % (4/1.000) der Patienten, die mit Dosen von bis zu 450 mg/Tag behandelt werden, mit Krampfanfällen in Verbindung gebracht. Die geschätzte Anfallshäufigkeit für WELLBUTRIN steigt zwischen 450 und 600 mg/Tag fast um das Zehnfache an.
Das Krampfrisiko kann verringert werden, wenn die Dosis von WELLBUTRIN 300 mg 450 mg/Tag nicht überschreitet, gegeben als 150 mg 3-mal täglich, und die Titrationsrate schrittweise erfolgt.
Hypertonie
Die Behandlung mit WELLBUTRIN kann zu erhöhtem Blutdruck und Bluthochdruck führen. Messen Sie den Blutdruck vor Beginn der Behandlung mit WELLBUTRIN 150 mg und überwachen Sie ihn regelmäßig während der Behandlung. Das Risiko für Bluthochdruck ist erhöht, wenn WELLBUTRIN 150 mg gleichzeitig mit MAO-Hemmern oder anderen Arzneimitteln angewendet wird, die die dopaminerge oder noradrenerge Aktivität erhöhen [siehe KONTRAINDIKATIONEN ].
Daten aus einer vergleichenden Studie mit der Formulierung von Bupropion-HCl mit verzögerter Freisetzung, dem transdermalen Nikotinsystem (NTS), der Kombination von Bupropion mit verzögerter Freisetzung plus NTS und Placebo als Hilfsmittel zur Raucherentwöhnung deuten auf eine höhere Inzidenz von behandlungsbedingter Hypertonie hin Patienten, die mit der Kombination von Bupropion mit verzögerter Freisetzung und NTS behandelt wurden. In dieser Studie hatten 6,1 % der mit der Kombination von Bupropion mit verzögerter Freisetzung und NTS behandelten Patienten eine behandlungsbedingte Hypertonie, verglichen mit 2,5 %, 1,6 % und 3,1 % der mit Bupropion mit verzögerter Freisetzung, NTS bzw. Placebo behandelten Patienten . Die Mehrheit dieser Probanden hatte Hinweise auf vorbestehenden Bluthochdruck. Drei Patienten (1,2 %), die mit der Kombination aus Bupropion mit verzögerter Freisetzung und NTS behandelt wurden, und 1 Patient (0,4 %), der mit NTS behandelt wurde, hatten die Studienmedikation aufgrund von Bluthochdruck abgesetzt, verglichen mit keinem der Patienten, die mit Bupropion mit verzögerter Freisetzung oder Placebo behandelt wurden. Bei Patienten, die die Kombination aus Bupropion und Nikotinersatz erhalten, wird eine Überwachung des Blutdrucks empfohlen.
In einer klinischen Studie mit sofortiger Freisetzung von Bupropion bei MDD-Patienten mit stabiler dekompensierter Herzinsuffizienz (N = 36) war Bupropion bei 2 Patienten mit einer Exazerbation einer vorbestehenden Hypertonie verbunden, was zum Abbruch der Bupropion-Behandlung führte. Es gibt keine kontrollierten Studien zur Bewertung der Sicherheit von Bupropion bei Patienten mit kürzlich aufgetretenem Myokardinfarkt oder instabiler Herzerkrankung.
Aktivierung von Manie/Hypomanie
Die Behandlung mit Antidepressiva kann eine manische, gemischte oder hypomanische manische Episode auslösen. Das Risiko scheint bei Patienten mit bipolarer Störung oder bei Patienten mit Risikofaktoren für eine bipolare Störung erhöht zu sein. Screenen Sie vor Beginn der Behandlung mit WELLBUTRIN die Patienten auf eine Bipolare Störung in der Vorgeschichte und das Vorhandensein von Risikofaktoren für eine Bipolare Störung (z. B. familiäre Vorgeschichte von Bipolarer Störung, Suizid oder Depression). WELLBUTRIN 150 mg ist nicht zur Behandlung von bipolarer Depression zugelassen.
Psychose und andere neuropsychiatrische Reaktionen
Depressive Patienten, die mit WELLBUTRIN behandelt wurden, hatten eine Vielzahl von neuropsychiatrischen Anzeichen und Symptomen, einschließlich Wahnvorstellungen, Halluzinationen, Psychosen, Konzentrationsstörungen, Paranoia und Verwirrtheit. Bei einigen dieser Patienten wurde eine bipolare Störung diagnostiziert. In einigen Fällen ließen diese Symptome nach Dosisreduktion und/oder Absetzen der Behandlung nach. Weisen Sie die Patienten an, sich an medizinisches Fachpersonal zu wenden, wenn solche Reaktionen auftreten.
Engwinkelglaukom
Die Pupillenerweiterung, die nach der Anwendung vieler Antidepressiva, einschließlich WELLBUTRIN 300 mg, auftritt, kann bei einem Patienten mit anatomisch engen Winkeln, der keine offene Iridektomie hat, eine Engwinkelattacke auslösen.
Überempfindlichkeitsreaktionen
Anaphylaktoide/anaphylaktische Reaktionen sind während klinischer Studien mit Bupropion aufgetreten. Die Reaktionen waren gekennzeichnet durch Pruritus, Urtikaria, Angioödem und Dyspnoe, die eine medizinische Behandlung erforderten. Darüber hinaus gab es nach Markteinführung seltene spontane Berichte über Erythema multiforme, Stevens-Johnson-Syndrom und anaphylaktischen Schock im Zusammenhang mit Bupropion. Weisen Sie die Patienten an, WELLBUTRIN 150 mg abzusetzen und einen Arzt zu konsultieren, wenn sie während der Behandlung eine allergische oder anaphylaktoide/anaphylaktische Reaktion entwickeln (z. B. Hautausschlag, Juckreiz, Nesselsucht, Brustschmerzen, Ödeme und Kurzatmigkeit).
Es gibt Berichte über Arthralgie, Myalgie, Fieber mit Hautausschlag und andere Serumkrankheits-ähnliche Symptome, die auf eine verzögerte Überempfindlichkeit hindeuten.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente ).
Selbstmordgedanken und Verhaltensweisen
Weisen Sie die Patienten, ihre Familien und/oder ihre Betreuer an, auf das Auftreten von Angstzuständen, Unruhe, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Unruhe), Hypomanie, Manie und anderen ungewöhnlichen Verhaltensänderungen zu achten , Verschlechterung von Depressionen und Suizidgedanken, besonders früh während der Behandlung mit Antidepressiva und wenn die Dosis nach oben oder unten angepasst wird. Weisen Sie Familien und Betreuer von Patienten an, täglich auf das Auftreten solcher Symptome zu achten, da Änderungen abrupt sein können. Solche Symptome sollten dem verschreibenden Arzt oder dem medizinischen Fachpersonal des Patienten gemeldet werden, insbesondere wenn sie schwerwiegend sind, abrupt einsetzen oder nicht zu den Symptomen des Patienten gehörten. Symptome wie diese können mit einem erhöhten Risiko für Suizidgedanken und -verhalten verbunden sein und weisen auf die Notwendigkeit einer sehr engmaschigen Überwachung und möglicherweise einer Änderung der Medikation hin.
Neuropsychiatrische Nebenwirkungen und Suizidrisiko bei der Raucherentwöhnungsbehandlung
Obwohl WELLBUTRIN 150 mg nicht zur Raucherentwöhnung indiziert ist, enthält es den gleichen Wirkstoff wie ZYBAN, das für diese Anwendung zugelassen ist. Informieren Sie die Patienten darüber, dass einige Patienten Stimmungsschwankungen (einschließlich Depression und Manie), Psychosen, Halluzinationen, Paranoia, Wahnvorstellungen, Mordgedanken, Aggression, Feindseligkeit, Erregung, Angst und Panik sowie Suizidgedanken und Suizid beim Versuch, mit dem Rauchen aufzuhören, erlebt haben Rauchen während der Einnahme von Bupropion. Weisen Sie die Patienten an, Bupropion abzusetzen und sich an medizinisches Fachpersonal zu wenden, wenn sie solche Symptome bemerken [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , NEBENWIRKUNGEN ].
Schwere allergische Reaktionen
Informieren Sie die Patienten über die Symptome einer Überempfindlichkeit und darüber, WELLBUTRIN 300 mg abzusetzen, wenn sie eine schwere allergische Reaktion haben.
Krampfanfall
Weisen Sie die Patienten an, WELLBUTRIN abzusetzen und nicht wieder aufzunehmen, wenn während der Behandlung ein Krampfanfall auftritt. Weisen Sie die Patienten darauf hin, dass der übermäßige Konsum oder das abrupte Absetzen von Alkohol, Benzodiazepinen, Antiepileptika oder Beruhigungsmitteln/Hypnotika das Krampfrisiko erhöhen kann. Raten Sie den Patienten, den Konsum von Alkohol zu minimieren oder zu vermeiden.
Engwinkelglaukom
Die Patienten sollten darauf hingewiesen werden, dass die Einnahme von WELLBUTRIN 150 mg eine leichte Pupillenerweiterung verursachen kann, die bei empfindlichen Personen zu einem Engwinkelglaukom führen kann. Ein vorbestehendes Glaukom ist fast immer ein Offenwinkelglaukom, da ein Engwinkelglaukom, wenn es diagnostiziert wird, definitiv mit einer Iridektomie behandelt werden kann. Das Offenwinkelglaukom ist kein Risikofaktor für das Engwinkelglaukom. Patienten möchten möglicherweise untersucht werden, um festzustellen, ob sie für Winkelverschluss anfällig sind, und sich einem prophylaktischen Verfahren (z. B. Iridektomie) unterziehen, wenn sie anfällig sind [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Bupropion-haltige Produkte
Informieren Sie die Patienten darüber, dass WELLBUTRIN 150 mg den gleichen Wirkstoff (Bupropionhydrochlorid) enthält wie ZYBAN, das als Hilfsmittel zur Raucherentwöhnung verwendet wird, und dass WELLBUTRIN 150 mg nicht in Kombination mit ZYBAN oder anderen Bupropion enthaltenden Arzneimitteln (wie z B. WELLBUTRIN 150 mg SR, die Retardformulierung und WELLBUTRIN XL oder FORFIVO XL, die Retardformulierungen, und APLENZIN, die Retardformulierung von Bupropionhydrobromid). Darüber hinaus gibt es eine Reihe generischer Bupropion-HCl-Produkte für Formulierungen mit sofortiger, verzögerter und verlängerter Freisetzung.
Potenzial für kognitive und motorische Beeinträchtigungen
Weisen Sie die Patienten darauf hin, dass jedes ZNS-aktive Medikament wie WELLBUTRIN ihre Fähigkeit beeinträchtigen kann, Aufgaben auszuführen, die Urteilsvermögen oder motorische und kognitive Fähigkeiten erfordern. Weisen Sie die Patienten darauf hin, dass sie, bis sie hinreichend sicher sind, dass WELLBUTRIN 300 mg ihre Leistungsfähigkeit nicht beeinträchtigt, davon absehen sollten, ein Auto zu führen oder komplexe, gefährliche Maschinen zu bedienen. WELLBUTRIN 150 mg kann zu einer verminderten Alkoholtoleranz führen.
Begleitmedikation
Raten Sie den Patienten, ihren Arzt zu informieren, wenn sie verschreibungspflichtige oder rezeptfreie Medikamente einnehmen oder planen, diese einzunehmen, da WELLBUTRIN 150 mg und andere Medikamente den Stoffwechsel der anderen beeinflussen können.
Schwangerschaft
Empfehlen Sie Patientinnen, ihren Arzt zu informieren, wenn sie während der Behandlung mit WELLBUTRIN schwanger werden oder eine Schwangerschaft planen. Weisen Sie die Patientinnen darauf hin, dass es ein Schwangerschaftsexpositionsregister gibt, das die Schwangerschaftsausgänge bei Frauen überwacht, die WELLBUTRIN 150 mg während der Schwangerschaft ausgesetzt waren [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Speicherinformationen
Weisen Sie die Patienten an, WELLBUTRIN bei Raumtemperatur zwischen 20 °C und 25 °C (68 °F und 77 °F) zu lagern und die Tabletten trocken und lichtgeschützt aufzubewahren.
Verwaltungsinformationen
Weisen Sie die Patienten an, WELLBUTRIN in gleichmäßig verteilten Dosen 3- oder 4-mal täglich einzunehmen, wobei zwischen den Dosen mindestens 6 Stunden liegen sollten, um das Risiko von Krampfanfällen zu minimieren. Weisen Sie die Patienten an, falls sie eine Dosis vergessen haben, keine zusätzliche Tablette einzunehmen, um die vergessene Dosis auszugleichen, und die nächste Tablette wegen des dosisabhängigen Krampfrisikos zur gewohnten Zeit einzunehmen. Weisen Sie die Patienten darauf hin, dass WELLBUTRIN-Tabletten im Ganzen geschluckt und nicht zerkleinert, geteilt oder gekaut werden sollten. WELLBUTRIN kann mit oder ohne Nahrung eingenommen werden.
WELLBUTRIN, WELLBUTRIN SR, WELLBUTRIN 150 mg XL und ZYBAN sind Warenzeichen der GSK-Unternehmensgruppe oder an diese lizenziert. Die anderen aufgeführten Marken sind Marken, die ihren jeweiligen Eigentümern gehören oder an diese lizenziert sind, und sind nicht Eigentum der GSK-Unternehmensgruppe oder an diese lizenziert. Die Hersteller dieser Marken sind nicht mit der GSK-Unternehmensgruppe oder ihren Produkten verbunden und unterstützen diese nicht.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenitätsstudien über die Lebenszeit wurden an Ratten und Mäusen mit Bupropion-Dosen von bis zu 300 bzw. 150 mg/kg/Tag durchgeführt. Diese Dosen entsprechen etwa dem 6- bzw. 2-fachen der MRHD auf mg/m2-Basis. In der Rattenstudie kam es bei Dosen von 100 bis 300 mg/kg/Tag (etwa das 2- bis 6-fache der MRHD auf mg/m2-Basis) zu einer Zunahme nodulärer proliferativer Läsionen der Leber; niedrigere Dosen wurden nicht getestet. Die Frage, ob solche Läsionen Vorläufer von Neoplasien der Leber sein können oder nicht, ist derzeit ungeklärt. Ähnliche Leberläsionen wurden in der Mausstudie nicht beobachtet, und in beiden Studien wurde keine Zunahme bösartiger Tumore der Leber und anderer Organe beobachtet.
Bupropion führte bei 2 von 5 Stämmen im bakteriellen Mutagenitätstest von Ames zu einer positiven Reaktion (2- bis 3-fache Kontrollmutationsrate). Bupropion führte in 1 von 3 zytogenetischen In-vivo-Studien zum Knochenmark von Ratten zu einer Zunahme von Chromosomenaberrationen.
Es gab keine Auswirkungen auf die männliche und weibliche Fertilität, wenn Ratten Bupropion in Dosen von bis zu 300 mg/kg/Tag (ungefähr das 6-fache der MRHD auf mg/m2-Basis) an Weibchen vor der Paarung und entweder bis zum 13. Tag der Trächtigkeit oral verabreicht wurde oder während der Laktation und an Männchen für 60 Tage vor und während der Paarung. Allerdings verursachten Dosen von 200 mg/kg/Tag (ungefähr das 4-fache der MRHD auf mg/m2-Basis) oder mehr vorübergehende Ataxie oder Verhaltensänderungen bei erwachsenen weiblichen Ratten. Es gab auch keine nachteiligen Auswirkungen auf die Fruchtbarkeit, Fortpflanzung oder das Wachstum und die Entwicklung männlicher oder weiblicher Nachkommen.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschafts-Expositionsregister
Es gibt ein unabhängiges Schwangerschaftsexpositionsregister, das die Schwangerschaftsausgänge bei Frauen überwacht, die während der Schwangerschaft Antidepressiva ausgesetzt waren. Gesundheitsdienstleister werden ermutigt, Patienten zu registrieren, indem sie das National Pregnancy Registry for Antidepressants unter 1-844-4056185 anrufen oder online unter https://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/antidepressants besuchen.
Zusammenfassung der Risiken
Daten aus epidemiologischen Studien an Schwangeren, die im ersten Trimenon Bupropion ausgesetzt waren, haben insgesamt kein erhöhtes Risiko für angeborene Fehlbildungen identifiziert (vgl Daten ). Mit einer unbehandelten Schwangerschaftsdepression sind Risiken für die Mutter verbunden (vgl Klinische Überlegungen ). Wenn Bupropion während der Organogenese trächtigen Ratten verabreicht wurde, gab es keine Hinweise auf fötale Fehlbildungen bei Dosen bis zum etwa 10-Fachen der maximal empfohlenen Humandosis (MRHD) von 450 mg/Tag. Bei Gabe an trächtige Kaninchen während der Organogenese wurde ein nicht dosisabhängiger Anstieg der Inzidenz fötaler Missbildungen und Skelettvariationen bei Dosen beobachtet, die ungefähr der MRHD entsprachen und höher waren. Verringerte fötale Gewichte wurden bei Dosen beobachtet, die doppelt so hoch waren wie die MRHD und höher (vgl Tierdaten ).
Das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten ist für die angegebene Population unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung beträgt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften 2 % bis 4 % bzw. 15 % bis 20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryonale/fetales Risiko
Eine prospektive Längsschnittstudie folgte 201 schwangeren Frauen mit einer Vorgeschichte von schweren depressiven Störungen, die euthymisch waren und zu Beginn der Schwangerschaft Antidepressiva während der Schwangerschaft einnahmen. Frauen, die Antidepressiva während der Schwangerschaft absetzten, erlitten mit größerer Wahrscheinlichkeit einen Rückfall einer schweren Depression als Frauen, die Antidepressiva weiter einnahmen. Berücksichtigen Sie die Risiken einer unbehandelten Depression für die Mutter und mögliche Auswirkungen auf den Fötus, wenn Sie die Behandlung mit Antidepressiva während der Schwangerschaft und nach der Geburt abbrechen oder ändern.
Daten
Menschliche Daten
Daten aus dem internationalen Bupropion-Schwangerschaftsregister (675 Expositionen im ersten Trimester) und einer retrospektiven Kohortenstudie unter Verwendung der Datenbank von United Healthcare (1.213 Expositionen im ersten Trimester) zeigten insgesamt kein erhöhtes Risiko für Fehlbildungen. Das Register wurde nicht entwickelt oder betrieben, um bestimmte Defekte zu bewerten, sondern deutete auf eine mögliche Zunahme von Herzfehlbildungen hin.
Nach einer Bupropion-Exposition während des ersten Trimesters wurde insgesamt kein erhöhtes Risiko für kardiovaskuläre Missbildungen beobachtet. Die prospektiv beobachtete Rate kardiovaskulärer Fehlbildungen bei Schwangerschaften mit Bupropion-Exposition im ersten Trimenon aus dem internationalen Schwangerschaftsregister betrug 1,3 % (9 kardiovaskuläre Fehlbildungen/675 mütterliche Bupropion-Exposition im ersten Trimenon), was ähnlich der Hintergrundrate kardiovaskulärer Fehlbildungen ist (ca 1 %). Daten aus der Datenbank von United Healthcare, die eine begrenzte Anzahl von exponierten Fällen mit kardiovaskulären Fehlbildungen enthielt, und eine Fall-Kontroll-Studie (6.853 Säuglinge mit kardiovaskulären Fehlbildungen und 5.763 mit nicht-kardiovaskulären Fehlbildungen) über den selbstberichteten Gebrauch von Bupropion aus den National Birth Defects Die Präventionsstudie (NBDPS) zeigte insgesamt kein erhöhtes Risiko für kardiovaskuläre Fehlbildungen nach einer Bupropion-Exposition während des ersten Trimesters.
Die Studienergebnisse zur Bupropion-Exposition während des ersten Trimesters und dem Risiko einer Obstruktion des linksventrikulären Ausflusstrakts (LVOTO) sind widersprüchlich und lassen keine Rückschlüsse auf einen möglichen Zusammenhang zu. Der Datenbank von United Healthcare fehlte es an ausreichender Power, um diese Assoziation zu bewerten; die NBDPS fand ein erhöhtes Risiko für LVOTO (n = 10; angepasstes OR = 2,6; 95 % KI: 1,2, 5,7) und die Fallkontrollstudie Slone Epidemiology fand kein erhöhtes Risiko für LVOTO.
Die Studienergebnisse zur Bupropion-Exposition während des ersten Trimesters und dem Risiko für einen Ventrikelseptumdefekt (VSD) sind widersprüchlich und lassen keine Schlussfolgerungen hinsichtlich eines möglichen Zusammenhangs zu. Die Slone Epidemiology Study fand ein erhöhtes Risiko für VSD nach mütterlicher Bupropion-Exposition im ersten Trimenon (n = 17; angepasstes OR = 2,5; 95 % KI: 1,3, 5,0), fand jedoch kein erhöhtes Risiko für andere untersuchte kardiovaskuläre Fehlbildungen (einschließlich LVOTO as Oben). Die Datenbankstudie von NBDPS und United Healthcare fand keinen Zusammenhang zwischen der Bupropion-Exposition der Mutter im ersten Trimenon und VSD.
Bezüglich der Ergebnisse von LVOTO und VSD waren die Studien durch die geringe Anzahl von exponierten Fällen, widersprüchliche Ergebnisse zwischen den Studien und das Potenzial für zufällige Ergebnisse aus mehreren Vergleichen in Fall-Kontroll-Studien begrenzt.
Tierdaten
In Studien an trächtigen Ratten und Kaninchen wurde Bupropion während der Organogenese in Dosen von bis zu 450 bzw. 150 mg/kg/Tag (etwa das 10- bzw. 6-fache der MRHD auf mg/m2-Basis) oral verabreicht ). Es gab keine Hinweise auf fötale Missbildungen bei Ratten. Bei Verabreichung an trächtige Kaninchen während der Organogenese wurde bei der niedrigsten getesteten Dosis (25 mg/kg/Tag, ungefähr gleich der MRHD auf mg/m2-Basis) ein nicht dosisabhängiger Anstieg der Inzidenz fötaler Missbildungen und Skelettvariationen beobachtet. und größer. Bei Dosen von 50 mg/kg/Tag (etwa das 2-fache der MRHD auf mg/m2-Basis) und darüber wurde ein verringertes fötales Gewicht beobachtet. Bei Dosen von 50 mg/kg/Tag oder weniger war keine maternale Toxizität erkennbar.
In einer prä- und postnatalen Entwicklungsstudie hatte Bupropion, das trächtigen Ratten oral in Dosen von bis zu 150 mg/kg/Tag (ungefähr das Dreifache der MRHD auf mg/m2-Basis) von der embryonalen Implantation bis zur Laktation verabreicht wurde, keine Wirkung auf das Wachstum der Jungtiere oder Entwicklung.
Stillzeit
Zusammenfassung der Risiken
Daten aus der veröffentlichten Literatur berichten über das Vorhandensein von Bupropion und seinen Metaboliten in der Muttermilch (vgl Daten ). Es liegen keine Daten zu den Wirkungen von Bupropion oder seinen Metaboliten auf die Milchproduktion vor. Begrenzte Daten aus Berichten nach Markteinführung haben keinen eindeutigen Zusammenhang zwischen Nebenwirkungen beim gestillten Säugling festgestellt. Die entwicklungsbezogenen und gesundheitlichen Vorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an WELLBUTRIN und möglichen Nebenwirkungen von WELLBUTRIN auf das gestillte Kind oder von der zugrunde liegenden Erkrankung der Mutter berücksichtigt werden.
Daten
In einer Laktationsstudie mit 10 Frauen wurden die Spiegel von oral verabreichtem Bupropion und seinen aktiven Metaboliten in abgepumpter Milch gemessen. Die durchschnittliche tägliche Säuglingsexposition (unter Annahme einer täglichen Aufnahme von 150 ml/kg) gegenüber Bupropion und seinen aktiven Metaboliten betrug 2 % der gewichtsadaptierten Dosis der Mutter. Postmarketing-Berichte haben Krampfanfälle bei gestillten Säuglingen beschrieben. Der Zusammenhang zwischen Bupropion-Exposition und diesen Anfällen ist unklar.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit in der pädiatrischen Population wurden nicht nachgewiesen [siehe Eingerahmte Warnung , WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Geriatrische Verwendung
Von den etwa 6.000 Probanden, die an klinischen Studien mit Bupropion-Retardtabletten teilnahmen (Studien zu Depressionen und Raucherentwöhnung), waren 275 ≥ 65 Jahre und 47 ≥ 75 Jahre alt. Darüber hinaus nahmen mehrere hundert Probanden im Alter von ≥ 65 Jahren an klinischen Studien mit der Formulierung mit sofortiger Wirkstofffreisetzung von Bupropion (Depressionsstudien) teil. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet. Berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Bupropion wird weitgehend in der Leber zu aktiven Metaboliten metabolisiert, die weiter metabolisiert und über die Nieren ausgeschieden werden. Das Risiko von Nebenwirkungen kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da ältere Patienten eher eine eingeschränkte Nierenfunktion haben, kann es notwendig sein, diesen Faktor bei der Dosisauswahl zu berücksichtigen; es kann sinnvoll sein, die Nierenfunktion zu überwachen [siehe DOSIERUNG UND ANWENDUNG , Verwendung in bestimmten Bevölkerungsgruppen , KLINISCHE PHARMAKOLOGIE ].
Nierenfunktionsstörung
Ziehen Sie bei Patienten mit eingeschränkter Nierenfunktion (glomeruläre Filtrationsrate: weniger als 90 ml/min) eine reduzierte Dosis und/oder Dosierungshäufigkeit von WELLBUTRIN in Betracht. Bupropion und seine Metaboliten werden renal ausgeschieden und können sich bei solchen Patienten in größerem Ausmaß als üblich anreichern. Überwachen Sie engmaschig auf Nebenwirkungen, die auf eine hohe Bupropion- oder Metaboliten-Exposition hindeuten könnten [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Bei Patienten mit mäßiger bis schwerer Leberfunktionsstörung (Child-Pugh-Score: 7 bis 15) beträgt die Höchstdosis von WELLBUTRIN 150 mg 75 mg täglich. Bei Patienten mit leichter Leberfunktionsstörung (Child-Pugh-Score: 5 bis 6) sollte eine Reduzierung der Dosis und/oder der Häufigkeit der Anwendung in Betracht gezogen werden [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Erfahrung mit Überdosierung beim Menschen
Überdosierungen von bis zu 30 Gramm Bupropion oder mehr wurden berichtet. Krampfanfälle wurden in etwa einem Drittel aller Fälle gemeldet. Andere schwerwiegende Reaktionen, die bei Überdosierung von Bupropion allein berichtet wurden, waren Halluzinationen, Bewusstlosigkeit, Sinustachykardie und EKG-Veränderungen wie Leitungsstörungen (einschließlich QRS-Verlängerung) oder Arrhythmien. Fieber, Muskelsteifheit, Rhabdomyolyse, Hypotonie, Stupor, Koma und Atemversagen wurden hauptsächlich berichtet, wenn Bupropion Teil mehrerer Überdosierungen war.
Obwohl sich die meisten Patienten ohne Folgeerscheinungen erholten, wurden Todesfälle im Zusammenhang mit einer Überdosierung von Bupropion allein bei Patienten berichtet, die große Dosen des Arzneimittels einnahmen. Bei diesen Patienten wurde über mehrere unkontrollierte Krampfanfälle, Bradykardie, Herzinsuffizienz und Herzstillstand vor dem Tod berichtet.
Überdosierungsmanagement
Wenden Sie sich an ein zertifiziertes Giftinformationszentrum, um aktuelle Anleitungen und Ratschläge zu erhalten. Telefonnummern für zertifizierte Giftnotrufzentralen sind in der Physician's Desk Reference (PDR) aufgeführt. Rufen Sie 1-800-222-1222 an oder besuchen Sie www.poison.org.
Gegenmittel für Bupropion sind nicht bekannt. Im Falle einer Überdosierung sorgen Sie für unterstützende Maßnahmen, einschließlich einer engmaschigen ärztlichen Überwachung und Überwachung. Berücksichtigen Sie die Möglichkeit einer mehrfachen Überdosierung von Medikamenten. Sorgen Sie für ausreichende Atemwege, Sauerstoffversorgung und Belüftung. Überwachen Sie den Herzrhythmus und die Vitalfunktionen. Die Induktion von Erbrechen wird nicht empfohlen.
KONTRAINDIKATIONEN
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Der genaue Mechanismus der antidepressiven Wirkung von Bupropion ist nicht bekannt, es wird jedoch angenommen, dass er mit noradrenergen und/oder dopaminergen Mechanismen zusammenhängt. Bupropion ist ein relativ schwacher Inhibitor der neuronalen Wiederaufnahme von Noradrenalin und Dopamin und hemmt nicht die Wiederaufnahme von Serotonin. Bupropion hemmt die Monoaminoxidase nicht.
Pharmakokinetik
Bupropion ist eine racemische Mischung. Die pharmakologische Aktivität und Pharmakokinetik der einzelnen Enantiomere wurde nicht untersucht. Die mittlere Eliminationshalbwertszeit (± SD) von Bupropion nach chronischer Gabe beträgt 21 (± 9) Stunden, und Steady-State-Plasmakonzentrationen von Bupropion werden innerhalb von 8 Tagen erreicht.
Absorption
Die absolute Bioverfügbarkeit von WELLBUTRIN beim Menschen wurde nicht bestimmt, da eine intravenöse Formulierung zur Anwendung beim Menschen nicht verfügbar ist. Es erscheint jedoch wahrscheinlich, dass nur ein kleiner Teil einer oral verabreichten Dosis den systemischen Kreislauf intakt erreicht. In Studien an Ratten und Hunden lag die Bioverfügbarkeit von Bupropion zwischen 5 % und 20 %.
Beim Menschen werden nach oraler Verabreichung von WELLBUTRIN 300 mg maximale Bupropion-Plasmakonzentrationen normalerweise innerhalb von 2 Stunden erreicht. Die Plasmakonzentrationen von Bupropion sind nach Einzeldosen von 100 bis 250 mg dosisproportional; es ist jedoch nicht bekannt, ob die Proportionalität zwischen Dosis und Plasmaspiegel bei chronischer Anwendung erhalten bleibt.
Verteilung
In-vitro-Tests zeigen, dass Bupropion bei Konzentrationen bis zu 200 µg/ml zu 84 % an menschliche Plasmaproteine gebunden ist. Das Ausmaß der Proteinbindung des Hydroxybupropion-Metaboliten ist ähnlich wie bei Bupropion, während das Ausmaß der Proteinbindung des Threohydrobupropion-Metaboliten etwa halb so groß ist wie bei Bupropion.
Stoffwechsel
Bupropion wird beim Menschen weitgehend metabolisiert. Drei Metaboliten sind aktiv: Hydroxybupropion, das durch Hydroxylierung der tert-Butylgruppe von Bupropion entsteht, und die Aminoalkoholisomere Threohydrobupropion und Erythrohydrobupropion, die durch Reduktion der Carbonylgruppe entstehen. In-vitro-Ergebnisse deuten darauf hin, dass CYP2B6 das hauptsächlich an der Bildung von Hydroxybupropion beteiligte Isoenzym ist, während Cytochrom-P450-Enzyme nicht an der Bildung von Threohydrobupropion beteiligt sind. Die Oxidation der Bupropion-Seitenkette führt zur Bildung eines Glycin-Konjugats von meta-Chlorbenzoesäure, das dann als Hauptmetabolit im Urin ausgeschieden wird. Potenz und Toxizität der Metaboliten im Vergleich zu Bupropion wurden noch nicht vollständig charakterisiert. In einem Antidepressiva-Screening-Test an Mäusen wurde jedoch gezeigt, dass Hydroxybupropion halb so stark wie Bupropion ist, während Threohydrobupropion und Erythrohydrobupropion 5-mal weniger stark als Bupropion sind. Dies kann von klinischer Bedeutung sein, da die Plasmakonzentrationen der Metaboliten genauso hoch oder höher als die von Bupropion sind.
Nach einer Einzeldosis beim Menschen treten Spitzenplasmakonzentrationen von Hydroxybupropion etwa 3 Stunden nach Verabreichung von WELLBUTRIN auf und betragen etwa das 10-fache des Spitzenspiegels der Ausgangssubstanz im Steady State. Die Eliminationshalbwertszeit von Hydroxybupropion beträgt etwa 20 (±5) Stunden, und seine AUC im Steady State ist etwa 17-mal so hoch wie die von Bupropion. Die Zeiten bis zum Erreichen der Spitzenkonzentrationen für die Erythrohydrobupropion- und Threohydrobupropion-Metaboliten sind ähnlich wie die des Hydroxybupropion-Metaboliten. Ihre Eliminationshalbwertszeit ist jedoch länger, 33 (±10) bzw. 37 (±13) Stunden, und die Steady-State-AUCs sind 1,5- bzw. 7-mal höher als die von Bupropion.
Bupropion und seine Metaboliten zeigen nach chronischer Gabe von 300 bis 450 mg/Tag eine lineare Kinetik.
Beseitigung
Nach oraler Gabe von 200 mg 14C-Bupropion beim Menschen wurden 87 % bzw. 10 % der radioaktiven Dosis im Urin bzw. im Stuhl wiedergefunden. Nur 0,5 % der oralen Dosis wurden als unverändertes Bupropion ausgeschieden.
Spezifische Populationen
Es ist zu erwarten, dass Faktoren oder Zustände, die die Stoffwechselkapazität verändern (z. B. Lebererkrankungen, dekompensierte Herzinsuffizienz [CHF], Alter, Begleitmedikation usw.) oder die Elimination den Grad und das Ausmaß der Akkumulation der aktiven Metaboliten von Bupropion beeinflussen. Die Ausscheidung der Hauptmetaboliten von Bupropion kann durch eine eingeschränkte Nieren- oder Leberfunktion beeinträchtigt werden, da es sich um mäßig polare Verbindungen handelt, die wahrscheinlich vor der Ausscheidung im Urin einer weiteren Metabolisierung oder Konjugation in der Leber unterliegen.
Patienten mit eingeschränkter Nierenfunktion
Es liegen nur begrenzte Informationen zur Pharmakokinetik von Bupropion bei Patienten mit eingeschränkter Nierenfunktion vor. Ein Vergleich zwischen den Studien zwischen gesunden Probanden und Probanden mit terminaler Niereninsuffizienz zeigte, dass die Cmax- und AUC-Werte der Ausgangssubstanz in den beiden Gruppen vergleichbar waren, während die Hydroxybupropion- und Threohydrobupropion-Metaboliten einen 2,3- bzw. 2,8-fachen Anstieg aufwiesen. in AUC für Patienten mit Nierenversagen im Endstadium. Eine zweite Studie, in der normale Probanden und Probanden mit mittelschwerer bis schwerer Nierenfunktionsstörung (GFR 30,9 ± 10,8 ml/min) verglichen wurden, zeigte, dass nach einer Einzeldosis von 150 mg Bupropion mit verzögerter Freisetzung die Bupropion-Exposition etwa 2-mal höher war bei Probanden mit eingeschränkter Nierenfunktion, während die Spiegel der Hydroxybupropion- und Threo/Erythrohydrobupropion-(kombinierten)-Metaboliten in den beiden Gruppen ähnlich waren. Bupropion wird weitgehend in der Leber zu aktiven Metaboliten metabolisiert, die weiter metabolisiert und anschließend über die Nieren ausgeschieden werden. Die Ausscheidung der Hauptmetaboliten von Bupropion kann durch eine eingeschränkte Nierenfunktion verringert sein. WELLBUTRIN sollte bei Patienten mit eingeschränkter Nierenfunktion mit Vorsicht angewendet werden und eine reduzierte Häufigkeit und/oder Dosis sollte in Betracht gezogen werden [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Patienten mit eingeschränkter Leberfunktion
Die Auswirkung einer Leberfunktionsstörung auf die Pharmakokinetik von Bupropion wurde in 2 Einzeldosis-Studien charakterisiert, eine bei Patienten mit alkoholbedingter Lebererkrankung und eine bei Patienten mit leichter bis schwerer Zirrhose. Die erste Studie zeigte, dass die Halbwertszeit von Hydroxybupropion bei 8 Probanden mit alkoholbedingter Lebererkrankung signifikant länger war als bei 8 gesunden Probanden (32 ± 14 Stunden gegenüber 21 ± 5 Stunden). Obwohl statistisch nicht signifikant, waren die AUCs für Bupropion und Hydroxybupropion variabler und tendenziell größer (um 53 % bis 57 %) bei Probanden mit alkoholbedingter Lebererkrankung. Die Unterschiede in der Halbwertszeit für Bupropion und die anderen Metaboliten in den beiden Gruppen waren minimal.
Die zweite Studie zeigte keine statistisch signifikanten Unterschiede in der Pharmakokinetik von Bupropion und seinen aktiven Metaboliten bei 9 Probanden mit leichter bis mittelschwerer Leberzirrhose im Vergleich zu 8 gesunden Probanden. Bei einigen der pharmakokinetischen Parameter von Bupropion (AUC, Cmax und Tmax) und seinen aktiven Metaboliten (t½) wurde jedoch bei Patienten mit leichter bis mittelschwerer Leberzirrhose eine größere Variabilität beobachtet. Bei Patienten mit schwerer Leberzirrhose wurden signifikante Veränderungen in der Pharmakokinetik von Bupropion und seinen Metaboliten beobachtet (Tabelle 3).
Patienten mit linksventrikulärer Dysfunktion
Während einer chronischen Dosierungsstudie mit Bupropion bei 14 depressiven Probanden mit linksventrikulärer Dysfunktion (Chronik in der Vorgeschichte oder vergrößertes Herz auf Röntgenbildern) gab es im Vergleich zu gesunden Probanden keine offensichtliche Wirkung auf die Pharmakokinetik von Bupropion oder seiner Metaboliten.
Das Alter
Die Wirkungen des Alters auf die Pharmakokinetik von Bupropion und seinen Metaboliten wurden nicht vollständig charakterisiert, aber eine Untersuchung der Bupropion-Konzentrationen im Steady-State aus mehreren Wirksamkeitsstudien bei Depressionen mit Probanden, die in einem Bereich von 300 bis 750 mg/Tag bei einer 3- Tageszeitplan ergab keinen Zusammenhang zwischen dem Alter (18 bis 83 Jahre) und der Plasmakonzentration von Bupropion. Eine pharmakokinetische Studie mit Einzeldosis zeigte, dass die Disposition von Bupropion und seinen Metaboliten bei älteren Probanden ähnlich war wie bei jüngeren Probanden. Diese Daten deuten darauf hin, dass das Alter keinen bedeutenden Einfluss auf die Bupropion-Konzentration hat; jedoch deutete eine andere Einzel- und Mehrfachdosis-Pharmakokinetikstudie darauf hin, dass ältere Menschen ein erhöhtes Risiko für eine Akkumulation von Bupropion und seinen Metaboliten haben [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Männliche und weibliche Patienten
Eine gepoolte Analyse der pharmakokinetischen Daten von Bupropion von 90 gesunden männlichen und 90 gesunden weiblichen Probanden ergab keine geschlechtsspezifischen Unterschiede in den maximalen Bupropion-Plasmakonzentrationen. Die mittlere systemische Exposition (AUC) war bei männlichen Probanden etwa 13 % höher als bei weiblichen Probanden. Die klinische Bedeutung dieses Befundes ist nicht bekannt.
Raucher
Die Auswirkungen des Zigarettenrauchens auf die Pharmakokinetik von Bupropion wurden an 34 gesunden männlichen und weiblichen Probanden untersucht; 17 waren chronische Zigarettenraucher und 17 waren Nichtraucher. Nach oraler Gabe einer Einzeldosis von 150 mg Bupropion gab es keine statistisch signifikanten Unterschiede bei Cmax, Halbwertszeit, Tmax, AUC oder Clearance von Bupropion oder seinen aktiven Metaboliten zwischen Rauchern und Nichtrauchern.
Arzneimittelwechselwirkungsstudien
Potenzial für andere Medikamente, WELLBUTRIN zu beeinflussen
In-vitro-Studien weisen darauf hin, dass Bupropion hauptsächlich durch CYP2B6 zu Hydroxybupropion metabolisiert wird. Daher besteht die Möglichkeit von Arzneimittelwechselwirkungen zwischen WELLBUTRIN und Arzneimitteln, die Inhibitoren oder Induktoren von CYP2B6 sind. Darüber hinaus deuten In-vitro-Studien darauf hin, dass Paroxetin, Sertralin, Norfluoxetin, Fluvoxamin und Nelfinavir die Hydroxylierung von Bupropion hemmen.
Inhibitoren von CYP2B6
Ticlopidin, Clopidogrel: In einer Studie mit gesunden männlichen Probanden erhöhte Clopidogrel 75 mg einmal täglich oder Ticlopidin 250 mg zweimal täglich die Exposition (Cmax und AUC) von Bupropion um 40 % und 60 % für Clopidogrel und um 38 % und 85 % für Ticlopidin , beziehungsweise. Die Exposition (Cmax und AUC) von Hydroxybupropion wurde durch Clopidogrel um 50 % bzw. 52 % und durch Ticlopidin um 78 % bzw. 84 % verringert. Es wird angenommen, dass dieser Effekt auf die Hemmung der CYP2B6-katalysierten Bupropion-Hydroxylierung zurückzuführen ist.
Prasugrel: Prasugrel ist ein schwacher Inhibitor von CYP2B6. Bei gesunden Probanden erhöhte Prasugrel die Cmax- und AUC-Werte von Bupropion um 14 % bzw. 18 % und senkte die Cmax- und AUC-Werte von Hydroxybupropion, einem aktiven Metaboliten von Bupropion, um 32 % bzw. 24 %.
Cimetidin: Der Threohydrobupropion-Metabolit von Bupropion scheint nicht von Cytochrom-P450-Enzymen produziert zu werden. Die Auswirkungen der gleichzeitigen Verabreichung von Cimetidin auf die Pharmakokinetik von Bupropion und seinen aktiven Metaboliten wurden an 24 gesunden jungen männlichen Probanden untersucht. Nach oraler Gabe von 300 mg Bupropion mit und ohne Cimetidin 800 mg blieb die Pharmakokinetik von Bupropion und Hydroxybupropion unbeeinflusst. Es gab jedoch einen Anstieg der AUC und Cmax um 16 % bzw. 32 % der kombinierten Bestandteile von Threohydrobupropion und Erythrohydrobupropion.
Citalopram: Citalopram beeinflusste die Pharmakokinetik von Bupropion und seinen drei Metaboliten nicht.
Induktoren von CYP2B6
Ritonavir und Lopinavir: In einer Studie mit gesunden Freiwilligen reduzierte Ritonavir 100 mg zweimal täglich die AUC und Cmax von Bupropion um 22 % bzw. 21 %. Die Exposition gegenüber dem Hydroxybupropion-Metaboliten war um 23 %, bei Threohydrobupropion um 38 % und bei Erythrohydrobupropion um 48 % verringert.
In einer zweiten Studie mit gesunden Freiwilligen verringerte Ritonavir in einer Dosis von 600 mg zweimal täglich die AUC und die Cmax von Bupropion um 66 % bzw. 62 %. Die Exposition gegenüber dem Hydroxybupropion-Metaboliten war um 78 %, bei Threohydrobupropion um 50 % und bei Erythrohydrobupropion um 68 % verringert.
In einer anderen Studie mit gesunden Probanden senkte Lopinavir 400 mg/Ritonavir 100 mg zweimal täglich die AUC und Cmax von Bupropion um 57 %. Die AUC und Cmax von Hydroxybupropion waren um 50 % bzw. 31 % verringert.
Efavirenz: In einer Studie mit gesunden Probanden reduzierte Efavirenz 600 mg einmal täglich über 2 Wochen die AUC und Cmax von Bupropion um etwa 55 % bzw. 34 %. Die AUC von Hydroxybupropion war unverändert, während Cmax von Hydroxybupropion um 50 % erhöht war.
Carbamazepin, Phenobarbital, Phenytoin: Obwohl nicht systematisch untersucht, können diese Medikamente den Metabolismus von Bupropion induzieren.
Potenzial für WELLBUTRIN, andere Medikamente zu beeinflussen
Tierexperimentelle Daten deuten darauf hin, dass Bupropion ein Induktor von Arzneimittel-metabolisierenden Enzymen beim Menschen sein kann. In einer Studie gab es nach chronischer Verabreichung von 100 mg Bupropion dreimal täglich an 8 gesunde männliche Freiwillige über 14 Tage keine Hinweise auf eine Induktion des eigenen Metabolismus. Dennoch kann es zu klinisch bedeutsamen Veränderungen der Blutspiegel von gleichzeitig angewendeten Arzneimitteln kommen.
Medikamente, die von CYP2D6 metabolisiert werden
In vitro sind Bupropion und seine Metaboliten (Erythrohydrobupropion, Threohydrobupropion, Hydroxybupropion) CYP2D6-Inhibitoren. In einer klinischen Studie mit 15 männlichen Probanden (im Alter von 19 bis 35 Jahren), die schnelle Metabolisierer von CYP2D6 waren, erhöhte Bupropion 300 mg/Tag, gefolgt von einer Einzeldosis von 50 mg Desipramin, die Cmax, AUC und t½ von Desipramin um durchschnittlich etwa 2-, 5- bzw. 2-fach. Die Wirkung hielt mindestens 7 Tage nach der letzten Bupropion-Dosis an. Die gleichzeitige Anwendung von Bupropion mit anderen Arzneimitteln, die durch CYP2D6 metabolisiert werden, wurde nicht formell untersucht.
Citalopram: Obwohl Citalopram nicht primär durch CYP2D6 metabolisiert wird, erhöhte Bupropion in einer Studie die Cmax und AUC von Citalopram um 30 % bzw. 40 %.
Lamotrigin: Mehrere orale Dosen von Bupropion hatten bei 12 gesunden Probanden keine statistisch signifikanten Auswirkungen auf die Pharmakokinetik von Lamotrigin nach einer Einzeldosis.
Digoxin: Literaturdaten zeigten, dass die Digoxin-Exposition verringert war, wenn eine orale Einzeldosis von 0,5 mg Digoxin 24 Stunden nach einer oralen Einzeldosis von 150 mg Bupropion mit verlängerter Freisetzung bei gesunden Probanden verabreicht wurde.
Klinische Studien
Die Wirksamkeit von WELLBUTRIN 150 mg bei der Behandlung von Major Depression wurde in zwei 4-wöchigen, placebokontrollierten Studien mit erwachsenen stationären Patienten mit MDD (Studien 1 und 2 in Tabelle 4) und in einer 6-wöchigen, placebokontrollierten Studie in nachgewiesen erwachsene ambulante Patienten mit MDD (Studie 3 in Tabelle 4). In der ersten Studie betrug der Dosisbereich von WELLBUTRIN 300 mg 300 mg bis 600 mg/Tag, verabreicht in 3 getrennten Dosen; 78 % der Patienten wurden mit Dosen von 300 mg bis 450 mg/Tag behandelt. Die Studie demonstrierte die Wirksamkeit von WELLBUTRIN 300 mg, gemessen anhand des Gesamtwertes der Hamilton Depression Rating Scale (HDRS), des HDRS-Items depressive Stimmung (Punkt 1) und des Clinical Global Impressions-Severity Score (CGI-S). Die zweite Studie umfasste 2 Dosen WELLBUTRIN (300 und 450 mg/Tag) und Placebo. Diese Studie zeigte die Wirksamkeit von WELLBUTRIN 150 mg nur für die Dosis von 450 mg/Tag. Die Wirksamkeitsergebnisse waren für den HDRS-Gesamtscore und den CGI-S-Score statistisch signifikant, nicht jedoch für HDRS-Item 1. In der dritten Studie wurden ambulante Patienten mit 300 mg/Tag WELLBUTRIN behandelt. Diese Studie demonstrierte die Wirksamkeit von WELLBUTRIN 150 mg, gemessen anhand des HDRS-Gesamtscores, des HDRS Item 1, der Montgomery-Asberg Depression Rating Scale (MADRS), des CGI-S-Scores und des CGI-Improvement Scale (CGI-I)-Scores . Die Wirksamkeit von WELLBUTRIN 300 mg bei Langzeitanwendung, d. h. länger als 6 Wochen, wurde nicht systematisch in kontrollierten Studien untersucht.
INFORMATIONEN ZUM PATIENTEN
WELLBUTRIN (GUT byu-trin) (Bupropionhydrochlorid) Tabletten
WICHTIG: Lesen Sie unbedingt die drei Abschnitte dieses Medikationsleitfadens. Im ersten Abschnitt geht es um das Risiko von Selbstmordgedanken und -handlungen mit Antidepressiva; im zweiten Abschnitt geht es um das Risiko von Denk- und Verhaltensänderungen, Depressionen und Suizidgedanken oder -handlungen im Zusammenhang mit Arzneimitteln zur Raucherentwöhnung; und der dritte Abschnitt trägt den Titel „Welche anderen wichtigen Informationen sollte ich über WELLBUTRIN 150 mg wissen?“
Antidepressiva, Depressionen und andere schwere psychische Erkrankungen sowie Selbstmordgedanken oder -handlungen
In diesem Abschnitt des Medikationsleitfadens geht es nur um das Risiko von Selbstmordgedanken und -handlungen mit Antidepressiva.
Was sind die wichtigsten Informationen, die ich über Antidepressiva, Depressionen und andere schwere psychische Erkrankungen sowie Selbstmordgedanken oder -handlungen wissen sollte?
1. Antidepressiva können das Risiko von Suizidgedanken oder -handlungen bei manchen Kindern, Jugendlichen oder jungen Erwachsenen in den ersten Behandlungsmonaten erhöhen.
2. Depressionen oder andere schwere psychische Erkrankungen sind die wichtigsten Ursachen für Selbstmordgedanken und -handlungen. Bei manchen Menschen besteht ein besonders hohes Risiko für Suizidgedanken oder -handlungen. Dazu gehören Menschen, die eine bipolare Erkrankung (auch manisch-depressive Erkrankung genannt) oder Suizidgedanken oder -handlungen haben (oder in deren Familienanamnese aufgetreten sind).
3. Wie kann ich Suizidgedanken und -handlungen bei mir oder einem Familienmitglied beobachten und versuchen zu verhindern?
Rufen Sie sofort Ihren Arzt an, wenn Sie oder Ihr Familienmitglied eines der folgenden Symptome haben, insbesondere wenn sie neu oder schlimmer sind oder Sie beunruhigen:
Was muss ich sonst noch über Antidepressiva wissen?
Es ist nicht bekannt, ob WELLBUTRIN bei Kindern unter 18 Jahren sicher und wirksam ist.
Raucherentwöhnung, Raucherentwöhnungsmedikamente, Veränderungen im Denken und Verhalten, Depression und Suizidgedanken oder -handlungen
In diesem Abschnitt des Medikationsleitfadens geht es nur um das Risiko von Denk- und Verhaltensänderungen, Depressionen und Selbstmordgedanken oder -handlungen im Zusammenhang mit Medikamenten zur Raucherentwöhnung. Obwohl WELLBUTRIN keine Behandlung zur Raucherentwöhnung ist, enthält es denselben Wirkstoff (Bupropionhydrochlorid) wie ZYBAN, das Patienten bei der Raucherentwöhnung hilft.
Sprechen Sie mit Ihrem Arzt oder dem Arzt Ihres Familienmitglieds über:
Wenn Sie versuchen, mit oder ohne Bupropion mit dem Rauchen aufzuhören, können Sie Symptome haben, die auf den Nikotinentzug zurückzuführen sein können, einschließlich:
Einige Menschen hatten sogar Selbstmordgedanken, als sie versuchten, ohne Medikamente mit dem Rauchen aufzuhören.
Manchmal kann das Aufhören mit dem Rauchen zu einer Verschlechterung bereits bestehender psychischer Gesundheitsprobleme wie Depressionen führen.
Einige Menschen hatten schwerwiegende Nebenwirkungen, während sie Bupropion einnahmen, um ihnen zu helfen, mit dem Rauchen aufzuhören, einschließlich: Neue oder schlimmere psychische Gesundheitsprobleme, wie Verhaltens- oder Denkänderungen, Aggression, Feindseligkeit, Unruhe, Depression oder Selbstmordgedanken oder -handlungen. Einige Menschen hatten diese Symptome, als sie mit der Einnahme von Bupropion begannen, und andere entwickelten sie nach mehreren Wochen der Behandlung oder nach dem Absetzen von Bupropion. Diese Symptome traten häufiger bei Menschen auf, die vor der Einnahme von Bupropion psychische Probleme hatten, als bei Menschen ohne psychische Probleme in der Vorgeschichte.
Brechen Sie die Einnahme von WELLBUTRIN ab und wenden Sie sich sofort an Ihren Arzt, wenn Sie, Ihre Familie oder Ihre Pflegekraft eines dieser Symptome bemerken. Arbeiten Sie mit Ihrem Arzt zusammen, um zu entscheiden, ob Sie WELLBUTRIN weiterhin einnehmen sollten. Bei vielen Menschen verschwanden diese Symptome nach dem Absetzen von WELLBUTRIN 300 mg, aber bei manchen Menschen hielten die Symptome auch nach dem Absetzen von WELLBUTRIN an. Es ist wichtig, dass Sie sich an Ihren Arzt wenden, bis Ihre Symptome verschwinden. Informieren Sie vor der Einnahme von WELLBUTRIN 150 mg Ihren Arzt, wenn Sie jemals an Depressionen oder anderen psychischen Problemen gelitten haben. Sie sollten Ihren Arzt auch über alle Symptome informieren, die Sie zu anderen Zeiten hatten, als Sie versuchten, mit oder ohne Bupropion mit dem Rauchen aufzuhören.
Welche anderen wichtigen Informationen sollte ich über WELLBUTRIN wissen?
Was ist Wellbutrin?
WELLBUTRIN ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von Erwachsenen mit einer bestimmten Art von Depression, die als Major Depression bezeichnet wird.
Wer sollte WELLBUTRIN 150 mg nicht einnehmen?
Nehmen Sie WELLBUTRIN nicht ein, wenn Sie
Was sollte ich meinem Arzt vor der Einnahme von WELLBUTRIN mitteilen?
Informieren Sie Ihren Arzt, wenn Sie jemals Depressionen, Selbstmordgedanken oder -handlungen oder andere psychische Gesundheitsprobleme hatten. Siehe „Antidepressiva, Depressionen und andere schwere psychische Erkrankungen sowie Selbstmordgedanken oder -handlungen“.
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger, rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen. Viele Arzneimittel erhöhen das Risiko von Krampfanfällen oder anderen schwerwiegenden Nebenwirkungen, wenn Sie sie einnehmen, während Sie WELLBUTRIN einnehmen.
Wie sollte ich WELLBUTRIN 300 mg einnehmen?
Was sollte ich während der Einnahme von WELLBUTRIN 300 mg vermeiden?
Welche Nebenwirkungen kann WELLBUTRIN 300mg haben?
WELLBUTRIN kann schwerwiegende Nebenwirkungen hervorrufen. Informationen zu schwerwiegenden Nebenwirkungen von WELLBUTRIN finden Sie in den Abschnitten am Anfang dieses Arzneimittelleitfadens.
Zu den häufigsten Nebenwirkungen von WELLBUTRIN gehören:
Wenn Sie Übelkeit haben, nehmen Sie Ihr Arzneimittel zusammen mit einer Mahlzeit ein. Wenn Sie Schlafstörungen haben, nehmen Sie Ihr Arzneimittel nicht zu kurz vor dem Schlafengehen ein.
Informieren Sie Ihren Arzt sofort über alle Nebenwirkungen, die Sie stören.
Dies sind nicht alle möglichen Nebenwirkungen von WELLBUTRIN. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
Rufen Sie Ihren Arzt an, um medizinischen Rat zu Nebenwirkungen zu erhalten. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Sie können Nebenwirkungen auch an GlaxoSmithKline unter 1-888-825-5249 melden.
Wie sollte ich WELLBUTRIN 300 mg aufbewahren?
Bewahren Sie WELLBUTRIN und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von WELLBUTRIN.
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie WELLBUTRIN 300 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie WELLBUTRIN nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Wenn Sie einen Urin-Drogen-Screening-Test machen, kann WELLBUTRIN das Testergebnis für Amphetamine positiv machen. Wenn Sie der Person, die Ihnen den Drogentest gibt, mitteilen, dass Sie WELLBUTRIN 300 mg einnehmen, kann sie einen spezifischeren Drogentest durchführen, bei dem dieses Problem nicht auftreten sollte.
Dieser Arzneimittelleitfaden fasst wichtige Informationen über WELLBUTRIN zusammen. Wenn Sie weitere Informationen wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Arzt oder Apotheker nach Informationen über WELLBUTRIN fragen, die für medizinisches Fachpersonal geschrieben sind.
Weitere Informationen zu WELLBUTRIN erhalten Sie telefonisch unter 1-888-825-5249.
Welche Inhaltsstoffe enthält WELLBUTRIN 300mg?
Wirkstoff: Bupropionhydrochlorid.
Inaktive Bestandteile: 75-mg-Tablette – D&C Yellow Nr. 10 Lake, FD&C Yellow Nr. 6 Lake, Hydroxypropylcellulose, Hypromellose, mikrokristalline Cellulose, Polyethylenglykol, Talk und Titandioxid; 100-mg-Tablette – FD&C Red No. 40 Lake, FD&C Yellow No. 6 Lake, Hydroxypropylcellulose, Hypromellose, mikrokristalline Cellulose, Polyethylenglycol, Talk und Titandioxid.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.