Paxil 10mg, 20mg, 30mg, 40mg Paroxetine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Paxil und wie wird es angewendet?
Paxil 20 mg ist ein verschreibungspflichtiges Medikament zur Behandlung der Symptome von Depression, Zwangsstörung (OCD), Panikstörung, sozialer Phobie, generalisierter Angststörung, posttraumatischer Belastungsstörung (PTSD) und prämenstrueller dysohorischer Störung (PMDD). Paxil kann allein oder mit anderen Medikamenten verwendet werden.
Welche Nebenwirkungen kann Paxil 30mg haben?
Paxil 10 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Paxil 30 mg sind:
Suizidalität und Antidepressiva
Antidepressiva erhöhten im Vergleich zu Placebo das Risiko für suizidales Denken und Verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen in Kurzzeitstudien zu Major Depression (MDD) und anderen psychiatrischen Erkrankungen. Jeder, der die Anwendung von PAXIL 40 mg oder anderen Antidepressiva bei einem Kind, Jugendlichen oder jungen Erwachsenen in Betracht zieht, muss dieses Risiko mit der klinischen Notwendigkeit abwägen. Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; Bei Erwachsenen ab 65 Jahren war das Risiko unter Antidepressiva im Vergleich zu Placebo geringer. Depressionen und bestimmte andere psychiatrische Störungen sind selbst mit einem erhöhten Suizidrisiko verbunden. Patienten jeden Alters, die mit einer antidepressiven Therapie begonnen werden, sollten angemessen überwacht und engmaschig auf klinische Verschlechterung, Suizidalität oder ungewöhnliche Verhaltensänderungen beobachtet werden. Familien und Betreuer sollten auf die Notwendigkeit einer genauen Beobachtung und Kommunikation mit dem verschreibenden Arzt hingewiesen werden. PAXIL 30 mg ist nicht für die Anwendung bei pädiatrischen Patienten zugelassen. (Siehe WARNHINWEISE: Klinische Verschlechterung und Suizidrisiko, PATIENTENINFORMATIONEN und VORSICHTSMASSNAHMEN: Anwendung bei Kindern.)
BEZEICHNUNG
PAXIL (Paroxetinhydrochlorid) ist ein oral verabreichtes Psychopharmakon. Es ist das Hydrochloridsalz einer Phenylpiperidinverbindung, die chemisch als (-)-trans-4R-(4'Fluorphenyl)-3S-[(3',4'-Methylendioxyphenoxy)methyl]piperidin-Hydrochlorid-Hemihydrat und identifiziert wird hat die Summenformel C19H20FNO3•HCl•½H2O. Das Molekulargewicht beträgt 374,8 (329,4 als freie Base). Die Strukturformel von Paroxetinhydrochlorid lautet:
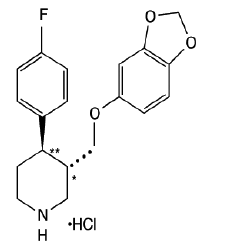
Paroxetinhydrochlorid ist ein geruchloses, weißliches Pulver mit einem Schmelzpunktbereich von 120 °C bis 138 °C und einer Löslichkeit von 5,4 mg/ml in Wasser.
Jede Filmtablette enthält Paroxetinhydrochlorid, das Paroxetin wie folgt entspricht: 10 mg – gelb (mit Bruchkerbe); 20 mg-rosa (gekerbt); 30 mg-blau, 40 mg-grün. Inaktive Inhaltsstoffe bestehen aus dibasischem Calciumphosphatdihydrat, Hypromellose, Magnesiumstearat, Polyethylenglycolen, Polysorbat 80, Natriumstärkeglycolat, Titandioxid und einem oder mehreren der folgenden Stoffe: D&C Red Nr. 30 Aluminiumlack, D&C Yellow Nr. 10 Aluminiumlack , FD&C Blau Nr. 2 Aluminiumlack, FD&C Gelb Nr. 6 Aluminiumlack.
Suspendierung zur oralen Verabreichung
Jeweils 5 ml der orangefarbenen Flüssigkeit mit Orangengeschmack enthalten Paroxetinhydrochlorid, das 10 mg Paroxetin entspricht. Inaktive Inhaltsstoffe bestehen aus Polacrilin-Kalium, mikrokristalliner Cellulose, Propylenglycol, Glycerin, Sorbitol, Methylparaben, Propylparaben, Natriumcitrat-Dihydrat, wasserfreier Citronensäure, Natriumsaccharin, Aromen, FD&C Yellow No. 6 Aluminiumlack und Simethicon-Emulsion, USP.
INDIKATIONEN
PAXIL 20 mg ist angezeigt bei Erwachsenen zur Behandlung von:
DOSIERUNG UND ANWENDUNG
Verwaltungsinformationen
PAXIL als tägliche Einzeldosis morgens mit oder ohne Nahrung verabreichen.
Schütteln Sie die Suspension zum Einnehmen vor der Verabreichung gut.
Empfohlene Dosierung für MDD, OCD, PD und PTSD
Die empfohlenen Anfangsdosierungen und maximalen Dosierungen von PAXIL 20 mg bei Patienten mit MDD, OCD, PD und PTSD sind in Tabelle 1 dargestellt.
Bei Patienten mit unzureichendem Ansprechen Dosiserhöhung in Schritten von 10 mg pro Tag in Abständen von mindestens 1 Woche, je nach Verträglichkeit.
Empfohlene Dosierung für SAD und GAD
TRAURIG
Die anfängliche und empfohlene Dosierung bei Patienten mit SAD beträgt 20 mg täglich. In klinischen Studien wurde die Wirksamkeit von PAXIL 30 mg bei Patienten mit einer Dosis von 20 mg bis 60 mg täglich nachgewiesen. Während die Sicherheit von PAXIL bei Patienten mit SAD in Dosen von bis zu 60 mg täglich untersucht wurde, weisen die verfügbaren Informationen nicht auf einen zusätzlichen Nutzen für Dosen über 20 mg täglich hin [siehe Klinische Studien ].
GAD
Die Anfangs- und empfohlene Dosierung bei Patienten mit GAD beträgt 20 mg täglich. In klinischen Studien wurde die Wirksamkeit von PAXIL 10 mg bei GAD bei Patienten nachgewiesen, die täglich in einem Bereich von 20 mg bis 50 mg dosiert wurden. Es gibt keine ausreichenden Beweise für einen größeren Nutzen von Dosen über 20 mg täglich [siehe Klinische Studien ].
Bei Patienten mit unzureichendem Ansprechen Dosiserhöhung in Schritten von 10 mg pro Tag in Abständen von mindestens 1 Woche, je nach Verträglichkeit.
Screening auf bipolare Störung vor Beginn von PAXIL
Vor Beginn der Behandlung mit PAXIL 10 mg oder einem anderen Antidepressivum sollten Patienten auf eine persönliche oder familiäre Vorgeschichte von bipolarer Störung, Manie oder Hypomanie untersucht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Empfohlene Dosierung für ältere Patienten, Patienten mit schwerer Nierenfunktionsstörung und Patienten mit schwerer Leberfunktionsstörung
Die empfohlene Anfangsdosis beträgt 10 mg pro Tag für ältere Patienten, Patienten mit schwerer Nierenfunktionsstörung und Patienten mit schwerer Leberfunktionsstörung. Die Dosierung sollte 40 mg/Tag nicht überschreiten.
Umstellung von Patienten auf oder von einem Monoaminoxidase-Hemmer (MAOI)
Zwischen dem Absetzen eines Monoaminoxidase-Hemmers (MAO-Hemmer) und dem Beginn einer Behandlung mit PAXIL müssen mindestens 14 Tage vergehen. Außerdem müssen nach dem Absetzen von PAXIL mindestens 14 Tage vergehen, bevor mit einem MAO-Hemmer begonnen werden kann [siehe KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Absetzen der Behandlung mit PAXIL
Nach Absetzen von PAXIL können Nebenwirkungen auftreten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Reduzieren Sie die Dosierung schrittweise, anstatt PAXIL abrupt zu stoppen, wann immer dies möglich ist.
WIE GELIEFERT
Darreichungsformen und Stärken
PAXIL-Tabletten sind erhältlich als:
PAXIL 20 mg Suspension zum Einnehmen ist erhältlich als:
Lagerung und Handhabung
PAXIL (Paroxetin) Tabletten sind ovale Tabletten, die geliefert werden als:
Tabletten zwischen 15° und 30°C (59° und 86°F) lagern.
PAXIL (Paroxetin) Suspension zum Einnehmen wird geliefert als:
Suspension bei oder unter 25 °C (77 °F) lagern
Hergestellt von: Apotex Inc., Toronto, Ontario, Kanada M9L 1T9. Überarbeitet: Februar 2021
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen sind in anderen Abschnitten der Verschreibungsinformationen detaillierter aufgeführt:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die Sicherheitsdaten für PAXIL stammen von:
Nebenwirkungen, die zum Absetzen führen
Zwanzig Prozent (1.199/6.145) der Patienten, die in klinischen Studien bei MDD mit PAXIL behandelt wurden, und 16,1 % (84/522), 11,8 % (64/542), 9,4 % (44/469), 10,7 % (79/735), und 11,7 % (79/676) der Patienten, die in klinischen Studien mit PAXIL bei SAD, OCD, PD, GAD bzw. PTSD behandelt wurden, brachen die Behandlung aufgrund einer Nebenwirkung ab. Die häufigsten Nebenwirkungen (≥ 1 %) im Zusammenhang mit dem Absetzen (d. h. die Nebenwirkungen im Zusammenhang mit einem Behandlungsabbruch mit einer etwa doppelt so hohen Rate bei PAXIL 10 mg im Vergleich zu Placebo) sind in Tabelle 3 aufgeführt:
Die häufigsten Nebenwirkungen
Die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von PAXIL (Inzidenz von 5 % oder mehr und mindestens doppelt so hoch wie bei Placebo) waren:
MDD
Asthenie, Schwitzen, Übelkeit, verminderter Appetit, Schläfrigkeit, Schwindel, Schlaflosigkeit, Zittern, Nervosität, Ejakulationsstörung und andere männliche Genitalstörungen.
Zwangsstörung
Übelkeit, trockener Mund, verminderter Appetit, Verstopfung, Schwindel, Schläfrigkeit, Zittern, Schwitzen, Impotenz und abnormale Ejakulation.
PD
Asthenie, Schwitzen, verminderter Appetit, verminderte Libido, Zittern, abnormale Ejakulation, weibliche Genitalstörungen und Impotenz.
TRAURIG
Schwitzen, Übelkeit, trockener Mund, Verstopfung, verminderter Appetit, Schläfrigkeit, Zittern, verminderte Libido, Gähnen, abnormale Ejakulation, weibliche Genitalstörungen und Impotenz.
GAD
Asthenie, Infektion, Verstopfung, verminderter Appetit, Mundtrockenheit, Übelkeit, verminderte Libido, Somnolenz, Zittern, Schwitzen und abnormale Ejakulation.
PTBS
Asthenie, Schwitzen, Übelkeit, Mundtrockenheit, Durchfall, verminderter Appetit, Schläfrigkeit, verminderte Libido, abnormale Ejakulation, weibliche Genitalstörungen und Impotenz.
Nebenwirkungen bei Patienten mit MDD
Tabelle 4 zeigt die Nebenwirkungen, die in klinischen Studien an mit PAXIL behandelten Patienten mit MDD mit einer Inzidenz von 1 % oder mehr und mehr als unter Placebo auftraten.
Nebenwirkungen bei Patienten mit OCD, PD und SAD
Tabelle 5 zeigt Nebenwirkungen, die in klinischen Studien bei Patienten mit OCD, PD und SAD mit einer Häufigkeit von 2 % oder mehr auftraten.
Nebenwirkungen bei Patienten mit GAD und PTSD
Tabelle 6 zeigt Nebenwirkungen, die in klinischen Studien bei Patienten mit GAD und PTSD mit einer Häufigkeit von 2 % oder mehr auftraten.
Dosisabhängige Nebenwirkungen
MDD
Ein Vergleich der Nebenwirkungsraten in einer Studie mit fester Dosierung, in der PAXIL 10 mg, 20 mg, 30 mg und 40 mg einmal täglich mit Placebo bei der Behandlung von MDD verglichen wurde, ergab dosisabhängige Nebenwirkungen, wie in Tabelle 7 gezeigt:
Zwangsstörung
In einer Fixdosis-Studie, in der Placebo und PAXIL 20 mg, 40 mg und 60 mg bei der Behandlung von Zwangsstörungen verglichen wurden, gab es keinen klaren Zusammenhang zwischen Nebenwirkungen und der Dosis von PAXIL 30 mg, der die Patienten zugewiesen wurden.
PD
In einer Fixdosis-Studie zum Vergleich von Placebo und PAXIL 10 mg, 20 mg und 40 mg bei der Behandlung von Parkinson wurde gezeigt, dass die folgenden Nebenwirkungen dosisabhängig waren: Asthenie, Mundtrockenheit, Angst, verminderte Libido, Tremor und abnormale Ejakulation.
TRAURIG
In einer Studie mit fester Dosierung, in der Placebo und PAXIL 20 mg, 40 mg und 60 mg bei der Behandlung von SAD verglichen wurden, gab es für die meisten Nebenwirkungen keinen klaren Zusammenhang zwischen Nebenwirkungen und der Dosis von PAXIL 10 mg, der die Patienten zugewiesen wurden .
GAD
In einer Fixdosis-Studie zum Vergleich von Placebo und PAXIL 20 mg und 40 mg bei der Behandlung von GAD wurde gezeigt, dass die folgenden Nebenwirkungen dosisabhängig waren: Asthenie, Verstopfung und abnormale Ejakulation.
PTBS
In einer Fixdosis-Studie zum Vergleich von Placebo und PAXIL 20 mg bzw. 40 mg bei der Behandlung von PTSD wurde gezeigt, dass die folgenden Nebenwirkungen dosisabhängig waren: Impotenz und abnormale Ejakulation.
Männliche und weibliche sexuelle Dysfunktion
Obwohl Veränderungen des sexuellen Verlangens, der sexuellen Leistung und der sexuellen Befriedigung häufig als Manifestationen einer psychiatrischen Störung auftreten, können sie auch eine Folge der SSRI-Behandlung sein. Zuverlässige Schätzungen der Häufigkeit und Schwere unerwünschter Erfahrungen mit sexuellem Verlangen, sexueller Leistung und Befriedigung sind jedoch schwierig zu erhalten, zum Teil, weil Patienten und Gesundheitsdienstleister möglicherweise zögern, darüber zu sprechen. Dementsprechend können Schätzungen der Häufigkeit von unerwünschten sexuellen Erfahrungen und Verhaltensweisen, die in der Kennzeichnung angegeben werden, ihre tatsächliche Häufigkeit unterschätzen.
Der Prozentsatz der Patienten, die bei Männern und Frauen mit MDD, OCD, PD, SAD, GAD und PTSD über Symptome einer sexuellen Dysfunktion berichten, ist in Tabelle 8 dargestellt.
Die Behandlung mit PAXIL 20 mg wurde mit mehreren Fällen von Priapismus in Verbindung gebracht. In den Fällen mit bekanntem Ausgang erholten sich die Patienten ohne Folgeerscheinungen.
Halluzinationen
In gepoolten klinischen Studien mit PAXIL wurden bei 0,2 % der mit PAXIL behandelten Patienten Halluzinationen beobachtet, verglichen mit 0,1 % der Patienten, die Placebo erhielten.
Weniger häufige Nebenwirkungen
Die folgenden Nebenwirkungen traten während der klinischen Studien mit PAXIL auf und sind an keiner anderen Stelle in der Kennzeichnung aufgeführt.
Die Nebenwirkungen sind nach Körpersystem kategorisiert und nach abnehmender Häufigkeit gemäß den folgenden Definitionen aufgelistet: Häufige Nebenwirkungen sind solche, die bei mindestens 1/100 Patienten einmal oder mehrmals auftreten; seltene Nebenwirkungen treten bei 1/100 bis 1/1.000 Patienten auf; seltene Nebenwirkungen treten bei weniger als 1/1.000 Patienten auf.
Körper als Ganzes
Selten: Allergische Reaktion, Schüttelfrost, Gesichtsödem, Unwohlsein, Nackenschmerzen; selten: Adrenerges Syndrom, Cellulitis, Moniliasis, Nackensteifigkeit, Beckenschmerzen, Peritonitis, Sepsis, Ulkus.
Herz-Kreislauf-System
Häufig: Bluthochdruck, Tachykardie; selten: Bradykardie, Hämatom, Hypotonie, Migräne, orthostatische Hypotonie, Synkope; selten: Angina pectoris, nodale Arrhythmie, Vorhofflimmern, Schenkelblock, zerebrale Ischämie, zerebrovaskulärer Insult, dekompensierte Herzinsuffizienz, Herzblock, niedriges Herzzeitvolumen, Myokardinfarkt, Myokardischämie, Blässe, Phlebitis, Lungenembolie, supraventrikuläre Extrasystolen, Thrombophlebitis, Thrombose, Krampfadern, vaskuläre Kopfschmerzen, ventrikuläre Extrasystolen.
Verdauungstrakt
Selten: Bruxismus, Colitis, Dysphagie, Aufstoßen, Gastritis, Gastroenteritis, Gingivitis, Glossitis, erhöhter Speichelfluss, abnormale Leberfunktionstests, rektale Blutungen, ulzerative Stomatitis; Selten: Aphthöse Stomatitis, blutiger Durchfall, Bulimie, Kardiospasmus, Cholelithiasis, Duodenitis, Enteritis, Ösophagitis, Kotstauung, Stuhlinkontinenz, Zahnfleischblutung, Hämatemesis, Hepatitis, Ileitis, Ileus, Darmverschluss, Gelbsucht, Meläna, Geschwüre im Mund, peptisches Ulkus, Speicheldrüsenvergrößerung, Sialadenitis, Magengeschwür, Stomatitis, Zungenverfärbung, Zungenödem, Zahnkaries.
Hormonsystem
Selten: Diabetes mellitus, Kropf, Hyperthyreose, Hypothyreose, Thyreoiditis.
Hemisches und lymphatisches System
Selten: Anämie, Leukopenie, Lymphadenopathie, Purpura; Selten: Abnormale Erythrozyten, Basophilie, erhöhte Blutungszeit, Eosinophilie, hypochrome Anämie, Eisenmangelanämie, Leukozytose, Lymphödem, abnorme Lymphozyten, Lymphozytose, mikrozytäre Anämie, Monozytose, normozytäre Anämie, Thrombozythämie, Thrombozytopenie.
Stoffwechsel und Ernährung
Häufig: Gewichtszunahme; selten: Ödeme, periphere Ödeme, SGOT erhöht, SGPT erhöht, Durst, Gewichtsverlust; Selten: Alkalische Phosphatase erhöht, Bilirubinämie, BUN erhöht, Kreatininphosphokinase erhöht, Dehydratation, Gammaglobuline erhöht, Gicht, Hyperkalzämie, Hypercholesterinämie, Hyperglykämie, Hyperkaliämie, Hyperphosphatämie, Hypokalzämie, Hypoglykämie, Hypokaliämie, Hyponatriämie, Ketose, Laktatdehydrogenase erhöht, kein Protein Stickstoff (NPN) erhöht.
Bewegungsapparat
Häufig: Arthralgie; selten: Arthritis, Arthrose; selten: Bursitis, Myositis, Osteoporose, generalisierter Krampf, Tenosynovitis, Tetanie.
Nervöses System
Häufig: Emotionale Labilität, Schwindel; selten: Denkstörungen, Alkoholmissbrauch, Ataxie, Dystonie, Dyskinesie, Euphorie, Feindseligkeit, Hypertonie, Hypästhesie, Hypokinesie, Koordinationsstörungen, Emotionslosigkeit, gesteigerte Libido, manische Reaktion, Neurose, Lähmung, paranoide Reaktion; selten: anormaler Gang, Akinesie, antisoziale Reaktion, Aphasie, Choreoathetose, zirkumorale Parästhesien, Krämpfe, Delirium, Wahnvorstellungen, Diplopie, Drogenabhängigkeit, Dysarthrie, extrapyramidales Syndrom, Faszikulationen, Grand-Mal-Krämpfe, Hyperalgesie, Hysterie, manisch-depressive Reaktion, Meningitis, Myelitis, Neuralgie, Neuropathie, Nystagmus, periphere Neuritis, psychotische Depression, Psychose, verminderte Reflexe, verstärkte Reflexe, Stupor, Torticollis, Trismus, Entzugssyndrom.
Atmungssystem
Selten: Asthma, Bronchitis, Dyspnoe, Nasenbluten, Hyperventilation, Lungenentzündung, Grippe der Atemwege; Selten: Emphysem, Hämoptyse, Schluckauf, Lungenfibrose, Lungenödem, vermehrter Auswurf, Stridor, Stimmveränderung.
Haut und Anhängsel
Häufig: Juckreiz; selten: Akne, Alopezie, Kontaktdermatitis, trockene Haut, Ekchymose, Ekzem, Herpes simplex, Lichtempfindlichkeit, Urtikaria; selten: Angioödem, Erythema nodosum, Erythema multiforme, exfoliative Dermatitis, Pilzdermatitis, Furunkulose; Herpes zoster, Hirsutismus, makulopapulöser Ausschlag, Seborrhoe, Hautverfärbung, Hauthypertrophie, Hautgeschwür, vermindertes Schwitzen, vesikulobullöser Ausschlag.
Besondere Sinne
Häufig: Tinnitus; selten: Akkommodationsstörung, Konjunktivitis, Ohrenschmerzen, Augenschmerzen, Keratokonjunktivitis, Mydriasis, Otitis media; Selten: Amblyopie, Anisokorie, Blepharitis, Katarakt, Bindehautödem, Hornhautgeschwür, Taubheit, Exophthalmus, Augenblutung, Glaukom, Hyperakusis, Nachtblindheit, Otitis externa, Parosmie, Photophobie, Ptosis, Netzhautblutung, Geschmacksverlust, Gesichtsfeldeinschränkung.
Urogenitalsystem
Selten: Amenorrhoe, Brustschmerzen, Zystitis, Dysurie, Hämaturie, Menorrhagie, Nykturie, Polyurie, Pyurie, Harninkontinenz, Harnverhalt, Harndrang, Vaginitis; Selten: Abort, Brustatrophie, Brustvergrößerung, Endometriumerkrankung, Nebenhodenentzündung, weibliche Laktation, fibrozystische Brust, Nierensteine, Nierenschmerzen, Leukorrhoe, Mastitis, Metrorrhagie, Nephritis, Oligurie, Salpingitis, Urethritis, Harnzylinder, Uterusspasmus, Urolith, Vaginal Blutungen, vaginale Moniliasis.
Postmarketing-Erfahrung
Die folgenden Reaktionen wurden während der Anwendung von PAXIL nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet wurden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Akute Pankreatitis, erhöhte Leberfunktionstests (die schwersten Fälle waren Todesfälle aufgrund von Lebernekrose und stark erhöhte Transaminasen in Verbindung mit schwerer Leberfunktionsstörung), Guillain-Barré-Syndrom, Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, Syndrom der unangemessenen ADH-Sekretion, Prolaktinämie und Galaktorrhoe; extrapyramidale Symptome, die Akathisie, Bradykinesie, Zahnradstarrheit, okulogyrische Krise, die mit der gleichzeitigen Anwendung von Pimozid in Verbindung gebracht wurden, umfassten; Status epilepticus, akutes Nierenversagen, pulmonale Hypertonie, allergische Alveolitis, Anaphylaxie, Eklampsie, Laryngismus, Optikusneuritis, Porphyrie, Restless-Legs-Syndrom (RLS), Kammerflimmern, ventrikuläre Tachykardie (einschließlich Torsade de Pointes), hämolytische Anämie, Ereignisse im Zusammenhang mit Störungen Hämatopoese (einschließlich aplastischer Anämie, Panzytopenie, Knochenmarkaplasie und Agranulozytose), vaskulitische Syndrome (wie Purpura Schönlein-Henoch) und Frühgeburten bei Schwangeren. Es gibt einen Fallbericht über schwere Hypotonie, wenn PAXIL 20 mg zu einer chronischen Behandlung mit Metoprolol hinzugefügt wurde.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Tabelle 9 zeigt klinisch signifikante Arzneimittelwechselwirkungen mit PAXIL.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Suizidgedanken und -verhalten bei Jugendlichen und jungen Erwachsenen
In gepoolten Analysen placebokontrollierter Studien mit Antidepressiva (SSRIs und andere Antidepressiva-Klassen), an denen etwa 77.000 erwachsene Patienten und 4.500 pädiatrische Patienten teilnahmen, war die Inzidenz von Suizidgedanken und -verhalten bei mit Antidepressiva behandelten Patienten im Alter von 24 Jahren und jünger höher als in mit Placebo behandelte Patienten. Es gab beträchtliche Unterschiede im Risiko für Selbstmordgedanken und -verhalten unter den Medikamenten, aber bei jungen Patienten wurde für die meisten untersuchten Medikamente ein erhöhtes Risiko festgestellt. Es gab Unterschiede im absoluten Risiko für Suizidgedanken und -verhalten bei den verschiedenen Indikationen, mit der höchsten Inzidenz bei Patienten mit MDD. Die Unterschiede zwischen Medikament und Placebo in der Anzahl der Fälle von Suizidgedanken und -verhalten pro 1000 behandelten Patienten sind in Tabelle 2 aufgeführt.
PAXIL 30 mg ist nicht für die Anwendung bei pädiatrischen Patienten zugelassen.
Es ist nicht bekannt, ob das Risiko von Suizidgedanken und -verhalten bei Kindern, Jugendlichen und jungen Erwachsenen auch bei längerfristiger Anwendung, dh über vier Monate hinaus, besteht. Aus Placebo-kontrollierten Erhaltungsstudien bei Erwachsenen mit MDD gibt es jedoch erhebliche Hinweise darauf, dass Antidepressiva das Wiederauftreten von Depressionen verzögern und dass Depressionen selbst ein Risikofaktor für Selbstmordgedanken und -verhalten sind.
Überwachen Sie alle mit Antidepressiva behandelten Patienten auf Anzeichen einer klinischen Verschlechterung und des Auftretens von Suizidgedanken und -verhalten, insbesondere während der ersten paar Monate der Arzneimitteltherapie und zu Zeiten von Dosisänderungen. Beraten Sie Familienmitglieder oder Betreuer von Patienten, um auf Verhaltensänderungen zu achten und den Gesundheitsdienstleister zu warnen. Erwägen Sie eine Änderung des therapeutischen Schemas, einschließlich eines möglichen Absetzens von PAXIL, bei Patienten, deren Depression sich anhaltend verschlimmert oder die aufkommende Suizidgedanken oder -verhalten zeigen.
Serotonin-Syndrom
SSRIs, einschließlich PAXIL, können das Serotonin-Syndrom auslösen, eine potenziell lebensbedrohliche Erkrankung. Das Risiko ist erhöht bei gleichzeitiger Anwendung von anderen serotonergen Arzneimitteln (einschließlich Triptanen, trizyklischen Antidepressiva, Fentanyl, Lithium, Tramadol, Tryptophan, Buspiron, Amphetaminen und Johanniskraut) und von Arzneimitteln, die den Stoffwechsel von Serotonin beeinträchtigen, dh MAO-Hemmern [siehe KONTRAINDIKATIONEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Ein Serotonin-Syndrom kann auch auftreten, wenn diese Medikamente allein verwendet werden.
Zu den Symptomen des Serotonin-Syndroms können Veränderungen des mentalen Status (z. B. Unruhe, Halluzinationen, Delirium und Koma), autonome Instabilität (z. B. Tachykardie, labiler Blutdruck, Schwindel, Diaphorese, Hitzewallungen, Hyperthermie), neuromuskuläre Symptome (z. B. Tremor, Steifheit, Myoklonus, Hyperreflexie, Koordinationsstörungen), Krampfanfälle und/oder gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Durchfall).
Die gleichzeitige Anwendung von PAXIL mit MAO-Hemmern ist kontraindiziert. Darüber hinaus darf PAXIL 30 mg nicht bei einem Patienten eingeleitet werden, der mit MAO-Hemmern wie Linezolid oder intravenösem Methylenblau behandelt wird. Es gab keine Berichte über die Verabreichung von Methylenblau auf anderem Wege (wie z. B. Tabletten zum Einnehmen oder lokale Gewebeinjektion) oder in niedrigeren Dosen. Wenn es notwendig ist, bei einem Patienten, der PAXIL 10 mg einnimmt, eine Behandlung mit einem MAO-Hemmer wie Linezolid oder intravenösem Methylenblau einzuleiten, setzen Sie PAXIL 40 mg ab, bevor Sie eine Behandlung mit dem MAO-Hemmer beginnen [siehe KONTRAINDIKATIONEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Überwachen Sie alle Patienten, die PAXIL 20 mg einnehmen, auf das Auftreten eines Serotonin-Syndroms. Brechen Sie die Behandlung mit PAXIL 20 mg und allen begleitenden serotonergen Arzneimitteln sofort ab, wenn die oben genannten Symptome auftreten, und leiten Sie eine unterstützende symptomatische Behandlung ein. Wenn die gleichzeitige Anwendung von PAXIL mit anderen serotonergen Arzneimitteln klinisch gerechtfertigt ist, informieren Sie die Patienten über das erhöhte Risiko für ein Serotoninsyndrom und überwachen Sie die Symptome.
Arzneimittelwechselwirkungen, die zu einer QT-Verlängerung führen
Die CYP2D6-hemmenden Eigenschaften von Paroxetin können die Plasmaspiegel von Thioridazin und Pimozid erhöhen. Da die alleinige Gabe von Thioridazin und Pimozid zu einer Verlängerung des QTc-Intervalls führen und das Risiko schwerer ventrikulärer Arrhythmien erhöhen, ist die Anwendung von PAXIL 40 mg in Kombination mit Thioridazin und Pimozid kontraindiziert [siehe KONTRAINDIKATIONEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , KLINISCHE PHARMAKOLOGIE ].
Embryofetale und neonatale Toxizität
PAXIL kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Epidemiologische Studien haben gezeigt, dass Säuglinge, die im ersten Trimenon der Schwangerschaft Paroxetin ausgesetzt waren, ein erhöhtes Risiko für kardiovaskuläre Missbildungen haben. Die Exposition gegenüber Paroxetin in der späten Schwangerschaft kann zu einem erhöhten Risiko für eine persistierende pulmonale Hypertonie des Neugeborenen (PPNH) und/oder neonatale Komplikationen führen, die einen längeren Krankenhausaufenthalt, Atemunterstützung und Sondenernährung erfordern.
Wenn PAXIL 20 mg während der Schwangerschaft angewendet wird oder wenn die Patientin während der Einnahme von PAXIL 30 mg schwanger wird, sollte die Patientin über die potenzielle Gefahr für den Fötus informiert werden [siehe Abschnitt 4.4]. Verwendung in bestimmten Bevölkerungsgruppen ].
Erhöhtes Blutungsrisiko
Arzneimittel, die die Hemmung der Serotonin-Wiederaufnahme beeinträchtigen, einschließlich PAXIL 40 mg, erhöhen das Risiko von Blutungsereignissen. Die gleichzeitige Anwendung von Aspirin, nichtsteroidalen Antirheumatika (NSAIDS), anderen Thrombozytenaggregationshemmern, Warfarin und anderen Antikoagulanzien kann dieses Risiko erhöhen. Fallberichte und epidemiologische Studien (Fall-Kontroll- und Kohortendesign) haben einen Zusammenhang zwischen der Einnahme von Arzneimitteln, die die Serotonin-Wiederaufnahme beeinträchtigen, und dem Auftreten von gastrointestinalen Blutungen gezeigt. Blutungsereignisse im Zusammenhang mit Arzneimitteln, die die Wiederaufnahme von Serotonin beeinträchtigen, reichen von Ekchymosen, Hämatomen, Epistaxis und Petechien bis hin zu lebensbedrohlichen Blutungen.
Informieren Sie die Patienten über das erhöhte Blutungsrisiko im Zusammenhang mit der gleichzeitigen Anwendung von PAXIL 20 mg und Thrombozytenaggregationshemmern oder Antikoagulanzien. Überwachen Sie bei Patienten, die Warfarin einnehmen, sorgfältig das international normalisierte Verhältnis.
Aktivierung von Manie oder Hypomanie
Bei Patienten mit bipolarer Störung kann die Behandlung einer depressiven Episode mit PAXIL 30 mg oder einem anderen Antidepressivum eine gemischte/manische Episode auslösen. Während kontrollierter klinischer Studien mit PAXIL trat Hypomanie oder Manie bei etwa 1 % der mit PAXIL behandelten unipolaren Patienten auf, verglichen mit 1,1 % der mit aktiver Kontrolle behandelten und 0,3 % der mit Placebo behandelten unipolaren Patienten. Vor Beginn der Behandlung mit PAXIL 20 mg sollten Patienten auf persönliche oder familiäre Vorgeschichte von bipolaren Störungen, Manie oder Hypomanie untersucht werden.
Abbruchsyndrom
Zu den Nebenwirkungen nach Absetzen von serotonergen Antidepressiva, insbesondere nach abruptem Absetzen, gehören: Übelkeit, Schwitzen, dysphorische Stimmung, Reizbarkeit, Unruhe, Schwindel, Sensibilitätsstörungen (z. Lethargie, emotionale Labilität, Schlaflosigkeit, Hypomanie, Tinnitus und Krampfanfälle. Wann immer möglich, wird eine allmähliche Reduzierung der Dosierung anstelle eines abrupten Absetzens empfohlen [siehe DOSIERUNG UND ANWENDUNG ].
Während klinischer Studien zu GAD und PTSD wurde die Tagesdosis schrittweise um 10 mg/Tag in wöchentlichen Abständen, gefolgt von 1 Woche mit 20 mg/Tag, angewendet, bevor die Behandlung abgebrochen wurde. Die folgenden Nebenwirkungen wurden mit einer Inzidenz von 2 % oder mehr unter PAXIL 20 mg berichtet und waren mindestens doppelt so hoch wie unter Placebo: Abnorme Träume, Parästhesien und Schwindel Bei pädiatrischen Patienten wurden nach Absetzen der Behandlung mit PAXIL Nebenwirkungen berichtet. Die Sicherheit und Wirksamkeit von PAXIL bei pädiatrischen Patienten wurde nicht nachgewiesen [siehe Eingerahmte Warnung , Suizidgedanken und -verhalten bei Jugendlichen und jungen Erwachsenen , Verwendung in bestimmten Bevölkerungsgruppen ].
Krampfanfälle
PAXIL 10 mg Tabletten und Suspension zum Einnehmen wurden bei Patienten mit Anfallsleiden nicht systematisch untersucht. Patienten mit Krampfanfällen in der Anamnese wurden von klinischen Studien ausgeschlossen. Während klinischer Studien traten bei 0,1 % der mit PAXIL behandelten Patienten Krampfanfälle auf. PAXIL sollte bei Patienten mit Anfallsleiden mit Vorsicht verschrieben werden. Setzen Sie PAXIL 30 mg bei jedem Patienten ab, der Krampfanfälle entwickelt.
Engwinkelglaukom
Die Pupillenerweiterung, die nach der Anwendung vieler Antidepressiva, einschließlich PAXIL, auftritt, kann bei einem Patienten mit anatomisch engen Winkeln, der keine offene Iridektomie hat, eine Engwinkelattacke auslösen. Fälle von Engwinkelglaukom im Zusammenhang mit der Anwendung von PAXIL 40 mg wurden berichtet. Vermeiden Sie die Anwendung von Antidepressiva, einschließlich PAXIL, bei Patienten mit unbehandelten anatomisch engen Winkeln.
Hyponatriämie
Hyponatriämie kann als Folge einer Behandlung mit SSRIs, einschließlich PAXIL, auftreten. Es wurden Fälle mit Serumnatriumwerten unter 110 mmol/l berichtet. Anzeichen und Symptome einer Hyponatriämie sind Kopfschmerzen, Konzentrationsschwierigkeiten, Gedächtnisstörungen, Verwirrtheit, Schwäche und Unsicherheit, die zu Stürzen führen können. Anzeichen und Symptome im Zusammenhang mit schwereren und/oder akuten Fällen waren Halluzinationen, Synkopen, Krampfanfälle, Koma, Atemstillstand und Tod. In vielen Fällen scheint diese Hyponatriämie das Ergebnis des Syndroms der inadäquaten Sekretion des antidiuretischen Hormons (SIADH) zu sein.
Bei Patienten mit symptomatischer Hyponatriämie PAXIL absetzen und geeignete medizinische Intervention einleiten. Ältere Patienten, Patienten, die Diuretika einnehmen, und Patienten mit Volumenmangel können unter SSRIs einem höheren Risiko ausgesetzt sein, eine Hyponatriämie zu entwickeln [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Verringerung der Wirksamkeit von Tamoxifen
Einige Studien haben gezeigt, dass die Wirksamkeit von Tamoxifen, gemessen am Risiko eines Rückfalls/einer Mortalität bei Brustkrebs, bei gleichzeitiger Anwendung von PAXIL aufgrund der irreversiblen Hemmung von CYP2D6 durch Paroxetin und niedrigerer Blutspiegel von Tamoxifen verringert sein kann [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Eine Studie weist darauf hin, dass das Risiko bei längerer gleichzeitiger Verabreichung zunehmen kann. Andere Studien konnten ein solches Risiko jedoch nicht nachweisen. Wenn Tamoxifen zur Behandlung oder Vorbeugung von Brustkrebs angewendet wird, sollten verschreibende Ärzte die Verwendung eines alternativen Antidepressivums mit geringer oder keiner CYP2D6-Hemmung in Erwägung ziehen.
Knochenbruch
Epidemiologische Studien zum Risiko von Knochenbrüchen während der Einnahme einiger Antidepressiva, einschließlich SSRIs, haben einen Zusammenhang zwischen der Behandlung mit Antidepressiva und Knochenbrüchen berichtet. Es gibt mehrere mögliche Ursachen für diese Beobachtung und es ist nicht bekannt, inwieweit das Frakturrisiko direkt auf die SSRI-Behandlung zurückzuführen ist.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente ).
Selbstmordgedanken und Verhaltensweisen
Weisen Sie Patienten und Pflegepersonal an, auf das Auftreten von Suizidalität zu achten, insbesondere zu Beginn der Behandlung und wenn die Dosierung nach oben oder unten angepasst wird, und weisen Sie sie an, solche Symptome dem medizinischen Fachpersonal zu melden [siehe Eingerahmte Warnung und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Serotonin-Syndrom
Warnen Sie Patienten vor dem Risiko eines Serotonin-Syndroms, insbesondere bei gleichzeitiger Anwendung von PAXIL mit anderen serotonergen Arzneimitteln, einschließlich Triptanen, trizyklischen Antidepressiva, Fentanyl, Lithium, Tramadol, Tryptophan, Buspiron, Amphetaminen, Johanniskraut und mit Arzneimitteln, die den Stoffwechsel beeinträchtigen Serotonin (insbesondere MAO-Hemmer, sowohl solche, die zur Behandlung psychiatrischer Störungen bestimmt sind, als auch andere, wie Linezolid). Weisen Sie die Patienten an, sich an ihren Arzt zu wenden oder sich in der Notaufnahme zu melden, wenn sie Anzeichen oder Symptome eines Serotonin-Syndroms bemerken [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Begleitmedikation
Weisen Sie die Patienten darauf hin, ihren Arzt zu informieren, wenn sie verschreibungspflichtige oder rezeptfreie Arzneimittel einnehmen oder deren Einnahme planen, da die Möglichkeit von Wechselwirkungen zwischen Arzneimitteln besteht [siehe WARNUNG UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Erhöhtes Blutungsrisiko
Informieren Sie die Patienten über die gleichzeitige Anwendung von PAXIL mit Aspirin, NSAIDs, anderen Thrombozytenaggregationshemmern, Warfarin oder anderen Antikoagulanzien, da die kombinierte Anwendung mit einem erhöhten Blutungsrisiko in Verbindung gebracht wurde. Raten Sie den Patienten, ihren Arzt zu informieren, wenn sie verschreibungspflichtige oder rezeptfreie Medikamente einnehmen oder die Einnahme planen, die das Blutungsrisiko erhöhen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Aktivierung von Manie/Hypomanie
Weisen Sie die Patienten und ihre Betreuer an, auf Anzeichen einer Aktivierung von Manie/Hypomanie zu achten, und weisen Sie sie an, solche Symptome dem medizinischen Fachpersonal zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Abbruchsyndrom
Weisen Sie die Patienten darauf hin, PAXIL 40 mg nicht abrupt abzusetzen und eine Ausschleichung mit ihrem Arzt zu besprechen. Informieren Sie die Patienten darüber, dass Nebenwirkungen auftreten können, wenn PAXIL abgesetzt wird [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Verabreichungsinformationen für die orale Suspension
Weisen Sie die Patienten an, die Suspension zum Einnehmen vor der Verabreichung gut zu schütteln [siehe DOSIERUNG UND ANWENDUNG ].
Allergische Reaktionen
Raten Sie den Patienten, ihren Arzt zu benachrichtigen, wenn sie eine allergische Reaktion wie Hautausschlag, Nesselsucht, Schwellungen oder Atembeschwerden entwickeln [siehe NEBENWIRKUNGEN ].
Embryo-fötale Toxizität
Informieren Sie Frauen über das potenzielle Risiko für den Fötus [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , Verwendung in bestimmten Bevölkerungsgruppen ]. Raten Sie Patientinnen, wegen des Risikos für den Fötus, ihren Arzt zu benachrichtigen, wenn sie während der Therapie schwanger werden oder eine Schwangerschaft beabsichtigen.
Pflege
Raten Sie Frauen, ihren Arzt zu informieren, wenn sie ein Kind stillen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Karzinogenitätsstudien über zwei Jahre wurden an Nagetieren durchgeführt, denen Paroxetin im Futter mit 1, 5 und 25 mg/kg/Tag (Mäuse) und 1, 5 und 20 mg/kg/Tag (Ratten) verabreicht wurde. Diese Dosen sind bis zum 2,0- (Maus) und 3,2-fachen (Ratte) der MRHD von 75 mg auf mg/m2-Basis. Es gab eine signifikant größere Anzahl männlicher Ratten in der Hochdosisgruppe mit Retikulumzellsarkomen (1/100, 0/50, 0/50 und 4/50 für die Kontroll-, Niedrig-, Mittel- und Hochdosisgruppe ) und ein signifikant erhöhter linearer Trend über die Dosisgruppen hinweg für das Auftreten von lymphoretikulären Tumoren bei männlichen Ratten. Weibliche Ratten waren nicht betroffen. Obwohl es bei Mäusen zu einem dosisabhängigen Anstieg der Tumorzahl kam, gab es keinen arzneimittelbedingten Anstieg der Tumorzahl bei Mäusen. Die Relevanz dieser Befunde für den Menschen ist nicht bekannt.

Mutagenese
Paroxetin zeigte keine genotoxischen Wirkungen in einer Reihe von 5 In-vitro- und 2 In-vivo-Tests, die Folgendes umfassten: Bakterienmutationstest, Maus-Lymphom-Mutationstest, außerplanmäßiger DNA-Synthesetest und Tests auf zytogenetische Aberrationen in vivo im Knochenmark von Mäusen und in vitro in menschlichen Lymphozyten und in einem Dominant-Letal-Test bei Ratten.
Beeinträchtigung der Fruchtbarkeit
Einige klinische Studien haben gezeigt, dass SSRIs (einschließlich Paroxetin) während der SSRI-Behandlung die Spermienqualität beeinträchtigen können, was bei manchen Männern die Fruchtbarkeit beeinträchtigen kann.
Eine verringerte Trächtigkeitsrate wurde in Reproduktionsstudien an Ratten bei einer Paroxetin-Dosis von 15 mg/kg/Tag festgestellt, was dem 2,4-fachen der MRHD von 75 mg auf mg/m2-Basis entspricht. Irreversible Läsionen traten im Fortpflanzungstrakt männlicher Ratten nach Verabreichung in Toxizitätsstudien über 2 bis 52 Wochen auf. Diese Läsionen bestanden aus einer Vakuolisierung des epididymalen tubulären Epithels bei 50 mg/kg/Tag und atrophischen Veränderungen in den Samenkanälchen der Hoden mit angehaltener Spermatogenese bei 25 mg/kg/Tag (8,2- und 4,1-fache MRHD von 75 mg bei einer mg/kg). m2 Basis).
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie D [Siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Epidemiologische Studien haben gezeigt, dass Säuglinge, die Paroxetin im ersten Trimenon der Schwangerschaft ausgesetzt waren, ein erhöhtes Risiko für angeborene Fehlbildungen, insbesondere kardiovaskuläre Fehlbildungen, haben. Wenn Paroxetin während der Schwangerschaft angewendet wird oder wenn die Patientin während der Einnahme von Paroxetin schwanger wird, weisen Sie die Patientin auf die potenzielle Gefahr für den Fötus hin.
Klinische Überlegungen
Sofern der Nutzen von Paroxetin für die Mutter eine Fortsetzung der Behandlung nicht rechtfertigt, sollte in Betracht gezogen werden, entweder die Behandlung mit Paroxetin abzubrechen oder auf ein anderes Antidepressivum umzusteigen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Zum
Andere Studien kamen zu unterschiedlichen Ergebnissen, ob ein erhöhtes Risiko für allgemeine, kardiovaskuläre oder spezifische angeborene Fehlbildungen bestand. Eine Meta-Analyse epidemiologischer Daten über einen Zeitraum von 16 Jahren (1992 bis 2008) zur Anwendung von Paroxetin im ersten Trimenon in der Schwangerschaft und zu angeborenen Fehlbildungen schloss die oben genannten Studien zusätzlich zu anderen ein (n = 17 Studien, die allgemeine Fehlbildungen und n = 14 Studien, die kardiovaskuläre Fehlbildungen einschlossen; n = 20 verschiedene Studien). Diese Meta-Analyse unterliegt Einschränkungen, weist aber auf ein erhöhtes Auftreten von kardiovaskulären Fehlbildungen (Prävalenz-Odds-Ratio [POR] 1,5; 95 % Konfidenzintervall 1,2 bis 1,9) und Gesamtfehlbildungen (POR 1,2; 95 % Konfidenzintervall 1,1 bis 1,4) mit Paroxetin hin Anwendung während des ersten Trimesters. Inwieweit die beobachtete Prävalenz kardiovaskulärer Fehlbildungen möglicherweise zu der Gesamtfehlbildung beigetragen haben könnte, konnte in dieser Metaanalyse nicht bestimmt werden, und es war auch nicht möglich festzustellen, ob bestimmte Arten von kardiovaskulären Fehlbildungen möglicherweise zur beobachteten Prävalenz beigetragen haben aller kardiovaskulären Fehlbildungen.
Sofern der Nutzen von Paroxetin für die Mutter eine Fortsetzung der Behandlung nicht rechtfertigt, sollte in Betracht gezogen werden, entweder die Behandlung mit Paroxetin abzubrechen oder auf ein anderes Antidepressivum umzusteigen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Bei Frauen, die eine Schwangerschaft planen oder sich im ersten Trimenon der Schwangerschaft befinden, sollte mit Paroxetin nur nach Abwägung der anderen verfügbaren Behandlungsoptionen begonnen werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Behandlung von schwangeren Frauen während ihres dritten Trimesters
Neugeborene, die gegen Ende des dritten Trimesters SSRIs oder Serotonin- und Noradrenalin-Wiederaufnahmehemmern (SNRIs), einschließlich PAXIL 40 mg, ausgesetzt waren, entwickelten Komplikationen, die einen längeren Krankenhausaufenthalt, Atemunterstützung und Sondenernährung erforderten. Solche Komplikationen können unmittelbar nach der Geburt auftreten. Zu den berichteten klinischen Befunden gehörten Atemnot, Zyanose, Apnoe, Krampfanfälle, Temperaturinstabilität, Schwierigkeiten beim Füttern, Erbrechen, Hypoglykämie, Hypotonie, Hypertonie, Hyperreflexie, Zittern, Nervosität, Reizbarkeit und ständiges Weinen. Diese Merkmale stimmen entweder mit einer direkten toxischen Wirkung von SSRIs und SNRIs oder möglicherweise mit einem Arzneimittelabsetzsyndrom überein. Es sollte beachtet werden, dass das klinische Bild in einigen Fällen mit dem Serotonin-Syndrom übereinstimmt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die Exposition gegenüber SSRIs in der späten Schwangerschaft kann ein erhöhtes Risiko für eine persistierende pulmonale Hypertonie des Neugeborenen (PPHN) haben. PPHN tritt bei 1 – 2 von 1.000 Lebendgeburten in der Allgemeinbevölkerung auf und ist mit einer erheblichen neonatalen Morbidität und Mortalität verbunden. In einer retrospektiven Fall-Kontroll-Studie mit 377 Frauen, deren Säuglinge mit PPHN geboren wurden, und 836 Frauen, deren Säuglinge gesund geboren wurden, war das Risiko für die Entwicklung einer PPHN bei Säuglingen, die nach der 20. Schwangerschaftswoche SSRI ausgesetzt waren, etwa sechsmal höher als bei Säuglingen die während der Schwangerschaft keinen Antidepressiva ausgesetzt waren.
Es gab auch Postmarketing-Berichte über Frühgeburten bei schwangeren Frauen, die Paroxetin oder anderen SSRIs ausgesetzt waren.
Bei der Behandlung einer schwangeren Frau mit Paroxetin während des dritten Trimesters sollte der Arzt sowohl die potenziellen Risiken als auch den Nutzen der Behandlung sorgfältig abwägen. Eine prospektive Längsschnittstudie mit 201 Frauen mit einer Vorgeschichte von schweren Depressionen, die zu Beginn der Schwangerschaft euthymisch waren. Die Frauen, die die Antidepressiva während der Schwangerschaft absetzten, erlitten mit größerer Wahrscheinlichkeit einen Rückfall einer schweren Depression als Frauen, die die Antidepressiva weiter einnahmen.
Tierische Funde
Reproduktionsstudien wurden mit Dosen von bis zu 50 mg/kg/Tag bei Ratten und 6 mg/kg/Tag bei Kaninchen durchgeführt, die während der Organogenese verabreicht wurden. Diese Dosen betragen ungefähr das 6-fache (Ratte) und weniger als das 2-fache (Kaninchen) der maximal empfohlenen Dosis beim Menschen (MRHD – 75 mg) auf mg/m2-Basis. Diese Studien haben keine Hinweise auf Auswirkungen auf die Entwicklung ergeben. Bei Ratten kam es jedoch während der ersten 4 Tage der Laktation zu einem Anstieg der Todesfälle bei den Jungtieren, wenn die Verabreichung während des letzten Trimenons der Trächtigkeit erfolgte und während der gesamten Laktation fortgesetzt wurde. Dieser Effekt trat bei einer Dosis von 1 mg/kg/Tag auf, was über der MRHD auf mg/m2-Basis liegt. Die No-Effect-Dosis für die Sterblichkeit von Rattenjungen wurde nicht bestimmt. Die Ursache dieser Todesfälle ist nicht bekannt.
Stillende Mutter
Wie viele andere Arzneimittel wird Paroxetin in die Muttermilch ausgeschieden. Aufgrund der Möglichkeit schwerwiegender Nebenwirkungen von PAXIL 20 mg bei gestillten Säuglingen sollte eine Entscheidung getroffen werden, ob gestillte Säuglinge oder das Arzneimittel abgesetzt werden sollen, wobei die Bedeutung des Arzneimittels für die Mutter zu berücksichtigen ist.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von PAXIL bei pädiatrischen Patienten wurde nicht nachgewiesen [siehe KASTENWARNUNG ]. Die Wirksamkeit wurde in drei placebokontrollierten Studien mit 752 mit PAXIL behandelten pädiatrischen Patienten mit MDD nicht nachgewiesen.
Antidepressiva erhöhen das Risiko von Suizidgedanken und -verhalten bei pädiatrischen Patienten [siehe Eingerahmte Warnung , WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Verminderter Appetit und Gewichtsverlust wurden im Zusammenhang mit der Anwendung von SSRIs beobachtet.
In placebokontrollierten klinischen Studien, die mit pädiatrischen Patienten durchgeführt wurden, wurden die folgenden Nebenwirkungen bei mindestens 2 % der mit PAXIL behandelten pädiatrischen Patienten berichtet und traten mindestens doppelt so häufig auf wie bei pädiatrischen Patienten, die Placebo erhielten: Emotionale Labilität (einschließlich Selbstverletzung , Selbstmordgedanken, Selbstmordversuch, Weinen und Stimmungsschwankungen), Feindseligkeit, verminderter Appetit, Zittern, Schwitzen, Hyperkinesie und Unruhe.
Nebenwirkungen nach Absetzen der Behandlung mit PAXIL in den pädiatrischen klinischen Studien, die ein Ausschleichen-Phasen-Schema beinhalteten, die bei mindestens 2 % der Patienten auftraten und mindestens doppelt so häufig waren wie unter Placebo, waren: Emotionale Labilität (einschließlich Suizidgedanken, Suizid Versuch, Stimmungsschwankungen und Weinerlichkeit), Nervosität, Schwindel, Übelkeit und Bauchschmerzen.
Geriatrische Verwendung
In klinischen Premarketing-Studien mit PAXIL 10 mg waren 17 % der mit PAXIL behandelten Patienten (ca. 700) 65 Jahre oder älter. Pharmakokinetische Studien zeigten eine verringerte Clearance bei älteren Patienten, und es wird eine niedrigere Anfangsdosis empfohlen; es wurden jedoch insgesamt keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen älteren und jüngeren Patienten beobachtet [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ].
SSRIs, einschließlich PAXIL, wurden mit Fällen von klinisch signifikanter Hyponatriämie bei älteren Patienten in Verbindung gebracht, die möglicherweise einem höheren Risiko für diese Nebenwirkung ausgesetzt sind [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nieren- und Leberfunktionsstörung
Erhöhte Plasmakonzentrationen von Paroxetin treten bei Patienten mit eingeschränkter Nieren- und Leberfunktion auf. Die Anfangsdosis von PAXIL sollte bei Patienten mit schwerer Nierenfunktionsstörung und bei Patienten mit schwerer Leberfunktionsstörung reduziert werden [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Menschliche Erfahrung
Seit der Einführung von PAXIL 30 mg in den Vereinigten Staaten wurden weltweit spontane Fälle von absichtlicher oder versehentlicher Überdosierung während der Behandlung mit Paroxetin gemeldet. Dazu gehören Überdosierungen mit Paroxetin allein und in Kombination mit anderen Substanzen. Es gibt Berichte über Todesfälle, bei denen Paroxetin allein beteiligt zu sein scheint.
Häufig berichtete Nebenwirkungen im Zusammenhang mit einer Paroxetin-Überdosierung sind Schläfrigkeit, Koma, Übelkeit, Tremor, Tachykardie, Verwirrtheit, Erbrechen und Schwindel. Andere bemerkenswerte Anzeichen und Symptome, die bei einer Überdosierung von Paroxetin (allein oder mit anderen Substanzen) beobachtet wurden, sind Mydriasis, Krämpfe (einschließlich Status epilepticus), ventrikuläre Rhythmusstörungen (einschließlich Torsade de Pointes), Bluthochdruck, aggressive Reaktionen, Synkope, Hypotonie, Stupor, Bradykardie, Dystonie , Rhabdomyolyse, Symptome einer Leberfunktionsstörung (einschließlich Leberversagen, Lebernekrose, Gelbsucht, Hepatitis und hepatische Steatose), Serotonin-Syndrom, manische Reaktionen, Myoklonus, akutes Nierenversagen und Harnverhalt.
Überdosierungsmanagement
Es sind keine spezifischen Gegenmittel für PAXIL bekannt. Wenn eine Überdosierung auftritt, rufen Sie Ihre Giftnotrufzentrale unter 1-800-222-1222 an, um die neuesten Empfehlungen zu erhalten.
KONTRAINDIKATIONEN
PAXIL ist kontraindiziert bei Patienten:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Der Wirkungsmechanismus von PAXIL bei der Behandlung von MDD, SAD, OCD\, PD, GAD und PTSD ist unbekannt, es wird jedoch vermutet, dass er mit einer Potenzierung der serotonergen Aktivität im Zentralnervensystem verbunden ist, die aus der Hemmung der neuronalen Wiederaufnahme von Serotonin resultiert (5-Hydroxytryptamin, 5-HT).
Pharmakodynamik
Studien mit klinisch relevanten Dosen am Menschen haben gezeigt, dass Paroxetin die Aufnahme von Serotonin in menschliche Blutplättchen blockiert. In-vitro-Studien an Tieren deuten auch darauf hin, dass Paroxetin ein potenter und hochselektiver Hemmer der neuronalen Serotonin-Wiederaufnahme (SSRI) ist und nur sehr schwache Wirkungen auf die neuronale Wiederaufnahme von Norepinephrin und Dopamin hat.
Pharmakokinetik
Bei steigenden Dosen von PAXIL wird eine Nichtlinearität der Pharmakokinetik beobachtet.
In einer Metaanalyse von Paroxetin aus 4 Studien, die an gesunden Freiwilligen nach Mehrfachdosierung von 20 mg/Tag bis 40 mg/Tag durchgeführt wurden, zeigten Männer keine signifikant niedrigere Cmax oder AUC als Frauen.
Absorption
Paroxetinhydrochlorid wird nach oraler Gabe einer Lösung des Hydrochloridsalzes vollständig resorbiert. In einer Studie, in der normale männliche Probanden (n = 15) 30 Tage lang täglich 30-mg-Tabletten erhielten, wurden Steady-State-Konzentrationen von Paroxetin bei den meisten Probanden nach etwa 10 Tagen erreicht, obwohl es bei einigen Patienten wesentlich länger dauern kann. Im Steady State betrugen die Mittelwerte von Cmax, Tmax, Cmin und T½ 61,7 ng/ml (VK 45 %), 5,2 h. (VK 10 %), 30,7 ng/ml (VK 67 %) bzw. 21,0 Stunden (VK 32 %). Die Steady-State-Cmax- und Cmin-Werte waren etwa 6- bis 14-mal so hoch wie aus Einzeldosisstudien vorhergesagt. Die Steady-State-Arzneimittelexposition, basierend auf AUC0-24, war etwa 8-mal höher als aufgrund der Einzeldosisdaten bei diesen Probanden vorhergesagt worden wäre. Die übermäßige Akkumulation ist eine Folge der Tatsache, dass eines der Enzyme, die Paroxetin metabolisieren, leicht sättigbar ist.
Paroxetin ist in der Suspension zum Einnehmen und in der Tablette gleichermaßen bioverfügbar.
Wirkung von Lebensmitteln
Die Auswirkungen von Nahrung auf die Bioverfügbarkeit von Paroxetin wurden bei Probanden untersucht, denen eine Einzeldosis mit und ohne Nahrung verabreicht wurde. Die AUC war nur geringfügig erhöht (6 %), wenn das Arzneimittel zusammen mit Nahrung verabreicht wurde, aber die Cmax war um 29 % höher, während die Zeit bis zum Erreichen der maximalen Plasmakonzentration von 6,4 Stunden nach der Einnahme auf 4,9 Stunden abnahm.
Verteilung
Paroxetin verteilt sich im ganzen Körper, einschließlich des ZNS, wobei nur 1 % im Plasma verbleibt.
Etwa 95 % bzw. 93 % von Paroxetin werden bei 100 ng/ml bzw. 400 ng/ml an Plasmaproteine gebunden. Unter klinischen Bedingungen liegen die Paroxetin-Konzentrationen normalerweise unter 400 ng/ml. Paroxetin verändert die Proteinbindung von Phenytoin oder Warfarin in vitro nicht.
Beseitigung
Stoffwechsel
Die mittlere Eliminationshalbwertszeit beträgt etwa 21 Stunden (CV 32 %) nach oraler Gabe von 30 mg Tabletten täglich über 30 Tage von PAXIL.
In Steady-State-Dosisproportionalitätsstudien mit älteren und jüngeren Patienten bei Dosierungen von 20 mg bis 40 mg täglich für ältere und 20 mg bis 50 mg täglich für ältere Patienten wurde in beiden Populationen eine gewisse Nichtlinearität beobachtet, was wiederum einen sättigbaren Stoffwechselweg widerspiegelt . Im Vergleich zu den Cmin-Werten nach 20 mg täglich waren die Werte nach 40 mg täglich nur etwa 2- bis 3-mal höher als verdoppelt.
Paroxetin wird nach oraler Gabe weitgehend metabolisiert. Die Hauptmetaboliten sind polare und konjugierte Oxidations- und Methylierungsprodukte, die leicht ausgeschieden werden. Konjugate mit Glucuronsäure und Sulfat überwiegen, und Hauptmetaboliten wurden isoliert und identifiziert. Die Daten weisen darauf hin, dass die Metaboliten nicht mehr als 1/50 der Potenz der Ausgangsverbindung bei der Hemmung der Serotoninaufnahme haben. Die Metabolisierung von Paroxetin wird teilweise durch CYP2D6 bewerkstelligt. Die Sättigung dieses Enzyms bei klinischen Dosen scheint die Nichtlinearität der Kinetik von Paroxetin mit zunehmender Dosis und zunehmender Behandlungsdauer zu erklären. Die Rolle dieses Enzyms im Paroxetin-Metabolismus deutet auch auf mögliche Wechselwirkungen zwischen Arzneimitteln hin [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Das pharmakokinetische Verhalten von Paroxetin wurde bei Patienten mit CYP2D6-Mangel (langsame Metabolisierer) nicht untersucht.
Ausscheidung
Ungefähr 64 % einer 30-mg-Dosis Paroxetin zum Einnehmen wurden über einen Zeitraum von 10 Tagen nach der Einnahme im Urin ausgeschieden, davon 2 % als Muttersubstanz und 62 % als Metaboliten. Etwa 36 % wurden in den Fäzes (wahrscheinlich über die Galle) ausgeschieden, hauptsächlich als Metaboliten und weniger als 1 % als Ausgangssubstanz über den 10-tägigen Zeitraum nach der Verabreichung.
Arzneimittelwechselwirkungsstudien
Es gibt klinisch signifikante, bekannte Arzneimittelwechselwirkungen zwischen Paroxetin und anderen Arzneimitteln [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Abbildung 1. Einfluss von Paroxetin auf die Pharmakokinetik gleichzeitig verabreichter Arzneimittel (logarithmischer Maßstab)
Abbildung 2. Einfluss gleichzeitig verabreichter Arzneimittel auf die Pharmakokinetik von Paroxetin
Theophyllin
Berichte über erhöhte Theophyllinspiegel im Zusammenhang mit der Behandlung mit PAXIL wurden berichtet. Obwohl diese Wechselwirkung nicht formell untersucht wurde, wird empfohlen, die Theophyllinspiegel zu überwachen, wenn diese Arzneimittel gleichzeitig verabreicht werden.
Medikamente, die durch Cytochrom CYP3A4 metabolisiert werden
Eine In-vivo-Interaktionsstudie, die die gleichzeitige Verabreichung von Paroxetin und Terfenadin, einem Substrat für CYP3A4, unter Steady-State-Bedingungen umfasste, zeigte keine Wirkung von Paroxetin auf die Pharmakokinetik von Terfenadin. Darüber hinaus haben In-vitro-Studien gezeigt, dass Ketoconazol, ein starker Inhibitor der CYP3A4-Aktivität, als Inhibitor des Metabolismus mehrerer Substrate für dieses Enzym, einschließlich Terfenadin, Astemizol, Cisaprid, Triazolam, mindestens 100-mal wirksamer als Paroxetin ist Cyclosporin. Es wird nicht erwartet, dass das Ausmaß der Hemmung der CYP3A4-Aktivität durch Paroxetin von klinischer Bedeutung ist.
Spezifische Populationen
Die Auswirkungen bestimmter Populationen auf die Pharmakokinetik von Paroxetin sind in Abbildung 3 dargestellt.
Die empfohlene Anfangsdosis und Höchstdosis von PAXIL ist bei älteren Patienten, Patienten mit schwerer Nierenfunktionsstörung und Patienten mit schwerer Leberfunktionsstörung reduziert [siehe DOSIERUNG UND ANWENDUNG ].
Abbildung 3. Einfluss einer bestimmten Population auf die Pharmakokinetik von Paroxetin (logarithmischer Maßstab)
Klinische Studien
Depression
Die Wirksamkeit von PAXIL zur Behandlung von Major Depression (MDD) wurde in 6 placebokontrollierten Studien an Patienten mit MDD (im Alter von 18 bis 73 Jahren) nachgewiesen. In diesen Studien wurde gezeigt, dass PAXIL bei der Behandlung von MDD statistisch signifikant wirksamer ist als Placebo bei mindestens 2 der folgenden Maßnahmen: Hamilton Depression Rating Scale (HDRS), das Hamilton Depressive Mood Item und der Clinical Global Impression (CGI)- Schweregrad der Erkrankung. PAXIL war statistisch signifikant besser als Placebo bei der Verbesserung der HDRS-Subfaktor-Scores, einschließlich des Items depressive Stimmung, Schlafstörungsfaktor und Angstfaktor.
Die langfristige Wirksamkeit von PAXIL 10 mg zur Behandlung von MDD bei ambulanten Patienten wurde in einer randomisierten Entzugsstudie nachgewiesen. Patienten, die während einer anfänglichen 8-wöchigen offenen Behandlungsphase auf PAXIL ansprachen (HDRS-Gesamtscore
Zwangsstörung
Die Wirksamkeit von PAXIL bei der Behandlung von Zwangsstörungen (OCD) wurde in zwei 12-wöchigen multizentrischen placebokontrollierten Studien mit erwachsenen ambulanten Patienten nachgewiesen (Studien 1 und 2). Die Patienten hatten eine mittelschwere bis schwere Zwangsstörung (DSM-IIIR) mit mittleren Ausgangsbewertungen auf der Yale Brown Obsessive Compulsive Scale (YBOCS)-Gesamtpunktzahl von 23 bis 26. In Studie 1, einer Dosisbereichsfindungsstudie, erhielten die Patienten feste Tagesdosen von PAXIL 20 mg, 40 mg oder 60 mg. Studie 1 zeigte, dass Tagesdosen von PAXIL 40 mg und 60 mg bei der Behandlung von Zwangsstörungen wirksam sind. Patienten, die PAXIL-Dosen von 40 mg und 60 mg erhielten, erlebten eine durchschnittliche Verringerung des YBOCS-Gesamtscores um etwa 6 bzw. 7 Punkte, was statistisch signifikant größer war als die Verringerung um etwa 4 Punkte bei 20 mg und eine Verringerung um 3 Punkte die mit Placebo behandelten Patienten. Studie 2 war eine Studie mit flexibler Dosierung, in der PAXIL 20 mg bis 60 mg täglich mit Clomipramin 25 mg bis 250 mg täglich oder Placebo verglichen wurde). In dieser Studie erfuhren Patienten, die PAXIL erhielten, eine durchschnittliche Verringerung des YBOCS-Gesamtscores um etwa 7 Punkte, was statistisch signifikant größer war als die durchschnittliche Verringerung von etwa 4 Punkten bei mit Placebo behandelten Patienten.
Die folgende Tabelle enthält die Ergebnisklassifikation nach Behandlungsgruppe in Bezug auf die Items zur globalen Verbesserung der Clinical Global Impression (CGI)-Skala für Studie 1.
Subgruppenanalysen zeigten keine Unterschiede in den Behandlungsergebnissen in Abhängigkeit von Alter oder Geschlecht.
Die Langzeitwirksamkeit von PAXIL zur Behandlung von Zwangsstörungen wurde in einer Langzeitverlängerung von Studie 1 nachgewiesen. Patienten, die während der 3-monatigen doppelblinden Phase und einer 6-monatigen Verlängerung der unverblindeten PAXIL 20 auf PAXIL ansprachen mg bis 60 mg täglich wurden in einer 6-monatigen doppelblinden Rückfallpräventionsphase randomisiert entweder PAXIL 10 mg oder Placebo zugeteilt. Bei Patienten, die randomisiert PAXIL zugeteilt wurden, war die Wahrscheinlichkeit eines Rückfalls statistisch signifikant geringer als bei Patienten, die mit Placebo behandelt wurden.
Panikstörung
Die Wirksamkeit von PAXIL 20 mg bei der Behandlung von Panikstörungen (PD) wurde in drei 10- bis 12-wöchigen multizentrischen, placebokontrollierten Studien mit erwachsenen ambulanten Patienten nachgewiesen (Studien 1, 2 und 3). Die Patienten hatten PD (DSM-IIIR) mit oder ohne Agoraphobie. In diesen Studien erwies sich PAXIL bei der Behandlung von PD als statistisch signifikant wirksamer als Placebo bei mindestens 2 von 3 Messwerten der Panikattackenhäufigkeit und dem Clinical Global Impression Severity of Illness-Score.
Studie 1 war eine 10-wöchige Dosisfindungsstudie; Patienten erhielten feste Dosen von PAXIL 10 mg, 20 mg oder 40 mg täglich oder Placebo. Ein statistisch signifikanter Unterschied zu Placebo wurde nur für die Gruppe mit täglich 40 mg PAXIL beobachtet. Am Endpunkt waren 76 % der Patienten, die PAXIL 40 mg täglich erhielten, frei von Panikattacken, verglichen mit 44 % der mit Placebo behandelten Patienten.
Studie 2 war eine 12-wöchige Studie mit flexibler Dosierung, in der PAXIL 10 mg bis 60 mg täglich mit Placebo verglichen wurde. Am Endpunkt waren 51 % der mit PAXIL behandelten Patienten frei von Panikattacken im Vergleich zu 32 % der mit Placebo behandelten Patienten.
Studie 3 war eine 12-wöchige Studie mit flexibler Dosierung, in der PAXIL 10 mg bis 60 mg täglich mit Placebo bei Patienten verglichen wurde, die gleichzeitig eine standardisierte kognitive Verhaltenstherapie erhielten. Am Endpunkt zeigten 33 % der mit PAXIL behandelten Patienten eine Reduktion auf 0 oder 1 Panikattacke im Vergleich zu 14 % der mit Placebo behandelten Patienten.
In den Studien 2 und 3 betrug die mittlere PAXIL-Dosis für die Absolvierenden am Endpunkt ungefähr 40 mg täglich.
Die Langzeitwirksamkeit von PAXIL 10 mg bei Parkinson wurde in einer Verlängerung von Studie 1 nachgewiesen. Patienten, die während der 10-wöchigen doppelblinden Phase und während einer 3-monatigen doppelblinden Verlängerungsphase auf PAXIL 20 mg ansprachen, wurden randomisiert entweder PAXIL 10 mg, 20 mg oder 40 mg täglich oder Placebo in einer 3-monatigen doppelblinden Rückfallpräventionsphase. Bei Patienten, die randomisiert PAXIL 20 mg zugeteilt wurden, war die Wahrscheinlichkeit eines Rückfalls statistisch signifikant geringer als bei Patienten, die mit Placebo behandelt wurden.
Subgruppenanalysen zeigten keine Unterschiede in den Behandlungsergebnissen in Abhängigkeit von Alter oder Geschlecht.
Soziale Angststörung
Die Wirksamkeit von PAXIL bei der Behandlung von sozialer Angststörung (SAD) wurde in drei 12-wöchigen, multizentrischen, placebokontrollierten Studien (Studien 1, 2 und 3) mit erwachsenen ambulanten Patienten mit SAD (DSM-IV) nachgewiesen. In diesen Studien wurde die Wirksamkeit von PAXIL 30 mg im Vergleich zu Placebo auf der Grundlage von (1) dem Anteil der Responder bewertet, definiert durch einen Clinical Global Impression (CGI) Improvement Score von 1 (sehr stark verbessert) oder 2 (stark verbessert ) und (2) Veränderung gegenüber dem Ausgangswert in der Liebowitz Social Anxiety Scale (LSAS).
Die Studien 1 und 2 waren Studien mit flexibler Dosierung, in denen PAXIL 20 mg mit 50 mg täglich und Placebo verglichen wurden. PAXIL zeigte eine statistisch signifikante Überlegenheit gegenüber Placebo sowohl beim CGI Improvement Responder-Kriterium als auch bei der Liebowitz Social Anxiety Scale (LSAS). In Studie 1 waren bei Patienten, die Woche 12 beendeten, 69 % der mit PAXIL behandelten Patienten im Vergleich zu 29 % der mit Placebo behandelten Patienten CGI-Verbesserungs-Responder. In Studie 2 waren 77 % der CGI Improvement Responder bei den mit PAXIL bzw. Placebo behandelten Patienten 42 %.
Studie 3 war eine 12-wöchige Studie, in der feste Dosen von PAXIL 20 mg, 40 mg oder 60 mg täglich mit Placebo verglichen wurden. PAXIL 20 mg war Placebo sowohl beim LSAS-Gesamtscore als auch beim CGI-Verbesserungs-Responder-Kriterium statistisch signifikant überlegen; es gab Tendenzen zur Überlegenheit gegenüber Placebo für die PAXIL-Gruppen mit 40 mg und 60 mg Tagesdosis. In dieser Studie gab es keinen Hinweis auf einen zusätzlichen Nutzen für Dosen von mehr als 20 mg täglich.
Subgruppenanalysen zeigten im Allgemeinen keine Unterschiede in den Behandlungsergebnissen als Funktion von Alter, Rasse oder Geschlecht.
Generalisierte Angststörung
Die Wirksamkeit von PAXIL bei der Behandlung der generalisierten Angststörung (GAD) wurde in zwei 8-wöchigen, multizentrischen, placebokontrollierten Studien (Studien 1 und 2) mit erwachsenen ambulanten Patienten mit GAD (DSM-IV) nachgewiesen.
Studie 1 war eine 8-wöchige Studie, in der feste Dosen von PAXIL 20 mg oder 40 mg täglich mit Placebo verglichen wurden. Dosen von PAXIL 20 mg oder 40 mg erwiesen sich beide als statistisch signifikant überlegen gegenüber Placebo auf der Hamilton Rating Scale for Anxiety (HAM-A) Gesamtpunktzahl.
In dieser Studie gab es keine ausreichende Evidenz für einen größeren Nutzen der Tagesdosis von 40 mg PAXIL im Vergleich zur Tagesdosis von 20 mg.
Studie 2 war eine Studie mit flexibler Dosierung, in der PAXIL 20 mg mit 50 mg täglich und Placebo verglichen wurden. PAXIL zeigte eine statistisch signifikante Überlegenheit gegenüber Placebo auf der Gesamtpunktzahl der Hamilton Rating Scale for Anxiety (HAM-A).
Eine dritte Studie, eine Studie mit flexibler Dosierung, in der PAXIL 20 mg bis 50 mg täglich mit Placebo verglichen wurde, zeigte keine statistisch signifikante Überlegenheit von PAXIL gegenüber Placebo auf dem Gesamtwert der Hamilton Rating Scale for Anxiety (HAM-A), dem primären Endpunkt.
Subgruppenanalysen zeigten keine Unterschiede in den Behandlungsergebnissen in Abhängigkeit von Rasse oder Geschlecht. Es gab nicht genügend ältere Patienten, um Subgruppenanalysen auf der Grundlage des Alters durchzuführen.
In einer Langzeitstudie wurden 566 Patienten, die die DSM-IV-Kriterien für GAD erfüllten und während einer einfach verblindeten, 8-wöchigen akuten Behandlungsphase mit PAXIL 20 mg bis 50 mg täglich angesprochen hatten, randomisiert zur Fortsetzung von PAXIL 30 mg zu ihrem Zeitpunkt derselben Dosis oder Placebo für eine bis zu 24-wöchige Beobachtung auf einen Rückfall. Das Ansprechen während der einfach verblindeten Phase wurde durch eine Abnahme von ≥ 2 Punkten im Vergleich zum Ausgangswert auf der CGI-Skala für den Schweregrad der Erkrankung auf eine Punktzahl von ≤ 3 definiert. Ein Rückfall während der doppelblinden Phase wurde definiert als ein Anstieg von ≥2 Punkten im Vergleich zum Ausgangswert auf der CGI-Skala für den Schweregrad der Erkrankung auf einen Wert von ≥4 oder als Abbruch aufgrund mangelnder Wirksamkeit. Bei Patienten, die weiterhin PAXIL 40 mg erhielten, kam es in den folgenden 24 Wochen zu einer statistisch signifikant geringeren Rückfallrate im Vergleich zu Patienten, die Placebo erhielten.
Posttraumatische Belastungsstörung
Die Wirksamkeit von PAXIL 20 mg bei der Behandlung von posttraumatischer Belastungsstörung (PTSD) wurde in zwei 12-wöchigen, multizentrischen, placebokontrollierten Studien (Studien 1 und 2) mit erwachsenen ambulanten Patienten nachgewiesen, die die DSM-IV-Kriterien für PTBS erfüllten. Die mittlere Dauer der PTBS-Symptome für die 2 Studien zusammen betrug 13 Jahre (von 0,1 Jahr bis 57 Jahre). Der Prozentsatz der Patienten mit sekundärer MDD oder nicht-PTBS-Angststörungen in den kombinierten 2 Studien betrug 41 % (356 von 858 Patienten) bzw. 40 % (345 von 858 Patienten). Das Studienergebnis wurde durch (1) den Score der Clinician-Administered PTSD Scale Part 2 (CAPS-2) und (2) die Clinical Global Impression-Global Improvement Scale (CGI-I) bewertet. Das CAPS-2 ist ein Multi-Item-Instrument, das 3 Aspekte der PTBS mit den folgenden Symptomclustern misst: Wiedererleben/Intrusion, Vermeidung/Betäubung und Übererregung. Die 2 primären Endpunkte für jede Studie waren (1) die Veränderung vom Ausgangswert zum Endpunkt des CAPS-2-Gesamtscores (17 Punkte) und (2) der Anteil der Responder im CGI-I, wobei Responder als Patienten mit einem Score definiert wurden von 1 (sehr stark verbessert) oder 2 (stark verbessert).
Studie 1 war eine 12-wöchige Studie, in der feste Dosen von PAXIL 20 mg oder 40 mg täglich mit Placebo verglichen wurden. Die Dosierungen von PAXIL 20 mg und 40 mg erwiesen sich als statistisch signifikant überlegen gegenüber Placebo in Bezug auf die Veränderung gegenüber dem Ausgangswert für den CAPS-2-Gesamtscore und den Anteil der Responder im CGI-I. In dieser Studie gab es keine ausreichende Evidenz für einen größeren Nutzen der 40-mg-Tagesdosis im Vergleich zur 20-mg-Tagesdosis.
Studie 2 war eine 12-wöchige Studie mit flexibler Dosierung, in der PAXIL 20 mg bis 50 mg täglich mit Placebo verglichen wurde. Es wurde gezeigt, dass PAXIL 40 mg dem Placebo in Bezug auf die Veränderung gegenüber dem Ausgangswert für den CAPS-2-Gesamtscore und den Anteil der Responder im CGI-I signifikant überlegen war.
Eine dritte Studie, eine Studie mit flexibler Dosierung, in der PAXIL 20 mg bis 50 mg täglich mit Placebo verglichen wurde, zeigte, dass PAXIL 20 mg Placebo statistisch signifikant überlegen war, was die Veränderung des CAPS-2-Gesamtscores gegenüber dem Ausgangswert betrifft, jedoch nicht den Anteil der Responder im CGI -ICH.
Die Mehrzahl der Patienten in diesen Studien waren Frauen (68 % Frauen: 377 von 551 Probanden in Studie 1 und 66 % Frauen: 202 von 303 Probanden in Studie 2). Subgruppenanalysen zeigten keine Unterschiede in den Behandlungsergebnissen als Funktion des Geschlechts. Es gab eine unzureichende Anzahl von Patienten, die 65 Jahre und älter waren oder keine Kaukasier waren, um Subgruppenanalysen auf der Grundlage von Alter bzw. Rasse durchzuführen.
INFORMATIONEN ZUM PATIENTEN
PAXIL® (PAX-il)(Paroxetin) Tabletten und Suspension zum Einnehmen
Was sind die wichtigsten Informationen, die ich über PAXIL wissen sollte?
PAXIL kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Wie kann ich Suizidgedanken und -handlungen beobachten und versuchen, sie zu verhindern?
Rufen Sie sofort Ihren Arzt an oder holen Sie sich sofort medizinische Hilfe, wenn Sie eines der folgenden Symptome haben, insbesondere wenn sie neu oder schlimmer sind oder Sie beunruhigen:
Was ist PAXIL?
PAXIL 30 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von:
Nehmen Sie PAXIL nicht ein, wenn Sie:
Fragen Sie Ihren Arzt oder Apotheker, wenn Sie sich nicht sicher sind, ob Sie einen MAO-Hemmer oder eines dieser Arzneimittel einnehmen, einschließlich des Antibiotikums Linezolid oder Methylenblau intravenös.
Beginnen Sie mindestens 14 Tage nach Beendigung der Behandlung mit PAXIL nicht mit der Einnahme eines MAOI.
Informieren Sie vor der Einnahme von PAXIL Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen.
PAXIL und einige andere Arzneimittel können sich gegenseitig beeinflussen und möglicherweise schwerwiegende Nebenwirkungen verursachen. PAXIL 30 mg kann die Wirkungsweise anderer Arzneimittel beeinflussen und andere Arzneimittel können die Wirkungsweise von PAXIL beeinflussen.
Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Fragen Sie Ihren Arzt, wenn Sie sich nicht sicher sind, ob Sie eines dieser Arzneimittel einnehmen. Ihr Arzt kann Ihnen sagen, ob es sicher ist, PAXIL 10 mg zusammen mit Ihren anderen Arzneimitteln einzunehmen.
Beginnen oder beenden Sie keine anderen Arzneimittel während der Behandlung mit PAXIL, ohne vorher mit Ihrem Arzt gesprochen zu haben. Das plötzliche Absetzen von PAXIL kann zu schwerwiegenden Nebenwirkungen führen. Sehen, „Was sind die möglichen Nebenwirkungen von PAXIL 20 mg?“
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste davon, die Sie Ihrem Arzt und Apotheker zeigen können, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich PAXIL einnehmen?
Was sind mögliche Nebenwirkungen von PAXIL 10 mg?
PAXIL 40 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
In schwereren oder plötzlicheren Fällen gehören zu den Anzeichen und Symptomen:
Zu den häufigsten Nebenwirkungen von PAXIL 10 mg gehören:
Dies sind nicht alle möglichen Nebenwirkungen von PAXIL.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist PAXIL aufzubewahren?
Bewahren Sie PAXIL und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von PAXIL.
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Nehmen Sie PAXIL nicht für einen Zustand ein, für den es nicht verschrieben wurde. Geben Sie PAXIL nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden. Sie können Ihren Arzt oder Apotheker um Informationen über PAXIL bitten, die für medizinisches Fachpersonal geschrieben sind.
Was sind die Inhaltsstoffe von PAXIL 30 mg?
Wirkstoff: Paroxetinhydrochlorid
Inaktive Zutaten:
dibasisches Calciumphosphatdihydrat, Hypromellose, Magnesiumstearat, Polyethylenglycole, Polysorbat 80, Natriumstärkeglycolat, Titandioxid und 1 oder mehrere der folgenden Stoffe: D&C Red Nr. 30 Aluminiumlack, D&C Yellow Nr. 10 Aluminiumlack, FD&C Blue Nr 2 Aluminiumlack, FD&C Yellow Nr. 6 Aluminiumlack
Suspension zum Einnehmen: Zitronensäure (wasserfrei), FD&C Yellow No. 6, Aromen, Glycerin, Methylparaben, mikrokristalline Cellulose und Carboxymethylcellulose-Natrium, Polacrilin-Kalium, Propylenglycol, Propylparaben, gereinigtes Wasser, Saccharin-Natrium, Simethicon-Emulsion und Natriumcitrat (Dihydrat)
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.