Seroquel 25mg, 50mg, 100mg, 200mg, 300mg Quetiapine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Seroquel 100 mg und wie wird es angewendet?
Seroquel 50 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Schizophrenie, Bipolar-I-Störung, Manie; Bipolare Störung, depressive Episoden; Bipolare I-Störung, Wartung; und Major Depression. Seroquel 50 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Seroquel gehört zu einer Medikamentenklasse namens Antipsychotika der 2. Generation; Antimanische Wirkstoffe.
Es ist nicht bekannt, ob Seroquel 200 mg bei Kindern unter 12 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Seroquel 50 mg haben?
Seroquel kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Seroquel gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Seroquel. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
ERHÖHTE STERBLICHKEIT BEI ÄLTEREN PATIENTEN MIT PSYCHOSE IM ZUSAMMENHANG MIT DEMENZ; und SELBSTMORDIGE GEDANKEN UND VERHALTENSWEISEN
Erhöhte Sterblichkeit bei älteren Patienten mit demenzbedingter Psychose
Ältere Patienten mit demenzbedingter Psychose, die mit Antipsychotika behandelt werden, haben ein erhöhtes Sterberisiko [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN]. SEROQUEL ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
Suizidgedanken und Verhaltensweisen
Antidepressiva erhöhten in Kurzzeitstudien das Risiko für Suizidgedanken und -verhalten bei Kindern, Jugendlichen und jungen Erwachsenen. Diese Studien zeigten keine Erhöhung des Risikos für Suizidgedanken und -verhalten bei Anwendung von Antidepressiva bei Patienten über 24 Jahren; bei Patienten im Alter von 65 Jahren und älter wurde das Risiko bei der Anwendung von Antidepressiva verringert [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
Bei Patienten jeden Alters, die mit einer antidepressiven Therapie begonnen werden, ist eine genaue Überwachung auf eine Verschlechterung und das Auftreten von Suizidgedanken und -verhalten vorzunehmen. Informieren Sie Familien und Pflegekräfte über die Notwendigkeit einer genauen Beobachtung und Kommunikation mit dem verschreibenden Arzt [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
SEROQUEL 50 mg ist nicht für die Anwendung bei pädiatrischen Patienten unter zehn Jahren zugelassen [siehe Anwendung bei bestimmten Patientengruppen].
BEZEICHNUNG
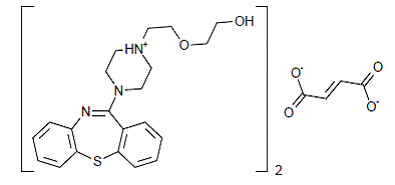
SEROQUEL® (Quetiapinfumarat) ist ein Psychopharmakon, das zu einer chemischen Klasse, den Dibenzothiazepin-Derivaten, gehört. Die chemische Bezeichnung lautet 2-[2-(4-Dibenzo[b,f][1,4]thiazepin-11-yl-1-piperazinyl)ethoxy]ethanolfumarat (2:1) (Salz). Es liegt in Tabletten als Fumaratsalz vor. Alle Dosierungen und Tablettenstärken sind als Milligramm der Base angegeben, nicht als Fumaratsalz. Seine Summenformel ist C42H50N6O4S2•C4H4O4 und es hat ein Molekulargewicht von 883,11 (Fumaratsalz). Die Strukturformel lautet:
Quetiapinfumarat ist ein weißes bis cremefarbenes kristallines Pulver, das in Wasser mäßig löslich ist.
SEROQUEL wird zur oralen Verabreichung als 25 mg (rund, pfirsichfarben), 50 mg (rund, weiß), 100 mg (rund, gelb), 200 mg (rund, weiß), 300 mg (kapselförmig, weiß) und geliefert 400 mg (kapselförmige, gelbe) Tabletten.
Inaktive Bestandteile sind Povidon, dibasisches Dicalciumphosphatdihydrat, mikrokristalline Cellulose, Natriumstärkeglycolat, Lactosemonohydrat, Magnesiumstearat, Hypromellose, Polyethylenglycol und Titandioxid.
Die 25-mg-Tabletten enthalten rotes Eisenoxid und gelbes Eisenoxid und die 100-mg- und 400-mg-Tabletten enthalten nur gelbes Eisenoxid.
INDIKATIONEN
Schizophrenie
SEROQUEL XR ist angezeigt zur Behandlung von Schizophrenie. Die Wirksamkeit von SEROQUEL XR bei Schizophrenie wurde in einer 6-wöchigen und einer Erhaltungsstudie bei Erwachsenen mit Schizophrenie nachgewiesen. Die Wirksamkeit wurde durch drei 6-wöchige Studien bei Erwachsenen mit Schizophrenie und eine 6-wöchige Studie bei Jugendlichen mit Schizophrenie (13-17 Jahre), die mit SEROQUEL behandelt wurden, gestützt [siehe Klinische Studien ].
Bipolare Störung
SEROQUEL 25 mg XR ist angezeigt zur akuten Behandlung von manischen oder gemischten Episoden im Zusammenhang mit einer Bipolar-I-Störung, sowohl als Monotherapie als auch als Zusatz zu Lithium oder Divalproex. Die Wirksamkeit von SEROQUEL XR bei manischen oder gemischten Episoden einer Bipolar-I-Störung wurde in einer 3-wöchigen Studie bei Erwachsenen mit manischen oder gemischten Episoden im Zusammenhang mit einer Bipolar-I-Störung nachgewiesen. Die Wirksamkeit wurde durch zwei 12-wöchige Monotherapie-Studien und eine 3-wöchige Zusatzstudie bei Erwachsenen mit manischen Episoden im Zusammenhang mit einer Bipolar-I-Störung sowie durch eine 3-wöchige Monotherapie-Studie bei Kindern und Jugendlichen (10–17 Jahre) mit manischen Episoden im Zusammenhang unterstützt mit Bipolar-I-Störung, behandelt mit SEROQUEL [siehe Klinische Studien ].
SEROQUEL 100 mg XR ist angezeigt zur akuten Behandlung depressiver Episoden im Zusammenhang mit einer bipolaren Störung. Die Wirksamkeit von SEROQUEL XR wurde in einer 8-wöchigen Studie bei Erwachsenen mit Bipolar-I- oder -II-Störung nachgewiesen und durch zwei 8-Wochen-Studien bei Erwachsenen mit Bipolar-I- oder -II-Störung, die mit SEROQUEL behandelt wurden, gestützt [siehe Klinische Studien ].
SEROQUEL 100 mg XR ist als Ergänzung zu Lithium oder Divalproex zur Erhaltungsbehandlung der Bipolar-I-Störung indiziert. Die Wirksamkeit wurde aus zwei Erhaltungsstudien bei Erwachsenen mit Bipolar-I-Störung, die mit SEROQUEL behandelt wurden, extrapoliert. Die Wirksamkeit einer Monotherapie zur Erhaltungstherapie der Bipolar-I-Störung wurde nicht systematisch in kontrollierten klinischen Studien untersucht [siehe Klinische Studien ].
Zusatzbehandlung der Major Depression (MDD)
SEROQUEL 100 mg XR ist als Begleittherapie zu Antidepressiva zur Behandlung von MDD indiziert. Die Wirksamkeit von SEROQUEL XR als Zusatztherapie zu Antidepressiva bei MDD wurde in zwei 6-wöchigen Studien bei Erwachsenen mit MDD nachgewiesen, die unzureichend auf eine Behandlung mit Antidepressiva ansprachen [siehe Klinische Studien ].
Besondere Überlegungen bei der Behandlung von pädiatrischer Schizophrenie und Bipolar-I-Störung
Pädiatrische Schizophrenie und Bipolar-I-Störung sind schwerwiegende psychische Störungen, die Diagnose kann jedoch schwierig sein. Bei der pädiatrischen Schizophrenie können die Symptomprofile variabel sein, und bei der Bipolar-I-Störung können Patienten unterschiedliche Muster der Periodizität von manischen oder gemischten Symptomen aufweisen. Es wird empfohlen, eine medikamentöse Therapie bei pädiatrischer Schizophrenie und Bipolar-I-Störung erst nach gründlicher diagnostischer Abklärung und sorgfältiger Abwägung der mit der medikamentösen Behandlung verbundenen Risiken einzuleiten. Die medikamentöse Behandlung sowohl der pädiatrischen Schizophrenie als auch der Bipolar-I-Störung ist als Teil eines Gesamtbehandlungsprogramms indiziert, das häufig psychologische, pädagogische und soziale Interventionen umfasst.
DOSIERUNG UND ANWENDUNG
Wichtige Verwaltungsanweisungen
SEROQUEL XR Tabletten sollten im Ganzen geschluckt und nicht geteilt, gekaut oder zerdrückt werden.
Es wird empfohlen, SEROQUEL 50 mg XR ohne Nahrung oder mit einer leichten Mahlzeit (ca. 300 Kalorien) einzunehmen [siehe KLINISCHE PHARMAKOLOGIE ].
SEROQUEL 25 mg XR sollte einmal täglich verabreicht werden, vorzugsweise abends.
Empfohlene Dosierung
Die empfohlene Anfangsdosis, Titration, Dosisbereich und Höchstdosis von SEROQUEL 50 mg XR für jede zugelassene Indikation sind in Tabelle 1 unten aufgeführt. Nach der Anfangsdosierung können je nach klinischem Ansprechen und Verträglichkeit des Patienten bei Bedarf Anpassungen nach oben oder unten vorgenommen werden [siehe Klinische Studien ].
Erhaltungstherapie bei Schizophrenie und Bipolar-I-Störung
Erhaltungsbehandlung
Die Patienten sollten regelmäßig neu untersucht werden, um die Notwendigkeit einer Erhaltungstherapie und die geeignete Dosis für eine solche Behandlung zu bestimmen [siehe Klinische Studien ].
Dosisanpassungen bei älteren Patienten
Bei älteren und geschwächten oder für hypotensive Reaktionen anfälligen Patienten sollte eine langsamere Dosistitration und eine niedrigere Zieldosis in Erwägung gezogen werden [siehe Verwendung in bestimmten Bevölkerungsgruppen , und KLINISCHE PHARMAKOLOGIE ]. Wenn angezeigt, sollte eine Dosissteigerung bei diesen Patienten mit Vorsicht durchgeführt werden.
Ältere Patienten sollten mit SEROQUEL XR 50 mg/Tag begonnen werden und die Dosis kann je nach klinischem Ansprechen und Verträglichkeit des einzelnen Patienten in Schritten von 50 mg/Tag erhöht werden.
Dosisänderungen bei Patienten mit eingeschränkter Leberfunktion
Patienten mit eingeschränkter Leberfunktion sollten mit SEROQUEL XR 50 mg/Tag beginnen. Die Dosis kann täglich in Schritten von 50 mg/Tag bis zu einer wirksamen Dosis erhöht werden, abhängig vom klinischen Ansprechen und der Verträglichkeit des Patienten.
Dosisänderungen bei Anwendung mit CYP3A4-Inhibitoren
Die Dosis von SEROQUEL XR sollte auf ein Sechstel der ursprünglichen Dosis reduziert werden, wenn es gleichzeitig mit einem starken CYP3A4-Hemmer (z. B. Ketoconazol, Itraconazol, Indinavir, Ritonavir, Nefazodon usw.) behandelt wird. Wenn der CYP3A4-Hemmer abgesetzt wird, sollte die Dosis von SEROQUEL XR um das 6-Fache erhöht werden [siehe KLINISCHE PHARMAKOLOGIE und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Dosisänderungen bei Verwendung mit CYP3A4-Induktoren
Die Dosis von SEROQUEL XR sollte bis auf das 5-fache der ursprünglichen Dosis erhöht werden, wenn sie in Kombination mit einer chronischen Behandlung (z. B. länger als 7-14 Tage) mit einem starken CYP3A4-Induktor (z. B. Phenytoin, Carbamazepin, Rifampin, Avasimibe, St B. Johanniskraut etc.). Die Dosis sollte basierend auf dem klinischen Ansprechen und der Verträglichkeit des einzelnen Patienten titriert werden. Wenn der CYP3A4-Induktor abgesetzt wird, sollte die Dosis von SEROQUEL 100 mg XR innerhalb von 7-14 Tagen auf das ursprüngliche Niveau reduziert werden [siehe KLINISCHE PHARMAKOLOGIE und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Wiederaufnahme der Behandlung bei Patienten, die zuvor abgebrochen wurden
Obwohl es keine Daten gibt, die sich speziell mit der Wiederaufnahme der Behandlung befassen, wird empfohlen, dass bei der Wiederaufnahme der Therapie von Patienten, die SEROQUEL 50 mg XR für mehr als eine Woche abgesetzt haben, das anfängliche Dosierungsschema befolgt werden sollte. Bei der Wiederaufnahme der Behandlung von Patienten, die SEROQUEL 300 mg XR für weniger als eine Woche abgesetzt hatten, ist möglicherweise keine schrittweise Dosissteigerung erforderlich und die Erhaltungsdosis kann wieder aufgenommen werden.
Umstellung von Patienten von SEROQUEL 50 mg Tabletten auf SEROQUEL 100 mg XR-Tabletten
Patienten, die derzeit mit SEROQUEL (Formulierung mit sofortiger Freisetzung) behandelt werden, können auf SEROQUEL XR in der äquivalenten Tagesgesamtdosis umgestellt werden, die einmal täglich eingenommen wird. Individuelle Dosisanpassungen können erforderlich sein.
Umstellung von Antipsychotika
Es liegen keine systematisch gesammelten Daten vor, die sich speziell mit der Umstellung von Patienten von anderen Antipsychotika auf SEROQUEL 200 mg XR oder mit der gleichzeitigen Verabreichung mit anderen Antipsychotika befassen. Während für einige Patienten ein sofortiges Absetzen der vorherigen antipsychotischen Behandlung akzeptabel sein kann, kann für andere ein langsameres Absetzen am besten geeignet sein. In allen Fällen sollte der Zeitraum der überlappenden Verabreichung von Antipsychotika minimiert werden. Wenn Patienten von Depot-Antipsychotika umgestellt werden, sollte, falls medizinisch angemessen, eine Behandlung mit SEROQUEL XR anstelle der nächsten planmäßigen Injektion eingeleitet werden. Die Notwendigkeit einer Fortführung der bestehenden Medikation gegen das extrapyramidale Syndrom sollte regelmäßig neu bewertet werden.
WIE GELIEFERT
Darreichungsformen und Stärken
Lagerung und Handhabung
50 mg Tabletten ( NDC 0310-0280-60) pfirsichfarbene, kapselförmige, bikonvexe Filmtablette mit Prägung „XR 50“ auf der einen Seite und glatt auf der anderen Seite sind in Flaschen mit 60 Tabletten erhältlich.
150 mg Tabletten ( NDC 0310-0281-60) weiße, filmbeschichtete, kapselförmige, bikonvexe, geprägte Tablette mit „XR 150“ auf der einen Seite und glatt auf der anderen Seite sind in Flaschen mit 60 Tabletten erhältlich.
200 mg Tabletten ( NDC 0310-0282-60) Gelbe, filmbeschichtete, kapselförmige, bikonvexe, geprägte Tablette mit „XR 200“ auf der einen Seite und glatt auf der anderen Seite sind in Flaschen mit 60 Tabletten erhältlich.
300 mg Tabletten ( NDC 0310-0283-60) blassgelbe, kapselförmige, bikonvexe Filmtablette mit Prägung „XR 300“ auf der einen Seite und glatt auf der anderen Seite sind in Flaschen mit 60 Tabletten erhältlich.
400 mg Tabletten ( NDC 0310-0284-60) weiße, filmbeschichtete, kapselförmige, bikonvexe Tablette mit Prägung „XR 400“ auf der einen Seite und glatt auf der anderen Seite sind in Flaschen mit 60 Tabletten erhältlich.
Lagern Sie SEROQUEL XR bei 25 °C (77 °F); Exkursionen erlaubt bis 15-30°C (59-86°F) [Siehe USP ].
Vertrieb durch: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Überarbeitet: März 2020
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden in anderen Abschnitten der Kennzeichnung ausführlicher erörtert:
Klinische Studienerfahrung
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien eines Arzneimittels beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Erwachsene
Die nachstehenden Informationen stammen aus einer klinischen Studiendatenbank für SEROQUEL 200 mg, die aus über 4300 Patienten besteht. Diese Datenbank umfasst 698 Patienten, die SEROQUEL zur Behandlung von bipolarer Depression erhielten, 405 Patienten, die SEROQUEL 200 mg zur Behandlung von akuter bipolarer Manie (Monotherapie und Zusatztherapie) erhielten, 646 Patienten, die SEROQUEL zur Erhaltungsbehandlung einer Bipolar-I-Störung als Zusatztherapie erhielten Therapie, und etwa 2600 Patienten und/oder normale Probanden, die 1 oder mehr Dosen von SEROQUEL 200 mg zur Behandlung von Schizophrenie erhielten.
Von diesen etwa 4.300 Probanden waren etwa 4.000 (2.300 bei Schizophrenie, 405 bei akuter bipolarer Manie, 698 bei bipolarer Depression und 646 bei der Erhaltungstherapie einer Bipolar-I-Störung) Patienten, die an Wirksamkeitsstudien mit mehreren Dosen teilgenommen haben und deren Erfahrung entsprach ca. 2400 Patientenjahre. Die Bedingungen und Dauer der Behandlung mit SEROQUEL 200 mg waren sehr unterschiedlich und umfassten (in sich überschneidenden Kategorien) offene und doppelblinde Phasen von Studien, stationäre und ambulante Patienten, Studien mit fester Dosis und Dosistitration sowie Kurzzeit- oder Langzeitstudien Exposition. Nebenwirkungen wurden bewertet, indem Nebenwirkungen, Ergebnisse körperlicher Untersuchungen, Vitalzeichen, Gewichte, Laboranalysen, EKGs und Ergebnisse ophthalmologischer Untersuchungen gesammelt wurden.
Die angegebenen Häufigkeiten von Nebenwirkungen stellen den Anteil der Personen dar, bei denen mindestens einmal eine Nebenwirkung der aufgeführten Art aufgetreten ist.
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung in placebokontrollierten Kurzzeitstudien
Schizophrenie
Insgesamt gab es in einem Pool kontrollierter Studien kaum Unterschiede in der Häufigkeit von Abbrüchen aufgrund von Nebenwirkungen (4 % für SEROQUEL vs. 3 % für Placebo). Abbrüche aufgrund von Somnolenz (0,8 % SEROQUEL 100 mg vs. 0 % Placebo) und Hypotonie (0,4 % SEROQUEL 200 mg vs. 0 % Placebo) wurden jedoch als arzneimittelbedingt angesehen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Bipolare Störung
Manie
Insgesamt betrug die Abbruchrate aufgrund von Nebenwirkungen 5,7 % bei SEROQUEL 25 mg vs. 5,1 % bei Placebo in Monotherapie und 3,6 % bei SEROQUEL vs. 5,9 % bei Placebo in Zusatztherapie.
Depression
Insgesamt lagen die Abbrüche aufgrund von Nebenwirkungen bei 12,3 % bei SEROQUEL 300 mg gegenüber 19,0 % bei SEROQUEL 600 mg und 5,2 % bei Placebo.
Häufig beobachtete Nebenwirkungen in placebokontrollierten Kurzzeitstudien
In den Studien zur Akuttherapie von Schizophrenie (bis zu 6 Wochen) und bipolarer Manie (bis zu 12 Wochen) waren die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von SEROQUEL als Monotherapie (Inzidenz von 5 % oder mehr) und wurden mit einer Häufigkeit von beobachtet SEROQUEL mindestens doppelt so hoch wie Placebo waren Schläfrigkeit (18 %), Schwindel (11 %), Mundtrockenheit (9 %), Verstopfung (8 %), ALT-Erhöhung (5 %), Gewichtszunahme (5 %) und Dyspepsie ( 5 %).
Nebenwirkungen, die bei mit SEROQUEL behandelten Patienten in Placebo-kontrollierten Kurzzeitstudien mit einer Inzidenz von 2 % oder mehr auftraten
Der verschreibende Arzt sollte sich darüber im Klaren sein, dass die Zahlen in den Tabellen und Tabellen nicht dazu verwendet werden können, das Auftreten von Nebenwirkungen im Laufe der üblichen medizinischen Praxis vorherzusagen, wenn sich die Patientencharakteristika und andere Faktoren von denen unterscheiden, die in den klinischen Studien vorherrschten. Ebenso können die angegebenen Häufigkeiten nicht mit Zahlen verglichen werden, die aus anderen klinischen Studien mit unterschiedlichen Behandlungen, Anwendungen und Prüfärzten stammen. Die zitierten Zahlen bieten dem verschreibenden Arzt jedoch eine gewisse Grundlage für die Abschätzung des relativen Beitrags von medikamentösen und nichtmedikamentösen Faktoren zum Auftreten von Nebenwirkungen in der untersuchten Population.
Tabelle 9 listet die auf den nächsten Prozent gerundete Inzidenz von Nebenwirkungen auf, die während der Akuttherapie von Schizophrenie (bis zu 6 Wochen) und bipolarer Manie (bis zu 12 Wochen) bei 2 % oder mehr der mit SEROQUEL behandelten Patienten (Dosen im Bereich von von 75 auf 800 mg/Tag), wobei die Inzidenz bei mit SEROQUEL behandelten Patienten größer war als die Inzidenz bei mit Placebo behandelten Patienten.
In den Studien zur akuten Zusatztherapie der bipolaren Manie (bis zu 3 Wochen) waren die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von SEROQUEL (Inzidenz von 5 % oder mehr) und wurden unter SEROQUEL mindestens doppelt so häufig beobachtet wie unter Placebo Somnolenz (34 %), Mundtrockenheit (19 %), Asthenie (10 %), Verstopfung (10 %), Bauchschmerzen (7 %), orthostatische Hypotonie (7 %), Pharyngitis (6 %) und Gewichtszunahme (6 %).
Tabelle 10 listet die auf den nächsten Prozent gerundete Häufigkeit von Nebenwirkungen auf, die während der Therapie (bis zu 3 Wochen) der akuten Manie bei 2 % oder mehr der mit SEROQUEL (Dosen im Bereich von 100 bis 800 mg/Tag) behandelten Patienten auftraten als Zusatztherapie zu Lithium und Divalproex, wenn die Inzidenz bei mit SEROQUEL behandelten Patienten höher war als die Inzidenz bei mit Placebo behandelten Patienten.
In Studien zu bipolaren Depressionen (bis zu 8 Wochen) waren die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von SEROQUEL (Inzidenz von 5 % oder mehr) und unter SEROQUEL 200 mg mindestens doppelt so häufig wie unter Placebo beobachtete Somnolenz (57 % ), Mundtrockenheit (44 %), Schwindel (18 %), Verstopfung (10 %) und Lethargie (5 %).
Tabelle 11 führt die auf den nächsten Prozentsatz gerundete Häufigkeit von Nebenwirkungen auf, die während der Therapie (bis zu 8 Wochen) der bipolaren Depression bei 2 % oder mehr der mit SEROQUEL (Dosen von 300 und 600 mg/Tag) behandelten Patienten auftraten, wobei die Die Inzidenz bei mit SEROQUEL behandelten Patienten war höher als die Inzidenz bei mit Placebo behandelten Patienten.
Untersuchungen zu Wechselwirkungen auf der Grundlage von Geschlecht, Alter und ethnischer Zugehörigkeit ergaben keine klinisch bedeutsamen Unterschiede beim Auftreten von Nebenwirkungen auf der Grundlage dieser demografischen Faktoren.
Dosisabhängigkeit von Nebenwirkungen in Placebo-kontrollierten Kurzzeitstudien
Dosisabhängige Nebenwirkungen
Spontan erhobene Nebenwirkungen aus einer Studie über Schizophrenie, in der fünf Fixdosen von SEROQUEL (75 mg, 150 mg, 300 mg, 600 mg und 750 mg/Tag) mit Placebo verglichen wurden, wurden auf dosisabhängige Nebenwirkungen untersucht. Logistische Regressionsanalysen ergaben eine positive Dosiswirkung (p
Nebenwirkungen in klinischen Studien mit Quetiapin, die nicht an anderer Stelle auf dem Etikett aufgeführt sind:
Die folgenden Nebenwirkungen wurden auch unter Quetiapin berichtet: Albträume, Überempfindlichkeit und Erhöhungen der Kreatinphosphokinase im Serum (nicht assoziiert mit NMS), Galaktorrhoe, Bradykardie (die bei oder kurz vor Beginn der Behandlung auftreten und mit Hypotonie und/oder Synkope einhergehen können ) verringerte Blutplättchenzahl, Somnambulismus (und andere verwandte Ereignisse), Erhöhungen der Gamma-GT-Spiegel, Hypothermie, Dyspnoe, Eosinophilie, Harnverhalt, Darmverschluss und Priapismus.
Extrapyramidale Symptome (EPS)
Dystonie
Klasseneffekt
Bei empfindlichen Personen können in den ersten Tagen der Behandlung Symptome einer Dystonie, verlängerte abnorme Kontraktionen von Muskelgruppen, auftreten. Zu den dystonischen Symptomen gehören: Krämpfe der Nackenmuskulatur, die sich manchmal zu einem Engegefühl im Hals entwickeln, Schluckbeschwerden, Atembeschwerden und/oder Heraustreten der Zunge. Während diese Symptome bei niedrigen Dosen auftreten können, treten sie häufiger und mit größerer Schwere bei hochpotenten und höheren Dosen von Antipsychotika der ersten Generation auf. Ein erhöhtes Risiko einer akuten Dystonie wird bei Männern und jüngeren Altersgruppen beobachtet.
Vier Methoden wurden verwendet, um EPS zu messen: (1) Simpson-Angus-Gesamtwert (mittlere Veränderung gegenüber dem Ausgangswert), der Parkinsonismus und Akathisie bewertet, (2) Barnes Akathisia Rating Scale (BARS) Global Assessment Score, (3) Inzidenz spontaner Beschwerden von EPS (Akathisie, Akinesie, Zahnradstarrheit, extrapyramidales Syndrom, Hypertonie, Hypokinesie, Nackensteifigkeit und Tremor) und (4) Verwendung von Anticholinergika zur Behandlung von EPS.
Erwachsene
Daten aus einer 6-wöchigen klinischen Schizophrenie-Studie, in der fünf Fixdosen von SEROQUEL (75, 150, 300, 600, 750 mg/Tag) verglichen wurden, lieferten Hinweise auf das Fehlen extrapyramidaler Symptome (EPS) und die Dosisabhängigkeit von EPS im Zusammenhang mit SEROQUEL 100 mg Behandlung. Drei Methoden wurden verwendet, um EPS zu messen: (1) Simpson-Angus-Gesamtscore (mittlere Veränderung gegenüber dem Ausgangswert), der Parkinsonismus und Akathisie bewertet, (2) Inzidenz spontaner Beschwerden von EPS (Akathisie, Akinesie, Zahnradstarrheit, extrapyramidales Syndrom, Hypertonie, Hypokinesie, Nackensteifigkeit und Zittern) und (3) Verwendung von Anticholinergika gegen EPS.
In Tabelle 12 umfassten dystonische Ereignisse Nackensteifigkeit, Hypertonie, Dystonie, Muskelsteifheit, Okulogieration; Parkinsonismus umfasste Zahnradstarrheit, Zittern, Sabbern, Hypokinesie; Akathisie umfasste Akathisie, psychomotorische Erregung; dyskinetisches Ereignis umfasste tardive Dyskinesie, Dyskinesie, Choreoathetose; und andere extrapyramidale Ereignisse umfassten Ruhelosigkeit, extrapyramidale Störungen, Bewegungsstörungen.
Parkinson-Inzidenzraten, gemessen anhand des Simpson-Angus-Gesamtscores für Placebo und die fünf Fixdosen (75, 150, 300, 600, 750 mg/Tag) waren: -0,6; -1,0, -1,2; -1,6; -1,8 und -1,8. Die Rate der Verwendung von Anticholinergika zur Behandlung von EPS für Placebo und die fünf Fixdosen betrug: 14 %; 11 %; 10 %; 8 %; 12 % und 11 %.
In sechs zusätzlichen placebokontrollierten klinischen Studien (3 bei akuter Manie und 3 bei Schizophrenie) mit variablen Dosierungen von SEROQUEL gab es keine Unterschiede zwischen der SEROQUEL- und der Placebo-Behandlungsgruppe in Bezug auf das Auftreten von EPS, wie anhand der Simpson-Angus-Gesamtscores bewertet wurde. Spontanbeschwerden von EPS und die gleichzeitige Anwendung von Anticholinergika zur Behandlung von EPS.
In zwei placebokontrollierten klinischen Studien zur Behandlung von bipolarer Depression mit 300 mg und 600 mg SEROQUEL 100 mg betrug die Inzidenz von Nebenwirkungen, die möglicherweise mit EPS zusammenhängen, 12 % in beiden Dosisgruppen und 6 % in der Placebogruppe. In diesen Studien war die Inzidenz der einzelnen Nebenwirkungen (Akathisie, extrapyramidale Störung, Tremor, Dyskinesie, Dystonie, Unruhe, unwillkürliche Muskelkontraktionen, psychomotorische Hyperaktivität und Muskelrigidität) im Allgemeinen gering und überstieg in keiner Behandlungsgruppe 4 %.
Die 3 Behandlungsgruppen waren in der mittleren Veränderung des SAS-Gesamtscores und des BARS-Global-Assessment-Scores am Ende der Behandlung ähnlich. Die gleichzeitige Anwendung von Anticholinergika war selten und in allen drei Behandlungsgruppen ähnlich.
Kinder und Jugendliche
Die nachstehenden Informationen stammen aus einer klinischen Studiendatenbank für SEROQUEL 200 mg, die aus über 1000 pädiatrischen Patienten besteht. Diese Datenbank umfasst 677 Patienten, die SEROQUEL 200 mg zur Behandlung von Schizophrenie erhielten, und 393 Kinder und Jugendliche (10-17 Jahre), die SEROQUEL zur Behandlung von akuter bipolarer Manie erhielten.
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung in Placebo-kontrollierten Kurzzeitstudien
Schizophrenie
Die Inzidenz von Behandlungsabbrüchen aufgrund von Nebenwirkungen betrug bei mit Quetiapin behandelten und mit Placebo behandelten Patienten 8,2 % bzw. 2,7 %. Die Nebenwirkung, die bei 1 % oder mehr der Patienten unter SEROQUEL und häufiger als unter Placebo zum Absetzen führte, war Somnolenz (2,7 % und 0 % unter Placebo).
Bipolare Ich-Manie
Die Inzidenz von Behandlungsabbrüchen aufgrund von Nebenwirkungen betrug bei mit Quetiapin behandelten und mit Placebo behandelten Patienten 11,4 % bzw. 4,4 %. Die Nebenwirkungen, die bei 2 % oder mehr der Patienten unter SEROQUEL und häufiger als unter Placebo zum Absetzen führten, waren Somnolenz (4,1 % vs. 1,1 %) und Müdigkeit (2,1 % vs. 0).
Häufig beobachtete Nebenwirkungen in placebokontrollierten Kurzzeitstudien
Bei der Behandlung von Schizophrenie (bis zu 6 Wochen) waren die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von Quetiapin bei Jugendlichen (Inzidenz von 5 % oder mehr und Quetiapin-Inzidenz mindestens doppelt so hoch wie unter Placebo) Schläfrigkeit (34 %) und Schwindel (12 %), Mundtrockenheit (7 %), Tachykardie (7 %).
In der Therapie der bipolaren Manie (bis zu 3 Wochen) waren die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von Quetiapin bei Kindern und Jugendlichen (Inzidenz von 5 % oder mehr und Quetiapin-Inzidenz mindestens doppelt so hoch wie unter Placebo) Schläfrigkeit (53 %), Schwindel (18 %), Müdigkeit (11 %), gesteigerter Appetit (9 %), Übelkeit (8 %), Erbrechen (8 %), Tachykardie (7 %), Mundtrockenheit (7 %) und Gewichtszunahme (6 % ).
In einer akuten (8-wöchigen) Studie mit SEROQUEL 100 mg XR bei Kindern und Jugendlichen (10-17 Jahre) mit bipolarer Depression, in der die Wirksamkeit nicht nachgewiesen wurde, waren die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von SEROQUEL XR (Inzidenz von 5 % oder mehr und mindestens doppelt so hoch wie unter Placebo) waren Schwindel 7 %, Durchfall 5 %, Müdigkeit 5 % und Übelkeit 5 %.
Nebenwirkungen, die bei mit SEROQUEL 300 mg behandelten Patienten in Placebo-kontrollierten Kurzzeitstudien mit einer Inzidenz von ≥ 2 % auftraten
Schizophrenie (Jugendliche, 13-17 Jahre)
Die folgenden Ergebnisse basieren auf einer 6-wöchigen placebokontrollierten Studie, in der Quetiapin entweder in Dosen von 400 oder 800 mg/Tag verabreicht wurde.
Tabelle 13 führt die auf den nächsten Prozent gerundete Häufigkeit von Nebenwirkungen auf, die während der Therapie (bis zu 6 Wochen) der Schizophrenie bei 2 % oder mehr der mit SEROQUEL (Dosen von 400 oder 800 mg/Tag) behandelten Patienten auftraten, wobei die Häufigkeit angegeben ist bei mit SEROQUEL behandelten Patienten war mindestens doppelt so häufig wie bei mit Placebo behandelten Patienten.
Nebenwirkungen, die in der 800-mg-Gruppe häufiger dosisabhängig waren als in der 400-mg-Gruppe, waren Schwindel (8 % vs. 15 %), Mundtrockenheit (4 % vs. 10 %) und Tachykardie (6 % vs .11%).
Bipolar I Mania (Kinder und Jugendliche im Alter von 10-17 Jahren)
Die folgenden Ergebnisse basieren auf einer 3-wöchigen placebokontrollierten Studie, in der Quetiapin entweder in Dosen von 400 oder 600 mg/Tag verabreicht wurde.
Häufig beobachtete Nebenwirkungen
In der Therapie der bipolaren Manie (bis zu 3 Wochen) waren die am häufigsten beobachteten Nebenwirkungen im Zusammenhang mit der Anwendung von Quetiapin bei Kindern und Jugendlichen (Inzidenz von 5 % oder mehr und Quetiapin-Inzidenz mindestens doppelt so hoch wie unter Placebo) Schläfrigkeit (53 %), Schwindel (18 %), Müdigkeit (11 %), gesteigerter Appetit (9 %), Übelkeit (8 %), Erbrechen (8 %), Tachykardie (7 %), Mundtrockenheit (7 %) und Gewichtszunahme (6 % ).
Tabelle 14 führt die auf den nächsten Prozentsatz gerundete Häufigkeit von Nebenwirkungen auf, die während der Therapie (bis zu 3 Wochen) der bipolaren Manie bei 2 % oder mehr der mit SEROQUEL (Dosen von 400 oder 600 mg/Tag) behandelten Patienten auftraten, wobei die Die Inzidenz bei mit SEROQUEL behandelten Patienten war höher als die Inzidenz bei mit Placebo behandelten Patienten.
Nebenwirkungen, die in der 600-mg-Gruppe häufiger dosisabhängig waren als in der 400-mg-Gruppe, waren Schläfrigkeit (50 % vs. 57 %), Übelkeit (6 % vs. 10 %) und Tachykardie (6 % vs. 9 %).
Extrapyramidale Symptome
In einer Placebo-kontrollierten Kurzzeit-Monotherapiestudie bei jugendlichen Patienten mit Schizophrenie (Dauer 6 Wochen) betrug die aggregierte Inzidenz extrapyramidaler Symptome 12,9 % (19/147) für SEROQUEL 100 mg und 5,3 % (4/75) für Placebo. obwohl die Inzidenz der einzelnen Nebenwirkungen (Akathisie, Tremor, extrapyramidale Störung, Hypokinesie, Ruhelosigkeit, psychomotorische Hyperaktivität, Muskelrigidität, Dyskinesie) in keiner Behandlungsgruppe 4,1 % überstieg. In einer Placebo-kontrollierten Kurzzeit-Monotherapiestudie bei Kindern und Jugendlichen mit bipolarer Manie (Dauer: 3 Wochen) betrug die aggregierte Inzidenz extrapyramidaler Symptome 3,6 % (7/193) für SEROQUEL und 1,1 % (1/90) für Placebo.
Tabelle 15 enthält eine Liste von Patienten mit Nebenwirkungen, die möglicherweise mit extrapyramidalen Symptomen in der Placebo-kontrollierten Kurzzeit-Monotherapiestudie bei jugendlichen Patienten mit Schizophrenie (Dauer 6 Wochen) verbunden waren.
In den Tabellen 15–16 umfassten dystonische Ereignisse Nackensteifigkeit, Hypertonie und Muskelsteifheit; Parkinsonismus umfasste Zahnradstarrheit und Zittern; Akathisie schloss nur Akathisie ein; dyskinetisches Ereignis umfasste tardive Dyskinesie, Dyskinesie und Choreoathetose; und andere extrapyramidale Ereignisse umfassten Unruhe und extrapyramidale Störungen.
Tabelle 16 zeigt eine Liste von Patienten mit Nebenwirkungen im Zusammenhang mit extrapyramidalen Symptomen in einer Placebo-kontrollierten Kurzzeit-Monotherapiestudie bei Kindern und Jugendlichen mit bipolarer Manie (Dauer: 3 Wochen).
Labor-, EKG- und Vitalzeichenveränderungen, die in klinischen Studien beobachtet wurden
Änderungen im Labor
Anzahl der Neutrophilen
Erwachsene
In placebokontrollierten klinischen Studien zur Monotherapie mit 3368 Patienten unter Quetiapinfumarat und 1515 unter Placebo war die Inzidenz von mindestens einem Auftreten einer Neutrophilenzahl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Transaminasenerhöhungen
Erwachsene
Asymptomatische, vorübergehende und reversible Erhöhungen der Serumtransaminasen (hauptsächlich ALT) wurden berichtet. In Schizophrenie-Studien bei Erwachsenen betrug der Anteil der Patienten mit Transaminase-Erhöhungen um mehr als das Dreifache der oberen Grenzen des normalen Referenzbereichs in einem Pool von 3- bis 6-wöchigen placebokontrollierten Studien etwa 6 % (29/483) für SEROQUEL verglichen mit 1 % (3/194) bei Placebo. In Studien zur akuten bipolaren Manie bei Erwachsenen betrug der Anteil der Patienten mit Transaminase-Erhöhungen von > dem Dreifachen der Obergrenzen des normalen Referenzbereichs in einem Pool von 3- bis 12-wöchigen placebokontrollierten Studien etwa 1 % für beide SEROQUEL (3 /560) und Placebo (3/294). Diese Leberenzymerhöhungen traten normalerweise innerhalb der ersten 3 Wochen der medikamentösen Behandlung auf und kehrten bei fortlaufender Behandlung mit SEROQUEL umgehend auf die Werte vor der Studie zurück. In Studien zu bipolaren Depressionen betrug der Anteil der Patienten mit Transaminase-Erhöhungen um mehr als das Dreifache der oberen Grenzen des normalen Referenzbereichs in zwei 8-wöchigen placebokontrollierten Studien 1 % (5/698) für SEROQUEL 50 mg und 2 % (6/ 347) für Placebo.
Vermindertes Hämoglobin
Erwachsene
In placebokontrollierten Kurzzeitstudien kam es bei 8,3 % (594/7155) der mit Quetiapin behandelten Patienten mindestens einmal zu einem Abfall des Hämoglobins auf ≤ 13 g/dl bei Männern, ≤ 12 g/dl bei Frauen im Vergleich zu 6,2 % ( 219/3536) von mit Placebo behandelten Patienten. In einer Datenbank kontrollierter und unkontrollierter klinischer Studien kam es bei 11 % (2277/20729) der mit Quetiapin behandelten Patienten mindestens einmal zu einem Abfall des Hämoglobins auf ≤ 13 g/dl bei Männern und ≤ 12 g/dl bei Frauen.
Interferenz mit Urin-Drug-Screens
Es gibt Literaturberichte, die auf falsch positive Ergebnisse in Urin-Enzymimmunoassays für Methadon und trizyklische Antidepressiva bei Patienten hindeuten, die Quetiapin eingenommen haben. Bei der Interpretation positiver Urin-Drogenscreening-Ergebnisse für diese Medikamente ist Vorsicht geboten, und eine Bestätigung durch alternative Analyseverfahren (z. B. chromatographische Methoden) sollte in Betracht gezogen werden.
EKG-Veränderungen
Erwachsene
Vergleiche zwischen den Gruppen für gepoolte placebokontrollierte Studien ergaben keine statistisch signifikanten SEROQUEL/Placebo-Unterschiede in den Anteilen der Patienten, bei denen potenziell wichtige Veränderungen der EKG-Parameter, einschließlich QT-, QTc- und PR-Intervalle, auftraten. Die Anteile der Patienten, die die Kriterien für Tachykardie erfüllten, wurden jedoch in vier 3- bis 6-wöchigen placebokontrollierten klinischen Studien zur Behandlung von Schizophrenie verglichen, die eine Inzidenz von 1 % (4/399) für SEROQUEL 100 mg im Vergleich zu 0,6 % (1 /156) Inzidenz für Placebo. In Studien zu akuter (Monotherapie) bipolarer Manie betrug der Anteil der Patienten, die die Kriterien für eine Tachykardie erfüllten, 0,5 % (1/192) für SEROQUEL 200 mg im Vergleich zu 0 % (0/178) für Placebo. In Studien zur akuten bipolaren Manie (zusätzlich) betrug der Anteil der Patienten, die die gleichen Kriterien erfüllten, 0,6 % (1/166) für SEROQUEL 100 mg im Vergleich zu 0 % (0/171) für Placebo. In Studien zu bipolaren Depressionen kam es bei keinem Patienten zu einem Anstieg der Herzfrequenz auf > 120 Schläge pro Minute. Die Anwendung von SEROQUEL 50 mg war mit einem durchschnittlichen Anstieg der Herzfrequenz, bestimmt durch EKG, von 7 Schlägen pro Minute verbunden, verglichen mit einem durchschnittlichen Anstieg von 1 Schlag pro Minute bei Placebo-Patienten. Diese leichte Neigung zu Tachykardie bei Erwachsenen kann mit dem Potenzial von SEROQUEL zusammenhängen, orthostatische Veränderungen hervorzurufen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Kinder und Jugendliche
In der akuten (6-wöchigen) Schizophrenie-Studie bei Jugendlichen trat bei 5,2 % (3/73) der Patienten, die SEROQUEL 400 mg erhielten, und bei 8,5 % (5/74) der Patienten, die SEROQUEL 800 erhielten, ein Anstieg der Herzfrequenz (> 110 bpm) auf mg im Vergleich zu 0 % (0/75) der Patienten, die Placebo erhielten. Die durchschnittliche Zunahme der Herzfrequenz betrug 3,8 bpm bzw. 11,2 bpm in der Gruppe mit SEROQUEL 400 mg bzw. 800 mg, verglichen mit einer Abnahme um 3,3 bpm in der Placebogruppe [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
In der akuten (3-wöchigen) Studie zur bipolaren Manie bei Kindern und Jugendlichen trat bei 1,1 % (1/89) der Patienten, die SEROQUEL 400 mg erhielten, und bei 4,7 % (4/85) der Patienten ein Anstieg der Herzfrequenz (> 110 bpm) auf die SEROQUEL 600 mg erhielten, im Vergleich zu 0 % (0/98) der Patienten, die Placebo erhielten. Die durchschnittliche Zunahme der Herzfrequenz betrug 12,8 bpm und 13,4 bpm in der Gruppe mit SEROQUEL 400 mg bzw. 600 mg, verglichen mit einer Abnahme um 1,7 bpm in der Placebogruppe [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
In einer akuten (8-wöchigen) Studie mit SEROQUEL XR bei Kindern und Jugendlichen (10-17 Jahre) mit bipolarer Depression, in der die Wirksamkeit nicht nachgewiesen wurde, kam es zu Anstiegen der Herzfrequenz (>110 bpm 10-12 Jahre und 13-17 Jahre) traten bei 0 % der mit SEROQUEL XR behandelten Patienten und bei 1,2 % der mit Placebo behandelten Patienten auf. Der mittlere Anstieg der Herzfrequenz betrug 3,4 bpm für SEROQUEL XR, verglichen mit 0,3 bpm in der Placebogruppe [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden nach der Zulassung von SEROQUEL identifiziert. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Seit der Markteinführung berichtete Nebenwirkungen, die in zeitlichem Zusammenhang mit der Quetiapin-Therapie standen, umfassen anaphylaktische Reaktionen, Kardiomyopathie, Arzneimittelreaktionen mit Eosinophilie und systemischen Symptomen (DRESS), Hyponatriämie, Myokarditis, nächtliches Einnässen, Pankreatitis, retrograde Amnesie, Rhabdomyolyse, Syndrom der inadäquaten ADH-Sekretion (SIADH), Stevens-Johnson-Syndrom (SJS), toxische epidermale Nekrolyse (TEN), verringerte Thrombozytenzahl, schwere Leberreaktionen (einschließlich Hepatitis, Lebernekrose und Leberversagen), Agranulozytose, Darmverschluss, Ileus, Dickdarmischämie, Harnverhalt , Schlafapnoe und akute generalisierte exanthematische Pustulose (AGEP).
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Wirkung anderer Medikamente auf Quetiapin
Die Risiken der Anwendung von SEROQUEL in Kombination mit anderen Arzneimitteln wurden nicht umfassend in systematischen Studien untersucht. Angesichts der primären ZNS-Wirkung von SEROQUEL ist Vorsicht geboten, wenn es in Kombination mit anderen zentral wirkenden Arzneimitteln eingenommen wird. SEROQUEL 300 mg potenzierte die kognitiven und motorischen Wirkungen von Alkohol in einer klinischen Studie bei Patienten mit ausgewählten psychotischen Störungen, und alkoholische Getränke sollten während der Einnahme von Quetiapin begrenzt werden.
Die Quetiapin-Exposition wird durch die Prototyp-CYP3A4-Inhibitoren (z. B. Ketoconazol, Itraconazol, Indinavir, Ritonavir, Nefazodon usw.) erhöht und durch die Prototyp-CYP3A4-Induktoren (z. B. Phenytoin, Carbamazepin, Rifampin, Avasimibe, Johanniskraut usw.) verringert. . Eine Dosisanpassung von Quetiapin ist erforderlich, wenn es gleichzeitig mit starken CYP3A4-Induktoren oder -Inhibitoren verabreicht wird.
CYP3A4-Inhibitoren
Die gleichzeitige Verabreichung von Ketoconazol, einem potenten Inhibitor des Cytochroms CYP3A4, führte zu einem signifikanten Anstieg der Quetiapin-Exposition. Die Dosis von SEROQUEL 200 mg sollte bei gleichzeitiger Anwendung mit einem starken CYP3A4-Hemmer auf ein Sechstel der ursprünglichen Dosis reduziert werden [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
CYP3A4-Induktoren
Die gleichzeitige Verabreichung von Quetiapin und Phenytoin, einem CYP3A4-Induktor, erhöhte die mittlere orale Clearance von Quetiapin um das Fünffache. Bei Patienten, die Quetiapin und Phenytoin oder andere bekannte potente CYP3A4-Induktoren erhalten, können erhöhte Dosen von SEROQUEL 50 mg bis zum 5-fachen erforderlich sein, um die Symptome der Schizophrenie unter Kontrolle zu halten [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ]. Wenn der CYP3A4-Induktor abgesetzt wird, sollte die Dosis von SEROQUEL 25 mg innerhalb von 7-14 Tagen auf das ursprüngliche Niveau reduziert werden [siehe DOSIERUNG UND ANWENDUNG ].
Die potenziellen Wirkungen mehrerer Begleitmedikationen auf die Pharmakokinetik von Quetiapin wurden untersucht [siehe KLINISCHE PHARMAKOLOGIE ].
Wirkung von Quetiapin auf andere Medikamente
Aufgrund seines Potenzials zur Induktion von Hypotonie kann SEROQUEL 50 mg die Wirkung bestimmter Antihypertonika verstärken.
SEROQUEL 25 mg kann die Wirkung von Levodopa und Dopaminagonisten antagonisieren.
Es gibt keine klinisch relevanten pharmakokinetischen Wechselwirkungen von Seroquel mit anderen Arzneimitteln, die auf dem CYP-Weg beruhen. Seroquel 50 mg und seine Metaboliten sind keine Inhibitoren der wichtigsten metabolisierenden CYPs (1A2, 2C9, 2C19, 2D6 und 3A4).
Drogenmissbrauch und -abhängigkeit
Kontrollierte Substanz
SEROQUEL ist keine kontrollierte Substanz.
Missbrauch
SEROQUEL wurde nicht systematisch an Tieren oder Menschen auf sein Potenzial für Missbrauch, Toleranz oder körperliche Abhängigkeit untersucht. Während die klinischen Studien keine Tendenz zu Drogensuchtverhalten aufzeigten, waren diese Beobachtungen nicht systematisch und es ist nicht möglich, auf der Grundlage dieser begrenzten Erfahrung vorherzusagen, in welchem Ausmaß ein ZNS-aktives Medikament missbraucht, abgezweigt, und/oder nach der Vermarktung missbraucht werden. Folglich sollten Patienten sorgfältig auf Drogenmissbrauch in der Vorgeschichte untersucht werden, und solche Patienten sollten engmaschig auf Anzeichen von Missbrauch oder Missbrauch von SEROQUEL beobachtet werden, z. B. Toleranzentwicklung, Dosissteigerungen, Suchtverhalten.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Erhöhte Sterblichkeit bei älteren Patienten mit demenzbedingter Psychose
Ältere Patienten mit demenzbedingter Psychose, die mit Antipsychotika behandelt werden, haben ein erhöhtes Sterberisiko. Die Analyse von 17 placebokontrollierten Studien (modale Dauer von 10 Wochen), hauptsächlich bei Patienten, die atypische Antipsychotika einnahmen, ergab ein Todesrisiko bei mit Arzneimitteln behandelten Patienten, das zwischen dem 1,6- und 1,7-fachen des Todesrisikos bei mit Placebo behandelten Patienten lag. Im Verlauf einer typischen 10-wöchigen kontrollierten Studie betrug die Todesrate bei mit Arzneimitteln behandelten Patienten etwa 4,5 %, verglichen mit einer Rate von etwa 2,6 % in der Placebogruppe. Obwohl die Todesursachen unterschiedlich waren, schienen die meisten Todesfälle entweder kardiovaskulärer (z. B. Herzinsuffizienz, plötzlicher Tod) oder infektiöser (z. B. Lungenentzündung) Natur zu sein. Beobachtungsstudien deuten darauf hin, dass die Behandlung mit konventionellen Antipsychotika, ähnlich wie bei atypischen Antipsychotika, die Sterblichkeit erhöhen kann. Inwieweit die Befunde einer erhöhten Sterblichkeit in Beobachtungsstudien auf das Antipsychotikum im Gegensatz zu einigen Merkmalen der Patienten zurückgeführt werden können, ist nicht klar. SEROQUEL ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen [siehe Eingerahmte Warnung ].
Suizidgedanken und -verhalten bei Jugendlichen und jungen Erwachsenen
Bei Patienten mit schwerer depressiver Störung (MDD), sowohl bei Erwachsenen als auch bei Kindern, kann es zu einer Verschlechterung ihrer Depression und/oder zum Auftreten von Suizidgedanken und -verhalten (Suizidalität) oder zu ungewöhnlichen Verhaltensänderungen kommen, unabhängig davon, ob sie Antidepressiva einnehmen oder nicht Das Risiko kann bestehen bleiben, bis eine signifikante Remission eintritt. Selbstmord ist ein bekanntes Risiko für Depressionen und bestimmte andere psychiatrische Störungen, und diese Störungen selbst sind die stärksten Prädiktoren für Selbstmord. Es besteht jedoch seit langem die Sorge, dass Antidepressiva bei bestimmten Patienten in den frühen Phasen der Behandlung eine Rolle bei der Induktion einer Verschlechterung der Depression und dem Auftreten von Suizidalität spielen könnten. Gepoolte Analysen von Placebo-kontrollierten Kurzzeitstudien mit Antidepressiva (SSRIs und andere) zeigten, dass diese Medikamente das Risiko von Suizidgedanken und -verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen (18-24 Jahre) mit Major Depression erhöhen Störung (MDD) und andere psychiatrische Störungen. Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; bei Erwachsenen ab 65 Jahren kam es unter Antidepressiva im Vergleich zu Placebo zu einer Reduktion.
Die gepoolten Analysen placebokontrollierter Studien bei Kindern und Jugendlichen mit MDD, Zwangsstörungen (OCD) oder anderen psychiatrischen Erkrankungen umfassten insgesamt 24 Kurzzeitstudien mit 9 Antidepressiva bei über 4400 Patienten. Die gepoolten Analysen placebokontrollierter Studien bei Erwachsenen mit MDD oder anderen psychiatrischen Erkrankungen umfassten insgesamt 295 Kurzzeitstudien (mediane Dauer von 2 Monaten) mit 11 Antidepressiva bei über 77.000 Patienten. Es gab beträchtliche Schwankungen des Suizidalitätsrisikos zwischen den Medikamenten, aber bei fast allen untersuchten Medikamenten eine Tendenz zu einem Anstieg bei den jüngeren Patienten. Es gab Unterschiede im absoluten Suizidalitätsrisiko zwischen den verschiedenen Indikationen, mit der höchsten Inzidenz bei MDD. Die Risikounterschiede (Medikament vs. Placebo) waren jedoch relativ stabil innerhalb der Altersschichten und über Indikationen hinweg. Diese Risikounterschiede (Arzneimittel-Placebo-Unterschied in der Anzahl der Fälle von Suizidalität pro 1000 behandelten Patienten) sind in Tabelle 2 aufgeführt.
In keiner der pädiatrischen Studien kam es zu Suiziden. In den Studien mit Erwachsenen gab es Suizide, aber die Anzahl reichte nicht aus, um zu einer Schlussfolgerung über die Wirkung des Medikaments auf Suizide zu gelangen.
Es ist nicht bekannt, ob sich das Suizidrisiko auf eine längerfristige Anwendung erstreckt, dh über mehrere Monate hinaus. Es gibt jedoch erhebliche Hinweise aus placebokontrollierten Erhaltungsstudien bei Erwachsenen mit Depressionen, dass die Anwendung von Antidepressiva das Wiederauftreten von Depressionen verzögern kann.
Alle Patienten, die mit Antidepressiva aus beliebigen Indikationen behandelt werden, sollten angemessen überwacht und engmaschig auf eine klinische Verschlechterung, Suizidalität und ungewöhnliche Verhaltensänderungen beobachtet werden, insbesondere während der ersten Monate einer medikamentösen Therapie oder bei Dosisänderungen oder -steigerungen oder abnimmt.
Die folgenden Symptome, Angst, Agitiertheit, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Ruhelosigkeit), Hypomanie und Manie, wurden bei erwachsenen und pädiatrischen Patienten berichtet, die ebenfalls mit Antidepressiva wegen schwerer depressiver Störung behandelt wurden wie für andere Indikationen, sowohl psychiatrische als auch nicht-psychiatrische. Obwohl ein kausaler Zusammenhang zwischen dem Auftreten solcher Symptome und entweder der Verschlechterung einer Depression und/oder dem Auftreten suizidaler Impulse nicht hergestellt werden konnte, besteht die Sorge, dass solche Symptome Vorboten einer aufkommenden Suizidalität sein könnten.
Bei Patienten, deren Depression sich anhaltend verschlimmert oder die an Suizidalität oder Symptomen leiden, die Vorboten einer Verschlechterung der Depression oder Suizidalität sein könnten, sollte eine Änderung des therapeutischen Schemas, einschließlich eines möglichen Absetzens der Medikation, in Betracht gezogen werden, insbesondere wenn diese Symptome schwerwiegend und abrupt sind zu Beginn oder waren nicht Teil der Symptome des Patienten.
Familien und Betreuer von Patienten, die wegen einer schweren depressiven Störung oder anderen psychiatrischen und nicht-psychiatrischen Indikationen mit Antidepressiva behandelt werden, sollten auf die Notwendigkeit aufmerksam gemacht werden, die Patienten auf das Auftreten von Unruhe, Reizbarkeit, ungewöhnlichen Verhaltensänderungen und anderen Symptomen zu überwachen wie oben beschrieben, sowie das Auftreten von Suizidalität, und solche Symptome unverzüglich dem Gesundheitsdienstleister zu melden. Eine solche Überwachung sollte die tägliche Beobachtung durch Familien und Betreuer umfassen. Verschreibungen für SEROQUEL sollten für die kleinste Tablettenmenge im Einklang mit einem guten Patientenmanagement ausgestellt werden, um das Risiko einer Überdosierung zu verringern.
Screening von Patienten auf bipolare Störungen
Eine schwere depressive Episode kann die anfängliche Präsentation einer bipolaren Störung sein. Es wird allgemein angenommen (obwohl dies nicht in kontrollierten Studien nachgewiesen wurde), dass die Behandlung einer solchen Episode mit einem Antidepressivum allein die Wahrscheinlichkeit des Auftretens einer gemischten/manischen Episode bei Patienten mit einem Risiko für eine bipolare Störung erhöhen kann. Ob eines der oben beschriebenen Symptome eine solche Konversion darstellt, ist unbekannt. Vor Beginn der Behandlung mit einem Antidepressivum, einschließlich SEROQUEL, sollten Patienten mit depressiven Symptomen jedoch angemessen untersucht werden, um festzustellen, ob bei ihnen ein Risiko für eine bipolare Störung besteht; Ein solches Screening sollte eine detaillierte psychiatrische Vorgeschichte umfassen, einschließlich einer Familienanamnese von Selbstmord, bipolarer Störung und Depression.
Zerebrovaskuläre Nebenwirkungen, einschließlich Schlaganfall, bei älteren Patienten mit demenzbedingter Psychose
In placebokontrollierten Studien mit Risperidon, Aripiprazol und Olanzapin bei älteren Patienten mit Demenz traten im Vergleich zu den mit Placebo behandelten Patienten häufiger zerebrovaskuläre Nebenwirkungen (zerebrovaskuläre Insultate und transitorische ischämische Attacken) auf, einschließlich Todesfälle. SEROQUEL ist nicht für die Behandlung von Patienten mit demenzbedingter Psychose zugelassen [siehe auch Eingerahmte Warnung und Erhöhte Sterblichkeit bei älteren Patienten mit demenzbedingter Psychose ].
Malignes neuroleptisches Syndrom (NMS)
Im Zusammenhang mit der Verabreichung von Antipsychotika, einschließlich SEROQUEL, wurde über einen potenziell tödlichen Symptomkomplex berichtet, der manchmal als malignes neuroleptisches Syndrom (NMS) bezeichnet wird. Unter SEROQUEL wurden seltene Fälle von NMS berichtet. Klinische Manifestationen von NMS sind Hyperpyrexie, Muskelrigidität, veränderter Geisteszustand und Anzeichen einer autonomen Instabilität (unregelmäßiger Puls oder Blutdruck, Tachykardie, Diaphorese und Herzrhythmusstörungen). Zusätzliche Anzeichen können erhöhte Kreatininphosphokinase, Myoglobinurie (Rhabdomyolyse) und akutes Nierenversagen sein.
Die diagnostische Beurteilung von Patienten mit diesem Syndrom ist kompliziert. Um zu einer Diagnose zu gelangen, ist es wichtig, Fälle auszuschließen, in denen das klinische Erscheinungsbild sowohl eine schwere medizinische Erkrankung (z. B. Lungenentzündung, systemische Infektion usw.) als auch unbehandelte oder unzureichend behandelte extrapyramidale Zeichen und Symptome (EPS) umfasst. Weitere wichtige Erwägungen bei der Differentialdiagnose sind zentrale anticholinerge Toxizität, Hitzschlag, Drogenfieber und primäre Pathologie des Zentralnervensystems (ZNS).
Das Management von NMS sollte umfassen: 1) sofortiges Absetzen von Antipsychotika und anderen Arzneimitteln, die für eine gleichzeitige Therapie nicht unbedingt erforderlich sind; 2) intensive symptomatische Behandlung und medizinische Überwachung; und 3) Behandlung aller begleitenden schwerwiegenden medizinischen Probleme, für die spezifische Behandlungen verfügbar sind. Es gibt keine allgemeine Einigung über spezifische pharmakologische Behandlungsschemata für NMS.
Wenn ein Patient nach Genesung von NMS eine antipsychotische medikamentöse Behandlung benötigt, sollte die mögliche Wiederaufnahme der medikamentösen Therapie sorgfältig erwogen werden. Der Patient sollte sorgfältig überwacht werden, da Rezidive von NMS berichtet wurden.
Stoffwechselveränderungen
Atypische Antipsychotika wurden mit metabolischen Veränderungen wie Hyperglykämie/Diabetes mellitus, Dyslipidämie und Körpergewichtszunahme in Verbindung gebracht. Obwohl gezeigt wurde, dass alle Medikamente dieser Klasse einige metabolische Veränderungen hervorrufen, hat jedes Medikament sein eigenes spezifisches Risikoprofil. Bei einigen Patienten wurde in klinischen Studien eine Verschlechterung von mehr als einem der Stoffwechselparameter Gewicht, Blutzucker und Lipide beobachtet. Änderungen dieser Stoffwechselprofile sollten klinisch angemessen behandelt werden.
Hyperglykämie und Diabetes mellitus
Hyperglykämie, in einigen Fällen extrem und mit Ketoazidose oder hyperosmolarem Koma oder Tod verbunden, wurde bei Patienten berichtet, die mit atypischen Antipsychotika, einschließlich Quetiapin, behandelt wurden. Die Beurteilung des Zusammenhangs zwischen der atypischen Anwendung von Antipsychotika und Glukoseanomalien wird durch die Möglichkeit eines erhöhten Hintergrundrisikos für Diabetes mellitus bei Patienten mit Schizophrenie und die zunehmende Inzidenz von Diabetes mellitus in der Allgemeinbevölkerung erschwert. Angesichts dieser Confounder ist die Beziehung zwischen der atypischen Anwendung von Antipsychotika und Hyperglykämie-bedingten Nebenwirkungen nicht vollständig geklärt. Epidemiologische Studien deuten jedoch auf ein erhöhtes Risiko für Hyperglykämie-bedingte Nebenwirkungen bei Patienten hin, die mit atypischen Antipsychotika behandelt werden. Präzise Risikoabschätzungen für Hyperglykämie-bedingte Nebenwirkungen bei Patienten, die mit atypischen Antipsychotika behandelt werden, sind nicht verfügbar.
Patienten mit einer gesicherten Diagnose von Diabetes mellitus, die mit atypischen Antipsychotika begonnen werden, sollten regelmäßig auf eine Verschlechterung der Glukosekontrolle überwacht werden. Patienten mit Risikofaktoren für Diabetes mellitus (z. B. Fettleibigkeit, Diabetes in der Familienanamnese), die eine Behandlung mit atypischen Antipsychotika beginnen, sollten zu Beginn der Behandlung und in regelmäßigen Abständen während der Behandlung einer Nüchtern-Blutzuckermessung unterzogen werden. Jeder Patient, der mit atypischen Antipsychotika behandelt wird, sollte auf Symptome einer Hyperglykämie einschließlich Polydipsie, Polyurie, Polyphagie und Schwäche überwacht werden. Patienten, die während der Behandlung mit atypischen Antipsychotika Symptome einer Hyperglykämie entwickeln, sollten sich einer Nüchtern-Blutzuckermessung unterziehen. In einigen Fällen klang die Hyperglykämie ab, wenn das atypische Antipsychotikum abgesetzt wurde; Einige Patienten benötigten jedoch trotz Absetzens des verdächtigen Medikaments eine Fortsetzung der antidiabetischen Behandlung.
Erwachsene
In einer 24-wöchigen Studie (aktiv kontrolliert, 115 mit SEROQUEL behandelte Patienten), die darauf ausgelegt war, den glykämischen Status mit oralen Glukosetoleranztests bei allen Patienten zu bewerten, betrug die Inzidenz eines Glukosespiegels nach der Glukosebelastung in Woche 24 ≥ 200 mg/dl 1,7 % und die Inzidenz eines Nüchtern-Blutzuckerspiegels ≥ 126 mg/dl betrug 2,6 %. Die mittlere Veränderung des Nüchternglukosespiegels gegenüber dem Ausgangswert betrug 3,2 mg/dl und die mittlere Veränderung des 2-Stunden-Glukosespiegels gegenüber dem Ausgangswert betrug -1,8 mg/dl für Quetiapin.
In 2 placebokontrollierten, randomisierten klinischen Langzeit-Entzugsstudien zur Aufrechterhaltung der Bipolar-I-Störung, mittlere Exposition von 213 Tagen für SEROQUEL (646 Patienten) und 152 Tage für Placebo (680 Patienten), betrug die mittlere Veränderung des Glukosespiegels gegenüber dem Ausgangswert +5,0 mg /dL für SEROQUEL 100 mg und –0,05 mg/dL für Placebo. Die expositionsbereinigte Rate für jeden erhöhten Blutzuckerspiegel (≥ 126 mg/dl) bei Patienten, die mehr als 8 Stunden nach einer Mahlzeit vergangen waren (einige Patienten wurden jedoch möglicherweise nicht von der Kalorienaufnahme durch Flüssigkeiten während der Fastenzeit ausgeschlossen) betrug 18,0 pro 100 Patientenjahre für SEROQUEL (10,7 % der Patienten; n = 556) und 9,5 für Placebo pro 100 Patientenjahre (4,6 % der Patienten; n = 581).
Kinder und Jugendliche
In einer placebokontrollierten Monotherapiestudie mit SEROQUEL 25 mg an jugendlichen Patienten (13-17 Jahre) mit Schizophrenie (Dauer 6 Wochen) war die mittlere Veränderung der Nüchternglukosewerte für SEROQUEL (n = 138) im Vergleich zu Placebo (n = 67) betrug – 0,75 mg/dL gegenüber –1,70 mg/dL. In einer placebokontrollierten Monotherapiestudie mit SEROQUEL 300 mg bei Kindern und Jugendlichen (10–17 Jahre) mit bipolarer Manie (Dauer: 3 Wochen) war die mittlere Veränderung des Nüchternglukosespiegels für SEROQUEL (n = 170) im Vergleich zu Placebo (n =81) betrug 3,62 mg/dl gegenüber –1,17 mg/dl. Kein Patient in beiden Studien mit einem normalen Nüchternglukosespiegel (
In einer placebokontrollierten SEROQUEL XR-Monotherapiestudie (Dauer 8 Wochen) mit Kindern und jugendlichen Patienten (1017 Jahre) mit bipolarer Depression, in der die Wirksamkeit nicht nachgewiesen wurde, war die mittlere Veränderung des Nüchternglukosespiegels für SEROQUEL 300 mg XR (n= 60) im Vergleich zu Placebo (n=62) betrug 1,8 mg/dl gegenüber 1,6 mg/dl. In dieser Studie gab es keine Patienten in den mit SEROQUEL XR oder Placebo behandelten Gruppen mit einem normalen Nüchternglukosespiegel ( 126 mg/dl aufwiesen. Es gab einen Patienten in der SEROQUEL 25 mg XR-Gruppe mit einem grenzwertigen Nüchternglukosewert (> 100 mg/dl und 126 mg/dl im Vergleich zu null Patienten in der Gruppe aufwies Placebo-Gruppe.
Dyslipidämie
Erwachsene
Tabelle 4 zeigt den Prozentsatz erwachsener Patienten mit Veränderungen des Gesamtcholesterins, der Triglyceride, des LDL-Cholesterins und des HDL-Cholesterins gegenüber dem Ausgangswert nach Indikation in klinischen Studien mit SEROQUEL.
Kinder und Jugendliche
Tabelle 5 zeigt den prozentualen Anteil von Kindern und Jugendlichen mit Veränderungen des Gesamtcholesterins, der Triglyzeride, des LDL-Cholesterins und des HDL-Cholesterins gegenüber dem Ausgangswert in klinischen Studien mit SEROQUEL.
In einer placebokontrollierten SEROQUEL XR-Monotherapiestudie (Dauer 8 Wochen) mit Kindern und Jugendlichen (1017 Jahre) mit bipolarer Depression, in der die Wirksamkeit nicht nachgewiesen wurde, war der Prozentsatz der Kinder und Jugendlichen mit Verschiebungen des Gesamtcholesterins (≥200 mg/dl), Triglyceride (≥ 150 mg/dl), LDL-Cholesterin (≥ 130 mg/dl) und HDL-Cholesterin (≤ 40 mg/dl) vom Ausgangswert bis zu klinisch signifikanten Werten: Gesamtcholesterin 8 % (7 /83) für SEROQUEL 50 mg XR vs. 6 % (5/84) für Placebo; Triglyceride 28 % (22/80) für SEROQUEL 100 mg XR vs. 9 % (7/82) für Placebo; LDL-Cholesterin 2 % (2/86) für SEROQUEL XR vs. 4 % (3/85) für Placebo und HDL-Cholesterin 20 % (13/65) für SEROQUEL XR vs. 15 % (11/74) für Placebo.
Gewichtszunahme
In klinischen Studien wurde eine Gewichtszunahme beobachtet. Patienten, die Quetiapin erhalten, sollten regelmäßig ihr Gewicht kontrollieren.
Erwachsene
In klinischen Studien mit SEROQUEL 50 mg wurde über folgende Gewichtszunahmen berichtet.
Kinder und Jugendliche
In zwei klinischen Studien mit SEROQUEL 25 mg, eine bei bipolarer Manie und eine bei Schizophrenie, sind die berichteten Gewichtszunahmen in Tabelle 7 enthalten.
Die mittlere Veränderung des Körpergewichts betrug in der Schizophrenie-Studie 2,0 kg in der SEROQUEL-25-mg-Gruppe und -0,4 kg in der Placebo-Gruppe und in der Bipolar-Mania-Studie 1,7 kg in der SEROQUEL-200-mg-Gruppe und 0,4 kg in der Placebo-Gruppe.
In einer offenen Studie, in die Patienten aus den beiden oben genannten pädiatrischen Studien aufgenommen wurden, beendeten 63 % der Patienten (241/380) eine 26-wöchige Therapie mit SEROQUEL. Nach 26-wöchiger Behandlung betrug die mittlere Zunahme des Körpergewichts 4,4 kg. 45 % der Patienten nahmen ≥ 7 % ihres Körpergewichts zu, nicht angepasst an normales Wachstum. Um ein normales Wachstum über 26 Wochen auszugleichen, wurde eine Erhöhung des BMI um mindestens 0,5 Standardabweichung vom Ausgangswert als Maß für eine klinisch signifikante Veränderung verwendet; 18,3 % der mit SEROQUEL behandelten Patienten erfüllten dieses Kriterium nach 26 Behandlungswochen.
In einer klinischen Studie mit SEROQUEL XR bei Kindern und Jugendlichen (10-17 Jahre) mit bipolarer Depression, in der die Wirksamkeit nicht nachgewiesen wurde, betrug der Prozentsatz der Patienten mit einer Gewichtszunahme von ≥ 7 % des Körpergewichts zu irgendeinem Zeitpunkt 15 % ( 14/92) für SEROQUEL 25 mg XR gegenüber 10 % (10/100) für Placebo. Die mittlere Veränderung des Körpergewichts betrug 1,4 kg in der Gruppe mit SEROQUEL 50 mg XR gegenüber 0,6 kg in der Placebogruppe.
Bei der Behandlung von pädiatrischen Patienten mit SEROQUEL 50 mg für jede Indikation sollte die Gewichtszunahme im Vergleich zu der erwarteten Gewichtszunahme bei normalem Wachstum beurteilt werden.
Tardive Dyskinesie
Bei Patienten, die mit Antipsychotika, einschließlich Quetiapin, behandelt werden, kann sich ein Syndrom potenziell irreversibler, unwillkürlicher, dyskinetischer Bewegungen entwickeln. Obwohl die Prävalenz des Syndroms bei älteren Menschen, insbesondere bei älteren Frauen, am höchsten zu sein scheint, ist es unmöglich, sich auf Prävalenzschätzungen zu verlassen, um zu Beginn einer antipsychotischen Behandlung vorherzusagen, welche Patienten wahrscheinlich das Syndrom entwickeln werden. Ob Antipsychotika sich in ihrem Potenzial unterscheiden, tardive Dyskinesie zu verursachen, ist nicht bekannt.
Es wird angenommen, dass das Risiko der Entwicklung einer tardiven Dyskinesie und die Wahrscheinlichkeit, dass sie irreversibel wird, mit der Dauer der Behandlung und der kumulativen Gesamtdosis der dem Patienten verabreichten Antipsychotika zunimmt. Das Syndrom kann sich jedoch, wenn auch viel seltener, nach relativ kurzen Behandlungszeiten bei niedrigen Dosen entwickeln oder sogar nach Absetzen der Behandlung auftreten.
Spätdyskinesie kann teilweise oder vollständig zurückgehen, wenn die antipsychotische Behandlung abgesetzt wird. Die antipsychotische Behandlung selbst kann jedoch die Anzeichen und Symptome des Syndroms unterdrücken (oder teilweise unterdrücken) und dadurch möglicherweise den zugrunde liegenden Prozess maskieren. Die Auswirkung der symptomatischen Unterdrückung auf den Langzeitverlauf des Syndroms ist unbekannt.
Angesichts dieser Überlegungen sollte SEROQUEL 50 mg so verschrieben werden, dass das Auftreten von tardiven Dyskinesien am wahrscheinlichsten minimiert wird. Eine chronische Behandlung mit Antipsychotika sollte im Allgemeinen Patienten vorbehalten bleiben, die anscheinend an einer chronischen Krankheit leiden, die (1) bekanntermaßen auf Antipsychotika anspricht und (2) für die alternative, ebenso wirksame, aber potenziell weniger schädliche Behandlungen nicht verfügbar oder angemessen sind . Bei Patienten, die eine chronische Behandlung benötigen, sollte die niedrigste Dosis und die kürzeste Behandlungsdauer angestrebt werden, die ein zufriedenstellendes klinisches Ansprechen bewirken. Die Notwendigkeit einer Fortsetzung der Behandlung sollte regelmäßig überprüft werden.

Wenn bei einem Patienten unter SEROQUEL 200 mg Anzeichen und Symptome einer tardiven Dyskinesie auftreten, sollte ein Absetzen des Arzneimittels in Erwägung gezogen werden. Einige Patienten können jedoch trotz des Vorliegens des Syndroms eine Behandlung mit SEROQUEL 200 mg benötigen.
Hypotonie
Quetiapin kann eine orthostatische Hypotonie hervorrufen, die mit Schwindel, Tachykardie und bei manchen Patienten mit Synkopen einhergeht, insbesondere während der Anfangsphase der Dosistitration, was wahrscheinlich seine α1-adrenergen antagonistischen Eigenschaften widerspiegelt. Synkopen wurden bei 1 % (28/3265) der mit SEROQUEL behandelten Patienten berichtet, verglichen mit 0,2 % (2/954) unter Placebo und etwa 0,4 % (2/527) unter aktiven Kontrollmedikamenten. Orthostatische Hypotonie, Schwindel und Synkopen können zu Stürzen führen.
SEROQUEL 25 mg sollte bei Patienten mit bekannter kardiovaskulärer Erkrankung (Myokardinfarkt oder ischämische Herzerkrankung in der Vorgeschichte, Herzinsuffizienz oder Reizleitungsstörungen), zerebrovaskulärer Erkrankung oder Zuständen, die Patienten für Hypotonie prädisponieren würden (Dehydratation, Hypovolämie und Behandlung mit blutdrucksenkende Medikamente). Das Risiko einer orthostatischen Hypotonie und Synkope kann minimiert werden, indem die Anfangsdosis auf 25 mg zweimal täglich begrenzt wird [siehe DOSIERUNG UND ANWENDUNG ]. Wenn während der Titration auf die Zieldosis eine Hypotonie auftritt, ist eine Rückkehr zur vorherigen Dosis im Titrationsplan angemessen.
Stürze
Atypische Antipsychotika, einschließlich SEROQUEL, können Somnolenz, posturale Hypotonie, motorische und sensorische Instabilität verursachen, was zu Stürzen und folglich zu Knochenbrüchen oder anderen Verletzungen führen kann. Führen Sie bei Patienten mit Krankheiten, Zuständen oder Medikamenten, die diese Wirkungen verschlimmern könnten, zu Beginn einer antipsychotischen Behandlung und wiederholt bei Patienten unter antipsychotischer Langzeittherapie eine Sturzrisikobewertung durch.
Anstieg des Blutdrucks (Kinder und Jugendliche)
In placebokontrollierten Studien bei Kindern und Jugendlichen mit Schizophrenie (Dauer 6 Wochen) oder bipolarer Manie (Dauer 3 Wochen) betrug die Inzidenz eines Anstiegs des systolischen Blutdrucks (≥ 20 mmHg) zu irgendeinem Zeitpunkt 15,2 % (51/335 ) für SEROQUEL 50 mg und 5,5 % (9/163) für Placebo; die Häufigkeit von Erhöhungen des diastolischen Blutdrucks (≥ 10 mmHg) zu irgendeinem Zeitpunkt betrug 40,6 % (136/335) für SEROQUEL und 24,5 % (40/163) für Placebo. In der 26-wöchigen offenen klinischen Studie erlitt ein Kind mit bekannter Vorgeschichte von Bluthochdruck eine hypertensive Krise. Der Blutdruck bei Kindern und Jugendlichen sollte zu Beginn und in regelmäßigen Abständen während der Behandlung gemessen werden.
In einer placebokontrollierten klinischen Studie mit SEROQUEL XR (Dauer 8 Wochen) bei Kindern und Jugendlichen (10-17 Jahre) mit bipolarer Depression, in der die Wirksamkeit nicht nachgewiesen wurde, war die Inzidenz von Anstiegen des systolischen Blutdrucks (≥ 20 mmHg) betrug 6,5 % (6/92) für SEROQUEL XR und 6,0 % (6/100) für Placebo; die Häufigkeit von Erhöhungen des diastolischen Blutdrucks (≥ 10 mmHg) zu irgendeinem Zeitpunkt betrug 46,7 % (43/92) für SEROQUEL 25 mg XR und 36,0 % (36/100) für Placebo.
Leukopenie, Neutropenie und Agranulozytose
In klinischen Studien und nach Markteinführung wurden Fälle von Leukopenie/Neutropenie in zeitlichem Zusammenhang mit atypischen Antipsychotika, einschließlich SEROQUEL, berichtet. Agranulozytose wurde berichtet.
Unter Quetiapin wurde über Agranulozytose (definiert als absolute Neutrophilenzahl
Mögliche Risikofaktoren für Leukopenie/Neutropenie sind eine vorbestehende niedrige Anzahl weißer Blutkörperchen (WBC) und eine arzneimittelinduzierte Leukopenie/Neutropenie in der Vorgeschichte. Bei Patienten mit vorbestehender niedriger Leukozytenzahl oder arzneimittelinduzierter Leukopenie/Neutropenie in der Vorgeschichte sollte ihr komplettes Blutbild (CBC) während der ersten Monate der Therapie häufig überwacht werden und SEROQUEL 50 mg beim ersten Anzeichen einer Abnahme der Leukozytenzahl abgesetzt werden Fehlen anderer ursächlicher Faktoren.
Patienten mit Neutropenie sollten sorgfältig auf Fieber oder andere Symptome oder Anzeichen einer Infektion überwacht und unverzüglich behandelt werden, wenn solche Symptome oder Anzeichen auftreten. Patienten mit schwerer Neutropenie (absolute Neutrophilenzahl
Grauer Star
Die Entwicklung von Katarakten wurde im Zusammenhang mit der Behandlung mit Quetiapin in Studien mit chronischen Hunden beobachtet [vgl Nichtklinische Toxikologie ]. Linsenveränderungen wurden auch bei Erwachsenen, Kindern und Jugendlichen während der Langzeitbehandlung mit SEROQUEL 100 mg beobachtet, aber ein kausaler Zusammenhang mit der Anwendung von SEROQUEL 200 mg wurde nicht hergestellt. Dennoch kann die Möglichkeit von Linsenveränderungen zum jetzigen Zeitpunkt nicht ausgeschlossen werden. Daher wird zu Beginn der Behandlung oder kurz danach und während einer Dauerbehandlung in Abständen von 6 Monaten eine Untersuchung der Linse mit Methoden empfohlen, die zum Nachweis einer Kataraktbildung geeignet sind, wie z. B. eine Spaltlampenuntersuchung oder andere angemessen empfindliche Methoden.
QT-Verlängerung
In klinischen Studien war Quetiapin nicht mit einer anhaltenden Verlängerung der QT-Intervalle verbunden. Der QT-Effekt wurde jedoch nicht systematisch in einer gründlichen QT-Studie evaluiert. Nach der Markteinführung wurden Fälle von QT-Verlängerung bei Patienten berichtet, die Quetiapin überdosiert hatten [siehe ÜBERDOSIS ], bei Patienten mit Begleiterkrankungen und bei Patienten, die Arzneimittel einnehmen, die bekanntermaßen ein Elektrolytungleichgewicht verursachen oder das QT-Intervall verlängern [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Die Anwendung von Quetiapin sollte in Kombination mit anderen Arzneimitteln vermieden werden, die bekanntermaßen das QTc verlängern, einschließlich Antiarrhythmika der Klasse 1A (z. B. Chinidin, Procainamid) oder Antiarrhythmika der Klasse III (z. B. Amiodaron, Sotalol), Antipsychotika (z. B. Ziprasidon, Chlorpromazin, Thioridazin), Antibiotika (z. B. Gatifloxacin, Moxifloxacin) oder jede andere Klasse von Medikamenten, von denen bekannt ist, dass sie das QTc-Intervall verlängern (z. B. Pentamidin, Levomethadylacetat, Methadon).
Quetiapin sollte auch unter Umständen vermieden werden, die das Risiko des Auftretens von Torsade de Pointes und/oder plötzlichem Tod erhöhen können, einschließlich (1) einer Vorgeschichte von Herzrhythmusstörungen wie Bradykardie; (2) Hypokaliämie oder Hypomagnesiämie; (3) gleichzeitige Anwendung anderer Arzneimittel, die das QTc-Intervall verlängern; und (4) Vorhandensein einer angeborenen Verlängerung des QT-Intervalls.
Vorsicht ist auch geboten, wenn Quetiapin Patienten mit erhöhtem Risiko einer QT-Verlängerung verschrieben wird (z. B. Herz-Kreislauf-Erkrankungen, QT-Verlängerung in der Familienanamnese, ältere Menschen, dekompensierte Herzinsuffizienz und Herzhypertrophie).
Krampfanfälle
Während klinischer Studien traten bei 0,5 % (20/3490) der mit SEROQUEL behandelten Patienten Krampfanfälle auf, verglichen mit 0,2 % (2/954) unter Placebo und 0,7 % (4/527) unter aktiven Kontrollmedikamenten. Wie andere Antipsychotika sollte SEROQUEL 25 mg bei Patienten mit Krampfanfällen in der Vorgeschichte oder mit Erkrankungen, die möglicherweise die Krampfschwelle senken, z. B. Alzheimer-Demenz, mit Vorsicht angewendet werden. Zustände, die die Anfallsschwelle senken, können in einer Bevölkerung von 65 Jahren oder älter häufiger auftreten.
Hypothyreose
Erwachsene
Klinische Studien mit Quetiapin zeigten dosisabhängige Abnahmen der Schilddrüsenhormonspiegel. Die Reduktion des Gesamt- und freien Thyroxins (T4) um etwa 20 % am oberen Ende des therapeutischen Dosisbereichs war in den ersten sechs Behandlungswochen maximal und blieb ohne Anpassung oder Progression während einer chronischeren Therapie bestehen. In fast allen Fällen war das Absetzen der Behandlung mit Quetiapin unabhängig von der Behandlungsdauer mit einer Umkehrung der Wirkungen auf Gesamt- und freies T4 verbunden. Der Mechanismus, durch den Quetiapin die Schilddrüsenachse beeinflusst, ist unklar. Wenn es eine Auswirkung auf die Hypothalamus-Hypophysen-Achse gibt, spiegelt die Messung von TSH allein möglicherweise nicht genau den Schilddrüsenstatus eines Patienten wider. Daher sollten sowohl TSH als auch freies T4 zusätzlich zur klinischen Beurteilung zu Studienbeginn und bei der Nachsorge gemessen werden.
In den Begleitstudien zur Manie, in denen SEROQUEL 50 mg zu Lithium oder Divalproex hinzugefügt wurde, hatten 12 % (24/196) der mit SEROQUEL 200 mg behandelten Patienten im Vergleich zu 7 % (15/203) der mit Placebo behandelten Patienten erhöhte TSH-Spiegel. Von den mit SEROQUEL 300 mg behandelten Patienten mit erhöhten TSH-Spiegeln hatten 3 gleichzeitig niedrige Werte von freiem T4 (freies T4
Bei etwa 0,7 % (26/3489) der SEROQUEL-Patienten kam es in Monotherapiestudien zu TSH-Anstiegen. Einige Patienten mit erhöhten TSH-Werten benötigten eine Schilddrüsenersatzbehandlung.
In allen Quetiapin-Studien betrug die Inzidenz von Veränderungen der Schilddrüsenhormone und des TSH1: Abnahme des freien T4 ( 5 mIU/l), 4,9 % (956/19412). Bei acht Patienten, bei denen TBG gemessen wurde, blieben die TBG-Spiegel unverändert.
Tabelle 8 zeigt die Inzidenz dieser Verschiebungen in placebokontrollierten klinischen Kurzzeitstudien.
In Placebo-kontrollierten Kurzzeit-Monotherapiestudien betrug die Inzidenz reziproker Verschiebungen von T3 und TSH 0,0 % für Quetiapin (1/4800) und Placebo (0/2190) und für T4 und TSH betrugen die Verschiebungen 0,1 % (7 /6154) für Quetiapin gegenüber 0,0 % (1/3007) für Placebo.
Kinder und Jugendliche
In akuten placebokontrollierten Studien bei Kindern und Jugendlichen mit Schizophrenie (Dauer 6 Wochen) oder bipolarer Manie (Dauer 3 Wochen) war die Inzidenz von Veränderungen der Schilddrüsenfunktionswerte zu jedem Zeitpunkt bei mit SEROQUEL 100 mg behandelten Patienten und bei mit Placebo behandelten Patienten bei erhöhtem TSH 2,9 % (8/280) vs. 0,7 % (1/138) und bei erniedrigtem Gesamtthyroxin 2,8 % (8/289) vs. 0 % (0/145). Von den mit SEROQUEL behandelten Patienten mit erhöhten TSH-Spiegeln hatte 1 gleichzeitig einen niedrigen freien T4-Spiegel am Ende der Behandlung.
Hyperprolaktinämie
Erwachsene
Während klinischer Studien mit Quetiapin kam es bei 3,6 % (158/4416) der mit Quetiapin behandelten Patienten im Vergleich zu 2,6 % (51/1968) unter Placebo zu Verschiebungen der Prolaktinspiegel auf einen klinisch signifikanten Wert.
Kinder und Jugendliche
In akuten placebokontrollierten Studien bei Kindern und Jugendlichen mit bipolarer Manie (Dauer 3 Wochen) oder Schizophrenie (Dauer 6 Wochen) war die Inzidenz von Verschiebungen der Prolaktinspiegel auf einen Wert (> 20 μg/L Männer; > 26 μg /L Frauen zu jedem Zeitpunkt) betrug 13,4 % (18/134) für SEROQUEL im Vergleich zu 4 % (3/75) für Placebo bei Männern und 8,7 % (9/104) für SEROQUEL 25 mg im Vergleich zu 0 % (0/39) für Placebo bei Frauen.
Wie andere Arzneimittel, die Dopamin-D2-Rezeptoren antagonisieren, erhöht SEROQUEL 300 mg bei einigen Patienten die Prolaktinspiegel, und die Erhöhung kann während einer chronischen Anwendung anhalten. Hyperprolaktinämie, unabhängig von der Ätiologie, kann hypothalamisches GnRH unterdrücken, was zu einer verringerten hypophysären Gonadotropinsekretion führt. Dies wiederum kann die Fortpflanzungsfunktion hemmen, indem es die gonadale Steroidogenese sowohl bei weiblichen als auch bei männlichen Patienten beeinträchtigt. Galaktorrhoe, Amenorrhoe, Gynäkomastie und Impotenz wurden bei Patienten berichtet, die Prolaktin-erhöhende Präparate erhielten. Langanhaltende Hyperprolaktinämie in Verbindung mit Hypogonadismus kann sowohl bei weiblichen als auch bei männlichen Probanden zu einer verminderten Knochendichte führen.
Gewebekulturexperimente weisen darauf hin, dass ungefähr ein Drittel der menschlichen Brustkrebserkrankungen in vitro Prolaktin-abhängig sind, ein Faktor von potenzieller Bedeutung, wenn die Verschreibung dieser Medikamente bei einer Patientin mit zuvor erkanntem Brustkrebs in Betracht gezogen wird. Wie bei Verbindungen, die die Prolaktinfreisetzung erhöhen, wurde in Kanzerogenitätsstudien an Mäusen und Ratten eine Neoplasie der Brustdrüse und der Inselzellen der Bauchspeicheldrüse (Mamma-Adenokarzinome, Hypophysen- und Pankreas-Adenome) beobachtet. Weder bisher durchgeführte klinische Studien noch epidemiologische Studien haben einen Zusammenhang zwischen der chronischen Verabreichung dieser Arzneimittelklasse und der Tumorentstehung beim Menschen gezeigt, aber die verfügbaren Beweise sind zu begrenzt, um schlüssig zu sein [siehe Nichtklinische Toxikologie ].
Potenzial für kognitive und motorische Beeinträchtigungen
Somnolenz war eine häufig berichtete Nebenwirkung bei Patienten, die mit SEROQUEL behandelt wurden, insbesondere während der 3- bis 5-tägigen Phase der anfänglichen Dosistitration. In Schizophrenie-Studien wurde Schläfrigkeit bei 18 % (89/510) der Patienten unter SEROQUEL 200 mg im Vergleich zu 11 % (22/206) der Placebo-Patienten berichtet. In Studien zur akuten bipolaren Manie mit SEROQUEL 200 mg als Monotherapie wurde bei 16 % (34/209) der Patienten unter SEROQUEL 300 mg Somnolenz berichtet, verglichen mit 4 % der Placebo-Patienten. In Studien zur akuten bipolaren Manie mit SEROQUEL als Zusatztherapie wurde Schläfrigkeit bei 34 % (66/196) der Patienten unter SEROQUEL im Vergleich zu 9 % (19/203) der Placebo-Patienten berichtet. In Studien zu bipolaren Depressionen wurde Schläfrigkeit bei 57 % (398/698) der Patienten unter SEROQUEL 50 mg im Vergleich zu 15 % (51/347) der Placebo-Patienten berichtet. Da SEROQUEL 25 mg das Urteilsvermögen, Denkvermögen oder motorische Fähigkeiten beeinträchtigen kann, sollten Patienten davor gewarnt werden, Aktivitäten durchzuführen, die geistige Wachsamkeit erfordern, wie z sie nicht negativ beeinflussen. Schläfrigkeit kann zu Stürzen führen.
Regulierung der Körpertemperatur
Obwohl dies nicht für SEROQUEL 100 mg berichtet wurde, wurde eine Störung der Fähigkeit des Körpers, die Körperkerntemperatur zu senken, auf Antipsychotika zurückgeführt. Bei der Verschreibung von SEROQUEL 300 mg für Patienten, die an Zuständen leiden, die zu einer Erhöhung der Körperkerntemperatur beitragen können, z. B. anstrengende körperliche Betätigung, extreme Hitzeeinwirkung, gleichzeitige Einnahme von Medikamenten mit anticholinerger Wirkung oder Dehydrierung, ist bei der Verschreibung von SEROQUEL 300 mg angemessene Vorsicht geboten.
Dysphagie
Dysmotilität und Aspiration des Ösophagus wurden mit dem Gebrauch von Antipsychotika in Verbindung gebracht. Aspirationspneumonie ist eine häufige Ursache für Morbidität und Mortalität bei älteren Patienten, insbesondere bei Patienten mit fortgeschrittener Alzheimer-Demenz. SEROQUEL 100 mg und andere Antipsychotika sollten bei Patienten mit einem Risiko für eine Aspirationspneumonie mit Vorsicht angewendet werden.
Abbruchsyndrom
Akute Entzugserscheinungen wie Schlaflosigkeit, Übelkeit und Erbrechen wurden nach abruptem Absetzen von atypischen Antipsychotika, einschließlich SEROQUEL, beschrieben. In placebokontrollierten klinischen Kurzzeitstudien zur Monotherapie mit SEROQUEL 25 mg XR, die eine Absetzphase umfassten, in der die Absetzsymptome bewertet wurden, betrug die aggregierte Inzidenz von Patienten, bei denen nach abruptem Absetzen ein oder mehrere Absetzsymptome auftraten, 12,1 % (241/1993) für SEROQUEL XR und 6,7 % (71/1065) für Placebo. Die Inzidenz der einzelnen Nebenwirkungen (dh Schlaflosigkeit, Übelkeit, Kopfschmerzen, Durchfall, Erbrechen, Schwindel und Reizbarkeit) überstieg in keiner Behandlungsgruppe 5,3 % und verschwand gewöhnlich 1 Woche nach Absetzen. Es wird ein schrittweiser Rückzug empfohlen. [sehen Verwendung in bestimmten Bevölkerungsgruppen ]
Anticholinerge (antimuskarinische) Wirkungen
Norquetiapin, ein aktiver Metabolit von Quetiapin, hat eine mäßige bis starke Affinität zu mehreren Muskarinrezeptor-Subtypen. Dies trägt zu anticholinergen Nebenwirkungen bei, wenn SEROQUEL 25 mg in therapeutischen Dosen, gleichzeitig mit anderen anticholinergen Arzneimitteln oder in Überdosierung eingenommen wird. SEROQUEL sollte bei Patienten, die Medikamente mit anticholinerger (antimuskarinischer) Wirkung erhalten, mit Vorsicht angewendet werden [siehe ÜBERDOSIS und KLINISCHE PHARMAKOLOGIE ].
Verstopfung war eine häufig berichtete Nebenwirkung bei mit Quetiapin behandelten Patienten und stellt einen Risikofaktor für Darmverschluss dar. Unter Quetiapin wurde über Darmverschluss berichtet, einschließlich tödlicher Fälle bei Patienten, die gleichzeitig mehrere Arzneimittel erhielten, die die Darmmotilität verringern.
SEROQUEL 300 mg sollte bei Patienten mit aktueller Diagnose oder Vorgeschichte von Harnverhalt, klinisch signifikanter Prostatahypertrophie, Verstopfung oder erhöhtem Augeninnendruck mit Vorsicht angewendet werden.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung (Medikamentenleitfaden) zu lesen.
Die Patienten sollten auf die folgenden Probleme hingewiesen und gebeten werden, ihren verschreibenden Arzt zu informieren, wenn diese während der Einnahme von SEROQUEL auftreten.
Erhöhte Sterblichkeit bei älteren Patienten mit Demenz-assoziierter Psychose Patienten und Betreuungspersonen sollten darauf hingewiesen werden, dass ältere Patienten mit Demenz-assoziierter Psychose, die mit atypischen Antipsychotika behandelt werden, im Vergleich zu Placebo einem erhöhten Sterberisiko ausgesetzt sind. Quetiapin ist für ältere Patienten mit demenzbedingter Psychose nicht zugelassen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Selbstmordgedanken und Verhaltensweisen
Patienten, ihre Familien und ihre Betreuer sollten ermutigt werden, auf das Auftreten von Angstzuständen, Unruhe, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Unruhe), Hypomanie, Manie und anderen ungewöhnlichen Verhaltensänderungen zu achten , Verschlechterung von Depressionen und Suizidgedanken, besonders früh während der Behandlung mit Antidepressiva und wenn die Dosis nach oben oder unten angepasst wird. Familien und Betreuer von Patienten sollten angewiesen werden, täglich auf das Auftreten solcher Symptome zu achten, da Änderungen abrupt sein können. Solche Symptome sollten dem verschreibenden Arzt oder medizinischen Fachpersonal des Patienten gemeldet werden, insbesondere wenn sie schwerwiegend sind, abrupt einsetzen oder nicht Teil der Symptome des Patienten waren. Symptome wie diese können mit einem erhöhten Risiko für Suizidgedanken und -verhalten verbunden sein und weisen auf die Notwendigkeit einer sehr engmaschigen Überwachung und möglicherweise einer Änderung der Medikation hin [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Malignes neuroleptisches Syndrom (NMS)
Patienten sollten angewiesen werden, ihrem Arzt alle Anzeichen oder Symptome zu melden, die mit NMS zusammenhängen könnten. Dazu können Muskelsteifheit und hohes Fieber gehören [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hyperglykämie und Diabetes mellitus
Patienten sollten sich der Symptome von Hyperglykämie (hoher Blutzucker) und Diabetes mellitus bewusst sein. Patienten, bei denen Diabetes diagnostiziert wurde, die Risikofaktoren für Diabetes aufweisen oder die diese Symptome während der Behandlung entwickeln, sollten ihren Blutzucker zu Beginn und in regelmäßigen Abständen während der Behandlung kontrollieren lassen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hyperlipidämie
Die Patienten sollten darauf hingewiesen werden, dass es zu einem Anstieg des Gesamtcholesterins, des LDL-Cholesterins und der Triglyceride und zu einem Abfall des HDL-Cholesterins kommen kann. Das Lipidprofil der Patienten sollte zu Beginn und in regelmäßigen Abständen während der Behandlung überwacht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Gewichtszunahme
Die Patienten sollten darauf hingewiesen werden, dass es zu einer Gewichtszunahme kommen kann. Das Gewicht der Patienten sollte regelmäßig überwacht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Orthostatische Hypotonie
Die Patienten sollten auf das Risiko einer orthostatischen Hypotonie hingewiesen werden (zu den Symptomen gehören Schwindel oder Benommenheit beim Aufstehen, was zu Stürzen führen kann), insbesondere während der anfänglichen Dosistitration und auch zu Zeiten der Wiederaufnahme der Behandlung oder Dosiserhöhungen [ sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Erhöhter Blutdruck bei Kindern und Jugendlichen
Bei Kindern und Jugendlichen sollte der Blutdruck zu Beginn und in regelmäßigen Abständen während der Behandlung gemessen werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Leukopenie/Neutropenie
Patienten mit vorbestehenden niedrigen Leukozytenzahlen oder arzneimittelinduzierter Leukopenie/Neutropenie in der Vorgeschichte sollten darauf hingewiesen werden, dass sie während der Einnahme von SEROQUEL ihr Blutbild überwachen lassen sollten. Patienten sollten angewiesen werden, so schnell wie möglich mit ihrem Arzt zu sprechen, wenn sie Fieber, grippeähnliche Symptome, Halsschmerzen oder eine andere Infektion haben, da dies die Folge einer sehr niedrigen Leukozytenzahl sein könnte, die SEROQUEL 100 mg erfordern kann abgesetzt und/oder behandelt werden [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Beeinträchtigung der kognitiven und motorischen Leistung
Die Patienten sollten auf das Risiko von Somnolenz oder Sedierung (die zu Stürzen führen können) hingewiesen werden, insbesondere während der Phase der anfänglichen Dosistitration. Patienten sollten davor gewarnt werden, Aktivitäten durchzuführen, die geistige Wachsamkeit erfordern, wie z. B. das Führen eines Kraftfahrzeugs (einschließlich Autos) oder das Bedienen von Maschinen, bis sie hinreichend sicher sind, dass die Quetiapin-Therapie sie nicht nachteilig beeinflusst [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hitzeeinwirkung und Austrocknung
Die Patienten sollten über angemessene Vorsichtsmaßnahmen zur Vermeidung von Überhitzung und Dehydration aufgeklärt werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Begleitmedikation
Wie bei anderen Medikamenten sollten Patienten angewiesen werden, ihren Arzt zu informieren, wenn sie verschreibungspflichtige oder rezeptfreie Medikamente einnehmen oder einnehmen möchten [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Schwangerschaft
Raten Sie schwangeren Frauen, ihren Arzt zu informieren, wenn sie schwanger werden oder beabsichtigen, während der Behandlung mit SEROQUEL schwanger zu werden. Weisen Sie die Patienten darauf hin, dass SEROQUEL bei einem Neugeborenen extrapyramidale Symptome und/oder Entzugssymptome (Agitiertheit, Hypertonie, Hypotonie, Tremor, Somnolenz, Atemnot und Fütterstörungen) verursachen kann. Weisen Sie die Patientinnen darauf hin, dass es ein Schwangerschaftsregister gibt, das den Ausgang der Schwangerschaft bei Frauen überwacht, die während der Schwangerschaft SEROQUEL 25 mg ausgesetzt waren [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Unfruchtbarkeit
Weisen Sie gebärfähige Frauen darauf hin, dass SEROQUEL die Fruchtbarkeit aufgrund eines Anstiegs der Prolaktinspiegel im Serum beeinträchtigen kann. Die Auswirkungen auf die Fertilität sind reversibel [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Notwendigkeit eines umfassenden Behandlungsprogramms
SEROQUEL ist als integraler Bestandteil eines Gesamtbehandlungsprogramms für Jugendliche mit Schizophrenie und pädiatrischer bipolarer Störung indiziert, das andere (psychologische, pädagogische und soziale) Maßnahmen umfassen kann. Wirksamkeit und Sicherheit von SEROQUEL 100 mg wurden bei pädiatrischen Patienten unter 13 Jahren bei Schizophrenie oder unter 10 Jahren bei bipolarer Manie nicht nachgewiesen. Eine angemessene schulische Unterbringung ist unerlässlich, und psychosoziale Interventionen sind oft hilfreich. Die Entscheidung, atypische Antipsychotika zu verschreiben, hängt von der Einschätzung des Arztes über die Chronizität und Schwere der Symptome des Patienten ab [siehe INDIKATIONEN ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Kanzerogenitätsstudien wurden an C57BL-Mäusen und Wistar-Ratten durchgeführt. Quetiapin wurde Mäusen in Dosen von 20, 75, 250 und 750 mg/kg über das Futter und Ratten in Dosen von 25, 75 und 250 mg/kg per Schlundsonde über zwei Jahre verabreicht. Diese Dosen entsprechen dem 0,1-, 0,5-, 1,5- und 4,5-fachen der MRHD von 800 mg/Tag, basierend auf mg/m2 Körperoberfläche (Mäuse) oder dem 0,3-, 1- und 3-fachen der MRHD, basierend auf mg/m2 Körperoberfläche (Ratten). Es gab statistisch signifikante Zunahmen follikulärer Adenome der Schilddrüse bei männlichen Mäusen bei Dosen, die das 1,5- und 4,5-fache der MRHD bezogen auf mg/m2 Körperoberfläche betrugen, und bei männlichen Ratten bei einer Dosis, die dem 3-fachen MRHD bezogen auf mg/m2 Körperoberfläche entsprach. Brustdrüsen-Adenokarzinome waren bei weiblichen Ratten bei allen getesteten Dosen statistisch signifikant erhöht (0,3-, 1- und 3-fache MRHD, basierend auf mg/m2 Körperoberfläche).
Adenome der follikulären Schilddrüsenzellen können aus einer chronischen Stimulation der Schilddrüse durch das Thyreoidea-stimulierende Hormon (TSH) resultieren, das aus einem verstärkten Metabolismus und der Clearance von Thyroxin durch die Leber von Nagetieren resultiert. Veränderungen von TSH, Thyroxin und Thyroxin-Clearance im Einklang mit diesem Mechanismus wurden in subchronischen Toxizitätsstudien an Ratten und Mäusen und in einer 1-Jahres-Toxizitätsstudie an Ratten beobachtet; Die Ergebnisse dieser Studien waren jedoch nicht endgültig. Die Relevanz des Anstiegs von Adenomen der Schilddrüsenfollikelzellen für das menschliche Risiko, durch welchen Mechanismus auch immer, ist unbekannt.
Es wurde gezeigt, dass Antipsychotika den Prolaktinspiegel bei Nagetieren chronisch erhöhen. Serummessungen in einer 1-Jahres-Toxizitätsstudie zeigten, dass Quetiapin die medianen Prolaktinspiegel im Serum bei männlichen bzw. weiblichen Ratten maximal um das 32- bzw. 13-Fache erhöhte. Bei Nagern wurde nach chronischer Verabreichung anderer Antipsychotika eine Zunahme von Mamma-Neoplasmen festgestellt, die als Prolaktin-vermittelt angesehen werden. Die Relevanz dieser erhöhten Inzidenz von Prolaktin-vermittelten Brustdrüsentumoren bei Ratten für das menschliche Risiko ist nicht bekannt [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Mutagenese
Quetiapin war in Standard-Genotoxizitätstests nicht mutagen oder klastogen. Das mutagene Potenzial von Quetiapin wurde im In-vitro-Ames-Bakterien-Genmutationstest und im In-vitro-Säugetier-Genmutationstest an Eierstockzellen des Chinesischen Hamsters getestet. Das klastogene Potenzial von Quetiapin wurde im In-vitro-Chromosomenaberrationsassay an kultivierten menschlichen Lymphozyten und im In-vivo-Knochenmark-Mikronukleus-Assay an Ratten bis zu 500 mg/kg getestet, was dem 6-fachen der empfohlenen Höchstdosis beim Menschen, basierend auf mg/m2, entspricht Körperoberfläche.
Beeinträchtigung der Fruchtbarkeit
Quetiapin verringerte die Paarung und Fertilität bei männlichen Sprague-Dawley-Ratten bei oralen Dosen von 50 und 150 mg/kg oder etwa dem 1- und 3-fachen der MRHD von 800 mg/Tag, basierend auf mg/m2 Körperoberfläche. Zu den medikamentenbedingten Wirkungen gehörten Verlängerungen des Paarungsintervalls und der Anzahl der Paarungen, die für eine erfolgreiche Befruchtung erforderlich sind. Diese Wirkungen wurden auch nach einem zweiwöchigen Zeitraum ohne Behandlung weiterhin beim 3-fachen der MRHD beobachtet. Die No-Effect-Dosis für beeinträchtigte Paarung und Fertilität bei männlichen Ratten betrug 25 mg/kg oder das 0,3-fache der MRHD-Dosis, basierend auf mg/m2 Körperoberfläche. Quetiapin beeinträchtigte die Paarung und Fertilität bei weiblichen Sprague-Dawley-Ratten bei einer oralen Dosis, die ungefähr dem 1-fachen der MRHD von 800 mg/Tag, basierend auf mg/m2 Körperoberfläche, entspricht. Zu den arzneimittelbedingten Wirkungen gehörten eine Abnahme der Paarungen und der Paarungen, die zu einer Schwangerschaft führten, sowie eine Verlängerung des Paarungsintervalls. Eine Zunahme unregelmäßiger Östruszyklen wurde bei Dosen von 10 und 50 mg/kg oder etwa dem 0,1- und 1-fachen der MRHD von 800 mg/Tag, basierend auf mg/m2 Körperoberfläche, beobachtet. Die Dosis ohne Wirkung bei weiblichen Ratten betrug 1 mg/kg oder das 0,01-fache der MRHD von 800 mg/Tag, basierend auf mg/m2 Körperoberfläche.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschafts-Expositionsregister
Es gibt ein Schwangerschafts-Expositionsregister, das die Schwangerschaftsausgänge bei Frauen überwacht, die während der Schwangerschaft atypischen Antipsychotika, einschließlich SEROQUEL 50 mg, ausgesetzt waren. Gesundheitsdienstleister werden ermutigt, Patienten zu registrieren, indem sie sich unter 1-866-961-2388 oder online an das National Pregnancy Registry for Atypical Antipsychotics wenden http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
Zusammenfassung der Risiken
Neugeborene, die während des dritten Trimesters Antipsychotika (einschließlich SEROQUEL) ausgesetzt waren, haben ein erhöhtes Risiko für extrapyramidale Symptome und/oder Entzugssymptome nach der Entbindung (siehe Klinische Überlegungen ). Insgesamt verfügbare Daten aus veröffentlichten epidemiologischen Studien an schwangeren Frauen, die Quetiapin ausgesetzt waren, haben kein arzneimittelbedingtes Risiko für schwerwiegende Geburtsfehler, Fehlgeburten oder unerwünschte Folgen für Mutter oder Fötus ergeben (siehe Daten ). Es bestehen Risiken für die Mutter im Zusammenhang mit einer unbehandelten Schizophrenie, Bipolar-I- oder schweren depressiven Störung und mit der Exposition gegenüber Antipsychotika, einschließlich SEROQUEL 200 mg, während der Schwangerschaft (siehe Klinische Überlegungen ).
In Tierstudien trat eine embryofetale Toxizität auf, einschließlich Verzögerungen der Skelettverknöcherung bei etwa dem 1- und 2-fachen der maximal empfohlenen Humandosis (MRHD) von 800 mg/Tag bei Ratten und Kaninchen und einer erhöhten Inzidenz von Handwurzel-/Tarsalflexur (geringfügige Weichteilanomalie) bei Kaninchenföten bei etwa dem 2-fachen der MRHD. Außerdem war das fetale Gewicht bei beiden Spezies verringert. Maternale Toxizität (beobachtet als verringertes Körpergewicht und/oder Tod) trat bei der 2-fachen MRHD bei Ratten und etwa der 1- bis 2-fachen MRHD bei Kaninchen auf.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebenen Populationen ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 bis 4 % bzw. 15 bis 20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder fötales Risiko
Es besteht ein Risiko für die Mutter durch unbehandelte Schizophrenie oder Bipolar-I-Störung, einschließlich eines erhöhten Rückfallrisikos, Krankenhausaufenthalts und Suizids. Schizophrenie und Bipolar-I-Störung sind mit erhöhten unerwünschten perinatalen Folgen, einschließlich Frühgeburten, verbunden. Es ist nicht bekannt, ob dies eine direkte Folge der Krankheit oder anderer komorbider Faktoren ist.
Eine prospektive Längsschnittstudie folgte 201 schwangeren Frauen mit einer Vorgeschichte von schweren depressiven Störungen, die euthymisch waren und zu Beginn der Schwangerschaft Antidepressiva einnahmen. Frauen, die Antidepressiva während der Schwangerschaft absetzten, erlitten mit größerer Wahrscheinlichkeit einen Rückfall einer schweren Depression als Frauen, die Antidepressiva weiter einnahmen. Berücksichtigen Sie das Risiko einer unbehandelten Depression, wenn Sie die Behandlung mit Antidepressiva während der Schwangerschaft und nach der Geburt abbrechen oder ändern.
Fetale/neonatale Nebenwirkungen
Extrapyramidale und/oder Entzugserscheinungen, einschließlich Agitiertheit, Hypertonie, Hypotonie, Tremor, Somnolenz, Atemnot und Fütterstörungen, wurden bei Neugeborenen berichtet, die während des dritten Trimenons der Schwangerschaft Antipsychotika, einschließlich SEROQUEL 50 mg, ausgesetzt waren. Diese Symptome waren unterschiedlich stark ausgeprägt. Überwachen Sie Neugeborene auf extrapyramidale und/oder Entzugserscheinungen und behandeln Sie die Symptome entsprechend. Einige Neugeborene erholten sich ohne spezifische Behandlung innerhalb von Stunden oder Tagen; andere erforderten einen längeren Krankenhausaufenthalt.
Daten
Menschliche Daten
Veröffentlichte Daten aus Beobachtungsstudien, Geburtsregistern und Fallberichten über die Anwendung atypischer Antipsychotika während der Schwangerschaft zeigen keinen eindeutigen Zusammenhang mit Antipsychotika und schweren Geburtsfehlern. Eine retrospektive Kohortenstudie aus einer Medicaid-Datenbank mit 9258 Frauen, die während der Schwangerschaft Antipsychotika ausgesetzt waren, zeigte kein insgesamt erhöhtes Risiko für schwere Geburtsfehler.
Tierdaten
Wenn trächtige Ratten und Kaninchen während der Organogenese Quetiapin ausgesetzt wurden, gab es keine teratogene Wirkung auf Föten. Die Dosierungen betrugen 25, 50 und 200 mg/kg bei Ratten und 25, 50 und 100 mg/kg bei Kaninchen, was ungefähr dem 0,3-, 0,6- und 2-fachen (Ratten) und dem 0,6-, 1- und 2-fachen (Kaninchen) der MRHD entspricht Schizophrenie von 800 mg/Tag, basierend auf mg/m2 Körperoberfläche. Es gab jedoch Hinweise auf eine embryofetale Toxizität, einschließlich Verzögerungen der Skelettossifikation bei etwa dem 1- und 2-fachen der MRHD von 800 mg/Tag sowohl bei Ratten als auch bei Kaninchen und einer erhöhten Inzidenz von Karpal-/Tarsalflexuren (geringfügige Weichteilanomalie) in Kaninchenföten bei etwa dem 2-fachen der MRHD. Außerdem war das fetale Gewicht bei beiden Spezies verringert. Maternale Toxizität (beobachtet als verringertes Körpergewicht und/oder Tod) trat bei der 2-fachen MRHD bei Ratten und etwa der 1-2-fachen MRHD (alle getesteten Dosen) bei Kaninchen auf.
In einer peri-/postnatalen Reproduktionsstudie an Ratten wurden keine arzneimittelbedingten Wirkungen beobachtet, wenn trächtige Muttertiere mit Quetiapin-Dosen behandelt wurden, die dem 0,01-, 0,1- und 0,2-Fachen der MRHD von 800 mg/Tag, basierend auf mg/m2 Körperoberfläche, entsprachen. In einer vorläufigen peri-/postnatalen Studie kam es jedoch zu einem Anstieg des Todes von Föten und Jungtieren und zu einem Rückgang des mittleren Wurfgewichts beim 3-fachen der MRHD.
Stillzeit
Zusammenfassung der Risiken
Begrenzte Daten aus der veröffentlichten Literatur berichten über das Vorhandensein von Quetiapin in der menschlichen Muttermilch bei einer relativen Säuglingsdosis von
Weibchen und Männchen mit reproduktivem Potenzial
Unfruchtbarkeit
Frauen
Basierend auf der pharmakologischen Wirkung von Quetiapin (D2-Antagonismus) kann die Behandlung mit SEROQUEL zu einem Anstieg der Serum-Prolaktinspiegel führen, was zu einer reversiblen Verringerung der Fertilität bei gebärfähigen Frauen führen kann [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Pädiatrische Verwendung
Im Allgemeinen waren die Nebenwirkungen, die bei Kindern und Jugendlichen während der klinischen Studien beobachtet wurden, mit wenigen Ausnahmen denen bei Erwachsenen ähnlich. Anstiege des systolischen und diastolischen Blutdrucks traten bei Kindern und Jugendlichen auf und traten bei Erwachsenen nicht auf. Orthostatische Hypotonie trat häufiger bei Erwachsenen (4-7 %) im Vergleich zu Kindern und Jugendlichen ( WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ].
Schizophrenie
Die Wirksamkeit und Sicherheit von SEROQUEL 50 mg bei der Behandlung von Schizophrenie bei Jugendlichen im Alter von 13 bis 17 Jahren wurden in einer 6-wöchigen, doppelblinden, placebokontrollierten Studie nachgewiesen [siehe INDIKATIONEN , DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN , und Klinische Studien ].
Die Sicherheit und Wirksamkeit von SEROQUEL 300 mg bei pädiatrischen Patienten unter 13 Jahren mit Schizophrenie wurde nicht nachgewiesen.
Wartung
Die Sicherheit und Wirksamkeit von SEROQUEL in der Erhaltungstherapie der bipolaren Störung wurde bei pädiatrischen Patienten unter 18 Jahren nicht nachgewiesen. Die Sicherheit und Wirksamkeit von SEROQUEL in der Erhaltungstherapie der Schizophrenie wurde bei keiner Patientenpopulation, einschließlich pädiatrischer Patienten, nachgewiesen.
Bipolare Manie
Die Wirksamkeit und Sicherheit von SEROQUEL bei der Behandlung von Manie bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren mit Bipolar-I-Störung wurde in einer 3-wöchigen, doppelblinden, placebokontrollierten, multizentrischen Studie nachgewiesen [siehe INDIKATIONEN , DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN , und Klinische Studien ]. Die Sicherheit und Wirksamkeit von SEROQUEL bei pädiatrischen Patienten unter 10 Jahren mit bipolarer Manie wurde nicht nachgewiesen.
Bipolare Depression
Sicherheit und Wirksamkeit von SEROQUEL 300 mg bei pädiatrischen Patienten unter 18 Jahren mit bipolarer Depression wurden nicht nachgewiesen. Eine klinische Studie mit SEROQUEL XR wurde bei Kindern und Jugendlichen (10-17 Jahre) mit bipolarer Depression durchgeführt, die Wirksamkeit wurde nicht nachgewiesen.
Einige Unterschiede in der Pharmakokinetik von Quetiapin wurden zwischen Kindern/Jugendlichen (10-17 Jahre) und Erwachsenen festgestellt. Gewichtsbereinigt waren die AUC und Cmax von Quetiapin bei Kindern und Jugendlichen um 41 % bzw. 39 % niedriger als bei Erwachsenen. Die Pharmakokinetik des aktiven Metaboliten Norquetiapin war nach Gewichtsanpassung bei Kindern/Jugendlichen und Erwachsenen ähnlich [siehe KLINISCHE PHARMAKOLOGIE ].
Geriatrische Verwendung
Von den ungefähr 3700 Patienten in klinischen Studien mit SEROQUEL 300 mg waren 7 % (232) 65 Jahre oder älter. Im Allgemeinen gab es keinen Hinweis auf eine unterschiedliche Verträglichkeit von SEROQUEL bei älteren Menschen im Vergleich zu jüngeren Erwachsenen. Dennoch sollte das Vorhandensein von Faktoren, die die pharmakokinetische Clearance verringern, die pharmakodynamische Reaktion auf SEROQUEL 200 mg verstärken oder eine schlechtere Verträglichkeit oder Orthostase verursachen könnten, dazu führen, dass eine niedrigere Anfangsdosis, eine langsamere Titration und eine sorgfältige Überwachung während der anfänglichen Dosierungsphase in Betracht gezogen werden Alten. Die mittlere Plasmaclearance von SEROQUEL 25 mg war bei älteren Patienten im Vergleich zu jüngeren Patienten um 30 % bis 50 % verringert [siehe KLINISCHE PHARMAKOLOGIE und DOSIERUNG UND ANWENDUNG ].
Nierenfunktionsstörung
Die klinische Erfahrung mit SEROQUEL bei Patienten mit eingeschränkter Nierenfunktion ist begrenzt [siehe KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Da Quetiapin weitgehend in der Leber metabolisiert wird, sind bei Patienten mit eingeschränkter Leberfunktion höhere Plasmaspiegel zu erwarten. Bei dieser Population wird eine niedrige Anfangsdosis von 25 mg/Tag empfohlen und die Dosis kann in Schritten von 25 mg/Tag bis 50 mg/Tag erhöht werden [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Menschliche Erfahrung
In klinischen Studien wurde über das Überleben bei akuter Überdosierung von bis zu 30 Gramm Quetiapin berichtet. Bei den meisten Patienten mit Überdosierung traten keine Nebenwirkungen auf oder sie erholten sich vollständig von den berichteten Ereignissen. In einer klinischen Studie wurde über Todesfälle nach einer Überdosis von 13,6 Gramm Quetiapin allein berichtet. Im Allgemeinen handelte es sich bei den gemeldeten Anzeichen und Symptomen um solche, die aus einer Übertreibung der bekannten pharmakologischen Wirkungen des Arzneimittels resultierten, dh Schläfrigkeit, Sedierung, Tachykardie, Hypotonie und anticholinerge Toxizität, einschließlich Koma und Delirium. Bei Patienten mit vorbestehender schwerer Herz-Kreislauf-Erkrankung besteht möglicherweise ein erhöhtes Risiko für die Auswirkungen einer Überdosierung [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Ein Fall mit einer geschätzten Überdosierung von 9600 mg war mit Hypokaliämie und Herzblock ersten Grades verbunden. Nach Markteinführung wurden Fälle von QT-Verlängerung bei Überdosierung berichtet.
Management einer Überdosierung
Schaffen und erhalten Sie einen Atemweg und sorgen Sie für eine ausreichende Sauerstoffversorgung und Belüftung. Die kardiovaskuläre Überwachung sollte sofort beginnen und eine kontinuierliche elektrokardiographische Überwachung umfassen, um mögliche Arrhythmien zu erkennen.
Angemessene unterstützende Maßnahmen sind die tragende Säule des Managements. Wenden Sie sich für die aktuellsten Informationen zum Umgang mit einer Seroquel XR-Überdosierung an ein zertifiziertes regionales Giftinformationszentrum (1-800-222-1222).
KONTRAINDIKATIONEN
Überempfindlichkeit gegen Quetiapin oder einen der sonstigen Bestandteile der SEROQUEL XR-Formulierung. Anaphylaktische Reaktionen wurden bei mit SEROQUEL XR behandelten Patienten berichtet.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Der Wirkungsmechanismus von Quetiapin in den aufgeführten Indikationen ist unklar. Die Wirksamkeit von Quetiapin bei diesen Indikationen könnte jedoch durch eine Kombination aus Dopamin-Typ-2-(D2)- und Serotonin-Typ-2-(5HT2)-Antagonismus vermittelt werden. Der aktive Metabolit, N-Desalkylquetiapin (Norquetiapin), hat eine ähnliche Aktivität an D2, aber eine größere Aktivität an 5HT2A-Rezeptoren als die Ausgangssubstanz (Quetiapin).
Pharmakodynamik
Quetiapin und sein Metabolit Norquetiapin haben eine Affinität zu mehreren Neurotransmitterrezeptoren, wobei Norquetiapin mit einer höheren Affinität als Quetiapin im Allgemeinen bindet. Die Ki-Werte für Quetiapin und Norquetiapin bei Dopamin D1 sind 428/99,8 nM, bei D2 626/489 nM, bei Serotonin 5HT1A 1040/191 nM, bei 5HT2A 38/2,9 nM, bei Histamin H1 4,4/1,1 nM, bei Muscarin M1 1086/ 38,3 nM und bei adrenergen α1b 14,6/46,4 nM bzw. bei α2-Rezeptoren 617/1290 nM. Quetiapin und Norquetiapin haben keine nennenswerte Affinität zu den Benzodiazepin-Rezeptoren.
Auswirkung auf das QT-Intervall
In klinischen Studien war Quetiapin nicht mit einer anhaltenden Verlängerung der QT-Intervalle verbunden. Der QT-Effekt wurde jedoch nicht systematisch in einer gründlichen QT-Studie evaluiert. Nach der Markteinführung wurden Fälle von QT-Verlängerung bei Patienten berichtet, die Quetiapin überdosiert hatten [siehe ÜBERDOSIS ], bei Patienten mit Begleiterkrankungen und bei Patienten, die Arzneimittel einnehmen, von denen bekannt ist, dass sie ein Elektrolytungleichgewicht verursachen oder das QT-Intervall verlängern.
Pharmakokinetik
Erwachsene
Die Aktivität von Quetiapinfumarat ist hauptsächlich auf die Muttersubstanz zurückzuführen. Die Pharmakokinetik von Quetiapin nach Mehrfachgabe ist innerhalb des vorgeschlagenen klinischen Dosisbereichs dosisproportional, und eine Akkumulation von Quetiapin ist bei Mehrfachgabe vorhersehbar. Die Elimination von Quetiapin erfolgt hauptsächlich über die Leber mit einer mittleren terminalen Halbwertszeit von etwa 6 Stunden innerhalb des vorgeschlagenen klinischen Dosisbereichs. Es wird erwartet, dass Steady-State-Konzentrationen innerhalb von zwei Tagen nach der Verabreichung erreicht werden. Es ist unwahrscheinlich, dass Quetiapin den Metabolismus von Arzneimitteln beeinflusst, die durch Cytochrom-P450-Enzyme metabolisiert werden.
Kinder und Jugendliche
Im Steady State war die Pharmakokinetik der Muttersubstanz bei Kindern und Jugendlichen (im Alter von 10 bis 17 Jahren) ähnlich wie bei Erwachsenen. Bei Dosis- und Gewichtsanpassung waren die AUC und Cmax der Muttersubstanz jedoch bei Kindern und Jugendlichen um 41 % bzw. 39 % niedriger als bei Erwachsenen. Für den aktiven Metaboliten Norquetiapin waren AUC und Cmax bei Kindern und Jugendlichen um 45 % bzw. 31 % höher als bei Erwachsenen. Nach Anpassung an Dosis und Gewicht war die Pharmakokinetik des Metaboliten Norquetiapin bei Kindern und Jugendlichen und Erwachsenen ähnlich [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Absorption
Quetiapinfumarat wird nach oraler Verabreichung schnell resorbiert und erreicht maximale Plasmakonzentrationen innerhalb von 1,5 Stunden. Die Tablettenformulierung ist relativ zur Lösung zu 100 % bioverfügbar. Die Bioverfügbarkeit von Quetiapin wird durch die Einnahme zusammen mit Nahrung geringfügig beeinflusst, wobei die Cmax- und AUC-Werte um 25 % bzw. 15 % ansteigen.
Verteilung
Quetiapin wird mit einem scheinbaren Verteilungsvolumen von 10 ± 4 l/kg weit im Körper verteilt. In therapeutischen Konzentrationen ist es zu 83 % an Plasmaproteine gebunden. In vitro hatte Quetiapin keinen Einfluss auf die Bindung von Warfarin oder Diazepam an Humanserumalbumin. Weder Warfarin noch Diazepam wiederum veränderten die Bindung von Quetiapin.
Stoffwechsel und Ausscheidung
Nach einer oralen Einzeldosis von 14C-Quetiapin wurde weniger als 1 % der verabreichten Dosis als unveränderter Wirkstoff ausgeschieden, was darauf hindeutet, dass Quetiapin stark metabolisiert wird. Ungefähr 73 % bzw. 20 % der Dosis wurden im Urin bzw. im Stuhl wiedergefunden.
Quetiapin wird weitgehend von der Leber metabolisiert. Die wichtigsten Stoffwechselwege sind die Sulfoxidation zum Sulfoxid-Metaboliten und die Oxidation zum Ausgangssäure-Metaboliten; beide Metaboliten sind pharmakologisch inaktiv. In-vitro-Studien mit menschlichen Lebermikrosomen zeigten, dass das Isoenzym Cytochrom P450 3A4 am Metabolismus von Quetiapin zu seinem wichtigsten, aber inaktiven Sulfoxid-Metaboliten und am Metabolismus seines aktiven Metaboliten N-Desalkylquetiapin beteiligt ist.
Das Alter
Die orale Clearance von Quetiapin war bei älteren Patienten (≥ 65 Jahre, n = 9) im Vergleich zu jungen Patienten (n = 12) um 40 % verringert, und eine Dosisanpassung kann erforderlich sein [siehe DOSIERUNG UND ANWENDUNG ].
Geschlecht
Es gibt keinen geschlechtsspezifischen Einfluss auf die Pharmakokinetik von Quetiapin.
Wettrennen
Es gibt keinen Einfluss der Rasse auf die Pharmakokinetik von Quetiapin.
Rauchen
Rauchen hat keinen Einfluss auf die orale Clearance von Quetiapin.
Niereninsuffizienz
Patienten mit schwerer Nierenfunktionsstörung (Clcr = 10-30 ml/min/1,73 m2, n=8) hatten eine um 25 % niedrigere mittlere orale Clearance als gesunde Probanden (Clcr > 80 ml/min/1,73 m2, n=8), aber Die Quetiapin-Plasmakonzentrationen bei Patienten mit Niereninsuffizienz lagen innerhalb des Konzentrationsbereichs, der bei normalen Patienten beobachtet wurde, die die gleiche Dosis erhielten. Eine Dosisanpassung ist daher bei diesen Patienten nicht erforderlich [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Leberinsuffizienz
Patienten mit eingeschränkter Leberfunktion (n = 8) hatten eine um 30 % niedrigere mittlere orale Clearance von Quetiapin als gesunde Probanden. Bei zwei der 8 Patienten mit eingeschränkter Leberfunktion waren AUC und Cmax dreimal höher als die typischerweise bei gesunden Probanden beobachteten. Da Quetiapin extensiv von der Leber metabolisiert wird, werden höhere Plasmaspiegel bei Patienten mit eingeschränkter Leberfunktion erwartet, und eine Dosisanpassung kann erforderlich sein [siehe DOSIERUNG UND ANWENDUNG und VERWENDUNG IN BESTIMMTEN POPULATIONEN ].
Arzneimittelwechselwirkungsstudien
Die In-vivo-Bewertungen der Wirkung anderer Arzneimittel auf die Pharmakokinetik von Quetiapin sind in Tabelle 17 zusammengefasst [vgl DOSIERUNG UND ANWENDUNG und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Daten zur In-vitro-Enzymhemmung deuten darauf hin, dass Quetiapin und 9 seiner Metaboliten eine geringe hemmende Wirkung auf den durch die Cytochrome CYP 1A2, 2C9, 2C19, 2D6 und 3A4 vermittelten In-vivo-Metabolismus haben würden. Quetiapin in Dosen von 750 mg/Tag hatte keinen Einfluss auf die Pharmakokinetik einer Einzeldosis von Antipyrin, Lithium oder Lorazepam (Tabelle 18) [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Tiertoxikologie und/oder Pharmakologie
Quetiapin verursachte eine dosisabhängige Zunahme der Pigmentablagerung in der Schilddrüse in Toxizitätsstudien an Ratten, die 4 Wochen oder länger dauerten, und in einer 2-jährigen Kanzerogenitätsstudie an Mäusen. In Rattenstudien betrugen die Dosen 10, 25, 50, 75, 150 und 250 mg/kg, was ungefähr dem 0,1-, 0,3-, 0,6-, 1-, 2- und 3-fachen der MRHD von 800 mg/Tag, basierend auf mg/m2 Körperoberfläche, entspricht , beziehungsweise. Die Dosen in der Karzinogenitätsstudie an Mäusen betrugen 20, 75, 250 und 750 mg/kg, was ungefähr dem 0,1-, 0,5-, 1,5- und 4,5-fachen der MRHD von 800 mg/Tag, basierend auf mg/m2 Körperoberfläche, entspricht. Es wurde gezeigt, dass die Pigmentablagerung bei Ratten irreversibel ist. Die Identität des Pigments konnte nicht bestimmt werden, es wurde jedoch festgestellt, dass es zusammen mit Quetiapin in follikulären Epithelzellen der Schilddrüse lokalisiert ist. Die funktionellen Auswirkungen und die Relevanz dieses Befunds für das menschliche Risiko sind nicht bekannt.
Bei Hunden, die Quetiapin für 6 oder 12 Monate, aber nicht für 1 Monat erhielten, traten bei einer Dosis von 100 mg/kg oder dem 4-fachen der MRHD von 800 fokale dreieckige Katarakte an der Verbindungsstelle der hinteren Nähte in der äußeren Kortikalis der Linse auf mg/Tag basierend auf mg/m2 Körperoberfläche. Dieser Befund kann auf die Hemmung der Cholesterinbiosynthese durch Quetiapin zurückzuführen sein. Quetiapin verursachte in Studien mit wiederholter Gabe an Hunden und Affen eine dosisabhängige Senkung des Plasmacholesterinspiegels; es gab jedoch keine Korrelation zwischen Plasmacholesterin und dem Vorhandensein von Katarakten bei einzelnen Hunden. Das Auftreten von delta-8-Cholestanol im Plasma steht im Einklang mit der Hemmung eines späten Stadiums der Cholesterinbiosynthese bei diesen Spezies. In einer speziellen Studie an mit Quetiapin behandelten weiblichen Hunden wurde auch eine 25%ige Verringerung des Cholesteringehalts der äußeren Kortikalis der Linse beobachtet. Arzneimittelbedingte Katarakte wurden bei keiner anderen Spezies beobachtet; In einer 1-Jahres-Studie an Affen wurde jedoch bei 2/7 Frauen bei einer Dosis von 225 mg/kg oder dem 5,5-fachen der MRHD von 800 mg/Tag, basierend auf mg/m2 Körper, ein gestreiftes Aussehen der vorderen Linsenoberfläche festgestellt Oberfläche.
Klinische Studien
Schizophrenie
Kurzzeitversuche-Erwachsene
Die Wirksamkeit von SEROQUEL 50 mg bei der Behandlung von Schizophrenie wurde in 3 kontrollierten Kurzzeitstudien (6 Wochen) mit stationären Patienten mit Schizophrenie nachgewiesen, die die DSM III-R-Kriterien für Schizophrenie erfüllten. Obwohl in einer der drei Studien ein Arm mit einer einzelnen Haloperidol-Festdosis als Vergleichsbehandlung eingeschlossen wurde, war diese Gruppe mit einer einzelnen Haloperidol-Dosis nicht geeignet, um einen zuverlässigen und gültigen Vergleich zwischen SEROQUEL 200 mg und Haloperidol zu ermöglichen.
In diesen Studien wurden mehrere Instrumente zur Bewertung psychiatrischer Anzeichen und Symptome verwendet, darunter die Brief Psychiatric Rating Scale (BPRS), eine aus mehreren Elementen bestehende Bestandsaufnahme der allgemeinen Psychopathologie, die traditionell zur Bewertung der Auswirkungen einer medikamentösen Behandlung bei Schizophrenie verwendet wird. Das BPRS-Psychose-Cluster (konzeptionelle Desorganisation, halluzinatorisches Verhalten, Misstrauen und ungewöhnliche Gedankeninhalte) gilt als besonders nützliche Untergruppe zur Beurteilung aktiv psychotischer schizophrener Patienten. Eine zweite traditionelle Bewertung, der Clinical Global Impression (CGI), spiegelt den Eindruck eines erfahrenen Beobachters, der mit den Manifestationen der Schizophrenie vollständig vertraut ist, über den klinischen Gesamtzustand des Patienten wider.
Die Ergebnisse der Versuche folgen:
Die primären Wirksamkeitsergebnisse dieser drei Studien zur Behandlung von Schizophrenie bei Erwachsenen sind in Tabelle 19 dargestellt.
Die Untersuchung von Bevölkerungsuntergruppen (Rasse, Geschlecht und Alter) ergab keine unterschiedliche Reaktionsfähigkeit auf der Grundlage von Rasse oder Geschlecht, mit einer offensichtlich größeren Wirkung bei Patienten unter 40 Jahren im Vergleich zu Patienten über 40. Die klinische Bedeutung von dieser Befund ist unbekannt.
Jugendliche (13-17 Jahre)
Die Wirksamkeit von SEROQUEL 300 mg bei der Behandlung von Schizophrenie bei Jugendlichen (im Alter von 13 bis 17 Jahren) wurde in einer 6-wöchigen, doppelblinden, placebokontrollierten Studie (Studie 4) nachgewiesen. Patienten, die die DSM-IV-Diagnosekriterien für Schizophrenie erfüllten, wurden randomisiert einer von drei Behandlungsgruppen zugeteilt: SEROQUEL 400 mg/Tag (n=73), SEROQUEL 800 mg/Tag (n=74) oder Placebo (n=75). Die Studienmedikation wurde mit 50 mg/Tag begonnen und am Tag 2 auf 100 mg/Tag erhöht (aufgeteilt und zwei- oder dreimal täglich verabreicht). Anschließend wurde die Dosis auf die Zieldosis von 400 mg/Tag oder 800 mg/Tag in Schritten von 100 mg/Tag titriert, aufgeteilt und zwei- oder dreimal täglich verabreicht. Die primäre Wirksamkeitsvariable war die mittlere Veränderung gegenüber dem Ausgangswert auf der gesamten positiven und negativen Syndromskala (PANSS).
SEROQUEL mit 400 mg/Tag und 800 mg/Tag war Placebo bei der Reduktion des PANSS-Gesamtscores überlegen. Die primären Wirksamkeitsergebnisse dieser Studie bei der Behandlung von Schizophrenie bei Jugendlichen sind in Tabelle 19 dargestellt.
Bipolare Störung
Bipolare I-Störung, manische oder gemischte Episoden
Erwachsene
Die Wirksamkeit von SEROQUEL bei der akuten Behandlung von manischen Episoden wurde in 3 placebokontrollierten Studien bei Patienten nachgewiesen, die die DSM-IV-Kriterien für eine Bipolar-I-Störung mit manischen Episoden erfüllten. Diese Studien schlossen Patienten mit oder ohne psychotische Merkmale ein und schlossen Patienten mit Rapid Cycling und gemischten Episoden aus. Von diesen Studien waren 2 eine Monotherapie (12 Wochen) und 1 eine Zusatztherapie (3 Wochen) zu entweder Lithium oder Divalproex. Die wichtigsten Ergebnisse dieser Studien waren die Veränderung des Young Mania Rating Scale (YMRS)-Scores gegenüber dem Ausgangswert nach 3 und 12 Wochen für die Monotherapie und nach 3 Wochen für die Zusatztherapie. Eine Zusatztherapie ist definiert als die gleichzeitige Einleitung oder anschließende Verabreichung von SEROQUEL 100 mg mit Lithium oder Divalproex.
Das primäre Bewertungsinstrument, das in diesen Studien zur Bewertung manischer Symptome verwendet wurde, war YMRS, eine 11-Punkte-Skala, die von Klinikern bewertet wurde und traditionell zur Bewertung des Grades manischer Symptomatik verwendet wird (Reizbarkeit, störendes/aggressives Verhalten, Schlaf, gehobene Stimmung, Sprache, erhöhte Aktivität, sexuelles Interesse, Sprach-/Denkstörung, Gedankeninhalt, Aussehen und Einsicht) in einem Bereich von 0 (keine manischen Züge) bis 60 (maximale Punktzahl).
Die Ergebnisse der Versuche folgen:
Monotherapie
Die Wirksamkeit von SEROQUEL bei der Akutbehandlung der bipolaren Manie wurde in 2 placebokontrollierten Studien nachgewiesen. In zwei 12-wöchigen Studien (n = 300, n = 299), in denen SEROQUEL mit Placebo verglichen wurde, war SEROQUEL 300 mg Placebo bei der Reduzierung des YMRS-Gesamtscores in Woche 3 und 12 überlegen. Die Mehrheit der Patienten in diesen Studien nahm SEROQUEL 100 mg ein wurden in einem Bereich zwischen 400 mg/Tag und 800 mg pro Tag dosiert (Studien 1 und 2 in Tabelle 20).
Zusatztherapie
In dieser 3-wöchigen placebokontrollierten Studie wurden 170 Patienten mit bipolarer Manie (YMRS ≥20) randomisiert und erhielten SEROQUEL 100 mg oder Placebo als Zusatzbehandlung zu Lithium oder Divalproex. Patienten können vor der Randomisierung eine angemessene Behandlung mit Lithium oder Divalproex erhalten haben oder auch nicht. SEROQUEL 50 mg war Placebo überlegen, wenn es zu Lithium oder Divalproex allein bei der Reduzierung des YMRS-Gesamtscores hinzugefügt wurde (Studie 3 in Tabelle 20).
Die Mehrheit der Patienten in dieser Studie, die SEROQUEL 25 mg einnahmen, erhielt eine Dosis zwischen 400 mg/Tag und 800 mg pro Tag. In einer ähnlich angelegten Studie (n=200) war SEROQUEL mit einer Verbesserung der YMRS-Scores verbunden, zeigte jedoch keine Überlegenheit gegenüber Placebo, möglicherweise aufgrund eines höheren Placebo-Effekts.
Die primären Wirksamkeitsergebnisse dieser Studien zur Behandlung von Manie bei Erwachsenen sind in Tabelle 20 dargestellt.
Kinder und Jugendliche (10-17 Jahre)
Die Wirksamkeit von SEROQUEL bei der akuten Behandlung von manischen Episoden im Zusammenhang mit einer Bipolar-I-Störung bei Kindern und Jugendlichen (im Alter von 10 bis 17 Jahren) wurde in einer 3-wöchigen, doppelblinden, placebokontrollierten, multizentrischen Studie nachgewiesen (Studie 4 in Tabelle 20). Patienten, die die DSM-IV-Diagnosekriterien für eine manische Episode erfüllten, wurden in eine von drei Behandlungsgruppen randomisiert: SEROQUEL 400 mg/Tag (n=95), SEROQUEL 600 mg/Tag (n=98) oder Placebo (n=91) . Die Studienmedikation wurde mit 50 mg/Tag begonnen und am Tag 2 auf 100 mg/Tag erhöht (geteilte Dosen zwei- oder dreimal täglich). Anschließend wurde die Dosis auf eine Zieldosis von 400 mg/Tag oder 600 mg/Tag unter Verwendung von Schritten von 100 mg/Tag titriert, die in geteilten Dosen zwei- oder dreimal täglich verabreicht wurden. Die primäre Wirksamkeitsvariable war die mittlere Veränderung des YMRS-Gesamtscores gegenüber dem Ausgangswert.
SEROQUEL 400 mg/Tag und 600 mg/Tag waren Placebo bei der Verringerung des YMRS-Gesamtscores überlegen (Tabelle 20).
Bipolare Störung, depressive Episoden
Erwachsene
Die Wirksamkeit von SEROQUEL 25 mg zur akuten Behandlung depressiver Episoden im Zusammenhang mit einer bipolaren Störung wurde in 2 identisch konzipierten 8-wöchigen, randomisierten, doppelblinden, placebokontrollierten Studien (N = 1045) nachgewiesen (Studien 5 und 6 in Tabelle 21). . Diese Studien umfassten Patienten mit Bipolar-I- oder -II-Störung und solche mit oder ohne Rapid-Cycling-Kurs. Patienten, die auf SEROQUEL 200 mg randomisiert wurden, erhielten feste Dosen von entweder 300 mg oder 600 mg einmal täglich.
Das primäre Bewertungsinstrument zur Bewertung depressiver Symptome in diesen Studien war die Montgomery-Asberg-Depressionsbewertungsskala (MADRS), eine 10-Punkte-Skala, die von Ärzten mit Werten von 0 bis 60 bewertet wurde. Der primäre Endpunkt in beiden Studien war die Veränderung von Ausgangswert des MADRS-Scores in Woche 8. In beiden Studien war SEROQUEL 50 mg Placebo bei der Senkung des MADRS-Scores überlegen. Eine Verbesserung der Symptome, gemessen an der Veränderung des MADRS-Scores im Vergleich zu Placebo, wurde in beiden Studien an Tag 8 (Woche 1) und danach beobachtet. In diesen Studien wurde bei der 600-mg-Dosis kein zusätzlicher Nutzen festgestellt. Bei der 300-mg-Dosisgruppe wurden statistisch signifikante Verbesserungen gegenüber Placebo bei der allgemeinen Lebensqualität und der Zufriedenheit in Bezug auf verschiedene Funktionsbereiche beobachtet, gemessen mit dem Q-LES-Q(SF).
Die primären Wirksamkeitsergebnisse dieser Studien bei der akuten Behandlung depressiver Episoden im Zusammenhang mit einer bipolaren Störung bei Erwachsenen sind in Tabelle 21 dargestellt.
Erhaltungsbehandlung als Ergänzung zu Lithium oder Divalproex
Die Wirksamkeit von SEROQUEL 100 mg bei der Erhaltungstherapie der Bipolar-I-Störung wurde in 2 placebokontrollierten Studien bei Patienten (n=1326) nachgewiesen, die die DSM-IV-Kriterien für Bipolar-I-Störung erfüllten (Studien 7 und 8 in Abbildungen 1 und 2). Die Studien umfassten Patienten, deren jüngste Episode manisch, depressiv oder gemischt war, mit oder ohne psychotische Merkmale. In der Open-Label-Phase mussten die Patienten mindestens 12 Wochen lang stabil auf SEROQUEL plus Lithium oder Divalproex sein, um randomisiert zu werden. Im Durchschnitt wurden die Patienten für 15 Wochen stabilisiert. In der Randomisierungsphase setzten die Patienten die Behandlung mit Lithium oder Divalproex fort und erhielten randomisiert entweder SEROQUEL (verabreicht zweimal täglich mit insgesamt 400 mg/Tag bis 800 mg/Tag) oder Placebo. Etwa 50 % der Patienten hatten die SEROQUEL-Gruppe bis Tag 280 und 50 % der Placebo-Gruppe bis Tag 117 der doppelblinden Behandlung abgebrochen. Der primäre Endpunkt in diesen Studien war die Zeit bis zum Wiederauftreten eines Stimmungsereignisses (manische, gemischte oder depressive Episode). Ein Stimmungsereignis wurde als Einleitung einer Medikation oder Krankenhausaufenthalt wegen einer Stimmungsepisode definiert; YMRS-Score≥20 oder MADRS-Score≥20 bei 2 aufeinanderfolgenden Bewertungen; oder Studienabbruch aufgrund eines Stimmungsereignisses (Abbildung 1 und Abbildung 2).
In beiden Studien war SEROQUEL dem Placebo bei der Verlängerung der Zeit bis zum Wiederauftreten jeglicher Stimmungsschwankungen überlegen. Der Behandlungseffekt war für die Verlängerung der Zeit bis zum Wiederauftreten sowohl manischer als auch depressiver Episoden vorhanden. Die Wirkung von SEROQUEL war unabhängig von einer bestimmten Untergruppe (zugewiesener Stimmungsstabilisator, Geschlecht, Alter, Rasse, jüngste bipolare Episode oder Rapid-Cycling-Kurs).
Abbildung 1: Kaplan-Meier-Kurven der Zeit bis zum Wiederauftreten eines Stimmungsereignisses (Studie 7)
Abbildung 2: Kaplan-Meier-Kurven der Zeit bis zum Wiederauftreten eines Stimmungsereignisses (Studie 8)
INFORMATIONEN ZUM PATIENTEN
SEROQUEL (SER-oh-kwell)(Quetiapinfumarat) Tabletten
Lesen Sie diesen Arzneimittelleitfaden, bevor Sie mit der Einnahme von SEROQUEL beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung.
Was sind die wichtigsten Informationen, die ich über SEROQUEL wissen sollte?
SEROQUEL 100 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Rufen Sie sofort einen Arzt an, wenn Sie oder Ihr Familienmitglied eines der folgenden Symptome haben, insbesondere wenn sie neu oder schlimmer sind oder Sie beunruhigen:
Was muss ich sonst noch über Antidepressiva wissen?
Was ist SEROQUEL 300mg?
SEROQUEL 100 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von:
Es ist nicht bekannt, ob SEROQUEL 100 mg bei Kindern unter 10 Jahren sicher und wirksam ist.
Was sollte ich meinem Arzt vor der Einnahme von SEROQUEL 100 mg mitteilen?
Bevor Sie SEROQUEL 200 mg einnehmen, informieren Sie Ihren Arzt, wenn Sie Folgendes haben oder hatten:
Informieren Sie den Arzt über alle Arzneimittel, die Sie einnehmen oder kürzlich eingenommen haben einschließlich verschreibungspflichtiger Arzneimittel, rezeptfreier Arzneimittel, Kräuterergänzungen und Vitamine.
SEROQUEL 300 mg und andere Arzneimittel können sich gegenseitig beeinflussen und schwerwiegende Nebenwirkungen verursachen. SEROQUEL 200 mg kann die Wirkungsweise anderer Arzneimittel beeinflussen, und andere Arzneimittel können die Wirkungsweise von SEROQUEL 200 mg beeinflussen.
Teilen Sie Ihrem medizinischen Betreuer mit, wenn Sie einen Drogenscreening im Urin haben, da SEROQUEL Ihre Testergebnisse beeinflussen kann. Teilen Sie den Testpersonen mit, dass Sie SEROQUEL einnehmen.
Wie sollte ich SEROQUEL einnehmen?
Was sollte ich während der Einnahme von SEROQUEL 100 mg vermeiden?
Welche Nebenwirkungen kann SEROQUEL 300 mg haben?
SEROQUEL 200 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Bei manchen Personen, die SEROQUEL einnehmen, kann es zu Blutzuckererhöhungen kommen. Extrem hoher Blutzucker kann zu Koma oder Tod führen. Wenn Sie an Diabetes oder Risikofaktoren für Diabetes leiden (z. B. Übergewicht oder Diabetes in der Familie), sollte Ihr Arzt Ihren Blutzuckerspiegel vor Beginn der Behandlung mit SEROQUEL 50 mg und während der Behandlung kontrollieren. Rufen Sie Ihren Arzt an, wenn Sie während der Einnahme von SEROQUEL eines dieser Symptome eines hohen Blutzuckers (Hyperglykämie) haben:
Zu den häufigsten Nebenwirkungen von SEROQUEL 50 mg gehören:
Bei Erwachsenen:
Bei Kindern und Jugendlichen:
Dies sind nicht alle möglichen Nebenwirkungen von SEROQUEL. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie sollte ich SEROQUEL 100 mg aufbewahren?
Allgemeine Informationen zur sicheren und wirksamen Anwendung von SEROQUEL
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie SEROQUEL nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie SEROQUEL nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Dieser Arzneimittelleitfaden fasst die wichtigsten Informationen zu SEROQUEL zusammen. Wenn Sie weitere Informationen wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Apotheker oder Gesundheitsdienstleister nach Informationen über SEROQUEL 100 mg fragen, die für Angehörige der Gesundheitsberufe bestimmt sind.
Weitere Informationen finden Sie unter www.SEROQUEL.com , oder rufen Sie 1-800-236-9933 an.
Welche Inhaltsstoffe enthält SEROQUEL 200 mg?
Wirkstoff: Quetiapinfumarat
Inaktive Zutaten: Povidon, dibasisches Dicalciumphosphatdihydrat, mikrokristalline Cellulose, Natriumstärkeglycolat, Lactosemonohydrat, Magnesiumstearat, Hypromellose, Polyethylenglycol und Titandioxid. Die 25-mg-Tabletten enthalten rotes und gelbes Eisenoxid. Die 100-mg- und 400-mg-Tabletten enthalten nur gelbes Eisenoxid.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.