Effexor 37.5mg, 75mg Venlafaxine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
INFORMATIONEN ZUM PATIENTEN
Effexor (Venlafaxin) (ven-la-fax-een) Tabletten, USP
Lesen Sie den Medikationsleitfaden, der mit Venlafaxin-Tabletten geliefert wird, USP, bevor Sie mit der Einnahme beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Dieser Medikationsleitfaden ersetzt nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung. Sprechen Sie mit Ihrem Arzt, wenn Sie etwas nicht verstehen oder mehr darüber erfahren möchten.
Was sind die wichtigsten Informationen, die ich über Venlafaxin-Tabletten, USP wissen sollte?
Venlafaxin-Tabletten, USP und andere Antidepressiva können schwerwiegende Nebenwirkungen haben, einschließlich:
1. Selbstmordgedanken oder -handlungen:
Halten Sie alle Nachsorgetermine bei Ihrem Arzt und rufen Sie zwischen den Terminen an, wenn Sie sich wegen der Symptome Sorgen machen.
Rufen Sie sofort Ihren Arzt an, wenn Sie eines der folgenden Symptome haben, oder rufen Sie 911 an, wenn ein Notfall auftritt, insbesondere wenn sie neu oder schlimmer sind oder Sie sich Sorgen machen:
Rufen Sie sofort Ihren Arzt an, wenn Sie eines der folgenden Symptome haben, oder rufen Sie im Notfall 911 an. Venlafaxin-Tabletten, USP können mit diesen schwerwiegenden Nebenwirkungen in Verbindung gebracht werden:
2. Serotonin-Syndrom
Dieser Zustand kann lebensbedrohlich sein und Folgendes umfassen:
3. Veränderungen des Blutdrucks. Venlafaxin Tabletten, USP kann:
4. Vergrößerte Pupillen (Mydriasis).
5. Angst und Schlaflosigkeit.
6. Veränderungen des Appetits oder des Gewichts.
7. Manische/hypomane Episoden:
8. Niedriger Salz- (Natrium-)Spiegel im Blut.
Ältere Menschen sind möglicherweise einem höheren Risiko ausgesetzt. Zu den Symptomen können gehören:
9. Krampfanfälle oder Krämpfe.
10. Anormale Blutungen: Venlafaxin-Tabletten, USP und andere Antidepressiva können Ihr Risiko für Blutungen oder Blutergüsse erhöhen, insbesondere wenn Sie den Blutverdünner Warfarin (Coumadin®, Jantoven®), ein nichtsteroidales Antirheumatikum (NSAIDs, wie z Ibuprofen oder Naproxen) oder Aspirin.
11. Erhöhter Cholesterinspiegel.
12. Lungenerkrankungen und Lungenentzündung: Venlafaxin-Tabletten, USP, können seltene Lungenprobleme verursachen. Zu den Symptomen gehören:
13. Schwere allergische Reaktionen:
14. Visuelle Probleme:
Nur einige Menschen sind für diese Probleme gefährdet. Möglicherweise möchten Sie sich einer Augenuntersuchung unterziehen, um festzustellen, ob Sie gefährdet sind, und eine vorbeugende Behandlung erhalten, wenn dies der Fall ist.
Setzen Sie Venlafaxine Tablets, USP nicht ab, ohne vorher mit Ihrem Arzt gesprochen zu haben. Ein zu schnelles Absetzen von Venlafaxin-Tabletten, USP oder ein zu schneller Wechsel von einem anderen Antidepressivum kann zu schwerwiegenden Symptomen führen, einschließlich:
Was sind Venlafaxin-Tabletten, USP?
Venlafaxin Tabletten, USP ist ein verschreibungspflichtiges Medikament zur Behandlung von Depressionen. Es ist wichtig, mit Ihrem Arzt über die Risiken der Behandlung von Depressionen und auch über die Risiken einer Nichtbehandlung zu sprechen. Sie sollten alle Behandlungsoptionen mit Ihrem Arzt besprechen.
Sprechen Sie mit Ihrem Arzt, wenn Sie nicht glauben, dass sich Ihr Zustand mit Venlafaxin-Tabletten, USP-Behandlung, bessert.
Wer sollte Venlafaxin-Tabletten, USP nicht einnehmen?
Personen, die Venlafaxin-Tabletten kurz vor einem MAO-Hemmer einnehmen, können schwerwiegende oder sogar lebensbedrohliche Nebenwirkungen haben. Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines dieser Symptome haben:
Was sollte ich meinem Arzt vor der Einnahme von Venlafaxin-Tabletten, USP, mitteilen? Fragen Sie nach, wenn Sie sich nicht sicher sind.
Bevor Sie mit Venlafaxin-Tabletten beginnen, informieren Sie Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und pflanzlicher Nahrungsergänzungsmittel. Venlafaxin-Tabletten, USP und einige Arzneimittel können miteinander interagieren, möglicherweise nicht so gut wirken oder schwerwiegende Nebenwirkungen verursachen.
Ihr Arzt oder Apotheker kann Ihnen sagen, ob es sicher ist, Venlafaxin-Tabletten, USP, zusammen mit Ihren anderen Arzneimitteln einzunehmen. Beginnen oder beenden Sie kein Arzneimittel, während Sie Venlafaxin-Tabletten einnehmen, ohne vorher mit Ihrem Arzt gesprochen zu haben.
Wenn Sie Venlafaxin-Tabletten, USP, einnehmen, sollten Sie keine anderen Arzneimittel einnehmen, die (Venlafaxin) enthalten, einschließlich: Venlafaxin-HCl.
Wie sollte ich Venlafaxin-Tabletten, USP, einnehmen?
Was sollte ich während der Einnahme von Venlafaxin-Tabletten, USP, vermeiden?
Venlafaxin-Tabletten, USP können Schläfrigkeit verursachen oder Ihre Fähigkeit beeinträchtigen, Entscheidungen zu treffen, klar zu denken oder schnell zu reagieren.
Sie sollten kein Fahrzeug führen, schwere Maschinen bedienen oder andere gefährliche Tätigkeiten ausüben, bis Sie wissen, wie Venlafaxin-Tabletten, USP, auf Sie wirkt. Trinken Sie keinen Alkohol, während Sie Venlafaxin-Tabletten, USP, verwenden.
Was sind die möglichen Nebenwirkungen von Venlafaxine Tablets, USP?
Venlafaxin-Tabletten, USP können schwerwiegende Nebenwirkungen verursachen, einschließlich:
Überprüfen Sie regelmäßig den Augendruck, wenn Sie:
Häufige mögliche Nebenwirkungen bei Personen, die Venlafaxin-Tabletten, USP, einnehmen, umfassen:
ungewöhnliche Träume
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Venlafaxin-Tabletten, USP.
Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
RUFEN SIE IHREN ARZT FÜR ÄRZTLICHE RATSCHLÄGE ÜBER NEBENWIRKUNGEN AN. SIE KÖNNEN NEBENWIRKUNGEN DER FDA UNTER 1-800-FDA-1088 MELDEN.
Wie soll ich Venlafaxine Tablets, USP aufbewahren?
Bewahren Sie Venlafaxin-Tabletten, USP und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zu Venlafaxin-Tabletten, USP-Arzneimittel werden manchmal für andere als die in einem Arzneimittelleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie keine Venlafaxin-Tabletten, USP für einen Zustand, für den es nicht verschrieben wurde. Geben Sie Venlafaxin-Tabletten, USP, nicht an andere Personen, selbst wenn sie denselben Zustand haben. Es kann ihnen schaden.
Dieser Arzneimittelleitfaden fasst die wichtigsten Informationen zu Venlafaxin-Tabletten, USP, zusammen. Wenn Sie weitere Informationen wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Arzt oder Apotheker um Informationen über Venlafaxin-Tabletten bitten, USP, die für medizinisches Fachpersonal geschrieben wurden.
Wenden Sie sich unter 1-800-818-4555 an Sun Pharmaceutical Industries, Inc., um VERMUTLICHE NEBENWIRKUNGEN zu melden.
Was sind die Inhaltsstoffe in Venlafaxin-Tabletten, USP?
Wirkstoff: (Venlafaxin)
Inaktive Zutaten:
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration für alle Antidepressiva genehmigt.
INDIKATIONEN
Depression
Effexor XR (Venlafaxinhydrochlorid)-Kapseln mit verlängerter Wirkstofffreisetzung sind für die Behandlung von Major Depression (MDD) indiziert. Die Wirksamkeit wurde in drei Kurzzeit- (4, 8 und 12 Wochen) und zwei Langzeit-Erhaltungsstudien nachgewiesen.
Generalisierte Angststörung
Effexor XR ist angezeigt zur Behandlung der generalisierten Angststörung (GAD). Die Wirksamkeit wurde in zwei 8-wöchigen und zwei 26-wöchigen placebokontrollierten Studien nachgewiesen.
Soziale Angststörung
Effexor XR ist angezeigt zur Behandlung der sozialen Angststörung (SAD), auch bekannt als soziale Phobie. Die Wirksamkeit wurde in vier 12-wöchigen und einer 26-wöchigen placebokontrollierten Studie nachgewiesen.
Panikstörung
Effexor XR ist angezeigt zur Behandlung von Panikstörungen (PD) mit oder ohne Agoraphobie. Die Wirksamkeit wurde in zwei 12-wöchigen placebokontrollierten Studien nachgewiesen.
DOSIERUNG UND ANWENDUNG
Effexor 37,5 mg XR sollte in einer Einzeldosis zusammen mit einer Mahlzeit verabreicht werden, entweder morgens oder abends, jeden Tag ungefähr zur gleichen Zeit [siehe KLINISCHE PHARMAKOLOGIE ]. Jede Kapsel sollte im Ganzen mit Flüssigkeit geschluckt und nicht geteilt, zerdrückt, gekaut oder in Wasser gelegt werden, oder sie kann verabreicht werden, indem die Kapsel vorsichtig geöffnet und der gesamte Inhalt auf einen Löffel Apfelmus gestreut wird. Diese Arzneimittel-Nahrungs-Mischung sollte sofort ohne Kauen geschluckt und anschließend mit einem Glas Wasser geschluckt werden, um sicherzustellen, dass die Pellets (Sphäroide) vollständig geschluckt werden.
Depression
Für die meisten Patienten beträgt die empfohlene Anfangsdosis für Effexor 37,5 mg XR 75 mg pro Tag, verabreicht in einer Einzeldosis. Bei einigen Patienten kann es wünschenswert sein, mit 37,5 mg pro Tag für 4 bis 7 Tage zu beginnen, damit neue Patienten sich an das Medikament gewöhnen können, bevor sie auf 75 mg pro Tag erhöhen. Patienten, die nicht auf die Anfangsdosis von 75 mg pro Tag ansprechen, können von einer Dosiserhöhung auf maximal 225 mg pro Tag profitieren. Dosiserhöhungen sollten je nach Bedarf in Schritten von bis zu 75 mg pro Tag und in Abständen von mindestens 4 Tagen erfolgen, da Steady-State-Plasmaspiegel von Venlafaxin und seinen Hauptmetaboliten bei den meisten Patienten am 4. Tag erreicht werden [sehen KLINISCHE PHARMAKOLOGIE ]. In den klinischen Studien zur Wirksamkeit war eine Auftitration in Abständen von 2 Wochen oder mehr erlaubt.
Es sollte beachtet werden, dass, während die empfohlene Höchstdosis für ambulante Patienten mit mäßiger Depression ebenfalls 225 mg pro Tag für Effexor (mit sofortiger Freisetzung) beträgt, stationäre Patienten mit schwererer Depression in einer Studie des Entwicklungsprogramms für dieses Produkt auf eine mittlere Dosis von 350 mg ansprachen mg pro Tag (Bereich von 150 bis 375 mg pro Tag). Ob höhere Dosen von Effexor 37,5 mg XR für schwerer depressive Patienten erforderlich sind oder nicht, ist nicht bekannt; Die Erfahrung mit Effexor 75 mg XR-Dosen von mehr als 225 mg pro Tag ist jedoch sehr begrenzt.
Generalisierte Angststörung
Für die meisten Patienten beträgt die empfohlene Anfangsdosis für Effexor XR 75 mg pro Tag, verabreicht in einer Einzeldosis. Bei einigen Patienten kann es wünschenswert sein, mit 37,5 mg pro Tag für 4 bis 7 Tage zu beginnen, damit neue Patienten sich an das Medikament gewöhnen können, bevor sie auf 75 mg pro Tag erhöhen. Patienten, die nicht auf die Anfangsdosis von 75 mg pro Tag ansprechen, können von einer Dosiserhöhung auf maximal 225 mg pro Tag profitieren. Dosiserhöhungen sollten je nach Bedarf in Schritten von bis zu 75 mg pro Tag und in Abständen von mindestens 4 Tagen erfolgen, da Steady-State-Plasmaspiegel von Venlafaxin und seinen Hauptmetaboliten bei den meisten Patienten am 4. Tag erreicht werden [sehen KLINISCHE PHARMAKOLOGIE ].
Soziale Angststörung (Soziale Phobie)
Die empfohlene Dosis beträgt 75 mg pro Tag, verabreicht als Einzeldosis. Es gab keine Hinweise darauf, dass höhere Dosen einen zusätzlichen Nutzen bringen.
Panikstörung
Die empfohlene Anfangsdosis beträgt 37,5 mg Effexor 75 mg XR pro Tag für 7 Tage. Patienten, die auf 75 mg pro Tag nicht ansprechen, können von einer Dosiserhöhung auf maximal etwa 225 mg pro Tag profitieren. Dosiserhöhungen sollten je nach Bedarf in Schritten von bis zu 75 mg pro Tag und in Abständen von mindestens 7 Tagen erfolgen.
Umstellung von Patienten von Effexor 37,5 mg Tabletten
Depressive Patienten, die derzeit mit einer therapeutischen Dosis von Effexor (mit sofortiger Freisetzung) behandelt werden, können auf Effexor 37,5 mg XR in der nächsten äquivalenten Dosis (mg pro Tag) umgestellt werden, z. B. 37,5 mg Venlafaxin zweimal täglich auf 75 mg Effexor 75 mg XR einmal täglich. Es können jedoch individuelle Dosisanpassungen erforderlich sein.
Spezifische Populationen
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit leichter (Child-Pugh = 5-6) bis mäßiger (Child-Pugh = 7-9) Leberfunktionsstörung sollte die tägliche Gesamtdosis um 50 % reduziert werden. Bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh = 10-15) oder Leberzirrhose kann es erforderlich sein, die Dosis um 50 % oder mehr zu reduzieren [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit leichter (CLcr = 60 – 89 ml/min) oder mäßiger (CLcr = 30 – 59 ml/min) Nierenfunktionsstörung sollte die tägliche Gesamtdosis um 25 % bis 50 % reduziert werden. Bei Patienten, die sich einer Hämodialyse unterziehen oder eine schwere Nierenfunktionsstörung (CLcr Verwendung in bestimmten Bevölkerungsgruppen ].
Erhaltungsbehandlung
Es gibt keine Evidenz aus kontrollierten Studien darüber, wie lange Patienten mit MDD, GAD, SAD oder PD mit Effexor 75 mg XR behandelt werden sollten.
Es besteht allgemein Einigkeit darüber, dass akute Episoden von MDD mehrere Monate oder länger einer anhaltenden pharmakologischen Therapie über das Ansprechen auf die akute Episode hinaus erfordern. Effexor XR/Effexor haben in klinischen Studien ein anhaltendes Ansprechen über einen Zeitraum von bis zu 52 Wochen bei der gleichen Dosis gezeigt, auf die die Patienten während der Erstbehandlung ansprachen [siehe Klinische Studien ]. Es ist nicht bekannt, ob die für die Erhaltungstherapie erforderliche Dosis von Effexor XR mit der Dosis identisch ist, die erforderlich ist, um ein anfängliches Ansprechen zu erzielen. Die Patienten sollten regelmäßig neu untersucht werden, um die Notwendigkeit einer Erhaltungstherapie und die geeignete Dosis für eine solche Behandlung zu bestimmen.
Bei Patienten mit GAD und SAD hat sich Effexor 37,5 mg XR in 6-monatigen klinischen Studien als wirksam erwiesen. Die Notwendigkeit einer Fortsetzung der Medikation bei Patienten mit GAD und SAD, die sich durch die Behandlung mit Effexor XR bessern, sollte regelmäßig neu bewertet werden.
In einer klinischen Studie für PD erlebten Patienten, die Effexor 75 mg XR in der gleichen Dosis erhielten, auf die sie während der ersten 12 Behandlungswochen ansprachen, eine statistisch signifikant längere Zeit bis zum Rückfall als Patienten, die randomisiert Placebo erhielten [siehe Klinische Studien ]. Die Notwendigkeit einer fortgesetzten Medikation bei Patienten mit Parkinson, die sich durch die Behandlung mit Effexor XR bessern, sollte regelmäßig neu bewertet werden.
Absetzen von Effexor XR
Beim Absetzen der Therapie mit Effexor 37,5 mg XR wird eher eine allmähliche Reduzierung der Dosis als ein abruptes Absetzen empfohlen. In klinischen Studien mit Effexor 37,5 mg XR wurde das Ausschleichen erreicht, indem die Tagesdosis in einwöchigen Abständen um 75 mg reduziert wurde. Eine Individualisierung des Taperings kann erforderlich sein [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Bei einigen Patienten muss das Absetzen möglicherweise über einen Zeitraum von mehreren Monaten erfolgen.
Umstellung von Patienten auf oder von einem Monoaminoxidase-Hemmer (MAOI) zur Behandlung psychiatrischer Erkrankungen
Zwischen dem Absetzen eines MAO-Hemmers (zur Behandlung psychiatrischer Erkrankungen) und dem Beginn der Therapie mit Effexor XR sollten mindestens 14 Tage vergehen. Darüber hinaus sollten nach dem Absetzen von Effexor XR mindestens 7 Tage vergehen, bevor mit einem MAO-Hemmer zur Behandlung psychiatrischer Erkrankungen begonnen wird [siehe KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN , und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Anwendung von Effexor XR mit anderen MAO-Hemmern wie Linezolid oder intravenösem Methylenblau
Beginnen Sie Effexor 75 mg XR nicht bei einem Patienten, der mit Linezolid oder intravenösem Methylenblau behandelt wird, da ein erhöhtes Risiko für ein Serotonin-Syndrom besteht. Bei einem Patienten, der eine dringendere Behandlung einer psychiatrischen Erkrankung benötigt, sollten andere Interventionen, einschließlich eines Krankenhausaufenthalts, in Betracht gezogen werden [siehe KONTRAINDIKATIONEN ].
In einigen Fällen kann ein Patient, der bereits eine Therapie mit Effexor 37,5 mg XR erhält, eine dringende Behandlung mit Linezolid oder intravenösem Methylenblau benötigen. Wenn keine akzeptablen Alternativen zu Linezolid oder intravenösem Methylenblau verfügbar sind und der potenzielle Nutzen einer Behandlung mit Linezolid oder intravenösem Methylenblau die Risiken eines Serotonin-Syndroms bei einem bestimmten Patienten überwiegen, sollte Effexor XR unverzüglich abgesetzt und Linezolid oder intravenöses Methylenblau verabreicht werden verwaltet werden können. Überwachen Sie den Patienten für 7 Tage oder bis 24 Stunden nach der letzten Dosis von Linezolid oder intravenösem Methylenblau, je nachdem, was zuerst eintritt, auf Symptome des Serotonin-Syndroms. Die Therapie mit Effexor 75 mg XR kann 24 Stunden nach der letzten Dosis von Linezolid oder intravenösem Methylenblau wieder aufgenommen werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Das Risiko der gleichzeitigen Verabreichung von Methylenblau auf nicht-intravenösem Weg (z. B. als Tabletten zum Einnehmen oder durch lokale Injektion) oder in intravenösen Dosen von viel weniger als 1 mg/kg zusammen mit Effexor XR ist unklar. Der Arzt sollte sich jedoch der Möglichkeit bewusst sein, dass bei einer solchen Anwendung Symptome des Serotonin-Syndroms auftreten können [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
WIE GELIEFERT
Darreichungsformen und Stärken
Effexor 37,5 mg XR® (Venlafaxinhydrochlorid) Kapseln mit verlängerter Freisetzung sind in den folgenden Stärken erhältlich:
Lagerung und Handhabung
Effexor XR® (Venlafaxinhydrochlorid) Kapseln mit verlängerter Freisetzung sind wie folgt erhältlich:
NDC 0008-0837-20, Flasche mit 15 Kapseln in Einheitspackung. NDC 0008-0837-21, Flasche mit 30 Kapseln in Einheitspackung. NDC 0008-0837-22, Flasche mit 90 Kapseln in Einheitspackung. NDC 0008-0837-03, Karton mit 10 Redipak® Blisterstreifen mit je 10 Kapseln.
NDC 0008-0833-20, Flasche mit 15 Kapseln in Einheitspackung. NDC 0008-0833-21, Flasche mit 30 Kapseln in Einheitspackung. NDC 0008-0833-22, Flasche mit 90 Kapseln in Einheitspackung. NDC 0008-0833-03, Karton mit 10 Redipak® Blisterstreifen mit je 10 Kapseln.
NDC 0008-0836-20, Flasche mit 15 Kapseln in Einheitspackung. NDC 0008-0836-21, Flasche mit 30 Kapseln in Einheitspackung. NDC 0008-0836-22, Flasche mit 90 Kapseln in Einheitspackung. NDC 0008-0836-03, Karton mit 10 Redipak® Blisterstreifen mit je 10 Kapseln.
Bei kontrollierter Raumtemperatur von 20° bis 25°C (68° bis 77°F) lagern.
Die Einheitspackung soll als Einheit abgegeben werden.
Vertrieb durch: Wyeth Pharmaceuticals LLC, eine Tochtergesellschaft von Pfizer Inc, Philadelphia, PA 19101. Überarbeitet: Nov. 2021
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden in anderen Abschnitten des Etiketts ausführlicher besprochen:
Klinische Studienerfahrung
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien eines Arzneimittels beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die häufigsten Nebenwirkungen
Die am häufigsten beobachteten Nebenwirkungen in der Datenbank klinischer Studien bei mit Effexor XR behandelten Patienten mit MDD, GAD, SAD und PD (Inzidenz ≥ 5 % und mindestens doppelt so häufig wie Placebo) waren: Übelkeit (30,0 %), Schläfrigkeit (15.3 %), Mundtrockenheit (14,8 %), Schwitzen (11,4 %), abnorme Ejakulation (9,9 %), Anorexie (9,8 %), Verstopfung (9,3 %), Impotenz (5,3 %) und verminderte Libido (5,1 %).
Nebenwirkungen, die als Gründe für den Abbruch der Behandlung berichtet wurden
Kombiniert aus placebokontrollierten Kurzzeitstudien vor der Markteinführung für alle Indikationen brachen 12 % der 3.558 Patienten, die Effexor XR (37,5–225 mg) erhielten, die Behandlung aufgrund einer Nebenwirkung ab, verglichen mit 4 % der 2.197 mit Placebo behandelten Patienten in diesen Studien.Die häufigsten Nebenwirkungen, die bei ≥ 1 % der mit Effexor XR behandelten Patienten in den Kurzzeitstudien (bis zu 12 Wochen) für alle Indikationen zum Absetzen führten, sind in Tabelle 7 aufgeführt.
Häufige Nebenwirkungen in Placebo-kontrollierten Studien
Die Anzahl der Patienten, die mehrere Dosen von Effexor XR während der Beurteilung vor der Markteinführung für jede zugelassene Indikation erhielten, ist in Tabelle 8 aufgeführt. Die Bedingungen und die Dauer der Venlafaxin-Exposition in allen Entwicklungsprogrammen waren sehr unterschiedlich und umfassten (in sich überschneidenden Kategorien) offene und doppelte Blindstudien, unkontrollierte und kontrollierte Studien, stationäre (nur Effexor) und ambulante Studien, Fixdosis- und Titrationsstudien.
Die Häufigkeit häufiger Nebenwirkungen (die bei ≥ 2 % der mit Effexor XR behandelten Patienten auftraten [357 MDD-Patienten, 1.381 GAD-Patienten, 819 SAD-Patienten und 1.001 PD-Patienten] und häufiger als Placebo) bei mit Effexor XR behandelten Patienten in Kürze Placebokontrollierte klinische Studien mit fester und flexibler Dosierung (Dosen von 37,5 bis 225 mg pro Tag) sind in Tabelle 9 aufgeführt.
Das Nebenwirkungsprofil unterschied sich zwischen den verschiedenen Patientenpopulationen nicht wesentlich.
Andere Nebenwirkungen, die in klinischen Studien beobachtet wurden
Körper als Ganzes: Lichtempfindlichkeitsreaktion, Schüttelfrost
Herz-Kreislauf-System: Orthostatische Hypotonie, Synkope, Hypotonie, Tachykardie
Verdauungstrakt: Magen-Darm-Blutung [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ],
Bruxismus Hämisches/Lymphatisches System: Ekchymose [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Stoffwechsel/Ernährung: Hypercholesterinämie, Gewichtszunahme [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ], Gewichtsverlust [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Nervöses System: Krampfanfälle [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ], manische Reaktion [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ], Unruhe, Verwirrtheit, Akathisie, Halluzinationen, Hypertonie, Myoklonus, Depersonalisation, Apathie
Haut und Anhängsel: Urtikaria, Pruritus, Hautausschlag, Alopezie
Besondere Sinne: Mydriasis, Anomalie der Akkommodation, Tinnitus, Geschmacksperversion
Urogenitalsystem: Harnverhalt, beeinträchtigtes Wasserlassen, Harninkontinenz, erhöhte Harnfrequenz, Menstruationsstörungen, die mit vermehrten Blutungen oder vermehrten unregelmäßigen Blutungen einhergehen (z. B. Menorrhagie, Metrorrhagie)
Veränderungen der Vitalzeichen
In placebokontrollierten Premarketing-Studien kam es zu Anstiegen des mittleren Blutdrucks (siehe Tabelle 10). Bei den meisten Indikationen war bei Patienten, die mit Effexor 37,5 mg XRs behandelt wurden, ein dosisabhängiger Anstieg des mittleren systolischen und diastolischen Blutdrucks in Rückenlage erkennbar. In allen klinischen Studien zu MDD, GAD, SAD und PD kam es bei 1,4 % der Patienten in den Effexor XR-Gruppen zu einem Anstieg des SDBP von ≥ 15 mm Hg zusammen mit einem Blutdruck von ≥ 105 mm Hg, verglichen mit 0,9 % der Patienten in den Effexor XR-Gruppen Placebo-Gruppen. In ähnlicher Weise kam es bei 1 % der Patienten in den Effexor 37,5 mg XR-Gruppen zu einem Anstieg des SSBP von ≥ 20 mm Hg bei einem Blutdruck ≥ 180 mm Hg, verglichen mit 0,3 % der Patienten in den Placebo-Gruppen.
Die Behandlung mit Effexor 37,5 mg XR war mit anhaltender Hypertonie verbunden (definiert als behandlungsbedingter diastolischer Blutdruck in Rückenlage [SDBP] ≥ 90 mm Hg und ≥ 10 mm Hg über dem Ausgangswert bei drei aufeinanderfolgenden Besuchen während der Therapie (siehe Tabelle 11). Eine unzureichende Anzahl der Patienten erhielten in klinischen Studien mittlere Dosen von Effexor XR über 300 mg pro Tag, um die Inzidenz eines anhaltenden Blutdruckanstiegs bei diesen höheren Dosen vollständig zu bewerten.
Effexor 37,5 mg XR war in placebokontrollierten Studien vor der Markteinführung mit einem mittleren Anstieg der Pulsfrequenz im Vergleich zu Placebo verbunden (siehe Tabelle 12) [siehe Tabelle 12]. WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Änderungen im Labor
Serum Cholesterin
Effexor XR war in klinischen Studien zu MDD, GAD, SAD und PD vor der Markteinführung mit mittleren Endanstiegen der Serumcholesterinkonzentrationen verbunden, verglichen mit mittleren Endabnahmen bei Placebo (Tabelle 13).
Die Behandlung mit Effexor 75 mg XR (Venlafaxinhydrochlorid)-Kapseln mit verlängerter Wirkstofffreisetzung über bis zu 12 Wochen war in placebokontrollierten Studien vor der Markteinführung bei schweren depressiven Störungen mit einem mittleren Anstieg der Serumcholesterinkonzentration während der Therapie um etwa 1,5 mg/dl im Vergleich zu a mittlere endgültige Abnahme von 7,4 mg/dl für Placebo. Die Behandlung mit Effexor XR über bis zu 8 Wochen und bis zu 6 Monaten war in placebokontrollierten GAD-Studien vor der Markteinführung mit einem mittleren Anstieg der Serumcholesterinkonzentration während der Therapie um etwa 1,0 mg/dl bzw. 2,3 mg/dl verbunden, während Placebo-Patienten auftraten mittlere endgültige Abnahmen von 4,9 mg/dl bzw. 7,7 mg/dl. Die Behandlung mit Effexor XR über bis zu 12 Wochen und bis zu 6 Monaten war in placebokontrollierten Studien zu sozialen Angststörungen vor der Markteinführung mit einem mittleren abschließenden Anstieg der Serumcholesterinkonzentration unter Therapie um etwa 7,9 mg/dl bzw. 5,6 mg/dl verbunden mit mittleren endgültigen Abnahmen von 2,9 bzw. 4,2 mg/dl für Placebo. Die bis zu 12-wöchige Behandlung mit Effexor XR in placebokontrollierten Studien zu Panikstörungen vor der Markteinführung war mit einem mittleren abschließenden Anstieg der Serumcholesterinkonzentration während der Therapie von etwa 5,8 mg/dl verbunden, verglichen mit einem mittleren abschließenden Abfall von 3,7 mg/dl unter Placebo.
Patienten, die in placebokontrollierten 12-monatigen Verlängerungsstudien mindestens 3 Monate lang mit Effexor (mit sofortiger Freisetzung) behandelt wurden, hatten einen mittleren abschließenden Anstieg des Gesamtcholesterins unter der Therapie von 9,1 mg/dl, verglichen mit einer Abnahme von 7,1 mg/dl unter Placebo. behandelte Patienten. Dieser Anstieg war während des Studienzeitraums von der Dauer abhängig und war bei höheren Dosen tendenziell größer. Klinisch relevante Anstiege des Serumcholesterins, definiert als 1) ein endgültiger Anstieg des Serumcholesterins während der Therapie um ≥ 50 mg/dl gegenüber dem Ausgangswert und auf einen Wert ≥ 261 mg/dl oder 2) ein durchschnittlicher Anstieg des Serumcholesterins während der Therapie ≥ 50 mg/dl vom Ausgangswert bis zu einem Wert von ≥ 261 mg/dl wurden bei 5,3 % der mit Venlafaxin behandelten Patienten und 0,0 % der mit Placebo behandelten Patienten verzeichnet.
Serum-Triglyceride
Effexor 75 mg XR war im Vergleich zu Placebo in klinischen Studien vor der Markteinführung von SAD und PD mit einer Dauer von bis zu 12 Wochen (gepoolte Daten) und einer Dauer von 6 Monaten mit einem mittleren Anstieg der Nüchtern-Serumtriglyceride während der Therapie verbunden (Tabelle 14).
Pädiatrische Patienten
Im Allgemeinen war das Nebenwirkungsprofil von Venlafaxin (in placebokontrollierten klinischen Studien) bei Kindern und Jugendlichen (im Alter von 6 bis 17 Jahren) ähnlich wie bei Erwachsenen. Wie bei Erwachsenen wurden verminderter Appetit, Gewichtsverlust, erhöhter Blutdruck und erhöhtes Serumcholesterin beobachtet [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
In pädiatrischen klinischen Studien wurde die Nebenwirkung Suizidgedanken beobachtet.
Insbesondere die folgenden Nebenwirkungen wurden bei pädiatrischen Patienten beobachtet: Bauchschmerzen, Unruhe, Dyspepsie, Ekchymose, Epistaxis und Myalgie.
Nebenwirkungen, die während der Verwendung nach der Zulassung festgestellt wurden
Die folgenden Nebenwirkungen wurden während der Anwendung von Effexor XR nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen:
Körper als Ganzes: Anaphylaxie, Angioödem
Herz-Kreislauf-System: QT-Verlängerung, Kammerflimmern, Kammertachykardie (einschließlich Torsade de Pointes), Takotsubo-Kardiomyopathie
Verdauungstrakt: Pankreatitis
Hämisches/Lymphatisches System: Schleimhautblutung [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ], Blutdyskrasie (einschließlich Agranulozytose, aplastische Anämie, Neutropenie und Panzytopenie), verlängerte Blutungszeit, Thrombozytopenie
Stoffwechsel/Ernährung: Hyponatriämie [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ], Syndrom der inadäquaten Sekretion des antidiuretischen Hormons (SIADH) [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ], abnorme Leberfunktionstests, Hepatitis, Prolaktin erhöht
Bewegungsapparat: Rhabdomyolyse
Nervöses System: Malignes neuroleptisches Syndrom (NMS) [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ], serotonerges Syndrom [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ], Delirium, extrapyramidale Reaktionen (einschließlich Dystonie und Dyskinesie), Koordinations- und Gleichgewichtsstörungen, tardive Dyskinesie
Atmungssystem: Dyspnoe, interstitielle Lungenerkrankung, pulmonale Eosinophilie [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Haut und Anhängsel: Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, Erythema multiforme
Besondere Sinne: Engwinkelglaukom [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Zentralnervensystem (ZNS)-aktive Medikamente
Das Risiko der Anwendung von Venlafaxin in Kombination mit anderen ZNS-aktiven Arzneimitteln wurde nicht systematisch bewertet. Daher ist Vorsicht geboten, wenn Effexor XR in Kombination mit anderen ZNS-aktiven Arzneimitteln eingenommen wird.
Monoaminoxidase-Inhibitoren
Nebenwirkungen, von denen einige schwerwiegend waren, wurden bei Patienten berichtet, die kürzlich einen MAO-Hemmer abgesetzt und mit Antidepressiva mit ähnlichen pharmakologischen Eigenschaften wie Effexor XR (SNRIs oder SSRIs) begonnen haben oder bei denen kürzlich eine SNRI- oder SSRI-Therapie abgebrochen wurde zur Einleitung eines MAOI [vgl DOSIERUNG UND ANWENDUNG , KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Serotonerge Medikamente
Basierend auf dem Wirkmechanismus von Effexor XR und dem Potenzial für ein Serotonin-Syndrom ist Vorsicht geboten, wenn Effexor XR zusammen mit anderen Arzneimitteln verabreicht wird, die das serotonerge Neurotransmittersystem beeinflussen können, wie Triptane, SSRIs, andere SNRIs, Linezolid (ein Antibiotikum, das ein reversibler nicht-selektiver MAOI), Lithium, Tramadol oder Johanniskraut. Wenn eine gleichzeitige Behandlung mit Effexor XR und diesen Arzneimitteln klinisch gerechtfertigt ist, wird eine sorgfältige Überwachung des Patienten empfohlen, insbesondere während der Einleitung der Behandlung und bei Dosiserhöhungen. Die gleichzeitige Anwendung von Effexor 75 mg XR mit Tryptophan-Ergänzungen wird nicht empfohlen [siehe DOSIERUNG UND ANWENDUNG , KONTRAINDIKATIONEN , und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Medikamente, die die Hämostase beeinträchtigen (z. B. NSAIDs, Aspirin und Warfarin)
Die Serotoninfreisetzung durch Blutplättchen spielt eine wichtige Rolle bei der Hämostase. Die Anwendung von Psychopharmaka, die die Wiederaufnahme von Serotonin beeinträchtigen, ist mit dem Auftreten von Blutungen im oberen Gastrointestinaltrakt verbunden, und die gleichzeitige Anwendung eines NSAID oder Aspirin kann dieses Blutungsrisiko verstärken [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Bei gleichzeitiger Gabe von SSRIs und SNRIs mit Warfarin wurde über veränderte gerinnungshemmende Wirkungen, einschließlich verstärkter Blutungen, berichtet. Patienten, die eine Warfarin-Therapie erhalten, sollten sorgfältig überwacht werden, wenn Effexor 37,5 mg XR begonnen oder abgesetzt wird.
Mittel zur Gewichtsabnahme
Die Sicherheit und Wirksamkeit einer Therapie mit Venlafaxin in Kombination mit Mitteln zur Gewichtsabnahme, einschließlich Phentermin, wurde nicht nachgewiesen. Die gleichzeitige Anwendung von Effexor XR und Mitteln zur Gewichtsabnahme wird nicht empfohlen. Effexor XR ist nicht zur Gewichtsabnahme allein oder in Kombination mit anderen Produkten angezeigt.
Auswirkungen anderer Medikamente auf Effexor XR
Abbildung 1: Wirkung interagierender Arzneimittel auf die Pharmakokinetik von Venlafaxin und des aktiven Metaboliten O-Desmethylvenlafaxin (ODV).
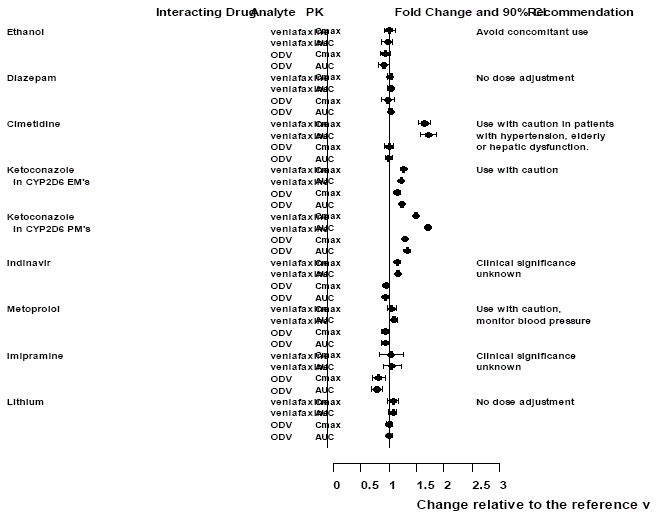
Auswirkungen von Effexor XR auf andere Medikamente
Abbildung 2: Wirkung von Venlafaxin auf die Pharmakokinetik interagierender Arzneimittel und ihrer aktiven Metaboliten.
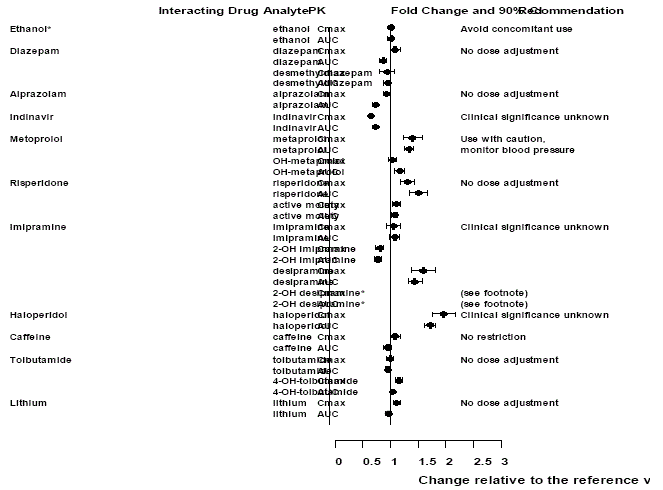
Notiz
Die Verabreichung von Venlafaxin in einem stabilen Regime verstärkte die durch Ethanol induzierten psychomotorischen und psychometrischen Wirkungen bei denselben Probanden nicht, wenn sie kein Venlafaxin erhielten.
Arzneimittel-Labortest-Wechselwirkungen
Bei Patienten, die Venlafaxin einnahmen, wurde über falsch-positive Urin-Immunoassay-Screeningtests für Phencyclidin (PCP) und Amphetamin berichtet. Dies liegt an der mangelnden Spezifität der Screening-Tests. Nach Absetzen der Venlafaxin-Therapie kann noch mehrere Tage lang mit falsch positiven Testergebnissen gerechnet werden. Bestätigungstests wie Gaschromatographie/Massenspektrometrie unterscheiden Venlafaxin von PCP und Amphetamin.
Drogenmissbrauch und -abhängigkeit
Kontrollierte Substanz
Effexor 75 mg XR ist keine kontrollierte Substanz.
Missbrauch
Obwohl Venlafaxin in klinischen Studien nicht systematisch auf sein Missbrauchspotenzial untersucht wurde, gab es in den klinischen Studien keinen Hinweis auf Drogensuchtverhalten. Es ist jedoch nicht möglich, auf der Grundlage von Erfahrungen vor der Markteinführung vorherzusagen, inwieweit ein ZNS-aktives Arzneimittel nach seiner Markteinführung missbraucht, abgezweigt und/oder missbraucht wird. Folglich sollten Ärzte Patienten sorgfältig auf Drogenmissbrauch in der Vorgeschichte untersuchen und solche Patienten engmaschig überwachen und sie auf Anzeichen von Missbrauch oder Missbrauch von Venlafaxin (z. B. Toleranzentwicklung, Erhöhung der Dosis, Suchtverhalten) beobachten.
Abhängigkeit
In-vitro-Studien zeigten, dass Venlafaxin praktisch keine Affinität zu Opiat-, Benzodiazepin-, Phencyclidin (PCP)- oder N-Methyl-D-Asparaginsäure (NMDA)-Rezeptoren hat.
Es wurde festgestellt, dass Venlafaxin bei Nagetieren keine signifikante ZNS-stimulierende Aktivität aufweist. In Studien zur Drogendiskriminierung bei Primaten zeigte Venlafaxin keine signifikante Neigung zum Missbrauch von Stimulanzien oder Beruhigungsmitteln.
Bei Patienten, die Venlafaxin erhielten, wurde über Absetzeffekte berichtet [siehe DOSIERUNG UND ANWENDUNG ].
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Selbstmordgedanken und -verhalten bei Kindern, Jugendlichen und jungen Erwachsenen
Bei Patienten mit schwerer depressiver Störung (MDD), sowohl bei Erwachsenen als auch bei Kindern, kann es zu einer Verschlechterung ihrer Depression und/oder zum Auftreten von Suizidgedanken und -verhalten (Suizidalität) oder zu ungewöhnlichen Verhaltensänderungen kommen, unabhängig davon, ob sie Antidepressiva einnehmen oder nicht Das Risiko kann bestehen bleiben, bis eine signifikante Remission eintritt. Selbstmord ist ein bekanntes Risiko für Depressionen und bestimmte andere psychiatrische Störungen, und diese Störungen selbst sind die stärksten Prädiktoren für Selbstmord. Es besteht jedoch seit langem die Sorge, dass Antidepressiva bei bestimmten Patienten in den frühen Phasen der Behandlung eine Rolle bei der Induktion einer Verschlechterung der Depression und dem Auftreten von Suizidalität spielen könnten. Gepoolte Analysen placebokontrollierter Kurzzeitstudien mit Antidepressiva (SSRIs und andere) zeigten, dass diese Medikamente das Risiko für suizidales Denken und Verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen (im Alter von 18 bis 24 Jahren) mit MDD erhöhen andere psychiatrische Störungen. Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; bei Erwachsenen ab 65 Jahren kam es unter Antidepressiva im Vergleich zu Placebo zu einer Reduktion.
Die gepoolten Analysen placebokontrollierter Studien bei Kindern und Jugendlichen mit MDD, Zwangsstörung (OCD) oder anderen psychiatrischen Erkrankungen umfassten insgesamt 24 Kurzzeitstudien mit 9 Antidepressiva bei über 4.400 Patienten. Die gepoolten Analysen placebokontrollierter Studien bei Erwachsenen mit MDD oder anderen psychiatrischen Erkrankungen umfassten insgesamt 295 Kurzzeitstudien (mediane Dauer von 2 Monaten) mit 11 Antidepressiva bei über 77.000 Patienten. Es gab beträchtliche Schwankungen des Suizidalitätsrisikos zwischen den Medikamenten, aber bei fast allen untersuchten Medikamenten eine Tendenz zu einem Anstieg bei den jüngeren Patienten. Es gab Unterschiede im absoluten Suizidalitätsrisiko zwischen den verschiedenen Indikationen, mit der höchsten Inzidenz bei MDD. Die Risikounterschiede (Medikament versus Placebo) waren jedoch relativ stabil innerhalb der Altersschichten und über Indikationen hinweg. Diese Risikounterschiede (Arzneimittel-Placebo-Unterschied in der Anzahl der Fälle von Suizidalität pro 1.000 behandelten Patienten) sind in Tabelle 1 aufgeführt.
In keiner der pädiatrischen Studien traten Suizide auf. In den Studien mit Erwachsenen gab es Suizide, aber die Anzahl reichte nicht aus, um zu einer Schlussfolgerung über die Wirkung des Medikaments auf Suizide zu gelangen.
Es ist nicht bekannt, ob sich das Suizidrisiko auf eine längerfristige Anwendung erstreckt, dh über mehrere Monate hinaus. Es gibt jedoch erhebliche Hinweise aus placebokontrollierten Erhaltungsstudien bei Erwachsenen mit Depressionen, dass die Anwendung von Antidepressiva das Wiederauftreten einer Depression verzögern kann.
Alle Patienten, die mit Antidepressiva aus beliebigen Indikationen behandelt werden, sollten angemessen überwacht und engmaschig auf eine klinische Verschlechterung, Suizidalität und ungewöhnliche Verhaltensänderungen beobachtet werden, insbesondere während der ersten Monate einer medikamentösen Therapie oder bei Dosisänderungen oder -steigerungen oder abnimmt.
Die folgenden Symptome, Angst, Unruhe, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie (psychomotorische Ruhelosigkeit), Hypomanie und Manie, wurden bei erwachsenen und pädiatrischen Patienten berichtet, die mit Antidepressiva gegen MDD behandelt wurden für andere Indikationen, sowohl psychiatrische als auch nichtpsychiatrische. Obwohl ein kausaler Zusammenhang zwischen dem Auftreten solcher Symptome und entweder der Verschlechterung einer Depression und/oder dem Auftreten suizidaler Impulse nicht hergestellt werden konnte, besteht die Sorge, dass solche Symptome Vorboten einer aufkommenden Suizidalität sein könnten.
Bei Patienten, deren Depression sich anhaltend verschlimmert oder die an Suizidalität oder Symptomen leiden, die Vorboten einer Verschlechterung der Depression oder Suizidalität sein könnten, sollte eine Änderung des therapeutischen Schemas, einschließlich eines möglichen Absetzens der Medikation, in Betracht gezogen werden, insbesondere wenn diese Symptome schwerwiegend und abrupt sind zu Beginn oder waren nicht Teil der Symptome des Patienten.
Wenn die Entscheidung getroffen wurde, die Behandlung abzubrechen, sollte die Medikation so schnell wie möglich ausgeschlichen werden, jedoch unter Berücksichtigung, dass ein abruptes Absetzen mit bestimmten Symptomen verbunden sein kann [siehe Abbruchsyndrom und DOSIERUNG UND ANWENDUNG ].
Familien und Betreuer von Patienten, die wegen MDD oder anderen Indikationen, sowohl psychiatrischen als auch nichtpsychiatrischen, mit Antidepressiva behandelt werden, sollten auf die Notwendigkeit aufmerksam gemacht werden, Patienten auf das Auftreten von Unruhe, Reizbarkeit, ungewöhnlichen Verhaltensänderungen und den anderen oben beschriebenen Symptomen zu überwachen, wie z sowie das Auftreten von Suizidalität zu melden und solche Symptome unverzüglich dem Gesundheitsdienstleister zu melden. Eine solche Überwachung sollte die tägliche Beobachtung durch Familien und Betreuer umfassen. Rezepte für Effexor XR sollten für die kleinste Menge an Kapseln im Einklang mit einem guten Patientenmanagement ausgestellt werden, um das Risiko einer Überdosierung zu verringern.
Screening von Patienten auf bipolare Störungen
Eine schwere depressive Episode kann die anfängliche Präsentation einer bipolaren Störung sein. Es wird allgemein angenommen (obwohl dies nicht in kontrollierten Studien nachgewiesen wurde), dass die Behandlung einer solchen Episode mit einem Antidepressivum allein die Wahrscheinlichkeit des Auftretens einer gemischten/manischen Episode bei Patienten mit einem Risiko für eine bipolare Störung erhöhen kann. Ob eines der oben beschriebenen Symptome eine solche Konversion darstellt, ist unbekannt. Vor Beginn der Behandlung mit einem Antidepressivum sollten Patienten mit depressiven Symptomen jedoch angemessen untersucht werden, um festzustellen, ob bei ihnen ein Risiko für eine bipolare Störung besteht; Ein solches Screening sollte eine detaillierte psychiatrische Vorgeschichte umfassen, einschließlich einer Familienanamnese von Selbstmord, bipolarer Störung und Depression. Es sollte beachtet werden, dass Effexor XR nicht zur Behandlung von bipolarer Depression zugelassen ist.
Serotonin-Syndrom
Die Entwicklung eines potenziell lebensbedrohlichen Serotonin-Syndroms wurde bei Serotonin-Noradrenalin-Wiederaufnahmehemmern (SNRIs) und SSRIs, einschließlich Effexor XR allein, aber insbesondere bei gleichzeitiger Anwendung anderer serotonerger Arzneimittel (einschließlich Triptane, trizyklische Antidepressiva, Fentanyl, Lithium, Tramadol, Tryptophan, Buspiron, Amphetamine und Johanniskraut) und mit Arzneimitteln, die insbesondere den Serotoninstoffwechsel beeinträchtigen, MAO-Hemmer, sowohl solche, die zur Behandlung psychiatrischer Erkrankungen bestimmt sind, als auch andere, wie Linezolid oder intravenöses Methylenblau).
Zu den Symptomen des Serotonin-Syndroms können Veränderungen des mentalen Status (z. B. Unruhe, Halluzinationen, Delirium, Koma), autonome Instabilität (z. B. Tachykardie, labiler Blutdruck, Hyperthermie, Schwitzen, Hitzewallungen und Schwindel), neuromuskuläre Symptome (z. B. Tremor, Steifheit, Myoklonus) gehören , Hyperreflexie, Koordinationsstörungen); Krampfanfälle und gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Durchfall). Die Patienten sollten auf das Auftreten eines Serotonin-Syndroms überwacht werden.
Die gleichzeitige Anwendung von Effexor XR mit MAO-Hemmern (zur Behandlung von psychiatrischen Erkrankungen) ist kontraindiziert. Effexor XR sollte auch nicht bei einem Patienten begonnen werden, der mit MAO-Hemmern wie Linezolid oder intravenösem Methylenblau behandelt wird. Alle Berichte mit Methylenblau, die Informationen zum Verabreichungsweg enthielten, betrafen die intravenöse Verabreichung im Dosisbereich von 1 mg/kg bis 8 mg/kg. Es gab keine Berichte über die Verabreichung von Methylenblau auf anderem Wege (wie z. B. Tabletten zum Einnehmen oder lokale Gewebeinjektion) oder in niedrigeren Dosen. Es kann Umstände geben, in denen es erforderlich ist, bei einem Patienten, der Effexor 37,5 mg XR einnimmt, eine Behandlung mit einem MAO-Hemmer wie Linezolid oder Methylenblau intravenös zu beginnen. Effexor XR sollte abgesetzt werden, bevor eine Behandlung mit dem MAO-Hemmer begonnen wird [siehe KONTRAINDIKATIONEN , DOSIERUNG UND ANWENDUNG , und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Wenn die gleichzeitige Anwendung von Effexor 37,5 mg XR mit anderen serotonergen Arzneimitteln (z. B. Triptanen, trizyklischen Antidepressiva, Mirtazapin, Fentanyl, Lithium, Tramadol, Buspiron, Amphetaminen, Tryptophan oder Johanniskraut) klinisch gerechtfertigt ist, sorgfältige Beobachtung des Patienten wird empfohlen, insbesondere zu Beginn der Behandlung und bei Dosiserhöhungen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Die Patienten sollten auf das potenzielle Risiko eines Serotonin-Syndroms aufmerksam gemacht werden. Die Behandlung mit Effexor XR und allen begleitenden serotonergen Arzneimitteln sollte sofort abgebrochen werden, wenn die oben genannten Ereignisse auftreten, und eine unterstützende symptomatische Behandlung eingeleitet werden.
Erhöhungen des Blutdrucks
In kontrollierten Studien kam es zu dosisabhängigen Erhöhungen des systolischen und diastolischen Blutdrucks sowie zu Fällen von anhaltender Hypertonie [vgl NEBENWIRKUNGEN ].
Kontrollieren Sie den Blutdruck vor Beginn der Behandlung mit Effexor 37,5 mg XR und regelmäßig während der Behandlung. Kontrollieren Sie vor Beginn der Behandlung mit Effexor 75 mg XR eine bereits bestehende Hypertonie. Seien Sie vorsichtig bei der Behandlung von Patienten mit vorbestehender Hypertonie oder kardiovaskulären oder zerebrovaskulären Erkrankungen, die durch einen Anstieg des Blutdrucks beeinträchtigt werden könnten. Eine anhaltende Erhöhung des Blutdrucks kann zu unerwünschten Folgen führen. Unter Effexor XR wurden Fälle von erhöhtem Blutdruck berichtet, die eine sofortige Behandlung erforderten. Erwägen Sie bei Patienten, bei denen ein anhaltender Blutdruckanstieg auftritt, eine Dosisreduktion oder ein Absetzen der Behandlung.
In allen klinischen Studien mit Effexor 37,5 mg kam es bei 1,4 % der Patienten in den mit Effexor XR behandelten Gruppen zu einem Anstieg des diastolischen Blutdrucks (SDBP) in Rückenlage um ≥ 15 mm Hg auf ≥ 105 mm Hg, verglichen mit 0,9 % der Patienten in den Placebogruppen. In ähnlicher Weise kam es bei 1 % der Patienten in den mit Effexor 75 mg XR behandelten Gruppen zu einem Anstieg des systolischen Blutdrucks (SSBP) in Rückenlage um ≥ 20 mm Hg mit einem Blutdruck von ≥ 180 mm Hg, verglichen mit 0,3 % der Patienten in den Placebogruppen [siehe Tabelle 10 in NEBENWIRKUNGEN ]. Die Behandlung mit Effexor 75 mg XR war mit anhaltender Hypertonie verbunden (definiert als behandlungsbedingter SDBP ≥ 90 mm Hg und ≥ 10 mm Hg über dem Ausgangswert bei drei aufeinanderfolgenden Behandlungsterminen [siehe Tabelle 11 in NEBENWIRKUNGEN ]. Eine unzureichende Anzahl von Patienten erhielt in klinischen Studien mittlere Dosen von Effexor 37,5 mg XR über 300 mg pro Tag, um die Inzidenz eines anhaltenden Blutdruckanstiegs bei diesen höheren Dosen vollständig zu bewerten.
Abnorme Blutung
SSRIs und SNRIs, einschließlich Effexor 37,5 mg XR, können das Risiko von Blutungsereignissen erhöhen, die von Ekchymosen, Hämatomen, Epistaxis, Petechien und gastrointestinalen Blutungen bis hin zu lebensbedrohlichen Blutungen reichen können. Die gleichzeitige Einnahme von Aspirin, nichtsteroidalen Antiphlogistika (NSAIDs), Warfarin und anderen Antikoagulanzien oder anderen Arzneimitteln, die bekanntermaßen die Blutplättchenfunktion beeinflussen, kann dieses Risiko erhöhen. Fallberichte und epidemiologische Studien (Fall-Kontroll- und Kohortendesign) haben einen Zusammenhang zwischen der Einnahme von Arzneimitteln, die die Serotonin-Wiederaufnahme beeinträchtigen, und dem Auftreten von gastrointestinalen Blutungen gezeigt. Warnen Sie die Patienten vor dem Blutungsrisiko im Zusammenhang mit der gleichzeitigen Anwendung von Effexor 75 mg XR und NSAIDs, Aspirin oder anderen Arzneimitteln, die die Blutgerinnung beeinflussen.
Engwinkelglaukom
Die Pupillenerweiterung, die nach der Anwendung vieler Antidepressiva, einschließlich Effexor XR, auftritt, kann bei einem Patienten mit anatomisch engen Winkeln, der keine offene Iridektomie hat, eine Winkelverschlussattacke auslösen.
Aktivierung von Manie/Hypomanie
Manie oder Hypomanie wurde bei mit Effexor 37,5 mg XR behandelten Patienten in den Premarketing-Studien bei MDD, SAD und PD berichtet (siehe Tabelle 2). Manie/Hypomanie wurde auch bei einem kleinen Anteil von Patienten mit Stimmungsstörungen berichtet, die mit anderen auf dem Markt erhältlichen Arzneimitteln zur Behandlung von MDD behandelt wurden. Effexor 37,5 mg XR sollte bei Patienten mit Manie oder Hypomanie in der Anamnese mit Vorsicht angewendet werden.
Abbruchsyndrom
Absetzsymptome wurden bei Patienten, die Venlafaxin einnahmen, systematisch bewertet, einschließlich prospektiver Analysen klinischer Studien zu GAD und retrospektiver Erhebungen von Studien zu MDD und SAD. Es wurde festgestellt, dass ein abruptes Absetzen oder eine Dosisreduktion von Venlafaxin bei verschiedenen Dosen mit dem Auftreten neuer Symptome verbunden ist, deren Häufigkeit mit steigender Dosis und längerer Behandlungsdauer zunimmt. Berichtete Symptome sind Agitiertheit, Anorexie, Angst, Verwirrtheit, Koordinations- und Gleichgewichtsstörungen, Durchfall, Schwindel, Mundtrockenheit, dysphorische Stimmung, Faszikulationen, Müdigkeit, grippeähnliche Symptome, Kopfschmerzen, Hypomanie, Schlaflosigkeit, Übelkeit, Nervosität, Alpträume, Sensibilitätsstörungen ( einschließlich schockartiger elektrischer Empfindungen), Somnolenz, Schwitzen, Zittern, Schwindel und Erbrechen.
Nach der Markteinführung liegen Berichte über schwerwiegende Absetzsymptome vor, die langwierig und schwerwiegend sein können. Vollendeter Suizid, Suizidgedanken, Aggression und gewalttätiges Verhalten wurden bei Patienten während der Reduzierung der Dosierung von Effexor 75 mg XR, einschließlich während des Absetzens, beobachtet. Andere Postmarketing-Berichte beschreiben visuelle Veränderungen (wie verschwommenes Sehen oder Konzentrationsschwierigkeiten) und erhöhten Blutdruck nach dem Absetzen oder Reduzieren der Dosis von Effexor XR.
Während der Vermarktung von Effexor XR, anderen SNRIs und SSRIs gab es spontane Berichte über andere unerwünschte Ereignisse, die nach Absetzen dieser Arzneimittel auftraten, insbesondere bei plötzlichem Absetzen, einschließlich der folgenden: Reizbarkeit, Lethargie, emotionale Labilität, Tinnitus und Krampfanfälle.
Patienten sollten auf diese Symptome überwacht werden, wenn sie die Behandlung mit Effexor XR beenden. Es wird empfohlen, die Dosis schrittweise zu reduzieren und nicht abrupt zu beenden. Wenn nach einer Verringerung der Dosis oder beim Absetzen der Behandlung unerträgliche Symptome auftreten, kann eine Wiederaufnahme der zuvor verschriebenen Dosis in Betracht gezogen werden. Anschließend kann der Gesundheitsdienstleister die Dosis weiter verringern, jedoch mit einer allmählicheren Rate. Bei manchen Patienten muss das Absetzen möglicherweise über einen Zeitraum von mehreren Monaten erfolgen [siehe DOSIERUNG UND ANWENDUNG ].
Krampfanfälle
Unter Venlafaxin-Therapie sind Krampfanfälle aufgetreten. Effexor 75 mg XR sollte, wie viele Antidepressiva, bei Patienten mit Krampfanfällen in der Vorgeschichte mit Vorsicht angewendet und bei jedem Patienten, der Krampfanfälle entwickelt, abgesetzt werden. [Muss das Risiko mindern: Risikofaktoren, begleitende Medikamente, die die Krampfschwelle senken.]
Hyponatriämie
Hyponatriämie kann als Folge einer Behandlung mit SSRIs und SNRIs, einschließlich Effexor 37,5 mg XR, auftreten. In vielen Fällen scheint die Hyponatriämie das Ergebnis des Syndroms der inadäquaten Sekretion des antidiuretischen Hormons (SIADH) zu sein. Es wurden Fälle mit Serumnatriumwerten unter 110 mmol/l berichtet. Ältere Patienten können unter SSRIs und SNRIs einem höheren Risiko ausgesetzt sein, eine Hyponatriämie zu entwickeln [siehe Verwendung in bestimmten Bevölkerungsgruppen ]. Auch Patienten, die Diuretika einnehmen, oder solche, die anderweitig an Volumenmangel leiden, können einem höheren Risiko ausgesetzt sein. Erwägen Sie das Absetzen von Effexor 37,5 mg XR bei Patienten mit symptomatischer Hyponatriämie und leiten Sie geeignete medizinische Maßnahmen ein.
Anzeichen und Symptome einer Hyponatriämie sind Kopfschmerzen, Konzentrationsschwierigkeiten, Gedächtnisstörungen, Verwirrtheit, Schwäche und Unsicherheit, die zu Stürzen führen können. Anzeichen und Symptome im Zusammenhang mit schwereren und/oder akuten Fällen waren Halluzinationen, Synkopen, Krampfanfälle, Koma, Atemstillstand und Tod.
Gewichts- und Größenänderungen bei pädiatrischen Patienten
Gewichtsänderungen
Die durchschnittliche Veränderung des Körpergewichts und die Inzidenz von Gewichtsverlust (Prozentsatz der Patienten, die 3,5 % oder mehr verloren) in den placebokontrollierten pädiatrischen Studien zu MDD, GAD und SAD sind in den Tabellen 3 und 4 dargestellt.
Der Gewichtsverlust war nicht auf Patienten mit behandlungsbedingter Anorexie beschränkt [siehe Appetitveränderungen bei pädiatrischen Patienten ].
Die mit der längerfristigen Anwendung von Effexor 75 mg XR verbundenen Risiken wurden in einer offenen MDD-Studie mit Kindern und Jugendlichen bewertet, die Effexor XR bis zu sechs Monate lang erhielten. Die Gewichtszunahme der Kinder und Jugendlichen in der Studie war geringer als erwartet, basierend auf Daten von Alters- und Geschlechtsgleichen. Der Unterschied zwischen beobachteter und erwarteter Gewichtszunahme war bei Kindern (
Höhenänderungen
Tabelle 5 zeigt die durchschnittliche Zunahme der Körpergröße bei pädiatrischen Patienten in den placebokontrollierten Kurzzeitstudien zu MDD, GAD und SAD. Die Unterschiede in der Zunahme der Körpergröße in GAD- und MDD-Studien waren am deutlichsten bei Patienten unter zwölf Jahren.
In der sechsmonatigen, offenen MDD-Studie hatten Kinder und Jugendliche eine Größenzunahme, die geringer war als erwartet, basierend auf Daten von Alters- und Geschlechtsgleichen. Der Unterschied zwischen beobachteten und erwarteten Wachstumsraten war bei Kindern (
Appetitveränderungen bei pädiatrischen Patienten
Verminderter Appetit (berichtet als behandlungsbedingte Anorexie) wurde häufiger bei mit Effexor XR behandelten Patienten im Vergleich zu mit Placebo behandelten Patienten in der Premarketing-Bewertung von Effexor XR für MDD, GAD und SAD beobachtet (siehe Tabelle 6).
Interstitielle Lungenerkrankung und eosinophile Pneumonie
Interstitielle Lungenerkrankung und eosinophile Pneumonie im Zusammenhang mit einer Therapie mit Venlafaxin wurden selten berichtet. Die Möglichkeit dieser Nebenwirkungen sollte bei mit Venlafaxin behandelten Patienten in Betracht gezogen werden, die sich mit fortschreitender Dyspnoe, Husten oder Brustbeschwerden vorstellen. Solche Patienten sollten umgehend medizinisch untersucht werden, und ein Abbruch der Venlafaxin-Therapie sollte in Betracht gezogen werden.
Sexuelle Funktionsstörung
Die Anwendung von SNRIs, einschließlich Effexor XR, kann Symptome einer sexuellen Dysfunktion verursachen [siehe NEBENWIRKUNGEN ]. Bei männlichen Patienten kann die Anwendung von SNRI zu Ejakulationsverzögerung oder -versagen, verminderter Libido und erektiler Dysfunktion führen. Bei weiblichen Patienten kann die Anwendung von SNRI zu einer verminderten Libido und einem verzögerten oder ausbleibenden Orgasmus führen.
Es ist wichtig, dass sich der verschreibende Arzt vor Beginn der Behandlung mit Effexor 37,5 mg XR nach der Sexualfunktion erkundigt und sich während der Behandlung speziell nach Veränderungen der Sexualfunktion erkundigt, da die Sexualfunktion möglicherweise nicht spontan gemeldet wird. Bei der Beurteilung von Veränderungen der Sexualfunktion ist es wichtig, eine detaillierte Anamnese (einschließlich des Zeitpunkts des Auftretens der Symptome) zu erheben, da sexuelle Symptome andere Ursachen haben können, einschließlich der zugrunde liegenden psychiatrischen Störung. Besprechen Sie mögliche Behandlungsstrategien, um Patienten dabei zu unterstützen, fundierte Entscheidungen über die Behandlung zu treffen.
Informationen zur Patientenberatung
Siehe FDA-zugelassen INFORMATIONEN ZUM PATIENTEN ( Leitfaden für Medikamente ).
Verschreibende Ärzte oder andere Angehörige der Gesundheitsberufe sollten Patienten, ihre Familien und ihre Betreuer über die Vorteile und Risiken im Zusammenhang mit der Behandlung mit Effexor 37,5 mg XR informieren und sie bezüglich der angemessenen Anwendung beraten. Für Effexor 75 mg XR ist ein Medikationsleitfaden für Patienten über „Antidepressiva, Depressionen und andere schwere psychische Erkrankungen sowie Selbstmordgedanken oder -handlungen“ verfügbar. Der verschreibende Arzt oder das medizinische Fachpersonal sollte Patienten, ihre Familien und ihre Betreuer anweisen, den Medikationsleitfaden zu lesen, und ihnen helfen, seinen Inhalt zu verstehen. Den Patienten sollte Gelegenheit gegeben werden, den Inhalt des Medikationsleitfadens zu diskutieren und Antworten auf eventuelle Fragen zu erhalten. Der vollständige Text des Medikationsleitfadens ist am Ende dieses Dokuments abgedruckt. Patienten sollten auf die folgenden Probleme hingewiesen und gebeten werden, ihren verschreibenden Arzt zu informieren, wenn diese während der Einnahme von Effexor XR auftreten.
Selbstmordgedanken und Verhaltensweisen
Weisen Sie Patienten, ihre Familien und Betreuer an, auf das Auftreten von Suizidalität, Verschlechterung von Depressionen und anderen psychiatrischen Symptomen (Angst, Unruhe, Panikattacken, Schlaflosigkeit, Reizbarkeit, Feindseligkeit, Aggressivität, Impulsivität, Akathisie, psychomotorische Unruhe, Hypomanie, Manie, andere ungewöhnliche Verhaltensänderungen), insbesondere zu Beginn der Behandlung und wenn die Dosis nach oben oder unten angepasst wird. Solche Symptome sollten dem verschreibenden Arzt oder medizinischen Fachpersonal des Patienten gemeldet werden, insbesondere wenn sie schwerwiegend sind, abrupt einsetzen oder nicht Teil der Symptome des Patienten waren. Symptome wie diese können mit einem erhöhten Risiko für Suizidgedanken und -verhalten verbunden sein und weisen auf die Notwendigkeit einer sehr engmaschigen Überwachung hin [siehe KASTENWARNUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Begleitmedikation
Weisen Sie Patienten, die Effexor XR einnehmen, darauf hin, nicht gleichzeitig andere Produkte anzuwenden, die Venlafaxin oder Desvenlafaxin enthalten. Medizinisches Fachpersonal sollte Patienten anweisen, Effexor XR nicht zusammen mit einem MAO-Hemmer oder innerhalb von 14 Tagen nach dem Absetzen eines MAO-Hemmers einzunehmen und nach dem Absetzen von Effexor XR 7 Tage warten, bevor ein MAO-Hemmer begonnen wird [siehe KONTRAINDIKATIONEN ].
Serotonin-Syndrom
Patienten sollten vor dem Risiko eines Serotoninsyndroms bei gleichzeitiger Anwendung von Effexor 75 mg XR und Triptanen, Tramadol, Amphetaminen, Tryptophan-Ergänzungen mit Antipsychotika oder anderen Dopaminantagonisten oder anderen serotonergen Mitteln gewarnt werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Erhöhter Blutdruck
Weisen Sie die Patienten darauf hin, dass sie während der Einnahme von Effexor XR regelmäßig den Blutdruck kontrollieren sollten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Abnorme Blutung
Patienten sollten vor der gleichzeitigen Anwendung von Effexor 75 mg XR und NSAIDs, Aspirin, Warfarin oder anderen Arzneimitteln, die die Blutgerinnung beeinflussen, gewarnt werden, da die kombinierte Anwendung von Psychopharmaka, die die Wiederaufnahme von Serotonin beeinträchtigen, mit einem erhöhten Blutungsrisiko in Verbindung gebracht wurde [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Engwinkelglaukom
Die Patienten sollten darauf hingewiesen werden, dass die Einnahme von Effexor XR zu einer leichten Pupillenerweiterung führen kann, die bei empfindlichen Personen zu einer Episode eines Engwinkelglaukoms führen kann. Ein vorbestehendes Glaukom ist fast immer ein Offenwinkelglaukom, da ein Winkelblockglaukom, wenn es diagnostiziert wird, definitiv mit einer Iridektomie behandelt werden kann. Das Offenwinkelglaukom ist kein Risikofaktor für das Engwinkelglaukom. Patienten möchten möglicherweise untersucht werden, um festzustellen, ob sie für Winkelverschluss anfällig sind, und sich einem prophylaktischen Verfahren (z. B. Iridektomie) unterziehen, wenn sie anfällig sind [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Aktivierung von Manie/Hypomanie
Weisen Sie Patienten, ihre Familien und Betreuer an, auf Anzeichen einer Aktivierung von Manie/Hypomanie zu achten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Herz-Kreislauf-/zerebrovaskuläre Erkrankung
Bei der Verabreichung von Effexor XR an Patienten mit kardiovaskulären, zerebrovaskulären oder Fettstoffwechselstörungen ist Vorsicht geboten [siehe NEBENWIRKUNGEN ].
Serumcholesterin- und Triglyceriderhöhung
Weisen Sie die Patienten darauf hin, dass Erhöhungen von Gesamtcholesterin, LDL und Triglyzeriden auftreten können und dass eine Messung der Serumlipide in Betracht gezogen werden kann [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Abbruchsyndrom
Weisen Sie die Patienten darauf hin, die Einnahme von Effexor 75 mg XR nicht abzubrechen, ohne vorher mit ihrem Arzt gesprochen zu haben. Patienten sollten sich darüber im Klaren sein, dass beim Absetzen von Effexor XR Absetzeffekte auftreten können [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ].
Sexuelle Funktionsstörung
Weisen Sie die Patienten darauf hin, dass die Anwendung von Effexor XR sowohl bei männlichen als auch bei weiblichen Patienten Symptome einer sexuellen Dysfunktion hervorrufen kann. Informieren Sie die Patienten darüber, dass sie alle Veränderungen der Sexualfunktion und potenzielle Behandlungsstrategien mit ihrem Arzt besprechen sollten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Beeinträchtigung der kognitiven und motorischen Leistung
Warnen Sie die Patienten vor dem Bedienen gefährlicher Maschinen, einschließlich Autos, bis sie hinreichend sicher sind, dass die Behandlung mit Effexor 37,5 mg XR ihre Fähigkeit zur Teilnahme an solchen Aktivitäten nicht beeinträchtigt.
Alkohol
Weisen Sie die Patienten darauf hin, Alkohol während der Einnahme von Effexor 37,5 mg XR zu vermeiden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Allergische Reaktionen
Raten Sie den Patienten, ihren Arzt zu benachrichtigen, wenn sie allergische Erscheinungen wie Hautausschlag, Nesselsucht, Schwellungen oder Atembeschwerden entwickeln.
Schwangerschaft
Raten Sie Patientinnen, ihren Arzt zu benachrichtigen, wenn sie schwanger werden oder beabsichtigen, während der Therapie schwanger zu werden [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Pflege
Raten Sie den Patientinnen, ihren Arzt zu informieren, wenn sie ein Kind stillen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Restliche Sphäroide
Effexor XR enthält Sphäroide, die den Wirkstoff langsam in den Verdauungstrakt abgeben. Der unlösliche Teil dieser Sphäroide wird eliminiert, und die Patienten bemerken möglicherweise, dass Sphäroide im Stuhl oder über die Kolostomie ausgeschieden werden. Die Patienten sollten darüber informiert werden, dass das aktive Medikament bereits absorbiert wurde, wenn der Patient die Sphäroide sieht.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Tumore wurden durch die Behandlung mit Venlafaxin bei Mäusen oder Ratten nicht vermehrt. Venlafaxin wurde Mäusen 18 Monate lang per Schlundsonde in Dosen von bis zu 120 mg/kg pro Tag verabreicht, was dem 1,7-fachen der empfohlenen Höchstdosis für Menschen auf mg/m2-Basis entsprach. Venlafaxin wurde Ratten auch 24 Monate lang per Schlundsonde in Dosen von bis zu 120 mg/kg pro Tag verabreicht. Bei Ratten, die die Dosis von 120 mg/kg erhielten, waren die Plasmakonzentrationen von Venlafaxin bei der Autopsie 1-mal (männliche Ratten) und 6-mal (weibliche Ratten) höher als die Plasmakonzentrationen von Patienten, die die maximal empfohlene Humandosis erhielten. Die Plasmaspiegel des O-Desmethyl-Metaboliten (ODV) waren bei Ratten niedriger als bei Patienten, die die maximal empfohlene Dosis erhielten. O-Desmethylvenlafaxin (ODV), der wichtigste menschliche Metabolit von Venlafaxin, der Mäusen und Ratten über 2 Jahre per Schlundsonde verabreicht wurde, erhöhte in keiner der Studien die Inzidenz von Tumoren. Mäuse erhielten ODV in Dosierungen von bis zu 500/300 mg/kg/Tag (Dosis wurde nach 45-wöchiger Verabreichung gesenkt). Die Exposition bei einer Dosis von 300 mg/kg/Tag beträgt das 9-fache einer Dosis von 225 mg/Tag beim Menschen. Ratten erhielten ODV in Dosierungen von bis zu 300 mg/kg/Tag (Männchen) oder 500 mg/kg/Tag (Weibchen). Die Exposition bei der höchsten Dosis beträgt ungefähr das 8- (Männer) oder 11-fache (Frauen) einer menschlichen Dosis von 225 mg/Tag.
Mutagenese
Venlafaxin und der Hauptmetabolit des Menschen, ODV, waren im Ames-Rückmutationsassay in Salmonella-Bakterien oder im Ovar-/HGPRT-Säugerzellen-Vorwärts-Genmutationsassay des chinesischen Hamsters nicht mutagen. Venlafaxin war auch im In-vitro-BALB/c-3T3-Zelltransformationstest der Maus, im Schwesterchromatid-Austauschtest in kultivierten Eierstockzellen des chinesischen Hamsters oder im In-vivo-Chromosomenaberrationstest im Knochenmark von Ratten nicht mutagen oder klastogen. ODV war im In-vitro-Chromosomenaberrationstest an Eierstockzellen des chinesischen Hamsters oder im In-vivo-Chromosomenaberrationstest bei Ratten nicht klastogen.
Beeinträchtigung der Fruchtbarkeit
Reproduktions- und Fertilitätsstudien mit Venlafaxin an Ratten zeigten keine unerwünschten Wirkungen von Venlafaxin auf die männliche oder weibliche Fertilität bei oralen Dosen bis zum Zweifachen der maximal empfohlenen Dosis von 225 mg/Tag beim Menschen auf mg/m2-Basis. In einer Studie, in der männliche und weibliche Ratten vor und während der Paarung und Trächtigkeit mit O-Desmethylvenlafaxin (ODV), dem wichtigsten menschlichen Metaboliten von Venlafaxin, behandelt wurden, wurde jedoch eine verringerte Fertilität beobachtet. Dies trat bei einer ODV-Exposition (AUC) auf, die ungefähr 2- bis 3-mal so hoch war wie bei einer humanen Venlafaxin-Dosis von 225 mg/Tag.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie C
Venlafaxin verursachte keine Missbildungen bei den Nachkommen von Ratten oder Kaninchen, wenn Dosen bis zum 2,5-Fachen (Ratte) oder 4-Fachen (Kaninchen) der maximal empfohlenen Tagesdosis beim Menschen auf mg/m2-Basis verabreicht wurden. Bei Ratten kam es jedoch während der ersten 5 Tage der Laktation, wenn die Dosierung während der Trächtigkeit begann und bis zum Absetzen fortgesetzt wurde, zu einer Abnahme des Gewichts der Jungtiere, einer Zunahme totgeborener Jungtiere und einer Zunahme der Todesfälle der Jungtiere. Die Ursache dieser Todesfälle ist nicht bekannt. Diese Wirkungen traten beim 2,5-fachen (mg/m2) der maximalen menschlichen Tagesdosis auf. Die No-Effect-Dosis für die Sterblichkeit von Rattenjungen betrug das 0,25-fache der Humandosis auf mg/m2-Basis. In Reproduktionsstudien an Ratten und Kaninchen mit O-Desmethylvenlafaxin (ODV), dem wichtigsten menschlichen Metaboliten von Venlafaxin, wurden bei Expositionsgrenzen von 13 bei Ratten und 0,3 bei Kaninchen keine Hinweise auf Teratogenität beobachtet. Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. Effexor XR sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Nicht teratogene Wirkungen
Neugeborene, die Ende des dritten Trimesters Effexor 37,5 mg XR, anderen SNRIs oder SSRIs ausgesetzt waren, entwickelten Komplikationen, die einen verlängerten Krankenhausaufenthalt, Atemunterstützung und Sondenernährung erforderten. Solche Komplikationen können unmittelbar nach der Geburt auftreten. Zu den berichteten klinischen Befunden gehörten Atemnot, Zyanose, Apnoe, Krampfanfälle, Temperaturinstabilität, Schwierigkeiten beim Füttern, Erbrechen, Hypoglykämie, Hypotonie, Hypertonie, Hyperreflexie, Zittern, Nervosität, Reizbarkeit und ständiges Weinen. Diese Merkmale stimmen entweder mit einer direkten toxischen Wirkung von SSRIs und SNRIs oder möglicherweise mit einem Arzneimittelabsetzsyndrom überein. Es sollte beachtet werden, dass das klinische Bild in einigen Fällen mit einem Serotonin-Syndrom übereinstimmt [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Bei der Behandlung einer schwangeren Frau mit Effexor XR während des dritten Trimesters sollte der Arzt die potenziellen Risiken und Vorteile der Behandlung sorgfältig abwägen.
Arbeit und Lieferung
Die Wirkung von Venlafaxin auf Wehen und Entbindung beim Menschen ist nicht bekannt.
Stillende Mutter
Es wurde berichtet, dass Venlafaxin und ODV in die Muttermilch ausgeschieden werden. Aufgrund der Möglichkeit schwerwiegender Nebenwirkungen von Effexor XR bei gestillten Säuglingen sollte unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter eine Entscheidung getroffen werden, ob das Stillen beendet oder das Arzneimittel abgesetzt werden soll.
Pädiatrische Verwendung
Zwei placebokontrollierte Studien mit 766 pädiatrischen Patienten mit MDD und zwei placebokontrollierte Studien mit 793 pädiatrischen Patienten mit GAD wurden mit Effexor XR durchgeführt, und die Daten reichten nicht aus, um eine Behauptung zur Anwendung bei pädiatrischen Patienten zu stützen.
Jeder, der die Anwendung von Effexor XR bei einem Kind oder Jugendlichen in Betracht zieht, muss die potenziellen Risiken mit der klinischen Notwendigkeit abwägen [siehe KASTENWARNUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ].
Obwohl keine Studien konzipiert wurden, um in erster Linie die Auswirkungen von Effexor 37,5 mg XR auf das Wachstum, die Entwicklung und die Reifung von Kindern und Jugendlichen zu beurteilen, deuten die durchgeführten Studien darauf hin, dass Effexor XR Gewicht und Körpergröße beeinträchtigen kann [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Sollte die Entscheidung getroffen werden, einen pädiatrischen Patienten mit Effexor XR zu behandeln, wird während der Behandlung eine regelmäßige Überwachung von Gewicht und Größe empfohlen, insbesondere wenn die Behandlung langfristig fortgesetzt werden soll [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Die Sicherheit der Behandlung mit Effexor 75 mg XR bei pädiatrischen Patienten wurde nicht systematisch für eine chronische Behandlung mit einer Dauer von mehr als sechs Monaten untersucht. In den an pädiatrischen Patienten (6-17 Jahre) durchgeführten Studien war das Auftreten von Blutdruck- und Cholesterinerhöhungen, die als klinisch relevant angesehen wurden, bei pädiatrischen Patienten ähnlich wie bei erwachsenen Patienten. Folglich gelten für pädiatrische Patienten die Vorsichtsmaßnahmen für Erwachsene [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Geriatrische Verwendung
Der Prozentsatz der Patienten in klinischen Studien mit Effexor 37,5 mg XR für MDD, GAD, SAD und PD, die 65 Jahre oder älter waren, ist in Tabelle 15 aufgeführt.
Insgesamt wurden keine Unterschiede in der Wirksamkeit oder Sicherheit zwischen geriatrischen Patienten und jüngeren Patienten beobachtet, und andere berichtete klinische Erfahrungen haben im Allgemeinen keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Eine erhöhte Empfindlichkeit einiger älterer Personen kann jedoch nicht ausgeschlossen werden. SSRIs und SNRIs, einschließlich Effexor XR, wurden mit Fällen von klinisch signifikanter Hyponatriämie bei älteren Patienten in Verbindung gebracht, die möglicherweise einem höheren Risiko für dieses unerwünschte Ereignis ausgesetzt sind [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die Pharmakokinetik von Venlafaxin und ODV ist bei älteren Menschen nicht wesentlich verändert [vgl KLINISCHE PHARMAKOLOGIE ] (siehe Abbildung 3). Für ältere Menschen wird keine Dosisanpassung allein aufgrund des Alters empfohlen, obwohl andere klinische Umstände, von denen einige bei älteren Menschen häufiger auftreten, wie z. B. Nieren- oder Leberfunktionsstörungen, eine Dosisreduktion rechtfertigen können [siehe DOSIERUNG UND ANWENDUNG ].
Alter und Geschlecht
Eine populationspharmakokinetische Analyse von 404 mit Effexor behandelten Patienten aus zwei Studien, die sowohl zweimal täglich als auch dreimal täglich verabreicht wurden, zeigte, dass die dosisnormalisierten Talplasmaspiegel von entweder Venlafaxin oder ODV durch Alters- oder Geschlechtsunterschiede unverändert blieben. Eine Dosisanpassung basierend auf dem Alter oder Geschlecht eines Patienten ist im Allgemeinen nicht erforderlich [siehe DOSIERUNG UND ANWENDUNG ] (siehe Tabelle 15).
Verwendung in Patientenuntergruppen
Abbildung 3: Pharmakokinetik von Venlafaxin und seinem Metaboliten O-Desmethylvenlafaxin (ODV) in speziellen Populationen.
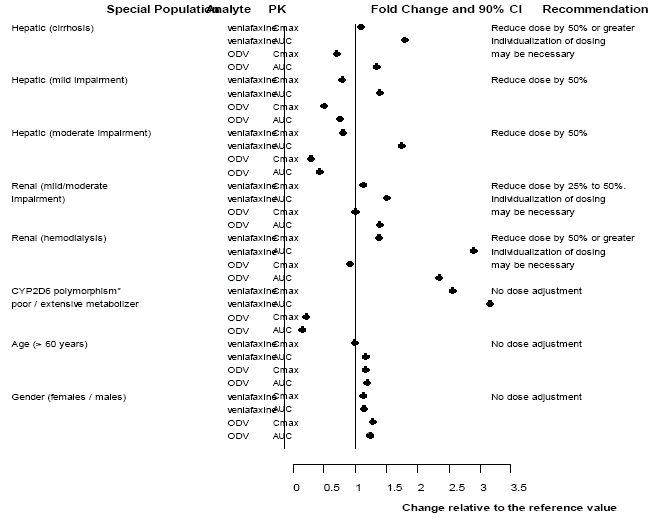
ÜBERDOSIS
Menschliche Erfahrung
Während der Premarketing-Bewertungen von Effexor 75 mg XR (für MDD, GAD, SAD und PD) und Effexor (für MDD) gab es zwanzig Berichte über eine akute Überdosierung mit Effexor (6 bzw. 14 Berichte bei Patienten mit Effexor XR und Effexor 75 mg). , entweder allein oder in Kombination mit anderen Drogen und/oder Alkohol.
Schläfrigkeit war das am häufigsten berichtete Symptom. Unter den anderen berichteten Symptomen waren Parästhesien aller vier Gliedmaßen, mäßiger Schwindel, Übelkeit, taube Hände und Füße und Hitze-Kälte-Anfälle 5 Tage nach der Überdosierung. In den meisten Fällen waren keine Anzeichen oder Symptome mit einer Überdosierung verbunden. Die Mehrzahl der Berichte betraf die Einnahme, bei der die eingenommene Gesamtdosis von Venlafaxin schätzungsweise nicht mehr als das Mehrfache der üblichen therapeutischen Dosis betrug. Bei einem Patienten, der 2,75 g Venlafaxin eingenommen hatte, wurden zwei generalisierte Krämpfe und eine QTc-Verlängerung auf 500 ms beobachtet, verglichen mit 405 ms zu Studienbeginn. Bei zwei der anderen Patienten wurde eine leichte Sinustachykardie berichtet.
Maßnahmen zur Behandlung der Überdosierung umfassten keine Behandlung, Krankenhausaufenthalt und symptomatische Behandlung sowie Krankenhausaufenthalt plus Behandlung mit Aktivkohle. Alle Patienten erholten sich.
Nach Markteinführung ist eine Überdosierung mit Venlafaxin überwiegend in Kombination mit Alkohol und/oder anderen Arzneimitteln aufgetreten. Zu den am häufigsten berichteten Ereignissen bei Überdosierung gehören Tachykardie, Bewusstseinsveränderungen (von Somnolenz bis Koma), Mydriasis, Krampfanfälle und Erbrechen.
Elektrokardiogrammveränderungen (z. B. Verlängerung des QT-Intervalls, Schenkelblock, QRS-Verlängerung), ventrikuläre Tachykardie, Bradykardie, Hypotonie, Rhabdomyolyse, Schwindel, Lebernekrose, Serotoninsyndrom und Tod wurden berichtet.
Veröffentlichte retrospektive Studien berichten, dass eine Überdosierung von Venlafaxin im Vergleich zu SSRI-Antidepressiva mit einem erhöhten Risiko für tödliche Ausgänge einhergehen kann, jedoch geringer als bei trizyklischen Antidepressiva. Epidemiologische Studien haben gezeigt, dass mit Venlafaxin behandelte Patienten eine höhere vorbestehende Belastung durch Suizidrisikofaktoren aufweisen als mit SSRI behandelte Patienten. Inwieweit der Befund eines erhöhten Risikos tödlicher Folgen der Toxizität von Venlafaxin bei Überdosierung im Gegensatz zu einigen Merkmalen der mit Venlafaxin behandelten Patienten zugeschrieben werden kann, ist nicht klar. Rezepte für Effexor 75 mg XR sollten für die kleinste Menge an Kapseln im Einklang mit einem guten Patientenmanagement ausgestellt werden, um das Risiko einer Überdosierung zu verringern.
Management einer Überdosierung
Konsultieren Sie ein zertifiziertes Giftinformationszentrum für aktuelle Anleitungen und Ratschläge (1-800-222-1222 oder www.poison.org). Im Falle einer Überdosierung sorgen Sie für unterstützende Maßnahmen, einschließlich einer engmaschigen ärztlichen Überwachung und Überwachung. Die Behandlung sollte aus den allgemeinen Maßnahmen bestehen, die bei der Behandlung einer Überdosierung mit jedem Arzneimittel angewendet werden. Berücksichtigen Sie die Möglichkeit einer mehrfachen Überdosierung von Medikamenten. Sorgen Sie für ausreichende Atemwege, Sauerstoffversorgung und Belüftung. Überwachen Sie den Herzrhythmus und die Vitalfunktionen. Sorgen Sie für unterstützende und symptomatische Maßnahmen.
KONTRAINDIKATIONEN
Überempfindlichkeit
Überempfindlichkeit gegen Venlafaxin-Hydrochlorid, Desvenlafaxin-Succinat oder einen der sonstigen Bestandteile der Formulierung
Gleichzeitige Anwendung mit Monoaminoxidase-Hemmern (MAO-Hemmern)
Die Anwendung von MAO-Hemmern (zur Behandlung psychiatrischer Erkrankungen) gleichzeitig mit Effexor 75 mg XR oder innerhalb von 7 Tagen nach Beendigung der Behandlung mit Effexor XR ist aufgrund eines erhöhten Risikos für ein Serotonin-Syndrom kontraindiziert. Die Anwendung von Effexor 37,5 mg XR innerhalb von 14 Tagen nach Beendigung der Behandlung mit einem MAO-Hemmer (zur Behandlung psychiatrischer Erkrankungen) ist ebenfalls kontraindiziert [siehe DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN , und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Der Beginn von Effexor XR bei einem Patienten, der mit einem MAO-Hemmer wie Linezolid oder intravenösem Methylenblau behandelt wird, ist aufgrund eines erhöhten Risikos für ein Serotonin-Syndrom ebenfalls kontraindiziert [siehe DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN , und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Der genaue Mechanismus der antidepressiven Wirkung von Venlafaxin beim Menschen ist unbekannt, es wird jedoch angenommen, dass er mit der Potenzierung von Serotonin und Norepinephrin im Zentralnervensystem durch Hemmung ihrer Wiederaufnahme zusammenhängt. Nichtklinische Studien haben gezeigt, dass Venlafaxin und sein aktiver Metabolit ODV wirksame und selektive Inhibitoren der neuronalen Serotonin- und Noradrenalin-Wiederaufnahme und schwache Inhibitoren der Dopamin-Wiederaufnahme sind.
Pharmakodynamik
Venlafaxin und ODV haben in vitro keine signifikante Affinität zu muskarinisch-cholinergen, H1-histaminergen oder α1-adrenergen Rezeptoren. Es wird angenommen, dass die pharmakologische Aktivität an diesen Rezeptoren mit den verschiedenen anticholinergen, sedierenden und kardiovaskulären Wirkungen assoziiert ist, die bei anderen Psychopharmaka beobachtet werden. Venlafaxin und ODV besitzen keine Monoaminooxidase (MAO)-Hemmwirkung.
Herzelektrophysiologie
Die Wirkung von Venlafaxin auf das QT-Intervall wurde in einer randomisierten, doppelblinden, Placebo- und positiv-kontrollierten gründlichen Crossover-QT-Studie über drei Perioden bei 54 gesunden erwachsenen Probanden untersucht. Es wurde keine signifikante QT-Verlängerungswirkung von Venlafaxin 450 mg festgestellt.
Pharmakokinetik
Steady-State-Konzentrationen von Venlafaxin und ODV im Plasma werden innerhalb von 3 Tagen nach oraler Mehrfachdosistherapie erreicht. Venlafaxin und ODV zeigten über den Dosisbereich von 75 bis 450 mg pro Tag eine lineare Kinetik. Die mittlere ± Standardabweichung der Plasmaclearance im Steady State von Venlafaxin und ODV beträgt 1,3 ± 0,6 bzw. 0,4 ± 0,2 l/h/kg; die scheinbare Eliminationshalbwertszeit beträgt 5±2 bzw. 11±2 Stunden; und das scheinbare (Steady State) Verteilungsvolumen beträgt 7,5 ± 3,7 bzw. 5,7 ± 1,8 l/kg. Venlafaxin und ODV werden in therapeutischen Konzentrationen minimal an Plasmaproteine gebunden (27 % bzw. 30 %).
Absorption und Verteilung
Venlafaxin wird gut resorbiert und umfassend in der Leber metabolisiert. ODV ist der wichtigste aktive Metabolit. Auf der Grundlage von Massenbilanzstudien werden mindestens 92 % einer oralen Einzeldosis von Venlafaxin resorbiert. Die absolute Bioverfügbarkeit von Venlafaxin beträgt etwa 45 %.
Die Verabreichung von Effexor 37,5 mg XR (150 mg einmal täglich) führte im Allgemeinen zu niedrigeren Cmax- und späteren Tmax-Werten als bei zweimal täglich verabreichtem Effexor (mit sofortiger Freisetzung) (Tabelle 16). Wenn gleiche Tagesdosen von Venlafaxin entweder als Tablette mit sofortiger Freisetzung oder als Kapsel mit verlängerter Freisetzung verabreicht wurden, war die Exposition gegenüber Venlafaxin und ODV bei den beiden Behandlungen ähnlich, und die Schwankungen der Plasmakonzentrationen waren bei Effexor 37,5 mg etwas geringer XR-Kapsel. Daher bietet Effexor XR eine langsamere Resorptionsrate, aber das gleiche Ausmaß an Resorption wie die Tablette mit sofortiger Wirkstofffreisetzung.
Nahrung hatte keinen Einfluss auf die Bioverfügbarkeit von Venlafaxin oder seines aktiven Metaboliten ODV. Der Verabreichungszeitpunkt (AM versus PM) hatte keinen Einfluss auf die Pharmakokinetik von Venlafaxin und ODV aus der 75-mg-Kapsel Effexor 75 mg XR.
Venlafaxin wird nicht stark an Plasmaproteine gebunden; Daher sollte die Verabreichung von Effexor 37,5 mg XR an einen Patienten, der ein anderes Arzneimittel mit hoher Proteinbindung einnimmt, keine erhöhten freien Konzentrationen des anderen Arzneimittels verursachen.
Stoffwechsel und Ausscheidung
Nach der Resorption wird Venlafaxin in der Leber extensiv präsystemisch metabolisiert, hauptsächlich zu ODV, aber auch zu N-Desmethylvenlafaxin, N,O-Didesmethylvenlafaxin und anderen Nebenmetaboliten. In-vitro-Studien weisen darauf hin, dass die Bildung von ODV durch CYP2D6 katalysiert wird; dies wurde in einer klinischen Studie bestätigt, die zeigte, dass Patienten mit niedrigen CYP2D6-Spiegeln (langsame Metabolisierer) im Vergleich zu Patienten mit normalen CYP2D6-Spiegeln (schnelle Metabolisierer) erhöhte Venlafaxinspiegel und verringerte ODV-Spiegel aufwiesen [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Etwa 87 % einer Venlafaxin-Dosis werden im Urin innerhalb von 48 Stunden als unverändertes Venlafaxin (5 %), unkonjugiertes ODV (29 %), konjugiertes ODV (26 %) oder andere geringfügige inaktive Metaboliten (27 %) wiedergefunden. Die renale Elimination von Venlafaxin und seinen Metaboliten ist daher der primäre Ausscheidungsweg.
Klinische Studien
Depression
Die Wirksamkeit von Effexor 75 mg XR (Venlafaxinhydrochlorid)-Kapseln mit verlängerter Wirkstofffreisetzung zur Behandlung von Major Depression (MDD) wurde in zwei placebokontrollierten, flexiblen Kurzzeitstudien (8 Wochen für Studie 1; 12 Wochen für Studie 2) nachgewiesen -Dosierungsstudien mit Dosierungen von 75 mg pro Tag bis hin zu 225 mg pro Tag bei erwachsenen ambulanten Patienten, die die DSM-III-R- oder DSM-IV-Kriterien für MDD erfüllen. Bei mäßig depressiven ambulanten Patienten betrug die Anfangsdosis von Venlafaxin 75 mg pro Tag. In beiden Studien zeigte Effexor XR eine Überlegenheit gegenüber Placebo in Bezug auf den primären Wirksamkeitsmaßstab, der als Änderung des HAM-D-21-Gesamtscores gegenüber dem Ausgangswert bis zum Endpunkt-Besuch definiert ist. Effexor XR zeigte auch eine Überlegenheit gegenüber Placebo in Bezug auf den wichtigsten sekundären Wirksamkeitsendpunkt, den klinischen Global Impressions (CGI) Schweregradskala der Krankheit. Die Untersuchung der geschlechtsspezifischen Untergruppen der untersuchten Bevölkerung ergab keine unterschiedliche Reaktionsfähigkeit auf der Grundlage des Geschlechts.
Eine 4-wöchige Studie mit stationären Patienten, die die DSM-III-R-Kriterien für MDD mit Melancholie erfüllten und Effexor 37,5 mg in einem Bereich von 150 bis 375 mg pro Tag (aufgeteilt in ein dreimal tägliches Schema) verwendeten, zeigte die Überlegenheit von Effexor gegenüber Placebo basierend auf dem HAM-D-21-Gesamtscore. Die mittlere Dosis bei den Absolvierenden betrug 350 mg pro Tag (Studie 3).
In einer längerfristigen Studie wurden erwachsene ambulante Patienten mit MDD, die während einer 8-wöchigen Open-Label-Studie auf Effexor 37,5 mg XR (75, 150 oder 225 mg, einmal täglich jeden Morgen) angesprochen hatten, zur Fortsetzung ihres gleichen Effexor randomisiert XR-Dosis oder Placebo für bis zu 26 Wochen Beobachtung auf Rückfall. Das Ansprechen während der Open-Label-Phase wurde definiert als ein Item-Score von CGI Severity of Illness von ≤ 3 und ein HAM-D-21-Gesamtscore von ≤ 10 bei der Bewertung am Tag 56. Rückfall während der doppelblinden Phase wurde wie folgt definiert: (1) ein Wiederauftreten einer schweren depressiven Störung gemäß Definition durch die DSM-IV-Kriterien und ein CGI-Schwere-der-Krankheit-Item-Score von ≥4 (mäßig krank), (2) 2 aufeinanderfolgende CGI Item-Scores für den Schweregrad der Erkrankung von ≥4 oder (3) ein abschließender CGI-Item-Score für den Schweregrad der Erkrankung von ≥4 für jeden Patienten, der aus irgendeinem Grund aus der Studie ausgeschieden ist. Bei Patienten, die die Behandlung mit Effexor 37,5 mg XR fortsetzten, kam es in den folgenden 26 Wochen zu statistisch signifikant niedrigeren Rückfallraten im Vergleich zu Patienten, die Placebo erhielten (Studie 4).
In einer zweiten längerfristigen Studie wurden erwachsene ambulante Patienten mit MDD vom rezidivierenden Typ, die angesprochen hatten (HAM-D21-Gesamtpunktzahl ≤ 12 am Tag 56) und weiterhin besser [definiert als die folgenden Kriterien erfüllt für die Tage 56 bis 180 : (1) kein HAM-D-21-Gesamtscore ≥ 20; (2) nicht mehr als 2 HAM39 D-21-Gesamtscores > 10 und (3) kein einzelner CGI-Score des Schweregrads der Erkrankung ≥ 4 (mäßig krank)] während der ersten 26 Behandlungswochen mit Effexor [100 bis 200 mg pro Tag, zweimal täglich] wurden randomisiert der Fortsetzung ihrer gleichen Effexor-Dosis oder Placebo zugeteilt. Die Nachbeobachtungszeit zur Beobachtung der Patienten auf einen Rückfall, definiert als CGI-Score des Schweregrads der Erkrankung ≥ 4, betrug bis zu 52 Wochen. Bei Patienten, die die Behandlung mit Effexor fortsetzten, kam es in den folgenden 52 Wochen zu statistisch signifikant niedrigeren Rückfallraten im Vergleich zu Patienten, die Placebo erhielten (Studie 5).
Generalisierte Angststörung
Die Wirksamkeit von Effexor XR zur Behandlung der generalisierten Angststörung (GAD) wurde in zwei 8-wöchigen, placebokontrollierten Studien mit fester Dosis (75 bis 225 mg pro Tag) und einer 6-monatigen, placebokontrollierten, flexiblen Studie nachgewiesen -Dosis-Studie (75 bis 225 mg pro Tag) und eine 6-monatige placebokontrollierte Studie mit fester Dosis (37,5, 75 und 150 mg pro Tag) bei erwachsenen ambulanten Patienten, die die DSM-IV-Kriterien für GAD erfüllen.
In einer 8-wöchigen Studie zeigte Effexor XR eine Überlegenheit gegenüber Placebo für die Tagesdosen von 75, 150 und 225 mg, gemessen anhand des Gesamtwertes der Hamilton Rating Scale for Anxiety (HAM-A), sowohl der HAM-A-Angst als auch der Anspannung Items und die Clinical Global Impressions (CGI)-Skala. Die Tagesdosen von 75 und 150 mg waren jedoch nicht so durchgängig wirksam wie die höchste Dosis (Studie 1). Eine zweite 8-wöchige Studie, in der Dosen von 75 und 150 mg pro Tag und Placebo bewertet wurden, zeigte, dass beide Dosen bei einigen dieser gleichen Endpunkte wirksamer waren als Placebo; Die Tagesdosis von 75 mg war jedoch durchgängig wirksamer als die Tagesdosis von 150 mg (Studie 2). Eine Dosis-Wirkungs-Beziehung für die Wirksamkeit bei GAD wurde im untersuchten Dosisbereich von 75 bis 225 mg pro Tag nicht eindeutig festgestellt.
Zwei 6-monatige Studien, von denen eine Effexor 75 mg XR-Dosen von 37,5, 75 und 150 mg pro Tag (Studie 3) und die andere Effexor XR-Dosen von 75 bis 225 mg pro Tag (Studie 4) bewertete, zeigten, dass Tagesdosen von 75 mg oder mehr waren während der 6-monatigen Behandlung wirksamer als Placebo auf den HAM-A-Gesamtwert, sowohl auf die HAM-A-Ängste und Anspannung als auch auf die CGI-Skala. Während es auch Hinweise auf eine Überlegenheit gegenüber Placebo für die Tagesdosis von 37,5 mg gab, war diese Dosis nicht so durchgängig wirksam wie die höheren Dosen.
Die Untersuchung der geschlechtsspezifischen Untergruppen der untersuchten Bevölkerung ergab keine unterschiedliche Reaktionsfähigkeit auf der Grundlage des Geschlechts.
Soziale Angststörung (auch bekannt als soziale Phobie)
Die Wirksamkeit von Effexor 37,5 mg XR zur Behandlung der sozialen Angststörung (SAD) wurde in vier doppelblinden, 12-wöchigen, multizentrischen, placebokontrollierten Parallelgruppenstudien mit flexibler Dosierung (Studien 1-4) und nachgewiesen eine doppelblinde, 6-monatige, placebokontrollierte Parallelgruppenstudie mit fester/flexibler Dosis, die Dosen in einem Bereich von 75 bis 225 mg pro Tag bei erwachsenen ambulanten Patienten umfasste, die die DSM-IV-Kriterien für SAD erfüllten (Studie 5 ).
In diesen fünf Studien war Effexor 75 mg XR statistisch signifikant wirksamer als Placebo in Bezug auf die Veränderung vom Ausgangswert zum Endpunkt des Gesamtscores der Liebowitz Social Anxiety Scale (LSAS). In der 6-monatigen Studie gab es keine Hinweise auf eine größere Wirksamkeit der Gruppe mit 150 bis 225 mg pro Tag im Vergleich zu der Gruppe mit 75 mg pro Tag.
Die Untersuchung von Untergruppen der untersuchten Population ergab keine unterschiedliche Reaktionsfähigkeit auf der Grundlage des Geschlechts. Es lagen keine ausreichenden Informationen vor, um die Auswirkung von Alter oder ethnischer Zugehörigkeit auf das Ergebnis dieser Studien zu bestimmen.
Panikstörung
Die Wirksamkeit von Effexor XR zur Behandlung von Panikstörungen (PD) wurde in zwei doppelblinden, 12-wöchigen, multizentrischen, placebokontrollierten Studien mit erwachsenen ambulanten Patienten nachgewiesen, die die DSM-IV-Kriterien für PD mit oder ohne Agoraphobie erfüllten. Die Patienten erhielten in einer Studie (Studie 1) feste Dosen von 75 oder 150 mg pro Tag und in der anderen Studie (Studie 2) 75 oder 225 mg pro Tag.
Die Wirksamkeit wurde auf der Grundlage von Ergebnissen in drei Variablen bewertet: (1) Prozentsatz der Patienten, die frei von Panikattacken mit allen Symptomen auf der Panic and Anticipatory Anxiety Scale (PAAS) waren; (2) mittlere Änderung vom Ausgangswert zum Endpunkt auf der Gesamtpunktzahl der Panikstörungs-Schweregradskala (PDSS); und (3) Prozentsatz der Patienten, die auf der Verbesserungsskala der Clinical Global Impressions (CGI) als Responder (stark verbessert oder sehr stark verbessert) eingestuft wurden. In diesen beiden Studien war Effexor XR bei allen drei Endpunkten statistisch signifikant wirksamer als Placebo (für jede feste Dosis), aber eine Dosis-Wirkungs-Beziehung wurde nicht eindeutig nachgewiesen.
Die Untersuchung von Untergruppen der untersuchten Population ergab keine unterschiedliche Reaktionsfähigkeit auf der Grundlage des Geschlechts. Es lagen keine ausreichenden Informationen vor, um die Auswirkung von Alter oder ethnischer Zugehörigkeit auf das Ergebnis dieser Studien zu bestimmen.
In einer längerfristigen Studie (Studie 3) wurden erwachsene ambulante Patienten, die die DSM-IV-Kriterien für PD erfüllten und während einer 12-wöchigen offenen Phase auf Effexor 75 mg XR (75 bis 225 mg pro Tag) angesprochen hatten, nach dem Zufallsprinzip weiterhin mit Effexor 75 mg behandelt XR-Dosis (75, 150 oder 225 mg) oder Umstellung auf Placebo zur Beobachtung eines Rückfalls unter doppelblinden Bedingungen. Das Ansprechen während der offenen Phase wurde definiert als ≤ 1 Panikattacke mit allen Symptomen pro Woche während der letzten 2 Wochen der offenen Phase und ein CGI-Verbesserungswert von 1 (sehr stark verbessert) oder 2 (stark verbessert). Rückfall während der doppelblinden Phase war definiert als 2 oder mehr Panikattacken mit vollem Symptom pro Woche für 2 aufeinanderfolgende Wochen oder als Absetzen aufgrund von Wirksamkeitsverlust, wie von den Prüfärzten während der Studie festgestellt wurde. Randomisierte Patienten befanden sich vor der Randomisierung durchschnittlich 34 Tage im Ansprechstatus. In der randomisierten Phase nach der 12-wöchigen Open-Label-Periode erlebten Patienten, die weiterhin Effexor 75 mg XR erhielten, eine statistisch signifikant längere Zeit bis zum Rückfall.
Pädiatrische Patienten
Zwei placebokontrollierte Studien an 766 pädiatrischen Patienten mit MDD und zwei placebokontrollierte Studien an 793 pädiatrischen Patienten mit GAD wurden mit Effexor XR durchgeführt, und die Daten reichten nicht aus, um eine Behauptung zur Anwendung bei pädiatrischen Patienten zu stützen.
Was ist Effexor und wie wird es angewendet?
Effexor ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Depressionen, generalisierter Angst, sozialer Angst und Panikstörung. Effexor kann allein oder mit anderen Medikamenten verwendet werden.
Effexor gehört zu einer Klasse von Arzneimitteln, die Antidepressiva, selektive Serotonin- und Noradrenalin-Wiederaufnahmehemmer (SNRIs) genannt werden.
Welche Nebenwirkungen kann Effexor 37,5 mg haben?
Effexor kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Effexor. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
Suizidalität und Antidepressiva
Antidepressiva erhöhten im Vergleich zu Placebo das Risiko für suizidales Denken und Verhalten (Suizidalität) bei Kindern, Jugendlichen und jungen Erwachsenen in Kurzzeitstudien zu Major Depression (MDD) und anderen psychiatrischen Erkrankungen. Jeder, der die Anwendung von Venlafaxin-Tabletten, USP oder anderen Antidepressiva bei einem Kind, Jugendlichen oder jungen Erwachsenen in Betracht zieht, muss dieses Risiko mit der klinischen Notwendigkeit abwägen. Kurzzeitstudien zeigten bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidalitätsrisikos mit Antidepressiva im Vergleich zu Placebo; Bei Erwachsenen ab 65 Jahren war das Risiko unter Antidepressiva im Vergleich zu Placebo geringer. Depressionen und bestimmte andere psychiatrische Störungen sind selbst mit einem erhöhten Suizidrisiko verbunden. Patienten jeden Alters, die mit einer antidepressiven Therapie begonnen werden, sollten angemessen überwacht und engmaschig auf klinische Verschlechterung, Suizidalität oder ungewöhnliche Verhaltensänderungen beobachtet werden. Familien und Betreuer sollten auf die Notwendigkeit einer genauen Beobachtung und Kommunikation mit dem verschreibenden Arzt hingewiesen werden. Venlafaxin Tabletten, USP ist nicht für die Anwendung bei pädiatrischen Patienten zugelassen. (Sehen WARNUNGEN : Klinische Verschlechterung und Suizidrisiko , INFORMATIONEN ZUM PATIENTEN , und VORSICHTSMASSNAHMEN : Pädiatrische Verwendung ).
BEZEICHNUNG
Venlafaxin Tabletten, USP ist ein strukturell neuartiges Antidepressivum zur oralen Verabreichung. Es wird als (R/S)-1-[2-(Dimethylamino)-1-(4-methoxyphenyl)ethyl]cyclohexanolhydrochlorid oder (±)-1-[α-[(Dimethylamino)methyl]-p- bezeichnet. Methoxybenzyl]cyclohexanolhydrochlorid und hat die empirische Formel C17H27NO2 HCl. Sein Molekulargewicht beträgt 313,87. Die Strukturformel ist unten gezeigt.
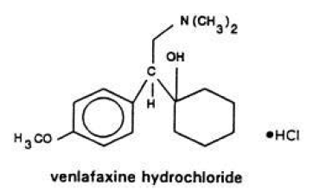
Venlafaxinhydrochlorid ist ein weißer bis cremefarbener kristalliner Feststoff mit einer Löslichkeit von 572 mg/ml in Wasser (mit Natriumchlorid auf eine Ionenstärke von 0,2 M eingestellt). Sein Verteilungskoeffizient Octanol:Wasser (0,2 M Natriumchlorid) beträgt 0,43.
Komprimierte Tabletten enthalten Venlafaxin-Hydrochlorid, USP entsprechend 25 mg, 37,5 mg, 50 mg, 75 mg oder 100 mg Venlafaxin-Base und die folgenden inaktiven Bestandteile: mikrokristalline Cellulose, Lactose-Monohydrat, vorverkleisterte Stärke, Natriumstärkeglycolat, Eisenoxidrot, Eisenoxidgelb, kolloidales Siliciumdioxid und Magnesiumstearat.