Amoxil 250mg, 500mg, 625mg, 1000mg Amoxicillin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Amoxicillin und wie wird es angewendet?
Was ist Amoxil 1000 mg?
Amoxil ist ein verschreibungspflichtiges Medikament zur Behandlung der Symptome vieler verschiedener Arten von bakteriellen Infektionen wie Tonsillitis, Bronchitis, Lungenentzündung und Infektionen der Ohren, Nase, des Rachens, der Haut oder der Harnwege. Amoxil 1000 mg kann allein oder mit anderen Medikamenten verwendet werden.
Amoxil gehört zu einer Klasse von Medikamenten namens Penicilline, Amino.
Welche Nebenwirkungen kann Amoxil haben?
Amoxil kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Amoxil sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Amoxil. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Formulierungen von AMOXIL enthalten Amoxicillin, ein halbsynthetisches Antibiotikum, ein Analogon von Ampicillin, mit einem breiten Spektrum an bakterizider Aktivität gegen viele grampositive und gramnegative Mikroorganismen. Chemisch ist es (2S,5,R,6,R)-6-[(,R)-(-)-2-Amino-2-(p-hydroxyphenyl)acetamido]-3,3-dimethyl-7- Oxo-4-thia-1-azabicyclo[3.2.0]heptan-2-carbonsäuretrihydrat. Es kann strukturell dargestellt werden als:
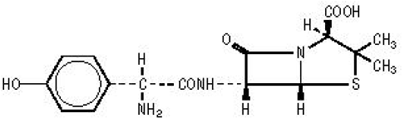
Die Molekularformel von Amoxicillin ist C16H19N3O5S·3H2O und das Molekulargewicht beträgt 419,45.
Kapseln : Jede Kapsel AMOXIL mit königsblauem, undurchsichtigem Oberteil und rosafarbenem, undurchsichtigem Unterteil enthält 250 mg oder 500 mg Amoxicillin als Trihydrat. Die Kappe und das Unterteil der 250-mg-Kapsel sind mit dem Produktnamen AMOXIL 1000 mg und 250 bedruckt; Ober- und Unterteil der 500-mg-Kapsel sind mit AMOXIL 1000 mg und 500 bedruckt. Inaktive Inhaltsstoffe: D&C Red Nr. 28, FD&C Blue Nr. 1, FD&C Red Nr. 40, Gelatine, Magnesiumstearat und Titandioxid.
Jede Tablette enthält 500 mg oder 875 mg Amoxicillin als Trihydrat. Jede rosa Filmtablette in Kapselform trägt die Prägung AMOXIL 500 mg, zentriert über 500 bzw. 875. Die 875-mg-Tablette hat eine Bruchkerbe auf der Rückseite. Inaktive Inhaltsstoffe: Kolloidales Siliziumdioxid, Crospovidon, FD&C Red Nr. 30 Aluminiumlack, Hypromellose, Magnesiumstearat, mikrokristalline Cellulose, Polyethylenglykol, Natriumstärkeglykolat und Titandioxid.
Pulver zur Herstellung einer Suspension zum Einnehmen 5 ml der rekonstituierten Suspension enthalten 125 mg, 200 mg, 250 mg oder 400 mg Amoxicillin als Trihydrat. Jeweils 5 ml der rekonstituierten 125-mg-Suspension enthalten 0,11 mEq (2,51 mg) Natrium. Jeweils 5 ml der rekonstituierten 200-mg-Suspension enthalten 0,15 mEq (3,39 mg) Natrium. Jeweils 5 ml der rekonstituierten 250-mg-Suspension enthalten 0,15 mEq (3,36 mg) Natrium; jeweils 5 ml der rekonstituierten 400-mg-Suspension enthalten 0,19 mEq (4,33 mg) Natrium. Inaktive Inhaltsstoffe: FD&C Red Nr. 3, Aromen, Kieselgel, Natriumbenzoat, Natriumcitrat, Saccharose und Xanthangummi.
INDIKATIONEN
Infektionen des Ohrs, der Nase und des Rachens
AMOXIL® ist indiziert zur Behandlung von Infektionen durch empfindliche (NUR β-Lactamase-negative) Isolate von Streptococcus-Spezies. (nur α- und β-hämolytische Isolate), Streptococcus pneumoniae, Staphylococcus spp. oder Haemophilus influenzae.
Infektionen des Urogenitaltraktes
AMOXIL® ist indiziert zur Behandlung von Infektionen durch empfindliche (NUR β-Lactamase-negative) Isolate von Escherichia coli, Proteus mirabilis oder Enterococcus faecalis.
Infektionen der Haut und Hautstruktur
AMOXIL® ist indiziert zur Behandlung von Infektionen durch empfindliche (NUR β-Lactamase-negative) Isolate von Streptococcus spp. (nur α- und β-hämolytische Isolate), Staphylococcus spp. oder E. coli.
Infektionen der unteren Atemwege
AMOXIL® ist indiziert zur Behandlung von Infektionen durch empfindliche (NUR β-Lactamase-negative) Isolate von Streptococcus spp. (nur α- und β-hämolytische Isolate), S. pneumoniae, Staphylococcus spp. oder H. influenzae.
Helicobacter-pylori-Infektion
Triple-Therapie für Helicobacter Pylori mit Clarithromycin und Lansoprazol
AMOXIL ist in Kombination mit Clarithromycin plus Lansoprazol als Dreifachtherapie zur Behandlung von Patienten mit H. pylori-Infektion und Zwölffingerdarmgeschwür (aktives oder seit 1 Jahr bestehendes Zwölffingerdarmgeschwür) zur Eradikation von H. pylori indiziert. Es wurde gezeigt, dass die Eradikation von H. pylori das Risiko eines erneuten Auftretens von Zwölffingerdarmgeschwüren verringert.
Duale Therapie für H. pylori mit Lansoprazol
AMOXIL ist in Kombination mit Lansoprazol-Retardkapseln als Zweifachtherapie zur Behandlung von Patienten mit H.-pylori-Infektion und Zwölffingerdarmgeschwüren (aktives Zwölffingerdarmgeschwür oder seit 1 Jahr bestehendes Zwölffingerdarmgeschwür) indiziert. die entweder allergisch oder intolerant gegenüber Clarithromycin sind oder bei denen eine Resistenz gegenüber Clarithromycin bekannt ist oder vermutet wird. (Sehen die Clarithromycin-Packungsbeilage , Mikrobiologie .) Es wurde gezeigt, dass die Eradikation von H. pylori das Risiko eines erneuten Auftretens von Zwölffingerdarmgeschwüren verringert.
Verwendungszweck
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von AMOXIL (Amoxicillin) und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte AMOXIL 250 mg nur zur Behandlung von Infektionen angewendet werden, die nachweislich oder stark vermutet durch Bakterien verursacht werden. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
DOSIERUNG UND ANWENDUNG
Dosierung für erwachsene und pädiatrische Patienten > 3 Monate alt
Die Behandlung sollte mindestens 48 bis 72 Stunden über den Zeitpunkt hinaus fortgesetzt werden, zu dem der Patient asymptomatisch wird oder Hinweise auf eine bakterielle Eradikation vorliegen. Es wird empfohlen, jede durch Streptococcus pyogenes verursachte Infektion mindestens 10 Tage lang zu behandeln, um das Auftreten eines akuten rheumatischen Fiebers zu verhindern. Bei einigen Infektionen kann eine mehrwöchige Therapie erforderlich sein. Es kann erforderlich sein, die klinische und/oder bakteriologische Nachsorge noch mehrere Monate nach Beendigung der Therapie fortzusetzen.
Dosierung bei Neugeborenen und Säuglingen im Alter von ≤ 12 Wochen (≤ 3 Monate)
Die Behandlung sollte mindestens 48 bis 72 Stunden über den Zeitpunkt hinaus fortgesetzt werden, zu dem der Patient asymptomatisch wird oder Hinweise auf eine bakterielle Eradikation vorliegen. Es wird empfohlen, jede durch Streptococcus pyogenes verursachte Infektion mindestens 10 Tage lang zu behandeln, um das Auftreten eines akuten rheumatischen Fiebers zu verhindern. Aufgrund der unvollständig entwickelten Nierenfunktion, die die Ausscheidung von Amoxicillin in dieser Altersgruppe beeinträchtigt, beträgt die empfohlene Höchstdosis von AMOXIL 30 mg/kg/Tag, aufgeteilt alle 12 Stunden. Derzeit gibt es keine Dosierungsempfehlungen für pädiatrische Patienten mit eingeschränkter Nierenfunktion.
Dosierung für H. Pylori-Infektion
Triple-Therapie
Die empfohlene orale Dosis für Erwachsene beträgt 1 Gramm AMOXIL 1000 mg, 500 mg Clarithromycin und 30 mg Lansoprazol, jeweils zweimal täglich (alle 12 Stunden) für 14 Tage.
Duale Therapie
Die empfohlene orale Dosis für Erwachsene beträgt 1 Gramm AMOXIL 625 mg und 30 mg Lansoprazol, jeweils dreimal täglich (alle 8 Stunden) über 14 Tage. Bitte beachten Sie die vollständigen Verschreibungsinformationen für Clarithromycin und Lansoprazol.
Dosierung bei eingeschränkter Nierenfunktion
Anleitung zum Mischen der Suspension zum Einnehmen
Klopfen Sie auf die Flasche, bis das gesamte Pulver frei fließt. Etwa 1/3 der Gesamtmenge an Wasser zur Rekonstitution hinzufügen (siehe Tabelle 2) und kräftig schütteln, bis ein feuchtes Pulver entsteht. Restliches Wasser zugeben und erneut kräftig schütteln.
Nach der Rekonstitution sollte die erforderliche Menge der Suspension zum Schlucken direkt auf die Zunge des Kindes gegeben werden. Alternative Verabreichungswege sind die Zugabe der erforderlichen Menge der Suspension zu Säuglingsnahrung, Milch, Fruchtsaft, Wasser, Ginger Ale oder kalten Getränken. Diese Präparate sollten dann sofort eingenommen werden.
HINWEIS: DIE ORALE SUSPENSION VOR DER VERWENDUNG GUT SCHÜTTELN. Flasche fest verschlossen halten. Jeder nicht verwendete Teil der rekonstituierten Suspension muss nach 14 Tagen verworfen werden. Kühlung ist wünschenswert, aber nicht erforderlich.
WIE GELIEFERT
Darreichungsformen und Stärken
Kapseln
250 mg, 500 mg. Jede Kapsel AMOXIL 625 mg mit königsblauem, undurchsichtigem Oberteil und rosafarbenem, undurchsichtigem Unterteil enthält 250 mg oder 500 mg Amoxicillin als Trihydrat. Das Oberteil und das Unterteil der 250-mg-Kapsel sind mit dem Produktnamen AMOXIL und 250 bedruckt; Ober- und Unterteil der 500-mg-Kapsel sind mit AMOXIL und 500 bedruckt.
Tablets
500 mg, 875 mg. Jede Tablette enthält 500 mg oder 875 mg Amoxicillin als Trihydrat. Jede rosa Filmtablette in Kapselform trägt die Prägung AMOXIL, zentriert über 500 bzw. 875. Die 875-mg-Tablette hat eine Bruchkerbe auf der Rückseite.
Pulver zur Herstellung einer Suspension zum Einnehmen
125 mg/5 ml, 200 mg/5 ml, 250 mg/5 ml, 400 mg/5 ml. Jede 5 ml rekonstituierte Suspension mit Erdbeergeschmack enthält 125 mg Amoxicillin als Trihydrat. Jede 5 ml rekonstituierte Suspension mit Kaugummigeschmack enthält 200 mg, 250 mg oder 400 mg Amoxicillin als Trihydrat.
Lagerung und Handhabung
Kapseln: Jede Amoxil-Kapsel mit königsblauem, undurchsichtigem Oberteil und rosafarbenem, undurchsichtigem Unterteil enthält 250 mg oder 500 mg Amoxicillin als Trihydrat. Das Oberteil und das Unterteil der 250-mg-Kapsel sind mit dem Produktnamen AMOXIL und 250 bedruckt; Ober- und Unterteil der 500-mg-Kapsel sind mit AMOXIL und 500 bedruckt.
250-mg-Kapsel
NDC 43598-025-01 Flaschen zu 100 NDC 43598-025-05 Flaschen zu 500
500-mg-Kapsel
NDC 43598-005-01 Flaschen zu 100 NDC 43598-005-05 Flaschen zu 500
Jede Tablette enthält 500 mg oder 875 mg Amoxicillin als Trihydrat. Jede rosa Filmtablette in Kapselform trägt die Prägung AMOXIL, zentriert über 500 bzw. 875. Die 875-mg-Tablette hat eine Bruchkerbe auf der Rückseite.
500-mg-Tablette
NDC 43598-024-01 Flaschen zu 100 NDC 43598-024-05 Flaschen zu 500
875-mg-Tablette
NDC 43598-019-01 Flaschen zu 100 NDC 43598-019-14 20er Flaschen
Pulver zur Herstellung einer Suspension zum Einnehmen: Jede 5 ml rekonstituierte Suspension mit Erdbeergeschmack enthält 125 mg Amoxicillin als Trihydrat. Jede 5 ml rekonstituierte Suspension mit Kaugummigeschmack enthält 200 mg, 250 mg oder 400 mg Amoxicillin als Trihydrat.
125 mg/5 ml
NDC 43598-022-80 80-ml-Flasche NDC 43598-022-52 100-ml-Flasche NDC 43598-022-53 150-ml-Flasche
200 mg/5 ml
NDC 43598-023-50 50-ml-Flasche NDC 43598-023-51 75-ml-Flasche NDC 43598-023-52 100-ml-Flasche
250 mg/5 ml
NDC 43598-009-80 80-ml-Flasche NDC 43598-009-52 100-ml-Flasche NDC 43598-009-53 150-ml-Flasche
400 mg/5 ml
NDC 43598-007-50 50-ml-Flasche NDC 43598-007-51 75-ml-Flasche NDC 43598-007-52 100-ml-Flasche
Bei oder unter 20 °C (68 °F) lagern -250 mg und 500 mg Kapseln und 125 mg und 250 mg nicht rekonstituiertes Pulver.
Bei oder unter 25 °C (77 °F) lagern -500 mg und 875 mg Tabletten und 200 mg und 400 mg nicht rekonstituiertes Pulver.
In einem dichten Behälter verteilen.
Hergestellt. Von: Dr. Reddys Laboratories Tennessee, LLC. Bristol, TN 37620. Überarbeitet: September 2015
NEBENWIRKUNGEN
Folgendes wird in anderen Abschnitten der Kennzeichnung ausführlicher behandelt:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die häufigsten Nebenwirkungen (> 1 %), die in klinischen Studien mit AMOXIL Kapseln, Tabletten oder Suspension zum Einnehmen beobachtet wurden, waren Durchfall, Hautausschlag, Erbrechen und Übelkeit.
Triple-Therapie : Die am häufigsten berichteten Nebenwirkungen bei Patienten, die eine Dreifachtherapie (Amoxicillin/Clarithromycin/Lansoprazol) erhielten, waren Durchfall (7 %), Kopfschmerzen (6 %) und Geschmacksstörungen (5 %).
Duale Therapie : Die am häufigsten berichteten Nebenwirkungen bei Patienten, die eine Doppeltherapie mit Amoxicillin/Lansoprazol erhielten, waren Durchfall (8 %) und Kopfschmerzen (7 %). Weitere Informationen zu Nebenwirkungen von Clarithromycin oder Lansoprazol finden Sie im Abschnitt „Nebenwirkungen“ der jeweiligen Packungsbeilage.
Postmarketing oder andere Erfahrung
Zusätzlich zu den aus klinischen Studien berichteten unerwünschten Ereignissen wurden die folgenden Ereignisse während der Anwendung von Penicillinen nach Markteinführung festgestellt. Da sie freiwillig aus einer Population unbekannter Größe gemeldet wurden, können keine Schätzungen zur Häufigkeit vorgenommen werden. Diese Ereignisse wurden aufgrund einer Kombination aus Schweregrad, Meldehäufigkeit oder potenziellem Kausalzusammenhang mit AMOXIL für die Aufnahme ausgewählt.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Probenecid
Probenecid verringert die renale tubuläre Sekretion von Amoxicillin. Die gleichzeitige Anwendung von Amoxicillin und Probenecid kann zu erhöhten und verlängerten Blutspiegeln von Amoxicillin führen.
Orale Antikoagulanzien
Bei Patienten, die Amoxicillin und orale Antikoagulanzien erhielten, wurde über eine abnormale Verlängerung der Prothrombinzeit (erhöhte international normalisierte Ratio [INR]) berichtet. Bei gleichzeitiger Verschreibung von Antikoagulanzien sollte eine angemessene Überwachung erfolgen. Anpassungen der Dosis von oralen Antikoagulanzien können erforderlich sein, um das gewünschte Niveau der Antikoagulation aufrechtzuerhalten.
Allopurinol
Die gleichzeitige Verabreichung von Allopurinol und Amoxicillin erhöht die Häufigkeit von Hautausschlägen bei Patienten, die beide Arzneimittel erhalten, im Vergleich zu Patienten, die Amoxicillin allein erhalten. Es ist nicht bekannt, ob diese Potenzierung von Amoxicillin-Ausschlägen auf Allopurinol oder die bei diesen Patienten vorhandene Hyperurikämie zurückzuführen ist.
Orale Kontrazeptiva
AMOXIL kann die Darmflora beeinträchtigen, was zu einer geringeren Östrogenreabsorption und einer verringerten Wirksamkeit kombinierter oraler Östrogen/Progesteron-Kontrazeptiva führt.

Andere Antibiotika
Chloramphenicol, Makrolide, Sulfonamide und Tetracycline können die bakterizide Wirkung von Penicillin beeinträchtigen. Dies wurde in vitro nachgewiesen; Die klinische Bedeutung dieser Wechselwirkung ist jedoch nicht gut dokumentiert.
Auswirkungen auf Labortests
Hohe Ampicillinkonzentrationen im Urin können zu falsch-positiven Reaktionen führen, wenn mit CLINITEST®, Benedict's Solution oder Fehling's Solution auf Glucose im Urin getestet wird. Da dieser Effekt auch unter Amoxicillin auftreten kann, wird empfohlen, Glukosetests auf Basis enzymatischer Glukoseoxidase-Reaktionen (z. B. CLINISTIX®) zu verwenden.
Nach der Verabreichung von Ampicillin oder Amoxicillin an schwangere Frauen wurde eine vorübergehende Abnahme der Plasmakonzentration von Gesamt-konjugiertem Estriol, Estriol-Glucuronid, konjugiertem Estron und Estradiol festgestellt.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Anaphylaktische Reaktionen
Schwerwiegende und gelegentlich tödliche Überempfindlichkeitsreaktionen (anaphylaktische Reaktionen) wurden bei Patienten unter Penicillin-Therapie, einschließlich Amoxicillin, berichtet. Obwohl eine Anaphylaxie nach einer parenteralen Therapie häufiger auftritt, ist sie bei Patienten aufgetreten, die orale Penicilline erhielten. Diese Reaktionen treten mit größerer Wahrscheinlichkeit bei Personen mit einer Vorgeschichte von Penicillin-Überempfindlichkeit und/oder einer Vorgeschichte von Empfindlichkeit gegenüber mehreren Allergenen auf. Es liegen Berichte über Personen mit bekannter Penicillin-Überempfindlichkeit vor, bei denen schwere Reaktionen auf die Behandlung mit Cephalosporinen aufgetreten sind. Vor Beginn der Therapie mit AMOXIL sollte sorgfältig nach früheren Überempfindlichkeitsreaktionen auf Penicilline, Cephalosporine oder andere Allergene gefragt werden.
Clostridium difficile assoziierter Durchfall
Clostridium difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln, einschließlich AMOXIL, berichtet und kann in ihrer Schwere von leichter Diarrhoe bis hin zu tödlicher Colitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficile führt.
C. difficile produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxin-produzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach der Anwendung von Antibiotika Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da über das Auftreten von CDAD über 2 Monate nach der Verabreichung von Antibiotika berichtet wurde.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende Anwendung von Antibiotika, die nicht gegen C. difficile gerichtet sind, möglicherweise eingestellt werden. Je nach klinischer Indikation sollte ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinergänzung, eine antibiotische Behandlung von C. difficile und eine chirurgische Untersuchung eingeleitet werden.
Entwicklung arzneimittelresistenter Bakterien
Es ist unwahrscheinlich, dass die Verschreibung von AMOXIL ohne nachgewiesene oder dringend vermutete bakterielle Infektion einen Nutzen für den Patienten bringt und das Risiko der Entwicklung arzneimittelresistenter Bakterien erhöht
Anwendung bei Patienten mit Mononukleose
Ein hoher Prozentsatz der Patienten mit Mononukleose, die Amoxicillin erhalten, entwickelt einen erythematösen Hautausschlag. Daher sollte Amoxicillin Patienten mit Mononukleose nicht verabreicht werden.
Phenylketonurika
Amoxil 250 mg Kautabletten enthalten Aspartam, das Phenylalanin enthält. Jede 200-mg-Kautablette enthält 1,82 mg Phenylalanin; Jede 400-mg-Kautablette enthält 3,64 mg Phenylalanin. Die oralen Suspensionen von Amoxil enthalten kein Phenylalanin und können von Phenylketonurikern verwendet werden.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es wurden keine Langzeitstudien an Tieren zur Bewertung des kanzerogenen Potenzials durchgeführt. Es wurden keine Studien zum Nachweis des mutagenen Potenzials von Amoxicillin allein durchgeführt; Die folgenden Informationen liegen jedoch aus Tests mit einer 4:1-Mischung aus Amoxicillin und Kaliumclavulanat (AUGMENTIN) vor. AUGMENTIN war im bakteriellen Ames-Mutationsassay und im Hefe-Genumwandlungsassay nicht mutagen. AUGMENTIN war im Maus-Lymphom-Assay schwach positiv, aber der Trend zu erhöhten Mutationshäufigkeiten in diesem Assay trat bei Dosen auf, die auch mit einem verringerten Überleben der Zellen verbunden waren. AUGMENTIN war im Maus-Mikrokerntest und im Dominant-Letal-Assay bei Mäusen negativ. Kaliumclavulanat allein wurde im Ames-Bakterienmutationstest und im Maus-Mikrokerntest getestet und war in jedem dieser Tests negativ. In einer Reproduktionsstudie über mehrere Generationen an Ratten wurden bei Dosen bis zu 500 mg/kg (etwa dem 2-Fachen der 3-g-Menschdosis, bezogen auf die Körperoberfläche) keine Beeinträchtigung der Fertilität oder andere nachteilige Wirkungen auf die Reproduktion beobachtet.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie B. Reproduktionsstudien wurden an Mäusen und Ratten mit Dosen bis zu 2000 mg/kg (das 3- und 6-fache der 3-g-Menschdosis, basierend auf der Körperoberfläche) durchgeführt. Es gab keine Hinweise auf eine Schädigung des Fötus durch Amoxicillin. Es gibt jedoch keine adäquaten und gut kontrollierten Studien bei Schwangeren. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte Amoxicillin während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Arbeit und Lieferung
Oral verabreichtes Ampicillin wird während der Geburt schlecht resorbiert. Es ist nicht bekannt, ob die Anwendung von Amoxicillin beim Menschen während der Wehen oder der Entbindung unmittelbare oder verzögerte Nebenwirkungen auf den Fötus hat, die Dauer der Wehen verlängert oder die Wahrscheinlichkeit der Notwendigkeit eines geburtshilflichen Eingriffs erhöht.
Stillende Mutter
Penicilline gehen nachweislich in die Muttermilch über. Die Anwendung von Amoxicillin durch stillende Mütter kann zu einer Sensibilisierung des Säuglings führen. Vorsicht ist geboten, wenn Amoxicillin einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Aufgrund der unvollständig entwickelten Nierenfunktion bei Neugeborenen und jungen Säuglingen kann die Elimination von Amoxicillin verzögert sein. Die Dosierung von AMOXIL 625 mg sollte bei pädiatrischen Patienten im Alter von 12 Wochen oder jünger (≤ 3 Monate) angepasst werden. [Sehen DOSIERUNG UND ANWENDUNG ]
Geriatrische Verwendung
Eine Analyse klinischer Studien mit AMOXIL 250 mg wurde durchgeführt, um festzustellen, ob Personen ab 65 Jahren anders auf die Behandlung ansprechen als jüngere Personen. Diese Analysen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Es ist bekannt, dass dieses Medikament im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko toxischer Reaktionen auf dieses Medikament kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da bei älteren Patienten mit größerer Wahrscheinlichkeit eine eingeschränkte Nierenfunktion vorliegt, sollte die Dosis sorgfältig ausgewählt werden, und es kann sinnvoll sein, die Nierenfunktion zu überwachen.
Dosierung bei eingeschränkter Nierenfunktion
Amoxicillin wird hauptsächlich über die Nieren ausgeschieden, und bei Patienten mit schwerer Nierenfunktionsstörung (GFR Dosierung bei eingeschränkter Nierenfunktion für spezifische Empfehlungen bei Patienten mit eingeschränkter Nierenfunktion.
ÜBERDOSIS
Im Falle einer Überdosierung die Medikation absetzen, symptomatisch behandeln und gegebenenfalls unterstützende Maßnahmen einleiten. Eine prospektive Studie an 51 pädiatrischen Patienten in einem Giftkontrollzentrum deutete darauf hin, dass Überdosierungen von weniger als 250 mg/kg Amoxicillin nicht mit signifikanten klinischen Symptomen verbunden sind.
Bei einer kleinen Anzahl von Patienten wurde nach Überdosierung mit Amoxicillin1 über interstitielle Nephritis berichtet, die zu oligurischem Nierenversagen führte.
Kristallurie, die in einigen Fällen zu Nierenversagen führte, wurde auch nach Amoxicillin-Überdosierung bei erwachsenen und pädiatrischen Patienten berichtet. Im Falle einer Überdosierung sollte eine ausreichende Flüssigkeitszufuhr und Diurese aufrechterhalten werden, um das Risiko einer Amoxicillin-Kristallurie zu verringern.
Die Nierenfunktionsstörung scheint nach Beendigung der Arzneimittelgabe reversibel zu sein. Hohe Blutspiegel können bei Patienten mit eingeschränkter Nierenfunktion aufgrund der verminderten renalen Clearance von Amoxicillin leichter auftreten. Amoxicillin kann durch Hämodialyse aus dem Kreislauf entfernt werden.
KONTRAINDIKATIONEN
AMOXIL 625 mg ist kontraindiziert bei Patienten, bei denen eine schwere Überempfindlichkeitsreaktion (z. B. Anaphylaxie oder Stevens-Johnson-Syndrom) auf AMOXIL oder andere β-Lactam-Antibiotika (z. B. Penicilline und Cephalosporine) aufgetreten ist.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Amoxicillin ist ein antibakterielles Medikament. [sehen Mikrobiologie ].
Pharmakokinetik
Absorption
Amoxicillin ist in Gegenwart von Magensäure stabil und wird nach oraler Verabreichung schnell resorbiert. Die Wirkung von Nahrung auf die Resorption von Amoxicillin aus den Tabletten und der Suspension von AMOXIL wurde teilweise untersucht; 400-mg- und 875-mg-Formulierungen wurden nur untersucht, wenn sie zu Beginn einer leichten Mahlzeit verabreicht wurden.
Oral verabreichte Dosen von 250 mg und 500 mg Amoxicillin-Kapseln führen 1 bis 2 Stunden nach der Verabreichung zu durchschnittlichen maximalen Blutspiegeln im Bereich von 3,5 µg/ml bis 5,0 µg/ml bzw. 5,5 µg/ml bis 7,5 µg/ml .
Mittlere pharmakokinetische Parameter von Amoxicillin aus einer offenen, zweiteiligen Crossover-Bioäquivalenzstudie mit Einzeldosis bei 27 Erwachsenen, in der 875 mg AMOXIL mit 875 mg AUGMENTIN® (Amoxicillin/Clavulanat-Kalium) verglichen wurden, zeigten, dass die 875-mg-Tablette mit AMOXIL 500 mg eine AUC0-∞ von 35,4 ± 8,1 µg•h/ml und eine Cmax von 13,8 ± 4,1 µg/ml. Die Dosierung erfolgte zu Beginn einer leichten Mahlzeit nach einem Fasten über Nacht.
Oral verabreichte Dosen der Amoxicillin-Suspension, 125 mg/5 ml und 250 mg/5 ml, führen 1 bis 2 Stunden nach der Verabreichung zu durchschnittlichen maximalen Blutspiegeln im Bereich von 1,5 µg/ml bis 3,0 µg/ml und 3,5 µg/ml bis 5,0 mcg/ml.
Die orale Gabe von Einzeldosen von 400 mg Kautabletten und 400 mg/5 ml Suspension von AMOXIL 625 mg an 24 erwachsene Probanden ergab vergleichbare pharmakokinetische Daten:
Verteilung
Amoxicillin diffundiert leicht in die meisten Körpergewebe und -flüssigkeiten, mit Ausnahme von Gehirn- und Rückenmarksflüssigkeit, außer wenn die Hirnhäute entzündet sind. Im Blutserum ist Amoxicillin zu etwa 20 % an Proteine gebunden. Nach einer 1-Gramm-Dosis und der Verwendung einer speziellen Hautfenstertechnik zur Bestimmung des Antibiotikumspiegels wurde festgestellt, dass therapeutische Spiegel in der interstitiellen Flüssigkeit gefunden wurden.
Stoffwechsel und Ausscheidung
Die Halbwertszeit von Amoxicillin beträgt 61,3 Minuten. Etwa 60 % einer oral verabreichten Amoxicillin-Dosis werden innerhalb von 6 bis 8 Stunden mit dem Urin ausgeschieden. Nachweisbare Serumspiegel werden bis zu 8 Stunden nach einer oral verabreichten Amoxicillin-Dosis beobachtet. Da der Großteil des Amoxicillins unverändert im Urin ausgeschieden wird, kann seine Ausscheidung durch gleichzeitige Gabe von Probenecid verzögert werden [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Mikrobiologie
Wirkmechanismus
Amoxicillin ähnelt Penicillin in seiner bakteriziden Wirkung gegen empfindliche Bakterien während des Stadiums der aktiven Vermehrung. Es wirkt durch die Hemmung der Zellwandbiosynthese, die zum Absterben der Bakterien führt.
Widerstandsmechanismus
Die Resistenz gegen Amoxicillin wird hauptsächlich durch Enzyme vermittelt, die als Beta-Lactamasen bezeichnet werden und den Beta-Lactam-Ring von Amoxicillin spalten, wodurch es inaktiv wird.
Amoxicillin hat sich als wirksam gegen die meisten Isolate der unten aufgeführten Bakterien erwiesen, sowohl in vitro als auch bei klinischen Infektionen, wie in beschrieben INDIKATIONEN UND VERWENDUNG Sektion.
Gram-positive Bakterien
Enterococcus faecalis Staphylococcus spp. Streptococcus pneumoniae Streptococcus spp. (alpha- und beta-hämolytisch)
Gramnegative Bakterien
Escherichia coli Haemophilus influenzae Helicobacter pylori Proteus mirabilis
Empfindlichkeitstestmethoden
Wenn verfügbar, sollte das Labor für klinische Mikrobiologie dem Arzt kumulative In-vitro-Empfindlichkeitstestergebnisse für antimikrobielle Arzneimittel, die in örtlichen Krankenhäusern und Praxisbereichen verwendet werden, als regelmäßige Berichte zur Verfügung stellen, die das Empfindlichkeitsprofil von nosokomialen und ambulant erworbenen Krankheitserregern beschreiben. Diese Berichte sollen dem Arzt bei der Auswahl des wirksamsten antimikrobiellen Mittels helfen.
Verdünnungstechniken: Zur Bestimmung der minimalen Hemmkonzentrationen (MHK) von antimikrobiellen Mitteln werden quantitative Methoden verwendet. Diese MICs liefern Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die MICs sollten mit einer standardisierten Testmethode bestimmt werden (Brühe oder Agar)2,4. Die MHK-Werte sollten gemäß den Kriterien in Tabelle 4 interpretiert werden.
Diffusionstechniken: Quantitative Methoden, die die Messung von Zonendurchmessern erfordern, können auch reproduzierbare Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen liefern3,4. Die Zonengröße sollte mit einem genormten Prüfverfahren3 bestimmt werden.
Auf Amoxicillin-Empfindlichkeit von Enterococcus spp., Enterobacteriaceae und H. influenzae kann durch Testen von Ampicillin geschlossen werden4. Auf Amoxicillin-Empfindlichkeit von Staphylococcus spp. und beta-hämolysierendem Streptococcus spp. kann durch Testen von Penicillin4 geschlossen werden. Die Mehrzahl der Isolate von Enterococcus spp. die gegen Ampicillin oder Amoxicillin resistent sind, produzieren eine Beta-Lactamase vom TEM-Typ. Ein Beta-Lactamase-Test kann ein schnelles Mittel zur Bestimmung der Resistenz gegen Ampicillin und Amoxicillin4 sein.
Auf Amoxicillin-Empfindlichkeit von Streptococcus pneumoniae (Nicht-Meningitis-Isolate) kann durch Tests auf Penicillin oder Oxacillin geschlossen werden4. Die Interpretationskriterien für S. pneumoniae gegenüber Amoxicillin sind in Tabelle 44 aufgeführt.
Ein Bericht „anfällig“ weist darauf hin, dass das antimikrobielle Mittel wahrscheinlich das Wachstum des Krankheitserregers hemmt, wenn die antimikrobielle Verbindung an der Infektionsstelle eine Konzentration erreicht, die erforderlich ist, um das Wachstum des Krankheitserregers zu hemmen. Ein Bericht mit „Zwischenergebnis“ weist darauf hin, dass das Ergebnis als zweideutig betrachtet werden sollte und der Test wiederholt werden sollte, wenn der Mikroorganismus nicht vollständig empfindlich gegenüber alternativen, klinisch geeigneten Arzneimitteln ist. Diese Kategorie impliziert eine mögliche klinische Anwendbarkeit an Körperstellen, wo das Arzneimittel physiologisch konzentriert ist. Diese Kategorie bietet auch eine Pufferzone, die verhindert, dass kleine unkontrollierte technische Faktoren größere Diskrepanzen bei der Interpretation verursachen. Ein Bericht „resistent“ weist darauf hin, dass das antimikrobielle Mittel das Wachstum des Pathogens wahrscheinlich nicht hemmt, wenn die antimikrobielle Verbindung die Konzentration erreicht, die normalerweise an der Infektionsstelle erreichbar ist; andere Therapie gewählt werden.
Empfindlichkeitstest für Helicobacter Pylori
In-vitro-Empfindlichkeitstestmethoden für Amoxicillin zur Bestimmung der minimalen Hemmkonzentrationen (MHK) und Zonengrößen wurden für Tests auf H. pylori nicht standardisiert, validiert oder zugelassen. Proben für H. pylori- und Clarithromycin-Empfindlichkeitstestergebnisse sollten von Isolaten von Patienten erhalten werden, bei denen die Dreifachtherapie versagt hat. Wenn eine Clarithromycin-Resistenz festgestellt wird, sollte ein Regime ohne Clarithromycin angewendet werden.
Qualitätskontrolle
Standardisierte Empfindlichkeitstestverfahren2,3,4 erfordern die Verwendung von Laborkontrollen, um die Genauigkeit und Präzision der im Assay verwendeten Materialien und Reagenzien sowie die Techniken der Personen, die die Testkontrolle durchführen, zu überwachen und sicherzustellen. Standard-Amoxicillin-Pulver sollte den folgenden Bereich von MHK-Werten aufweisen, die in Tabelle 54 angegeben sind. Für die Diffusionstechnik sollten die in Tabelle 5 angegebenen Kriterien erreicht werden.
Klinische Studien
H. pylori-Eradikation zur Verringerung des Risikos eines erneuten Auftretens von Zwölffingerdarmgeschwüren
Randomisierte, doppelblinde klinische Studien, die in den Vereinigten Staaten bei Patienten mit H. pylori und Zwölffingerdarmgeschwüren (definiert als aktives Geschwür oder Geschwüre in der Anamnese innerhalb eines Jahres) durchgeführt wurden, untersuchten die Wirksamkeit von Lansoprazol in Kombination mit Amoxicillin-Kapseln und Clarithromycin-Tabletten als dreifache 14-tägige Therapie oder in Kombination mit Amoxicillin-Kapseln als zweifache 14-tägige Therapie zur Eradikation von H. pylori. Basierend auf den Ergebnissen dieser Studien wurden die Sicherheit und Wirksamkeit von 2 verschiedenen Eradikationsschemata festgestellt: Dreifachtherapie: Amoxicillin 1 Gramm zweimal täglich/Clarithromycin 500 mg zweimal täglich/Lansoprazol 30 mg zweimal täglich (siehe Tabelle 6). Doppeltherapie: Amoxicillin 1 Gramm dreimal täglich/Lansoprazol 30 mg dreimal täglich (siehe Tabelle 7. Alle Behandlungen dauerten 14 Tage. H. pylori-Eradikation wurde definiert als 2 negative Tests (Kultur und Histologie) 4 bis 6 Wochen nach der Ende der Behandlung Die Dreifachtherapie erwies sich als wirksamer als alle möglichen Zweifachtherapiekombinationen Die Zweifachtherapie erwies sich als wirksamer als beide Monotherapien Die Eradikation von H. pylori verringerte nachweislich das Risiko eines erneuten Auftretens von Zwölffingerdarmgeschwüren.
VERWEISE
1. Swanson-Biearman B, Dean BS, Lopez G, Krenzelok EP. Die Auswirkungen der Einnahme von Penicillin und Cephalosporin bei Kindern unter sechs Jahren. Tierarzt Hum Toxicol. 1988; 30: 66-67.
2. Institut für klinische und Laborstandards (CLSI). Methoden zur Verdünnung Antimikrobielle Empfindlichkeitstests für Bakterien, die aerob wachsen; Genehmigter Standard – Zehnte Ausgabe. CLSI-Dokument M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
3. Clinical and Laboratory Standards Institute (CLSI). Leistungsstandards für antimikrobielle Disk-Diffusions-Empfindlichkeitstests; Genehmigter Standard – Zwölfte Ausgabe. CLSI-Dokument M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
4. Institut für klinische und Laborstandards (CLSI). Leistungsstandards für antimikrobielle Empfindlichkeitstests; Fünfundzwanzigste Informationsergänzung, CLSI-Dokument M100-S25. CLSI-Dokument M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.