Vantin 200mg, 100mg Cefpodoxime Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Vantin 100 mg und wie wird es angewendet?
Vantin 100 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome verschiedener bakterieller Infektionen wie Bronchitis, Lungenentzündung, Sinusitis, Pharyngitis, Mandelentzündung, Harnwegsinfektionen, Hautinfektionen und Tripper. Vantin 200 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Vantin gehört zu einer Klasse von Arzneimitteln namens Caphalosporine, 3. Generation.
Es ist nicht bekannt, ob Vantin bei Kindern unter 2 Monaten sicher und wirksam ist.
Welche Nebenwirkungen kann Vantin 200mg haben?
Vantin kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Vantin gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Vantin. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von VANTIN 100 mg und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte VANTIN 100 mg nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf Bakterien zurückzuführen sind.
BEZEICHNUNG
Cefpodoxim-Proxetil ist ein oral verabreichtes, halbsynthetisches Antibiotikum mit erweitertem Wirkungsspektrum aus der Klasse der Cephalosporine. Der chemische Name ist (RS)-1(Isopropoxycarbonyloxy)ethyl (+)-(6R,7R)-7-[2-(2-amino-4-thiazolyl)-2-{(Z)methoxyimino}acetamido]-3 -Methoxymethyl-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-en-2-carboxylat. Seine empirische Formel ist C21H27N5O9S2 und seine Strukturformel ist unten dargestellt:
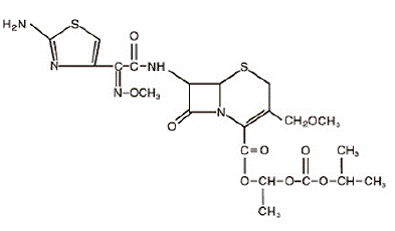
Das Molekulargewicht von Cefpodoximproxetil beträgt 557,6.
Cefpodoxim-Proxetil ist ein Prodrug; Sein aktiver Metabolit ist Cefpodoxim. Alle Cefpodoxim-Proxetil-Dosen in dieser Packungsbeilage sind als aktive Cefpodoxim-Einheit ausgedrückt. Das Arzneimittel wird sowohl als Filmtabletten als auch als aromatisiertes Granulat zur oralen Suspension geliefert.
VANTIN Tabletten enthalten Cefpodoxim-Proxetil entsprechend 100 mg oder 200 mg Cefpodoxim-Aktivität und die folgenden inaktiven Bestandteile: Carboxymethylcellulose-Calcium, Carnaubawachs, FD&C Yellow No. 6, Hydroxypropylcellulose, Hypromellose, Lactose, Magnesiumstearat, Propylenglykol, Natriumlaurylsulfat und Titandioxid. Zusätzlich enthalten die 100-mg-Filmtabletten D&C Yellow Nr. 10 und die 200-mg-Filmtabletten FD&C Red Nr. 40.
Jede 5 ml VANTIN Suspension zum Einnehmen enthält Cefpodoxim-Proxetil entsprechend 50 mg oder 100 mg Cefpodoxim-Aktivität nach Zubereitung und die folgenden inaktiven Bestandteile: künstliche Aromen, butyliertes Hydroxyanisol (BHA), Carboxymethylcellulose-Natrium, mikrokristalline Cellulose, Carrageenan, Zitronensäure, kolloidal Siliziumdioxid, Croscarmellose-Natrium, Hydroxypropylcellulose, Lactose, Maltodextrin, natürliche Aromastoffe, Propylenglykolalginat, Natriumcitrat, Natriumbenzoat, Stärke, Saccharose und Pflanzenöl.
INDIKATIONEN
Cefpodoximproxetil ist indiziert zur Behandlung von Patienten mit leichten bis mittelschweren Infektionen, die durch empfindliche Stämme der bezeichneten Mikroorganismen unter den unten aufgeführten Erkrankungen verursacht werden.
Empfohlene Dosierungen, Therapiedauer und anwendbare Patientenpopulationen variieren bei diesen Infektionen. Siehe DOSIERUNG UND VERABREICHUNG für spezifische Empfehlungen. Akute Otitis media verursacht durch Streptococcus pneumoniae (mit Ausnahme von Penicillin-resistenten Stämmen), Streptococcus pyogenes, Haemophilus influenzae (einschließlich Beta-Lactamase-produzierende Stämme) oder Moraxella (Branhamella) catarrhalis (einschließlich Beta-Lactamase-produzierende Stämme).
Pharyngitis und/oder Mandelentzündung, verursacht durch Streptococcus pyogenes.
HINWEIS: Es hat sich gezeigt, dass nur Penicillin bei intramuskulärer Verabreichung zur Prophylaxe von rheumatischem Fieber wirksam ist. Cefpodoximproxetil ist im Allgemeinen wirksam bei der Eradikation von Streptokokken aus dem Oropharynx. Es liegen jedoch keine Daten vor, die die Wirksamkeit von Cefpodoxim-Proxetil zur Prophylaxe eines nachfolgenden rheumatischen Fiebers belegen.
Ambulant erworbene Lungenentzündung verursacht durch S. pneumoniae oder H. Influenzae (einschließlich beta-Lactamase-produzierender Stämme).
Akute bakterielle Exazerbation einer chronischen Bronchitis verursacht durch S. pneumoniae, H. influenzae (nur Stämme, die keine Betalactamase produzieren) oder M. catarrhalis. Derzeit sind die Daten nicht ausreichend, um die Wirksamkeit bei Patienten mit akuter bakterieller Exazerbation einer chronischen Bronchitis, die durch beta-Lactamase-produzierende Stämme von H. influenzae verursacht wird, nachzuweisen.
Akute, unkomplizierte urethrale und zervikale Gonorrhoe verursacht durch Neisseria gonorrhoeae (einschließlich penicillinaseproduzierender Stämme).
Akute, unkomplizierte anorektale Infektionen bei Frauen aufgrund von Neisseria gonorrhoeae (einschließlich penicillinaseproduzierender Stämme).
HINWEIS: Die Wirksamkeit von Cefpodoxim bei der Behandlung männlicher Patienten mit durch N. gonorrhoeae verursachten rektalen Infektionen wurde nicht nachgewiesen. Die Daten unterstützen nicht die Anwendung von Cefpodoxim-Proxetil bei der Behandlung von Racheninfektionen aufgrund von N. gonorrhoeae bei Männern oder Frauen.
Unkomplizierte Haut- und Hautstrukturinfektionen verursacht durch Staphylococcus aureus (einschließlich Penicillinase-produzierender Stämme) oder Streptococcus pyogenes. Abszesse sollten nach klinischer Indikation chirurgisch drainiert werden.
HINWEIS: In klinischen Studien war die erfolgreiche Behandlung von unkomplizierten Haut- und Hautstrukturinfektionen dosisabhängig. Die wirksame therapeutische Dosis bei Hautinfektionen war höher als bei anderen empfohlenen Indikationen. (Sehen DOSIERUNG UND ANWENDUNG .)
Akute Kieferhöhlenentzündung verursacht durch Haemophilus influenzae (einschließlich beta-Lactamase-produzierender Stämme), Streptococcus pneumoniae und Moraxella catarrhalis.
Unkomplizierte Harnwegsinfektionen (Zystitis) verursacht durch Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis oder Staphylococcus saprophyticus.
HINWEIS: Bei der Erwägung der Anwendung von Cefpodoxim-Proxetil zur Behandlung von Zystitis sollten die niedrigeren bakteriellen Eradikationsraten von Cefpodoxim-Proxetil gegen die erhöhten Eradikationsraten und unterschiedlichen Sicherheitsprofile einiger anderer zugelassener Wirkstoffklassen abgewogen werden. (Sehen Klinische Studien Sektion.)
Es sollten geeignete Proben für eine bakteriologische Untersuchung entnommen werden, um verursachende Organismen zu isolieren und zu identifizieren und ihre Empfindlichkeit gegenüber Cefpodoxim zu bestimmen. Die Therapie kann eingeleitet werden, während die Ergebnisse dieser Studien abgewartet werden. Sobald diese Ergebnisse vorliegen, sollte die antimikrobielle Therapie entsprechend angepasst werden.
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von VANTIN 100 mg und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte VANTIN 200 mg nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf empfindliche Bakterien zurückzuführen sind. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
DOSIERUNG UND ANWENDUNG
(Sehen INDIKATIONEN UND VERWENDUNG für indizierte Krankheitserreger.)
Filmtabletten
VANTIN Tabletten sollten oral mit Nahrung eingenommen werden, um die Resorption zu verbessern. (Sehen KLINISCHE PHARMAKOLOGIE .)
Die empfohlenen Dosierungen, Behandlungsdauern und anwendbaren Patientengruppen sind in der folgenden Tabelle beschrieben:
Erwachsene und Jugendliche (ab 12 Jahren)
Granulat zur oralen Suspension
VANTIN Suspension zum Einnehmen kann unabhängig von Nahrung verabreicht werden. Die empfohlenen Dosierungen, Behandlungsdauern und anwendbaren Patientenpopulationen sind in der folgenden Tabelle beschrieben:
Erwachsene und Jugendliche (ab 12 Jahren)
Säuglinge und pädiatrische Patienten (Alter 2 Monate bis 12 Jahre)
Patienten mit Nierenfunktionsstörung
Bei Patienten mit schwerer Nierenfunktionsstörung (
Wenn nur der Serum-Kreatininspiegel verfügbar ist, kann die folgende Formel (basierend auf Geschlecht, Gewicht und Alter des Patienten) verwendet werden, um die Kreatinin-Clearance (ml/min) abzuschätzen. Damit diese Schätzung gültig ist, sollte der Serumkreatininspiegel einen stabilen Zustand der Nierenfunktion darstellen.
Männer (ml/min): Gewicht (kg) x (140 - Alter)/ 72 x Serumkreatinin (mg/100 ml)
Frauen (ml/min) : 0,85 x über dem Wert
Patienten mit Zirrhose
Die Pharmakokinetik von Cefpodoxim bei Zirrhosepatienten (mit oder ohne Aszites) ist ähnlich wie bei gesunden Probanden. Eine Dosisanpassung ist bei dieser Patientengruppe nicht erforderlich.
Vorbereitung der Suspension
Verfassungsanweisungen für die mündliche Suspendierung
Nach dem Mischen sollte die Suspension im Kühlschrank bei 2 °C bis 8 °C (36 °F bis 46 °F) gelagert werden. Vor Gebrauch gut schütteln. Behälter dicht geschlossen halten. Die Mischung kann 14 Tage verwendet werden. Verwerfen Sie nicht verwendete Portionen nach 14 Tagen.
WIE GELIEFERT
VANTIN-Tabletten sind in den folgenden Stärken (Cefpodoxim-Äquivalent), Farben und Größen erhältlich:
100 mg (hellorange, elliptisch, geprägt mit U3617)
Flaschen zu 20 NDC 0009-3617-01 Flaschen zu 100 NDC 0009-3617-02 Einzeldosispackungen mit 100 Stück NDC 0009-3617-03
200 mg (korallenrot, elliptisch, geprägt mit U3618)
Flaschen zu 20 NDC 0009-3618-01 Flaschen zu 100 NDC 0009-3618-02
200 mg (korallenrot, elliptisch, geprägt mit U3618)
Einheitsdosispackungen mit 100 NDC 0009-3618-03
Tabletten bei kontrollierter Raumtemperatur von 20° bis 25°C (68° bis 77°F) lagern [siehe USP ].
Setzen Sie die Kappe nach jedem Öffnen fest auf. Einzeldosispackungen vor übermäßiger Feuchtigkeit schützen.
VANTIN 200 mg Suspension zum Einnehmen liefert das Äquivalent von 50 mg oder 100 mg Cefpodoxim pro 5 ml Suspension (bei bestimmungsgemäßer Zusammensetzung) und ist in Zitronen-Creme-Geschmack in den folgenden Größen erhältlich:
50 mg/5 ml
100-ml-Suspension NDC 0009-3531-01 75-ml-Suspension NDC 0009-3531-02 50-ml-Suspension NDC 0009-3531-03
100 mg/5 ml
100-ml-Suspension NDC 0009-3615-01 75-ml-Suspension NDC 0009-3615-02 50-ml-Suspension NDC 0009-3615-03
Unsuspendiertes Granulat bei kontrollierter Raumtemperatur von 20° bis 25°C (68° bis 77°F) lagern [siehe USP ].
Anweisungen zum Mischen sind auf dem Etikett enthalten. Nach dem Mischen sollte die Suspension im Kühlschrank bei 2 °C bis 8 °C (36 °F bis 46 °F) gelagert werden. Vor Gebrauch gut schütteln. Behälter dicht geschlossen halten. Die Mischung kann 14 Tage verwendet werden. Verwerfen Sie nicht verwendete Portionen nach 14 Tagen.
Vertrieb durch: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. Überarbeitet: August 2016
NEBENWIRKUNGEN
Klinische Versuche
Filmtabletten (Mehrfachdosis)
In klinischen Studien mit mehrere Dosen von Cefpodoxim-Proxetil-Filmtabletten wurden 4696 Patienten mit den empfohlenen Dosierungen von Cefpodoxim (100 bis 400 mg alle 12 Stunden) behandelt. Es gab keine Todesfälle oder dauerhaften Behinderungen, die im Zusammenhang mit der Arzneimitteltoxizität vermutet wurden. Einhundertneunundzwanzig (2,7 %) Patienten brachen die Medikation aufgrund von Nebenwirkungen ab, von denen angenommen wurde, dass sie möglicherweise oder wahrscheinlich mit der Arzneimitteltoxizität zusammenhängen. Dreiundneunzig (52 %) der 178 Patienten, die die Therapie abbrachen (unabhängig davon, ob ein Zusammenhang mit der Arzneimitteltherapie vermutet wurde oder nicht), taten dies aufgrund von gastrointestinalen Störungen, Übelkeit, Erbrechen oder Durchfall. Der Prozentsatz der mit Cefpodoxim-Proxetil behandelten Patienten, die das Studienmedikament aufgrund von Nebenwirkungen abbrachen, war bei einer Dosis von 800 mg täglich signifikant größer als bei einer Dosis von 400 mg täglich oder bei einer Dosis von 200 mg täglich. Nebenwirkungen, von denen angenommen wurde, dass sie in klinischen Mehrfachdosis-Studien (n = 4696 mit Cefpodoxim behandelte Patienten) möglicherweise oder wahrscheinlich mit Cefpodoxim in Zusammenhang stehen, waren:
Inzidenz größer als 1 %
Durchfall 7,0 %
Durchfall oder weicher Stuhl waren dosisabhängig: Abnahme von 10,4 % der Patienten, die 800 mg pro Tag erhielten, auf 5,7 % der Patienten, die 200 mg pro Tag erhielten. 10 % der Patienten mit Durchfall hatten C. difficile-Organismen oder -Toxine im Stuhl. (Sehen WARNUNGEN .)
Übelkeit 3,3 % Vaginale Pilzinfektionen 1,0 % Vulvovaginale Infektionen 1,3 % Bauchschmerzen 1,2 % Kopfschmerzen 1,0 %
Inzidenz weniger als 1 %
Nach Körpersystem in absteigender Reihenfolge
Klinische Studien
Nebenwirkungen, die möglicherweise oder wahrscheinlich mit Cefpodoxim Proxetil zusammenhängen und bei weniger als 1 % der Patienten auftraten (n = 4696)
Körper - Pilzinfektionen, aufgeblähter Bauch, Unwohlsein, Müdigkeit, Asthenie, Fieber, Brustschmerzen, Rückenschmerzen, Schüttelfrost, allgemeine Schmerzen, anormale mikrobiologische Tests, Moniliasis, Abszess, allergische Reaktion, Gesichtsödem, bakterielle Infektionen, parasitäre Infektionen, lokalisierte Ödeme, lokalisierte Schmerzen .
Herz-Kreislauf - Herzinsuffizienz, Migräne, Herzklopfen, Vasodilatation, Hämatom, Bluthochdruck, Hypotonie.
Verdauungs- Erbrechen, Dyspepsie, Mundtrockenheit, Blähungen, verminderter Appetit, Verstopfung, orale Moniliasis, Anorexie, Aufstoßen, Gastritis, Geschwüre im Mund, Magen-Darm-Beschwerden, Rektumbeschwerden, Zungenbeschwerden, Zahnbeschwerden, vermehrter Durst, orale Läsionen, Tenesmus, trockener Hals, Zahnschmerzen .
Hämisch und lymphatisch - Anämie.
Stoffwechsel und Ernährung - Dehydration, Gicht, periphere Ödeme, Gewichtszunahme.
Muskel-Skelett - Myalgie.
Nervös - Schwindel, Schlaflosigkeit, Somnolenz, Angstzustände, Zittern, Nervosität, Hirninfarkt, Traumveränderungen, Konzentrationsstörungen, Verwirrtheit, Alpträume, Parästhesien, Schwindel.
Atmung - Asthma, Husten, Epistaxis, Rhinitis, Keuchen, Bronchitis, Dyspnoe, Pleuraerguss, Lungenentzündung, Sinusitis.
Haut - Urtikaria, Hautausschlag, Juckreiz an der Nicht-Auftragungsstelle, Schwitzen, Makulopapulöser Ausschlag, Pilzdermatitis, Schuppung, Trockene Haut an der Nicht-Auftragungsstelle, Haarausfall, vesikulobullöser Ausschlag, Sonnenbrand.
Besondere Sinne - Geschmacksveränderungen, Augenreizung, Geschmacksverlust, Tinnitus.
Urogenital - Hämaturie, Harnwegsinfektionen, Metrorrhagie, Dysurie, häufiges Wasserlassen, Nykturie, Penisinfektion, Proteinurie, vaginale Schmerzen.
Granulat zur oralen Suspension (Mehrfachdosis)
In klinischen Studien mit Mehrfachdosen von Cefpodoxim-Proxetil-Granulat zur Herstellung einer Suspension zum Einnehmen wurden 2128 pädiatrische Patienten (93 % davon jünger als 12 Jahre) mit den empfohlenen Dosierungen von Cefpodoxim (10 mg/kg/Tag alle 24 Stunden oder aufgeteilt) behandelt Q 12 Stunden bis zu einer maximalen äquivalenten Erwachsenendosis). Bei keinem der Patienten in diesen Studien traten Todesfälle oder dauerhafte Behinderungen auf. Vierundzwanzig Patienten (1,1 %) brachen die Medikation aufgrund von Nebenwirkungen ab, von denen angenommen wurde, dass sie möglicherweise oder wahrscheinlich mit dem Studienmedikament zusammenhängen. Diese Unterbrechungen erfolgten in erster Linie wegen gastrointestinaler Störungen, in der Regel Durchfall, Erbrechen oder Hautausschläge.
Nebenwirkungen, die in klinischen Mehrfachdosis-Studien (N = 2128 mit Cefpodoxim behandelte Patienten) für einen möglichen oder wahrscheinlichen Zusammenhang mit Cefpodoxim-Proxetil oder einen unbekannten Zusammenhang mit Cefpodoxim-Proxetil zur oralen Suspension gehalten wurden, waren:
Inzidenz größer als 1 %
Durchfall 6,0 % Die Inzidenz von Durchfall bei Säuglingen und Kleinkindern (im Alter von 1 Monat bis 2 Jahren) betrug 12,8 %. Windelausschlag/Pilzhautausschlag 2,0 % (einschließlich Moniliasis) Die Inzidenz von Windelausschlag bei Säuglingen und Kleinkindern betrug 8,5 %. Andere Hautausschläge 1,8 % Erbrechen 2,3 %
Inzidenz weniger als 1 %
Körper: Lokalisierte Bauchschmerzen, Bauchkrämpfe, Kopfschmerzen, Monilia, generalisierte Bauchschmerzen, Asthenie, Fieber, Pilzinfektion.
Verdauungs: Übelkeit, Monilia, Anorexie, Mundtrockenheit, Stomatitis, pseudomembranöse Kolitis.
Hämisch & lymphatisch: Thrombozythämie, positiver direkter Coombs-Test, Eosinophilie, Leukozytose, Leukopenie, verlängerte partielle Thromboplastinzeit, thrombozytopenische Purpura.
Stoffwechsel & Ernährung: Erhöhter SGPT.
Muskel-Skelett: Myalgie.
Nervös: Halluzination, Hyperkinesie, Nervosität, Schläfrigkeit.
Atmung: Epistaxis, Rhinitis.

Haut: Moniliasis der Haut, Urtikaria, Pilzdermatitis, Akne, exfoliative Dermatitis, makulopapulöser Ausschlag.
Besondere Sinne: Probieren Sie Perversion.
Filmtabletten (Einzeldosis)
In klinischen Studien mit a Einzelne Dosis von Cefpodoxim-Proxetil-Filmtabletten wurden 509 Patienten mit der empfohlenen Dosierung von Cefpodoxim (200 mg) behandelt. In diesen Studien gab es keine Todesfälle oder dauerhaften Behinderungen, die im Zusammenhang mit der Arzneimitteltoxizität vermutet wurden.
Nebenwirkungen, von denen angenommen wurde, dass sie möglicherweise oder wahrscheinlich mit Cefpodoxim in Zusammenhang stehen, waren in klinischen Einzeldosisstudien, die in den Vereinigten Staaten durchgeführt wurden:
Inzidenz größer als 1 %
Übelkeit 1,4 % Durchfall 1,2 %
Inzidenz weniger als 1 %
Zentralnervensystem: Schwindel, Kopfschmerzen, Synkope. Dermatologisch: Hautausschlag. Genital: Vaginitis. Magen-Darm: Bauchschmerzen. Psychiatrie: Angst.
Änderungen im Labor
Signifikante Veränderungen der Laborwerte, die bei erwachsenen und pädiatrischen Patienten in klinischen Studien mit Cefpodoxim-Proxetil ohne Berücksichtigung der Arzneimittelbeziehung berichtet wurden, waren:
Leber: Vorübergehender Anstieg von AST (SGOT), ALT (SGPT), GGT, alkalischer Phosphatase, Bilirubin und LDH.
Hämatologisch: Eosinophilie, Leukozytose, Lymphozytose, Granulozytose, Basophilie, Monozytose, Thrombozytose, verringertes Hämoglobin, verringerter Hämatokrit, Leukopenie, Neutropenie, Lymphozytopenie, Thrombozytopenie, Thrombozythämie, positiver Coombs-Test und verlängerte PT und PTT.
Serumchemie: Hyperglykämie, Hypoglykämie, Hypoalbuminämie, Hypoproteinämie, Hyperkaliämie und Hyponatriämie.
Nieren: Erhöhungen von BUN und Kreatinin.
Die meisten dieser Anomalien waren vorübergehend und nicht klinisch signifikant.
Post-Marketing-Erfahrung
Die folgenden schwerwiegenden Nebenwirkungen wurden berichtet: allergische Reaktionen einschließlich Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, Erythema multiforme und Reaktionen ähnlich der Serumkrankheit, pseudomembranöse Kolitis, blutiger Durchfall mit Bauchschmerzen, Colitis ulcerosa, Rektorrhagie mit Hypotonie, anaphylaktischer Schock, akut Leberschädigung, In-utero-Exposition mit Fehlgeburt, Purpurnephritis, Lungeninfiltrat mit Eosinophilie und Augenliddermatitis.
Ein Todesfall wurde einer pseudomembranösen Kolitis und einer disseminierten intravaskulären Gerinnung zugeschrieben.
Cephalosporin-Klassenkennzeichnung
Zusätzlich zu den oben aufgeführten Nebenwirkungen, die bei Patienten beobachtet wurden, die mit Cefpodoxim-Proxetil behandelt wurden, wurden die folgenden Nebenwirkungen und veränderten Labortests für Antibiotika der Cephalosporin-Klasse berichtet:
Nebenwirkungen und anormale Labortests: Nierenfunktionsstörung, toxische Nephropathie, Leberfunktionsstörung einschließlich Cholestase, aplastische Anämie, hämolytische Anämie, Serumkrankheit-ähnliche Reaktion, Blutung, Agranulozytose und Panzytopenie.
Mehrere Cephalosporine wurden mit der Auslösung von Krampfanfällen in Verbindung gebracht, insbesondere bei Patienten mit eingeschränkter Nierenfunktion, wenn die Dosis nicht reduziert wurde. (Sehen DOSIERUNG UND ANWENDUNG und ÜBERDOSIERUNG .) Wenn Anfälle im Zusammenhang mit einer medikamentösen Therapie auftreten, sollte das Medikament abgesetzt werden. Bei klinischer Indikation kann eine antikonvulsive Therapie gegeben werden.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Antazida
Die gleichzeitige Verabreichung hoher Dosen von Antazida (Natriumbicarbonat und Aluminiumhydroxid) oder H2-Blockern reduziert die Spitzenplasmaspiegel um 24 % bis 42 % bzw. das Ausmaß der Resorption um 27 % bis 32 %. Die Resorptionsrate wird durch diese Begleitmedikation nicht verändert. Orale Anticholinergika (z. B. Propanthelin) verzögern die maximalen Plasmaspiegel (47 % Anstieg von Tmax), beeinflussen aber nicht das Ausmaß der Resorption (AUC).
Probenecid
Wie bei anderen Beta-Lactam-Antibiotika wurde die renale Ausscheidung von Cefpodoxim durch Probenecid gehemmt und führte zu einem etwa 31 %igen Anstieg der AUC und einem 20 %igen Anstieg der maximalen Cefpodoxim-Plasmaspiegel.
Nephrotoxische Medikamente
Obwohl bei alleiniger Gabe von Cefpodoximproxetil keine Nephrotoxizität festgestellt wurde, wird eine engmaschige Überwachung der Nierenfunktion empfohlen, wenn Cefpodoximproxetil gleichzeitig mit Verbindungen mit bekanntem nephrotoxischem Potenzial verabreicht wird.
Arzneimittel-/Labortest-Wechselwirkungen
Es ist bekannt, dass Cephalosporine, einschließlich Cefpodoxim-Proxetil, gelegentlich einen positiven direkten Coombs-Test hervorrufen.
WARNUNGEN
BEVOR EINE THERAPIE MIT CEFPODOXIM PROXETIL EINGELEITET WIRD, SOLLTE SORGFÄLTIG ABGEFRAGT WERDEN, UM ZU BESTIMMEN, OB DER PATIENT FRÜHERE ÜBERSENSIBILITÄTSREAKTIONEN GEGEN CEFPODOXIM, ANDERE CEPHALOSPORINE, PENICILLINE ODER ANDERE ARZNEIMITTEL HAT. WENN CEFPODOXIM AN PENICILLIN-EMPFINDLICHE PATIENTEN VERABREICHT WERDEN SOLLTE, SOLLTE VORSICHT GEGEBEN WERDEN, DA EINE KREUZÜBERSENSIBILITÄT BEI BETA-LACTAM-ANTIBIOTIKA EINDEUTIG DOKUMENTIERT WURDE UND BEI BIS ZU 10 % DER PATIENTEN MIT EINER VORGESCHICHTENEN PENICILLIN-ALLERGIE AUFTRETEN KANN. WENN EINE ALLERGISCHE REAKTION AUF CEFPODOXIM PROXETIL AUFTRITT, STELLEN SIE DAS ARZNEIMITTEL AB. SCHWERE AKUTE ÜBERSENSIBILITÄTSREAKTIONEN KÖNNEN EINE BEHANDLUNG MIT Epinephrin UND ANDERE NOTFALLMASSNAHMEN, EINSCHLIESSLICH SAUERSTOFF, INTRAVENÖSE FLÜSSIGKEITEN, INTRAVENÖSE ANTIHISTAMINE UND ATEMWEGSMANAGEMENT ERFORDERLICH MACHEN, WIE KLINISCH INDIVIDUELL.
Clostridium difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln, einschließlich VANTIN, berichtet und kann in ihrer Schwere von leichter Diarrhoe bis hin zu tödlicher Kolitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficile führt.
C. difficile produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxin produzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach der Anwendung von Antibiotika Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da berichtet wurde, dass CDAD mehr als zwei Monate nach der Verabreichung von Antibiotika auftritt.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende Anwendung von Antibiotika, die nicht gegen C. difficile gerichtet sind, möglicherweise eingestellt werden. Je nach klinischer Indikation sollte ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinergänzung, eine antibiotische Behandlung von C. difficile und eine chirurgische Untersuchung eingeleitet werden.
Aufgrund einer erhöhten Inzidenz von Durchfall im Zusammenhang mit C. difficile in frühen Studien bei gesunden Probanden wurde eine konzertierte Anstrengung zur Überwachung auf C. difficile bei mit Cefpodoxim behandelten Patienten mit Durchfall unternommen. C. difficile-Organismen oder -Toxine wurden bei 10 % der mit Cefpodoxim behandelten erwachsenen Patienten mit Durchfall berichtet; bei diesen Patienten wurde jedoch keine spezifische Diagnose einer pseudomembranösen Kolitis gestellt.
Nach der Markteinführung sind außerhalb der Vereinigten Staaten Berichte über pseudomembranöse Kolitis im Zusammenhang mit der Anwendung von Cefpodoxim-Proxetil eingegangen.
VORSICHTSMASSNAHMEN
Allgemein
Bei Patienten mit vorübergehender oder anhaltender Verringerung der Harnausscheidung aufgrund von Niereninsuffizienz sollte die tägliche Gesamtdosis von Cefpodoximproxetil reduziert werden, da bei diesen Personen nach üblichen Dosen hohe und anhaltende Antibiotikakonzentrationen im Serum auftreten können. Cefpodoxim sollte, wie andere Cephalosporine, bei Patienten, die gleichzeitig mit starken Diuretika behandelt werden, mit Vorsicht angewendet werden. (Sehen DOSIERUNG UND ANWENDUNG .)
Wie bei anderen Antibiotika kann die längere Anwendung von Cefpodoximproxetil zu einem übermäßigen Wachstum von nicht empfindlichen Organismen führen. Eine wiederholte Beurteilung des Zustands des Patienten ist unerlässlich. Wenn während der Therapie eine Superinfektion auftritt, sollten geeignete Maßnahmen ergriffen werden.
Die Verschreibung von VANTIN in Ermangelung einer nachgewiesenen oder dringend vermuteten bakteriellen Infektion oder einer prophylaktischen Indikation wird dem Patienten wahrscheinlich keinen Nutzen bringen und das Risiko der Entwicklung arzneimittelresistenter Bakterien erhöhen.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es wurden keine Langzeitstudien zur Kanzerogenese bei Tieren mit Cefpodoxim-Proxetil durchgeführt. Mutagenesestudien zu Cefpodoxim, einschließlich des Ames-Tests mit und ohne metabolische Aktivierung, des Chromosomenaberrationstests, des außerplanmäßigen DNA-Synthesetests, der mitotischen Rekombination und Genkonversion, des Vorwärts-Genmutationstests und des In-vivo-Mikrokerntests, waren alle negativ. Bei oraler Verabreichung an Ratten von 100 mg/kg/Tag oder weniger (das Doppelte der Humandosis, basierend auf mg/m²) wurden keine negativen Auswirkungen auf die Fruchtbarkeit oder Reproduktion festgestellt.
Schwangerschaft
Teratogene Wirkungen
Cefpodoximproxetil war weder teratogen noch embryozid, wenn es Ratten während der Organogenese in Dosen von bis zu 100 mg/kg/Tag (das Zweifache der menschlichen Dosis, basierend auf mg/m²) oder Kaninchen in Dosen von bis zu 30 mg/kg/Tag verabreicht wurde (1 -2-fache menschliche Dosis basierend auf mg/m²).
Es liegen jedoch keine angemessenen und gut kontrollierten Studien zur Anwendung von Cefpodoximproxetil bei Schwangeren vor. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Arbeit und Lieferung
Die Anwendung von Cefpodoximproxetil während der Wehen und der Geburt wurde nicht untersucht. Eine Behandlung sollte nur erfolgen, wenn dies eindeutig erforderlich ist.
Stillende Mutter
Cefpodoxim wird in die Muttermilch ausgeschieden. In einer Studie mit 3 stillenden Frauen betrug der Cefpodoximspiegel in der Muttermilch 4 Stunden nach einer oralen Dosis von 200 mg Cefpodoxim-Proxetil 0 %, 2 % und 6 % des gleichzeitigen Serumspiegels. 6 Stunden nach der Einnahme betrugen die Spiegel 0 %, 9 % und 16 % der gleichzeitigen Serumspiegel. Aufgrund der Möglichkeit schwerwiegender Reaktionen bei gestillten Säuglingen sollte eine Entscheidung getroffen werden, ob das Stillen oder das Arzneimittel abgesetzt werden soll, wobei die Bedeutung des Arzneimittels für die Mutter zu berücksichtigen ist.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei Säuglingen unter 2 Monaten sind nicht erwiesen.
Geriatrische Verwendung
Von den 3338 Patienten in klinischen Mehrfachdosisstudien mit Cefpodoxim-Proxetil-Filmtabletten waren 521 (16 %) 65 Jahre und älter, während 214 (6 %) 75 Jahre und älter waren. Insgesamt wurden keine Unterschiede in der Wirksamkeit oder Sicherheit zwischen älteren und jüngeren Patienten beobachtet. Bei gesunden geriatrischen Probanden mit normaler Nierenfunktion betrug die Halbwertszeit von Cefpodoxim im Plasma durchschnittlich 4,2 Stunden und die Wiederfindung im Urin durchschnittlich 21 %, nachdem eine Dosis von 400 mg alle 12 Stunden über 15 Tage gegeben wurde. Andere pharmakokinetische Parameter waren im Vergleich zu denen, die bei gesunden jüngeren Probanden beobachtet wurden, unverändert.
Eine Dosisanpassung bei älteren Patienten mit normaler Nierenfunktion ist nicht erforderlich.
ÜBERDOSIS
In Studien zur akuten Nagertoxizität verursachte eine orale Einzeldosis von 5 g/kg keine Nebenwirkungen.
Im Falle einer schwerwiegenden toxischen Reaktion aufgrund einer Überdosierung kann eine Hämodialyse oder Peritonealdialyse die Entfernung von Cefpodoxim aus dem Körper unterstützen, insbesondere wenn die Nierenfunktion beeinträchtigt ist.
Die toxischen Symptome nach einer Überdosierung von Beta-Lactam-Antibiotika können Übelkeit, Erbrechen, epigastrische Beschwerden und Durchfall umfassen.
KONTRAINDIKATIONEN
Cefpodoximproxetil ist kontraindiziert bei Patienten mit einer bekannten Allergie gegen Cefpodoxim oder gegen die Antibiotika der Cephalosporin-Gruppe.
KLINISCHE PHARMAKOLOGIE
Absorption und Ausscheidung
Cefpodoxim-Proxetil ist ein Prodrug, das aus dem Gastrointestinaltrakt resorbiert und zu seinem aktiven Metaboliten Cefpodoxim entestert wird. Nach oraler Verabreichung von 100 mg Cefpodoxim-Proxetil an nüchterne Probanden wurden etwa 50 % der verabreichten Cefpodoxim-Dosis systemisch resorbiert. Über den empfohlenen Dosierungsbereich (100 bis 400 mg) wurden ungefähr 29 bis 33 % der verabreichten Cefpodoxim-Dosis innerhalb von 12 Stunden unverändert mit dem Urin ausgeschieden. Cefpodoxim wird in vivo nur minimal metabolisiert.
Auswirkungen von Lebensmitteln
Das Ausmaß der Resorption (mittlere AUC) und die mittlere maximale Plasmakonzentration nahmen zu, wenn Filmtabletten zusammen mit Nahrung eingenommen wurden. Nach Einnahme einer 200-mg-Tablette mit Nahrung war die AUC um 21 bis 33 % höher als unter nüchternen Bedingungen, und die maximale Plasmakonzentration betrug durchschnittlich 3,1 µg/ml bei Probanden nach Nahrungsaufnahme im Vergleich zu 2,6 µg/ml bei Probanden, die nüchtern waren. Die Zeit bis zum Erreichen der maximalen Konzentration unterschied sich nicht signifikant zwischen gefütterten und nüchternen Probanden.
Wenn eine 200-mg-Dosis der Suspension zusammen mit Nahrung eingenommen wurde, unterschied sich das Ausmaß der Resorption (mittlere AUC) und die mittlere maximale Plasmakonzentration bei ernährten Probanden nicht signifikant von nüchternen Probanden, aber die Resorptionsrate war mit Nahrung langsamer (48 % Anstieg bei Tmax).
Pharmakokinetik von Cefpodoxim Proxetil Filmtabletten
Über den empfohlenen Dosierungsbereich (100 bis 400 mg) waren Geschwindigkeit und Ausmaß der Resorption von Cefpodoxim dosisabhängig; dosisnormalisierte Cmax und AUC nahmen mit zunehmender Dosis um bis zu 32 % ab. Über dem empfohlenen Dosierungsbereich betrug die Tmax ungefähr 2 bis 3 Stunden und die T½ reichte von 2,09 bis 2,84 Stunden. Die mittlere Cmax betrug 1,4 µg/ml für die 100-mg-Dosis, 2,3 µg/ml für die 200-mg-Dosis und 3,9 µg/ml für die 400-mg-Dosis. Bei Patienten mit normaler Nierenfunktion wurden nach mehrfacher oraler Gabe von bis zu 400 mg alle 12 Stunden weder eine Akkumulation noch signifikante Veränderungen anderer pharmakokinetischer Parameter festgestellt.
CEFPODOXIM-PLASMASPIEGEL (mcg/ml) BEI ERWACHSENEN IM NACHTUNGSZUSTAND NACH DER VERABREICHUNG EINER FILMTABLETTE (Einzeldosis)
Pharmakokinetik der Cefpodoxim-Proxetil-Suspension
Bei erwachsenen Probanden führte eine 100-mg-Dosis der Suspension zum Einnehmen zu einer durchschnittlichen Cefpodoxim-Spitzenkonzentration von etwa 1,5 µg/ml (Bereich: 1,1 bis 2,1 µg/ml), was der nach Verabreichung der 100-mg-Tablette berichteten entspricht. Die Zeit bis zum Erreichen der maximalen Plasmakonzentration und die Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC) der Suspension zum Einnehmen entsprachen ebenfalls denen, die mit Filmtabletten bei Erwachsenen nach einer oralen Dosis von 100 mg erreicht wurden.
Die Pharmakokinetik von Cefpodoxim wurde bei 29 Patienten im Alter von 1 bis 17 Jahren untersucht. Jeder Patient erhielt eine orale Einzeldosis von 5 mg/kg Cefpodoxim-Suspension zum Einnehmen. Plasma- und Urinproben wurden 12 Stunden nach der Verabreichung gesammelt. Die aus dieser Studie berichteten Plasmaspiegel sind wie folgt:
CEFPODOXIM-PLASMASPIEGEL (mcg/ml) BEI Nüchternen Patienten (im Alter von 1 bis 17 Jahren) nach Verabreichung der Suspension
Verteilung
Die Proteinbindung von Cefpodoxim liegt zwischen 22 und 33 % im Serum und zwischen 21 und 29 % im Plasma.
Hautblase
Nach Mehrfachgabe von 200 mg oder 400 mg Cefpodoxim-Proxetil alle 12 Stunden über 5 Tage betrug die mittlere maximale Cefpodoxim-Konzentration in der Hautblasenflüssigkeit durchschnittlich 1,6 bzw. 2,8 µg/ml. Die Cefpodoxim-Spiegel in der Hautblase lagen 12 Stunden nach der Einnahme im Durchschnitt bei 0,2 bzw. 0,4 µg/ml für die 200-mg- bzw. 400-mg-Mehrfachdosis-Schemata.
Mandelgewebe
Nach einer einzelnen oralen 100-mg-Cefpodoxim-Proxetil-Filmtablette betrug die mittlere maximale Cefpodoxim-Konzentration im Tonsillengewebe durchschnittlich 0,24 Mikrogramm/g 4 Stunden nach der Einnahme und 0,09 Mikrogramm/g 7 Stunden nach der Einnahme. Das Gleichgewicht zwischen Plasma und Tonsillengewebe wurde innerhalb von 4 Stunden nach der Verabreichung erreicht. 12 Stunden nach der Verabreichung wurde kein Nachweis von Cefpodoxim im Tonsillengewebe gemeldet. Diese Ergebnisse zeigten, dass die Konzentrationen von Cefpodoxim die MHK90 von S. pyogenes für mindestens 7 Stunden nach Gabe von 100 mg Cefpodoxim-Proxetil überschritten.
Lungengewebe
Nach einer einzelnen oralen 200-mg-Cefpodoxim-Proxetil-Filmtablette betrug die mittlere maximale Cefpodoxim-Konzentration im Lungengewebe durchschnittlich 0,63 µg/g 3 Stunden nach der Einnahme, 0,52 µg/g 6 Stunden nach der Einnahme und 0,19 µg/g 12 Stunden nach der Dosierung. Die Ergebnisse dieser Studie zeigten, dass Cefpodoxim in das Lungengewebe eindrang und mindestens 12 Stunden lang nach der Verabreichung anhaltende Wirkstoffkonzentrationen erzeugte, die die MHK90 für S. pneumoniae und H. influenzae überschritten.
Liquor
Ausreichende Daten zu den Cefpodoxim-Spiegeln im Liquor sind nicht verfügbar.
Auswirkungen einer verminderten Nierenfunktion
Die Elimination von Cefpodoxim ist bei Patienten mit mäßiger bis schwerer Nierenfunktionsstörung ( VORSICHTSMASSNAHMEN und DOSIERUNG UND ANWENDUNG .) Bei Patienten mit leicht eingeschränkter Nierenfunktion (50 bis 80 ml/min Kreatinin-Clearance) betrug die durchschnittliche Plasmahalbwertszeit von Cefpodoxim 3,5 Stunden. Bei Patienten mit mäßiger (30 bis 49 ml/min Kreatinin-Clearance) oder schwerer Nierenfunktionsstörung (5 bis 29 ml/min Kreatinin-Clearance) verlängerte sich die Halbwertszeit auf 5,9 bzw. 9,8 Stunden. Etwa 23 % der verabreichten Dosis wurden während eines standardmäßigen 3-stündigen Hämodialyseverfahrens aus dem Körper ausgeschieden.
Auswirkung einer Leberfunktionsstörung (Zirrhose)
Bei Patienten mit Zirrhose war die Resorption etwas verringert und die Elimination unverändert. Die mittlere Cefpodoxim-T½ und die renale Clearance bei Patienten mit Zirrhose waren ähnlich denen, die in Studien mit gesunden Probanden ermittelt wurden. Aszites schien die Werte bei Personen mit Zirrhose nicht zu beeinflussen. Bei dieser Patientengruppe wird keine Dosisanpassung empfohlen.
Pharmakokinetik bei älteren Probanden
Bei älteren Personen ist keine Dosisanpassung erforderlich, es sei denn, sie haben eine eingeschränkte Nierenfunktion. (Sehen VORSICHTSMASSNAHMEN .) Bei gesunden geriatrischen Probanden betrug die Halbwertszeit von Cefpodoxim im Plasma durchschnittlich 4,2 Stunden (gegenüber 3,3 bei jüngeren Probanden) und die Wiederfindung im Urin betrug durchschnittlich 21 %, nachdem alle 12 Stunden eine Dosis von 400 mg verabreicht wurde. Andere pharmakokinetische Parameter (Cmax, AUC und Tmax) waren im Vergleich zu denen, die bei gesunden jungen Probanden beobachtet wurden, unverändert.
Mikrobiologie
Wirkmechanismus
Cefpodoxim ist ein bakterizides Mittel, das durch Hemmung der bakteriellen Zellwandsynthese wirkt. Cefpodoxim wirkt in Gegenwart einiger Beta-Laktamasen, sowohl Penicillinasen als auch Cephalosporinasen, von gramnegativen und grampositiven Bakterien.
Widerstandsmechanismus
Die Resistenz gegenüber Cefpodoxim beruht hauptsächlich auf Hydrolyse durch Beta-Lactamase, Veränderung von Penicillin-bindenden Proteinen (PBPs) und verringerter Permeabilität.
Cefpodoxim hat sich als wirksam gegen die meisten Isolate der folgenden Bakterien erwiesen, sowohl in vitro als auch bei klinischen Infektionen, wie im Abschnitt „Indikationen und Anwendung“ (1) beschrieben:
Grampositive Bakterien
Staphylococcus aureus (Methicillin-empfindliche Stämme, einschließlich solcher, die Penicillinasen produzieren) Staphylococcus saprophyticus Streptococcus pneumoniae (ausgenommen Penicillin-resistente Isolate) Streptococcus pyogenes
Gramnegative Bakterien
Escherichia coli Klebsiella pneumoniae Proteus mirabilis Haemophilus influenzae (einschließlich Beta-Lactamase-bildende Isolate) Moraxella catarrhalis Neisseria gonorrhoeae (einschließlich Penicillinase-bildende Isolate)
Die folgenden In-vitro-Daten sind verfügbar, ihre klinische Bedeutung ist jedoch nicht bekannt. Mindestens 90 Prozent der folgenden Mikroorganismen weisen eine minimale In-vitro-Hemmkonzentration (MHK) von weniger als oder gleich dem Empfindlichkeitsgrenzwert für Cefpodoxim auf. Die Wirksamkeit von Cefpodoxim bei der Behandlung klinischer Infektionen durch diese Mikroorganismen wurde jedoch nicht in angemessenen und gut kontrollierten klinischen Studien nachgewiesen.
Grampositive Bakterien
Streptococcus agalactiae Streptococcus spp. (Gruppen C, F, G)
Gramnegative Bakterien
Citrobacter diversus Klebsiella oxytoca Proteus vulgaris Providencia rettgeri Haemophilus parainfluenzae
Anaerobe grampositive Bakterien
Peptostreptococcus magnus
Empfindlichkeitstestmethoden
Sofern verfügbar, sollte das klinisch-mikrobiologische Labor die Ergebnisse von In-vitro-Empfindlichkeitstests für antimikrobielle Arzneimittel, die in niedergelassenen Krankenhäusern verwendet werden, dem Arzt als regelmäßige Berichte zur Verfügung stellen, die das Empfindlichkeitsprofil von nosokomialen und ambulant erworbenen Krankheitserregern beschreiben. Diese Berichte sollen dem Arzt bei der Auswahl eines antibakteriellen Arzneimittels für die Behandlung helfen.
Verdünnungstechniken
Quantitative Methoden werden verwendet, um antimikrobielle minimale Hemmkonzentrationen (MICs) zu bestimmen. Diese MICs liefern Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die MHK-Werte sollten mit einem standardisierten Testverfahren bestimmt werden. Die MHK-Werte sollten gemäß den in Tabelle 1 angegebenen Kriterien interpretiert werden.
Diffusionstechniken
Quantitative Methoden, die die Messung von Zonendurchmessern erfordern, liefern auch reproduzierbare Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die Zonengröße liefert eine Schätzung der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die Zonengröße sollte mit einem genormten Prüfverfahren bestimmt werden. Bei diesem Verfahren werden mit 10 µg Cefpodoxim imprägnierte Papierscheiben verwendet, um die Empfindlichkeit von Mikroorganismen gegenüber Cefpodoxim zu testen. Die Interpretationskriterien für die Disk-Diffusion sind in Tabelle 1 angegeben.
Ein Bericht über Anfällig weist darauf hin, dass das antimikrobielle Mittel wahrscheinlich das Wachstum des Pathogens hemmt, wenn die antimikrobielle Verbindung an der Infektionsstelle die Konzentration erreicht, die erforderlich ist, um das Wachstum des Pathogens zu hemmen. Ein Zwischenergebnis weist darauf hin, dass das Ergebnis als zweideutig betrachtet werden sollte und der Test wiederholt werden sollte, wenn der Mikroorganismus nicht vollständig empfindlich gegenüber alternativen, klinisch geeigneten Arzneimitteln ist. Diese Kategorie impliziert eine mögliche klinische Anwendbarkeit an Körperstellen, an denen das Arzneimittel physiologisch konzentriert ist, oder in Situationen, in denen eine hohe Arzneimitteldosis verwendet werden kann. Diese Kategorie bietet auch eine Pufferzone, die verhindert, dass kleine unkontrollierte technische Faktoren größere Diskrepanzen bei der Interpretation verursachen. Ein Bericht von Resistant weist darauf hin, dass das antimikrobielle Mittel das Wachstum des Pathogens wahrscheinlich nicht hemmt, wenn die antimikrobielle Verbindung die Konzentrationen erreicht, die normalerweise an der Infektionsstelle erreichbar sind; andere Therapie gewählt werden.
Qualitätskontrolle
Standardisierte Empfindlichkeitstestverfahren erfordern die Verwendung von Laborkontrollen, um die Genauigkeit und Präzision der im Assay verwendeten Materialien und Reagenzien sowie die Techniken der Person, die den Test durchführt, zu überwachen und sicherzustellen1,2,3. Standard-Cefpodoxim-Pulver sollte den folgenden Bereich von MHK-Werten aufweisen, die in Tabelle 2 angegeben sind. Für die Diffusionstechnik unter Verwendung der 10-mcg-Scheibe sollten die Kriterien in Tabelle 2 erreicht werden.
Klinische Versuche
Zystitis
In zwei doppelblinden, randomisierten 2:1-Vergleichsstudien, die an Erwachsenen in den Vereinigten Staaten durchgeführt wurden, wurde Cefpodoxim-Proxetil mit anderen Beta-Lactam-Antibiotika verglichen. In diesen Studien wurden die folgenden bakteriellen Eradikationsraten 5 bis 9 Tage nach der Therapie erzielt:
In diesen Studien waren die klinischen Heilungsraten und bakteriellen Eradikationsraten für Cefpodoximproxetil vergleichbar mit den Vergleichsmitteln; die klinischen Heilungsraten und die bakteriologische Eradikationsrate waren jedoch niedriger als bei einigen anderen zugelassenen Zystitis-Mitteln.
Akute Otitis Media Studies
In kontrollierten Studien zu akuter Mittelohrentzündung, die in den Vereinigten Staaten durchgeführt wurden und in denen signifikante Raten von Betalactamase-bildenden Organismen gefunden wurden, wurde Cefpodoxim-Proxetil mit Cefixim verglichen. In diesen Studien wurden unter Anwendung sehr strenger Auswertbarkeitskriterien und mikrobiologischer und klinischer Ansprechkriterien bei der Nachuntersuchung 4 bis 21 Tage nach der Therapie die folgenden voraussichtlichen bakteriellen Eradikations-/klinischen Erfolgsergebnisse (geheilt und verbessert) erzielt.
VERWEISE
1. Clinical and Laboratory Standards Institute (CLSI). Methoden zur Verdünnung Antimikrobielle Empfindlichkeitstests für Bakterien, die aerob wachsen; Genehmigter Standard - Neunte Ausgabe. CLSI-Dokument M07-A9, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2012.
2. Institut für klinische und Laborstandards (CLSI). Leistungsstandards für antimikrobielle Empfindlichkeitstests; Dreiundzwanzigste Informationsergänzung, CLSI-Dokument M100-S23. CLSI-Dokument M100-S23, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2013.
3. Clinical and Laboratory Standards Institute (CLSI). Leistungsstandards für antimikrobielle Disk-Diffusions-Empfindlichkeitstests; Genehmigter Standard – Elfte Ausgabe CLSI-Dokument M02-A11, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2012.
INFORMATIONEN ZUM PATIENTEN
Die Patienten sollten darauf hingewiesen werden, dass antibakterielle Arzneimittel, einschließlich VANTIN, nur zur Behandlung bakterieller Infektionen angewendet werden sollten. Sie behandeln keine Virusinfektionen (z. B. Erkältung). Wenn VANTIN zur Behandlung einer bakteriellen Infektion verschrieben wird, sollten die Patienten darüber aufgeklärt werden, dass das Medikament genau nach Anweisung eingenommen werden sollte, obwohl es üblich ist, sich zu Beginn der Therapie besser zu fühlen. Das Auslassen von Dosen oder das Nichtbeenden des vollständigen Therapieverlaufs kann (1) die Wirksamkeit der sofortigen Behandlung verringern und (2) die Wahrscheinlichkeit erhöhen, dass Bakterien Resistenzen entwickeln und in Zukunft nicht mehr mit VANTIN oder anderen antibakteriellen Arzneimitteln behandelbar sind.
Durchfall ist ein häufiges Problem, das durch Antibiotika verursacht wird und normalerweise endet, wenn das Antibiotikum abgesetzt wird. Manchmal können Patienten nach Beginn der Behandlung mit Antibiotika wässrigen und blutigen Stuhl (mit oder ohne Magenkrämpfe und Fieber) sogar noch zwei oder mehr Monate nach Einnahme der letzten Dosis des Antibiotikums entwickeln. In diesem Fall sollten die Patienten so schnell wie möglich ihren Arzt kontaktieren.