Cleocin 150mg, 300mg Clindamycin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was sind Cleocin 300 mg Hydrochlorid-Kapseln?
Cleocin-Hydrochlorid-Kapseln enthalten ein Antibiotikum, das zur Behandlung schwerer Infektionen angezeigt ist, die durch anfällige anaerobe Bakterien verursacht werden. Cleocin 150 mg Hydrochlorid ist auch indiziert zur Behandlung schwerer Infektionen durch empfindliche Stämme von Streptokokken, Pneumokokken und Staphylokokken. Seine Anwendung sollte Penicillin-allergischen Patienten oder anderen Patienten vorbehalten bleiben, für die nach Einschätzung des Arztes ein Penicillin ungeeignet ist. Cleocin Hydrochlorid ist in generischer Form erhältlich.
Was sind Nebenwirkungen von Cleocin 300 mg Hydrochlorid-Kapseln?
Häufige Nebenwirkungen von Cleocin Hydrochlorid sind:
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von CLEOCIN 300 mg HCl und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte CLEOCIN 300 mg HCl nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf Bakterien zurückzuführen sind.
WARNUNG
Clostridium difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln, einschließlich CLEOCIN HCl, berichtet und kann in ihrer Schwere von leichter Diarrhoe bis hin zu tödlicher Colitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficle führt.
Da die Therapie mit CLEOCIN 150 mg HCl mit schwerer Kolitis in Verbindung gebracht wurde, die tödlich enden kann, sollte sie schweren Infektionen vorbehalten bleiben, bei denen weniger toxische antimikrobielle Mittel ungeeignet sind, wie in beschrieben INDIKATIONEN UND VERWENDUNG Sektion. Es sollte nicht bei Patienten mit nichtbakteriellen Infektionen, wie den meisten Infektionen der oberen Atemwege, angewendet werden.
C. difficle produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxin produzierende Stämme von C. difficle verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach der Anwendung von Antibiotika Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da berichtet wurde, dass CDAD mehr als zwei Monate nach der Verabreichung von Antibiotika auftritt.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende Anwendung von Antibiotika, die nicht gegen C. difficle gerichtet sind, möglicherweise eingestellt werden. Je nach klinischer Indikation sollte ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinergänzung, eine antibiotische Behandlung von C. difficle und eine chirurgische Untersuchung eingeleitet werden.
BEZEICHNUNG
Clindamycinhydrochlorid ist das hydratisierte Hydrochloridsalz von Clindamycin. Clindamycin ist ein halbsynthetisches Antibiotikum, das durch eine 7(S)-Chlor-Substitution der 7(R)-Hydroxylgruppe der Stammverbindung Lincomycin hergestellt wird.
CLEOCIN HCl Kapseln enthalten Clindamycinhydrochlorid entsprechend 75 mg, 150 mg oder 300 mg Clindamycin.
Inaktive Inhaltsstoffe: 75 mg - Maisstärke, FD&C blau Nr. 1, FD&C gelb Nr. 5, Gelatine, Lactose, Magnesiumstearat und Talk; 150 mg - Maisstärke, FD&C blau Nr. 1, FD&C gelb Nr. 5, Gelatine, Lactose, Magnesiumstearat, Talk und Titandioxid; 300 mg - Maisstärke, FD&C blau Nr. 1, Gelatine, Lactose, Magnesiumstearat, Talk und Titandioxid.
Die Strukturformel ist unten dargestellt:
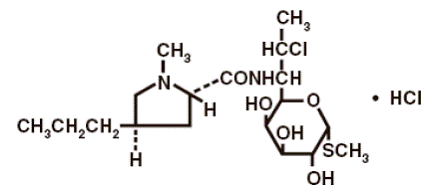
Der chemische Name für Clindamycinhydrochlorid ist Methyl 7-chloro-6,7,8-trideoxy-6-(1-methyl-trans-4-propyl-L-2-pyrrolidinecarboxamido)-1-thio-L-threo-α- D-Galacto-Octopyranosid-Monohydrochlorid.
INDIKATIONEN
Clindamycin ist indiziert zur Behandlung schwerer Infektionen, die durch anfällige anaerobe Bakterien verursacht werden.
Clindamycin ist auch indiziert zur Behandlung schwerer Infektionen durch empfindliche Stämme von Streptokokken, Pneumokokken und Staphylokokken. Seine Anwendung sollte Penicillin-allergischen Patienten oder anderen Patienten vorbehalten bleiben, für die nach Einschätzung des Arztes ein Penicillin ungeeignet ist. Aufgrund des Colitis-Risikos, wie im UMKÄSTEN WARNHINWEIS beschrieben, sollte der Arzt vor der Auswahl von Clindamycin die Art der Infektion und die Eignung weniger toxischer Alternativen (z. B. Erythromycin) berücksichtigen.
Anaerobier: Schwere Atemwegsinfektionen wie Empyem, anaerobe Pneumonitis und Lungenabszess; schwere Haut- und Weichteilinfektionen; Blutvergiftung; intraabdominelle Infektionen wie Peritonitis und intraabdomineller Abszess (typischerweise resultierend aus anaeroben Organismen, die im normalen Gastrointestinaltrakt vorhanden sind); Infektionen des weiblichen Beckens und des Genitaltrakts wie Endometritis, nichtgonokokkaler Tubo-Ovarial-Abszess, Beckencellulitis und postoperative Infektion der Vaginalmanschette.
Streptokokken: Schwere Atemwegsinfektionen; schwere Haut- und Weichteilinfektionen.
Staphylokokken: Schwere Atemwegsinfektionen; schwere Haut- und Weichteilinfektionen.
Pneumokokken: Schwere Infektionen der Atemwege.
Es sollten bakteriologische Studien durchgeführt werden, um die verursachenden Organismen und ihre Empfindlichkeit gegenüber Clindamycin zu bestimmen.
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von CLEOCIN HCl und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte CLEOCIN HCl nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf empfindliche Bakterien zurückzuführen sind. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
DOSIERUNG UND ANWENDUNG
Wenn während der Therapie signifikanter Durchfall auftritt, sollte dieses Antibiotikum abgesetzt werden (siehe Eingerahmte Warnung ).
Erwachsene
Schwere Infektionen - 150 bis 300 mg alle 6 Stunden. Schwerere Infektionen - 300 bis 450 mg alle 6 Stunden.
Pädiatrische Patienten (für Kinder, die Kapseln schlucken können):
Schwere Infektionen 8 bis 16 mg/kg/Tag (4 bis 8 mg/lb/Tag), aufgeteilt in drei oder vier gleiche Dosen. Schwerere Infektionen – 16 bis 20 mg/kg/Tag (8 bis 10 mg/lb/Tag), aufgeteilt in drei oder vier gleiche Dosen.
Um die Möglichkeit einer Reizung der Speiseröhre zu vermeiden, sollten CLEOCIN 300 mg HCl-Kapseln mit einem vollen Glas Wasser eingenommen werden.
CLEOCIN HCl Kapseln sind nicht für Kinder geeignet, die sie nicht im Ganzen schlucken können. Die Kapseln liefern keine genauen mg/kg-Dosen, daher kann es in einigen Fällen erforderlich sein, die orale Lösung von Clindamycinpalmitat zu verwenden.
Schwere Infektionen durch anaerobe Bakterien werden normalerweise mit CLEOCIN PHOSPHATE® Sterile Lösung behandelt. Unter klinisch angemessenen Umständen kann der Arzt jedoch entscheiden, die Behandlung mit CLEOCIN 150 mg HCl-Kapseln einzuleiten oder fortzusetzen.
Bei Infektionen mit β-hämolytischen Streptokokken sollte die Behandlung mindestens 10 Tage fortgesetzt werden.
WIE GELIEFERT
CLEOCIN HCl-Kapseln sind in folgenden Stärken, Farben und Größen erhältlich:
75mg Grüne Flaschen von 100 NDC 0009-0331-02
150mg Hellblaue und grüne Flaschen mit 100 Stück NDC 0009-0225-02
300mg Hellblaue 100er Flaschen NDC 0009-0395-14
Bei kontrollierter Raumtemperatur von 20° bis 25° C (68° bis 77° F) lagern [siehe USP ].
Vertrieb durch: Pharmacia & Upjohn Co, Division of Pfizer Inc, NY, NY 10017. Überarbeitet 2017
NEBENWIRKUNGEN
Die folgenden Reaktionen wurden bei der Anwendung von Clindamycin berichtet.
Infektionen und Schädlinge: Clostridium difficile-Kolitis
Magen-Darm: Bauchschmerzen, pseudomembranöse Kolitis, Ösophagitis, Übelkeit, Erbrechen und Durchfall (vgl Eingerahmte Warnung ). Das Auftreten pseudomembranöser Colitis-Symptome kann während oder nach einer antibakteriellen Behandlung auftreten (vgl WARNUNGEN ). Ösophagus-Geschwür wurde berichtet. Nach oraler Verabreichung wurde über einen unangenehmen oder metallischen Geschmack berichtet.
Überempfindlichkeitsreaktionen: Generalisierte leichte bis mittelschwere morbilliforme (makulopapulöse) Hautausschläge sind die am häufigsten berichteten Nebenwirkungen. Während der medikamentösen Therapie wurden vesikulobullöse Hautausschläge sowie Urtikaria beobachtet. Schwere Hautreaktionen wie toxische epidermale Nekrolyse, einige mit tödlichem Ausgang, wurden berichtet (siehe WARNUNGEN ). Fälle von akuter generalisierter exanthematischer Pustulose (AGEP), Erythema multiforme, einige ähneln dem Stevens-Johnson-Syndrom, anaphylaktischem Schock, anaphylaktischer Reaktion und Überempfindlichkeit wurden ebenfalls berichtet.
Haut und Schleimhäute: Pruritus, Vaginitis, Angioödem und seltene Fälle von exfoliativer Dermatitis wurden berichtet. (Sehen Überempfindlichkeitsreaktionen .)
Leber: Während der Therapie mit Clindamycin wurden Gelbsucht und Anomalien bei Leberfunktionstests beobachtet.
Nieren: Obwohl kein direkter Zusammenhang zwischen Clindamycin und Nierenschäden festgestellt wurde, wurde eine Nierenfunktionsstörung beobachtet, die sich in Azotämie, Oligurie und/oder Proteinurie zeigt.
Hämatopoetisch: Vorübergehende Neutropenie (Leukopenie) und Eosinophilie wurden berichtet. Es liegen Berichte über Agranulozytose und Thrombozytopenie vor. In keiner der vorstehenden Ausführungen konnte eine direkte ätiologische Beziehung zur gleichzeitigen Clindamycin-Therapie hergestellt werden.
Immunsystem: Fälle von Arzneimittelreaktionen mit Eosinophilie und systemischen Symptomen (DRESS) wurden berichtet.
Bewegungsapparat: Fälle von Polyarthritis wurden berichtet.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Clindamycin hat nachweislich neuromuskuläre Blockereigenschaften, die die Wirkung anderer neuromuskulärer Blocker verstärken können. Daher sollte es bei Patienten, die solche Mittel erhalten, mit Vorsicht angewendet werden.
Clindamycin wird überwiegend durch CYP3A4 und in geringerem Maße durch CYP3A5 zum Hauptmetaboliten Clindamycinsulfoxid und zum Nebenmetaboliten N-Desmethylclindamycin metabolisiert. Daher können Inhibitoren von CYP3A4 und CYP3A5 die Plasmakonzentrationen von Clindamycin erhöhen und Induktoren dieser Isoenzyme können die Plasmakonzentrationen von Clindamycin verringern. Bei Vorhandensein starker CYP3A4-Inhibitoren auf Nebenwirkungen achten. Bei Vorhandensein starker CYP3A4-Induktoren wie Rifampicin auf Wirksamkeitsverlust achten.
In-vitro-Studien weisen darauf hin, dass Clindamycin CYP1A2, CYP2C9, CYP2C19, CYP2E1 oder CYP2D6 nicht hemmt und CYP3A4 nur mäßig hemmt.
Antagonismus wurde zwischen Clindamycin und Erythromycin in vitro nachgewiesen. Wegen möglicher klinischer Bedeutung sollten diese beiden Arzneimittel nicht gleichzeitig verabreicht werden.
WARNUNGEN
Sehen Eingerahmte Warnung
Clostridium difficile assoziierter Durchfall
Clostridium difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln, einschließlich CLEOCIN 300 mg HCl, berichtet und kann in ihrer Schwere von leichter Diarrhoe bis hin zu tödlicher Colitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficle führt.
C. difficle produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxin produzierende Stämme von C. difficle verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach der Anwendung von Antibiotika Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da berichtet wurde, dass CDAD mehr als zwei Monate nach der Verabreichung von Antibiotika auftritt.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende Anwendung von Antibiotika, die nicht gegen C. difficle gerichtet sind, möglicherweise eingestellt werden. Je nach klinischer Indikation sollte ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinergänzung, eine antibiotische Behandlung von C. difficle und eine chirurgische Untersuchung eingeleitet werden.
Anaphylaktische und schwere Überempfindlichkeitsreaktionen
Anaphylaktischer Schock und anaphylaktische Reaktionen wurden berichtet (vgl NEBENWIRKUNGEN ).
Schwere Überempfindlichkeitsreaktionen, einschließlich schwerer Hautreaktionen wie toxische epidermale Nekrolyse (TEN), Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS) und Stevens-Johnson-Syndrom (SJS), einige mit tödlichem Ausgang, wurden berichtet (siehe NEBENWIRKUNGEN ).
Im Falle einer solchen anaphylaktischen oder schweren Überempfindlichkeitsreaktion die Behandlung dauerhaft abbrechen und eine geeignete Therapie einleiten.
Frühere Überempfindlichkeiten gegenüber Arzneimitteln und anderen Allergenen sollten sorgfältig abgefragt werden.
Anwendung bei Meningitis
Da Clindamycin nicht ausreichend in die Zerebrospinalflüssigkeit diffundiert, sollte das Arzneimittel nicht zur Behandlung von Meningitis verwendet werden.
VORSICHTSMASSNAHMEN
Allgemein
Die Überprüfung der bisherigen Erfahrungen deutet darauf hin, dass eine Untergruppe älterer Patienten mit einer damit verbundenen schweren Erkrankung Durchfall möglicherweise weniger gut verträgt. Wenn Clindamycin bei diesen Patienten indiziert ist, sollten sie sorgfältig auf Veränderungen der Stuhlfrequenz überwacht werden.
CLEOCIN 300 mg HCl sollte Personen mit einer Vorgeschichte von Magen-Darm-Erkrankungen, insbesondere Colitis, mit Vorsicht verschrieben werden.
CLEOCIN 300 mg HCl sollte bei atopischen Personen mit Vorsicht verschrieben werden.
Indizierte chirurgische Eingriffe sollten in Verbindung mit einer Antibiotikatherapie durchgeführt werden.
Die Anwendung von CLEOCIN 150 mg HCl führt gelegentlich zu einem übermäßigen Wachstum von unempfindlichen Organismen, insbesondere Hefen. Beim Auftreten von Superinfektionen sollten je nach klinischer Situation geeignete Maßnahmen ergriffen werden.
Bei Patienten mit Nierenerkrankungen ist eine Dosisanpassung von Clindamycin möglicherweise nicht erforderlich. Bei Patienten mit mittelschwerer bis schwerer Lebererkrankung wurde eine Verlängerung der Halbwertszeit von Clindamycin festgestellt. Aus Studien wurde jedoch postuliert, dass bei einer Verabreichung alle acht Stunden eine Akkumulation selten auftreten sollte. Daher ist eine Dosisanpassung bei Patienten mit Lebererkrankungen möglicherweise nicht erforderlich. Bei der Behandlung von Patienten mit schwerer Lebererkrankung sollten jedoch regelmäßige Leberenzymbestimmungen durchgeführt werden.
Die 75-mg- und 150-mg-Kapseln enthalten FD&C gelb Nr. 5 (Tartrazin), das bei bestimmten empfindlichen Personen allergische Reaktionen (einschließlich Bronchialasthma) hervorrufen kann. Obwohl die Gesamtinzidenz von FD&C-Gelb Nr. 5 (Tartrazin) Empfindlichkeit in der Allgemeinbevölkerung gering ist, wird sie häufig bei Patienten beobachtet, die auch eine Aspirin-Überempfindlichkeit haben.
Die Verschreibung von CLEOCIN 150 mg HCl in Ermangelung einer nachgewiesenen oder dringend vermuteten bakteriellen Infektion oder einer prophylaktischen Indikation wird dem Patienten wahrscheinlich keinen Nutzen bringen und das Risiko der Entwicklung arzneimittelresistenter Bakterien erhöhen.
Labortests
Während einer längeren Therapie sollten regelmäßige Leber- und Nierenfunktionstests und Blutbilder durchgeführt werden.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es wurden keine Langzeitstudien an Tieren mit Clindamycin zur Bewertung des kanzerogenen Potenzials durchgeführt. Die durchgeführten Genotoxizitätstests umfassten einen Ratten-Mikrokerntest und einen Ames-Salmonella-Reversionstest. Beide Tests waren negativ.
Fertilitätsstudien an Ratten, die oral mit bis zu 300 mg/kg/Tag (etwa das 1,6-fache der höchsten empfohlenen Dosis für Erwachsene, basierend auf mg/m²) behandelt wurden, zeigten keine Auswirkungen auf die Fertilität oder die Paarungsfähigkeit.
Schwangerschaft
Teratogene Wirkungen
In klinischen Studien mit schwangeren Frauen wurde die systemische Verabreichung von Clindamycin während des zweiten und dritten Trimesters nicht mit einer erhöhten Häufigkeit angeborener Anomalien in Verbindung gebracht.
Clindamycin sollte im ersten Trimenon der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist. Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren im ersten Trimenon der Schwangerschaft vor. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Reproduktionsstudien an Ratten und Mäusen mit oralen Clindamycin-Dosen von bis zu 600 mg/kg/Tag (das 3,2- bzw. 1,6-fache der höchsten empfohlenen Dosis für Erwachsene, basierend auf mg/m²) oder subkutanen Clindamycin-Dosen von bis zu 250 mg/kg /Tag (das 1,3- bzw. 0,7-fache der höchsten empfohlenen Dosis für Erwachsene, basierend auf mg/m²) ergab keine Hinweise auf Teratogenität.
Stillende Mutter
Es wurde berichtet, dass Clindamycin in der Muttermilch im Bereich von 0,7 bis 3,8 mcg/ml vorkommt. Clindamycin hat das Potenzial, negative Auswirkungen auf die Magen-Darm-Flora des gestillten Säuglings zu haben. Wenn eine stillende Mutter orales oder intravenöses Clindamycin benötigt, ist dies kein Grund, das Stillen abzubrechen, aber ein alternatives Medikament kann bevorzugt werden. Überwachen Sie den Säugling auf mögliche nachteilige Auswirkungen auf die Magen-Darm-Flora, wie Durchfall, Candidiasis (Soor, Windelausschlag) oder selten Blut im Stuhl, was auf eine mögliche Antibiotika-assoziierte Kolitis hinweist.
Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an Clindamycin und möglichen Nebenwirkungen von Clindamycin oder der zugrunde liegenden Erkrankung der Mutter auf das gestillte Kind berücksichtigt werden.
Pädiatrische Verwendung
Bei Verabreichung von CLEOCIN 300 mg HCl an Kinder und Jugendliche (Geburt bis 16 Jahre) ist eine angemessene Überwachung der Organsystemfunktionen wünschenswert.
Geriatrische Verwendung
Klinische Studien mit Clindamycin schlossen keine ausreichende Anzahl von Patienten im Alter von 65 Jahren und älter ein, um festzustellen, ob sie anders ansprechen als jüngere Patienten. Andere berichtete klinische Erfahrungen weisen jedoch darauf hin, dass Antibiotika-assoziierte Kolitis und Durchfall (aufgrund von Clostridium difficile), die in Verbindung mit den meisten Antibiotika beobachtet werden, bei älteren Menschen (> 60 Jahre) häufiger auftreten und schwerer verlaufen können. Diese Patienten sollten sorgfältig auf die Entwicklung von Durchfall überwacht werden.
Pharmakokinetische Studien mit Clindamycin haben nach oraler oder intravenöser Verabreichung keine klinisch bedeutsamen Unterschiede zwischen jungen und älteren Probanden mit normaler Leberfunktion und normaler (altersangepasster) Nierenfunktion gezeigt.
ÜBERDOSIS
Eine signifikante Mortalität wurde bei Mäusen bei einer intravenösen Dosis von 855 mg/kg und bei Ratten bei einer oralen oder subkutanen Dosis von etwa 2618 mg/kg beobachtet. Bei den Mäusen wurden Krämpfe und Depressionen beobachtet.
Hämodialyse und Peritonealdialyse sind bei der Entfernung von Clindamycin aus dem Serum nicht wirksam.
KONTRAINDIKATIONEN
CLEOCIN 150 mg HCl ist kontraindiziert bei Personen mit bekannter Überempfindlichkeit gegen Präparate, die Clindamycin oder Lincomycin enthalten.
KLINISCHE PHARMAKOLOGIE
Humanpharmakologie
Absorption
Serumspiegelstudien mit einer oralen Dosis von 150 mg Clindamycinhydrochlorid bei 24 normalen erwachsenen Freiwilligen zeigten, dass Clindamycin nach oraler Verabreichung schnell resorbiert wurde. Ein durchschnittlicher Spitzenserumspiegel von 2,50 mcg/ml wurde in 45 Minuten erreicht; Die Serumspiegel betrugen nach 3 Stunden durchschnittlich 1,51 µg/ml und nach 6 Stunden 0,70 µg/ml. Die Resorption einer oralen Dosis ist praktisch vollständig (90 %), und die gleichzeitige Einnahme von Nahrung verändert die Serumkonzentrationen nicht nennenswert; Die Serumspiegel waren von Person zu Person und von Dosis zu Dosis einheitlich und vorhersagbar. Untersuchungen des Serumspiegels nach mehreren Dosen von CLEOCIN 150 mg HCl für bis zu 14 Tage zeigen keine Hinweise auf eine Akkumulation oder einen veränderten Metabolismus des Arzneimittels. Dosen von bis zu 2 Gramm Clindamycin pro Tag über 14 Tage wurden von gesunden Probanden gut vertragen, außer dass die Häufigkeit von gastrointestinalen Nebenwirkungen bei höheren Dosen größer ist.
Verteilung
Die Konzentrationen von Clindamycin im Serum stiegen mit zunehmender Dosis linear an. Die Serumspiegel übersteigen die MHK (minimale Hemmkonzentration) für die meisten indizierten Organismen für mindestens sechs Stunden nach Verabreichung der üblicherweise empfohlenen Dosen. Clindamycin ist in Körperflüssigkeiten und Geweben (einschließlich Knochen) weit verbreitet. Im Liquor cerebrospinalis werden selbst bei entzündeten Hirnhäuten keine signifikanten Clindamycinspiegel erreicht.
Stoffwechsel
In-vitro-Studien an menschlichen Leber- und Darmmikrosomen zeigten, dass Clindamycin überwiegend durch Cytochrom P450 3A4 (CYP3A4) mit geringem Anteil von CYP3A5 zu Clindamycinsulfoxid und einem Nebenmetaboliten, N-Desmethylclindamycin, metabolisiert wird.
Ausscheidung
Die durchschnittliche biologische Halbwertszeit beträgt 2,4 Stunden. Etwa 10 % der Bioaktivität werden im Urin und 3,6 % im Stuhl ausgeschieden; der Rest wird als bioinaktive Metaboliten ausgeschieden.
Besondere Populationen
Nierenfunktionsstörung
Die Serumhalbwertszeit von Clindamycin ist bei Patienten mit deutlich eingeschränkter Nierenfunktion leicht verlängert. Hämodialyse und Peritonealdialyse sind bei der Entfernung von Clindamycin aus dem Serum nicht wirksam.
Anwendung bei älteren Menschen
Pharmakokinetische Studien bei älteren Probanden (61-79 Jahre) und jüngeren Erwachsenen (18-39 Jahre) zeigen, dass das Alter allein die Pharmakokinetik von Clindamycin (Clearance, Eliminationshalbwertszeit, Verteilungsvolumen und Fläche unter der Serumkonzentrations-Zeit-Kurve) nicht verändert ) nach intravenöser Gabe von Clindamycinphosphat. Nach oraler Gabe von Clindamycinhydrochlorid verlängert sich die Eliminationshalbwertszeit bei älteren Menschen auf etwa 4,0 Stunden (Bereich 3,4 – 5,1 Stunden) im Vergleich zu 3,2 Stunden (Bereich 2,1 – 4,2 Stunden) bei jüngeren Erwachsenen. Das Ausmaß der Resorption unterscheidet sich jedoch nicht zwischen den Altersgruppen, und für ältere Menschen mit normaler Leberfunktion und normaler (altersangepasster) Nierenfunktion ist keine Dosisänderung erforderlich1.
Mikrobiologie
Wirkmechanismus
Clindamycin hemmt die bakterielle Proteinsynthese durch Bindung an die 23S-RNA der 50S-Untereinheit des Ribosoms. Clindamycin ist bakteriostatisch.
Widerstand
Die Resistenz gegen Clindamycin wird meistens durch die Modifikation spezifischer Basen der ribosomalen 23S-RNA verursacht. Die Kreuzresistenz zwischen Clindamycin und Lincomycin ist vollständig. Da sich die Bindungsstellen für diese antibakteriellen Wirkstoffe überlappen, wird manchmal eine Kreuzresistenz zwischen Lincosamiden, Makroliden und Streptogramin B beobachtet. Eine Makrolid-induzierbare Resistenz gegen Clindamycin tritt bei einigen Isolaten von Makrolid-resistenten Bakterien auf. Makrolid-resistente Isolate von Staphylokokken und beta-hämolysierenden Streptokokken sollten mit dem D-Zonen-Test auf Induktion einer Clindamycin-Resistenz untersucht werden.
Antimikrobielle Aktivität
Clindamycin hat sich als wirksam gegen die meisten Isolate der folgenden Mikroorganismen erwiesen, sowohl in vitro als auch bei klinischen Infektionen, wie in beschrieben INDIKATIONEN UND VERWENDUNG Sektion.
Grampositive Bakterien
Staphylococcus aureus (Methicillin-empfindliche Stämme) Streptococcus pneumoniae (Penicillin-empfindliche Stämme) Streptococcus pyogenes
Anaerobe Bakterien
Clostridium perfringens Fusobacterium necrophorum Fusobacterium nucleatum Peptostreptococcus anaerobius Prevotella melaninogenica
Mindestens 90 % der unten aufgeführten Mikroorganismen weisen in vitro minimale Hemmkonzentrationen (MHK) auf, die kleiner oder gleich dem Clindamycin-empfindlichen MHK-Grenzwert für Organismen eines ähnlichen Typs wie den in Tabelle 1 gezeigten sind. Die Wirksamkeit von Clindamycin bei der Behandlung von klinischen Infektionen durch diese Mikroorganismen wurden in angemessenen und gut kontrollierten klinischen Studien nicht nachgewiesen.
Grampositive Bakterien
Staphylococcus epidermidis (Methicillin-empfindliche Stämme) Streptococcus agalactiae Streptococcus anginosus Streptococcus mitis Streptococcus oralis
Anaerobe Bakterien
Actinomyces israelii Clostridium clostridioforme Eggerthella lenta Finegoldia (Peptostreptococcus) magna Micromonas (Peptostreptococcus) micros Prevotella bivia Prevotella intermedia Propionibacterium acnes
Empfindlichkeitstestmethoden
Wenn verfügbar, sollte das Labor für klinische Mikrobiologie dem Arzt kumulative In-vitro-Empfindlichkeitstestergebnisse für antimikrobielle Arzneimittel, die in örtlichen Krankenhäusern und Praxisbereichen verwendet werden, als regelmäßige Berichte zur Verfügung stellen, die das Empfindlichkeitsprofil von nosokomialen und ambulant erworbenen Krankheitserregern beschreiben. Diese Berichte sollen dem Arzt bei der Auswahl eines antibakteriellen Medikaments für die Behandlung helfen.
Verdünnungstechniken
Zur Bestimmung der minimalen Hemmkonzentrationen (MHK) von antimikrobiellen Mitteln werden quantitative Methoden verwendet. Diese MICs liefern Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die MHK sollten mit einer standardisierten Testmethode2,3 (Brühe und/oder Agar) bestimmt werden. Die MHK-Werte sollten gemäß den in Tabelle 1 angegebenen Kriterien interpretiert werden.
Diffusionstechniken
Quantitative Methoden, die die Messung von Zonendurchmessern erfordern, können ebenfalls reproduzierbare Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen liefern. Die Zonengröße sollte nach einer standardisierten Methode bestimmt werden2,5. Bei diesem Verfahren werden mit 2 µg Clindamycin imprägnierte Papierscheiben verwendet, um die Empfindlichkeit von Bakterien gegenüber Clindamycin zu testen. Die Haltepunkte der Plattendiffusion sind in Tabelle 1 angegeben.
Anaerobe Techniken
Bei anaeroben Bakterien kann die Empfindlichkeit gegenüber Clindamycin durch ein standardisiertes Testverfahren bestimmt werden2,4. Die erhaltenen MHK-Werte sollten gemäß den in Tabelle 1 angegebenen Kriterien interpretiert werden.
Ein Bericht über empfindlich (S) zeigt an, dass das antimikrobielle Medikament wahrscheinlich das Wachstum des Pathogens hemmt, wenn das antimikrobielle Medikament die Konzentration erreicht, die normalerweise an der Infektionsstelle erreichbar ist. Ein Bericht von Intermediat (I) weist darauf hin, dass das Ergebnis als zweideutig betrachtet werden sollte und der Test wiederholt werden sollte, wenn der Mikroorganismus nicht vollständig empfindlich gegenüber alternativen, klinisch geeigneten Arzneimitteln ist. Diese Kategorie impliziert eine mögliche klinische Anwendbarkeit an Körperstellen, an denen das Arzneimittel physiologisch konzentriert ist, oder in Situationen, in denen eine hohe Dosierung des Arzneimittels verwendet werden kann. Diese Kategorie bietet auch eine Pufferzone, die verhindert, dass kleine, unkontrollierte technische Faktoren zu großen Diskrepanzen bei der Interpretation führen. Ein Bericht über resistent (R) weist darauf hin, dass das antimikrobielle Medikament das Wachstum des Pathogens wahrscheinlich nicht hemmt, wenn das antimikrobielle Medikament die Konzentration erreicht, die normalerweise an der Infektionsstelle erreichbar ist; andere Therapie gewählt werden.
Qualitätskontrolle
Standardisierte Empfindlichkeitstestverfahren erfordern die Verwendung von Laborkontrollen, um die Genauigkeit und Präzision der im Assay verwendeten Materialien und Reagenzien sowie die Techniken der Personen, die den Test durchführen, zu überwachen und sicherzustellen.2,3,4,5 Standard-Clindamycin-Pulver sollte bereitstellen die MHK-Bereiche in Tabelle 2. Für die Scheibendiffusionstechnik unter Verwendung der 2-µg-Clindamycin-Scheibe sollten die in Tabelle 2 angegebenen Kriterien erreicht werden.
Anaerobier können entweder durch Bouillon-Mikroverdünnung oder Agar-Verdünnungsverfahren getestet werden. NA=Nicht zutreffend ATCC® ist ein eingetragenes Warenzeichen der American Type Culture Collection
VERWEISE
1. Smith RB, Phillips JP: Bewertung von CLEOCIN HCl und CLEOCIN Phosphat in einer älteren Bevölkerung. Upjohn TR 8147-82-9122-021, Dezember 1982.
2. CLSI. Leistungsstandards für antimikrobielle Empfindlichkeitstests: 26. Ausgabe. CLSI-Ergänzung M100S. Wayne, PA: Institut für klinische und Laborstandards; 2016.
3. CLSI. Methoden zur Verdünnung Antimikrobielle Empfindlichkeitstests für Bakterien, die aerob wachsen; Genehmigter Standard - Zehnte Ausgabe. CLSI-Dokument M07-A10. Wayne, PA: Institut für klinische und Laborstandards; 2015.
4. CLSI. Methoden zur antimikrobiellen Empfindlichkeitsprüfung anaerober Bakterien; Genehmigte Standard-Achte Ausgabe. CLSI-Dokument M11-A8. Wayne, PA: Institut für klinische und Laborstandards; 2012.
5. CLSI. Leistungsstandards für antimikrobielle Disk-Empfindlichkeitstests; Genehmigter Standard - Zwölfte Ausgabe. CLSI-Dokument M02-A12. Wayne, PA: Institut für klinische und Laborstandards; 2015.
INFORMATIONEN ZUM PATIENTEN
Die Patienten sollten darauf hingewiesen werden, dass antibakterielle Arzneimittel, einschließlich CLEOCIN HCl, nur zur Behandlung bakterieller Infektionen angewendet werden sollten. Sie behandeln keine Virusinfektionen (z. B. Erkältung). Wenn CLEOCIN HCl zur Behandlung einer bakteriellen Infektion verschrieben wird, sollten die Patienten darüber aufgeklärt werden, dass sie sich zwar zu Beginn der Therapie besser fühlen, das Medikament jedoch genau nach Anweisung eingenommen werden sollte. Das Auslassen von Dosen oder das Nichtabschließen des vollständigen Therapieverlaufs kann (1) die Wirksamkeit der sofortigen Behandlung verringern und (2) die Wahrscheinlichkeit erhöhen, dass Bakterien Resistenzen entwickeln und in Zukunft nicht mehr mit CLEOCIN 150 mg HCl oder anderen antibakteriellen Arzneimitteln behandelbar sind.
Durchfall ist ein häufiges Problem, das durch Antibiotika verursacht wird und normalerweise endet, wenn das Antibiotikum abgesetzt wird. Manchmal können Patienten nach Beginn der Behandlung mit Antibiotika wässrigen und blutigen Stuhl (mit oder ohne Magenkrämpfe und Fieber) sogar noch zwei oder mehr Monate nach Einnahme der letzten Dosis des Antibiotikums entwickeln. In diesem Fall sollten die Patienten so schnell wie möglich ihren Arzt kontaktieren.