Zyvox 600mg Linezolid Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Zyvox 600 mg und wie wird es angewendet?
Zyvox ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome bakterieller Infektionen wie Lungenentzündung, Hautinfektionen und Infektionen, die gegen andere Antibiotika resistent sind. Zyvox 600 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Zyvox gehört zu einer Klasse von Arzneimitteln namens Antibiotika, andere; Oxazolidinone.
Es ist nicht bekannt, ob Zyvox bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Zyvox haben?
Zyvox kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Zyvox gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Zyvox. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
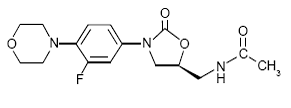
ZYVOX 600 mg i.v. Injektion, ZYVOX Tabletten und ZYVOX zur oralen Suspension enthalten Linezolid, ein synthetisches antibakterielles Mittel aus der Klasse der Oxazolidinone. Der chemische Name für Linezolid ist (S)-N-[[3-[3-Fluoro-4-(4morpholinyl)phenyl]-2-oxo-5-oxazolidinyl]methyl]acetamid.
Die Summenformel lautet C16H20FN3O4. Sein Molekulargewicht beträgt 337,35 und seine chemische Struktur ist unten dargestellt:
ZYVOX 600 mg i.v. Injektion wird als gebrauchsfertige sterile isotonische Lösung zur intravenösen Infusion geliefert. Jeder ml enthält 2 mg Linezolid. Inaktive Inhaltsstoffe sind Natriumcitrat, Zitronensäure und Dextrose in einem wässrigen Vehikel zur intravenösen Verabreichung. Der Natriumgehalt (Na+) beträgt 0,38 mg/ml (5 mEq/300-ml-Beutel und 1,7 mEq/100-ml-Beutel).
ZYVOX Tablette zur oralen Verabreichung enthält 600 mg Linezolid als Filmtablette. Inaktive Inhaltsstoffe sind Maisstärke, mikrokristalline Cellulose, Hydroxypropylcellulose, Natriumstärkeglykolat, Magnesiumstearat, Hypromellose, Polyethylenglykol, Titandioxid und Carnaubawachs. Der Natriumgehalt (Na+) beträgt 2,92 mg pro 600-mg-Tablette (0,1 mEq/Tablette).
ZYVOX 600 mg zur Herstellung einer Suspension zum Einnehmen wird als Granulat/Pulver mit Orangengeschmack zur Herstellung einer Suspension zur oralen Verabreichung geliefert. Nach der Konstitution enthalten je 5 ml 100 mg Linezolid. Inaktive Inhaltsstoffe sind Saccharose, Citronensäure, Natriumcitrat, mikrokristalline Cellulose und Natriumcarboxymethylcellulose, Aspartam, Xanthangummi, Mannit, Natriumbenzoat, kolloidales Siliciumdioxid, Natriumchlorid und Aromen [siehe INFORMATIONEN ZUM PATIENTEN ]. Der Gehalt an Natrium (Na+) beträgt 8,52 mg/5 ml (0,4 mEq/5 ml).
INDIKATIONEN
Nosokomiale Pneumonie
ZYVOX ist indiziert zur Behandlung von nosokomialer Pneumonie, die durch Staphylococcus aureus (Methicillin-empfindliche und -resistente Isolate) oder Streptococcus pneumoniae verursacht wird [siehe Klinische Studien ].
Ambulant erworbene Pneumonie
ZYVOX 600 mg ist indiziert zur Behandlung von ambulant erworbener Pneumonie, die durch Streptococcus pneumoniae verursacht wird, einschließlich Fällen mit gleichzeitiger Bakteriämie, oder Staphylococcus aureus (nur Methicillin-empfindliche Isolate) [siehe Klinische Studien ].
Komplizierte Haut- und Hautstrukturinfektionen
ZYVOX 600 mg ist indiziert zur Behandlung komplizierter Haut- und Hautstrukturinfektionen, einschließlich diabetischer Fußinfektionen, ohne begleitende Osteomyelitis, die durch Staphylococcus aureus (Methicillin-empfindliche und -resistente Isolate), Streptococcus pyogenes oder Streptococcus agalactiae verursacht werden. ZYVOX wurde bei der Behandlung von Dekubitus nicht untersucht [siehe Klinische Studien ].
Unkomplizierte Haut- und Hautstrukturinfektionen
ZYVOX 600 mg ist angezeigt zur Behandlung von unkomplizierten Haut- und Hautstrukturinfektionen, die durch Staphylococcus aureus (nur Methicillin-empfindliche Isolate) oder Streptococcus pyogenes verursacht werden [siehe Klinische Studien ].
Vancomycin-resistente Enterococcus faecium-Infektionen
ZYVOX 600 mg ist indiziert zur Behandlung von Infektionen mit Vancomycin-resistentem Enterococcus faecium, einschließlich Fällen mit gleichzeitiger Bakteriämie [siehe Klinische Studien ].
Nutzungsbeschränkungen
Verwendungszweck
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von ZYVOX 600 mg und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte ZYVOX nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf empfindliche Bakterien zurückzuführen sind. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
DOSIERUNG UND ANWENDUNG
Allgemeine Dosierung und Verabreichung
Die empfohlene Dosierung für ZYVOX 600 mg-Formulierungen zur Behandlung von Infektionen ist in Tabelle 1 beschrieben.
Beim Wechsel von der intravenösen auf die orale Gabe ist keine Dosisanpassung erforderlich.
Intravenöse Verabreichung
ZYVOX 600 mg i.v. Injektion wird in gebrauchsfertigen Einzeldosis-Infusionsbeuteln geliefert. Parenterale Arzneimittel sollten vor der Verabreichung visuell auf Partikel untersucht werden. Prüfen Sie auf winzige Lecks, indem Sie den Beutel fest zusammendrücken. Wenn Undichtigkeiten festgestellt werden, entsorgen Sie die Lösung, da die Sterilität beeinträchtigt werden kann. Bewahren Sie die Infusionsbeutel bis zur Verwendung in der Umverpackung auf. Bei Raumtemperatur lagern. Vor Frost schützen. ZYVOX 600 mg i.v. Injektion kann eine gelbe Farbe aufweisen, die sich mit der Zeit intensivieren kann, ohne die Wirksamkeit zu beeinträchtigen.
ZYVOX IV Injection sollte als intravenöse Infusion über einen Zeitraum von 30 bis 120 Minuten verabreicht werden. Verwenden Sie diesen Infusionsbeutel nicht in Reihenschaltungen. In diese Lösung sollten keine Zusätze eingebracht werden. Wenn ZYVOX 600 mg i.v. Injektion gleichzeitig mit einem anderen Arzneimittel verabreicht werden soll, sollte jedes Arzneimittel gemäß der empfohlenen Dosierung und Verabreichungsart für jedes Produkt separat verabreicht werden. Verwerfen Sie unbenutzte Portionen.
Wenn derselbe intravenöse Zugang zur sequentiellen Infusion mehrerer Arzneimittel verwendet wird, sollte der Zugang vor und nach der Infusion von ZYVOX i.v. Injektion mit einer Infusionslösung gespült werden, die mit ZYVOX 600 mg i.v. Injektion und mit allen anderen über diesen gemeinsamen Zugang verabreichten Arzneimitteln kompatibel ist .
Kompatibilitäten
Zu den kompatiblen intravenösen Lösungen gehören 0,9 % Natriumchlorid-Injektion, USP, 5 % Dextrose-Injektion, USP, und Laktierte Ringer-Injektion, USP.
Inkompatibilitäten
Physikalische Inkompatibilitäten traten auf, wenn ZYVOX 600 mg i.v. Injektion mit den folgenden Arzneimitteln während einer simulierten Verabreichung an der Y-Stelle kombiniert wurde: Amphotericin B, Chlorpromazin-HCl, Diazepam, Pentamidin-Isothionat, Erythromycin-Lactobionat, Phenytoin-Natrium und Trimethoprim-Sulfamethoxazol. Außerdem kam es zu einer chemischen Inkompatibilität, wenn ZYVOX IV Injection mit Ceftriaxon-Natrium kombiniert wurde.
Verfassung der mündlichen Suspendierung
ZYVOX zur oralen Suspension wird als Pulver/Granulat zur Konstitution geliefert. Klopfen Sie vorsichtig auf die Flasche, um das Pulver zu lösen. Fügen Sie insgesamt 123 ml destilliertes Wasser in zwei Portionen hinzu. Nachdem Sie die erste Hälfte hinzugefügt haben, schütteln Sie kräftig, um das gesamte Pulver zu benetzen. Dann die zweite Hälfte des Wassers hinzufügen und kräftig schütteln, um eine gleichmäßige Suspension zu erhalten. Nach der Konstitution enthalten jeweils 5 ml der Suspension 100 mg Linezolid. Vor Gebrauch vorsichtig mischen, indem die Flasche 3 bis 5 Mal umgedreht wird. Nicht schütteln. Konfektionierte Suspension bei Raumtemperatur lagern. Verwenden Sie innerhalb von 21 Tagen nach der Zubereitung.
WIE GELIEFERT
Darreichungsformen und Stärken
ZYVOX 600 mg i.v. Injektion: 200 mg/100 ml (2 mg/ml) und 600 mg/300 ml (2 mg/ml) Linezolid-Einzeldosis, gebrauchsfertige flexible Infusionsbeutel aus Kunststoff in einer Umhüllung aus Folienlaminat.
ZYVOX 600 mg Tablette:
weiße, kapselförmige Filmtablette mit der Prägung „ZYV“ auf der einen Seite und „600“ auf der anderen Seite ZYVOX 600 mg zur Herstellung einer Suspension zum Einnehmen: trockenes, weißes bis cremefarbenes Granulat/Pulver mit Orangengeschmack. Bei bestimmungsgemäßer Zusammensetzung enthält jede Flasche 150 ml einer Suspension, die das Äquivalent von 100 mg Linezolid pro 5 ml enthält.
Lagerung und Handhabung
Injektion
ZYVOX 600 mg i.v Injection ist in gebrauchsfertigen flexiblen Infusionsbeuteln aus Kunststoff in einer Folienlaminatumhüllung erhältlich. Die Infusionsbeutel und Ports sind nicht aus Naturkautschuklatex hergestellt. Die Infusionsbeutel sind in folgenden Packungsgrößen erhältlich:
200 mg/100 ml (2 mg/ml) Linezolid x 10 - NDC 0009-5137-04 600 mg/300 ml (2 mg/ml) Linezolid x 10 - NDC 0009-5140-04
Tablets
ZYVOX 600 mg Tabletten sind wie folgt erhältlich:
600 mg (weiße, kapselförmige Filmtabletten mit der Prägung „ZYV“ auf der einen und „600“ auf der anderen Seite)
20 Tabletten in HDPE-Flasche - NDC 0009-5138-02 Einzeldosispackungen mit 30 Tabletten - NDC 0009-5138-03
Mündliche Suspendierung
ZYVOX zur oralen Suspension ist als trockenes, weißes bis cremefarbenes Granulat/Pulver mit Orangengeschmack erhältlich. Bei bestimmungsgemäßer Zusammensetzung enthält jede Flasche 150 ml einer Suspension, die das Äquivalent von 100 mg Linezolid pro 5 ml enthält. ZYVOX zur Herstellung einer Suspension zum Einnehmen wird wie folgt geliefert:
100 mg/5 ml in 240-ml-Glasflaschen - NDC 0009-5136-01
Lagerung und Handhabung
Bei 25 °C (77 °F) lagern. Vor Licht schützen. Flaschen fest verschlossen halten, um den Inhalt vor Feuchtigkeit zu schützen. Es wird empfohlen, die Infusionsbeutel bis zur Verwendung in der Umhüllung aufzubewahren. Schützen Sie die Infusionsbeutel vor dem Einfrieren.
Vertrieb durch Pharmacia & Upjohn Co Division of Pfizer Inc, NY, NY 10017. Überarbeitet: November 2021.
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Erwachsene
Die Sicherheit von ZYVOX 600 mg-Formulierungen wurde bei 2.046 erwachsenen Patienten untersucht, die in sieben Phase-3-vergleichskontrollierte klinische Studien aufgenommen und bis zu 28 Tage lang behandelt wurden.
Von den Patienten, die wegen unkomplizierter Haut- und Hautstrukturinfektionen (uSSSIs) behandelt wurden, kam es bei 25,4 % der mit ZYVOX behandelten und 19,6 % der mit Vergleichspräparat behandelten Patienten zu mindestens einem arzneimittelbedingten unerwünschten Ereignis. Bei allen anderen Indikationen kam es bei 20,4 % der mit ZYVOX behandelten und 14,3 % der mit dem Vergleichspräparat behandelten Patienten zu mindestens einem arzneimittelbedingten unerwünschten Ereignis.
Tabelle 2 zeigt die Inzidenz behandlungsbedingter Nebenwirkungen jeglicher Ursache, die bei mindestens 1 % der erwachsenen Patienten in diesen Studien nach ZYVOX-Dosis berichtet wurden.
Von den wegen uSSSIs behandelten Patienten brachen 3,5 % der mit ZYVOX behandelten und 2,4 % der mit Vergleichspräparat behandelten Patienten die Behandlung aufgrund arzneimittelbedingter unerwünschter Ereignisse ab. Bei allen anderen Indikationen kam es bei 2,1 % der mit ZYVOX behandelten und 1,7 % der mit dem Vergleichspräparat behandelten Patienten zu Behandlungsabbrüchen aufgrund arzneimittelbedingter unerwünschter Ereignisse. Die am häufigsten berichteten arzneimittelbedingten unerwünschten Ereignisse, die zum Abbruch der Behandlung führten, waren Übelkeit, Kopfschmerzen, Durchfall und Erbrechen.
Pädiatrische Patienten
Die Sicherheit von ZYVOX-Formulierungen wurde an 215 pädiatrischen Patienten im Alter von Geburt bis 11 Jahren und an 248 pädiatrischen Patienten im Alter von 5 bis 17 Jahren (146 von diesen 248 im Alter von 5 bis 11 und 102 im Alter von 12 bis 17) untersucht. Diese Patienten wurden in zwei vergleichskontrollierte klinische Phase-3-Studien aufgenommen und bis zu 28 Tage lang behandelt. In der Studie mit hospitalisierten pädiatrischen Patienten (Geburt bis 11 Jahre) mit grampositiven Infektionen, die 2 zu 1 randomisiert wurden (Linezolid: Vancomycin), betrug die Sterblichkeit 6,0 % (13/215) im Linezolid-Arm und 3,0 % (3/101) im Vancomycin-Arm. Aufgrund der schweren Grunderkrankung der Patientenpopulation konnte jedoch keine Kausalität festgestellt werden.
Von den wegen uSSSI behandelten pädiatrischen Patienten kam es bei 19,2 % der mit ZYVOX behandelten und 14,1 % der mit Vergleichspräparat behandelten Patienten zu mindestens einem arzneimittelbedingten unerwünschten Ereignis. Bei allen anderen Indikationen kam es bei 18,8 % der mit ZYVOX behandelten und 34,3 % der mit Vergleichspräparat behandelten Patienten zu mindestens einem arzneimittelbedingten unerwünschten Ereignis.
Tabelle 3 zeigt die Inzidenz von behandlungsbedingten Nebenwirkungen jeglicher Ursache, die bei mehr als 1 % der pädiatrischen Patienten (und mehr als 1 Patient) in jeder Behandlungsgruppe in den Vergleichs-kontrollierten Phase-3-Studien berichtet wurden.
Von den wegen uSSSI behandelten pädiatrischen Patienten brachen 1,6 % der mit ZYVOX behandelten und 2,4 % der mit Vergleichspräparat behandelten Patienten die Behandlung aufgrund arzneimittelbedingter unerwünschter Ereignisse ab. Bei allen anderen Indikationen kam es bei 0,9 % der mit ZYVOX behandelten und 6,1 % der mit dem Vergleichspräparat behandelten Patienten zu Behandlungsabbrüchen aufgrund arzneimittelbedingter unerwünschter Ereignisse.
Laboranomalien
ZYVOX wurde mit Thrombozytopenie in Verbindung gebracht, wenn es bis zu 28 Tage lang in Dosen bis einschließlich 600 mg alle 12 Stunden angewendet wurde. In komparatorkontrollierten Phase-3-Studien betrug der Prozentsatz der erwachsenen Patienten, die eine deutlich niedrige Thrombozytenzahl (definiert als weniger als 75 % der Untergrenze des Normalwerts und/oder des Ausgangswerts) entwickelten, 2,4 % (Bereich zwischen den Studien: 0,3 bis 10,0 %). mit ZYVOX 600 mg und 1,5 % (Bereich zwischen den Studien: 0,4 bis 7,0 %) mit einem Vergleichspräparat. In einer Studie mit hospitalisierten pädiatrischen Patienten im Alter von der Geburt bis zum Alter von 11 Jahren betrug der Prozentsatz der Patienten, die eine wesentlich niedrige Thrombozytenzahl (definiert als weniger als 75 % der Untergrenze des Normalwerts und/oder des Ausgangswerts) entwickelten, unter ZYVOX 600 mg 12,9 % und 13,4 % mit Vancomycin. In einer ambulanten Studie mit pädiatrischen Patienten im Alter von 5 bis 17 Jahren betrug der Prozentsatz der Patienten, die eine wesentlich niedrigere Thrombozytenzahl entwickelten, 0 % unter ZYVOX und 0,4 % unter Cefadroxil. Thrombozytopenie im Zusammenhang mit der Anwendung von ZYVOX scheint von der Behandlungsdauer (im Allgemeinen mehr als 2 Behandlungswochen) abzuhängen. Die Thrombozytenzahlen kehrten bei den meisten Patienten während des Nachbeobachtungszeitraums in den normalen Bereich/Basiswert zurück. In klinischen Phase-3-Studien bei Patienten, die eine Thrombozytopenie entwickelten, wurden keine damit verbundenen klinischen unerwünschten Ereignisse festgestellt. Blutungsereignisse wurden bei Patienten mit Thrombozytopenie in einem Compassionate-Use-Programm für ZYVOX festgestellt; die Rolle von Linezolid bei diesen Ereignissen kann nicht bestimmt werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Änderungen, die bei anderen Laborparametern ohne Berücksichtigung der Arzneimittelbeziehung festgestellt wurden, zeigten keine wesentlichen Unterschiede zwischen ZYVOX 600 mg und den Vergleichspräparaten. Diese Veränderungen waren im Allgemeinen klinisch nicht signifikant, führten nicht zu einem Therapieabbruch und waren reversibel. Die Inzidenz von erwachsenen und pädiatrischen Patienten mit mindestens einem wesentlich abnormalen hämatologischen oder Serumchemiewert ist in den Tabellen 4, 5, 6 und 7 dargestellt.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von ZYVOX nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen:
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Monoaminoxidase-Inhibitoren
Linezolid ist ein reversibler, nicht selektiver Inhibitor der Monoaminoxidase [vgl KONTRAINDIKATIONEN und KLINISCHE PHARMAKOLOGIE ].
Adrenerge und serotonerge Wirkstoffe
Linezolid hat das Potenzial für Wechselwirkungen mit adrenergen und serotonergen Wirkstoffen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Myelosuppression
Myelosuppression (einschließlich Anämie, Leukopenie, Panzytopenie und Thrombozytopenie) wurde bei Patienten berichtet, die Linezolid erhielten. In Fällen, in denen das Ergebnis bekannt ist, sind die betroffenen hämatologischen Parameter nach Absetzen von Linezolid auf die Werte vor der Behandlung angestiegen. Das komplette Blutbild sollte bei Patienten, die Linezolid erhalten, wöchentlich überwacht werden, insbesondere bei Patienten, die Linezolid länger als zwei Wochen erhalten, bei Patienten mit vorbestehender Myelosuppression, bei Patienten, die gleichzeitig Arzneimittel erhalten, die eine Knochenmarksuppression bewirken, oder bei Patienten mit einer chronischen Infektion vorherige oder begleitende antibakterielle Arzneimitteltherapie erhalten haben. Bei Patienten, die eine Myelosuppression entwickeln oder verschlechtern, sollte ein Abbruch der Therapie mit Linezolid in Betracht gezogen werden.
Periphere und optische Neuropathie
Periphere und Optikusneuropathien wurden bei Patienten berichtet, die mit ZYVOX 600 mg behandelt wurden, hauptsächlich bei Patienten, die länger als die maximal empfohlene Dauer von 28 Tagen behandelt wurden. In Fällen von Optikusneuropathie, die bis zum Verlust des Sehvermögens fortschritt, wurden die Patienten über längere Zeiträume über die maximal empfohlene Dauer hinaus behandelt. Bei einigen Patienten, die weniger als 28 Tage mit ZYVOX behandelt wurden, wurde über verschwommenes Sehen berichtet. Bei Kindern wurde auch über periphere und optische Neuropathie berichtet.
Wenn bei Patienten Symptome einer Sehbehinderung auftreten, wie z. B. Veränderungen der Sehschärfe, Veränderungen des Farbsehens, verschwommenes Sehen oder Gesichtsfeldausfälle, wird eine sofortige augenärztliche Untersuchung empfohlen. Die Sehfunktion sollte bei allen Patienten, die ZYVOX über einen längeren Zeitraum (≥ 3 Monate) einnehmen, und bei allen Patienten, die über neue visuelle Symptome berichten, überwacht werden, unabhängig von der Dauer der Therapie mit ZYVOX. Wenn eine periphere oder optische Neuropathie auftritt, sollte die fortgesetzte Anwendung von ZYVOX 600 mg bei diesen Patienten gegen die potenziellen Risiken abgewogen werden.
Serotonin-Syndrom
Im Zusammenhang mit der gleichzeitigen Anwendung von ZYVOX und serotonergen Wirkstoffen, einschließlich Antidepressiva wie selektiven Serotonin-Wiederaufnahmehemmern (SSRIs), wurden Spontanberichte über ein Serotonin-Syndrom, einschließlich tödlicher Fälle, berichtet.
Sofern es nicht klinisch angemessen ist und die Patienten sorgfältig auf Anzeichen und/oder Symptome eines Serotoninsyndroms oder eines malignen neuroleptischen Syndroms (NMS-ähnlich) beobachtet werden, sollte Linezolid nicht an Patienten mit Karzinoidsyndrom und/oder Patienten verabreicht werden, die eines der folgenden Arzneimittel einnehmen : Serotonin-Wiederaufnahmehemmer, trizyklische Antidepressiva, Bupropion, Buspiron, Serotonin-5-HT1-Rezeptoragonisten (Triptane) und Opioide, einschließlich Meperidin [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
In einigen Fällen kann ein Patient, der bereits ein serotonerges Antidepressivum oder Buspiron erhält, eine dringende Behandlung mit Linezolid benötigen. Wenn keine Alternativen zu Linezolid verfügbar sind und der potenzielle Nutzen von Linezolid die Risiken eines Serotoninsyndroms oder NMS-ähnlicher Reaktionen überwiegt, sollte das serotonerge Antidepressivum unverzüglich abgesetzt und Linezolid verabreicht werden. Der Patient sollte zwei Wochen (fünf Wochen, wenn Fluoxetin eingenommen wurde) oder bis 24 Stunden nach der letzten Linezolid-Dosis überwacht werden, je nachdem, was zuerst eintritt. Zu den Symptomen des Serotonin-Syndroms oder NMS-ähnlicher Reaktionen gehören Hyperthermie, Starrheit, Myoklonus, autonome Instabilität und Veränderungen des mentalen Status, einschließlich extremer Erregung, die zu Delirium und Koma fortschreitet. Der Patient sollte auch auf Absetzsymptome des Antidepressivums überwacht werden (eine Beschreibung der damit verbundenen Absetzsymptome finden Sie in der Packungsbeilage der angegebenen Wirkstoffe).
Sterblichkeitsungleichgewicht in einer Untersuchungsstudie bei Patienten mit katheterbedingten Blutbahninfektionen, einschließlich Patienten mit Infektionen an der Katheterstelle
In einer offenen Studie mit schwerkranken Patienten mit intravaskulären katheterbedingten Infektionen wurde bei mit Linezolid behandelten Patienten im Vergleich zu Vancomycin/Dicloxacillin/Oxacillin ein Ungleichgewicht in der Sterblichkeit beobachtet [78/363 (21,5 %) vs. 58/363 (16,0 % ); Odds Ratio 1,426, 95 % KI 0,970, 2,098]. Obwohl die Kausalität nicht nachgewiesen wurde, trat dieses beobachtete Ungleichgewicht hauptsächlich bei mit Linezolid behandelten Patienten auf, bei denen entweder gramnegative Pathogene, gemischte gramnegative und grampositive Pathogene oder kein Pathogen zu Studienbeginn identifiziert wurden, wurde jedoch nicht bei Patienten mit beobachtet Nur grampositive Infektionen.
Linezolid ist nicht zugelassen und sollte nicht zur Behandlung von Patienten mit katheterbedingten Blutbahninfektionen oder Infektionen an der Katheterstelle angewendet werden.
Linezolid hat keine klinische Aktivität gegen gramnegative Erreger und ist nicht zur Behandlung gramnegativer Infektionen indiziert. Es ist entscheidend, dass sofort eine spezifische gramnegative Therapie eingeleitet wird, wenn ein begleitender gramnegativer Erreger dokumentiert oder vermutet wird [siehe INDIKATIONEN ].
Clostridioides difficile-assoziierter Durchfall
Clostridioides difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln, einschließlich ZYVOX 600 mg, berichtet und kann in ihrer Schwere von leichter Diarrhoe bis hin zu tödlicher Colitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficile führt.
C. difficile produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxin produzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, die nach der Anwendung antibakterieller Medikamente an Durchfall leiden.
Eine sorgfältige Anamnese ist erforderlich, da berichtet wurde, dass CDAD mehr als zwei Monate nach der Verabreichung von Antibiotika auftritt.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende Anwendung antibakterieller Arzneimittel, die nicht gegen C. difficile gerichtet sind, möglicherweise eingestellt werden. Je nach klinischer Indikation sollte ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinergänzung, eine antibakterielle medikamentöse Behandlung von C. difficile und eine chirurgische Untersuchung eingeleitet werden.
Mögliche Wechselwirkungen, die zu einer Erhöhung des Blutdrucks führen
Linezolid sollte Patienten mit unkontrolliertem Bluthochdruck, Phäochromozytom, Thyreotoxikose und/oder Patienten, die eine der folgenden Arten von Medikamenten einnehmen, nicht verabreicht werden, es sei denn, die Patienten werden auf einen möglichen Anstieg des Blutdrucks überwacht: direkt oder indirekt wirkende Sympathomimetika (z. B. Pseudoephedrin), Vasopressiva (z. B. Epinephrin, Norepinephrin), dopaminerge Mittel (z. B. Dopamin, Dobutamin) [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
Laktatazidose
Bei der Anwendung von ZYVOX wurde über Laktatazidose berichtet. In gemeldeten Fällen kam es bei Patienten zu wiederholten Episoden von Übelkeit und Erbrechen. Patienten, die während der Behandlung mit ZYVOX wiederholt Übelkeit oder Erbrechen, unerklärliche Azidose oder einen niedrigen Bikarbonatspiegel entwickeln, sollten unverzüglich medizinisch untersucht werden.
Krämpfe
Bei Patienten, die mit Linezolid behandelt wurden, wurde über Krämpfe berichtet. In einigen dieser Fälle wurde über eine Vorgeschichte von Krampfanfällen oder Risikofaktoren für Krampfanfälle berichtet.
Hypoglykämie
Postmarketing-Fälle von symptomatischer Hypoglykämie wurden bei Patienten mit Diabetes mellitus berichtet, die Insulin oder orale Antidiabetika erhielten, wenn sie mit Linezolid, einem reversiblen, nichtselektiven MAO-Hemmer, behandelt wurden. Einige MAO-Hemmer wurden mit hypoglykämischen Episoden bei Diabetikern in Verbindung gebracht, die Insulin oder hypoglykämische Mittel erhielten. Obwohl ein kausaler Zusammenhang zwischen Linezolid und Hypoglykämie nicht nachgewiesen wurde, sollten Diabetiker vor möglichen hypoglykämischen Reaktionen gewarnt werden, wenn sie mit Linezolid behandelt werden.
Wenn eine Hypoglykämie auftritt, kann eine Verringerung der Dosis von Insulin oder oralen Antidiabetika oder das Absetzen von oralen Antidiabetika, Insulin oder Linezolid erforderlich sein.
Hyponatriämie und/oder Syndrom der inadäquaten ADH-Sekretion (SIADH)
Postmarketing-Fälle von Hyponatriämie und/oder Syndrom der inadäquaten ADH-Sekretion (SIADH) wurden bei mit Linezolid behandelten Patienten beobachtet. In gemeldeten Fällen umfassten die Anzeichen und Symptome Verwirrtheit, Schläfrigkeit, allgemeine Schwäche und führten in schweren Fällen zu Atemversagen und sogar zum Tod. Kontrollieren Sie während der Einnahme von ZYVOX regelmäßig die Natriumspiegel im Serum bei älteren Patienten, bei Patienten, die Diuretika einnehmen, und bei anderen Patienten mit einem Risiko für Hyponatriämie und/oder SIADH. Wenn Anzeichen und Symptome einer Hyponatriämie und/oder SIADH auftreten, brechen Sie ZYVOX 600 mg ab und leiten Sie geeignete unterstützende Maßnahmen ein.
Risiken bei Patienten mit Phenylketonurie
Phenylalanin kann für Patienten mit Phenylketonurie (PKU) schädlich sein. ZYVOX zur oralen Suspension enthält Phenylalanin, einen Bestandteil von Aspartam. Jeweils 5 ml der 100 mg/5 ml Suspension zum Einnehmen enthalten 20 mg Phenylalanin. Bevor Sie einem Patienten mit PKU ZYVOX 600 mg zur Herstellung einer Suspension zum Einnehmen verschreiben, berücksichtigen Sie die kombinierte tägliche Menge an Phenylalanin aus allen Quellen, einschließlich ZYVOX zur Herstellung einer Suspension zum Einnehmen.
Die anderen ZYVOX-Formulierungen enthalten kein Phenylalanin.
Entwicklung arzneimittelresistenter Bakterien
Die Verschreibung von ZYVOX ohne nachgewiesene oder dringend vermutete bakterielle Infektion oder ohne prophylaktische Indikation bringt dem Patienten wahrscheinlich keinen Nutzen und erhöht das Risiko der Entwicklung arzneimittelresistenter Bakterien.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es wurden keine Lebenszeitstudien an Tieren durchgeführt, um das karzinogene Potenzial von Linezolid zu bewerten. Weder mutagenes noch klastogenes Potenzial wurde in einer Reihe von Tests festgestellt, darunter: Assays auf Mutagenität (Ames-Bakterienreversion und CHO-Zellmutation), ein in vitro-Assay zur außerplanmäßigen DNA-Synthese (UDS), ein in vitro-Chromosomenaberrationsassay in menschlichen Lymphozyten und an In-vivo-Maus-Mikronukleus-Assay.
Linezolid hatte keinen Einfluss auf die Fertilität oder Reproduktionsleistung erwachsener weiblicher Ratten, denen orale Dosen von bis zu 100 mg/kg/Tag über 14 Tage vor der Paarung bis zum 7. Trächtigkeitstag verabreicht wurden Dosen ≥ 50 mg/kg/Tag, mit Expositionen, die ungefähr gleich oder größer als die erwartete Exposition beim Menschen sind (Expositionsvergleiche basieren auf AUCs). Die reversiblen Fruchtbarkeitseffekte wurden durch eine veränderte Spermatogenese vermittelt. Betroffene Spermatiden enthielten abnormal geformte und orientierte Mitochondrien und waren nicht lebensfähig. Epithelzellhypertrophie und -hyperplasie in den Nebenhoden wurden in Verbindung mit verminderter Fertilität beobachtet. Ähnliche Nebenhodenveränderungen wurden bei Hunden nicht beobachtet.
Bei geschlechtsreifen männlichen Ratten, die dem Arzneimittel als Jungtiere ausgesetzt waren, wurde nach der Behandlung mit Linezolid während des größten Teils ihrer sexuellen Entwicklung (50 mg/kg/Tag vom 7. bis zum 36. Lebenstag und 100 mg/kg/Tag) eine leicht verringerte Fertilität beobachtet vom 37. bis zum 55. Lebenstag), mit Expositionen, die bis zu 1,7-mal höher waren als die mittleren AUCs, die bei pädiatrischen Patienten im Alter von 3 Monaten bis 11 Jahren beobachtet wurden. Eine verminderte Fertilität wurde bei kürzeren Behandlungsdauern nicht beobachtet, die einer Exposition in utero während der frühen Neugeborenenperiode (6. Tag der Schwangerschaft bis zum 5. Tag nach der Geburt), einer neonatalen Exposition (5. bis 21. Tag nach der Geburt) oder einer juvenilen Exposition (22. bis 35. Tag nach der Geburt) entsprachen ). Bei Ratten, die vom 22. bis zum 35. Tag nach der Geburt behandelt wurden, wurden reversible Verringerungen der Spermienmotilität und eine veränderte Spermienmorphologie beobachtet.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Verfügbare Daten aus veröffentlichten und Postmarketing-Fallberichten über die Anwendung von Linezolid bei schwangeren Frauen haben kein arzneimittelbedingtes Risiko für schwerwiegende Geburtsfehler, Fehlgeburten oder unerwünschte mütterliche oder fetale Folgen identifiziert. Bei Verabreichung während der Organogenese verursachte Linezolid keine Missbildungen bei Mäusen, Ratten oder Kaninchen bei maternaler Exposition, die etwa dem 6,5-Fachen (Mäuse), entsprechend (Ratten) oder dem 0,06-Fachen (Kaninchen) der klinisch-therapeutischen Exposition, basierend auf den AUCs, entspricht. Allerdings wurde bei Mäusen bei 6,5-facher Exposition gegenüber dem Menschen embryofetale Letalität beobachtet. Wenn weiblichen Ratten während der Organogenese bis zur Laktation eine Dosis verabreicht wurde, verringerte sich das postnatale Überleben der Jungtiere bei Dosen, die ungefähr der geschätzten Humanexposition, basierend auf den AUCs, entsprachen (siehe Daten ).
Das Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebenen Populationen ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2–4 % bzw. 15–20 %.
Daten
Tierdaten
Bei Mäusen wurden embryofetale Toxizitäten nur bei Dosen beobachtet, die eine maternale Toxizität verursachten (klinische Symptome und verringerte Körpergewichtszunahme). Eine orale Dosis von 450 mg/kg/Tag, verabreicht vom Gestationstag (GD) 6-16 (das 6,5-fache der geschätzten Humanexposition basierend auf AUCs) korrelierte mit einem erhöhten postimplantativen Embryotod, einschließlich totalem Wurfverlust, verringertem fötalen Körpergewicht und an erhöhte Inzidenz von Rippenknorpelfusion. Weder maternale noch embryofetale Toxizitäten wurden bei Dosen bis zu 150 mg/kg/Tag beobachtet. Fetale Missbildungen wurden nicht beobachtet.
Bei Ratten wurde eine fötale Toxizität bei oraler Verabreichung von 15 und 50 mg/kg/Tag von GD 6-17 beobachtet (Expositionen, die dem 0,22-fachen bis etwa äquivalenten der geschätzten Humanexposition entsprechen, basierend auf den AUCs). Die Wirkungen bestanden in einem verringerten fötalen Körpergewicht und einer verringerten Verknöcherung der Brustbeine, ein Befund, der häufig in Verbindung mit einem verringerten fötalen Körpergewicht beobachtet wird. Fetale Missbildungen wurden nicht beobachtet. Bei 50 mg/kg/Tag wurde maternale Toxizität in Form einer verminderten Körpergewichtszunahme beobachtet.
Bei Kaninchen trat ein reduziertes fötales Körpergewicht nur bei maternaler Toxizität (klinische Anzeichen, reduzierte Körpergewichtsentwicklung und Futteraufnahme) auf, wenn eine orale Dosis von 15 mg/kg/Tag von GD 6-20 (das 0,06-fache der geschätzte menschliche Exposition basierend auf AUCs). Fetale Missbildungen wurden nicht beobachtet.
Wenn weibliche Ratten während der Trächtigkeit und Laktation (GD 6 bis Laktationstag 20) mit 50 mg/kg/Tag (ungefähr entsprechend der geschätzten Humanexposition basierend auf den AUCs) Linezolid behandelt wurden, war das Überleben der Jungtiere an den postnatalen Tagen 1 bis 4 verringert Männliche und weibliche Jungtiere, die bis zum reproduktiven Alter reifen durften, zeigten bei der Paarung einen Anstieg des Präimplantationsverlusts.
Stillzeit
Zusammenfassung der Risiken
Linezolid ist in der Muttermilch enthalten. Basierend auf Daten aus verfügbaren veröffentlichten Fallberichten würde die tägliche Linezolid-Dosis, die der Säugling über die Muttermilch erhalten würde, etwa 6 % bis 9 % der empfohlenen therapeutischen Säuglingsdosis (10 mg/kg alle 8 Stunden) betragen. Es liegen keine Informationen über die Auswirkungen von Linezolid auf den gestillten Säugling vor; Durchfall und Erbrechen waren jedoch die häufigsten Nebenwirkungen, die in klinischen Studien bei Säuglingen berichtet wurden, die Linezolid therapeutisch erhielten [siehe NEBENWIRKUNGEN und (siehe Klinische Überlegungen). Es liegen keine Informationen über die Auswirkungen von Linezolid auf die Milchproduktion vor. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an Linezolid und möglichen Nebenwirkungen von Linezolid oder der zugrunde liegenden Erkrankung der Mutter auf das gestillte Kind berücksichtigt werden.
Klinische Überlegungen
Raten Sie stillenden Frauen, einen gestillten Säugling auf Durchfall und Erbrechen zu überwachen.
Weibchen und Männchen mit reproduktivem Potenzial
Unfruchtbarkeit
Männchen
Basierend auf Ergebnissen aus Studien an Ratten kann ZYVOX die Fertilität bei männlichen Patienten reversibel beeinträchtigen [vgl Nichtklinische Toxikologie )].
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von ZYVOX 600 mg zur Behandlung von pädiatrischen Patienten mit den folgenden Infektionen werden durch Belege aus angemessenen und gut kontrollierten Studien an Erwachsenen, pharmakokinetische Daten bei pädiatrischen Patienten und zusätzliche Daten aus einer Vergleichs-kontrollierten Studie mit grampositiven Patienten gestützt Infektionen bei pädiatrischen Patienten im Alter von der Geburt bis zum 11. Lebensjahr [siehe INDIKATIONEN , KLINISCHE PHARMAKOLOGIE und Klinische Studien ]:
Die Sicherheit und Wirksamkeit von ZYVOX 600 mg zur Behandlung von pädiatrischen Patienten mit der folgenden Infektion wurden in einer Vergleichs-kontrollierten Studie bei pädiatrischen Patienten im Alter von 5 bis 17 Jahren nachgewiesen [siehe Klinische Studien ]:
Pharmakokinetische Daten, die bei pädiatrischen Patienten mit ventrikuloperitonealen Shunts erhoben wurden, zeigten unterschiedliche Konzentrationen von Linezolid in der Zerebrospinalflüssigkeit (CSF) nach Einzel- und Mehrfachdosierung von Linezolid; therapeutische Konzentrationen wurden im Liquor nicht durchgängig erreicht oder aufrechterhalten. Daher wird die Anwendung von Linezolid zur empirischen Behandlung von pädiatrischen Patienten mit Infektionen des zentralen Nervensystems nicht empfohlen.
Die Pharmakokinetik von Linezolid wurde bei pädiatrischen Patienten von der Geburt bis zum Alter von 17 Jahren untersucht. Im Allgemeinen nimmt die gewichtsbasierte Clearance von Linezolid mit zunehmendem Alter pädiatrischer Patienten allmählich ab. Bei Frühgeborenen (Gestationsalter DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
Nach begrenzter klinischer Erfahrung kam es bei 5 von 6 (83 %) pädiatrischen Patienten mit Infektionen durch grampositive Pathogene mit einer minimalen Hemmkonzentration (MHK) von 4 µg/ml, die mit ZYVOX 600 mg behandelt wurden, zu einer klinischen Heilung. Allerdings weisen pädiatrische Patienten im Vergleich zu Erwachsenen eine größere Variabilität in der Linezolid-Clearance und der systemischen Exposition (AUC) auf. Bei pädiatrischen Patienten mit einem suboptimalen klinischen Ansprechen, insbesondere solchen mit Pathogenen mit einer MHK von 4 µg/ml, sollten bei der Beurteilung des klinischen Ansprechens eine niedrigere systemische Exposition, Ort und Schweregrad der Infektion und die zugrunde liegende Erkrankung berücksichtigt werden [siehe KLINISCHE PHARMAKOLOGIE und DOSIERUNG UND ANWENDUNG ].
Geriatrische Verwendung
Von den 2.046 Patienten, die mit ZYVOX 600 mg in vergleichskontrollierten klinischen Studien der Phase 3 behandelt wurden, waren 589 (29 %) 65 Jahre oder älter und 253 (12 %) waren 75 Jahre oder älter. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Patienten und jüngeren Patienten beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
ÜBERDOSIS
Im Falle einer Überdosierung wird eine unterstützende Behandlung mit Aufrechterhaltung der glomerulären Filtration empfohlen. Eine Hämodialyse kann eine schnellere Elimination von Linezolid erleichtern. In einer klinischen Phase-1-Studie wurden etwa 30 % einer Linezolid-Dosis während einer 3-stündigen Hämodialysesitzung entfernt, die 3 Stunden nach Verabreichung der Linezolid-Dosis begann. Es liegen keine Daten zur Entfernung von Linezolid mit Peritonealdialyse oder Hämoperfusion vor. Klinische Anzeichen einer akuten Toxizität bei Tieren waren verringerte Aktivität und Ataxie bei Ratten und Erbrechen und Zittern bei Hunden, die mit 3.000 mg/kg/Tag bzw. 2.000 mg/kg/Tag behandelt wurden.
KONTRAINDIKATIONEN
Überempfindlichkeit
ZYVOX-Formulierungen sind kontraindiziert für die Anwendung bei Patienten mit bekannter Überempfindlichkeit gegen Linezolid oder einen der anderen Produktbestandteile.
Monoaminoxidase-Inhibitoren
Linezolid sollte nicht bei Patienten angewendet werden, die Arzneimittel einnehmen, die die Monoaminoxidasen A oder B hemmen (z. B. Phenelzin, Isocarboxazid), oder innerhalb von zwei Wochen nach der Einnahme eines solchen Arzneimittels.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
ZYVOX ist ein antibakterielles Medikament [siehe Mikrobiologie ].
Pharmakodynamik
In einer randomisierten, positiv- und Placebo-kontrollierten gründlichen Crossover-QT-Studie erhielten 40 gesunde Probanden eine 600-mg-Einzeldosis ZYVOX über eine 1-stündige IV-Infusion, eine 1.200-mg-Einzeldosis ZYVOX über eine 1-stündige IV-Infusion, Placebo und a orale Einzeldosis der Positivkontrolle. Sowohl bei der 600-mg- als auch bei der 1.200-mg-Dosierung von ZYVOX 600 mg wurde keine signifikante Wirkung auf das QTc-Intervall bei der maximalen Plasmakonzentration oder zu irgendeinem anderen Zeitpunkt festgestellt.
Pharmakokinetik
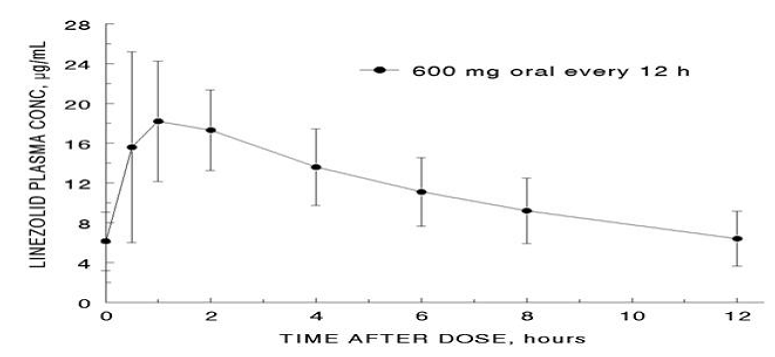
Die mittleren pharmakokinetischen Parameter von Linezolid bei Erwachsenen nach einmaliger und mehrfacher oraler und intravenöser Gabe sind in Tabelle 8 zusammengefasst. Die Plasmakonzentrationen von Linezolid im Steady State nach oraler Gabe von 600 mg alle 12 Stunden sind in Abbildung 1 dargestellt.
Abbildung 1. Plasmakonzentrationen von Linezolid bei Erwachsenen im Steady-State nach oraler Gabe alle 12 Stunden (Mittelwert ± Standardabweichung, n=16)
Absorption
Linezolid wird nach oraler Gabe weitgehend resorbiert. Maximale Plasmakonzentrationen werden etwa 1 bis 2 Stunden nach der Einnahme erreicht, und die absolute Bioverfügbarkeit beträgt etwa 100 %. Daher kann Linezolid ohne Dosisanpassung oral oder intravenös verabreicht werden.
Linezolid kann unabhängig vom Zeitpunkt der Mahlzeiten verabreicht werden. Die Zeit bis zum Erreichen der maximalen Konzentration verzögert sich von 1,5 Stunden auf 2,2 Stunden und Cmax wird um etwa 17 % verringert, wenn fettreiche Nahrung mit Linezolid gegeben wird. Die als AUC0-∞ gemessene Gesamtexposition ist jedoch unter beiden Bedingungen ähnlich.
Verteilung
Pharmakokinetische Studien an Tieren und Menschen haben gezeigt, dass sich Linezolid leicht in gut durchblutete Gewebe verteilt. Die Plasmaproteinbindung von Linezolid beträgt etwa 31 % und ist konzentrationsunabhängig. Das Verteilungsvolumen von Linezolid im Steady State betrug bei gesunden erwachsenen Probanden durchschnittlich 40 bis 50 Liter.
Linezolid-Konzentrationen wurden in verschiedenen Flüssigkeiten einer begrenzten Anzahl von Probanden in Phase-1-Studien mit Probanden nach mehrfacher Gabe von Linezolid bestimmt. Das Verhältnis von Linezolid im Speichel zu Plasma betrug 1,2 zu 1 und das Verhältnis von Linezolid in Schweiß zu Plasma 0,55 zu 1.
Stoffwechsel
Linezolid wird hauptsächlich durch Oxidation des Morpholinrings metabolisiert, was zu zwei inaktiven ringgeöffneten Carbonsäure-Metaboliten führt: dem Aminoethoxyessigsäure-Metaboliten (A) und dem Hydroxyethylglycin-Metaboliten (B). Es wird angenommen, dass die Bildung von Metabolit A über einen enzymatischen Weg gebildet wird, während Metabolit B durch einen nicht-enzymatischen chemischen Oxidationsmechanismus in vitro vermittelt wird. In-vitro-Studien haben gezeigt, dass Linezolid nur minimal metabolisiert wird und möglicherweise durch humanes Cytochrom P450 vermittelt wird. Der Stoffwechselweg von Linezolid ist jedoch noch nicht vollständig aufgeklärt.
Ausscheidung
Die nicht renale Clearance macht etwa 65 % der Gesamtclearance von Linezolid aus. Unter Steady-State-Bedingungen erscheinen etwa 30 % der Dosis im Urin als Linezolid, 40 % als Metabolit B und 10 % als Metabolit A. Die mittlere renale Clearance von Linezolid beträgt 40 ml/min, was auf eine tubuläre Netto-Reabsorption hindeutet. Im Stuhl tritt praktisch kein Linezolid auf, während etwa 6 % der Dosis als Metabolit B und 3 % als Metabolit A im Stuhl erscheinen.
Bei steigenden Linezolid-Dosen wurde eine geringfügige Nichtlinearität der Clearance beobachtet, was auf die geringere renale und nicht-renale Clearance von Linezolid bei höheren Konzentrationen zurückzuführen zu sein scheint. Der Unterschied in der Clearance war jedoch gering und spiegelte sich nicht in der scheinbaren Eliminationshalbwertszeit wider.
Spezifische Populationen
Geriatrische Patienten
Die Pharmakokinetik von Linezolid ist bei älteren Patienten (65 Jahre oder älter) nicht signifikant verändert. Daher ist eine Dosisanpassung für geriatrische Patienten nicht erforderlich.
Pädiatrische Patienten
Die Pharmakokinetik von Linezolid nach intravenöser Einzeldosis wurde bei pädiatrischen Patienten im Alter von der Geburt bis zum vollendeten 17. Lebensjahr (einschließlich Frühgeborene und Reifgeborene), bei gesunden jugendlichen Probanden im Alter von 12 bis 17 Jahren und bei pädiatrischen Patienten im Alter von 12 bis 17 Jahren untersucht im Alter von 1 Woche bis 12 Jahren. Die pharmakokinetischen Parameter von Linezolid sind in Tabelle 9 für die untersuchten pädiatrischen Populationen und gesunden erwachsenen Probanden nach Verabreichung einer intravenösen Einzeldosis zusammengefasst.
Die Cmax und das Verteilungsvolumen (Vss) von Linezolid sind bei pädiatrischen Patienten unabhängig vom Alter ähnlich. Die Plasmaclearance von Linezolid variiert jedoch in Abhängigkeit vom Alter. Mit Ausnahme von Frühgeborenen im Alter von weniger als einer Woche ist die gewichtsbasierte Clearance in den jüngsten Altersgruppen von
Ähnliche mittlere tägliche AUC-Werte wurden bei pädiatrischen Patienten von der Geburt bis zum Alter von 11 Jahren beobachtet, die alle 8 Stunden behandelt wurden, im Vergleich zu Jugendlichen oder Erwachsenen, die alle 12 Stunden behandelt wurden. Daher sollte die Dosierung für pädiatrische Patienten bis zum Alter von 11 Jahren 10 mg/kg alle 8 Stunden betragen. Pädiatrische Patienten ab 12 Jahren sollten alle 12 Stunden 600 mg erhalten [siehe DOSIERUNG UND ANWENDUNG ].
Geschlecht
Frauen haben ein etwas geringeres Verteilungsvolumen von Linezolid als Männer. Die Plasmakonzentrationen sind bei Frauen höher als bei Männern, was teilweise auf Unterschiede im Körpergewicht zurückzuführen ist. Nach einer Dosis von 600 mg ist die mittlere orale Clearance bei Frauen etwa 38 % niedriger als bei Männern. Es gibt jedoch keine signifikanten geschlechtsspezifischen Unterschiede bei der mittleren scheinbaren Eliminationskonstante oder der Halbwertszeit. Daher ist nicht zu erwarten, dass die Arzneimittelexposition bei Frauen wesentlich über ein Niveau ansteigt, von dem bekannt ist, dass es gut vertragen wird. Daher scheint eine Dosisanpassung nach Geschlecht nicht erforderlich zu sein.
Nierenfunktionsstörung
Die Pharmakokinetik der Muttersubstanz Linezolid ist bei Patienten mit eingeschränkter Nierenfunktion in keinem Grad verändert; Die beiden Hauptmetaboliten von Linezolid akkumulieren jedoch bei Patienten mit eingeschränkter Nierenfunktion, wobei die Akkumulationsmenge mit der Schwere der Nierenfunktionsstörung zunimmt (siehe Tabelle 10). Die Pharmakokinetik von Linezolid und seinen beiden Metaboliten wurde auch bei Patienten mit terminaler Niereninsuffizienz (ESRD), die eine Hämodialyse erhielten, untersucht. In der ESRD-Studie wurde 14 Patienten 14,5 Tage lang alle 12 Stunden 600 mg Linezolid verabreicht (siehe Tabelle 11). Da unabhängig von der Nierenfunktion ähnliche Plasmakonzentrationen von Linezolid erreicht werden, wird für Patienten mit eingeschränkter Nierenfunktion keine Dosisanpassung empfohlen. Da jedoch keine Informationen über die klinische Bedeutung der Akkumulation der primären Metaboliten vorliegen, sollte die Anwendung von Linezolid bei Patienten mit eingeschränkter Nierenfunktion gegen die potenziellen Risiken einer Akkumulation dieser Metaboliten abgewogen werden. Sowohl Linezolid als auch die beiden Metaboliten werden durch Hämodialyse eliminiert. Es liegen keine Informationen über die Auswirkungen der Peritonealdialyse auf die Pharmakokinetik von Linezolid vor. Ungefähr 30 % einer Dosis wurden in einer 3-stündigen Hämodialysesitzung ausgeschieden, die 3 Stunden nach Verabreichung der Linezolid-Dosis begann; Daher sollte Linezolid nach der Hämodialyse verabreicht werden.
Leberfunktionsstörung
Die Pharmakokinetik von Linezolid ist bei Patienten (n = 7) mit leichter bis mittelschwerer Leberfunktionsstörung (Child-Pugh-Klasse A oder B) nicht verändert. Auf der Grundlage der verfügbaren Informationen wird für Patienten mit leichter bis mittelschwerer Leberfunktionsstörung keine Dosisanpassung empfohlen. Die Pharmakokinetik von Linezolid bei Patienten mit schwerer Leberfunktionsstörung wurde nicht untersucht.
Wechselwirkungen mit anderen Medikamenten
Medikamente, die durch Cytochrom P450 metabolisiert werden
Linezolid ist kein Induktor von Cytochrom P450 (CYP450) bei Ratten. Darüber hinaus hemmt Linezolid nicht die Aktivitäten klinisch signifikanter humaner CYP-Isoformen (z. B. 1A2, 2C9, 2C19, 2D6, 2E1, 3A4). Daher ist nicht zu erwarten, dass Linezolid die Pharmakokinetik anderer Arzneimittel, die durch diese Hauptenzyme metabolisiert werden, beeinflusst. Die gleichzeitige Verabreichung von Linezolid verändert die pharmakokinetischen Eigenschaften von (S)-Warfarin, das weitgehend durch CYP2C9 metabolisiert wird, nicht wesentlich. Arzneimittel wie Warfarin und Phenytoin, die CYP2C9-Substrate sind, können zusammen mit Linezolid ohne Änderung des Dosierungsschemas verabreicht werden.
Antibakterielle Medikamente
Aztreonam: Die Pharmakokinetik von Linezolid oder Aztreonam wird bei gemeinsamer Anwendung nicht verändert.
Gentamicin: Die Pharmakokinetik von Linezolid oder Gentamicin wird bei gemeinsamer Verabreichung nicht verändert.
Antioxidantien
Das Potenzial für Arzneimittelwechselwirkungen mit Linezolid und den Antioxidantien Vitamin C und Vitamin E wurde an gesunden Probanden untersucht. Den Probanden wurde an Tag 1 eine orale Dosis von 600 mg Linezolid und an Tag 8 eine weitere Dosis von 600 mg Linezolid verabreicht. An den Tagen 2–9 erhielten die Probanden entweder Vitamin C (1.000 mg/Tag) oder Vitamin E (800 Tag). Die AUC0-∞ von Linezolid stieg um 2,3 % bei gleichzeitiger Anwendung mit Vitamin C und um 10,9 % bei gleichzeitiger Anwendung mit Vitamin E. Bei gleichzeitiger Anwendung mit Vitamin C oder Vitamin E wird keine Dosisanpassung von Linezolid empfohlen.
Starke CYP 3A4-Induktoren
Rifampin
Die Wirkung von Rifampin auf die Pharmakokinetik von Linezolid wurde in einer Studie mit 16 gesunden erwachsenen Männern untersucht. Freiwillige erhielten 600 mg Linezolid oral zweimal täglich für 5 Dosen mit und ohne Rifampin 600 mg einmal täglich für 8 Tage. Die gleichzeitige Anwendung von Rifampin mit Linezolid führte zu einer Abnahme der Cmax von Linezolid um 21 % [90 % KI, 15 % – 27 %] und einer Abnahme der Linezolid AUC0-12 um 32 % [90 % KI, 27 % – 37 %]. Die klinische Bedeutung dieser Wechselwirkung ist nicht bekannt. Der Mechanismus dieser Wechselwirkung ist noch nicht vollständig geklärt und könnte mit der Induktion von Leberenzymen zusammenhängen. Andere starke Induktoren von Leberenzymen (z. B. Carbamazepin, Phenytoin, Phenobarbital) könnten eine ähnliche oder geringere Verringerung der Linezolid-Exposition verursachen.
Hemmung der Monoaminoxidase
Linezolid ist ein reversibler, nicht selektiver Inhibitor der Monoaminoxidase. Daher hat Linezolid das Potenzial für Wechselwirkungen mit adrenergen und serotonergen Wirkstoffen.
Adrenerge Wirkstoffe
Bei einigen Personen, die ZYVOX 600 mg erhalten, kann es zu einer reversiblen Verstärkung der pressorischen Reaktion auf indirekt wirkende Sympathomimetika, Vasopressoren oder dopaminerge Mittel kommen. Häufig verwendete Medikamente wie Phenylpropanolamin und Pseudoephedrin wurden speziell untersucht. Anfangsdosen von adrenergen Wirkstoffen wie Dopamin oder Epinephrin sollten reduziert und titriert werden, um die gewünschte Wirkung zu erzielen.
Tyramin
Bei gesunden erwachsenen Probanden, die Linezolid- und Tyramin-Dosen von mehr als 100 mg erhielten, wurde eine signifikante blutdrucksteigernde Reaktion beobachtet. Daher müssen Patienten, die Linezolid erhalten, den Verzehr großer Mengen von Nahrungsmitteln oder Getränken mit hohem Tyramingehalt vermeiden [siehe INFORMATIONEN ZUM PATIENTEN ].
Pseudoephedrin-HCl oder Phenylpropanolamin-HCl
Eine reversible Verstärkung der pressorischen Reaktion von entweder Pseudoephedrin-HCl (PSE) oder Phenylpropanolamin-HCl (PPA) wird beobachtet, wenn Linezolid gesunden normotensiven Probanden verabreicht wird [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Eine ähnliche Studie wurde bei Bluthochdruckpatienten nicht durchgeführt. Die Wechselwirkungsstudien, die bei normotensiven Probanden durchgeführt wurden, untersuchten die Auswirkungen von Placebo, PPA oder PSE allein, Linezolid allein und der Kombination von Linezolid im Steady-State (600 mg alle 12 Stunden für 3 Tage) mit zwei Dosen PPA ( 25 mg) oder PSE (60 mg) im Abstand von 4 Stunden. Die Herzfrequenz wurde durch keine der Behandlungen beeinflusst. Der Blutdruck wurde mit beiden Kombinationsbehandlungen erhöht. Maximale Blutdruckwerte wurden 2 bis 3 Stunden nach der zweiten PPA- oder PSE-Dosis beobachtet und kehrten 2 bis 3 Stunden nach dem Höhepunkt auf die Grundlinie zurück. Die Ergebnisse der PPA-Studie folgen und zeigen den mittleren (und Bereich) maximalen systolischen Blutdruck in mm Hg: Placebo = 121 (103 bis 158); Linezolid allein = 120 (107 bis 135); PPA allein = 125 (106 bis 139); PPA mit Linezolid = 147 (129 bis 176). Die Ergebnisse der PSE-Studie waren denen der PPA-Studie ähnlich. Der mittlere maximale Anstieg des systolischen Blutdrucks gegenüber dem Ausgangswert betrug 32 mm Hg (Bereich: 20 – 52 mm Hg) und 38 mm Hg (Bereich: 18 – 79 mm Hg) bei gleichzeitiger Anwendung von Linezolid mit Pseudoephedrin bzw. Phenylpropanolamin.
Serotonerge Wirkstoffe
Dextromethorphan
Die mögliche Arzneimittelwechselwirkung mit Dextromethorphan wurde an gesunden Probanden untersucht. Den Probanden wurde Dextromethorphan (zwei 20-mg-Dosen im Abstand von 4 Stunden) mit oder ohne Linezolid verabreicht. Bei gesunden Probanden, die Linezolid und Dextromethorphan erhielten, wurden keine Auswirkungen des Serotonin-Syndroms (Verwirrtheit, Delirium, Unruhe, Zittern, Erröten, Diaphorese, Hyperpyrexie) beobachtet.
Mikrobiologie
Wirkmechanismus
Linezolid ist ein synthetisches antibakterielles Mittel der Klasse der Oxazolidinone, das klinischen Nutzen bei der Behandlung von Infektionen hat, die durch aerobe grampositive Bakterien verursacht werden. Das In-vitro-Wirkungsspektrum von Linezolid umfasst auch bestimmte gramnegative Bakterien und anaerobe Bakterien. Linezolid bindet an eine Stelle der bakteriellen 23S-ribosomalen RNA der 50S-Untereinheit und verhindert die Bildung eines funktionellen 70S-Initiationskomplexes, der für die bakterielle Reproduktion unerlässlich ist. Die Ergebnisse von Timekill-Studien haben gezeigt, dass Linezolid bakteriostatisch gegen Enterokokken und Staphylokokken wirkt. Bei Streptokokken erwies sich Linezolid bei der Mehrzahl der Isolate als bakterizid.
Widerstand
In-vitro-Studien haben gezeigt, dass Punktmutationen in der 23S-rRNA mit Linezolid-Resistenz assoziiert sind. Es wurden Berichte darüber veröffentlicht, dass Vancomycin-resistenter Enterococcus faecium während seiner klinischen Anwendung gegen Linezolid resistent wurde. Es liegen Berichte vor, dass Staphylococcus aureus (Methicillin-resistent) während der klinischen Anwendung eine Resistenz gegen Linezolid entwickelt hat. Die Linezolid-Resistenz in diesen Organismen ist mit einer Punktmutation in der 23S-rRNA (Substitution von Guanin durch Thymin an Position 2576) des Organismus verbunden. Organismen, die aufgrund von Mutationen in chromosomalen Genen, die für 23S-rRNA oder ribosomale Proteine (L3 und L4) kodieren, gegen Oxazolidinone resistent sind, sind im Allgemeinen kreuzresistent gegen Linezolid. Es wurde auch über eine durch das Enzym Methyltransferase vermittelte Linezolid-Resistenz bei Staphylokokken berichtet. Diese Resistenz wird durch das cfr (Chloramphenicol-Florfenicol)-Gen vermittelt, das sich auf einem zwischen Staphylokokken übertragbaren Plasmid befindet.
Wechselwirkung mit anderen antimikrobiellen Arzneimitteln
In-vitro-Studien haben eine Additivität oder Indifferenz zwischen Linezolid und Vancomycin, Gentamicin, Rifampin, Imipenem-Cilastatin, Aztreonam, Ampicillin oder Streptomycin gezeigt.
Es wurde gezeigt, dass Linezolid gegen die meisten Isolate der folgenden Mikroorganismen aktiv ist, sowohl in vitro als auch bei klinischen Infektionen [vgl INDIKATIONEN ].
Gram-positive Bakterien
Enterococcus faecium (nur Vancomycin-resistente Isolate) Staphylococcus aureus (einschließlich Methicillin-resistente Isolate) Streptococcus agalactiae Streptococcus pneumoniae Streptococcus pyogenes
Die folgenden In-vitro-Daten sind verfügbar, ihre klinische Bedeutung ist jedoch nicht bekannt. Mehr als 90 % der folgenden Bakterien weisen eine In-vitro-MHK auf, die kleiner oder gleich dem Linezolid-empfindlichen Grenzwert für Organismen ähnlicher Gattung ist. Die Sicherheit und Wirksamkeit von Linezolid bei der Behandlung klinischer Infektionen durch diese Bakterien wurden nicht in angemessenen und gut kontrollierten klinischen Studien nachgewiesen.
Gram-positive Bakterien
Enterococcus faecalis (einschließlich Vancomycin-resistente Isolate) Enterococcus faecium (Vancomycin-empfindliche Isolate) Staphylococcus epidermidis (einschließlich Methicillin-resistente Isolate) Staphylococcus haemolyticus Streptokokken der Viridans-Gruppe
Gramnegative Bakterien
Pasteurella multocida
Empfindlichkeitsprüfung
Spezifische Informationen zu den Interpretationskriterien von Empfindlichkeitstests und zugehörigen Testmethoden und Qualitätskontrollstandards, die von der FDA für dieses Medikament anerkannt sind, finden Sie unter: https://www.fda.gov/STIC.
Tiertoxikologie und/oder Pharmakologie
Die Zielorgane der Linezolid-Toxizität waren bei juvenilen und erwachsenen Ratten und Hunden ähnlich. In Tierstudien wurde eine dosis- und zeitabhängige Myelosuppression beobachtet, die durch Hypozellularität/verringerte Hämatopoese des Knochenmarks, verringerte extramedulläre Hämatopoese in Milz und Leber und verringerte Spiegel zirkulierender Erythrozyten, Leukozyten und Blutplättchen belegt wurde. Im Thymus, in den Lymphknoten und in der Milz trat eine lymphoide Depletion auf. Im Allgemeinen waren die lymphoiden Befunde mit Anorexie, Gewichtsverlust und Unterdrückung der Körpergewichtszunahme verbunden, was möglicherweise zu den beobachteten Wirkungen beigetragen hat.
Bei Ratten, denen Linezolid 6 Monate lang oral verabreicht wurde, wurde eine nicht reversible, minimale bis leichte axonale Degeneration der Ischiasnerven bei 80 mg/kg/Tag beobachtet; bei 1 Mann wurde bei dieser Dosisstufe bei einer 3-Monats-Zwischensektion ebenfalls eine minimale Degeneration des Ischiasnervs beobachtet. Es wurde eine empfindliche morphologische Bewertung von perfusionsfixierten Geweben durchgeführt, um Anzeichen einer Degeneration des Sehnervs zu untersuchen. Eine minimale bis mäßige Degeneration des Sehnervs war bei 2 männlichen Ratten nach 6-monatiger Verabreichung offensichtlich, aber die direkte Beziehung zum Medikament war aufgrund der akuten Natur des Befundes und seiner asymmetrischen Verteilung nicht eindeutig. Die beobachtete Nervendegeneration war mikroskopisch vergleichbar mit der spontanen unilateralen Degeneration des Sehnervs, die bei alternden Ratten berichtet wurde, und kann eine Verschlimmerung einer gemeinsamen Hintergrundveränderung sein.
Diese Wirkungen wurden bei Expositionsniveaus beobachtet, die mit denen vergleichbar sind, die bei einigen menschlichen Probanden beobachtet wurden. Die hämatopoetischen und lymphoiden Wirkungen waren reversibel, obwohl in einigen Studien die Umkehrung innerhalb der Dauer der Erholungsphase unvollständig war.
Klinische Studien
Erwachsene
Nosokomiale Pneumonie
Erwachsene Patienten mit klinisch und radiologisch dokumentierter nosokomialer Pneumonie wurden in eine randomisierte, multizentrische, doppelblinde Studie aufgenommen. Die Patienten wurden 7 bis 21 Tage lang behandelt. Eine Gruppe erhielt alle 12 Stunden 600 mg ZYVOX i.v. Injektion, und die andere Gruppe erhielt alle 12 Stunden 1 g Vancomycin intravenös. Beide Gruppen erhielten gleichzeitig Aztreonam (1 bis 2 g alle 8 Stunden intravenös), das bei klinischer Indikation fortgesetzt werden konnte. An der Studie nahmen 203 mit Linezolid und 193 mit Vancomycin behandelte Patienten teil. Einhundertzweiundzwanzig (60 %) mit Linezolid behandelte Patienten und 103 (53 %) mit Vancomycin behandelte Patienten waren klinisch auswertbar. Die Heilungsraten bei klinisch auswertbaren Patienten betrugen 57 % bei mit Linezolid behandelten Patienten und 60 % bei mit Vancomycin behandelten Patienten. Die Heilungsraten bei klinisch auswertbaren Patienten mit beatmungsassoziierter Pneumonie betrugen 47 % bei mit Linezolid behandelten Patienten und 40 % bei mit Vancomycin behandelten Patienten. Eine modifizierte Intent-to-treat (MITT)-Analyse von 94 mit Linezolid behandelten Patienten und 83 mit Vancomycin behandelten Patienten umfasste Patienten, bei denen vor der Behandlung ein Pathogen isoliert worden war. Die Heilungsraten in der MITT-Analyse betrugen 57 % bei den mit Linezolid behandelten Patienten und 46 % bei den mit Vancomycin behandelten Patienten. Die Heilungsraten nach Erregern für mikrobiologisch auswertbare Patienten sind in Tabelle 12 dargestellt.
Komplizierte Haut- und Hautstrukturinfektionen
Erwachsene Patienten mit klinisch dokumentierten komplizierten Haut- und Hautstrukturinfektionen wurden in eine randomisierte, multizentrische, doppelblinde Double-Dummy-Studie aufgenommen, in der intravenös verabreichte Studienmedikationen gefolgt von oral verabreichten Medikamenten für insgesamt 10 bis 21 Behandlungstage verglichen wurden. Eine Patientengruppe erhielt alle 12 Stunden 600 mg ZYVOX IV-Injektion, gefolgt von 600 mg ZYVOX-Tabletten alle 12 Stunden; die andere Gruppe erhielt Oxacillin 2 g alle 6 Stunden intravenös, gefolgt von Dicloxacillin 500 mg alle 6 Stunden oral. Patienten können Aztreonam begleitend erhalten, wenn dies klinisch indiziert ist. An der Studie nahmen 400 mit Linezolid und 419 mit Oxacillin behandelte Patienten teil. Zweihundertfünfundvierzig (61 %) mit Linezolid behandelte Patienten und 242 (58 %) mit Oxacillin behandelte Patienten waren klinisch auswertbar. Die Heilungsraten bei klinisch auswertbaren Patienten betrugen 90 % bei mit Linezolid behandelten Patienten und 85 % bei mit Oxacillin behandelten Patienten. Eine modifizierte Intent-to-treat (MITT)-Analyse von 316 mit Linezolid behandelten Patienten und 313 mit Oxacillin behandelten Patienten schloss Probanden ein, die alle Kriterien für die Aufnahme in die Studie erfüllten. Die Heilungsraten in der MITT-Analyse betrugen 86 % bei den mit Linezolid behandelten Patienten und 82 % bei den mit Oxacillin behandelten Patienten. Die Heilungsraten nach Erregern für mikrobiologisch auswertbare Patienten sind in Tabelle 13 dargestellt.
Eine separate Studie lieferte zusätzliche Erfahrungen mit der Anwendung von ZYVOX bei der Behandlung von Infektionen mit Methicillin-resistentem Staphylococcus aureus (MRSA). Dies war eine randomisierte, unverblindete Studie mit erwachsenen Krankenhauspatienten mit dokumentierter oder vermuteter MRSA-Infektion.
Eine Patientengruppe erhielt alle 12 Stunden 600 mg ZYVOX i.v. Injektion, gefolgt von 600 mg ZYVOX Tabletten alle 12 Stunden. Die andere Patientengruppe erhielt Vancomycin 1 g alle 12 Stunden intravenös. Beide Gruppen wurden 7 bis 28 Tage lang behandelt und konnten bei klinischer Indikation gleichzeitig Aztreonam oder Gentamicin erhalten. Die Heilungsraten bei mikrobiologisch auswertbaren Patienten mit MRSA-Haut- und Hautstrukturinfektionen betrugen 26/33 (79 %) für die mit Linezolid behandelten Patienten und 24/33 (73 %) für die mit Vancomycin behandelten Patienten.
Diabetische Fußinfektionen
Erwachsene Diabetiker mit klinisch dokumentierten komplizierten Haut- und Hautstrukturinfektionen („diabetische Fußinfektionen“) wurden in eine randomisierte (Verhältnis 2:1), multizentrische, offene Studie aufgenommen, in der die intravenös oder oral verabreichten Studienmedikationen insgesamt verglichen wurden 14 bis 28 Tage Behandlung. Eine Patientengruppe erhielt ZYVOX 600 mg alle 12 Stunden intravenös oder oral; die andere Gruppe erhielt Ampicillin/Sulbactam 1,5–3 g intravenös oder Amoxicillin/Clavulanat 500–875 mg alle 8–12 Stunden oral. In Ländern, in denen Ampicillin/Sulbactam nicht vermarktet wird, wurde Amoxicillin/Clavulanat 500 mg bis 2 g alle 6 Stunden für das intravenöse Regime verwendet. Patienten in der Vergleichsgruppe konnten auch mit Vancomycin 1 g alle 12 Stunden intravenös behandelt werden, wenn MRSA aus der Fußinfektion isoliert wurde. Patienten in beiden Behandlungsgruppen, bei denen gramnegative Bazillen aus der Infektionsstelle isoliert wurden, konnten auch Aztreonam 1 bis 2 g alle 8-12 Stunden intravenös erhalten. Alle Patienten kamen für geeignete ergänzende Behandlungsmethoden wie Débridement und Entlastung in Frage, wie sie typischerweise bei der Behandlung von Infektionen des diabetischen Fußes erforderlich sind, und die meisten Patienten erhielten diese Behandlungen. In der Intent-to-treat (ITT)-Studienpopulation befanden sich 241 mit Linezolid und 120 mit einem Vergleichspräparat behandelte Patienten. Zweihundertzwölf (86 %) mit Linezolid behandelte Patienten und 105 (85 %) mit einem Vergleichspräparat behandelte Patienten waren klinisch auswertbar. In der ITT-Population betrugen die Heilungsraten 68,5 % (165/241) bei den mit Linezolid behandelten Patienten und 64 % (77/120) bei den mit Vergleichspräparaten behandelten Patienten, wobei diejenigen mit unbestimmten und fehlenden Ergebnissen als Versagen galten. Die Heilungsraten bei den klinisch auswertbaren Patienten (ohne Patienten mit unbestimmtem und fehlendem Ausgang) betrugen 83 % (159/192) bzw. 73 % (74/101) bei den mit Linezolid bzw. Vergleichspräparat behandelten Patienten. Eine kritische Post-hoc-Analyse konzentrierte sich auf 121 mit Linezolid und 60 mit einem Vergleichspräparat behandelte Patienten, bei denen ein grampositiver Erreger aus der Infektionsstelle oder aus dem Blut isoliert wurde, die weniger Anzeichen einer zugrunde liegenden Osteomyelitis aufwiesen als die gesamte Studienpopulation, und die keine verbotenen antimikrobiellen Mittel erhalten haben. Basierend auf dieser Analyse betrugen die Heilungsraten 71 % (86/121) bei den mit Linezolid behandelten Patienten und 63 % (38/60) bei den mit dem Vergleichspräparat behandelten Patienten. Keine der oben genannten Analysen wurde für die Verwendung von Zusatztherapien angepasst. Die Heilungsraten nach Erregern für mikrobiologisch auswertbare Patienten sind in Tabelle 14 dargestellt.
Vancomycin-resistente Enterokokken-Infektionen
Erwachsene Patienten mit nachgewiesener oder vermuteter Vancomycin-resistenter Enterokokkeninfektion wurden in eine randomisierte, multizentrische Doppelblindstudie aufgenommen, in der eine hohe ZYVOX-Dosis (600 mg) mit einer niedrigen ZYVOX-Dosis (200 mg) verglichen wurde, die alle 12 Stunden gegeben wurde intravenös (IV) oder oral für 7 bis 28 Tage. Die Patienten könnten gleichzeitig Aztreonam oder Aminoglykoside erhalten. 79 Patienten wurden randomisiert auf hochdosiertes Linezolid und 66 auf niedrigdosiertes Linezolid randomisiert. Die Intent-to-treat (ITT)-Population mit dokumentierter Vancomycin-resistenter Enterokokken-Infektion zu Studienbeginn bestand aus 65 Patienten im Hochdosis-Arm und 52 im Niedrigdosis-Arm.
Die Heilungsraten für die ITT-Population mit dokumentierter Vancomycin-resistenter Enterokokkeninfektion zu Studienbeginn sind in Tabelle 15 nach Infektionsquelle dargestellt. Diese Heilungsraten beinhalten keine Patienten mit fehlenden oder unbestimmten Ergebnissen. Die Heilungsrate war im Hochdosis-Arm höher als im Niedrigdosis-Arm, obwohl der Unterschied auf dem Niveau von 0,05 statistisch nicht signifikant war.
Pädiatrische Patienten
Infektionen durch grampositive Bakterien
Eine Sicherheits- und Wirksamkeitsstudie lieferte Erfahrungen mit der Anwendung von ZYVOX 600 mg bei pädiatrischen Patienten zur Behandlung von nosokomialer Pneumonie, komplizierten Haut- und Hautstrukturinfektionen und anderen Infektionen durch grampositive bakterielle Krankheitserreger, einschließlich Methicillin-resistenter und -empfindlicher Staphylococcus aureus und Vancomycin-resistenter Enterococcus faecium. Pädiatrische Patienten im Alter von der Geburt bis zu 11 Jahren mit Infektionen, die durch die dokumentierten oder vermuteten grampositiven Bakterien verursacht wurden, wurden in eine randomisierte, vergleichskontrollierte OpenPage-Label-Studie aufgenommen. Eine Patientengruppe erhielt ZYVOX 600 mg i.v. Injektion 10 mg/kg alle 8 Stunden, gefolgt von ZYVOX 600 mg zur oralen Suspension 10 mg/kg alle 8 Stunden. Eine zweite Gruppe erhielt Vancomycin 10 bis 15 mg/kg intravenös alle 6 bis 24 Stunden, je nach Alter und renaler Clearance. Patienten mit bestätigter VRE-Infektion wurden in einen dritten Arm der Studie aufgenommen und erhielten ZYVOX 10 mg/kg alle 8 Stunden intravenös und/oder oral. Alle Patienten wurden insgesamt 10 bis 28 Tage lang behandelt und konnten bei klinischer Indikation begleitend gramnegative antibakterielle Medikamente erhalten. In der Intent-to-treat (ITT)-Population wurden 206 Patienten auf Linezolid und 102 Patienten auf Vancomycin randomisiert. Die Heilungsraten für ITT, MITT und klinisch auswertbare Patienten sind in Tabelle 16 dargestellt. Nach Abschluss der Studie wurden 13 weitere Patienten im Alter von 4 Tagen bis 16 Jahren in eine offene Verlängerung des VRE-Arms aufgenommen lernen. Tabelle 17 zeigt klinische Heilungsraten nach Erregern für mikrobiologisch auswertbare Patienten, einschließlich mikrobiologisch auswertbarer Patienten mit Vancomycin-resistentem Enterococcus faecium aus der Verlängerung dieser Studie.
INFORMATIONEN ZUM PATIENTEN
Wichtige Verwaltungsanweisungen
Weisen Sie die Patienten darauf hin, dass ZYVOX mit oder ohne Nahrung eingenommen werden kann.
Periphere und optische Neuropathie
Raten Sie den Patienten, ihren Arzt zu informieren, wenn sie während der Einnahme von ZYVOX Sehstörungen bemerken [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Serotonin-Syndrom
Raten Sie den Patienten, ihren Arzt zu informieren, wenn sie serotonerge Mittel einnehmen, einschließlich Serotonin-Wiederaufnahmehemmer oder andere Antidepressiva und Opioide [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Mögliche Wechselwirkungen, die zu einer Erhöhung des Blutdrucks führen
Laktatazidose
Raten Sie den Patienten, ihren Arzt zu informieren, wenn sie während der Behandlung mit ZYVOX wiederholt unter Übelkeit oder Erbrechen leiden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Krämpfe
Raten Sie den Patienten, ihren Arzt zu informieren, wenn sie in der Vorgeschichte Anfälle oder Krämpfe hatten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hypoglykämie
Raten Sie den Patienten, ihren Arzt zu informieren, wenn sie an Diabetes mellitus leiden. Bei der Behandlung mit Linezolid können hypoglykämische Reaktionen wie Diaphorese und Zittern zusammen mit niedrigen Blutzuckermesswerten auftreten. Wenn solche Reaktionen auftreten, sollten Patienten einen Arzt oder anderes medizinisches Fachpersonal für eine angemessene Behandlung kontaktieren [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hyponatriämie und/oder SIADH
Weisen Sie Patienten mit Hyponatriämie-Risiko an, ihren Arzt zu informieren, wenn bei ihnen Anzeichen und Symptome einer Hyponatriämie und/oder SIADH auftreten, einschließlich Verwirrtheit, Somnolenz, allgemeiner Schwäche und Atemnot [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Phenylketonurie
Weisen Sie Patienten mit Phenylketonurie (PKU) darauf hin, dass je 5 ml der 100 mg/5 ml ZYVOX zur oralen Suspension 20 mg Phenylalanin enthalten. Die anderen Formulierungen von ZYVOX 600 mg enthalten kein Phenylalanin. Phenylalanin kann für Patienten mit Phenylketonurie schädlich sein. Wenden Sie sich an Ihren Arzt oder Apotheker, wenn Ihnen ZYVOX 600 mg zur Herstellung einer Suspension zum Einnehmen verschrieben wurde [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Antibakterielle Resistenz
Die Patienten sollten darauf hingewiesen werden, dass antibakterielle Arzneimittel, einschließlich ZYVOX, nur zur Behandlung bakterieller Infektionen angewendet werden sollten. Sie behandeln keine Virusinfektionen (z. B. Erkältung). Wenn ZYVOX 600 mg zur Behandlung einer bakteriellen Infektion verschrieben wird, sollten die Patienten darüber aufgeklärt werden, dass sie sich zwar zu Beginn der Therapie besser fühlen, das Medikament jedoch genau nach Anweisung eingenommen werden sollte. Das Auslassen von Dosen oder das Nichtbeenden des vollständigen Therapiezyklus kann die Wirksamkeit der sofortigen Behandlung verringern und die Wahrscheinlichkeit erhöhen, dass Bakterien Resistenzen entwickeln und in Zukunft nicht mehr mit ZYVOX oder anderen antibakteriellen Arzneimitteln behandelbar sind.
Durchfall
Durchfall ist ein häufiges Problem, das durch antibakterielle Medikamente verursacht wird und normalerweise endet, wenn das antibakterielle Medikament abgesetzt wird. Manchmal können Patienten nach Beginn der Behandlung mit antibakteriellen Arzneimitteln wässrigen und blutigen Stuhl (mit oder ohne Magenkrämpfe und Fieber) sogar noch zwei oder mehr Monate nach Einnahme der letzten Dosis des antibakteriellen Arzneimittels entwickeln. In diesem Fall sollten sich die Patienten so schnell wie möglich an ihren Arzt wenden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Unfruchtbarkeit
Weisen Sie männliche Patienten darauf hin, dass ZYVOX die Fertilität reversibel beeinträchtigen kann [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Die Kennzeichnung dieses Produkts wurde möglicherweise aktualisiert. Die neuesten Verschreibungsinformationen finden Sie unter www.pfizer.com.